Similar presentations:
Гетерофункциональные соединения
1. ГЕТЕРОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ (соединения со смешанными функциями)
- соединения, в молекулахкоторых имеются различные
функциональные группы
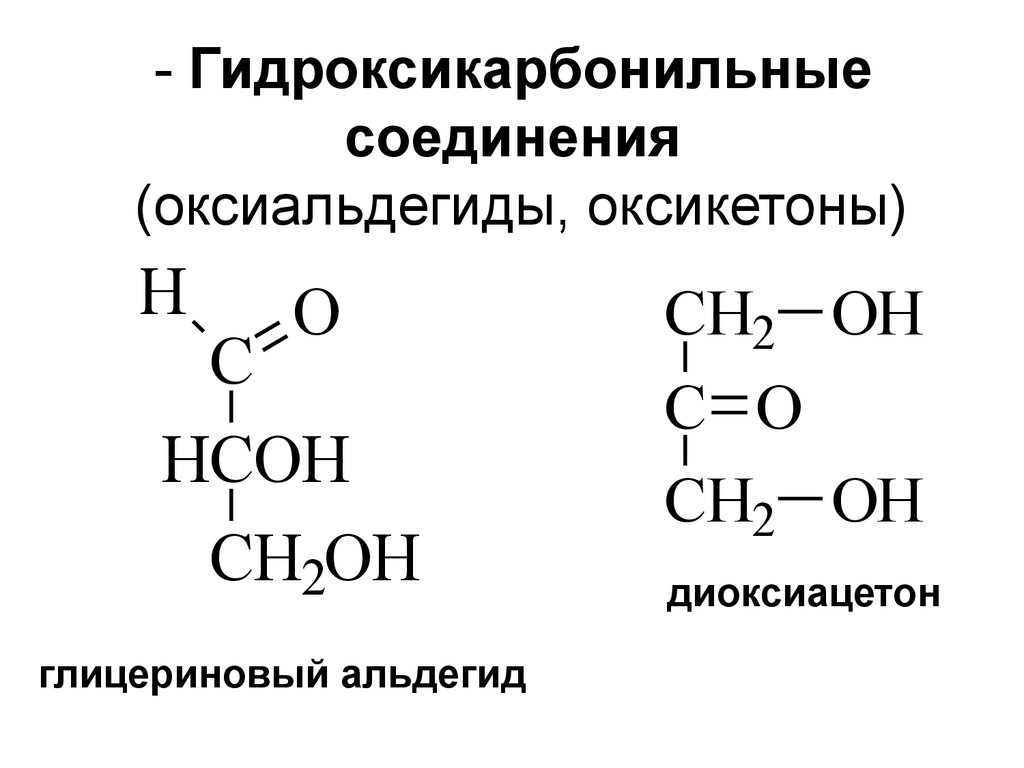
2. - Гидроксикарбонильные соединения (оксиальдегиды, оксикетоны)
HO
C
HCOH
CH2OH
глицериновый альдегид
CH2 OH
C O
CH2 OH
диоксиацетон
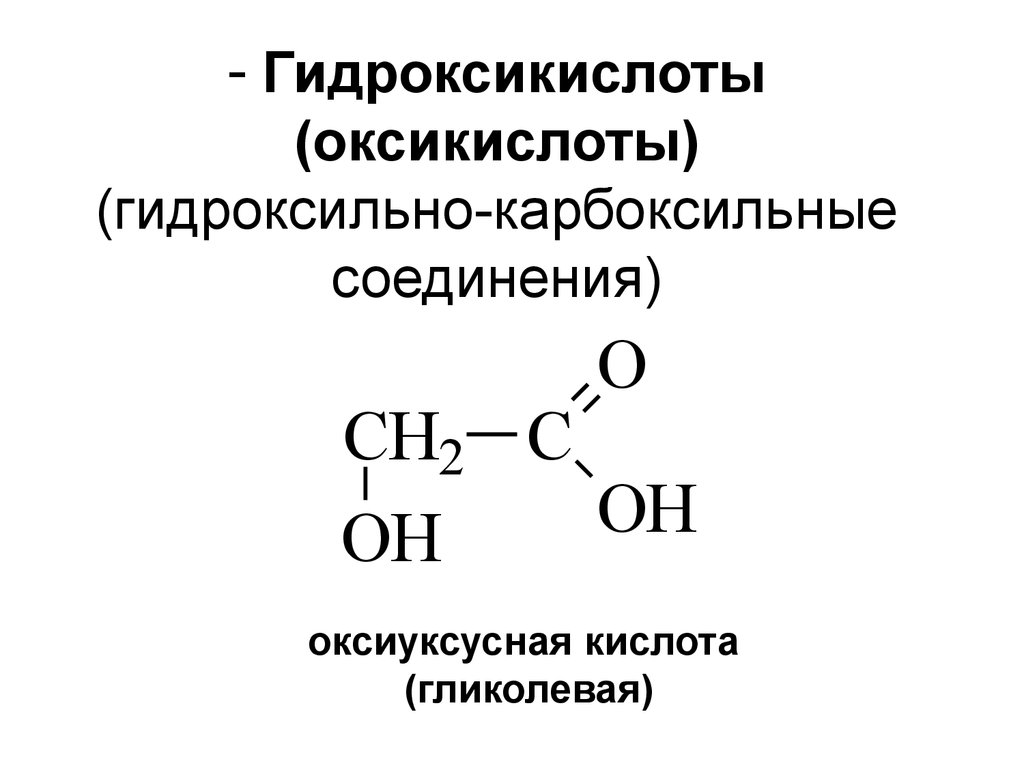
3. Гидроксикислоты (оксикислоты) (гидроксильно-карбоксильные соединения)
- Гидроксикислоты(оксикислоты)
(гидроксильно-карбоксильные
соединения)
O
CH2 C
OH
OH
оксиуксусная кислота
(гликолевая)
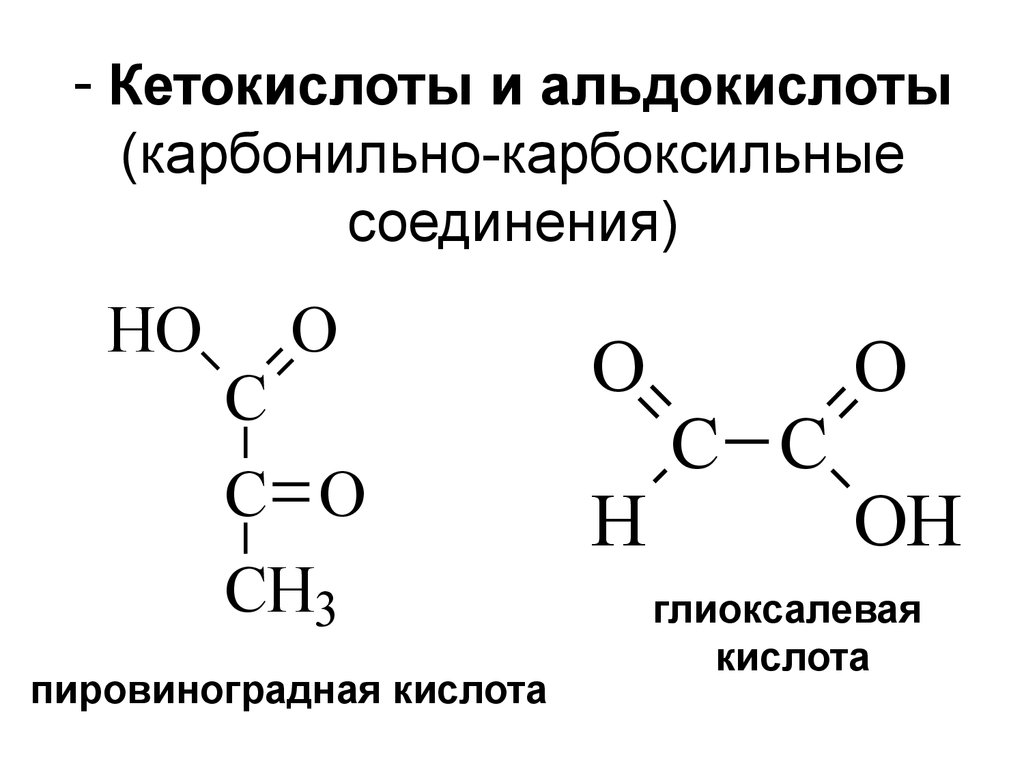
4. Кетокислоты и альдокислоты (карбонильно-карбоксильные соединения)
- Кетокислоты и альдокислоты(карбонильно-карбоксильные
соединения)
HO
O
C
C O
CH3
пировиноградная кислота
O
H
C C
O
OH
глиоксалевая
кислота
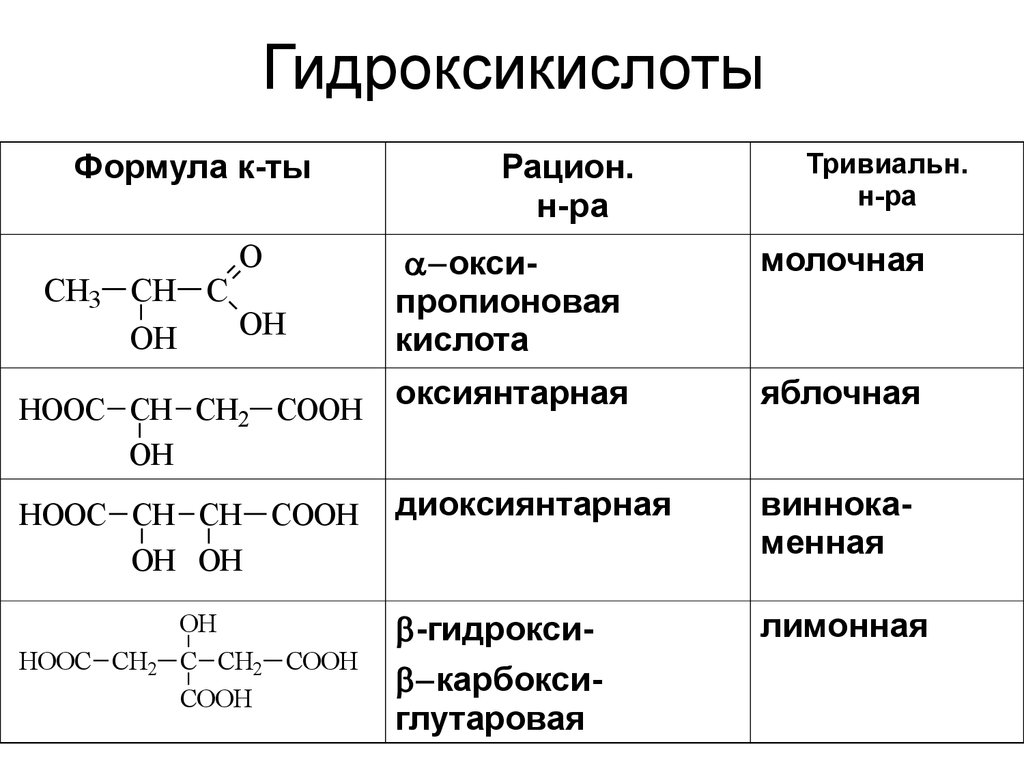
5. Гидроксикислоты
Формула к-тыO
CH3 CH C
OH
OH
HOOC CH CH2 COOH
OH
HOOC CH CH COOH
OH OH
HOOC CH2
OH
C CH2 COOH
COOH
Рацион.
н-ра
Тривиальн.
н-ра
оксипропионовая
кислота
молочная
оксиянтарная
яблочная
диоксиянтарная
виннокаменная
-гидрокси карбоксиглутаровая
лимонная
6.
CH3 CH2 CH COOHOH
CH3 CH CH2 COOH
OH
CH2 CH2 CH2 COOH
OH
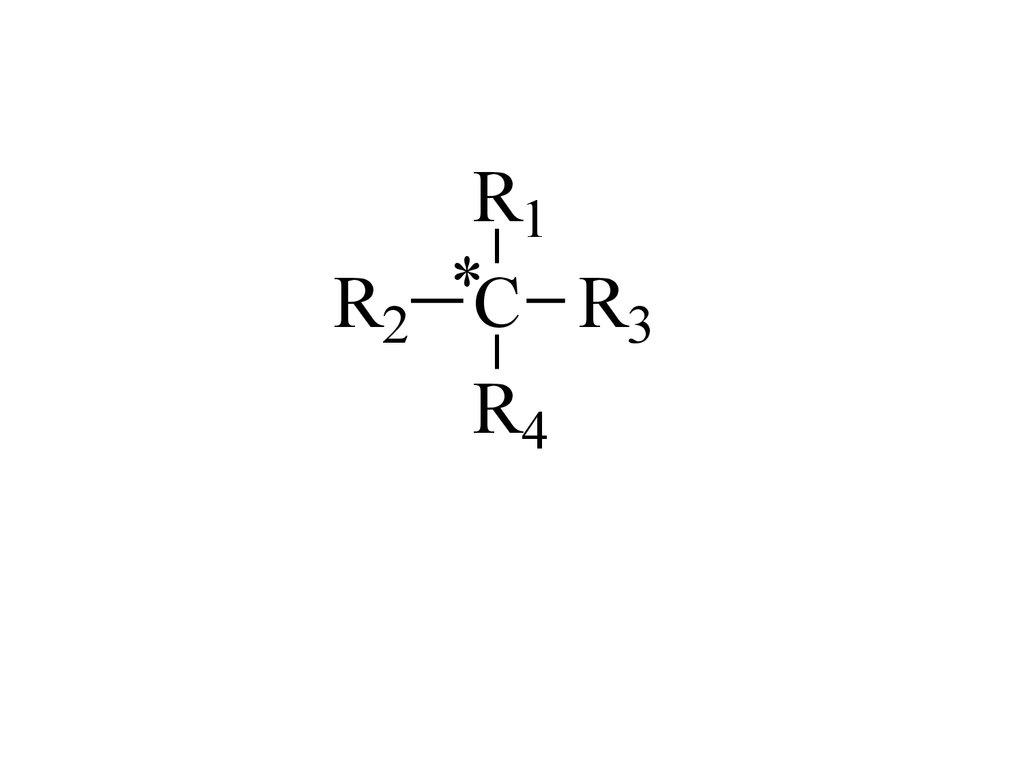
7.
R1*
R2 C R3
R4
8.
Оптическая изомерияЭтот вид изомерии связан с различиями во вращении
плоскости поляризованного света.
Способность соединений вращать
плоскополяризованный свет (ППС) называется
ОПТИЧЕСКОЙ АКТИВНОСТЬЮ.
Обычный свет
ППС
Свет распространяется перпендикулярно плоскости рисунка, колебания
происходят в плоскости рисунка
9.
Оптически активным веществом является вещество,которое вращает плоскость поляризованного
света. Когда луч такого света, колебания которого
происходили в определённой плоскости, выходит из
оптически активного вещества, то его колебания уже
совершаются в другой плоскости.
Если соединение отклоняет пропущенный через него ППС
вправо (по часовой стрелке), то оно правовращающее.
Если соединение отклоняет пропущенный через него ППС
влево (против часовой стрелки), то это левовращающее
соединение.
Соединения, вращающие ППС, имеют асимметрически
построенные молекулы, т.е. они не имеют ни центра
симметрии, ни плоскости симметрии.
10.
Оптически активные соединения имеютасимметрический атом углерода – атом, который
связан с 4 различными атомами или атомными
группировками.
Асимметрический атом углерода называют хиральным
центром.
Молекула должна иметь хотя бы один хиральный центр,
тогда она будет оптически активной.
Соединение хиральное, если его молекула существует
в виде пары энантиомеров (оптических изомеров) –
несовместимых между собой в пространстве соединений,
относящихся друг к другу как предмет и его зеркальное
изображение.
enantio (греч.) - противоположный
Энантиомеры – изомеры, которые являются зеркальными
отображениями друг друга.
11. Связь пространственного строения соединений с их биологической активностью
• Биохимические процессы стереоспецифичны:в реакцию вовлекаются определённые
стереоизомеры и результатом реакции
являются также стереохимически
определённые продукты.
• Как правило, один из энантиомеров
проявляет биологическое действие, а другой
неактивен, а иногда проявляет иное или даже
противоположное действие.
12. Связь пространственного строения соединений с их биологической активностью
• Многие лекарственные вещества проявляютфармакологический эффект при
взаимодействии с рецепторами клетки.
Конфигурация молекулы лекарственного
вещества должна обеспечивать наиболее
полное связывание с рецептором.
Т.о., биологическое действие биорегуляторов
связано с пространственным строением их
молекул.
13.
Глицериновый альдегид – ключевое соединениедля определения конфигурации кислоты
H
O
C
*
H C OH
CH2OH
H
O
C
*
HO C H
CH2OH
D-конфигурация
L-конфигурация
Направление стрелки
совпадает с часовой
Направление стрелки
не совпадает с часовой
14.
• «+» - правое вращение• «-» - левое вращение
15.
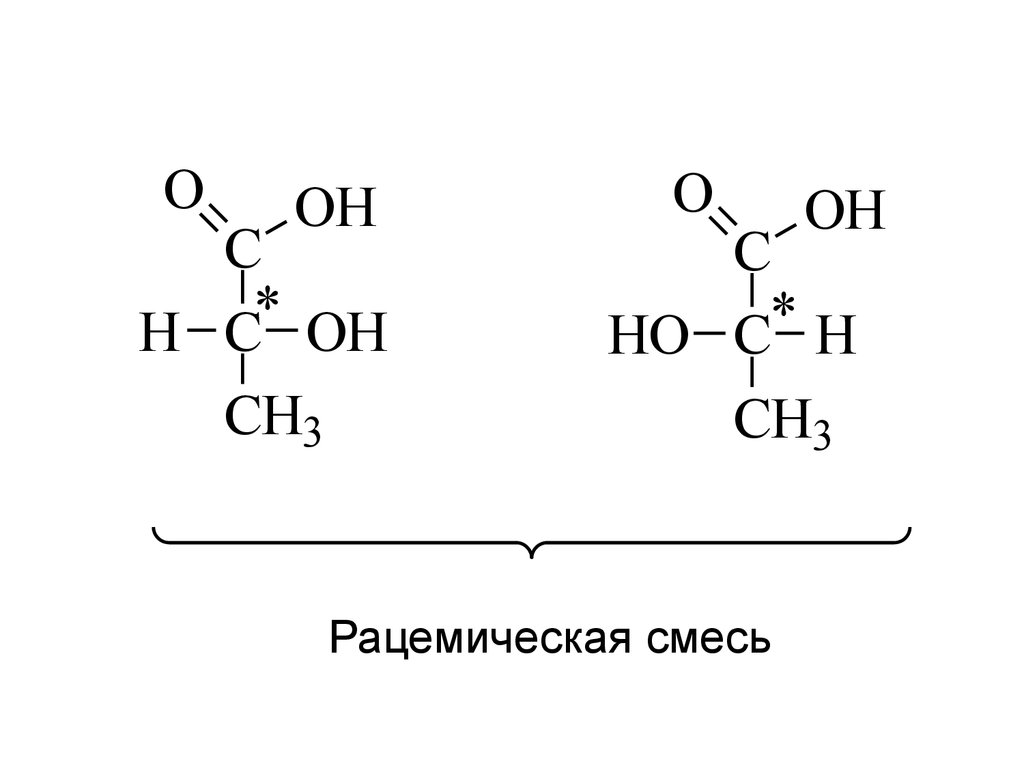
OOH
C
*
H C OH
CH3
D (-)
O
OH
C
*
HO C H
CH3
L (+)
16.
OOH
C
*
H C OH
CH3
O
OH
C
*
HO C H
CH3
Рацемическая смесь
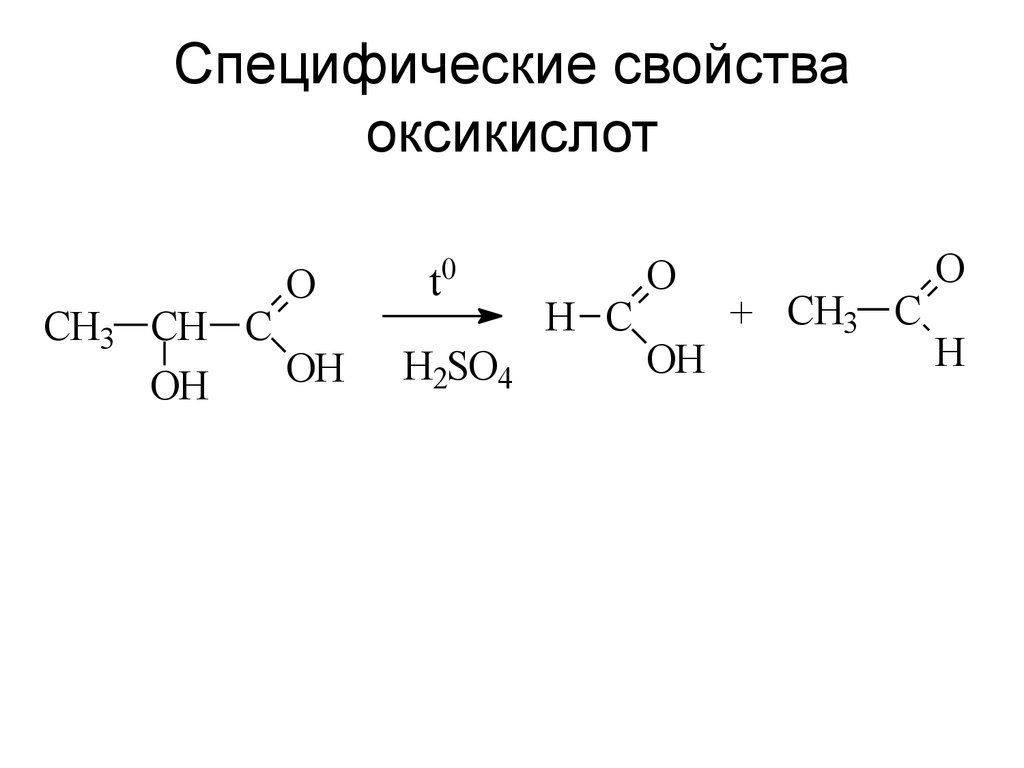
17. Специфические свойства оксикислот
OCH3 CH C
OH
OH
t0
H2SO4
H C
O
OH
+ CH3 C
O
H
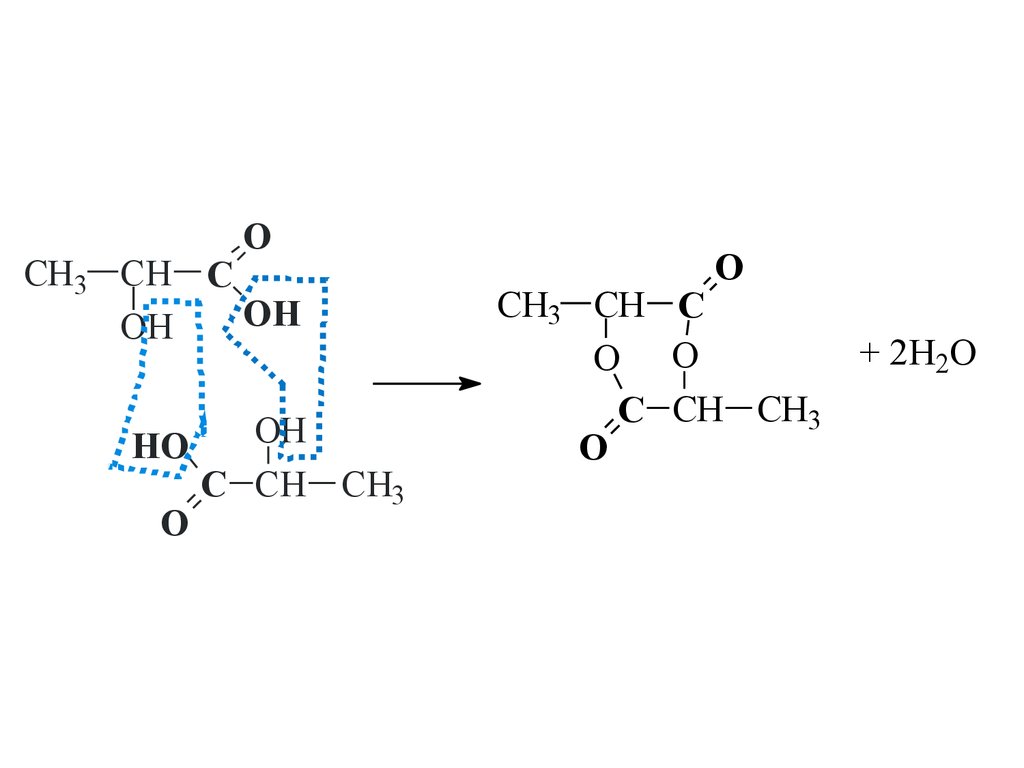
18.
OCH3 CH C
OH
OH
HO
O
OH
C CH CH3
O
CH3 CH C
O O
C CH CH3
O
+ 2H2O
19.
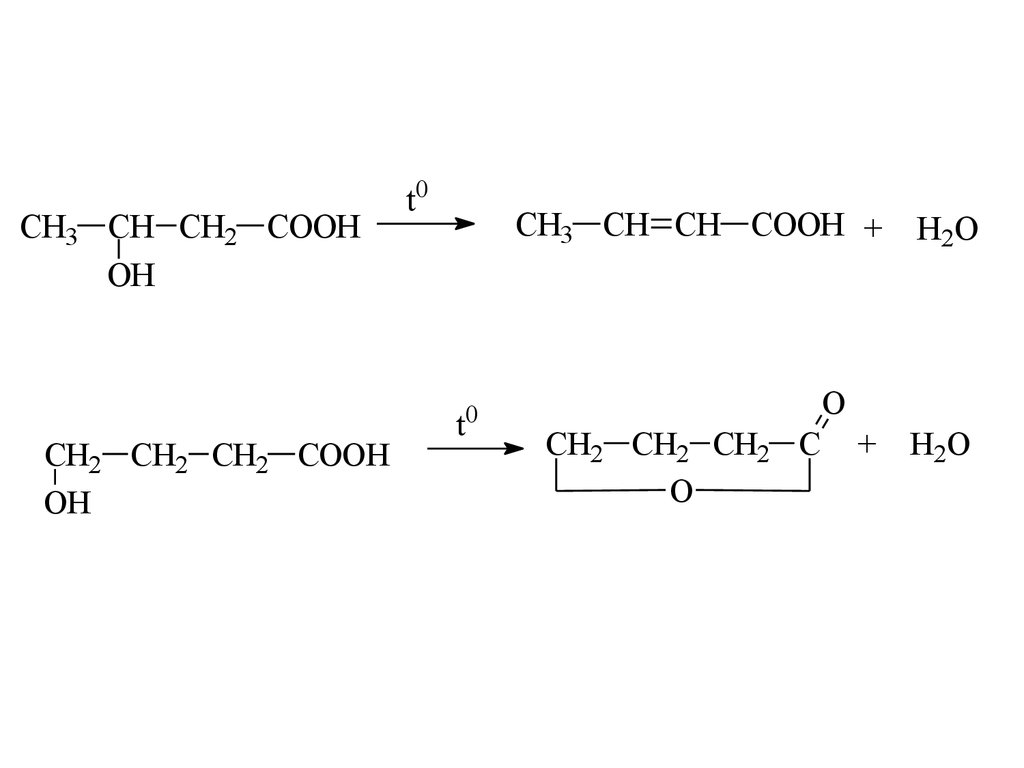
CH3 CH CH2 COOHOH
CH2 CH2 CH2 COOH
OH
t0
CH3 CH CH COOH +
t0
H2O
O
CH2 CH2 CH2 C
O
+
H2O
20.
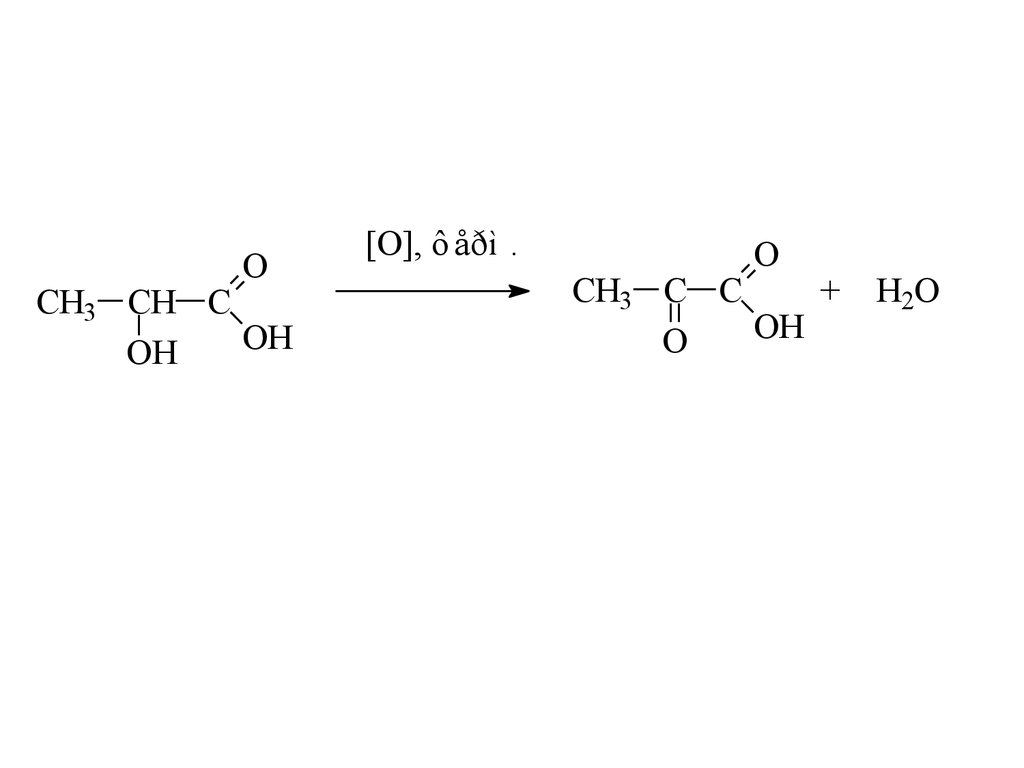
OCH3 CH C
OH
OH
[O], ô åðì .
O
CH3 C C
+
OH
O
H2O
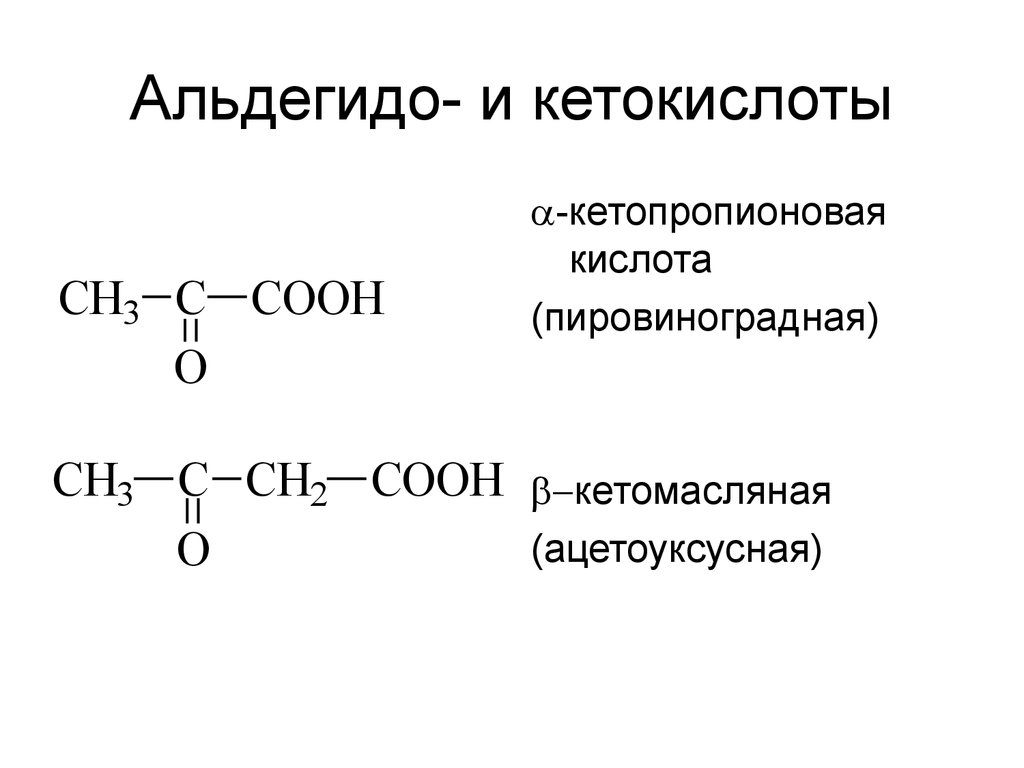
21. Альдегидо- и кетокислоты
CH3 C COOHO
-кетопропионовая
кислота
(пировиноградная)
CH3 C CH2 COOH кетомасляная
(ацетоуксусная)
O
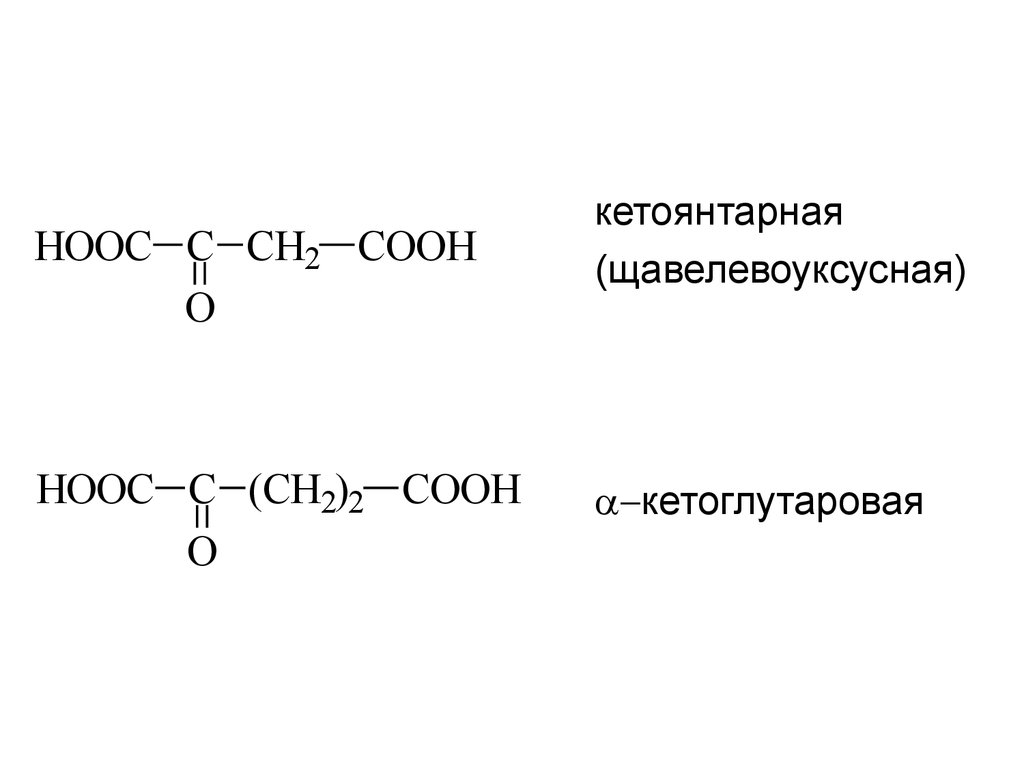
22.
HOOC C CH2 COOHO
HOOC C (CH2)2 COOH
O
кетоянтарная
(щавелевоуксусная)
кетоглутаровая
23.
COOHC O
CH3
кетонная форма
COOH
C OH
CH2
енольная форма
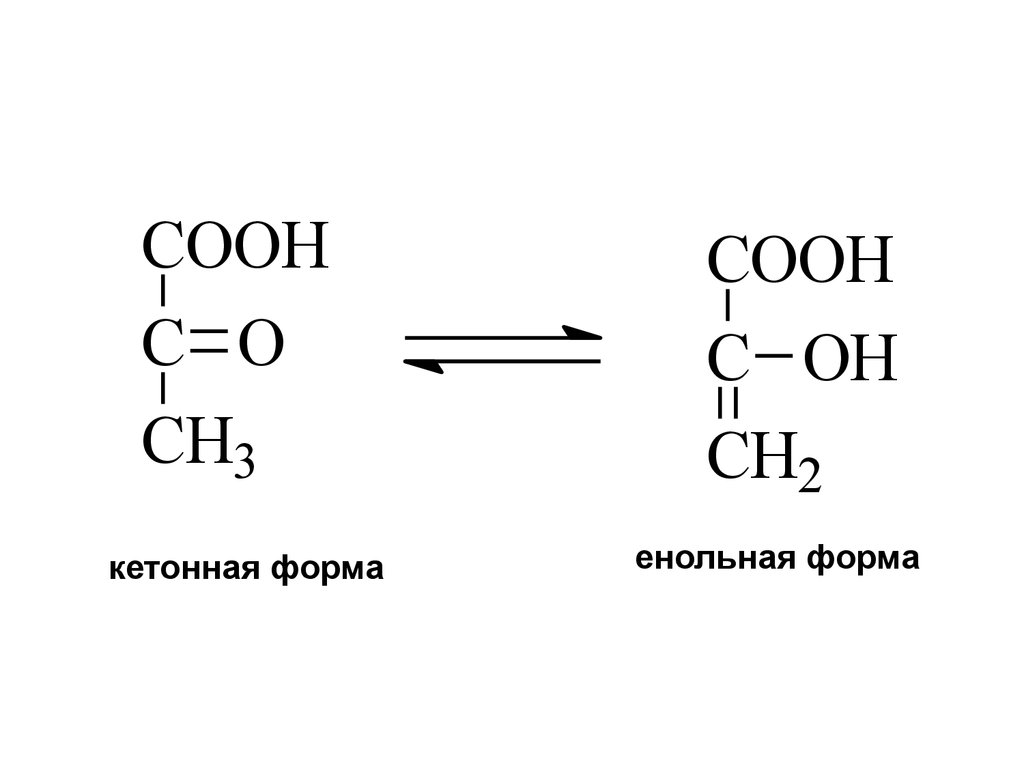
24.
[H]CH3 C COOH
O
[O]
CH3 CH COOH
OH
25.
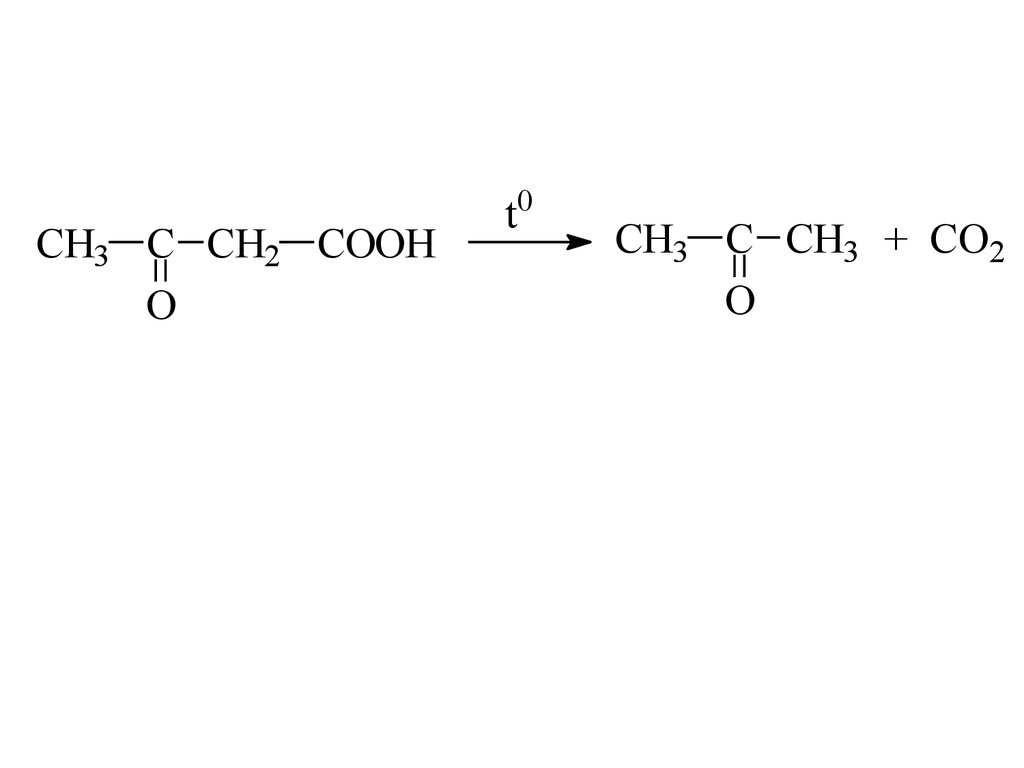
CH3 C CH2 COOHO
t0
CH3 C CH3 + CO2
O
26.
CH3 C CH2 COOHO
кетонная форма
CH3 C CH COOH
OH
енольная форма
27.
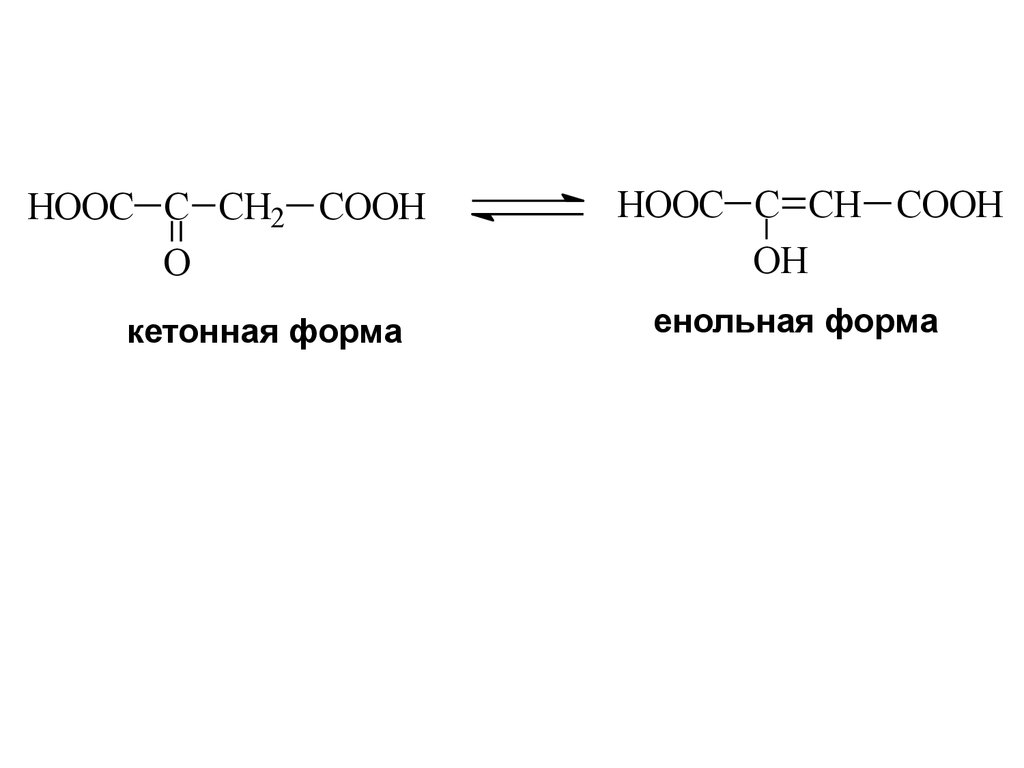
HOOC C CH2 COOHO
кетонная форма
HOOC C CH COOH
OH
енольная форма
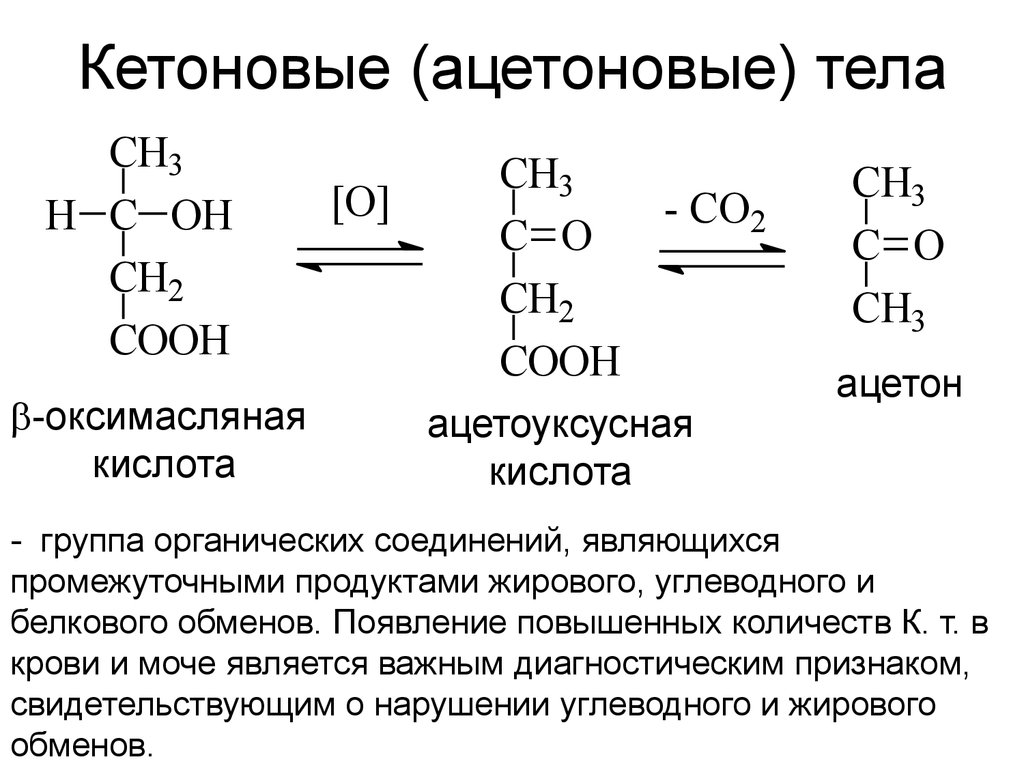
28. Кетоновые (ацетоновые) тела
CH3H C OH
CH2
COOH
-оксимасляная
кислота
[O]
CH3
- CO2
C O
CH2
COOH
ацетоуксусная
кислота
CH3
C O
CH3
ацетон
- группа органических соединений, являющихся
промежуточными продуктами жирового, углеводного и
белкового обменов. Появление повышенных количеств К. т. в
крови и моче является важным диагностическим признаком,
свидетельствующим о нарушении углеводного и жирового
обменов.
29.
• Кетооновые телао (синоним ацетоновыетела) группа органических соединений,
являющихся промежуточными продуктами
жирового, углеводного и белкового обменов. К
кетоновым телам относят β-оксимасляную и
ацетоуксусную кислоты и ацетон, имеющие
сходное строение и способные к
взаимопревращениям. Появление
повышенных количеств К. т. в крови и моче
является важным диагностическим
признаком, свидетельствующим о нарушении
углеводного и жирового обменов.
30. УГЛЕВОДЫ
31. Углеводы
• Входят в состав клеток и тканей всехрастительных и животных организмов.
• По массе составляют основную часть
органического вещества на Земле: на
долю углеводов приходится не менее
12% сухого веса любых организмов, они
составляют основную часть биомассы
растений (до 90 % сухого вещества).
32. Углеводы
• Источники энергии в метаболическихпроцессах (крахмал, гликоген)
• Структурные компоненты клеточных
стенок (целлюлоза, хитин и др.)
• Составные элементы жизненно важных
веществ (нуклеиновые кислоты и др.)
• Используются как лекарственные
средства
33. Углеводы
• Образуются в растениях в процессефотосинтеза из диоксида углерода и
воды.
• Животные организмы не способны
синтезировать углеводы и получают их
из растительных источников.
• Углеводы служат основным
ингредиентом пищи млекопитающих.
34. Углеводы
• Класс углеводов (сахаров,карбогидратов) объединяет
соединения, имеющие состав СnH2nOn и
обладающие при этом весьма
разнообразными свойствами.
35.
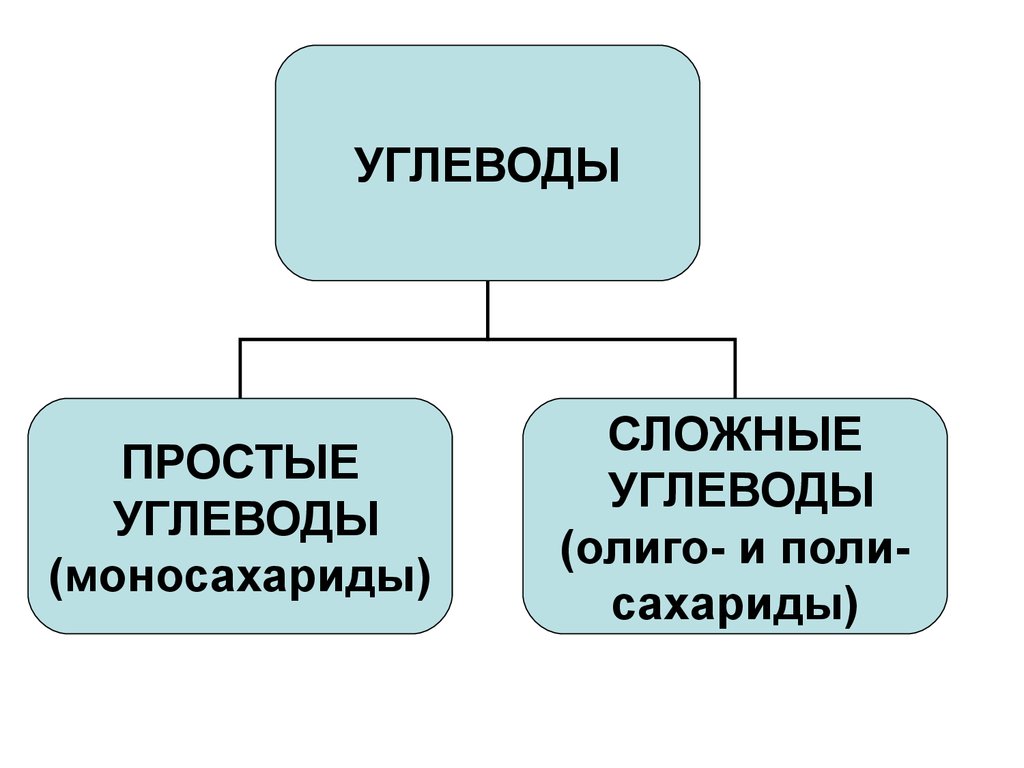
УГЛЕВОДЫПРОСТЫЕ
УГЛЕВОДЫ
(моносахариды)
СЛОЖНЫЕ
УГЛЕВОДЫ
(олиго- и полисахариды)
36. Углеводы
• По способности к гидролизу:- Моносахариды (простые сахара, монозы) не
гидролизуются с образованием более простых
углеводов.
- Олигосахариды - соединения, имеющие в
своем составе от 2 до 10 остатков
моносахаридов, связанных О–гликозидными
связями.
- Полисахариды, представляющие собой
высокомолекулярные вещества, соединенные
О–гликозидными связями, со степенью
полимеризации выше 10.
37. Моносахариды
Гетерофункциональные соединения,содержат одновременно карбонильную
и несколько гидроксильных групп:
- полигидроксиальдегиды (альдозы)
- полигидроксикетоны (кетозы)
Для них характерна неразветвлённая
углеродная цепь.
Для названий моносахаридов используют
суффикс -оза
38.
• Все моносахариды представляют собойкристаллические вещества, хорошо
растворимые в воде и обладающие, как
правило, сладким вкусом. В растворе
существуют в открытой и циклической
формах, которые находятся в
состоянии динамического равновесия.
39.
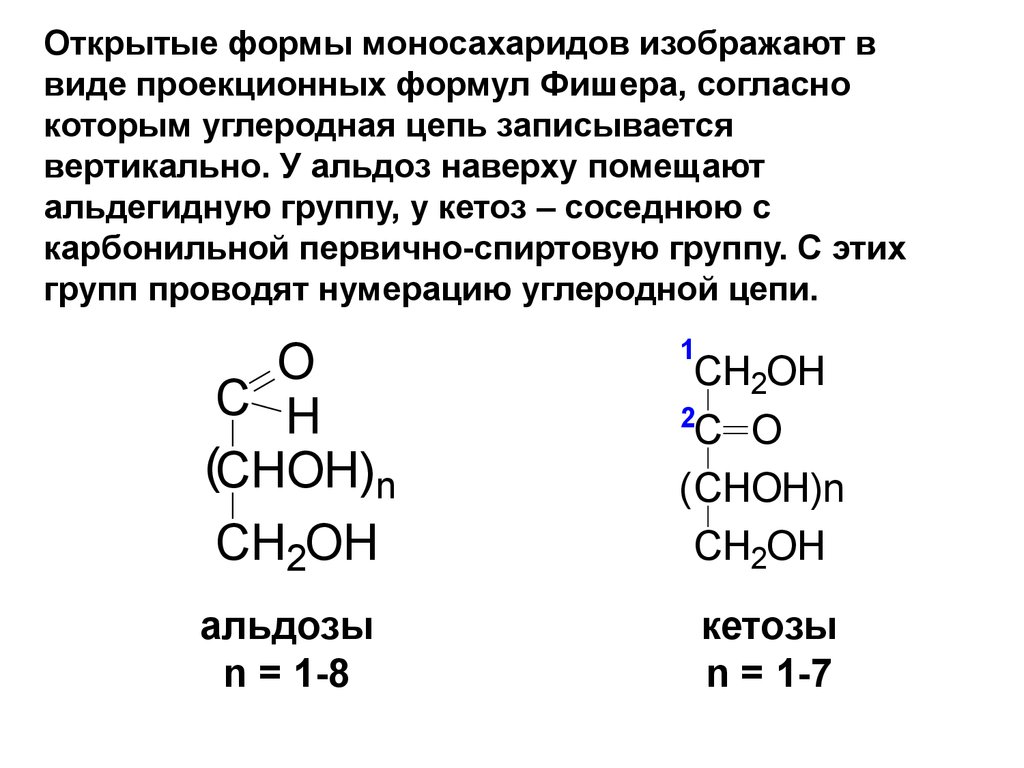
Открытые формы моносахаридов изображают ввиде проекционных формул Фишера, согласно
которым углеродная цепь записывается
вертикально. У альдоз наверху помещают
альдегидную группу, у кетоз – соседнюю с
карбонильной первично-спиртовую группу. С этих
групп проводят нумерацию углеродной цепи.
O
C H
(CHOH)n
CH2OH
альдозы
n = 1-8
1
CH2OH
2
C O
( CHOH)n
CH2OH
кетозы
n = 1-7
40. Моносахариды
• В зависимости от длины углероднойцепи (3 – 10 атомов):
- триозы
- тетрозы
- пентозы
- гексозы
- гептозы
41.
• Наличие в молекулах моносахаридовнескольких центров хиральности –
причина существования большого
числа стереоизомеров,
соответствующих одной и той же
структурной формуле.
42. Альдогексоза
HOCH2(*CHOH)4CHOчисло стереоизомеров = 24 = 16 (8 пар
энантиомеров)
В биологических средах преимущественно
распространены D-изомеры моносахаридов,
что обусловлено особенностями их
первичного синтеза в растениях. В связи с
этим, человек, животные, а также
микроорганизмы не способны усваивать Lизомеры.
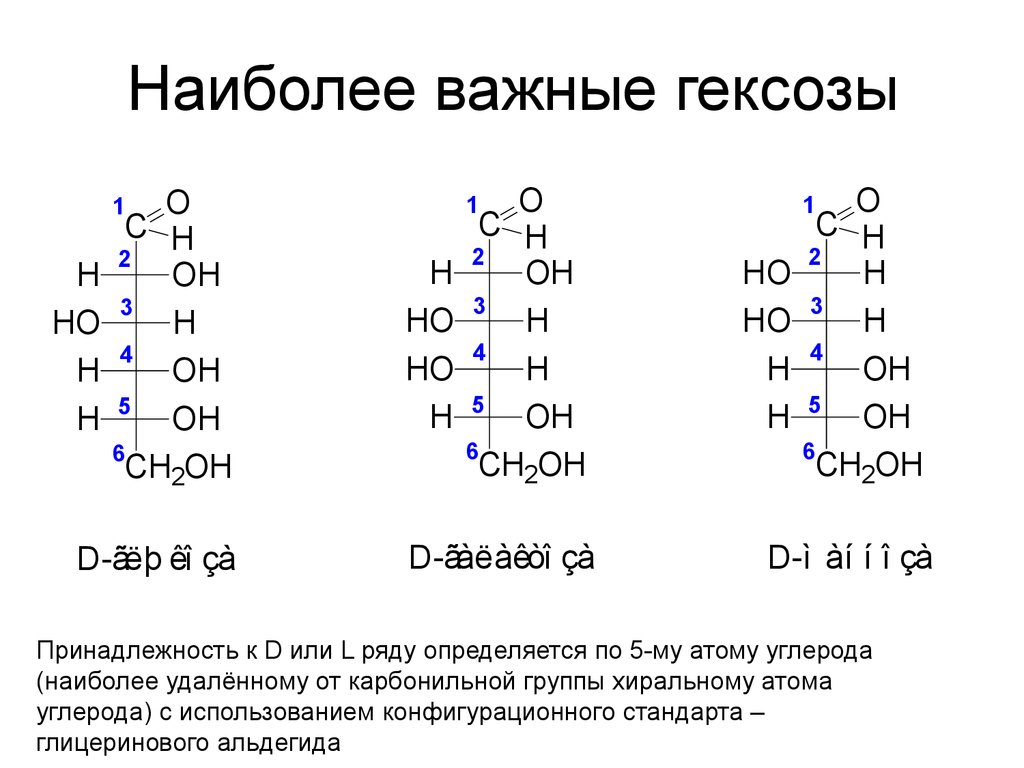
43. Наиболее важные гексозы
OC H
2
OH
3
H
4
OH
5
OH
6
CH2OH
H
HO
H
H
D-ãëþ êî çà
O
C H
2
OH
3
H
4
H
5
OH
6
CH2OH
1
1
H
HO
HO
H
D-ãàëàêòî çà
O
C H
2
H
3
H
4
OH
5
OH
6
CH2OH
1
HO
HO
H
H
D-ì àí í î çà
Принадлежность к D или L ряду определяется по 5-му атому углерода
(наиболее удалённому от карбонильной группы хиральному атома
углерода) с использованием конфигурационного стандарта –
глицеринового альдегида
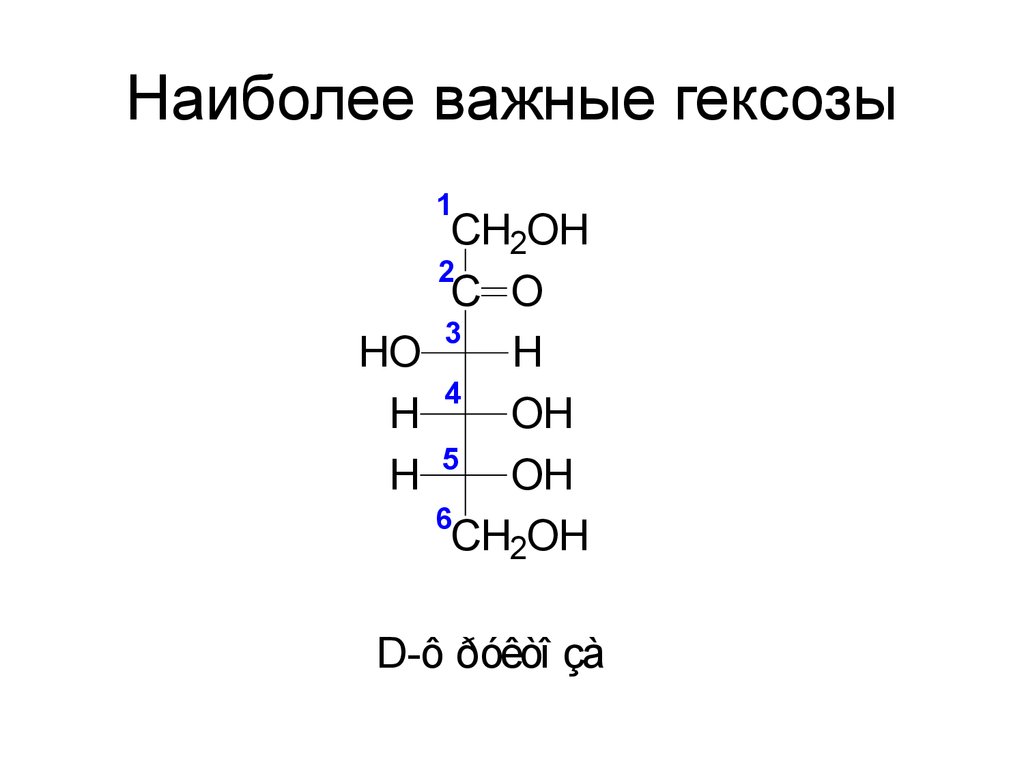
44. Наиболее важные гексозы
1CH2OH
2
C O
3
HO
H
4
H
OH
5
H
OH
6
CH2OH
D-ô ðóêòî çà
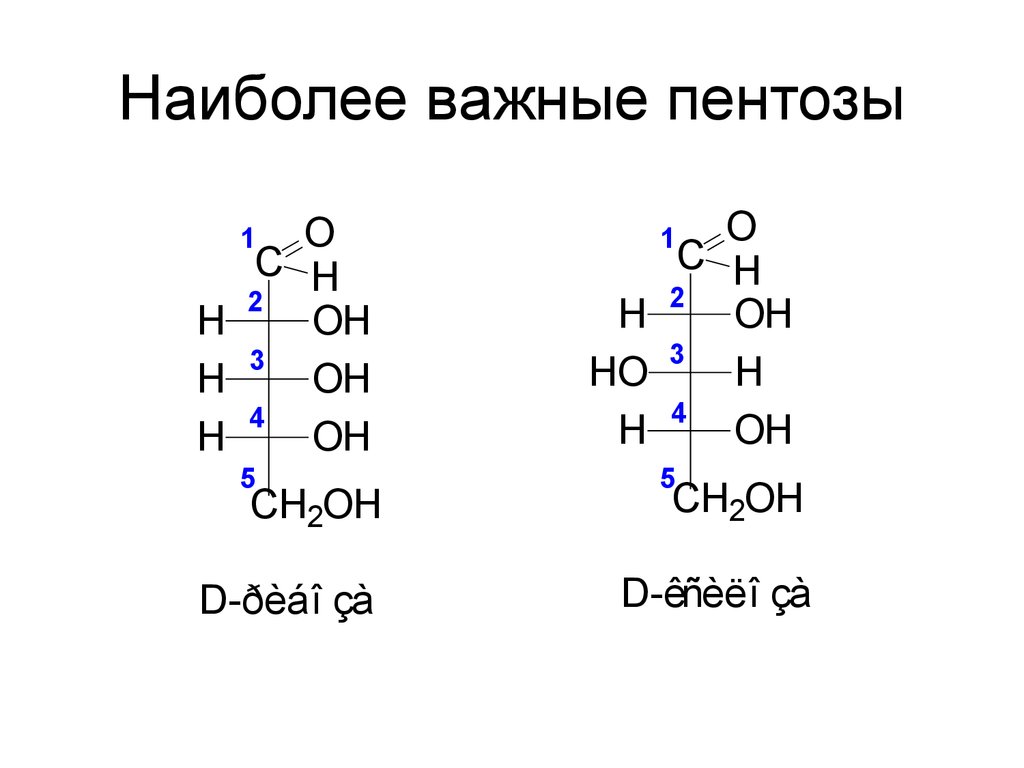
45. Наиболее важные пентозы
OC H
2
H
OH
3
H
OH
4
H
OH
1
5
CH2OH
D-ðèáî çà
O
C H
2
H
OH
3
HO
H
4
H
OH
1
5
CH2OH
D-êñèëî çà
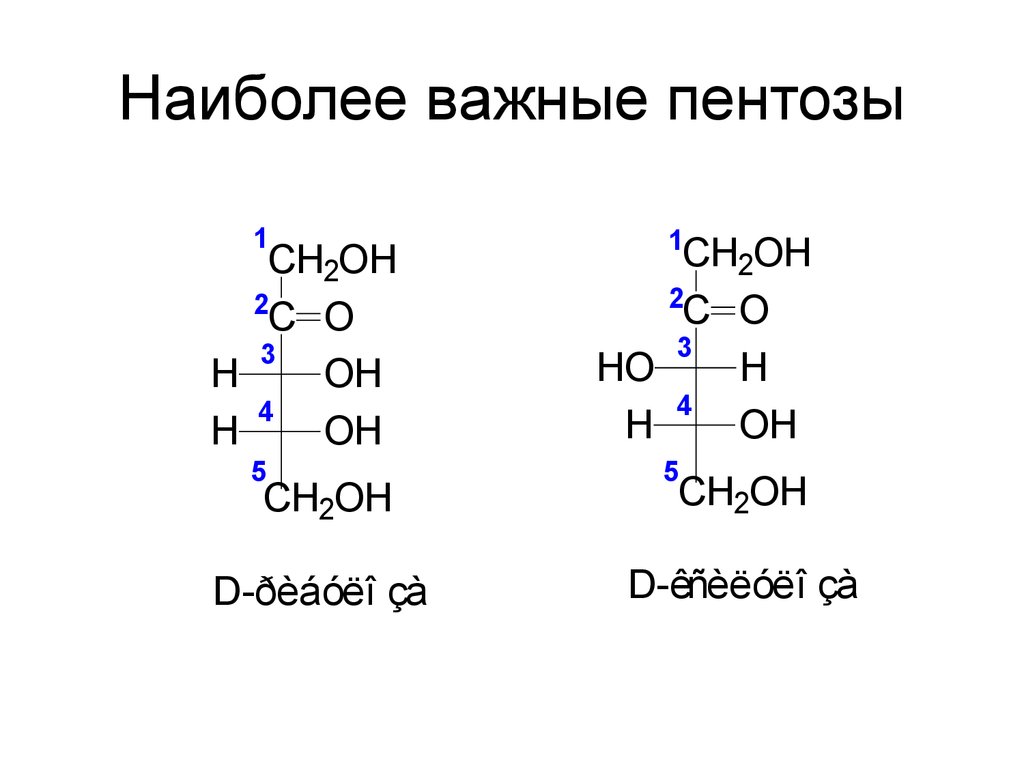
46. Наиболее важные пентозы
1CH2OH
2
C O
3
H
OH
4
H
OH
5
CH2OH
D-ðèáóëî çà
1
CH2OH
2
C O
3
HO
H
4
H
OH
5
CH2OH
D-êñèëóëî çà
47. Циклические формы
- по химической природе являютсяциклическими полуацеталями.
Моносахариды за счет
внутримолекулярного взаимодействия
сближенных в пространстве
карбонильной и гидроксильной групп,
образуют устойчивые фуранозные
(пятичленные) или пиранозные
(шестичленные) циклы.
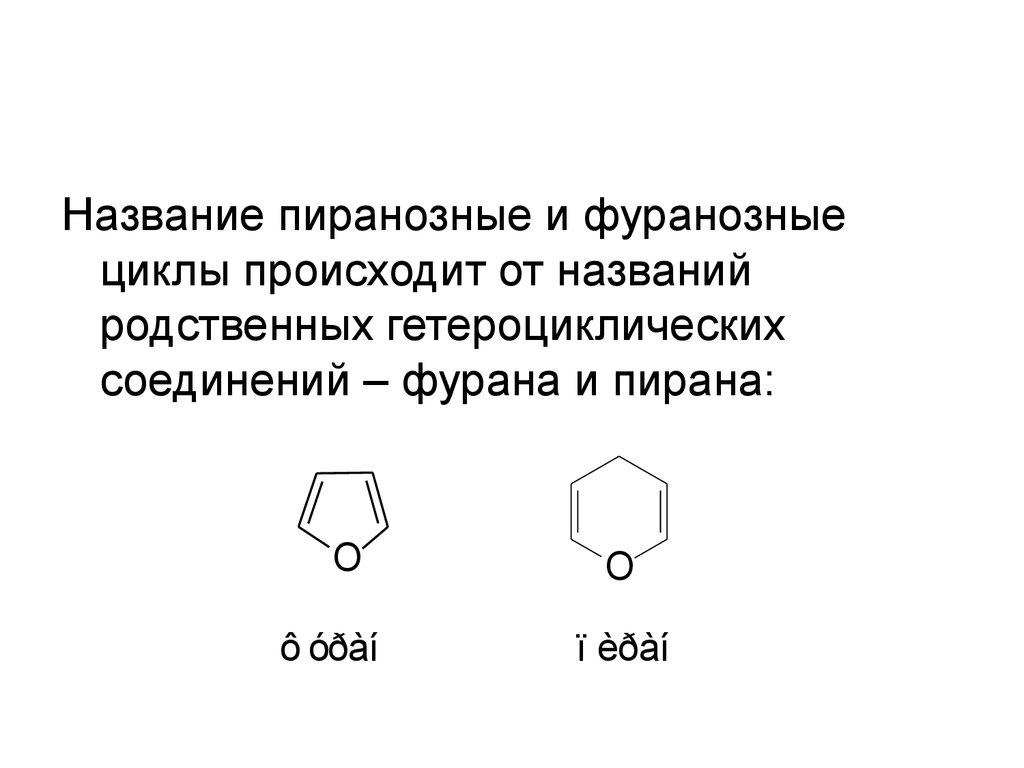
48.
Название пиранозные и фуранозныециклы происходит от названий
родственных гетероциклических
соединений – фурана и пирана:
O
ô óðàí
O
ï èðàí
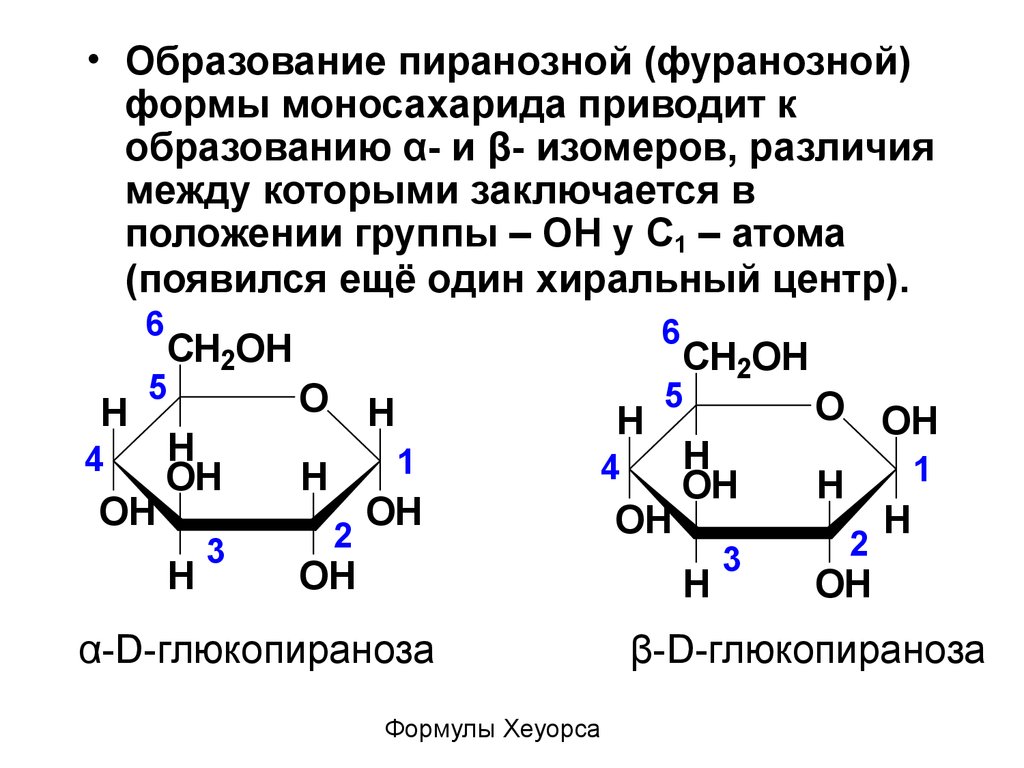
49.
• Образование пиранозной (фуранозной)формы моносахарида приводит к
образованию α- и β- изомеров, различия
между которыми заключается в
положении группы – ОН у С1 – атома
(появился ещё один хиральный центр).
6
H
5
4
OH
6
CH2OH
H
OH
H
3
O H
1
H
2
H
5
4
OH
OH
CH2OH
OH
H
OH
H
α-D-глюкопираноза
Формулы Хеуорса
3
O OH
1
H
2
H
OH
β-D-глюкопираноза
50.
• Появившаяся дополнительнаягидроксильная группа, связанная с С1 –
атомом, называется гликозидной
(полуацетальной). По свойствам она
значительно отличается от спиртовых
(гликозных) гидроксильных групп
моносахарида.
51.
• В растворах сахаров при стояниинаблюдается изменение угла
отклонения плоскости поляризованного
света, т.е. изменение оптической
активности – мутаротация.
• Объясняется установлением
равновесия между циклической и
нециклической формами , а также
между α- и β- формами. После
установления равновесия угол
отклонения ППС принимает
определённое значение.
52. ХИМИЧЕСКИЕ СВОЙСТВА МОНОСАХАРИДОВ
• I. Химические реакции с участиемгидроксильных групп.
I.1. Полуацетальный гидроксил непрочно
связан с атомом углерода и может
достаточно легко вступать во
взаимодействие со спиртами,
фенолами, карбоновыми кислотами,
аминами и т.д. (как правило, в условиях
кислотного катализа)
53.
CH2OHH
OH
H
OH
H
- H2O
OH
H
OH
OH
- H2O
CH2OH
CH2OH
H
OH
H
+ CH3COOH
+ CH3OH
H
O H
O H
H
H
OH
OH
OCH3
H
OH
H
O H
H
OH
CH3
O
C
O
Вещество, которое действует на полуацетальный
гидроксил моносахарида, называется агликоном, а продукт
реакции – гликозидом. Гликозиды, как и все ацетали,
достаточно легко гидролизуются разбавленными
кислотами, однако в слабощелочных средах они не
подвергаются распаду.
54.
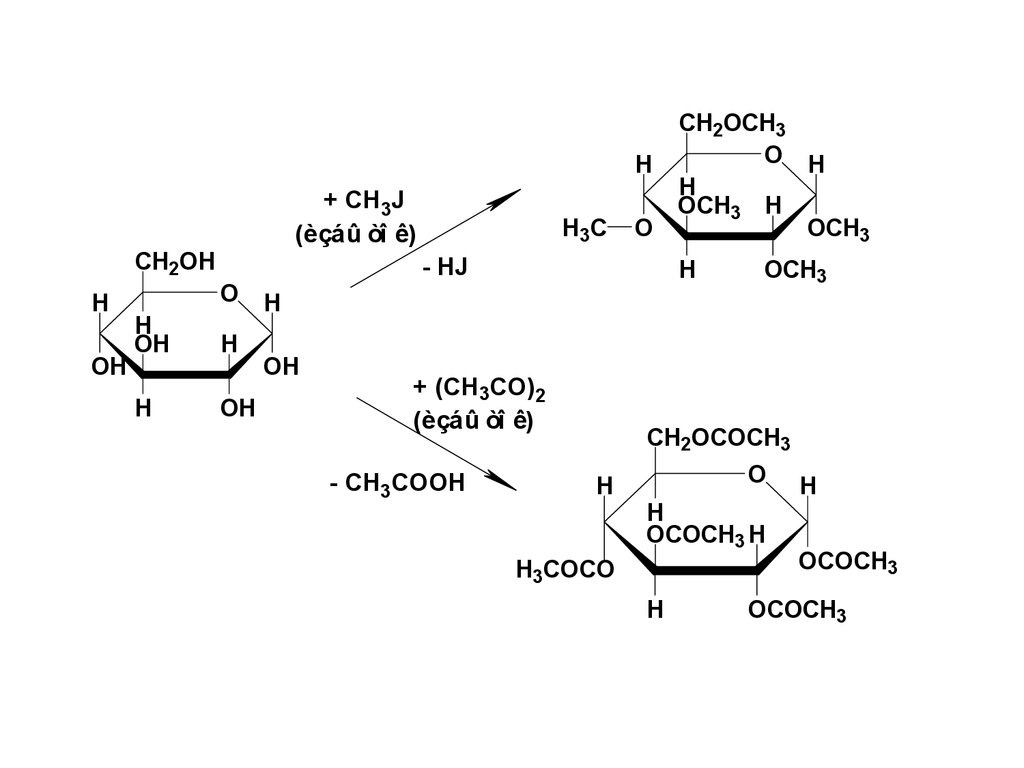
I.2. При определённых условиях вреакцию вступает не только
полуацетальный гидроксил, но и
имеющиеся в молекуле спиртовые
гидроксильные группы.
55.
+ CH3J(èçáû òî ê)
CH2OH
H
OH
H
OH
H
O H
H
OH
OH
H3C
CH2OCH3
O H
H
H
OCH3 H
O
OCH3
- HJ
H
+ (CH3CO)2
(èçáû òî ê)
- CH3COOH
OCH3
CH2OCOCH3
H
O
H
OCOCH3 H
H3COCO
H
H
OCOCH3
OCOCH3
56.
• Наибольшее значение среди эфировмоносахаридов имеют эфиры фосфорной
кислоты – фосфаты. Они содержатся во всех
растительных и животных организмах и
играют ключевую роль в ряде жизненно
важных процессов.
H
O
O H
O P O CH2
H
OH
H
OH
H
O OH
H
H
OH
глюкозо-6-фосфат
57.
I.3. Образование аминосахаровзамещением гидроксильной группы на
аминогруппу
6
H
CH2OH
5
4
OH
6
H
OH
H
3
O H
H
1
H
2
OH
глюкоза
OH
CH2OH
5
4
OH
H
OH
H
3
O H
1
H
2
OH
NH2
глюкозамин
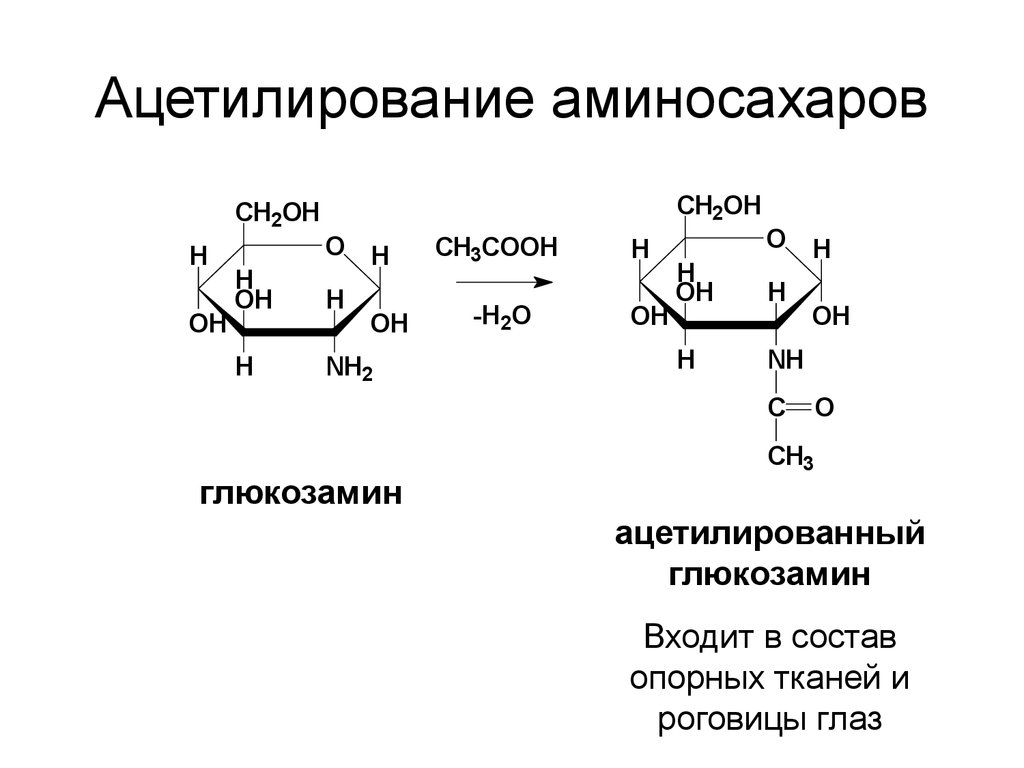
58. Ацетилирование аминосахаров
CH2OHCH2OH
H
OH
H
OH
H
O H
H
OH
NH2
CH3COOH
-H2O
H
OH
H
OH
H
O H
H
OH
NH
C
глюкозамин
O
CH3
ацетилированный
глюкозамин
Входит в состав
опорных тканей и
роговицы глаз
59.
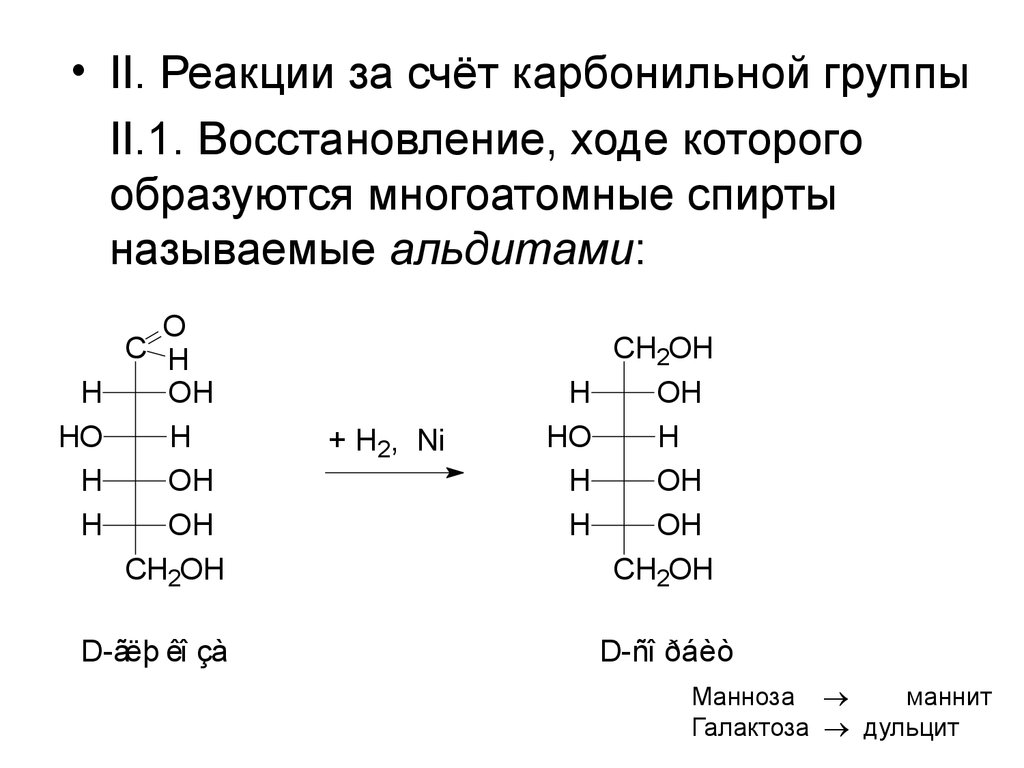
• II. Реакции за счёт карбонильной группыII.1. Восстановление, ходе которого
образуются многоатомные спирты
называемые альдитами:
H
HO
H
H
O
C H
OH
H
OH
OH
CH2OH
D-ãëþ êî çà
+ H2, Ni
H
HO
H
H
CH2OH
OH
H
OH
OH
CH2OH
D-ñî ðáèò
Манноза
маннит
Галактоза дульцит
60.
II.2. Окисление - важная реакция в химии углеводов. Егоиспользуют для получения ряда
соединений в структурных
исследованиях и биохимических
анализах.
В зависимости от условий окисления
моносахаридов образуются различные
продукты. В щелочной среде окисление
сопровождается разрушением
углеродной цепи молекулы (реакция
”серебряного зеркала”).
Окисление в нейтральной среде
позволяет сохранить углеродный
скелет.
61.
Под действием мягких окислителей окисляетсятолько карбонильная группа. С помощью
сильного окислителя концевые группы в случае
альдоз одновременно окисляются в
карбоксильные группы:
H
HO
H
H
O
C H
OH
H
OH
OH
CH2OH
D-ãëþ êî çà
[O], Br2 + H2O
H
HO
H
H
[O], HNO3 (ðàçá.)
COOH
OH
H
OH
OH
CH2OH
H
HO
H
H
ãëþ êî í î âàÿ
êèñëî òà
COOH
OH
H
OH
OH
COOH
ãëþ êàðî âàÿ
êèñëî òà
62.
• При защите от окисления альдегидной группыокисляется лишь спиртовая группа с
образованием уроновых кислот:
H
HO
H
H
O
C H
OH
H
OH
OH
CH2OH
[O]
H
HO
H
H
O
C H
OH
H
OH
OH
C O
OH
глюкуроновая кислота



































 biology
biology chemistry
chemistry








