Similar presentations:
Механизмы реакций органических соединений
1. Механизмы реакций органических соединений проф. Кацев А.М.
Радикальное замещение (SR) – алканыЭлектрофильное присоединение (AE) – алкены
Электрофильное замещение (SE) – арены
Нуклеофильное замещение (SN) – спирты
Нуклеофильное присоединение (AN) – альдегиды,
кетоны
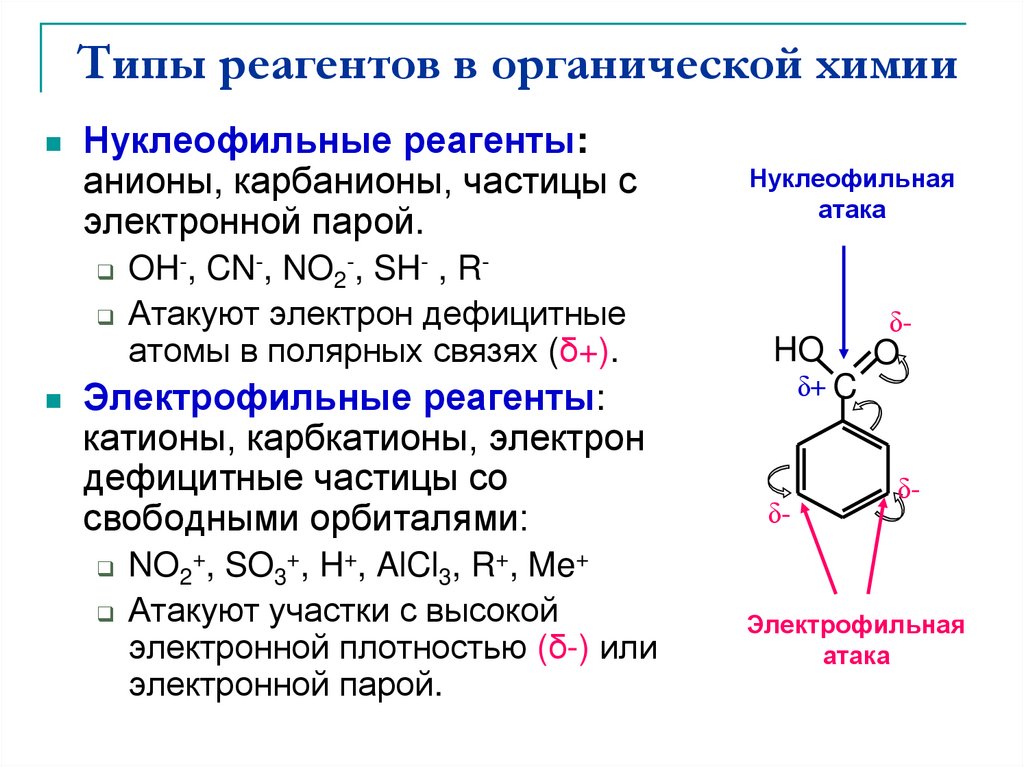
2. Типы реагентов в органической химии
Нуклеофильные реагенты:анионы, карбанионы, частицы с
электронной парой.
OH-, CN-, NO2-, SH- , RАтакуют электрон дефицитные
атомы в полярных связях (δ+).
Электрофильные реагенты:
катионы, карбкатионы, электрон
дефицитные частицы со
свободными орбиталями:
NO2+, SO3+, H+, AlCl3, R+, Me+
Атакуют участки с высокой
электронной плотностью (δ-) или
электронной парой.
Нуклеофильная
атака
HO
δ+ C
δ-
δ-
O
δ-
Электрофильная
атака
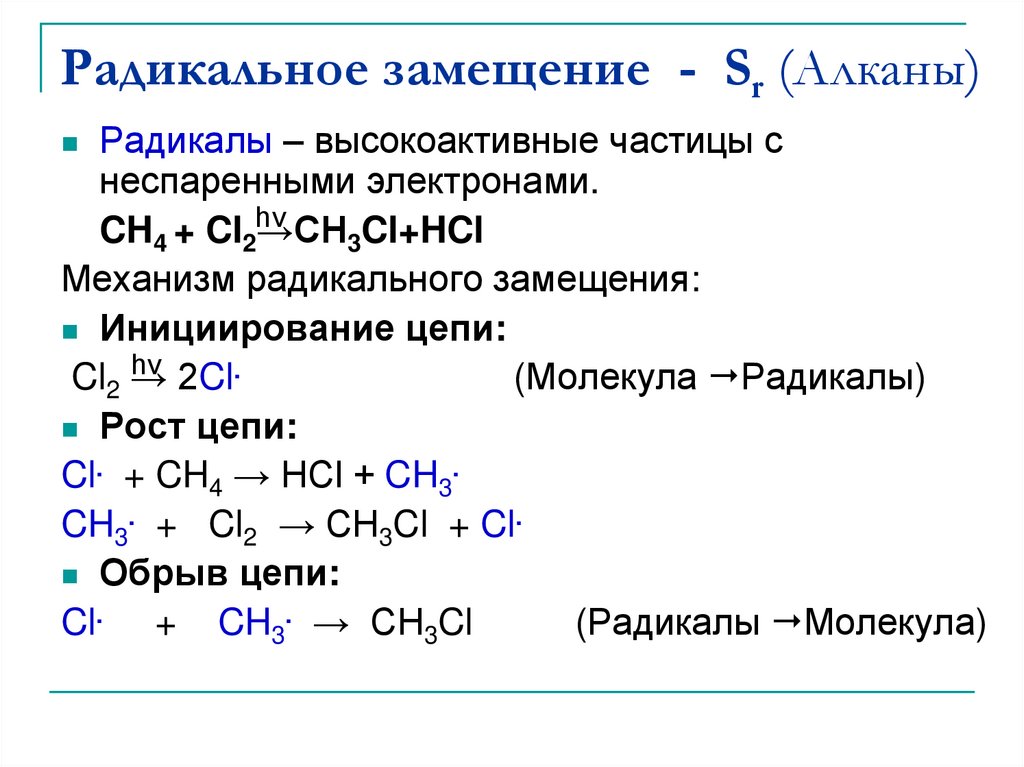
3. Радикальное замещение - Sr (Алканы)
Радикалы – высокоактивные частицы снеспаренными электронами.
CH4 + Cl2hν
→CH3Cl+HCl
Механизм радикального замещения:
Инициирование цепи:
hν
Cl2 →
2Cl.
(Молекула Радикалы)
Рост цепи:
Cl. + CH4 → HCl + CH3.
CH3. + Cl2 → CH3Cl + Cl.
Обрыв цепи:
Cl. + CH3. → CH3Cl
(Радикалы Молекула)
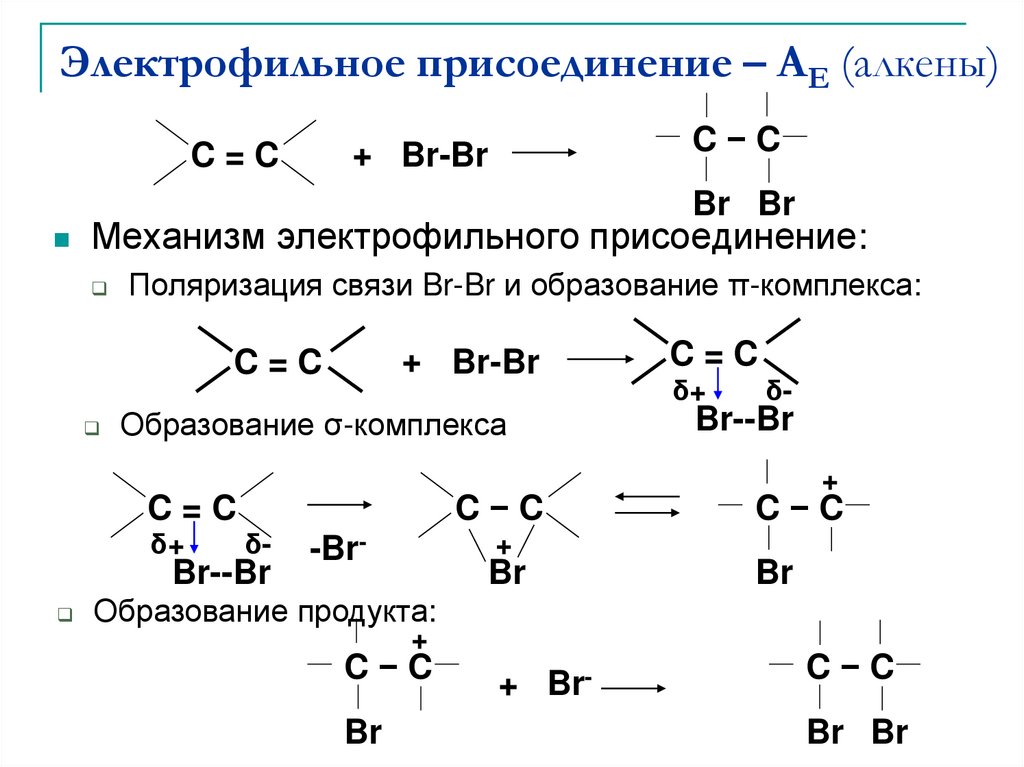
4. Электрофильное присоединение – AE (алкены)
C−C+ Br-Br
C=C
Br Br
Механизм электрофильного присоединение:
Поляризация связи Br-Br и образование π-комплекса:
+ Br-Br
C=C
Образование σ-комплекса
C−C
C=C
δ+
δ-
Br--Br
-Br-
+
Br
C=C
δ+
δ-
Br--Br
+
C−C
Br
Образование продукта:
+
C−C
Br
+ Br-
C−C
Br Br
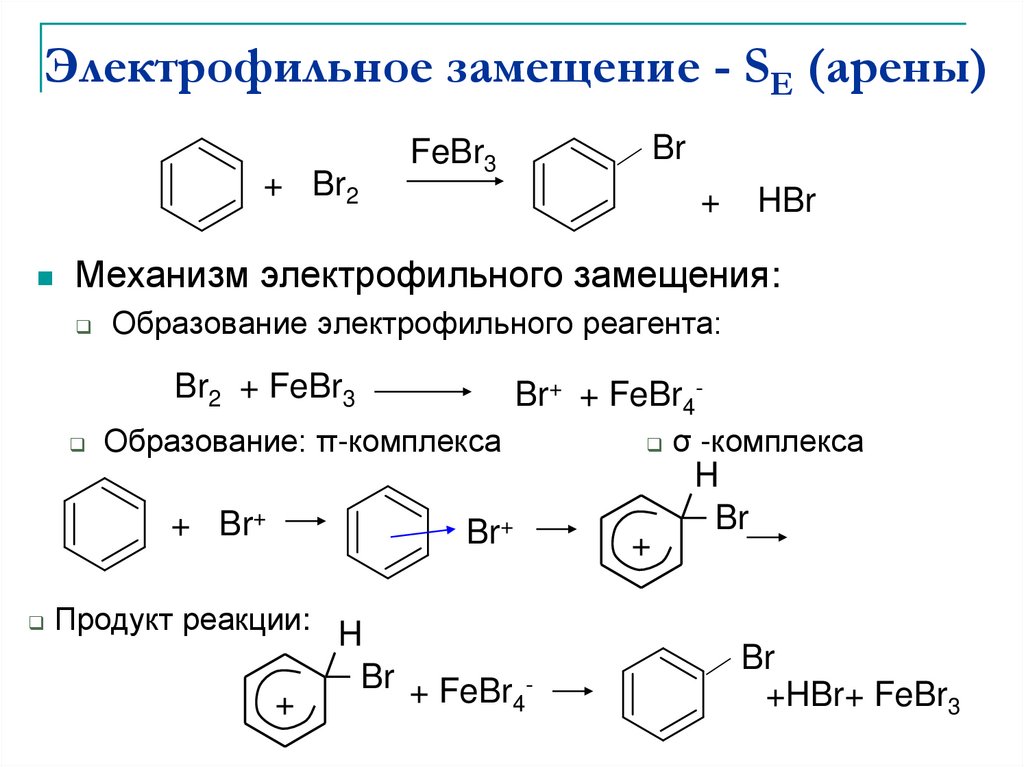
5. Электрофильное замещение - SE (арены)
+ Br2+
HBr
Механизм электрофильного замещения:
Образование электрофильного реагента:
Br2 + FeBr3
Br+ + FeBr4-
Образование: π-комплекса
+ Br+
Br
FeBr3
Br+
Продукт реакции:
+
H
Br + FeBr 4
+
σ -комплекса
H
Br
Br
+HBr+ FeBr3
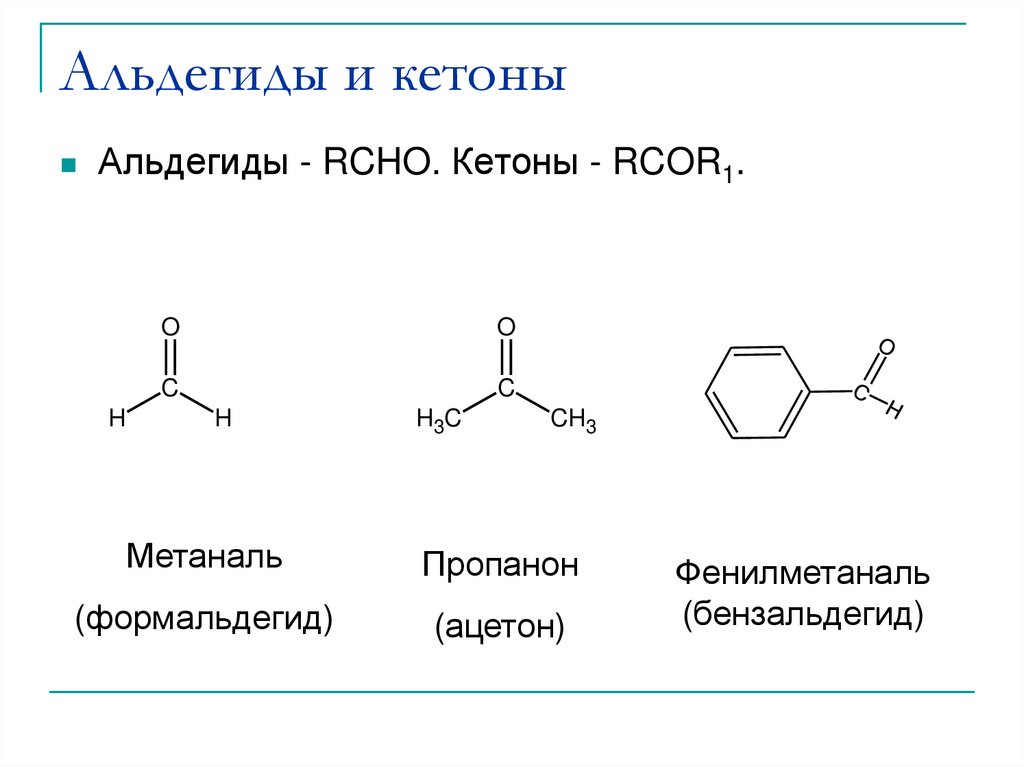
6. Альдегиды и кетоны
Альдегиды - RCHO. Кетоны - RCOR1.H
O
O
C
C
H
H3C
CH3
Метаналь
Пропанон
(формальдегид)
(ацетон)
Фенилметаналь
(бензальдегид)
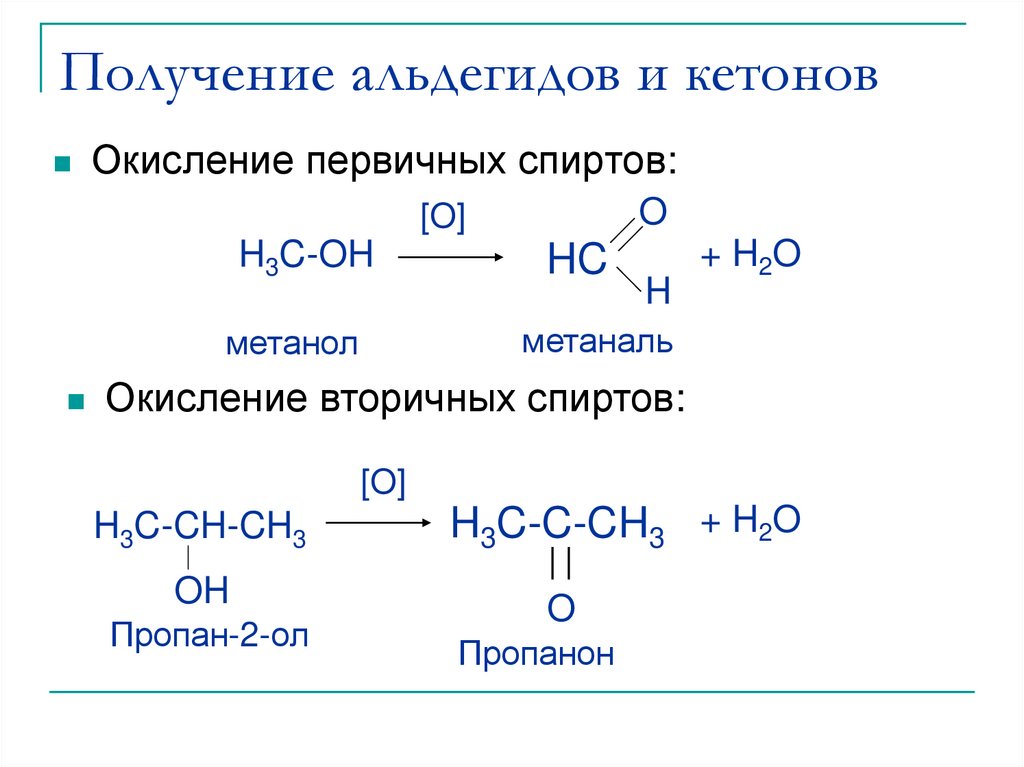
7. Получение альдегидов и кетонов
Окисление первичных спиртов:O
[O]
H3C-OH
H
+ H2O
метаналь
метанол
HC
Окисление вторичных спиртов:
[O]
H3C-CH-CH3
OH
Пропан-2-ол
H3C-C-CH3 + H2O
O
Пропанон
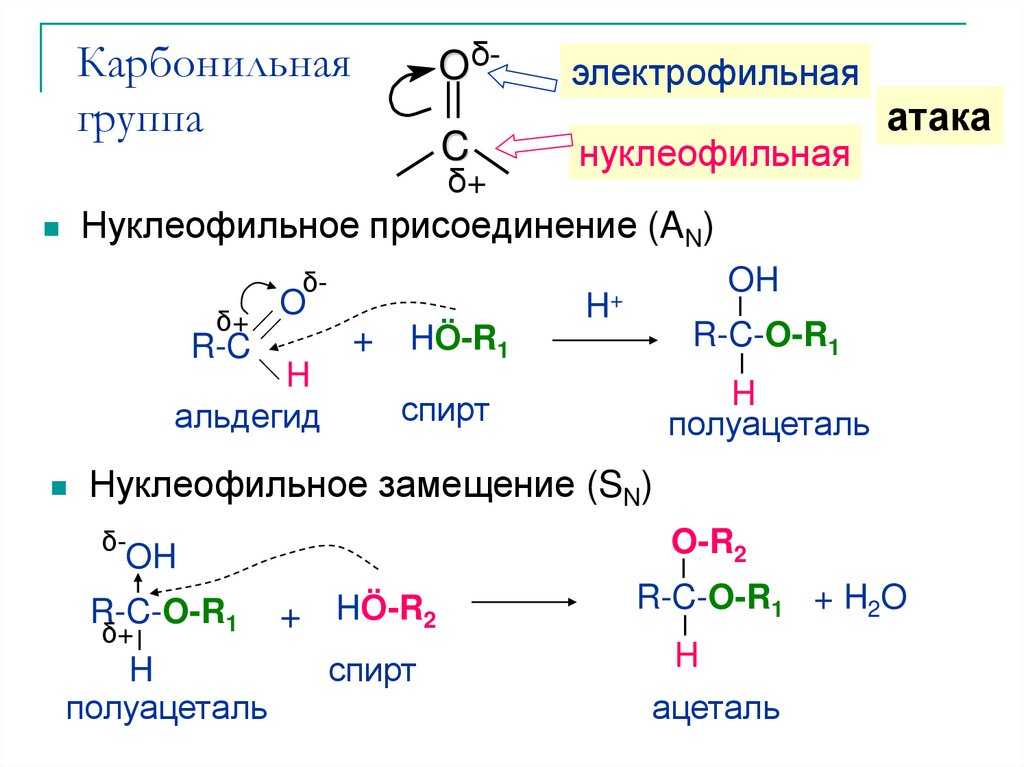
8. Карбонильная группа
Oδ-Карбонильная
группа
C
δ+
электрофильная
нуклеофильная
атака
Нуклеофильное присоединение (AN)
δ-
δ+
O
R-C
H
альдегид
+ HÖ-R1
OH
H+
R-C-O-R1
H
полуацеталь
спирт
Нуклеофильное замещение (SN)
δ-
O-R2
OH
R-C-O-R1
δ+
H
полуацеталь
+
HÖ-R2
спирт
R-C-O-R1 + H2O
H
ацеталь
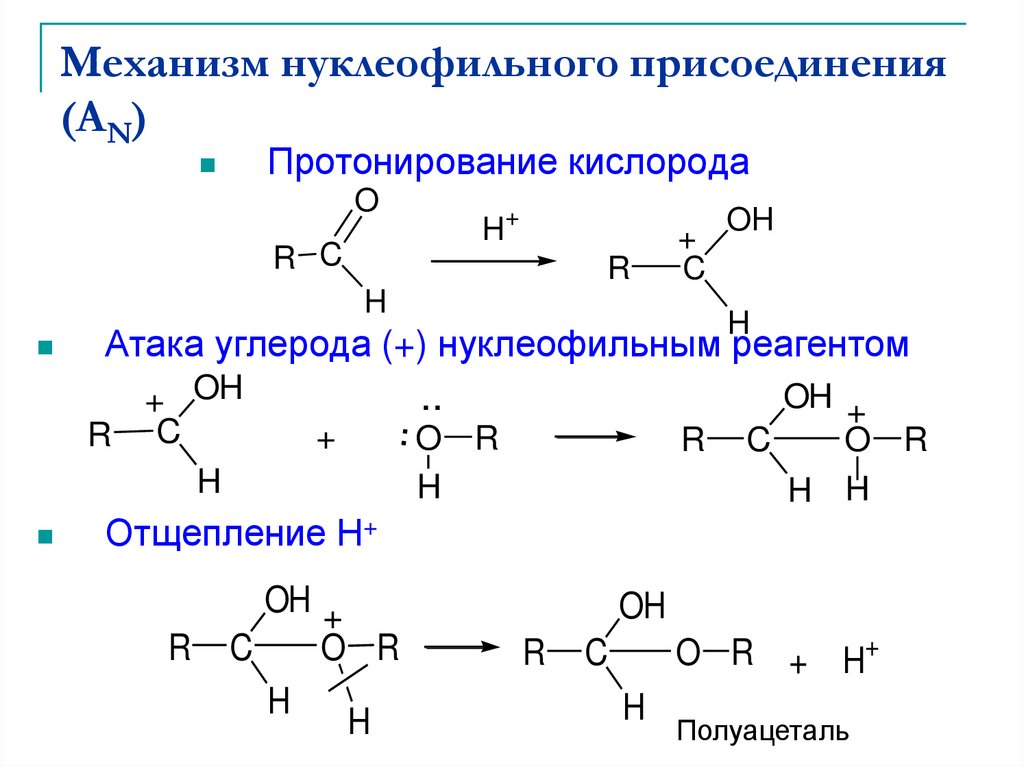
9. Механизм нуклеофильного присоединения (AN)
Протонирование кислородаO
H+
R C
R
+
C
H
+ OH
R C
H
H
Атака углерода (+) нуклеофильным реагентом
..
+
..
OH
O R
H
R
OH +
C
O R
H H
Отщепление Н+
R
OH +
C
O R
H
H
OH
R
O R + H+
C
H
Полуацеталь
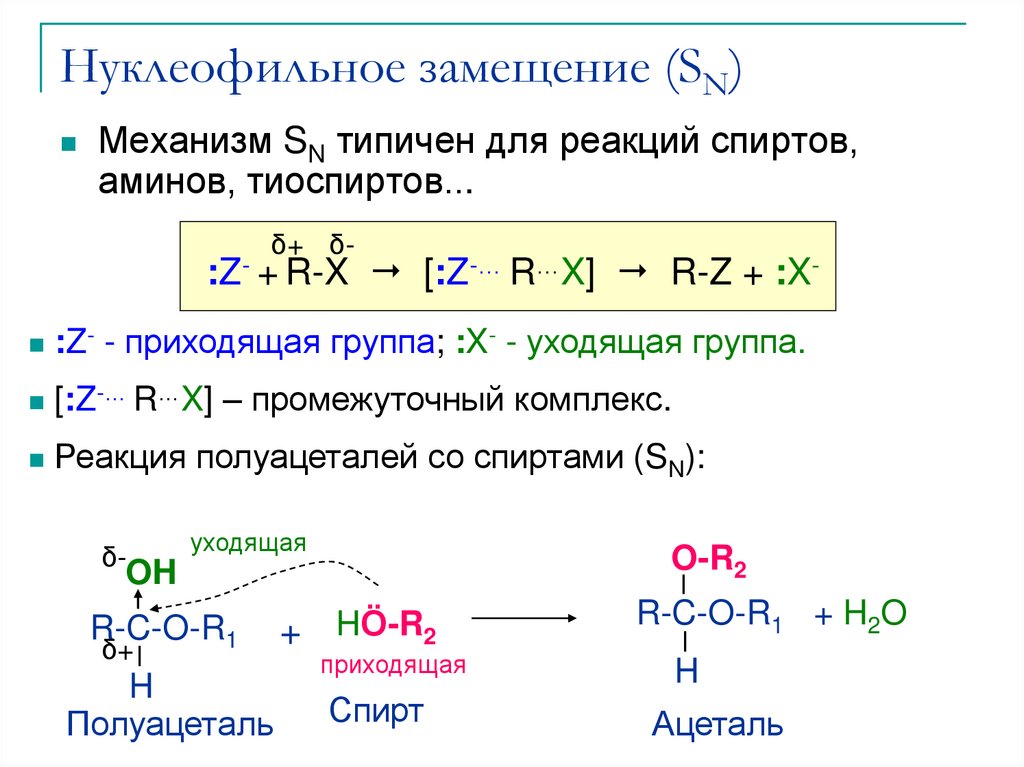
10. Нуклеофильное замещение (SN)
Механизм SN типичен для реакций спиртов,аминов, тиоспиртов...
δ+ δ-
:Z- + R-X [:Z-… R…X] R-Z + :X
:Z- - приходящая группа; :X- - уходящая группа.
[:Z-… R…X] – промежуточный комплекс.
Реакция полуацеталей со спиртами (SN):
δ-
уходящая
O-R2
OH
R-C-O-R1
δ+
H
Полуацеталь
+
HÖ-R2
приходящая
Спирт
R-C-O-R1 + H2O
H
Ацеталь
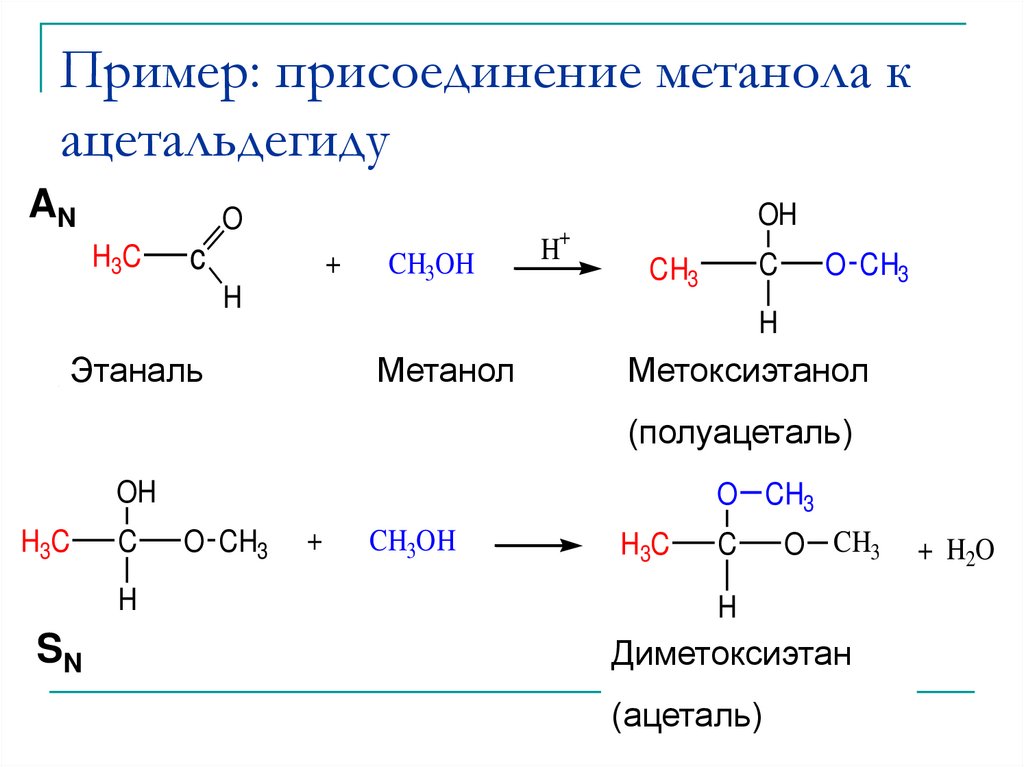
11. Пример: присоединение метанола к ацетальдегиду
ANO
H3C
c
+
CH3OH
H
H+
OH
C
CH3
O CH3
H
Этаналь (Ethanal)
Acetaldehyde
Метанол
Methanol
Метоксиэтанол
Methoxyethanol
(Hemiacetal)
(полуацеталь)
OH
H3C
C
H
SN
O CH3
O CH3
+
CH3OH
H3C
C
O CH3
H
Dimethoxyethane
Диметоксиэтан
(ацеталь)
(Acetal)
+ H2O
12. Углеводы
МоносахаридыДисахариды
Полисахариды
13. Углеводы (сахара)
Углеводы широко распространены врастительном и животном мире.
Основной источник углеводов – это растения,
которые синтезируют их путем фотосинтеза:
энергия (hν) + CO2 + H2O углеводы + O2
Животные употребляя углеводы окисляют их до
CO2 и воды, получая при этом энергию:
углеводы + O2 энергия(ATФ) + CO2 + H2O
14. Углеводы
Углеводы – это гетерофункциональныеорганические соединения, содержащие несколько
спиртовых групп и карбонильную группу
(альдегидную или кетонную).
Классификация углеводов:
Моносахариды – содержат одну полигидроксиальдегидную или кетонную структурную единицу.
Дисахариды содержат две моносахаридные единицы,
соединенные гликозидной связью.
Олигосахариды содержат 3-10 моносахаридных
остатков.
Полисахариды содержат более 10 моносахаридных
остатков.
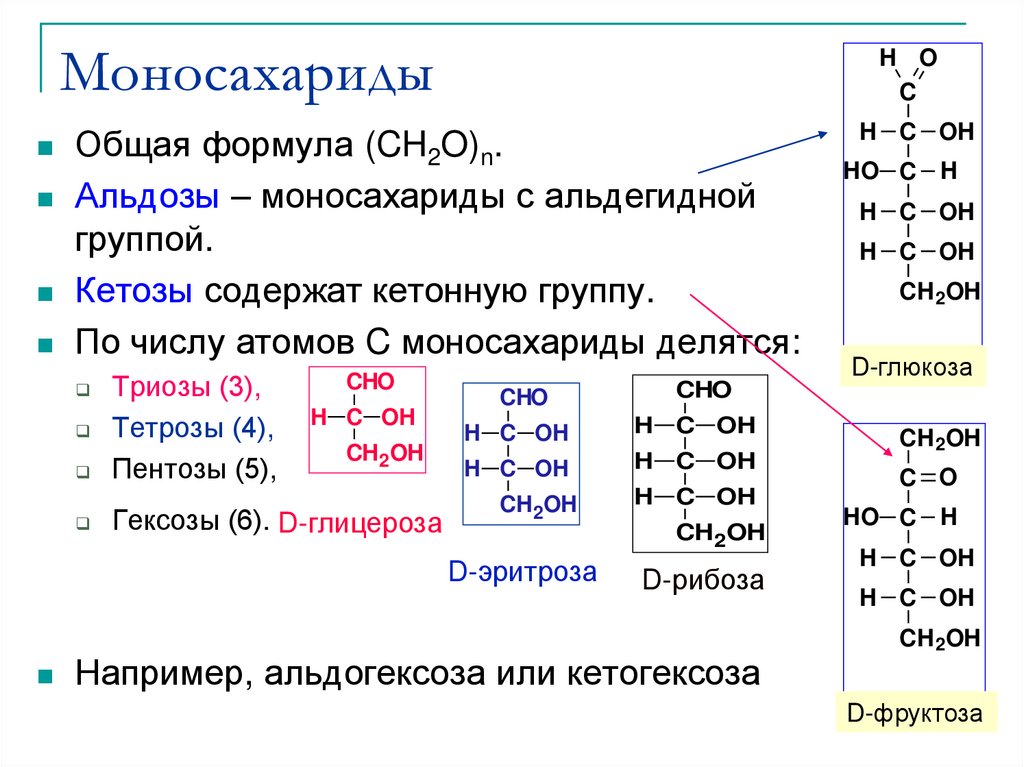
15. Моносахариды
H OC
Общая формула (CH2O)n.
Альдозы – моносахариды с альдегидной
группой.
Кетозы содержат кетонную группу.
По числу атомов C моносахариды делятся:
Триозы (3),
Тетрозы (4),
Пентозы (5),
CHO
H C OH
CH2OH
Гексозы (6). D-глицероза
CHO
H C OH
H C OH
H C OH
H C OH
CH2OH
D-эритроза
HO C H
H C OH
H C OH
CH 2OH
D-глюкоза
D-Glucose
CHO
H C OH
CH 2OH
H C OH
D-рибоза
Например, альдогексоза или кетогексоза
CH2OH
C O
HO C H
H C OH
H C OH
CH2OH
D-фруктоза
D-Fructose
16. Изомерия моносахаридов
Основной тип изомерии моносахаридов – этостереоизомерия.
Стереоизмеры отличаются различным
пространственным расположением атомов или
функциональных групп.
Основой стереоизомерии являются ассиметрические
или хиральные центры в молекуле.
Углерод, связанный с четырьмя различными
заместителями, называется хиральным центром.
Количество стереоизомеров
составляет 2n, где n – количество
хиральных углеродов.
n=1; изомеров=21=2
глицеральдегид
CHO
*
H C OH
CH2OH
D
CHO
*
HO C H
CH2OH
L
17. Оптическая изомерия
Стереоизомеры, которые являются зеркальнымиотображениями, называются энантиомерами.
Энантиомеры обладают одинаковыми
химическими и физическими свойствами и
отличаются по оптической активности –
способности вращать плоскость поляризации
света.
Правовращающие изомеры обозначаются (+),
левовращающие - (-).
Остальные стереоизомеры называются
диастереомерами.
Диастереомеры являются различными химическими
соединениями, с различными физическими и
химическими свойствами.
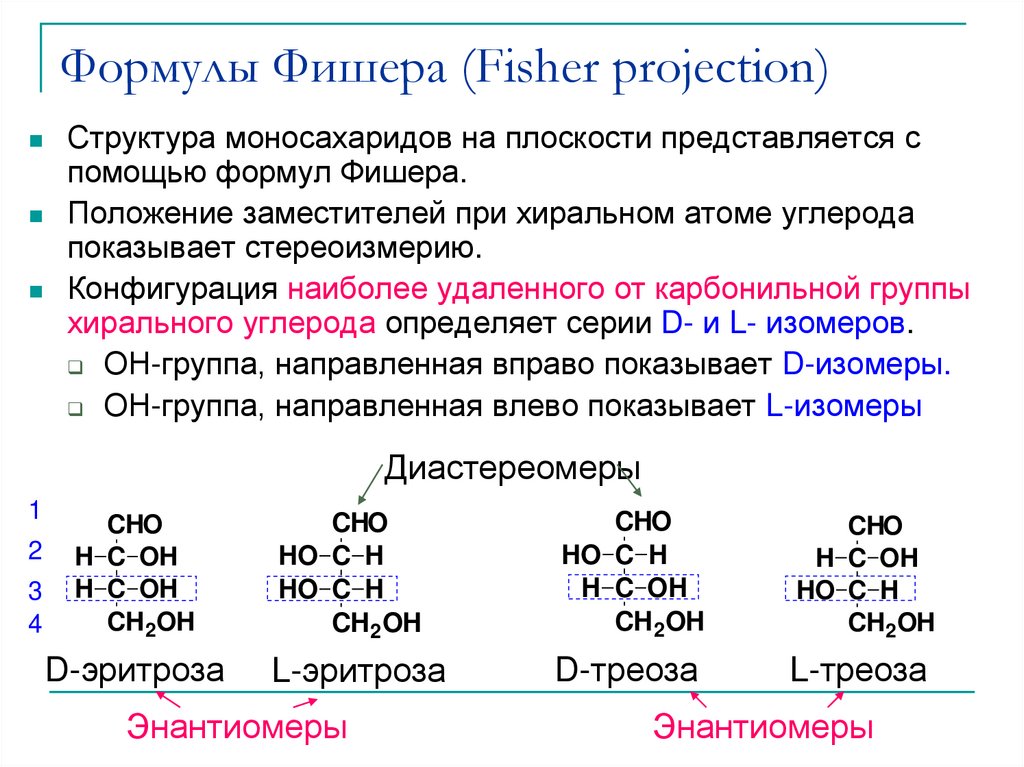
18. Формулы Фишера (Fisher projection)
Структура моносахаридов на плоскости представляется спомощью формул Фишера.
Положение заместителей при хиральном атоме углерода
показывает стереоизмерию.
Конфигурация наиболее удаленного от карбонильной группы
хирального углерода определяет серии D- и L- изомеров.
ОН-группа, направленная вправо показывает D-изомеры.
ОН-группа, направленная влево показывает L-изомеры
Диастереомеры
1
2
3
4
CHO
H C OH
H C OH
CH 2OH
D-эритроза
CHO
HO C H
HO C H
CH 2OH
CHO
HO C H
H C OH
CH 2OH
CHO
H C OH
HO C H
CH 2OH
L-эритроза
D-треоза
L-треоза
Энантиомеры
Энантиомеры
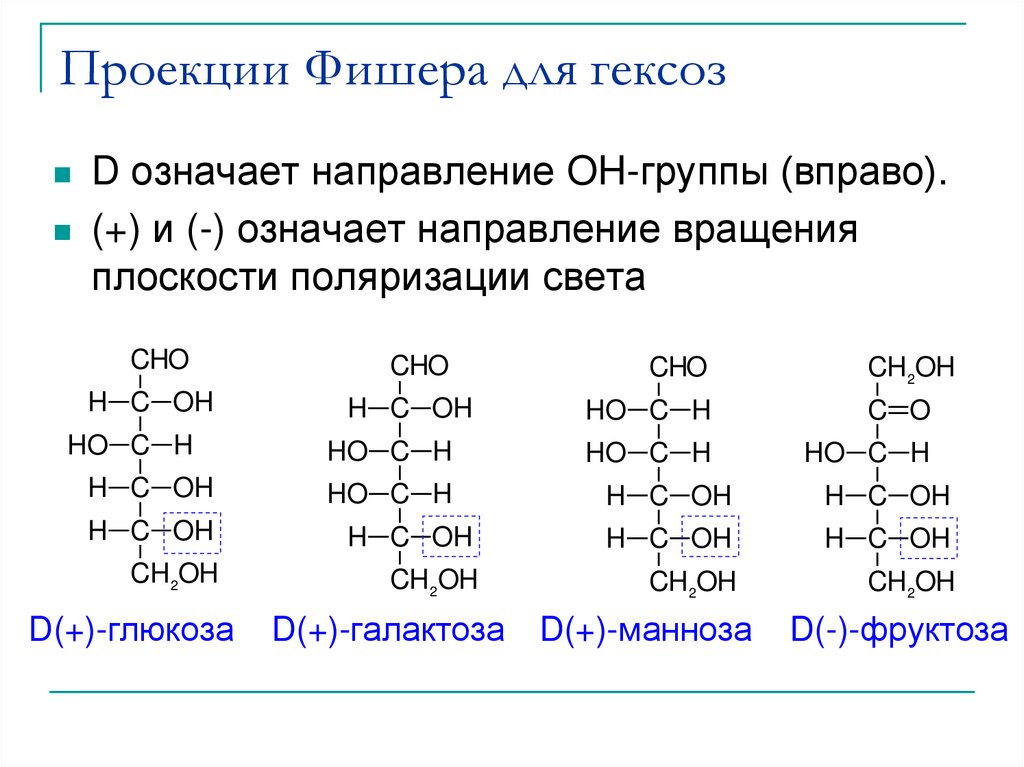
19. Проекции Фишера для гексоз
D означает направление OH-группы (вправо).(+) и (-) означает направление вращения
плоскости поляризации света
CHO
H C OH
HO C H
H C OH
CHO
H C OH
HO C H
HO C H
CHO
CH2OH
HO C H
C O
HO C H
HO C H
H C OH
H C OH
H C OH
H C OH
H C OH
H C OH
CH2OH
CH2OH
CH2OH
CH2OH
D(+)-глюкоза
D(+)-галактоза
D(+)-манноза
D(-)-фруктоза
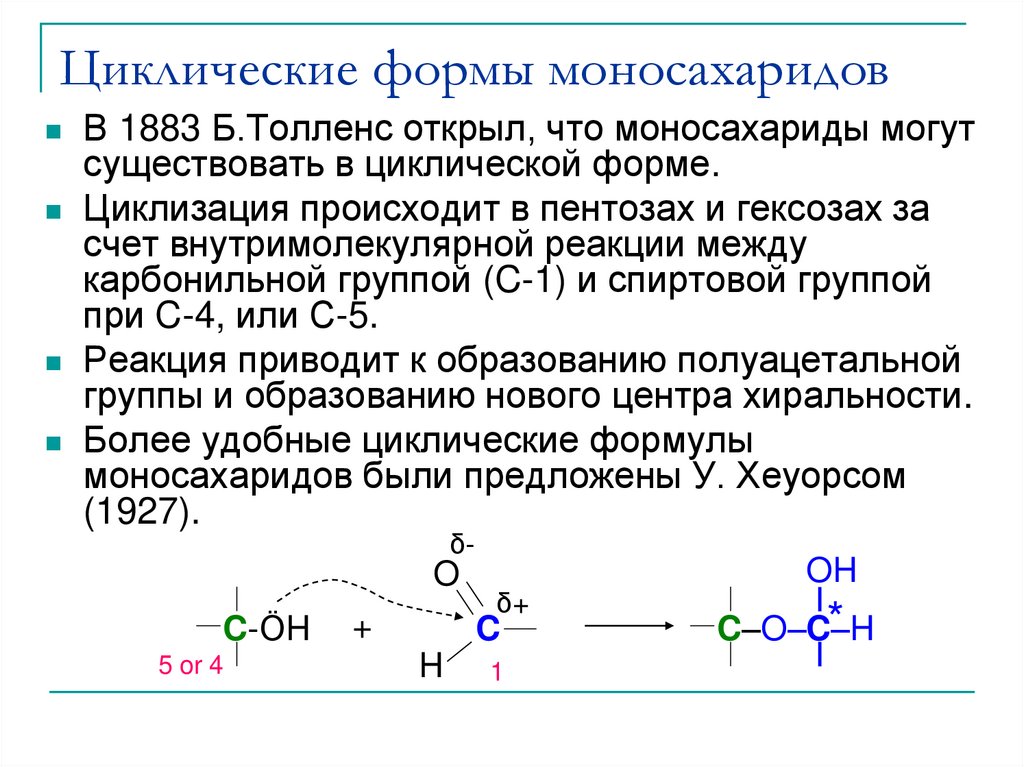
20. Циклические формы моносахаридов
В 1883 Б.Толленс открыл, что моносахариды могутсуществовать в циклической форме.
Циклизация происходит в пентозах и гексозах за
счет внутримолекулярной реакции между
карбонильной группой (C-1) и спиртовой группой
при C-4, или С-5.
Реакция приводит к образованию полуацетальной
группы и образованию нового центра хиральности.
Более удобные циклические формулы
моносахаридов были предложены У. Хеуорсом
(1927).
δ-
O
C-ÖH
5 or 4
+
δ+
C
H
1
OH
*
C–O–C–H
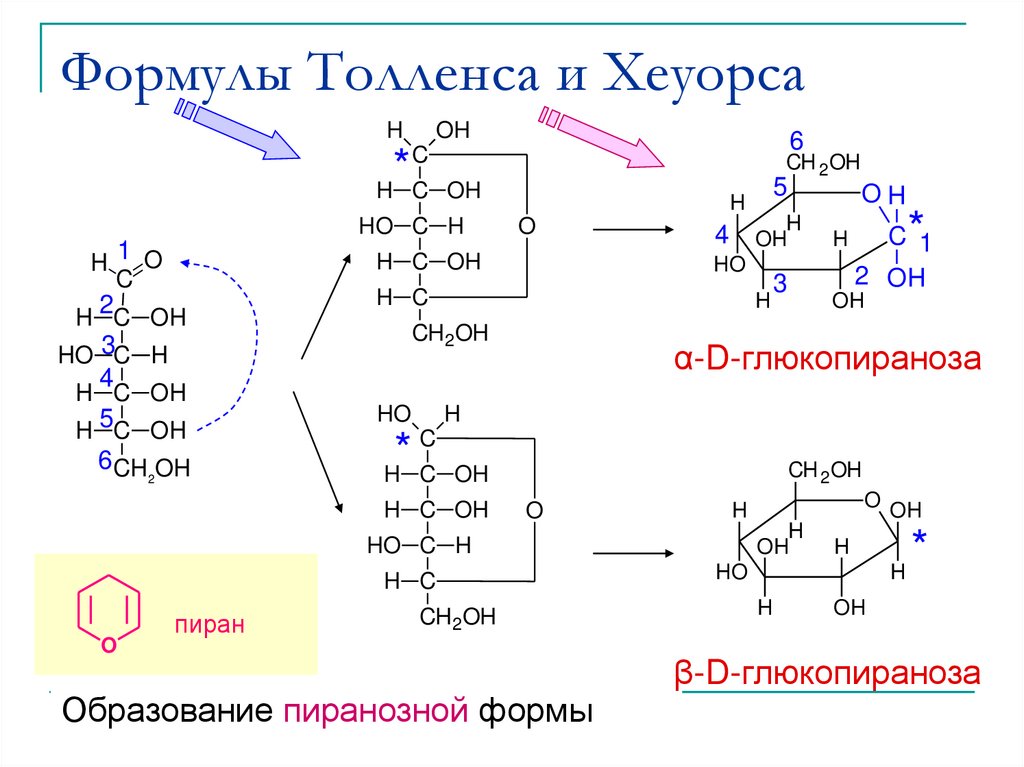
21. Формулы Толленса и Хеуорса
H*
OH
6
C
CH 2 OH
H C OH
HO C H
H 1 O
O
H C OH
C
2
H C OH
H C OH
H 5C OH
6 CH OH
2
HO
H
CH2OH
HO
*
C 1
2 OH
OH
α-D-глюкопираноза
C
*
H C
CH 2 OH
OH
O
H C
CH2OH
Образование пиранозной формы
O OH
H
H
OH
HO C H
O
3
H
H
H C OH
пиран
OH
H
OH
4
H C
HO 3C H
4
5
H
H
HO
H
H
*
OH
β-D-глюкопираноза
22. Правила написания формул Хеуорса
Возможно образование только 5-членных циклов(фуранозная форма) и 6-членных циклов (пиранозная
форма).
Полуацетальная группа записывается справа.
Гидроксил, направленный в формуле Фишера вправо,
по Хеуорсу должен быть направлен вниз.
Гидроксил, направленный в формуле Фишера влево, по
Хеуорсу должен быть направлен вверх.
CH OH
2
Нумерация начинается с полуацетального
углерода.
Положение гидроксила при новом хиральном
центре образует два новых стереоизомера,
которые называются аномеры.
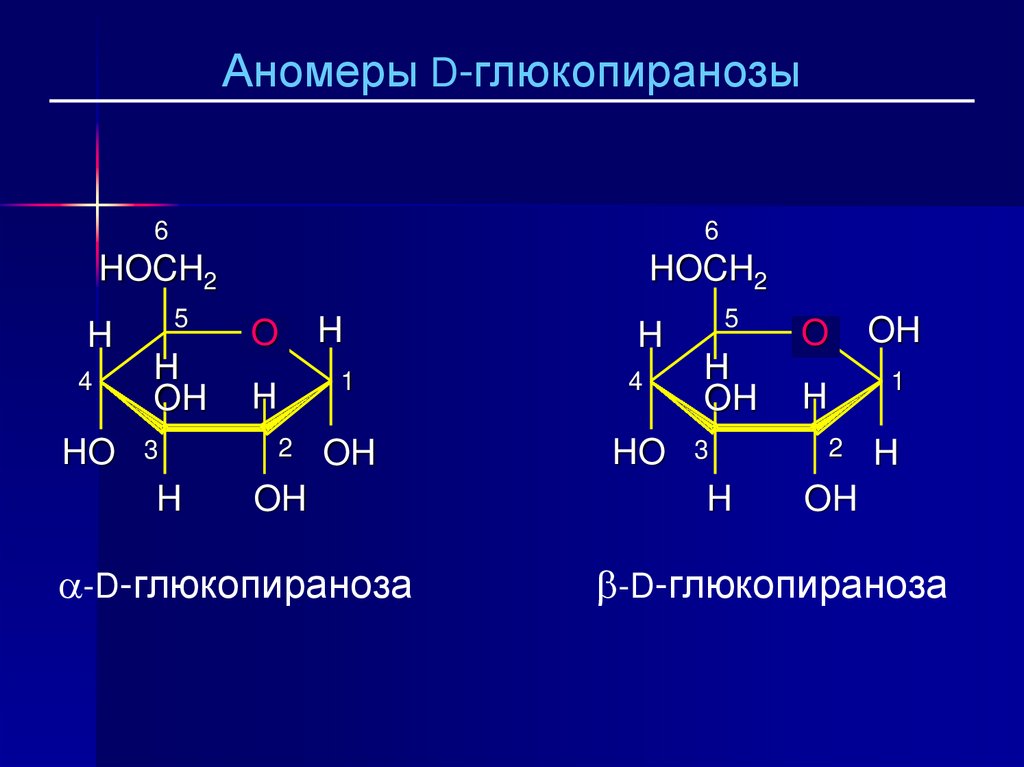
α-аномер содержит OH-группу, направленную вниз.
β-аномер содержит OH-группу, направленную вверх.
H
H
OH
OH
H
HO
OH
H
OH
CH2OH
O OH
H
H
OH H
HO
H
H
OH
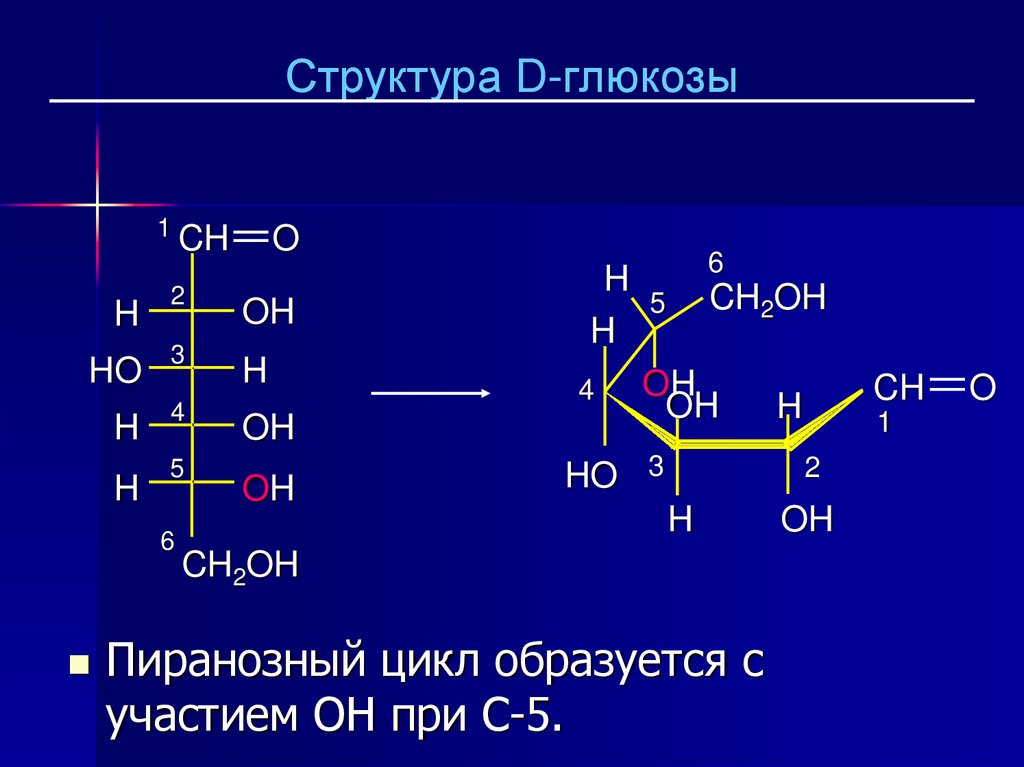
23.
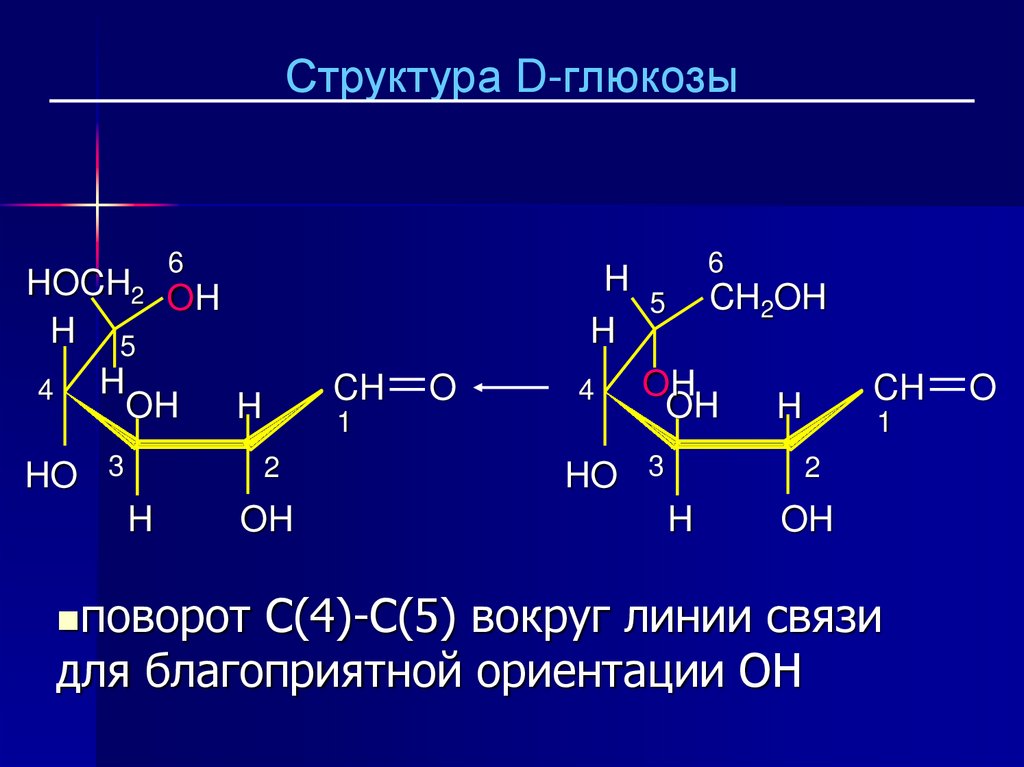
Структура D-глюкозы1
CH
O
2
OH
HO
3
H
H
4
H
H
5
6
OH
OH
6
H
CH2OH
5
H
OH
4
OH
H
HO 3
2
H
CH2OH
Пиранозный цикл образуется с
участием OH при C-5.
OH
CH
1
O
24.
Структура D-глюкозы6
6
HOCH2 OH
H 5
H
4
OH
H
HO 3
CH
1
2
H
OH
поворот
O
H
CH2OH
5
H
OH
4
OH
H
HO 3
CH
1
2
H
OH
C(4)-C(5) вокруг линии связи
для благоприятной ориентации OH
O
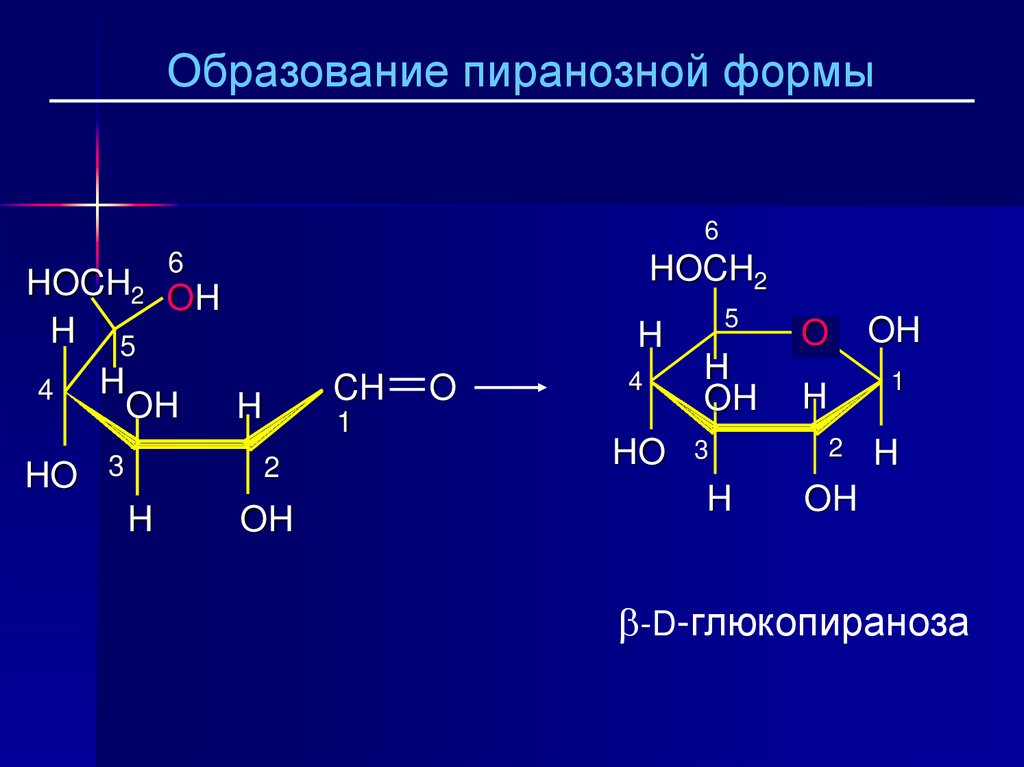
25.
Образование пиранозной формы6
6
HOCH2
HOCH2 OH
H 5
H
4
OH
H
HO
3
H
CH
1
2
H
O
4
OH
HO
5
H
OH
3
H
O
OH
H
1
2
H
OH
-D-глюкопираноза
26.
Аномеры D-глюкопиранозы6
6
HOCH2
HOCH2
H
4
HO
5
H
OH
3
H
O
H
2
H
H
1
4
OH
HO
OH
-D-глюкопираноза
5
H
OH
3
H
O
OH
H
1
2
H
OH
-D-глюкопираноза
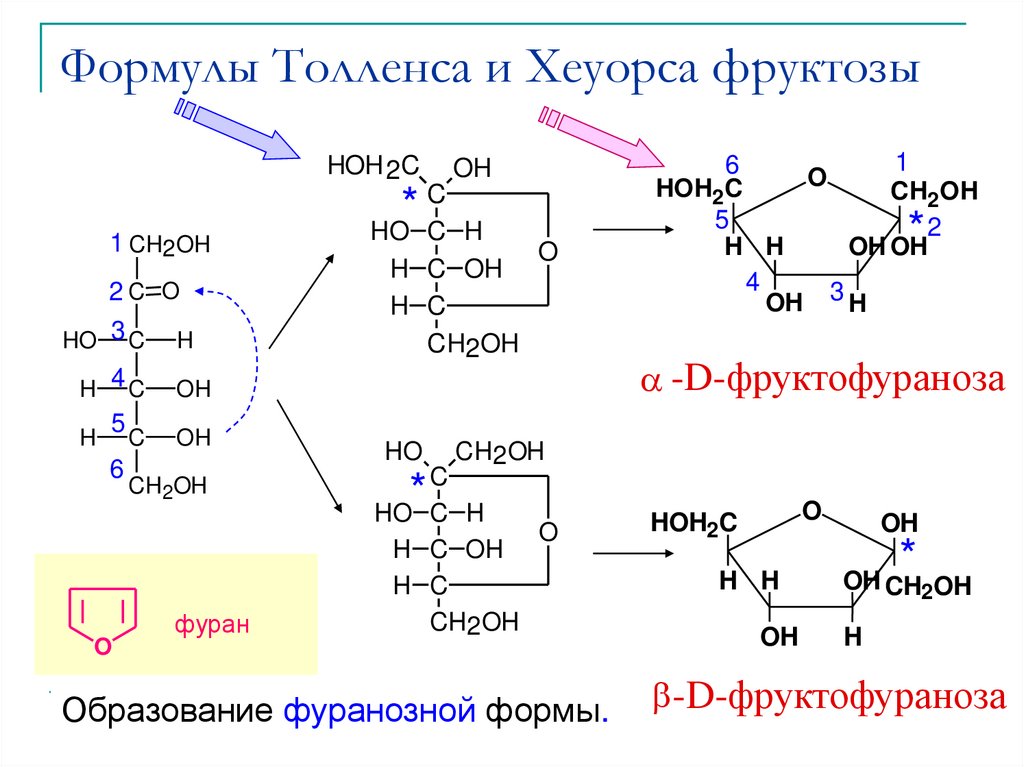
27. Формулы Толленса и Хеуорса фруктозы
HOH 2C1 CH2OH
2C O
HO 3 C
H 4C
H
5
6
C
H
C
*
HO C
H
O
H C OH
H C
CH2OH
OH
OH
CH2OH
фуран
O
OH
HO
C
*
HO C
1
6
O
HOH2C
CH2OH
5
2
H H
OH OH
4
OH 3 H
*
-D-фруктофураноза
CH2 OH
H
O
H C OH
H C
CH2 OH
Образование фуранозной формы.
O
HOH2C
H H
OH
OH
*
OH CH2OH
H
-D-фруктофураноза
28. Мутаротация
В водном растворе устанавливается равновесие междуциклическими и линейными структурами
моносахаридов, которое носит название мутаротация.
-D-глюкоза D- глюкоза (линейная) β-D- глюкоза
(36%)
(следы)
(64%)
Например в водном растворе глюкозы наблюдается
равновесие, при котором, α-формы - 36% , β - 64%
(>99% глюкозы находится в пиранозной форме).
В ряде случаев мутаротация приводит к изменению
угла вращения плоскости поляризации света во
времени.
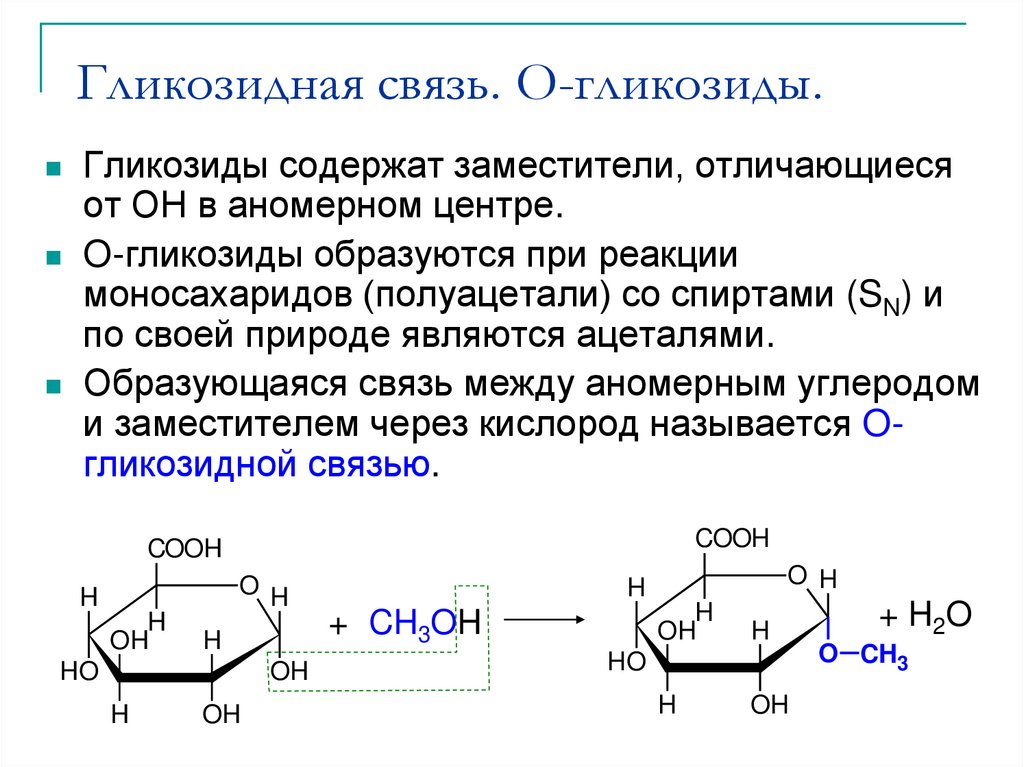
29. Гликозидная связь. O-гликозиды.
Гликозиды содержат заместители, отличающиесяот ОН в аномерном центре.
O-гликозиды образуются при реакции
моносахаридов (полуацетали) со спиртами (SN) и
по своей природе являются ацеталями.
Образующаяся связь между аномерным углеродом
и заместителем через кислород называется Oгликозидной связью.
COOH
COOH
O H
H
H
OH
H
HO
OH
H
OH
O H
H
+ CH3OH
H
OH
H
H
OH
HO
+ H2O
O CH3
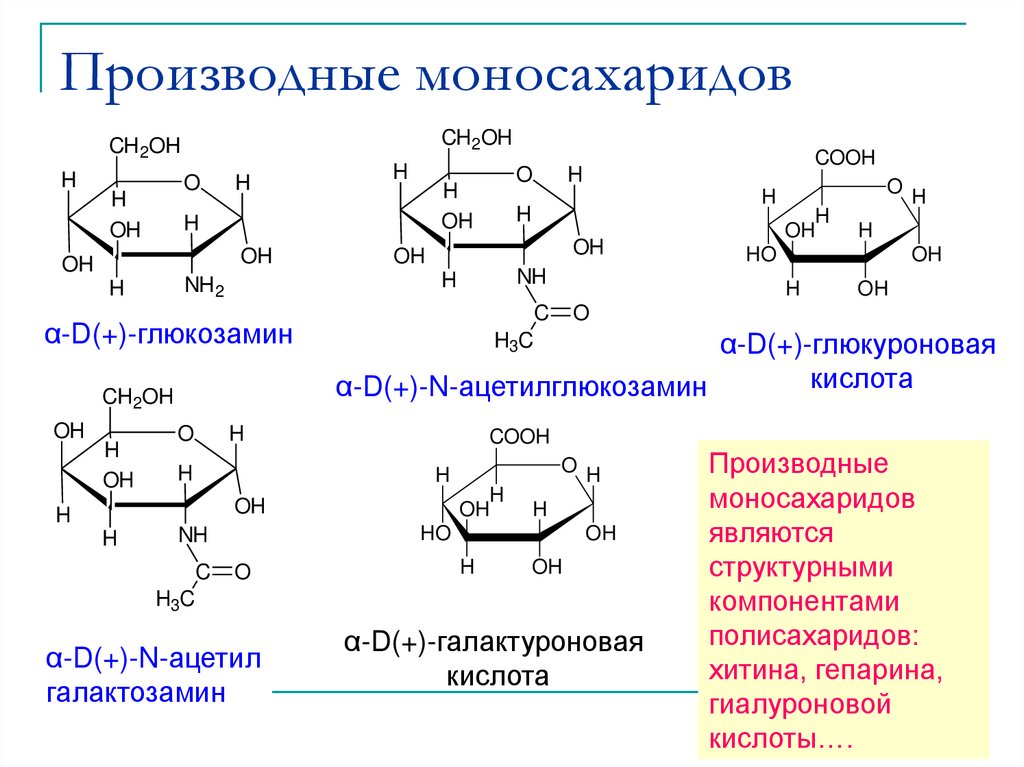
30. Производные моносахаридов
CH 2OHCH2OH
H
O
H
OH
H
OH
α-D(+)-глюкозамин
CH 2OH
H
OH
O
OH
C
O
HO
OH
OH
α-D(+)-глюкуроновая
кислота
α-D(+)-N-ацетилглюкозамин
H3C
COOH
O H
H
OH
H
OH
H
OH
H3C
α-D(+)-N-ацетил
галактозамин
H
O
HO
NH
H
OH
H
C
OH
H
NH
H
H
O H
H
OH
H
H
COOH
H
H
H
NH2
H
O
H
OH
H
OH
OH
H
α-D(+)-галактуроновая
кислота
Производные
моносахаридов
являются
структурными
компонентами
полисахаридов:
хитина, гепарина,
гиалуроновой
кислоты….
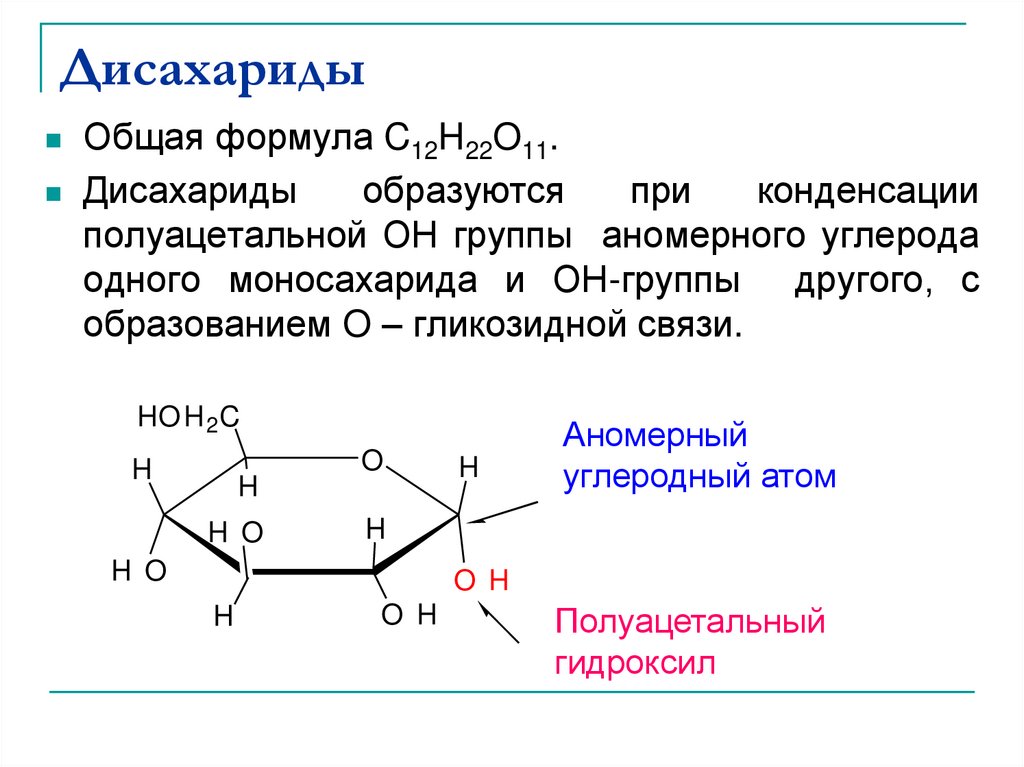
31. Дисахариды
Общая формула C12H22O11.Дисахариды
образуются
при
конденсации
полуацетальной ОН группы аномерного углерода
одного моносахарида и ОН-группы другого, с
образованием O – гликозидной связи.
HO H 2 C
H
H
H O
O
H
Аномерный
углеродный атом
H
H O
O H
H
O H
Полуацетальный
гидроксил
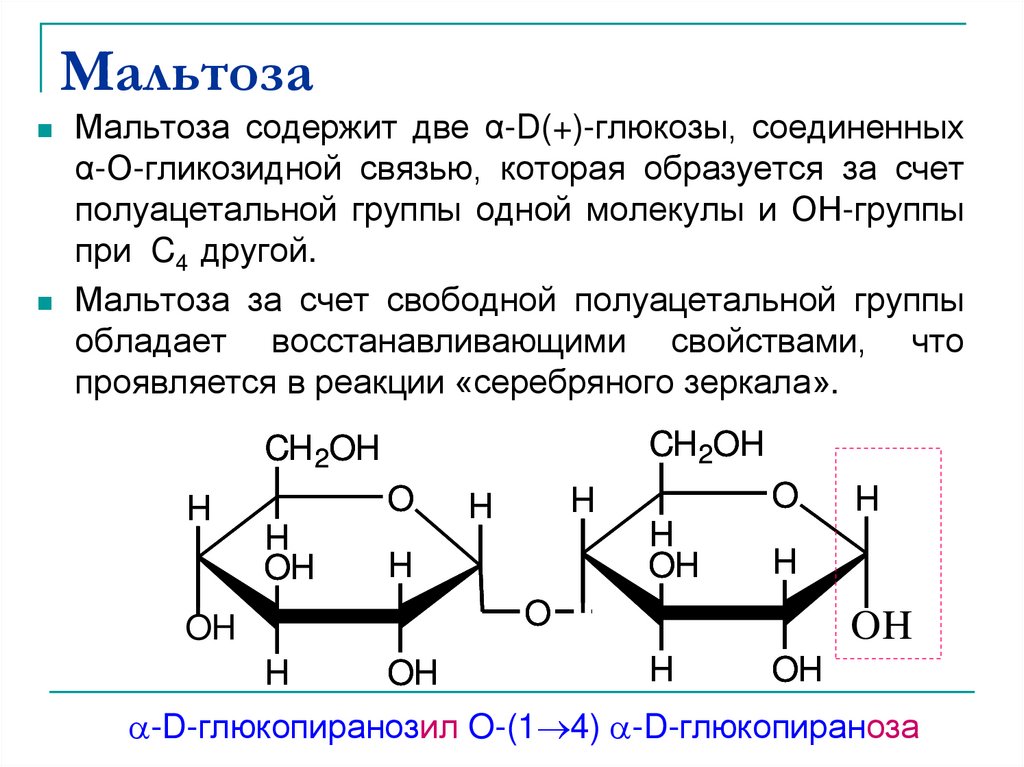
32. Мальтоза
Мальтоза содержит две α-D(+)-глюкозы, соединенныхα-О-гликозидной связью, которая образуется за счет
полуацетальной группы одной молекулы и ОН-группы
при C4 другой.
Мальтоза за счет свободной полуацетальной группы
обладает восстанавливающими свойствами, что
проявляется в реакции «серебряного зеркала».
CH2OH
CH2OH
H
O
H
OH
O
H
H
H
OH
H
H
O
OH
H
OH
H
OH
H
OH
-D-глюкопиранозил O-(1 4) -D-глюкопираноза
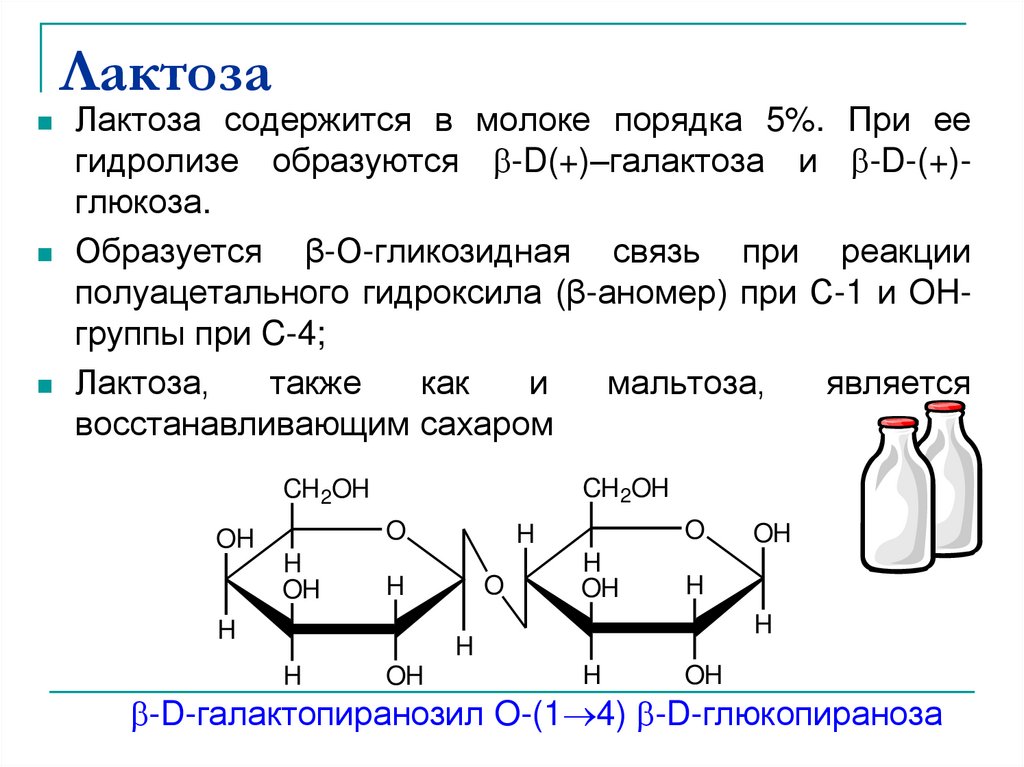
33. Лактоза
Лактоза содержится в молоке порядка 5%. При еегидролизе образуются -D(+)–галактоза и -D-(+)глюкоза.
Образуется β-О-гликозидная связь при реакции
полуацетального гидроксила (β-аномер) при С-1 и OHгруппы при C-4;
Лактоза,
также
как
и
мальтоза,
является
восстанавливающим сахаром
CH 2OH
CH 2OH
O
OH
H
OH
O
H
H
O
H
H
OH
H
H
H
H
OH
OH
H
OH
-D-галактопиранозил O-(1 4) -D-глюкопираноза
34. Сахароза
Сахароза состоит из -D(+)глюкозы и β-D(-)-фруктозы, которыесвязаны О-гликозидной связью.
В образовании связи принимают
участие полуацетальный углерод
фруктозы (C-2) и полуацетальный
углерода глюкозы С-1.
Сахароза является
невосстанавливающим сахаром изза отсутствия свободных
полуацетальных групп.
CH 2OH
O
H
H
OH
H
H
OH
H
OH
O
HOH2C
O
H
OH
CH 2OH
H
OH
H
-D-глюкопиранозил O-(1 2) -D- фруктофуранозид
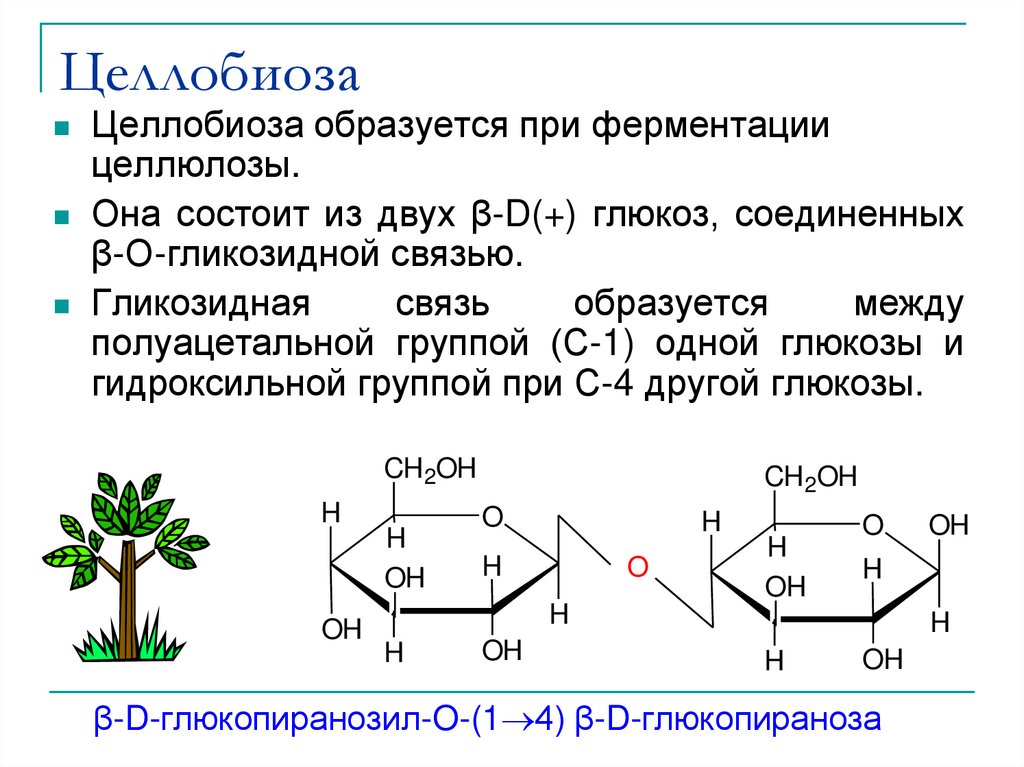
35. Целлобиоза
Целлобиоза образуется при ферментациицеллюлозы.
Она состоит из двух β-D(+) глюкоз, соединенных
β-О-гликозидной связью.
Гликозидная
связь
образуется
между
полуацетальной группой (С-1) одной глюкозы и
гидроксильной группой при С-4 другой глюкозы.
CH2OH
H
OH
H
OH
CH 2OH
O
H
H
O
H
OH
O
H
H
H
OH
OH
H
H
OH
β-D-глюкопиранозил-O-(1 4) β-D-глюкопираноза
36. Полисахариды
Общая формула (C6H10O5)n.Полисахариды делятся на:
Гомополисахариды (крахмал, целлюлоза,
гликоген, хитин), состоящие только из
одного типа моносахаридов.
Гетерополисахариды (гиалуроновая
кислота, хондроитин-4-сульфат, гепарин),
состоящие из двух или более типов
моносахаридов.
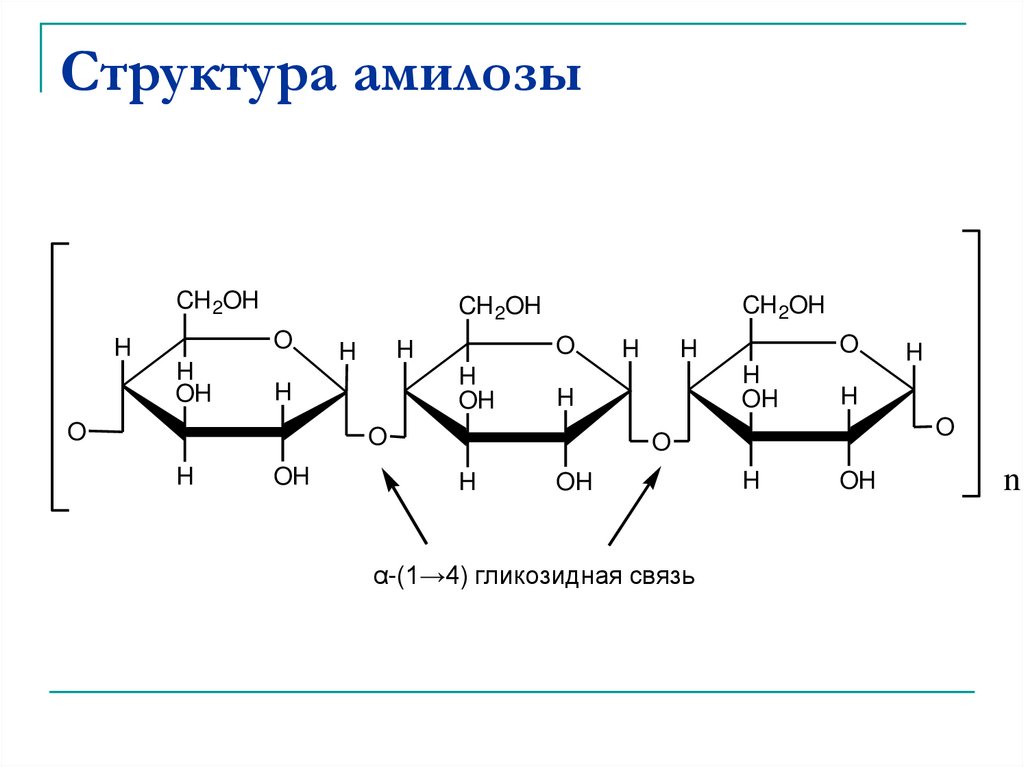
37. Гомополисахариды
Крахмал - состоит из двух компонентов:амилозы, растворимой в воде (15-20%), и
амилопектина, нерастворимого в воде (8580%).
Амилоза состоит из неразветвленных цепей,
построенных из молекул α-глюкозы,
соединенных 1→4 гликозидными связями.
Амилопектин cостоит из разветвленных
цепей α-глюкозы, построенных за счет 1→4
гликозидных связей, и соединенных между
собой 1→6 связями.
38. Структура амилозы
CH 2OHO
H
H
OH
CH 2OH
CH 2OH
H
OH
H
O
O
H
H
OH
O
H
H
OH
H
O
H
H
H
O
O
H
OH
α-(1→4) гликозидная связь
H
H
OH
n
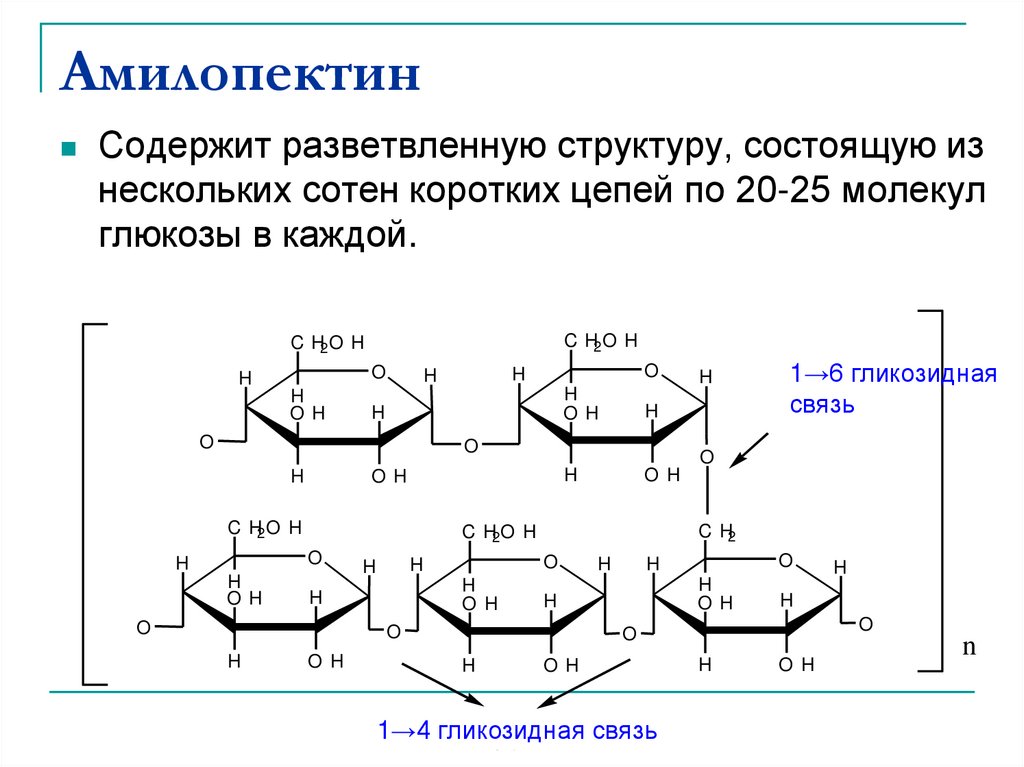
39. Амилопектин
Содержит разветвленную структуру, состоящую изнескольких сотен коротких цепей по 20-25 молекул
глюкозы в каждой.
C H2 O H
C H2 O H
O
H
H
O H
O
H
H
H
O
H
O H
H
H
O H
O
H
H
O H
C H2
C H2 O H
O
H
H
O H
H
O
O
H
H
O H
H
O
H
H
O H
H
O
H
1→6 гликозидная
связь
O
O H
C H2 O H
H
H
O
O
H
O H
1→4 гликозидная
bond
1-4 glycosidicсвязь
H
H
O H
n
40. Целлюлоза
Целлюлоза – гомополисахарид, состоящий изнеразветвленных цепей β-глюкозы, соединенных
1→4 гликозидной связью.
CH 2OH
O
H
O
H
OH
CH 2OH
CH 2OH
O
H
H
O
H
OH
H
OH
O
H
H
O
H
H
OH
H
H
H
H
OH
β (1→ 4) гликозидная связь
O
H
OH
n
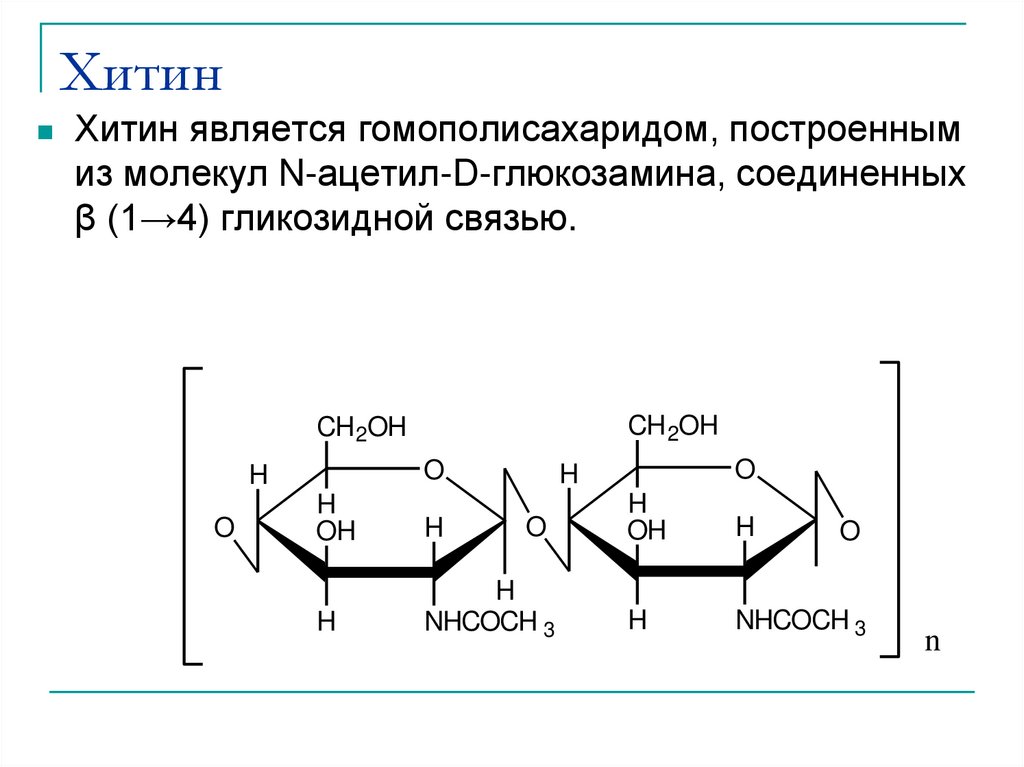
41. Хитин
Хитин является гомополисахаридом, построеннымиз молекул N-ацетил-D-глюкозамина, соединенных
β (1→4) гликозидной связью.
CH 2OH
CH 2OH
O
H
O
O
H
H
OH
H
H
H
NHCOCH 3
O
H
OH
H
H
NHCOCH 3
O
n
42. Гетерополисахариды
Гетерополисахаридыпостроены
из
различных
моносахаридов
и
их
производных.
Гиалуроновая кислота (β-глюкуроновая
кислота и N-ацетил глюкозамин).
Хондроитин-4-сульфат (β-глюкуроновая
кислота и N-ацетил галактозамин-4сульфат).
Гепарин (α-D-глюкозамин и уроновые
кислоты).
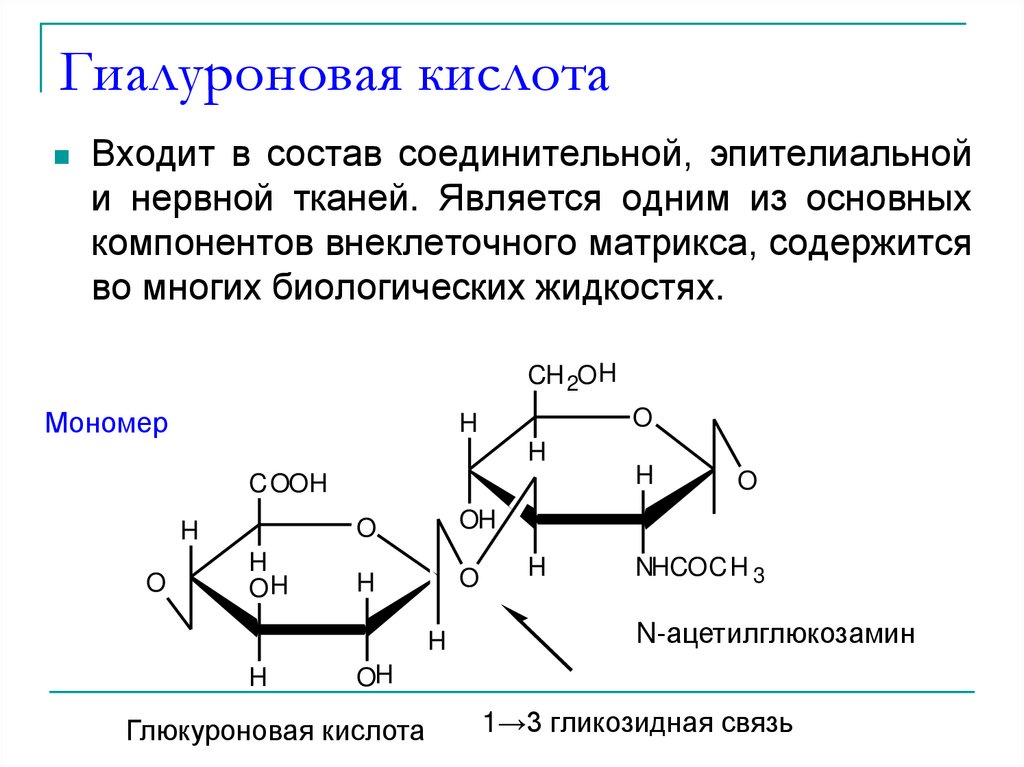
43. Гиалуроновая кислота
Входит в состав соединительной, эпителиальнойи нервной тканей. Является одним из основных
компонентов внеклеточного матрикса, содержится
во многих биологических жидкостях.
CH 2O H
Мономер
O
H
H
COOH
H
O
H
OH
O
OH
H
O
H
H
H
H
O
NHCOCH 3
N-ацетилглюкозамин
OH
Глюкуроновая кислота
1→3 гликозидная связь
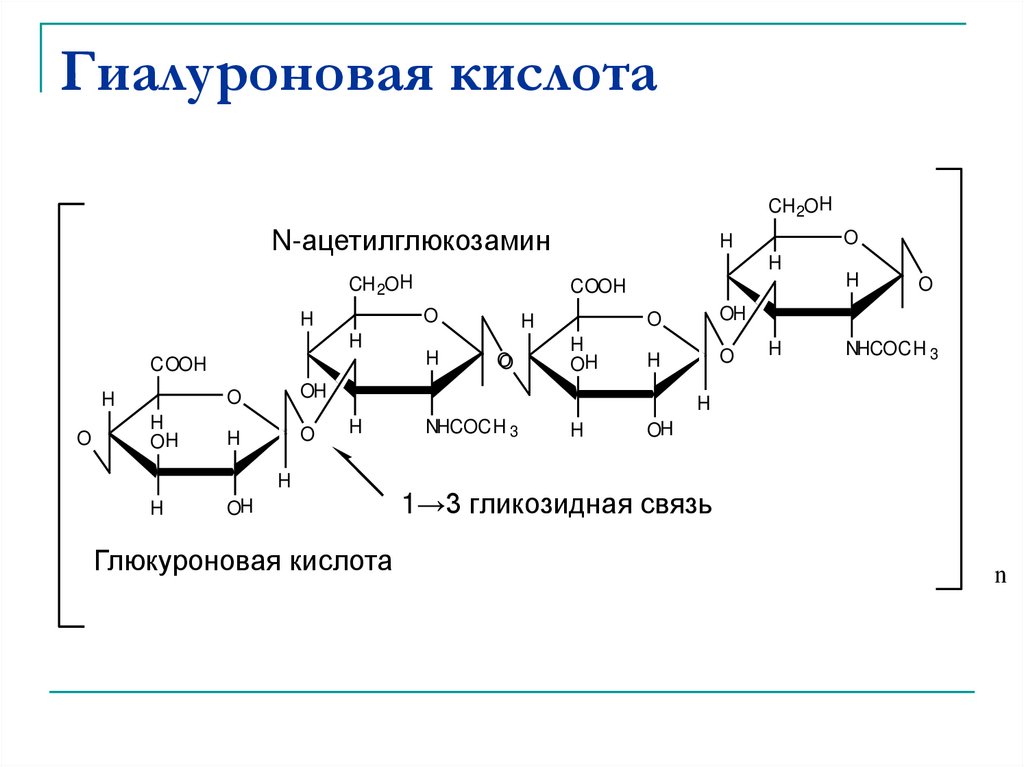
44. Гиалуроновая кислота
CH 2OHN-ацетилглюкозамин
N-acetylglucosamine
CH 2OH
H
H
COOH
H
O
H
OH
O
OH
H
O
H
H
OH
H
COOH
O
H
O
H
H
O
H
OH
O
OH
H
O
H
H
O
NHCOCH 3
H
H
NHCOCH 3
H
OH
11→3
3 glycosidic
bond связь
гликозидная
Glucuronic acid кислота
Глюкуроновая
n
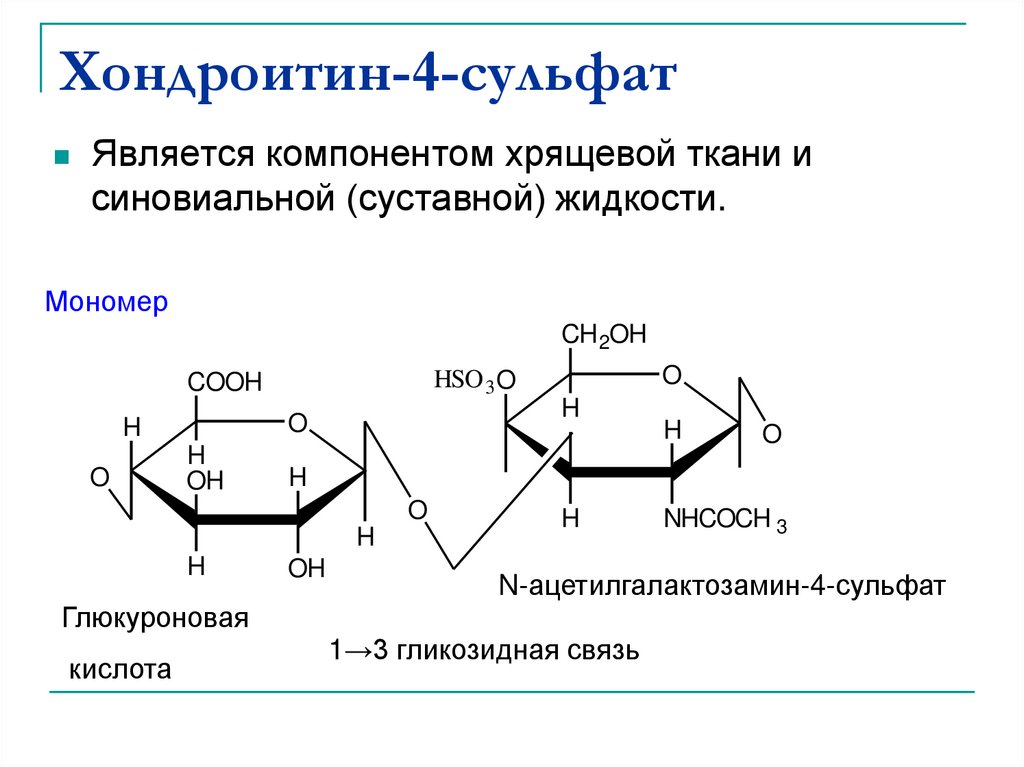
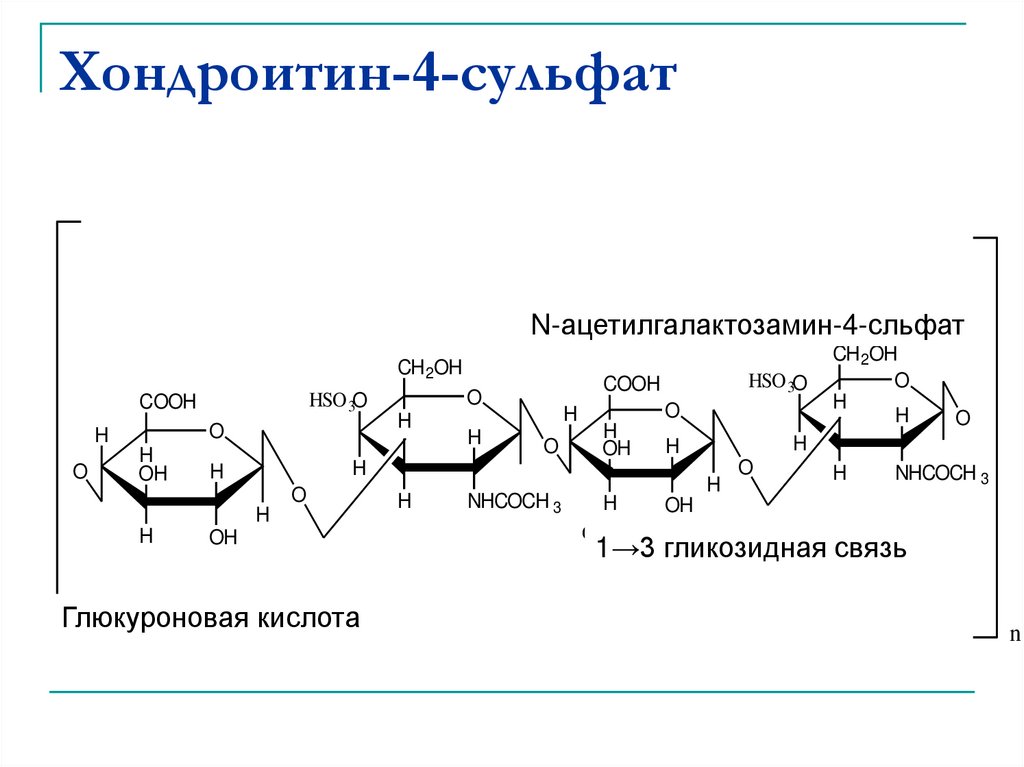
45. Хондроитин-4-сульфат
Является компонентом хрящевой ткани исиновиальной (суставной) жидкости.
Мономер
CH 2OH
O
H
O
H
H
OH
H
Glucuronic acid
Глюкуроновая
кислота
H
O
H
O
H
O
HSO 3 O
COOH
OH
H
NHCOCH 3
N-acetyl galactoseamine-4-sulfate
N-ацетилгалактозамин-4-сульфат
11→3 гликозидная
3 glycosidic bond
связь
46. Хондроитин-4-сульфат
N-ацетилгалактозамин-4-сльфатN-acetyl galactoseamine-4-sulfate
CH 2OH
HSO 3O
COOH
O
H
O
H
OH
H
H
O
H
H
O
H
H
H
OH
Глюкуроновая кислота
H
HSO 3O
COOH
O
NHCOCH 3
O
H
OH
CH 2OH
O
H
H
O
H
H
H
O
H
NHCOCH 3
H
OH
Glucuronic acid
1→3 гликозидная
1
3 glycosidic связь
bond
n













 chemistry
chemistry








