Similar presentations:
Механизмы органических реакций
1.
Механизм реакции- последовательность элементарных
стадий процесса, в результате
которого исходные вещества
превращаются в продукты
4
2.
53. Механизмы разрыва ковалентной связи
ГомолитическийX
Гетеролитический
:Y
X
:Y
(h )
.
.
X+ +
X + Y
Свободные радикалы
:Y
Ионы
X+ - электрофил
SR
AR
S – англ. substitution –
замещение
A – англ. addition –
присоединение
Y- - нуклеофил
S
SE SN
A
AE
AN
10
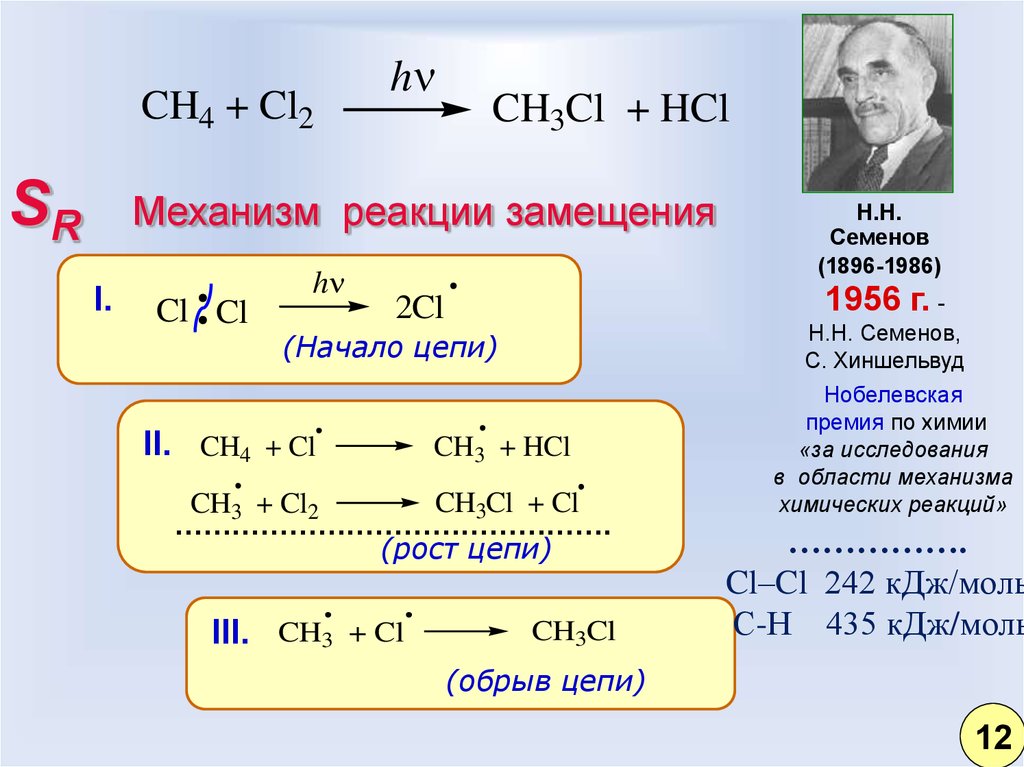
4. Радикальное замещение SR
115.
CH4 + Cl2SR
h
CH3Cl + HCl
Механизм реакции замещения
I.
Cl Cl
h
1956 г. -
2Cl
(Начало цепи)
II. CH4 + Cl
CH3 + HCl
CH3Cl + Cl
CH3 + Cl2
……………………………………….
(рост цепи)
III. CH3 + Cl
Н.Н.
Семенов
(1896-1986)
CH3Cl
Н.Н. Семенов,
С. Хиншельвуд
Нобелевская
премия по химии
«за исследования
в области механизма
химических реакций»
…………….
Cl–Cl 242 кДж/моль
С-Н 435 кДж/моль
(обрыв цепи)
12
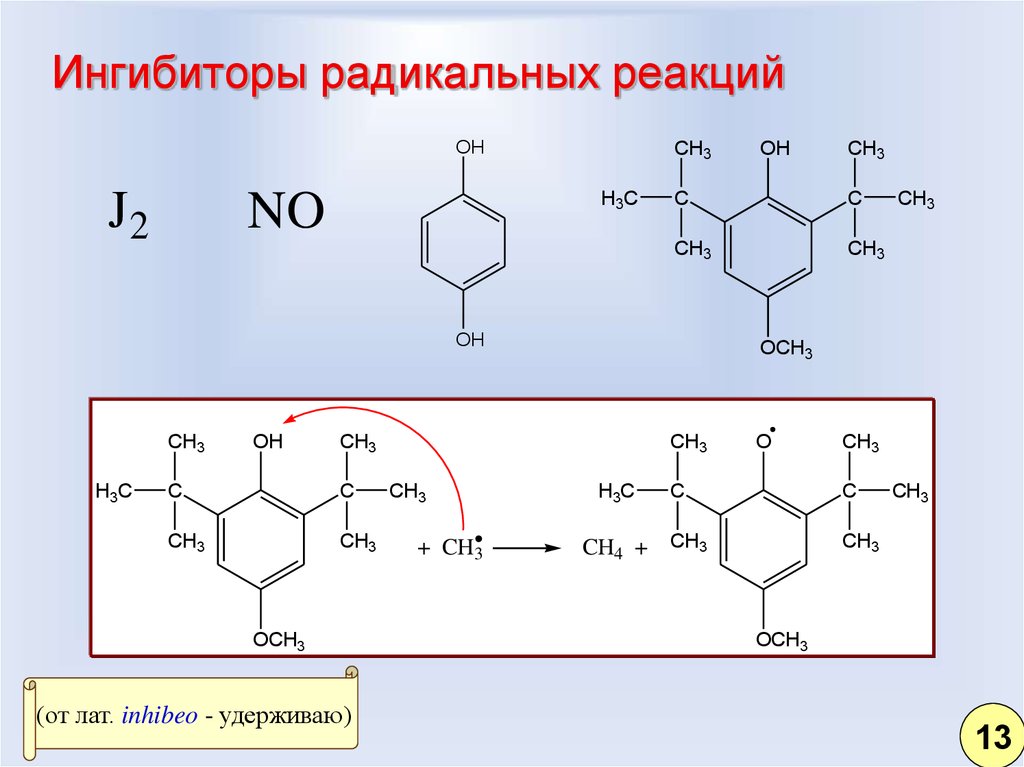
6. Ингибиторы радикальных реакций
OHJ2
CH3
H3C
NO
H3C
OH
C
CH3
CH3
C
CH3
CH3
OCH3
(от лат. inhibeo - удерживаю)
CH3
CH3
+ CH3
CH3
OCH3
CH3
C
CH3
C
OH
CH3
OH
H3C
O
C
CH3
C
CH4 + CH3
CH3
CH3
OCH3
13
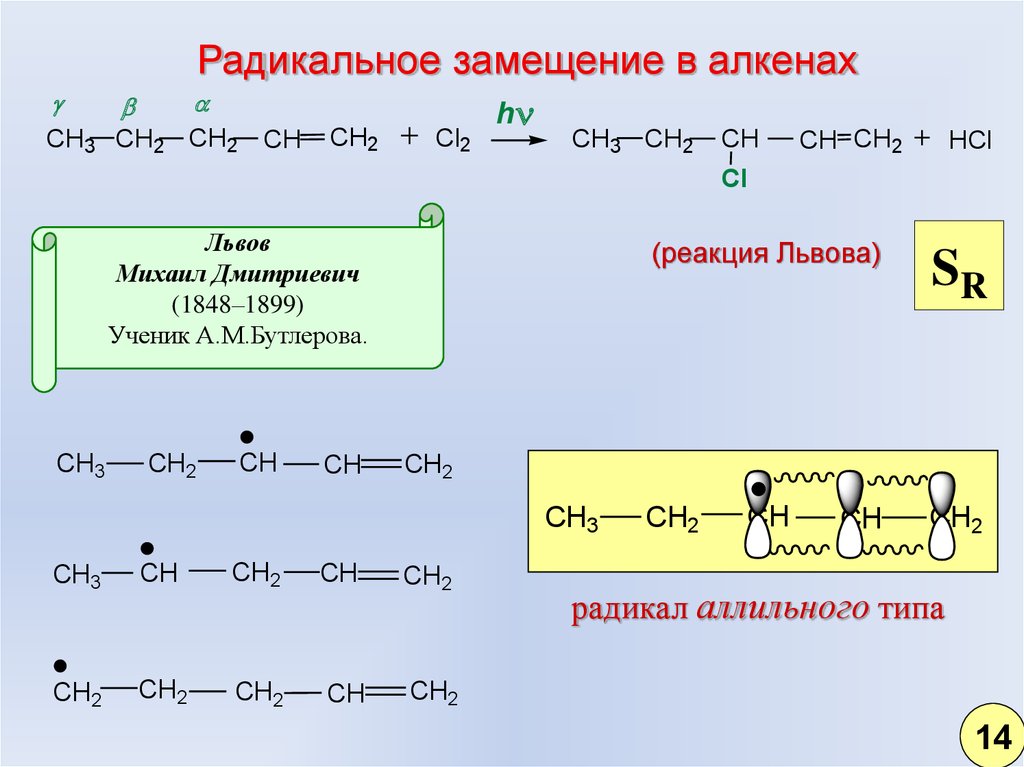
7.
Радикальное замещение в алкенахCH3 CH2 CH2
CH
CH2
Cl2
h
CH3 CH2
CH
CH CH2
HCl
Cl
Львов
Михаил Дмитриевич
(1848–1899)
Ученик А.М.Бутлерова.
CH3
CH2
CH
CH
(реакция Львова)
SR
CH
CH2
CH2
CH3
CH3
CH
CH2
CH
CH2
CH2
CH2
CH2
CH
CH2
CH2
CH
радикал аллильного типа
14
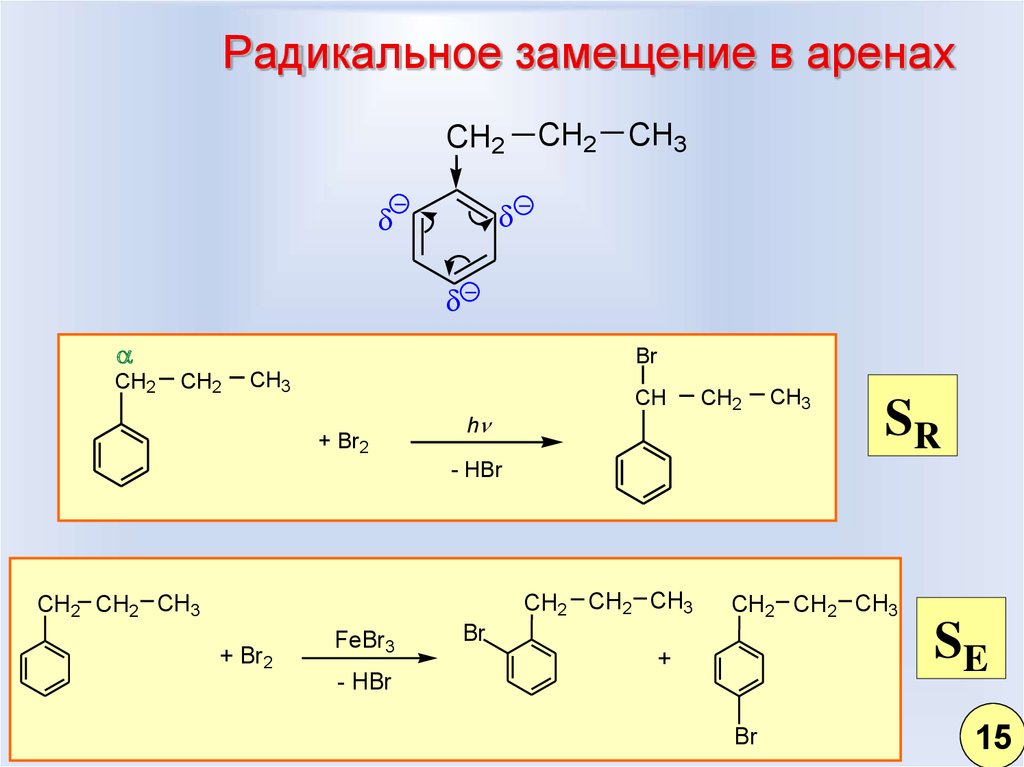
8. Радикальное замещение в аренах
CH2CH2
CH3
CH2
Br
CH2
CH3
+ Br2
h
CH
CH2
CH3
SR
- HBr
CH2 CH2 CH3
CH2 CH2 CH3
+ Br2
FeBr3
CH2 CH2 CH3
SE
Br
+
- HBr
Br
15
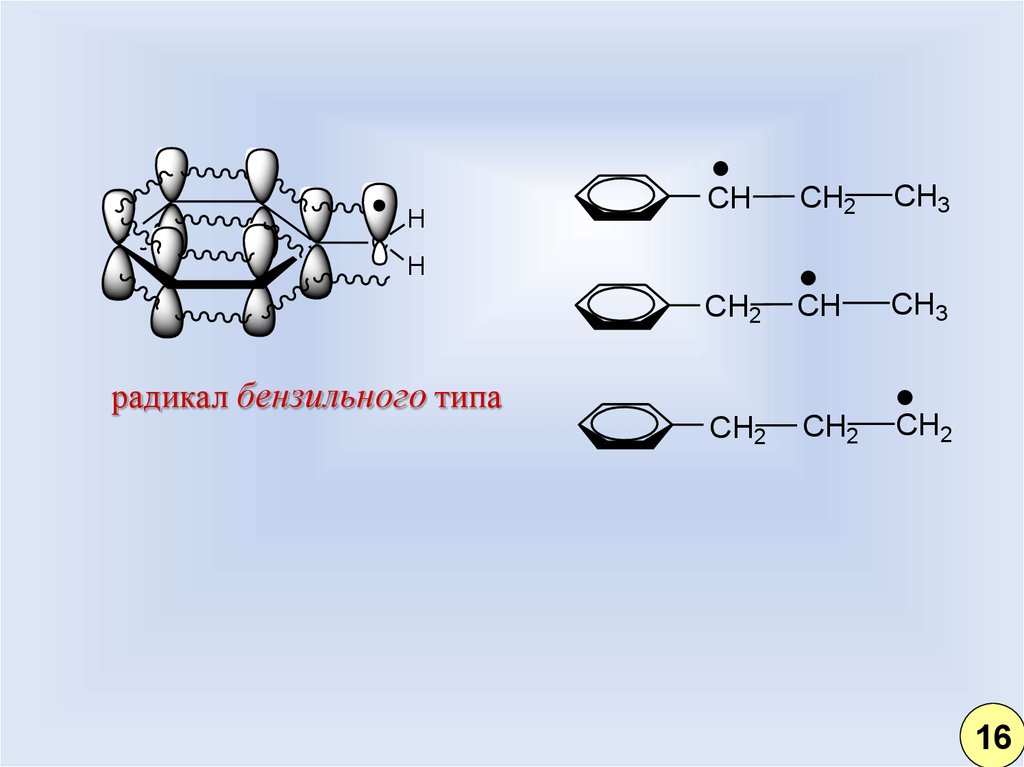
9.
HCH
CH2
CH3
CH2
CH
CH3
CH2
CH2
CH2
C
H
радикал бензильного типа
16
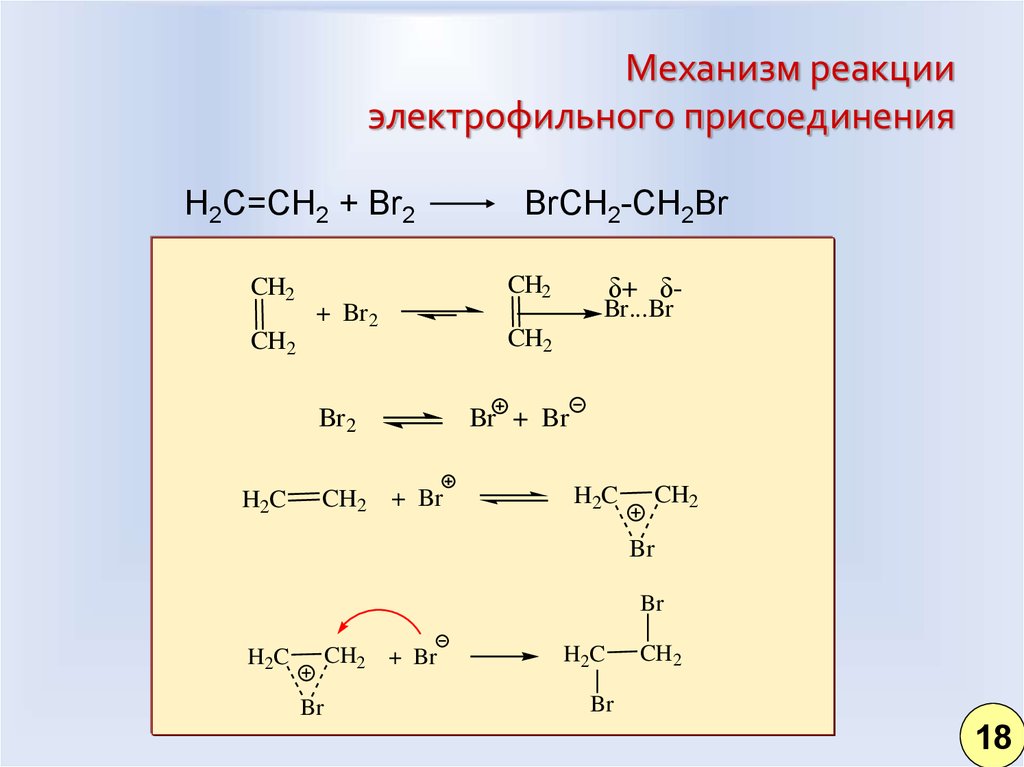
10.
11. Механизм реакции электрофильного присоединения
H2C=CH2 + Br2CH2
δ+ δ-
CH2
+ Br 2
Br 2
CH2
Br...Br
CH2
CH2
H2C
BrCH2-CH2Br
Br + Br
+ Br
H2C
CH2
Br
Br
CH2 + Br
H2C
Br
H2C
CH2
Br
18
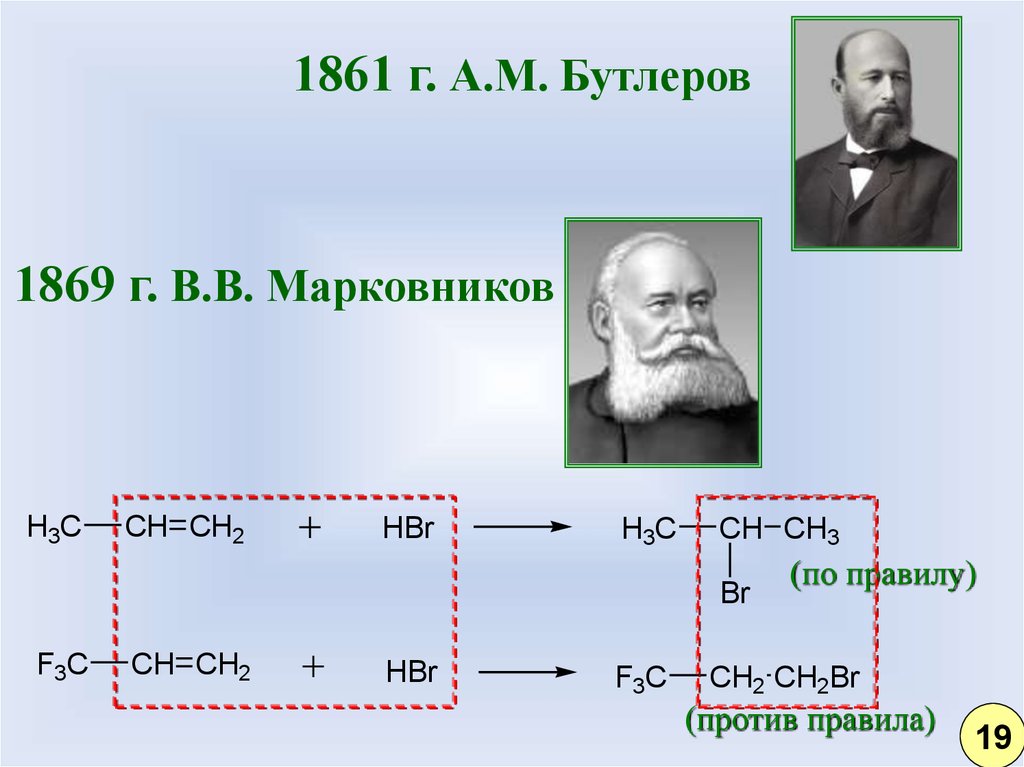
12.
1861 г. А.М. Бутлеров1869 г. В.В. Марковников
H3C
CH CH2
HBr
H3C
CH CH3
Br
F3C
CH CH2
HBr
F3C
(по правилу)
CH2 CH2Br
(против правила)
19
13.
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ 19(ДОНОРНЫЕ, АКЦЕПТОРНЫЕ)
ИЗМЕНЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В
МОЛЕКУЛЕ
РЕАКЦИОННАЯ СПОСОБНОСТЬ
I. Индуктивный эффект
δ+
δ-
С―С―С―С
Х
δ-
δ+
С―С―С―С
У
-I
+I
ЭО
F3C
CH CH2
H3C
CH CH2
Сsp3
Csp2
Csp
2,5
2,8
3,2
20
14. Электронная интерпретация правила Марковникова
а)AE
б)
1
H3C
а)
H 3C
(R
CH2
CH2
CH2
)
CH CH2
?
H+
б)
H3C
CH
CH3
(R
CH
R
)
21
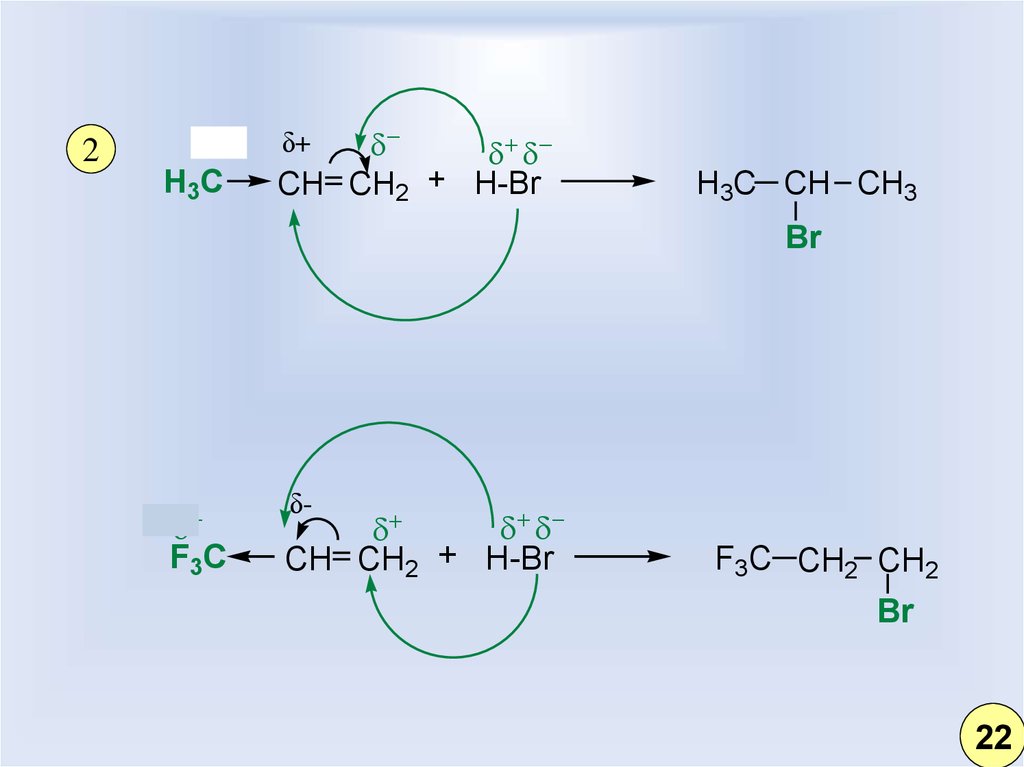
15.
2H3C
CH CH2 + H-Br
δ+
H3C CH CH3
Br
F3C
δ-
CH CH2 + H-Br
F3C CH2 CH2
Br
22
16.
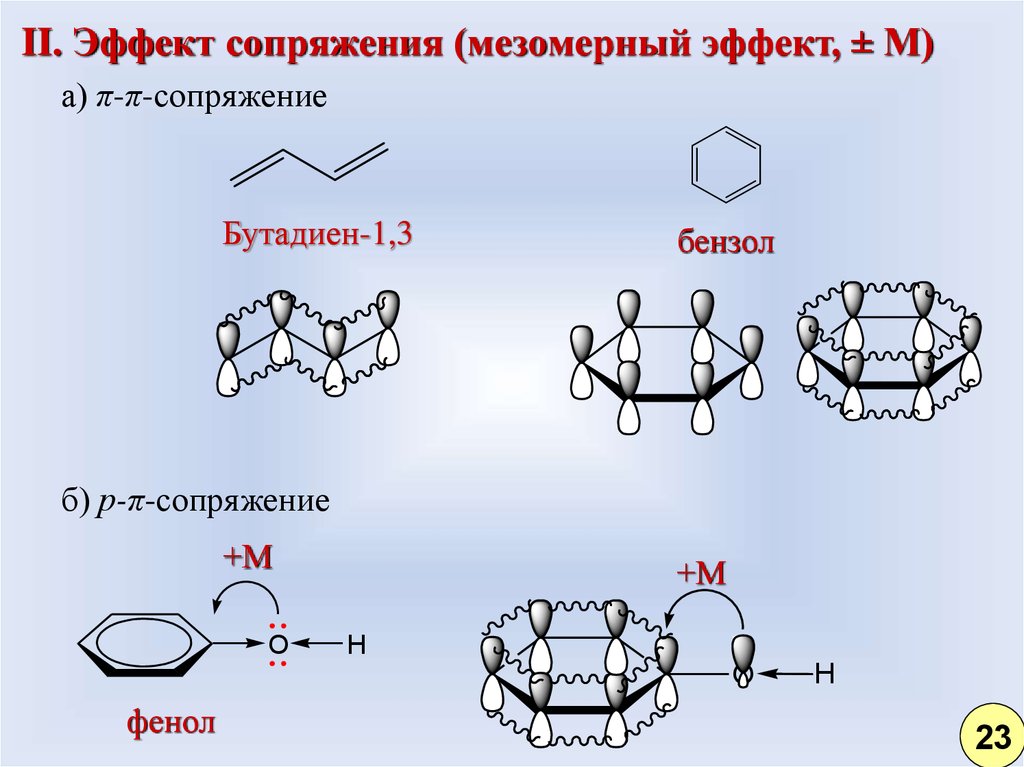
II. Эффект сопряжения (мезомерный эффект, ± М)а) π-π-сопряжение
Бутадиен-1,3
бензол
б) р-π-сопряжение
+М
O
+М
H
O
фенол
H
23
17.
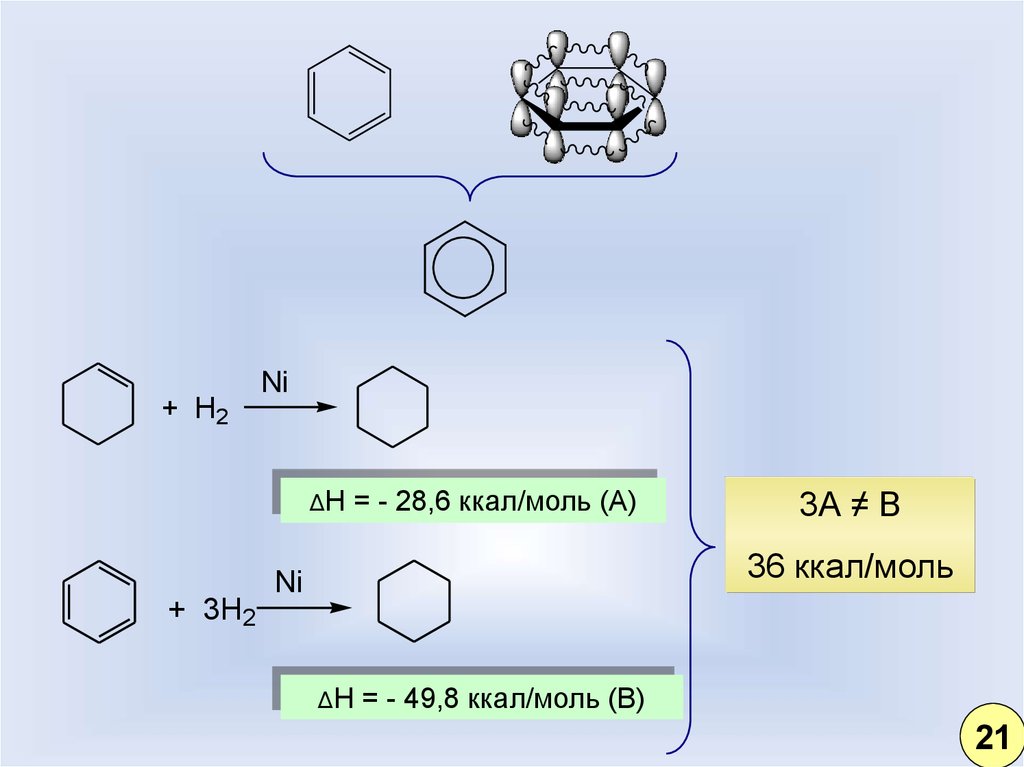
18.
+ H2Ni
ΔH
+ 3H2
= - 28,6 ккал/моль (А)
3А ≠ В
36 ккал/моль
Ni
ΔH
= - 49,8 ккал/моль (В)
21
19.
Химические свойства бензолаBr
1.
CH2CH3
FeBr3
+ Br2
hν
+ HBr
1.
CHBrCH3
+ Br2
+ HBr
NO2
2.
+ HNO3
H2SO4(k)
+ H2O
Cl
2.
CH3
3.
+ CH3Cl
AlCl3
+ 3Cl2
hν
+ HCl
Cl
Cl
Cl
Cl
Cl
O
C
4.
+ H3C
C
O AlCl
3
CH3
+ HCl
Ñl
3.
+ 3H2
Ni, t
SO3H
5.
+ H2SO4 (êî í ö)
+ H2O
25
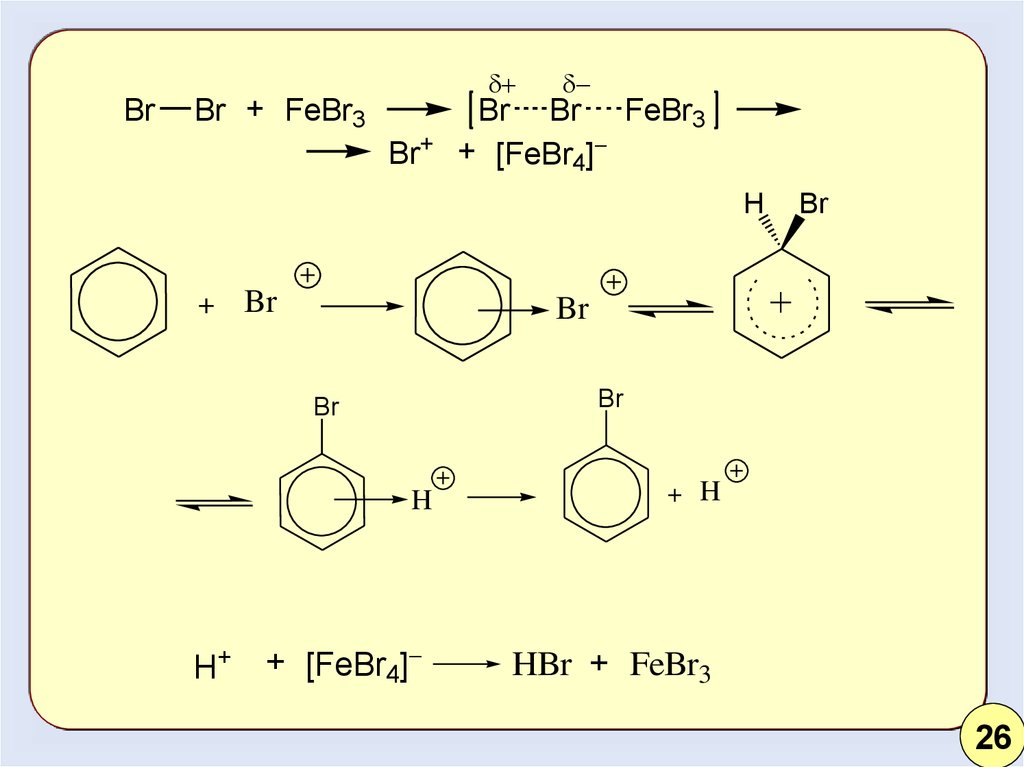
20.
BrBr + FeBr3
Br+
Br Br FeBr3
+ [FeBr4]
H
+
Br
Br
Br
Br
H
H+
Br
+ [FeBr4]
+ H
HBr + FeBr3
26
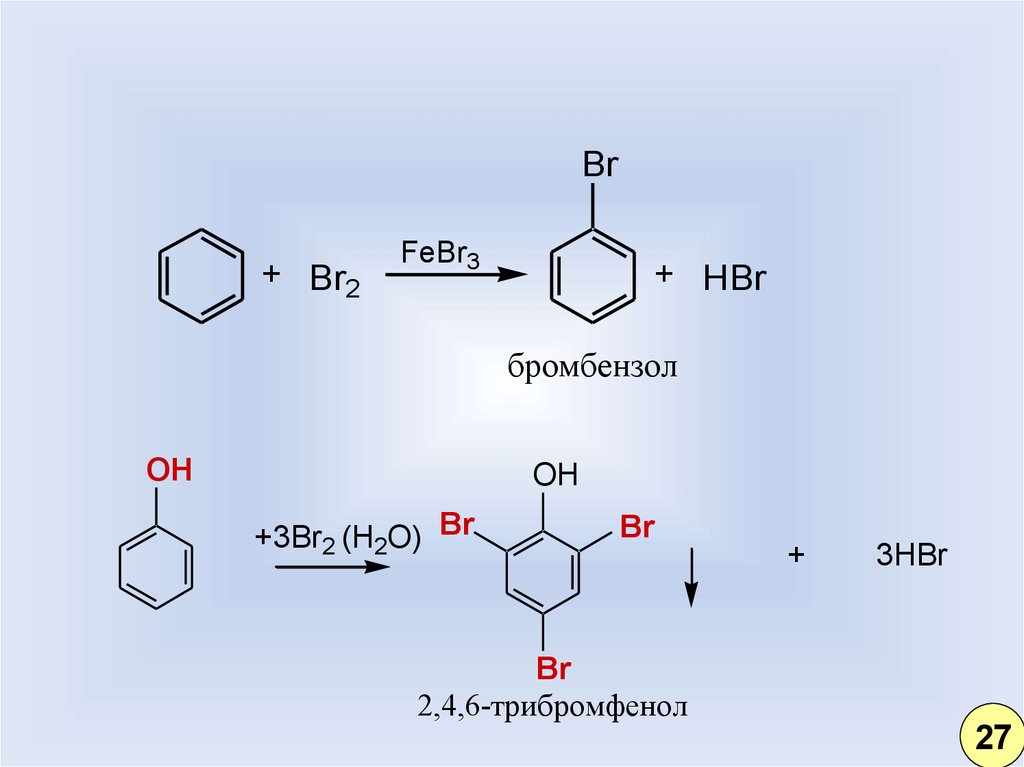
21.
Br+ Br2
FeBr3
+ HBr
бромбензол
OH
OH
+3Br2 (H2O) Br
Br
+
3HBr
Br
2,4,6-трибромфенол
27
22.
+Br
Br + FeBr3
Х+
+
Br
Br Br FeBr3
+ [FeBr4]
+М
O
H
фенол
28
23.
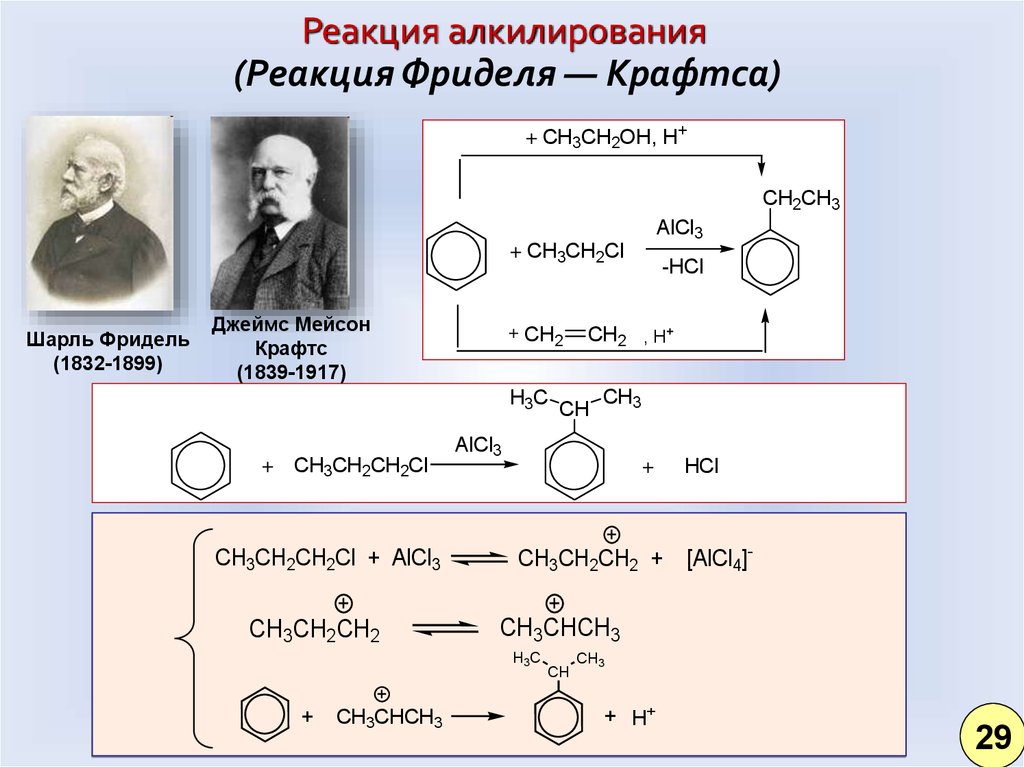
Реакция алкилирования(Реакция Фриделя — Крафтса)
+ CH3CH2OH, H+
CH2CH3
AlCl3
+ CH3CH2Cl
Шарль Фридель
(1832-1899)
Джеймс Мейсон
Крафтс
(1839-1917)
+ CH2
H3C
+ CH3CH2CH2Cl
CH3CH2CH2Cl + AlCl3
CH3CH2CH2
CH3CHCH3
CH2 , H+
CH
CH3
AlCl3
+
CH3CH2CH2 +
HCl
[AlCl4]-
CH3CHCH3
H3C
+
-HCl
CH
CH3
+ H+
29
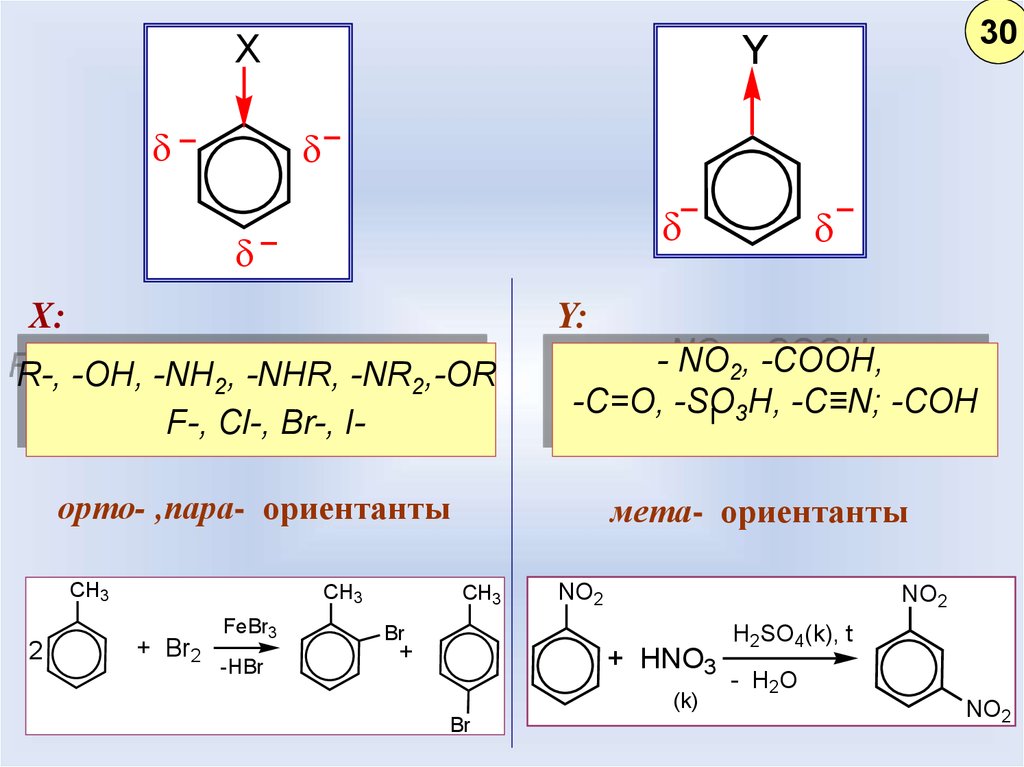
24.
XX:
Y:
R-, -OH, -NH2, -NHR, -NR2,-OR
F-, Cl-, Br-, I-
- NO2, -COOH,
-C=O, -SO3H, -С≡N; -СОН
орто- ,пара- ориентанты
CH3
2
30
Y
CH3
+ Br2
FeBr3
-HBr
мета- ориентанты
CH3
NO2
NO2
Br
+
+ HNO3
(k)
Br
H2SO4(k), t
- H2O
NO2
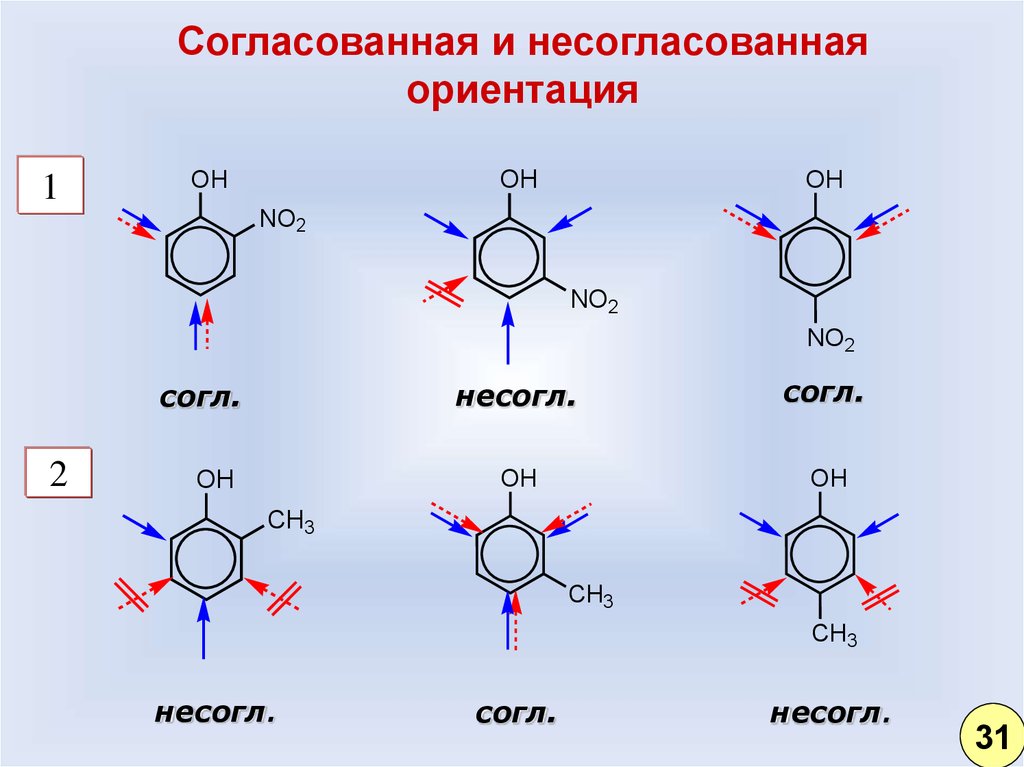
25.
Согласованная и несогласованнаяориентация
1
OH
OH
OH
NO2
NO2
NO2
согл.
2
OH
несогл.
согл.
OH
OH
CH3
CH3
CH3
несогл.
согл.
несогл.
31
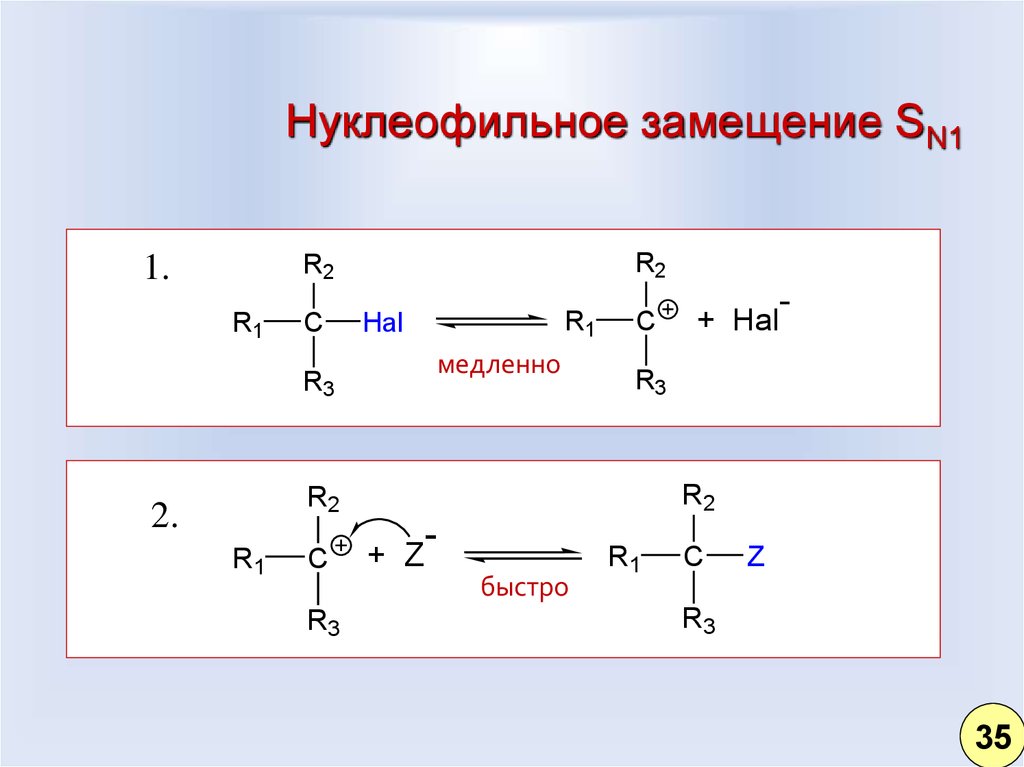
26. Нуклеофильное замещение SN1
1.R2
R2
R1
C
R1
Hal
медленно
R3
C
R3
R2
R2
2.
R1
C
-
+ Z
быстро
R3
+ Hal
-
R1
C
Z
R3
35
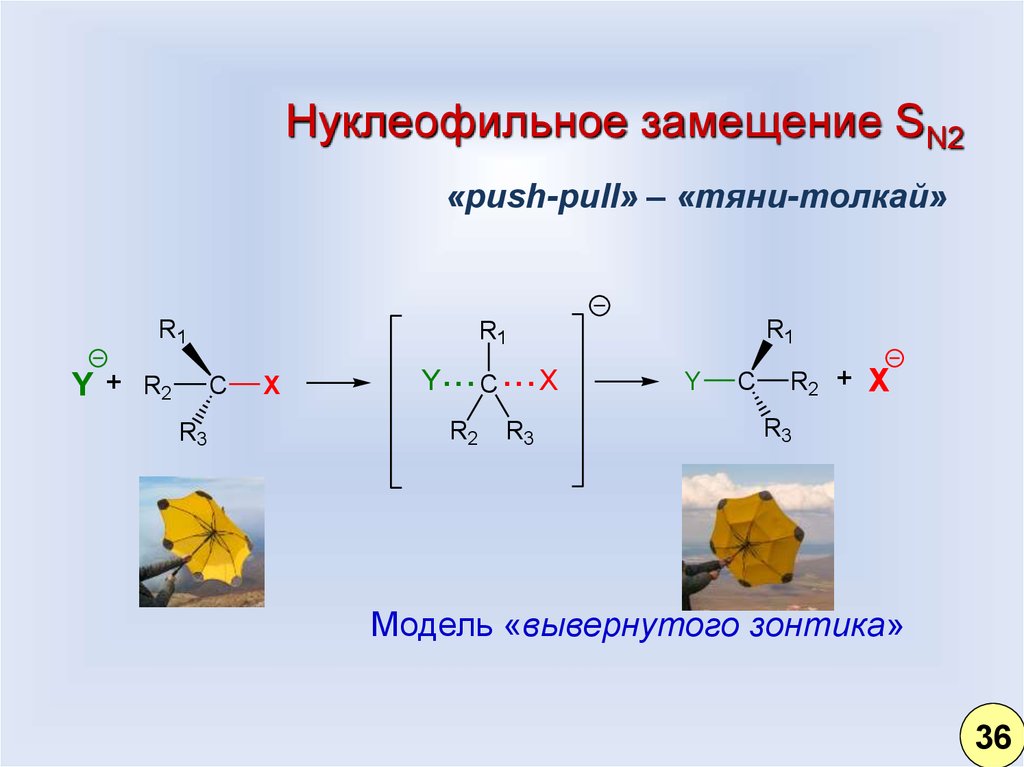
27.
Нуклеофильное замещение SN2«push-pull» – «тяни-толкай»
R1
Y+
R2
C
R3
R1
R1
X
Y... C ... X
R2
R3
Y
C
R2 +
X
R3
Модель «вывернутого зонтика»
36
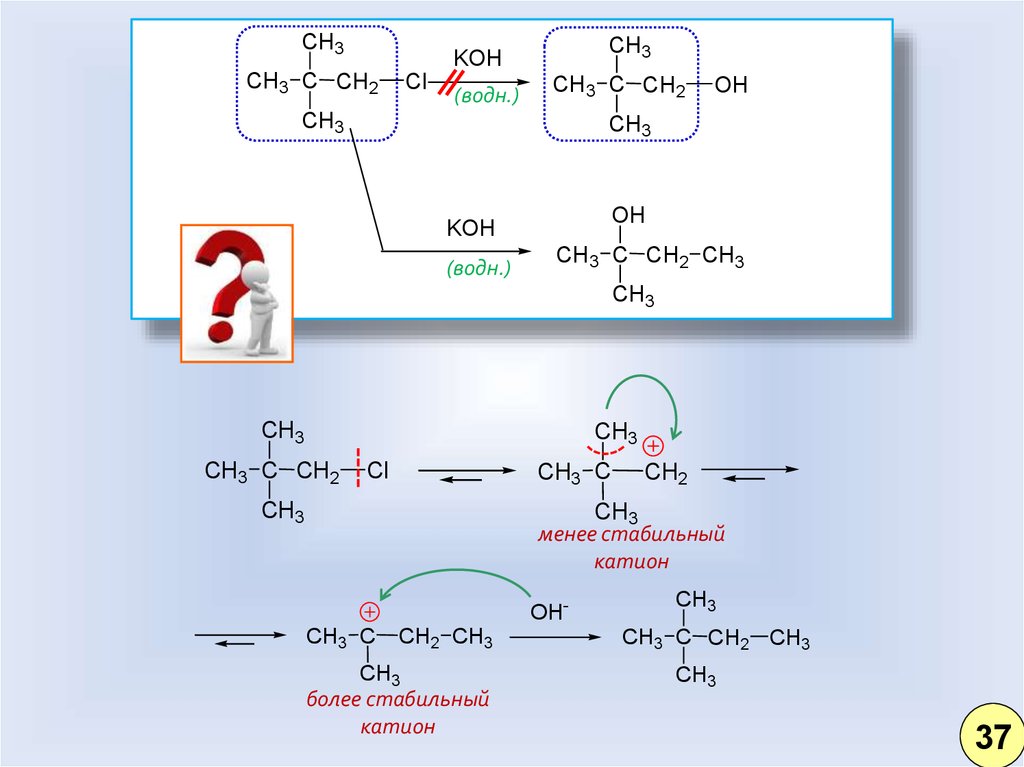
28.
CH3CH3
KOH
CH3 C CH2
Cl
(водн.)
CH3 C CH2
CH3
OH
CH3
OH
KOH
(водн.)
CH3 C CH2 CH3
CH3
CH3
CH3
CH3 C CH2
Cl
CH3 C
CH3
CH2
CH3
менее стабильный
катион
OHCH3 C
CH2 CH3
CH3
более стабильный
катион
CH3
CH3 C CH2 CH3
CH3
37
29.
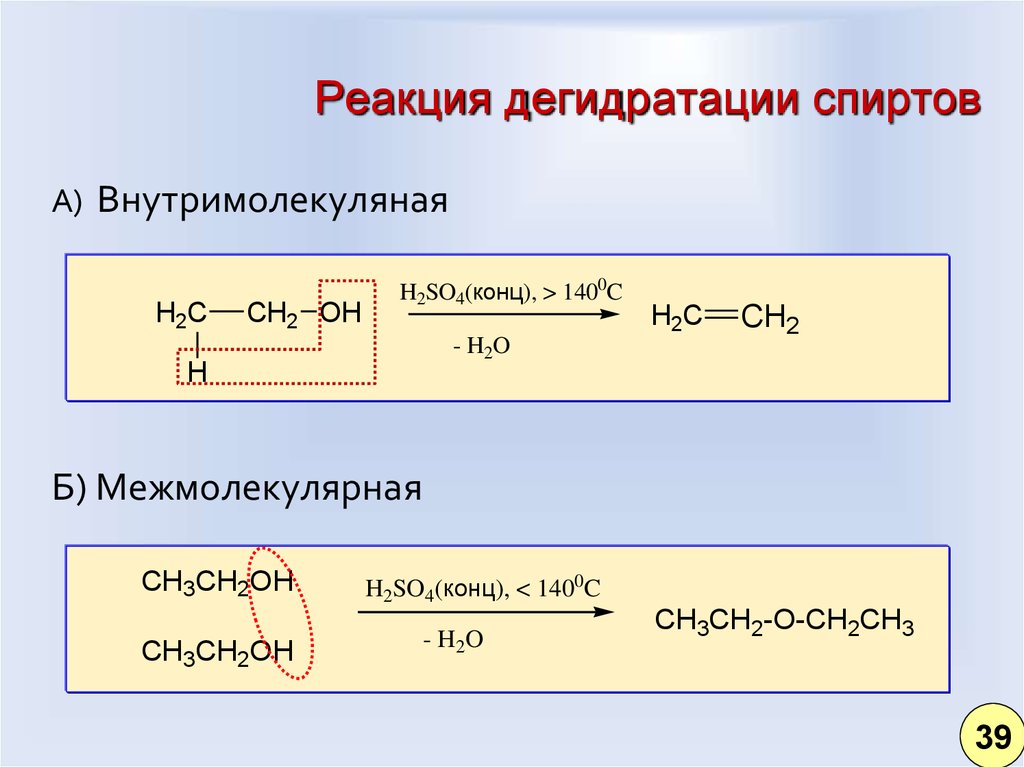
30. Реакция дегидратации спиртов
А) ВнутримолекулянаяH2C
CH2 OH
H2SO4(конц), > 1400C
- H2O
H
H2C
CH2
Б) Межмолекулярная
CH3CH2OH
CH3CH2OH
H2SO4(конц), < 1400C
- H2O
CH3CH2-O-CH2CH3
39
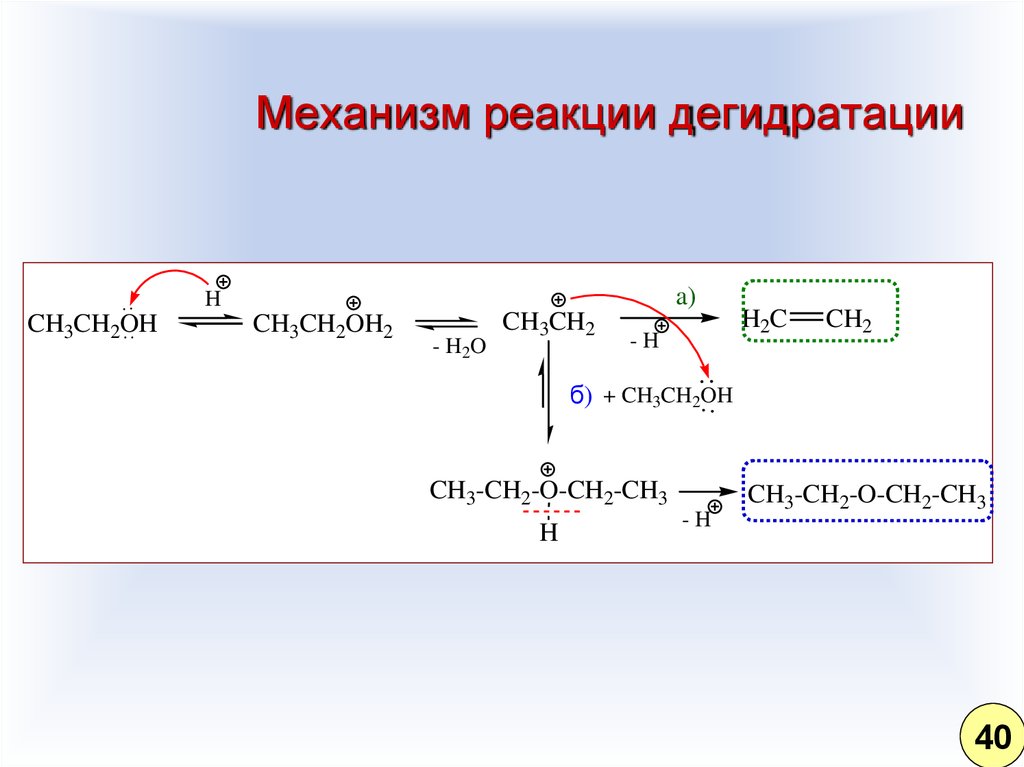
31. Механизм реакции дегидратации
a)H
CH3CH2OH
CH3CH2OH2
- H2O
CH3CH2
-H
H2C
CH2
б) + CH3CH2OH
CH3-CH2-O-CH2-CH3
H
-H
CH3-CH2-O-CH2-CH3
40
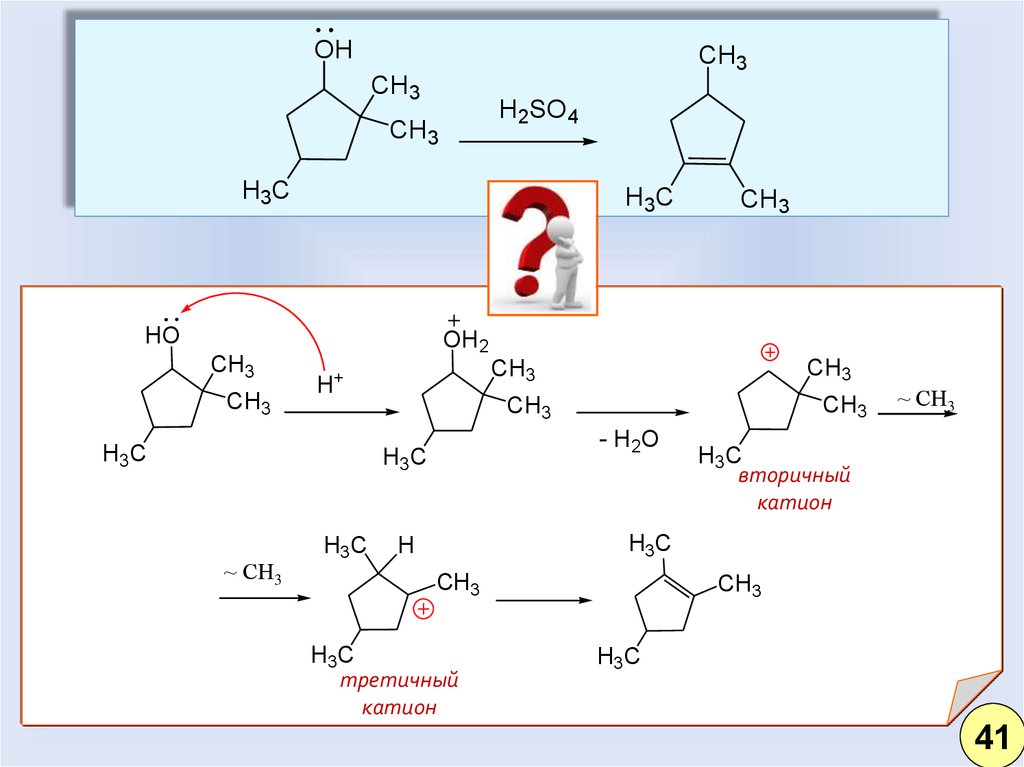
32.
OHCH3
CH3
H2SO4
CH3
H3C
H3 C
HO
CH3
CH3
OH2
CH3
CH3
- H2O
H3C
H3 C
CH3
CH3
H+
H3C
~ СH3
CH3
~ СH3
H3C
вторичный
катион
H 3C
H
CH3
H3 C
третичный
катион
CH3
H3 C
41
33.
Реакция этерификацииO
R
O
H+
+
C
R'OH
R
C
OH
+
H2O
OR'
?
O
R
+
C
OH
42
18
HO-R'
O
H+
R
+
C
H2O
18
OR'
Этерификация –
от лат. слова aether – эфир.
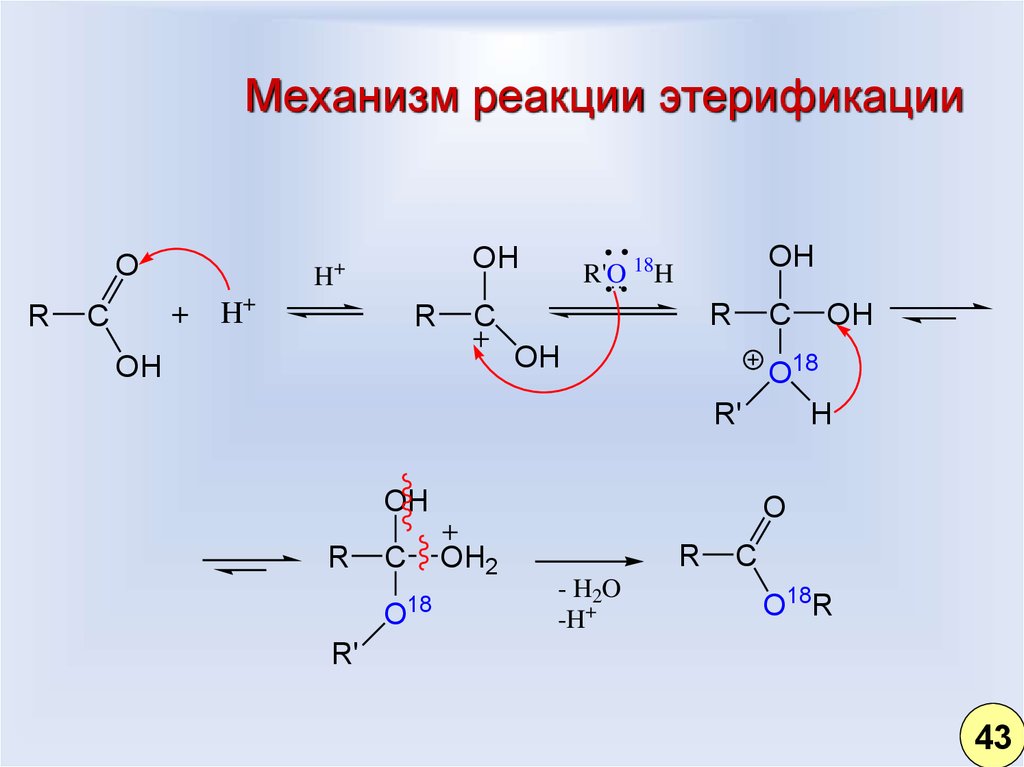
34. Механизм реакции этерификации
OR
H
+
C
OH
+
H+
R
OH
R'O 18H
R
C
OH
OH
C
O18
R'
H
OH
R
C
O
R
OH2
18
O
OH
- H2O
-H+
C
O18R
R'
43
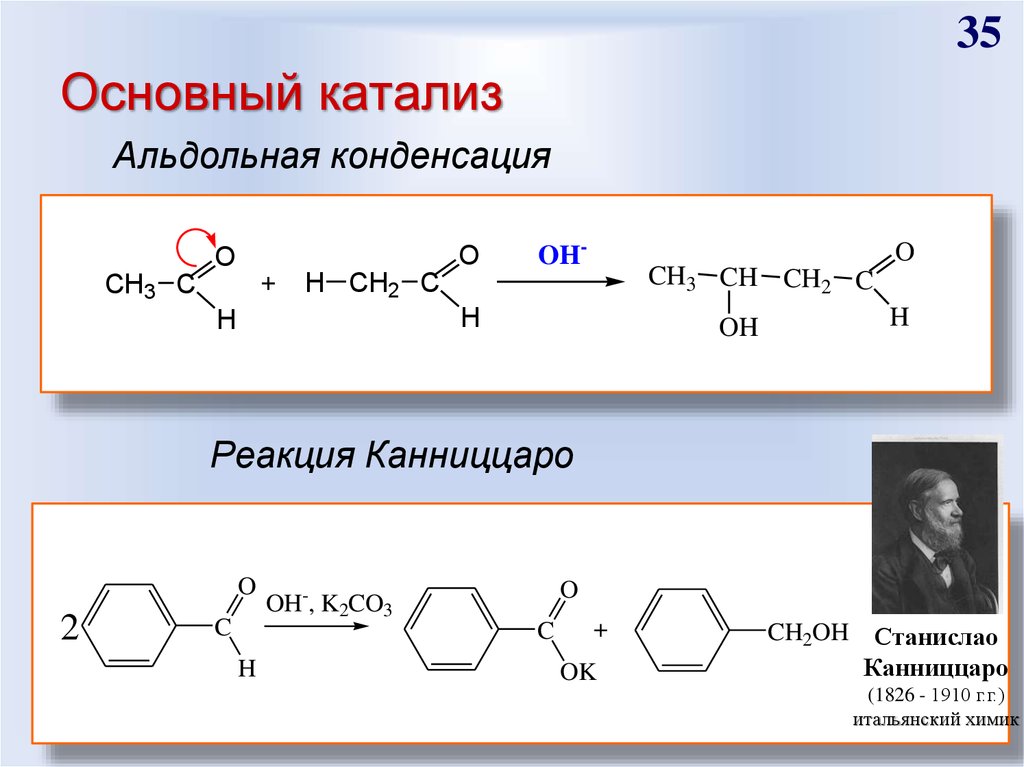
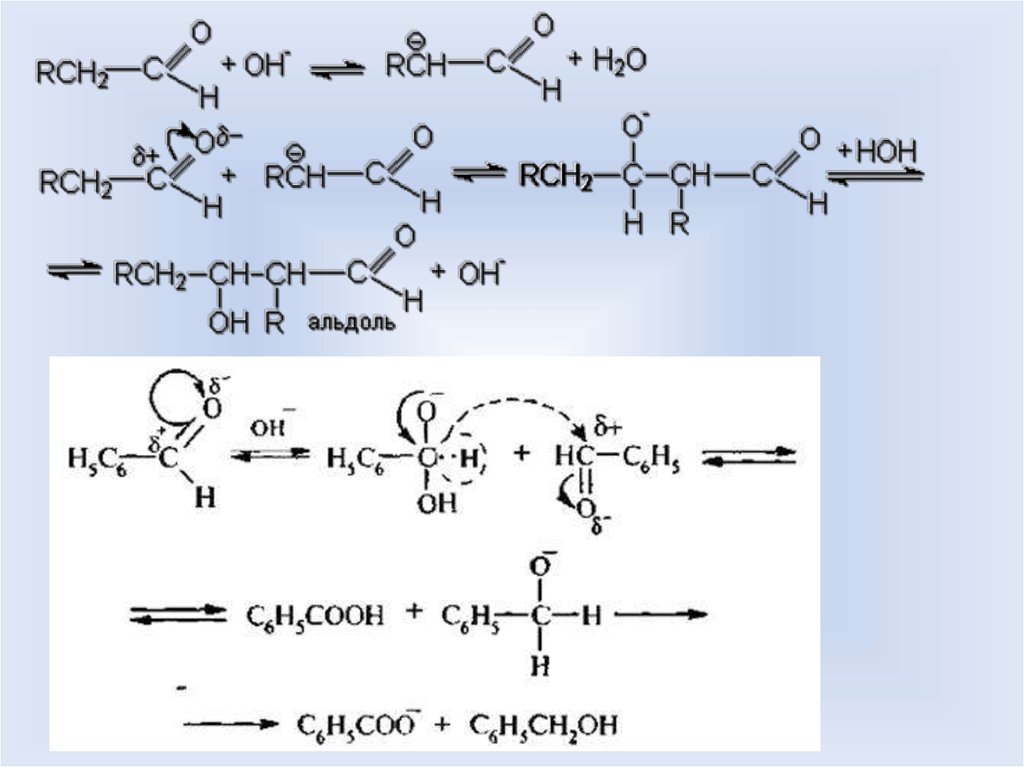
35. Основный катализ
35Основный катализ
Альдольная конденсация
O
O
+
CH3 C
OH-
O
CH3 CH CH2 C
H CH2 C
H
H
OH
H
Реакция Канниццаро
O
2
C
O
OH-, K2CO3
C
H
+
OK
CH2OH Станислао
Канниццаро
(1826 - 1910 г.г.)
итальянский химик
36.
37.
38.
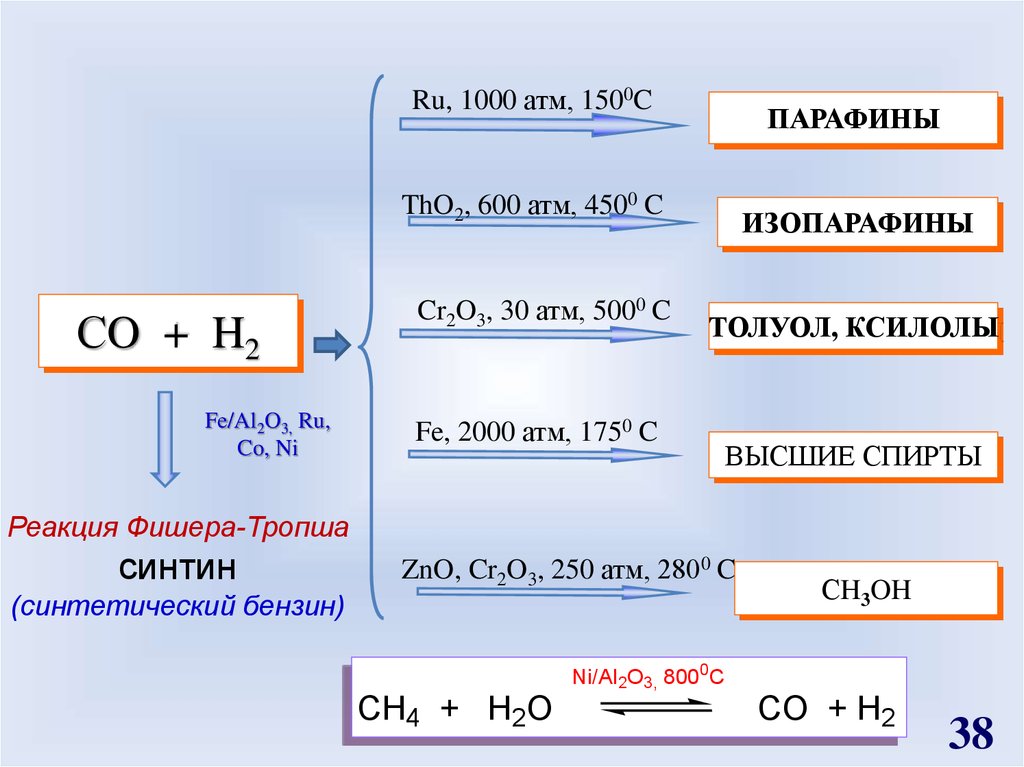
Ru, 1000 атм, 1500CПАРАФИНЫ
ThO2, 600 атм, 4500 C
СO + H2
Fe/Al2O3, Ru,
Co, Ni
Cr2O3, 30 атм, 5000 C
ИЗОПАРАФИНЫ
ТОЛУОЛ, КСИЛОЛЫ
Fe, 2000 атм, 1750 C
ВЫСШИЕ СПИРТЫ
Реакция Фишера-Тропша
синтин
ZnO, Cr2O3, 250 атм, 2800 C
(синтетический бензин)
СH3OH
Ni/Al2O3, 8000C
CH4 + H2O
CO + H2
38
39.
Какие из следующих утверждений верны?1. При риформинге н-гептана образуется бензол.
2. Винилацетилен получают димеризацией ацетилена.
3. Ацетилен можно получить в результате термического
разложения метана.
4. Карбидный способ получения ацетилена заключается в
обработке карбида алюминия водой.
5. Стереорегулярные
каучуки
получают
при
полимеризации
1,3-диеновых
углеводородов
в
присутствии металлического натрия.
39
40.
n H2CC
CH CH2
TiCl4 . Al(C2H5)3
CH3
CH2
C
CH2
CH
H3C
n
Цис-полиизопрен
Катализатор Циглера - Натта
1963 г. –
НАТТА
Джулио
ЦИГЛЕР
Карл Вальдемар
(1903–1979)
(1898 –1973)
Нобелевская премия
по химии «за
открытия в области
химии и технологии
высокомолекулярны
х полимеров»
51
41.
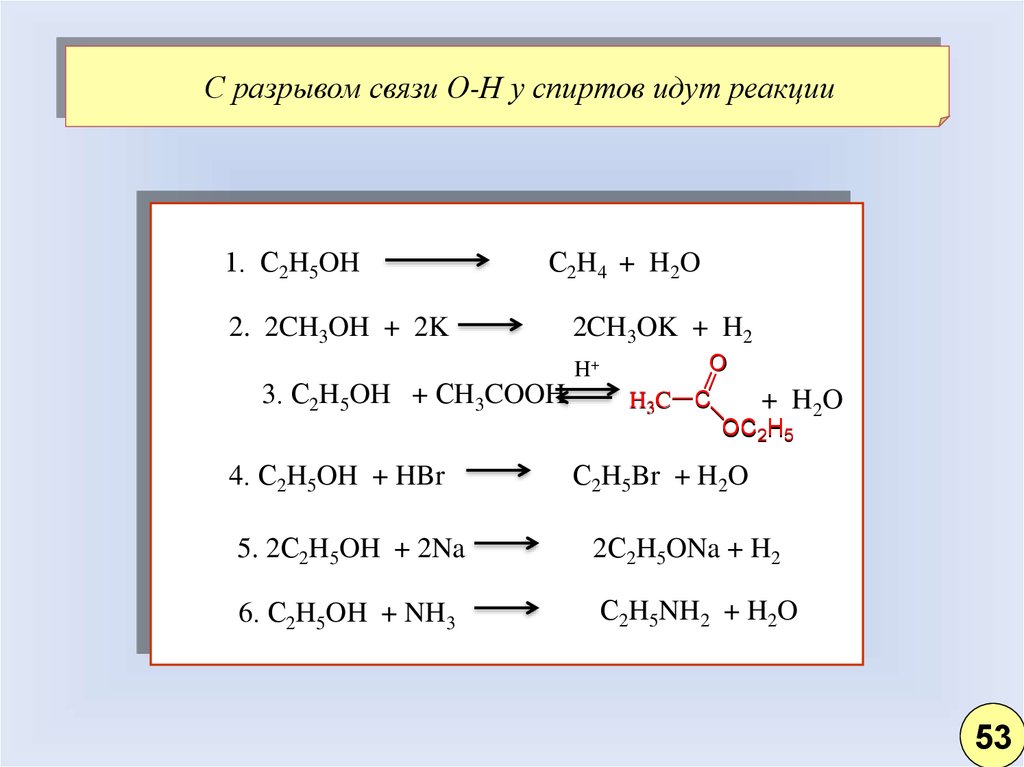
С разрывом связи О-Н у спиртов идут реакции1. С2H5OH
С2H4 + H2O
2. 2CH3OH + 2K
3. С2H5OH + СH3COOH
2CH3OK + H2
H+
O
H3C C
+ H 2O
OC2H5
4. С2H5OH + HBr
С2H5Br + H2O
5. 2С2H5OH + 2Na
2С2H5ONa + H2
6. С2H5OH + NH3
С2H5NH2 + H2O
53
42.
СИЛА ОРГАНИЧЕСКИХ КИСЛОТO
H
H
O
CC
H
> H3C
O
C
OH
>
H3C
O
~
C
~ H3C
OH
CH2
CH2
CH2
O
C
OH
OH
H 2C
C
O
O
H
Cl
H3C
O
C
<
OH
уксусная
CH2
O
C
<
OH
Cl
монохлоруксусная
Cl
CH
O
C
OH
Cl
дихлоруксусная
Cl
<
Cl
C
O
C
OH
Cl
трихлоруксусная
к и с л о т ы
42
43.
H3CCOOH
+I
<
<
H
COOH
I=0
Cl2HC
< ClH2C
-I
COOH
<
Cl3C
OH
OH
>
7,1
<
COOH
OH
>
NO2
pKa
COOH
CH3
10,0
CH3COOH + H2O
10,2
CH3COO- + H3O+
[CH 3COO ][ H 3O ]
Ka
[CH 3COOH ]
pKa lg Ka
43
44.
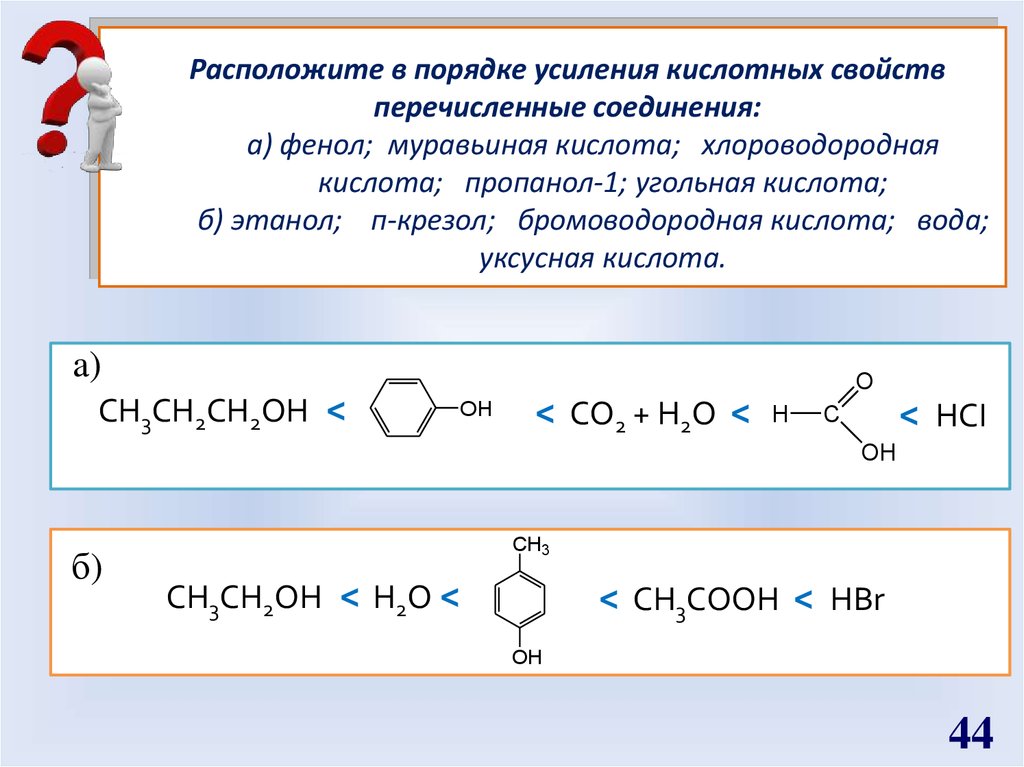
Расположите в порядке усиления кислотных свойствперечисленные соединения:
а) фенол; муравьиная кислота; хлороводородная
кислота; пропанол-1; угольная кислота;
б) этанол; п-крезол; бромоводородная кислота; вода;
уксусная кислота.
a)
CH3CH2CH2OH <
O
OH
< CO2 + H2O <
H
< HCI
C
OH
б)
CH3
CH3CH2OH < H2O <
< CH3COOH < HBr
OH
44
45.
Дипольные моменты (µ) винилхлорида и этилхлоридаравны, соответственно 1,44 D и 2, 05 D. Как можно
объяснить это различие на основании строения
указанных хлоридов? Какие прогнозы относительно
реакционной способности данных соединений можно
сделать?
СН3–СН2–Сl
CH2=CH–Cl
C–Cl= 0.177 нм
C–Cl = 0,169 нм
μ(C–Cl)=2.05 D
μ(C–Cl)=1.44 D
45
46.
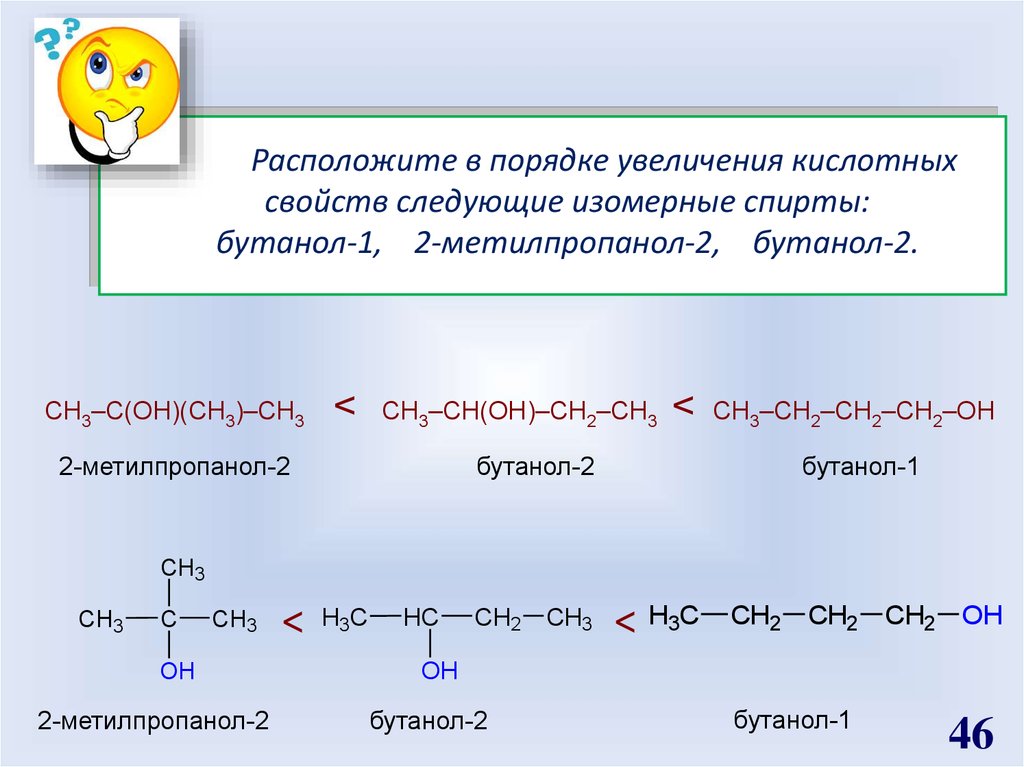
Расположите в порядке увеличения кислотныхсвойств следующие изомерные спирты:
бутанол-1, 2-метилпропанол-2, бутанол-2.
СН3–С(ОН)(СН3)–СН3
<
СН3–СН(ОН)–СН2–СН3
<
бутанол-2
2-метилпропанол-2
СН3–СН2–СН2–СН2–ОН
бутанол-1
CH3
CH3
C
CH3
OH
2-метилпропанол-2
<
H3C
HC
CH2 CH3
< H3C
CH2 CH2 CH2 OH
OH
бутанол-2
бутанол-1
46
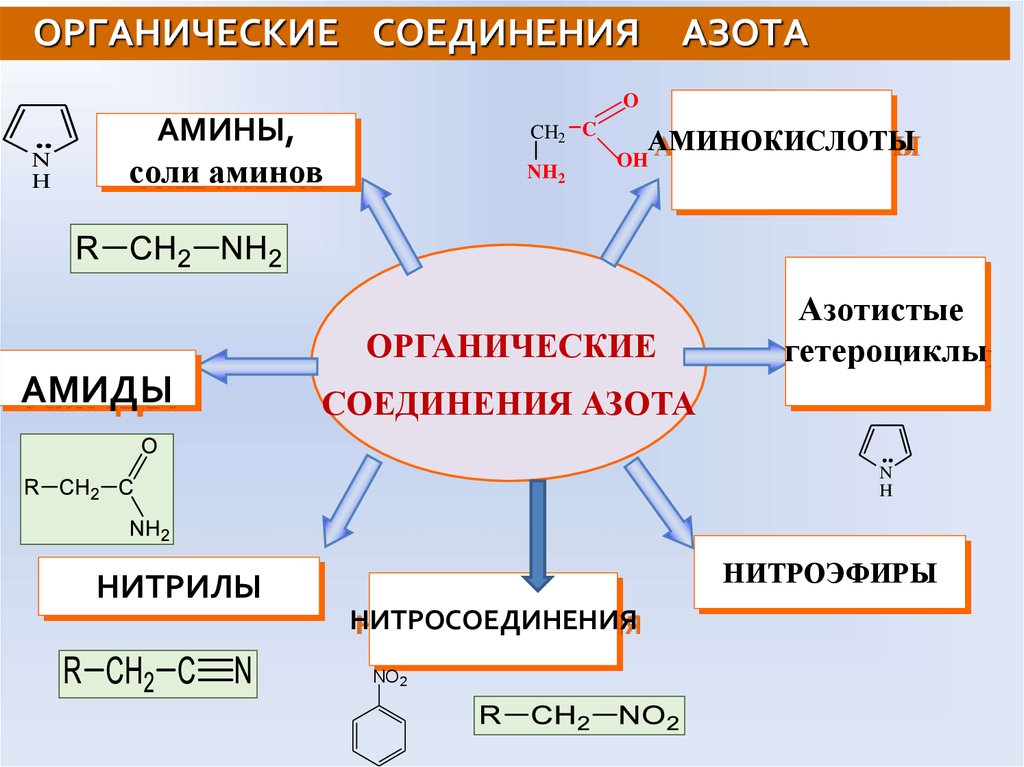
47. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ АЗОТА
ON
H
АМИНЫ,
соли аминов
CH2 C
NH2
АМИНОКИСЛОТЫ
OH
ОРГАНИЧЕСКИЕ
АМИДЫ
Азотистые
гетероциклы
СОЕДИНЕНИЯ АЗОТА
N
H
НИТРОЭФИРЫ
НИТРИЛЫ
НИТРОСОЕДИНЕНИЯ
NO2
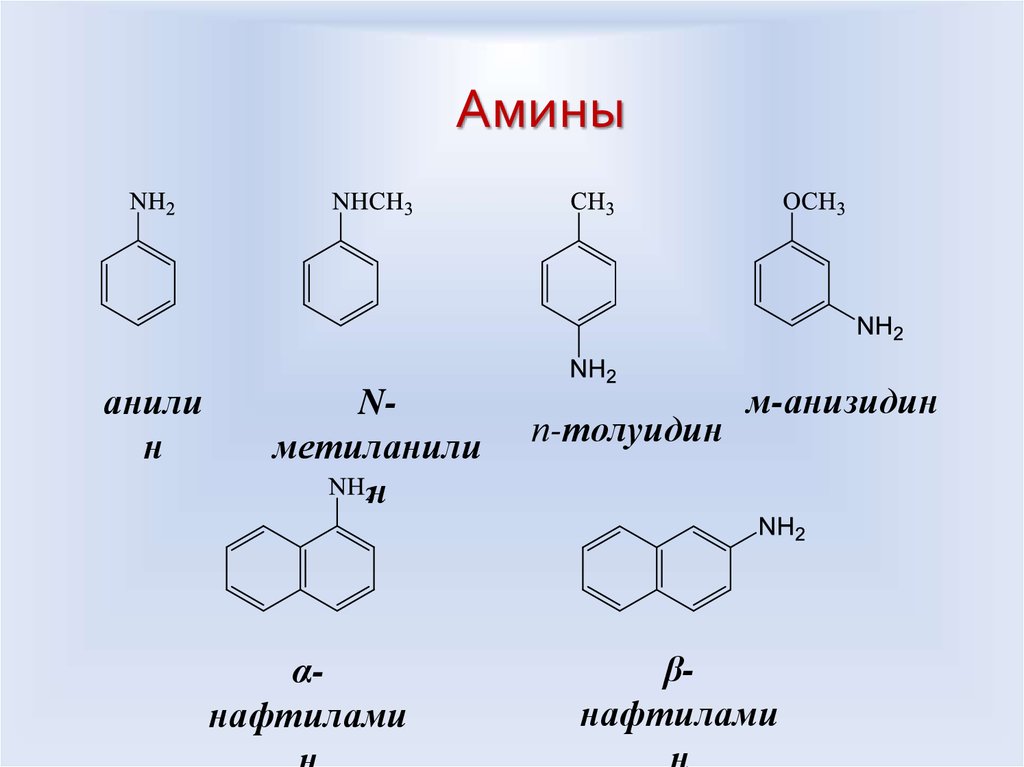
48.
Аминыанили
н
Nметиланили
н
αнафтилами
п-толуидин
м-анизидин
βнафтилами
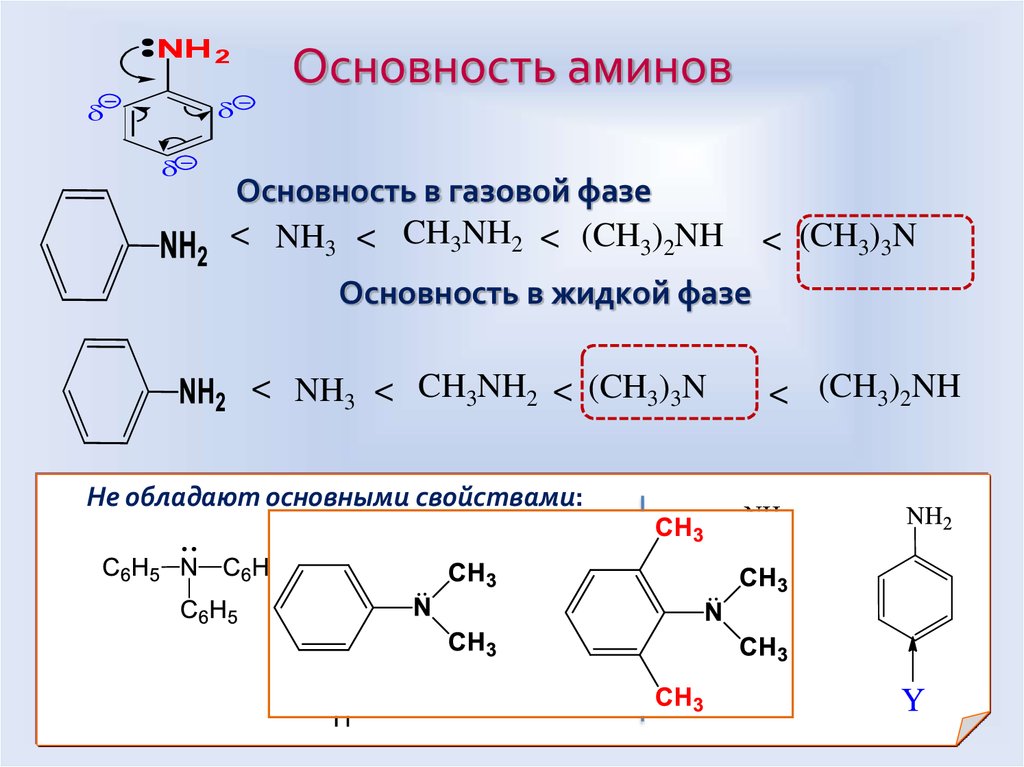
49. Основность в газовой фазе
NH 2Основность аминов
Основность в газовой фазе
< NH3 < CH3NH2 < (CH3)2NH
< (CH3)3N
Основность в жидкой фазе
< NH3 < CH3NH2 < (CH3)3N
Не обладают основными свойствами:
< (CH3)2NH
50.
Более слабым основанием, чем аммиак является1. диэтиламин
2. анилин
3. диметиламин
4. дифениламин
5. этиламин
6. пиридин
50
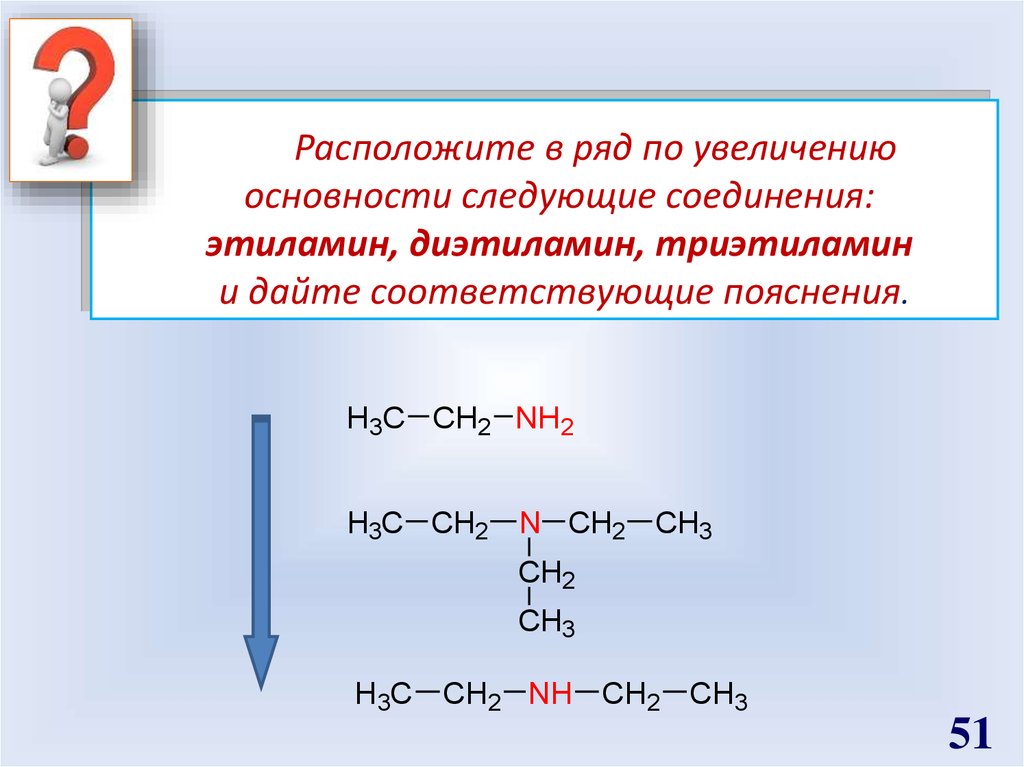
51.
Расположите в ряд по увеличениюосновности следующие соединения:
этиламин, диэтиламин, триэтиламин
и дайте соответствующие пояснения.
H3C CH2 NH2
H3C CH2
N CH2 CH3
CH2
CH3
H3C CH2 NH CH2 CH3
51
52.
Первое вещество обладает большимиосновными свойствами
1. Аммиак и диметиламин
2. Метиламин и анилин
3. Анилин и аммиак
4. Диэтиламин и дифениламин
5. Триметиламин и метиламин
6. Этиламин и пиридин
52
53.
Какие из следующих утверждений полностью верны?1. Анилин - жидкость, хорошо растворимая в воде
2. Анилин легче реагирует с бромом, чем бензол.
3. Анилин токсичен и легко окисляется на воздухе
4. Диметиламин – твердое вещество , взаимодействует
с ионами меди (II)
5. Триэтиламин растворяется в воде лучше, чем
этиламин и способен к образованию
межмолекулярных водородных связей.
53
54.
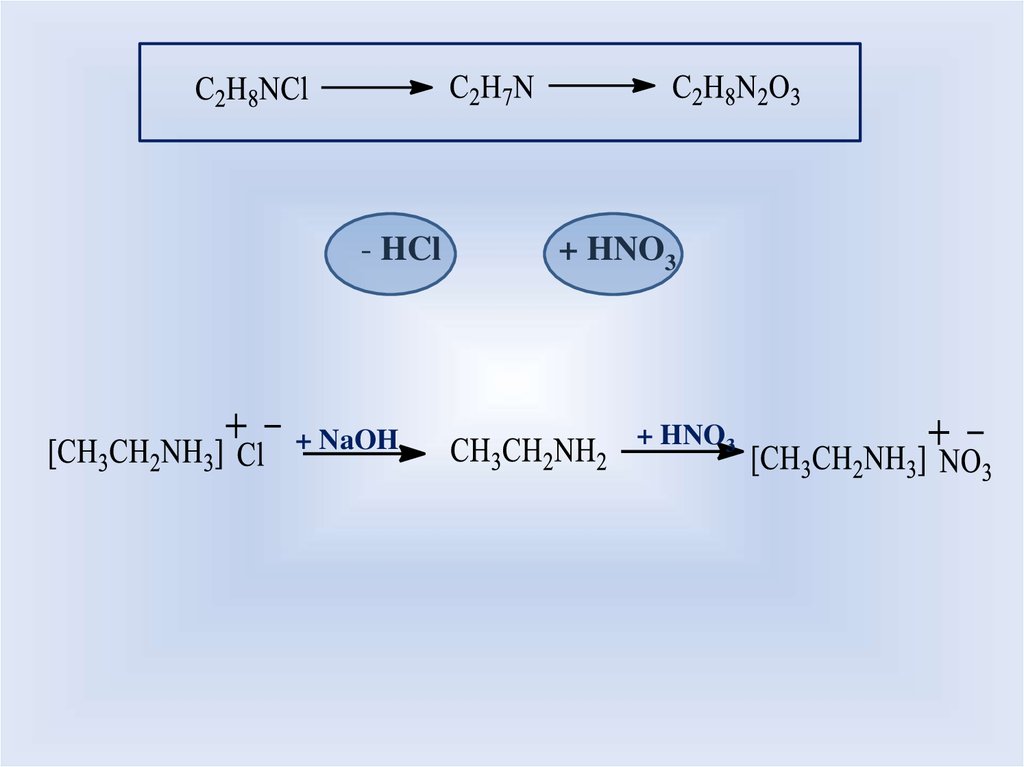
- HCl+ NaOH
+ HNO3
+ HNO3
55.
Хлоридфениламмония1. Реагирует с КОН
2. Имеет молекулярную структуру
3. Реагирует с AgNO3
4. Обесцвечивает бромную воду
5. Реагирует c HCl
55
56.
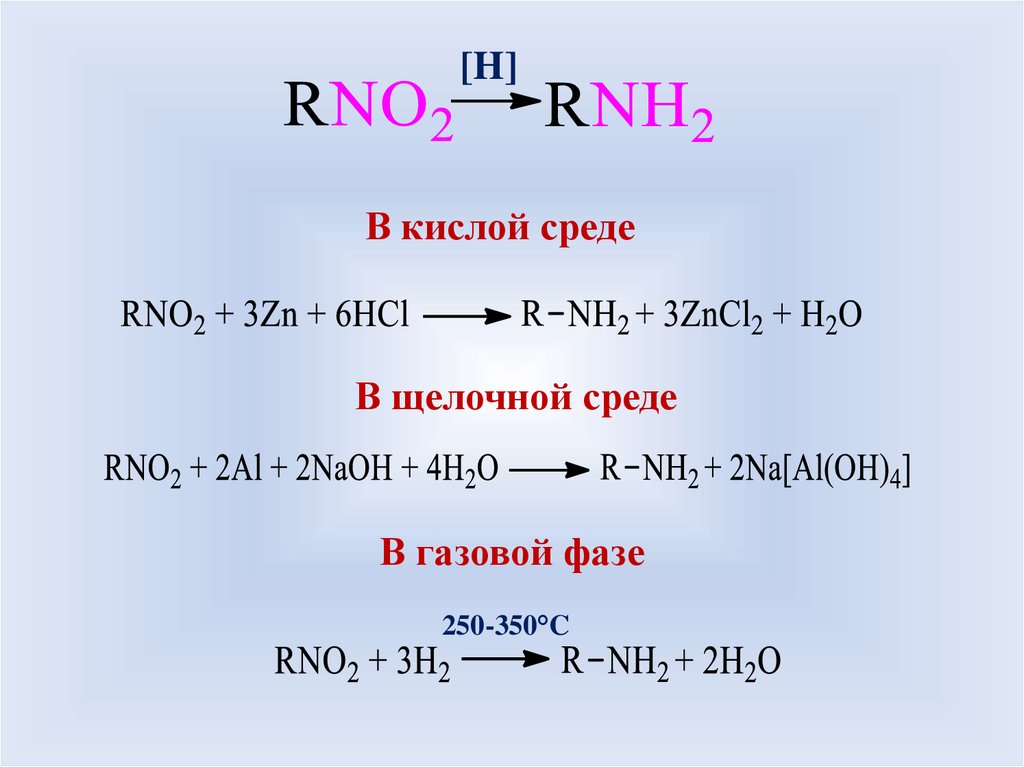
[H]В кислой среде
В щелочной среде
В газовой фазе
250-350°C
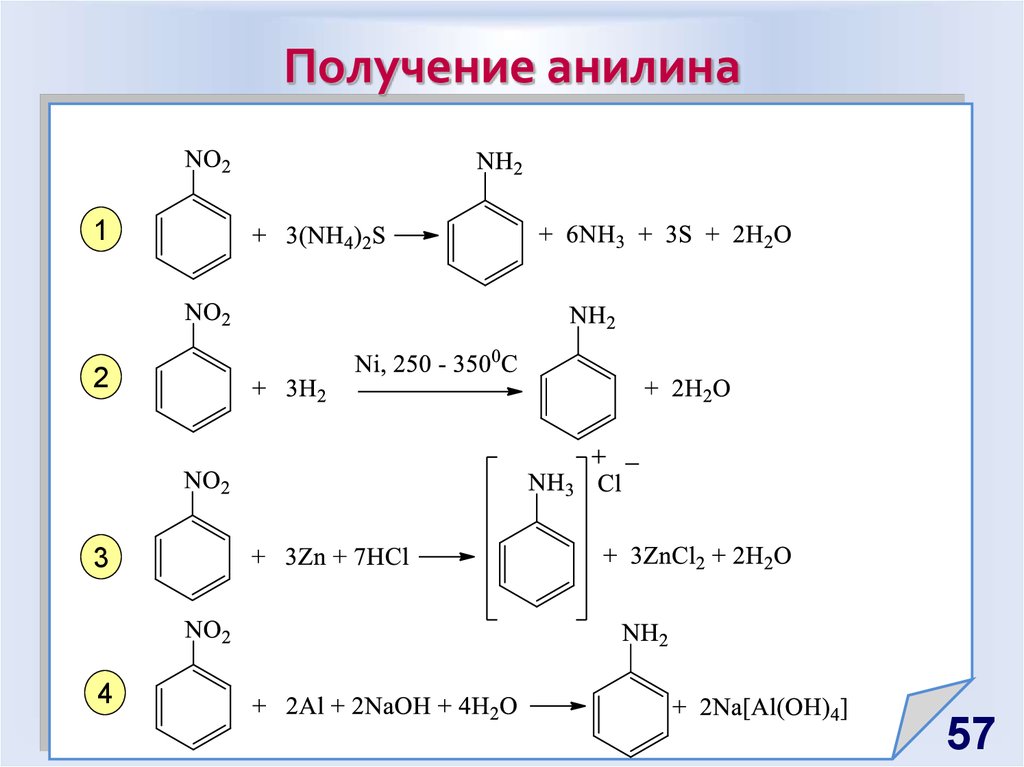
57. Получение анилина
12
3
4
57
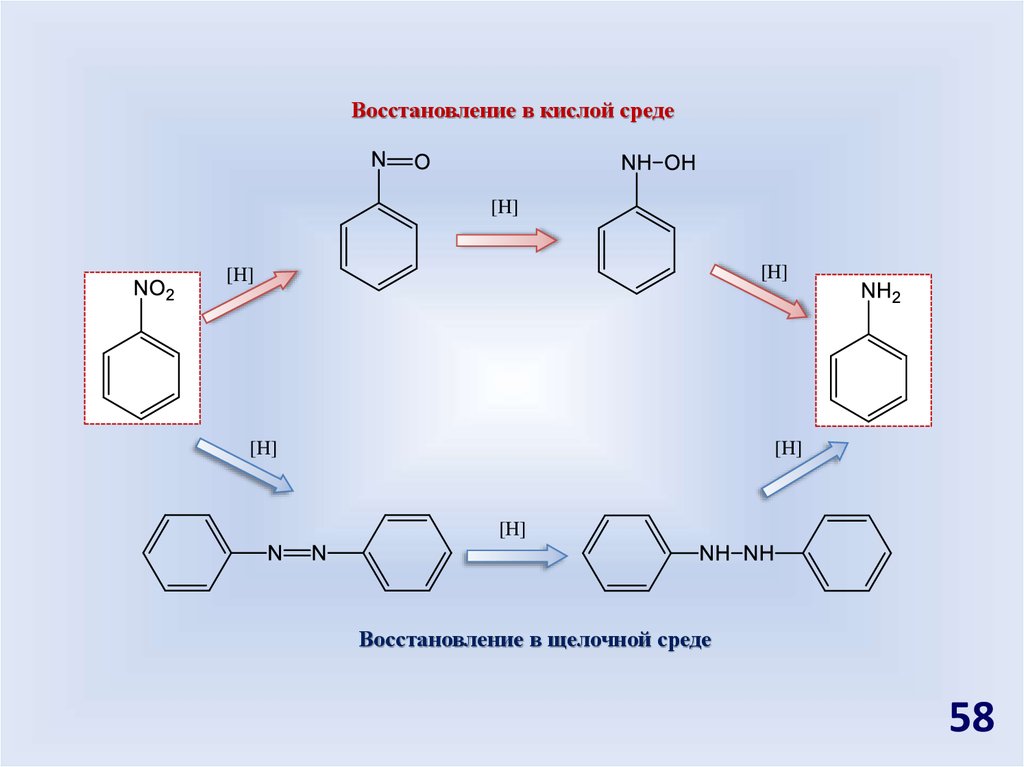
58.
Восстановление в кислой среде[H]
[H]
[H]
[H]
[H]
[H]
Восстановление в щелочной среде
58
59.
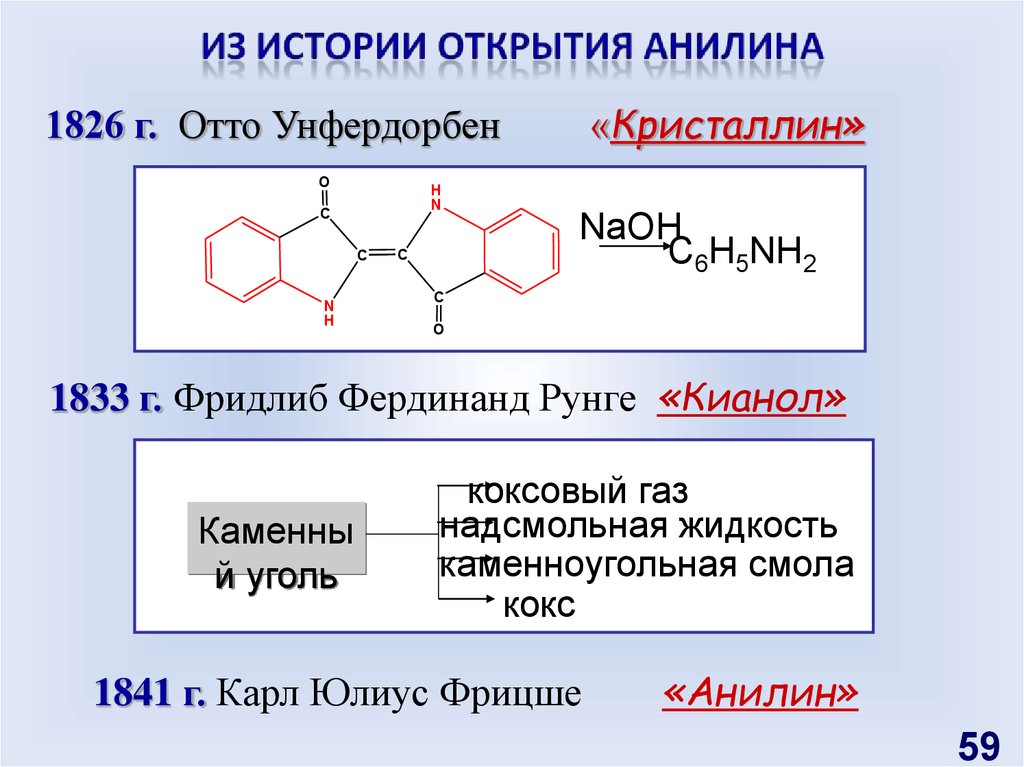
1826 г. Отто УнфердорбенO
H
N
C
C
N
H
C
«Кристаллин»
NaOH
C6H5NH2
C
O
1833 г. Фридлиб Фердинанд Рунге «Кианол»
Каменны
й уголь
коксовый газ
надсмольная жидкость
каменноугольная смола
кокс
1841 г. Карл Юлиус Фрицше
«Анилин»
59
60.
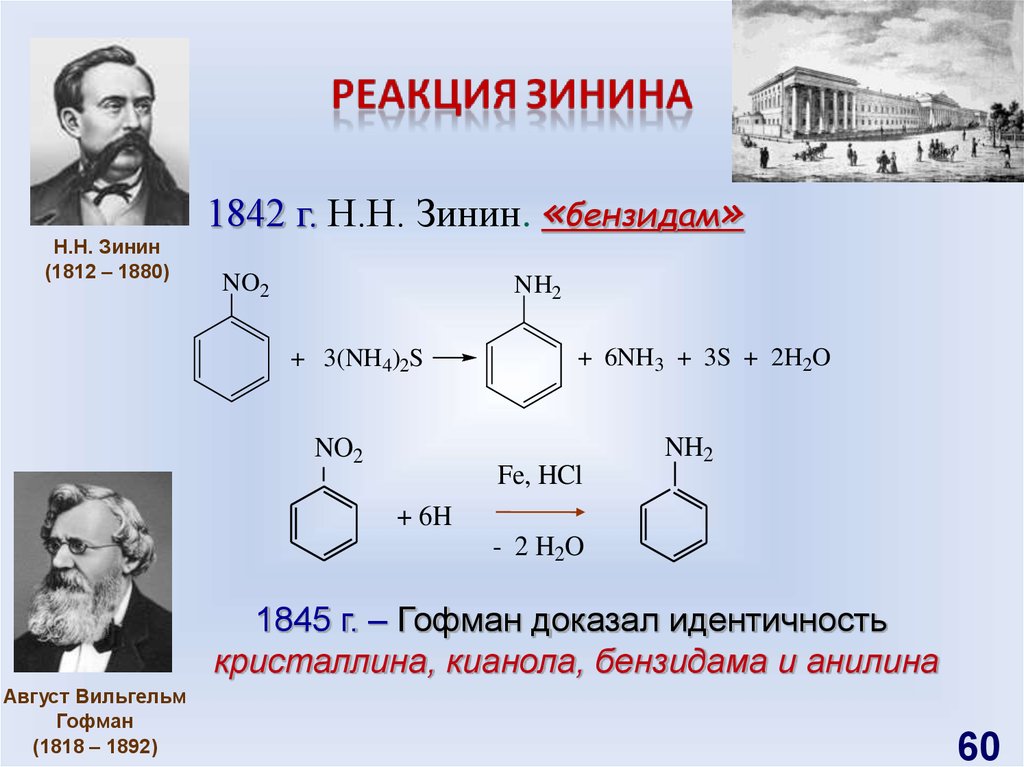
Н.Н. Зинин(1812 – 1880)
1842 г. Н.Н. Зинин. «бензидам»
NO2
NH2
+ 3(NH4)2S
NO2
+ 6NH3 + 3S + 2H2O
Fe, HCl
NH2
+ 6H
- 2 H2O
1845 г. – Гофман доказал идентичность
кристаллина, кианола, бензидама и анилина
Август Вильгельм
Гофман
(1818 – 1892)
60
61.
«Если бы Зинин не сделал ничего более, кроме превращениянитробензола в анилин, то и тогда его имя осталось бы
записанным золотыми буквами в истории химии»
А. В. Гофман. Президент немецкого химического общества
Александр Абрамович
ВОСКРЕСЕНСКИЙ
(1809—1880)
Ю́стус ЛИ́БИХ
(1803— 1873)
.
Николай Николаевич
ЗИНИН
(1812— 1880) .
6 ноября 1868 г - состоялось первое заседание Русского химического
общества. Первым президентом стал Н.Н.Зинин.
61
62.
Синтезы на основе анилинаСинтетические
красители;
индикаторы
Лекарственные
препараты:
сульфаниламид и его
производные; анестезин,
новокаин и т.д.
Пестициды
Стабилизирующие
добавки к
полимерам
Взрывчатые
вещества
62
63.
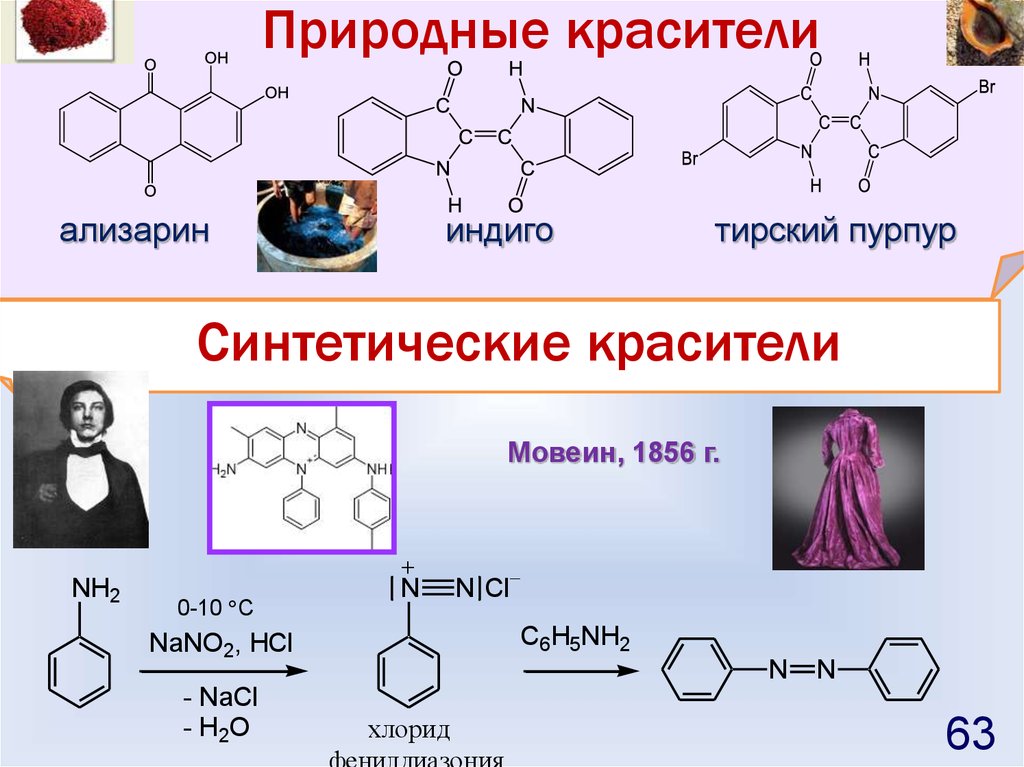
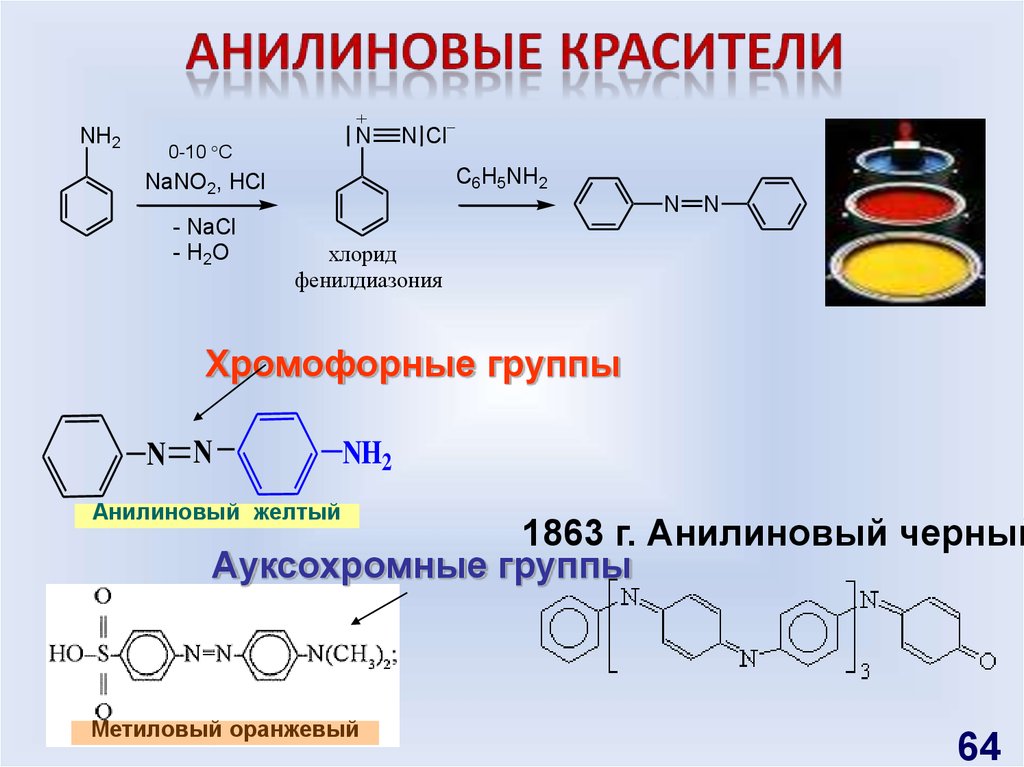
Природные красителиализарин
индиго
тирский пурпур
Синтетические красители
Мовеин, 1856 г.
NH2
0-10 C
N
C6H5NH2
NaNO2, HCl
- NaCl
- H2O
N Cl
N
хлорид
N
63
64.
NH2N
0-10 C
N Cl
C6H5NH2
NaNO2, HCl
- NaCl
- H2O
N
N
хлорид
фенилдиазония
Хромофорные группы
N N
NH2
Анилиновый желтый
1863 г. Анилиновый черный
Ауксохромные группы
Метиловый оранжевый
64
65. Свойства
В отличие от триметиламина анилин1. Реагирует с НСI
2. Взаимодействует с СН3СI
3. Образует с бромной водой осадок
4. Является жидкостью
5. При горении образуются N2, CO2, H2O
6. Способен образовывать межмолекулярные
водородные связи
65
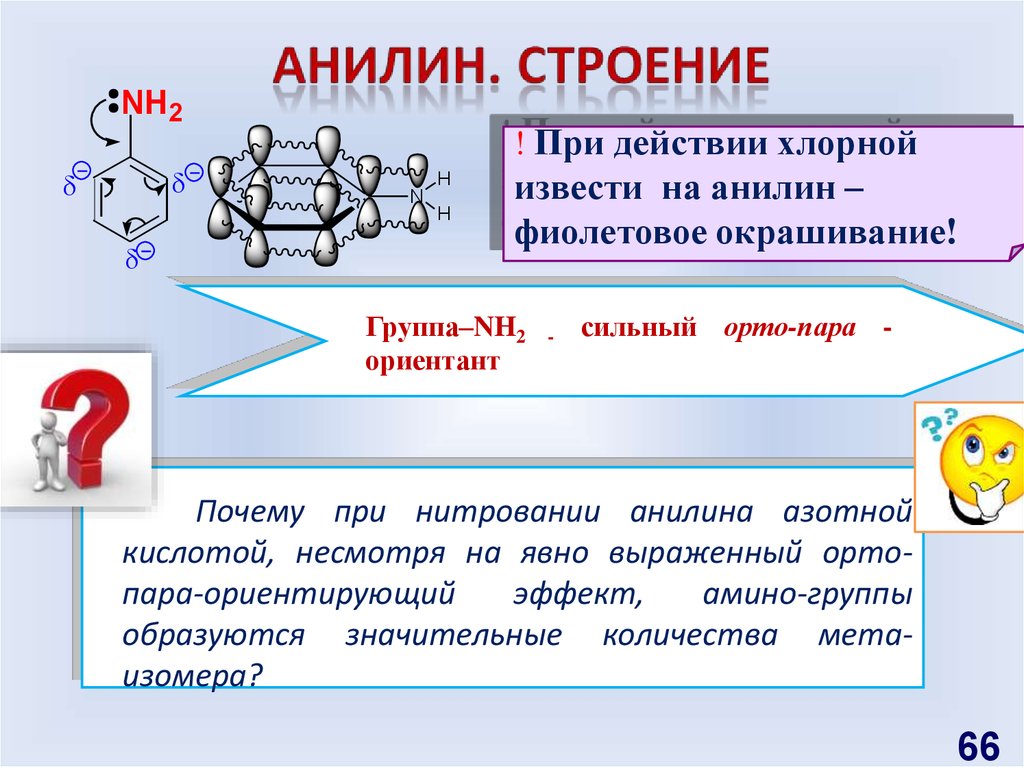
66.
NH 2! При действии хлорной
H
N
H
извести на анилин –
фиолетовое окрашивание!
Группа–NH2
ориентант
-
сильный орто-пара -
Почему при нитровании анилина азотной
кислотой, несмотря на явно выраженный ортопара-ориентирующий
эффект,
амино-группы
образуются значительные количества метаизомера?
66
67. Свойства
Нельзя различить с помощью бромной воды1. бензол и фенол
2. бензол и анилин
3. анилин и фенол
4. ацетилен и пропен
5. глюкоза и фруктоза
6. циклогексан и бензол
67
68. Свойства
Установить соответствие между двумявеществами и реагентом, позволяющим их
отличить:
Реагенты
Органические соединения
1) [Ag(NH3)2]
А) нитробензол и бензальдегид
Б) нитробензол и анилин
OH
В) нитробензол и фенол
2) HCI
Г) пропиламин и метилэтиламин
3) HNO2
4) FeCI3
А
Б
В
Г
1
2
4
3
68
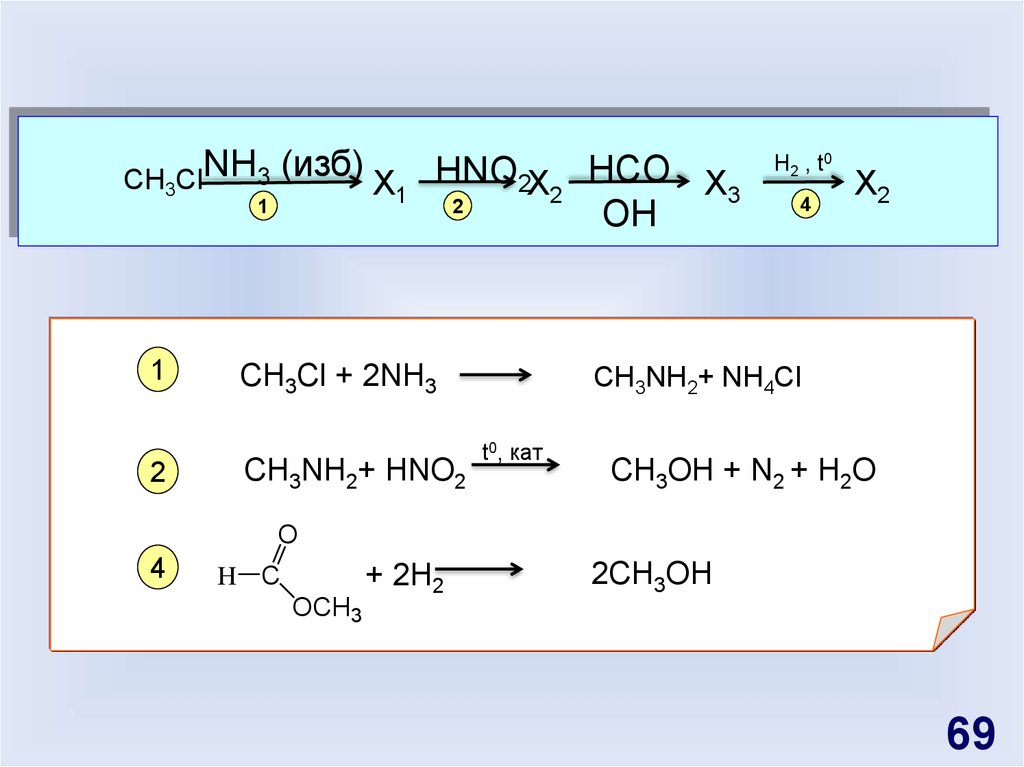
69.
CH ClNH3 (изб) X3
1
2
1
1
HNO2X
2
2
CH3Cl + 2NH3
CH3NH2+ HNO2
HCO X
3
OH
H2 , t0
4
X2
CH3NH2+ NH4Cl
t0, кат
CH3OH + N2 + H2O
O
4
+ 2H2
H C
2CH3OH
OCH3
69
70.
В схеме превращений вещество X3H SO4
CH3СH2CH2CH2OH 2
(конц) HBr,
NH3 X
X
X
2
3
t0>1400 1 H O
2 2
1. 1-аминобутан
2. 2-аминобутан
3. бромидбутиламмония
4. 1-бромбутан
70
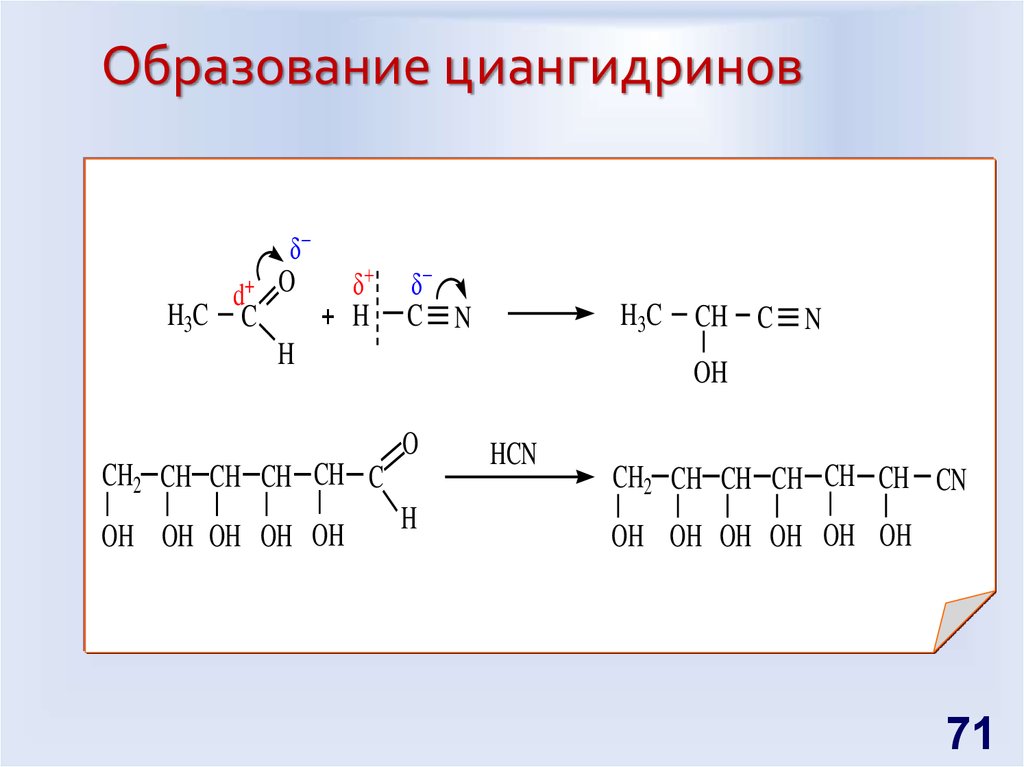
71. Образование циангидринов
+d
H3C C
O
+ H
C N
H3C
H
N
OH
O
CH2 CH CH CH CH C
OH OH OH OH OH
CH C
H
HCN
CH2 CH CH CH CH CH CN
OH OH OH OH OH OH
71
72.
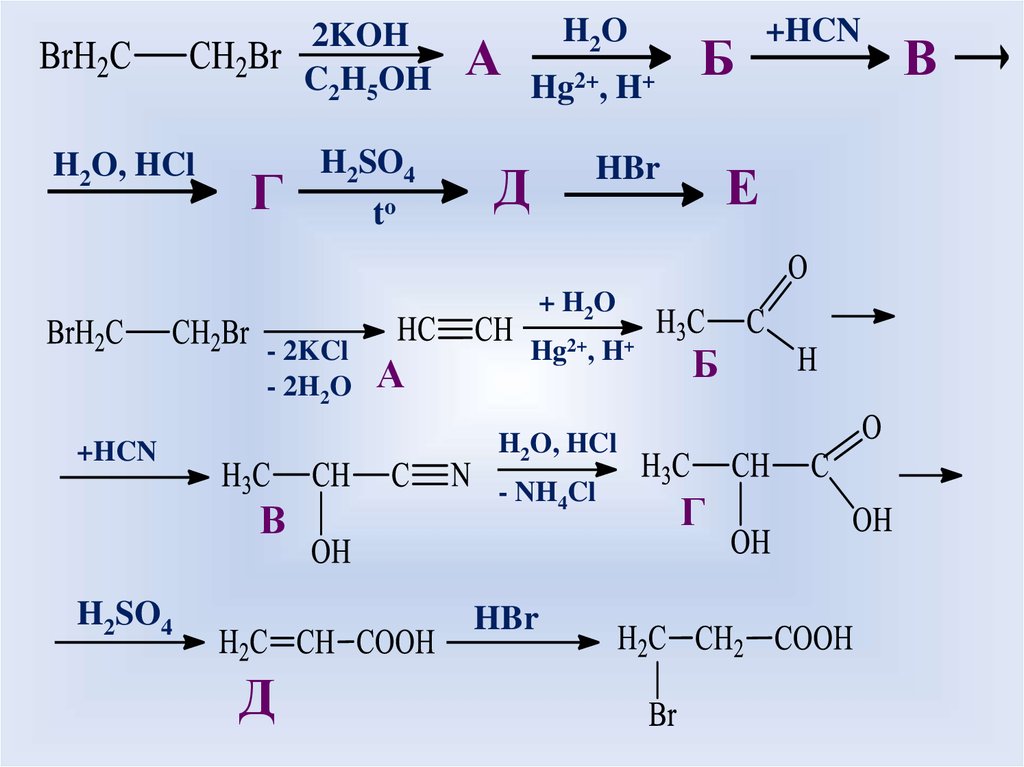
2KOHC2H5OH
H2O, HCl
Г
H2SO4
to
А
H2O
Hg2+,
H+
Б
HBr
Д
Е
+ H2 O
- 2KCl
- 2H2O
А
Hg2+, H+
Б
H2O, HCl
+HCN
В
H2SO4
- NH4Cl
HBr
Д
Г
+HCN
В
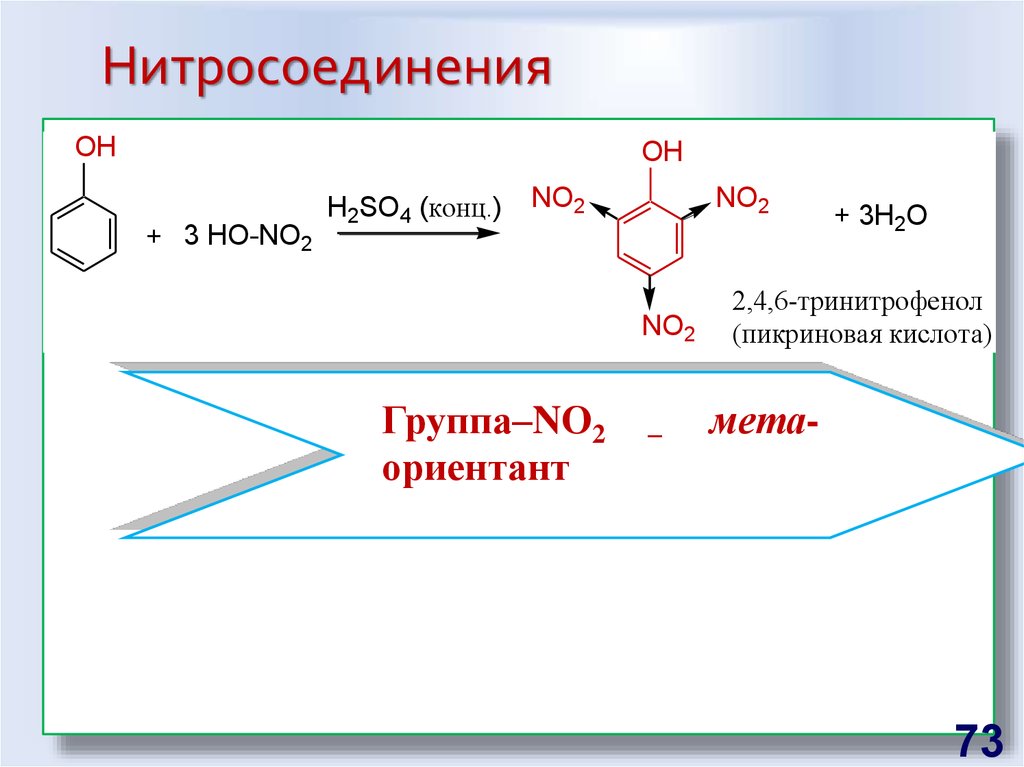
73. Нитросоединения
OHOH
+ 3 HO-NO2
H2SO4 (конц.)
NO2
NO2
NO2
Группа–NО2
ориентант
–
+ 3H2O
2,4,6-тринитрофенол
(пикриновая кислота)
мета-
73
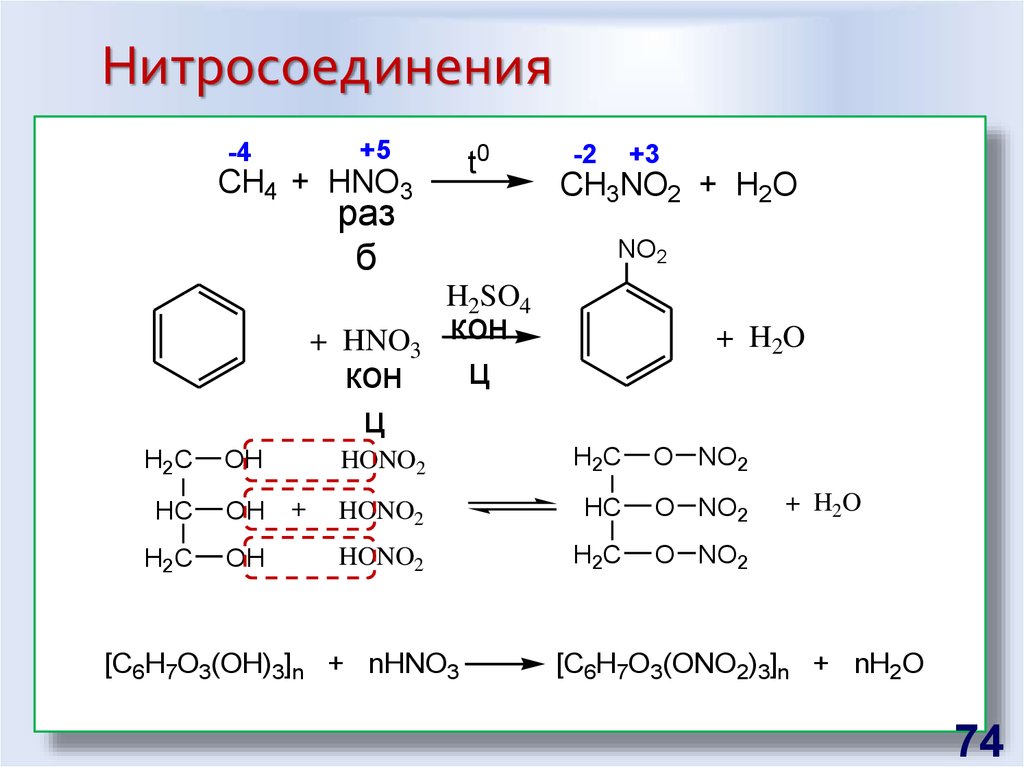
74. Нитросоединения
+5-4
t0
CH4 + HNO3
раз
б
-2
+3
CH3NO2 + H2O
NO2
H2SO4
+ HNO3
кон
ц
H2C
OH
HC
OH
H2C
OH
+
кон
ц
+ H2O
HONO2
H2C
O NO2
HONO2
HC
O NO2
HONO2
H2C
O NO2
[C6H7O3(OH)3]n + nHNO3
+ H2O
[C6H7O3(ONO2)3]n + nH2O
74
75.
Нитроцеллюлоза и ее производныеНачинка для снарядов
и морских мин
«Бездымный
(кордит)
Кристиан Фридрих
Шёнбейн
(1799-1868 гг)
профессор
Базельскогго
университета
порох»
Целлулоид
(нитроцеллюлоза
+
камфора)
–
первая
синтетическая пластмасса
(заменитель
слоновой
кости)
«Искусственный
шелк
Шардонне»
(1884
г.,
патент;
«Гремучий
студень»
нитроцеллюлоза
+
нитроглицерин –
75
76.
Нитроглицерин -сосудорасширяющее средство
1998 г. – Нобелевская премия по
физиологии и медицине
«За открытие роли оксида азота как
сигнальной молекулы в регуляции
сердечно-сосудистой системы»
Ферид Мурад
76
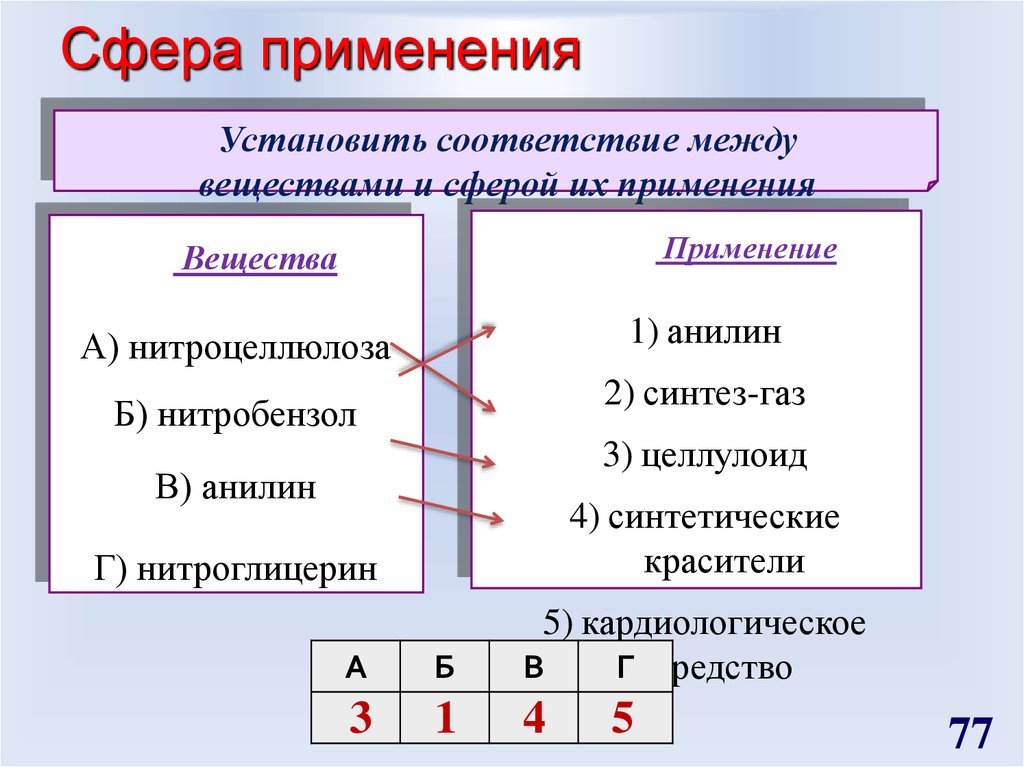
77. Сфера применения
Установить соответствие междувеществами и сферой их применения
Применение
Вещества
1) анилин
А) нитроцеллюлоза
2) синтез-газ
Б) нитробензол
3) целлулоид
В) анилин
4) синтетические
красители
Г) нитроглицерин
А
Б
5) кардиологическое
В
Г средство
3
1
4
5
77
78.
Для фенилаланина справедливо:1. Формула С6H5-CH(NH2)-CH2-COOH.
2. Ароматический амин.
3. Образует со спиртами сложные эфиры.
4. Участвует в реакции поликонденсации.
5. Не реагирует с основаниями.
6. Не взаимодействует с HNO3.
78
79.
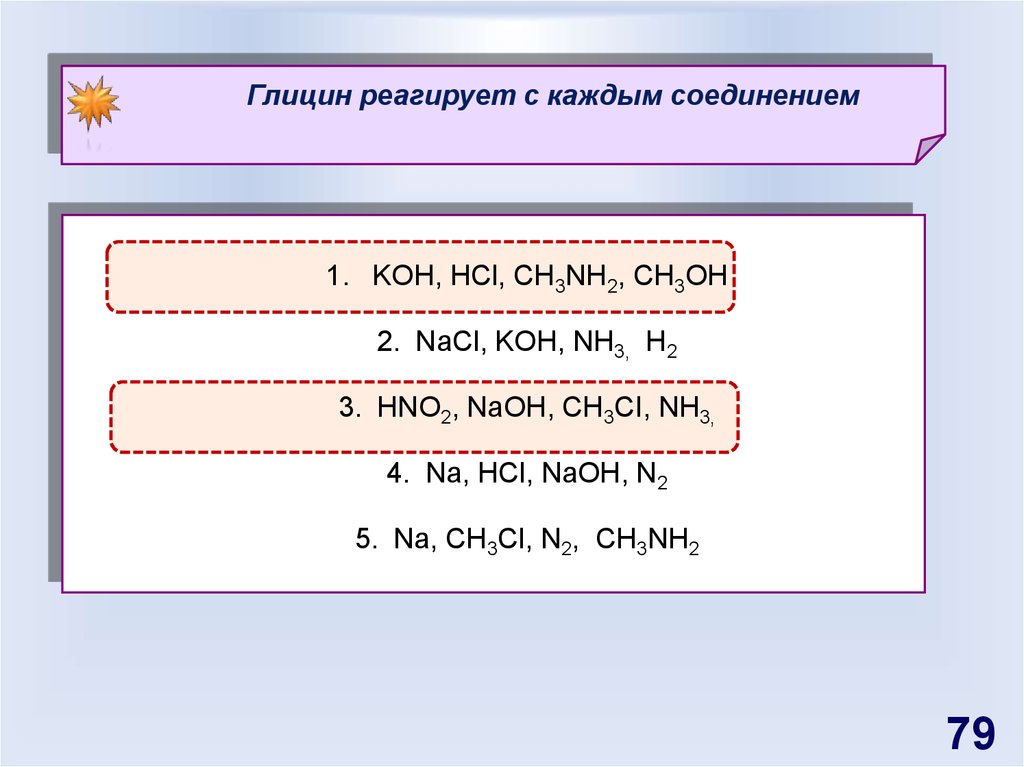
Глицин реагирует с каждым соединением1. KOH, HCl, CH3NH2, СН3OH
2. NaCl, KOH, NH3, H2
3. HNO2, NaOH, СН3СI, NH3,
4. Na, HCl, NaOH, N2
5. Na, CH3Cl, N2, CH3NH2
79
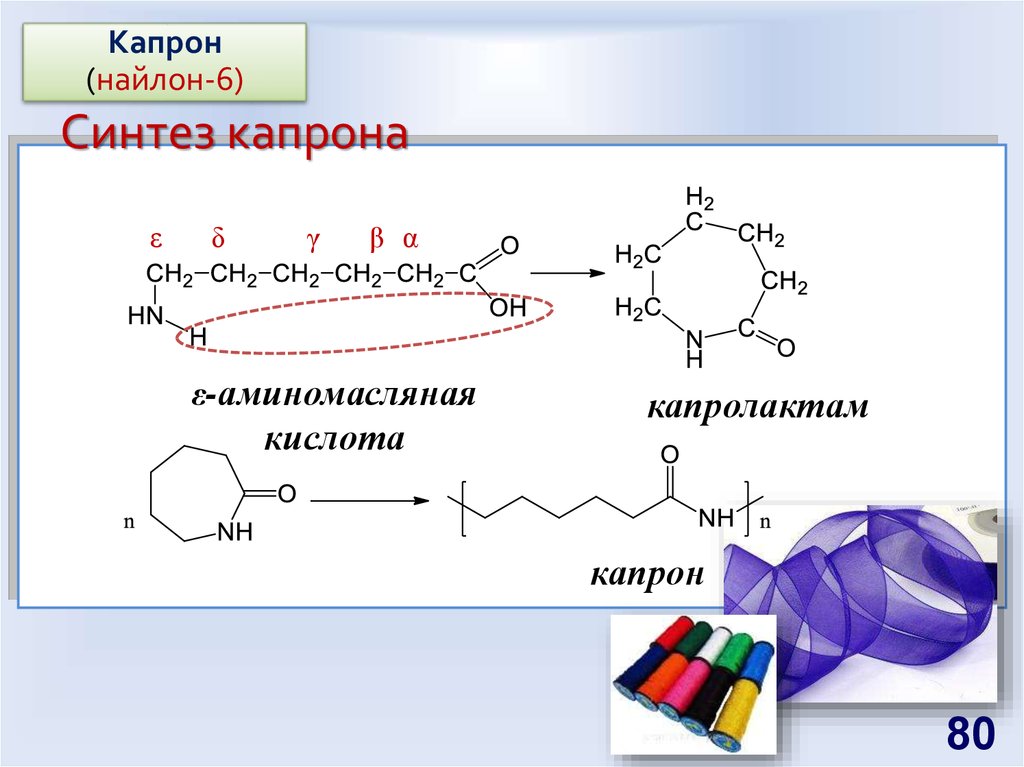
80. Синтез капрона
Капрон(найлон-6)
Синтез капрона
ε
δ
γ
β α
ε-аминомасляная
кислота
капролактам
капрон
80
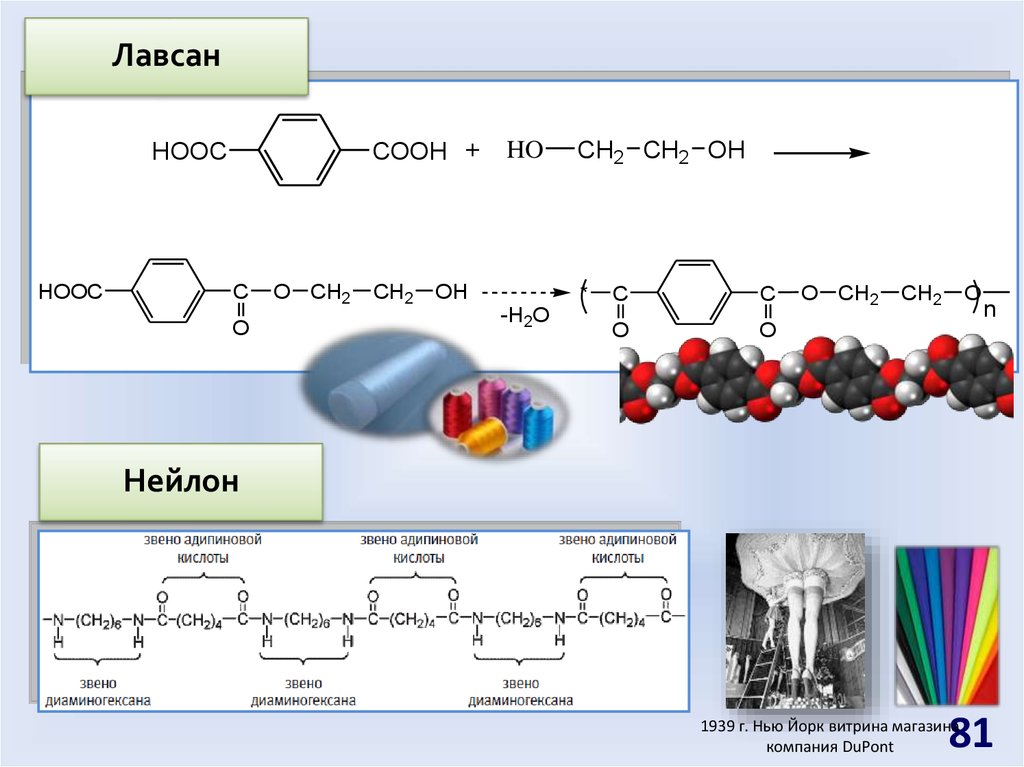
81.
ЛавсанCOOH +
HOOC
HOOC
C
O
O CH2
CH2
HO
OH
CH2 CH2 OH
*
-H2O
C
C
O
O
O CH2
CH2
O
n
Нейлон
81
1939 г. Нью Йорк витрина магазина
компания DuPont
82.
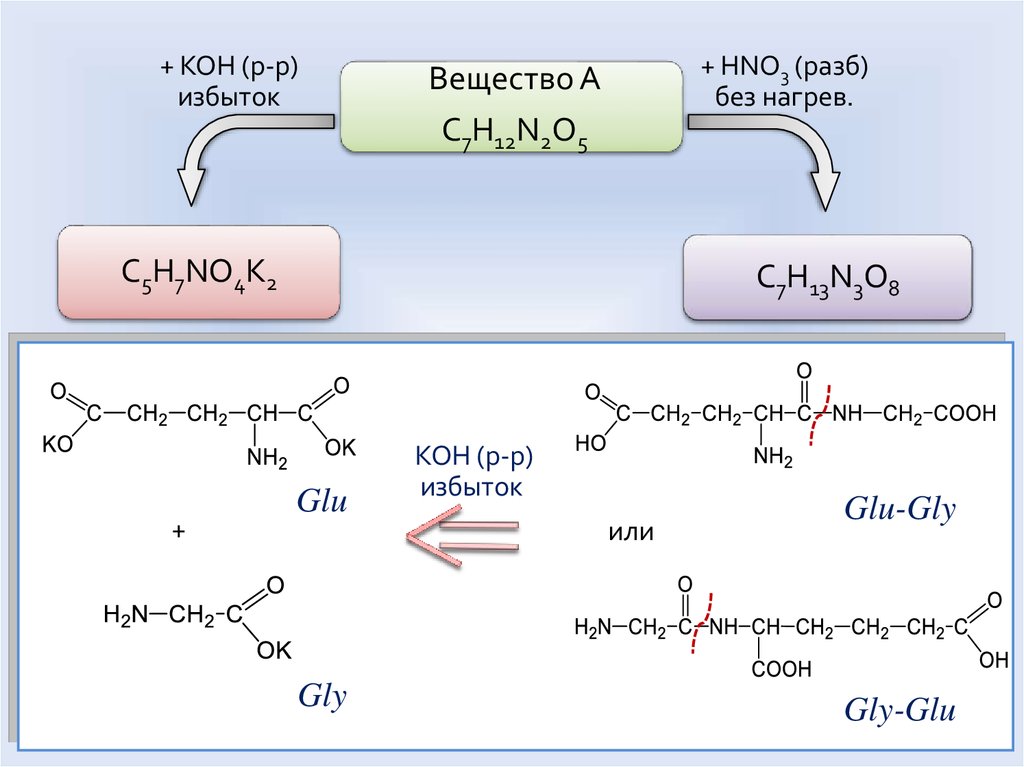
+ KOH (р-р)избыток
+ HNO3 (разб)
без нагрев.
Вещество А
C7H12N2O5
C5H7NO4K2
+
C7H13N3O8
Glu
Gly
KOH (р-р)
избыток
или
Glu-Gly
Gly-Glu
83.
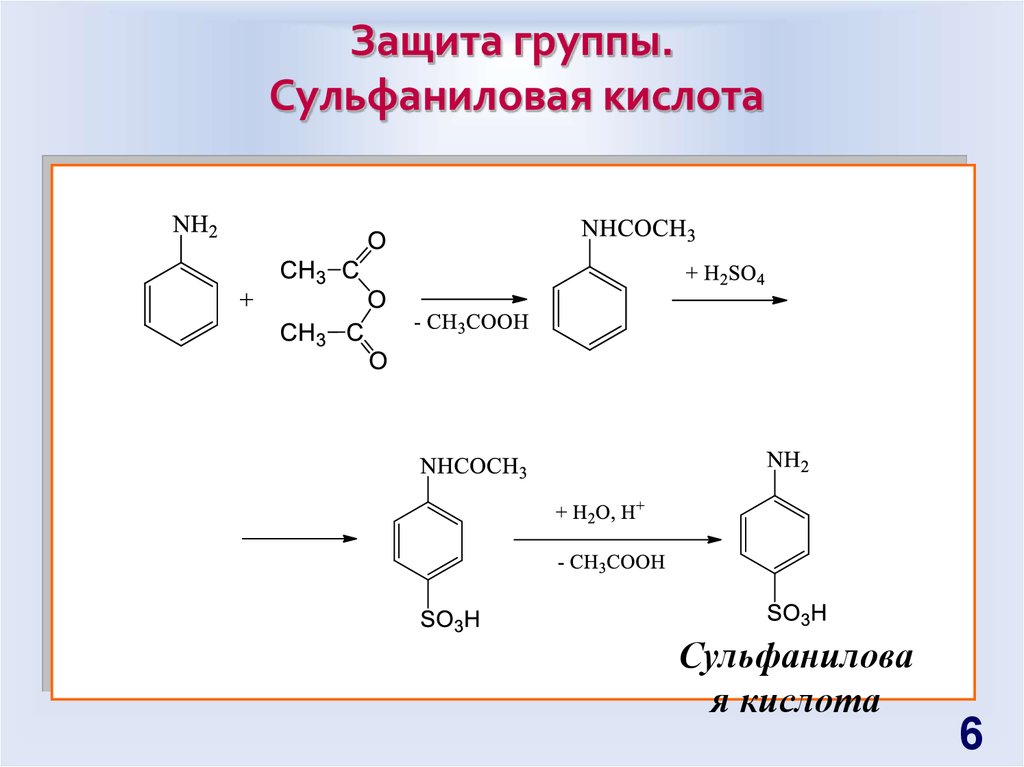
Защита группы.Cульфаниловая кислота
Сульфанилова
я кислота
6
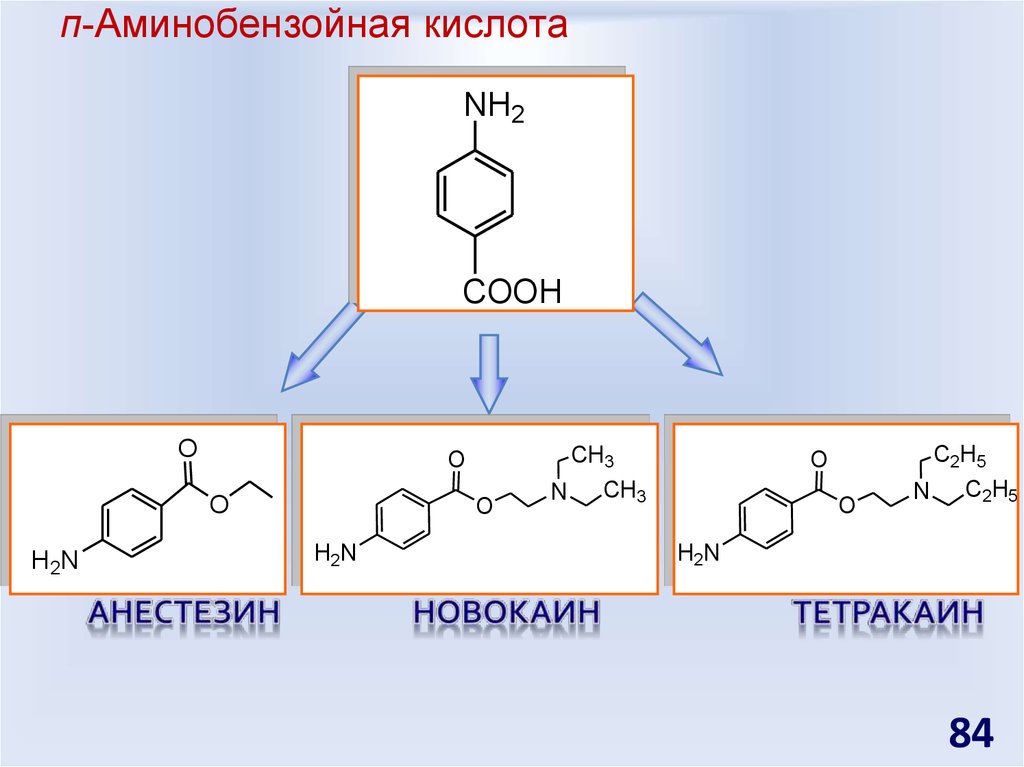
84. п-Аминобензойная кислота
NH2COOH
O
O
H 2N
CH3
O
O
H2N
N
C2H5
O
CH3
O
N
C2H5
H2N
84
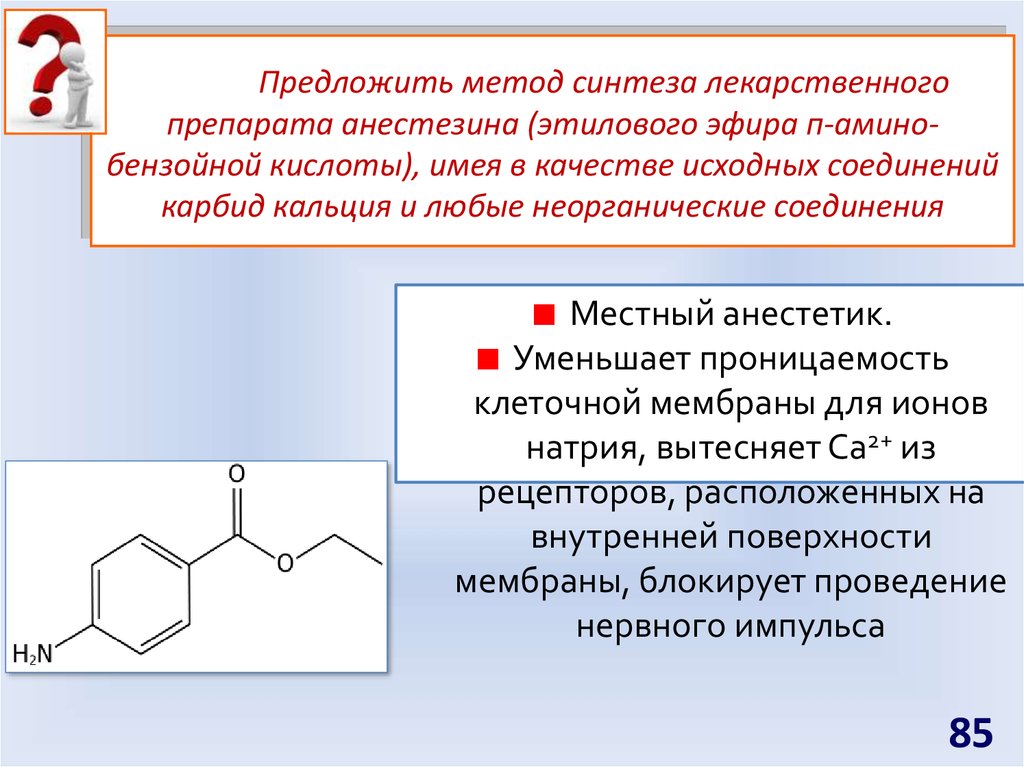
85.
Предложить метод синтеза лекарственногопрепарата анестезина (этилового эфира п-аминобензойной кислоты), имея в качестве исходных соединений
карбид кальция и любые неорганические соединения
Местный анестетик.
Уменьшает проницаемость
клеточной мембраны для ионов
натрия, вытесняет Ca2+ из
рецепторов, расположенных на
внутренней поверхности
мембраны, блокирует проведение
нервного импульса
85
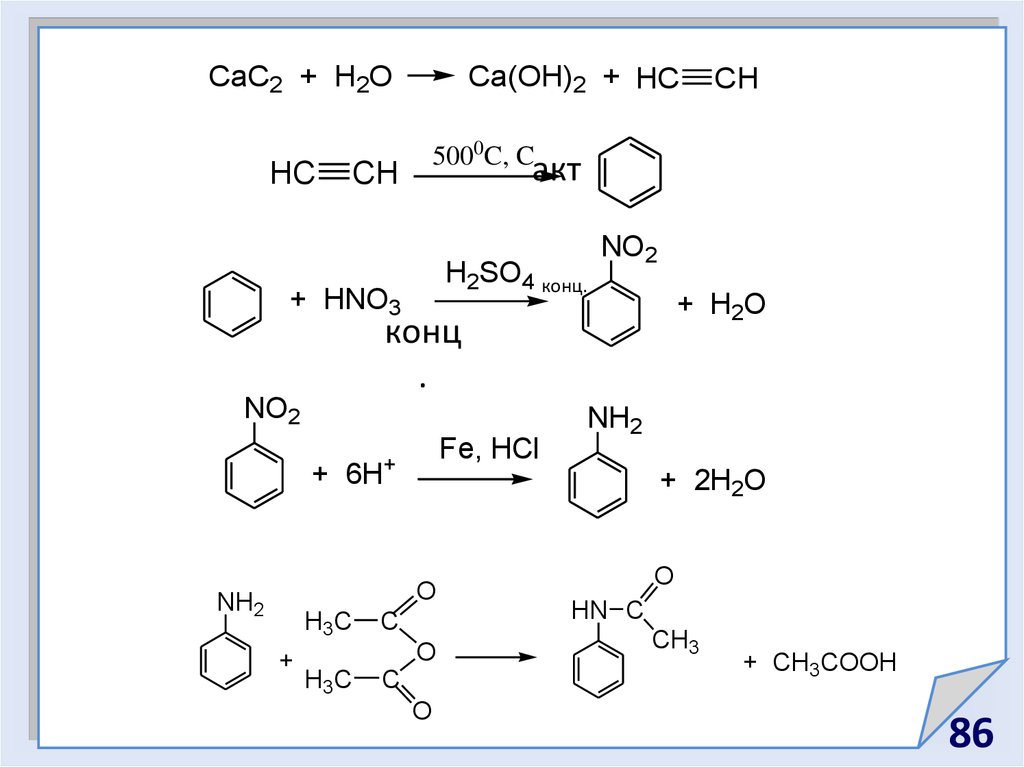
86.
CaC2 + H2OHC
Ca(OH)2 + HC
5000C, C
акт
CH
H2SO4 конц.
+ HNO3
NO2
+ H2O
конц
.
NO2
Fe, HCl
+
+ 6H
H3C
+
C
O
H3C
NH2
+ 2H2O
O
NH2
CH
C
O
O
HN C
CH3
+ CH3COOH
86
87.
OO
HN C
HN C
CH3
+ CH3Cl
AlCl3
CH3
+ HCl
CH3
O
O
HN C
HN C
CH3
CH3
KMnO4, H+
COOH
CH3
O
HN C
NH2
CH3
+ H2O, H+
- CH3COOH
COOH
COOH
87
88.
88NH2
NH2
+ H+
+ C2H5OH
+ H2O
C
COOH
C2H5O
O
O
CH3
O
H2N
+
HO
N
CH3
CH3
O
CH3ONa
H2N
O
N
CH3
89.
ЗадачаNO2
COOH
NH2
OH
NH2
OH
?
Разделить.
OK
C
OK
эфир
эфир
O
вода
KOH (водн.)
KOH (водн.)/ C2H5-O-C2H5
NO2
NH2
Эфирный
слой
NH2
вода
OK
77
90.
OOK
C
OK
NH2
OK
C2H5-O-C2H5 , СО2
эфи
р
вода
78
91.
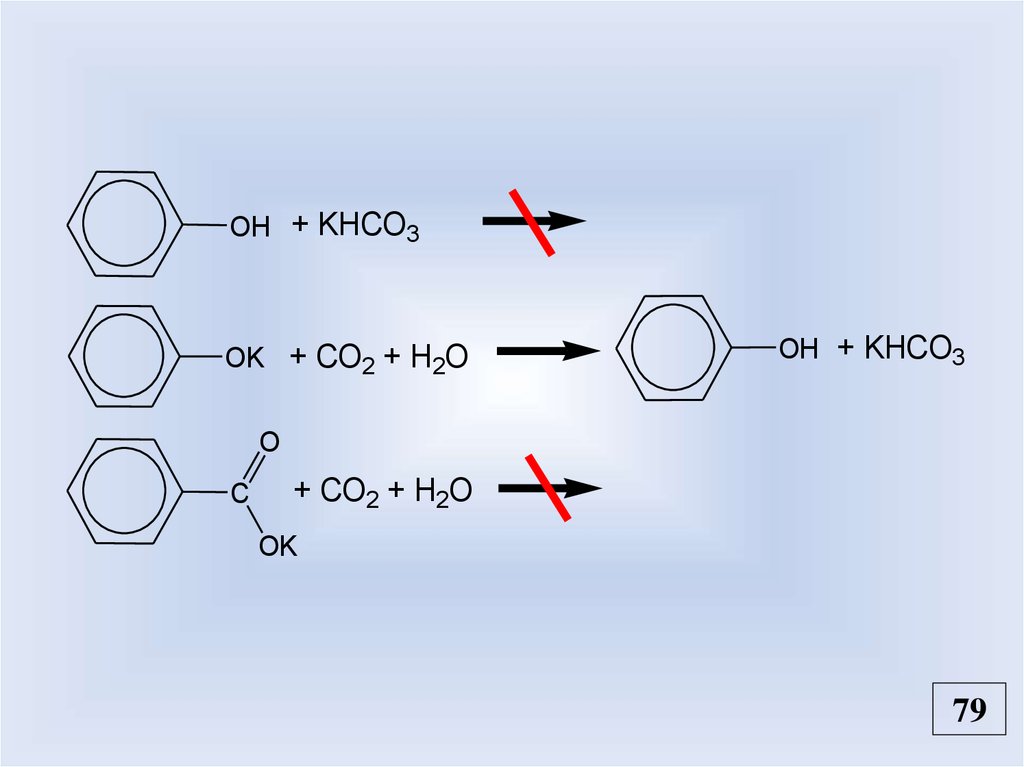
OH + KHCO3OK + CO2 + H2O
OH + KHCO3
O
C
+ CO2 + H2O
OK
79
92.
OOK
C
OK
80
NH2
OK
C2H5-O-C2H5 , СО2
Эфирный слой
Водный слой
O
OK
NH2
OH
C
эфир
OH
вода
+H2O, HCl
+HCl
COOH
OH
NH3+Cl-
OH
93.
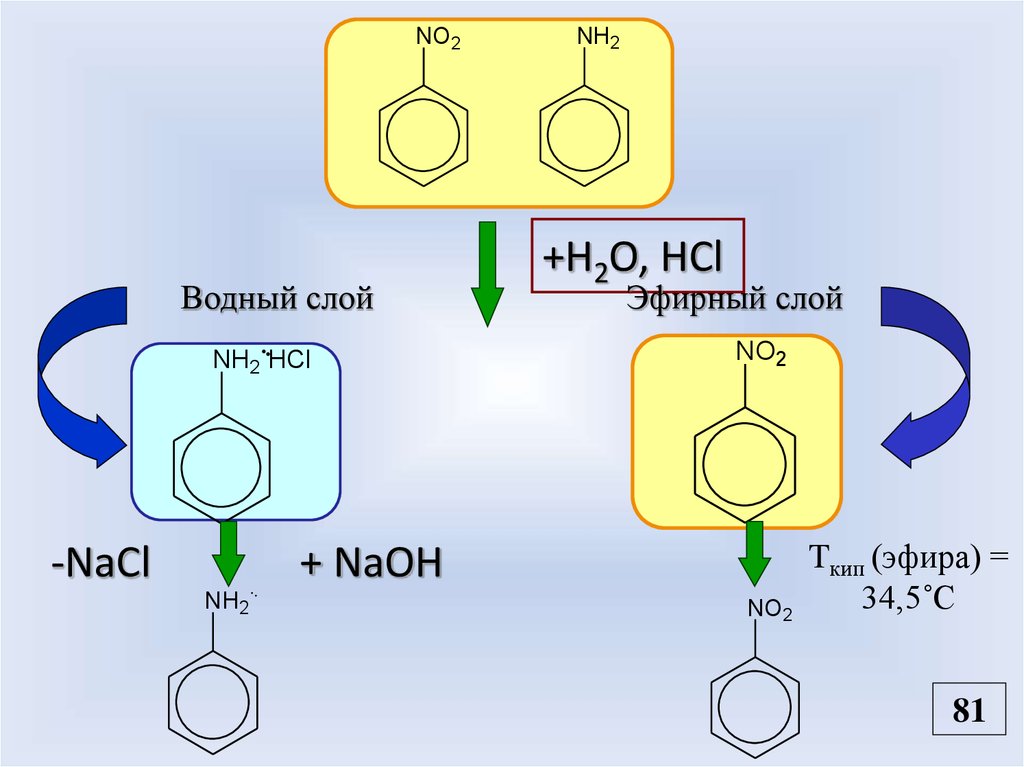
NO2Водный слой
NH2 HCl
NH2
+H2O, HCl
Эфирный слой
NO2
+ NaOH
-NaCl
NH2
NO2
Tкип (эфира) =
34,5˚С
81
94. «Химия создает свой предмет. Эта творческая способность, подобная искусству, коренным образом отличает химию от остальных
естественных игуманитарных наук»
М. Бертло, 1860 г.
35
































 chemistry
chemistry








