Similar presentations:
Кислородосодержащие органические соединения
1. Кислородосодержащие органические соединения
2. Что такое кислородсодержащие органические соединения?
Кислородсодержащие органические соединения — этоорганические вещества, в молекулах которых, помимо углерода
и водорода, присутствует также кислород.
Эти соединения отличаются большим разнообразием и
классифицируются по типу функциональных групп, содержащих
атомы кислорода.
Систематические названия спиртов производятся
добавлением суффикса -ол к названию
соответствующего углеводорода и при необходимости
указанием номера атома углерода, при котором
находится группа –ОН
При одном и том же атоме
углерода не может находиться
более одной гидроксогруппы.
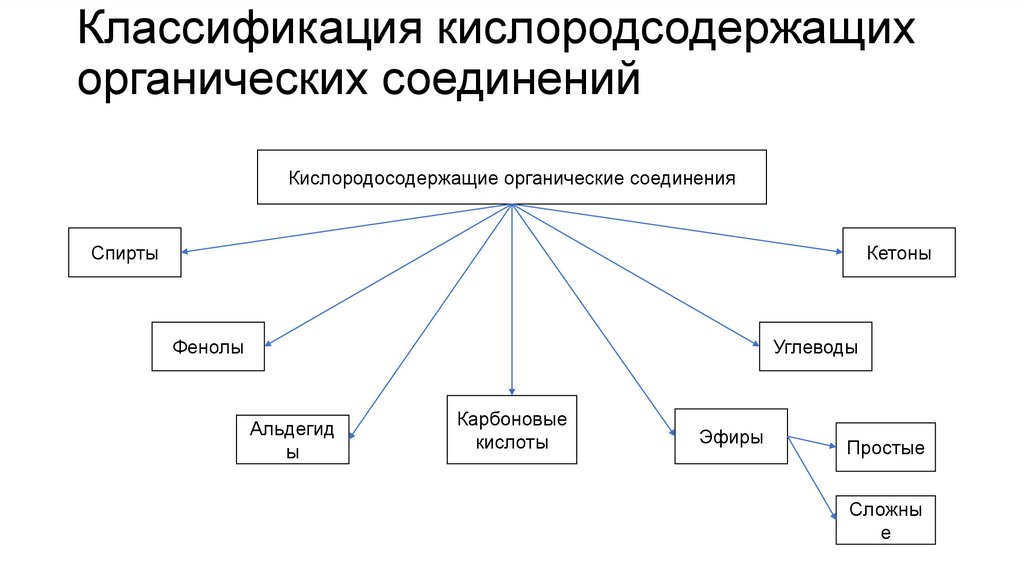
3. Классификация кислородсодержащих органических соединений
Кислородосодержащие органические соединенияСпирты
Кетоны
Углеводы
Фенолы
Альдегид
ы
Карбоновые
кислоты
Эфиры
Простые
Сложны
е
4. Спирты
Спирты — это производные углеводородов, вкоторых один или несколько атомов водорода
заменены на гидроксильную группу –OH
Общая формула
спиртов:
R−OH
Классификация спиртов
1. По количеству гидроксильных групп:
Одноатомные спирты имеют одну гидроксильную группу.
C₂H₅OH
Двухатомные спирты имеют две гидроксильной группы.
HO–CH₂–CH₂–OH
Многоатомные спирты имеют три и больше
гидроксильных групп. HO–CH₂–CH(OH)–CH₂OH
2. По строению углеродного скелета (по степени
насыщенности):
Насыщенные спирты (алканолы): CnH₂n+1OH
Ненасыщенные спирты (алкенолы, алкиновые и т. д.)
Ароматические спирты — OH-группа вне
ароматического кольца (например, бензиловый спирт)
3. По положению –OH группы:
Первичный (1°) – Этанол – –CH₂–OH
Вторичный (2°) – Изопропанол – –CH–OH (с
двумя радикалами)
Третичный (3°)– Трет-бутанол – –C–OH (с тремя
радикалами)
5. Спирты
Химические свойства спиртов1. Кислотные свойства:
Слабо выраженные, могут реагировать с активными металлами:
2C2H5OH+2Na→2C2H5ONa+H2↑
Способы получения спиртов
1. Гидратация алкенов:
CH2=CH2+H2O → CH3CH2OH (вприсутствии
H2SO4)
2. Образование простых эфиров (дегидратация спиртов):
2CH3CH2OH H2SO4, t° CH3CH2–O–CH2CH3+H2O
2. Восстановление альдегидов и
кетонов:
CH3CHO+H2 → CH3CH2OH
3. Окисление:
CH3CH2OH [O] CH3CHO
[O]
CH3COOH
4. Реакции с галогенводородами:
C2H5OH+HCl ZnCl2 C2H5Cl+H2O
3. Гидролиз галогеналканов:
CH3CH2Cl+NaOH(водн.) → CH3CH2OH+NaCl
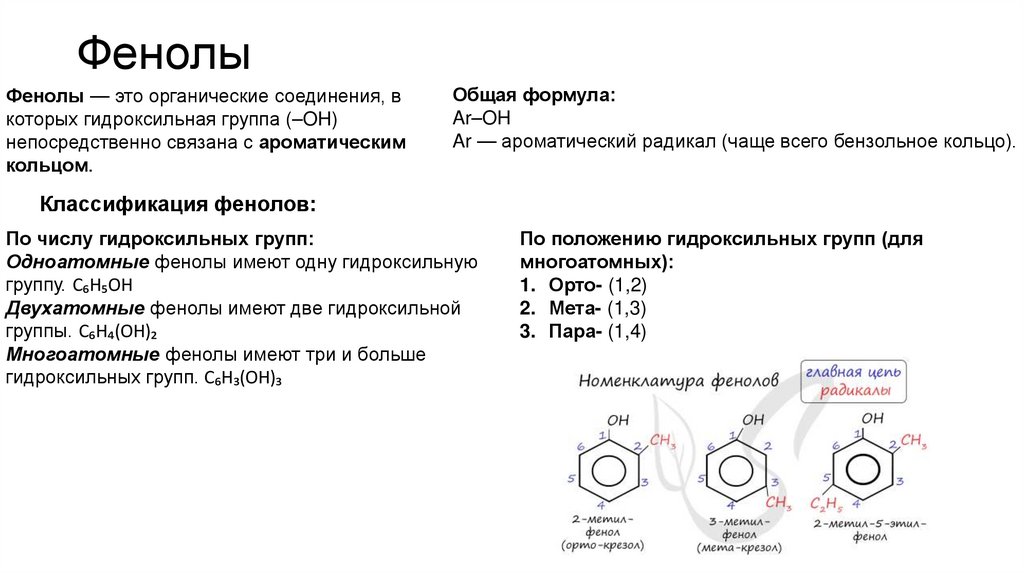
6. Фенолы
Фенолы — это органические соединения, вкоторых гидроксильная группа (–OH)
непосредственно связана с ароматическим
кольцом.
Общая формула:
Ar–OH
Ar — ароматический радикал (чаще всего бензольное кольцо).
Классификация фенолов:
По числу гидроксильных групп:
Одноатомные фенолы имеют одну гидроксильную
группу. C₆H₅OH
Двухатомные фенолы имеют две гидроксильной
группы. C₆H₄(OH)₂
Многоатомные фенолы имеют три и больше
гидроксильных групп. C₆H₃(OH)₃
По положению гидроксильных групп (для
многоатомных):
1. Орто- (1,2)
2. Мета- (1,3)
3. Пара- (1,4)
7. Фенолы
Химические свойства феноловФенолы сочетают свойства ароматических соединений, спиртов
и слабых кислот.
1. Кислотные свойства (в отличие от спиртов):
Фенол отдает протон и образует фенолят:
C6H5OH+Na→C6H5ONa+1Τ2H2↑
C6H5OH+NaOH→C6H5ONa+H2O
Спирты не реагируют с щелочами, а фенолы — да!
2. Реакции электрофильного замещения в ароматическом
кольце:
–OH группа активирует бензольное кольцо по орто- и параположениям, облегчая замещение.
Галогенирование (без катализатора):
C6H5OH+3Br2→C6H2Br3OH+3HBr
3. Реакция с солями железа (III):
(качественная реакция на фенол)
C6H5OH+FeCl3→фиолетовое окрашивание
4. Окисление фенолов:
Фенол может легко окисляться на воздухе, особенно в
щелочной среде, превращаясь в хиноны.
Получение фенолов
1. Из бензолсульфоновой кислоты:
t, p
C6H5SO3Na+NaOH
C6H5OH+Na2SO3
2. Гидролиз хлорбензола:
C6H5Cl+NaOH t, p C6H5OH+NaCl
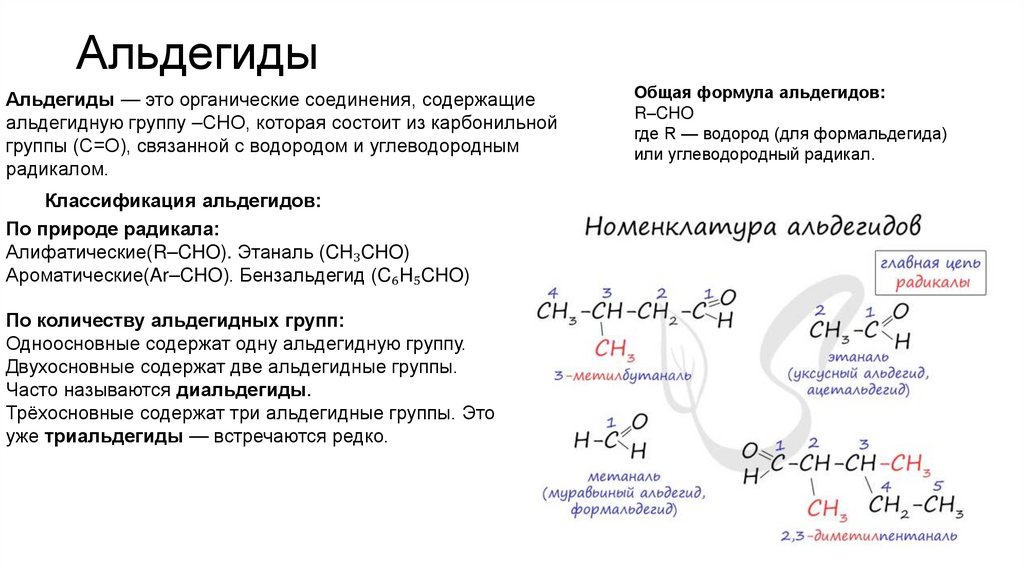
8. Альдегиды
Альдегиды — это органические соединения, содержащиеальдегидную группу –CHO, которая состоит из карбонильной
группы (C=O), связанной с водородом и углеводородным
радикалом.
Классификация альдегидов:
По природе радикала:
Алифатические(R–CHO). Этаналь (CH₃CHO)
Ароматические(Ar–CHO). Бензальдегид (C₆H₅CHO)
По количеству альдегидных групп:
Одноосновные содержат одну альдегидную группу.
Двухосновные содержат две альдегидные группы.
Часто называются диальдегиды.
Трёхосновные содержат три альдегидные группы. Это
уже триальдегиды — встречаются редко.
Общая формула альдегидов:
R–CHO
где R — водород (для формальдегида)
или углеводородный радикал.
9. Альдегиды
Способы получения альдегидов1. Окисление первичных спиртов:
RCH2OH [O] RCHO+H2O
2. Дегидрирование спиртов:
RCH2OH Cu,t° RCHO+H2↑
3. Гидратация ацетилена (в присутствии Hg²⁺):
HC≡CH+H2O HgSO4,H2SO4 CH3CHO
Альдегиды очень
реакционноспособны благодаря
полярной группе –CHO
Химические свойства альдегидов:
1. Реакции окисления:
Альдегиды окисляются до карбоновых кислот:
RCHO+[O]→RCOOH
2. Качественные реакция:
Реакция с аммиачным раствором оксида серебра
(реакция серебряного зеркала):
RCHO+[O]
RCOOH+Ag↓
Образуется серебряное зеркало на стенках пробирки.
3. Восстановление до спиртов:
RCHO+H2
RCH2OH
4. Реакции нуклеофильного присоединения
Альдегиды активно вступают в реакции с веществами,
содержащими нуклеофильные группы.
1) Присоединение воды:
RCHO+H2O⇌RCH(OH)2 (геминальный диол)
2) Присоединение спиртов (образование полуацеталей и
ацеталей):
RCHO+R′OH⇌RCH(OH)(OR′) (полуацеталь)
10. Карбоновые кислоты
Карбоновые кислоты — это органические соединения,содержащие карбоксильную группу –COOH. Она состоит из
карбонильной группы (C=O) и гидроксильной группы (–OH).
Классификация карбоновых кислот:
По числу карбоксильных групп:
Монокарбоновые содержат одну карбоксильную группу.
Дикарбоновые содержат две карбоксильной группы
Поликарбоновые содержат три и более карбоксильных
групп.
Общая формула:
R–COOH
где R — углеводородный радикал.
11. Карбоновые кислоты
Способы получения1. Окисление альдегидов:
R–CHO+[O]→R–COOH
2. Окисление первичных спиртов:
R–CH2OH [O] R–COOH
3. Гидролиз сложных эфиров:
+
−
R–COOR′+H2O H или OH R–COOH+R′OH
4. Гидролиз нитрилов:
+
R–CN+2H2O H , t R–COOH+NH3
Карбоновые кислоты проявляют
кислотные свойства, а также
участвуют в реакциях по
карбоксильной группе.
1. Кислотные свойства:
R–COOH+NaOH→R–COONa+H2O
2R–COOH+Ca(OH)2→(R–COO)2Ca+2H2O
Реакция с основаниями, солями слабых кислот, металлами
(как неорганические кислоты)
2. Образование солей:
Карбоновые кислоты образуют карбонаты с
щелочами или основными оксидами:
2CH3COOH+Na2CO3→2CH3COONa+CO2+H2O
3. Образование сложных эфиров (этерификация):
R–COOH+R′–OH H+ R–COOR′+H2O
Эта реакция обратима, протекает в кислой среде,
используется для получения ароматических эфиров.
4. Восстановление до спиртов:
R–COOH+4[H]→R–CH2OH+H2O
5. Декарбоксилирование (удаление CO₂):
t,катализатор
R–COOH
RH+CO2↑
12. Кетоны
Кетоны — это органические соединения, в которыхкарбонильная группа (C=O) связана с двумя
углеводородными радикалами. В отличие от
альдегидов, где один из заместителей — водород, у
кетонов оба — углеводородные. Карбонильная группа
— полярная, поэтому кетоны хорошо растворимы в
воде (низшие) и вступают в реакции с нуклеофилами
Общая формула кетонов:
R–CO–R′
Классификация кетонов:
Симметричные, если оба радикала одинаковы. CH₃–
CO–CH₃ (Ацетон)
Асимметричные, если радикалы различаются. CH₃–
CO–C₂H₅ (Метилэтилкетон)
Ароматические, если соединяет ароматические
соединения
А) Ацетон
По количеству карбонильных групп:
Монокетоны — одна группа.
Дикетоны — две группы.
где R и R′ — алкильные или
арильные группы (не водород)
Б) Ацетилацетон
13. Кетоны
Химические свойства кетоновКетоны — менее реакционноспособны, чем
Способы получения кетонов
альдегиды, но тоже участвуют в реакциях по
1. Окисление вторичных спиртов:
карбонильной группе.
R–CHOH–R′ [O]
R–CO–R′+H2O
1. Реакции нуклеофильного присоединения
2. Дегидрирование вторичных спиртов:
С водородом (восстановление) получаются вторичные
R–CHOH–R′ Cu, t° R–CO–R′+H2↑
спирты:
3. Гидратация алкинов (в присутствии Hg²⁺):
Ni, t°
2+
+
R–CO–R′+H
R–CHOH–R′
2
CH≡CH3+H2O Hg , H
CH3–CO–CH3
4. Фриделя-Крафтса ацилирование (ароматические С циановодородом (HCN) образуются циангидрины:
R–CO–R′+HCN→R–C(OH)(CN)–R′
кетоны):
AlCl3
2. Реакции с гидразином(образуется),
C6H6+RCOCl
C6H5–CO–R+HCl
гидроксиламином и др. (реакции конденсации):
4. Окисление кетонов:
R–CO–R′+H2N–NH2→R–C=N–NH2+H2O
Кетоны устойчивы к мягким окислителям (в отличие от 3. Альдольная конденсация (если есть α-водород):
−
альдегидов)
2CH3–CO–CH3 OH CH3–CO–CH2–CH(OH)–CH3 →
Могут окисляться жёсткими реагентами (например,
ненасыщенный кетон (при нагревании)
HNO₃), разрушаясь на более мелкие молекулы
(кислоты и CO₂)
Кетоны не дают реакцию серебряного зеркала и
реакцию с Cu(OH)₂ в щелочи.
14. Углеводы
Углеводы — это органические соединения, состоящие изуглерода (C), водорода (H) и кислорода (O), с общей
формулой: Cn(H2O)m. Углеводы — важнейшие источники
энергии и структурные элементы для живых организмов.
Классификация углеводов:
Моносахариды содержат альдегидную или кетонную
группу. Имеют несколько гидроксильных групп (–OH).
Дисахариды образуются при соединении двух
моносахаридов с отщеплением воды (гликозидная
связь).
Полисахариды — это высокомолекулярные
соединения, состоящие из сотен и тысяч моносахаридов
(крахмал, гликоген).
Сахариды:
1. Моносахариды — это простые сахара. Они
бывают:
Альдозы (с –CHO): глюкоза
Кетозы (с >C=O): фруктоза
Общая формула: CnH2nOn
2. Дисахариды состоят из двух остатков
моносахаридов, соединённых гликозидной связью.
Сахароза = Глюкоза + фруктоза
Лактоза = Глюкоза + галактоза
3. Полисахариды — это высокомолекулярные
соединения, состоящие из большого числа
моносахаридов.
15. Углеводы
Химические свойства моносахаридов:1. Окисление. Реакция серебряного зеркала
(глюкоза — восстановитель):
CH2OH–(CHOH)4–CHO+2[Ag(NH3)2]OH→CH2OH–
(CHOH)4–COONH4+2Ag↓+3NH3+H2O
серебро выпадает в осадок — кач. реакция на альдегидную группу
2. Восстановление → Полиолы (многоатомные
спирты):
CH2OH–(CHOH)4–CHO+H2 Ni, t° CH2OH–(CHOH)4–
CH2OH
глюкоза → сорбит
Химические свойства дисахаридов:
1. Гидролиз (разрыв гликозидной связи с H₂O):
+
C12H22O11+H2O H , t° или ферменты C6H12O6+C6H12O6
2. Окисление. Мальтоза и лактоза —
восстанавливающие дисахариды
C12H22O11+2[Ag(NH3)2]OH→кислота+2Ag↓+…
Гидролиз углеводов:
Полисахариды → дисахариды → моносахариды.
Крахмал гидролизуется до мальтозы, потом до
глюкозы
+
(C6H10O5)n+nH2O ферменты, H nC6H12O6
Химические свойства полисахаридов:
1. Гидролиз полисахаридов
(C6H10O5)n+nH2O H+, t° или ферменты nC6H12O6
Крахмал / гликоген / целлюлоза → мальтоза → глюкоза
2. Реакция с йодом (крахмал)
Крахмал+I2→синий комплекс
Цвет исчезает при нагревании и появляется при охлаждении
3. Окисление целлюлозы
С жёсткими окислителями (например, HNO₃, H₂SO₄)
целлюлоза разрушается до: CO₂, Водорастворимых кислот,
иногда → нитроцеллюлоза (при обработке HNO₃ + H₂SO₄)
16. Эфиры
Эфиры — это органические соединения, в которыхдва углеводородных радикала соединены через атом
кислорода.
Общая формула:
Простые: R–O–R′
Сложные: R–COO–R′
Химические свойства эфиров:
1. Гидролиз (разложение водой):
Происходит при действии кислот или щелочей (обычно при
нагревании)
Кислотный гидролиз:
R–O–R’ + H₂O H+, Δ R–OH + R’–OH
Сложный эфир — производные кислот.
Название спиртовой части (как радикал) + название
кислоты (с заменой -овая → -оат).
2. Горение:
Как и другие органические вещества, эфиры горят с
образованием CO₂ и H₂O:
C₂H₅–O–C₂H₅ + 6O₂ → 4CO₂ + 5H₂O













 chemistry
chemistry








