Similar presentations:
Кислородсодержащие органические соединения
1.
КИСЛОРОДСОДЕРЖАЩИЕОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ
2.
К кислородсодержащим органическим соединениямотносят многочисленные органические соединения,
как природного происхождения, так и синтетические,
являющиеся производными углеводородов, в
молекулах которых содержатся углеродные атомы,
непосредственно связанные с кислородом.
В органических кислородсодержащих веществах
кислород в соединении с углеродом образует
различные группы, в которых углерод затрачивает на
соединении с атомами кислорода одну, две или три
валентные связи:
O
C OH
гидроксильная
группа
C O
карбонильная
группа
–С
OH
карбоксильная
группа
3.
Остальные валентности углерода могут участвовать вобразовании связи либо с углеродными атомами,
либо с атомами водорода или других элементов.
Таким образом, приведённые кислородсодержащие
группы, можно представить как различные стадии
окисления углеродных атомов в органических
молекулах; эти группы связаны между собой так же,
как и соединения, в состав которых они входят,
взаимными окислительно-восстановительными
превращениями. Гидроксильная группа содержится в
спиртах, карбонильная – в альдегидах и кетонах,
карбоксильная – в карбоновых кислотах.
4. Спирты и их производные
Производные углеводородов, представляющие собойпродукты замещения атома водорода в
углеводородной молекуле водным остатком, т.е.
гидроксильной группой – OH, называют спиртами.
Эти вещества можно рассматривать и как
производные воды, в молекуле которой один атом
водорода замещён углеводородным радикалом R.
Это можно представить схемой:
R–H
углеводород
R–OH
спирт
Н–OH
вода
5.
Спирты могут содержать и несколько гидроксильныхгрупп но при разных атомах углерода. Число их
характеризует атомность спирта. В соответствии с
этим спирты бывают одноатомные и многоатомные;
последние подразделяются на двухатомные,
трёхатомные и т.д. спирты.
6. Строение. Изомерия.
Изомерия предельных одноатомных спиртов, общаяформула которых CnH2n+1OH, обусловлена изомерией
углеродного скелета и изомерией положения
гидроксильной группы.
Спирту состава C3H7OH соответствует два изомера по
положению гидроксильной группы:
CH 3 CH 2 CH 2 OH
пропиловый спирт
(первичный)
CH 3 CH CH3
OH
вторичный пропиловый
спирт (изопропиловый)
7.
Из бутана и изобутана могут быть произведены четыреизомерных бутиловых спирта.
В зависимости от положения гидроксильной группы при
первичном, вторичном и третичном углеродном
атоме спирты могут быть первичными, вторичными и
третичными:
R/
R CH 2 OH
первичный спирт
R CH OH
вторичный спирт
R/
R C
OH
R //
третичный спирт
8. Химические свойства
Химические свойства спиртов обусловлены наличиемгидроксильной группы. В разнообразных химических
превращениях спиртов особая роль принадлежит
двум типам реакций:
R
CH2 O H
(1) (2)
разрыву связи между атомами C и O (1), O и H(2).
Положение гидроксильной группы существенно влияет
на её поведение в этих превращениях.
9. Кислотные свойства спиртов.
Атомы водорода гидроксильных групп в спиртахпроявляют определённую подвижность. Подобно
воде, спирты реагируют со щелочными металлами,
которые замещают водород спиртовых
гидроксильных групп; при этом образуются
алкоголяты и выделяется водород:
2R
OH + 2Na
2R ONa + H2
алкоголят
натрия
2CH 3 CH2 OH + 2Na
этиловый
спирт
2CH 3 CH2
этилат
натрия
ONa + H2
10.
По мере увеличения числа углеродных атомов вуглеводородных радикалах спиртов активность
последних в этой реакции всё более уменьшается.
Высшие спирты реагируют с натрием лишь при
нагревании. Первичные спирты значительно активнее
в реакциях со щелочными металлами, чем
изомерные им вторичные и особенно третичные.
В реакции со щелочными металлами спирты проявляют
свойства кислот; но в результате влияния,
оказываемого на гидроксильную группу алкильным
радикалом, спирты – ещё более слабые кислоты, чем
вода. Практически спирты – нейтральные вещества:
они не показывают ни кислой, ни щелочной реакции
на лакмус, не проводят электрический ток.
11. Окисление спиртов.
Кислород воздуха окисляет спирты только при высокойтемпературе; при этом они горят. В результате
происходит полное разрушение молекул с
образованием оксида углерода(IV) и воды.Возможно
и умеренное окисление спиртов: при этом они
окисляются легче, чем соответствующие предельные
углеводороды. Углеводороды на холоду не
взаимодействуют с раствором перманганата калия
или хромовой смесью, спирты же окисляются
ими.Внешне реакция проявляется в том, что в случае
перманганата калия (KMnO4) исчезает его
фиолетовая окраска, а в случае хромовой смеси
(K2Cr2O7+H2SO4) её оранжевый цвет переходит в
зеленый.
12.
Большая склонность спиртов к окислению посравнению с углеводородами объясняется влиянием
имеющейся в их молекулах гидроксильной группы.
Молекулы спиртов содержат углеродные атомы, как
бы уже подвергшиеся окислению, т.е. связанные с
кислородом гидроксида, и поэтому действие
окислителя прежде всего направляется на спиртовую
группу. При этом окислению легче подвергаются
спирты, в которых при углероде спиртовой группы
имеется водород, - первичные и вторичные.
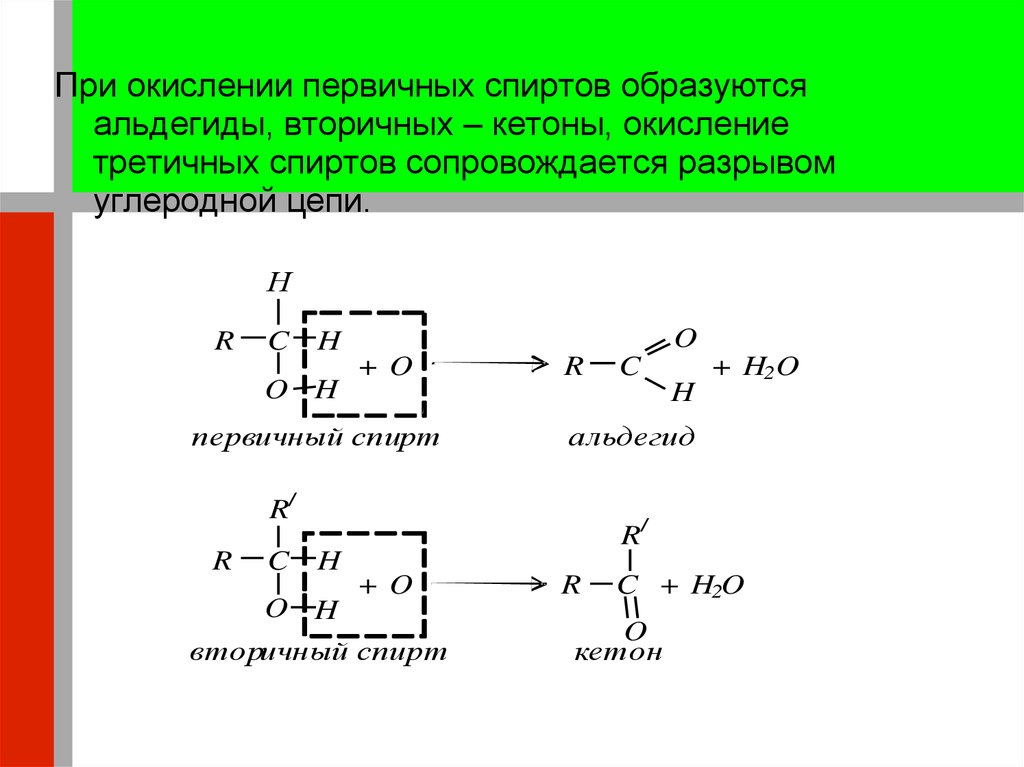
13.
При окислении первичных спиртов образуютсяальдегиды, вторичных – кетоны, окисление
третичных спиртов сопровождается разрывом
углеродной цепи.
Н
R
C
O
H
O H
+O
R
H
первичный спирт
C
+ H2 O
альдегид
R/
R
C
R/
H
+O
O H
вторичный спирт
R
C + H2O
O
кетон
14. Дегидратация спиртов.
Дегидратация (отнятие воды от молекулы спирта)приводит к образованию этиленовых углеводородов
или простых эфиров. При избытке спирта
дегидратация протекает межмолекулярно, что
приводит к образованию простого эфира:
130 o
CH3 CH2 OH + HO CH2 CH3 H SO C2H5 – О – С2Н5 + Н2О
2 4
15.
Внутримолекулярная дегидратация, т.е. за счёт одноймолекулы спирта, приводит к образованию
этиленового углеводорода:
o
CH 2 H
160
CH2 OH
H SO
2 4
CH2
CH2
+ H2O
16. Образование сложных эфиров.
Взаимодействие спиртов с кислотами (органическими инеорганическими) приводит к образованию
производных кислот, называемых сложными
эфирами:
O
CH3 CH 2 OH + CH3
этиловый
спирт
C
OH
уксусная
кислота
O
-Н2 О
CH3
C
O C2 H5
этиловый эфир
уксусной кислоты
Эта реакция называется реакцией этерификации.
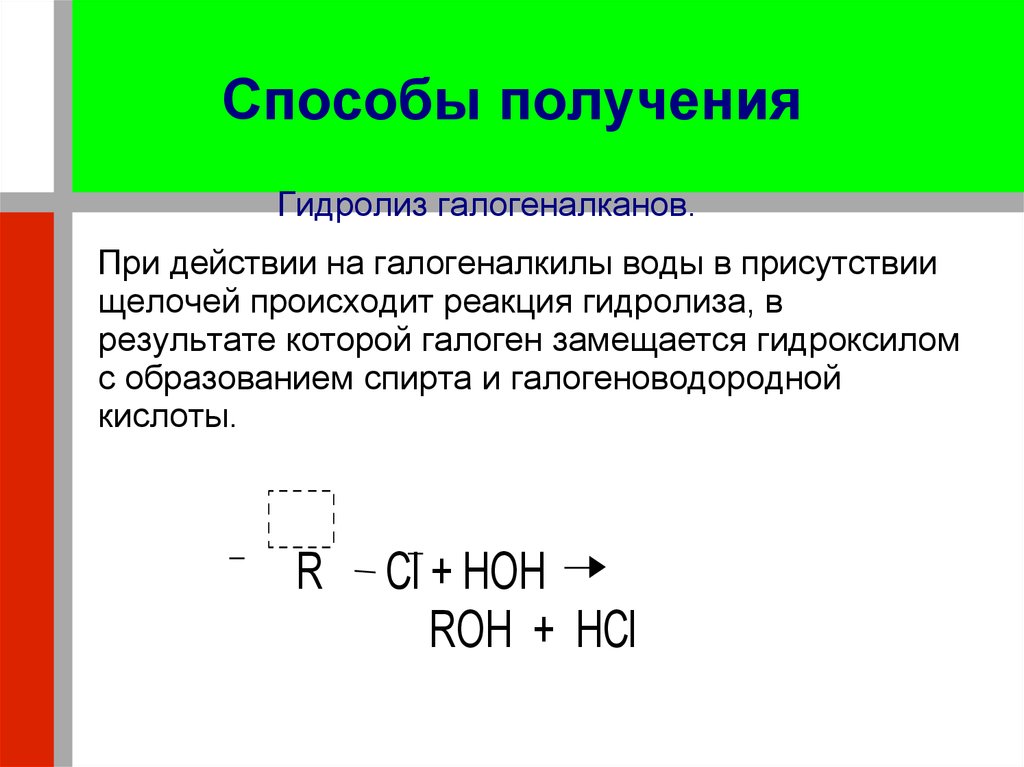
17. Способы получения
Гидролиз галогеналканов.При действии на галогеналкилы воды в присутствии
щелочей происходит реакция гидролиза, в
результате которой галоген замещается гидроксилом
с образованием спирта и галогеноводородной
кислоты.
R
Cl + HOH
ROH + HCl
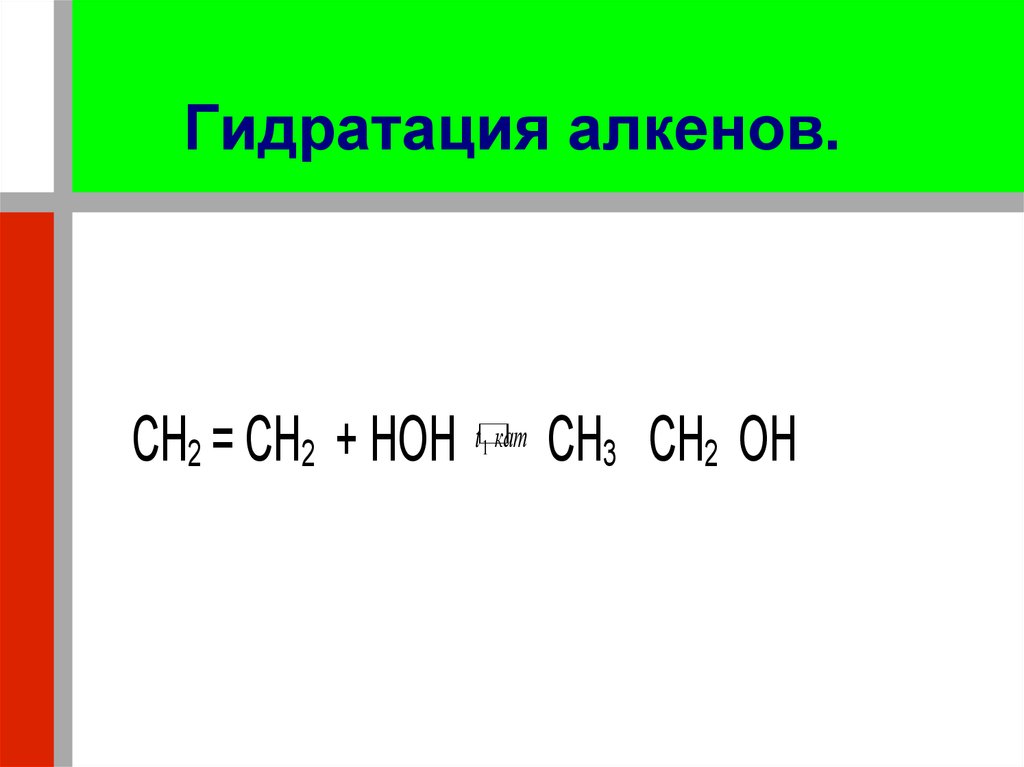
18. Гидратация алкенов.
CH2 = CH2 + HOH t кат CH3 CH2 OH1
19.
С гомологоми этилена реакция протекает по правилуМарковникова.
Например:
CH 2 = CH CH3 + HOH CH3 CH CH3
OH
пропен
2 - пропанол
20. Восстановление альдегидов и кетонов.
При действии водорода в момент выделения (H) накарбонильные соединения альдегиды
восстанавливаются в первичные спирты, а кетоны –
во вторичные:
R׀
R׀
R
CH 2 [ H ] R
CH2
O
OH
R
C 2 [H ] R
CH
O
OH
альдегид
кетон
первичный спирт
вторичный спирт
21. Специфические способы получения спиртов.
Некоторые спирты получают характерными только дляних способами. Так, метанол в промышленности
получают при взаимодействии водорода с оксидом
углерода (II) при повышенном давлении и высокой
температуре на поверхности катализатора:
CO + H2
t 1 P 1 ZnO
синтез газ - метанол
CH3
OH
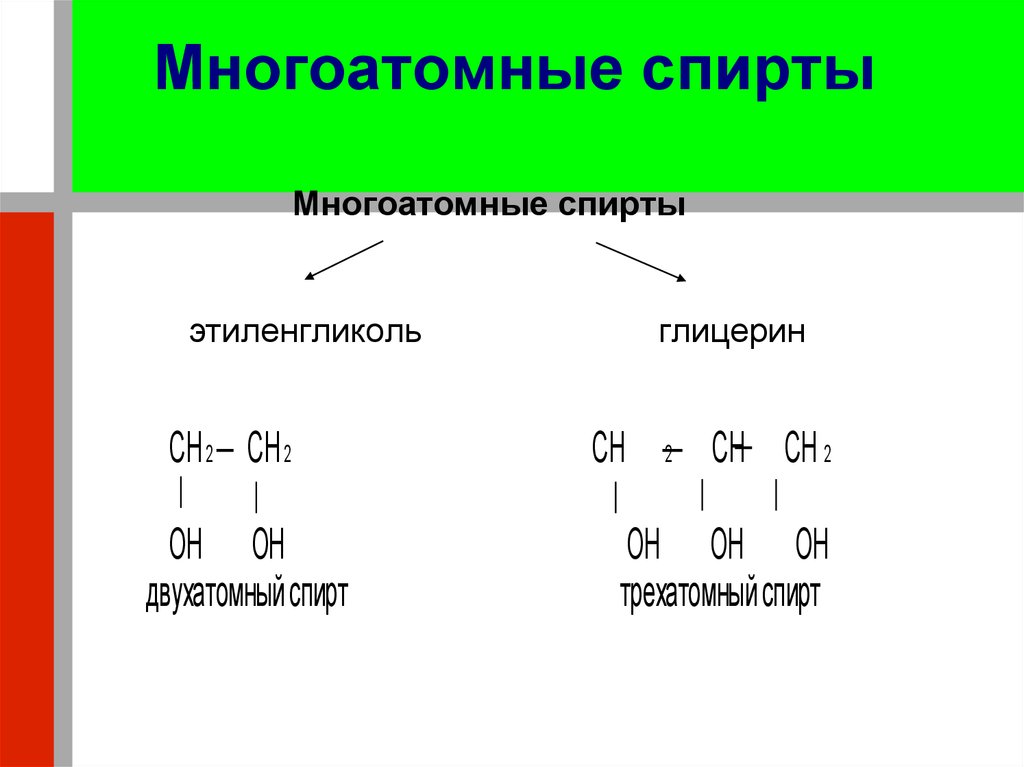
22. Многоатомные спирты
Многоатомные спиртыэтиленгликоль
CH 2 CH 2
OH OH
двухатомный спирт
глицерин
CH
2
CH CH 2
OH OH OH
трехатомный спирт
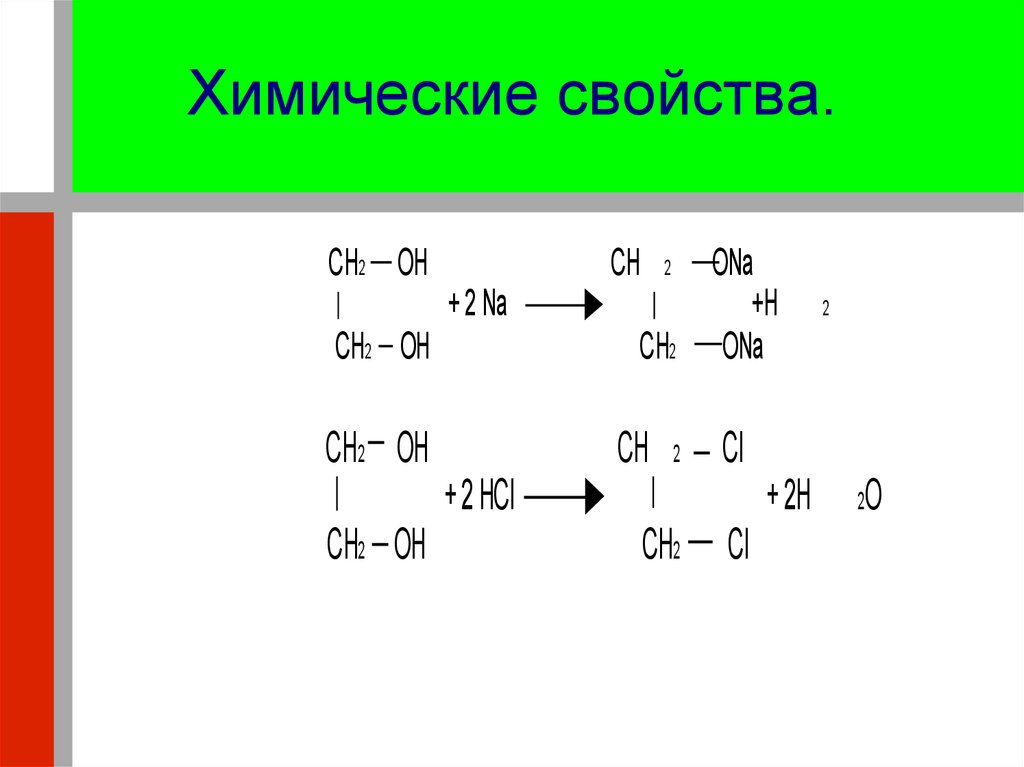
23. Химические свойства.
CH2 OHCH
2
+ 2 Na
CH2 OH
CH2
CH2 OH
CH
2
ONa
+H
ONa
Cl
+ 2 HCl
CH2 OH
+ 2H
CH2
2
Cl
2
O
24.
3. Реагируют с кислотами, образуя сложные эфиры:CH2 OH
CH
+ 2 HNO
CH2 OH
3
O NO 2
H 2 SO4
+ 2H 2 O
CH2 O NO2
2
4. Реагируют с гидроксидом меди (II) – качественная
реакция на многоатомные спирты (ярко-синее
окрашивание раствора)
H 2C OH
HO H 2 C
HC OH + HO Cu OH + HO
H2 C OH
HC
HO H2 C
H2 C O
Cu
HC O
HO H 2C
H
H
O CH 2
O
CH
+2H2 O
CH 2OH



















 chemistry
chemistry








