Similar presentations:
Азотсодержащие органические соединения
1. Азотсодержащие органические соединения
АЗОТСОДЕРЖАЩИЕОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ
2. классификация
• КЛАССИФИКАЦИЯв эту группу соединений объединяют несколько классов:
•Амины
•Амиды
•Имиды
•Азосоединения
•Диазосоединения.
•Аминокислоты
•Нитросоединения
•Нитрозосоединения
3. амины
АМИНЫАмины могут быть рассмотрены как производные
аммиака.
H
.. N
H
H
Аминами называют органические соединения,
которые получают замещением атомов водорода в
аммиаке углеводородными радикалами.
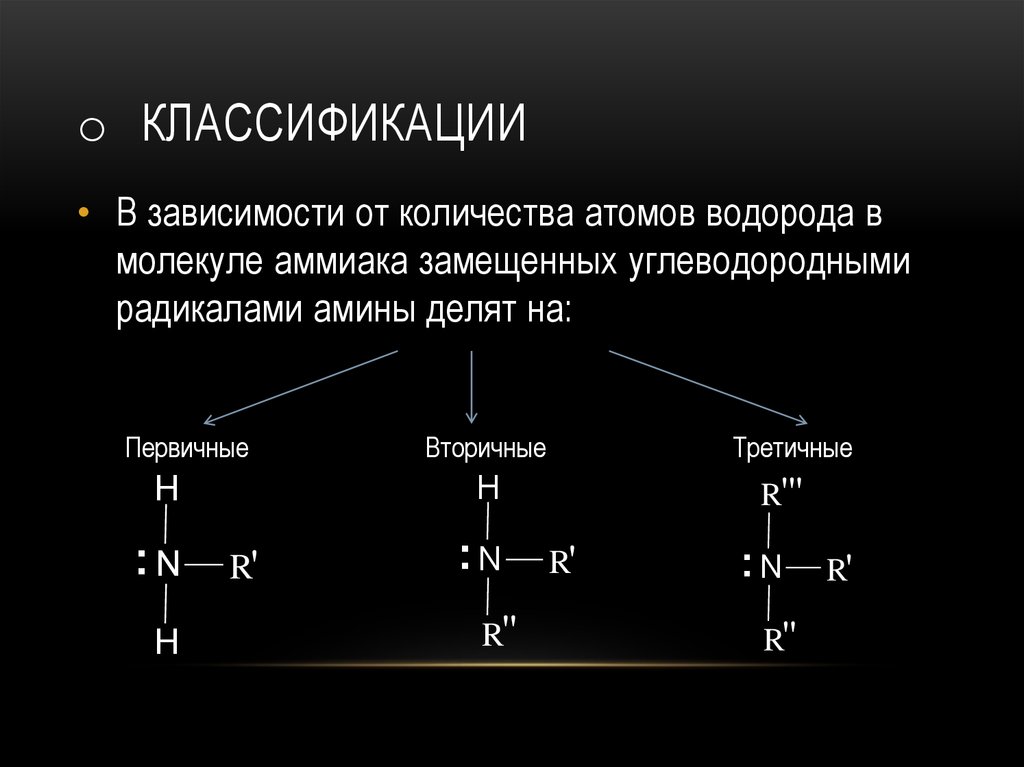
4. Классификации
o КЛАССИФИКАЦИИ• В зависимости от количества атомов водорода в
молекуле аммиака замещенных углеводородными
радикалами амины делят на:
Первичные
H
Третичные
H
H
.. N
Вторичные
R'
.. N
R"
R'"
R'
.. N
R"
R'
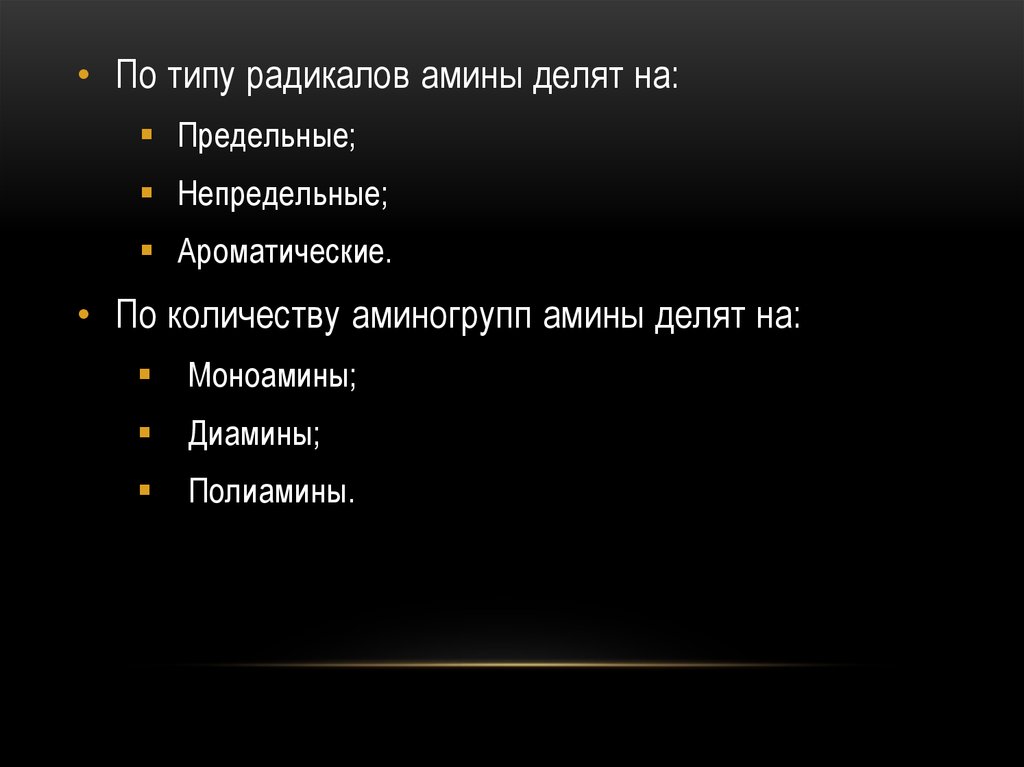
5.
• По типу радикалов амины делят на:Предельные;
Непредельные;
Ароматические.
• По количеству аминогрупп амины делят на:
Моноамины;
Диамины;
Полиамины.
6. номенклатура
o НОМЕНКЛАТУРА• Универсальная.
Название амина строят из двух слов: названия
углеводородных радикалов по радикальной номенклатуре и
слова «амин».
• Рациональная.
Употребляется для построения названий только первичных
аминов. В основе лежит название углеводорода и приставка
«амино-» перед которой цифрой указывают положение
аминогруппы. Иногда вместо приставки используют
суффикс «амин».
7.
Первичные аминыH3C
H3C
H3C
Метиламин
Аминометан
Металомин
NH2
CH2
CH2
H3C
Этиламин
Аминоэтан
NH2
CH2
CH
Пропиламин
1-аминопропан
NH2
Изопропиламин
2-аминопропан
Пропиламин-2
Втор.пропиламин
CH3
NH2
H3C
CH2
CH2
CH2
NH2
Бутиламин
1-аминобутан
8.
H3CCH
CH2
CH3
CH2
NH2
NH2
H3C
CH
CH3
CH3
H3C
C
Втор.бутиламин
2-аминобутан
Изобутиламин
2-метил-1-аминопропан
аминоизобутан
Трет.бутиламин
2-метил-2-аминопропан
2-метилпропиламин-2
NH2
CH3
Вторичные амины
H3C
H3C
NH
NH
Диметиламин
CH3
CH2
CH3
Метилэтиламин
9.
Третичные аминыH3C
H3C
H3C
CH3
N
Триметиламин
CH3
N
CH2
CH2
CH3
Диметилэтиламин
CH3
N
CH2
CH3
CH3
Метилдиэтиламин
10. изомерия
o ИЗОМЕРИЯ• Положения аминогрупп
• Структурная (углеродного скелета)
• Метамерия
H3C
CH2
CH2
NH2
H3C
CH2
NH
CH3
H3C
N
CH3
CH3
11. Физические свойства
o ФИЗИЧЕСКИЕ СВОЙСТВАМетиламин, диметиламин, триметиламин представляют
собой газы. Остальные низшие амины – жидкости. Высшие
амины – твердые вещества.
Амины обладают неприятным запахом «селедочного
рассола», который у низших выражен ярче, а у высших –
слабее (или отсутствует).
Низшие амины (первые представители) довольно
хорошо растворимы в воде (подобно аммиаку), их растворы
имеют основную реакцию среды.
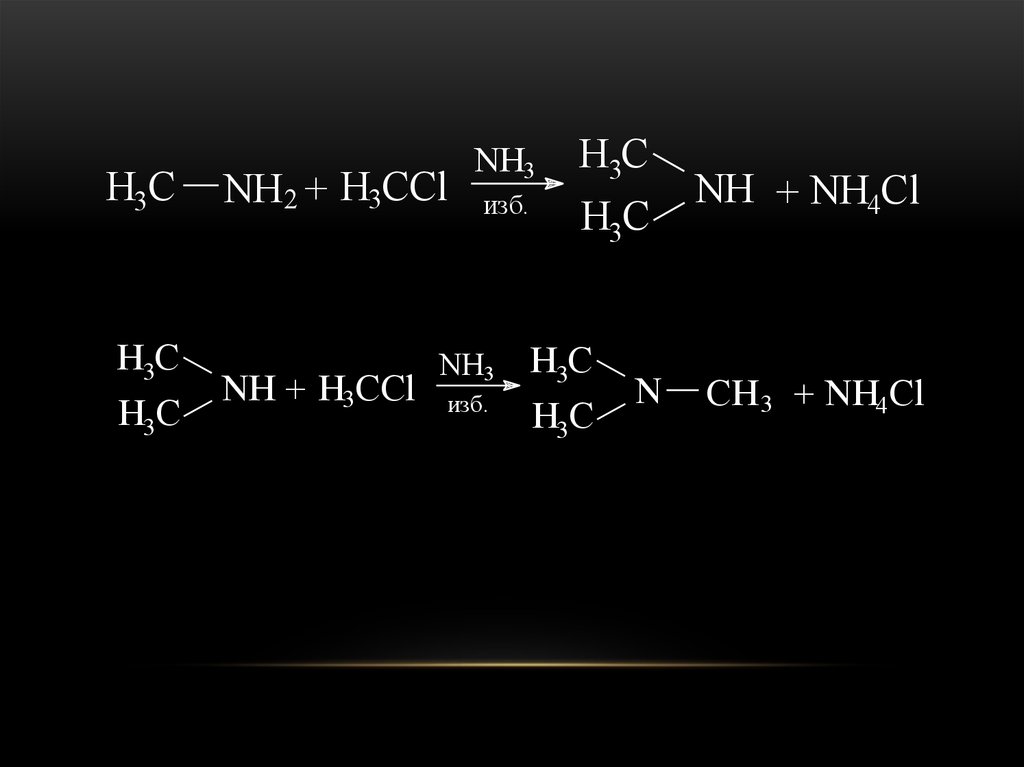
12. Способы получения
o СПОСОБЫ ПОЛУЧЕНИЯ• В 1850 году немецкий ученый Гофман впервые получил
амин в результате химической реакции взаимодействия
галогенпроизводного углеводорода с избытком аммиака
H3CCl + 2 NH3
H3C
NH2 + NH4Cl
Избыток аммиака нужен для получения чистого амина. При недостатке
аммиака всегда образуется смесь.
13.
H3CH3C
H3C
NH2 + H3CCl
NH + H3CCl
NH3
изб.
NH3
изб.
H3C
H3C
H3C
H3C
N
NH + NH4Cl
CH 3 + NH4Cl
14.
• Наиболее биологически активными являются первичныеамины. Их получили разложением амидов кислот
(перегруппировка Гофмана).
H3C
CH2 C
Амид пропионовой
кислоты
O
+ NaOBr
NH2
H3C CH2 NH2 + CO2 + NaBr
NaOH + Br 2
Этот способ широко используется в лабораторной практике.
15.
• В промышленности первичные амины получаютвосстановлением нитросоединений и нитрилов кислот.
H3C
CH2 NO2 + 3 H2
нитроэтан
H3C
CH2 C
H3C CH2 NH2 + 2 H2O
этиламин
N + 2 H2
Нитрил пропионовой кислоты
H3C
CH2 CH2 NH2
пропиламин
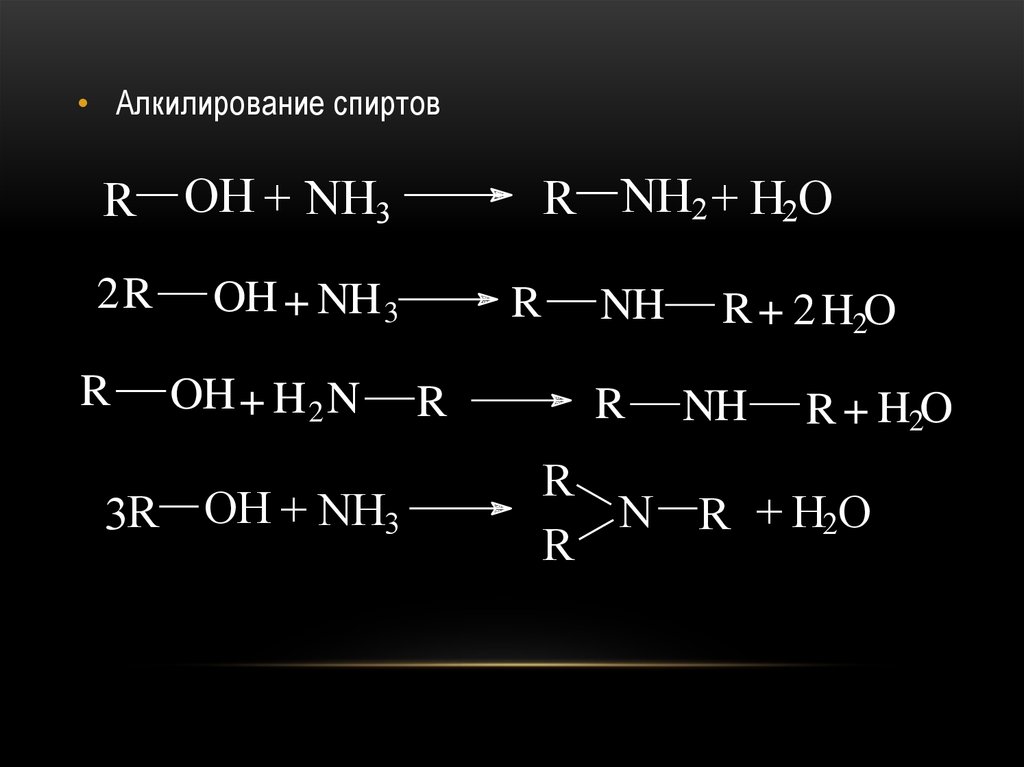
16.
• Алкилирование спиртовR OH + NH3
2R
R
R NH2 + H2O
OH + NH 3
OH + H 2 N
3R OH + NH3
R
R
NH
R
R + 2 H2O
NH
R + H2O
R
N R + H2O
R
17.
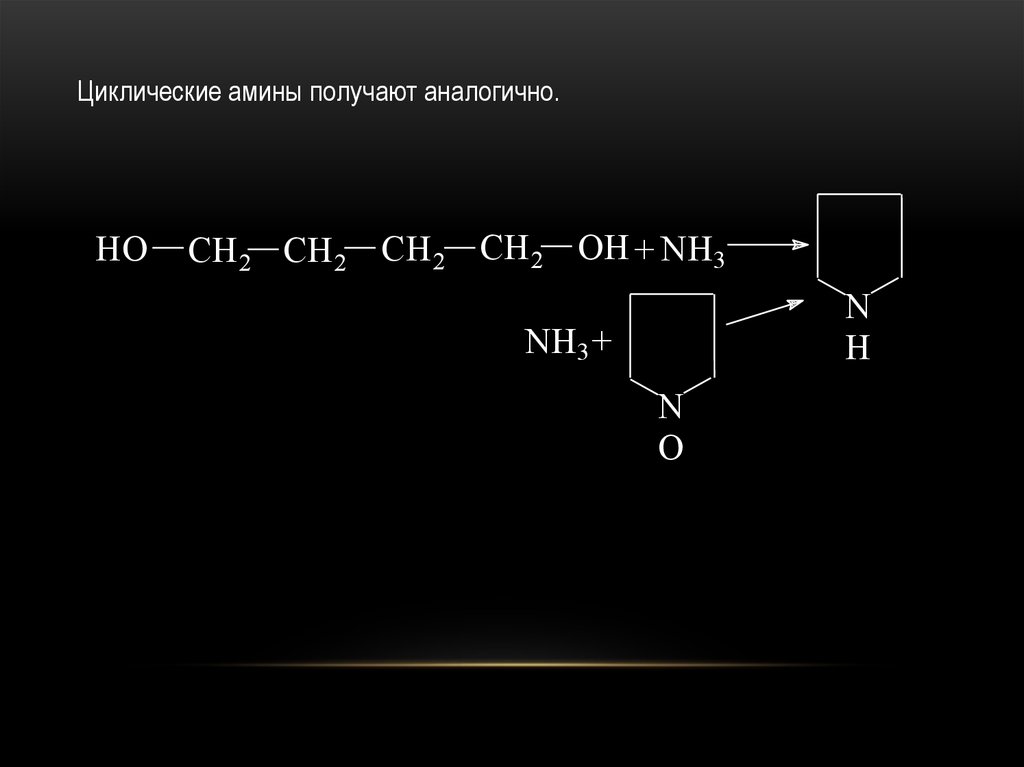
Циклические амины получают аналогично.HO
CH 2 CH 2 CH 2 CH 2 OH + NH3
N
H
NH3 +
N
O
18.
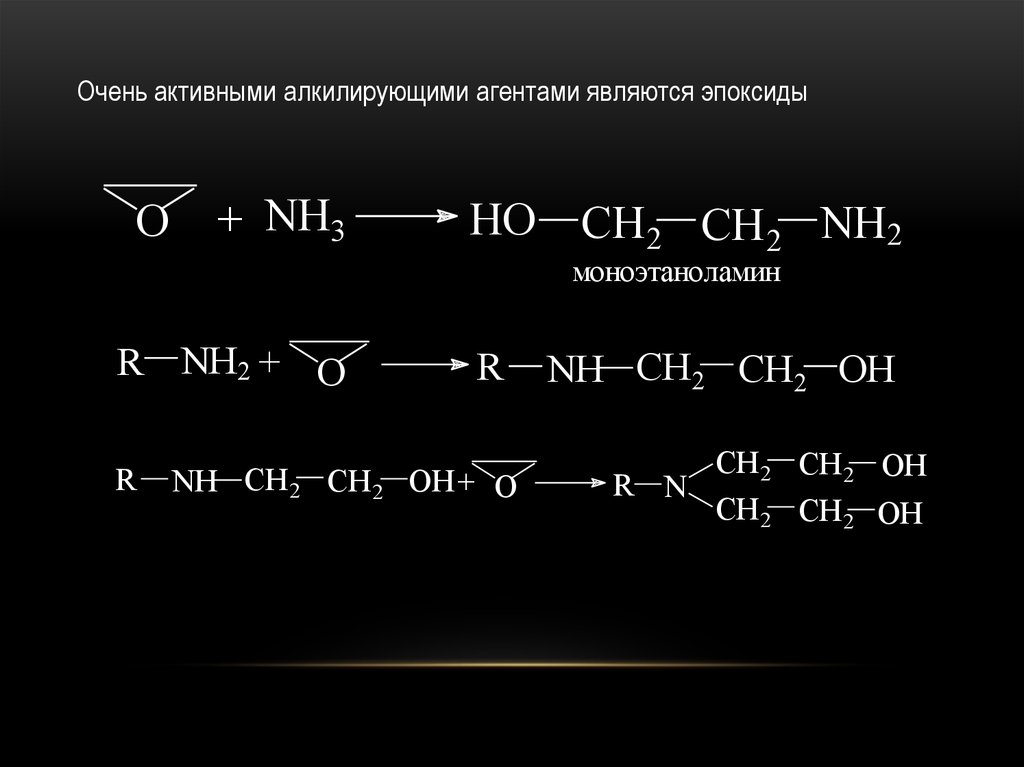
Очень активными алкилирующими агентами являются эпоксидыO
+ NH3
HO CH2 CH2 NH2
моноэтаноламин
R NH2 + O
R
R
NH CH2 CH2 OH + O
NH CH2 CH2 OH
CH2 CH2 OH
R N
CH2 CH2 OH
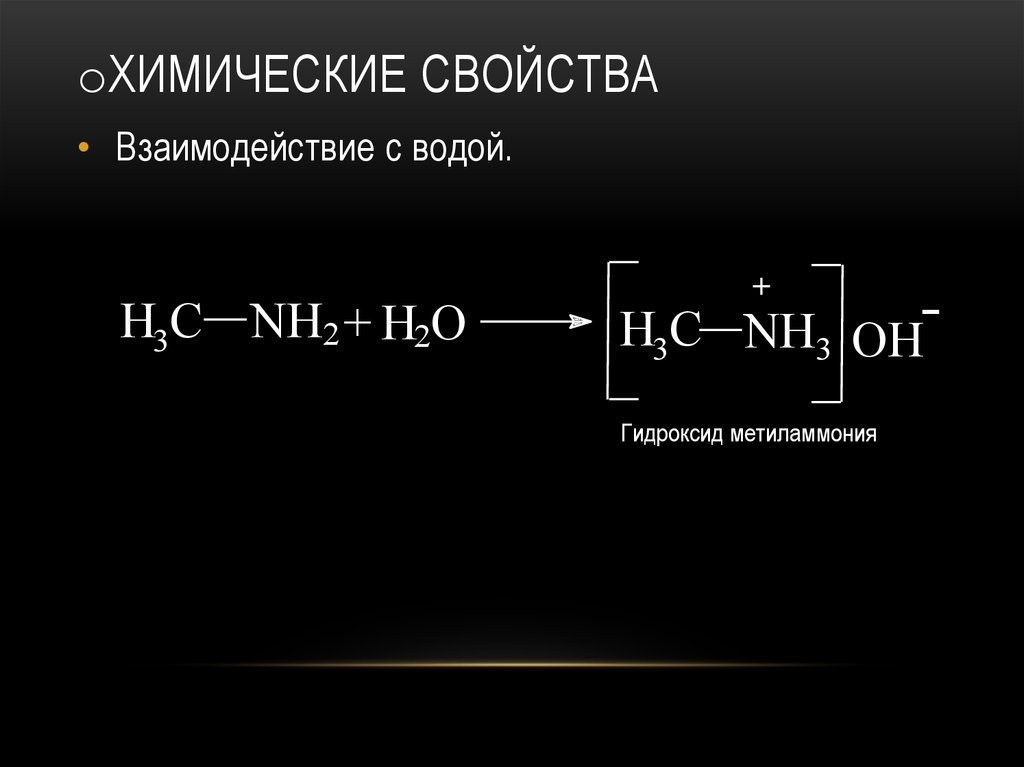
19. Химические свойства
oХИМИЧЕСКИЕ СВОЙСТВА• Взаимодействие с водой.
H3C NH2 + H2O
+
H3C NH3 OHГидроксид метиламмония
20.
• Взаимодействие с кислотами.• С соляной
H3C NH2 + HCl
+
H3C NH3 Cl Хлорид метиламмония
21.
• С серной (разбавленной)H3C NH2 + H2SO4
H3C
+
2
NH3 2SO4
сульфат метиламмония
-
22.
• Взаимодействие с азотистой кислотой• При взаимодействии первичных аминов с азотистой кислотой
образуются первичные спирты.
H3C
NH2 + HO N
O
H3C
OH + N2+ H2O
23.
• Вторичные амины при взаимодействии с азотистой кислотой образуютнитрозамины (окрашенные соединения желто-оранжевого цвета).
H3C
NH + HO N
H3C
O
H3C
H3C
N
N
O + H2O
диметилнитрозоамин
24.
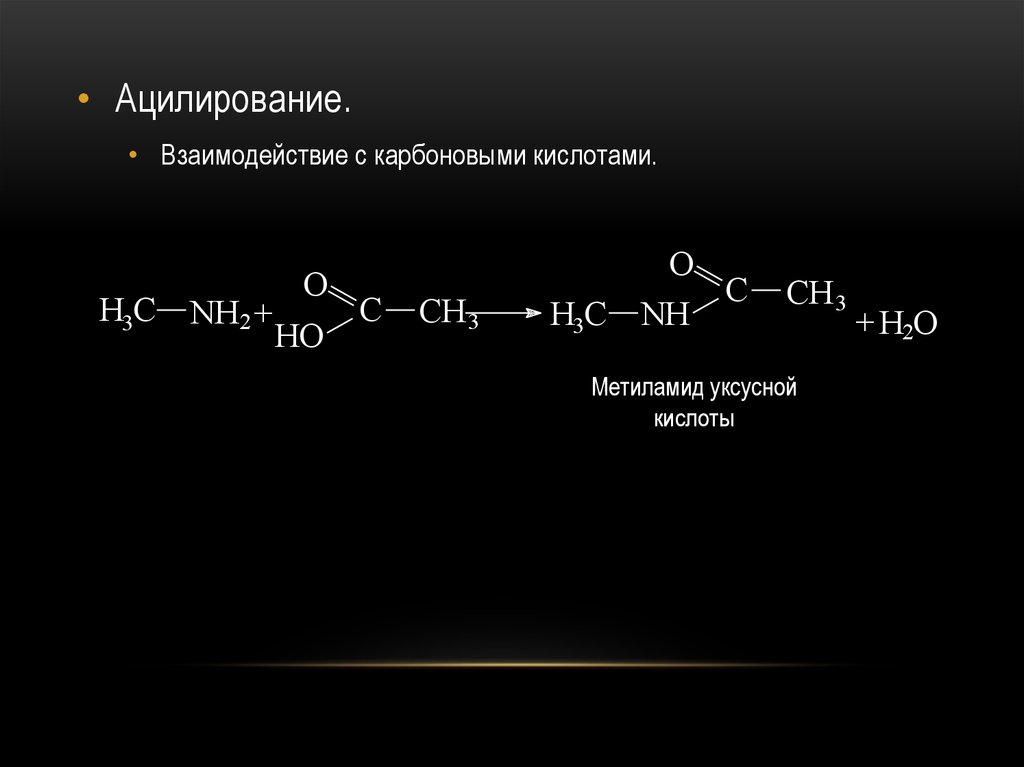
• Ацилирование.• Взаимодействие с карбоновыми кислотами.
O
H3C NH2 +
C
HO
CH 3
O
C
H3C NH
CH 3
Метиламид уксусной
кислоты
+ H2O
25.
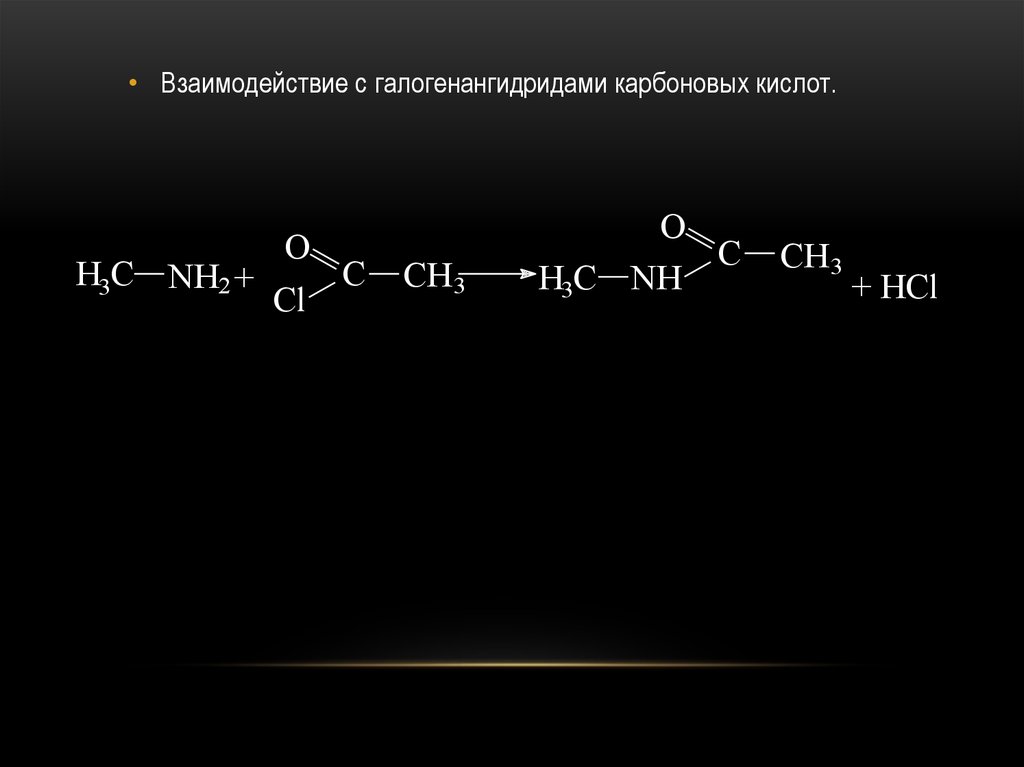
• Взаимодействие с галогенангидридами карбоновых кислот.O
H3C NH2 +
C
Cl
CH 3
O
C
H3C NH
CH 3
+ HCl
26.
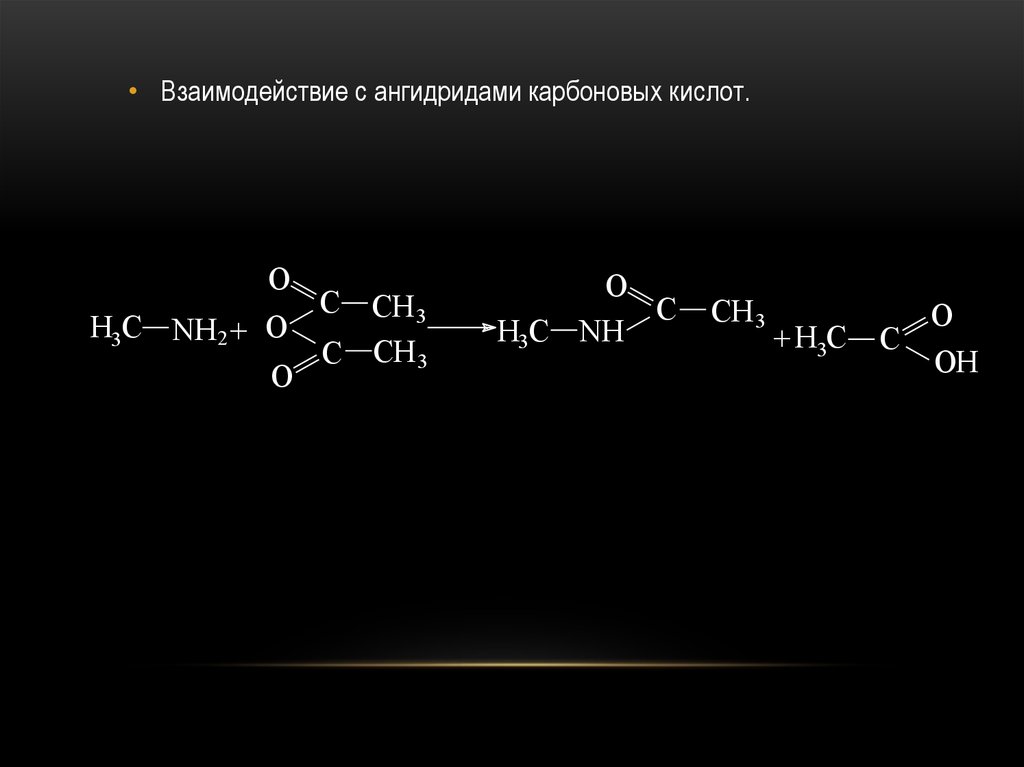
• Взаимодействие с ангидридами карбоновых кислот.O
H3C NH2 + O
O
C
CH 3
C CH 3
O
C
H3C NH
CH 3
+ H3C
O
C
OH
27.
• Горение.4 H3C NH2 + 9O2
4 CO2+10 H2O + 2 N2
28.
• Окисление.протекает трудно, а результат зависит от структуры.
• Окисление первичных аминов приводит к образованию
нитросоединений.
H3C NH2
[O]
H3C NO2
29.
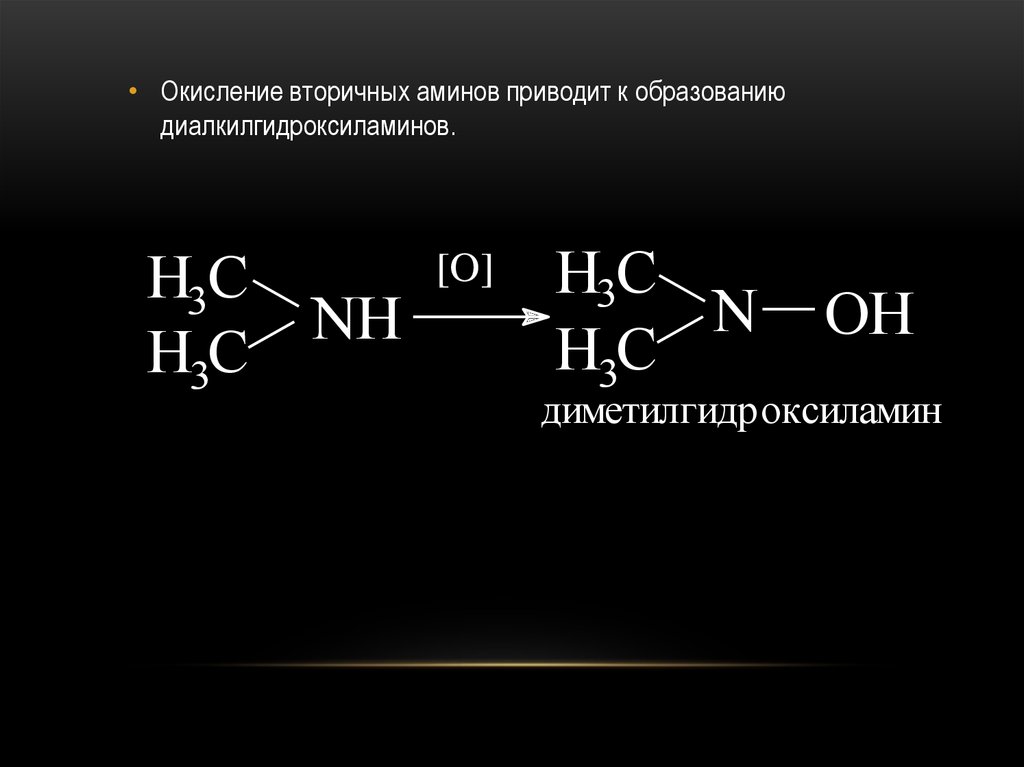
• Окисление вторичных аминов приводит к образованиюдиалкилгидроксиламинов.
H3C
H3C
NH
[O]
H3C
N
H3C
OH
диметилгидроксиламин
30.
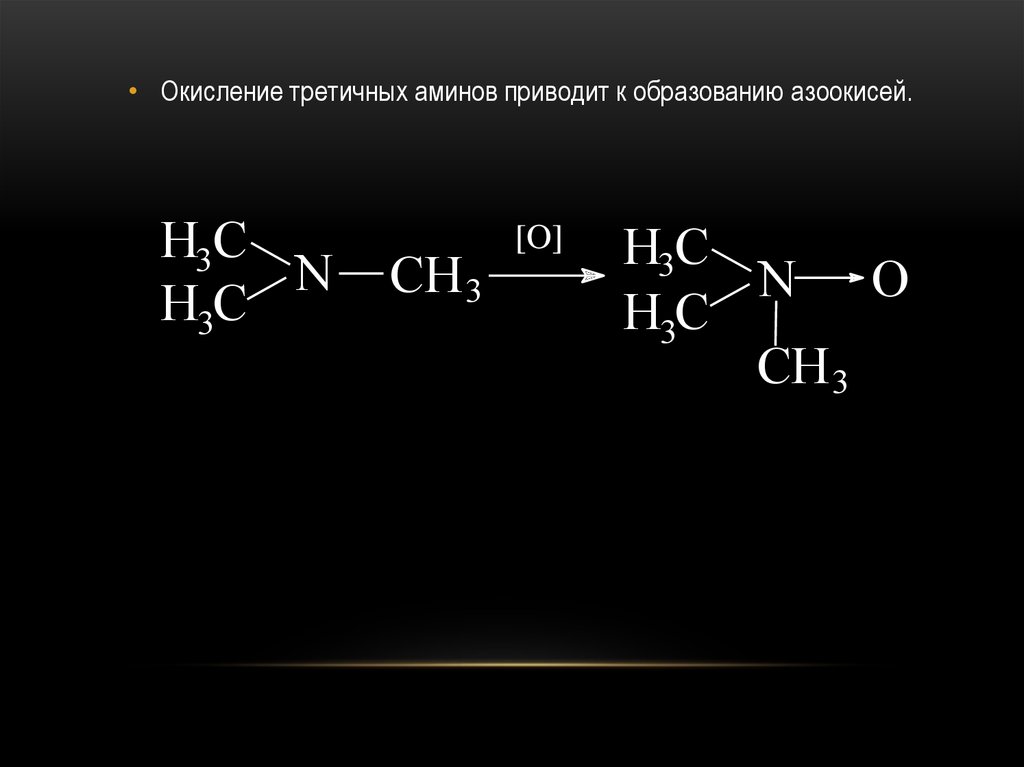
• Окисление третичных аминов приводит к образованию азоокисей.H3C
N
H3C
CH 3
[O]
H3C
N O
H3C
CH 3
31. Ароматические амины
АРОМАТИЧЕСКИЕ АМИНЫ32.
Это соединения, в молекулах которых аминогруппа связана сбензольным кольцом.
Простейшим представителем и родоначальником анилиновых
красителей является
NH2
анилин
фениламин
аминобензол
бензоламин
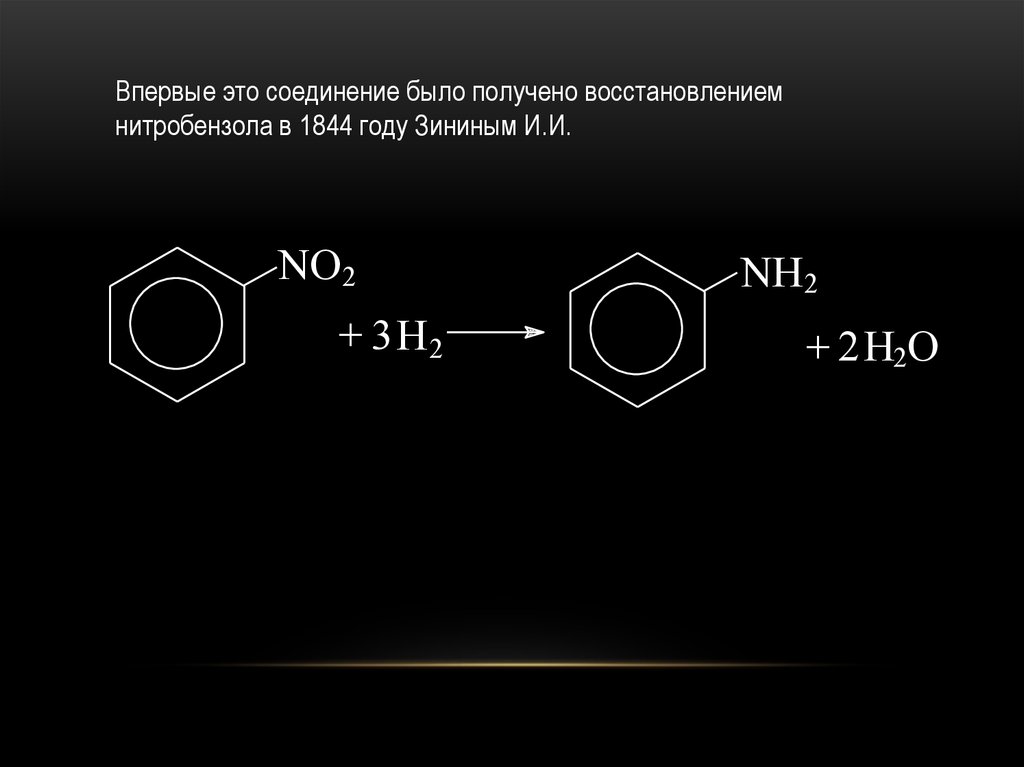
33.
Впервые это соединение было получено восстановлениемнитробензола в 1844 году Зининым И.И.
NO2
+ 3 H2
NH2
+ 2H2O
34. Физические свойства
oФИЗИЧЕСКИЕ СВОЙСТВААнилин – бесцветная, быстро
буреющая на воздухе, жидкость.
Плохо растворяется в воде.
35. Химические свойства
oХИМИЧЕСКИЕ СВОЙСТВАобусловлены как аминогруппой, так и
бензольным кольцом. Аминогруппа –
заместитель электроннодонорный и свойства
анилина обусловленные бензольным
кольцом следующие:
36.
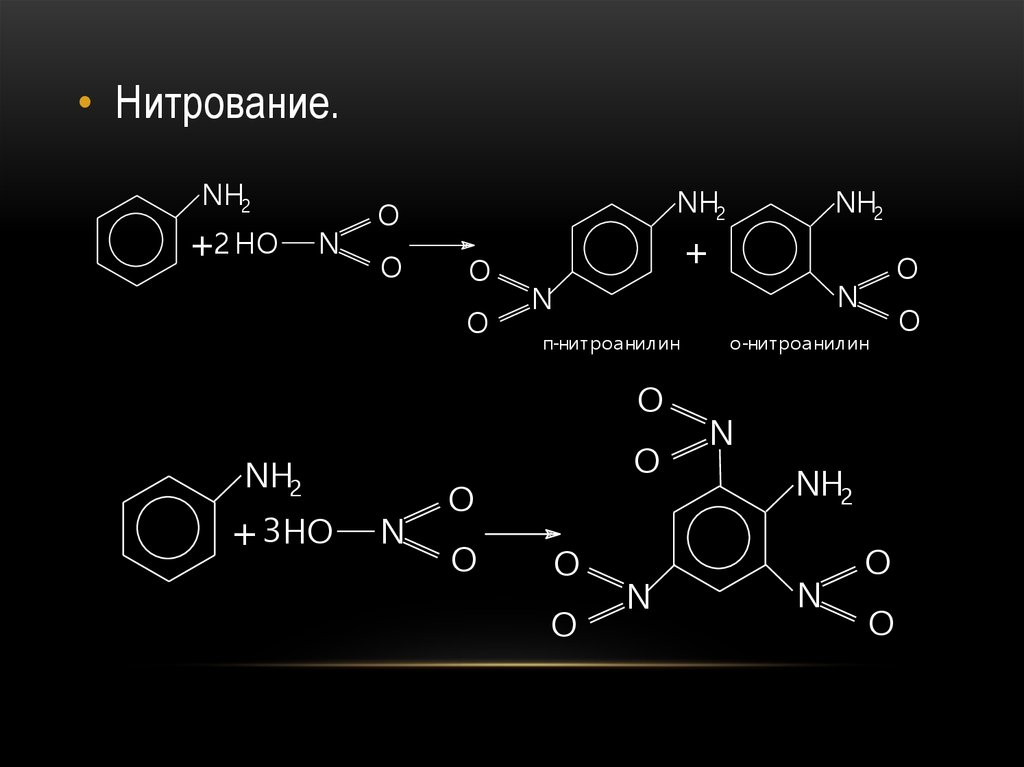
• Нитрование.NH2
+2 HO
N
NH2
O
O
O
O
+
+ 3HO
N
п-нитроанилин
O
O
O
O
N
N
O
NH2
NH2
O
O
N
о-нитроанилин
N
NH2
N
O
O
O
37.
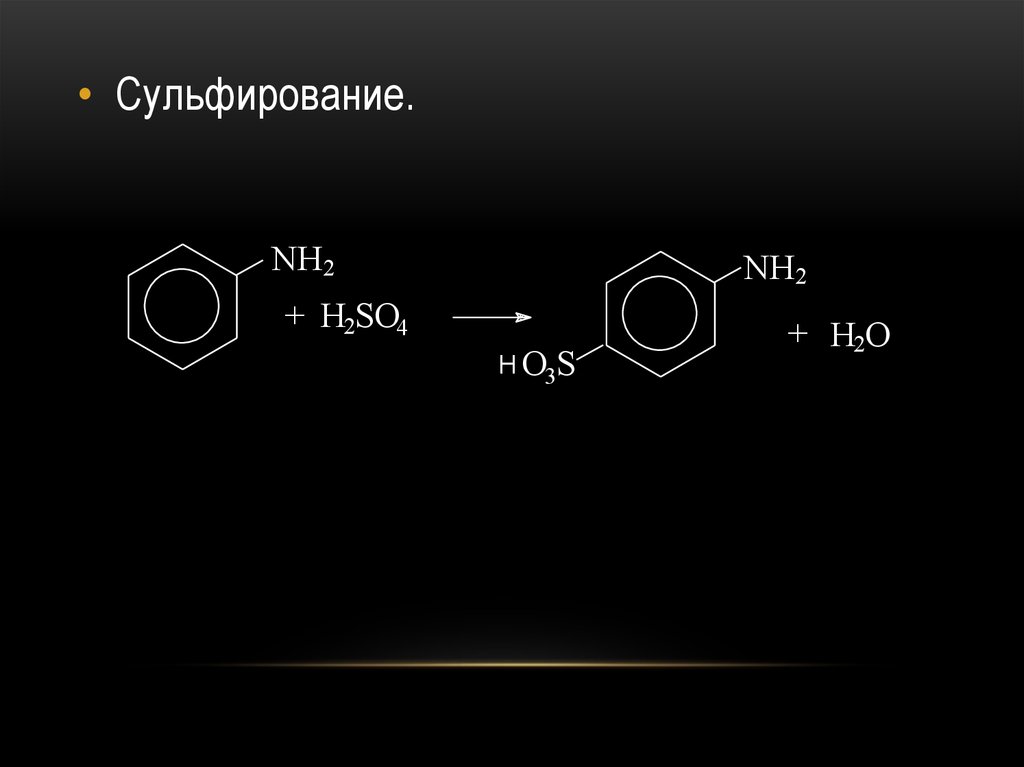
• Сульфирование.NH2
NH2
+ H2SO4
H O3S
+ H2O
38.
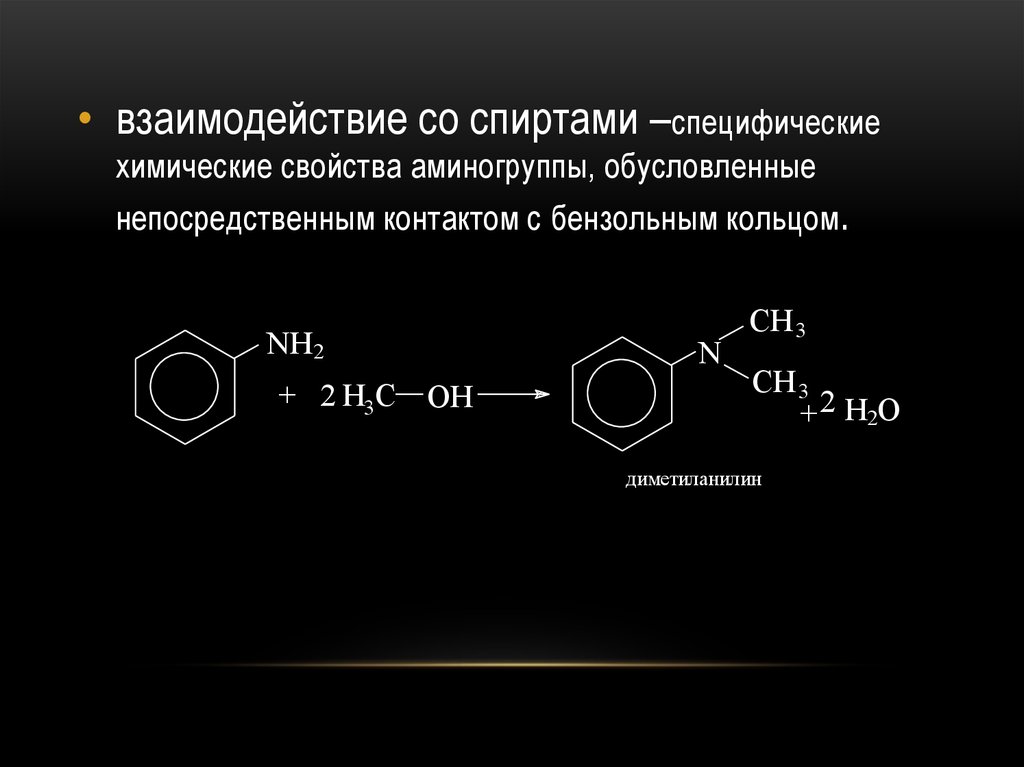
• взаимодействие со спиртами –специфическиехимические свойства аминогруппы, обусловленные
непосредственным контактом с бензольным кольцом.
NH2
+ 2 H3C OH
N
CH 3
CH 3
+ 2 H2O
диметиланилин
39. амиды
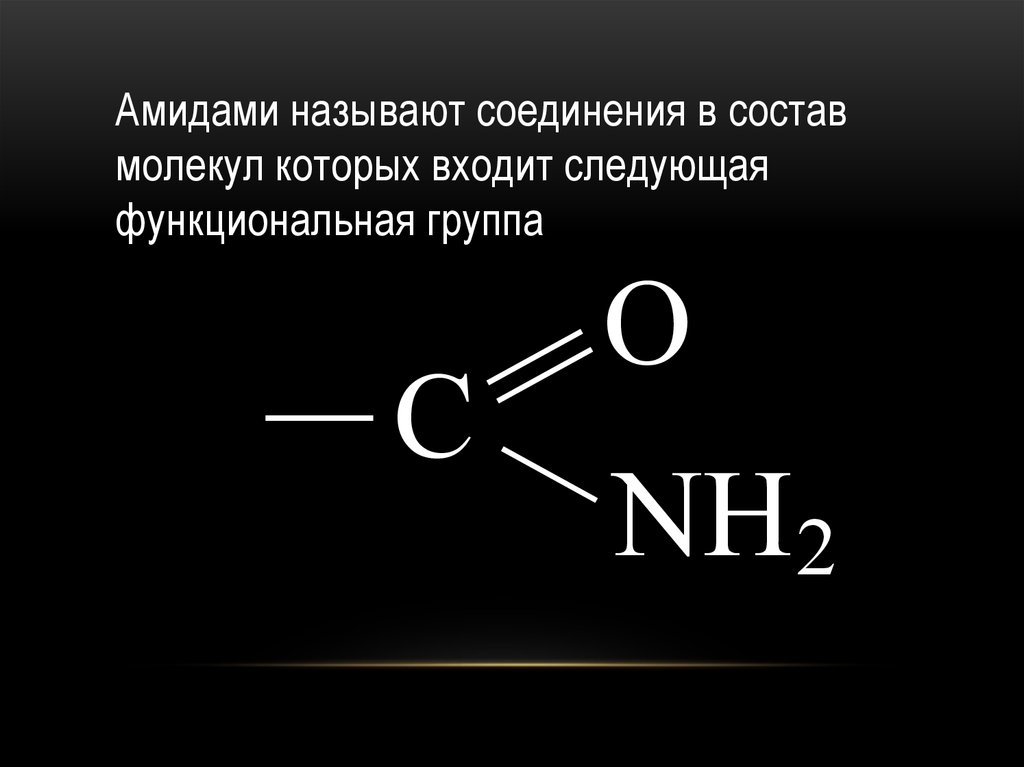
АМИДЫ40.
Амидами называют соединения в составмолекул которых входит следующая
функциональная группа
C
O
NH2
41.
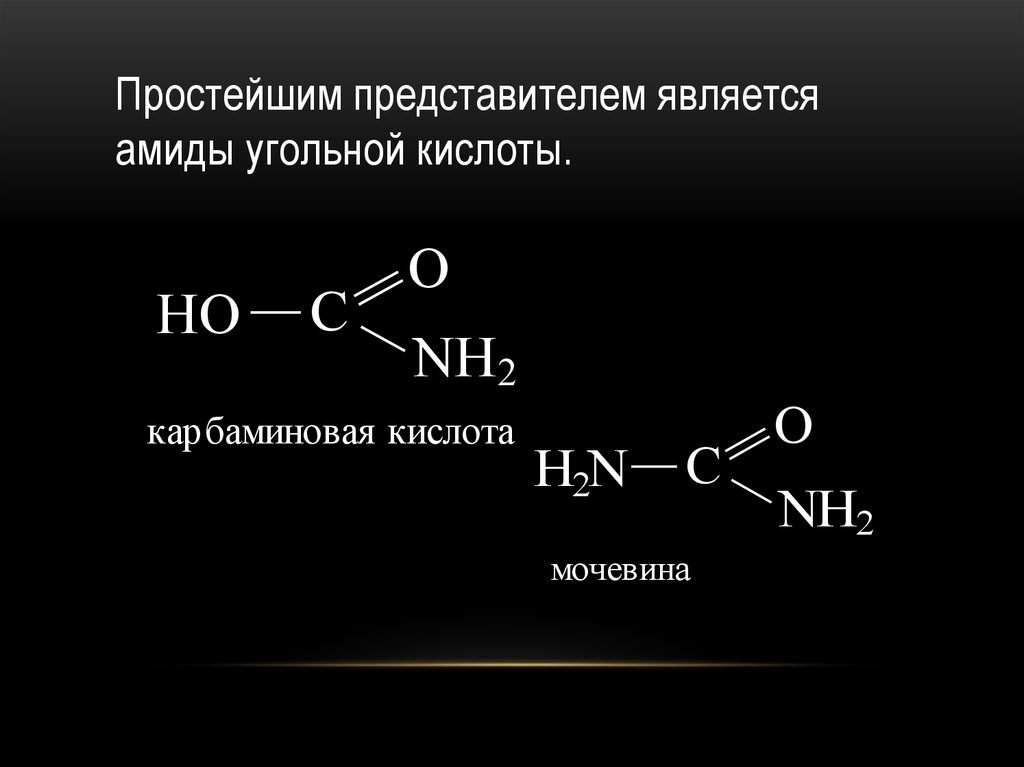
Простейшим представителем являетсяамиды угольной кислоты.
HO
C
O
NH2
карбаминовая кислота
H2N
C
мочевина
O
NH2
42. мочевина
МОЧЕВИНАявляется полным амидом угольной кислоты. Широко
распространена в природе. Является конечным
продуктом белкового обмена.
При обычных условиях мочевина – твердое
кристаллическое
вещество,
плавящееся
при
температуре 133 С. Хорошо растворима в полярных и
абсолютно
нерастворима
в
неполярных
растворителях.
Обладает слабыми основными свойствами, но
они выражены слабее, чем у аминов, из-за
карбонильной группы.
43.
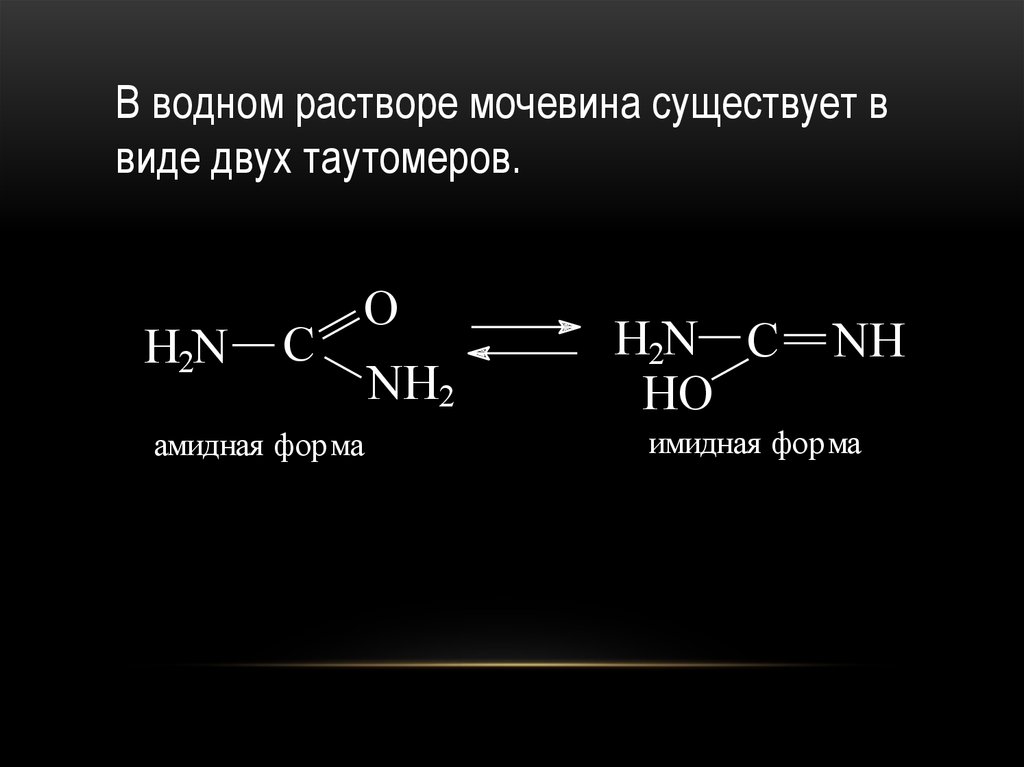
В водном растворе мочевина существует ввиде двух таутомеров.
H2N
C
O
амидная форма
NH2
H2N C
HO
NH
имидная форма
44. ПОЛУЧЕНИЕ МОЧЕВИНЫ
В промышленности мочевину получают следующимиспособами:
• Взаимодействием полного галогенангидрида
угольной кислоты с аммиаком
O
C
Cl
Cl + 2 NH3
H2N
C
O
+ 2 HCl
NH2
45.
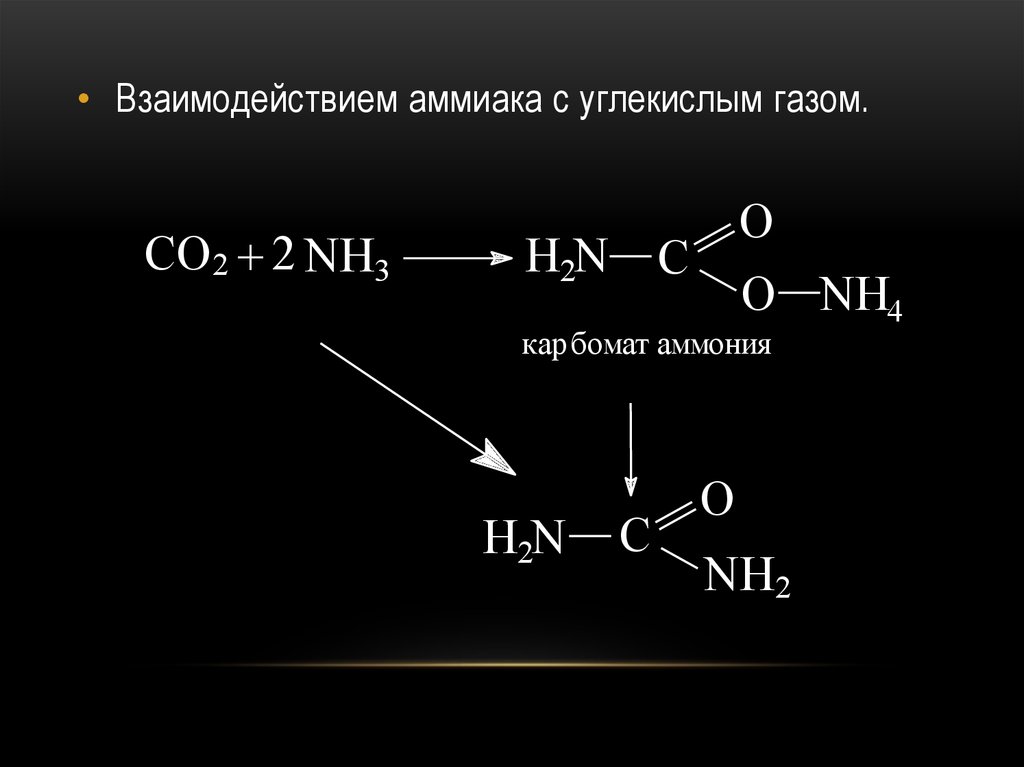
• Взаимодействием аммиака с углекислым газом.CO2 + 2 NH3
O
H2N C
O NH4
карбомат аммония
H2N
C
O
NH2
46. Химические свойства мочевины
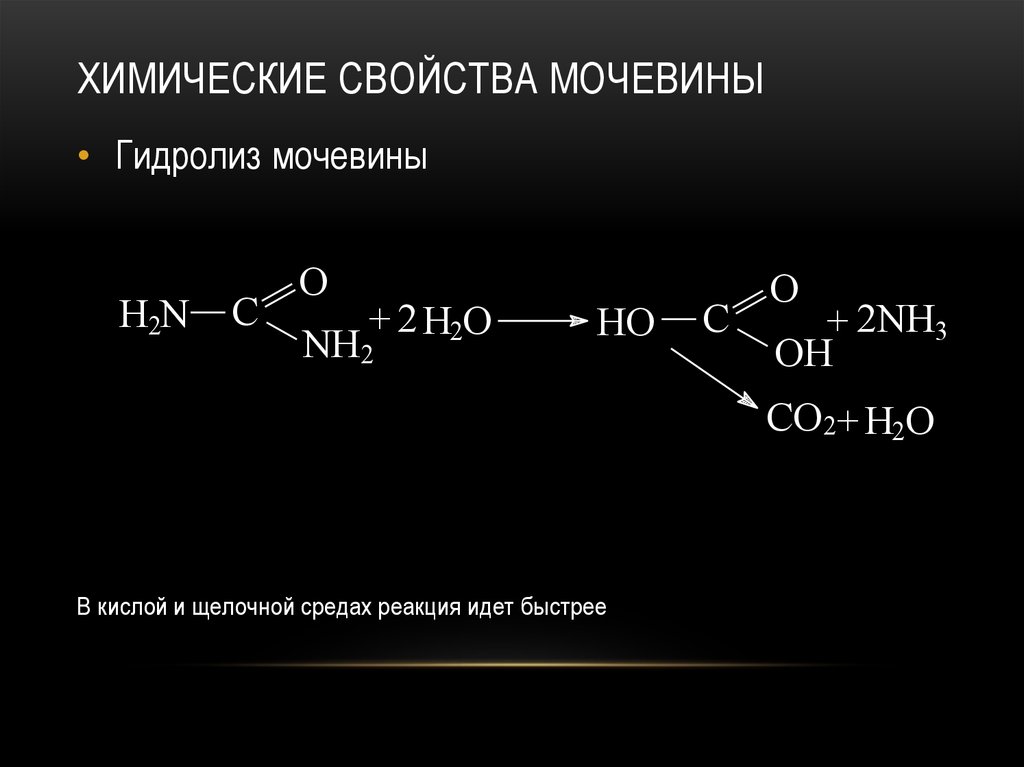
ХИМИЧЕСКИЕ СВОЙСТВА МОЧЕВИНЫ• Гидролиз мочевины
H2N
C
O
+ 2 H2O
NH2
HO
C
O
+ 2NH3
OH
CO2+ H2O
В кислой и щелочной средах реакция идет быстрее
47.
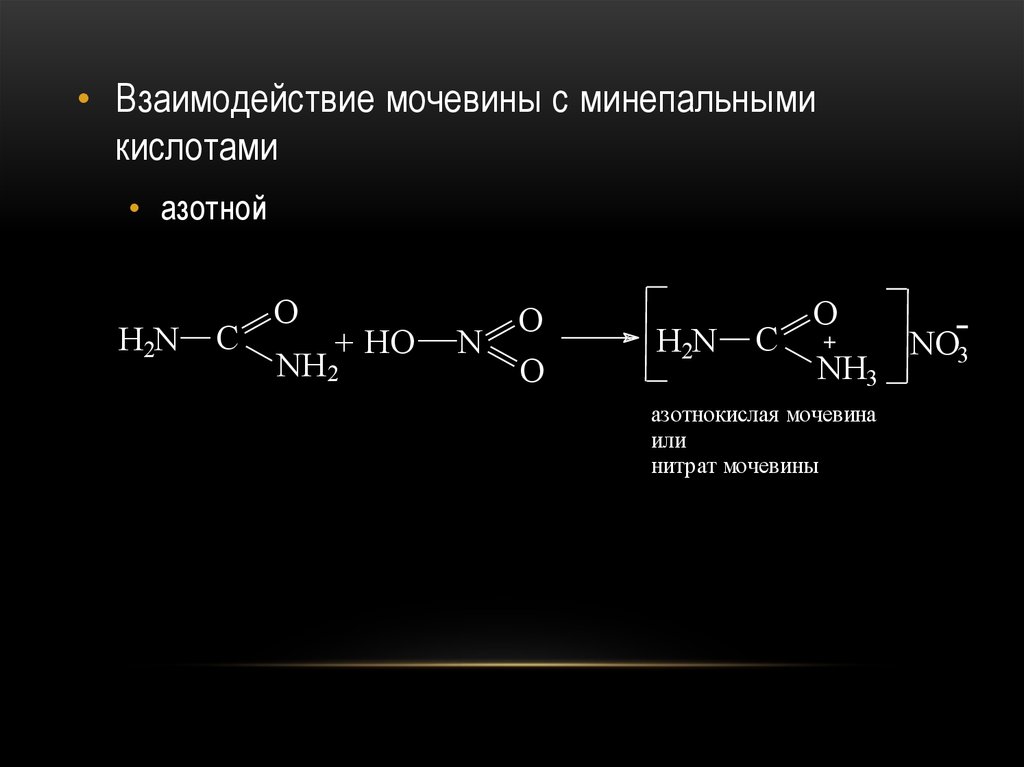
• Взаимодействие мочевины с минепальнымикислотами
• азотной
H2N
C
O
+ HO
NH2
N
O
O
H2N
C
O
+
NH3
азотнокислая мочевина
или
нитрат мочевины
NO-3
48.
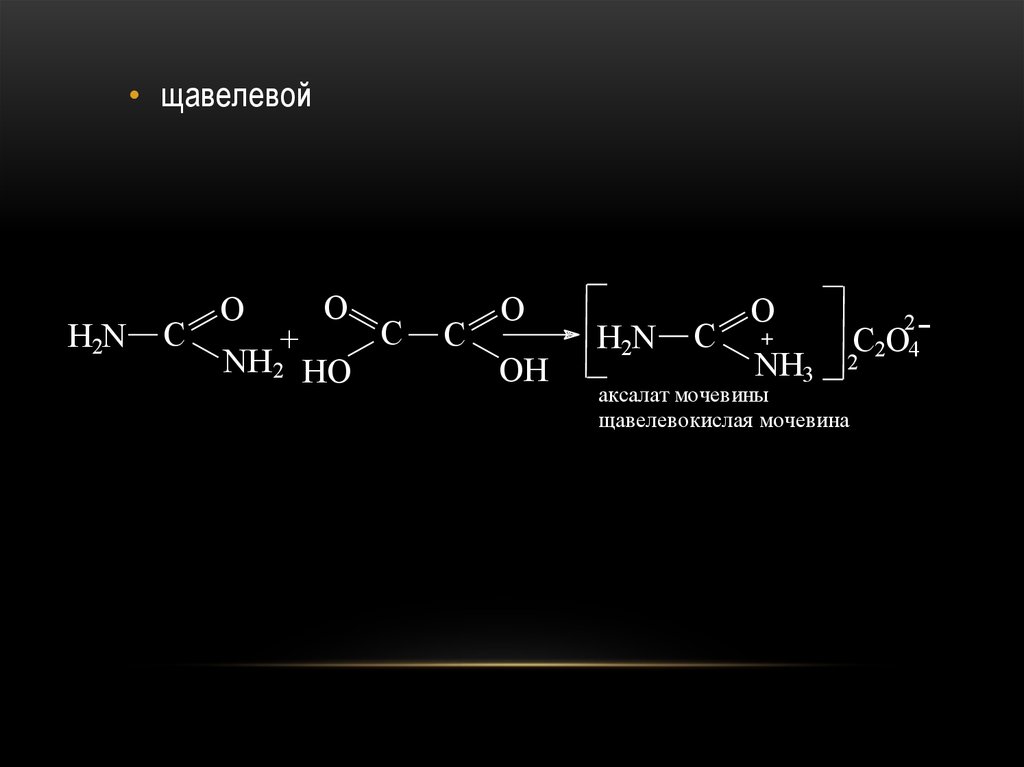
• щавелевойH2N
C
O
+
O
NH2 HO
C
C
O
OH
H2N
C
O
+
NH3
C2O42
2
аксалат мочевины
щавелевокислая мочевина
49.
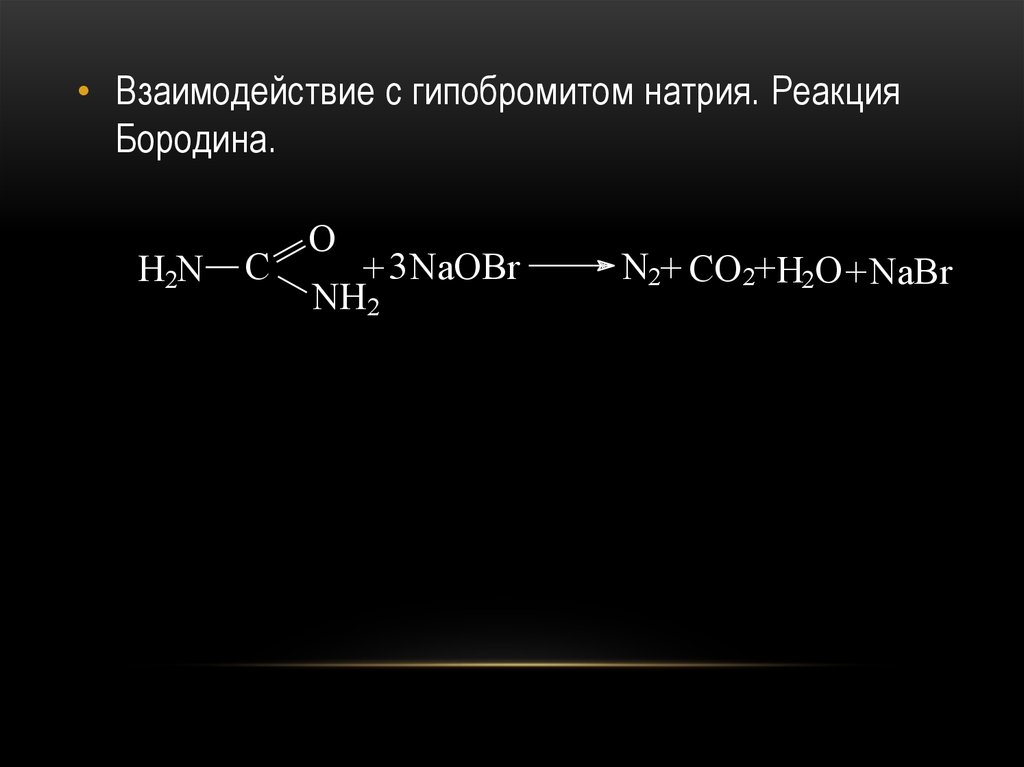
• Взаимодействие с гипобромитом натрия. РеакцияБородина.
H2N
C
O
+ 3 NaOBr
NH2
N2+ CO2+H2O + NaBr
50.
• Взаимодействие с формалиномH2N
H2N
O
C
C
O
O
+
C H
NH2 H
N
CH2 + H
C
H2N
C
O
N
монометиленмочевина
O
H
H2C N
C
O
+ H2O
CH2
N
диметиленмочевина
CH2 + H2O
51.
За счет разрыва двойных связейдиметиленмочевина подвергается полимеризации с
образованием мочевино-формальдегидных смол.
52.
• Нагревание сухой мочевиныH2N
NH2 H2N
NH2
C
+
C
O
O
H2N
NH
NH2
C
C
O
O
биурет
53.
Биурет является простейшим органическим соединением спептидной связью.
Пептидная связь является основной связью всех природных
белковых тел.
Реакция биурета с гидроксидом меди(II) является
качественной реакцией на белки.
2
H2N
O
C
NH
C
O
H
O
HN
C O
HN
+ Cu(OH)2
NH
HN
C
NH2
Cu
H
O C
NH
O C
NH
+ 2 H2O
54.
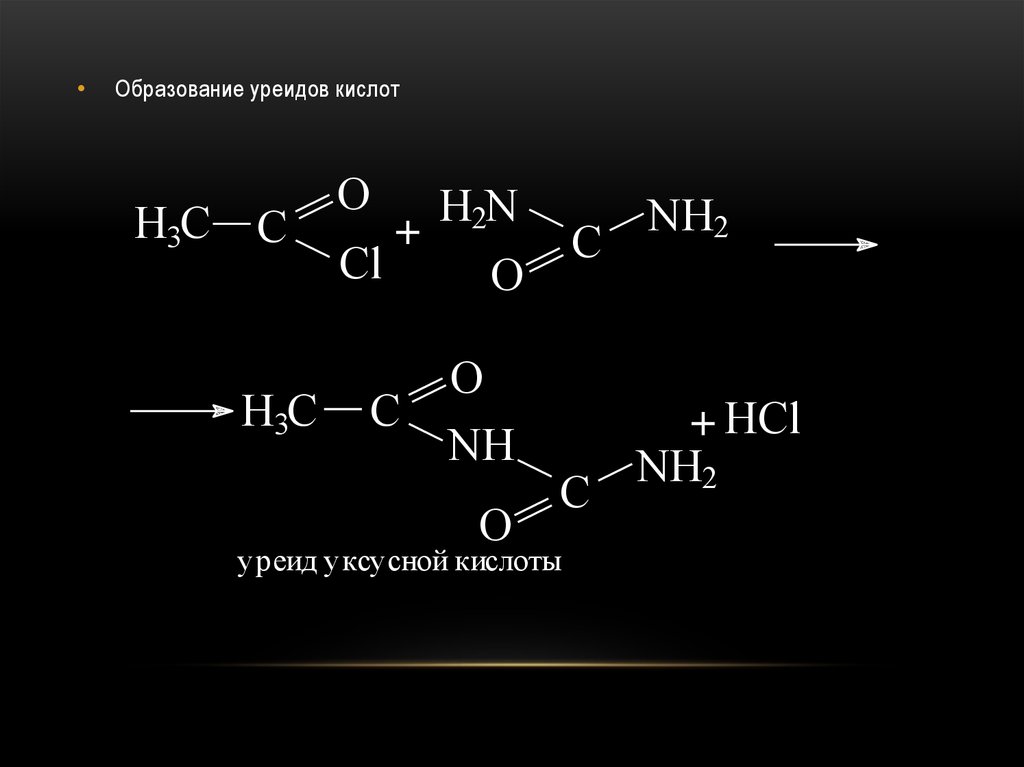
Образование уреидов кислот
H3C
C
H3C
O H2N
+
Cl
O
C
O
NH
O
C
C
уреид уксусной кислоты
NH2
+ HCl
NH2
55. аминокислоты
АМИНОКИСЛОТЫ56.
Аминокислотами называюттакие производные карбоновых
кислот, которые можно
получить замещением одного
или нескольких атомов
водорода в радикале кислоты
аминогруппами.
57. классификации
o КЛАССИФИКАЦИИ• В зависимости от количества
карбоксильных групп:
• Одноосновные
• Двухосновные
• Многоосновные
58.
• В зависимости от количествааминогрупп:
• Моно-аминокислоты
• Ди-аминокислоты
• Три-аминокислоты
• В зависимости от строения радикала:
• С открытой цепью
• Циклические
59. номенклатура
o НОМЕНКЛАТУРА• УНИВЕРСАЛЬНАЯ: правила построения названий
такие же как для карбоновых кислот только с
указанием в префиксе наличия, количества и
положения аминогрупп.
• РАЦИОНАЛЬНАЯ: положение аминогрупп
указывается буквами греческого алфавита + слово
«амино» + название карбоновой кислоты по
рациональной номенклатуре.
60. изомерия
o ИЗОМЕРИЯ• Изомерия положения аминогруппы относительно
карбоксильной группы. Различают α-, β-, γ-, δ-, ε- и
т.д.
• Структурная изомерия
• Оптическая изомерия
61. получение
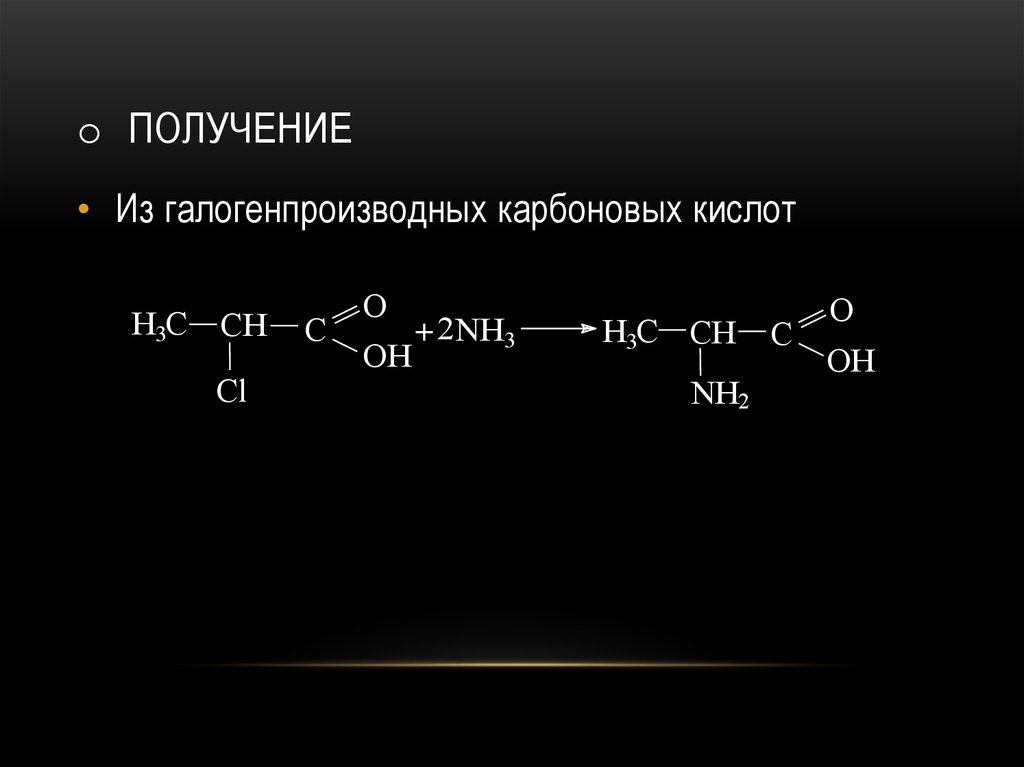
o ПОЛУЧЕНИЕ• Из галогенпроизводных карбоновых кислот
H3C CH
Cl
C
O
+ 2 NH3
OH
H3C CH
NH2
O
C
OH
62.
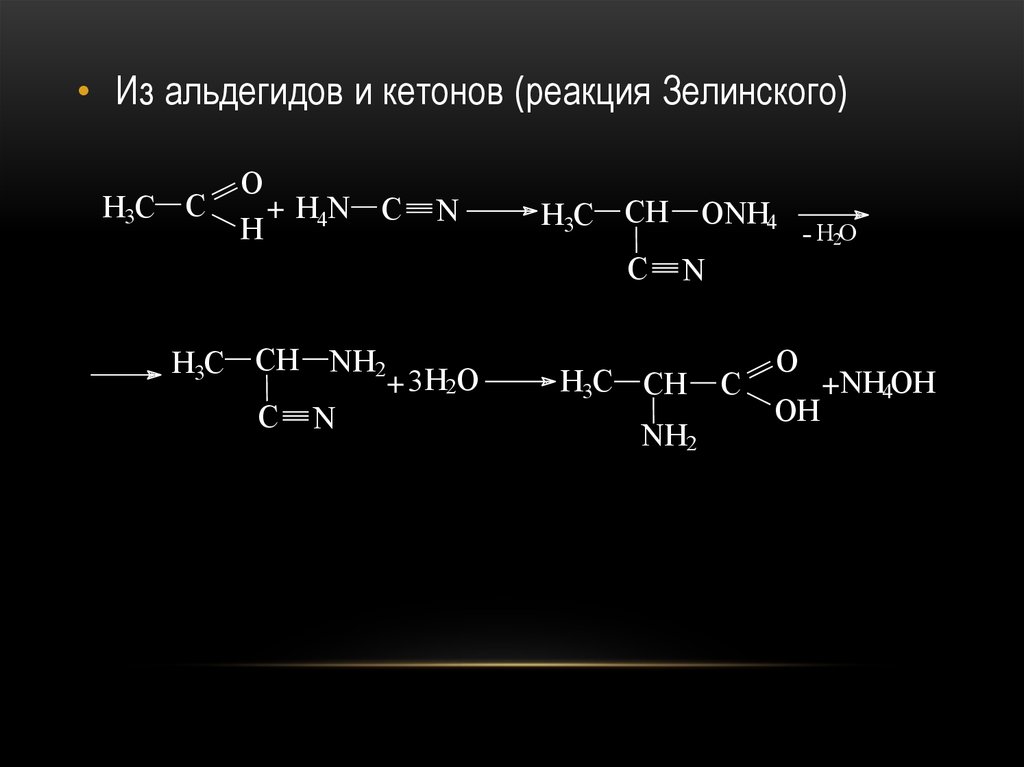
• Из альдегидов и кетонов (реакция Зелинского)H3C C
O
+ H4N C
H
N
H3C CH
C
H3C CH NH2
C
N
+ 3 H2O
ONH4
- H2O
N
H3C CH
NH2
C
O
OH
+NH4OH
63.
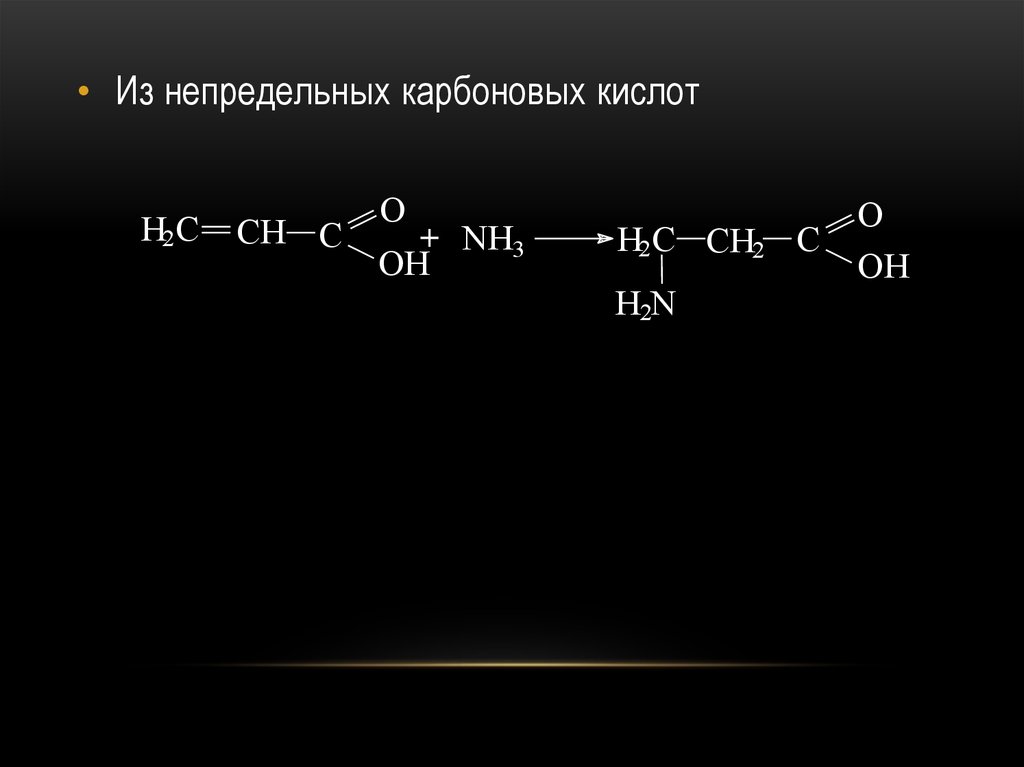
• Из непредельных карбоновых кислотH2 C
CH C
O
+ NH3
OH
H2 C CH2 C
H2N
O
OH
64. Физические свойства
o ФИЗИЧЕСКИЕ СВОЙСТВААминокислоты – бесцветные кристаллические
вещества, обладающие высокими показателями
температуры плавления. Не летучи. Плавятся с
разложением. Хорошо растворяются в воде и плохо
растворяются в органических растворителях.
Обладают оптической активностью.
65. моноаминокислоты
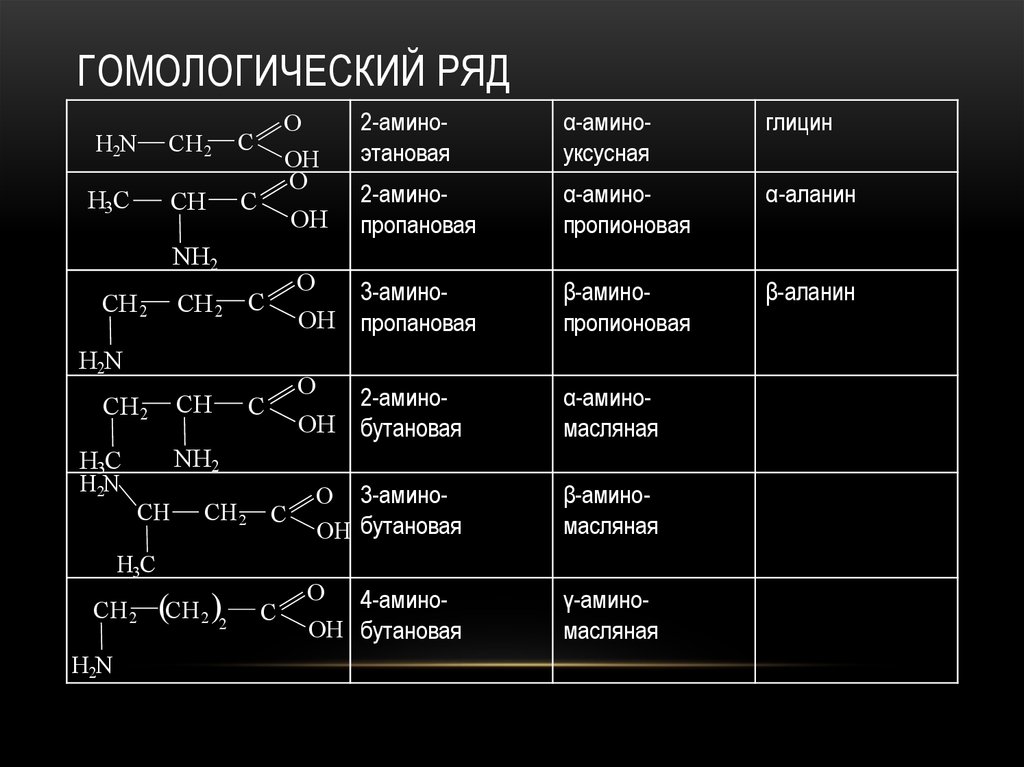
МОНОАМИНОКИСЛОТЫ66. Гомологический ряд
ГОМОЛОГИЧЕСКИЙ РЯДH2N
CH 2
H3C
O
OH
C
α-аланин
β-аланин
C
O
OH
3-аминопропановая
β-аминопропионовая
CH
C
O
OH
2-аминобутановая
α-аминомасляная
CH
O 3-аминоOH бутановая
β-аминомасляная
O 4-аминоOH бутановая
γ-аминомасляная
CH 2
C
H3C
H2N
α-аминопропионовая
NH2
H3C
CH 2
2-аминопропановая
CH 2
H2N
H2N
глицин
C
NH2
CH 2
α-аминоуксусная
O
OH
CH
CH 2
2-аминоэтановая
(CH 2 )2
C
67. Химические свойства
o ХИМИЧЕСКИЕ СВОЙСТВА• РЕАКЦИИ КАРБОКСИЛЬНОЙ ГРУППЫ
• Взаимодействие с гидроксидами
• щелочными
H2N
CH 2
C
O
+ KOH
OH
H2N
CH 2
C
O
+ H2O
OK
68.
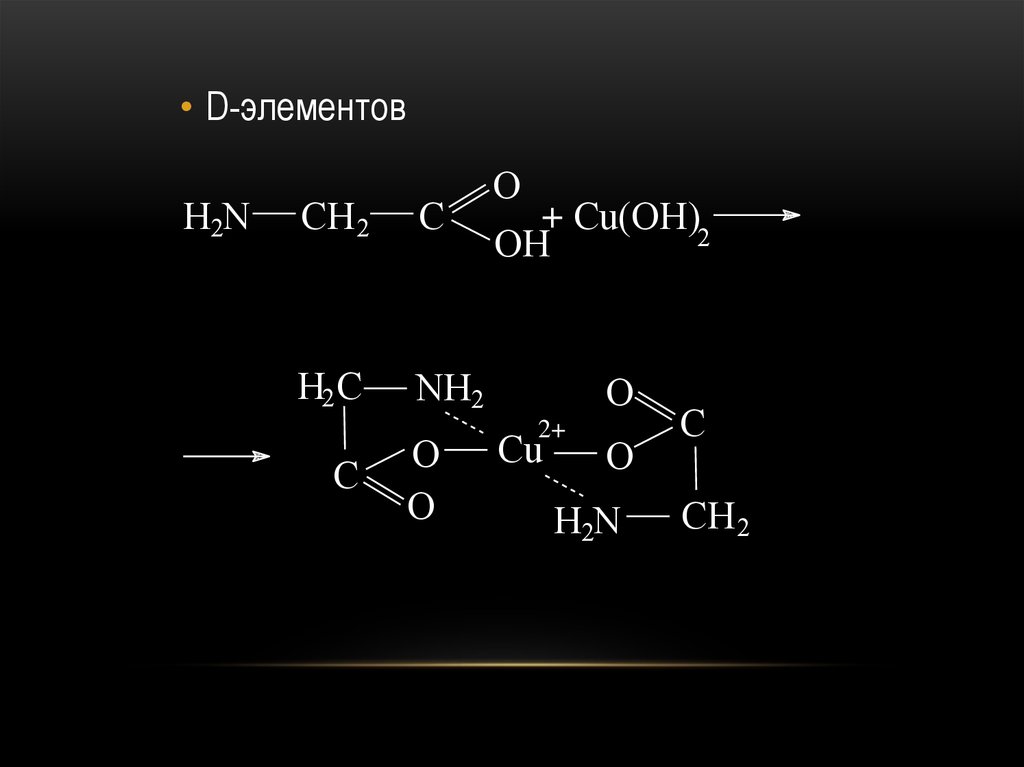
• D-элементовH2N
CH 2
C
H2 C
NH2
C
O
O
O
+ Cu(OH)2
OH
O
2+
Cu
O
H2N
C
CH 2
69.
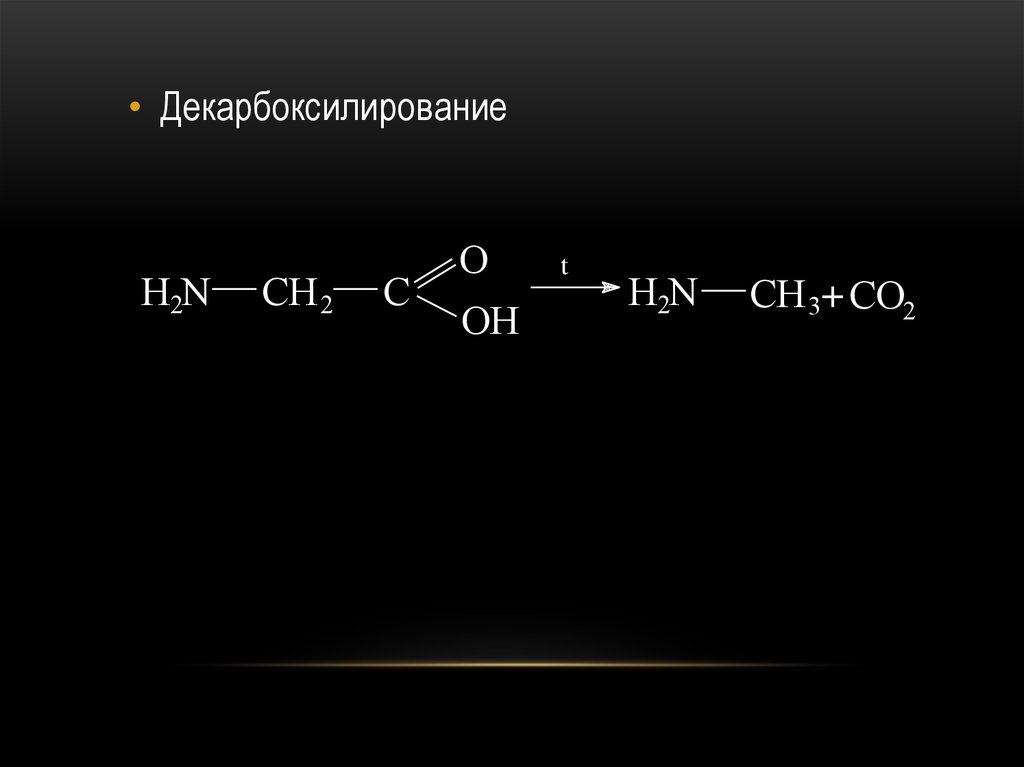
• ДекарбоксилированиеH2N
CH 2
C
O
OH
t
H2N
CH 3+ CO2
70.
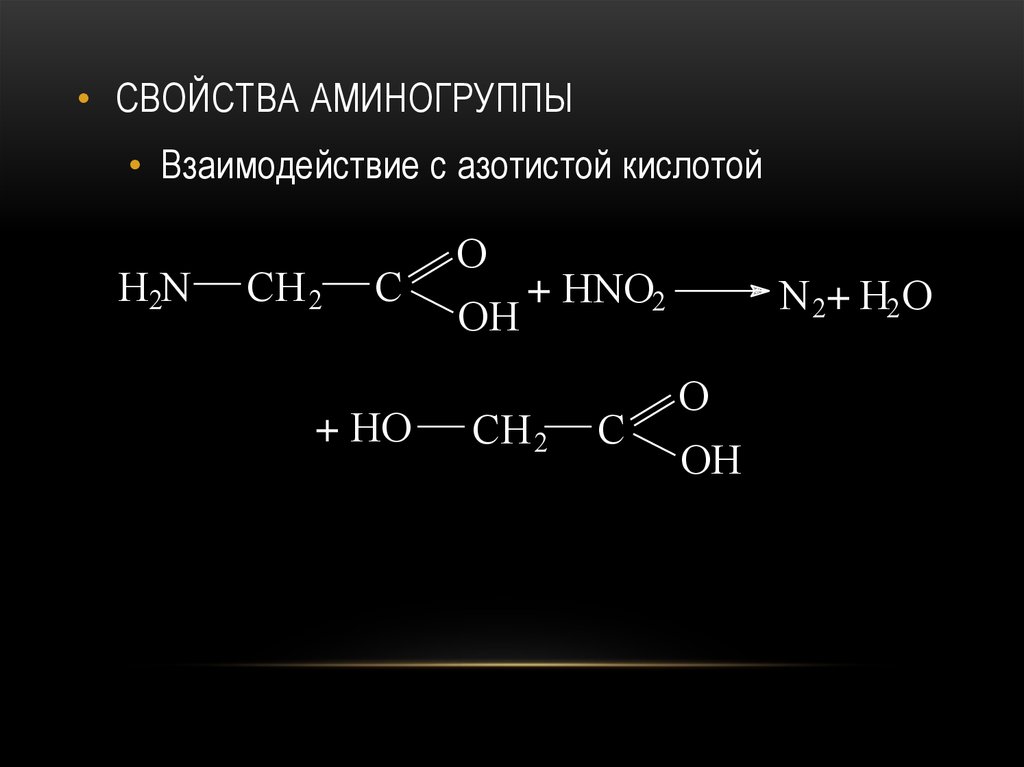
• СВОЙСТВА АМИНОГРУППЫ• Взаимодействие с азотистой кислотой
H2N
CH 2
C
+ HO
O
+ HNO2
OH
CH 2
C
N 2+ H2O
O
OH
71.
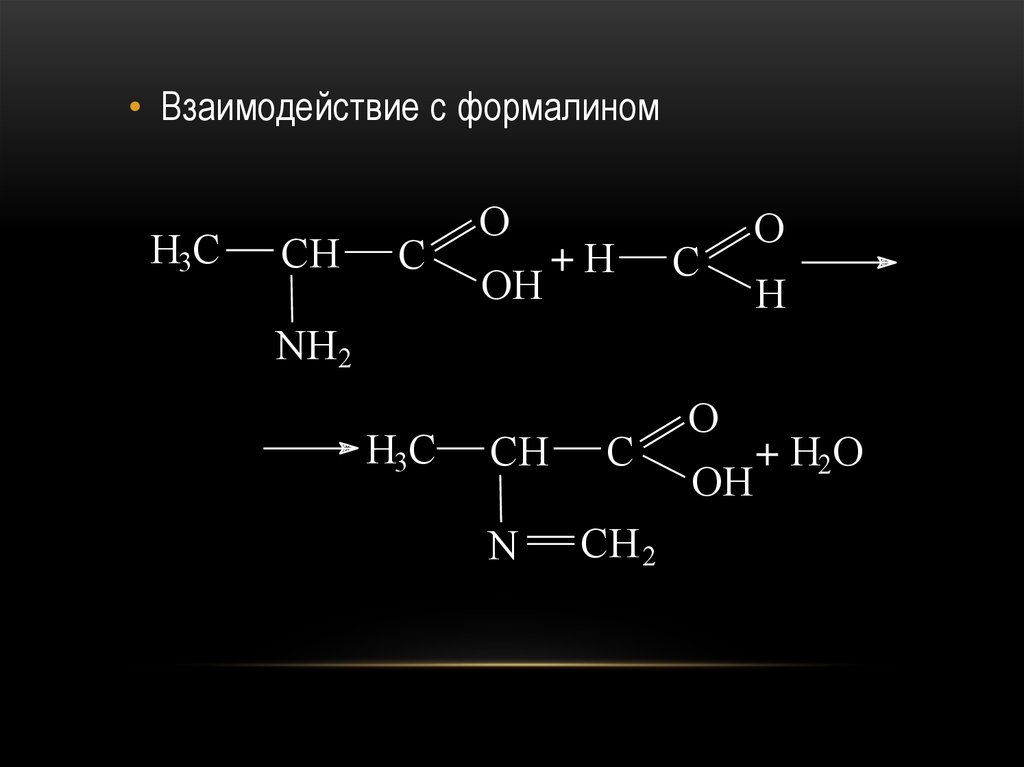
• Взаимодействие с формалиномH3C
CH
C
O
+H
OH
C
O
H
NH2
H3C
CH
N
C
CH 2
O
+ H2O
OH
72.
• СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ• Отношение к нагреванию
• α-аминокислоты
• В отсутствии минеральных кислот
H2N
CH 2 C
H2N
O
+ H2N
OH
CH 2
C
CH 2
O
NH
C
CH 2
O
OH
C
O
+ H2O
OH
73.
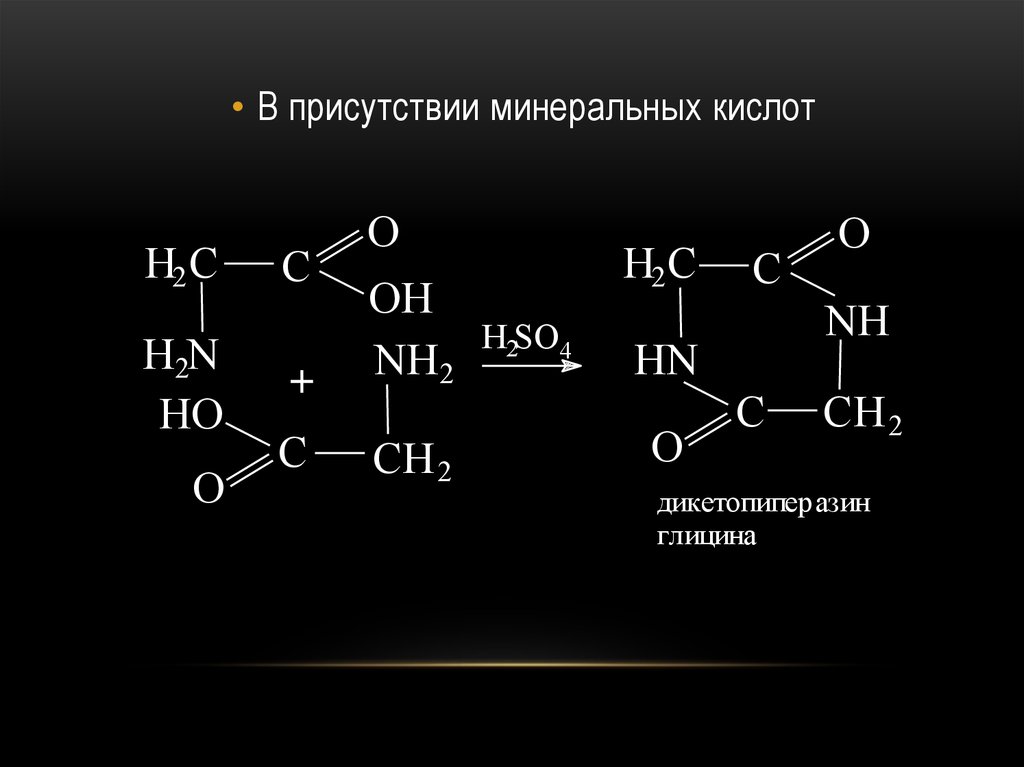
• В присутствии минеральных кислотH2 C
H2N
HO
O
+
O
OH
NH2
C
CH 2
C
H2 C
H2SO4
C
NH
HN
O
O
C
CH 2
дикетопиперазин
глицина
74.
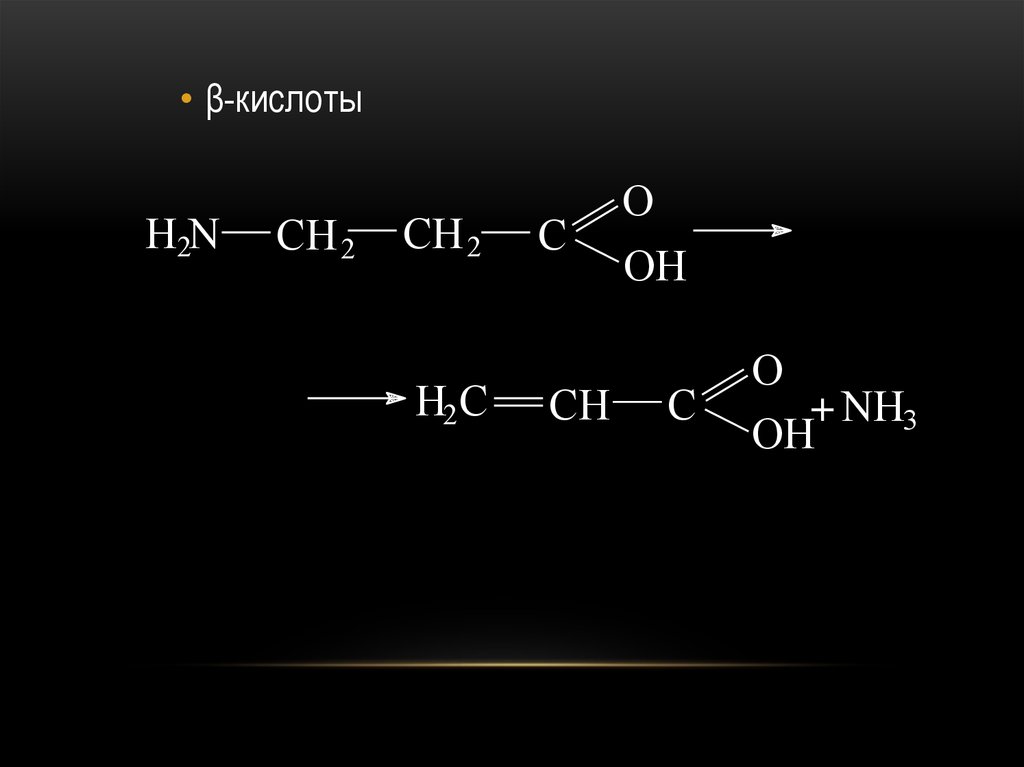
• β-кислотыH2N
CH 2
CH 2
H2 C
C
CH
O
OH
C
O
+ NH3
OH
75.
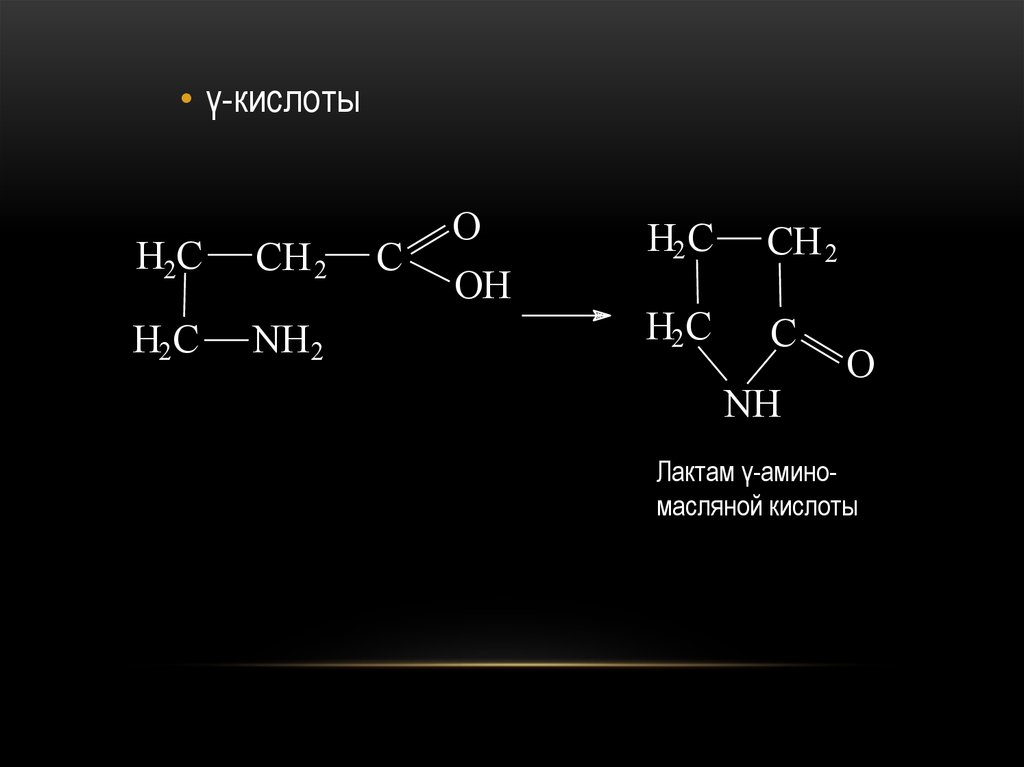
• γ-кислотыH2C
CH 2
H2 C
NH2
C
O
OH
H2 C
CH 2
H2 C
C
NH
O
Лактам γ-аминомасляной кислоты
76. Двухосновные аминокислоты
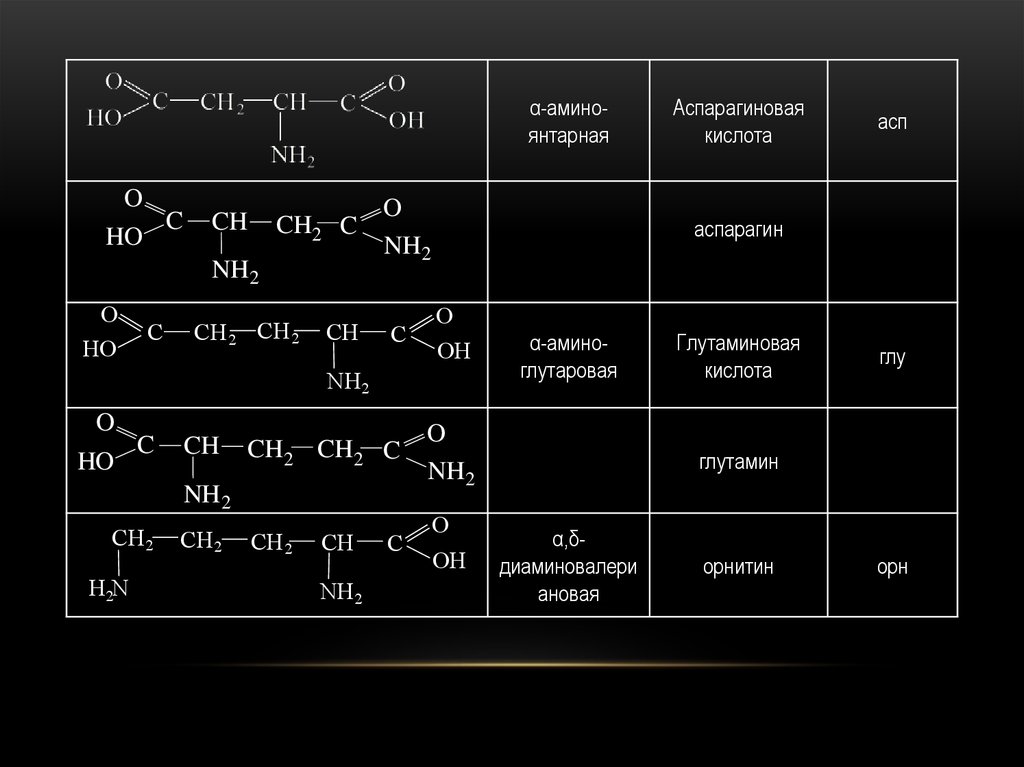
ДВУХОСНОВНЫЕ АМИНОКИСЛОТЫ77.
представители
O
HO
C
CH 2
Аминоянтарная
аспарагиновая
CH
C
O
OH
NH2
O
HO
C
CH 2
CH 2
α-аминоглутаровая
глутаминовая
CH
NH2
C
O
OH
78.
Двухосновные аминокислоты способны образовыватьвнутренние соли. Обе встречаются среди продуктов гидролиза
белковых тел.
Аспарагиновая кислота в свободном виде встречается
в животных и растительных организмах. Играет важную роль в
азотистом обмене. Образует амид – аспаргин.
Глутаминовая кислота используется при лечении
психических расстройств. Образует амид – глутамин.
79. диаминокислоты
ДИАМИНОКИСЛОТЫ80.
• представителиCH 2
CH 2
CH 2
CH
H2N
C
O
OH
NH2
α,δ-диаминовалериановая кислота
орнитин
CH 2
CH 2
CH 2
CH 2
H2N
α,ε-диаминокапронова кислота
лизин
CH
NH2
C
O
OH
81. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВА• Взаимодействие с водой (в водных растворах pH>7)
82.
• ДекарбоксилированиеCH 2
H2N
CH 2
CH 2
орнитин
CH 2
H2N
CH
C
O
OH
NH2
CH 2
CH 2
нутрисцин
CH 2 + CO
2
NH2
CH 2
H2N
CH 2
CH 2
CH 2
H2N
C
O
OH
NH2
лизин
CH 2
CH
CH 2
CH 2
кадоверин
CH 2
CH 2 + CO
2
NH2
83.
α-аминокислоты участвуют в синтезе белка.В состав белковых тел входят и такие аминокислоты,
которые кроме аминогрупп содержат и другие функциональные
группы.
По своей значимости для организма все аминокислоты
делятся на:
Заменимые (синтезируются в организме)
Не заменимые (запас пополняется только с пищей)
84.
НазваниеФормула
H2N
CH 2
H2N
CH
C
C
O
OH
O
OH
CH 3
H3C
CH
CH
C
O
OH
CH 3 NH2
H3C
CH
CH 2
CH 3
H3C
CH
C
O
OH
По номенклатуре
тривиальное
Усл. Об.
α-аминоуксусная
Глицин
гли
α-аминопропионовая
Аланин
Ала
α-аминоизовалериановая
Валин
вал
α-аминоизокапроновая
Лейцин
лей
Втор.бутил –αаминоуксусная
Изолейцин
иле
NH2
CH 2 CH
CH 3
CH
NH2
C
O
OH
85.
α-аминоянтарнаяO
C
HO
CH
CH2 C
NH 2
O
HO
C
O
NH2
C
CH2 CH2 C
O
NH 2
CH 2
O
OH
CH
NH2
O
C
HO
CH
NH 2
CH 2
H2N
CH 2
CH
NH2
C
асп
аспарагин
O
OH
CH 2 CH 2
Аспарагиновая
кислота
α-аминоглутаровая
Глутаминовая
кислота
глу
глутамин
α,δдиаминовалери
ановая
орнитин
орн
86.
CH 2CH 2
CH 2
CH 2
H2N
H2 C
NH2
CH 2
HO
CH
C
O
OH
C
CH 2
CH
O
OH
α,εдиаминокап
роновая
кислота
лизин
лиз
АРГ
C
O
OH
α-амино-βокипропионо
вая
серин
сер
C
O
OH
α-аминоβоксимаслян
ая
треонин
тре
β-тио-αаминопропио
новая
цистеин
цис
NH
NH 2
CH
NH2
H3C
C
α-амино-δгуанидовале аргинин
риановая
NH 2
H2 C
HN
CH
CH
NH2
HO
O
H2 C CH C
OH
HS NH2
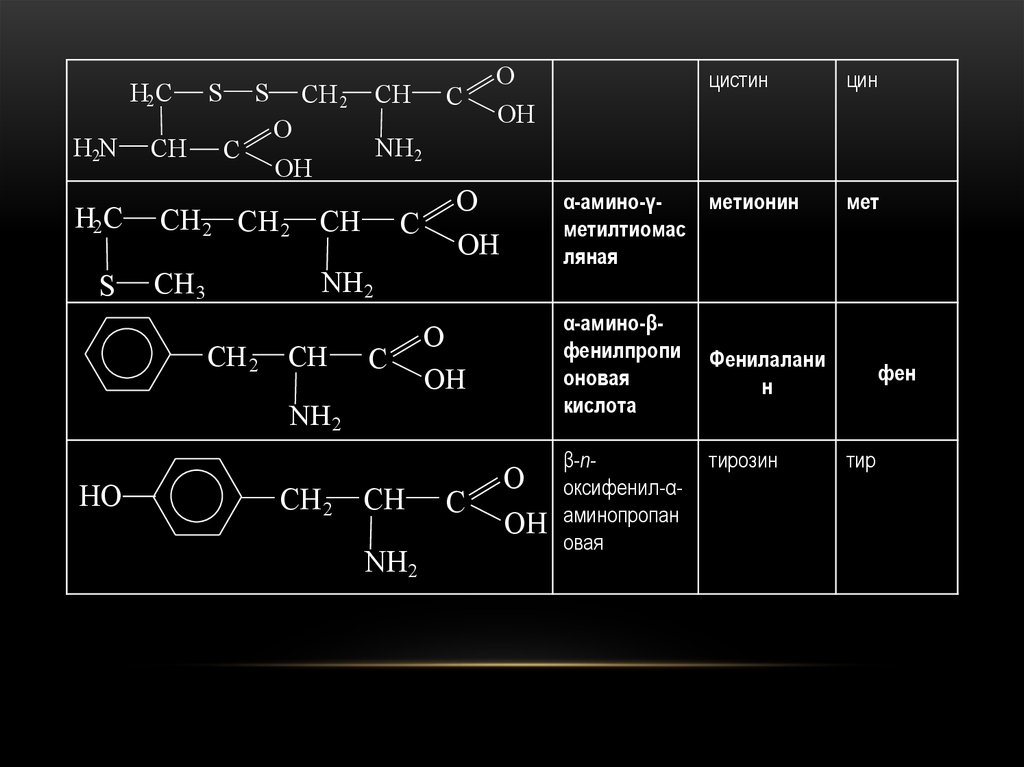
87.
H2 CH2N
H2 C
S
CH
S
S
C
CH 2
CH
O
OH
O
OH
CH
CH 3
NH2
CH
C
C
O
OH
α-амино-γметионин
метилтиомас
ляная
α-амино-βфенилпропи
оновая
кислота
O
OH
NH2
HO
цистин
цин
NH2
CH 2 CH 2
CH 2
C
CH 2
CH
NH2
C
O
OH
β-поксифенил-αаминопропан
овая
мет
Фенилалани
н
тирозин
фен
тир
88.
OC
HO
CH
CH2 C
NH2
HC
N
β-имидозолил αаланин
гистидин
гис
β-индолил-αаланин
триптофан
три
CH
NH
O
C
HO
CH
CH
CH2 C
NH 2
H2C
H2C
HC
C
CH
CH
C
NH CH
CH2
CH
O
NH C
OH
пролин
про
89. белки
БЕЛКИБелками, или белковыми веществами, называют
высокомолекулярные органические соединения, молекулы которых построены
из остатков α-аминокислот, связанных между собой пептидными связями.
Количество последних может колебаться очень сильно и достигать иногда
нескольких тысяч.
Структура белков очень сложная. Отдельные пептидные цепи или их
участки могут быть связаны между собой дисульфидными , солевыми или
водородными связями.
Солевые связи образуются между свободными аминогруппами (например,
концевая аминогруппа, расположенная на одном конце полипептидной цепи
или ε-аминогруппа лизина) и свободными карбоксильными группами
(концевая карбоксильная группа цепи или свободные карбоксильные группы
двухосновных аминокислот);
Водородные связи могут возникать между атомом кислорода карбонильной
группы и атомом водорода аминогруппы, а также за счет гидроксогрупп
оксиаминокислот и кислорода пептидных групп.
90. белки
БЕЛКИРазличают первичную, вторичную, третичную и
четвертичную структуры белковых молекул.
Все белки, независимо от того к какой группе они
относятся и какие функции выполняют, построены из
относительно небольшого набора (обычно 20) аминокислот,
которые расположены в различной, но всегда строго
определенной для данного вида белка последовательности.
Белки подразделяют на протеины и протеиды.
Пртеины – простые белки, состоящие только из остатков
аминокислот.
Альбумины – обладают сравнительно небольшой
молекулярной массой, хорошо растворимы в воде, при
нагревании свертываются.
91. белки
БЕЛКИГлобулины – не растворимы в чистой воде, но
растворимы в теплом 10%-ном растворе NaCl.
Проламины – незначительно растворимы в воде, но
растворимы в 60÷80%-ном водном этиловом спирте.
Глютелины – растворимы только в 0,2%-ной щелочи.
Протамины – совершенно не содержат серы.
Пртеиноиды – нерастворимые белки.
Фосфопротеины – содержат фосфорную кислоту
(козеин).
92. белки
БЕЛКИПртеиды – сложные белки, в состав которых наряду с
аминокислотами входят углеводы, липиды, гетероциклические
соединения, нуклеиновые кислоты, фосфорная кислота.
Липопротеиды – гидролизуются на простой белок и липиды.
(зерна хлорофила, протоплазма клеток).
Гликопротеиды – гидролизуются на простые белки и
высокомолекулярные углеводы. (слизистые выделения
животных).
Хромопротеиды – гидролизуются на простые белки и
красящие вещества (гемоглобин)
Нуклеопротеиды – гидролизуются на простые белки (обычно
протамины) и нуклеиновые кислоты
















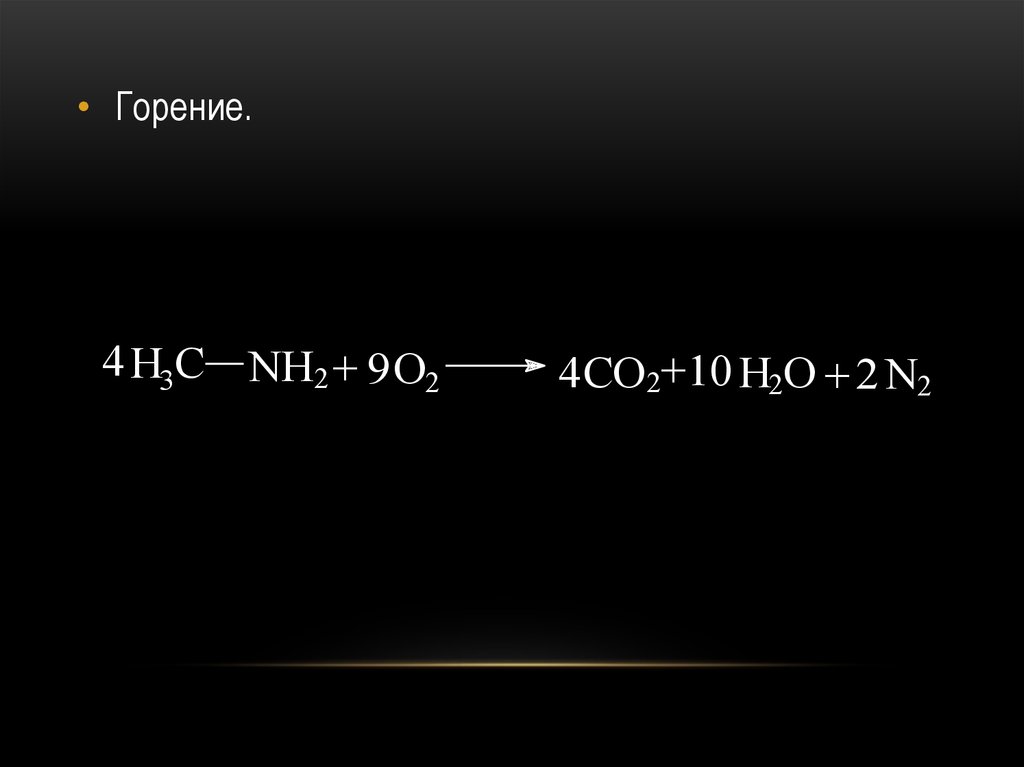





































 chemistry
chemistry








