Similar presentations:
Азотсодержащие соединения: аминокислоты
1. Лекция Азотсодержащие соединения: аминокислоты
2. План:
1.Классификация аминокислот.2. Получение аминокислот.
3.Аминокислоты и их свойства.
3.
Известно более 150 аминокислот,20 из них играют исключительную
биологическую роль
Общая формула аминокислот:
4. Аминокислоты –
органические соединения,содержащие два типа
функциональных групп с
противоположными свойствами:
аминогруппу (–NH2) и
карбоксильную группу (–СООН).
H2N CH COOH
R
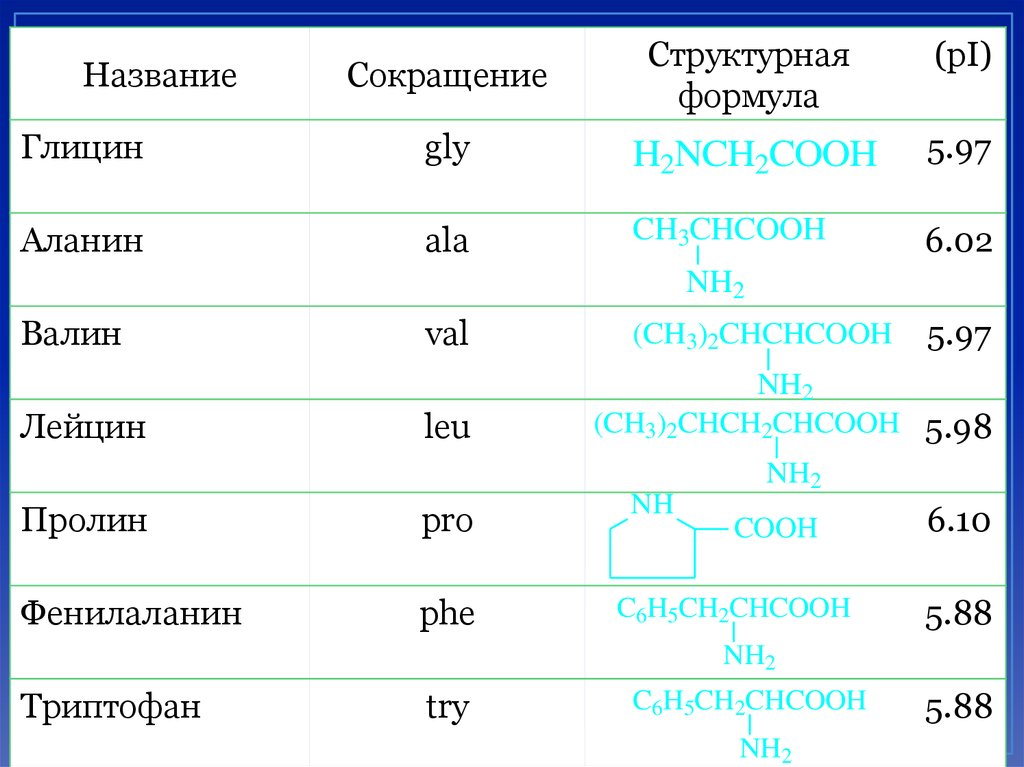
5.
СокращениеСтруктурная
формула
(pI)
Глицин
gly
H2NCH2COOH
5.97
Аланин
ala
CH3CHCOOH
6.02
Название
NH2
Валин
val
Лейцин
leu
Пролин
pro
Фенилаланин
phe
(CH3)2CHCHCOOH
5.97
NH2
(CH3)2CHCH2CHCOOH 5.98
NH2
NH
6.10
COOH
C6H5CH2CHCOOH
5.88
NH2
Триптофан
try
C6H5CH2CHCOOH
NH2
5.88
5
6.
НазваниеАспарагин
(pI)
Сокращени
е
Структурная формула
asn
H2N(O)CCH2CHCOOH
5.41
NH2
Глутаминовая
кислота
glu
Лизин
lys
3.22
HOOCCH2CH2CHCOOH
NH2
H2NCH2CH2CH2CH2CHCOOH 9.74
NH2
Аргинин
arg
10.76
HN
H2N
C NH CH2CH2CH2CHCOOH
NH2
6
7.
НазваниеГистидин
Сокращение
Структурная формула
his
(pI)
7.58
N
NH2
NH
Тирозин
CH2CHCOOH
tyr
5.65
HO
CH2CHCOOH
NH2
Цистеин
cySH
HSCH2CHCOOH
5.02
NH2
7
8. 1.Классификация аминокислот
9. Аминокислоты классифицируют по двум структурным признакам.
В зависимости от взаимногорасположения амино- и карбоксильной
групп аминокислоты подразделяют на
α-, β-, γ-, δ-, ε- и т. д.
10. По функциональным группам
Алифатические• Моноаминомонокарбоновые: глицин, аланин,
валин, изолейцин, лейцин
• Оксимоноаминокарбоновые: серин, треонин
• Моноаминодикарбоновые: аспартат, глутамат, за
счёт второй карбоксильной группы несут в растворе
отрицательный заряд
• Амиды моноаминодикарбоновых: аспарагин,
глутамин
• Диаминомонокарбоновые: лизин, аргинин, несут в
растворе положительный заряд
• Серосодержащие: цистеин, метионин
Ароматические: фенилаланин, тирозин,
триптофан, (гистидин)
Гетероциклические: триптофан, гистидин,
пролин
11. Незаменимые аминокислоты —
необходимые аминокислоты, которые не могутбыть синтезированы в том или ином организме.
Поэтому их поступление в организм с пищей
необходимо.
• Незаменимыми являются
9 аминокислот: валин, гистидин,
изолейцин, лейцин, лизин,
метионин, треонин, триптофан,
фенилаланин.
Остальные аминокислоты могут синтезироваться
в организме животных, их называют
заменимыми: аланин, аргинин, аспарагин,
аспарагиновая кислота, глицин, глутамин,
глутаминовая кислота, пролин, серин, цистеин,
тирозин.
12.
Содержание самых важных аминокислот:триптофана, метионина и лизина в некоторых
продуктах, наиболее близкое к идеальному
составу:
• в мясе 1:2,5:8,5
• в рыбе 0,9:2,8:10,1
• в куриных яйцах 1,6:3,3:6,9
• в свежем молоке 1,5:2,1:7,4
• в пшеничном зерне 1,2:1,2:2,5
• в сое 1,0:1,6:6,3
13. Незаменимые кислоты содержатся в следующих продуктах:
• Валин – в зерновых, грибах, мясе, молочныхпродуктах, сое, арахисе.
• Изолейцин – в орехах кешью и миндале, курином
мясе и яйцах, рыбе, печени, мясе, ржи, чечевице,
сое и в большинстве семян.
• Лейцин – в мясе и рыбе, орехах, чечевице, буром
рисе и также в большинстве семян.
• Лизин – в рыбе, мясе, молоке и молочных
продуктах, пшенице и орехах.
• Метионин – в молоке, рыбе, яйцах, мясе, бобовых.
• Треонин – в яйцах и молочных продуктах.
• Триптофан – в мясе, бананах, финиках, кунжуте,
арахисе, овсе.
• Фенилаланин – в говядине, курице, рыбе, яйцах,
сое, молоке и твороге.
14. 2. Получение аминокислот.
15. 1. Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
16. 2. Присоединение аммиака к α-, β-непредельным кислотам с образованием β-аминокислот:
CH2=CH–COOH + NH3 →H2N–CH2–CH2–COOH.
17. 3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот):
O2N–C6H4–COOH + 3H2 →H2N–C6H4–COOH + 2H2O.
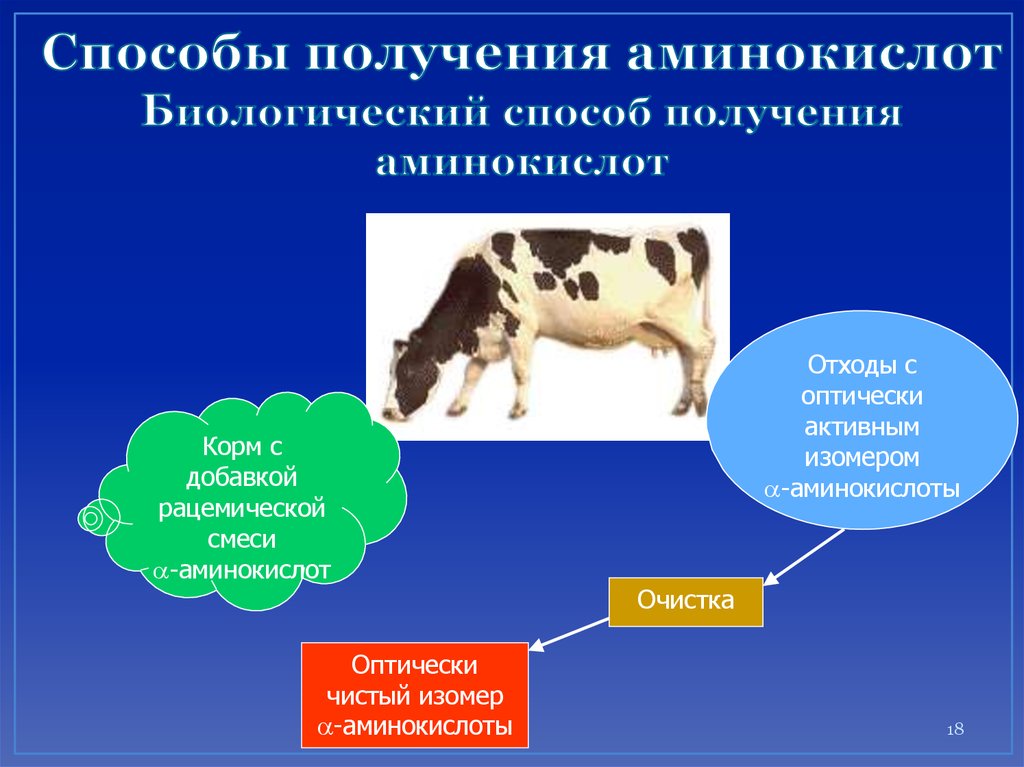
18. Способы получения аминокислот Биологический способ получения аминокислот
Корм сдобавкой
рацемической
смеси
a-аминокислот
Оптически
чистый изомер
a-аминокислоты
Отходы с
оптически
активным
изомером
a-аминокислоты
Очистка
18
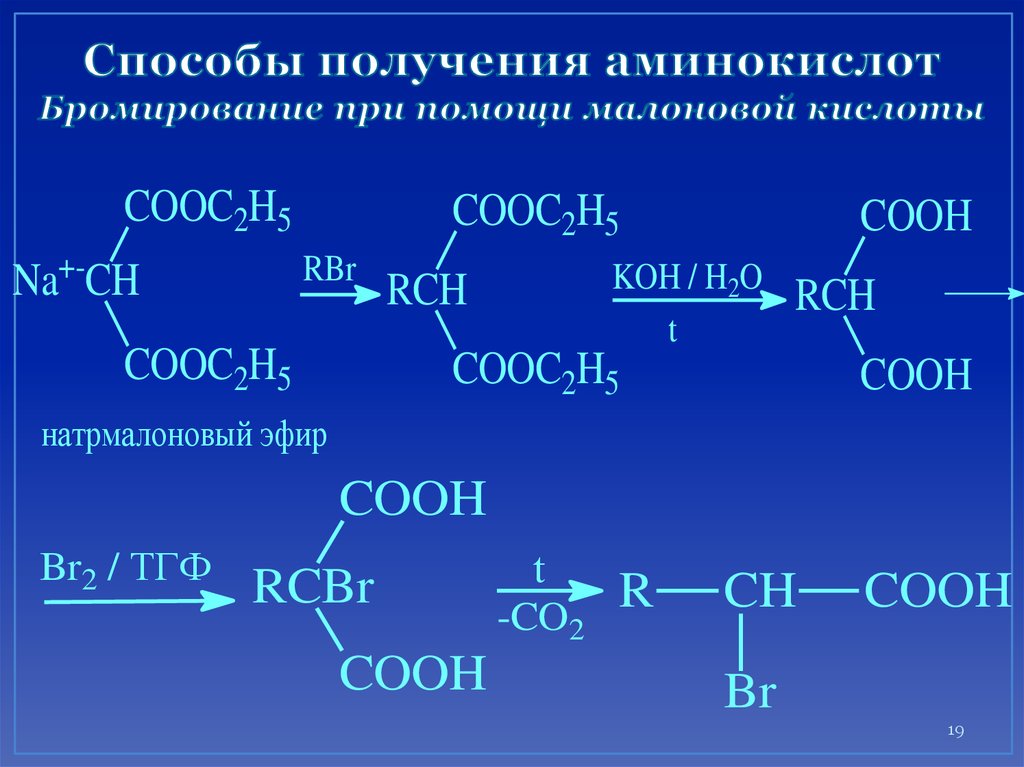
19. Способы получения аминокислот Бромирование при помощи малоновой кислоты
COOC2H5Na+-CH
COOC2H5
RBr
COOC2H5
COOH
KOH / H2O
t
RCH
RCH
COOC2H5
COOH
натрмалоновый эфир
COOH
Br2 / ТГФ
RCBr
COOH
t
-CO2
R
CH
COOH
Br
19
20. 3.Аминокислоты и их свойства.
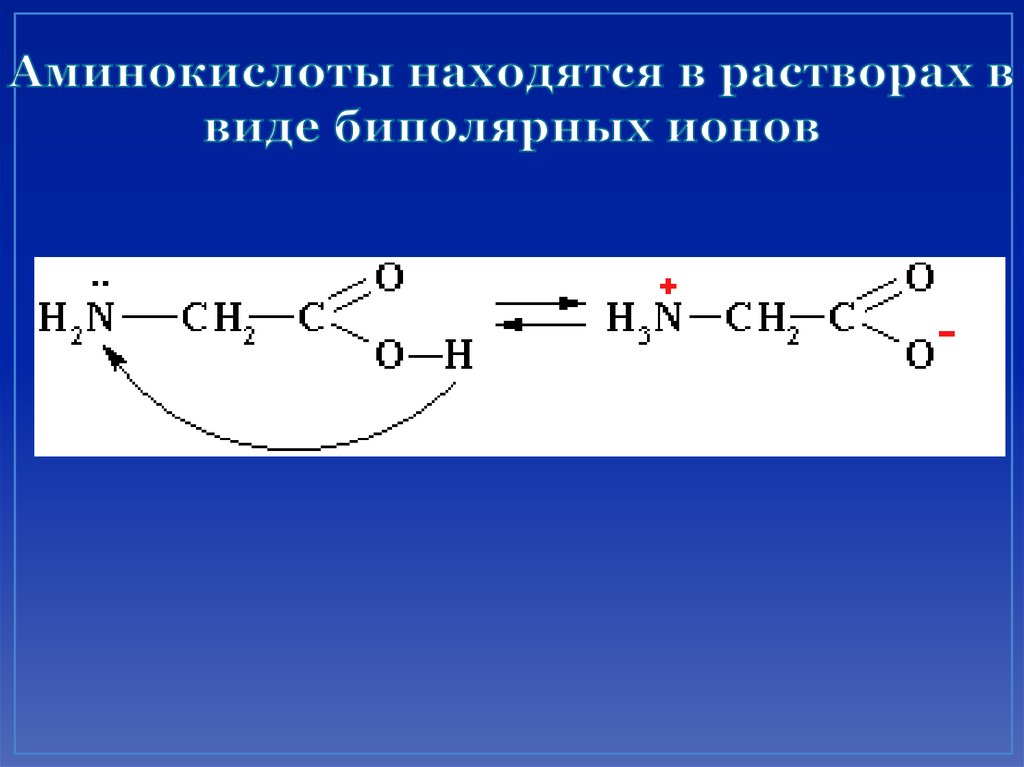
21. Аминокислоты находятся в растворах в виде биполярных ионов
22. Изменение суммарного заряда аминокислот в зависимость от рН среды
23. Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т. е. являются
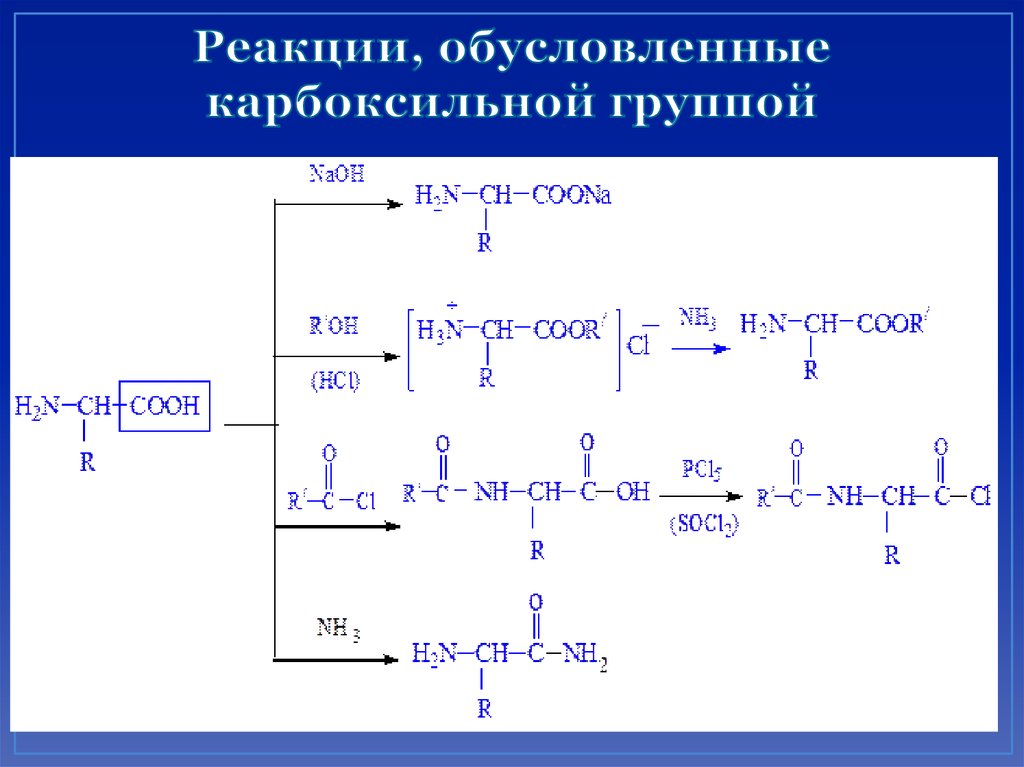
• Подобно аминам, они реагируют с кислотамис образованием солей аммония:
H2N–CH2–COOH + HCl →
+
–
[H3N –CH2–COOH]Cl .
• Как карбоновые кислоты они образуют соли :
H2N–CH2–COOH + NaOH →
H2N–CH2–COONa + H2O.
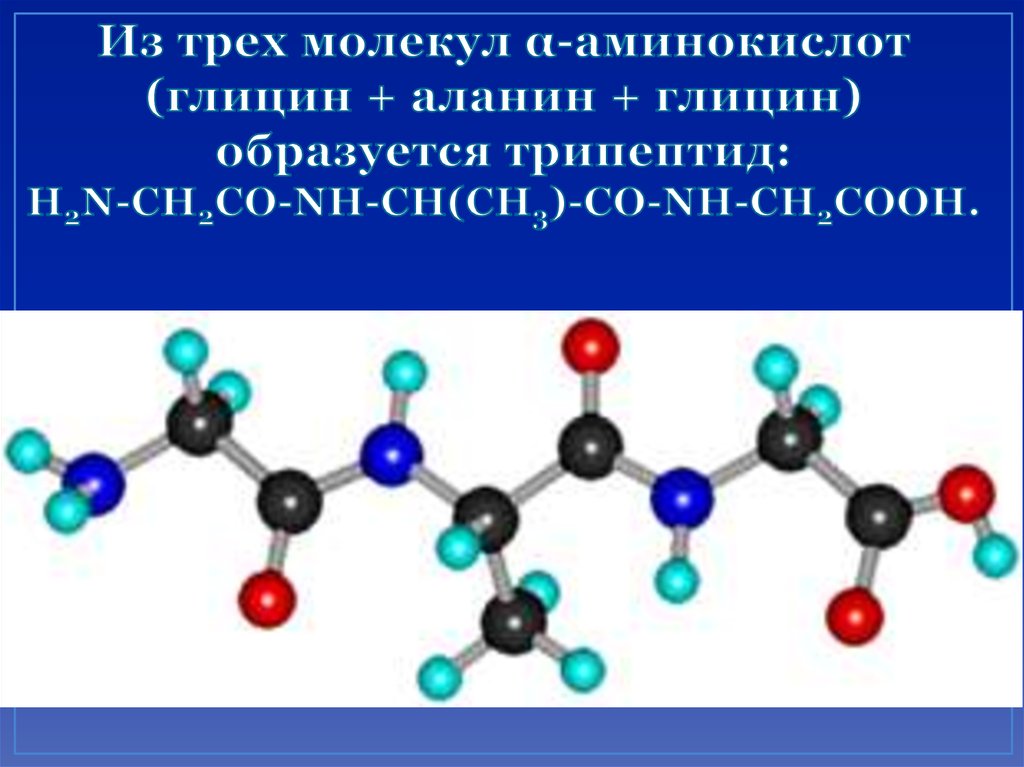
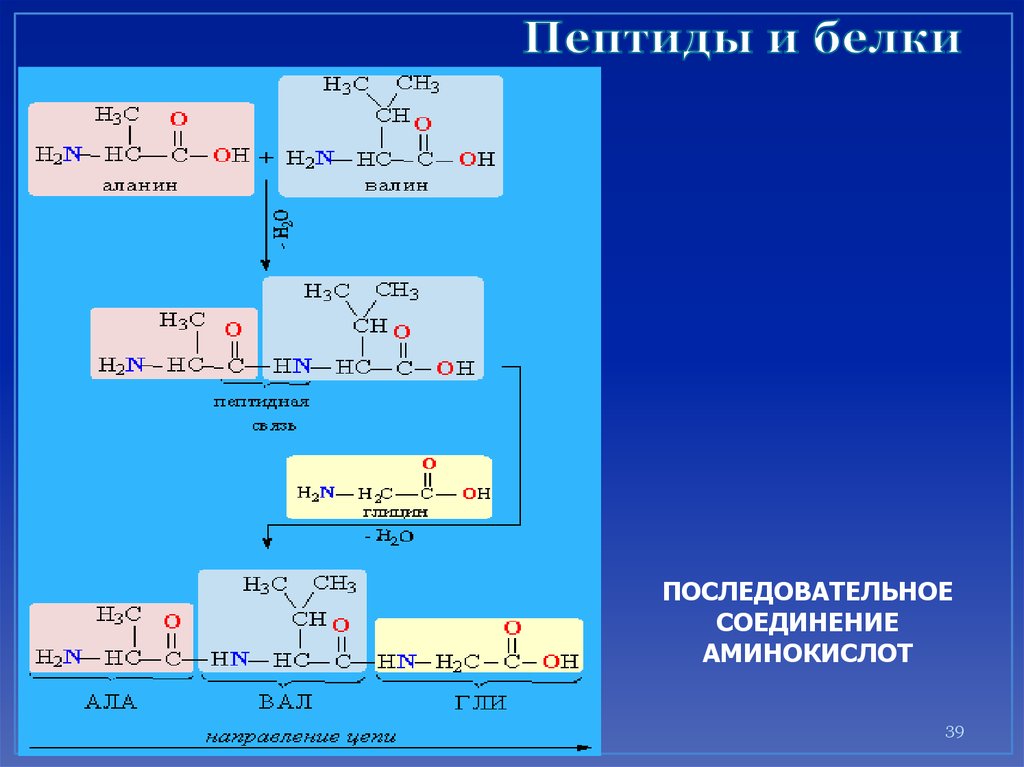
24. Межмолекулярное взаимодействие α-аминокислот приводит к образованию пептидов.
25. Из трех молекул α-аминокислот (глицин + аланин + глицин) образуется трипептид: H2N-CH2CO-NH-CH(CH3)-CO-NH-CH2COOH.
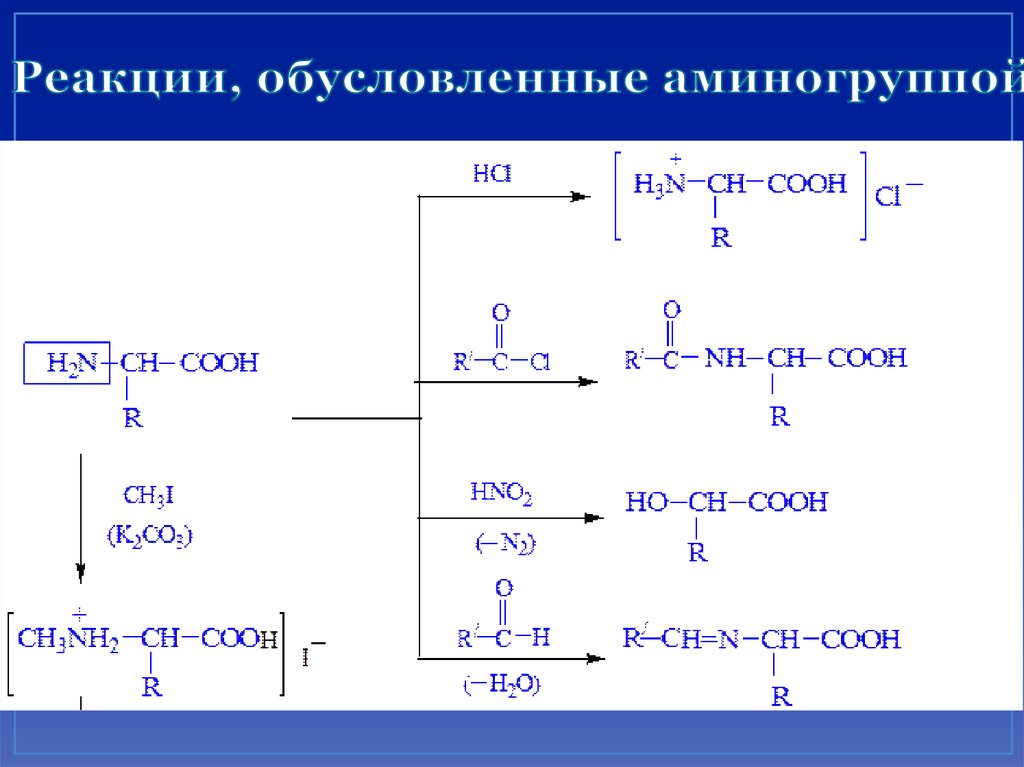
26. Реакции, обусловленные аминогруппой
27. Химические свойства аминокислот Реакции аминогруппы
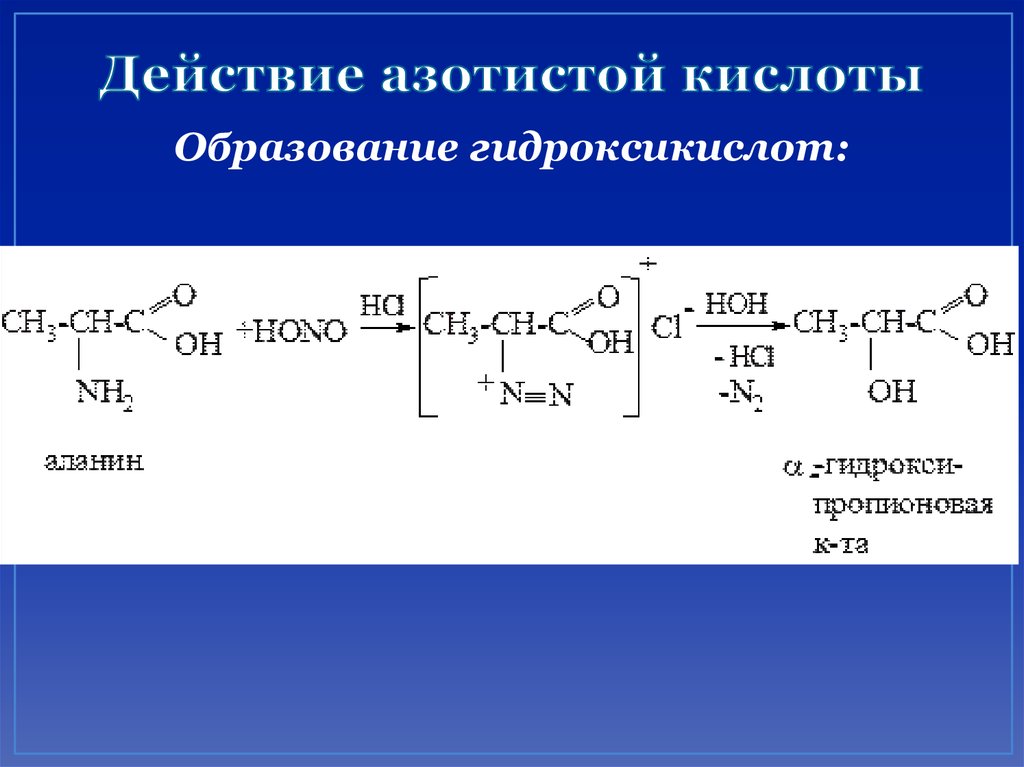
CH3CHCOOH + [HNO2]NH2
аланин
CH3CHCOOH + N2 + H2O
OH
молочная
кислота
Метод Ван-Слайка
27
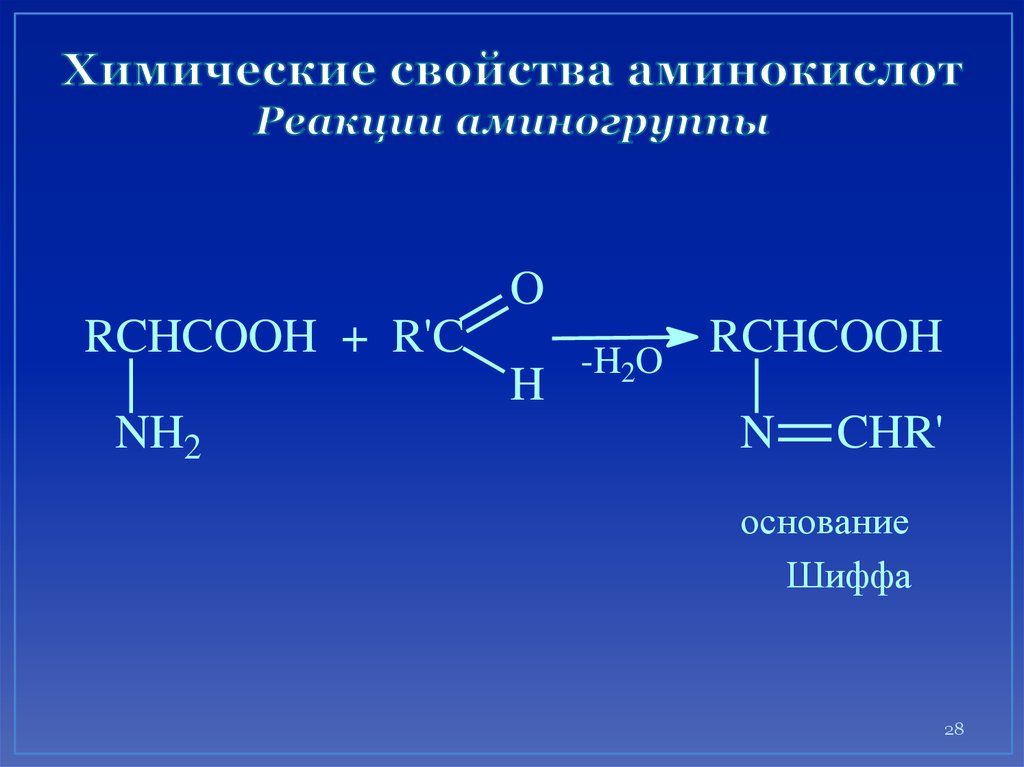
28. Химические свойства аминокислот Реакции аминогруппы
ORCHCOOH + R'C
H
NH2
RCHCOOH
-H2O
N
CHR'
основание
Шиффа
28
29. Реакции, обусловленные карбоксильной группой
30. Реакции декарбоксилирования
Декарбоксилирование α-аминокислот, содержащих вкачестве заместителя +NH3-группу, приводит к
образованию биогенных аминов. В живом организме
данный процесс протекает под действием фермента
декарбоксилазы и витамина пиридоксальфосфата.
При декарбоксилировании β-фенил-α-аланина, лизина,
серина и гистидина образуются, соответственно, фенамин, 1,5диаминопентан (кадаверин), 2-аминоэтанол-1 (коламин) и
триптамин.
31. Химические свойства аминокислот Реакции карбоксильной группы
HOCH2CHCOOHNH2
серин
HOOCCHCH2CH2COOH
NH2
HOCH2CH2NH2 + CO2
коламин
H2NCH2CH2CH2COOH + CO2
4-аминобутановая кислота
глутаминовая кислота
31
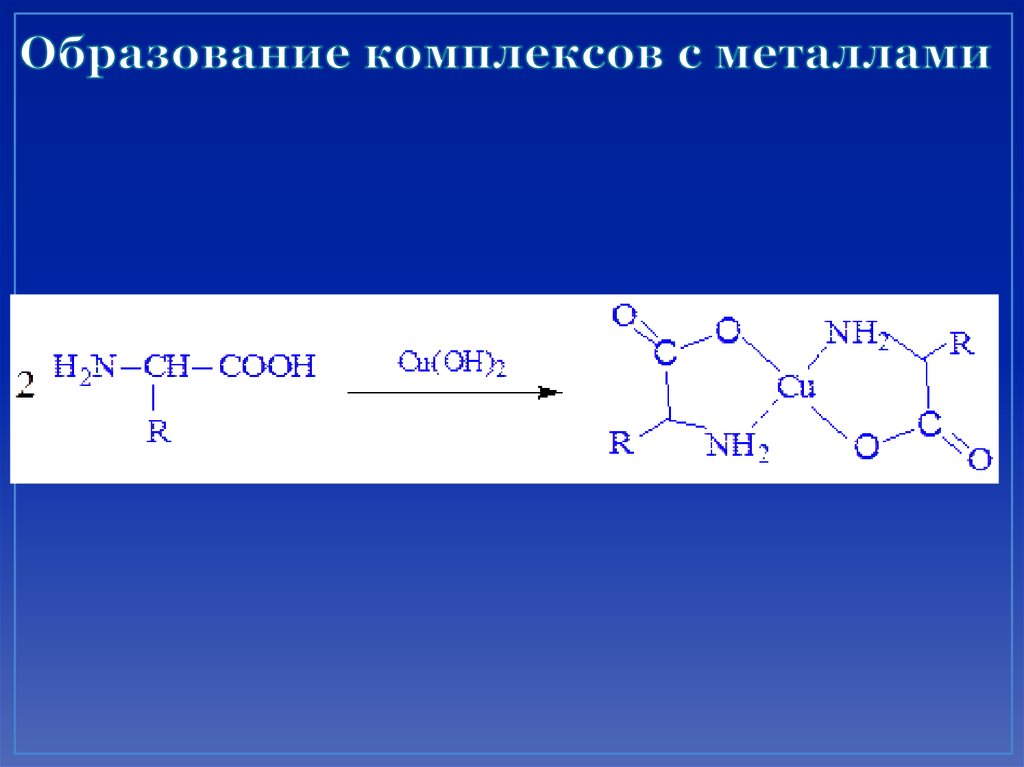
32. Образование комплексов с металлами
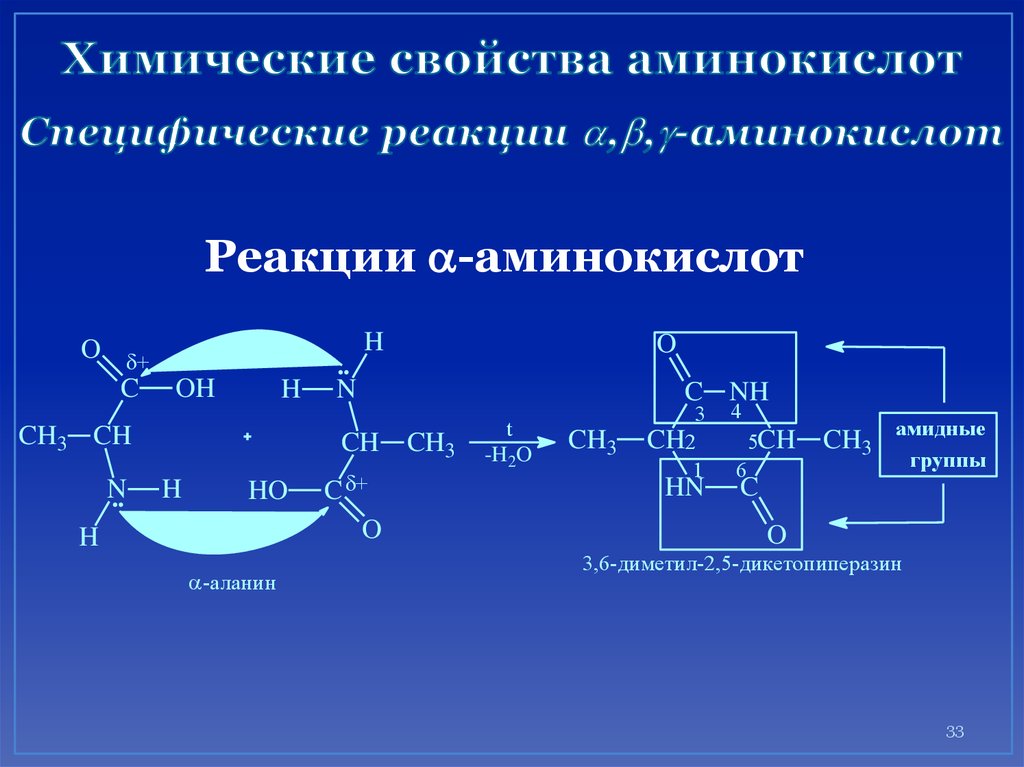
33. Химические свойства аминокислот Специфические реакции ,,-аминокислот
Реакции a-аминокислотH
O +
C OH
H
CH3 CH
N
N
CH CH3
H
HO
H
a-аланин
O
C +
O
C NH
t
-H2O
CH3
3
CH2
1
HN
4
5CH
6
CH3 амидные
группы
C
O
3,6-диметил-2,5-дикетопиперазин
33
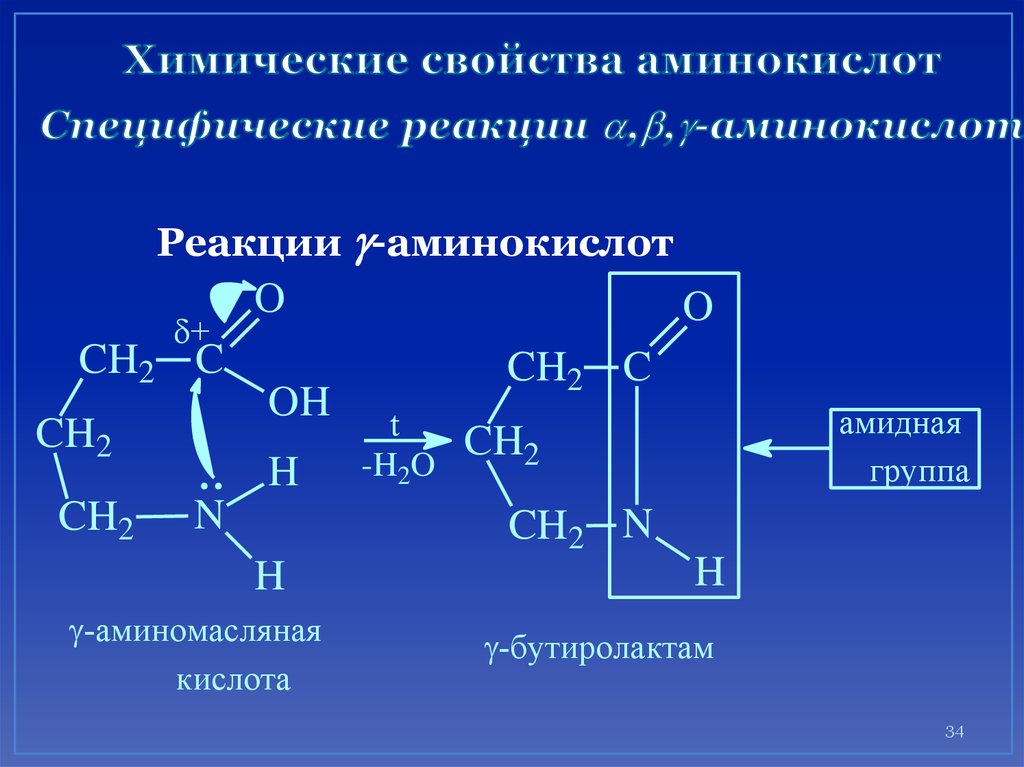
34. Химические свойства аминокислот Специфические реакции ,,-аминокислот
Реакции -аминокислот+
CH2 C
CH2
CH2
O
OH
H
N
O
CH2 C
t
-H2O
амидная
группа
CH2
CH2 N
H
-аминомасляная
кислота
H
-бутиролактам
34
35. Действие азотистой кислоты
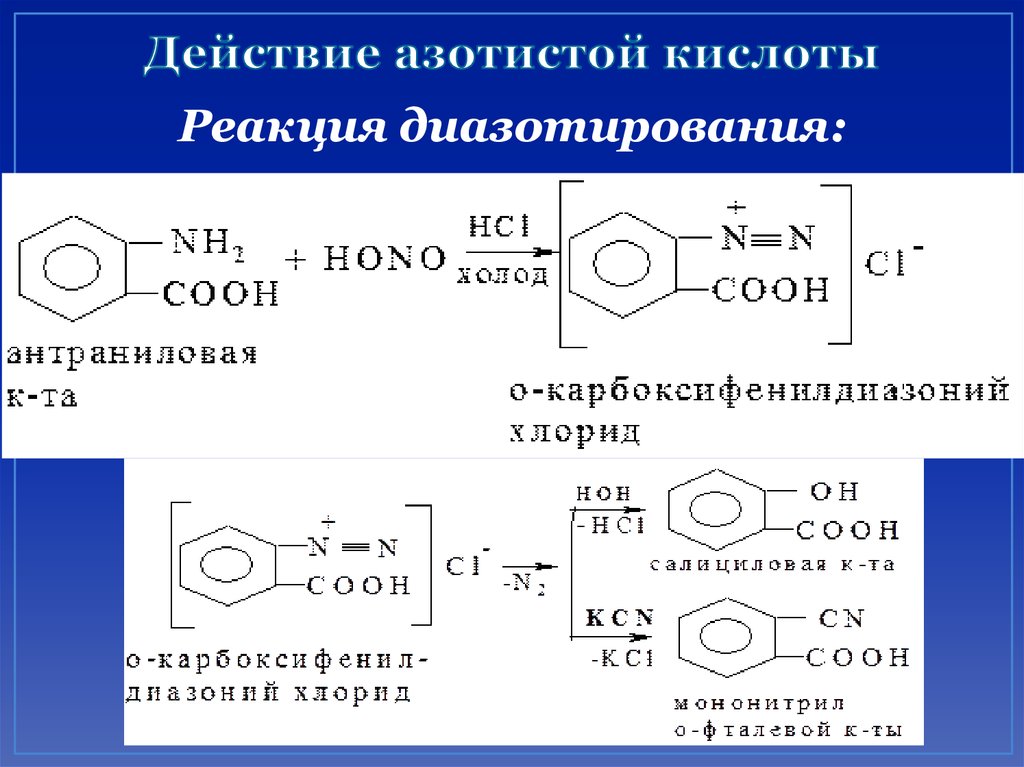
Образование гидроксикислот:36. Действие азотистой кислоты
Реакция диазотирования:37. лекция
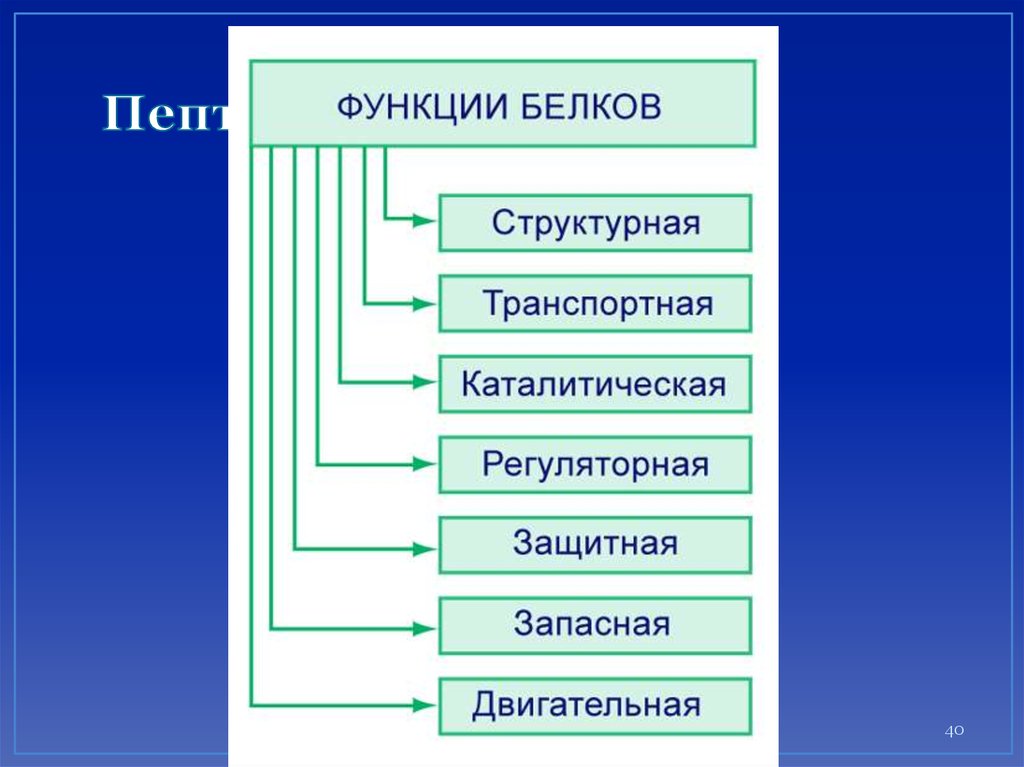
Пептиды и белки38. Белки (полипептиды) –
биополимеры, построенные из остатковα-аминокислот, соединенных
пептидными (амидными) связями.
39. Пептиды и белки
ПОСЛЕДОВАТЕЛЬНОЕСОЕДИНЕНИЕ
АМИНОКИСЛОТ
39
40. Пептиды и белки
4041. Выделяют четыре уровня структурной организации белков.
Первичная структура
Вторичная структура
Третичная структура
Четвертичная структура
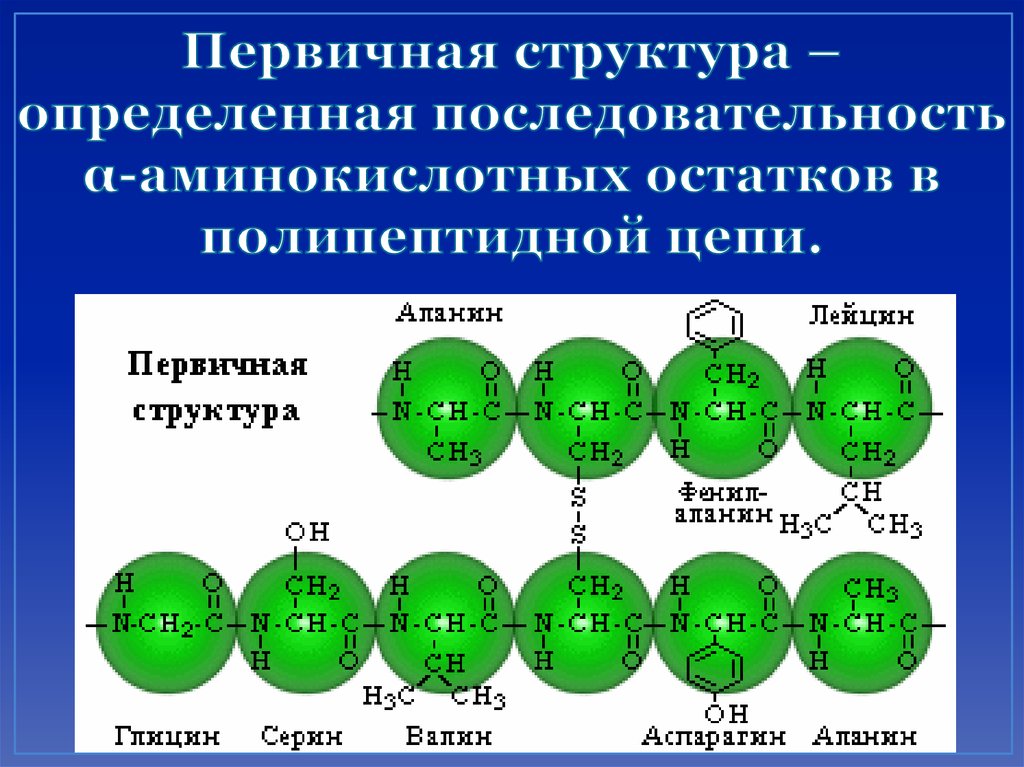
42. Первичная структура – определенная последовательность α-аминокислотных остатков в полипептидной цепи.
43. Пептиды и белки
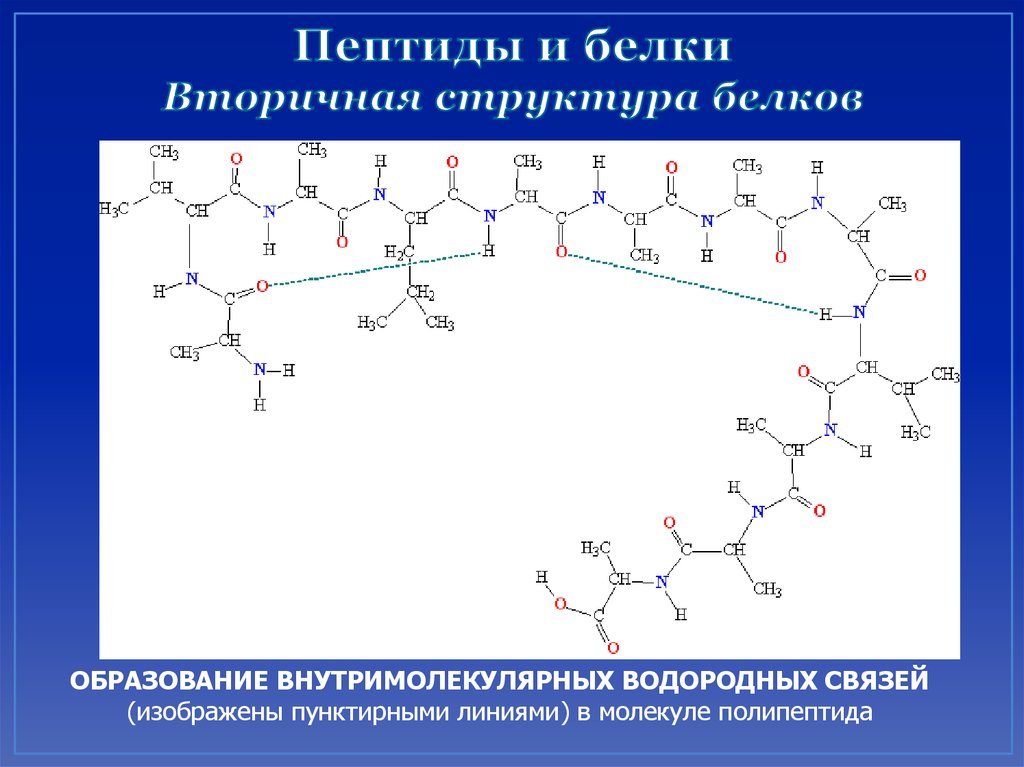
Первичная структура белка инсулина.44. Вторичная структура – конформация полипептидной цепи, закрепленная множеством водородных связей между группамиN–H и С=О. Одна
45. Пептиды и белки Вторичная структура белков
ОБРАЗОВАНИЕ ВНУТРИМОЛЕКУЛЯРНЫХ ВОДОРОДНЫХ СВЯЗЕЙ(изображены пунктирными линиями) в молекуле полипептида
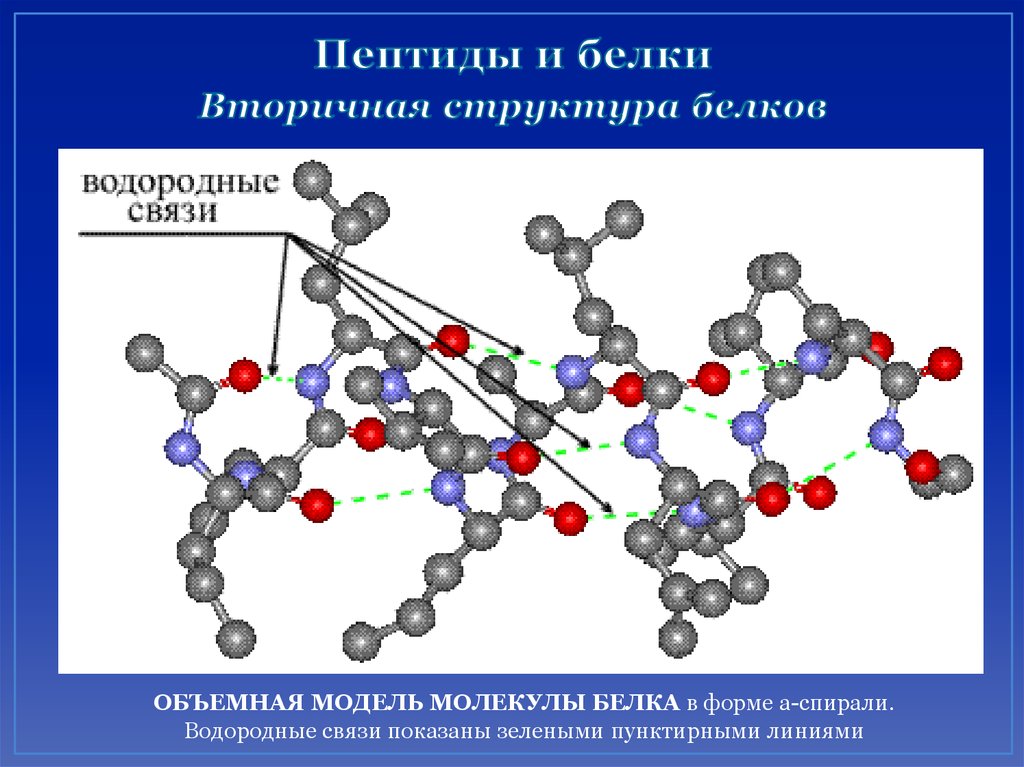
46. Пептиды и белки Вторичная структура белков
ОБЪЕМНАЯ МОДЕЛЬ МОЛЕКУЛЫ БЕЛКА в форме a-спирали.Водородные связи показаны зелеными пунктирными линиями
47. Пептиды и белки Вторичная структура белков
α-спиральмолекулы белка
47
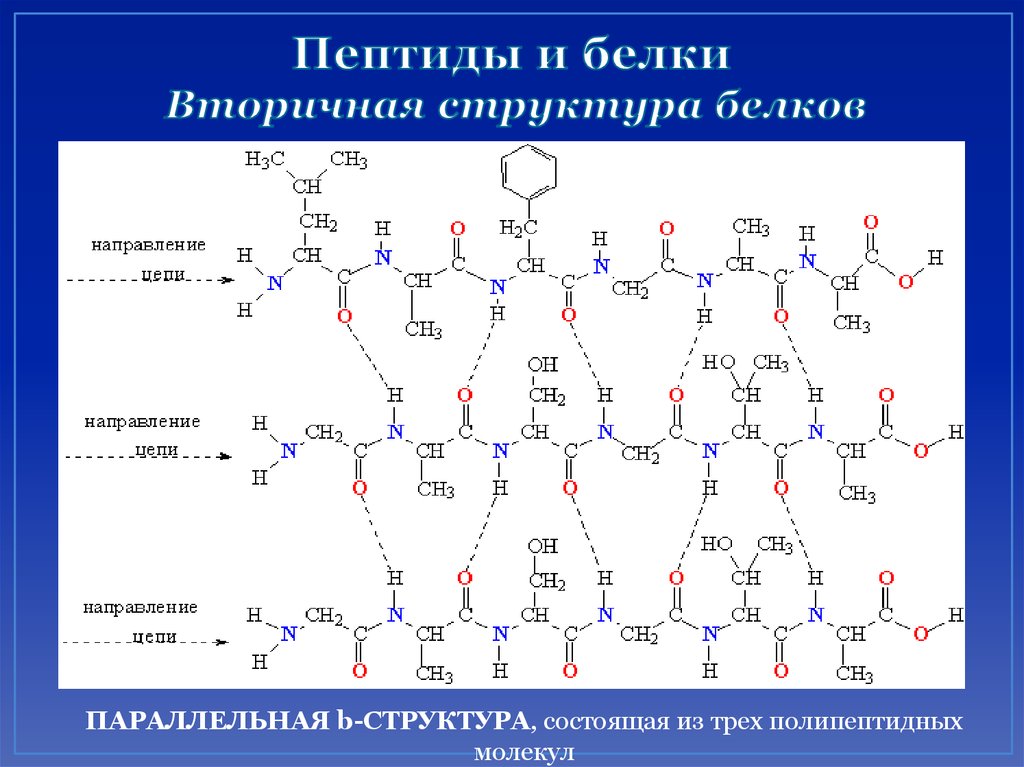
48. Пептиды и белки Вторичная структура белков
ПАРАЛЛЕЛЬНАЯ b-СТРУКТУРА, состоящая из трех полипептидныхмолекул
49. Пептиды и белки Вторичная структура белков
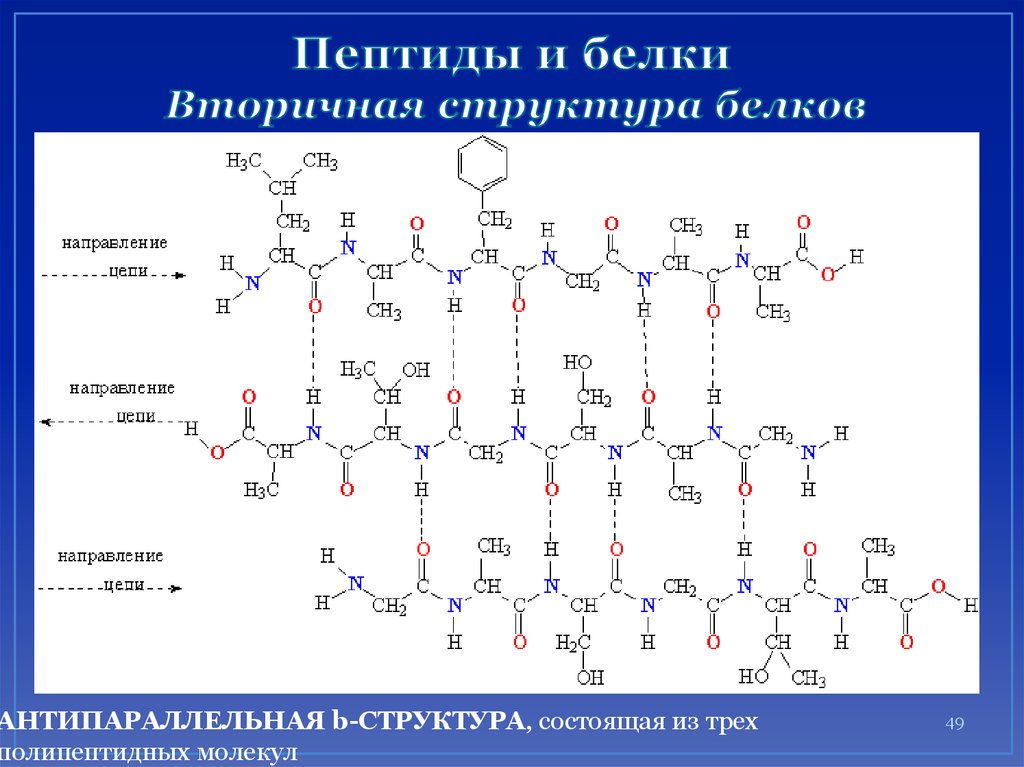
АНТИПАРАЛЛЕЛЬНАЯ b-СТРУКТУРА, состоящая из трехполипептидных молекул
49
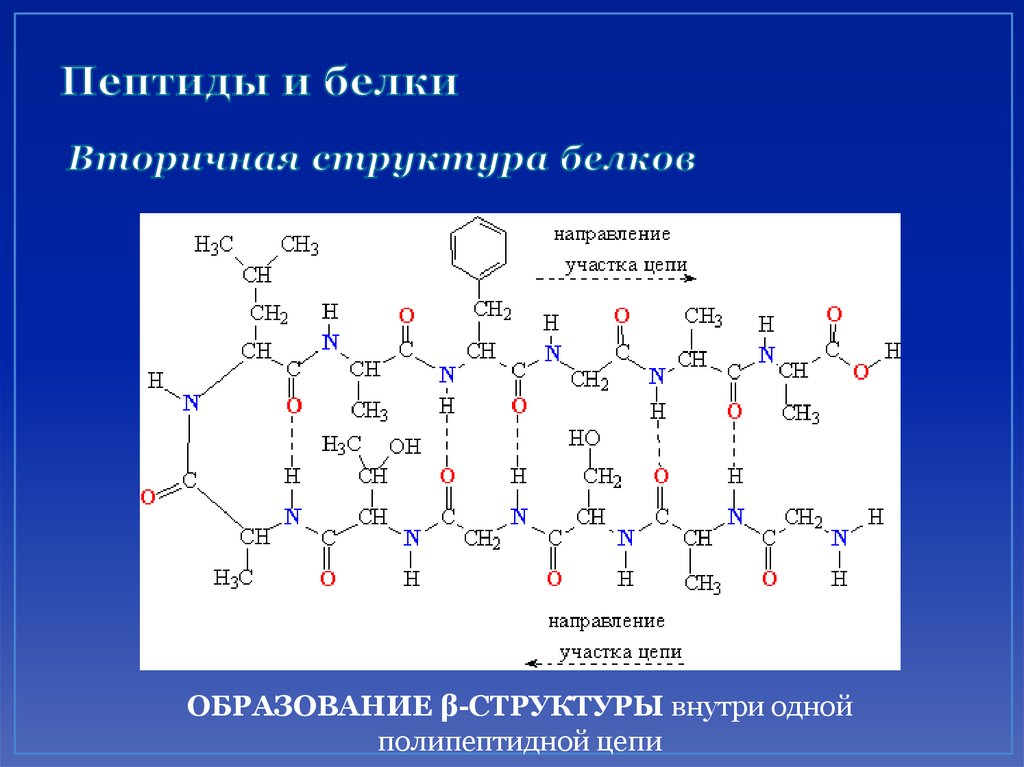
50. Пептиды и белки Вторичная структура белков
ОБРАЗОВАНИЕ β-СТРУКТУРЫ внутри однойполипептидной цепи
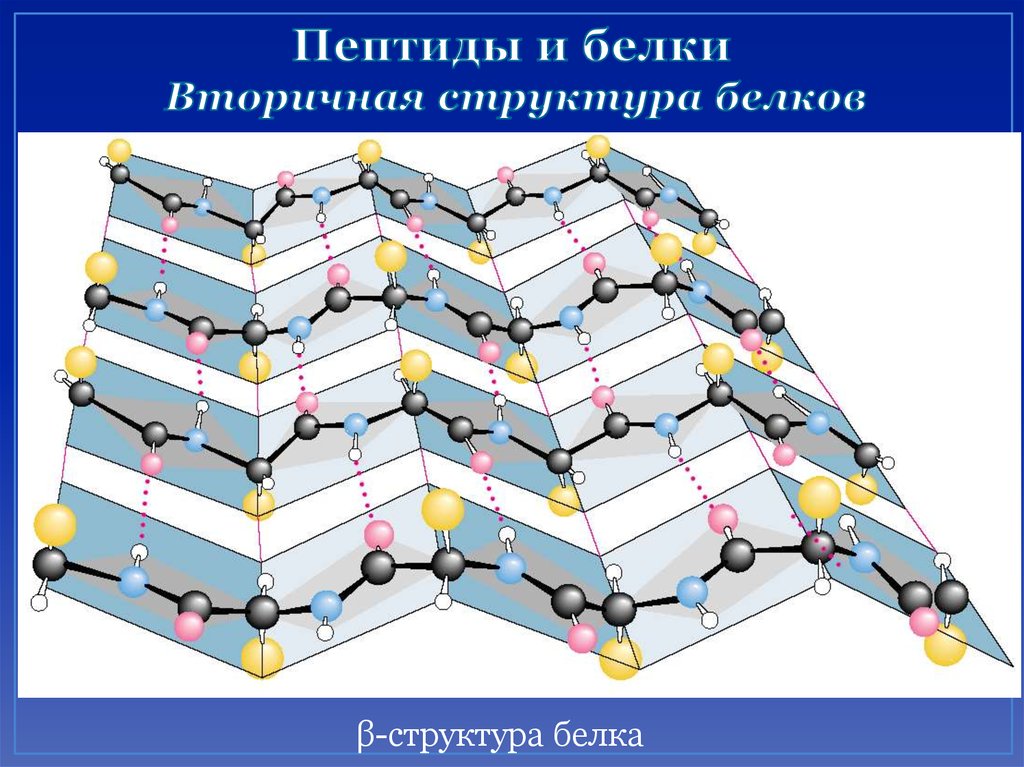
51. Пептиды и белки Вторичная структура белков
β-структура белка52. Третичная структура – форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков
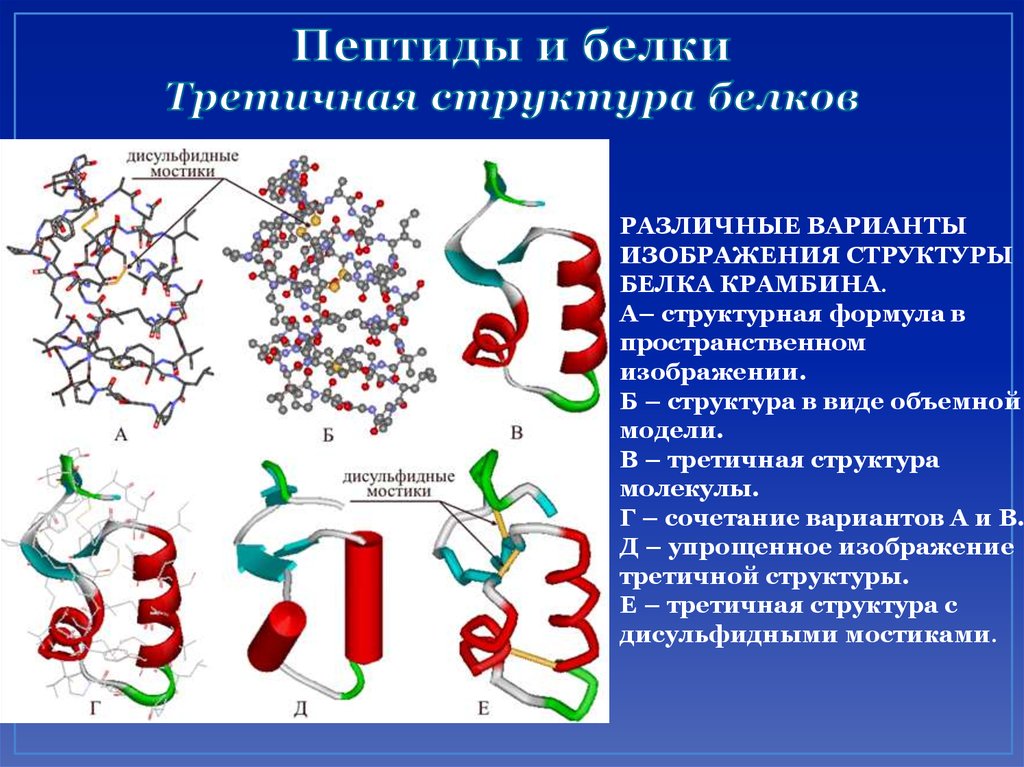
53. Пептиды и белки Третичная структура белков
РАЗЛИЧНЫЕ ВАРИАНТЫИЗОБРАЖЕНИЯ СТРУКТУРЫ
БЕЛКА КРАМБИНА.
А– структурная формула в
пространственном
изображении.
Б – структура в виде объемной
модели.
В – третичная структура
молекулы.
Г – сочетание вариантов А и В.
Д – упрощенное изображение
третичной структуры.
Е – третичная структура с
дисульфидными мостиками.
54. Пептиды и белки Глобулярные белки
ГЛОБУЛЯРНАЯСТРУКТУРА АЛЬБУМИНА
(белок куриного яйца). В
структуре помимо
дисульфидных мостиков
присутствуют свободные
сульфгидридные HSгруппы цистеина, которые
в процессе разложения
белка легко образуют
сероводород – источник
запаха тухлых яиц.
Дисульфидные мостики
намного более устойчивы и
при разложении белка
сероводород не образуют
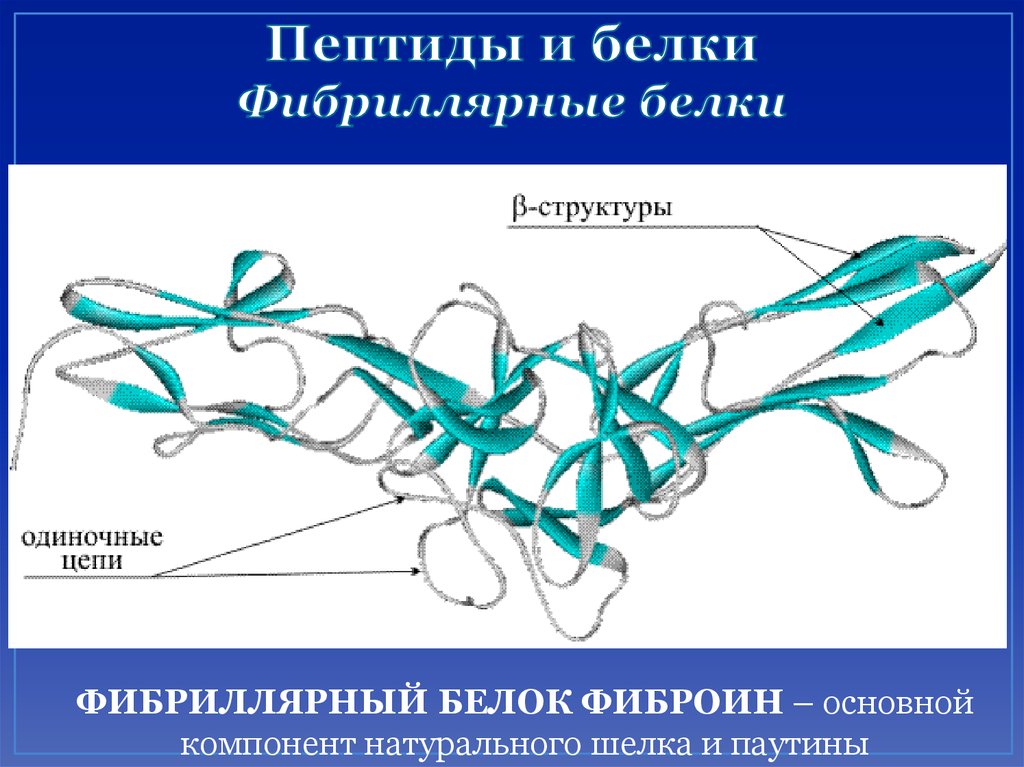
55. Пептиды и белки Фибриллярные белки
ФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН – основнойкомпонент натурального шелка и паутины
56. Четвертичная структура – агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия
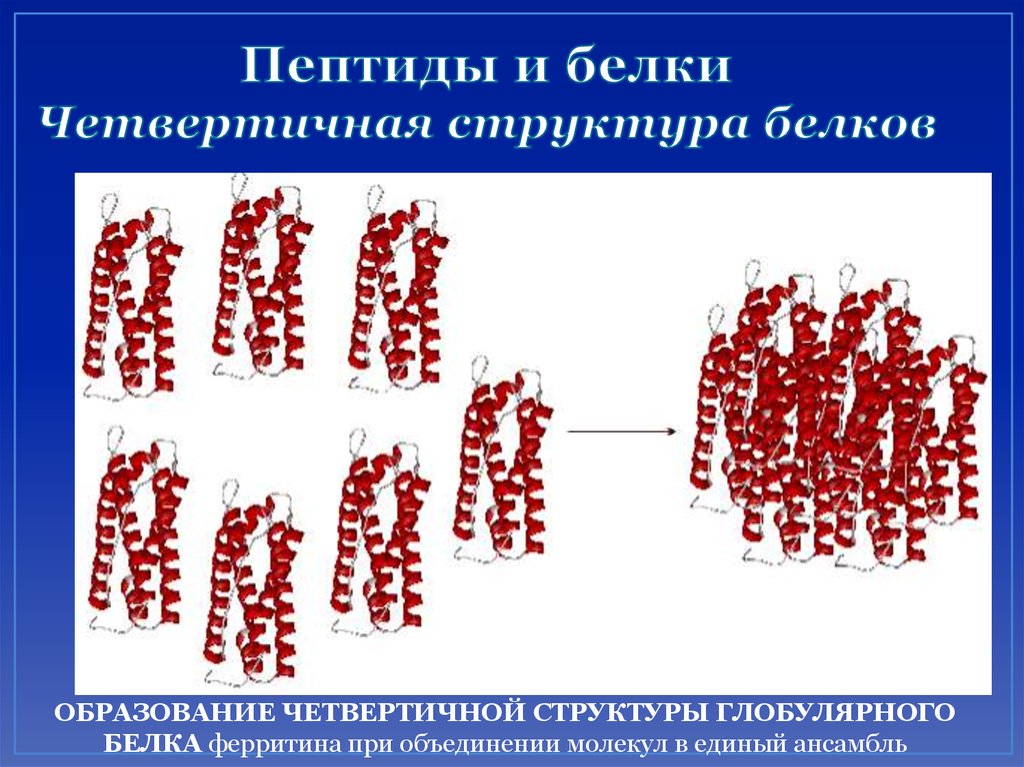
57. Пептиды и белки Четвертичная структура белков
ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ ГЛОБУЛЯРНОГОБЕЛКА ферритина при объединении молекул в единый ансамбль
58. Пептиды и белки Четвертичная структура белков
НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА
ФИБРИЛЛЯРНОГО
БЕЛКА
КОЛЛАГЕНА. На
примере коллагена
можно видеть, что в
образовании
фибриллярных белков
могут участвовать как
a-спирали, так и bструктуры. То же и для
глобулярных белков, в
них могут быть оба
типа третичных
структур
58
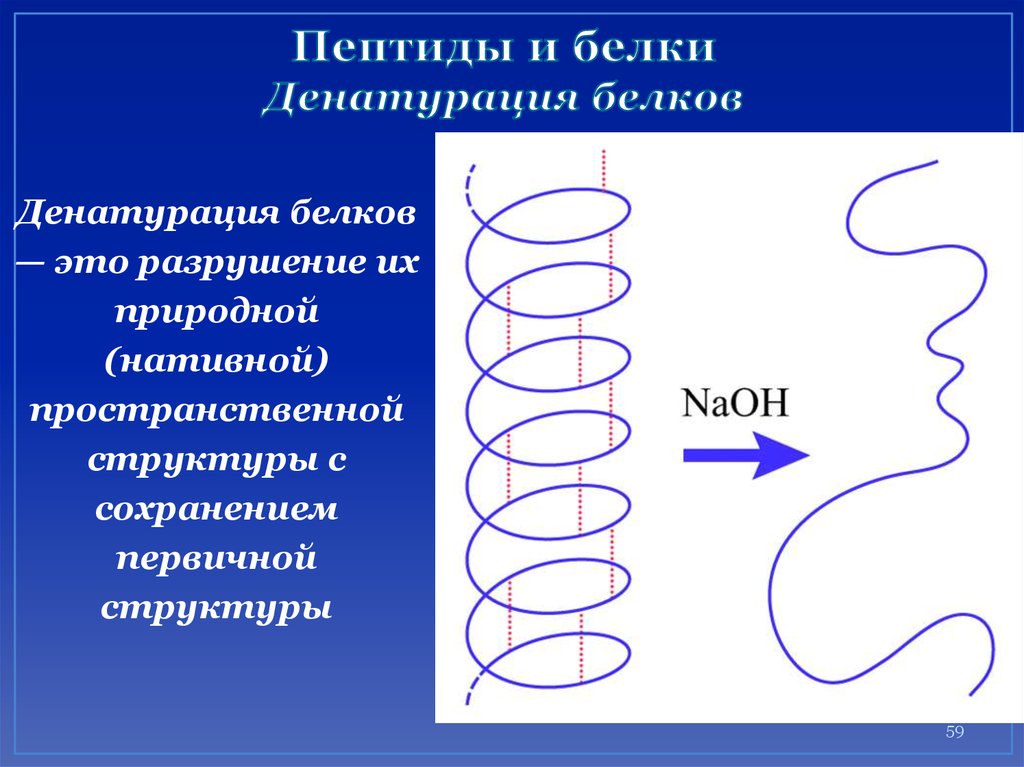
59. Пептиды и белки Денатурация белков
Денатурация белков— это разрушение их
природной
(нативной)
пространственной
структуры с
сохранением
первичной
структуры
59
60. Цветные реакции белков
Качественные реакции на остаткиаминокислот
61. Указатель реакций
• Биуретоваяa) Уравнение реакции
b) Проведение опыта
• Нингидриновая
• Ксантопротеиновая
a) Уравнение реакции
b) Проведение опыта
• Миллона
• Гопкинса-Коле
• Диазореакция Паули
62. Функция качественных реакций
• Для аминокислот, постоянно встречающихся всоставе белков, разработано множество цветных
(в том числе именных) реакций. Многие из них
высокоспецифичны, что позволяет определять
ничтожные количества той или иной
аминокислоты.
• Надо помнить, что все качественные реакции –
это реакции не собственно на белки, а на
определенные аминокислоты, входящие в их
состав.
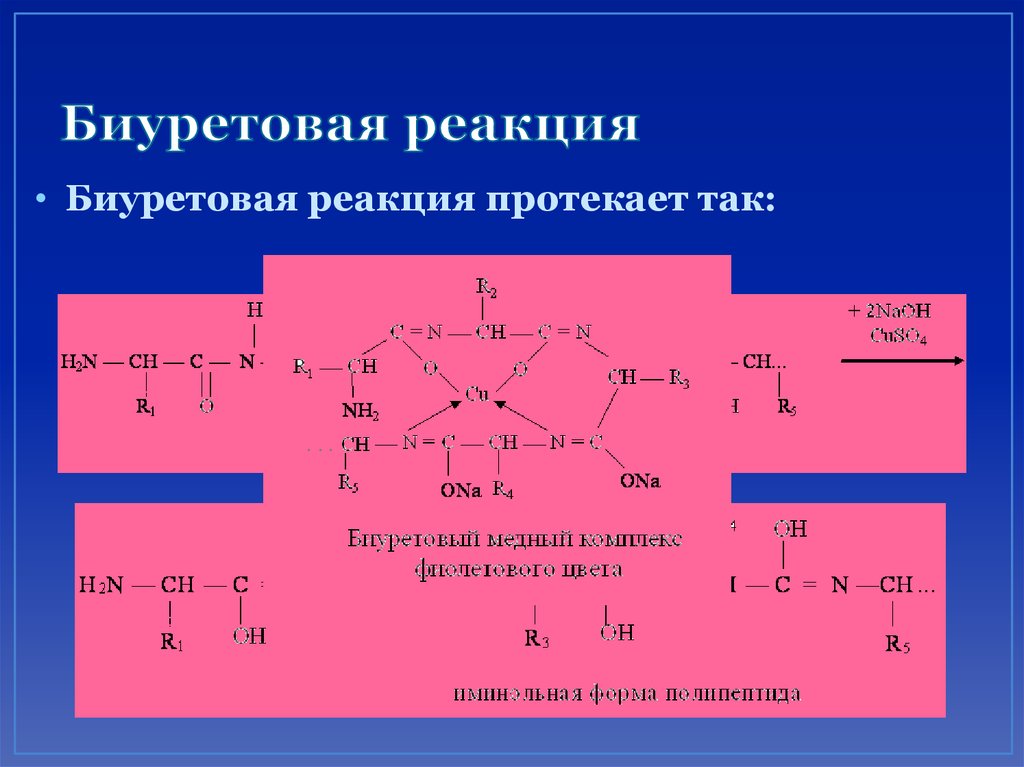
63. Биуретовая реакция
• Определяет наличие пептидной связи врастворе исследуемого соединения.
пептидная связь
64. Биуретовая реакция
• Реакция обусловлена образованием биуретовогокомплекса в результате соединения меди с
пептидной группировкой белка.
• В пептидах и белках пептидная связь обычно
находится в амидной форме (или кетоформе), но в
щелочной среде она переходит в иминольную
(енольную):
65. Биуретовая реакция
• Биуретовая реакция протекает так:+CuSO
+NaOH
4
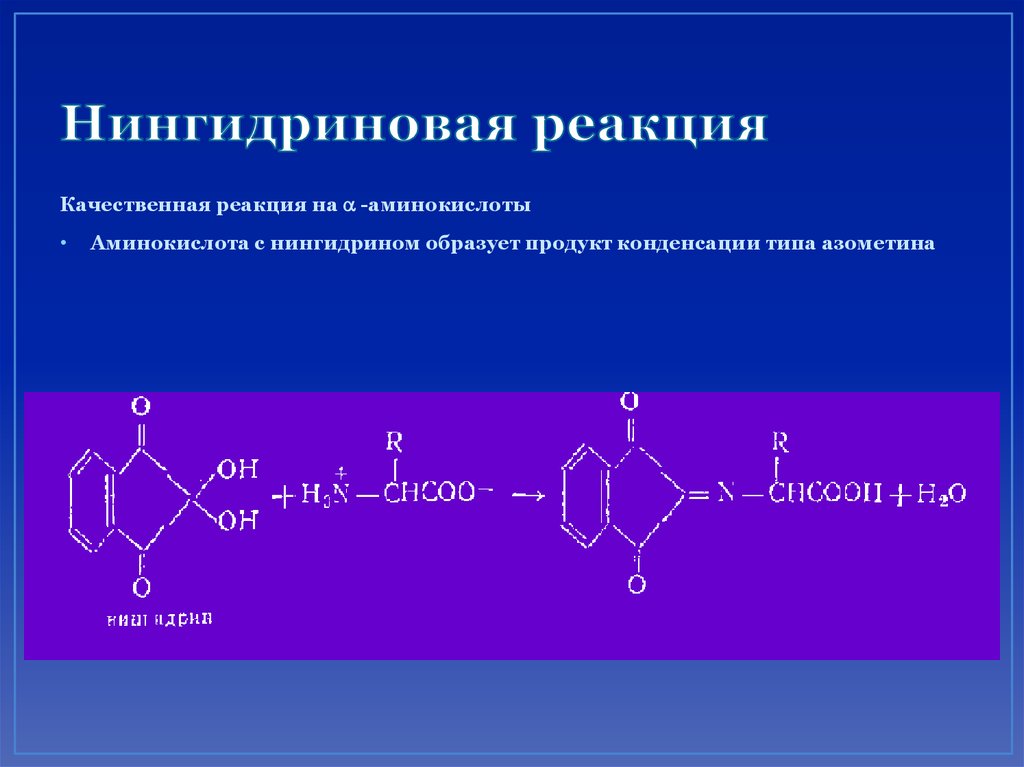
66. Нингидриновая реакция
Качественная реакция на a -аминокислотыАминокислота с нингидрином образует продукт конденсации типа азометина
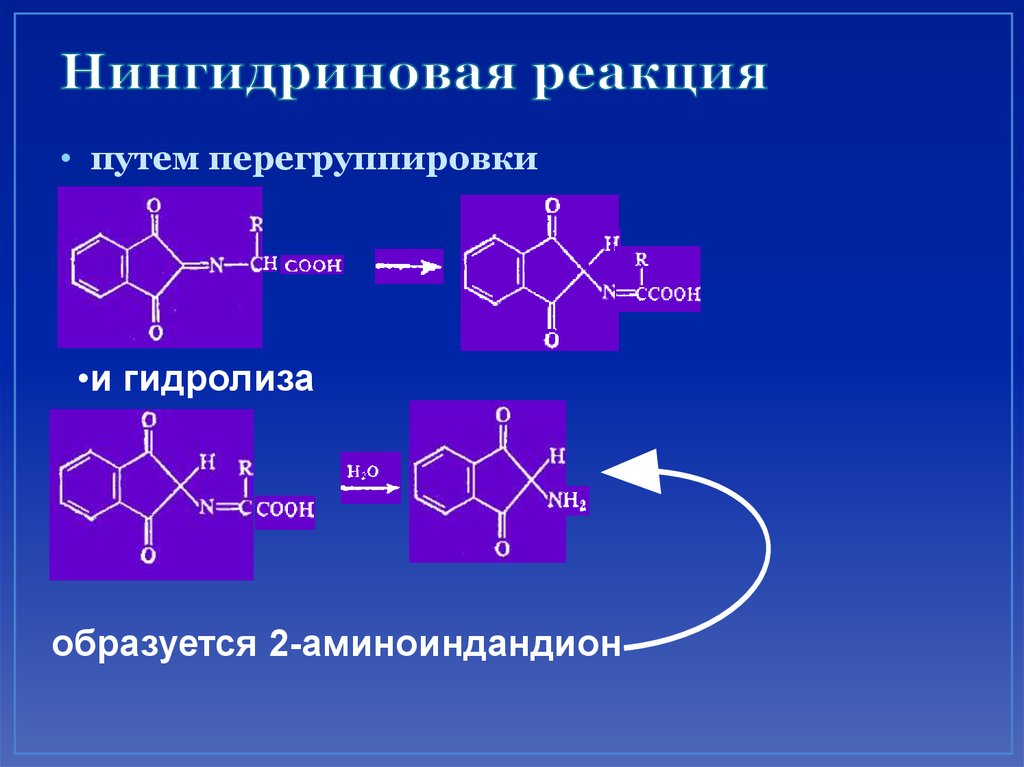
67. Нингидриновая реакция
• путем перегруппировки•и гидролиза
образуется 2-аминоиндандион
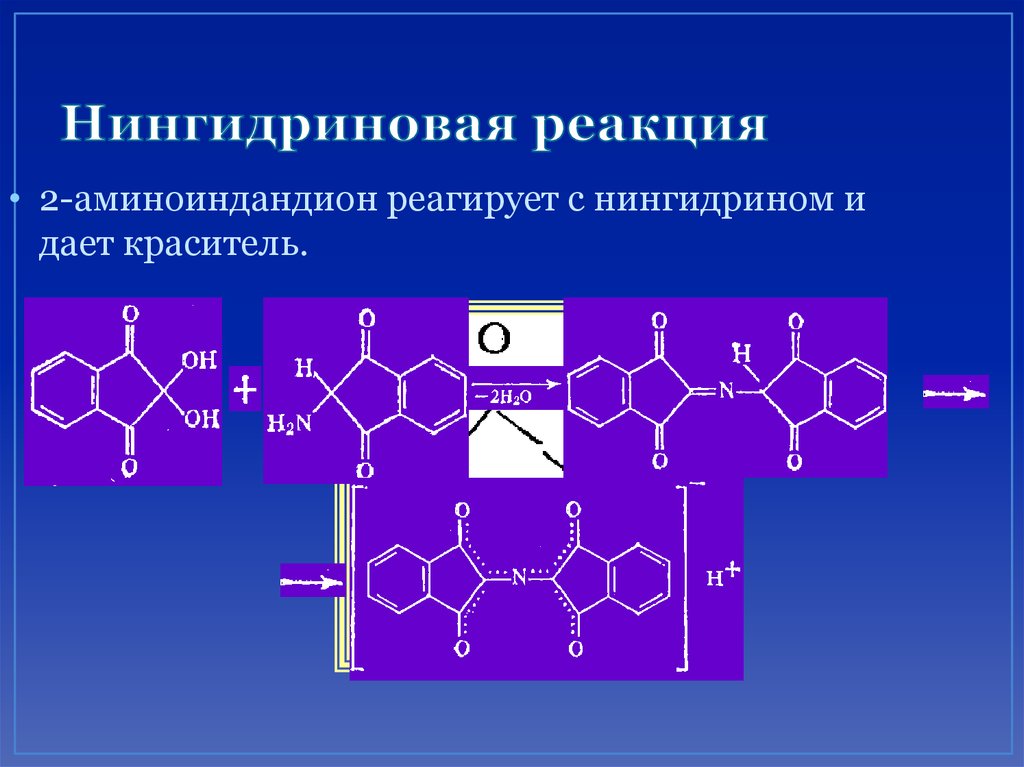
68. Нингидриновая реакция
• 2-аминоиндандион реагирует с нингидрином идает краситель.
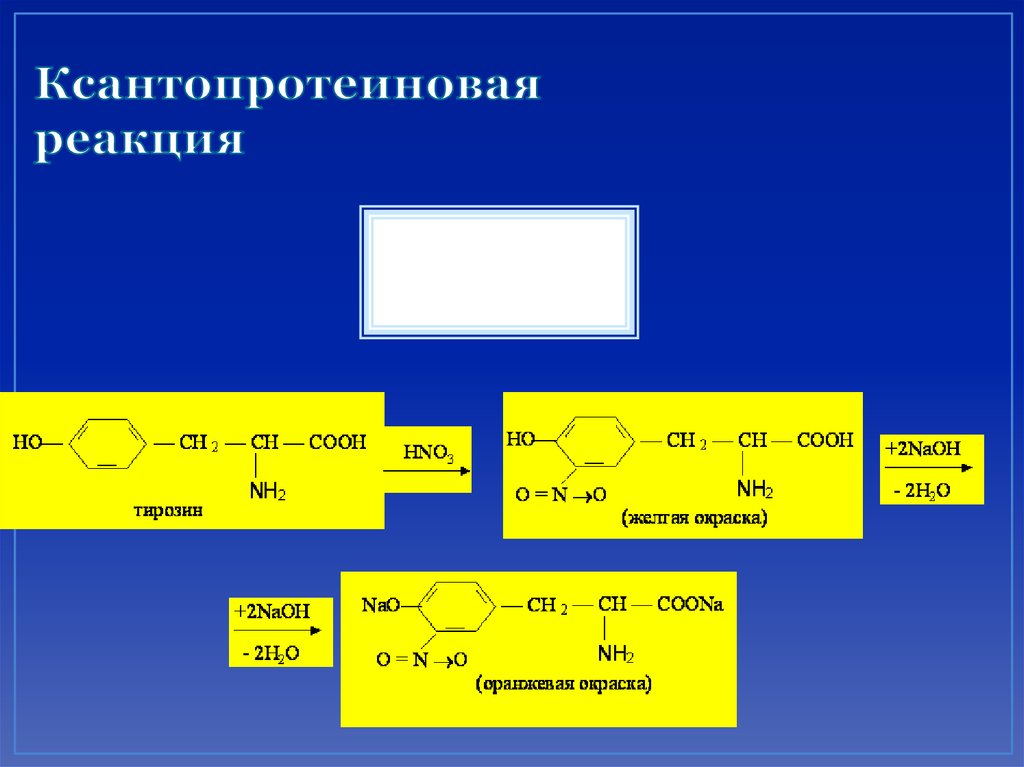
69. Ксантопротеиновая реакция
Определяет присутствие в белкеароматических и гетероциклических a аминокислот :
• триптофана,
• фенилаланина,
• тирозина,
• гистидина.
70. Ксантопротеиновая реакция
+HNO371. Реакция Миллона
• Это реакция нааминокислоту
тирозин
72. Реакция Миллона
• Реактив Миллона (раствор HgNO3 и Hg(NO2)2 вразбавленной HNO3, содержащей примесь HNO2)
взаимодействует с тирозином с образованием
ртутной соли нитропроизводного
тирозина,
3
окрашенной в розовато-красный цвет:
+HgNO
+Hg(NO2)2
+HNO3
+HNO2
73. Рекомендации к проведению опыта
• Эта реакцияопределяет
аминокислоту
триптофан.
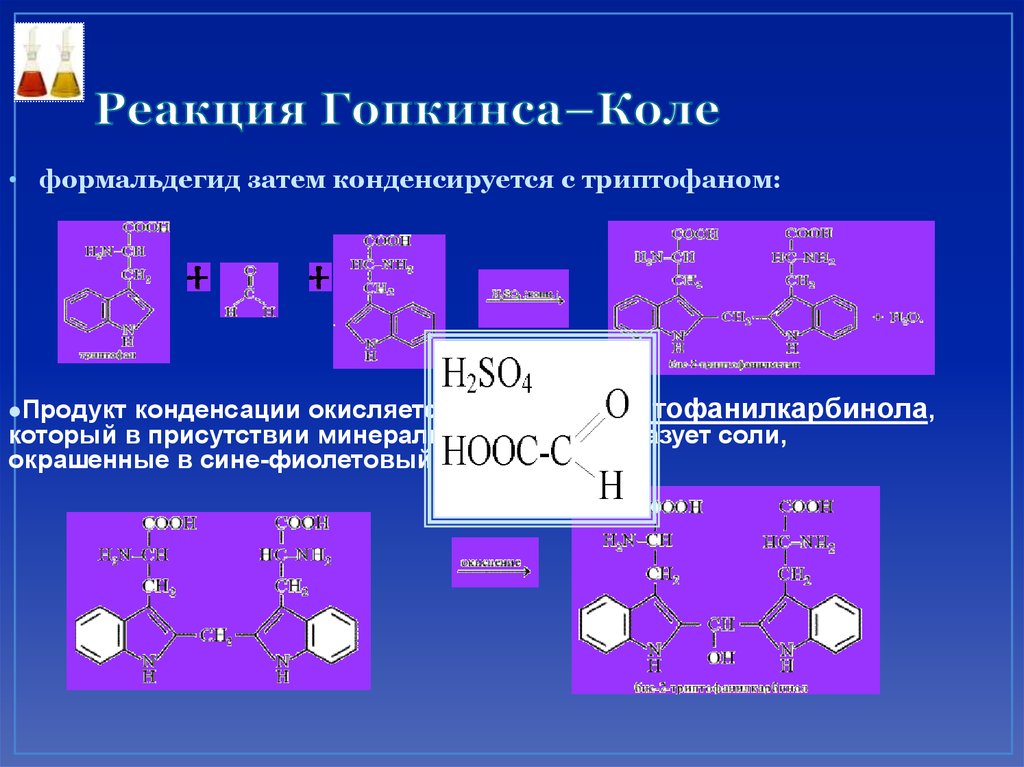
74. Реакция Гопкинса–Коле
• Из глиоксиловой кислоты под действиемконцентрированной серной кислоты сначала
получается формальдегид:
СО2
75. Реакция Гопкинса–Коле
• формальдегид затем конденсируется с триптофаном:конденсации окисляется до бис-2-триптофанилкарбинола,
который в присутствии минеральных кислот образует соли,
окрашенные в сине-фиолетовый цвет:
Продукт
76. Реакция Гопкинса–Коле
Эта реакцияаминокислоту
гистидин.
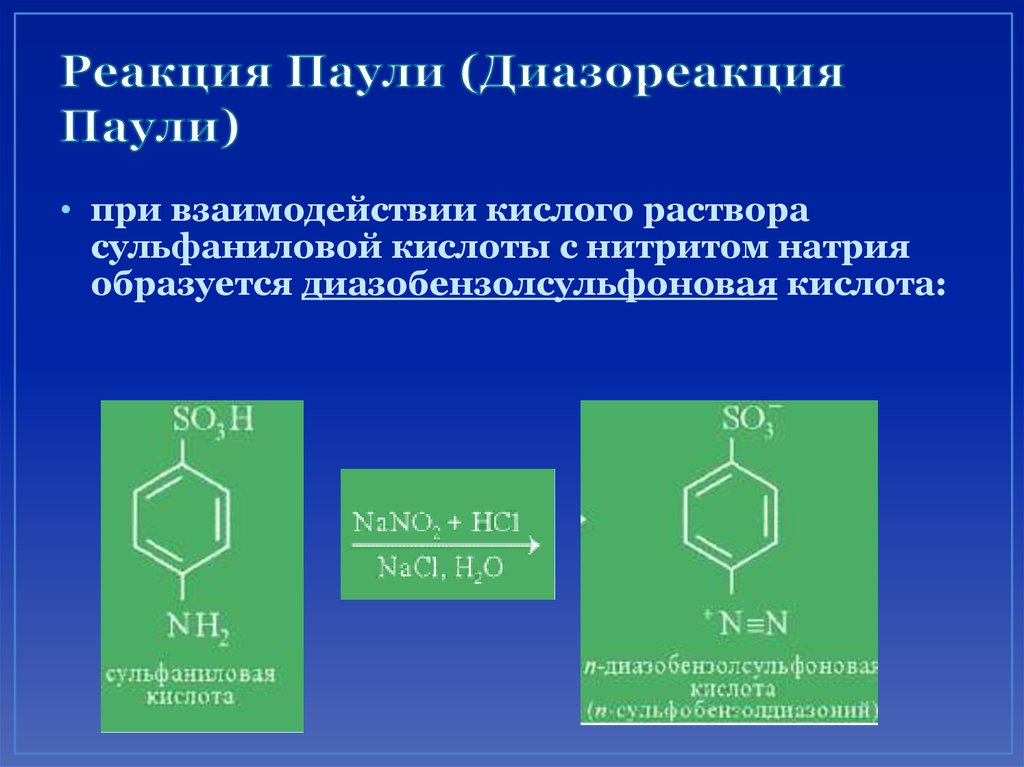
77. Реакция Паули (Диазореакция Паули)
• при взаимодействии кислого растворасульфаниловой кислоты с нитритом натрия
образуется диазобензолсульфоновая кислота:












































 chemistry
chemistry








