Similar presentations:
Кислородсодержащие классы органических соединений. Гидроксисоединения. Карбонильные соединения. (Лекция 3)
1.
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯАКАДЕМИЯ
КАФЕДРА ХИМИИ
БИООРГАНИЧЕСКАЯ ХИМИЯ
Лекция 3
Кислородсодержащие классы
органических соединений.
Гидроксисоединения.
Карбонильные соединения
Лектор: доктор биологических наук, профессор, зав.
кафедрой химии Степанова Ирина Петровна
2.
ЦЕЛИ ЛЕКЦИИОБУЧАЮЩАЯ: сформировать знания о
строении, номенклатуре и реакционной
способности спиртов, фенолов и
карбонильных соединений.
РАЗВИВАЮЩАЯ: расширить кругозор
обучающихся на основе интеграции знаний,
развить логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать
формированию у обучающихся устойчивого
интереса к изучению дисциплины.
3.
ПЛАН ЛЕКЦИИ• Спирты
• Фенолы
• Альдегиды и кетоны
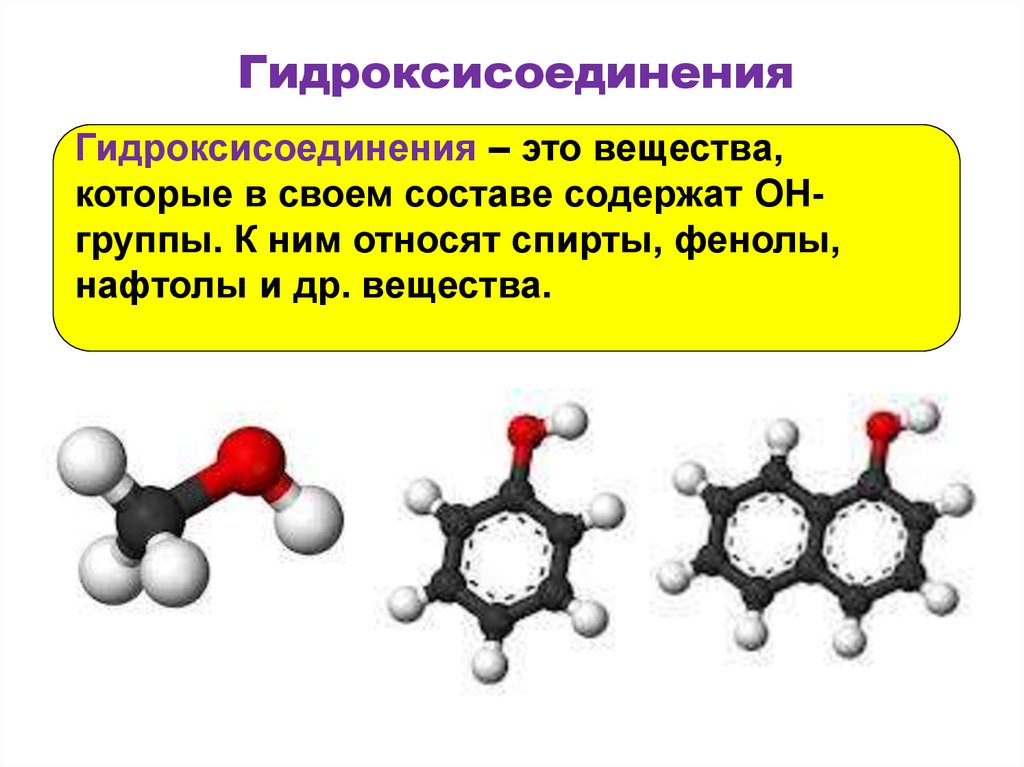
4. Гидроксисоединения
Гидроксисоединения – это вещества,которые в своем составе содержат OHгруппы. К ним относят спирты, фенолы,
нафтолы и др. вещества.
5. Спирты
Спирты – это гидроксисоединения, вмолекулах которых OH-группы связаны с
насыщенным атомом углерода,
3
находящимся в состоянии sp-гибридизации.
Общая формула R-OH.
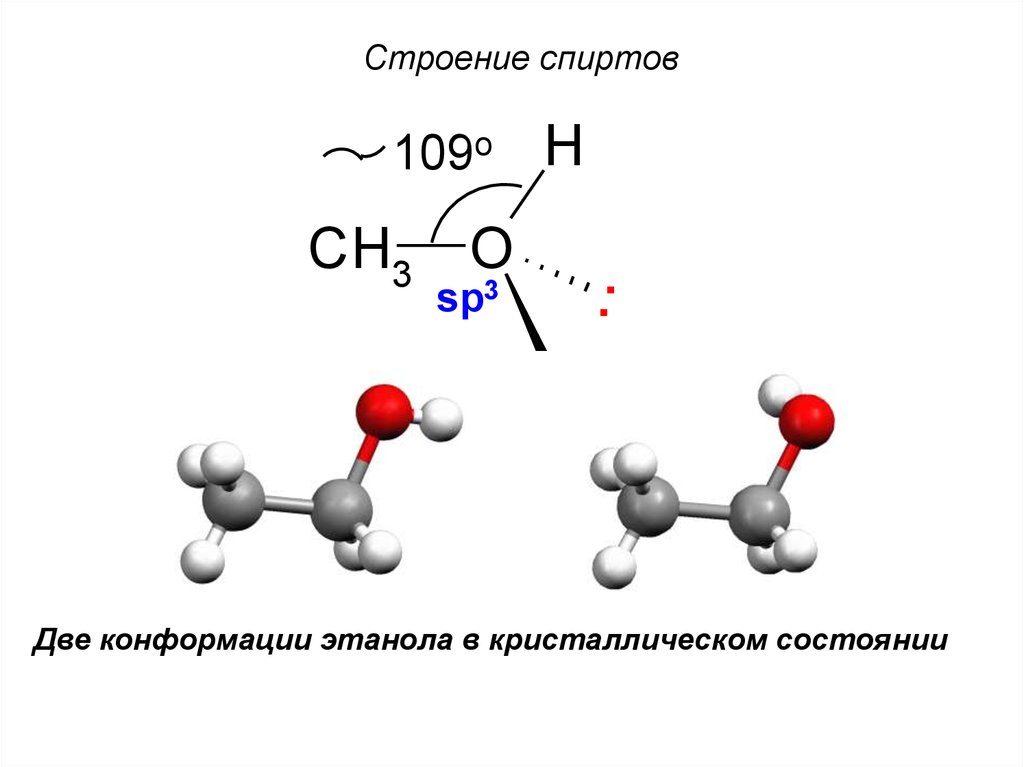
6. Строение спиртов
109oCH3
H
O
sp3
..
..
Две конформации этанола в кристаллическом состоянии
7. Классификация спиртов
I. По числу OH-групп различают:a) одноатомные спирты
CH3-CH2-OH
CH2-OH
этанол (используется как
антисептическое средство и
растворитель)
бензиловый спирт (используется
для приготовления препаратов,
используемых при лечении кожных
и инфекционных заболеваниях)
8. Спирты
b) многоатомные спирты (содержат 2 иболее гидроксильные группы)
CH2-OH
CH-OH
Диольный
фрагмент
Глицерин (является
структурным
компонентом липидов)
CH2-OH
CH2 - OH
CH - OH
HO - CH
CH - OH
CH -OH
CH2 - OH
Сорбит (используется в
качестве
заменителя сахара)
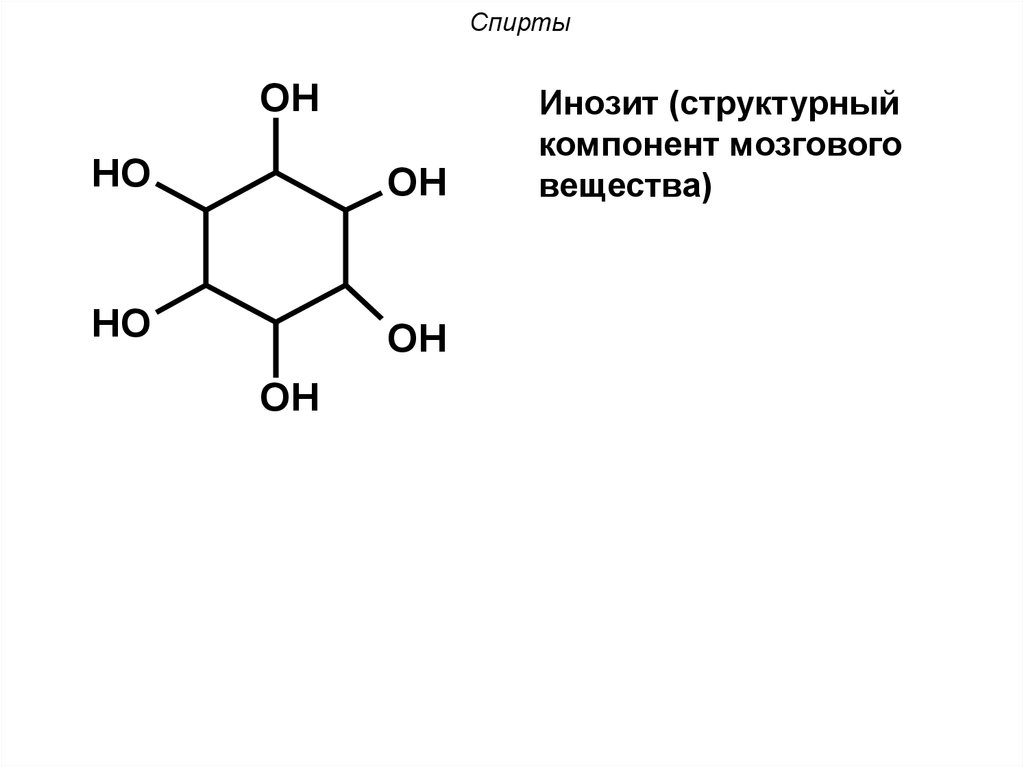
9. Спирты
OHHO
OH
HO
OH
OH
Инозит (структурный
компонент мозгового
вещества)
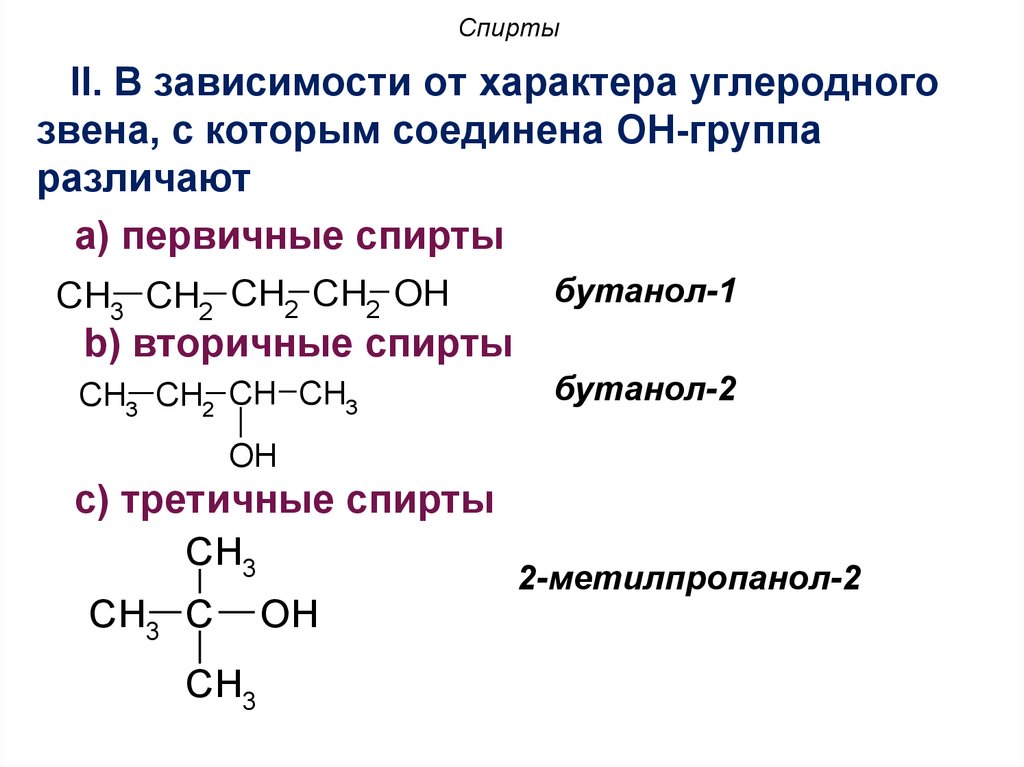
10. Спирты
II. В зависимости от характера углеродногозвена, с которым соединена OH-группа
различают
a) первичные спирты
CH3 CH2 CH2 CH2 OH
бутанол-1
b) вторичные спирты
CH3 CH2 CH CH3
бутанол-2
OH
с) третичные спирты
CH3
CH3 C
CH3
OH
2-метилпропанол-2
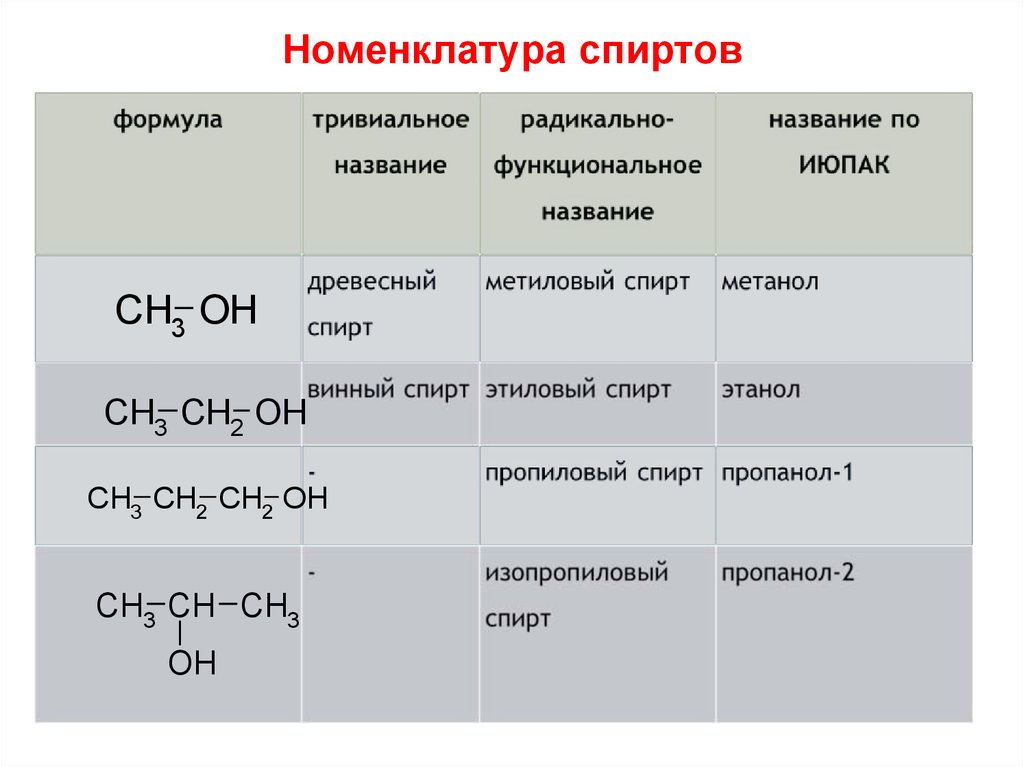
11. Номенклатура спиртов
CH3 OHCH3 CH2 OH
CH3 CH2 CH2 OH
CH3 CH CH3
OH
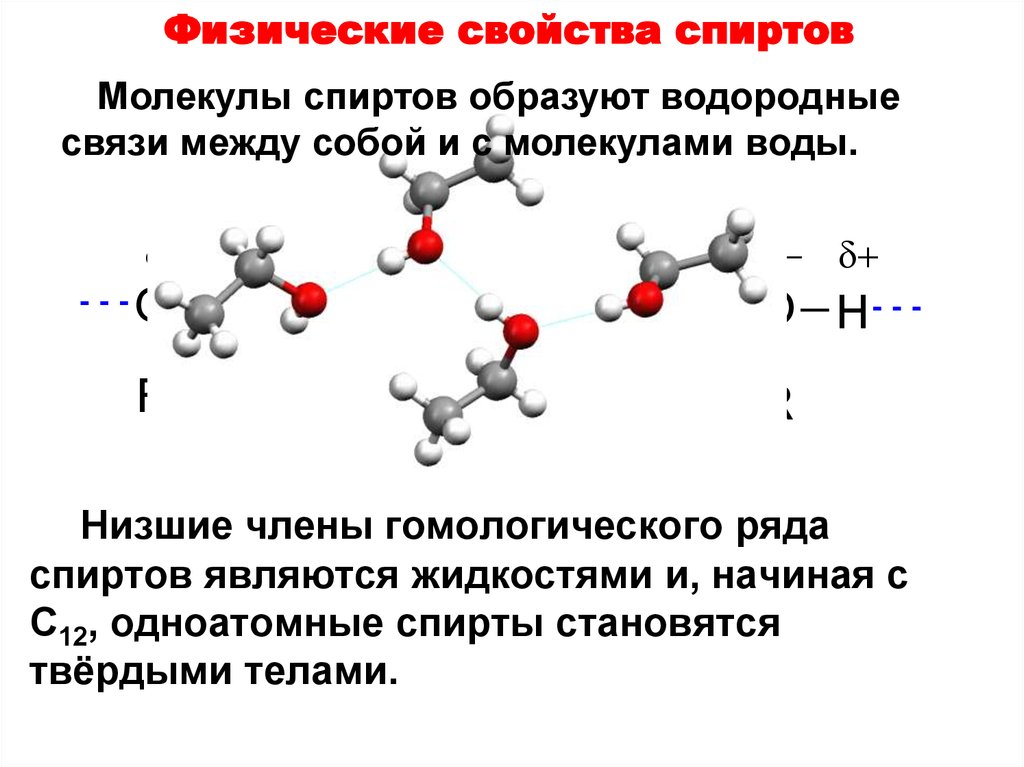
12. Физические свойства спиртов
Молекулы спиртов образуют водородныесвязи между собой и с молекулами воды.
O H
O H
O H
O H
R
R
R
R
Низшие члены гомологического ряда
спиртов являются жидкостями и, начиная с
C12, одноатомные спирты становятся
твёрдыми телами.
13. Спирты
Гидроксигруппа является сильно полярнойгруппой, поэтому низшие спирты
растворяются в воде неограниченно:
метанол, этанол, пропанол смешиваются с
водой во всех отношениях.
С увеличением количества атомов
углерода спирты всё более начинают
напоминать углеводороды.
Растворимость амилового спирта
(пентанола-1) – 2,7 г/ 100 мл, растворимость
октанола-1 – 0,059 г/ 100 мл.
14. Спирты
НЕ ПЕЙМЕТИЛОВЫЙ
СПИРТ
Метиловый спирт
считается самым ядовитым
спиртом. Прием внутрь
вызывает слепоту или смерть.
15.
СпиртыОбщее действие этанола
характеризуется угнетением функции
ЦНС, а возникающие на начальных
этапах эйфория и возбуждение
являются признаками ослабления
тормозных механизмов ЦНС.
16. Спирты
Злоупотреблениеэтанолом ведёт к развитию
алкоголизма,
деградации
личности,
психическим
расстройствам
и
соматическим
заболеваниям.
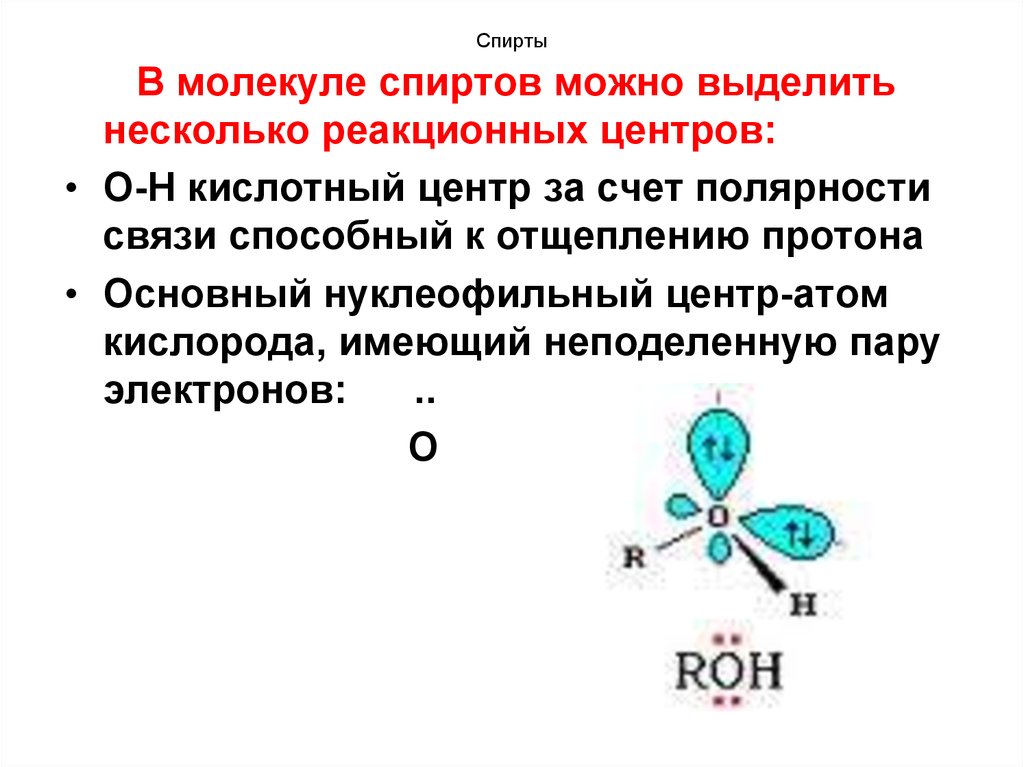
17. Спирты
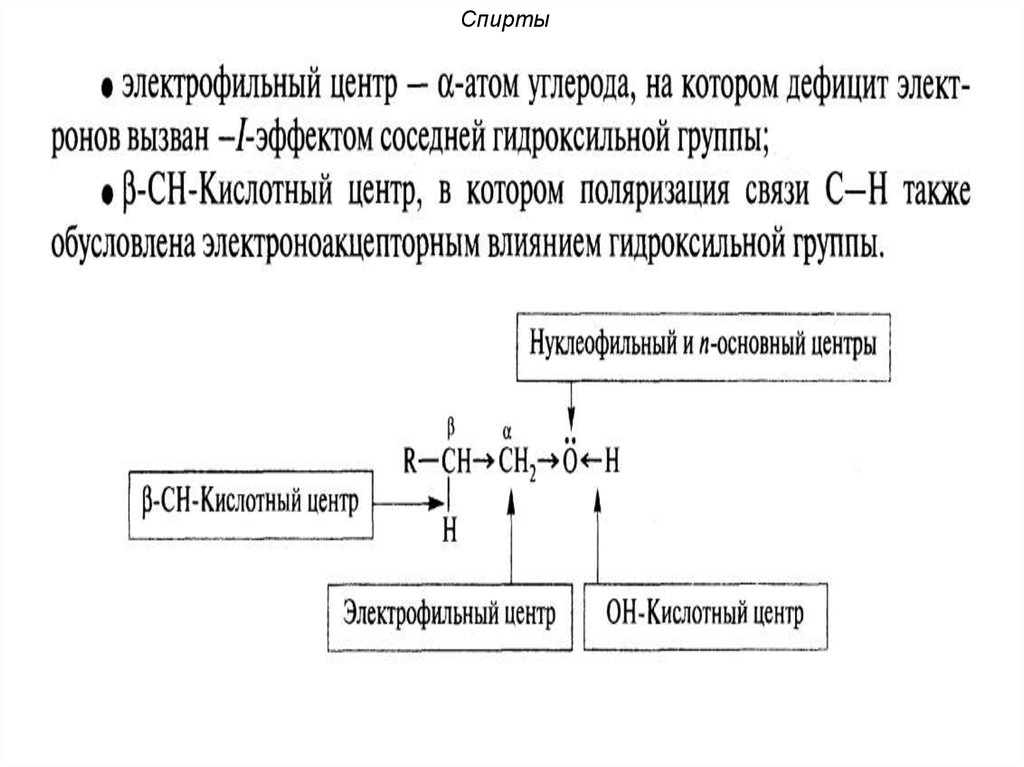
В молекуле спиртов можно выделитьнесколько реакционных центров:
• О-Н кислотный центр за счет полярности
связи способный к отщеплению протона
• Основный нуклеофильный центр-атом
кислорода, имеющий неподеленную пару
электронов:
..
О
18. Спирты
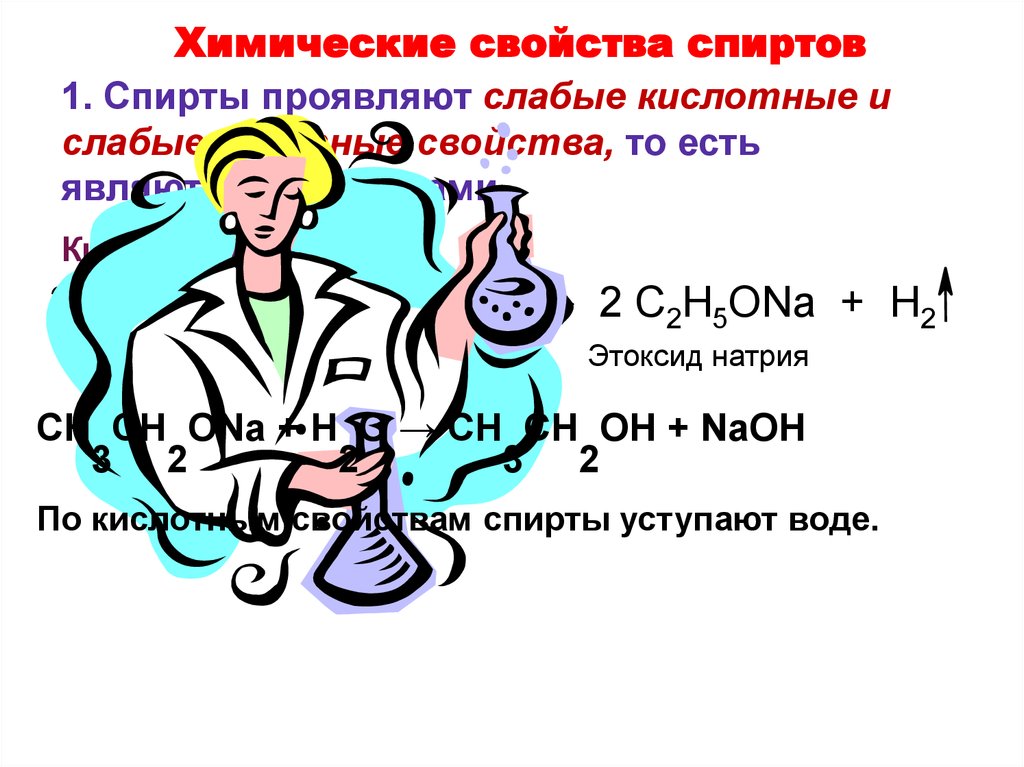
19. Химические свойства спиртов
1. Спирты проявляют слабые кислотные ислабые основные свойства, то есть
являются амфолитами.
Кислотные свойства:
2 C2H5OH + 2 Na
2 C2H5ONa + H2
Этоксид натрия
CH CH ONa + H O → CH CH OH + NaOH
3 2
2
3 2
По кислотным свойствам спирты уступают воде.
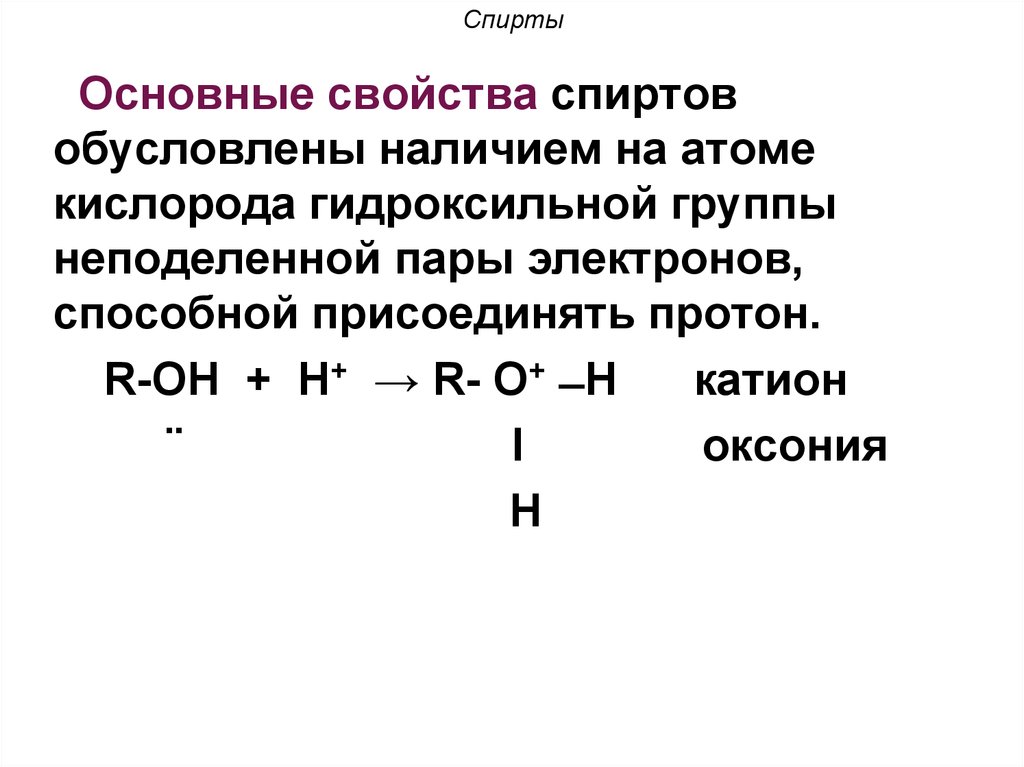
20. Спирты
Основные свойства спиртовобусловлены наличием на атоме
кислорода гидроксильной группы
неподеленной пары электронов,
способной присоединять протон.
R-ОН + Н+ → R- О+ ̶ Н
катион
¨
l
оксония
Н
21. Спирты
2. Реакции окисления: внутри организма (invivo) эти реакции протекают с участием
ферментов дегидрогеназ.
Окисление первичных и вторичных спиртов:
При окислении
первичных спиртов
Н
О
а)
НАД+
СН
СН3 – СН
+ НАДН
образуются
вторичных
– + Н+
3 – СН2 – С – ОНальдегиды,
2 – С
кетоны.
Н
пропаналь
Н
пропанол -1
б)
НАД+
СН3 – СН – СН3
СН3 – С – СН3
ОН
О
пропанол-2
пропанон
+ НАДН + Н+
22. Спирты
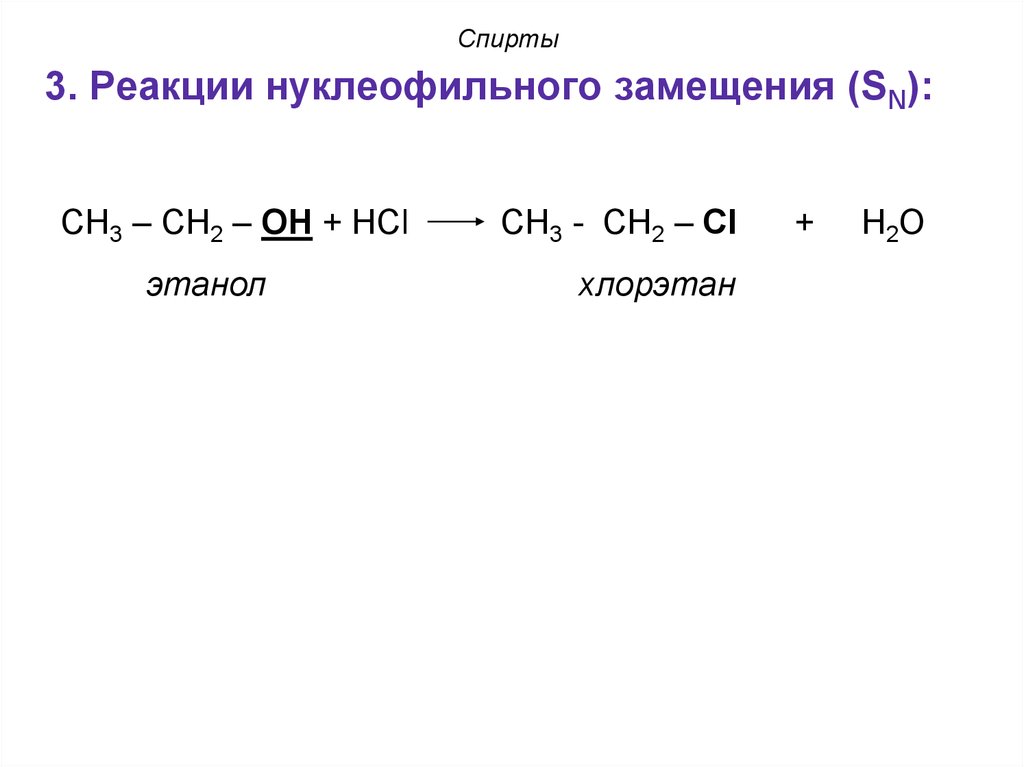
3. Реакции нуклеофильного замещения (SN):СН3 – СН2 – ОН + НCl
этанол
СН3 - СН2 – Сl
хлорэтан
+
Н2О
23. Спирты
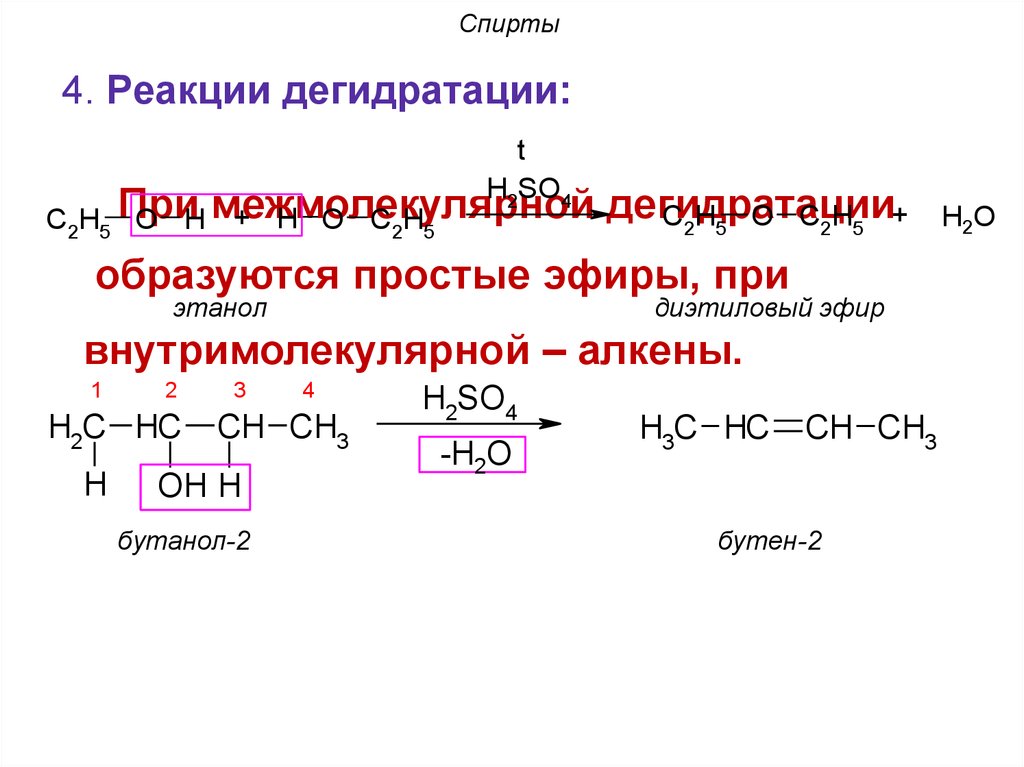
4. Реакции дегидратации:t
H2SO4
+ H O C2H5
C2H5 При
O H межмолекулярной
дегидратации
C2H5 O C2H5 +
образуются простые эфиры, при
этанол
диэтиловый эфир
внутримолекулярной – алкены.
1
2
H2C HC
H
3
4
CH CH3
OH H
бутанол-2
H2SO4
-H2O
H3C HC
CH CH3
бутен-2
H2O
24. Спирты
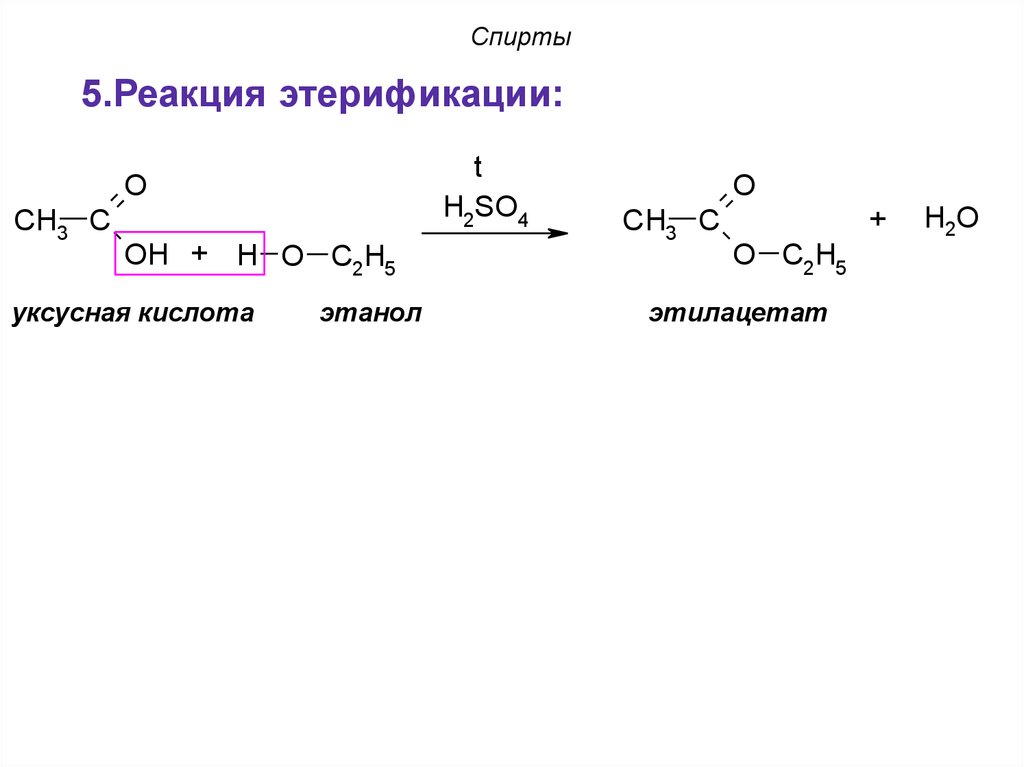
5.Реакция этерификации:t
H2SO4
O
CH3 C
OH + H O C2H5
уксусная кислота
этанол
O
CH3 C
+
O C2H5
этилацетат
H2O
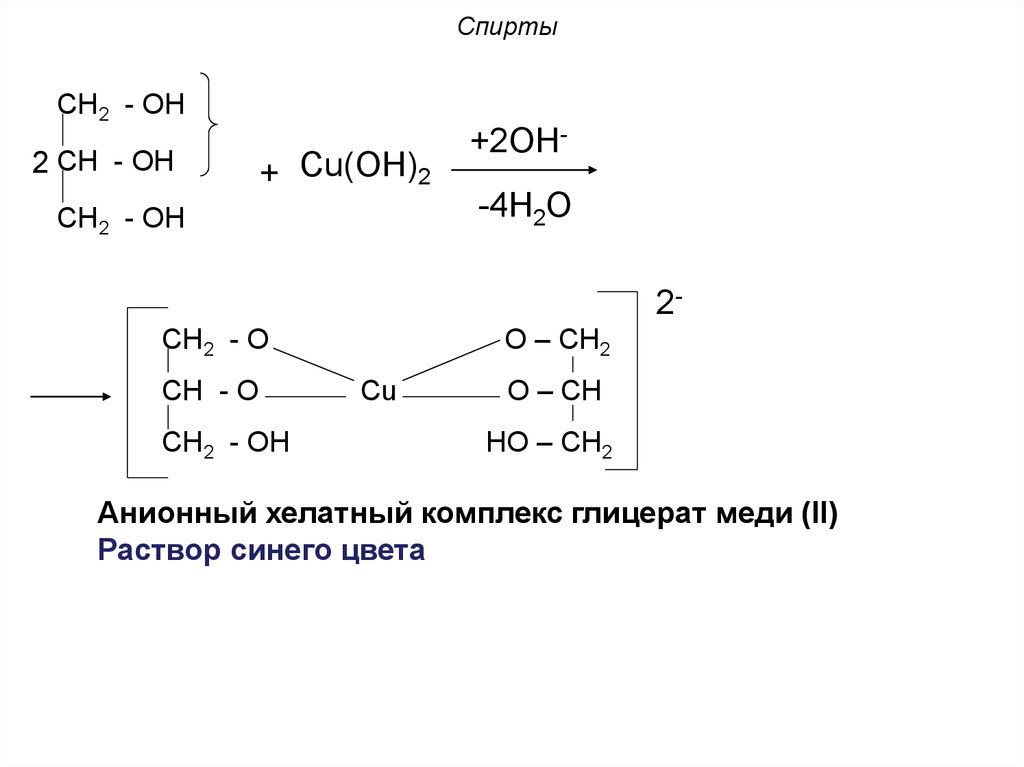
25. Спирты
6. Реакция хелатообразования:Многоатомные спирты, проявляя более
выраженные
кислотные
свойства
по
сравнению с одноатомными спиртами при
взаимодействии с Сu(ОН)2 в щелочной среде
образуют растворимый хелатный комплекс
ярко синего цвета.
Данная
реакция
используется
для
качественного обнаружения многоатомных
спиртов.
В реакцию при этом вступает α-диольный
фрагмент.
26. Спирты
CH2 - OH2 CH - OH
+ Cu(ОН)2
CH2 - OH
+2ОН-4Н2О
2О – СН2
CH2 - O
CH - O
CH2 - OH
Cu
О – СН
НО – СН2
Анионный хелатный комплекс глицерат меди (II)
Раствор синего цвета
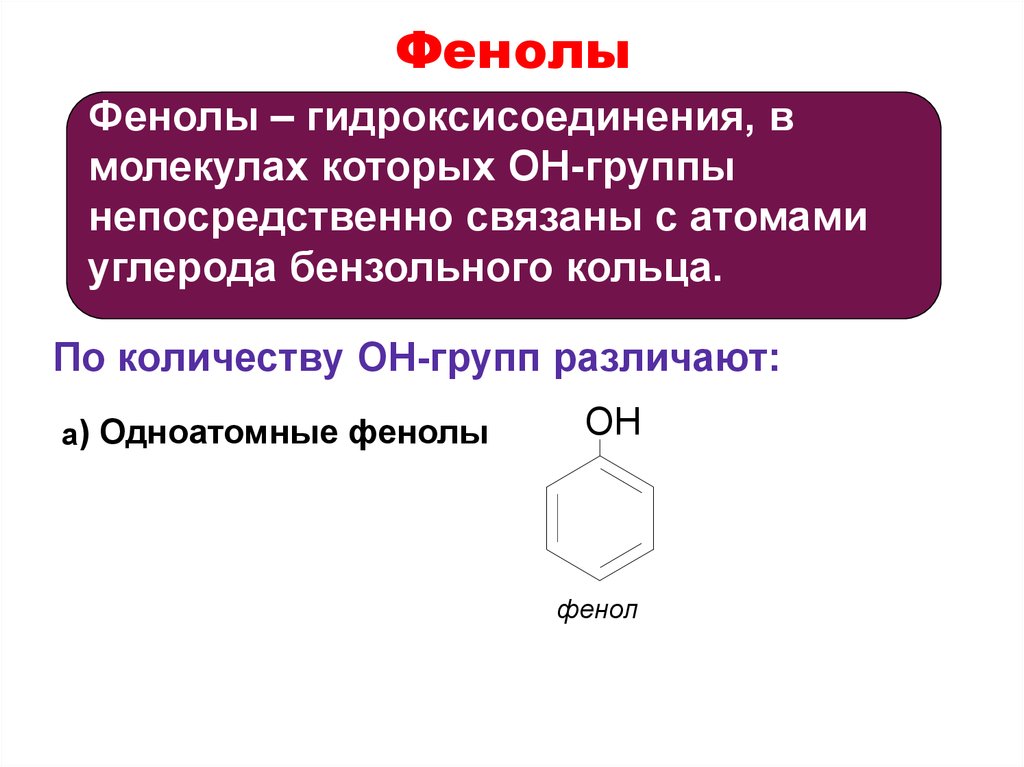
27. Фенолы
Фенолы – гидроксисоединения, вмолекулах которых OH-группы
непосредственно связаны с атомами
углерода бензольного кольца.
По количеству OH-групп различают:
a) Одноатомные фенолы
OH
фенол
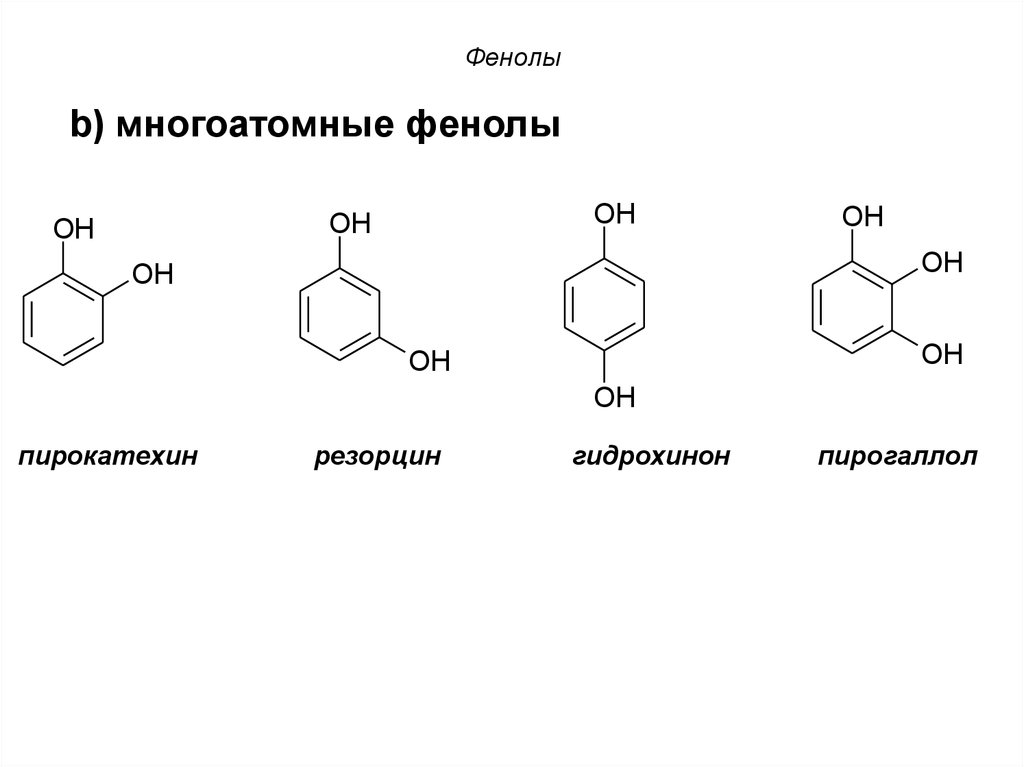
28. Фенолы
b) многоатомные фенолыOH
OH
OH
OH
OH
OH
OH
OH
OH
пирокатехин
резорцин
гидрохинон
пирогаллол
29. Физические свойства фенола
Фенол- кристаллическое вещество, антисептик.30.
Применение фенолов в стоматологииПрепараты на основе фенола
Фенол - сильное
дезинфицирующее
средство;
применяется для
обезвреживания ран, в
процессе лечения
воспалительных
заболеваний полости
рта, горла и уха, а
также как консервант
для инъекционных
растворов.
31.
Применение фенолов в стоматологииПрепараты на основе пара-хлофенола
32.
Применение фенолов в стоматологииПрепараты на основе производных
фенола
33.
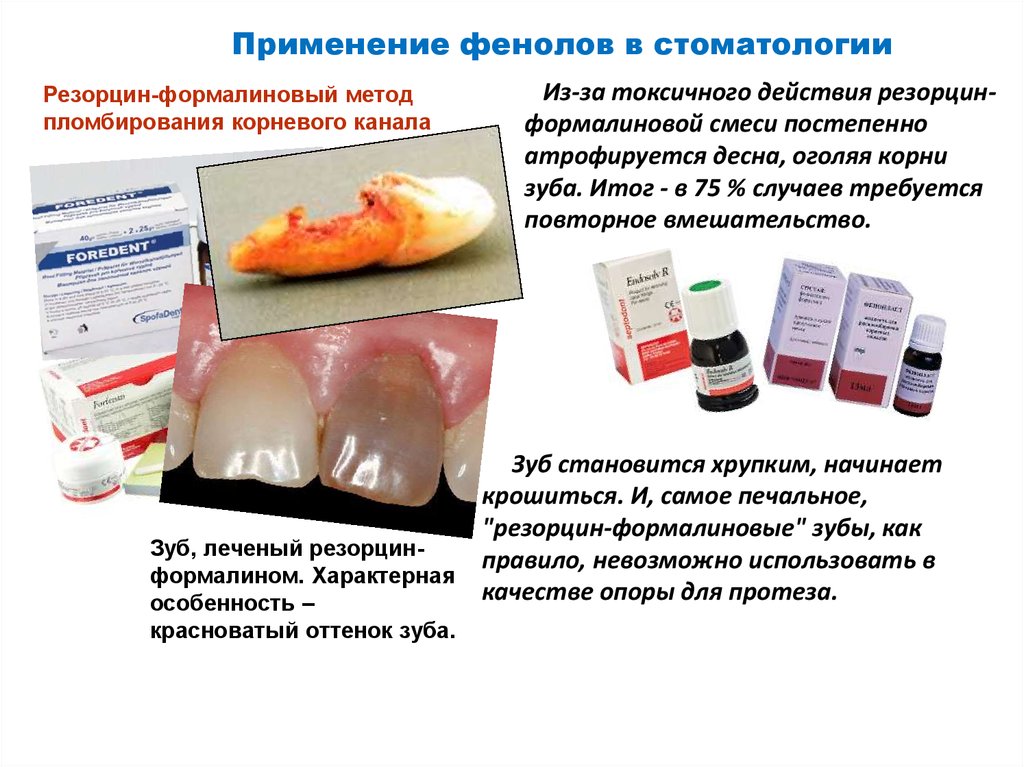
Применение фенолов в стоматологииРезорцин-формалиновый метод
пломбирования корневого канала
Из-за токсичного действия резорцинформалиновой смеси постепенно
атрофируется десна, оголяя корни
зуба. Итог - в 75 % случаев требуется
повторное вмешательство.
Зуб становится хрупким, начинает
крошиться. И, самое печальное,
"резорцин-формалиновые" зубы, как
Зуб, леченый резорцинправило, невозможно использовать в
формалином. Характерная
качестве опоры для протеза.
особенность –
красноватый оттенок зуба.
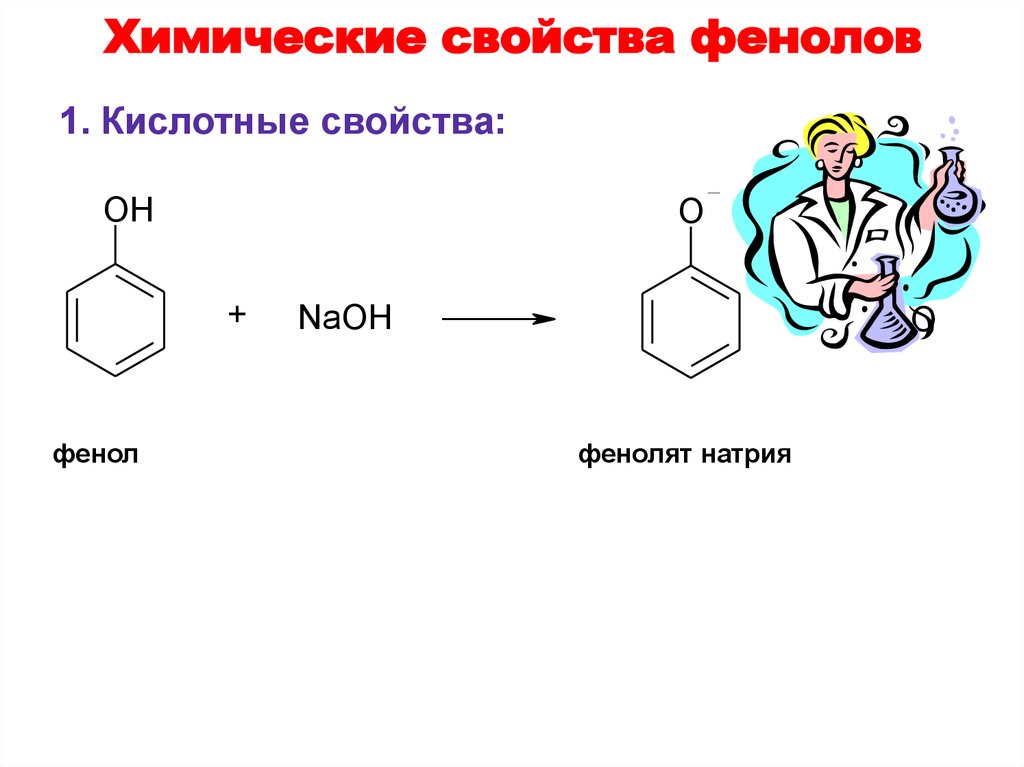
34. Химические свойства фенолов
1. Кислотные свойства:O Na
OH
+
фенол
+
+
NaOH
фенолят натрия
H2O
35. Фенолы
2. Реакции электрофильного замещения (SE):OH
OH
Br
Br
а)
+ 3 Br2
+
3 HBr
Br
фенол
2, 4, 6 -трибромфенол
OH
б)
OH
+ 3 HNO3
H2SO4 t
NO2
O2N
+
NO2
фенол
пикриновая кислота
3 H2O
36. Фенолы
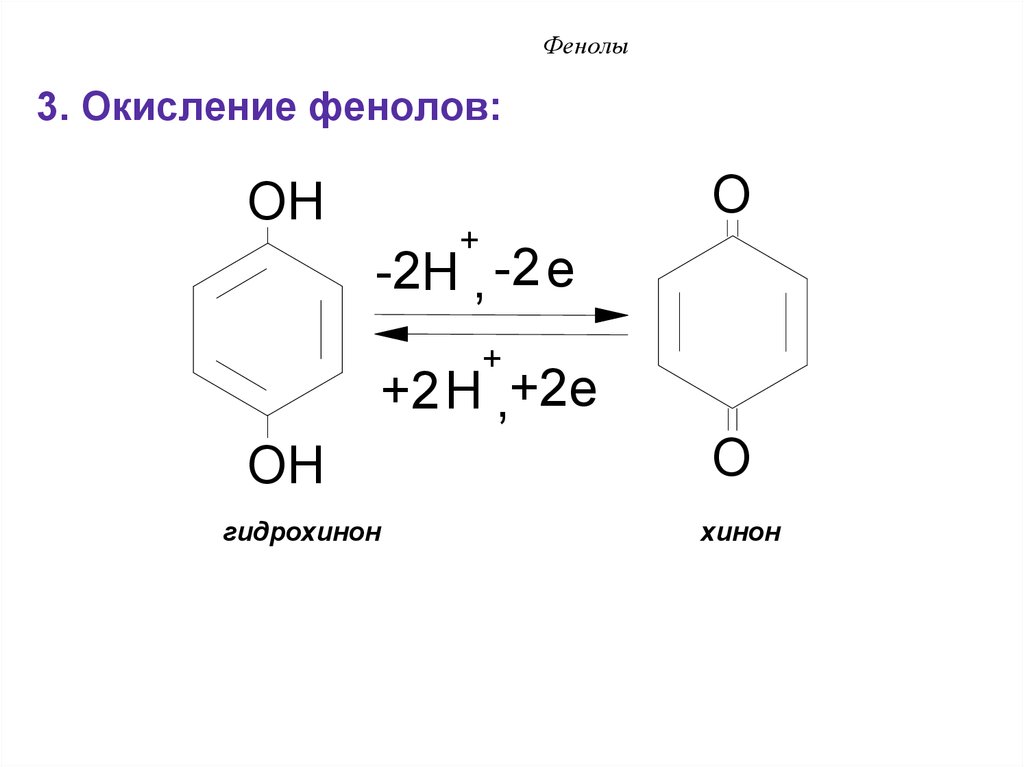
3. Окисление фенолов:O
OH
+
-2H , -2 e
+
+2H ,+2e
OH
гидрохинон
O
хинон
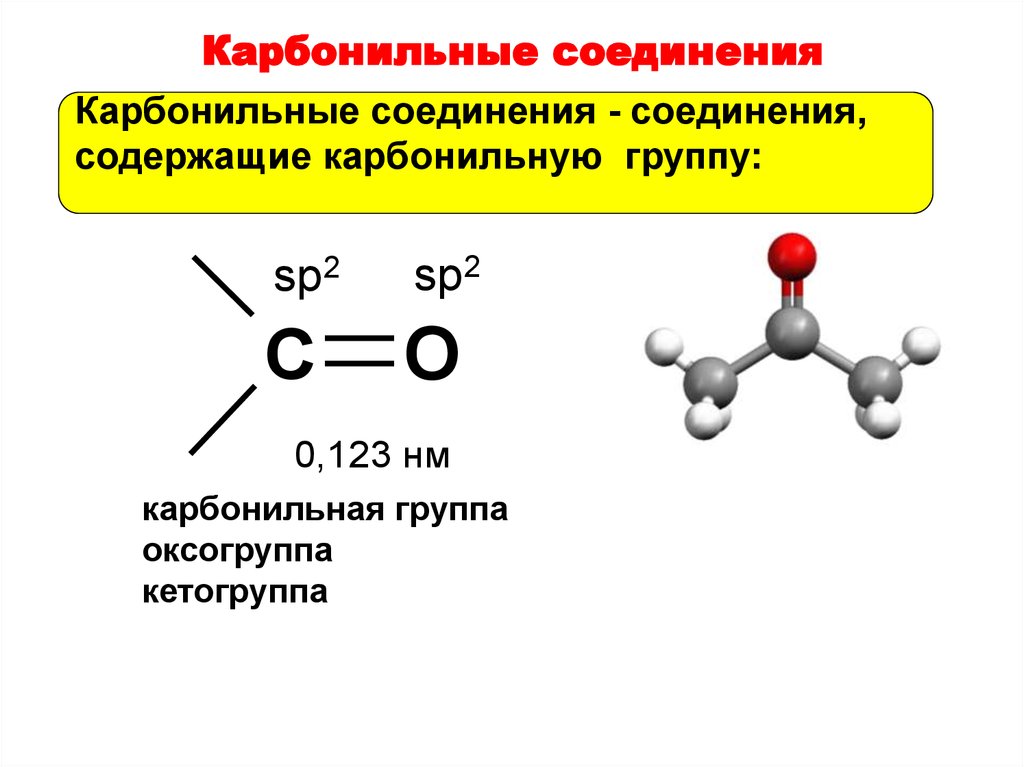
37. Карбонильные соединения
Карбонильные соединения - соединения,содержащие карбонильную группу:
sp2
sp2
C
O
0,123 нм
карбонильная группа
оксогруппа
кетогруппа
38.
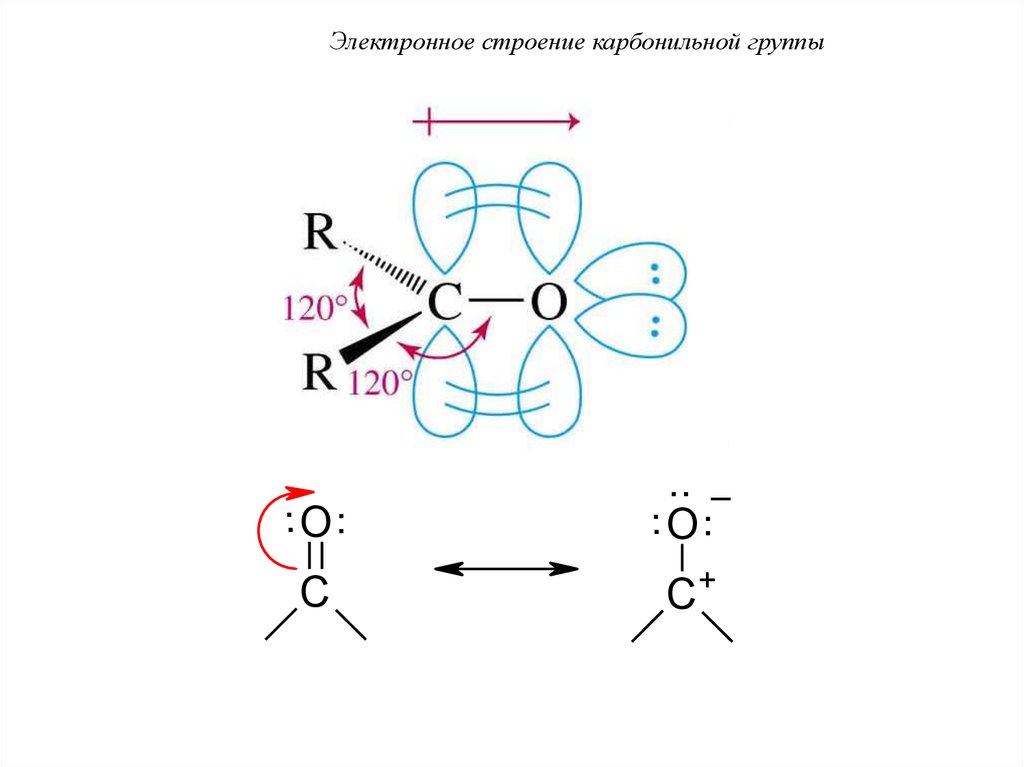
Электронное строение карбонильной группы2
Атом углерода находится в состоянии sp -гибридизации.
Гибридные орбитали располагаются в одной плоскости,
валентный угол составляет 120°.
39.
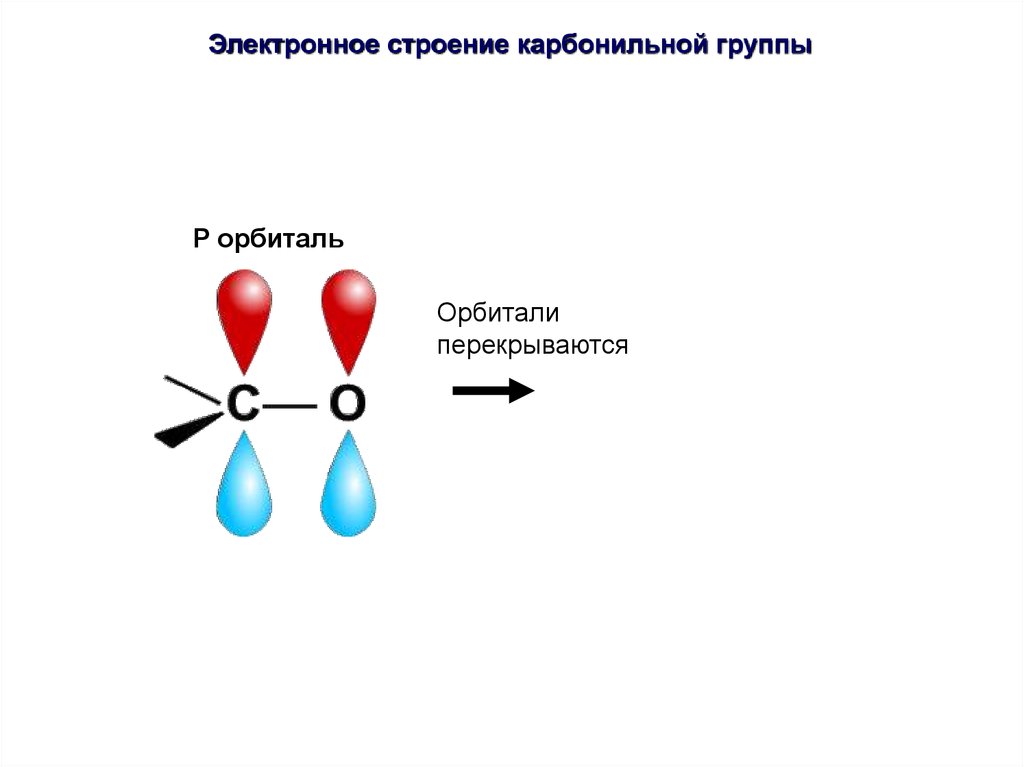
Электронное строение карбонильной группыP орбиталь
40.
Электронное строение карбонильной группыАтом углерода соединен с атомом кислорода двумя
ковалентными связями (σ- и π-связи).
P орбиталь
41.
Электронное строение карбонильной группыP орбиталь
Орбитали
перекрываются
42.
Электронное строение карбонильной группыP орбиталь
орбитали
перекрываются
новая
орбиталь
43.
Электронное строение карбонильной группыπ-связь сильно поляризована, её электронная плотность смещена к
более элекроотрицательному элементу кислороду, на котором
возникает частичный отрицательный заряд. На атоме углерода при
этом наблюдается недостаток электронной плотности.
P орбиталь
орбитали
перекрываются
Новая
орбиталь
44.
Электронное строение карбонильной группы.. O ..
.. _
.. O ..
C
C+
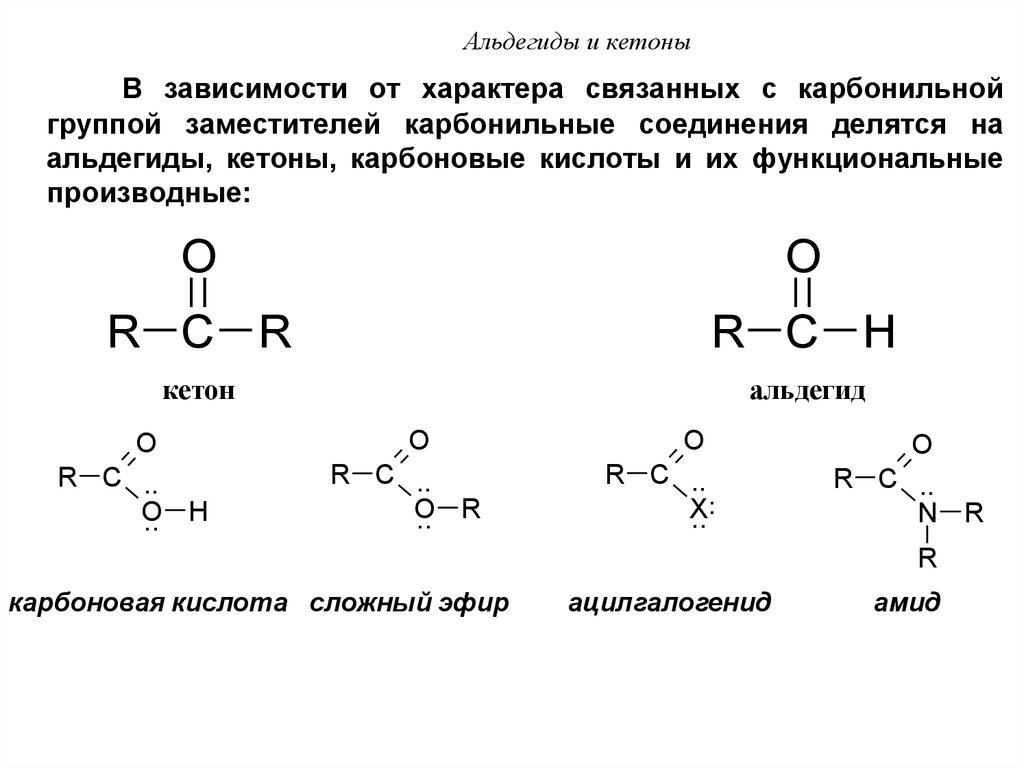
45. Альдегиды и кетоны
В зависимости от характера связанных с карбонильнойгруппой заместителей карбонильные соединения делятся на
альдегиды, кетоны, карбоновые кислоты и их функциональные
производные:
O
O
R C R
R C H
кетон
альдегид
O
R C ..
O
.. H
O
R C ..
O
.. R
O
R C ..
..
X
..
O
R C ..
N R
R
карбоновая кислота сложный эфир
ацилгалогенид
амид
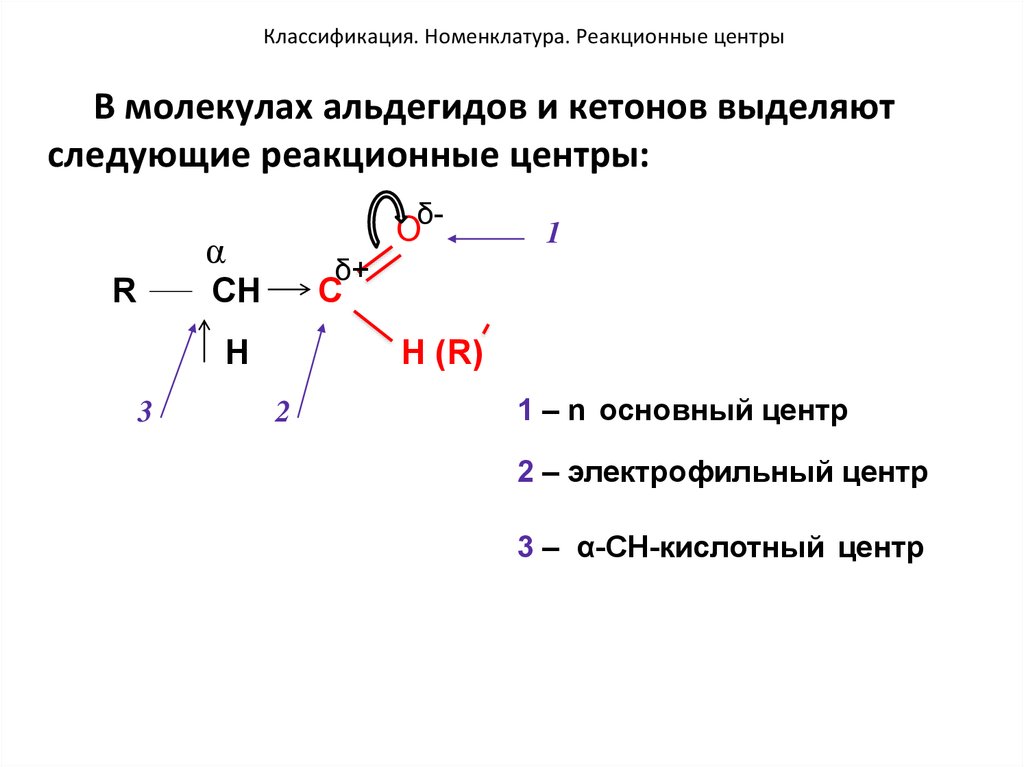
46. Классификация. Номенклатура. Реакционные центры
В молекулах альдегидов и кетонов выделяютследующие реакционные центры:
Oδ-
α
R
δ+
CH
C
H
3
1
H (R)
2
1 – n основный центр
2 – электрофильный центр
3 – α-CH-кислотный центр
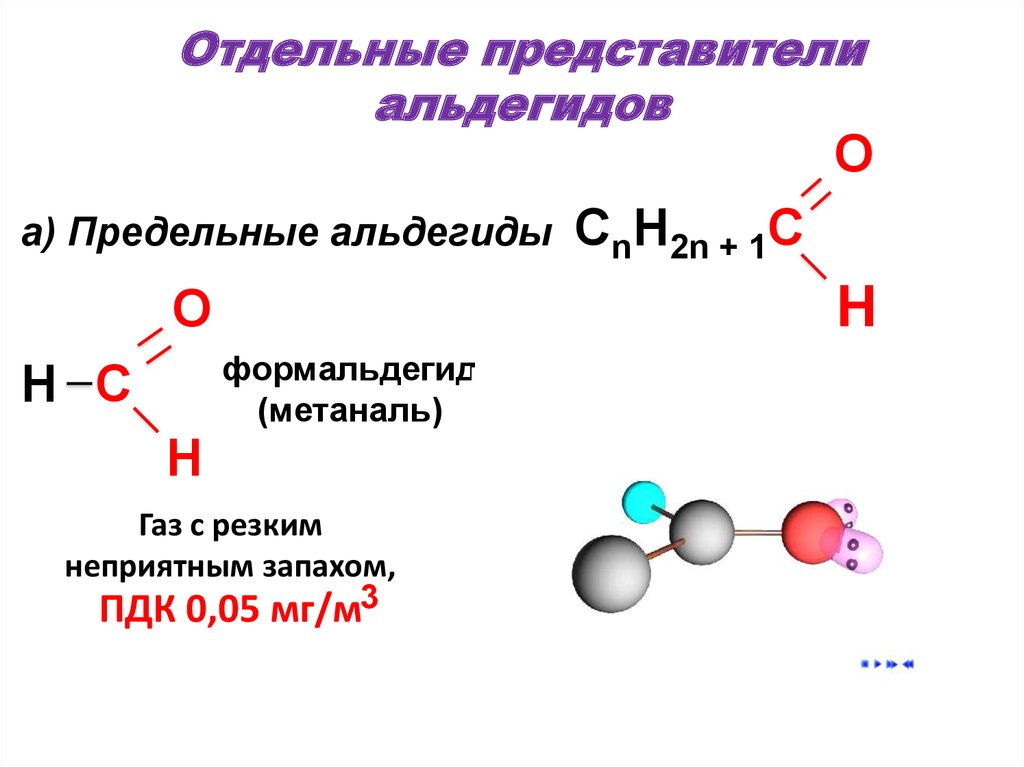
47. Отдельные представители альдегидов
Oa) Предельные альдегиды
H
O
формальдегид
(метаналь)
H C
CnH2n + 1C
H
Газ с резким
неприятным запахом,
ПДК 0,05 мг/м3
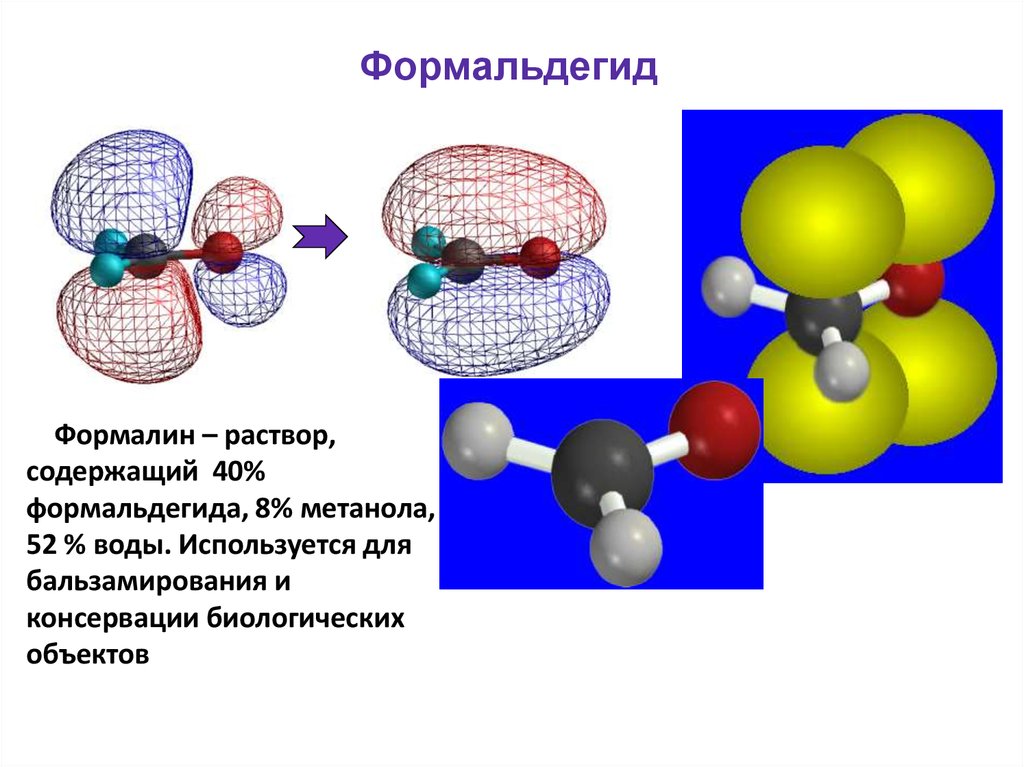
48. Формальдегид
Формалин – раствор,содержащий 40%
формальдегида, 8% метанола,
52 % воды. Используется для
бальзамирования и
консервации биологических
объектов
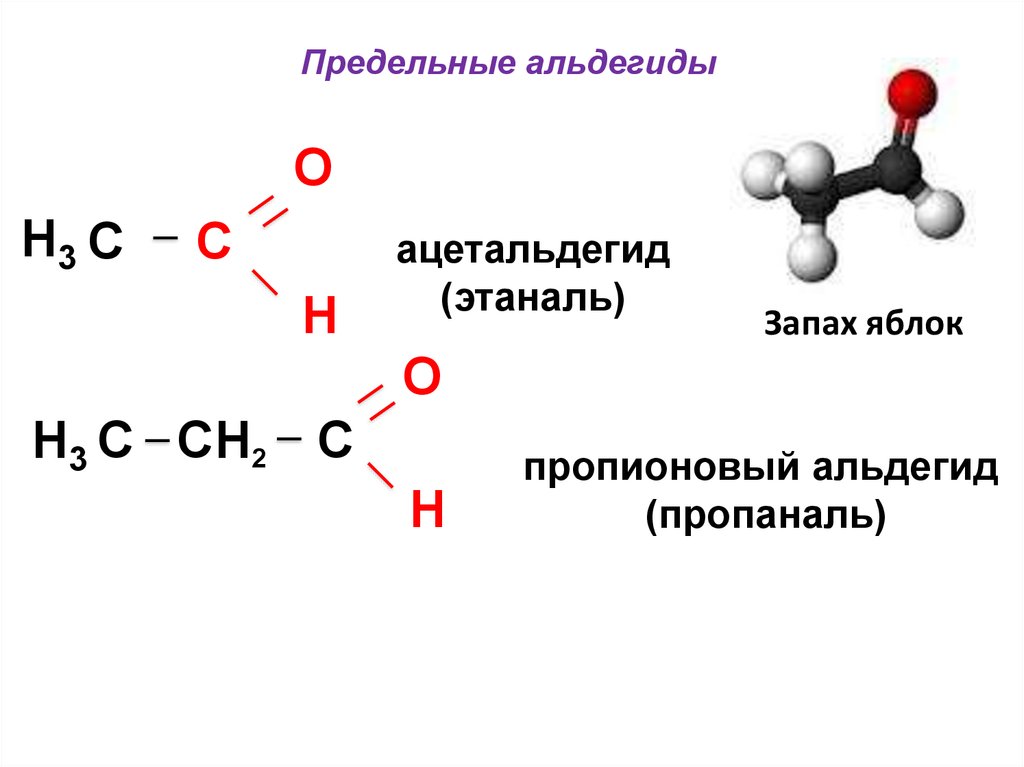
49.
Предельные альдегидыO
H3 C
C
H
ацетальдегид
(этаналь)
Запах яблок
O
H3 C CH2 C
H
пропионовый альдегид
(пропаналь)
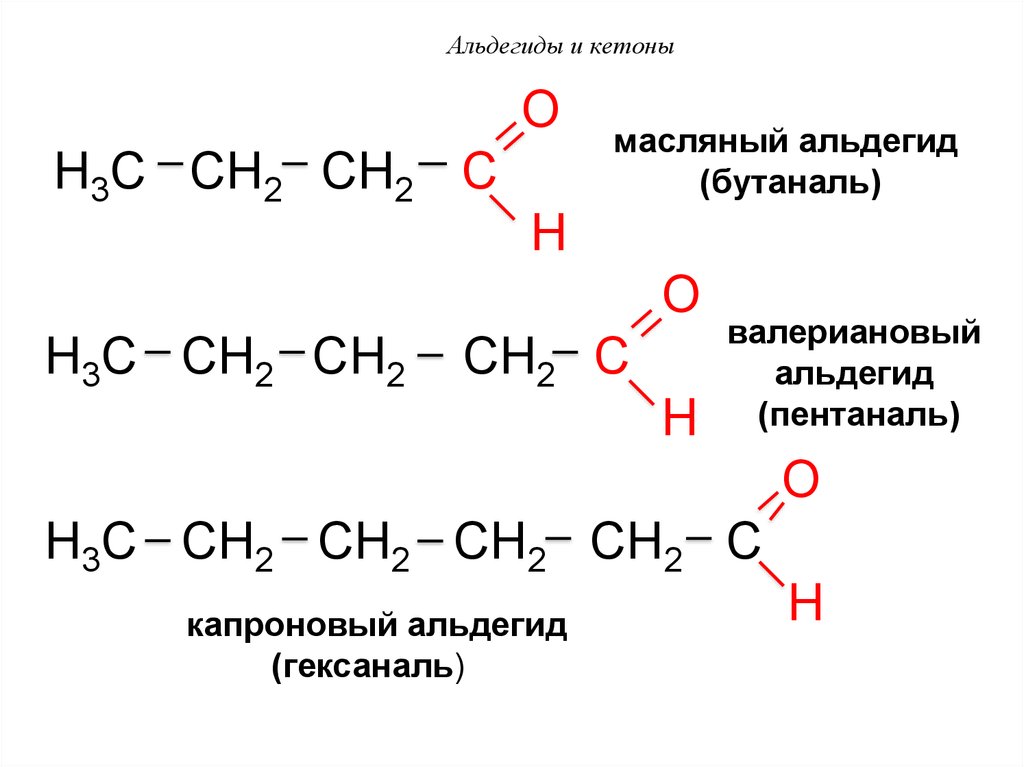
50. Альдегиды и кетоны
OH3C CH2 CH2 C
масляный альдегид
(бутаналь)
H
O
H3C CH2 CH2
CH2 C
H
валериановый
альдегид
(пентаналь)
O
H3C CH2 CH2 CH2 CH2 C
капроновый альдегид
(гексаналь)
H
51.
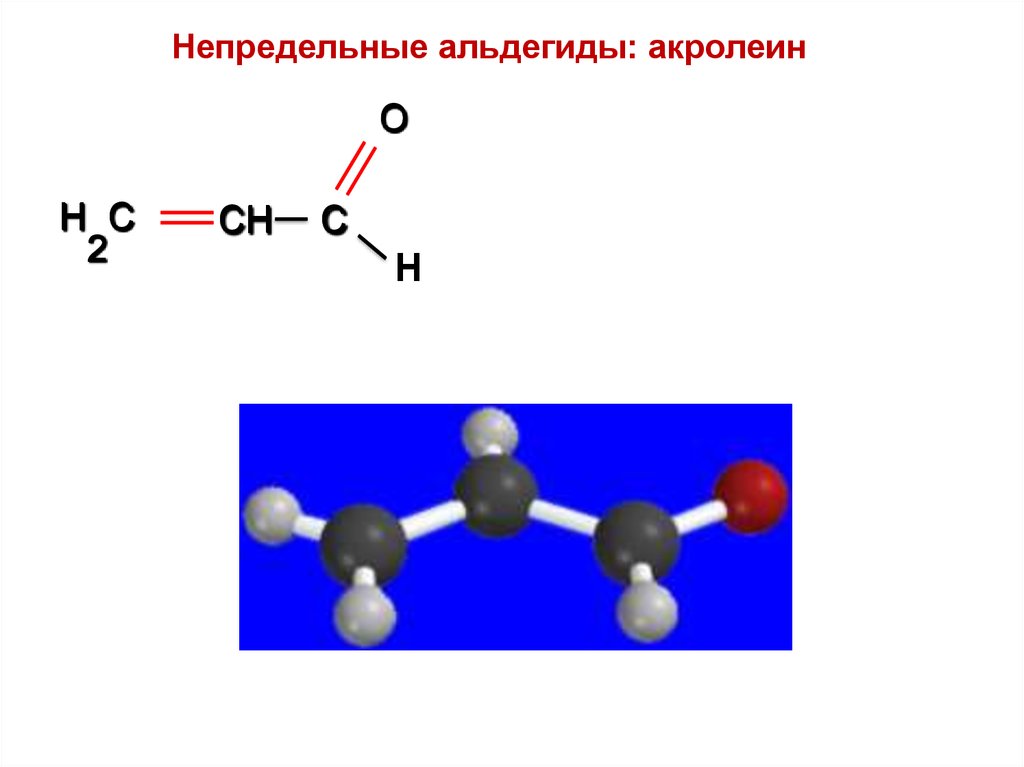
Непредельные альдегиды: акролеинO
H C
2
CH
C
Н
52.
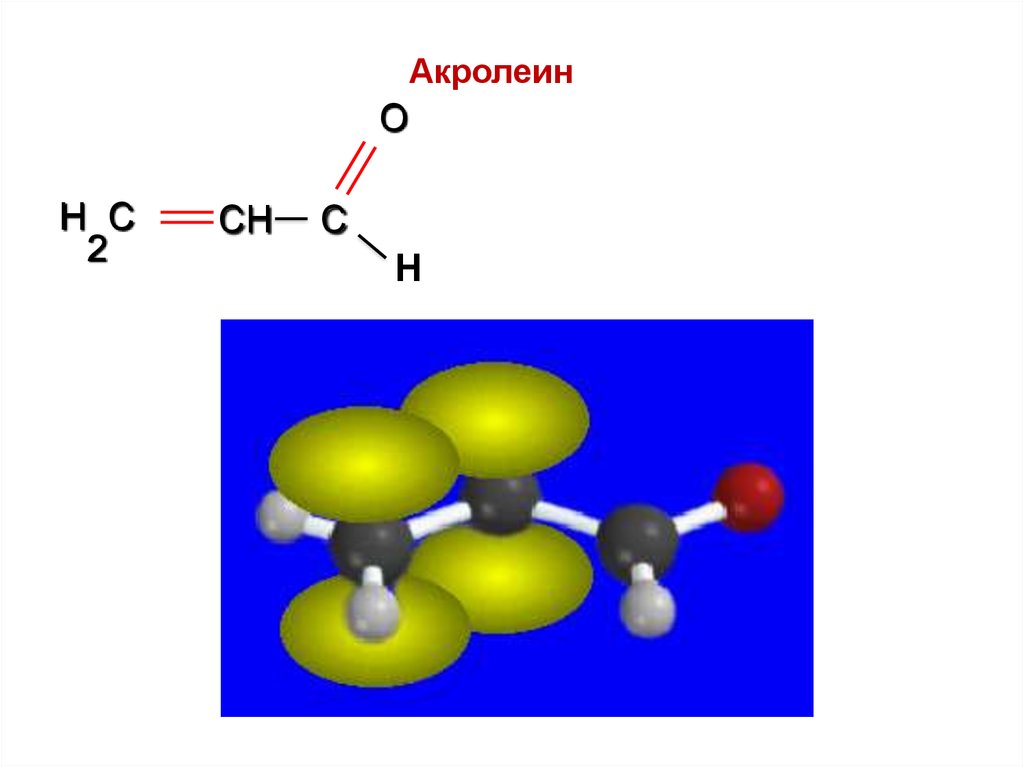
АкролеинO
H C
2
CH
C
Н
53.
АкролеинO
H C
2
CH
C
Н
54.
АкролеинO
H C
2
CH
C
Н
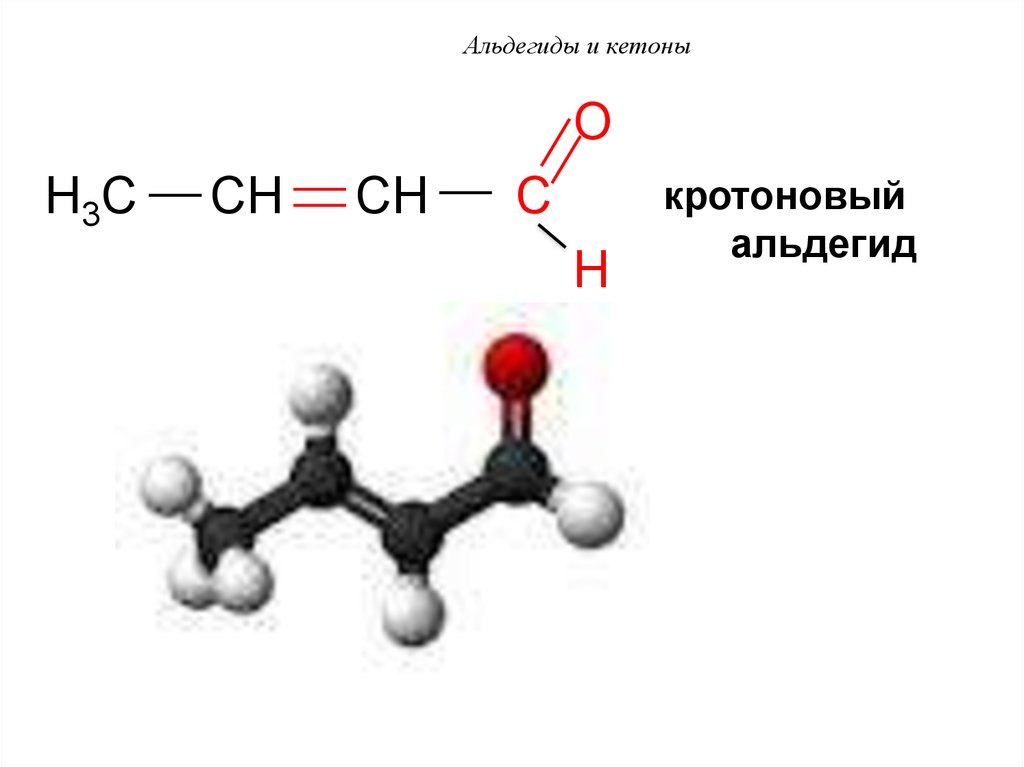
55. Альдегиды и кетоны
OH3C
CH
CH
C
H
кротоновый
альдегид
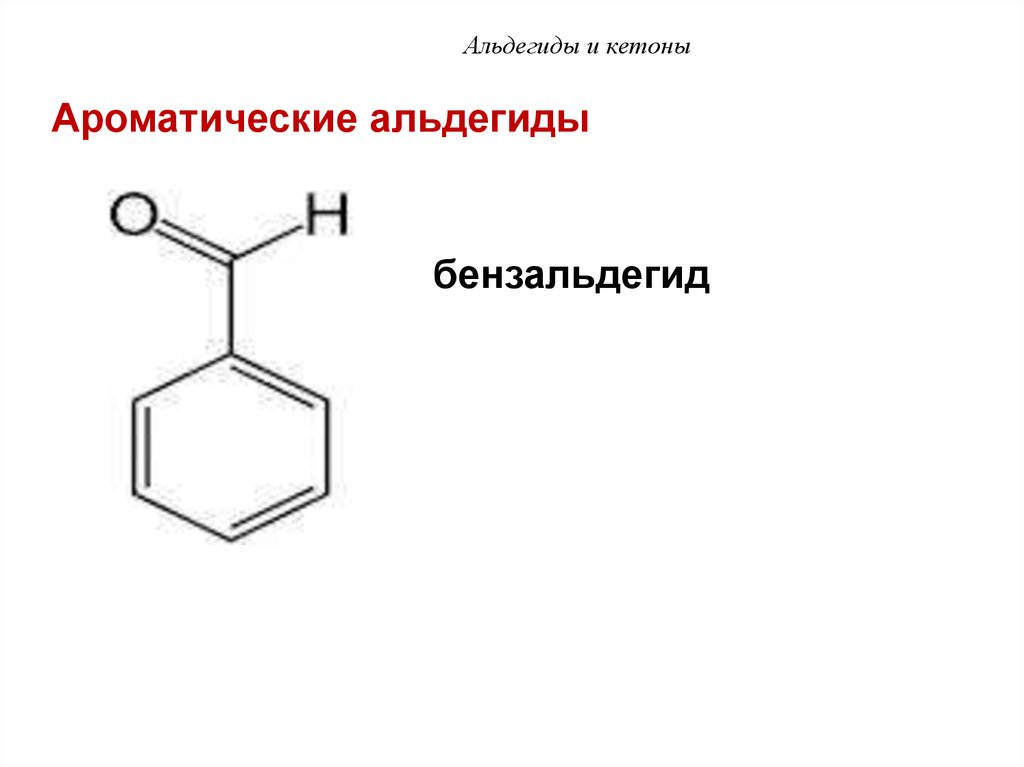
56. Альдегиды и кетоны
Ароматические альдегидыбензальдегид
57. Отдельные представители кетонов
OCH3 C CH3
пропанон (диметилкетон)
O
CH3 C CH2 CH3
бутанон (метилэтилкетон)
O
CH3 C CH2 CH2 CH3
пентанон-2 (метилпропилкетон)
O
CH3 CH2 C CH2 CH3
пентанон-3 (диэтилкетон)
O
CH3 C CH CH2
бутенон (метилвинилкетон)
58. Физические свойства альдегидов и кетонов
Низшие альдегиды – газы с резким запахом.Низшие кетоны являются подвижными жидкостями
с освежающим запахом.
Низшие кетоны и альдегиды смешиваются и с
водой, и с органическими гидрофобными
растворителями.
С увеличением углеводородной цепи
растворимость в воде уменьшается.
59. Применение альдегидов в стоматологии
OO
С
H
СH
2
СH
2
СH
2
Глутаровый альдегид
входит в состав
дезинфицирующие средств
стоматологических оттисков,
зубопротезных заготовок,
артикуляторов.
СH
2
C
H
60.
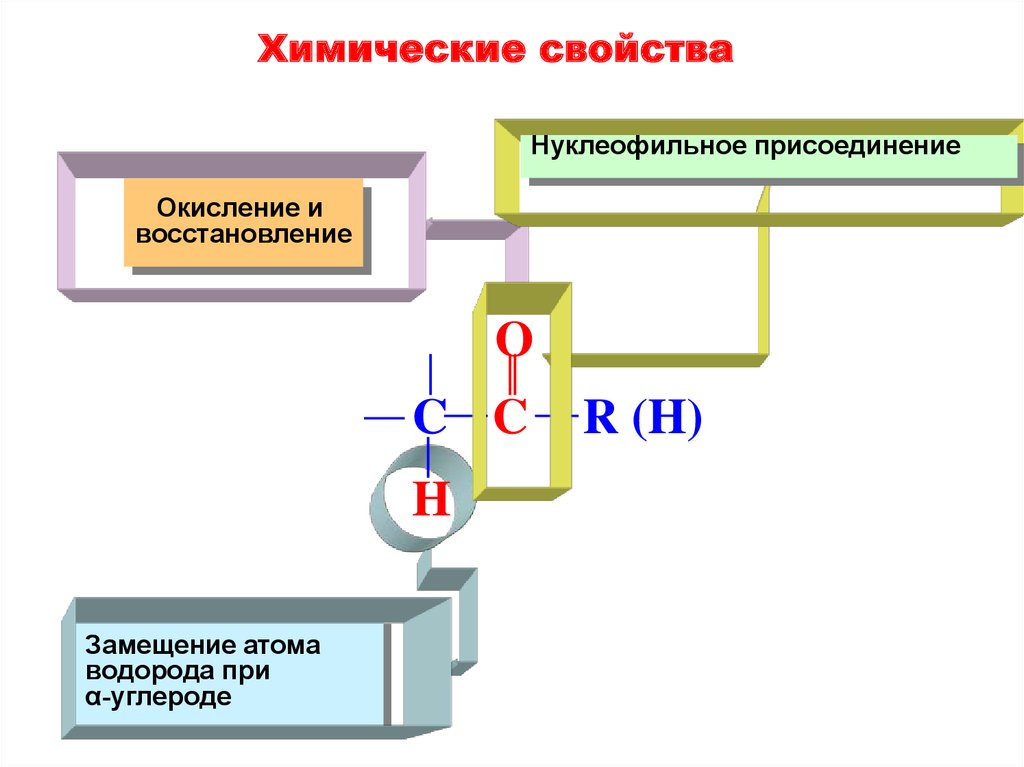
Химические свойстваНуклеофильное присоединение
Окисление и
восстановление
O
C C
H
Замещение атома
водорода при
α-углероде
R (H)
61.
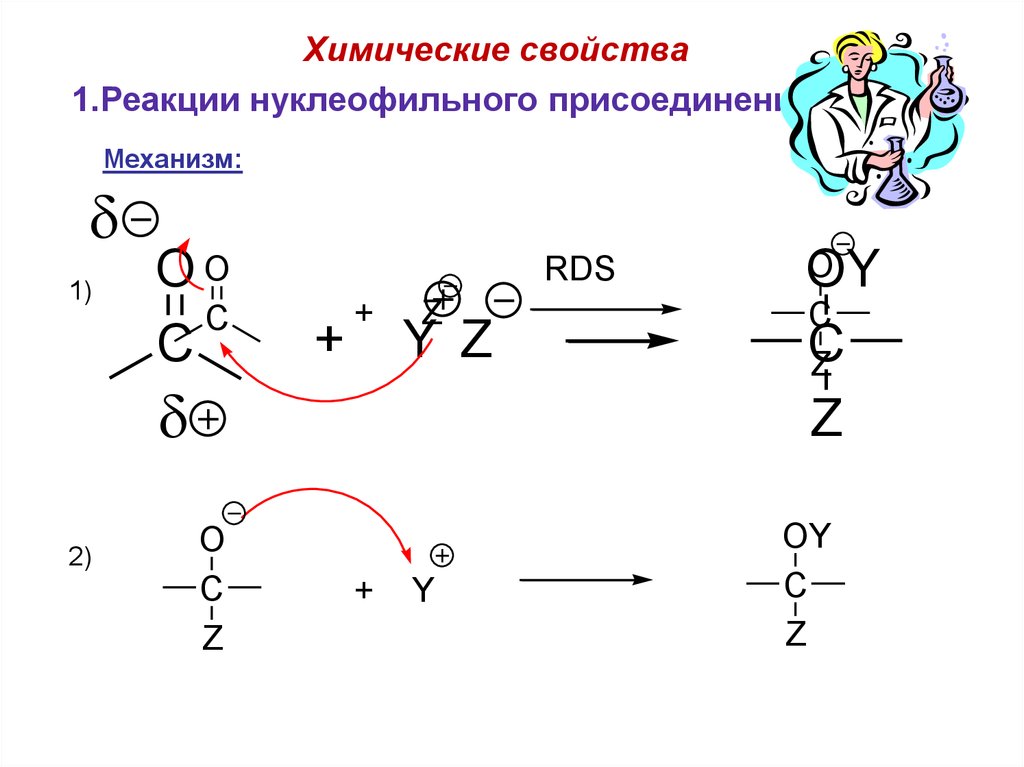
Химические свойства1.Реакции нуклеофильного присоединения (A ).
N
Механизм:
1)
OO
C
C
RDS
+
+
Z
Y Z
2)
O
C
Z
+
Y
O
OY
C
C
Z
Z
OY
C
Z
62.
Химические свойстваМеханизм:
63.
Химические свойстваПрисоединение спиртов (реакция ацетализации):
O
C
+
+ ROH, H
OH
C
OR
OR
C
OR
acetal
Ацеталь
hemiacetal
Полуацеталь
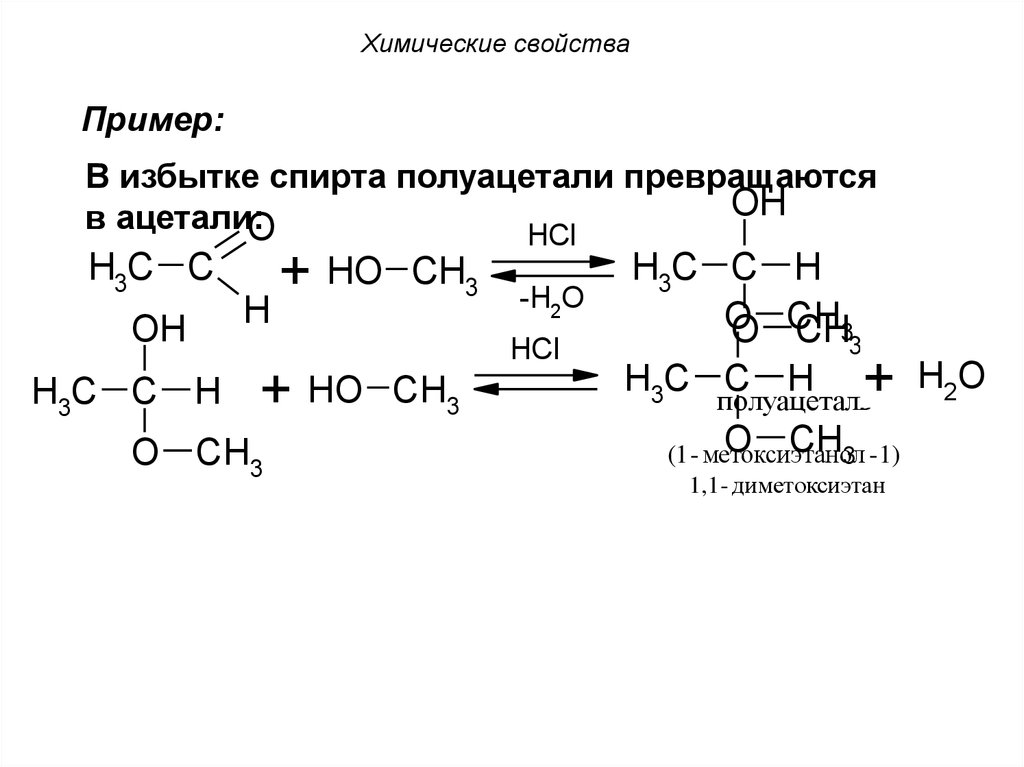
64. Химические свойства
Пример:В избытке спирта полуацетали превращаются
OH
в ацетали:
O
HCl
H3C C
OH
H3C C
H
+ HO
CH3
-H2O
HCl
H
+ HO
O CH3
CH3
H3C C H
O
O CH
CH33
H3C C H + H2O
полуацеталь
O CHнол
(1 - метоксиэта
3 - 1)
1,1 - диметоксиэтан
65. Альдегиды и кетоны
2. Окисление альдегидов:O
а) H3C
C
+
2 Cu(OH)2
t0
H
ацетальдегид
O
H3C
C
+
2CuOH
OH
уксусная кислота
Cu2O H2O
кирпичнокрасный
осадок
+ H2 O
66. Альдегиды и кетоны
б) Реакция «серебряного зеркала»:O
CH3 C
H
ацетальдегид
Ag(NH3)2OH
-Ag
O
CH3 C
OH
уксусная кислота
67.
Альдегиды и кетоны3. Альдольная
и кротоновая
конденсация
Общая схема
альдольной
конденсации:
Под влиянием основных катализаторов альдегиды реагируют с
образованием продуктов, имеющих удвоенную молекулярную
массу по сравнению с исходной молекулой. В организме реакции
H
OH
конденсацииOпроисходят в присутствии
O OH - ферментов альдолаз. O
R CH
R CH тоже
C способны кRэтой
Некоторые
реакции,
только
C в
CH
+ кетоны
2 C
2 CH CH
H условиях.
H
более жестких
H
R
Альдольная
конденсация протекает по механизму A .
карбонильн
ая
метиленовая
альдоль N
компонента
компонента
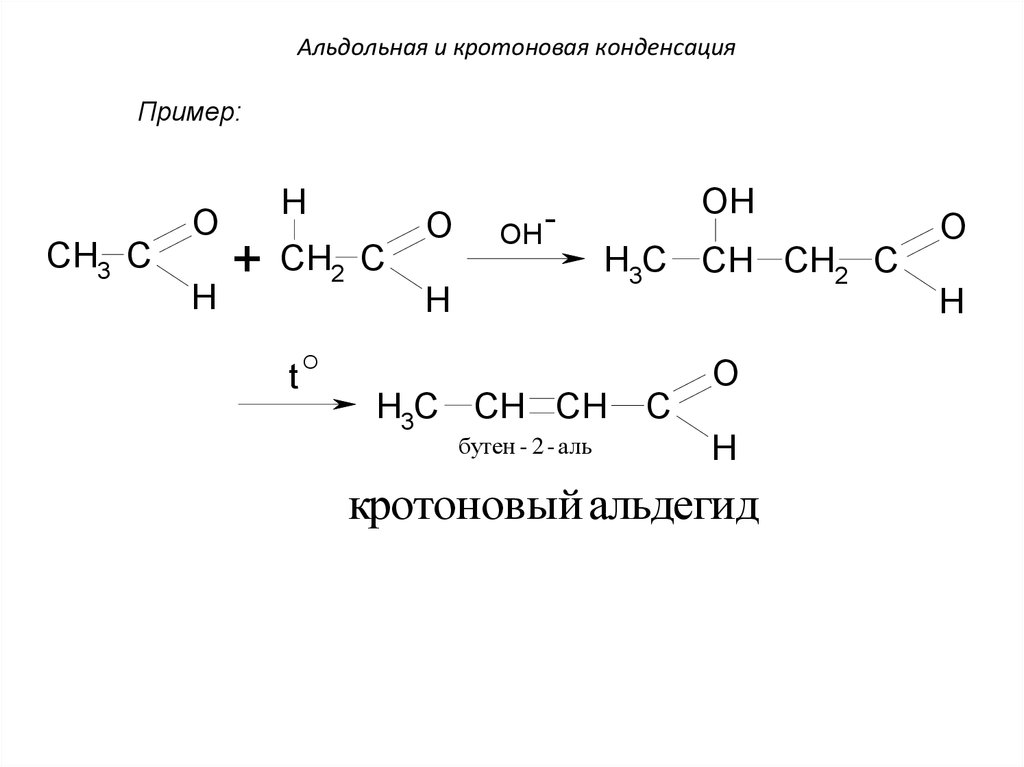
68. Альдольная и кротоновая конденсация
Пример:O
CH3 C
H
H
+
O
CH2 C
t
OH
H
OH
H3C CH CH2 C
O
O
H3C CH CH
бутен - 2 - аль
C
H
кротоновый альдегид
O
H
69.
Альдольная конденсация была открыта практически одновременно в1872 году французским химиком Ш.А. Вюрцем и русским химиком и
композитором А.П. Бородиным.
Шарль-Адольф Вюрц
(1817 – 1884)
Александр Порфирьевич Бородин
(1833 —1887)
70.
А.П. Бородин открыл реакциюБородина-Хунсдикера, впервые
получил фторорганическое
соединение — фтористый бензоил,
открыл альдольную конденсацию.
А.П. Бородин считается также одним
из основателей классических жанров
симфонии и квартета в России.
Написал 4 оперы (самая известная “Князь Игорь”), 3 симфонии (самая
известная - Симфония № 2, h-moll
«Богатырская»), произведения для
камерно-инструментальных
ансамблей (самый известный
струнный квартет – квартет № 2), для
фортепиано, романсы и т.д.
А. П. Бородин. Портрет работы
Ильи Репина (1888)
71.
Спасибоза
Ваше внимание!































 chemistry
chemistry








