Similar presentations:
Кислородосодержащие органические соединения
1. Кислородосодержащие органические соединения
2. Что такое кислородсодержащие органические соединения?
Кислородсодержащие органические соединения — этоорганические вещества, в молекулах которых, помимо углерода
и водорода, присутствует также кислород.
Эти соединения отличаются большим разнообразием и
классифицируются по типу функциональных групп, содержащих
атомы кислорода.
Систематические названия спиртов производятся
добавлением суффикса -ол к названию
соответствующего углеводорода и при необходимости
указанием номера атома углерода, при котором
находится группа –ОН
При одном и том же атоме
углерода не может находиться
более одной гидроксогруппы.
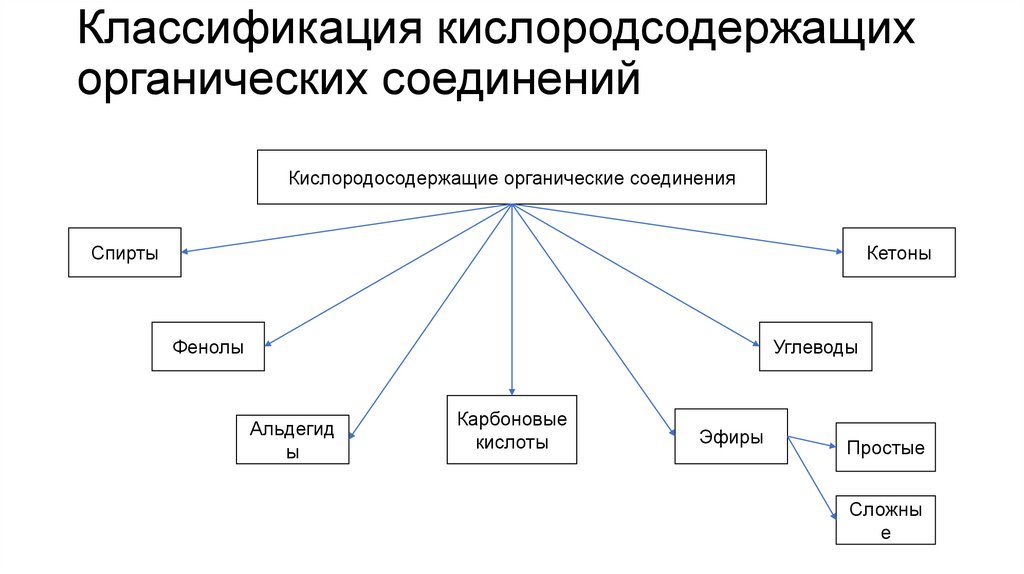
3. Классификация кислородсодержащих органических соединений
Кислородосодержащие органические соединенияСпирты
Кетоны
Углеводы
Фенолы
Альдегид
ы
Карбоновые
кислоты
Эфиры
Простые
Сложны
е
4. Спирты
Общий вид формулы:R–OH
Спирты — это органические вещества, содержащие
одну или несколько гидроксильных групп (–OH),
соединённых с насыщенным углеродным атомом
Классификация спиртов:
1. По числу гидроксильных групп:
Одноатомные – Этанол – C₂H₅OH
Двухатомные (гликоли) – Этиленгликоль – HO–CH₂–CH₂–OH
Трёхатомные и более – Глицерин – HO–CH₂–CHOH–CH₂OH
2. По типу углеродного атома, к которому
присоединена –OH группа:
Первичный (1°) – Этанол – –CH₂–OH
Вторичный (2°) – Изопропанол – –CH–OH (с двумя радикалами)
Третичный (3°)– Трет-бутанол – –C–OH (с тремя радикалами)
3. По характеру углеродной цепи:
Ациклические – Открытая цепь –
Циклические – Замкнутая цепь –
Ароматические – (–OH) группа при ароматическом
кольце – (но это уже фенолы)
Химические свойства спиртов:
1. Образование эфиров (с кислотами):
R–OH + R’–COOH → R’–COOR + H₂O
2. Окисление:
1. Первичные спирты → альдегиды → кислоты
2. Вторичные → кетоны
3. Третичные — трудно окисляются
3. Реакция с активными металлами (например, Na):
2R–OH + 2Na → 2R–ONa + H₂↑
4. Обезвоживание (дегидратация):
При нагревании с кислотами → алкены или
простые эфиры
5. Фенолы
Общий вид формулы:Ar–OH
где Ar — ароматический
радикал (например,
бензол)
Фенолы — это органические соединения, в которых
гидроксильная группа (–OH) непосредственно связана
с атомом углерода ароматического кольца (чаще
Химические свойства фенолов:
всего бензольного).
1. Кислотные свойства:
Классификация фенолов:
Фенол может отдавать протон –OH группы → образует соли
(феноляты): C₆H₅OH + Na → C₆H₅ONa + ½H₂
1. По числу –OH групп:
Спирты так с Na реагируют только при более жёстких
Одноатомные – Фенол – C₆H₅OH
условиях.
Двухатомные – Орто-крезол, резорцин – C₆H₄(OH)₂
2. Реакция с бромной водой (качественная реакция!)
Трёхатомные и более – Пирогаллол – C₆H₃(OH)₃
Фенол обесцвечивает бромную воду и образует белый осадок:
2. По расположению заместителей в кольце C₆H₅OH + 3Br₂ → C₆H₂Br₃OH + 3HBr
(если есть ещё группы, кроме –OH):
(2,4,6-трибромфенол — белый осадок)
Орто- (1,2-)
3. Реакции электрофильного замещения:
Мета- (1,3-)
Замещение в ароматическом кольце происходит легко (–OH
Пара- (1,4-)
активирует кольцо): C₆H₅OH + HNO₃ → C₆H₄(OH)(NO₂) + H₂O
(например, образуется орто- или пара-нитрофенол)
4. Образование сложных эфиров:
С кислотами (или ангидридами) фенолы образуют эфиры:
C₆H₅OH + CH₃COOH → C₆H₅OCOCH₃ + H₂Oм
(фениловый эфир уксусной кислоты)
6. Альдегиды
Альдегиды — это органические соединения,содержащие альдегидную группу. Она состоит из
карбонильной группы (C=O), к которой присоединён
атом водорода и углеводородный радикал (R).
Примеры альдегидов:
Формальдегид – H–CHO – H–C(=O)–H
Ацетальдегид – CH₃–CHO – CH₃–C(=O)–H
Бензальдегид – C₆H₅–CHO – C₆H₅–C(=O)–H
Классификация альдегидов:
1. По строению углеродной цепи:
Ациклические (алифатические): Формальдегид, ацетальдегид
Циклические (в т.ч. ароматические): Бензальдегид
2. По числу альдегидных групп:
Одноосновные: H–CHO
Двухосновные: OHC–(CH₂)₄–CHO (глутаровый диальдегид)
Общая формула альдегидов:
R–CHO
Химические свойства альдегидов:
Альдегиды очень реакционноспособны благодаря
карбонильной группе.
1. Окисление:
Альдегиды легко окисляются до карбоновых кислот:
R–CHO + [O] → R–COOH (например: CH₃–CHO → CH₃–
COOH)
2. Восстановление до спиртов:
R–CHO + H₂ → R–CH₂OH
3. Качественные реакции на альдегиды:
Реакция серебряного зеркала (с аммиачным Ag₂O):
R–CHO + [O] → R–COOH + Ag↓ (зеркало)
Реакция с гидроксидом меди(II) при нагревании:
R–CHO + 2Cu(OH)₂ → R–
COOH + Cu₂O↓ (кирпичный осадок)
4. Реакции с нуклеофилами:
Альдегиды вступают в реакции присоединения —
например, с многоатомными спиртами, аммиаком и
его производными.
7. Кетоны
Общая формула кетонов:R–CO–R’
Кетоны
Кетоны — это органические соединения, содержащие
карбонильную группу (C=O), которая связана с двумя
углеводородными радикалами. В отличие от альдегидов,
у кетонов нет атома водорода при карбонильной группе!
Примеры кетонов:
Ацетон – Простейший кетон – CH₃–CO–CH₃
Метилэтилкетон – Пром. растворитель – CH₃–CO–C₂H₅
Циклогеканон – Применяется в парфюмерии –
Циклический кетон
Классификация кетонов:
1. По строению углеродной цепи:
Ациклические (алифатические): ацетон,
метилэтилкетон
Циклические: циклопентанон, циклогеканон
Ароматические: бензофенон (C₆H₅–CO–C₆H₅)
2. По симметричности:
Симметричные: R–CO–R (одинаковые радикалы, как в
ацетоне)
Асимметричные: R–CO–R' (разные радикалы)
Химические свойства кетонов:
1. Реакции присоединения (нуклеофильное
присоединение):
Присоединение спиртов: образование полуацеталей
и ацеталей
Присоединение аминов: образование имино́в
(шлиффовских оснований)
2. Восстановление до спиртов:
R–CO–R’ + H₂ → R–CHOH–R’ (вторичный спирт)
3. Окисление(НЕ дают реакцию серебряного зеркала):
Трудно окисляются, при сильных условиях → смесь
кислот
4. Конденсации:
Альдольная конденсация с образованием βгидрокикетонов:
2CH3COCH3
NaOH, Δ
CH3COCH2CH(OH)CH3
8. Углеводы
Углеводы — это органические соединения, содержащиеуглерод, водород и кислород. То есть, они как бы "гидраты
углерода" (отсюда и название). На самом деле структура
сложнее, но формула отражает общий принцип.
Углеводы — это альдегиды или кетоны с несколькими
гидроксильными группами (–OH).
Общая формула углеводов:
Cn(H2O)m
Сахариды:
1. Моносахариды — это простые сахара. Они
бывают:
Альдозы (с –CHO): глюкоза
Кетозы (с >C=O): фруктоза
Классификация углеводов:
По сложности строения:
Моносахариды – Глюкоза, фруктоза – Простейшие сахара,
не гидролизуются
Дисахариды – Сахароза, лактоза – Состоят из 2 остатков
моносахаридов
Полисахариды – Крахмал, целлюлоза – Макромолекулы
из десятков/сотен остатков
Химические свойства углеводов:
1. Реакции на альдегидную группу (моносахариды):
Серебряное зеркало:
Глюкоза + [Ag(NH₃)₂]OH → зеркальный осадок
Кирпичный осадок с Cu(OH)₂:
Глюкоза + Cu(OH)₂ → Cu₂O↓ (красный)
Общая формула: CnH2nOn
2. Дисахариды остоят из двух остатков
моносахаридов, соединённых гликозидной
связью.
Сахароза = Глюкоза + фруктоза
Лактоза = Глюкоза + галактоза
3. Полисахариды - это высокомолекулярные
соединения, состоящие из большого числа
моносахаридов.
9. Эфиры
Эфиры — это органические соединения, в которых атомкислорода соединяет два углеводородных радикала (R и R′).
Они имеют формулу:
R–O–R’
где R и R′ — алкильные или
арильные группы (могут быть
одинаковыми или разными).
Примеры эфиров:
Химические свойства эфиров:
Номенклатура (название) эфиров:
2. Горение:
Как и другие органические вещества, эфиры горят
с образованием CO₂ и H₂O:
C₂H₅–O–C₂H₅ + 6O₂ → 4CO₂ + 5H₂O
3. Реакция с кислотами (образование сложных
эфиров — не путать!):
Хотя простые эфиры сами не образуют сложные
эфиры, они могут участвовать в реакциях, если
активированы.
Диметиловый эфир (диметиловый эфир) – Самый простой эфир 1. Гидролиз (разложение водой):
Происходит при действии кислот или щелочей (обычно
– CH₃–O–CH₃
при нагревании)
Метилэтиловый эфир – Эфир с разными радикалами – CH₃–O–
Кислотный гидролиз:
C₂H₅
H+, Δ
R–OH + R’–OH
Диэтиловый эфир – Летучая горючая жидкость – C₂H₅–O–C₂H₅ R–O–R’ + H₂O
Сначала называют более простую алкильную группу, затем
более сложную, и в конце добавляют слово "эфир".
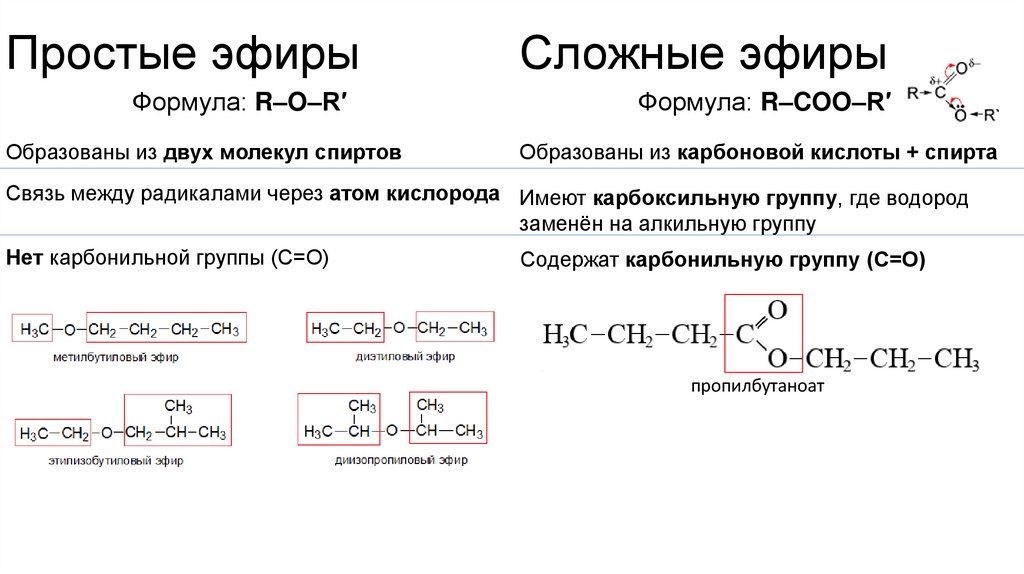
10. Простые эфиры
Сложные эфирыФормула: R–O–R′
Формула: R–COO–R′
Образованы из двух молекул спиртов
Образованы из карбоновой кислоты + спирта
Связь между радикалами через атом кислорода Имеют карбоксильную группу, где водород
заменён на алкильную группу
Нет карбонильной группы (C=O)
Содержат карбонильную группу (C=O)
пропилбутаноат








 chemistry
chemistry








