Similar presentations:
Кислородсодержащие органические соединения. Спирты
1. ОРГАНИЧЕСКАЯ ХИМИЯ Лекция 9
*1. Кислородсодержащие
органические соединения
2. Спирты
Нижник Я.П. http:// norgchem.professorjournal.ru
1
14.12.2018
2. КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
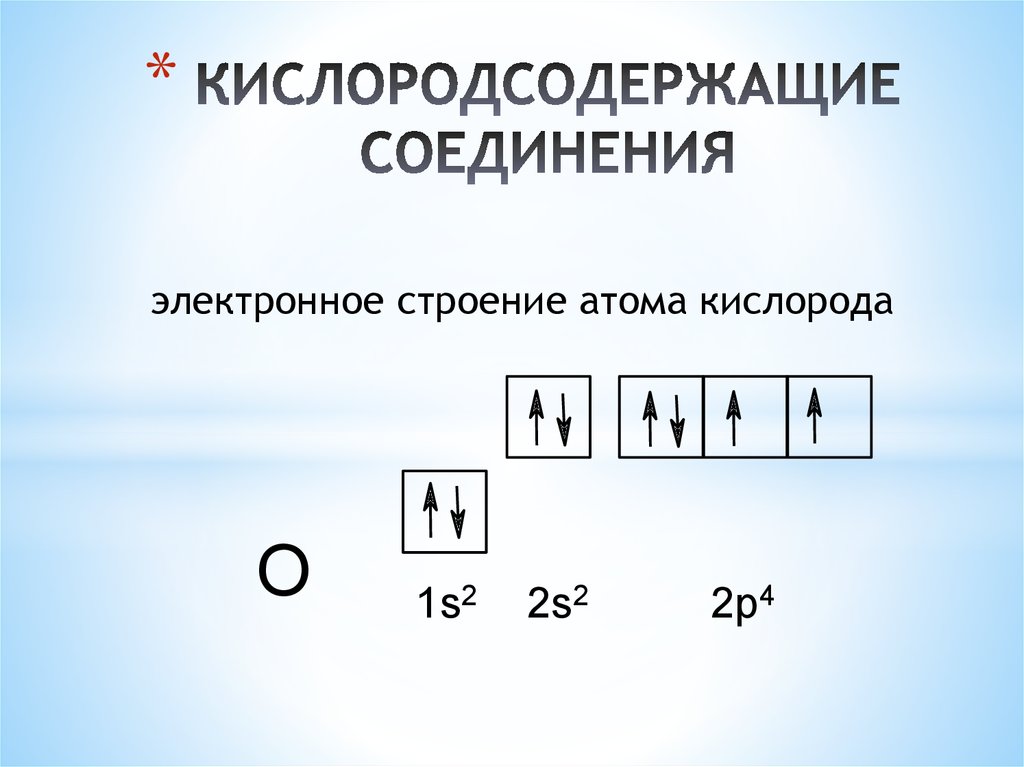
*электронное строение атома кислорода
O
1s2
2s2
2p4
3. КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
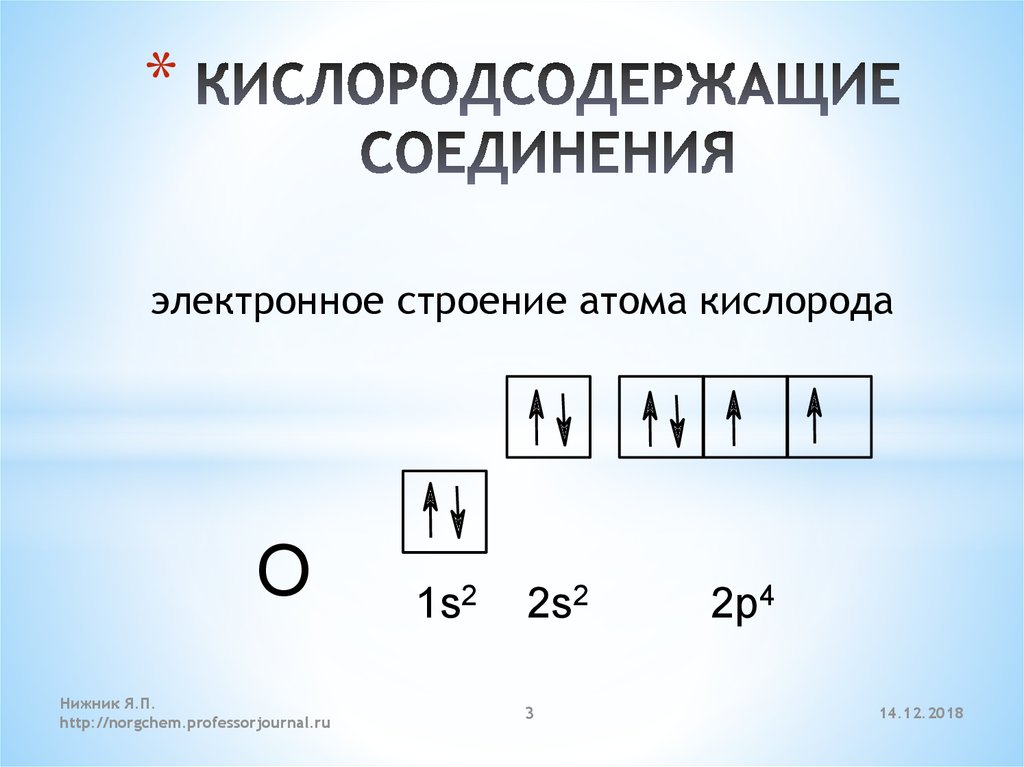
*электронное строение атома кислорода
O
Нижник Я.П.
http://norgchem.professorjournal.ru
1s2
2s2
3
2p4
14.12.2018
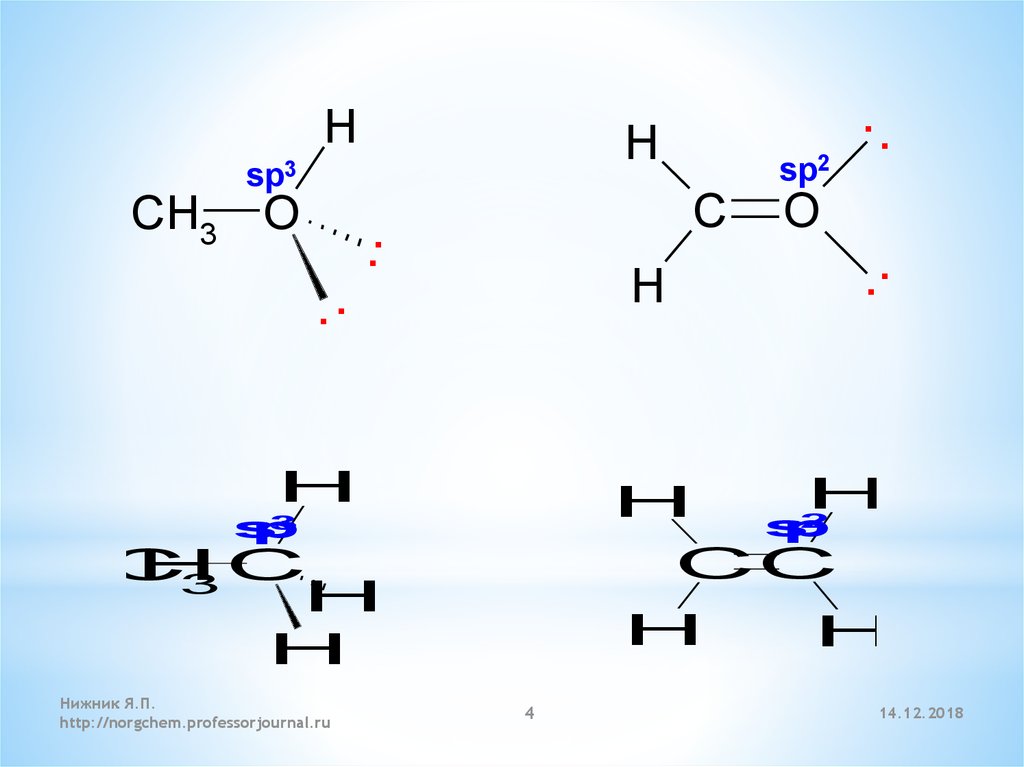
4.
HH
sp3
CH3
O
..
C
..
H
H
O
..
H
H
2
s
p
CC
3
s
p
C
H
C
3
H
H
Нижник Я.П.
http://norgchem.professorjournal.ru
sp2
..
H
4
H
14.12.2018
5.
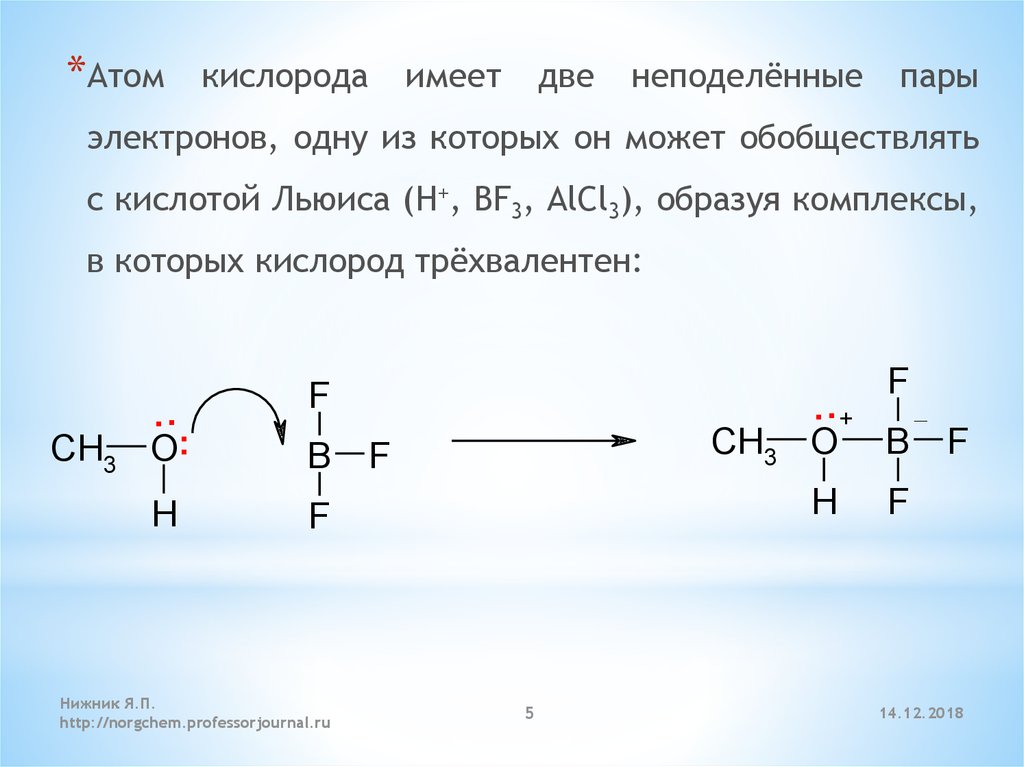
*Атомкислорода
имеет
две
неподелённые
пары
электронов, одну из которых он может обобществлять
с кислотой Льюиса (H+, BF3, AlCl3), образуя комплексы,
в которых кислород трёхвалентен:
CH3
..+
F
...
O.
B
H
F
Нижник Я.П.
http://norgchem.professorjournal.ru
F
5
F
CH3 O
B
H
F
F
14.12.2018
6.
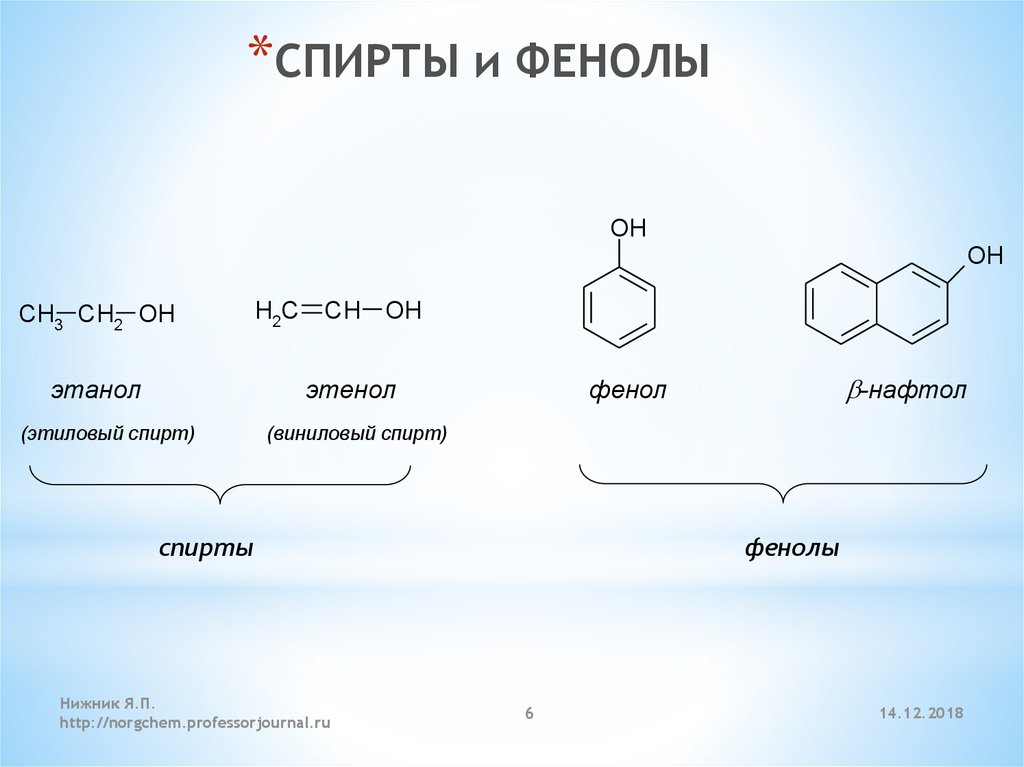
*СПИРТЫ и ФЕНОЛЫOH
OH
CH3 CH2 OH
этанол
H2C
CH OH
этенол
(этиловый спирт)
b-нафтол
фенол
(виниловый спирт)
спирты
Нижник Я.П.
http://norgchem.professorjournal.ru
фенолы
6
14.12.2018
7.
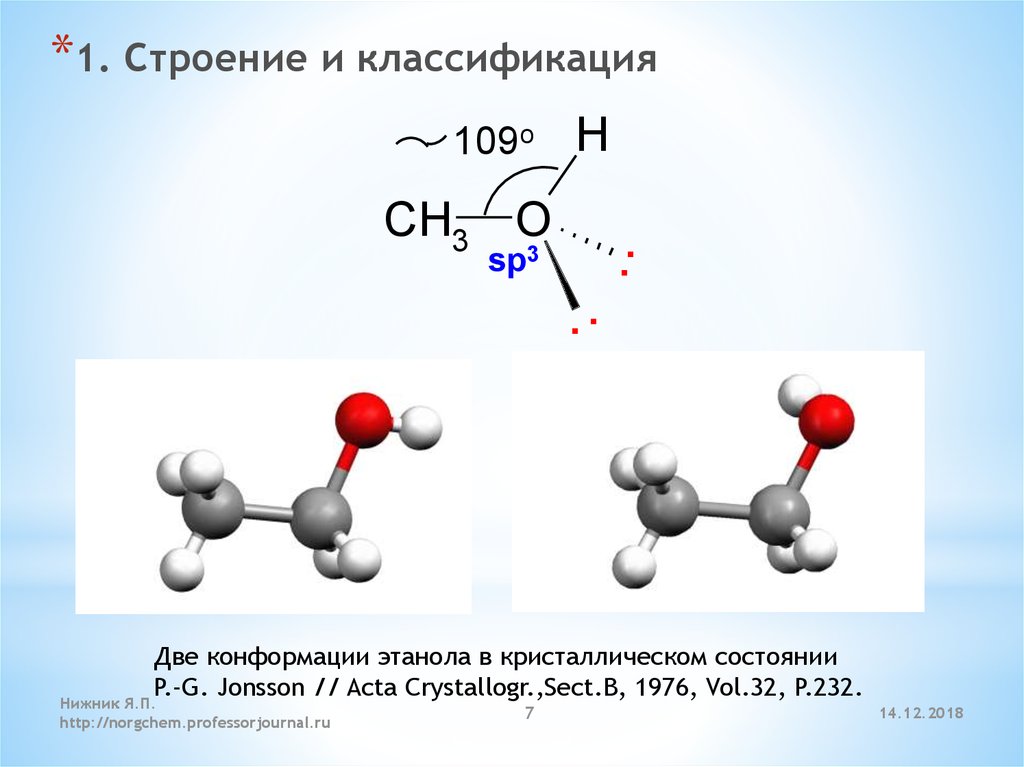
*1. Строение и классификация109o
H
CH3 O
sp3
..
..
Две конформации этанола в кристаллическом состоянии
P.-G. Jonsson // Acta Crystallogr.,Sect.B, 1976, Vol.32, P.232.
Нижник Я.П.
http://norgchem.professorjournal.ru
7
14.12.2018
8.
* 1. Классификация спиртов по количествугидроксильных групп
1). Одноатомные спирты (моноолы)
CH3 CH2 OH
2). двухатомные спирты (диолы)
CH3 CH OH
OH
этандиол-1,1
CH3 CH CH2
CH2 OH
CH2 CH2
OH
OH OH
OH OH
этандиол-1,2
(этиленгликоль)
пропандиол-1,2
(пропиленгликоль)
метандиол
гем-диолы
Нижник Я.П.
http://norgchem.professorjournal.ru
гликоли
8
14.12.2018
9.
3). Многоатомные спиртыC
H
C
H
C
H
C
H
C
H
C
H
C
H
2
2
2
2
O
H
O
H
O
H
O
H
O
H
O
H
O
H
пропантриол-1,2,3
(глицерин)
Нижник Я.П.
http://norgchem.professorjournal.ru
бутантетраол-1,2,3,4
(эритрит)
9
14.12.2018
10.
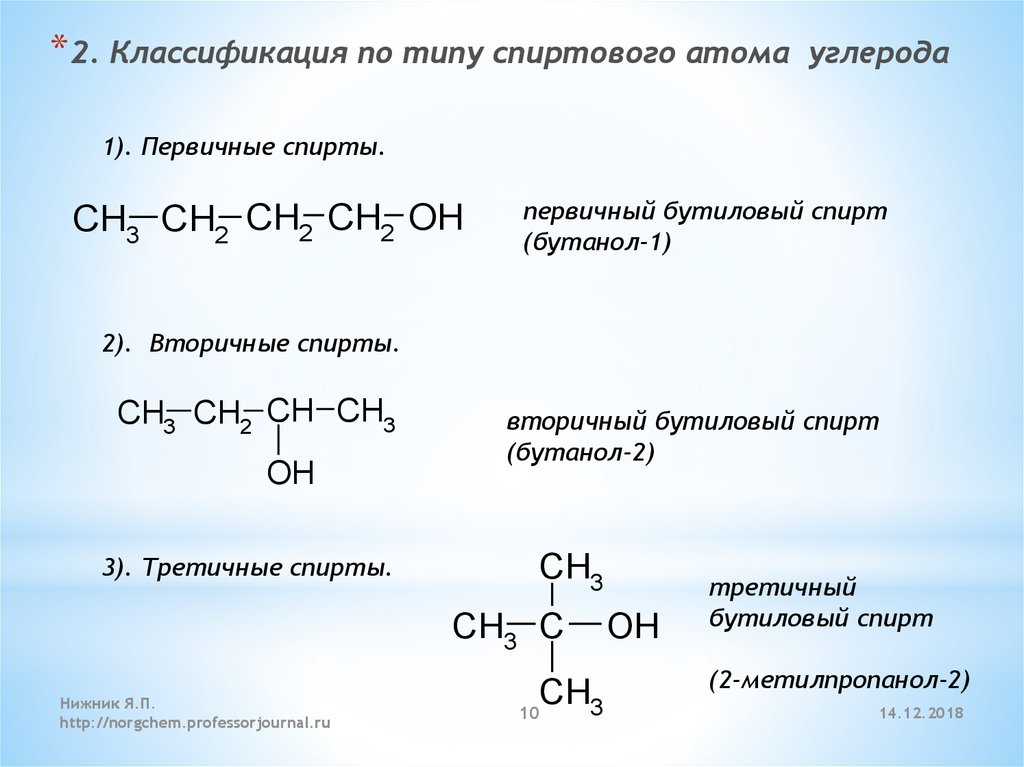
* 2. Классификация по типу спиртового атомауглерода
1). Первичные спирты.
CH3 CH2 CH2 CH2 OH
первичный бутиловый спирт
(бутанол-1)
2). Вторичные спирты.
CH3 CH2 CH CH3
OH
3). Третичные спирты.
вторичный бутиловый спирт
(бутанол-2)
CH3
CH3 C
Нижник Я.П.
http://norgchem.professorjournal.ru
CH3
10
OH
третичный
бутиловый спирт
(2-метилпропанол-2)
14.12.2018
11.
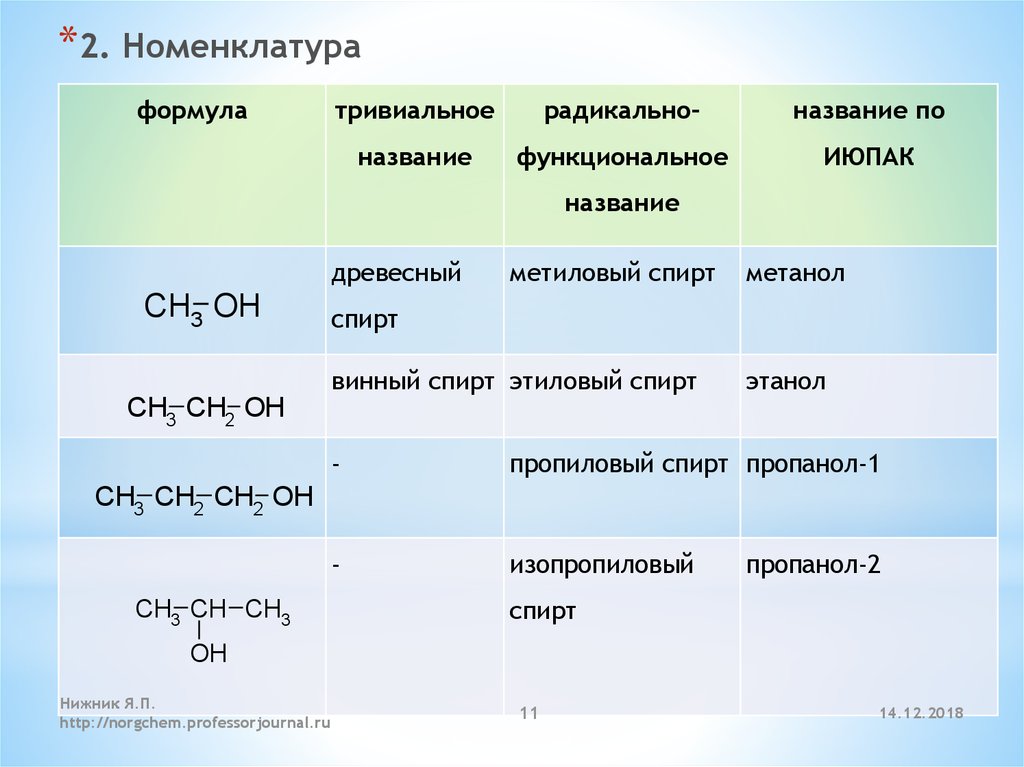
*2. Номенклатураформула
тривиальное
радикально-
название по
название
функциональное
ИЮПАК
название
древесный
CH3 OH
метиловый спирт
метанол
спирт
винный спирт этиловый спирт
этанол
CH3 CH2 OH
-
пропиловый спирт пропанол-1
-
изопропиловый
CH3 CH2 CH2 OH
CH3 CH CH3
пропанол-2
спирт
OH
Нижник Я.П.
http://norgchem.professorjournal.ru
11
14.12.2018
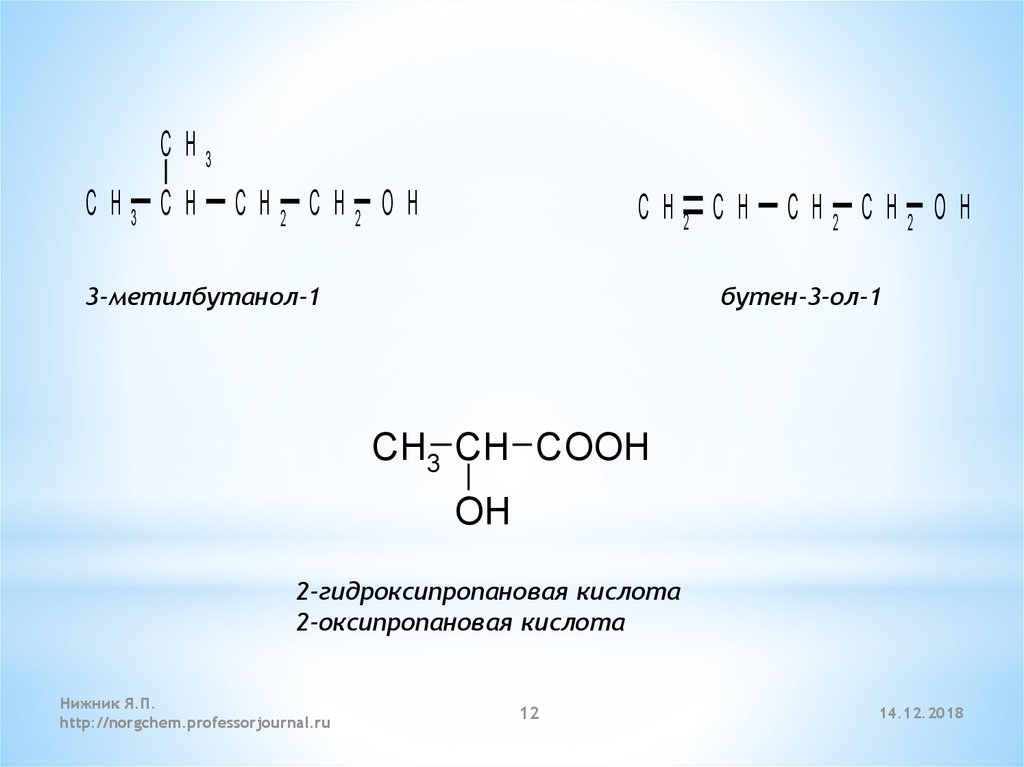
12.
CHCH
3
CH
3
CH
2
CH
2
O H
CH
3-метилбутанол-1
2
CH
CH
2
CH
2
O H
бутен-3-ол-1
CH3 CH COOH
OH
2-гидроксипропановая кислота
2-оксипропановая кислота
Нижник Я.П.
http://norgchem.professorjournal.ru
12
14.12.2018
13.
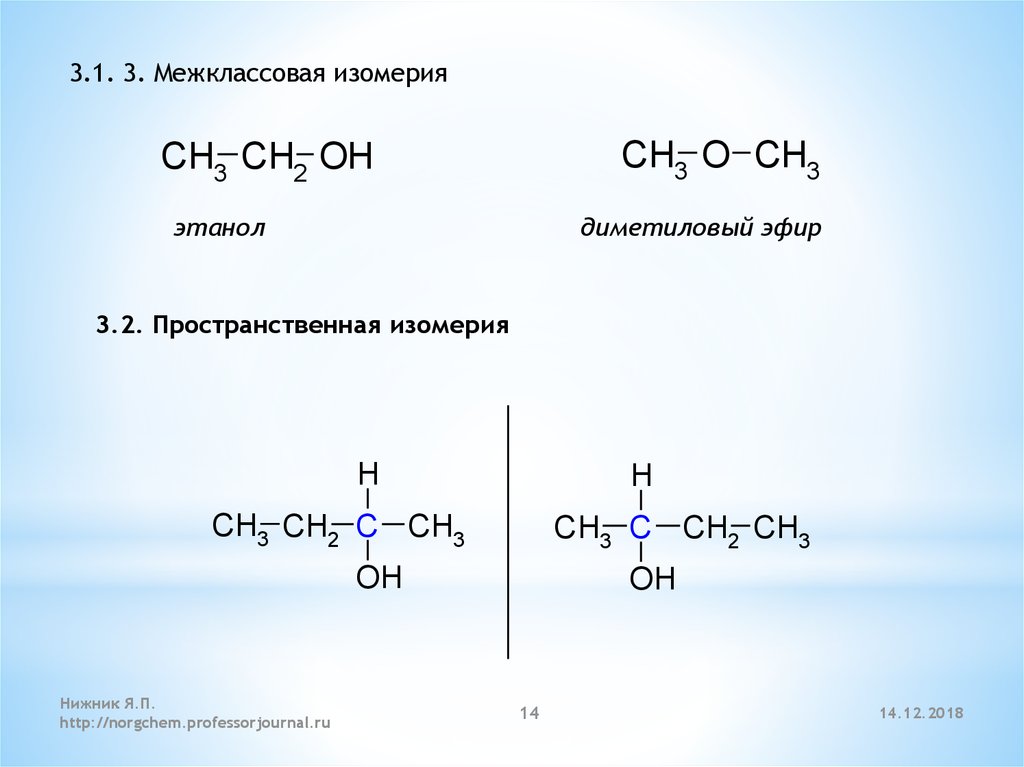
*3. Изомерия3.1. Cтруктурная изомерия
3.1. 1. Изомерия положения
заместителей
CH3 CH2 CH2 CH2 CH2
CH3 CH2 CH2 CH CH3
OH
пентанол-1
CH3 CH2 CH CH2 CH3
OH
OH
пентанол-2
пентанол-3
3.1. 2. Изомерия углеродного скелета
CH3
CH3 CH CH2 OH
CH3 CH2 CH2 CH2 OH
бутанол-1
Нижник Я.П.
http://norgchem.professorjournal.ru
2-метилпропанол-1
13
14.12.2018
14.
3.1. 3. Межклассовая изомерияCH3 O CH3
CH3 CH2 OH
этанол
диметиловый эфир
3.2. Пространственная изомерия
H
H
CH3 CH2 C CH3
CH3 C CH2 CH3
OH
Нижник Я.П.
http://norgchem.professorjournal.ru
OH
14
14.12.2018
15.
*4. Физические и биологические свойства*Гидроксигруппа является сильно полярной
группой, поэтому низшие спирты растворяются
в воде неограниченно: метанол, этанол,
пропанол смешиваются с водой во всех
отношениях.
*С увеличением количества атомов углерода
спирты всё более начинают напоминать
углеводороды.
*Растворимость амилового спирта (пентанола-1)
– 2,7 г/ 100 мл,
*растворимость октанола-1 – 0,059 г/ 100 г.
Нижник Я.П.
http://norgchem.professorjournal.ru
15
14.12.2018
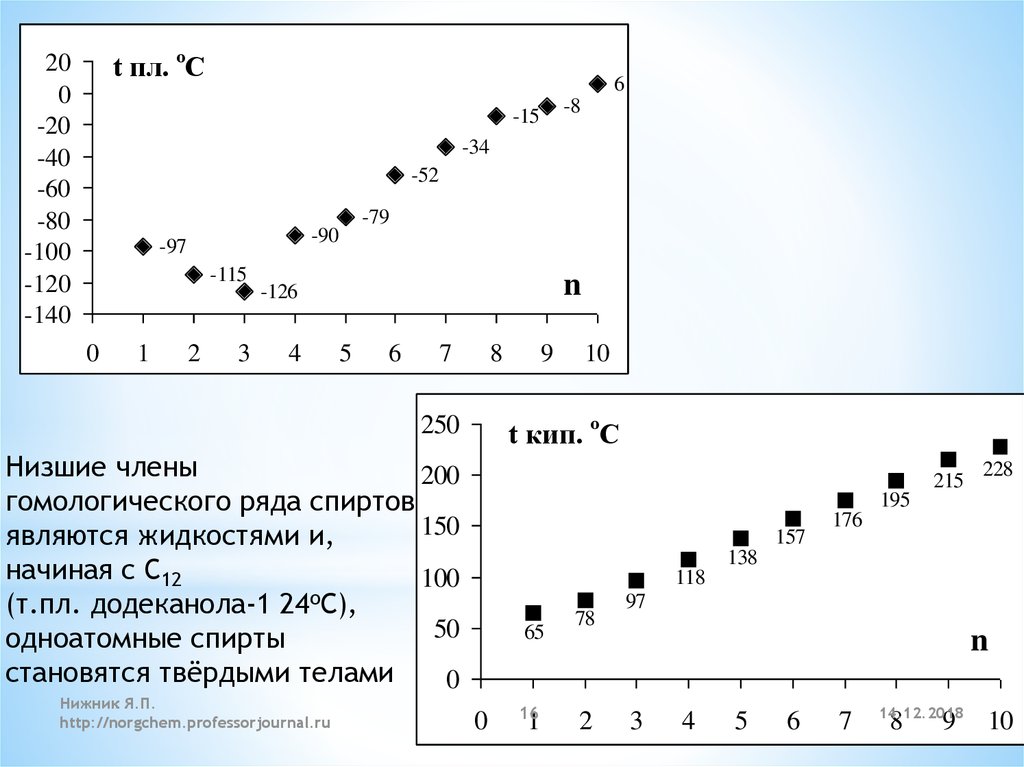
16.
t пл. оС20
0
-20
-40
-60
-80
-100
-120
-140
6
-8
-15
-34
-52
-97
-115
0
1
-79
-90
2
3
n
-126
4
5
6
7
8
10
t кип. оС
250
Низшие члены
200
гомологического ряда спиртов
150
являются жидкостями и,
начиная с C12
100
о
(т.пл. додеканола-1 24 С),
50
одноатомные спирты
становятся твёрдыми телами
0
Нижник Я.П.
http://norgchem.professorjournal.ru
9
*
215
228
195
157
176
138
118
65
0
16
1
78
2
97
n
3
4
5
6
7
14.12.2018
8
9
10
17.
* Температуры кипения спиртов являются аномально высокимипо сравнению с температурами кипения изомерных им
простых эфиров.
Таблица 2. Сопоставление
спиртов и простых эфиров
температур
кипения
изомерных
спирт
формула
Т. кип. оС
Эфир
формула
Т. кип. оС
этиловый
C2H5OH
78
диметиловый
CH3OCH3
-24
бутиловый
C4H9OH
118
диэтиловый
C2H5OC2H5
+34.6
гексиловый
C6H13OH
157
дипропиловый
C3H7OC3H7
141
Нижник Я.П.
http://norgchem.professorjournal.ru
17
14.12.2018
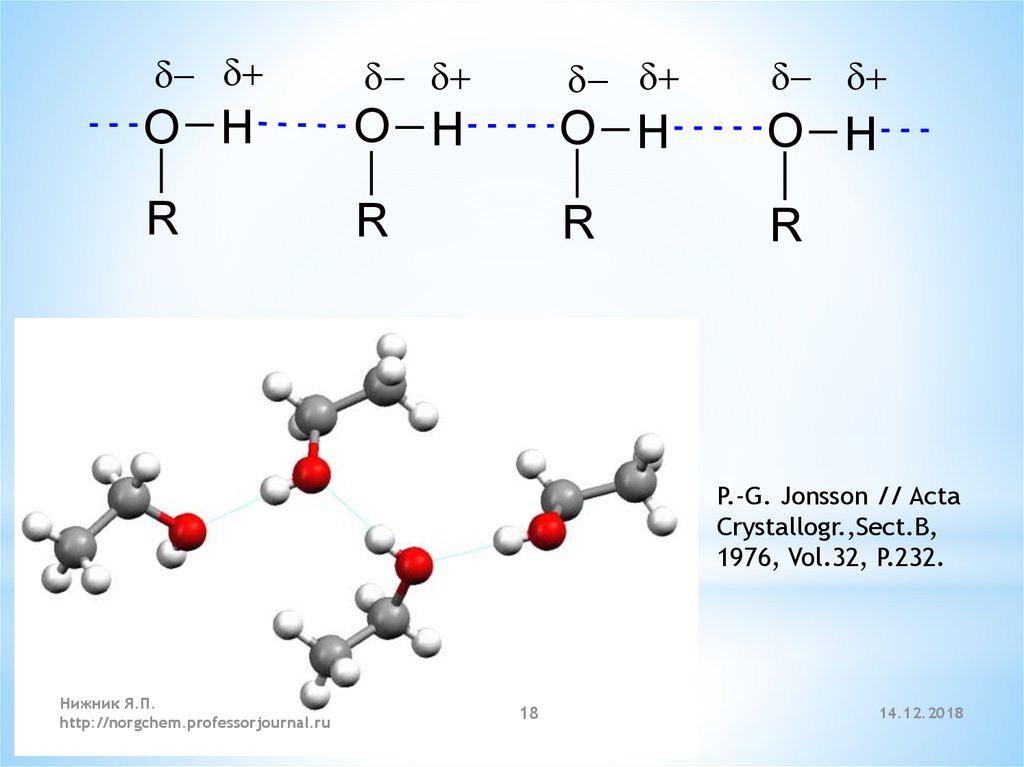
18.
O HO H
O H
O H
R
R
R
R
P.-G. Jonsson // Acta
Crystallogr.,Sect.B,
1976, Vol.32, P.232.
Нижник Я.П.
http://norgchem.professorjournal.ru
18
14.12.2018
19.
Метиловый спирт считаетсясамым ядовитым спиртом.
Вызывает
слепоту
или
смерть.
http://photofile.ru/users/pratezgalavy/2175396/37069795/
Нижник Я.П.
http://norgchem.professorjournal.ru
19
14.12.2018
20.
* Токсическоедействие метанола связано с угнетением центральной
нервной системы, развитием тяжелого метаболического ацидоза,
поражением сетчатки глаза и дистрофией зрительного нерва.
* Летальная доза при приёме внутрь — 100 мл (без предварительного
приёма этанола).
* Клиника интоксикации
* Опьянение выражено слабо. Метиловый спирт обычно вызывает
алкогольное оглушение без типичного опьянения. Далее наступает
латентный период, который длится в среднем 12-24 часа (от 1 часа
до 40 часов).
* С окончанием латентного периода усиливаются симптомы
интоксикации — тошнота, рвота, боли в животе, головная боль,
головокружение, боль в икроножных мышцах. Нарушается зрение
(снижение остроты зрения, неясность видения, мелькание «мушек»
перед глазами, диплопия, слепота); отмечаются мидриаз и
ослабленная реакция зрачков на свет.
* Сознание спутано, возможно психомоторное возбуждение или кома,
судороги или гипертонус мышц конечностей. Развивается
быстропрогрессирующая
острая
сердечно-сосудистая
недостаточность в сочетании с центральными нарушениями
дыхания. Смерть наступает от остановки дыхания, отёка мозга.
http://www.spruce.ru/urgent/toxic/methanol.html
Нижник Я.П.
http://norgchem.professorjournal.ru
20
14.12.2018
21.
*Этиловый спирт оказывает опьяняющеедействие.
“вино веселит сердце человека” (Псалом103:15)
*В высоких концентрациях этанол оказывает
анестезирующее действие.
*Злоупотребление этанолом ведёт к развитию
алкоголизма, деградации личности психическим
расстройствам и соматическим заболеваниям.
Нижник Я.П.
http://norgchem.professorjournal.ru
21
14.12.2018
22.
Нижник Я.П.http://norgchem.professorjournal.ru
22
14.12.2018
23.
*5. Химические свойства*5.1. Кислотные свойства спиртов
2 C2H5OH + 2 Na
2 C2H5ONa + H2
этоксид натрия
Нижник Я.П.
http://norgchem.professorjournal.ru
23
14.12.2018
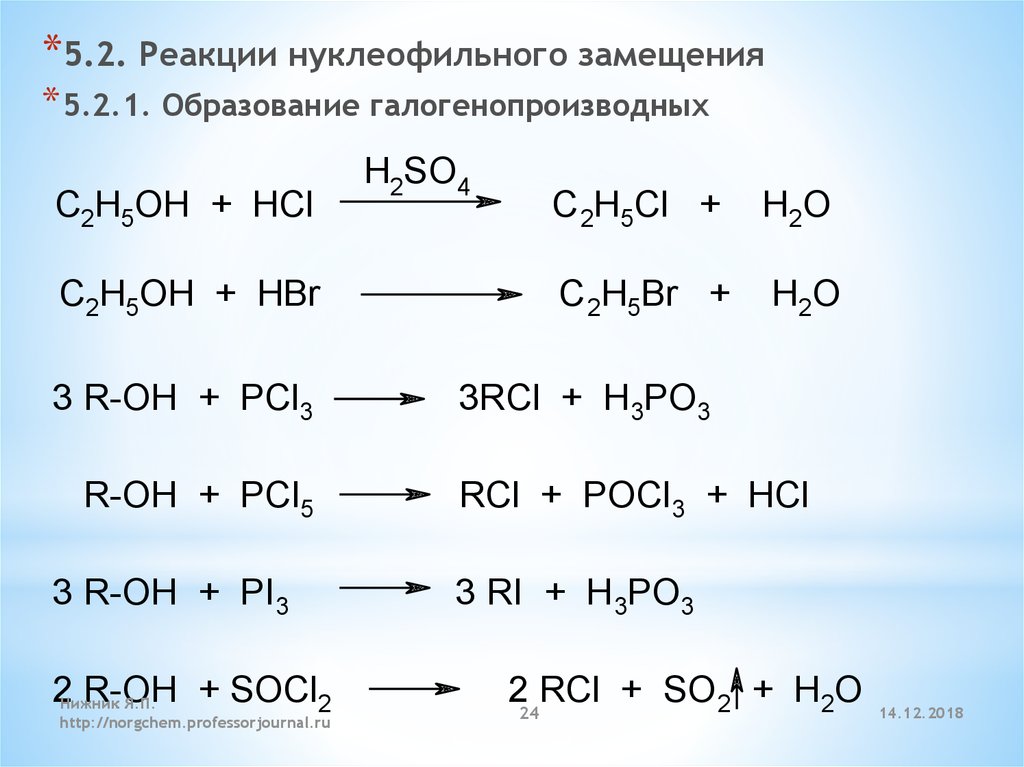
24.
*5.2. Реакции нуклеофильного замещения* 5.2.1. Образование галогенопроизводных
C2H5OH + HCl
C2H5OH + HBr
3 R-OH + PCl3
R-OH + PCl5
3 R-OH + PI3
+ SOCl2
R-OH
2Нижник
Я.П.
http://norgchem.professorjournal.ru
H2SO4
C 2H5Cl +
H2O
C 2H5Br +
H2O
3RCl + H3PO3
RCl + POCl3 + HCl
3 RI + H3PO3
224RCl + SO 2 + H2O
14.12.2018
25.
*5.2.2. Образование простых эфировC2H5 O H + H O C2H5
t
H2SO4
этанол
H2O
диэтилововый эфир
300oC
- H2O
C2H5OH
C2H5 O C2H5 +
C2H5 O C2H5
Al2O3
375oC
Нижник Я.П.
http://norgchem.professorjournal.ru
- H252O
H2C CH2
14.12.2018
26.
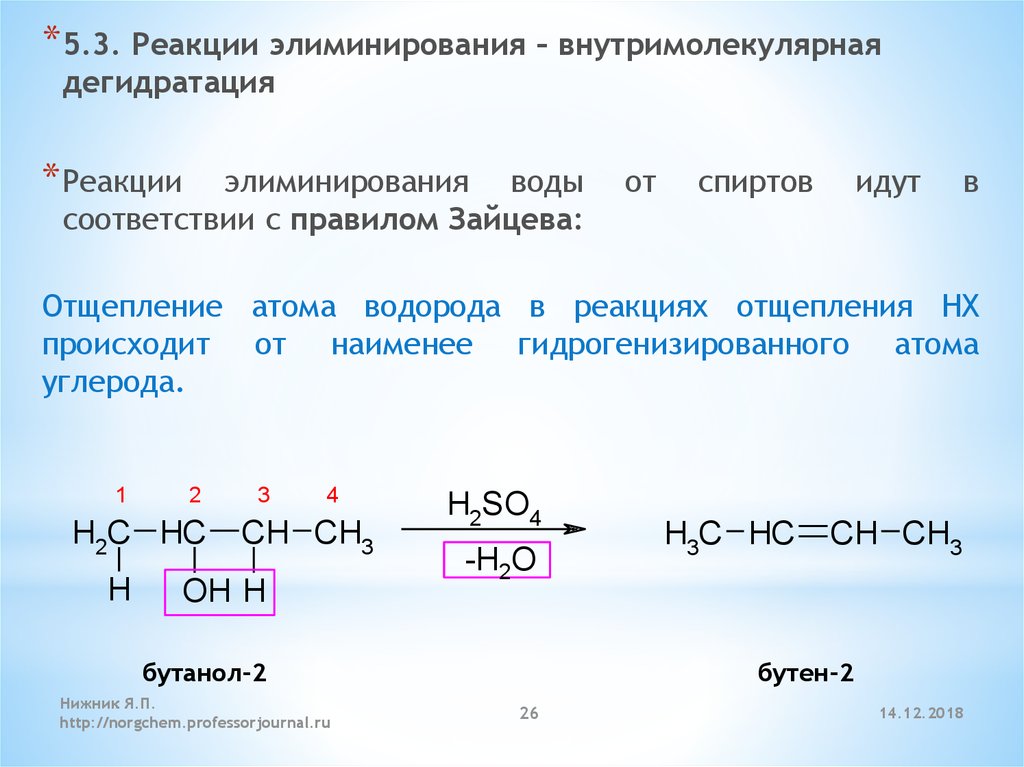
* 5.3. Реакции элиминирования – внутримолекулярнаядегидратация
* Реакции
элиминирования воды
соответствии с правилом Зайцева:
от
спиртов
идут
в
Отщепление атома водорода в реакциях отщепления HX
происходит от наименее гидрогенизированного атома
углерода.
1
2
H2C HC
H
3
4
CH CH3
OH H
H2SO4
-H2O
бутанол-2
Нижник Я.П.
http://norgchem.professorjournal.ru
H3C HC
CH CH3
бутен-2
26
14.12.2018
27.
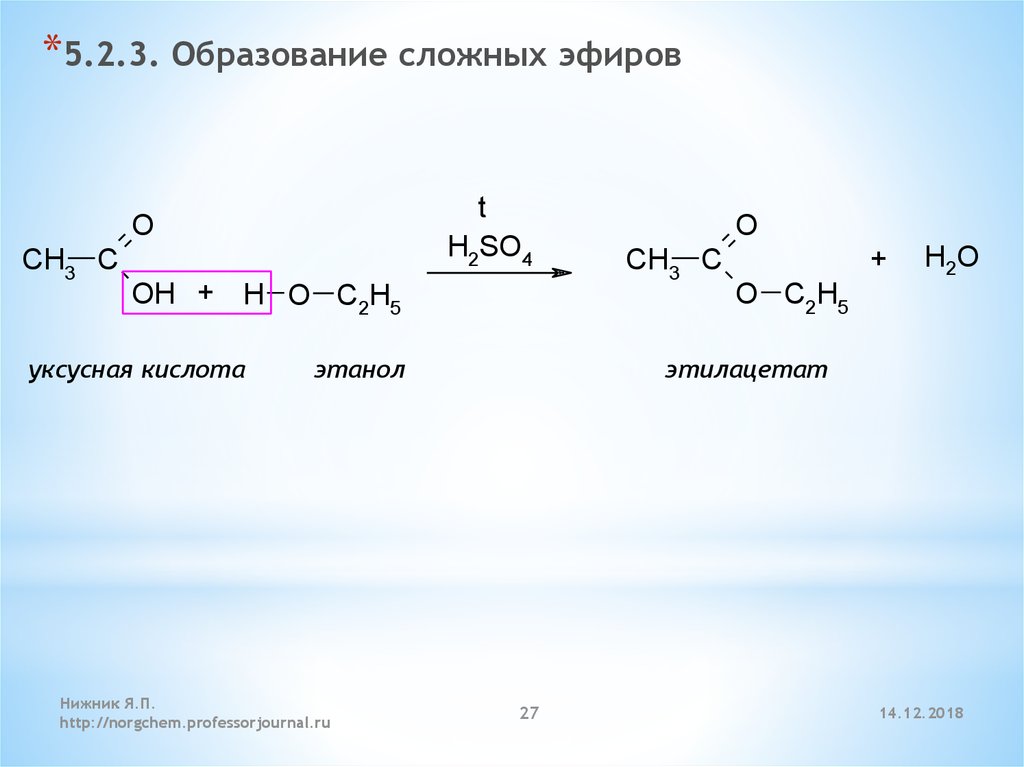
*5.2.3. Образование сложных эфировt
H2SO4
O
CH3 C
OH + H O C2H5
уксусная кислота
этанол
Нижник Я.П.
http://norgchem.professorjournal.ru
O
CH3 C
+
H2O
O C2H5
этилацетат
27
14.12.2018
28.
*5.3. Реакции окисления спиртов*Мягкие окислители окисляют первичные
спирты в альдегиды, а вторичные спирты в
кетоны.
*В жёстких условиях окисление идёт до
карбоновых кислот.
*Третичные спирты окисляются в жёстких
условиях с разрывом связи C-C
R CH2 OH
Нижник Я.П.
http://norgchem.professorjournal.ru
H2CrO4
O
R C
H
28
14.12.2018
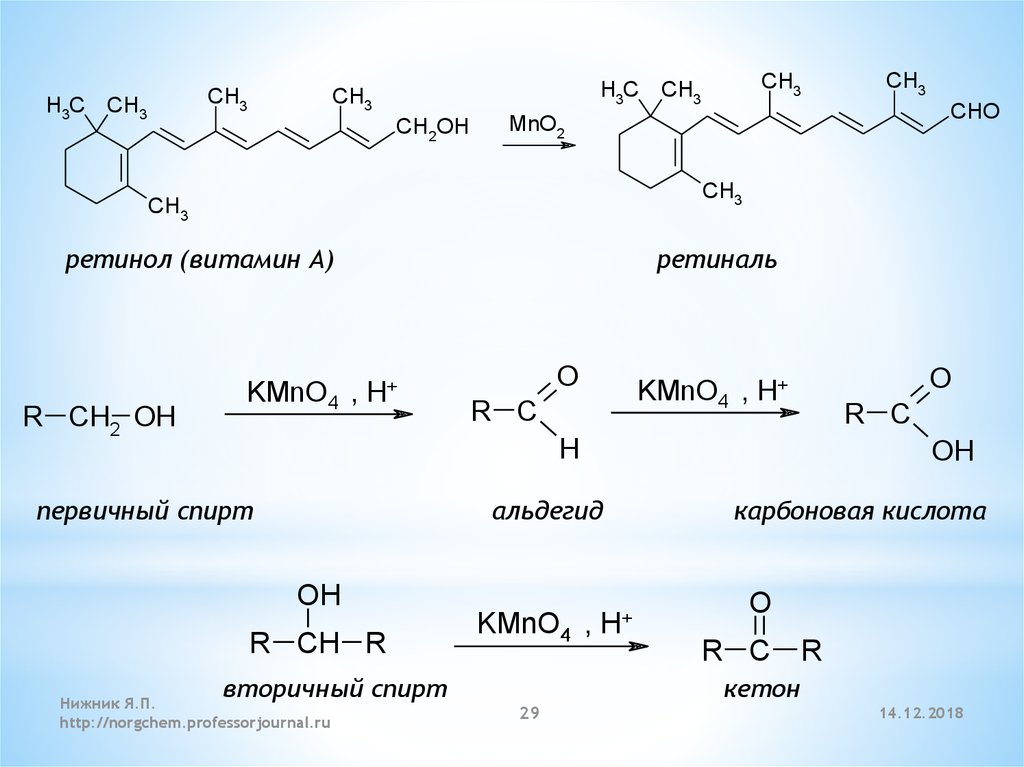
29.
H3CCH3
H3C
CH3
CH3
CH2OH
CH3
CHO
MnO2
CH3
CH3
ретинол (витамин А)
R CH2 OH
CH3
CH3
KMnO4 , H+
ретиналь
O
O
KMnO4 , H+
R C
R C
H
первичный спирт
OH
альдегид
OH
R CH R
KMnO4 ,
вторичный спирт
Нижник Я.П.
http://norgchem.professorjournal.ru
H+
карбоновая кислота
O
R C
R
кетон
29
14.12.2018
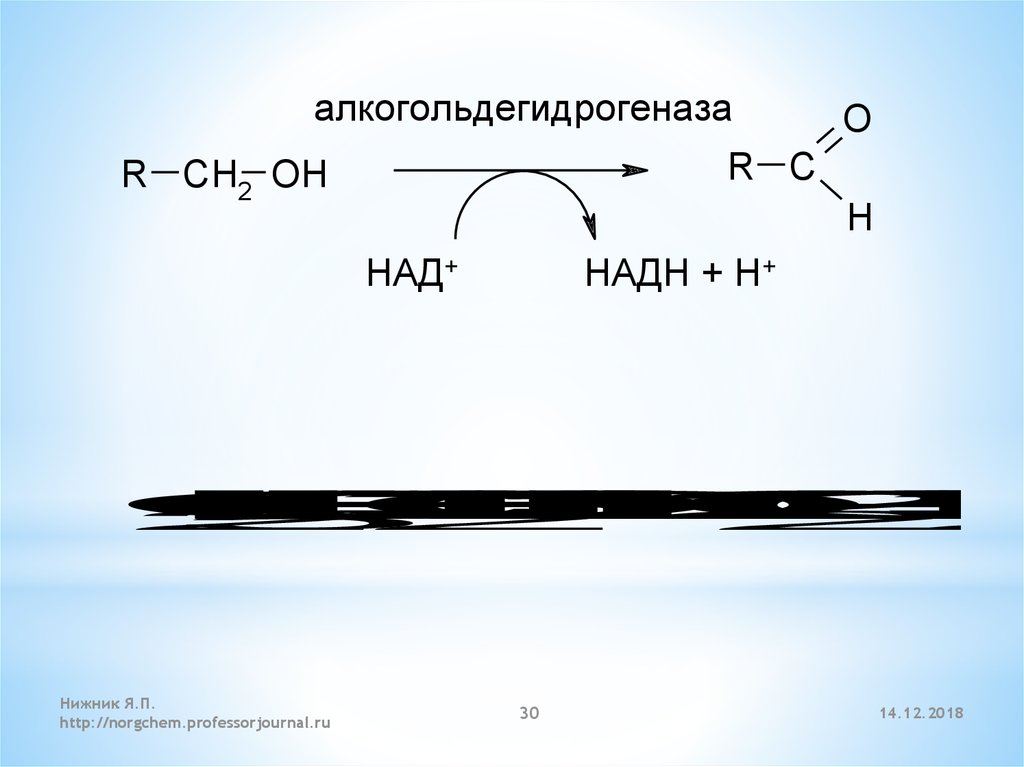
30.
алкогольдeгидрогeназаO
R C
R CH2 OH
H
НАД+
НАДН + H+
C
H
O
H
+
3
O
C
O
+
3
H
O
2
5
22
2
2
Нижник Я.П.
http://norgchem.professorjournal.ru
30
14.12.2018
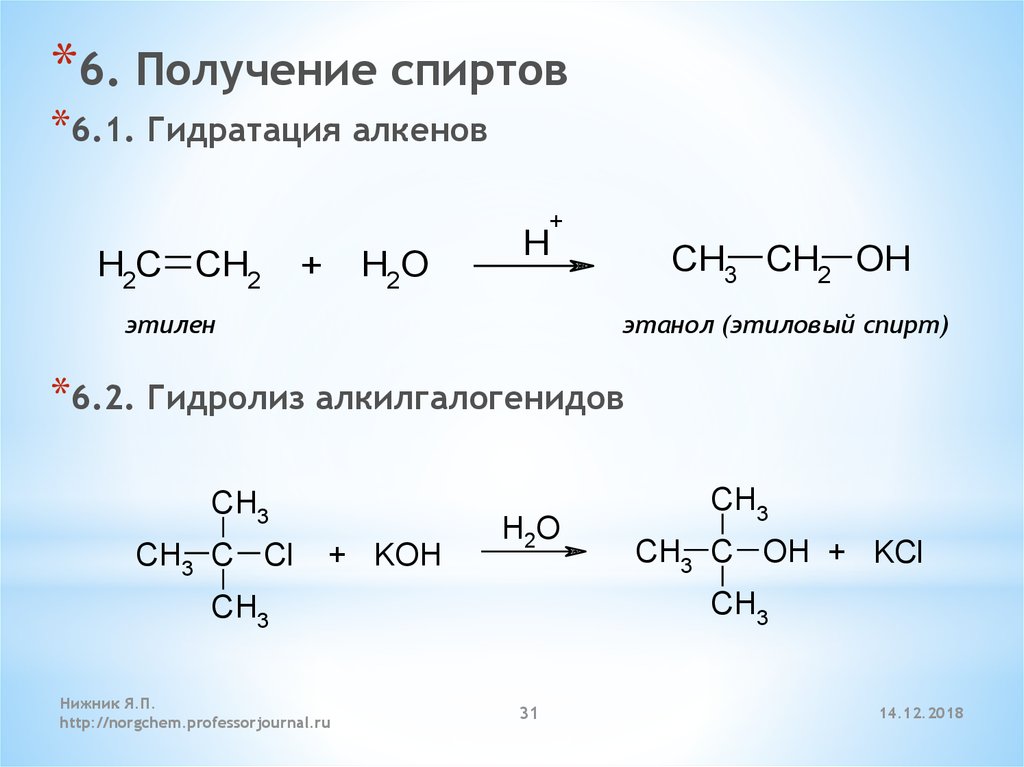
31.
*6. Получение спиртов*6.1. Гидратация алкенов
+
H2C CH2
H2O
+
H
этилен
CH3 CH2 OH
этанол (этиловый спирт)
*6.2. Гидролиз алкилгалогенидов
CH3
CH3 C Cl
+ KOH
H2O
CH3 C OH + KCl
CH3
CH3
Нижник Я.П.
http://norgchem.professorjournal.ru
CH3
31
14.12.2018
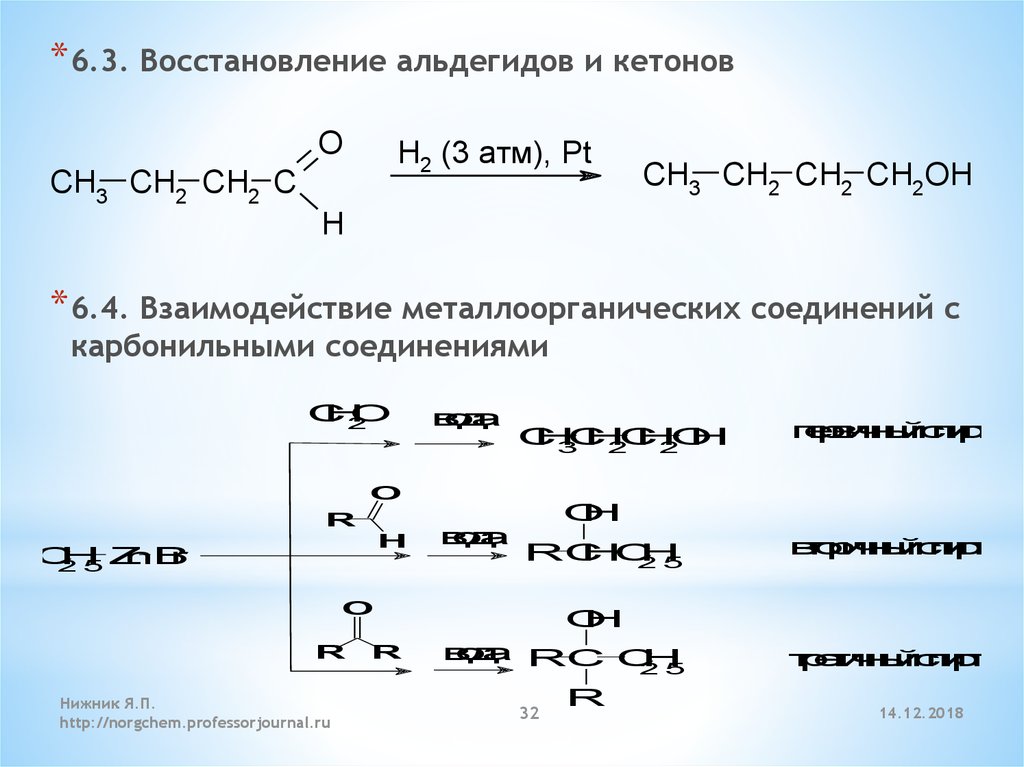
32.
* 6.3. Восстановление альдегидов и кетоновO
H2 (3 атм), Pt
CH3 CH2 CH2 C
CH3 CH2 CH2 CH2OH
H
* 6.4. Взаимодействие металлоорганических соединений с
карбонильными соединениями
C
H
O
2
в
о
д
а
C
H
C
H
C
H
O
H
3
2
2
O
R
H
C
HZ
nB
r
25
в
о
д
а
O
H
RC
HC
H
25
O
R
Нижник Я.П.
http://norgchem.professorjournal.ru
R
п
e
р
в
и
ч
н
ы
йс
п
и
р
т
в
т
о
р
и
ч
н
ы
йс
п
и
р
т
O
H
в
о
д
а RC C
H
25
32
R
т
р
e
т
и
ч
н
ы
йс
п
и
р
т
14.12.2018
33.
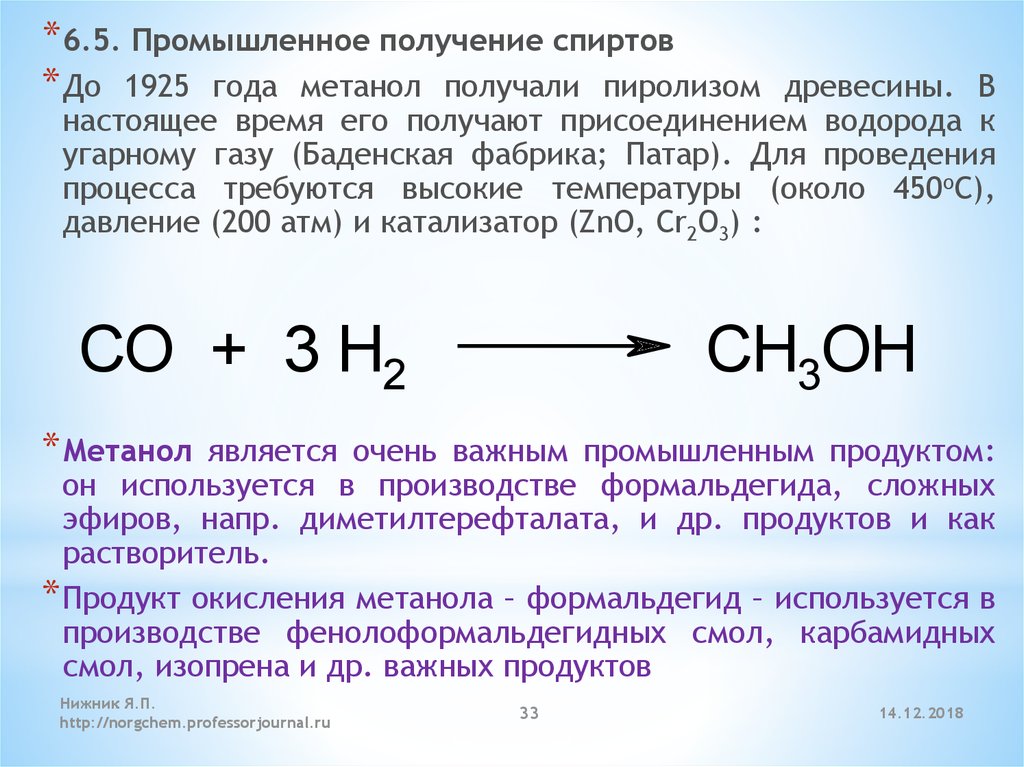
* 6.5. Промышленное получение спиртов* До 1925 года метанол получали пиролизом
древесины. В
настоящее время его получают присоединением водорода к
угарному газу (Баденская фабрика; Патар). Для проведения
процесса требуются высокие температуры (около 450оС),
давление (200 атм) и катализатор (ZnO, Cr2O3) :
CO + 3 H2
CH3OH
* Метанол
является очень важным промышленным продуктом:
он используется в производстве формальдегида, сложных
эфиров, напр. диметилтерефталата, и др. продуктов и как
растворитель.
* Продукт окисления метанола – формальдегид – используется в
производстве фенолоформальдегидных смол, карбамидных
смол, изопрена и др. важных продуктов
Нижник Я.П.
http://norgchem.professorjournal.ru
33
14.12.2018
34.
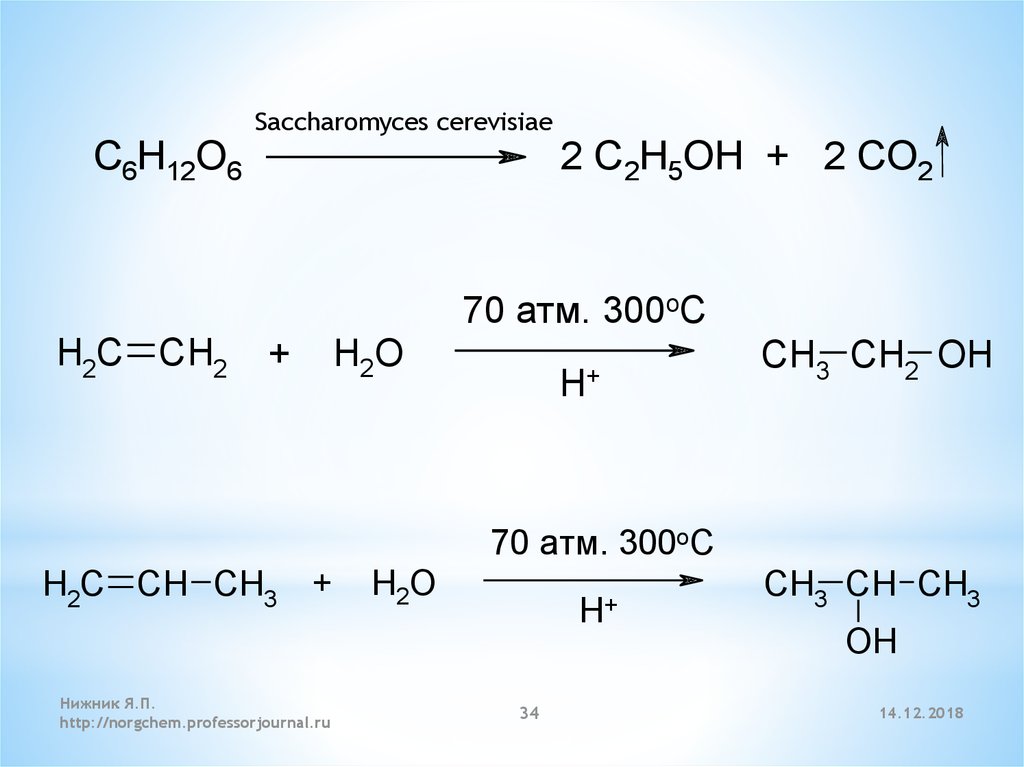
Saccharomyces cerevisiaeC6H12O6
2 C2H5OH + 2 CO2
70 атм. 300oC
H2C CH2
+
H2O
H+
CH3 CH2 OH
70 атм. 300oC
H2C CH CH3
+
Нижник Я.П.
http://norgchem.professorjournal.ru
H2O
H+
34
CH3 CH CH3
OH
14.12.2018
35.
* Бутиловый спирт используется как растворитель, топливои для получения пластификаторов (дибутилфталата) и т.д.
* Бутиловый спирт получают действием бактерий Clostridium
acetobutylicum (Weizmann) на углеводы.
* Микробиологический синтез бутанола был разработан
Хаимом Вейцманом - первым президентом Израиля.
Clostridium acetobutylicum
http://www.napier.ac.uk/randkt/rktcentres/bfrc/Pages/A
BEhistory.aspx
Нижник Я.П.
http://norgchem.professorjournal.ru
Хаим Вейцман (слева, в арабской
35
традиционной
одежде) и эмир14.12.2018
Фейсал I
http://ru.wikipedia.org/wiki/Вейцман_Хаим
36.
*МНОГОАТОМНЫЕ СПИРТЫ*1. Изомерия и номенклатура
CH2 OH
CH2 OH
этиленгликоль
Нижник Я.П.
http://norgchem.professorjournal.ru
CH2 OH
CH OH
CH2 OH
глицерин
36
CH2 OH
CH OH
CH OH
CH2 OH
эритрит
14.12.2018
37.
CH2 OHCH2 OH
H C
OH
H C
H C
OH
HO C
H C
OH
H C
HO C
H
OH
CH2 OH
CH2 OH
рибит
ксилит
CH2 OH
H C
OH
OH
CH2 OH
H C
CH2 OH
OH
HO C
H
H
H
HO C
H
HO C
H C
OH
HO C
H
H C
OH
H C
OH
H C
OH
H C
OH
CH2OH
D-сорбит (D-глюцит)
CH2OH
дульцит
37
Нижник Я.П.
http://norgchem.professorjournal.ru
CH2OH
D- маннит
14.12.2018
38.
*2. Физические и биологические свойства* Этиленгликоль
и
пропиленгликоль
являются
высококипящими жидкостями, глицерин представляет собой
очень вязкую жидкость. Многоатомные спирты с
количеством
гидроксигрупп
больше
трёх
являются
твёрдыми телами.
* Многоатомные
спирты прекрасно растворяются в воде. Это
обусловлено наличием нескольких полярных групп OH.
Водные растворы этиленгликоля не замерзают при очень
низкой температуре, поэтому используются как антифризы,
которые используются в системах охлаждения двигателей
внутреннего сгорания.
* Почти
все многоатомные спирты обладают сладким вкусом.
Поэтому ксилит и сорбит используются в питании больных
диабетом.
Нижник Я.П.
http://norgchem.professorjournal.ru
38
14.12.2018
39.
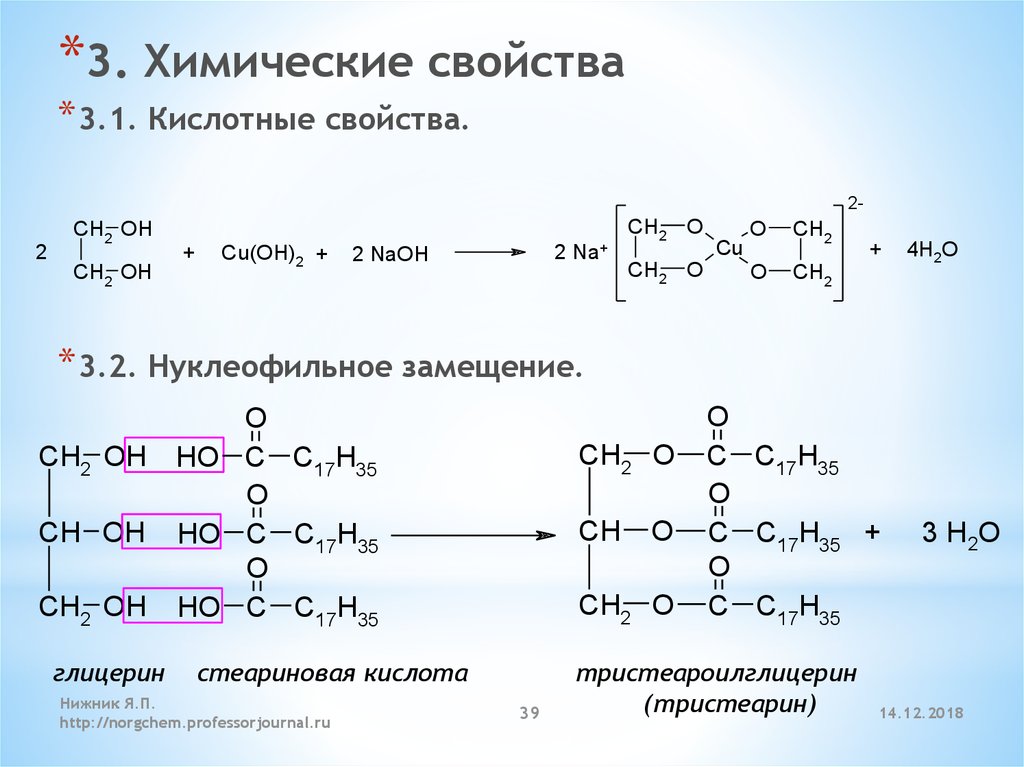
*3. Химические свойства* 3.1. Кислотные свойства.
2-
2
CH2 OH
CH2 OH
+
Cu(OH)2 +
2
2 NaOH
Na+
CH2 O
CH2 O
Cu
O
O
CH2
+
CH2
4H2O
* 3.2. Нуклеофильное замещение.
CH2 OH
CH OH
CH2 OH
глицерин
O
HO C C17H35
O
HO C C17H35
O
HO C C17H35
CH2 O
CH
CH2 O
стеариновая кислота
Нижник Я.П.
http://norgchem.professorjournal.ru
O
39
O
C C17H35
O
C C17H35 +
O
C C17H35
тристеароилглицерин
(тристеарин)
3 H2O
14.12.2018
40.
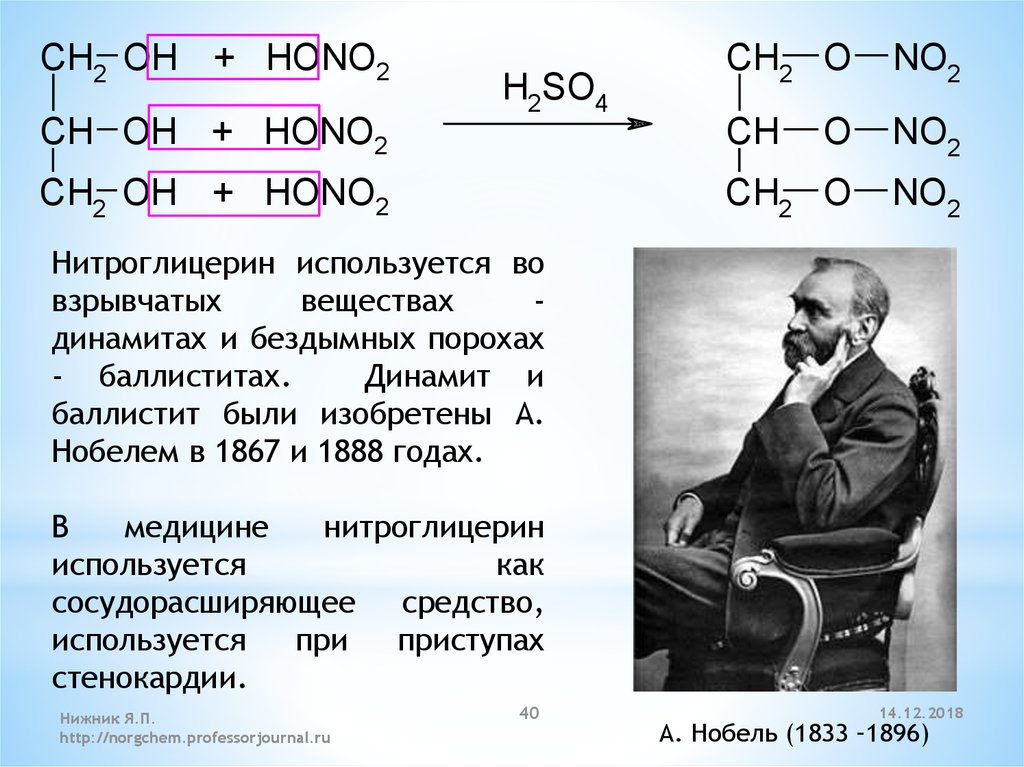
CH2 OH + HONO2CH2 O
NO2
CH OH + HONO2
CH
O
NO2
CH2 OH + HONO2
CH2 O
NO2
H2SO4
Нитроглицерин используется во
взрывчатых
веществах
динамитах и бездымных порохах
- баллиститах.
Динамит и
баллистит были изобретены А.
Нобелем в 1867 и 1888 годах.
В
медицине
нитроглицерин
используется
как
сосудорасширяющее средство,
используется
при
приступах
стенокардии.
Нижник Я.П.
http://norgchem.professorjournal.ru
40
14.12.2018
А. Нобель (1833 –1896)
41.
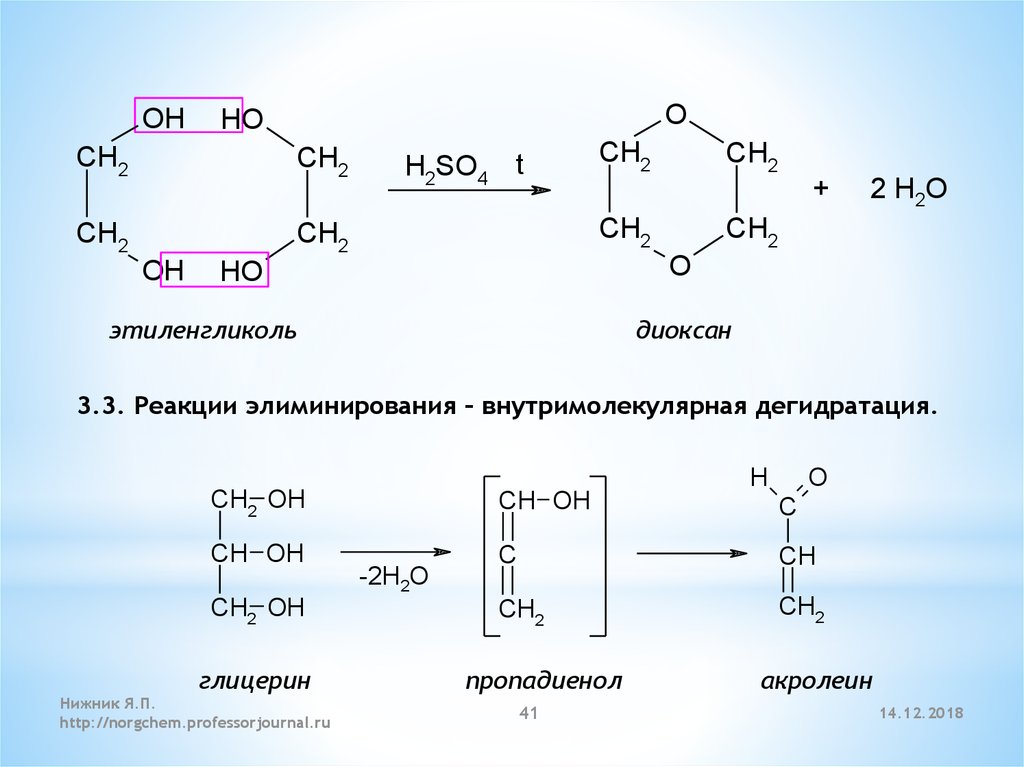
OHO
HO
CH2
CH2
CH2
CH2
OH
H2SO4
t
CH2
CH2
+
CH2
2 H2O
CH2
O
HO
этиленгликоль
диоксан
3.3. Реакции элиминирования – внутримолекулярная дегидратация.
H
O
CH2 OH
CH OH
C
CH OH
C
CH
CH2
CH2
CH2 OH
глицерин
Нижник Я.П.
http://norgchem.professorjournal.ru
-2H2O
пропадиенол
41
акролеин
14.12.2018
42.
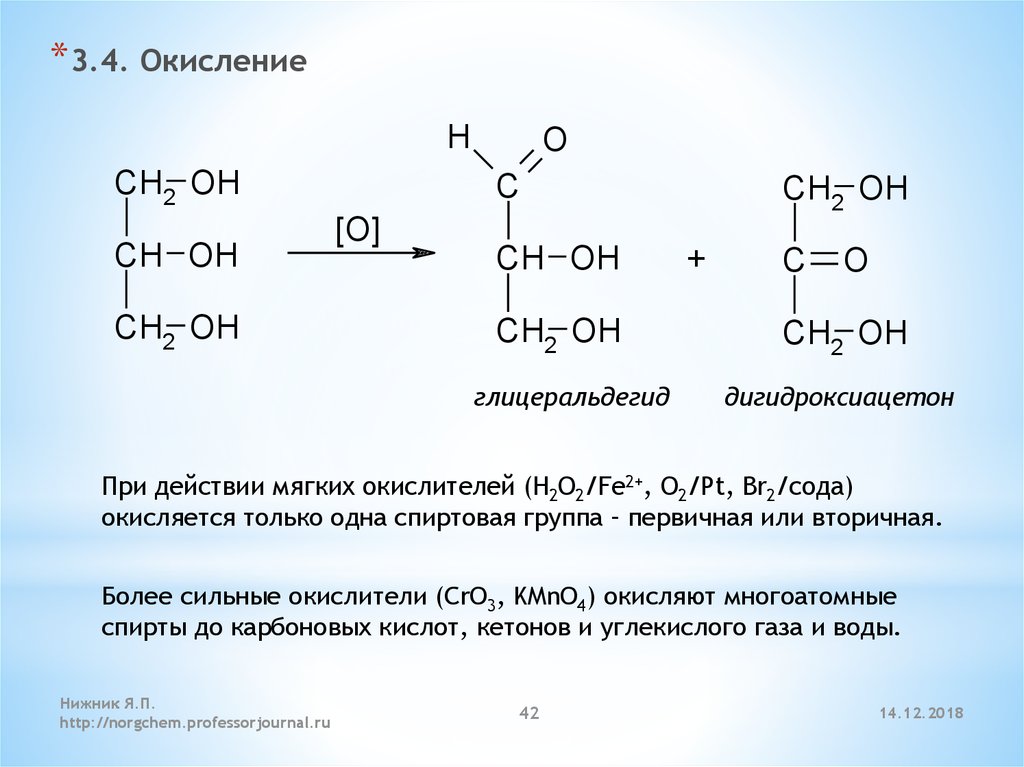
* 3.4. ОкислениеH
CH2 OH
CH OH
CH2 OH
O
C
[O]
CH OH
CH2 OH
глицеральдегид
CH2 OH
+
C
O
CH2 OH
дигидроксиацетон
При действии мягких окислителей (H2O2/Fe2+, O2/Pt, Br2/сода)
окисляется только одна спиртовая группа – первичная или вторичная.
Более сильные окислители (CrO3, KMnO4) окисляют многоатомные
спирты до карбоновых кислот, кетонов и углекислого газа и воды.
Нижник Я.П.
http://norgchem.professorjournal.ru
42
14.12.2018
43.
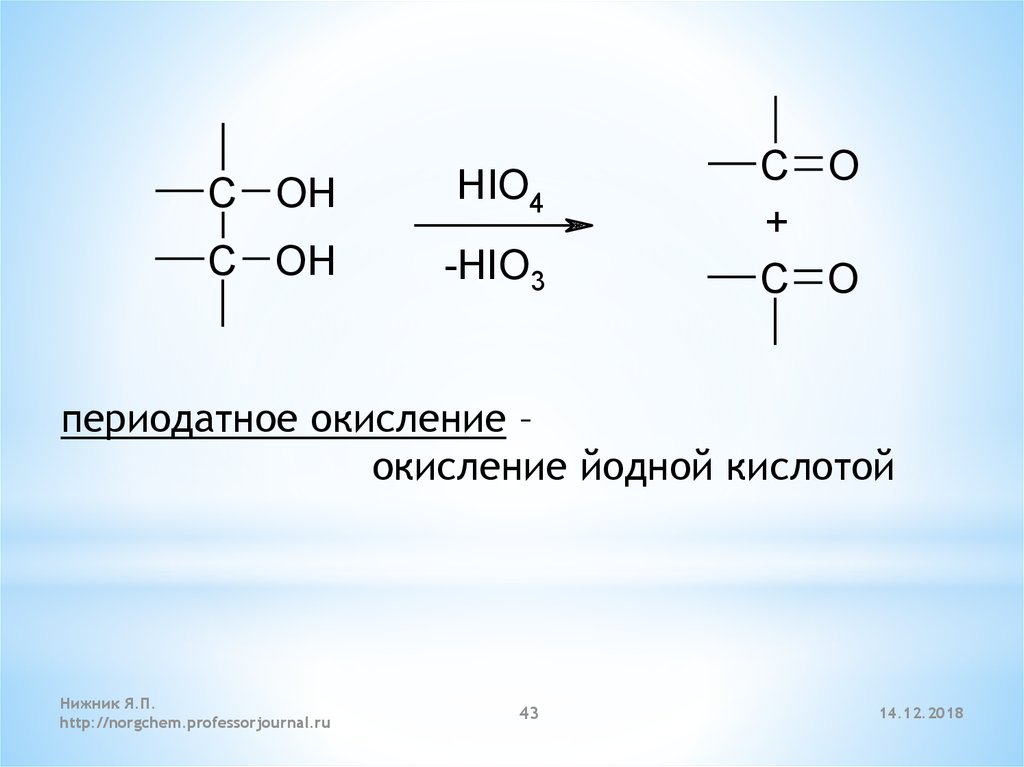
C OHHIO4
C OH
-HIO3
C O
+
C O
периодатное окисление –
окисление йодной кислотой
Нижник Я.П.
http://norgchem.professorjournal.ru
43
14.12.2018
44.
*4. ПолучениеH2C
CH2
CH3
t, кат.
CH2
CH3
-H2
CH2
этан
KMnO4 OH-MnO2
O2, Ag, 250 oC
H2C
CH2
HO
OH
+
O
H2C
этилен
H2C
этиленоксид
H2O , H
CH2 OH
CH2 OH
этиленгликоль
Этиленгликоль – бесцветная вязкая жидкость, tкип 197,6 °С. Применяется как
компонент антифризов и в производстве полимеров, взрывчатых и душистых
веществ.
Нижник Я.П.
http://norgchem.professorjournal.ru
44
14.12.2018
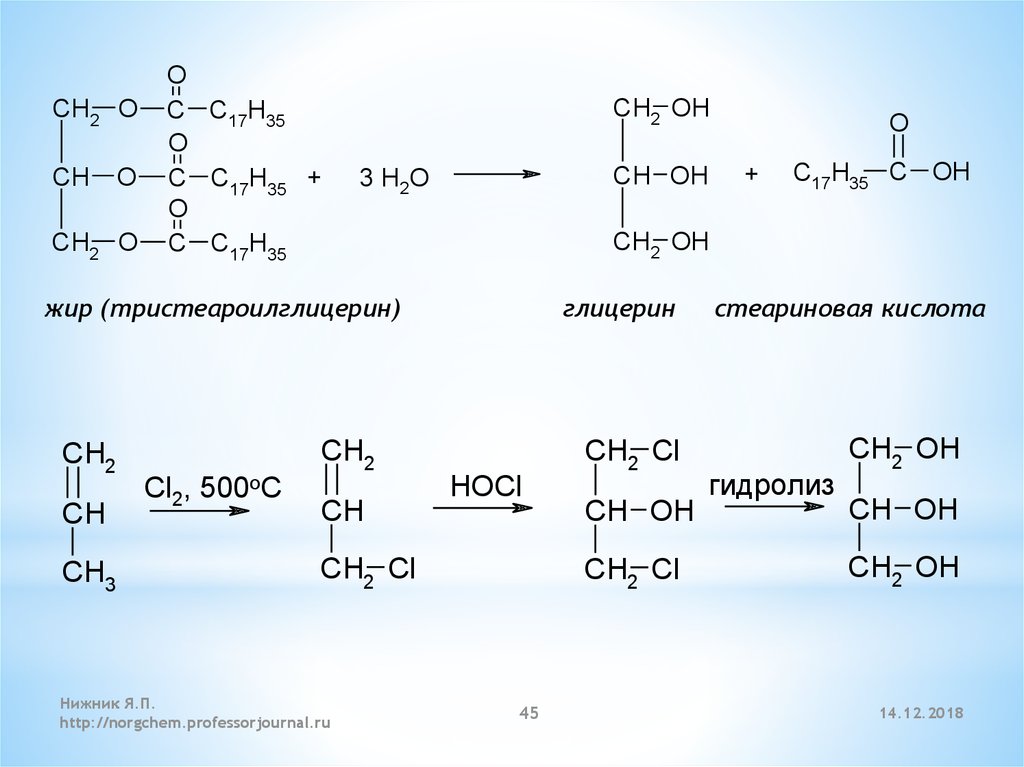
45.
CH2 OCH
O
CH2 O
O
C C17H35
O
C C17H35 +
O
C C17H35
CH2 OH
CH
CH3
глицерин
CH2
Cl2, 500oC
CH
CH2 Cl
HOCl
CH2 Cl
Нижник Я.П.
http://norgchem.professorjournal.ru
C17H35 C OH
CH2 OH
жир (тристеароилглицерин)
CH2
+
CH OH
3 H2O
O
CH OH
CH2 Cl
45
стеариновая кислота
гидролиз
CH2 OH
CH OH
CH2 OH
14.12.2018
46.
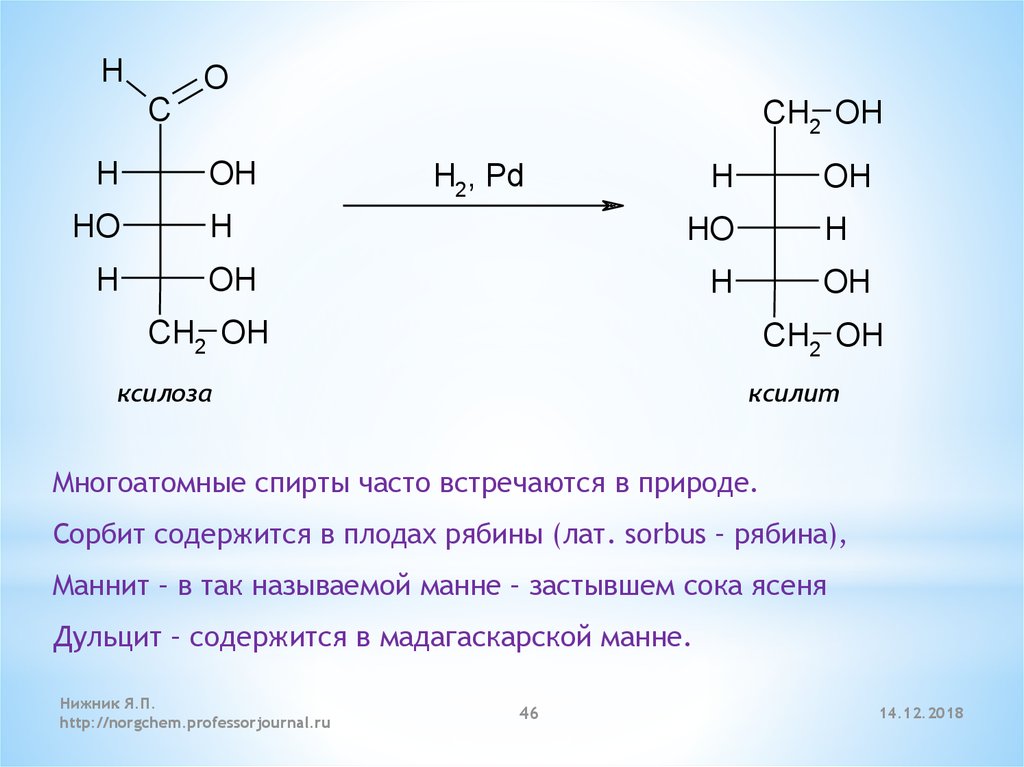
HO
C
H
HO
H
CH2 OH
OH
H2, Pd
H
H
OH
HO
OH
H
H
OH
CH2 OH
CH2 OH
ксилоза
ксилит
Многоатомные спирты часто встречаются в природе.
Сорбит содержится в плодах рябины (лат. sorbus – рябина),
Маннит – в так называемой манне – застывшем сока ясеня
Дульцит – содержится в мадагаскарской манне.
Нижник Я.П.
http://norgchem.professorjournal.ru
46
14.12.2018
47. Спасибо за Ваше внимание!
Нижник Я.П. http://norgchem.professorjournal.ru
47
14.12.2018

















 chemistry
chemistry








