Similar presentations:
Кислородсодержащие соединения. Тема 1: спирты
1.
Кислородсодержащиесоединения
ТЕМА 1:
СПИРТЫ
2.
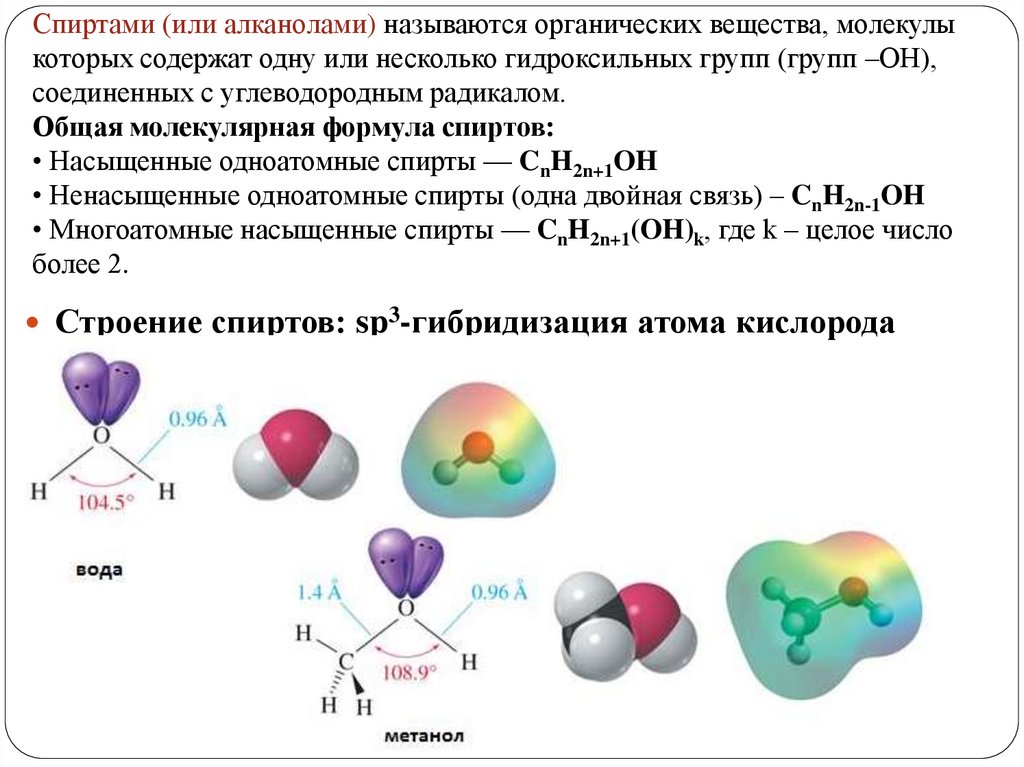
Спиртами (или алканолами) называются органических вещества, молекулыкоторых содержат одну или несколько гидроксильных групп (групп –ОН),
соединенных с углеводородным радикалом.
Общая молекулярная формула спиртов:
• Насыщенные одноатомные спирты — CnH2n+1OH
• Ненасыщенные одноатомные спирты (одна двойная связь) – CnH2n-1OH
• Многоатомные насыщенные спирты — CnH2n+1(OH)k, где k – целое число
более 2.
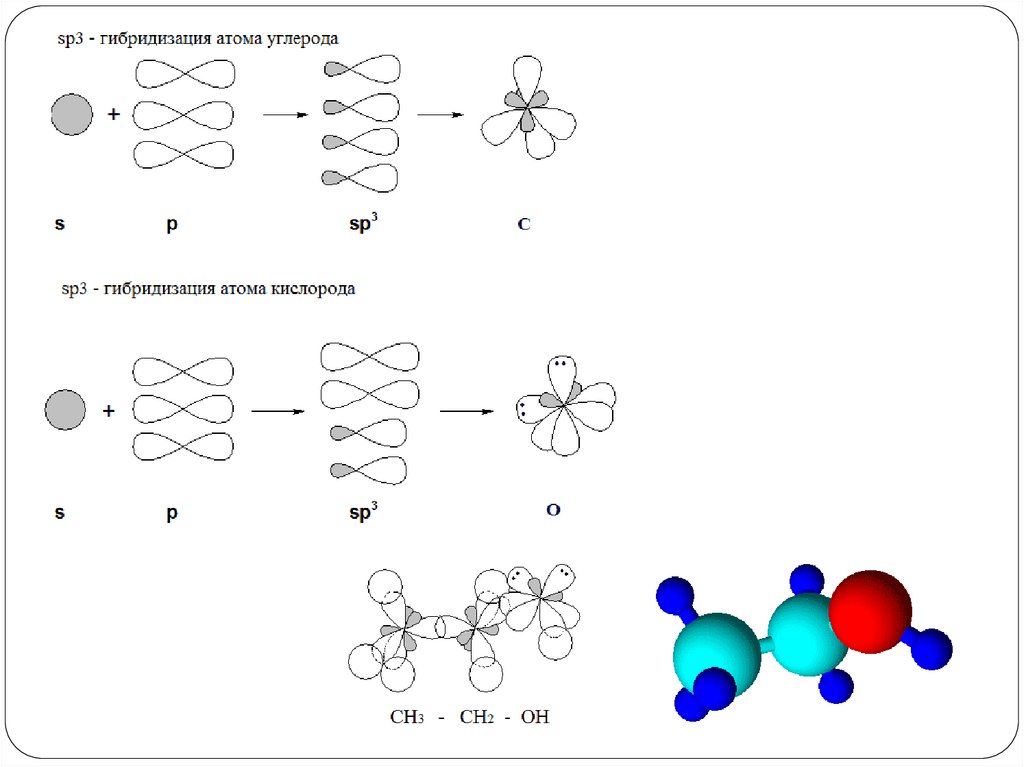
Строение спиртов: sp3-гибридизация атома кислорода
3.
4.
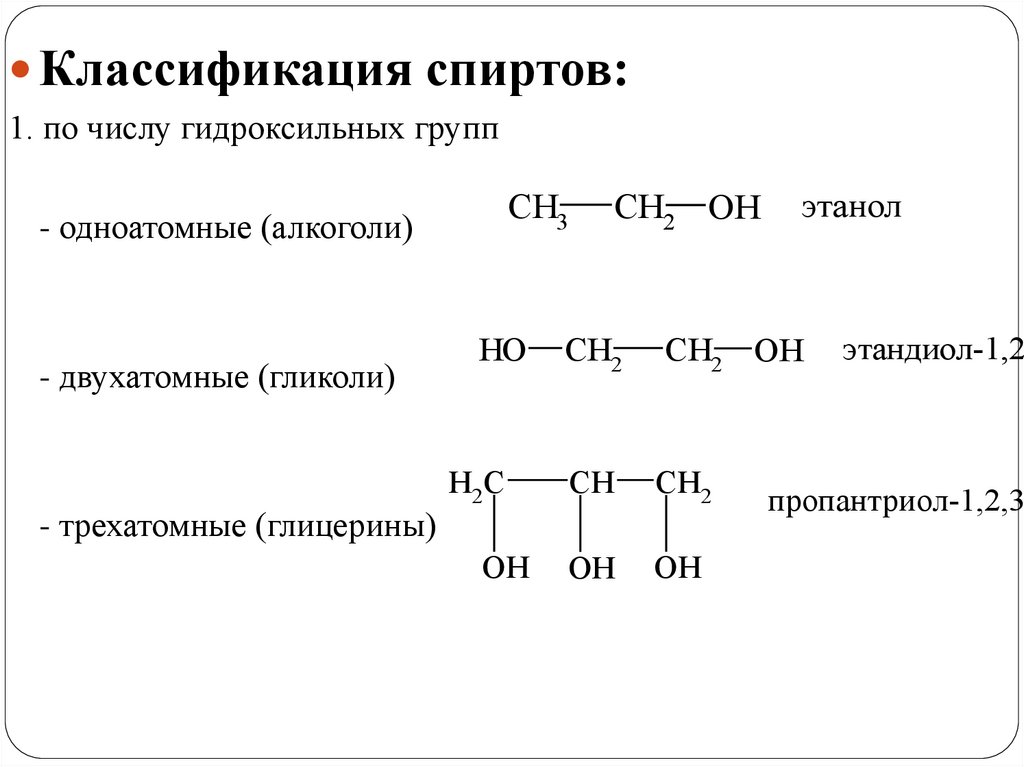
Классификация спиртов:1. по числу гидроксильных групп
CH3
- одноатомные (алкоголи)
- двухатомные (гликоли)
- трехатомные (глицерины)
HO
H2C
OH
CH2 OH
CH2
этанол
CH2 OH
CH
CH2
OH
OH
этандиол-1,2
пропантриол-1,2,3
5.
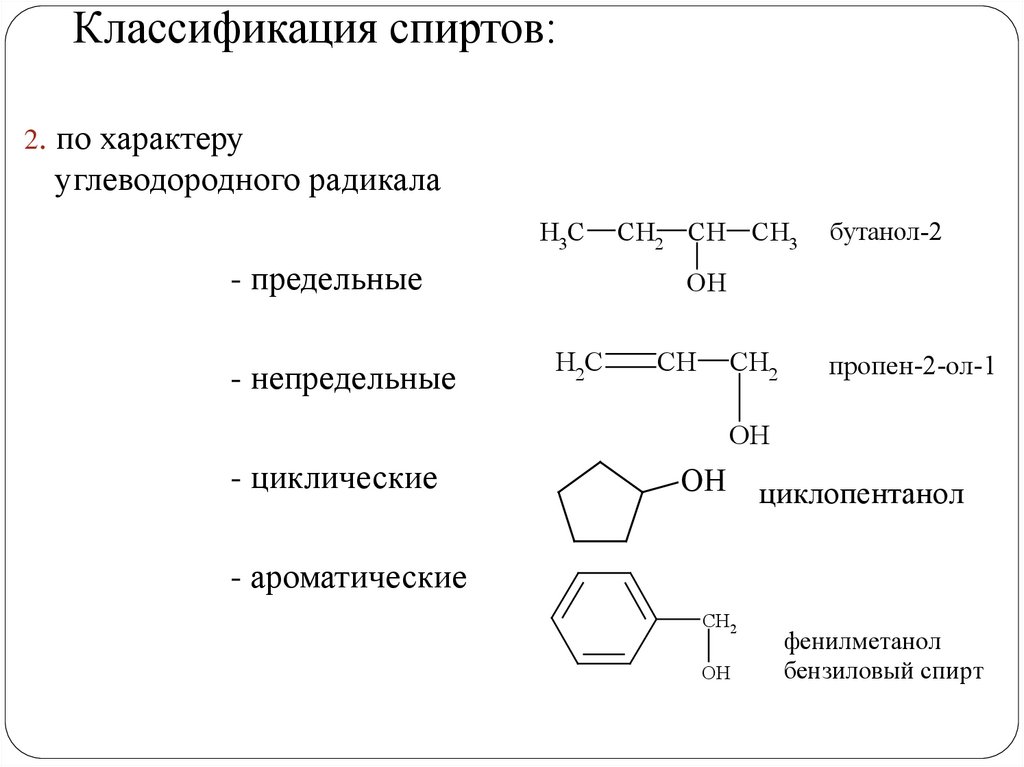
Классификация спиртов:2. по характеру
углеводородного радикала
H3C
- предельные
- непредельные
CH2 CH CH3
бутанол-2
OH
H2C
CH
CH2
пропен-2-ол-1
OH
- циклические
OH
циклопентанол
- ароматические
CH2
OH
фенилметанол
бензиловый спирт
6.
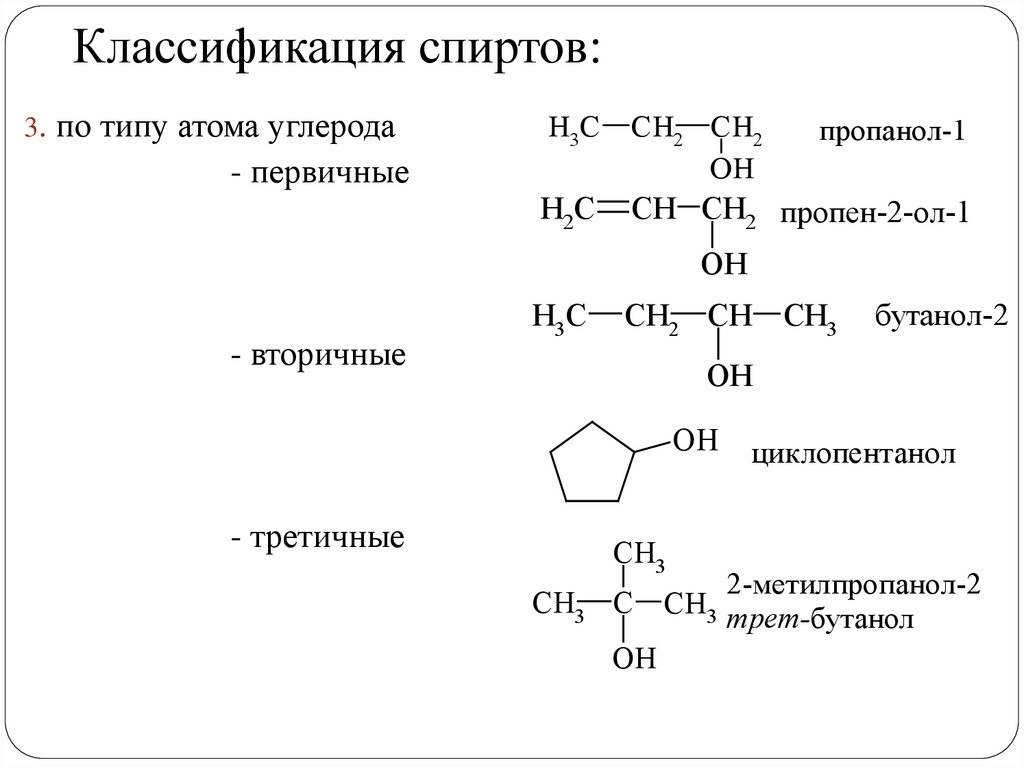
Классификация спиртов:3. по типу атома углерода
H3C
CH2 CH2
OH
H2C
CH CH2 пропен-2-ол-1
- первичные
пропанол-1
OH
- вторичные
H3C
CH2 CH CH3
OH
OH
- третичные
бутанол-2
CH3
CH3 C
OH
циклопентанол
2-метилпропанол-2
CH3 трет-бутанол
7.
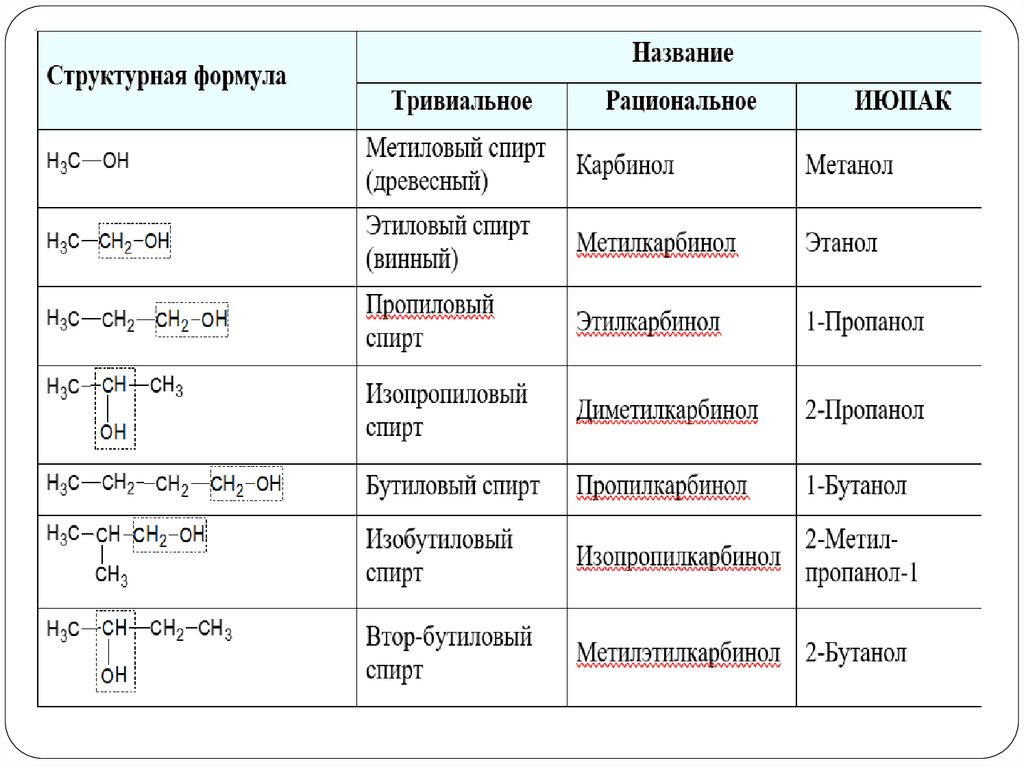
Номенклатура спиртов1. Номенклатура IUPAC
При образовании названий спирта к
4
H3C
3
2
1
CH2 CH CH3 бутанол-2
названию соответствующего
углеводорода добавляют суффикс –ол,
OH
3
2
1
4
цифрами после суффикса указывают
H3C CH CH CH3 бутандиол-2,3
положение гидроксильной группы, а
OH OH
префиксами ди-, три- и т.д. их число.
CH3
В нумерации атомов углерода в
3
2
1
4
главной цепи положение
H3C CH2 CH CH3 3-метилбутанол-2
гидроксильной группы приоритетно
OH
перед положением кратной связи,
3
2
1
4
галогенов и углеводородных
H2C CH CH CH3 бутен-3-ол-2
радикалов.
При наличии старшего заместителя,
OH
нумерацию начинают от него, а ОНO
группу обозначают приставкой окси
3
2
1
4
3-оксибутаналь
(гидрокси)
H3C CH CH2 C
H
OH
8.
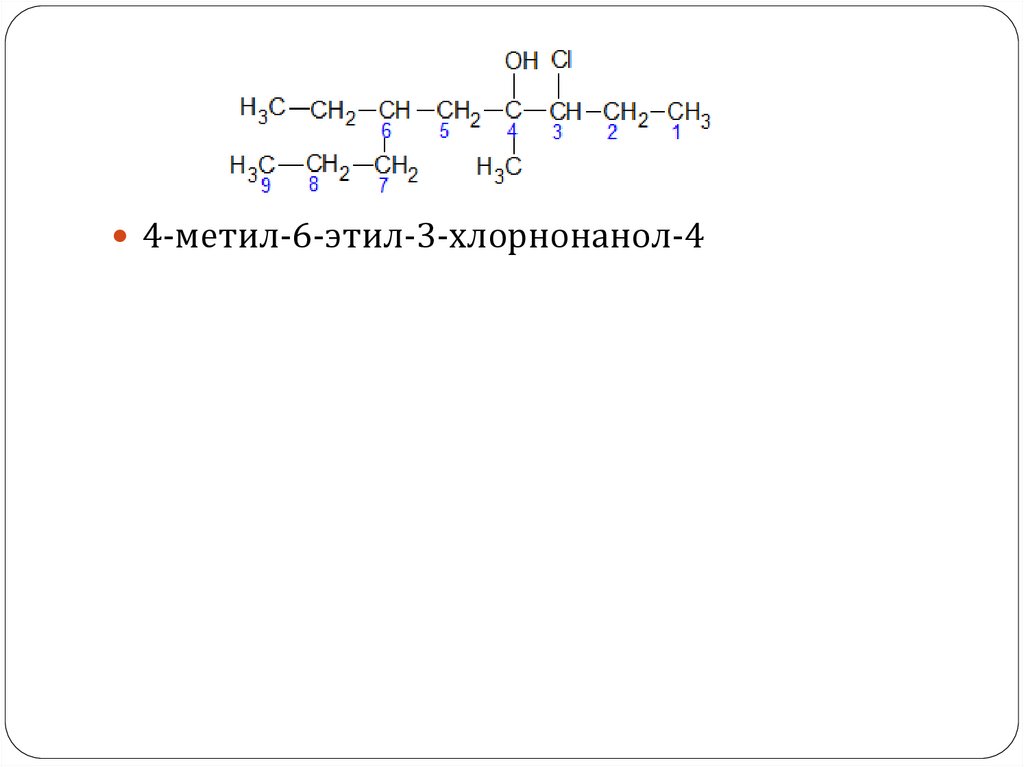
4-метил-6-этил-3-хлорнонанол-49.
Номенклатура спиртов2. По углеводородному радикалу
CH3 OH метанол
H3C
CH2 CH2 пропанол
OH
H3C
CH
H3C
CH2 CH2 CH2 бутанол
OH
CH3 изопропанол H3C
CH2 CH CH3 вторбутанол
OH
OH
H2C
HC
CH CH2 аллиловый
спирт
ОН
C
CH2 пропаргиловый
спирт
ОН
CH3
H3C
C
CH3 третбутанол
ОН
CH3
CH3 CH2 CH2 изобутанол
OH
10.
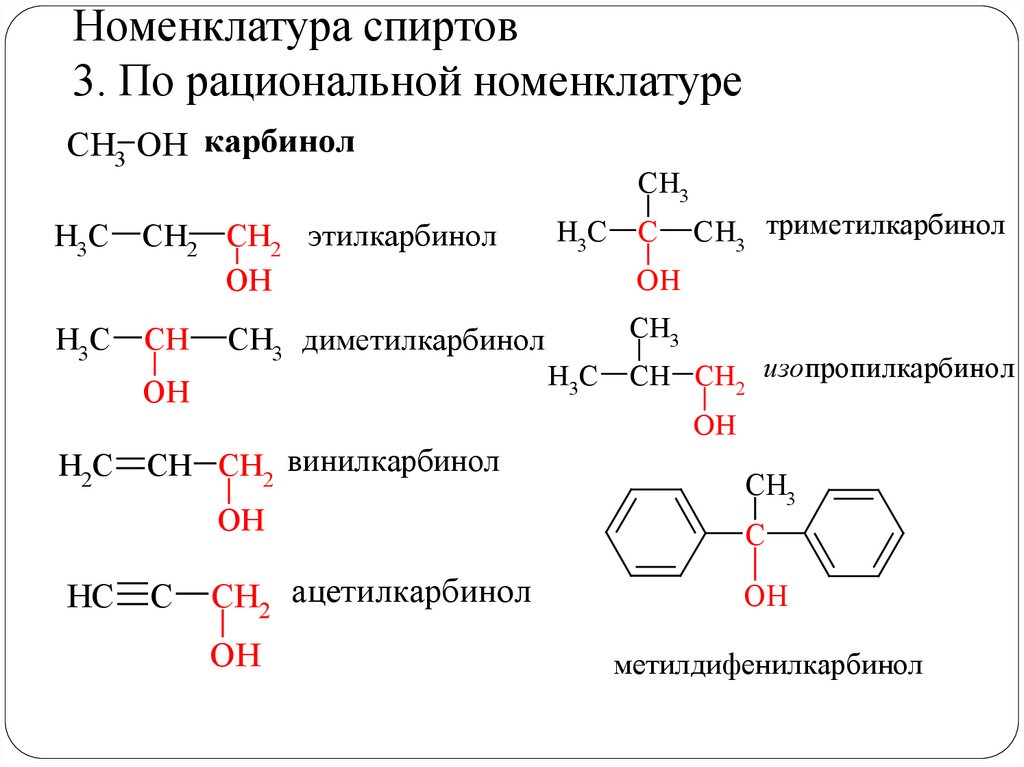
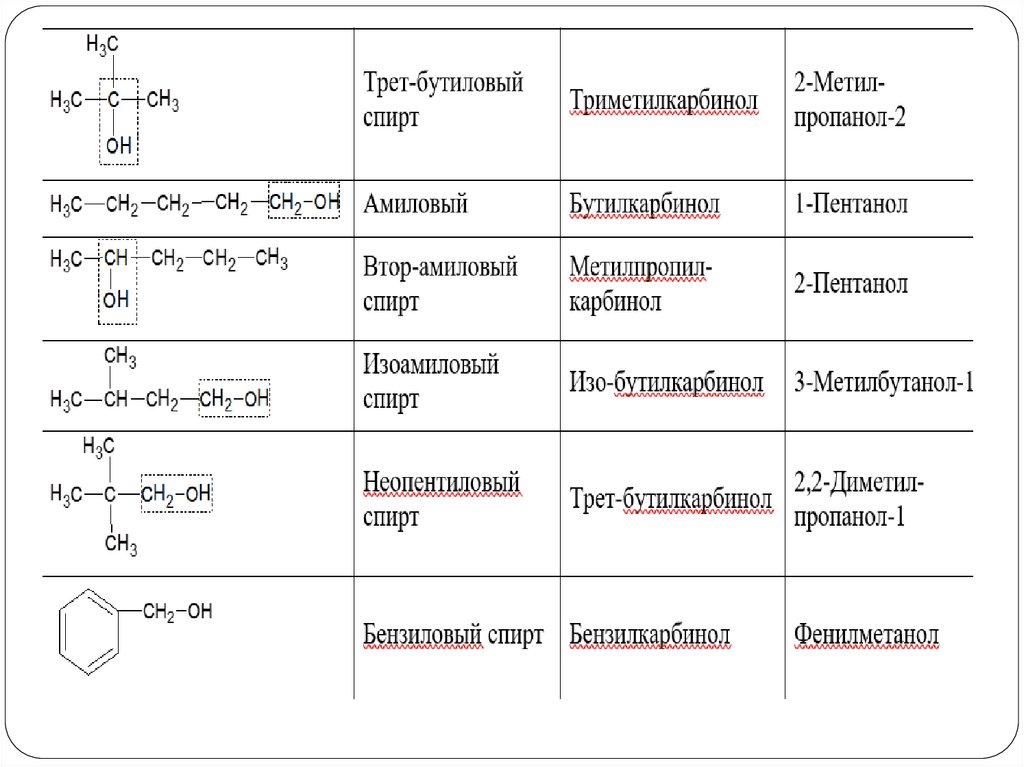
Номенклатура спиртов3. По рациональной номенклатуре
CH3 OH карбинол
H3C
H3C
CH2 CH2 этилкарбинол
OH
CH
CH3 диметилкарбинол
OH
H2C
CH CH2 винилкарбинол
C
H3C
C
CH3 триметилкарбинол
ОН
CH3
H3C
CH CH2 изопропилкарбинол
ОН
ОН
HC
CH3
CH2 ацетилкарбинол
ОН
CH3
C
OH
метилдифенилкарбинол
11.
12.
13.
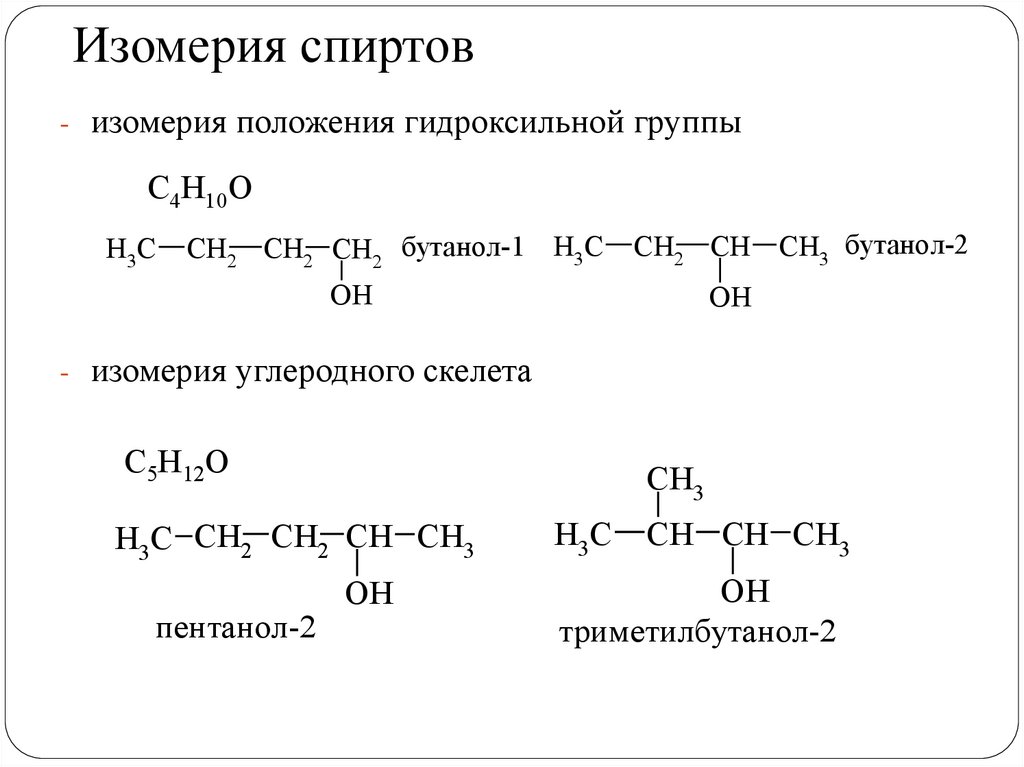
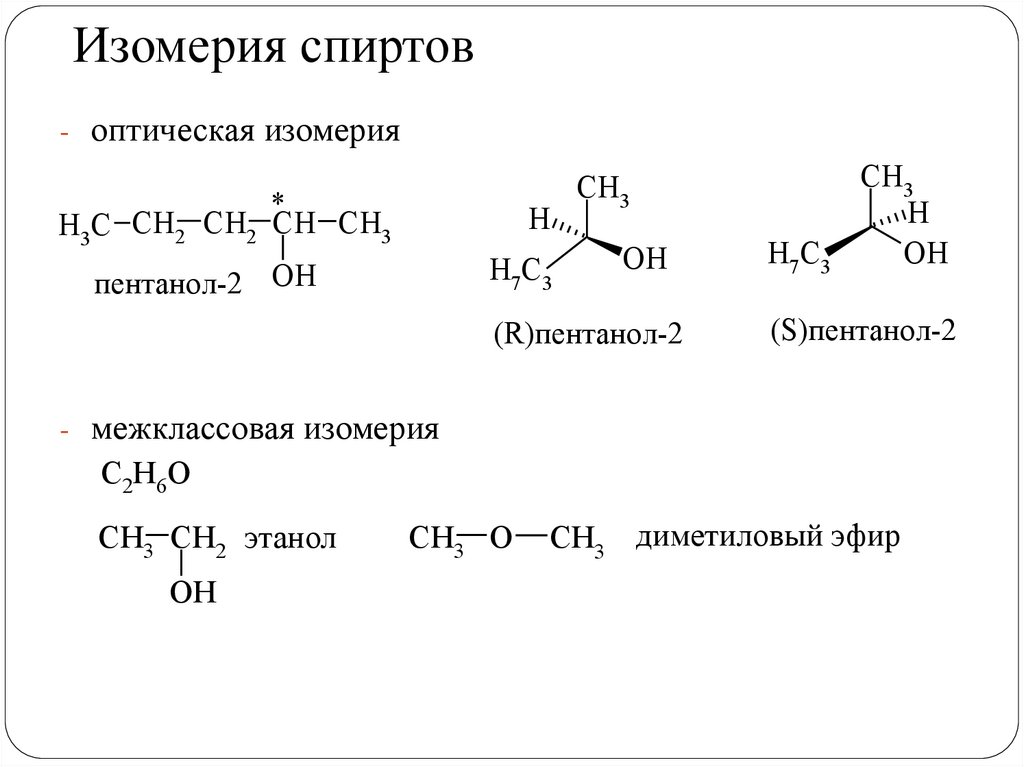
Изомерия спиртов- изомерия положения гидроксильной группы
С4Н10О
H3C
CH2 CH2 CH2 бутанол-1 H3C
CH2 CH CH3 бутанол-2
OH
OH
- изомерия углеродного скелета
С5Н12О
CH3
H3C CH2 CH2 CH CH3
пентанол-2
ОН
H3C
CH CH CH3
ОН
триметилбутанол-2
14.
Изомерия спиртов- оптическая изомерия
*
H3C CH2 CH2 CH CH3
H
H7C3
пентанол-2 ОН
CH3
ОН
(R)пентанол-2
H7C3
CH3
H
ОН
(S)пентанол-2
- межклассовая изомерия
С2Н6О
CH3 CH2 этанол
ОН
CH3 O
CH3 диметиловый эфир
15.
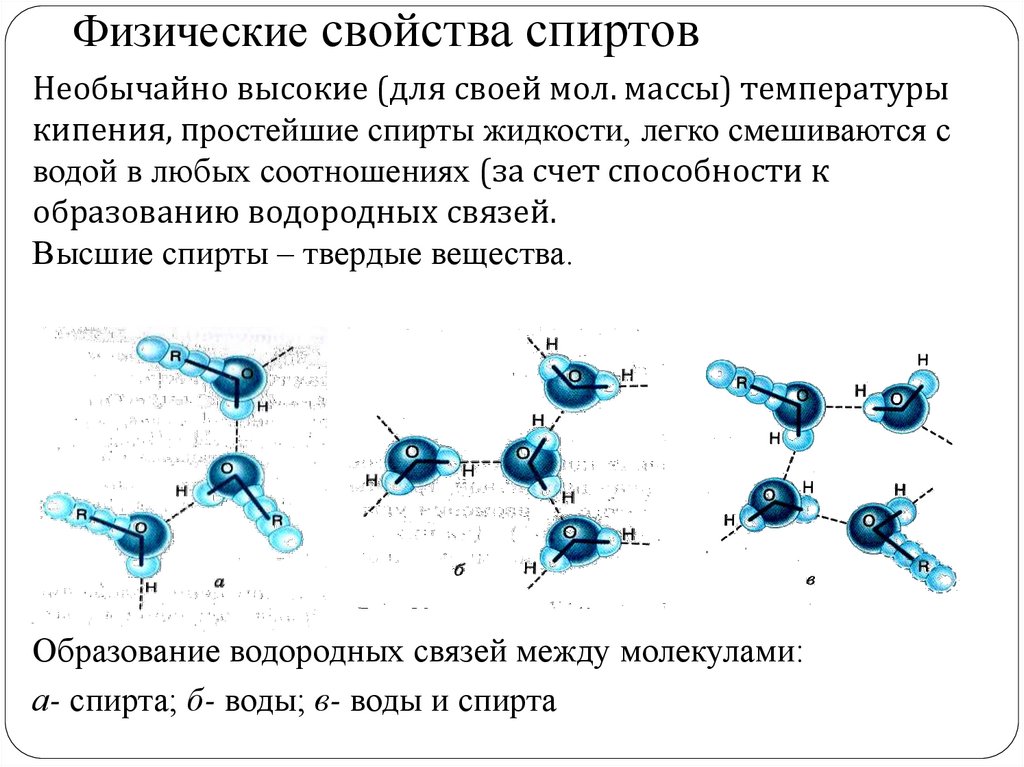
Физические свойства спиртовНеобычайно высокие (для своей мол. массы) температуры
кипения, простейшие спирты жидкости, легко смешиваются с
водой в любых соотношениях (за счет способности к
образованию водородных связей.
Высшие спирты – твердые вещества.
Образование водородных связей между молекулами:
а- спирта; б- воды; в- воды и спирта
16.
Д/з. Привести уравнения реакций, позволяющихосуществить данные превращения
17.
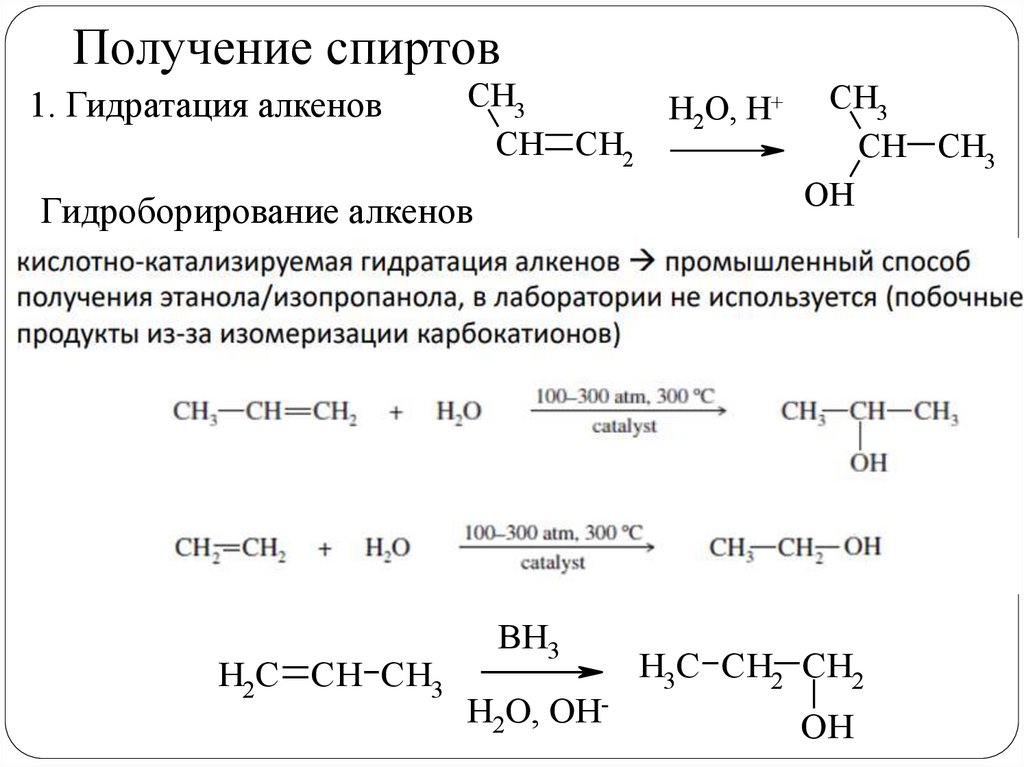
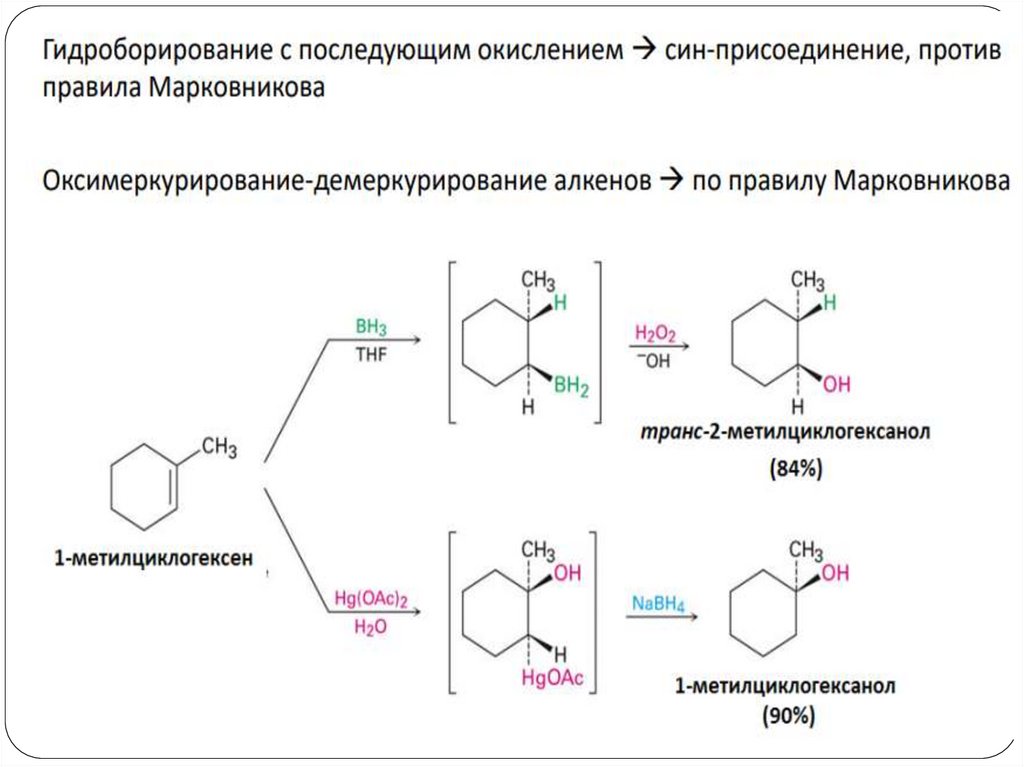
Получение спиртов1. Гидратация алкенов
CH3
CH CH2
Гидроборирование алкенов
H2C CH CH3
BH3
H2O, OH-
H2O, H+
CH3
CH CH3
ОН
H3C CH2 CH2
ОН
18.
19.
2. Гидролиз галогенпроизводныхR-Hal + Н-OH → R-OH + H-Hal
Br
H3C CH CH3
H2O, OH-
OH
H3C CH CH3
20.
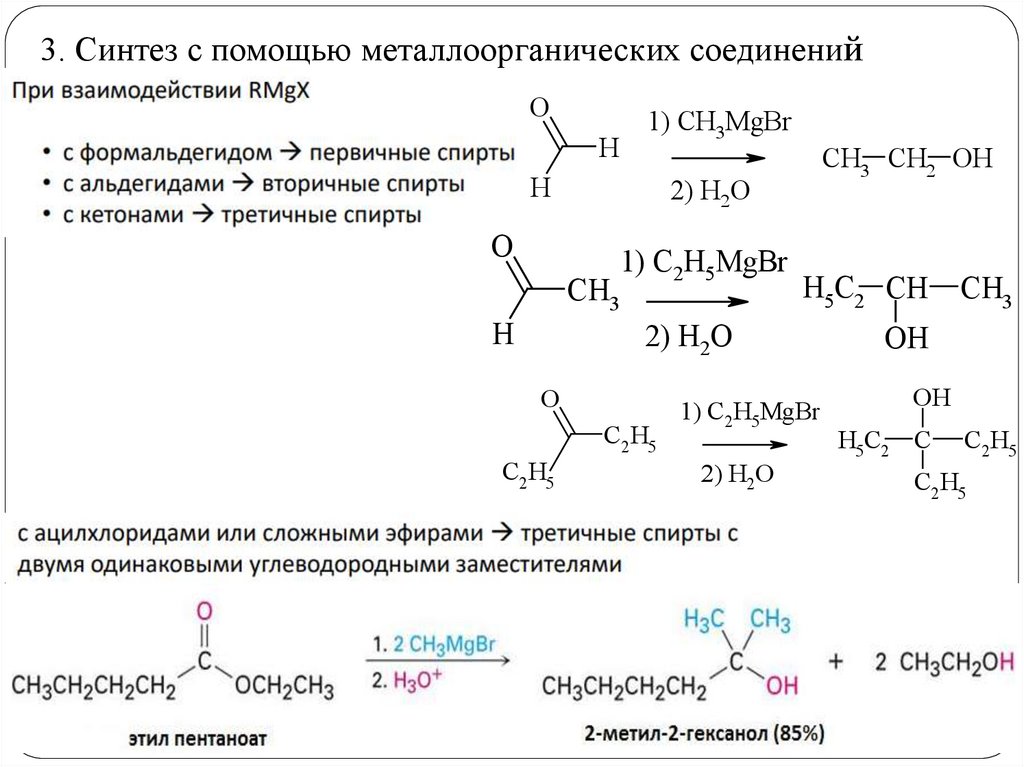
3. Синтез с помощью металлоорганических соединенийO
H
1) CH3MgBr
H
2) H2O
O
CH3
H
CH3 CH2 ОН
1) C2H5MgBr
H5C2 CH
2) H2O
O
C2H5
C2H5
1) C2H5MgBr
2) H2O
CH3
ОН
ОН
H5C2 C
C2H5
C2H5
21.
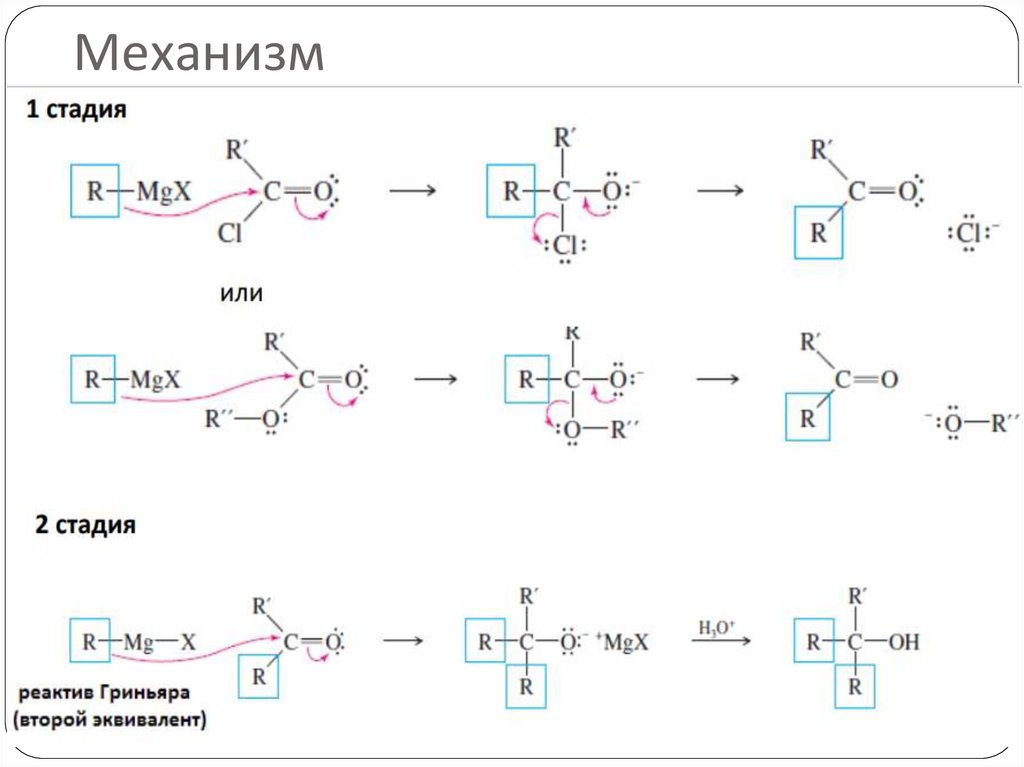
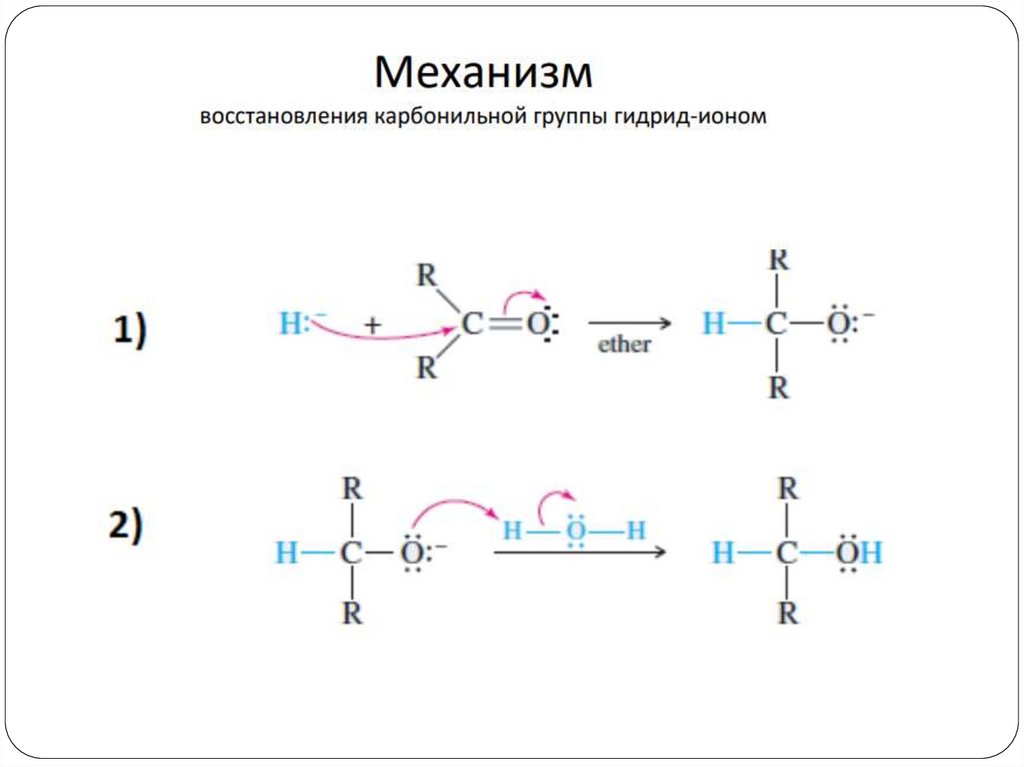
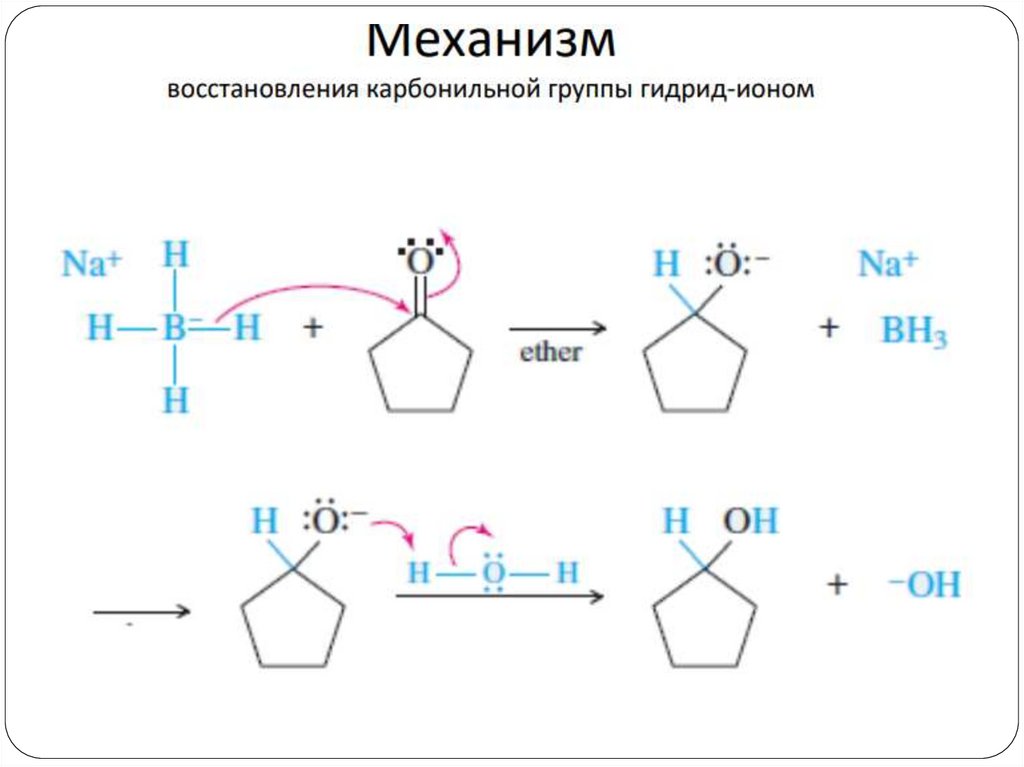
Механизм22.
Раскрытие цикла идет со стерически менее затрудненной стороны
23.
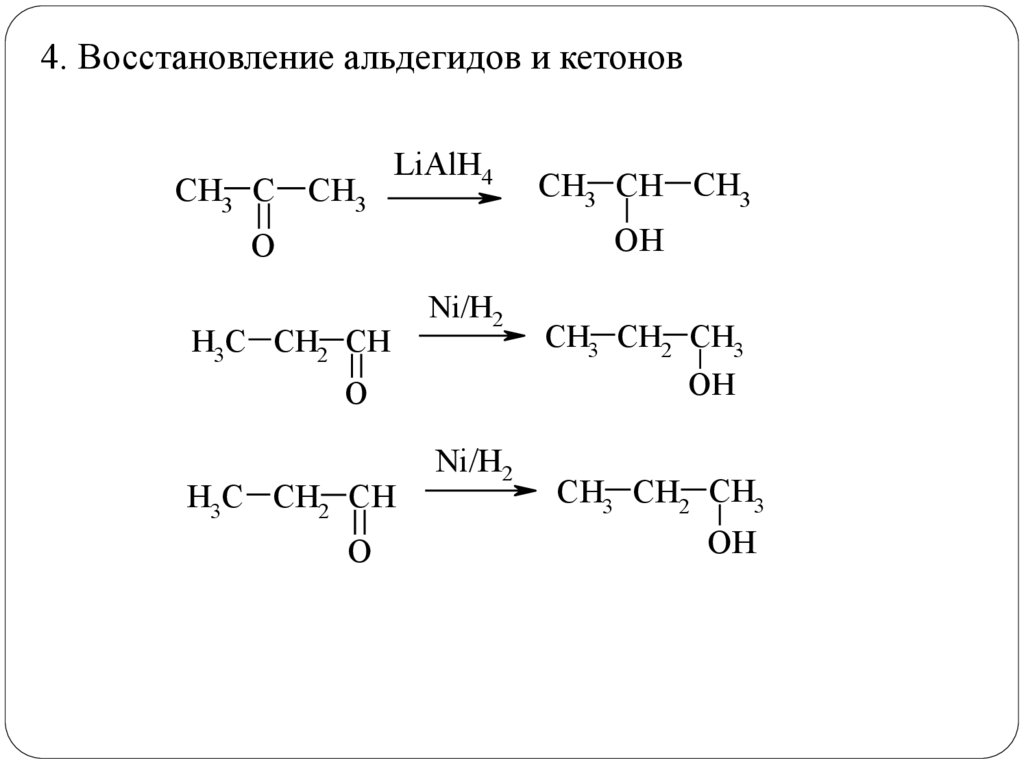
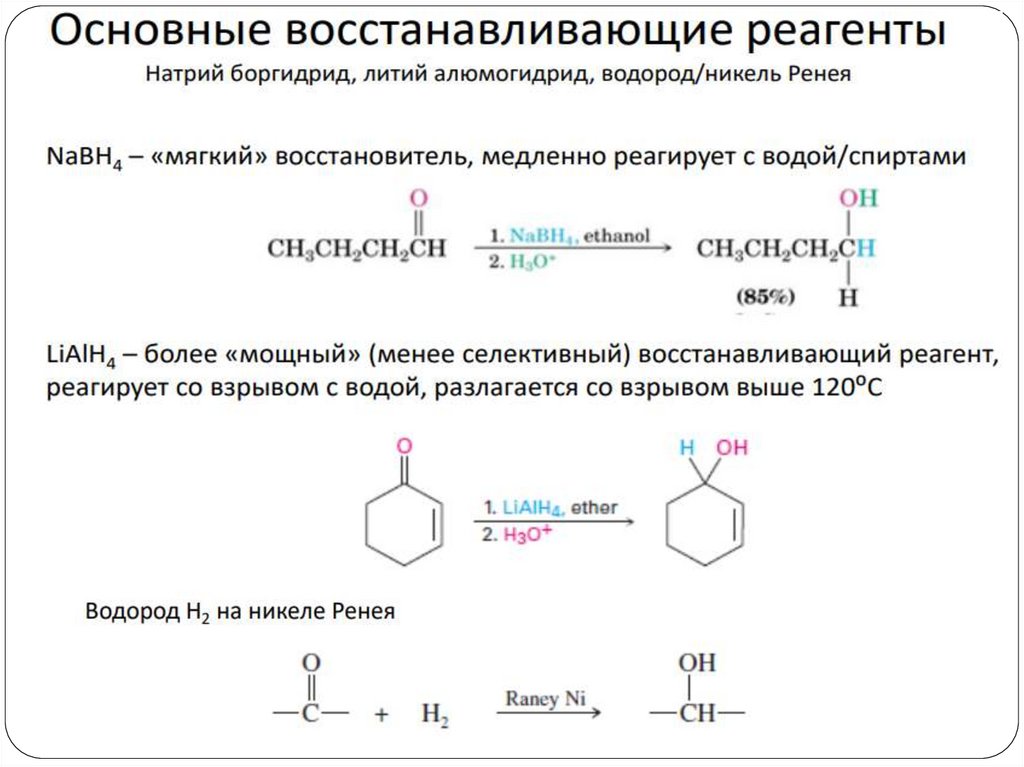
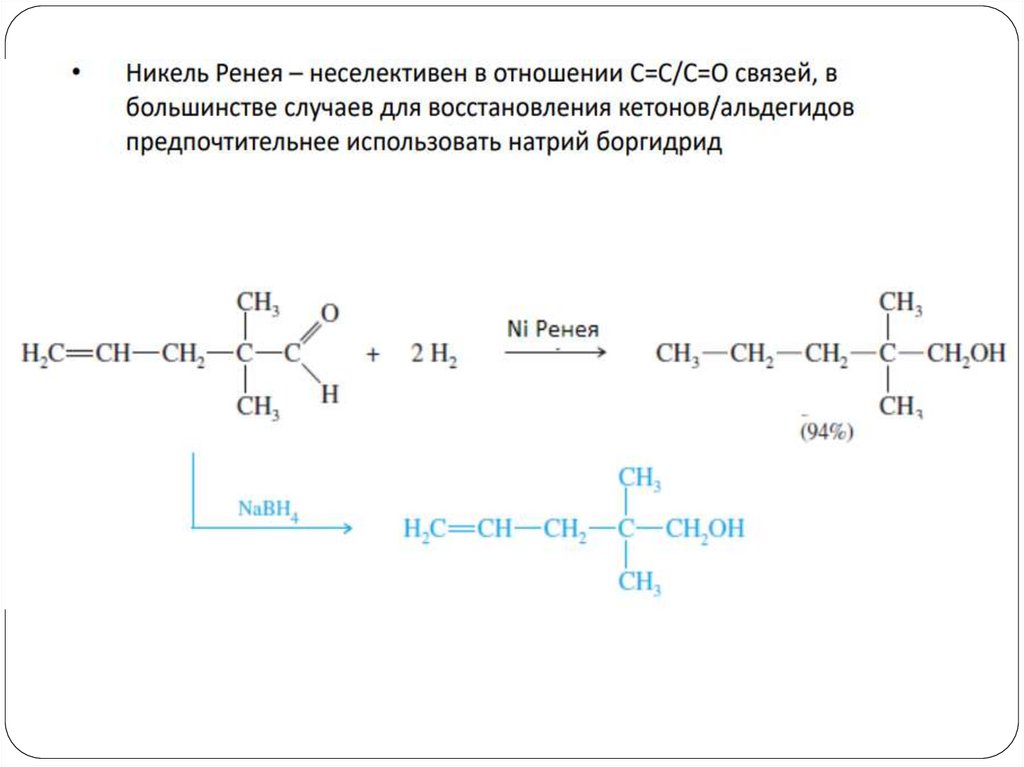
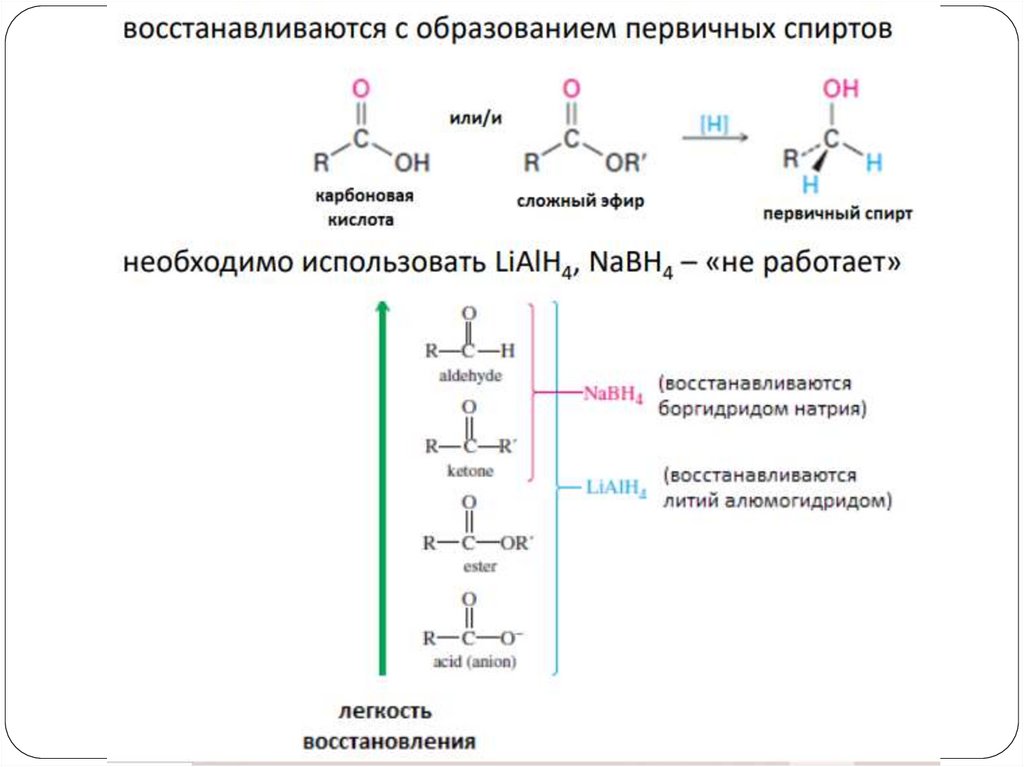
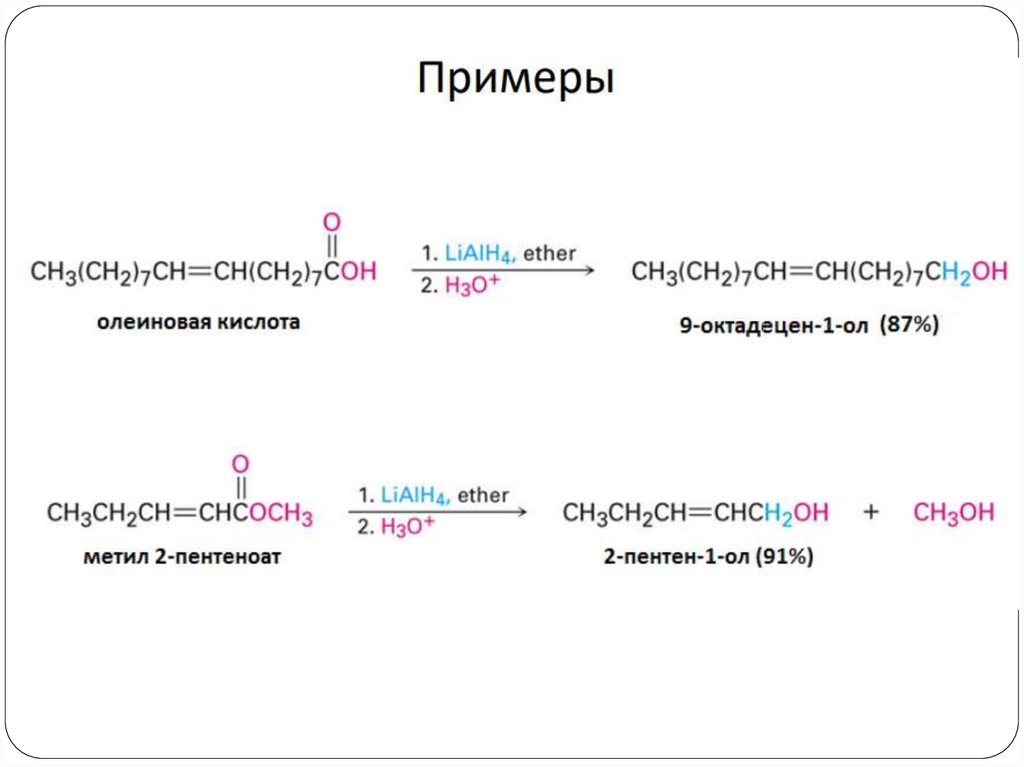
4. Восстановление альдегидов и кетоновCH3 C СН3
LiAlH4
CH3 CH СН3
OН
O
H3C CH2 CH
Ni/H2
OH
O
H3C CH2 CH
O
CH3 CH2 СН3
Ni/H2
CH3 CH2 СН3
OH
24.
25.
26.
27.
28.
29.
30.
Специфические методы:Дрожжевое брожение сахаров (глюкозы,
фруктозы, мальтозы и после предварительного
гидролиза сахарозы) приводит к образованию
этанола и углекислого газа:
Гидрирование окиси углерода в различных
условиях позволяет получить как чистый
метиловый спирт, так и смесь его первичных
гомологов:
СО + 2 Н2
31.
Химические свойства спиртовКислотные свойства – определяются возможностью
отщепления
протона,
что
зависит
от
строения
углеводородного радикала. Т.к. алкильные группы обладают
+I эффектом, спирты более слабые кислоты, чем вода, и с
увеличением числа алкильных радикалов кислотные свойства
ослабевают:
CH3
H2O CH3 CH2
OH
H3C
CH2 CH2
OH
H3C
CH
CH3 H3C
OH
уменьшение кислотных свойств
C
OH
CH3
32.
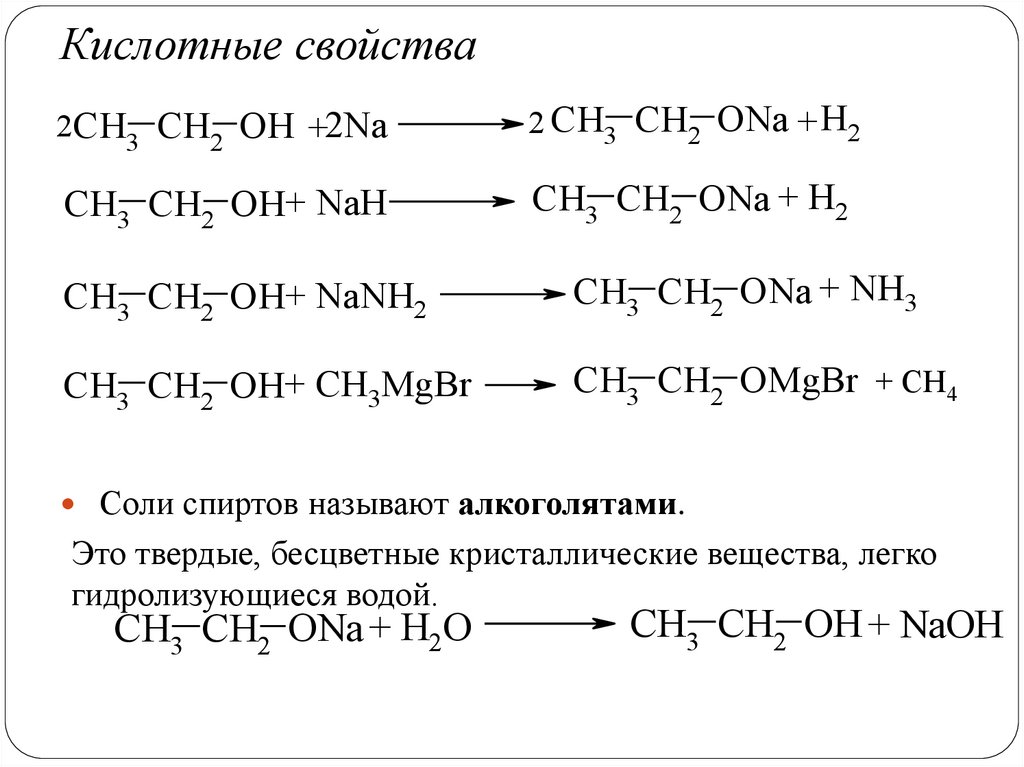
Кислотные свойства2CH3 CH2 OH +2Na
2 CH3 CH2 ONa + H2
CH3 CH2 OH+ NaН
CH3 CH2 ONa + H2
CH3 CH2 OH+ NaNН2
CH3 CH2 ONa + NH3
CH3 CH2 OH+ CH3MgBr
CH3 CH2 OMgBr + CH4
Соли спиртов называют алкоголятами.
Это твердые, бесцветные кристаллические вещества, легко
гидролизующиеся водой.
CH3 CH2 ONa + H2O
CH3 CH2 OH + NaOН
33.
Основные и нуклеофильные свойстваопределяются способностью передавать НЭП протону или
электрофилу.
Спирты могут также вести себя как слабые основания
Льюиса, образовывая с сильными минеральными
кислотами соли алкоксония, а также давая донорноакцепторные комплексы с кислотами Льюиса.
R OH + HX
R OH + BF3
+
R OH2 + X-
R O
+
-
BF 3
H
34.
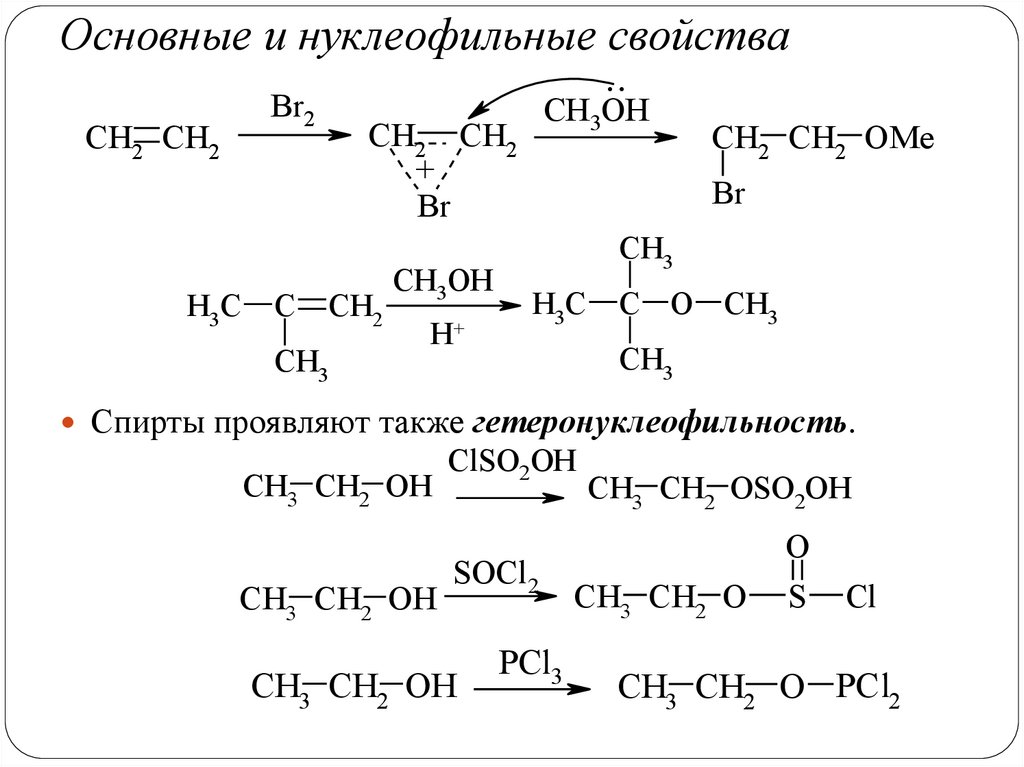
Основные и нуклеофильные свойства..
Br2
CH2 CH2
H3C
C
CH3OH
CH2 CH2
+
Br
CH2
CH3
CH3OH
H+
CH2 CH2 OMe
Br
CH3
H3C
C O CH3
CH3
Спирты проявляют также гетеронуклеофильность.
CH3 CH2 OH
CH3 CH2 OH
ClSO2OH
SOCl2
CH3 CH2 OH
PCl3
CH3 CH2 OSO2OH
O
CH3 CH2 O
S
Cl
CH3 CH2 O PCl2
35.
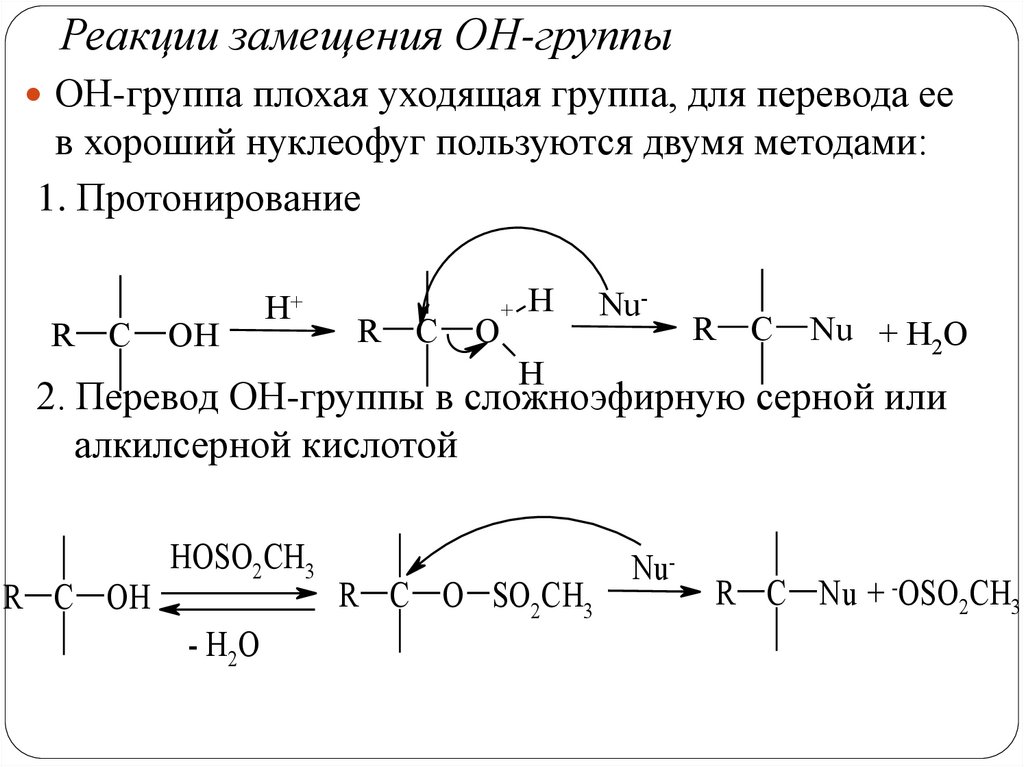
Реакции замещения ОН-группыОН-группа плохая уходящая группа, для перевода ее
в хороший нуклеофуг пользуются двумя методами:
1. Протонирование
R
C
OH
H+
R
C
O
+
H
Nu-
H
R
C
Nu + H2O
2. Перевод ОН-группы в сложноэфирную серной или
алкилсерной кислотой
R C OH
HOSO2CH3
- H2O
R C O SO2CH3
Nu-
R C Nu + -OSO2CH3
36.
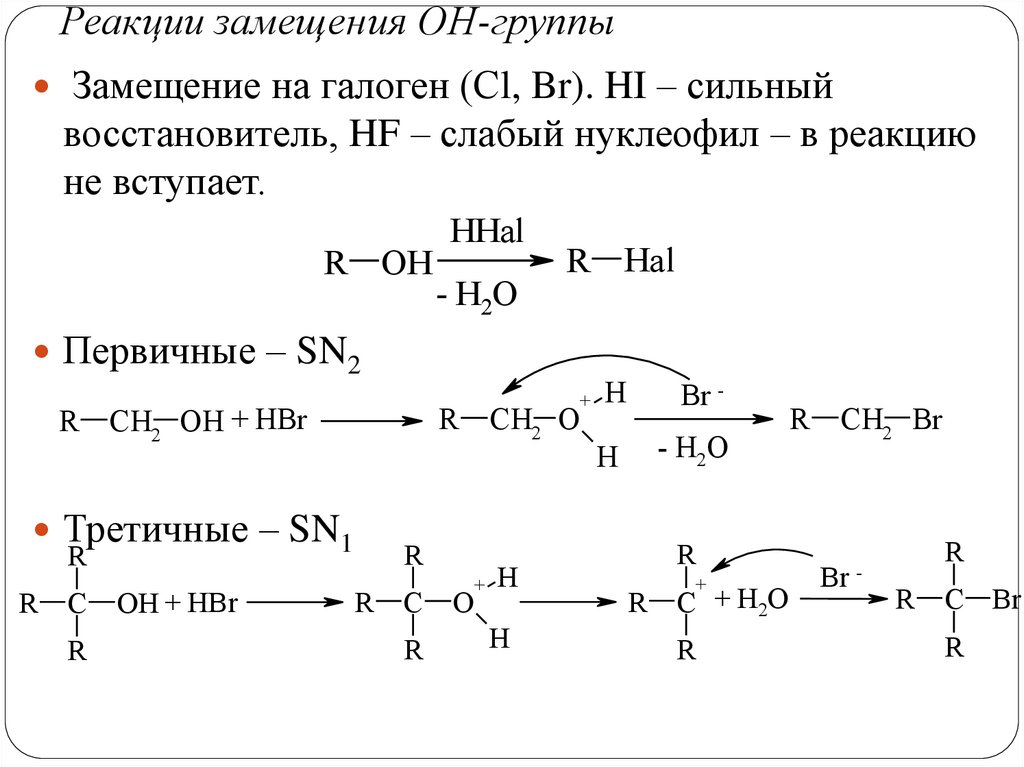
Реакции замещения ОН-группыЗамещение на галоген (Сl, Br). HI – сильный
восстановитель, HF – слабый нуклеофил – в реакцию
не вступает.
R OH
HHal
- H2O
R Hal
Первичные – SN2
R
CH2 OH + HBr
R
Третичные – SN1
R
R
R
C
R
OH + HBr
CH2 O
R
C
R
O
+
H
H
+
H
Br -
H
- H2O
R
R
+
C + H2O
R
R
CH2 Br
Br
R
-
R
C
R
Br
37.
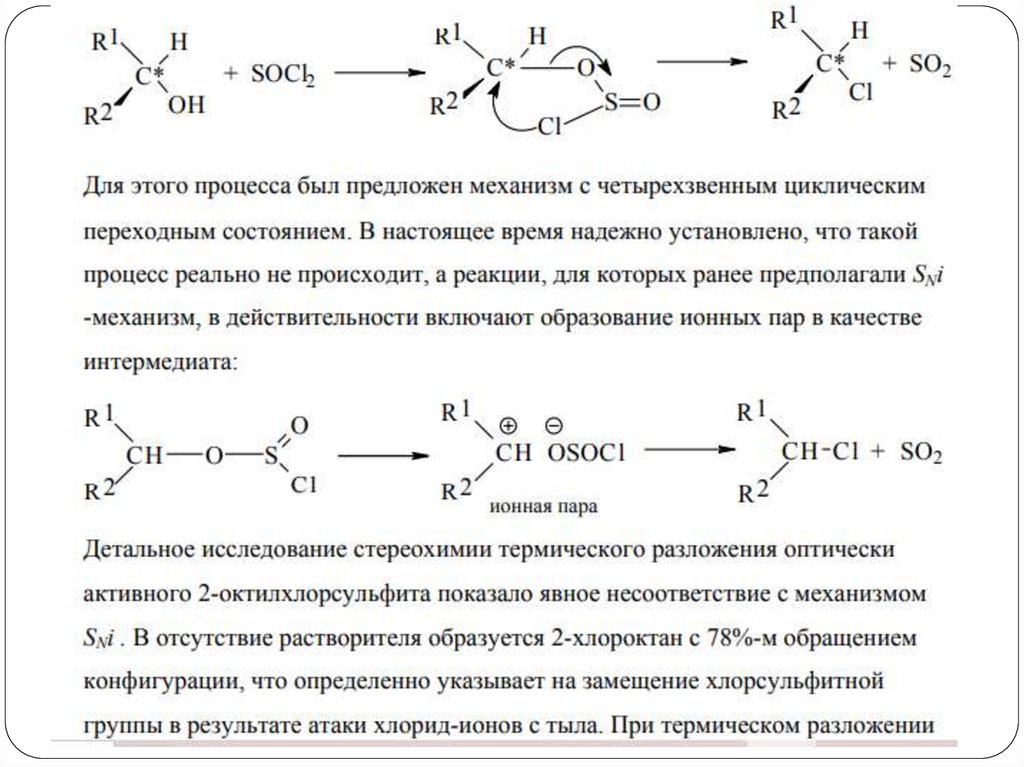
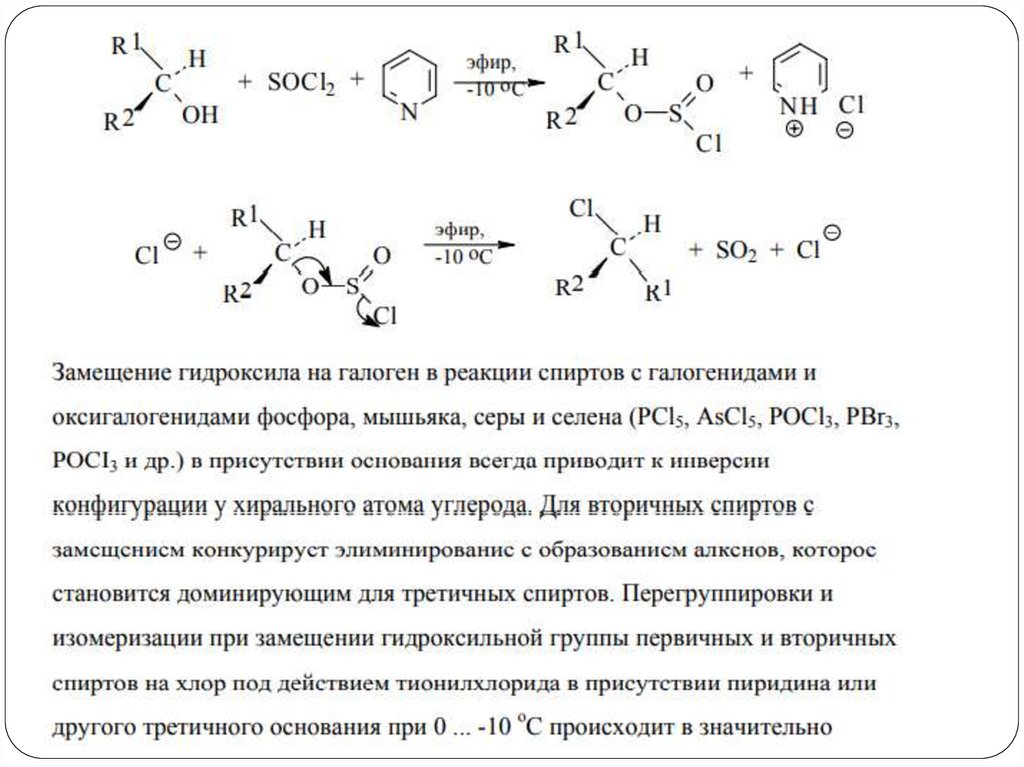
Реакции замещения ОН-группыЗамещение по механизму SNi
H3C CH2 OH
SOCl2
-Cl-
O
H3C CH2 O S Cl
-Cl-
H3C CH2 Cl + SO2 + Cl-
При таком замещении хиральный атом углерода
сохраняет свою конфигурацию.
..
Cl Cl
Cl Cl
R OH + P
Cl
- HCl
Cl
Cl
R O
P
Cl
Cl
R Cl + O=PCl3
38.
39.
40.
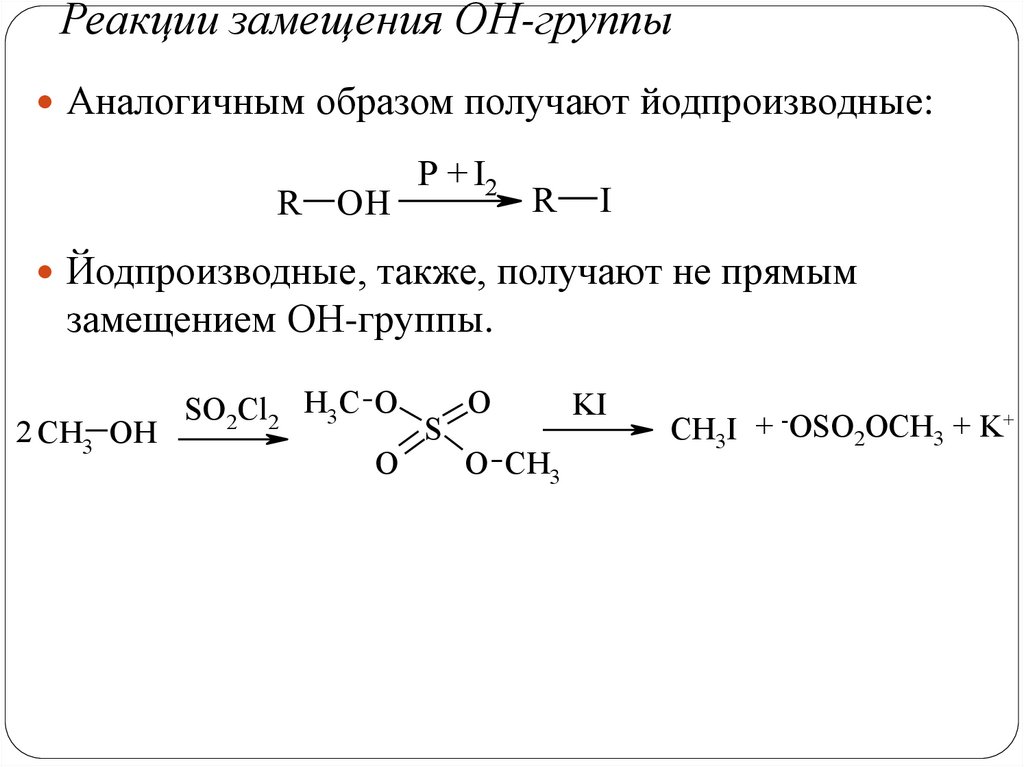
Реакции замещения ОН-группыАналогичным образом получают йодпроизводные:
R OH
P + I2
R
I
Йодпроизводные, также, получают не прямым
замещением ОН-группы.
2 CH3 OH
SO2Cl2 H3C O
O
S
O
O CH3
KI
CH3I + -OSO2OCH3 + K+
41.
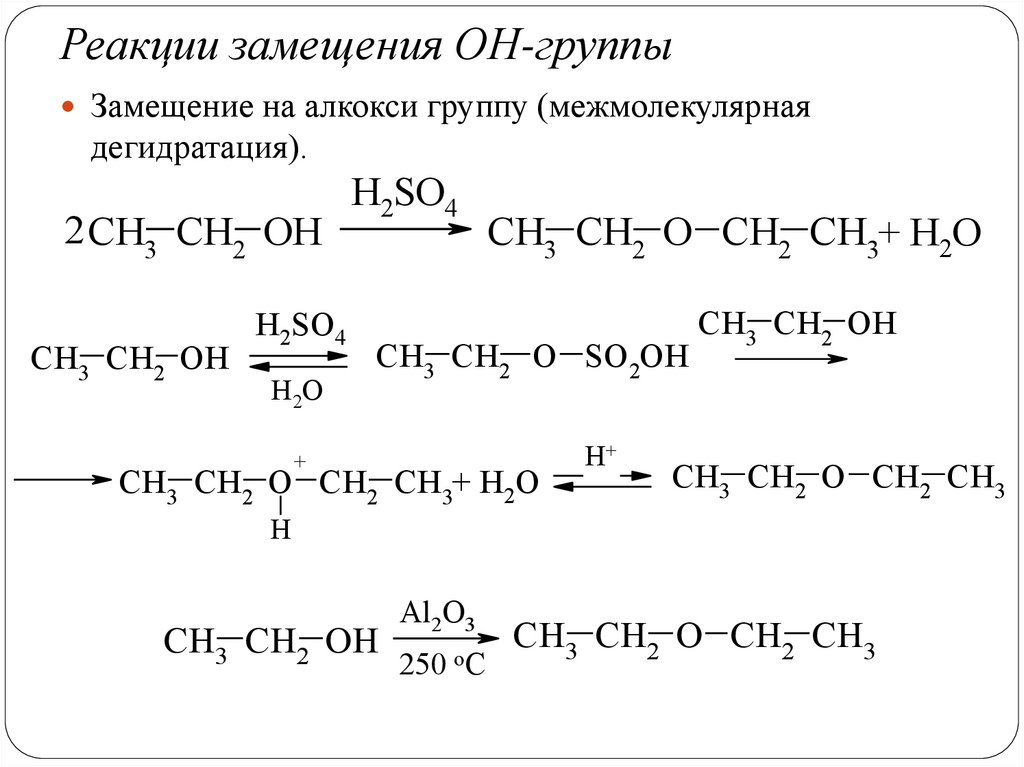
Реакции замещения ОН-группыЗамещение на алкокси группу (межмолекулярная
дегидратация).
2 CH3 CH2 OH
CH3 CH2 OH
H2SO4
H2O
H2SO4
CH3 CH2 O CH2 CH3+ H2O
CH3 CH2 O SO2OH
+
CH3 CH2 O CH2 CH3+ H2O
H+
CH3 CH2 OH
CH3 CH2 O CH2 CH3
H
CH3 CH2 OH
Al2O3
250
oC
CH3 CH2 O CH2 CH3
42.
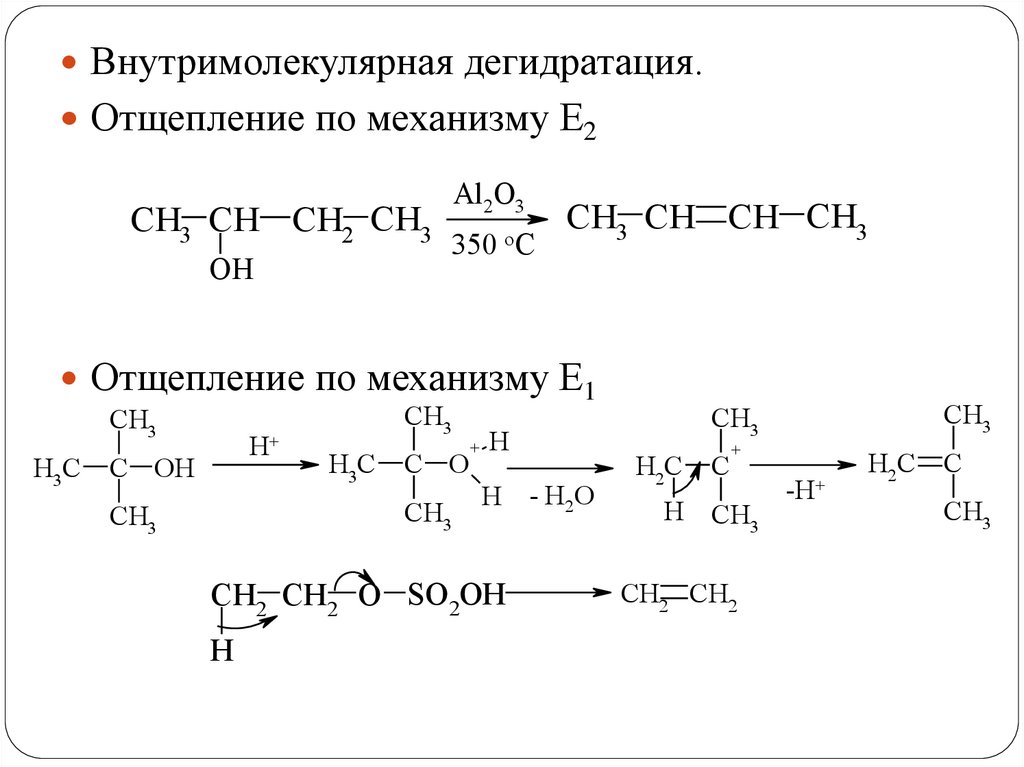
Внутримолекулярная дегидратация.Отщепление по механизму Е2
CH3 CH CH2 CH3
OH
Al2O3
350
oC
CH3 CH CH CH3
Отщепление по механизму Е1
CH3
H3C
H+
C OH
CH3
H3C
C O
CH3
CH3
+
H
H - H2O
CH2 CH2 O SO2OH
H
CH3
CH3
H2C
C
+
H CH3
CH2 CH2
-H+
H2C
C
CH3
43.
Окисление и дегидрирование спиртовCH3 CH CH2 CH3
OH
CH2 CH2 CH3
OH
Cu
250 0C
Cu
250 0C
H3C CH2 CH2 OH
CH3
CH3 CH OH
CrO3
CrO3
CH3 C CH2 CH3 + H2
O
CH CH2 CH3 + H2
O
H3C CH2 CH O
CH3
CH3 C
O
Окисление первичных спиртов проводят при
температуре ниже температуры кипения спирта, но
выше температуры кипения альдегида, чтобы избежать
дальнейшего окисления.
Третичные спирты не окисляются, а в жестких
условиях разлагаются.
44.
Нахождение в природеСпирты имеют самое широкое распространение в
природе, особенно в виде сложных эфиров, однако и в
свободном состоянии их можно встретить достаточно
часто.
Метиловый
спирт в небольшом количестве
содержится в некоторых растениях, например:
борщевике.
Этиловый спирт — естественный продукт спиртового
брожения органических продуктов, содержащих
углеводы, часто образующийся в прокисших ягодах и
фруктах без всякого участия человека. Кроме того,
этанол является естественным метаболитом и
содержится в тканях и крови животных и человека.
45.
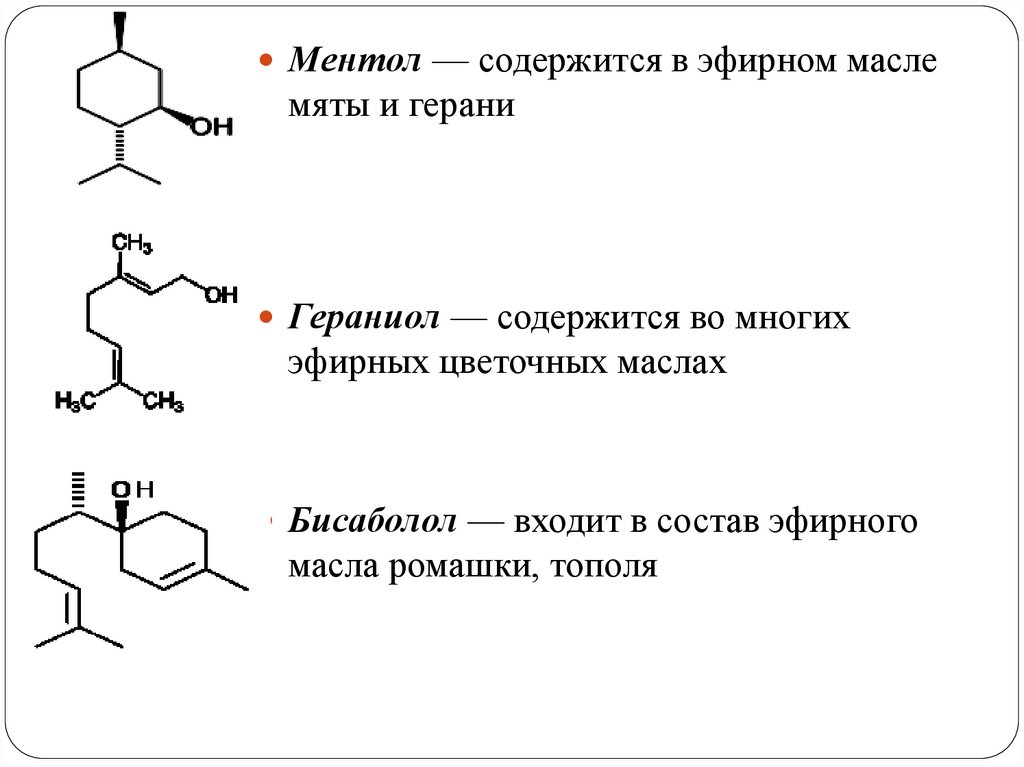
Ментол — содержится в эфирном маслемяты и герани
Гераниол — содержится во многих
эфирных цветочных маслах
Бисаболол — входит в состав эфирного
масла ромашки, тополя
46.
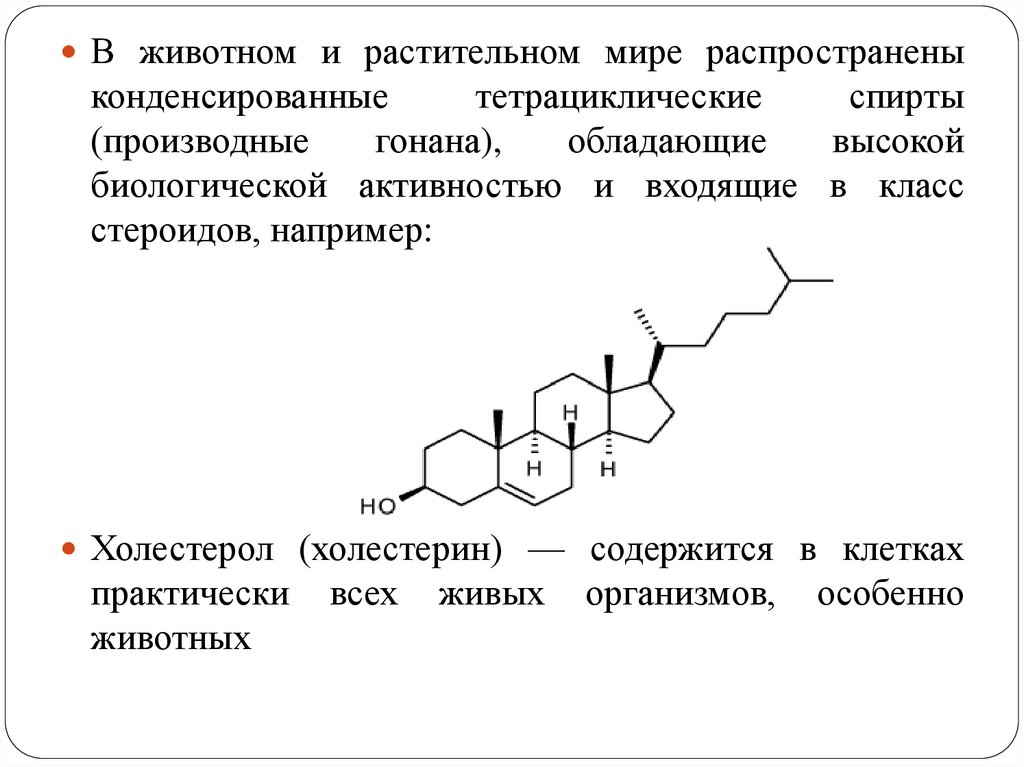
В животном и растительном мире распространеныконденсированные
тетрациклические
спирты
(производные
гонана),
обладающие
высокой
биологической активностью и входящие в класс
стероидов, например:
Холестерол (холестерин) — содержится в клетках
практически
животных
всех
живых
организмов,
особенно
47.
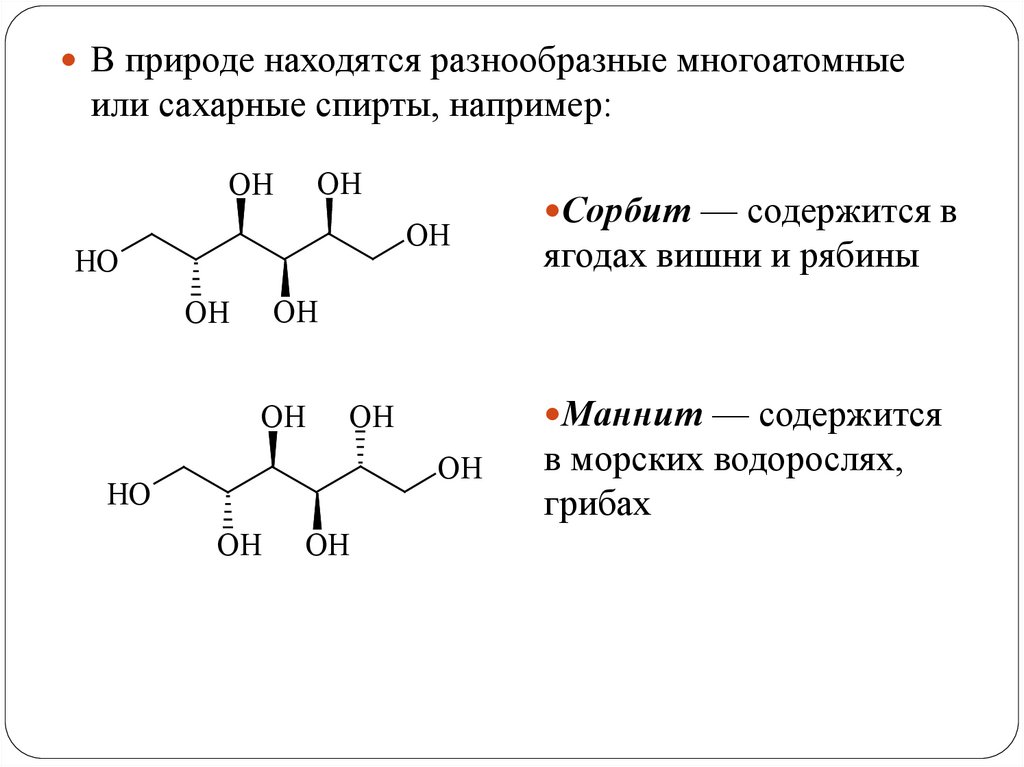
В природе находятся разнообразные многоатомныеили сахарные спирты, например:
OH
OH
OH
HO
Сорбит — содержится в
ягодах вишни и рябины
OH
OH
OH
Маннит — содержится
OH
OH
HO
OH
OH
в морских водорослях,
грибах
48.
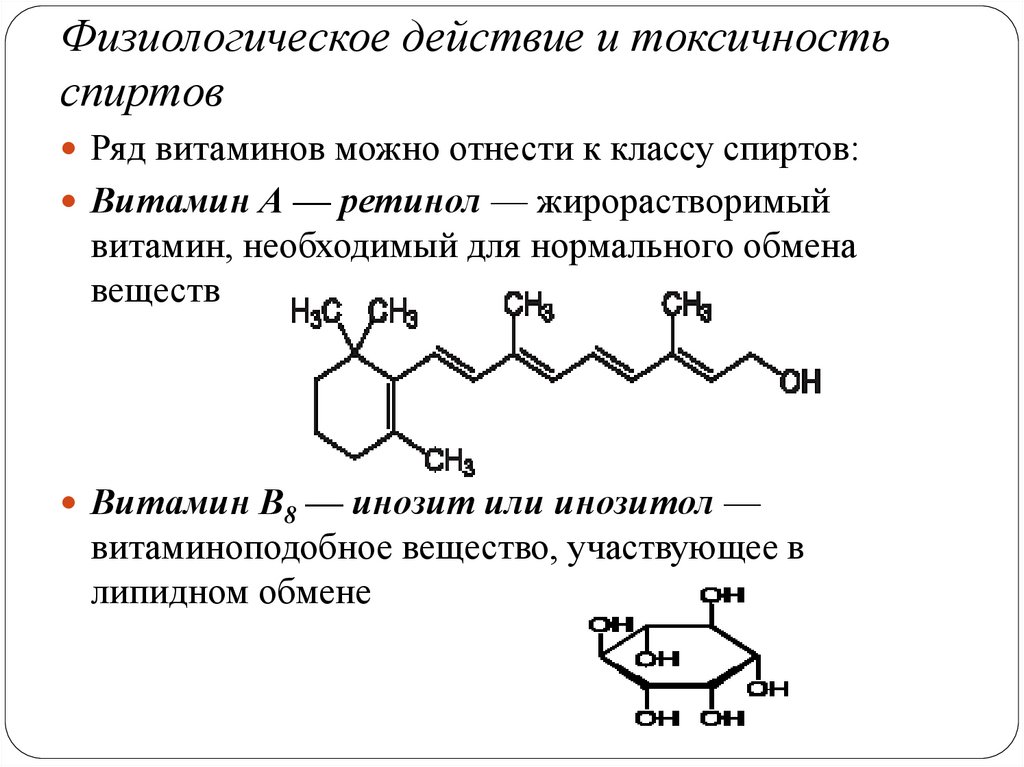
Физиологическое действие и токсичностьспиртов
Ряд витаминов можно отнести к классу спиртов:
Витамин А — ретинол — жирорастворимый
витамин, необходимый для нормального обмена
веществ
Витамин B8 — инозит или инозитол —
витаминоподобное вещество, участвующее в
липидном обмене
49.
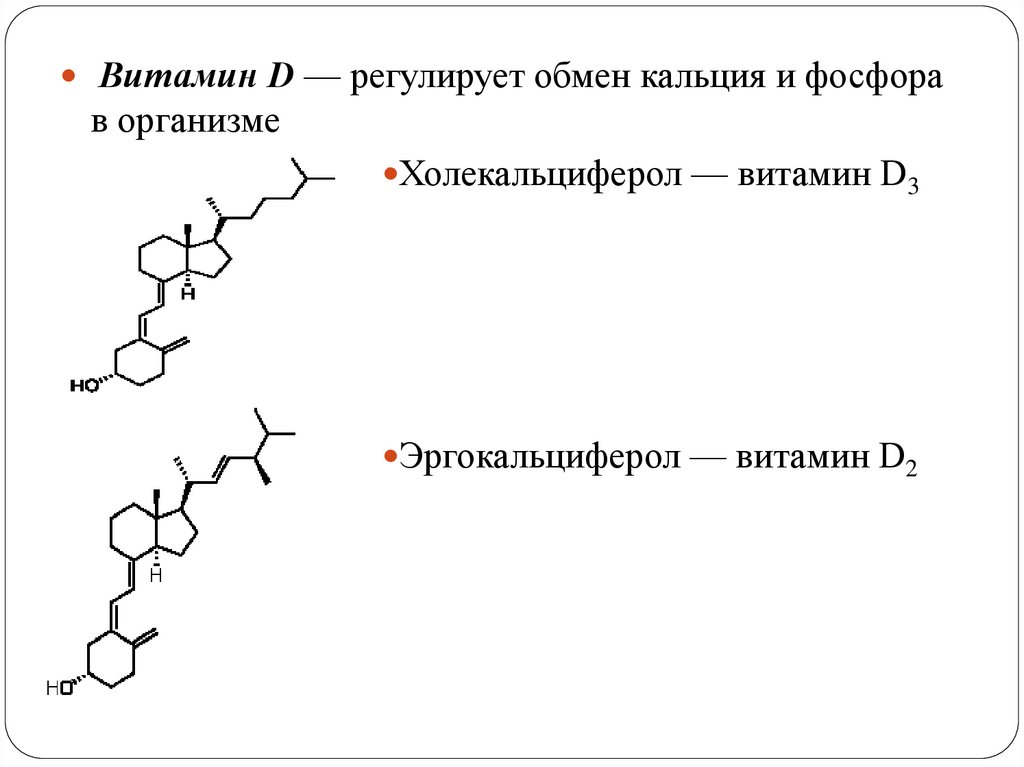
Витамин D — регулирует обмен кальция и фосфорав организме
Холекальциферол — витамин D3
Эргокальциферол — витамин D2
50.
Одноатомные предельные спирты вводят организм внаркозоподобное или гипнотическое состояние, а
также оказывают токсическое действие. Эти эффекты
усиливаются (токсический — начиная с этанола) с
увеличением углеродной цепи, достигая максимума
при С6—С8. Одноатомные спирты неразветвлённого
строения с нечётным количеством атомов и спирты
изо строения с чётным гораздо более токсичны за счёт
образования опасных продуктов метаболизма —
формальдегида и муравьиной кислоты.
Пары спиртов оказывают раздражающее действие на
слизистые оболочки; поражают зрение — метиловый,
гексиловый, гептиловый, нониловый и дециловый
спирты
51.
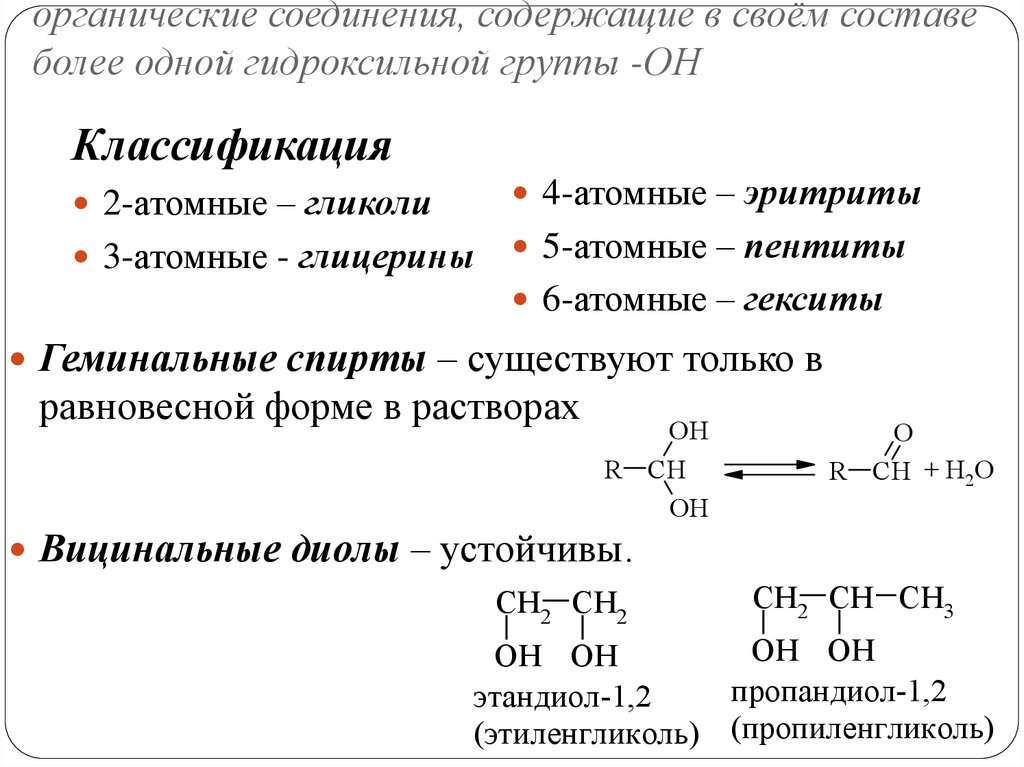
органические соединения, содержащие в своём составеболее одной гидроксильной группы -ОН
Классификация
2-атомные – гликоли
4-атомные – эритриты
3-атомные - глицерины
5-атомные – пентиты
6-атомные – гекситы
Геминальные спирты – существуют только в
равновесной форме в растворах
OH
R CH
OH
O
R CH + H2O
Вицинальные диолы – устойчивы.
CH2 CH2
CH2 CH CH3
OH OH
OH OH
пропандиол-1,2
этандиол-1,2
(этиленгликоль) (пропиленгликоль)
52.
Физические свойстваЭтиленгликоль и глицерин – бесцветные вязкие
жидкости со сладким вкусом (от греч. glykys–
сладкий), хорошо растворимы в воде, плохо — в
органических растворителях; имеют высокие
температуры кипения. Температуры кипения
этиленгликоля – 197,2 °С, глицерина – 290 °С.
Этиленгликоль – яд, при пероральном попадании в
организм; поражает ЦНС и почки, вызывает гемолиз
эритроцитов; обладает мутагенным действием.
53.
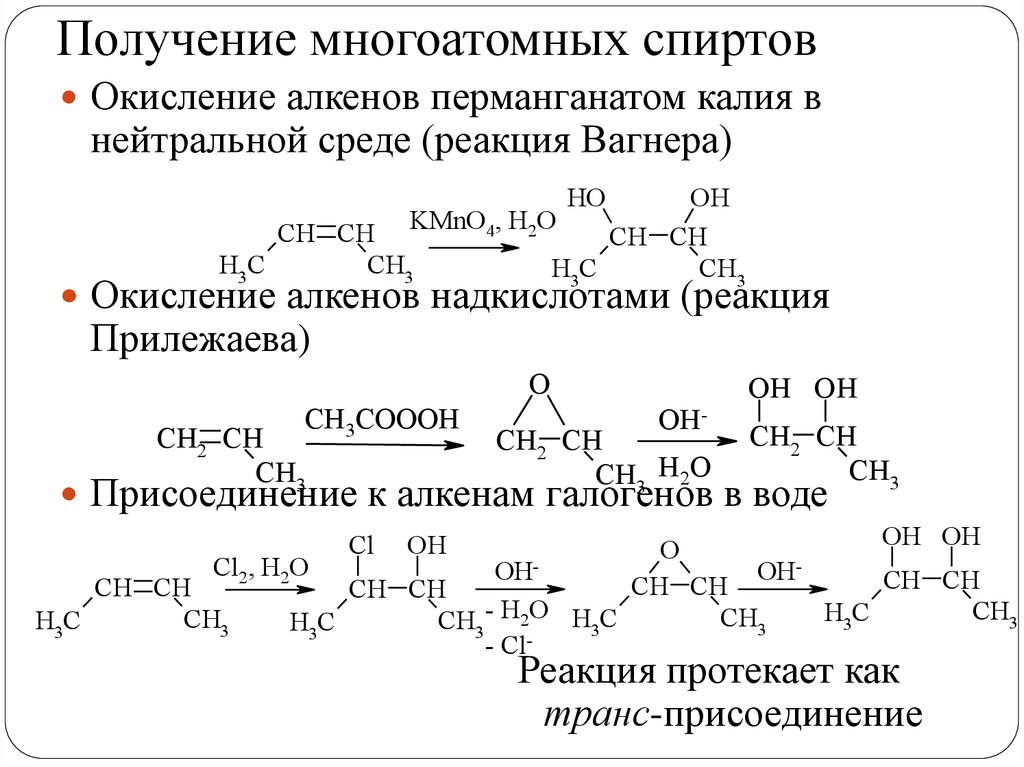
Получение многоатомных спиртовОкисление алкенов перманганатом калия в
нейтральной среде (реакция Вагнера)
HO
OH
CH CH KMnO4, H2O
CH CH
H3C
CH3
H3C
CH3
Окисление алкенов надкислотами (реакция
Прилежаева)
O
CH3COOOH
CH2 CH
CH3
OH-
CH2 CH
CH3 H2O
OH OH
CH2 CH
CH3
Присоединение к алкенам галогенов в воде
OH OH
O
Cl2, H2O
OHOHCH CH
CH CH
CH CH
CH CH
CH3
H3C
CH3
CH3
H3C
CH3 - H2O H3C
H3C
- ClCl
OH
Реакция протекает как
транс-присоединение
54.
Гидролиз вицинальных дигалогенпроизводныхCH2 CH2
Cl
Cl
+ 2NaOH
водн.р-р
CH2 CH2
OH OH
+ 2NaСl
Глицерин получают из жиров, а также синтетическим
путем из газов крекинга нефти (пропилена), т.е. из
непищевого сырья.
CH2 O
СO R
CH O
СO R' + 3NaOH
CH2 O
СO R"
CH2 CH CH3
OH-
Cl2, t
t
CH2 OH
CH OH + RCOONa + R'COONa + R"COONa
CH2 OH
CH2 CH CH2Cl
CH2 CH CH2
OH OH OH
H2O
CH2 CH CH2OH
Cl2, H2O
CH2 CH CH2OH
Cl
OH
55.
Химические свойстваКислотность
многоатомных спиртов выше, чем
одноатомных, что объясняется наличием в молекуле
дополнительных гидроксильных групп, обладающих
отрицательным индуктивным эффектом. Поэтому
многоатомные спирты, в отличие от одноатомных,
реагируют только с щелочными металлами, но и с
гидроксидами тяжелых металлов.
По
CH2 CH2
Na
OH OH
-1/2H2
CH2 CH2
Na
OH ONa -1/2H2
CH2 CH2
ONa ONa
аналогии с алкоголятами соли двухатомных
спиртов называются гликолятами, а трехатомных —
глицератами.
56.
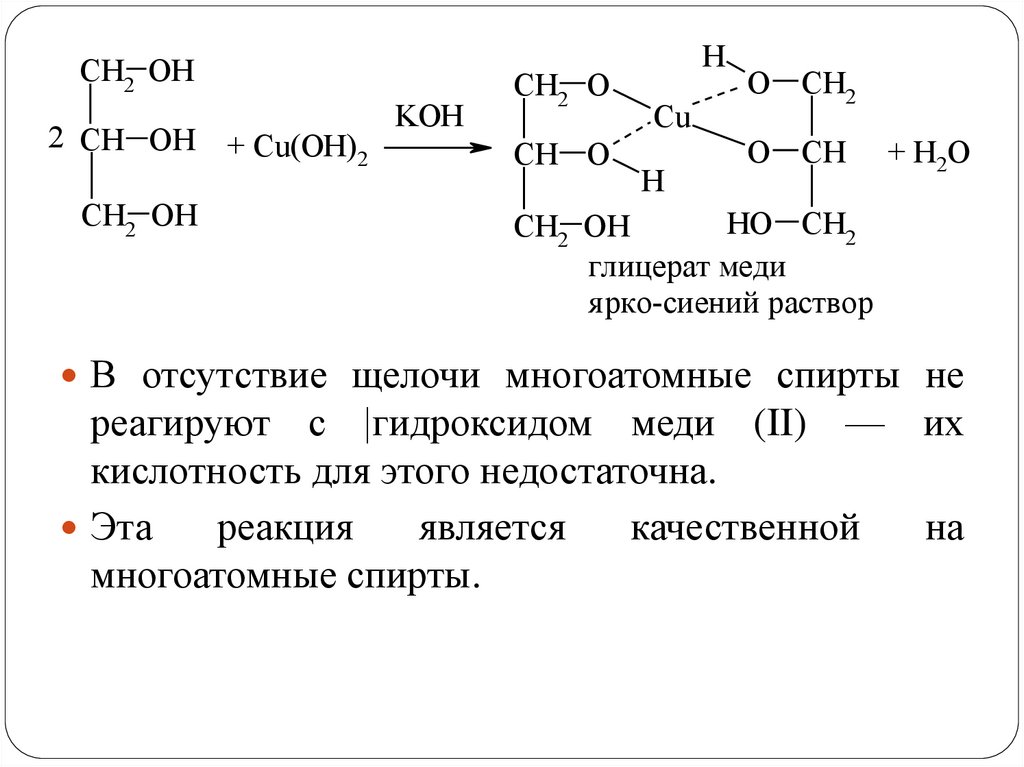
CH2 OH2 CH OH + Cu(OH)
2
CH2 OH
KOH
CH2 O
CH O
H
Cu
H
O CH2
O CH
+ H2O
HO CH2
CH2 OH
глицерат меди
я рко-сиений раствор
В отсутствие щелочи многоатомные спирты не
реагируют с |гидроксидом меди (II) — их
кислотность для этого недостаточна.
Эта
реакция
является
качественной
на
многоатомные спирты.
57.
Привзаимодействии
этиленгликоля
с
галогеноводородами
(НСl,
HBr)
одна
гидроксильная группа замещается на галоген.
Вторая гидроксогруппа замещается труднее, под
действием РСl5
CH2 CH2
OH OH
HCl
CH2 CH2
PCl5
OH Cl
этиленхлоргидрин
CH2 CH2
Cl
Cl
58.
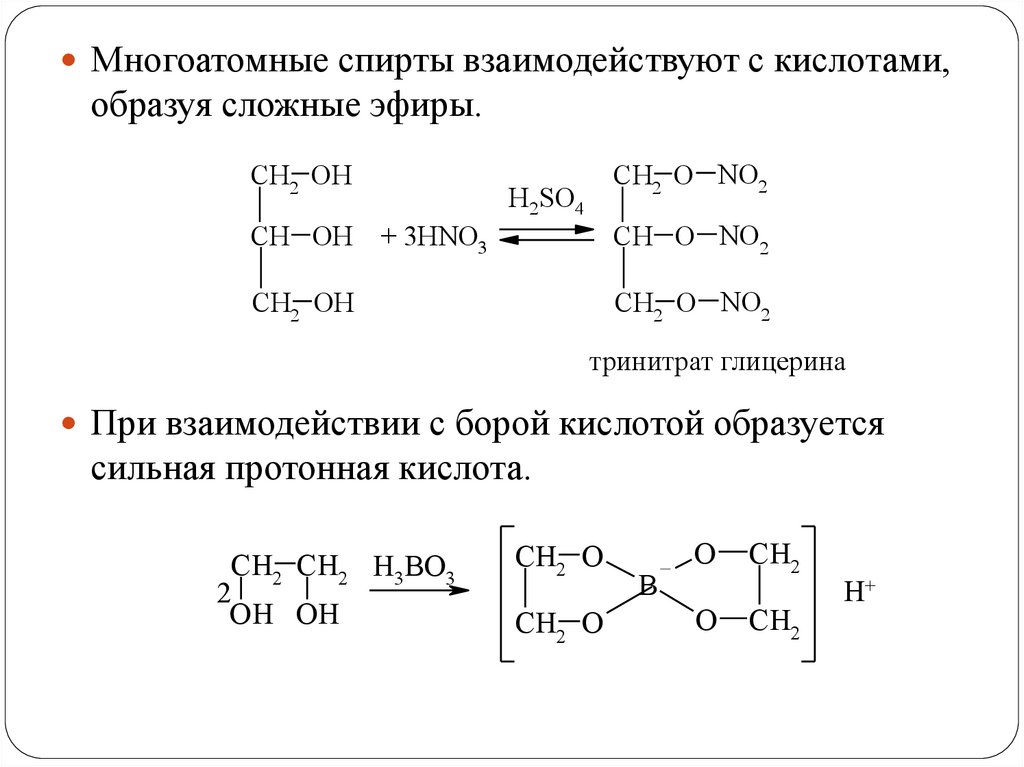
Многоатомные спирты взаимодействуют с кислотами,образуя сложные эфиры.
CH2 OH
CH2 O NO2
H2SO4
CH OH + 3HNO3
CH O NO2
CH2 OH
CH2 O NO2
тринитрат глицерина
При взаимодействии с борой кислотой образуется
сильная протонная кислота.
CH2 CH2 H3BO3
2
OH OH
CH2 O
CH2 O
B
O
O
CH2
CH2
H+
59.
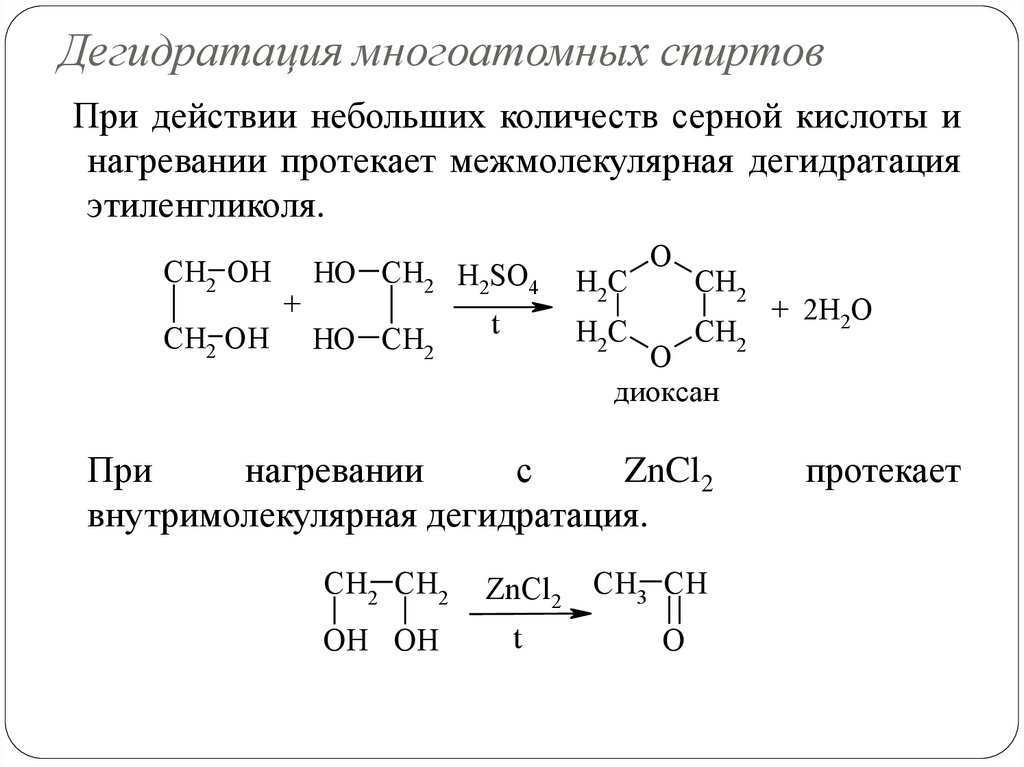
Дегидратация многоатомных спиртовПри действии небольших количеств серной кислоты и
нагревании протекает межмолекулярная дегидратация
этиленгликоля.
CH2 OH
CH2 OH
+
HO CH2 H2SO4
HO CH2
t
H2C
O
H2C
CH2
CH2
+ 2H2O
O
диоксан
При
нагревании
с
ZnCl2
внутримолекулярная дегидратация.
CH2 CH2
ZnCl2
OH OH
t
CH3 CH
O
протекает
60.
Дегидратация многоатомных спиртовдегидратация глицерина
H
CH2 CH CH2
KHSO4
OH O+ OH
H
H
OH OH OH
перенос Н+ CH CH CH
2
2
OH
+
CH2 CH CH2
O
CH2 CH CH
- H2O
OH
CH2 CH2 CH
H+
H
O
+
H
O
O
- H2O
H -H+
CH2 C
H
OH
CH2 CH CH
O
акролеин
C H
O
H
61.
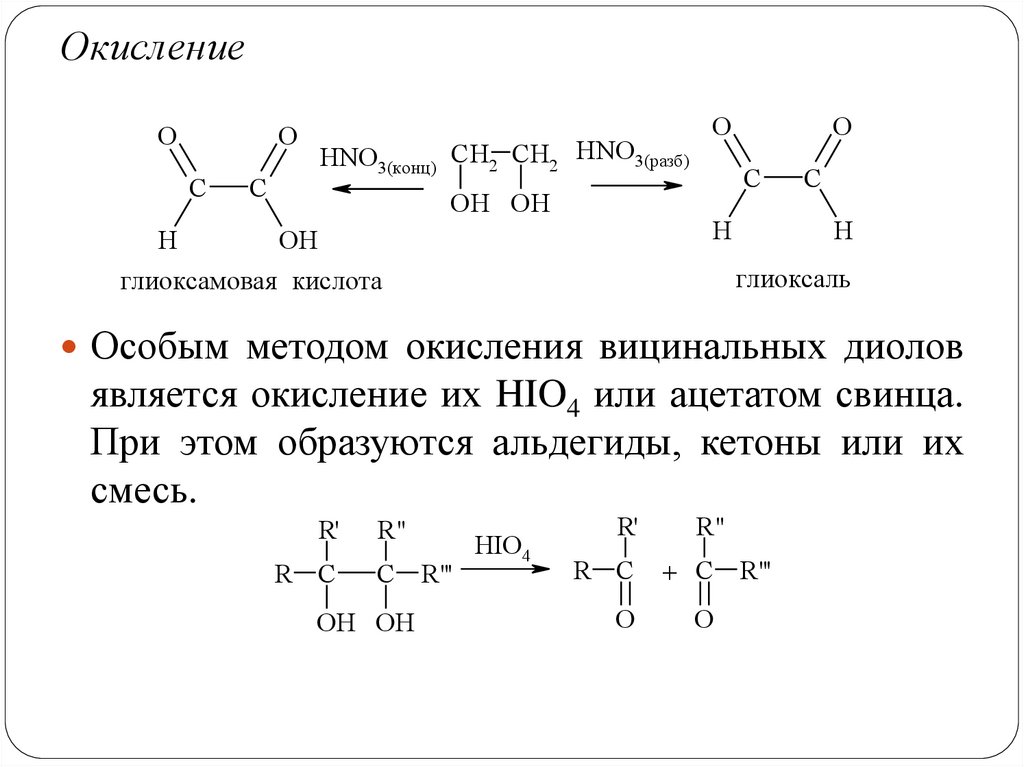
ОкислениеO
O
C
C
HNO3(конц) CH2 CH2 HNO3(разб)
OH OH
O
O
C
H
H
OH
глиоксамовая кислота
C
H
глиоксаль
Особым методом окисления вицинальных диолов
является окисление их HIO4 или ацетатом свинца.
При этом образуются альдегиды, кетоны или их
смесь.
R'
R C
R"
C
OH OH
R"'
HIO4
R'
R"
R C
+ C
O
O
R"'
62.
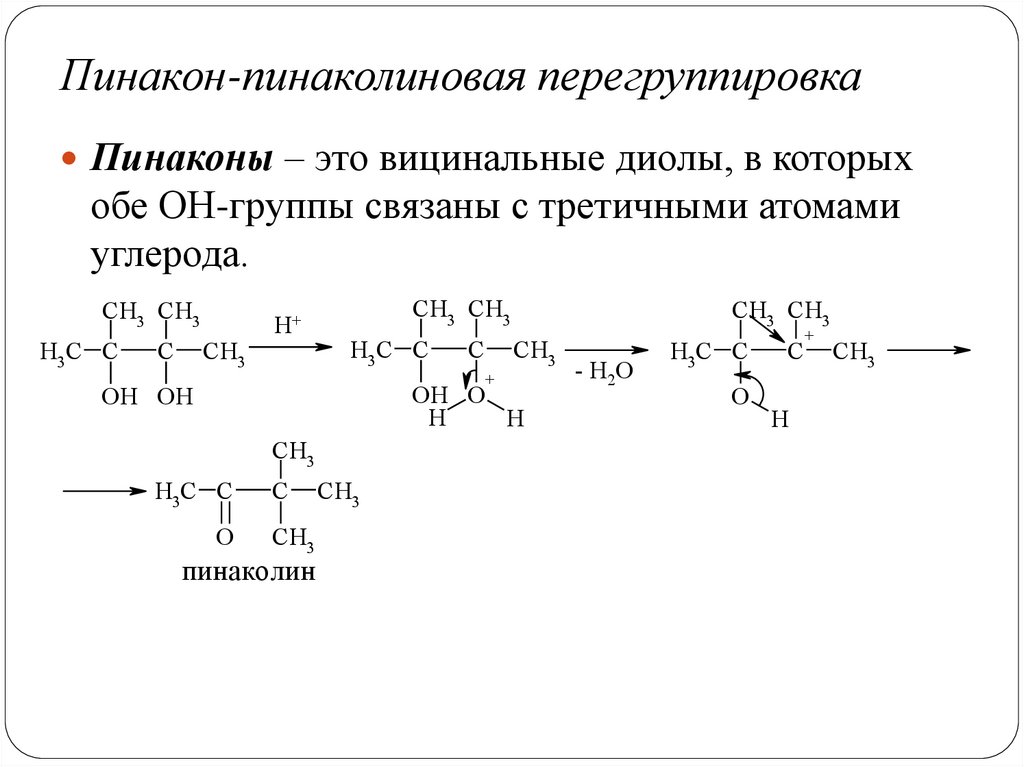
Пинакон-пинаколиновая перегруппировкаПинаконы – это вицинальные диолы, в которых
обе ОН-группы связаны с третичными атомами
углерода.
CH3 CH3
H3C C
C
CH3
H+
CH3 CH3
H3C C
C
CH3 CH3
CH3
+
OH O
H
H
OH OH
CH3
H3C C
O
C
CH3
пинаколин
CH3
- H2O
H3C C
O
C
H
+
CH3
63.
ПрименениеЭтиленгликоль
используется главным образом для
производства лавсана и для приготовления антифризов —
водных растворов, замерзающих значительно ниже 0°С
(использование их для охлаждения двигателей позволяет
автомобилям
работать
в
зимнее
время).
Глицерин широко используется в кожевенной, текстильной
промышленности при отделке кож и тканей и в других
областях народного хозяйства. Наиболее важной областью
применения глицерина является производство тринитрата
глицерина (неверно называемого нитроглицерином) — это
сильное взрывчатое вещество, которое взрывается от
удара, а также лекарство (сосудорасширяющее средство).
Сорбит (шестиатомный спирт) используется как
заменитель сахара для больных диабетом.

















 chemistry
chemistry