Similar presentations:
Спирты
1.
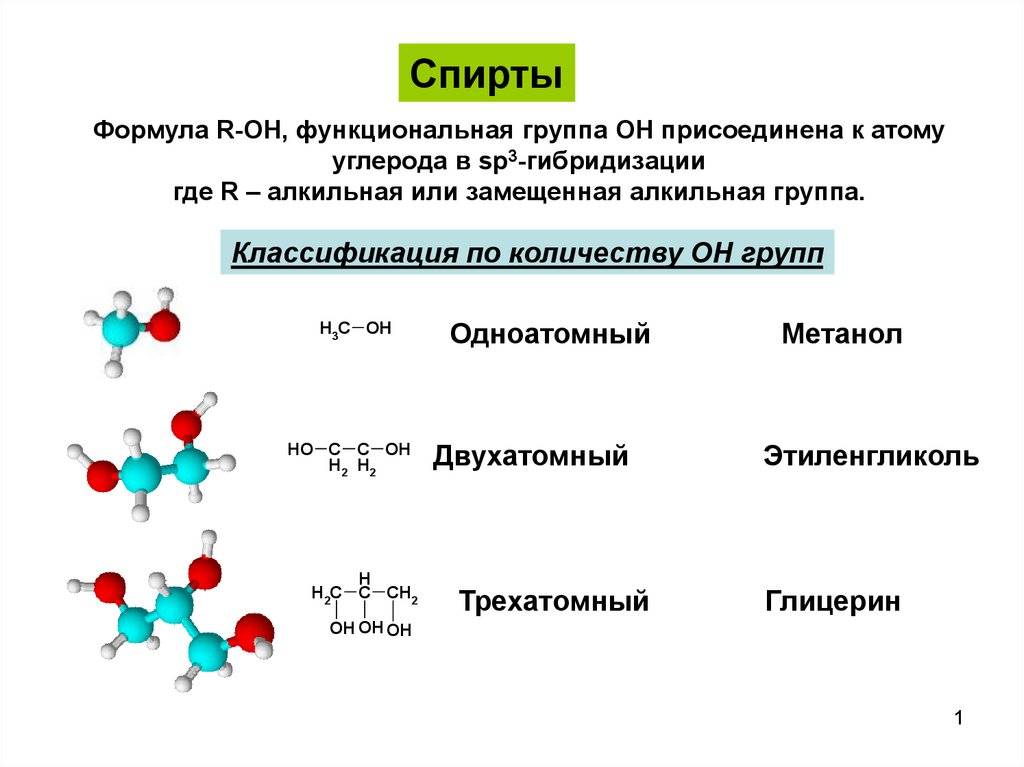
СпиртыФормула R-OH, функциональная группа OH присоединена к атому
углерода в sp3-гибридизации
где R – алкильная или замещенная алкильная группа.
Классификация по количеству OH групп
H3C OH
HO C C OH
H2 H2
H
H2C C CH2
Одноатомный
Двухатомный
Трехатомный
Метанол
Этиленгликоль
Глицерин
OH OH OH
1
2.
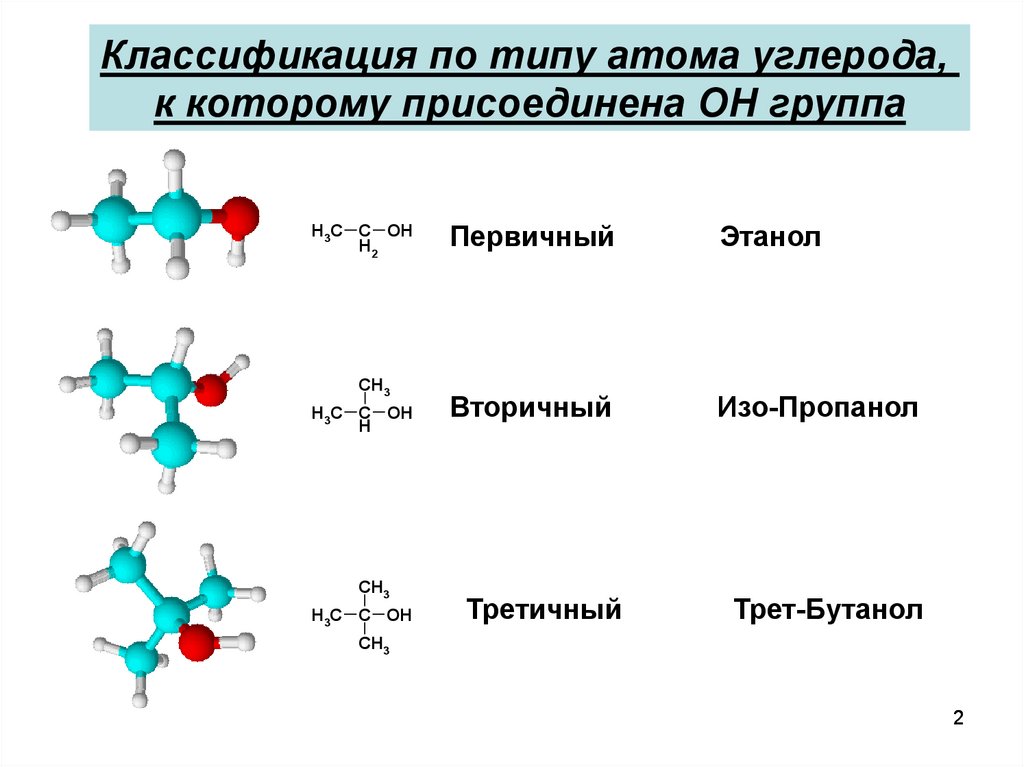
Классификация по типу атома углерода,к которому присоединена OH группа
H3C C OH
H2
CH3
H3C C OH
H
CH3
H3C C OH
Первичный
Этанол
Вторичный
Изо-Пропанол
Третичный
Трет-Бутанол
CH3
2
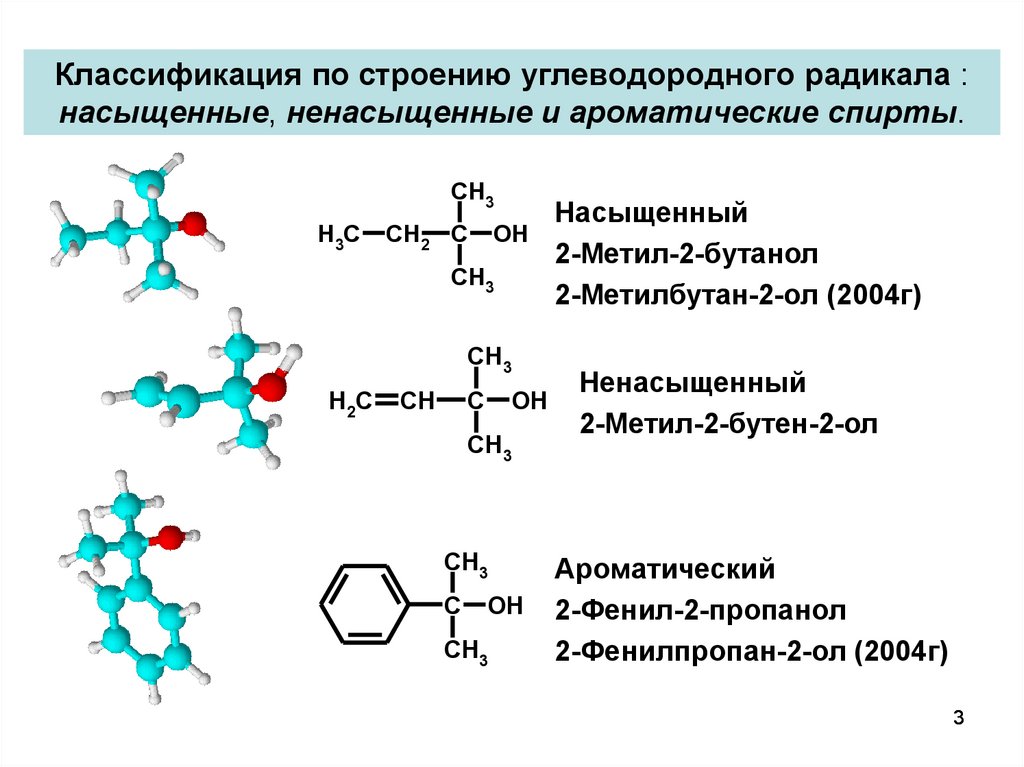
3. Классификация по строению углеводородного радикала : насыщенные, ненасыщенные и ароматические спирты.
CH3H3C
CH2 C
OH
CH3
CH3
H2C
CH
C
OH
CH3
CH3
C
OH
CH3
Насыщенный
2-Метил-2-бутанол
2-Метилбутан-2-ол (2004г)
Ненасыщенный
2-Метил-2-бутен-2-ол
Ароматический
2-Фенил-2-пропанол
2-Фенилпропан-2-ол (2004г)
3
4.
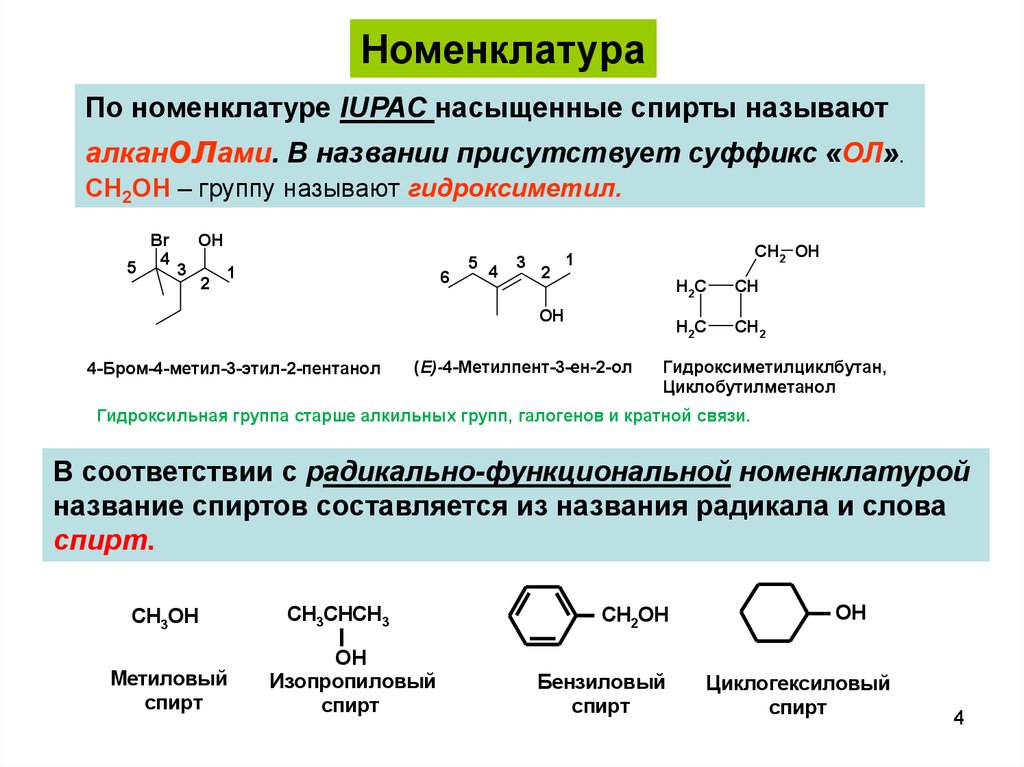
НоменклатураПо номенклатуре IUPAC насыщенные спирты называют
алканолами. В названии присутствует суффикс «ОЛ».
CH2OH – группу называют гидроксиметил.
5
Br
4
OH
3
2
1
6
5
4
3
2
CH2 OH
1
OH
4-Бром-4-метил-3-этил-2-пентанол
(E)-4-Метилпент-3-ен-2-ол
H2C
CH
H2C
CH2
Гидроксиметилциклбутан,
Циклобутилметанол
Гидроксильная группа старше алкильных групп, галогенов и кратной связи.
В соответствии с радикально-функциональной номенклатурой
название спиртов составляется из названия радикала и слова
спирт.
СН3ОН
Метиловый
спирт
СН3СНСН3
ОН
Изопропиловый
спирт
СН2ОН
Бензиловый
спирт
ОН
Циклогексиловый
спирт
4
5.
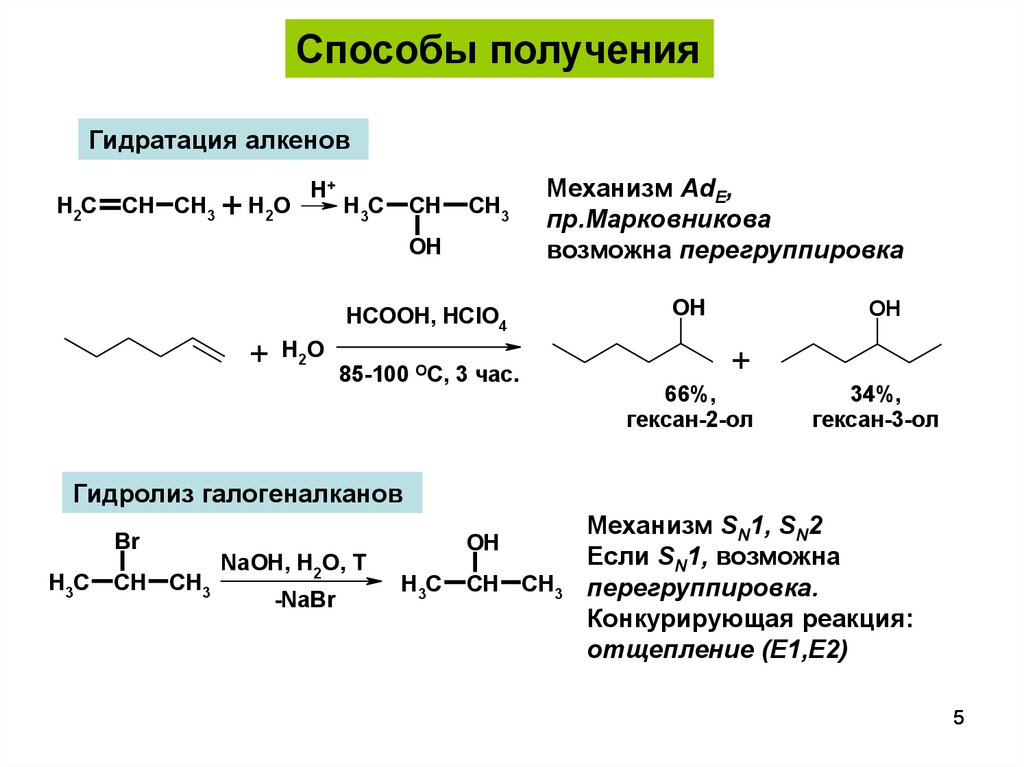
Способы полученияГидратация алкенов
H2C
CH CH3
+
H2O
Н+
H3C
CH
CH3
OH
Механизм AdE,
пр.Марковникова
возможна перегруппировка
HCOOH, HClO4
+
H2O
85-100 ОС, 3 час.
OH
OH
+
66%,
гексан-2-ол
34%,
гексан-3-ол
Гидролиз галогеналканов
Br
H3C
CH CH3
NaOH, H2O, T
-NaBr
OH
H3C
CH CH3
Механизм SN1, SN2
Если SN1, возможна
перегруппировка.
Конкурирующая реакция:
отщепление (E1,E2)
5
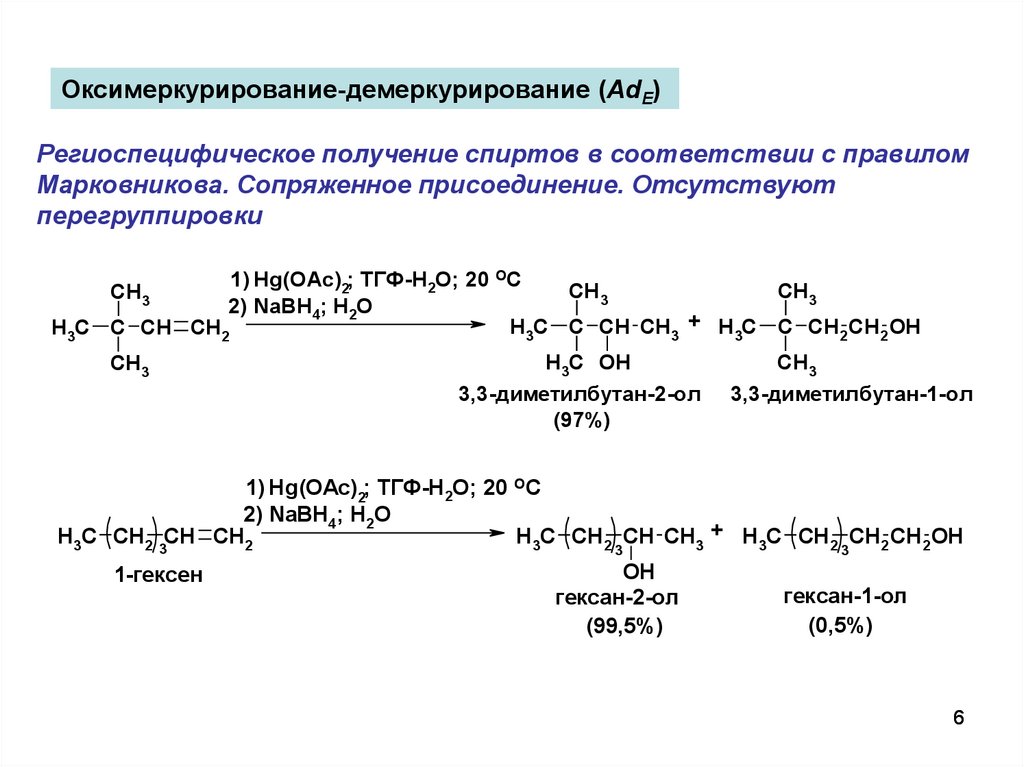
6.
Оксимеркурирование-демеркурирование (AdE)Региоспецифическое получение спиртов в соответствии с правилом
Марковникова. Сопряженное присоединение. Отсутствуют
перегруппировки
1) Hg(OAc)2; ТГФ-H2O; 20 OC
CH3
CH3
2) NaBH4; H2O
H3C C CH CH3 + H3C C CH2 CH2 OH
H3C C CH CH2
CH3
CH3
H3C OH
3,3-диметилбутан-2-ол
(97%)
CH3
3,3-диметилбутан-1-ол
1) Hg(OAc)2; ТГФ-H2O; 20 OC
2) NaBH4; H2O
H3C CH2 3CH CH2
H3C CH2 CH CH3 + H3C CH2 CH2 CH2 OH
1-гексен
3
3
OH
гексан-2-ол
(99,5%)
гексан-1-ол
(0,5%)
6
7.
Механизм реакцииR HC CH2 +
+
HgOAc
R HC
H2 O
+
CH2
OH
+
R CH CH2 Hg OAc + H
Hg
OAc
циклический
меркуриниевый ион
NaBH4
R CH CH2 HgH
OH
R CH CH3 + Hg
OH
гидроксиалкилмеркурогидрид
Сопряженное присоединение. Роль внешнего нуклеофила выполняет
растворитель – вода.
7
8.
Синтез с помощью реактива ГриньяраРеакция с альдегидами и кетонами. AdN
(H) R1 +
С
(H) R2
R3
О
(абс. эф.) (H) R1
+
MgBr
(H) R2
H2O, HCl
С
О
R3
MgBr
-MgBrCl
(H) R1
(H) R2
С
ОH
R3
Формальдегид→первичный спирт
Альдегиды→вторичный спирт
Кетоны→третичный спирт
абс.
H
H2O, HCl
эфир
CH3CH2CH2OMgBr
C O + CH3CH2MgBr
CH3CH2CH2OH
H
пропоксимагнийпропан-1-ол
бромид
абс.
CH3
CH3
H3C
эфир
H2O, HCl
C O + CH3CH2MgBr
H3C H2C HC OMgBr
H3C H2C HC OH + MgClBr
H
2-бутоксимагнийбутан-2-ол
бромид
абс.
CH3
CH3
H3C
H
O,
HCl
эфир
2
C O + CH3CH2MgBr
H3C H2C C OMgBr
H3C H2C C OH
H3C
CH3
CH3
2-метил-2-бутоксимагний2-метилбутан-2-ол
бромид
8
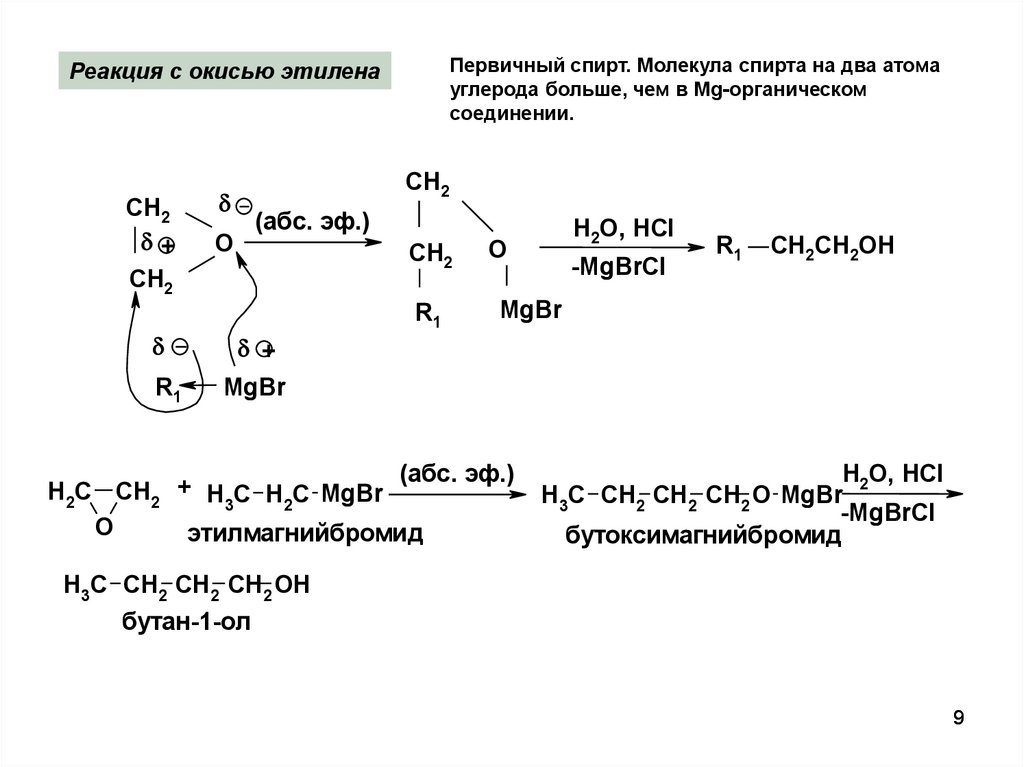
9.
Первичный спирт. Молекула спирта на два атомауглерода больше, чем в Mg-органическом
соединении.
Реакция с окисью этилена
СН2
+
О
СН2
(абс. эф.)
СН2
R1
СН2
R1
H2O, HCl
О
-MgBrCl
R1
CH2СН2OH
MgBr
+
MgBr
(абс. эф.)
H2C CH2 + H3C H2C MgBr
O
этилмагнийбромид
H2O, HCl
H3C CH2 CH2 CH2 O MgBr
-MgBrCl
бутоксимагнийбромид
H3C CH2 CH2 CH2 OH
бутан-1-ол
9
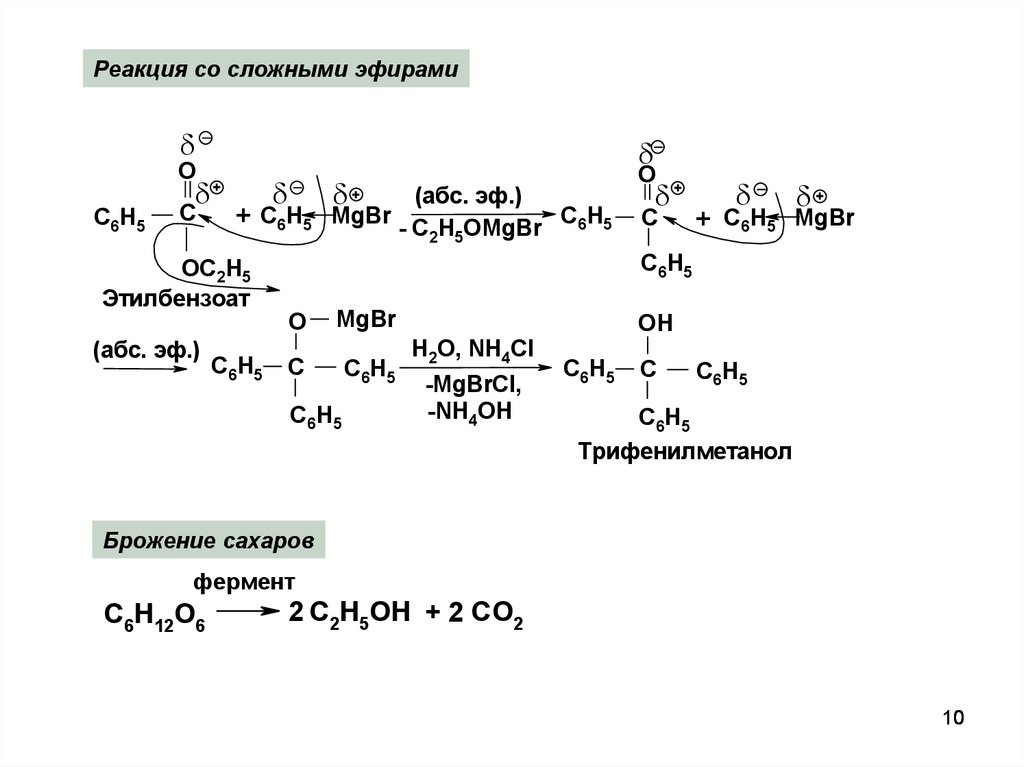
10.
Реакция со сложными эфирамиO
С6 Н5
+
С
+ С6 Н 5
ОС2Н5
Этилбензоат
(абс. эф.)
С6 Н 5
+
(абс. эф.)
С6 Н 5
MgBr
- С2Н5ОMgBr
O
+
С
+
+
С6Н5 MgBr
С6 Н5
О
MgBr
С
С6 Н5
С6 Н5
ОН
H2O, NH4Cl
-MgBrCl,
-NH4OH
С6 Н5
С
С 6 Н5
С6 Н5
Трифенилметанол
Брожение сахаров
фермент
C6H12O6
2 C2H5OH + 2 CO2
10
11.
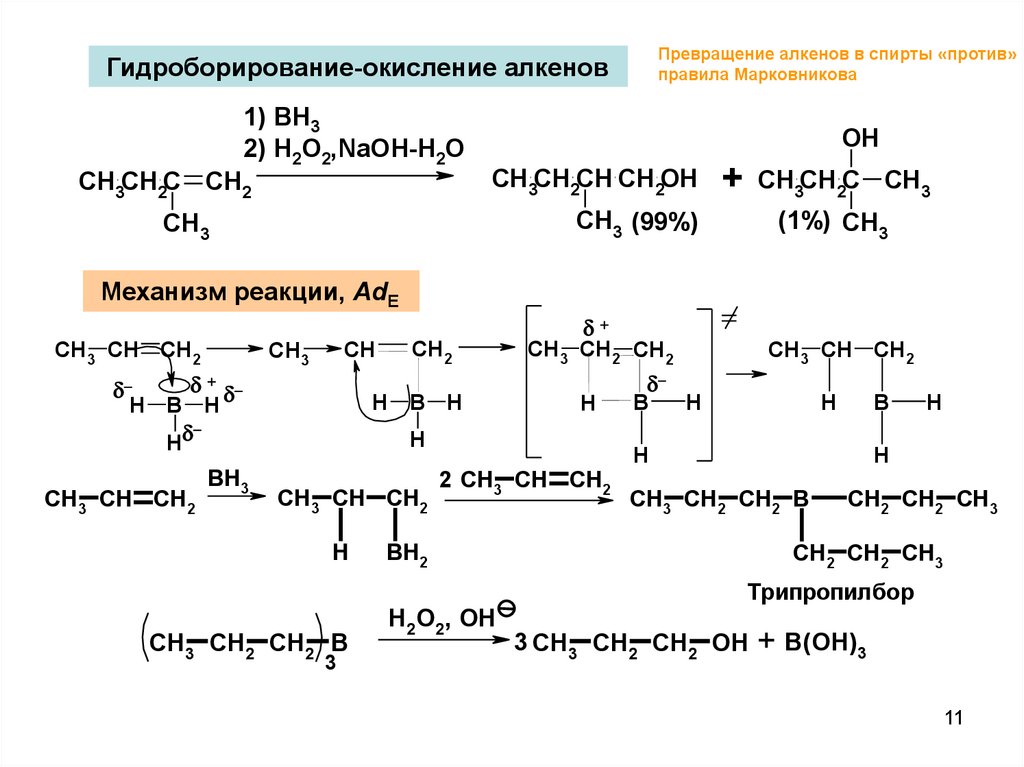
Превращение алкенов в спирты «против»правила Марковникова
Гидроборирование-окисление алкенов
1) BH3
2) H2O2,NaOH-H2O
OH
CH3CH2CH CH2OH
CH3CH2C CH2
+
CH3CH2C CH3
CH3 (99%)
CH3
(1%) CH3
Механизм реакции, AdE
CH3 CH CH2
CH
CH3
H B H
H
CH2
CH3 CH2 CH2
CH3 CH CH2
BH3
H B H
H
H
CH3 CH CH2
H
CH3 CH2 CH2 B
3
2 CH3 CH CH2
CH3 CH CH2
B
H
H
H
H
H
CH3 CH2 CH2 B
BH2
H2O2, OH
B
CH2 CH2 CH3
CH2 CH2 CH3
Трипропилбор
3 CH3 CH2 CH2 OH
+ B(OH)3
11
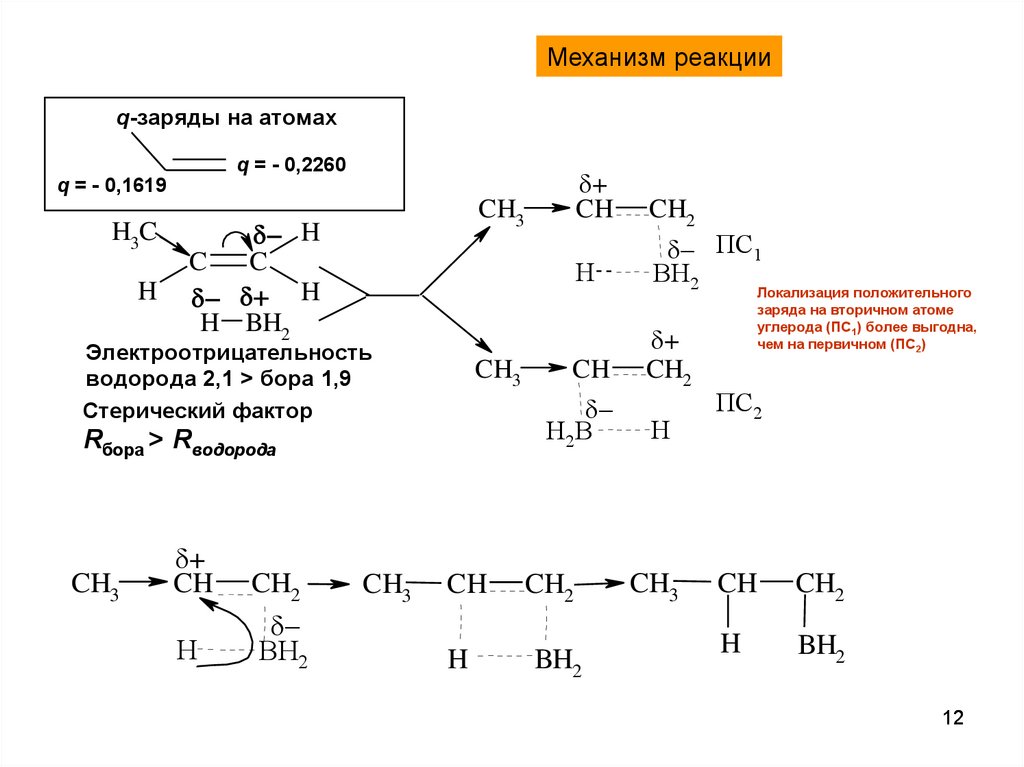
12.
Механизм реакцииq-заряды на атомах
q = - 0,2260
q = - 0,1619
H3C
H
CH3
H
C
C
H
H BH2
Электроотрицательность
водорода 2,1 > бора 1,9
Стерический фактор
CH3
CH3
CH2
H
BH2
CH3
CH
H
CH2
H
ПС1
BH2
CH
+
CH2
H2B
Rбора > Rводорода
+
CH
+
CH
CH2
BH2
H
CH3
Локализация положительного
заряда на вторичном атоме
углерода (ПС1) более выгодна,
чем на первичном (ПС2)
ПС2
CH
CH2
H
BH2
12
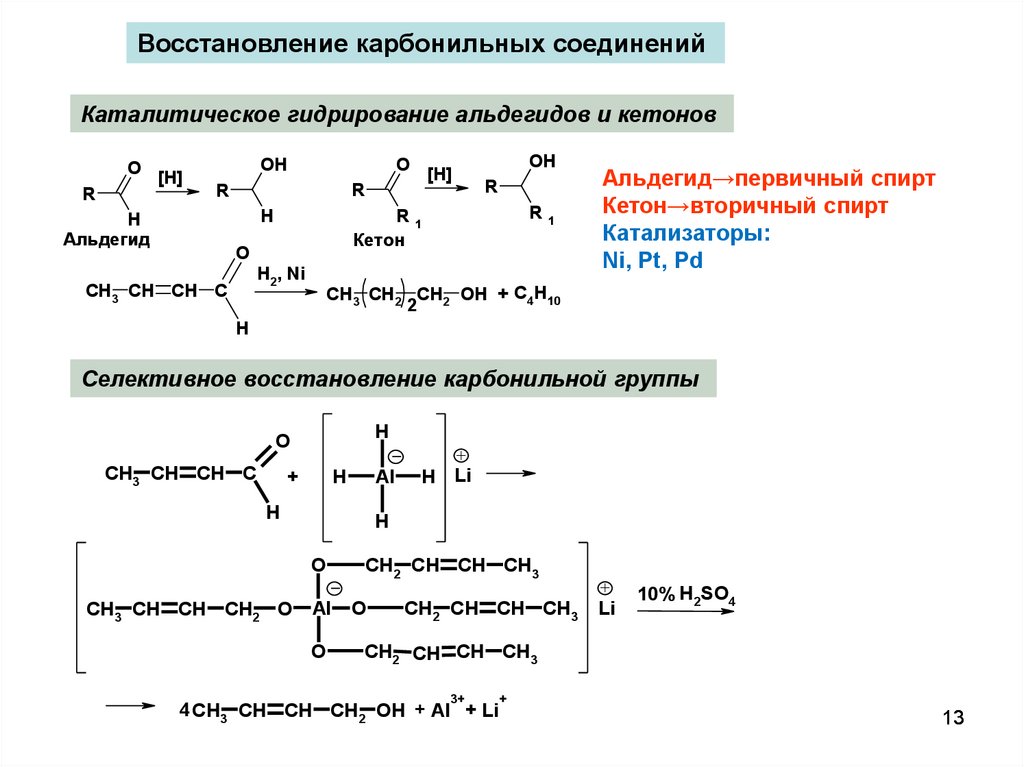
13.
Восстановление карбонильных соединенийКаталитическое гидрирование альдегидов и кетонов
O
R
[H]
O
OH
R
R
O
H2, Ni
CH3 CH CH C
R
R1
R1
Кетон
H
H
Альдегид
OH
[H]
Альдегид→первичный спирт
Кетон→вторичный спирт
Катализаторы:
Ni, Pt, Pd
CH3 CH2 CH2 OH + C4H10
2
H
Селективное восстановление карбонильной группы
H
O
CH3 CH CH C
+
+
H
Al
H
Li
H
O
CH3 CH CH CH2 O
H
Al
O
CH2 CH CH CH3
O
CH2 CH CH CH3
+
Li
10% H2SO4
CH2 CH CH CH3
3+
4 CH3 CH CH CH2 OH + Al + Li
+
13
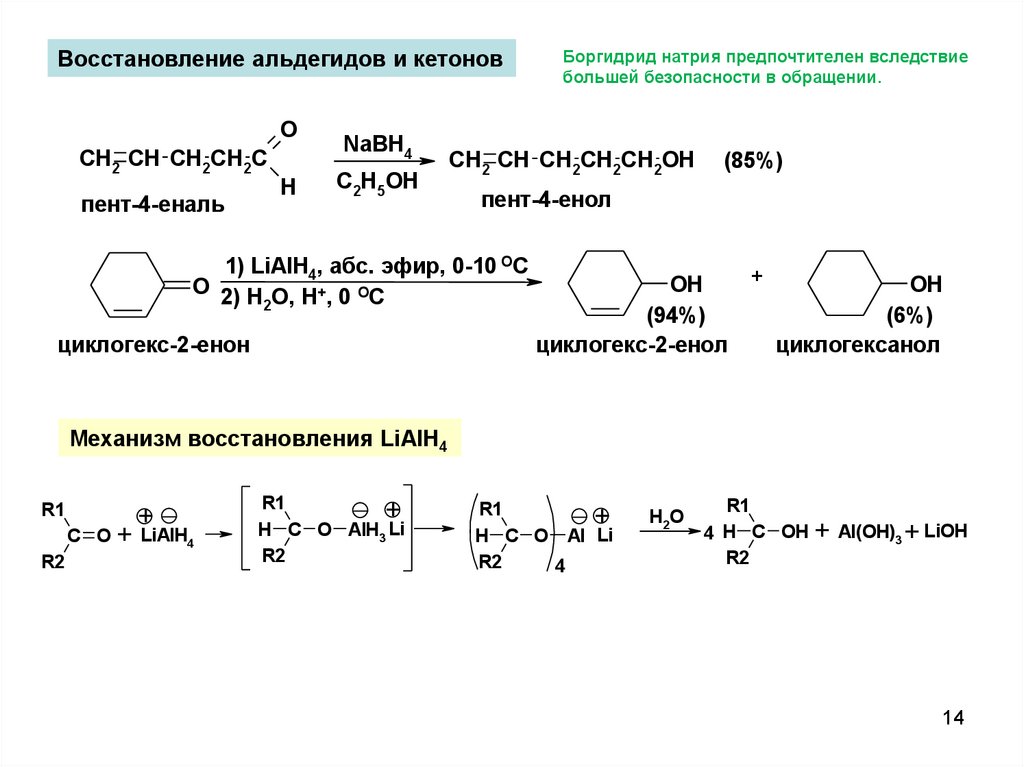
14.
Восстановление альдегидов и кетоновO
CH2 CH CH2CH2C
пент-4-еналь
H
NaBH4
C2H5OH
CH2 CH CH2CH2CH2OH
(85%)
пент-4-енол
1) LiAlH4, абс. эфир, 0-10 ОС
O 2) H O, H+, 0 OC
2
циклогекс-2-енон
Боргидрид натрия предпочтителен вследствие
большей безопасности в обращении.
+
OH
OH
(94%)
(6%)
циклогекс-2-енол
циклогексанол
Механизм восстановления LiAlH4
R1
C O
R2
+
+ LiAlH4
R1
+
H C O AlH3 Li
R2
R1
+
H C O Al Li
R2
4
H2 O
R1
4 H C OH
R2
+ Al(OH)3 + LiOH
14
15.
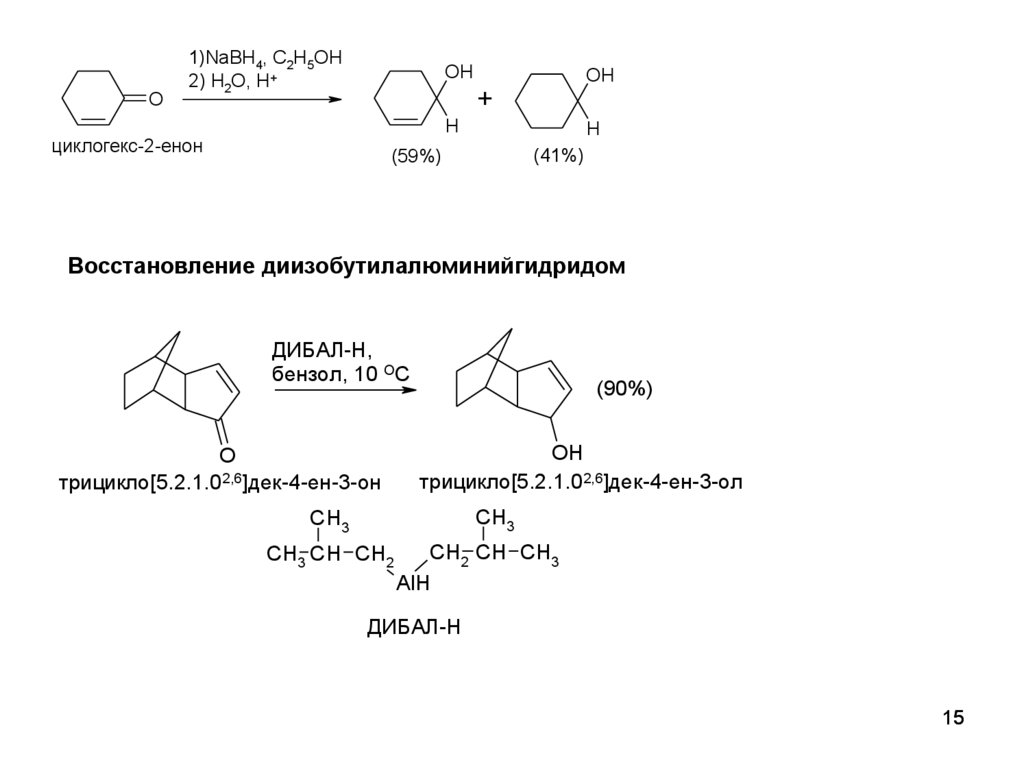
O1)NaBH4, C2H5OH
2) H2O, H+
OH
OH
+
H
циклогекс-2-енон
H
(41%)
(59%)
Восстановление диизобутилалюминийгидридом
ДИБАЛ-Н,
бензол, 10 ОС
O
трицикло[5.2.1.02,6]дек-4-ен-3-он
(90%)
OH
трицикло[5.2.1.02,6]дек-4-ен-3-ол
CH3
CH3
CH3 CH CH2
CH2 CH CH3
AlH
ДИБАЛ-Н
15
16.
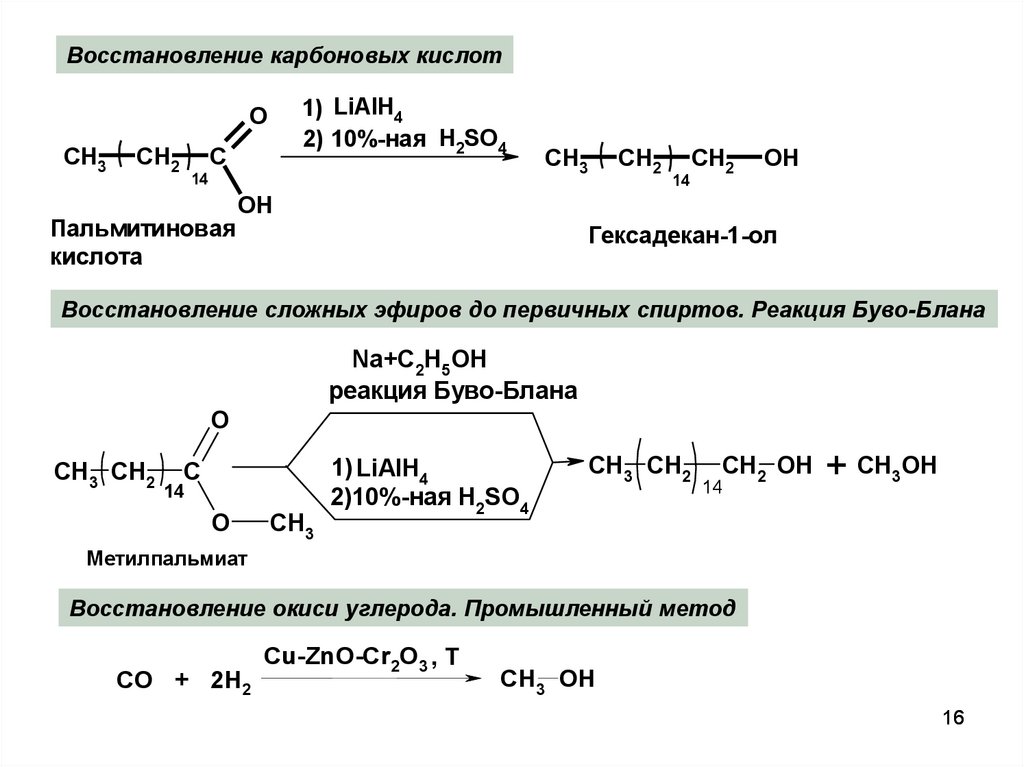
Восстановление карбоновых кислот1) LiAlH4
2) 10%-ная H2SO4
O
CH3
CH2
C
14
Пальмитиновая
кислота
CH3
CH2
14
CH2
OH
OH
Гексадекан-1-ол
Восстановление сложных эфиров до первичных спиртов. Реакция Буво-Блана
Na+C2H5OH
реакция Буво-Блана
O
CH3 CH2
C
14
O
CH3
1) LiAlH4
2)10%-ная H2SO4
CH3 CH2
CH2 OH
14
+ CH3OH
Метилпальмиат
Восстановление окиси углерода. Промышленный метод
СО + 2Н2
Cu-ZnO-Cr2O3 , Т
CH3 OH
16
17.
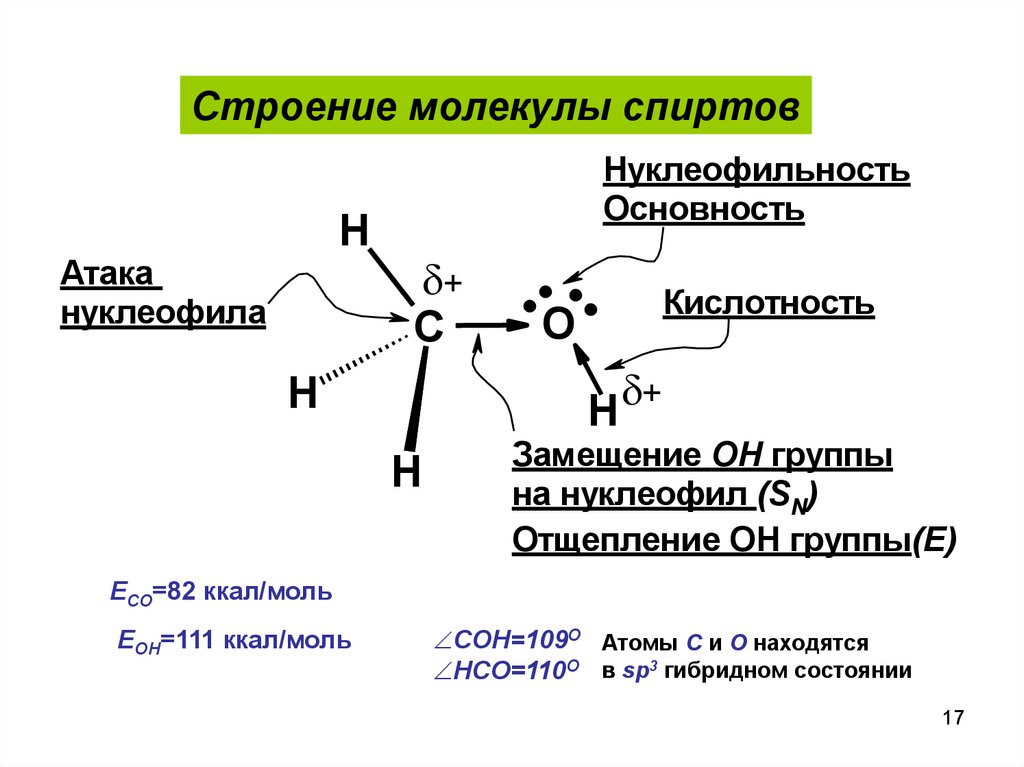
Строение молекулы спиртовH
Атака
нуклеофила
Нуклеофильность
Основность
+
C
....
O
Кислотность
H +
H
H
Замещение OH группы
на нуклеофил (SN)
Отщепление OH группы(E)
ECO=82 ккал/моль
EOH=111 ккал/моль
COH=109О Атомы С и О находятся
HCO=110О в sp3 гибридном состоянии
17
18.
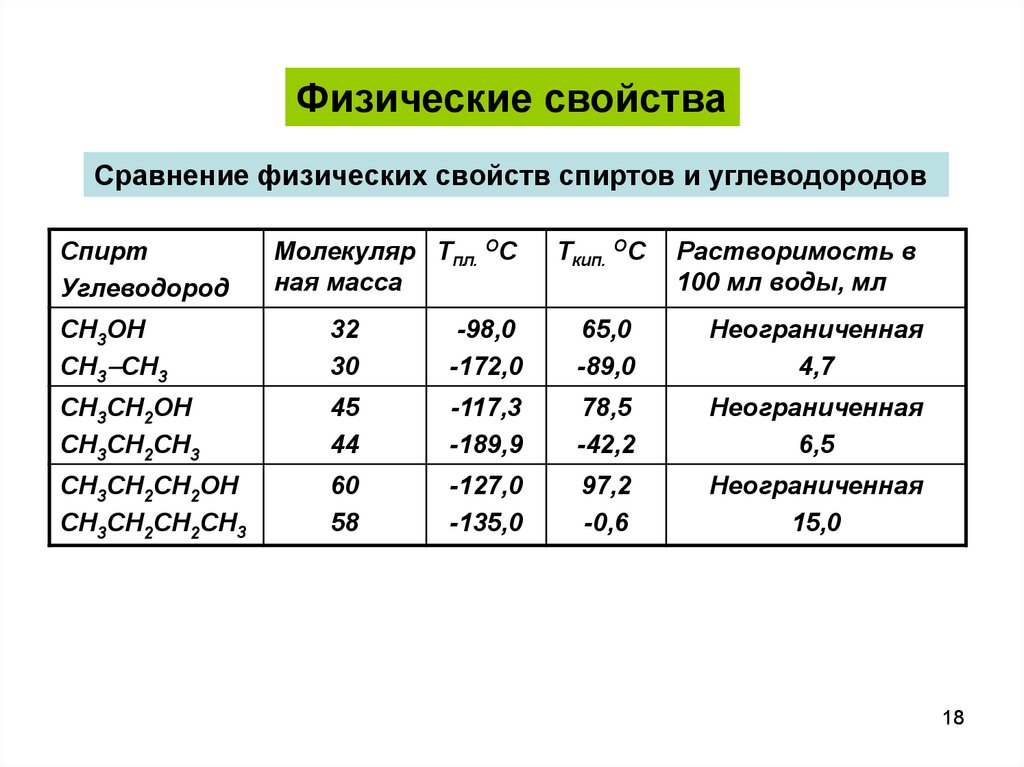
Физические свойстваСравнение физических свойств спиртов и углеводородов
Спирт
Углеводород
Молекуляр Тпл. ОС
ная масса
Ткип. ОС
Растворимость в
100 мл воды, мл
СН3ОН
СН3 СН3
32
30
-98,0
-172,0
65,0
-89,0
Неограниченная
4,7
СН3СН2ОН
СН3СН2СН3
45
44
-117,3
-189,9
78,5
-42,2
Неограниченная
6,5
СН3СН2СН2ОН
СН3СН2СН2CH3
60
58
-127,0
-135,0
97,2
-0,6
Неограниченная
15,0
18
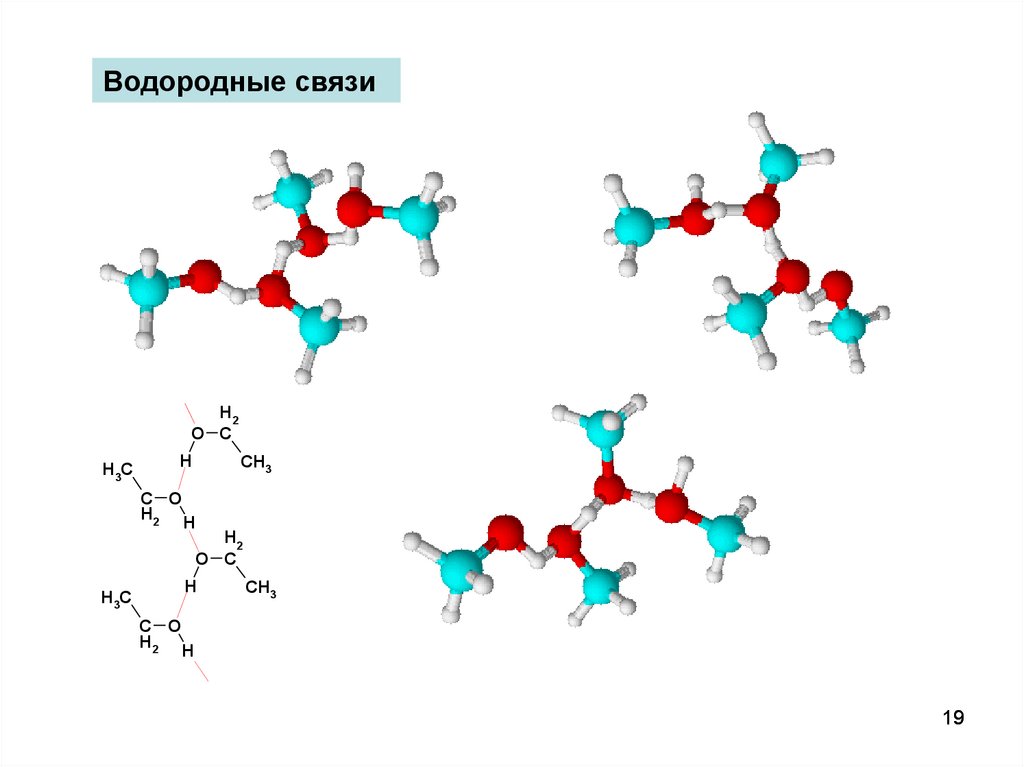
19.
Водородные связиH2
O C
H3C
H
C O
H2
H
CH3
H2
O C
H
H3C
C O
H2
CH3
H
19
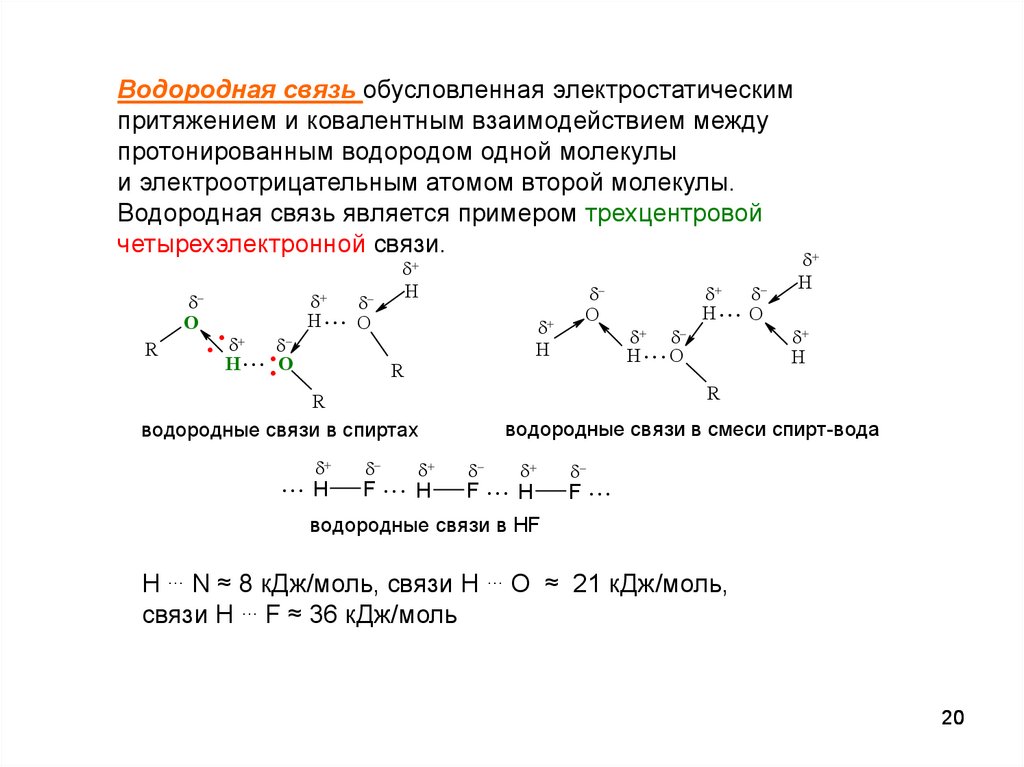
20.
Водородная связь обусловленная электростатическимпритяжением и ковалентным взаимодействием между
протонированным водородом одной молекулы
и электроотрицательным атомом второй молекулы.
Водородная связь является примером трехцентровой
четырехэлектронной связи.
O
R
. . ... .
H
.O
H
...
O
H
O
H
R
H
H
... O
водородные связи в смеси спирт-вода
водородные связи в спиртах
... H
...
O
R
R
H
H
F
... H
F
... H
F
...
водородные связи в HF
H … N ≈ 8 кДж/моль, связи H … О ≈ 21 кДж/моль,
связи H … F ≈ 36 кДж/моль
20
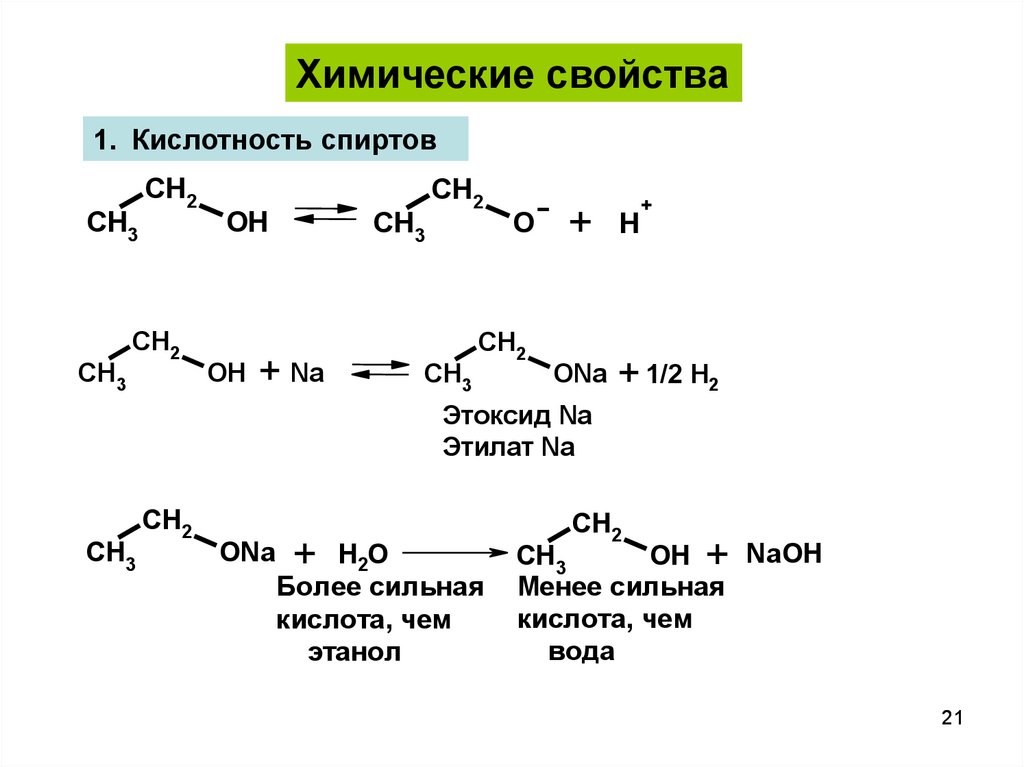
21.
Химические свойства1. Кислотность спиртов
CH2
CH3
CH2
OH
CH2
CH3
OH
CH3
+ Na
O
CH2
CH3
+
ONa
H
+
+ 1/2 H2
Этоксид Na
Этилат Na
CH2
CH3
ONa
+
H2O
Более сильная
кислота, чем
этанол
CH2
CH3
OH + NaOH
Менее сильная
кислота, чем
вода
21
22.
Кислотность спиртов в водных растворахR OH
+
R O + H
алкоголя
- т-анион,
алкоксид-анион
Чем стабильнее алкоголят-анион,
тем сильнее кислотные свойства спирта
pKa
трет-Бутанол
18,0
Этанол
15,9
Метанол
15,5
Вода
15,7
FCH2CH2OH
13,9
CF3CH2OH
12,4
(CF3)3COH
5,0
Ka
[RO ][H ]
[ROH]
pKa=-lgKa
+I-эффект
алкильных групп
-M-эффект F
22
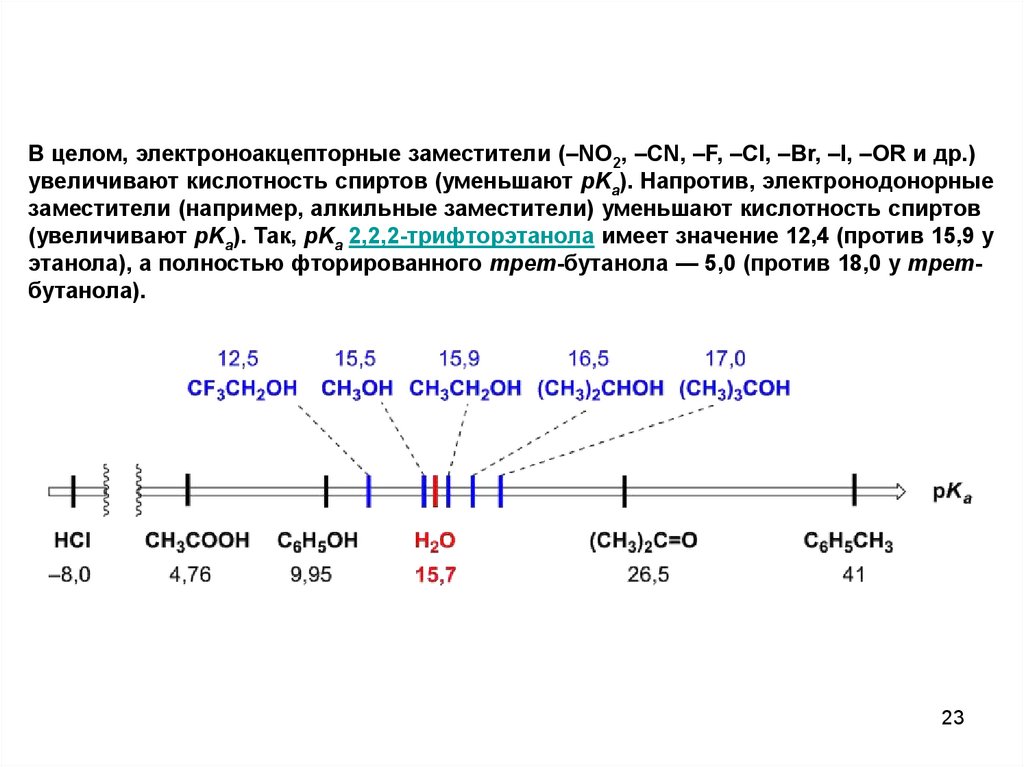
23.
В целом, электроноакцепторные заместители (–NO2, –CN, –F, –Cl, –Br, –I, –OR и др.)увеличивают кислотность спиртов (уменьшают pKa). Напротив, электронодонорные
заместители (например, алкильные заместители) уменьшают кислотность спиртов
(увеличивают pKa). Так, pKa 2,2,2-трифторэтанола имеет значение 12,4 (против 15,9 у
этанола), а полностью фторированного трет-бутанола — 5,0 (против 18,0 у третбутанола).
23
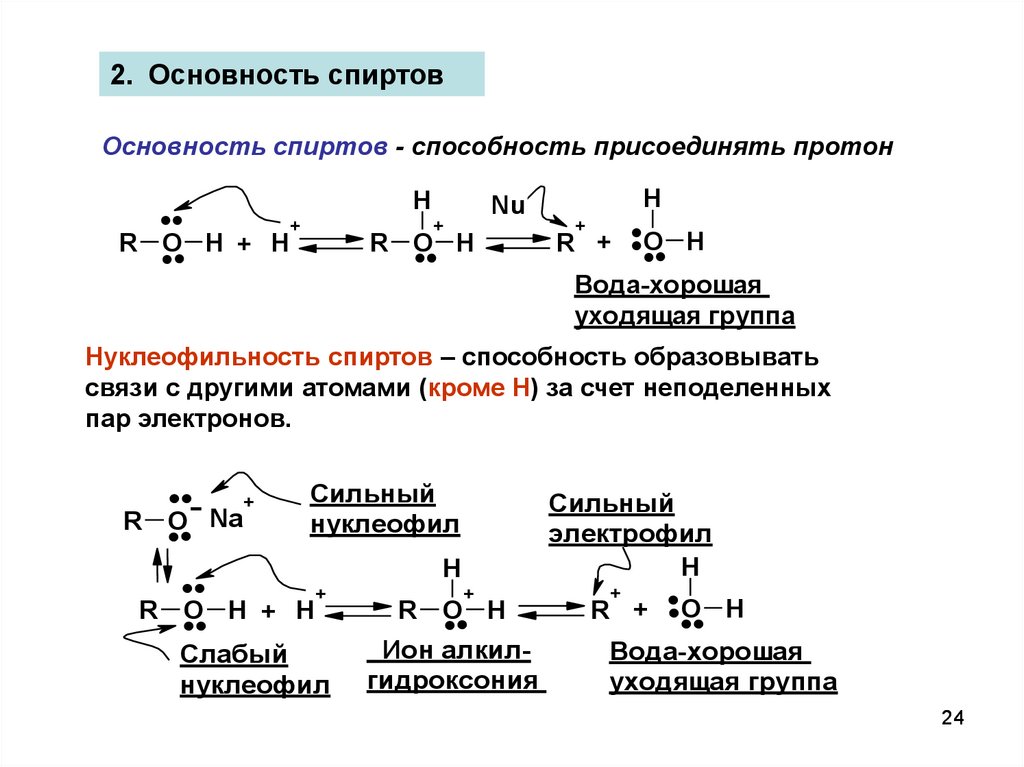
24.
2. Основность спиртовОсновность спиртов - способность присоединять протон
....
H
R O H + H
..
+
+
R O H
...
H
Nu
+
R +
O H
Вода-хорошая
уходящая группа
Нуклеофильность спиртов – способность образовывать
связи с другими атомами (кроме Н) за счет неподеленных
пар электронов.
....
....
R O Na
+
Сильный
нуклеофил
R O H + H
H
+
Слабый
нуклеофил
..
+
R O H
Ион алкилгидроксония
Сильный
электрофил
H
+
R +
...
O H
Вода-хорошая
уходящая группа
24
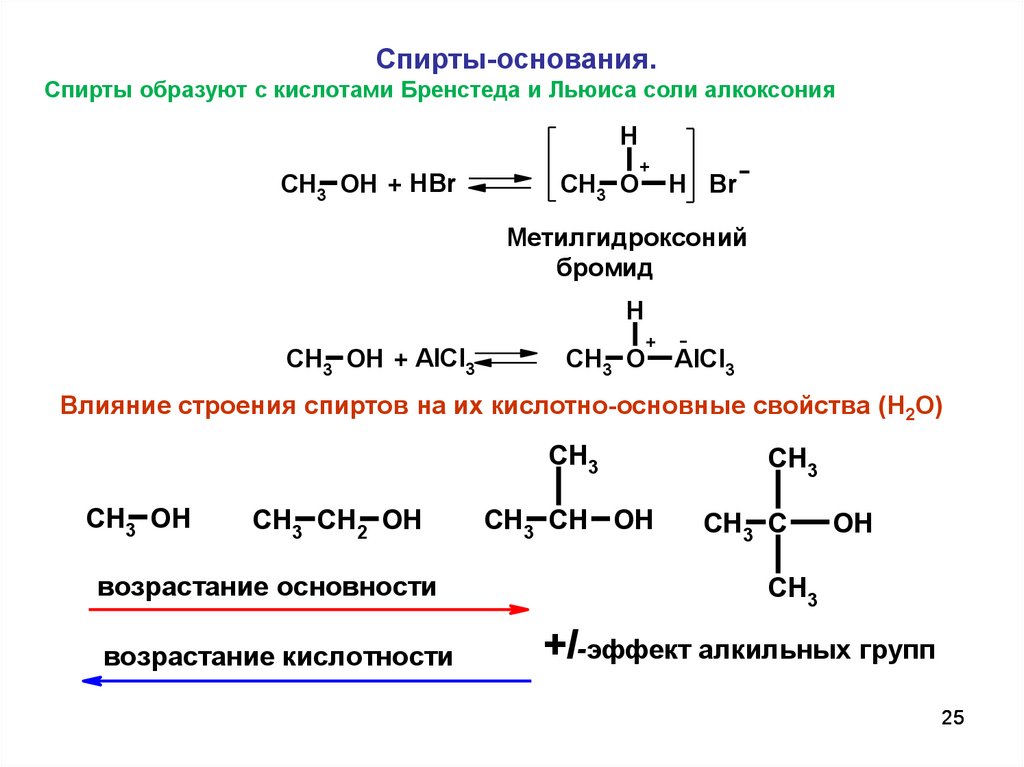
25.
Спирты-основания.Спирты образуют с кислотами Бренстеда и Льюиса соли алкоксония
H
CH3 OH + HBr
+
CH3 O
H Br
Метилгидроксоний
бромид
H
CH3 OH + AlCl3
+
CH3 O
AlCl3
Влияние строения спиртов на их кислотно-основные свойства (H2O)
CH3
CH3 OH
CH3 CH2 OH
возрастание основности
возрастание кислотности
CH3 CH OH
CH3
CH3 C
OH
CH3
+I-эффект алкильных групп
25
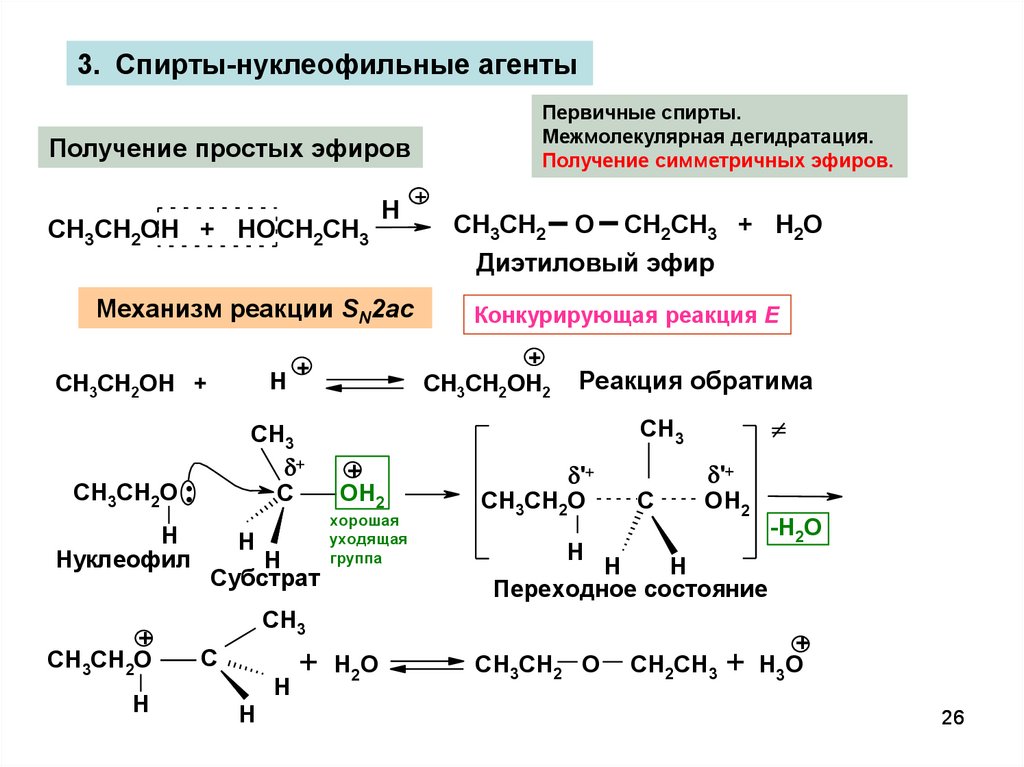
26.
3. Спирты-нуклеофильные агентыПервичные спирты.
Межмолекулярная дегидратация.
Получение симметричных эфиров.
Получение простых эфиров
СH3СH2OH + HOCH2CH3
H
Механизм реакции SN2ac
H
CH3CH2O :
CH3
C
H
Нуклеофил
+
CH3CH2O
H
H
H
Субстрат
СH3СH2
O
CH2CH3 + H2O
Диэтиловый эфир
Конкурирующая реакция E
+
СH3СH2OH2
+
СH3СH2OH +
+
Реакция обратима
CH3
+
OH2
хорошая
уходящая
группа
'
CH3CH2O
C
'
OH2
H
H
H
Переходное состояние
CH3
C
H
H
+
H2 O
-H2O
CH3CH2 O
CH2CH3
+
+
H3 O
26
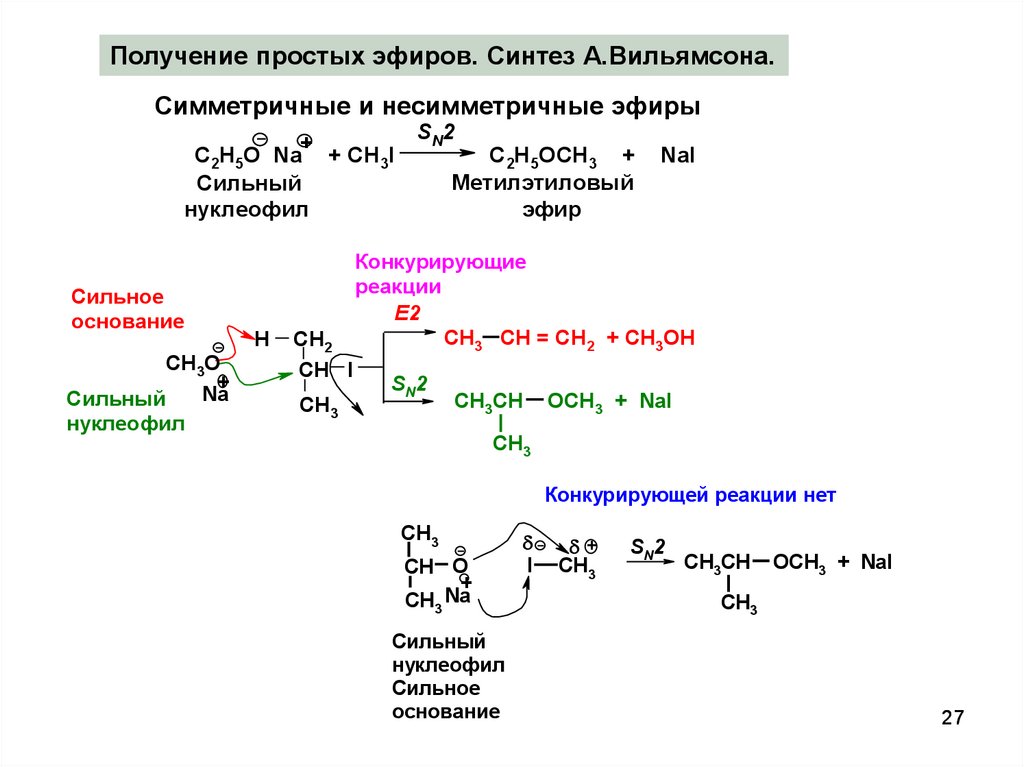
27.
Получение простых эфиров. Синтез А.Вильямсона.Симметричные и несимметричные эфиры
+
С2Н5О Na + CH3I
Сильный
нуклеофил
Сильное
основание
CH3О
+
Na
Сильный
нуклеофил
H
CH2
CH I
CH3
SN2
C2H5OCH3 +
Метилэтиловый
эфир
NaI
Конкурирующие
реакции
E2
CH3 CH = CH2 + CH3OH
SN2
CH3CH
OCH3 + NaI
CH3
Конкурирующей реакции нет
CH3
CH О
+
CH Na
3
Сильный
нуклеофил
Сильное
основание
I
+
CH3
SN2
CH3CH
OCH3 + NaI
CH3
27
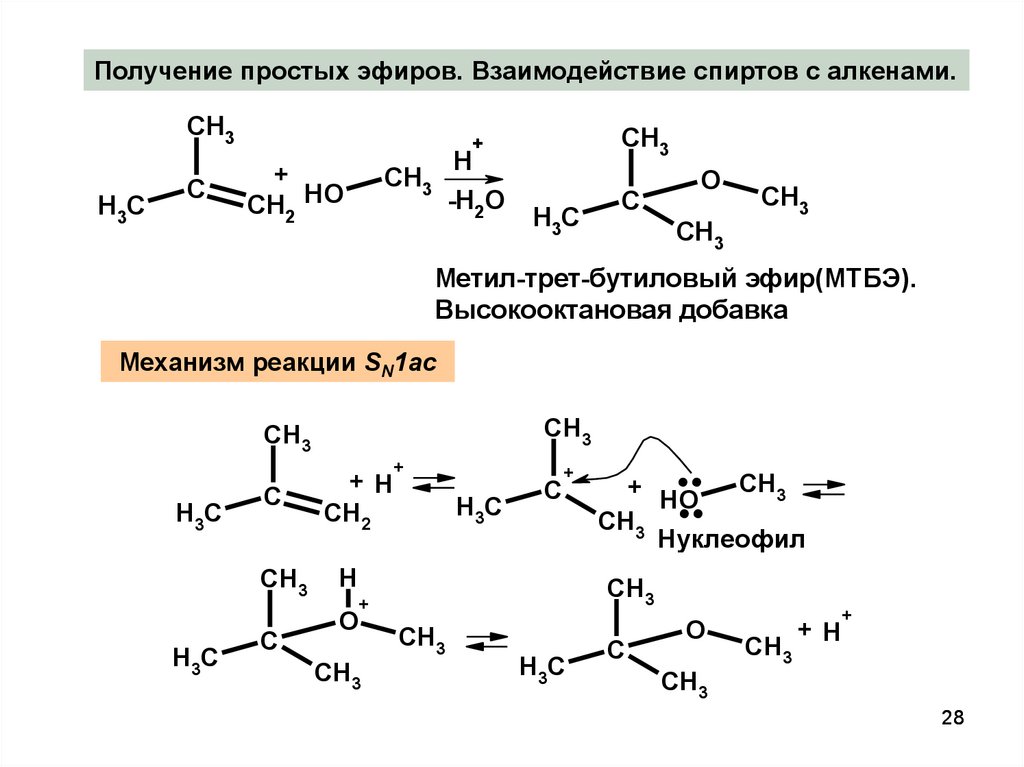
28.
Получение простых эфиров. Взаимодействие спиртов с алкенами.CH3
H3C
C
CH3
+
+
CH2 HO
H
-H2O
CH3
H3C
C
O
CH3
CH3
Метил-трет-бутиловый эфир(МТБЭ).
Высокооктановая добавка
Механизм реакции SN1ac
H3C
C
CH3
H3C
C
....
CH3
CH3
+H
CH2
+
H3C
C
+
H
CH3
+
O
CH3
CH3
+
HO
CH3
Нуклеофил
CH3
H3C
C
O
CH3
+H
+
CH3
28
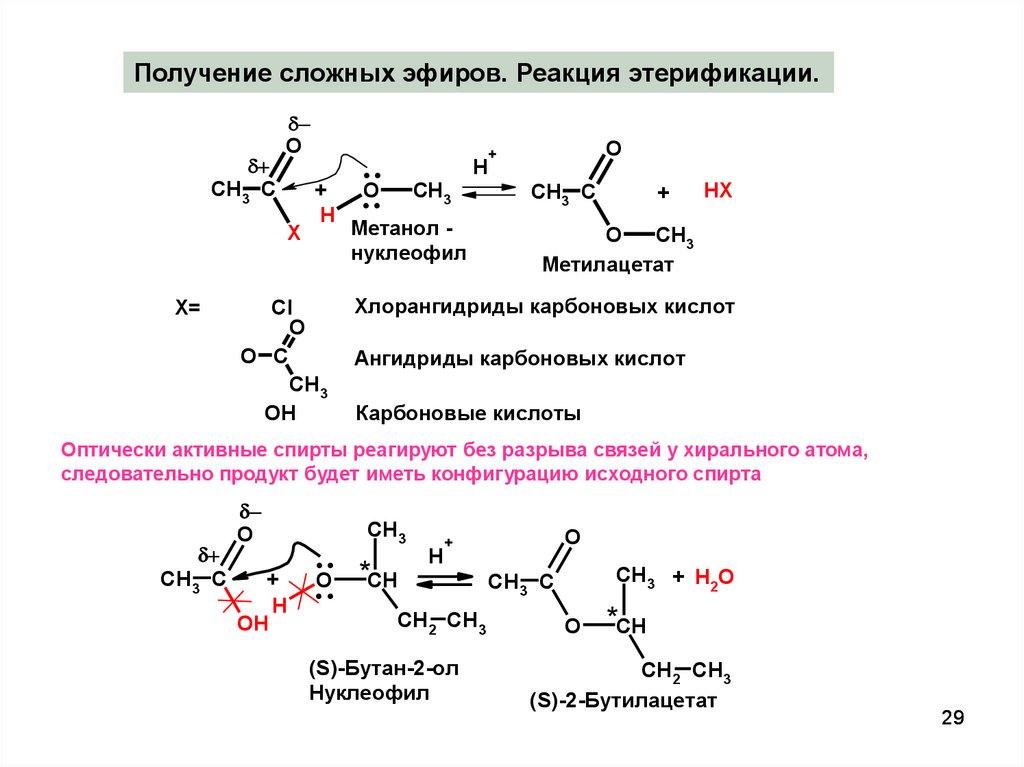
29.
Получение сложных эфиров. Реакция этерификации.CH3 C
O
X
X=
+
H
Cl
O
O C
CH3
OH
..
O
..
H
CH3
Метанол нуклеофил
O
+
CH3 C
+
HX
O
CH3
Метилацетат
Хлорангидриды карбоновых кислот
Ангидриды карбоновых кислот
Карбоновые кислоты
Оптически активные спирты реагируют без разрыва связей у хирального атома,
следовательно продукт будет иметь конфигурацию исходного спирта
CH3 C
O
+
H
OH
CH3
.. *
O
CH
..
H
O
+
CH2 CH3
(S)-Бутан-2-ол
Нуклеофил
CH3 + H2O
CH3 C
O
*CH
CH2 CH3
(S)-2-Бутилацетат
29
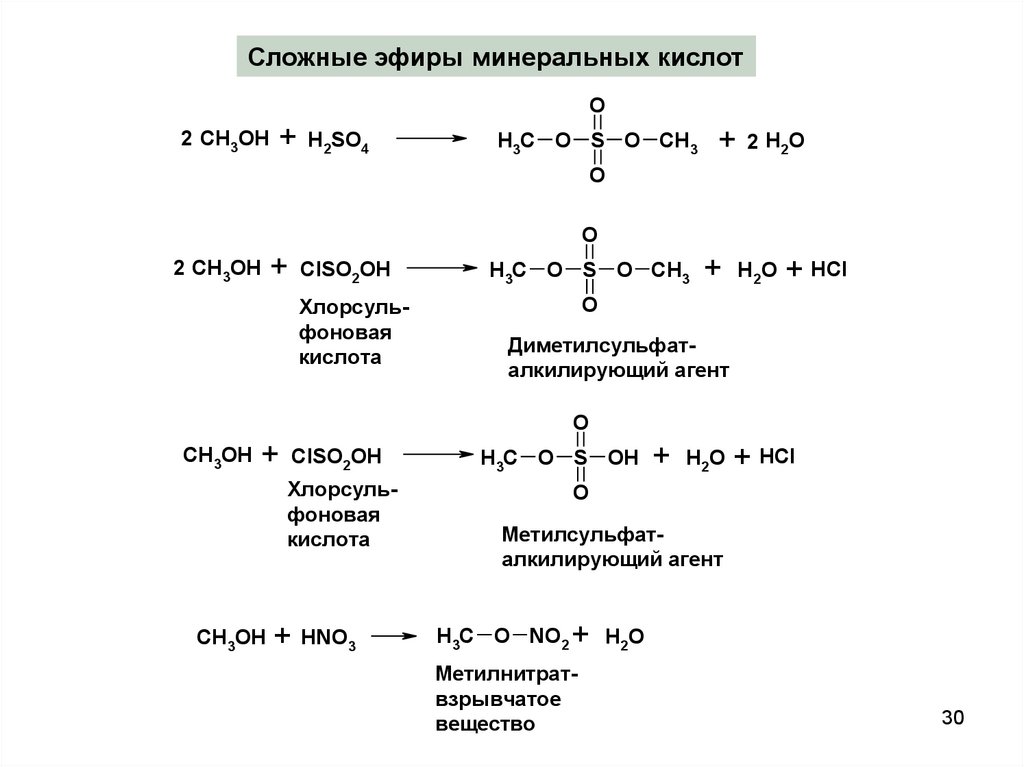
30.
Сложные эфиры минеральных кислотO
2 CH3OH
+
H2SO4
H3C O S O CH3
+
2 H 2O
O
O
2 CH3OH
+
ClSO2OH
Хлорсульфоновая
кислота
H3C O S O CH3
+
H 2O
+ HCl
O
Диметилсульфаталкилирующий агент
O
CH3OH
+
ClSO2OH
Хлорсульфоновая
кислота
CH3OH
+ HNO3
H3C O S OH
+
H 2O
+ HCl
O
Mетилсульфаталкилирующий агент
H3C O NO2 + H2O
Метилнитратвзрывчатое
вещество
30
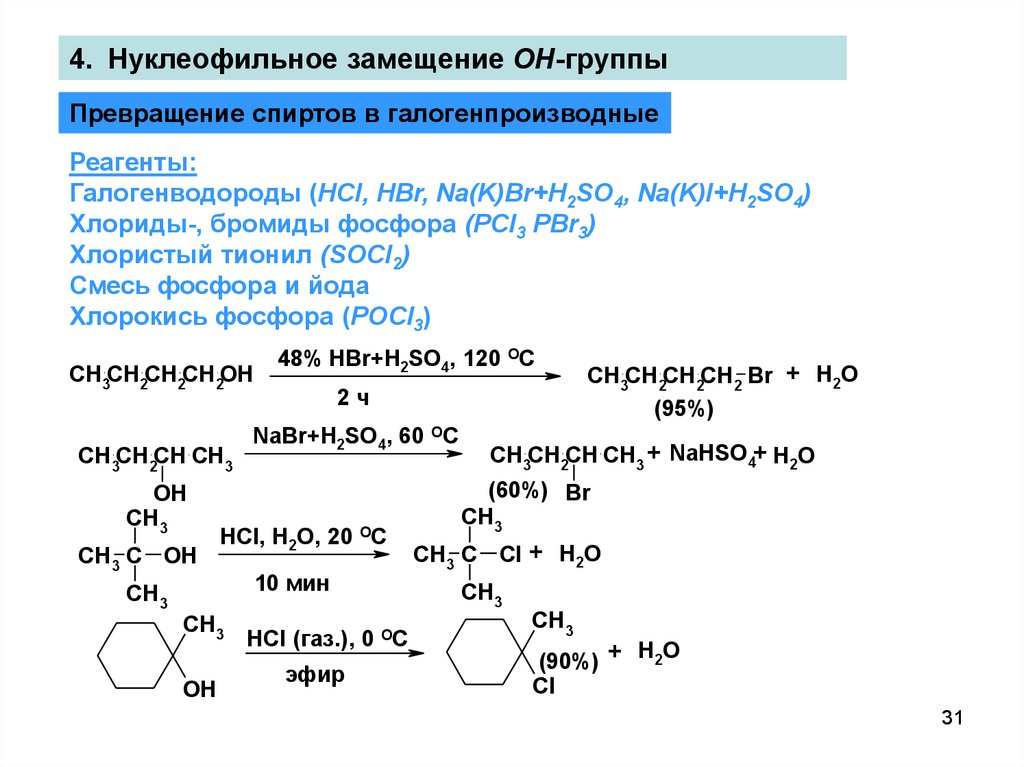
31.
4. Нуклеофильное замещение OH-группыПревращение спиртов в галогенпроизводные
Реагенты:
Галогенводороды (HCl, HBr, Na(K)Br+H2SO4, Na(K)I+H2SO4)
Хлориды-, бромиды фосфора (PCl3 PBr3)
Хлористый тионил (SOCl2)
Смесь фосфора и йода
Хлорокись фосфора (POCl3)
CH3CH2CH2CH2OH
CH3CH2CH CH3
OH
CH3
CH3 C OH
2ч
NaBr+H2SO4, 60 OC
HCl, H2O, 20 OC
CH3
CH3
OH
48% HBr+H2SO4, 120 OC
10 мин
HCl (газ.), 0 OC
эфир
CH3CH2CH2CH2 Br + H2O
(95%)
CH3CH2CH CH3 + NaHSO4+ H2O
(60%) Br
CH3
CH3 C Cl + H2O
CH3
CH3
(90%) + H2O
Cl
31
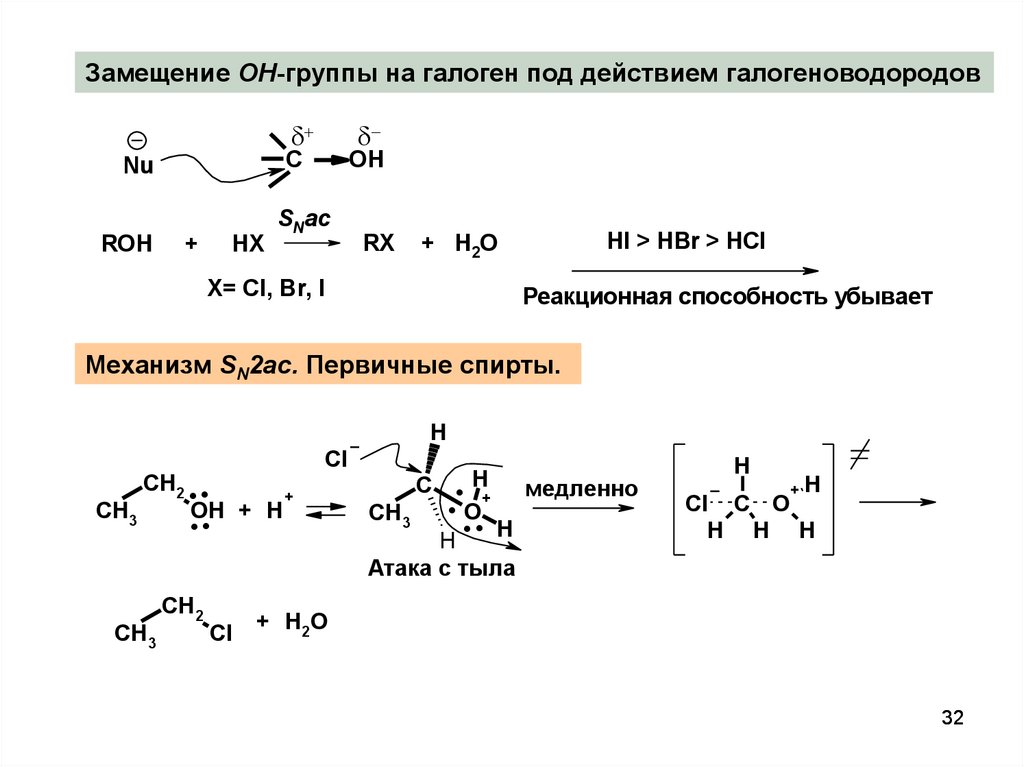
32.
Замещение OH-группы на галоген под действием галогеноводородовC
Nu
ROH
+
HX
OH
SNac
RХ
HI > HBr > HCl
+ H2O
X= Cl, Br, I
Реакционная способность убывает
Механизм SN2ac. Первичные спирты.
H
CH2 . .
+
+
OH
CH3
H
..
CH3
CH2
Cl
Cl
.. H+ медленно
O.
CH3
.
H
H
Атака с тыла
C
H
+H
Cl C O
H H H
+ H2O
32
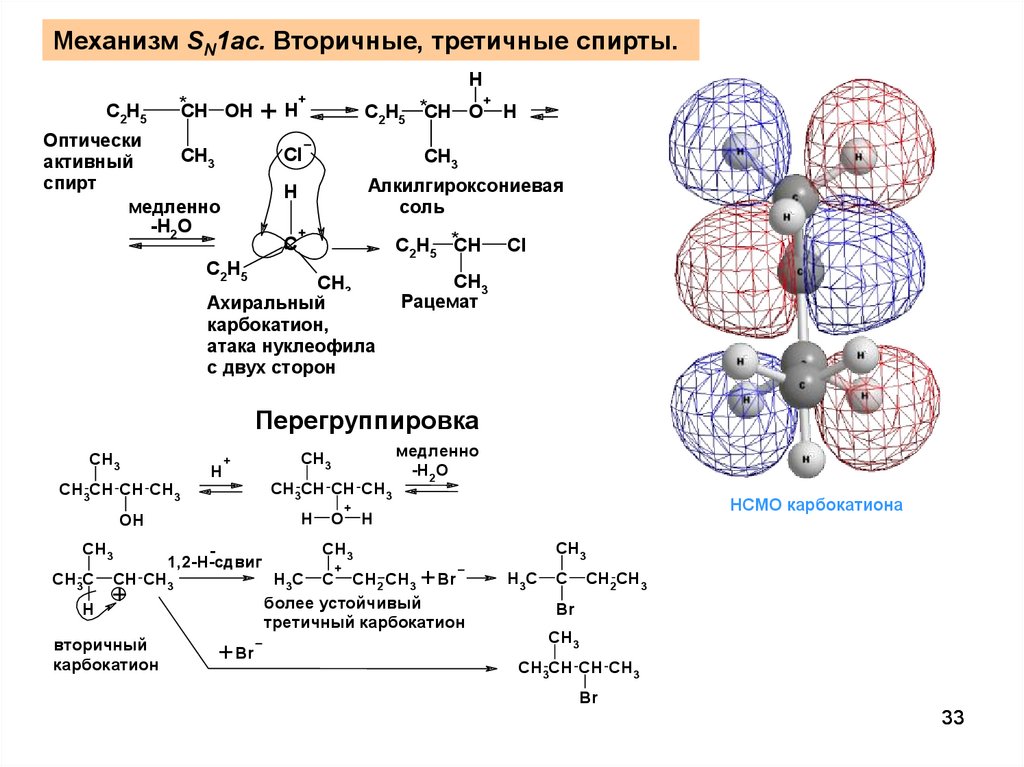
33.
Механизм SN1ac. Вторичные, третичные спирты.H
*CH OH
C2H5
+H
Оптически
CH3
активный
спирт
медленно
-H2O
+
+
C2H5 *CH O H
Cl
CH3
Алкилгироксониевая
соль
H
C
+
C2H5 *CH
C2H5
CH3
Ахиральный
карбокатион,
атака нуклеофила
с двух сторон
Cl
CH3
Рацемат
Перегруппировка
CH3
CH3CH CH CH3
H
CH3
+
CH3CH CH CH3
H
OH
CH3
CH3C
H
1,2-H-сдвиг
CH CH3
+
вторичный
карбокатион
+
Br
O
+
медленно
-H2O
НСМО карбокатиона
H
CH3
CH3
+
+
H3C C CH2 CH3 Br
более устойчивый
третичный карбокатион
H3C
C
CH2CH3
Br
CH3
CH3CH CH CH3
Br
33
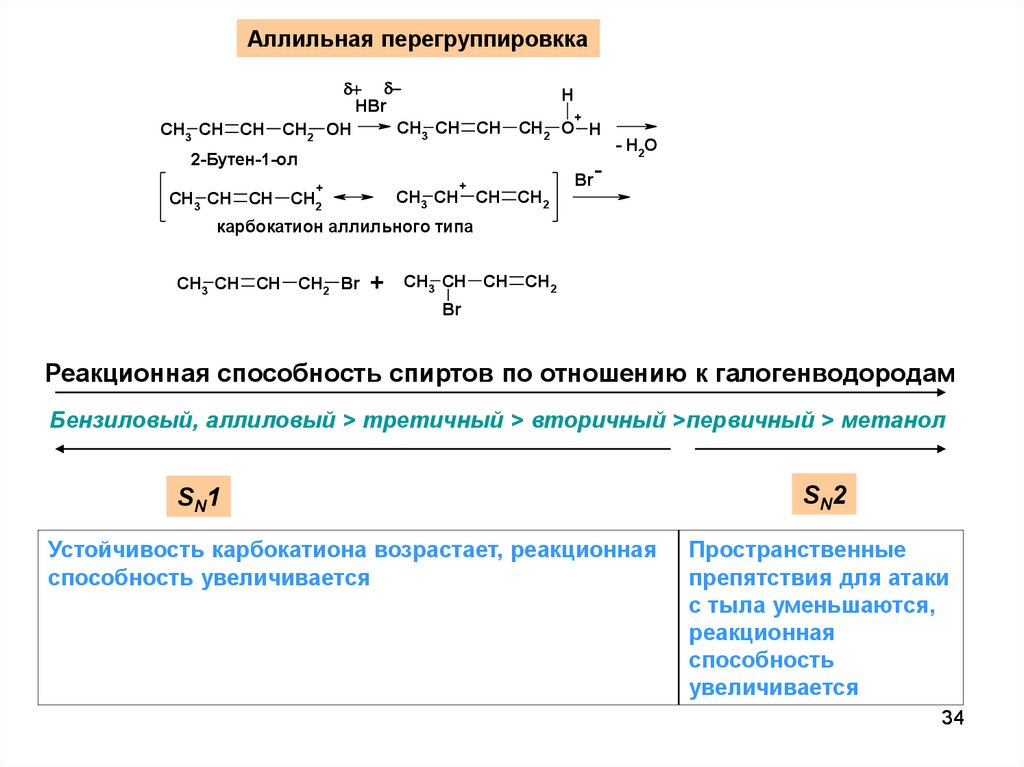
34.
Аллильная перегруппировккаCH3 CH CH
HBr
CH3 CH CH
OH
CH2
H
+
CH2 O H
2-Бутен-1-ол
CH3 CH CH
+
+
CH3 CH CH
CH2
- H 2O
Br
CH2
карбокатион аллильного типа
CH3 CH CH
CH2 Br
+
CH3 CH CH
CH2
Br
Реакционная способность спиртов по отношению к галогенводородам
Бензиловый, аллиловый > третичный > вторичный >первичный > метанол
SN1
Устойчивость карбокатиона возрастает, реакционная
способность увеличивается
SN2
Пространственные
препятствия для атаки
с тыла уменьшаются,
реакционная
способность
увеличивается
34
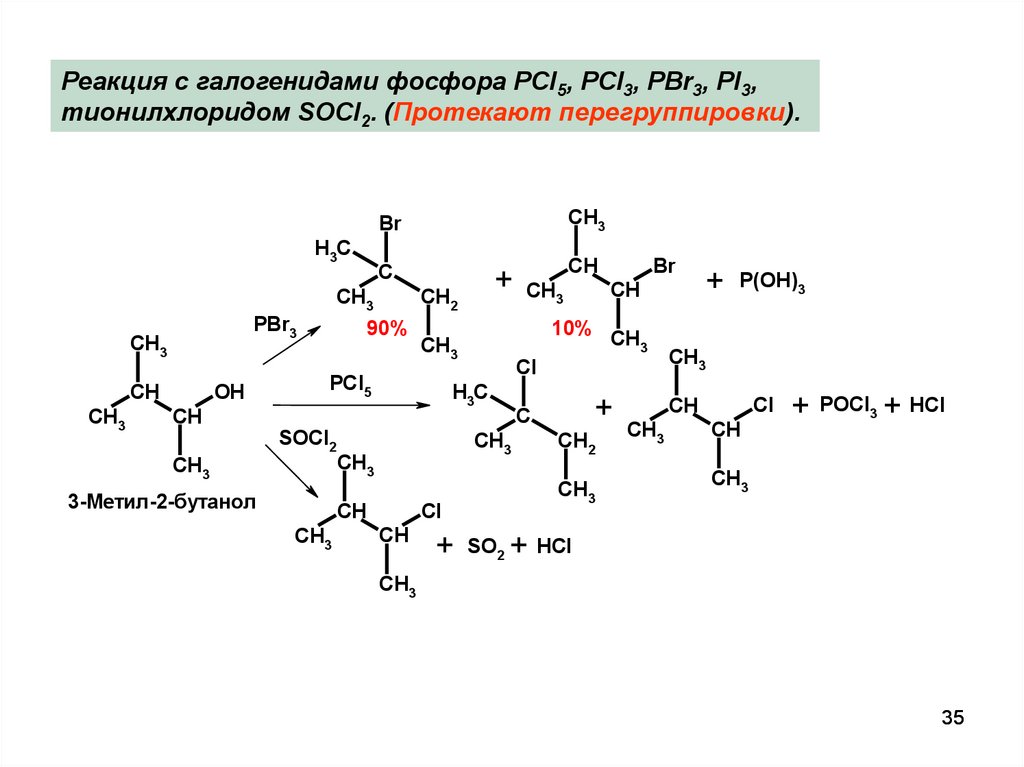
35.
Реакция с галогенидами фосфора PCl5, PCl3, PBr3, PI3,тионилхлоридом SOCl2. (Протекают перегруппировки).
CH3
Br
H3C
C
CH2
CH3
PBr3
CH3
OH
CH
CH3
+
90%
PCl5
+
C
CH
CH3
CH3
CH3
3-Метил-2-бутанол
CH3
CH
+
CH2
CH3
Cl
CH
CH3
Cl
H3C
SOCl2
CH
CH3
10%
CH3
Br
CH
SO2
+
P(OH)3
CH3
Cl
CH
CH3
CH
+ POCl3 + HCl
CH3
+ HCl
CH3
35
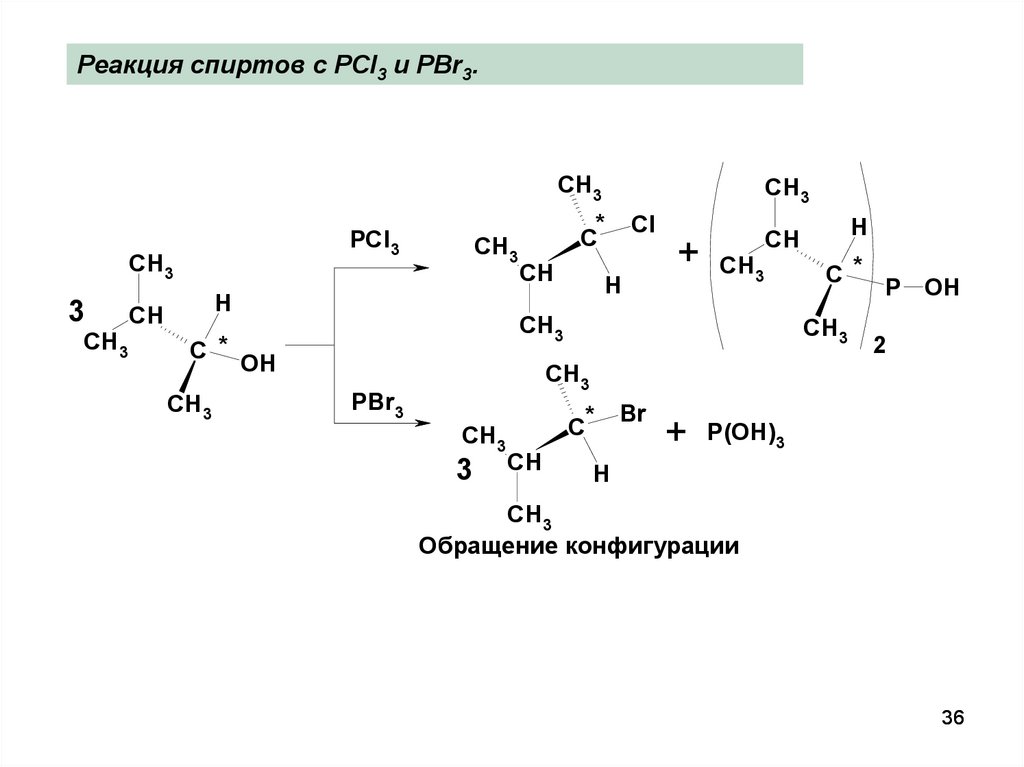
36.
Реакция спиртов с PCl3 и PBr3.CH3
PCl3
CH3
3
CH3
CH3
H
CH
C *
CH3
CH3
*
C
CH
Cl
H
+
CH3
CH
CH3
OH
PBr3
H
C*
CH3
P OH
2
CH3
CH3
3
C*
CH
Br
+
P(OH)3
H
CH3
Обращение конфигурации
36
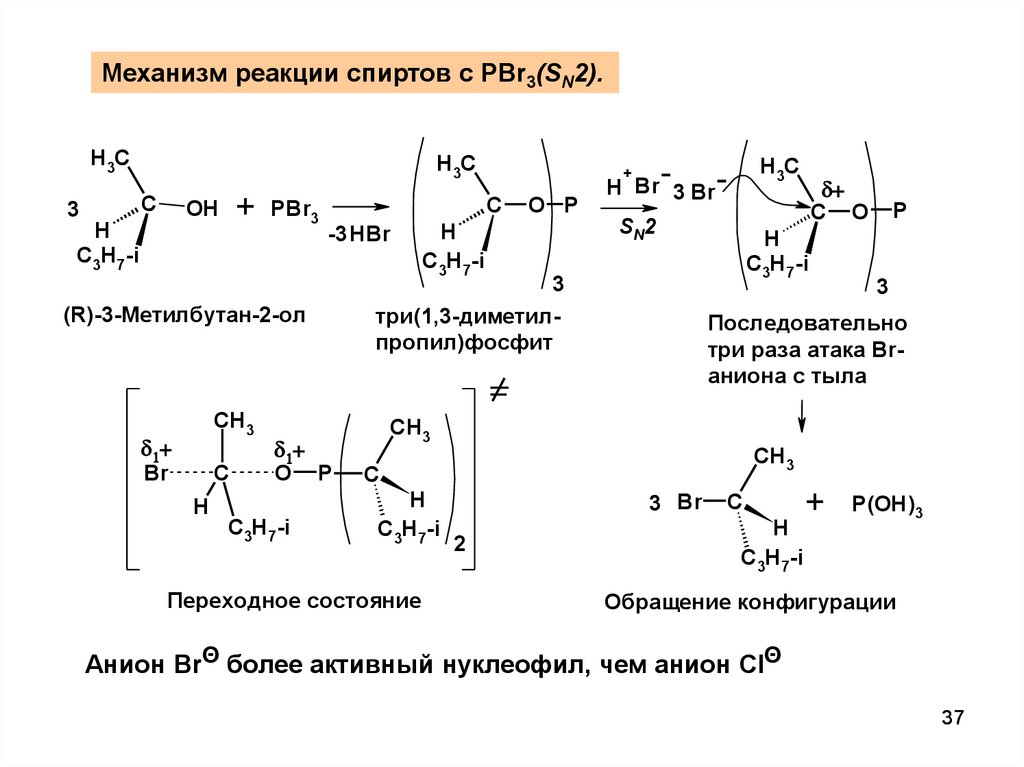
37.
Механизм реакции спиртов с PBr3(SN2).H3C
3
H3C
C
+
OH
H
C3H7-i
PBr3
C
-3 HBr
(R)-3-Метилбутан-2-ол
CH3
Br
C
H
O P
C3H7-i
H
C3H7-i
H3C
+
O P
H Br 3 Br
SN2
3
три(1,3-диметилпропил)фосфит
H
C3H7-i
3
CH3
C
Переходное состояние
P
Последовательно
три раза атака Brаниона с тыла
CH3
H
C3H7-i
C O
3 Br
2
C
H
C3H7-i
+
P(OH)3
Обращение конфигурации
Анион BrΘ более активный нуклеофил, чем анион ClΘ
37
38.
Роль сульфонатной группы в реакциях нуклеофильного замещения OH в спиртахO
R OH
+
R'
S Cl
O
R O S R'
ДМФА
O
R' =
N
п-Толуолсульфохлорид (тозилхлорид)
CH3
Метансульфохлорид
(мезилхлорид)
CF3
Трифторметансульфохлорид
O
CH3
тозилат (Tos)
O
O
R O S CH3
+
O
сульфонатная
группа - хорошая
уходящая группа
CH3 ,
R O S
+
мезилат (Mes)
N
H Cl
H2
DMSO, RT
C
+ NaBr
CH CH3
H3C
- NaOTos
OTos
хорошая
1-methyl-4-(pentanуходящая
3-ylsulfonyl)benzene
группа
H2
C
H2
C
H3C
H2
C
CH CH3 (85%)
Br
3-Пентилтозилат
H2
H2
C2H5OH, H2O
C H
C H
HC
HC
C
C
+ KCN - KOTos
HC
H
C
C C OTos
C C CN
хорошая
H2 H2
H2 H2
уходящая
4-Цианометил4-Тозилоксигруппа
циклопентен
метилциклопентен
O
O
R O S CF3
O
трифлат (Tf)
38
39.
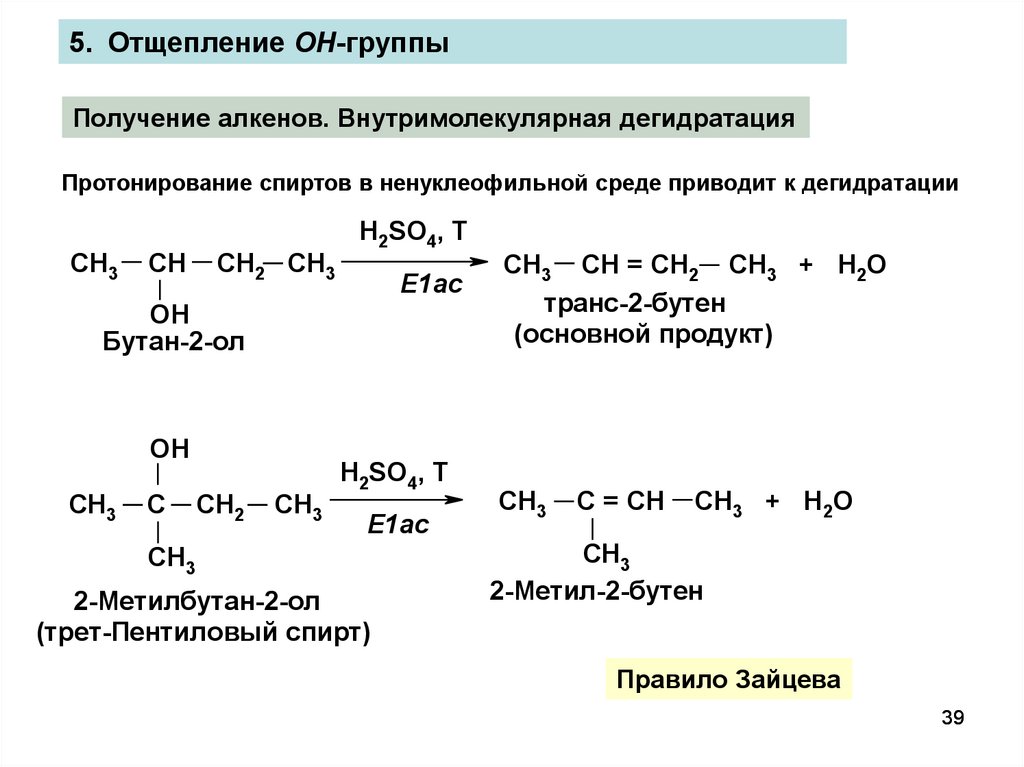
5. Отщепление OH-группыПолучение алкенов. Внутримолекулярная дегидратация
Протонирование спиртов в ненуклеофильной среде приводит к дегидратации
CH3
CH
CH2 CH3
H2SO4, T
E1ac
OH
Бутан-2-ол
ОН
CH3
C
CH2
CH3
H2SO4, T
E1ac
СН3
2-Метилбутан-2-ол
(трет-Пентиловый спирт)
CH3 CH = CH2 CH3 + H2O
транс-2-бутен
(основной продукт)
CH3
C = CH
CH3 + Н2О
СН3
2-Метил-2-бутен
Правило Зайцева
39
40.
Первичные спирты.CH2
CH3
OH
CH2
96% H2SO4, 180OC
H3C
HC CH2
-H2O
Механизм реакции E2ac
..
..
1) CH3 CH2 OH + H
+
CH2 CH2
H
..H
..O H
+
H2C
CH2 + H2O + H2SO4
OSO2OH
Синхронно: отрыв воды
и протона
O
2) RCH2CH2OH + H2SO4
RCH2CH2
O S OH + H2O
O
O
HSO4RCH CH2 + H2SO4 + HSO4R CH CH2 O S OH
170 - 190 OC
O
H
40
41.
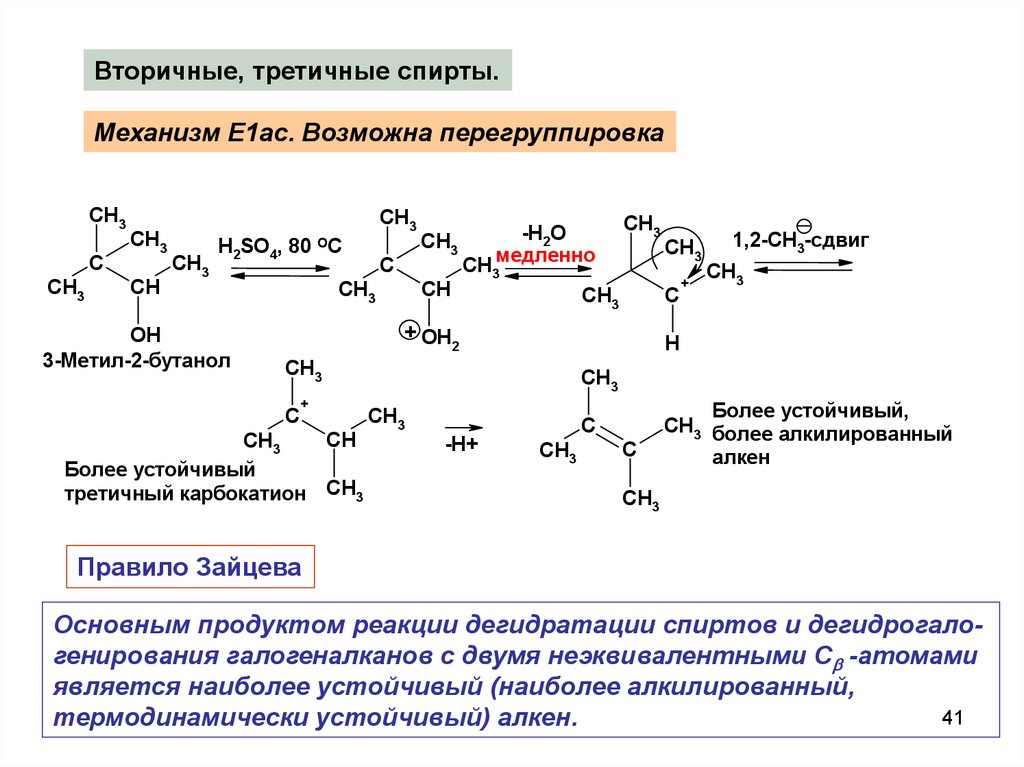
Вторичные, третичные спирты.Механизм E1ac. Возможна перегруппировка
CH3
C
CH3
CH3
CH3
CH3
H2SO4, 80
ОС
CH
OH
3-Метил-2-бутанол
C
CH3
-H2O
CH медленно
+ OH
CH
CH3
Более устойчивый
третичный карбокатион CH3
C
CH3
+
1,2-CН3-сдвиг
CH3
H
2
CH3
+
CH3
3
CH
CH3
C
CH3
CH3
CH3
-H+
C
CH3
C
Более устойчивый,
CH3 более алкилированный
алкен
CH3
Правило Зайцева
Основным продуктом реакции дегидратации спиртов и дегидрогалогенирования галогеналканов с двумя неэквивалентными С -атомами
является наиболее устойчивый (наиболее алкилированный,
41
термодинамически устойчивый) алкен.
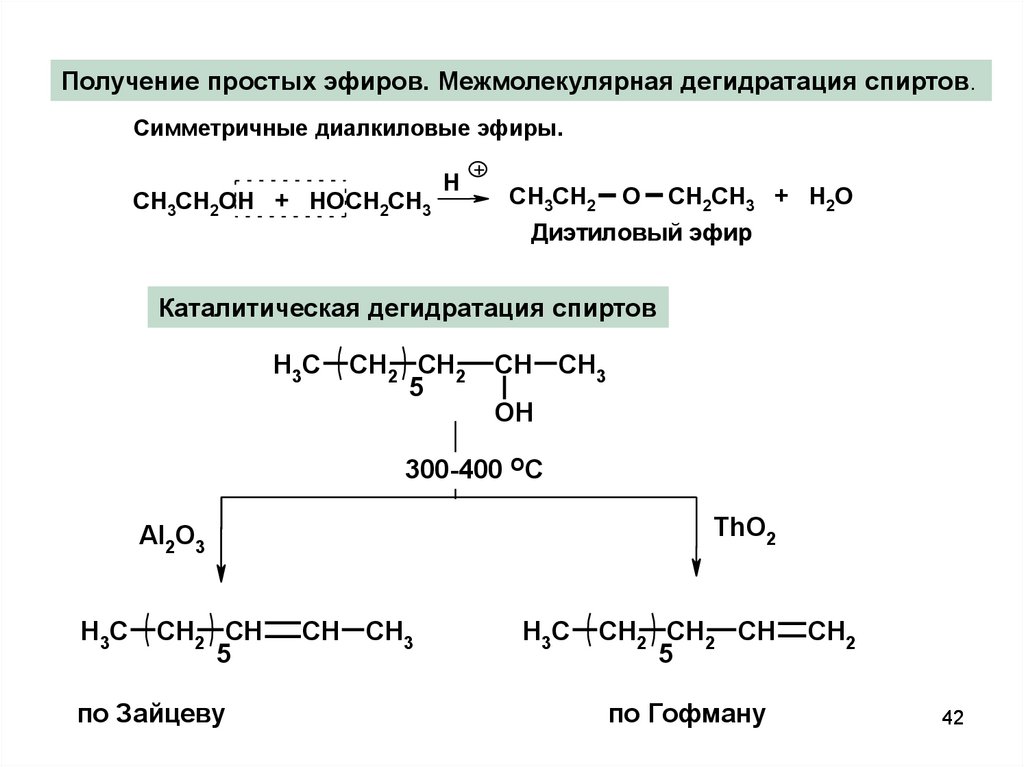
42.
Получение простых эфиров. Межмолекулярная дегидратация спиртов.Симметричные диалкиловые эфиры.
СH3СH2OH + HOCH2CH3
H
+
СH3СH2
O
CH2CH3 + H2O
Диэтиловый эфир
Каталитическая дегидратация спиртов
H3C
CH2 CH2
5
CH CH3
OH
300-400 OC
ThO2
Al2O3
H3C
CH2 CH
5
по Зайцеву
CH CH3
H3C
CH2 CH2 CH
5
по Гофману
CH2
42
43.
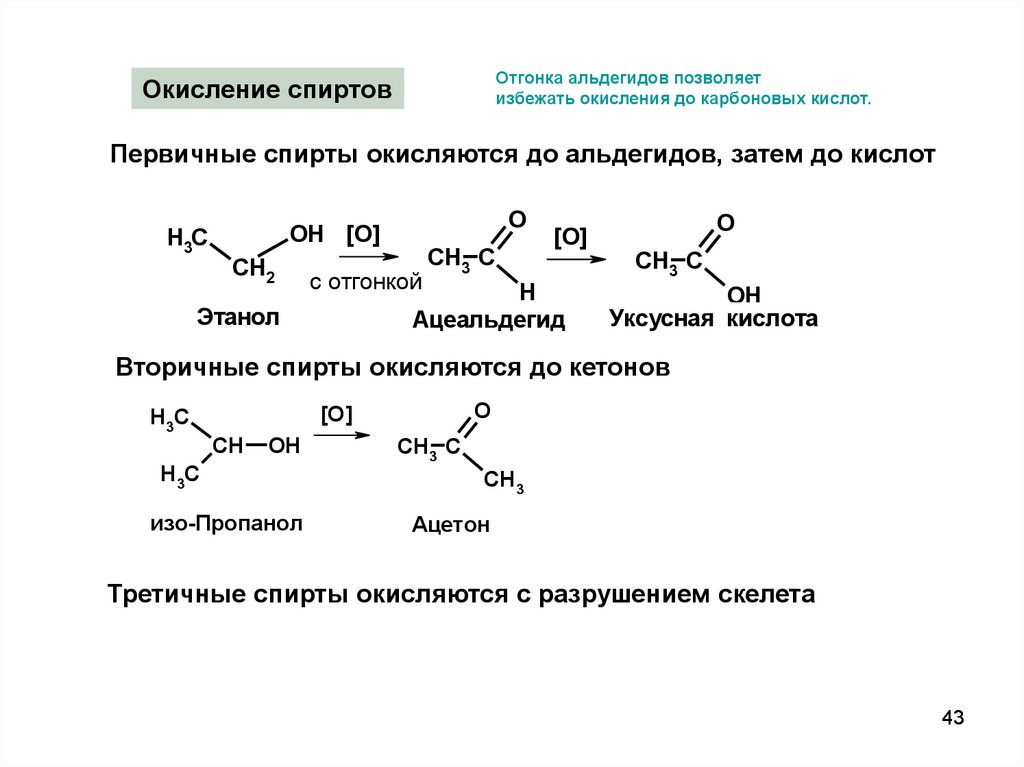
Отгонка альдегидов позволяетизбежать окисления до карбоновых кислот.
Окисление спиртов
Первичные спирты окисляются до альдегидов, затем до кислот
H3C
O
OH [O]
CH2
с отгонкой
CH3 C
[O]
H
Ацеальдегид
Этанол
O
CH3 C
OH
Уксусная кислота
Вторичные спирты окисляются до кетонов
H3C
O
[O]
CH
OH
H3C
изо-Пропанол
CH3 C
CH3
Ацетон
Третичные спирты окисляются с разрушением скелета
43
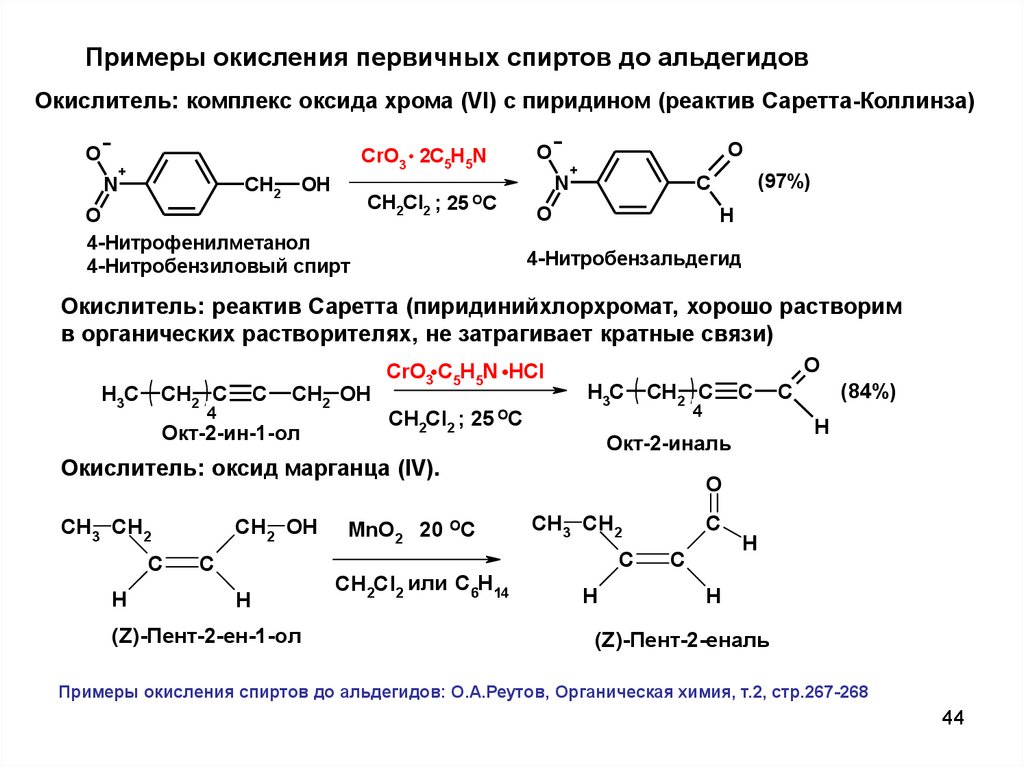
44.
Примеры окисления первичных спиртов до альдегидовОкислитель: комплекс оксида хрома (VI) с пиридином (реактив Саретта-Коллинза)
O
N
.
+
CH2
OH
O
4-Нитрофенилметанол
4-Нитробензиловый спирт
O
O
CrO3 2C5H5N
N
CH2Cl2 ; 25 OC
+
(97%)
C
O
H
4-Нитробензальдегид
Окислитель: реактив Саретта (пиридинийхлорхромат, хорошо растворим
в органических растворителях, не затрагивает кратные связи)
H3C
CH2 C
C
4
CH2 OH
Окт-2-ин-1-ол
.
.
CrO3 C5H5N HCl
CH2Cl2 ;
25 OC
O
H3C
CH2 C
4
CH2 OH
C
H
C
H
(Z)-Пент-2-ен-1-ол
MnO2 20 OC
CH2Cl2 или C6H14
(84%)
C
H
Окт-2-иналь
Окислитель: оксид марганца (IV).
CH3 CH2
C
O
C
CH3 CH2
C
H
C
H
H
(Z)-Пент-2-еналь
Примеры окисления спиртов до альдегидов: О.А.Реутов, Органическая химия, т.2, стр.267-268
44
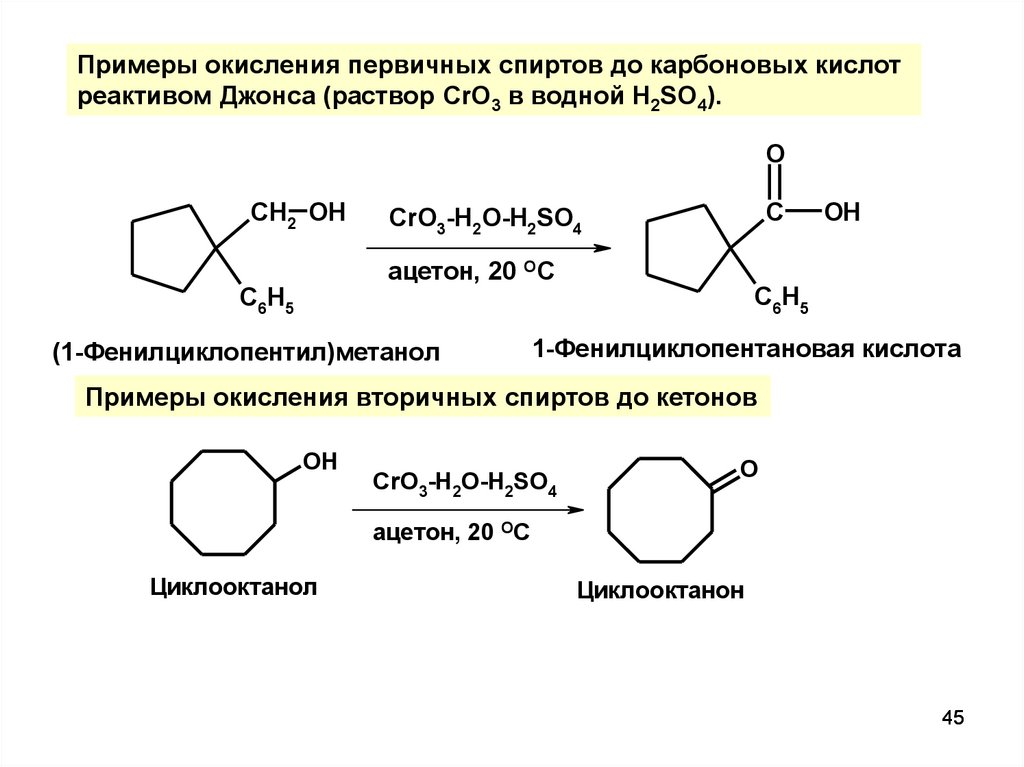
45.
Примеры окисления первичных спиртов до карбоновых кислотреактивом Джонса (раствор CrO3 в водной H2SO4).
O
CH2 OH
C
CrO3-H2O-H2SO4
ацетон, 20 ОС
C6H5
(1-Фенилциклопентил)метанол
OH
C6H5
1-Фенилциклопентановая кислота
Примеры окисления вторичных спиртов до кетонов
OH
CrO3-H2O-H2SO4
O
ацетон, 20 ОС
Циклооктанол
Циклооктанон
45
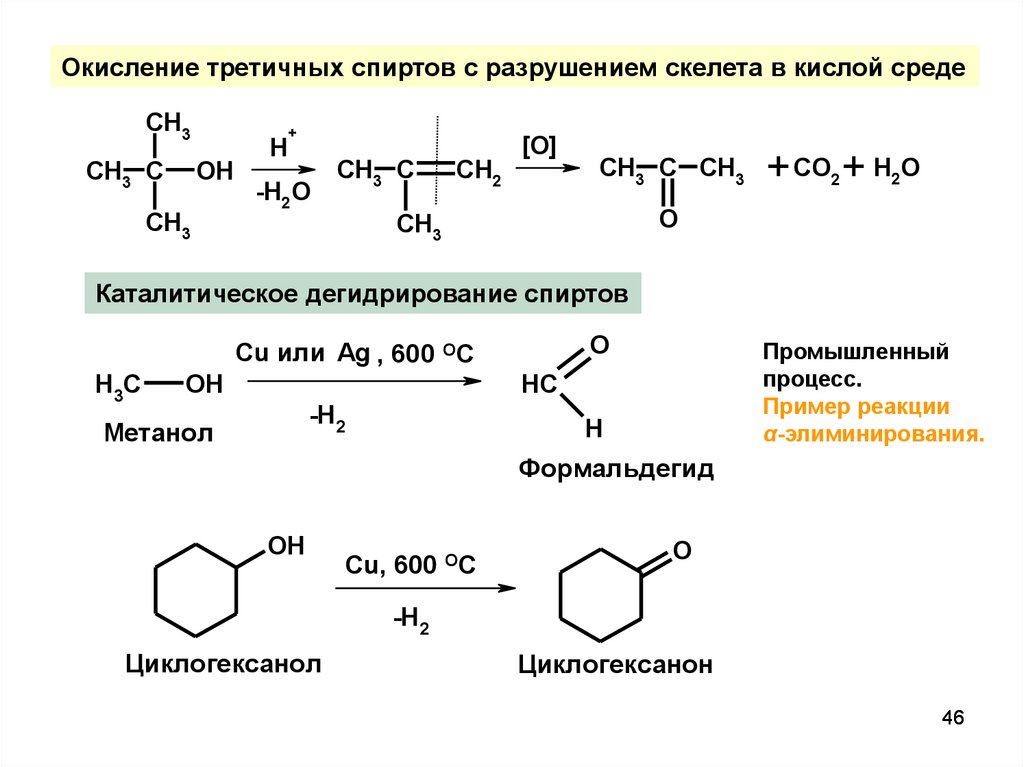
46.
Окисление третичных спиртов с разрушением скелета в кислой средеCH3
CH3 C
OH
CH3
H
+
-H2O
CH3 C
CH2
[O]
CH3 C CH3
+ CO2 + H2O
O
CH3
Каталитическое дегидрирование спиртов
O
Cu или Ag , 600 ОС
H3C
OH
Промышленный
процесс.
Пример реакции
α-элиминирования.
HC
-H2
Метанол
H
Формальдегид
OH
Cu, 600 OC
O
-H2
Циклогексанол
Циклогексанон
46
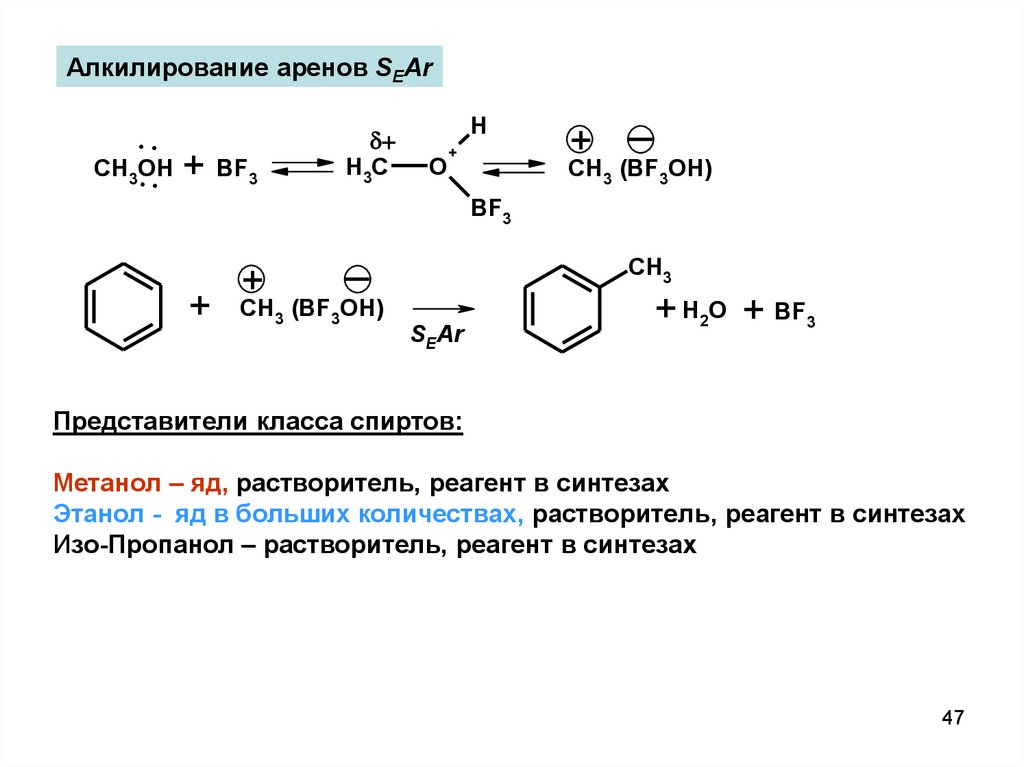
47.
Алкилирование аренов SEAr..
CH .OH
. + BF
3
3
+
H3C
H
O
+
CH3 (BF3OH)
BF3
CH3
+
CH3 (BF3OH)
+
SEAr
+ H2O + BF3
Представители класса спиртов:
Метанол – яд, растворитель, реагент в синтезах
Этанол - яд в больших количествах, растворитель, реагент в синтезах
Изо-Пропанол – растворитель, реагент в синтезах
47
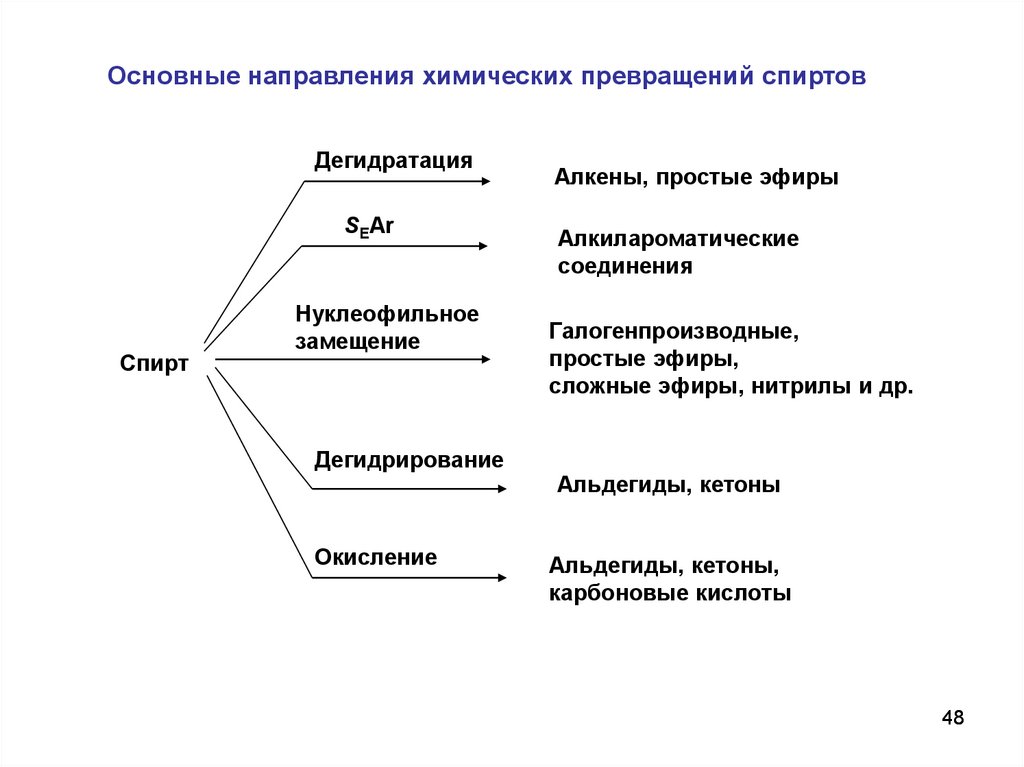
48.
Основные направления химических превращений спиртовДегидратация
SEAr
Спирт
Нуклеофильное
замещение
Дегидрирование
Окисление
Алкены, простые эфиры
Алкилароматические
соединения
Галогенпроизводные,
простые эфиры,
сложные эфиры, нитрилы и др.
Альдегиды, кетоны
Альдегиды, кетоны,
карбоновые кислоты
48
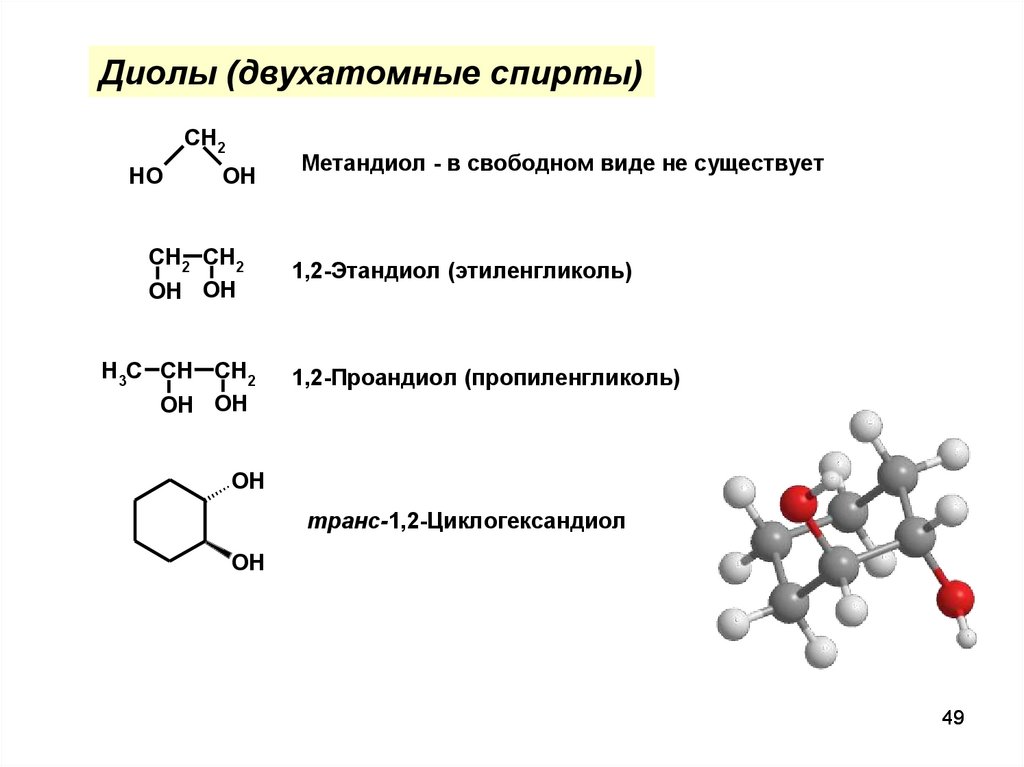
49.
Диолы (двухатомные спирты)CH2
HO
OH
CH2 CH2
OH OH
H3C CH CH2
OH OH
Метандиол - в свободном виде не существует
1,2-Этандиол (этиленгликоль)
1,2-Проандиол (пропиленгликоль)
OH
транс-1,2-Циклогександиол
OH
49
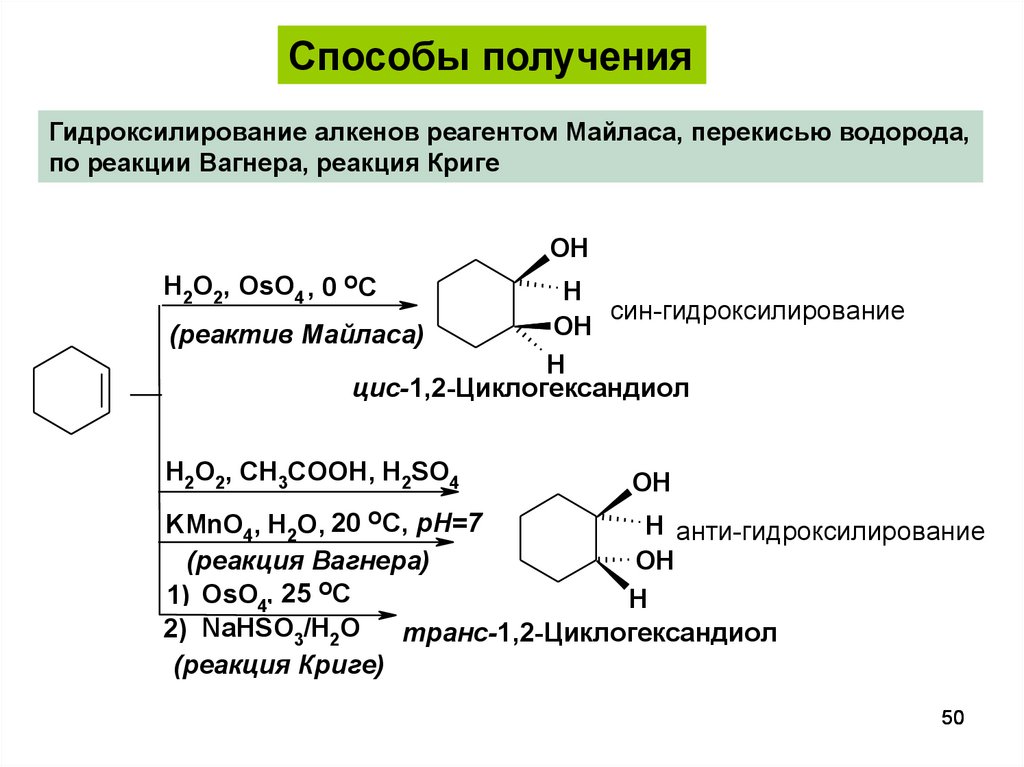
50.
Способы полученияГидроксилирование алкенов реагентом Майласа, перекисью водорода,
по реакции Вагнера, реакция Криге
OH
H2O2, OsO4 , 0 OC
H
син-гидроксилирование
OH
(реактив Майласа)
H
цис-1,2-Циклогександиол
H2O2, CH3COOH, H2SO4
OH
KMnO4, H2O, 20 OC, pH=7
H анти-гидроксилирование
(реакция Вагнера)
OH
1) OsO4, 25 OC
H
2) NaHSO3/H2O
транс-1,2-Циклогександиол
(реакция Криге)
50
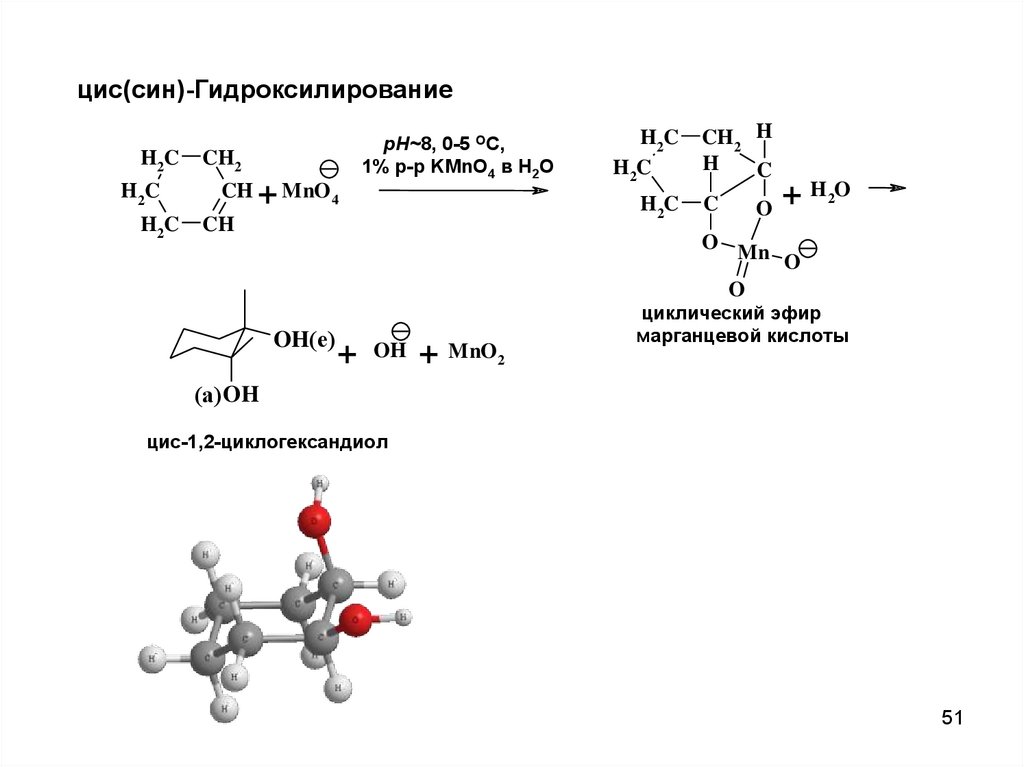
51.
цис(син)-ГидроксилированиеH2C
H2C
H2C
CH2
CH
+ MnO4
pH~8, 0-5 OC,
1% р-р KMnO4 в H2O
H2C
H2C
H2C
CH
CH2 H
H
C
C
H 2O
+
O
O Mn
O
O
OH(е)
+
OH
+ MnO2
циклический эфир
марганцевой кислоты
(а) OH
циc-1,2-циклогександиол
51
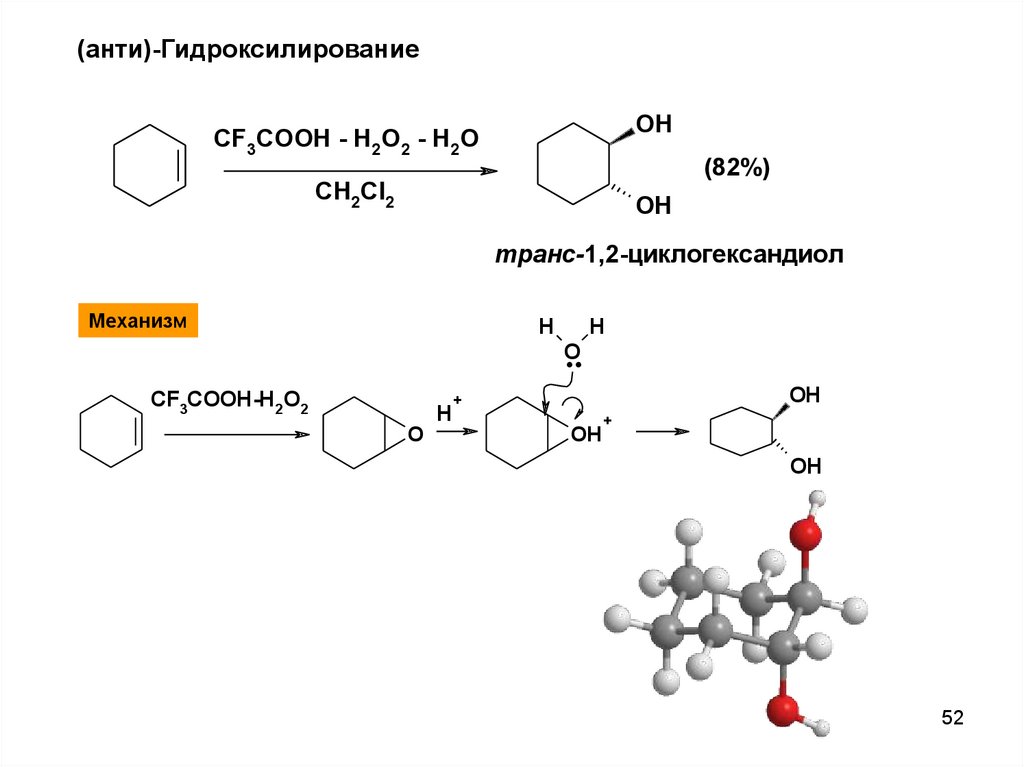
52.
(анти)-ГидроксилированиеOH
CF3COOH - H2O2 - H2O
(82%)
CH2Cl2
OH
транс-1,2-циклогександиол
Механизм
H
CF3COOH-H2O2
O
H
O
..
H
OH
+
OH
+
OH
52
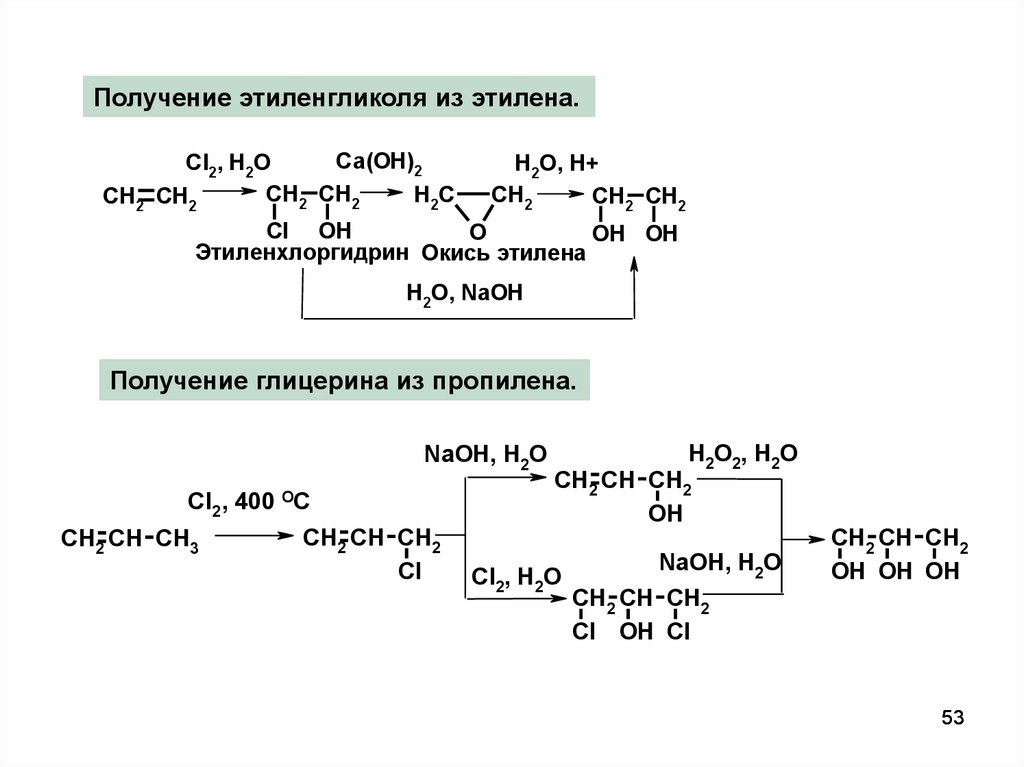
53.
Получение этиленгликоля из этилена.Ca(OH)2
Cl2, H2O
CH2 CH2
H2C
CH2 CH2
H2O, H+
CH2
CH2 CH2
Cl OH
O
OH OH
Этиленхлоргидрин Окись этилена
H2O, NaOH
Получение глицерина из пропилена.
NaOH, H2O
Cl2 , 400
CH2 CH CH3
OC
CH2 CH CH2
Cl
H2O2, H2O
CH2 CH CH2
OH
Cl2, H2O
NaOH, H2O
CH2 CH CH2
OH OH OH
CH2 CH CH2
Cl OH Cl
53
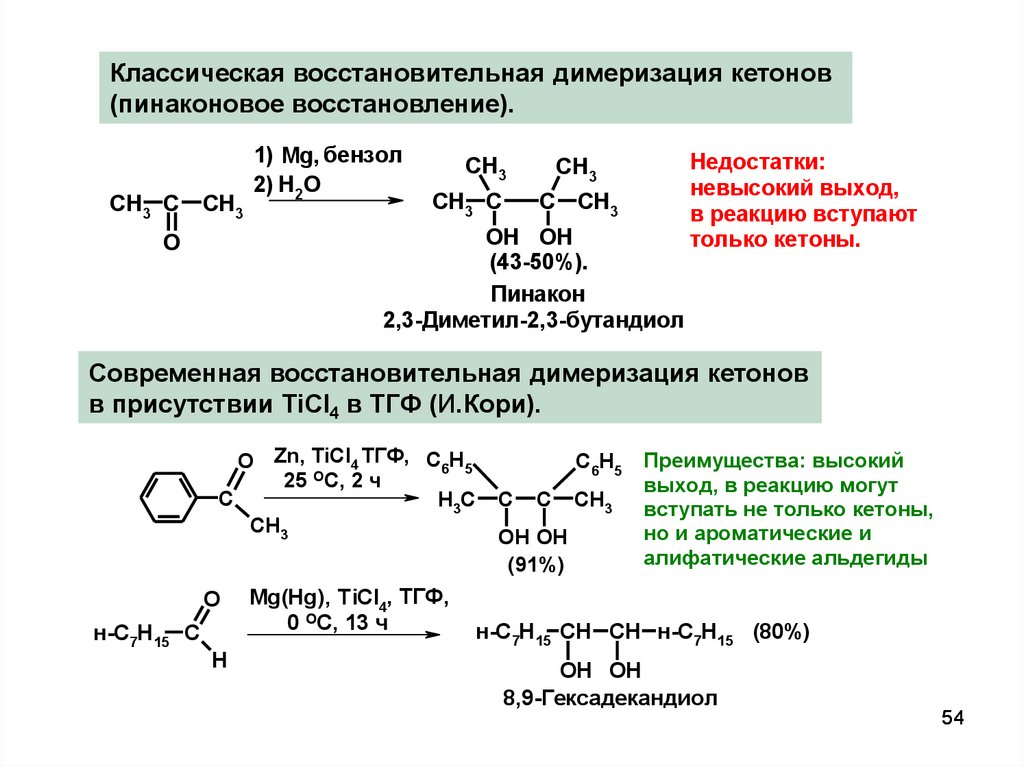
54.
Классическая восстановительная димеризация кетонов(пинаконовое восстановление).
CH3 C
CH3
1) Mg, бензол
2) H2O
CH3
CH3 C
CH3
C CH3
OH OH
(43-50%).
Пинакон
2,3-Диметил-2,3-бутандиол
O
Недостатки:
невысокий выход,
в реакцию вступают
только кетоны.
Современная восстановительная димеризация кетонов
в присутствии TiCl4 в ТГФ (И.Кори).
O Zn, TiCl4 ТГФ, C6H5
25 ОС, 2 ч
C
H3C
CH3
O
н-C7H15 C
H
Mg(Hg), TiCl4, ТГФ,
0 ОС, 13 ч
C6H5
C
C
OH OH
(91%)
CH3
Преимущества: высокий
выход, в реакцию могут
вступать не только кетоны,
но и ароматические и
алифатические альдегиды
н-C7H15 CH CH н-C7H15 (80%)
OH OH
8,9-Гексадекандиол
54
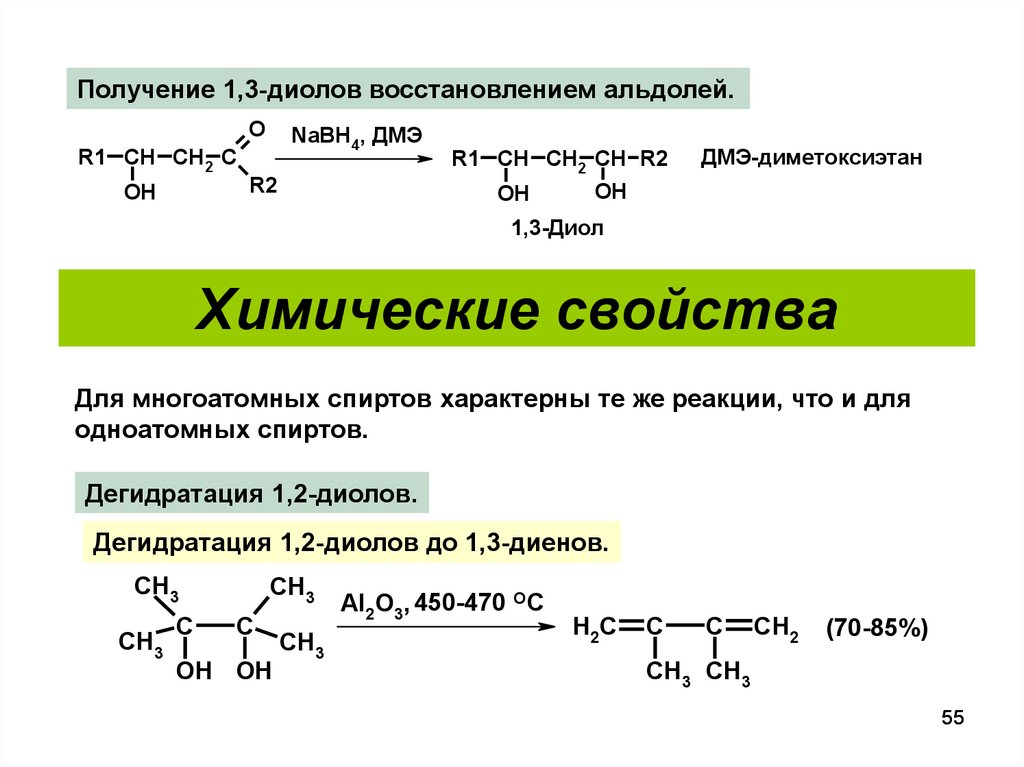
55.
Получение 1,3-диолов восстановлением альдолей.O
R1 CH CH2 C
OH
NaBH4, ДМЭ
R2
R1 CH CH2 CH R2
OH
OH
ДМЭ-диметоксиэтан
1,3-Диол
Химические свойства
Для многоатомных спиртов характерны те же реакции, что и для
одноатомных спиртов.
Дегидратация 1,2-диолов.
Дегидратация 1,2-диолов до 1,3-диенов.
CH3
CH3
C
CH3
C
OH OH
CH3
Al2O3, 450-470 OC
H2C
C
C
CH2
(70-85%)
CH3 CH3
55
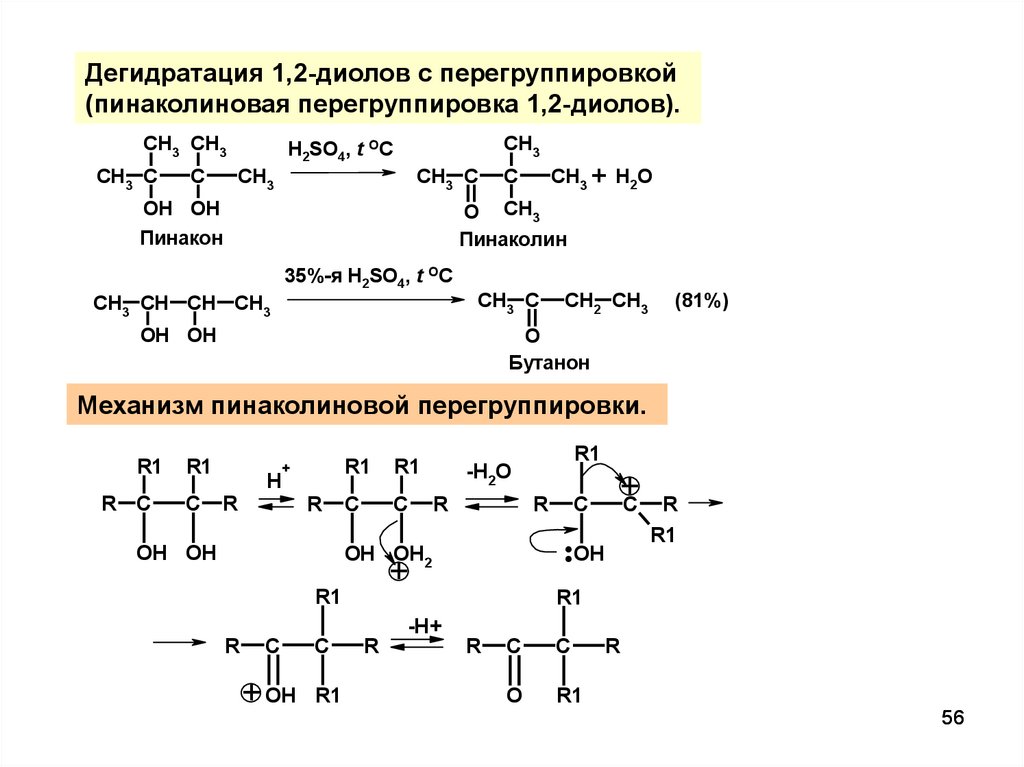
56.
Дегидратация 1,2-диолов с перегруппировкой(пинаколиновая перегруппировка 1,2-диолов).
CH3 CH3
CH3 C
C
CH3
H2SO4, t OC
CH3
CH3 C
OH OH
C
CH3 + H2O
O CH3
Пинаколин
Пинакон
35%-я H2SO4, t OC
CH3 CH CH CH3
CH3 C
OH OH
CH2 CH3
(81%)
O
Бутанон
Механизм пинаколиновой перегруппировки.
R1
R C
R1
C
H
+
R
R
OH OH
R1
R1
C
C
R
R
R
C
+ OH
C
+
R1
R
-H+
C
+
C
..OH
OH OH2
R1
R1
-H2O
R
R1
R1
R
C
C
O
R1
R
56
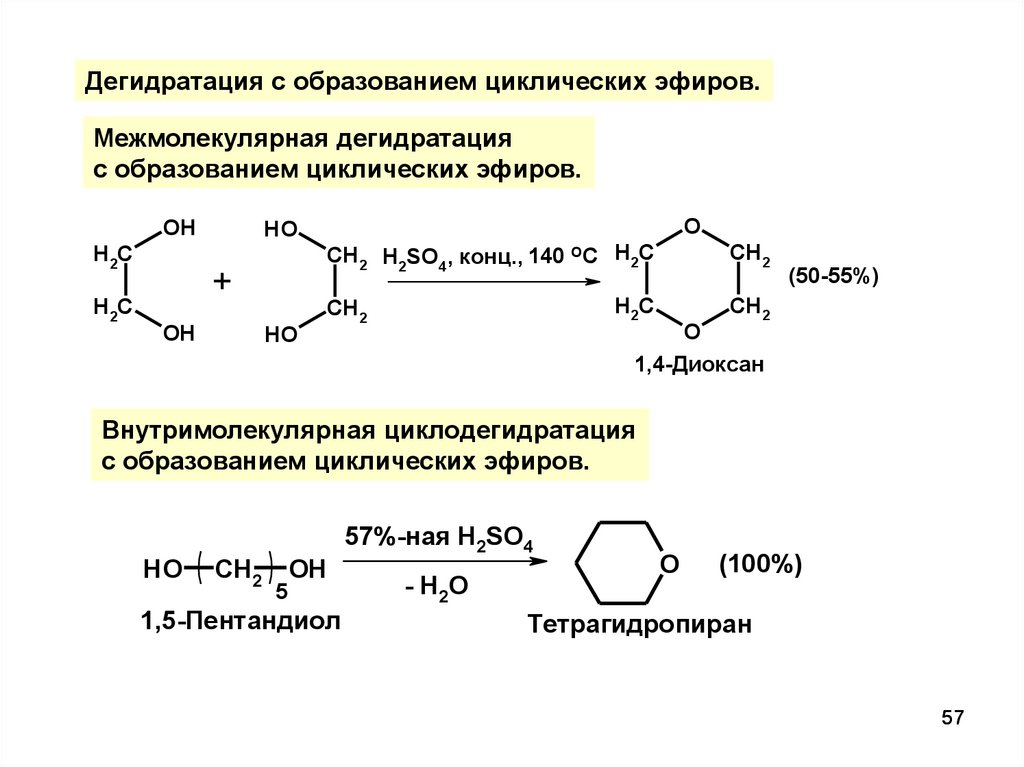
57.
Дегидратация с образованием циклических эфиров.Межмолекулярная дегидратация
с образованием циклических эфиров.
OH
H2C
H2C
HO
+
OH
HO
O
CH2 H2SO4, конц., 140 ОС H2C
CH2
H2C
CH2
CH2
(50-55%)
O
1,4-Диоксан
Внутримолекулярная циклодегидратация
с образованием циклических эфиров.
HO
CH2
5
OH
1,5-Пентандиол
57%-ная H2SO4
- H2 O
O
(100%)
Тетрагидропиран
57
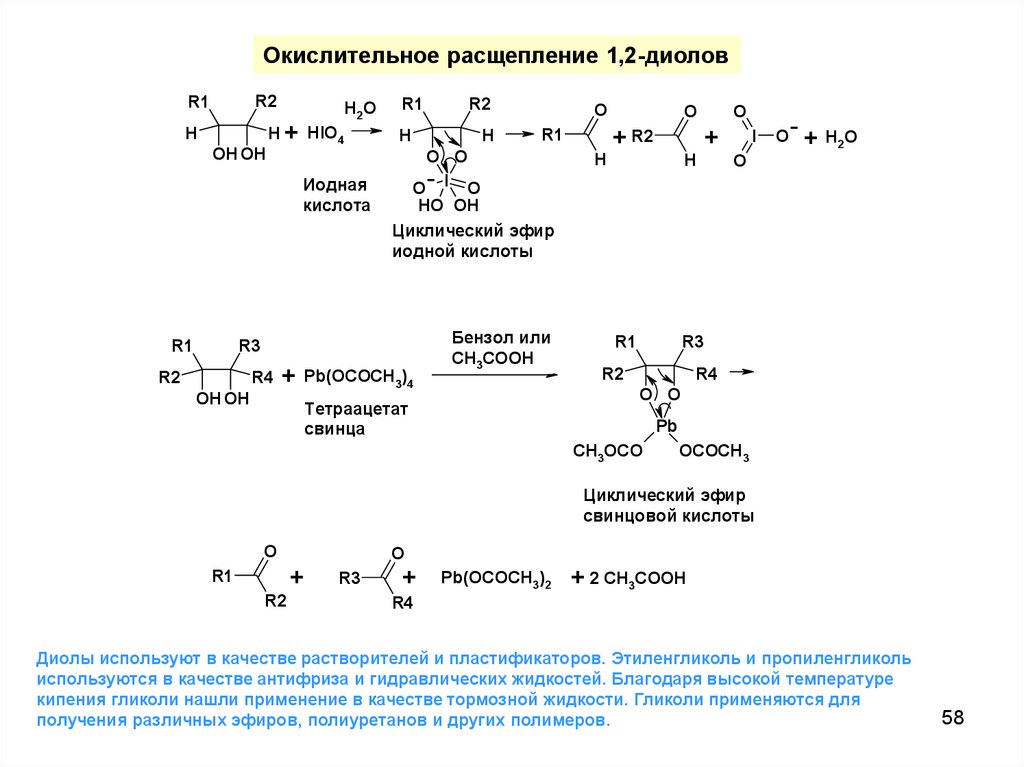
58.
Окислительное расщепление 1,2-диоловR2
R1
H 2O
H + HIO4
H
OH OH
Иодная
кислота
R1
H
R2
R4
+ Pb(OCOCH3)4
OH OH
H
O
Бензол или
CH3COOH
O
+ R2
R1
O O
O I O
HO OH
Циклический эфир
иодной кислоты
R3
R1
R2
O
+
H
H
I
O
+ H 2O
O
R3
R1
R2
R4
O O
Тетраацетат
свинца
Pb
CH3OCO
OCOCH3
Циклический эфир
свинцовой кислоты
O
O
+
R1
R2
R3
+
Pb(OCOCH3)2
+ 2 CH3COOH
R4
Диолы используют в качестве растворителей и пластификаторов. Этиленгликоль и пропиленгликоль
используются в качестве антифриза и гидравлических жидкостей. Благодаря высокой температуре
кипения гликоли нашли применение в качестве тормозной жидкости. Гликоли применяются для
получения различных эфиров, полиуретанов и других полимеров.
58
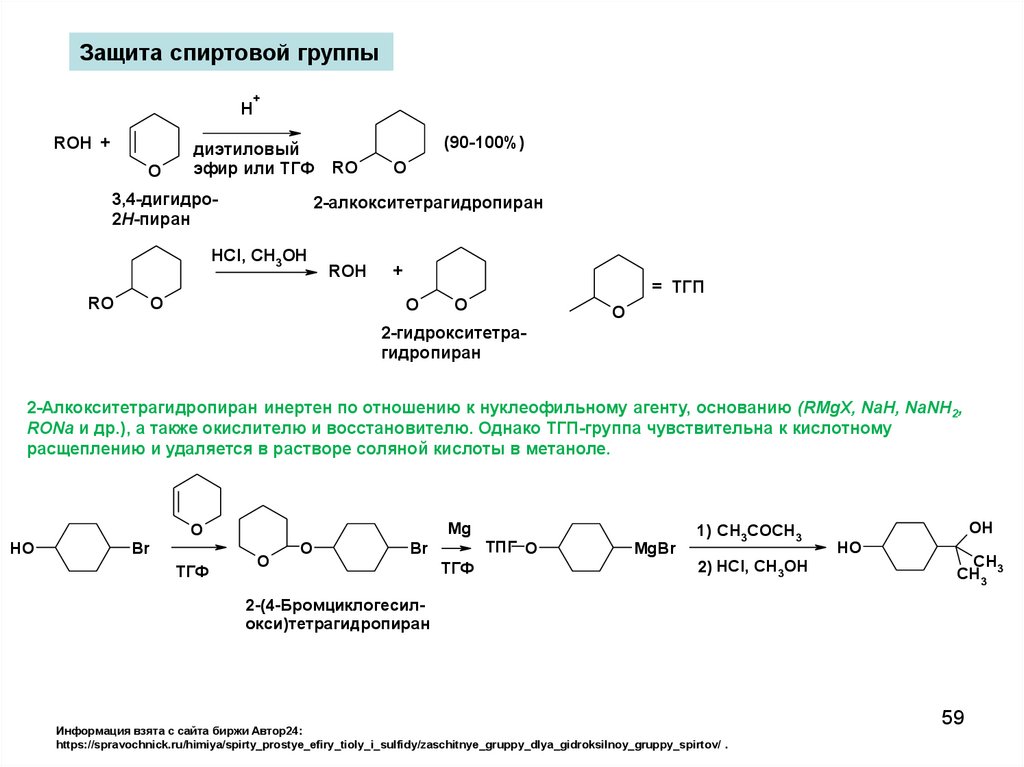
59.
Защита спиртовой группыH
ROH +
O
+
диэтиловый
эфир или ТГФ
3,4-дигидро2H-пиран
RO
O
2-алкокситетрагидропиран
HCl, CH3OH
RO
(90-100%)
O
ROH
+
O
= ТГП
O
O
2-гидрокситетрагидропиран
2-Алкокситетрагидропиран инертен по отношению к нуклеофильному агенту, основанию (RMgX, NaH, NaNH2,
RONa и др.), а также окислителю и восстановителю. Однако ТГП-группа чувствительна к кислотному
расщеплению и удаляется в растворе соляной кислоты в метаноле.
Mg
O
HO
Br
ТГФ
O
O
ТПГ O
Br
ТГФ
MgBr
1) CH3COCH3
2) HCl, CH3OH
OH
HO
CH
CH3 3
2-(4-Бромциклогесилокси)тетрагидропиран
Информация взята с сайта биржи Автор24:
https://spravochnick.ru/himiya/spirty_prostye_efiry_tioly_i_sulfidy/zaschitnye_gruppy_dlya_gidroksilnoy_gruppy_spirtov/ .
59
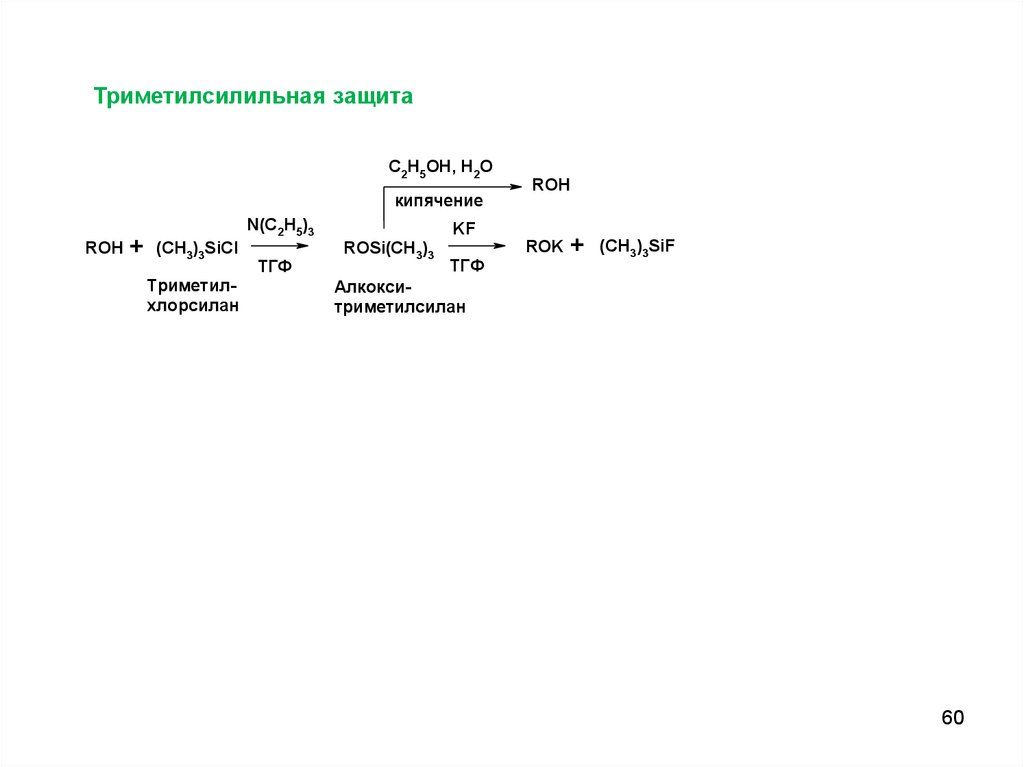
60.
Триметилсилильная защитаC2H5OH, H2O
кипячение
ROH
+
(CH3)3SiCl
Триметилхлорсилан
N(C2H5)3
ТГФ
KF
ROSi(CH3)3
ТГФ
ROH
ROK
+
(CH3)3SiF
Алкокситриметилсилан
60
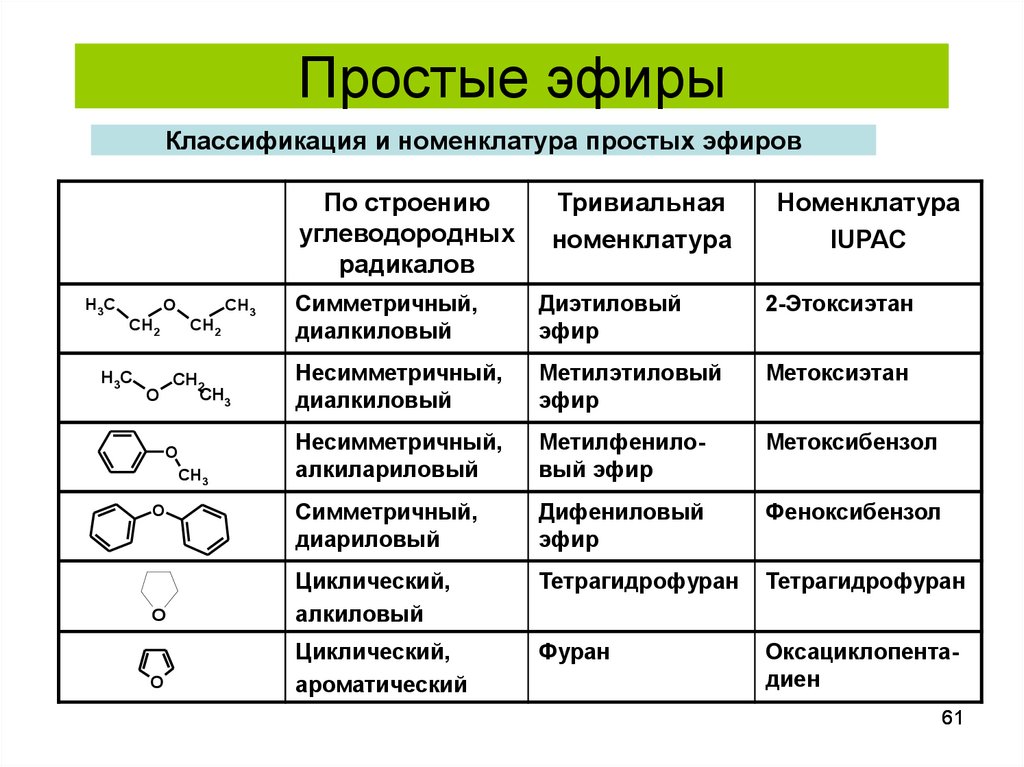
61. Классификация и номенклатура простых эфиров
Простые эфирыКлассификация и номенклатура простых эфиров
По строению
углеводородных
радикалов
H3C
Номенклатура
IUPAC
Симметричный,
диалкиловый
Диэтиловый
эфир
2-Этоксиэтан
Несимметричный,
диалкиловый
Метилэтиловый
эфир
Метоксиэтан
Несимметричный,
алкилариловый
Метилфениловый эфир
Метоксибензол
Симметричный,
диариловый
Дифениловый
эфир
Феноксибензол
Тетрагидрофуран
Тетрагидрофуран
O
Циклический,
алкиловый
Фуран
O
Циклический,
ароматический
Оксациклопентадиен
O
CH2
CH2
H3C
Тривиальная
номенклатура
CH3
CH2
CH3
O
O
CH3
O
61
62.
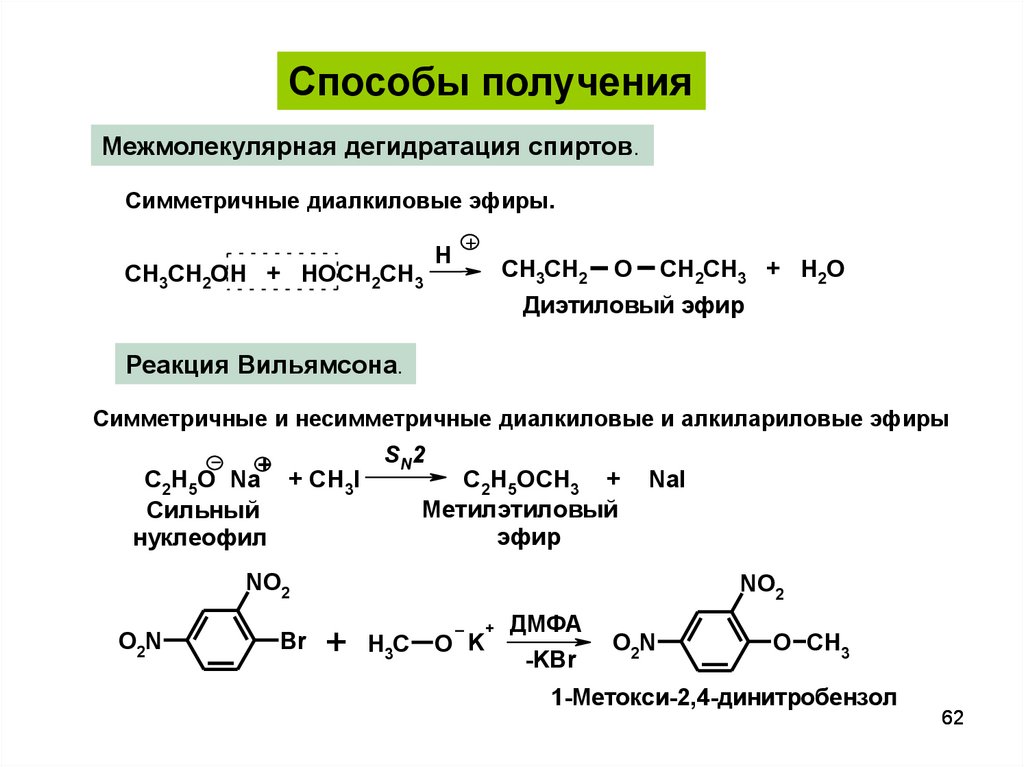
Способы полученияМежмолекулярная дегидратация спиртов.
Симметричные диалкиловые эфиры.
СH3СH2OH + HOCH2CH3
H
+
СH3СH2
O
CH2CH3 + H2O
Диэтиловый эфир
Реакция Вильямсона.
Симметричные и несимметричные диалкиловые и алкилариловые эфиры
SN2
+
С2Н5О Na + CH3I
C2H5OCH3 +
Метилэтиловый
Сильный
эфир
нуклеофил
NaI
NO2
O2N
Br
NO2
+
H3C
O K
+
ДМФА
-KBr
O2N
O CH3
1-Метокси-2,4-динитробензол
62
63.
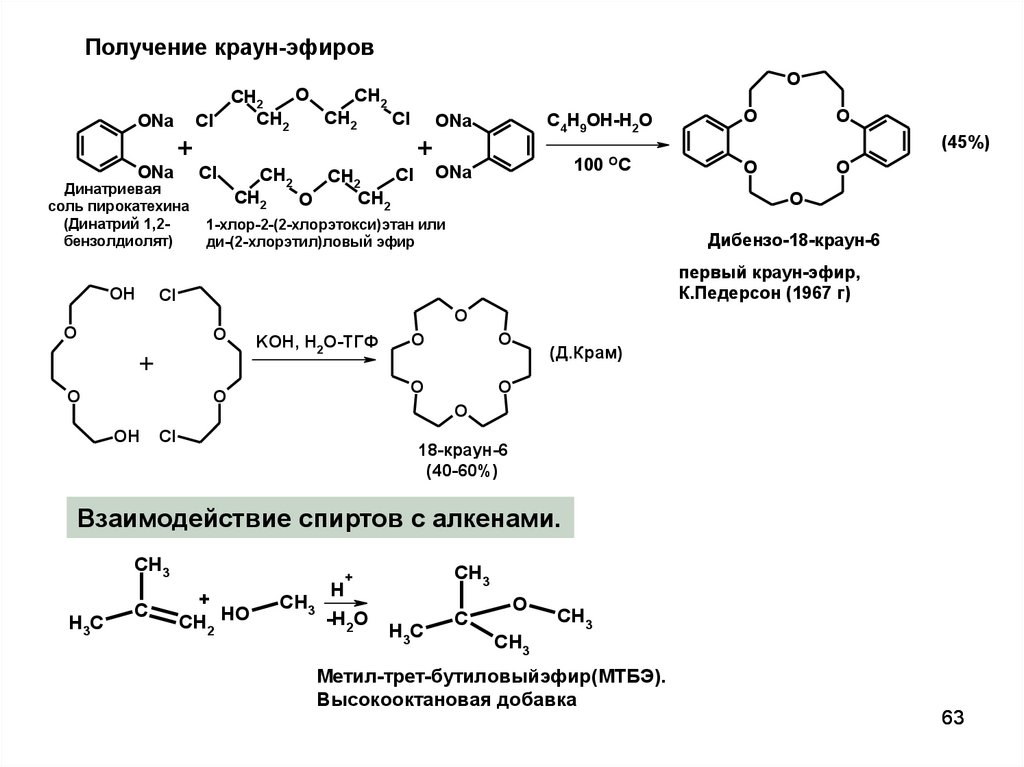
Получение краун-эфировONa
ONa
+
Динатриевая
соль пирокатехина
(Динатрий 1,2бензолдиолят)
OH
O
O
CH2
CH2
CH2
CH2
Cl
Cl
Cl
CH2
CH2
C4H9OH-H2O
ONa
+
Cl
CH2
CH2
O
100
ONa
OC
1-хлор-2-(2-хлорэтокси)этан или
ди-(2-хлорэтил)ловый эфир
+
O
O
Дибензо-18-краун-6
O
KOH, H2O-ТГФ
O
OH
(45%)
первый краун-эфир,
К.Педерсон (1967 г)
O
O
O
O
Cl
O
O
O
O
O
O
(Д.Крам)
O
Cl
18-краун-6
(40-60%)
Взаимодействие спиртов с алкенами.
CH3
H3C
C
CH3
+
+
CH2 HO
H
CH3
-H2O
H3C
C
O
CH3
CH3
Метил-трет-бутиловыйэфир(МТБЭ).
Высокооктановая добавка
63
64.
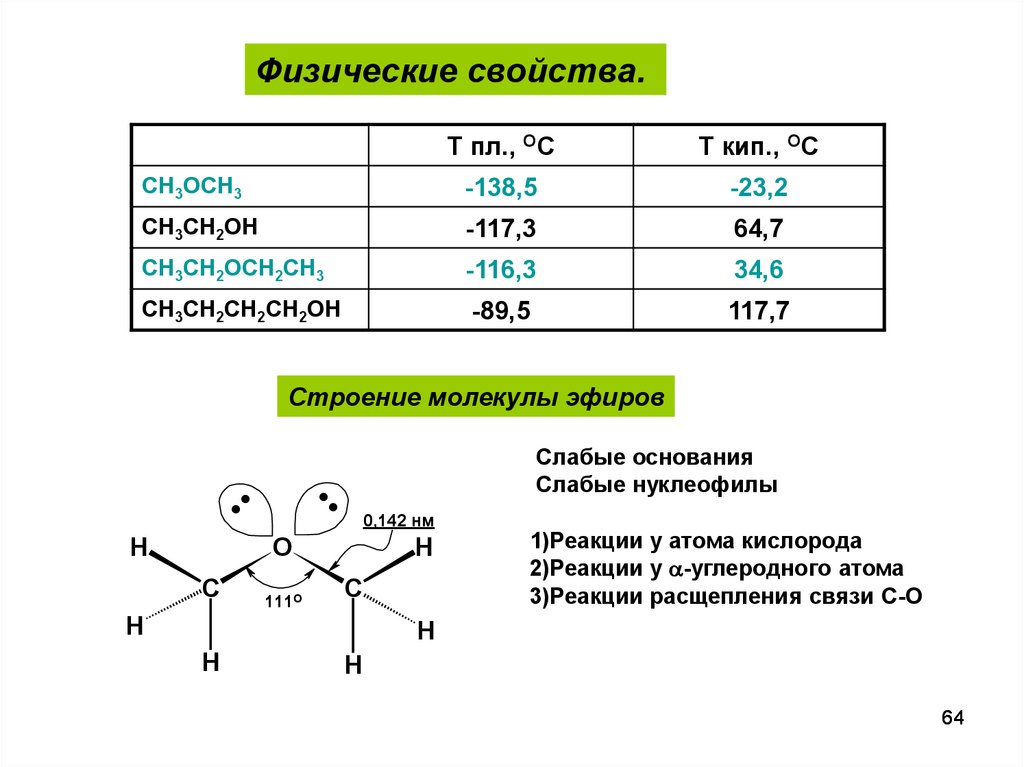
Физические свойства.Т пл., ОС
Т кип., ОС
CH3OCH3
-138,5
-23,2
CH3CH2OH
-117,3
64,7
CH3CH2OCH2CH3
-116,3
34,6
CH3CH2CH2CH2OH
-89,5
117,7
Строение молекулы эфиров
.. ..
H
Слабые основания
Слабые нуклеофилы
0,142 нм
H
O
C
111О
C
H
1)Реакции у атома кислорода
2)Реакции у a-углеродного атома
3)Реакции расщепления связи С-О
H
H
H
64
65.
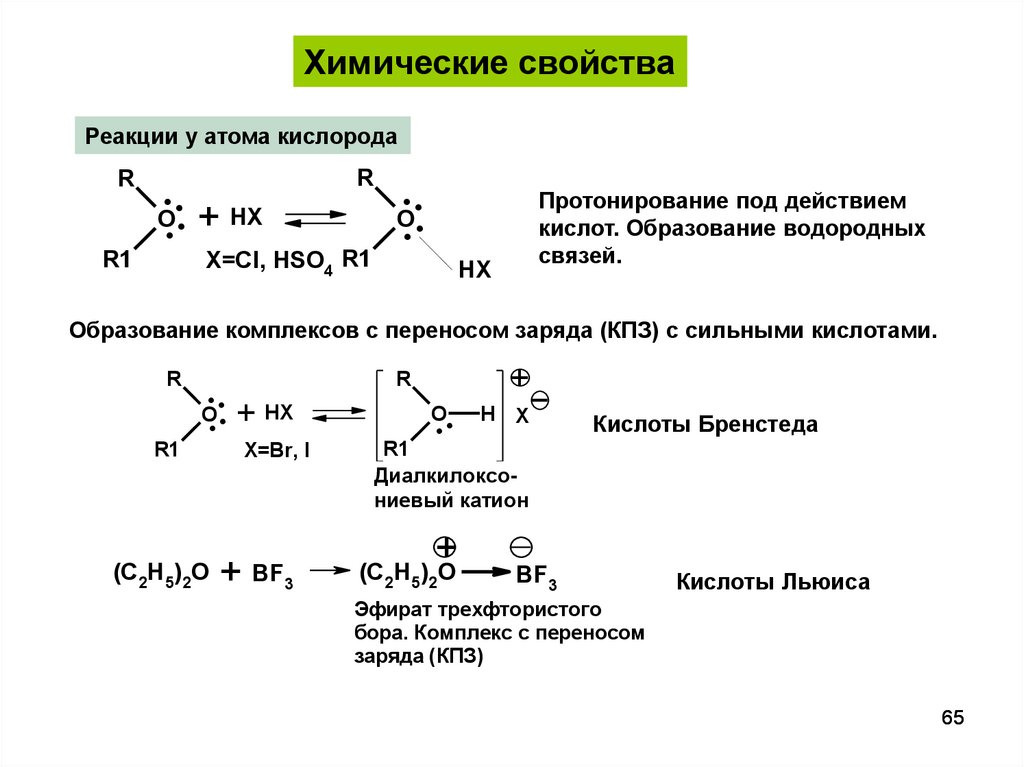
Химические свойстваРеакции у атома кислорода
R
R1
..
O. . + HX
R
X=Cl, HSO4 R1
..
O.
.
Протонирование под действием
кислот. Образование водородных
связей.
HX
Образование комплексов с переносом заряда (КПЗ) с сильными кислотами.
R
R1
..
O. . + HX
(C2H5)2O
X=Br, I
+ BF3
+
R
O.
.
H X
Кислоты Бренстеда
R1
Диалкилоксониевый катион
+
(C2H5)2O
BF3
Кислоты Льюиса
Эфират трехфтористого
бора. Комплекс с переносом
заряда (КПЗ)
65
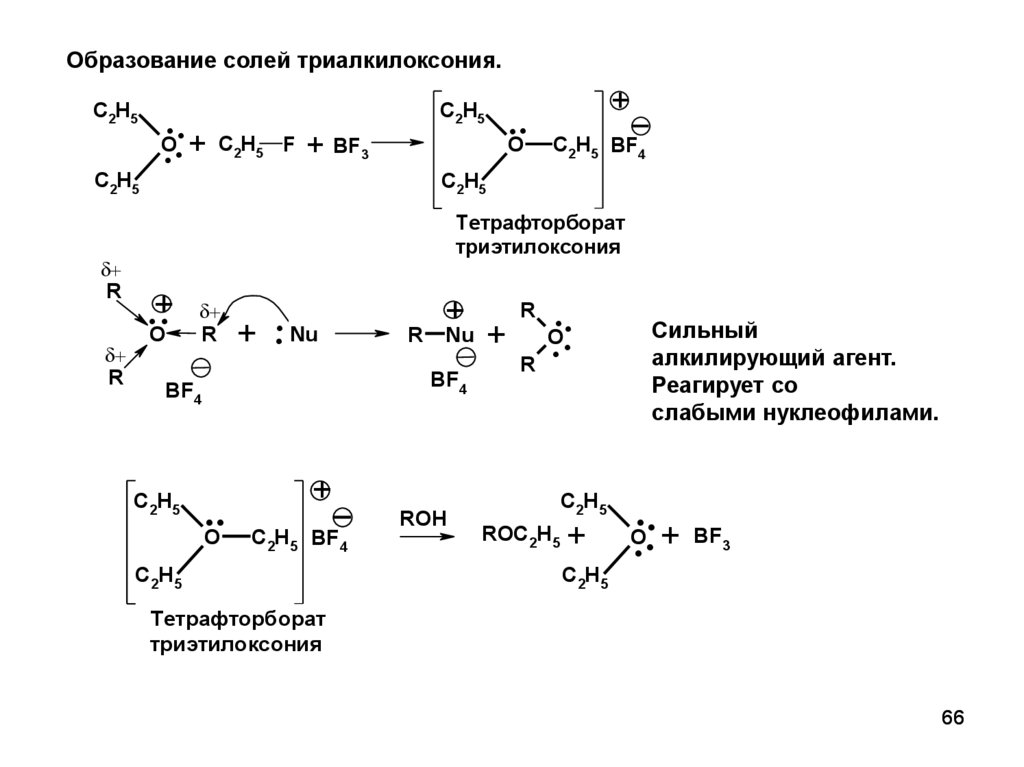
66.
Образование солей триалкилоксония.C2H5
..
.. + C H
O
C2H5
R
R
2
5
F
C2H5
+ BF3
..
O
+
C2H5 BF4
C2H5
Тетрафторборат
триэтилоксония
.+.
O
R
+ .. Nu
Nu
BF4
BF4
C2H5
R
+
..
O
+
R
..
..
R
+
C2H5 BF4
C2H5
ROH
Сильный
алкилирующий агент.
Реагирует со
слабыми нуклеофилами.
O
C2H5
ROC2H5
+
C2H5
..
.. +
O
BF3
Тетрафторборат
триэтилоксония
66
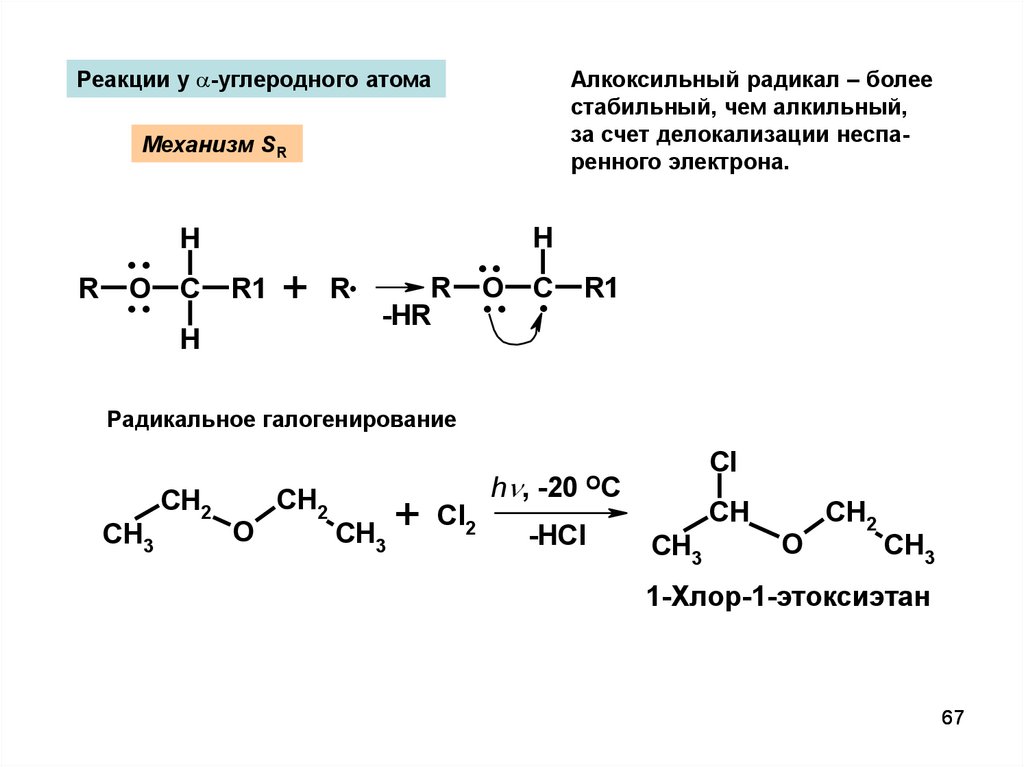
67.
Реакции у a-углеродного атомаАлкоксильный радикал – более
стабильный, чем алкильный,
за счет делокализации неспаренного электрона.
Механизм SR
R
..
O
..
H
H
C
R1
+
H
R
R
-HR
..
O C
.. .
R1
Радикальное галогенирование
CH3
CH2
O
CH2
CH3 +
Cl2
h , -20
Cl
OC
-HCl
CH
CH3
O
CH2
CH3
1-Хлор-1-этоксиэтан
67
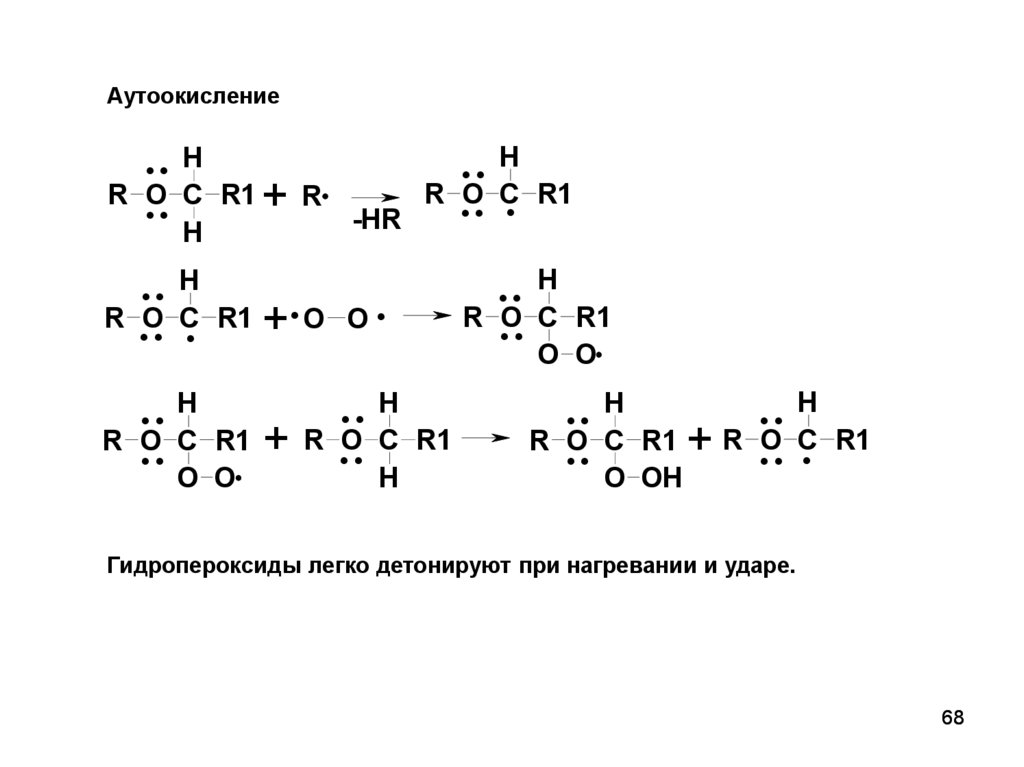
68.
АутоокислениеR
.. H
O
.. C
R1
H
R
.. H
O C.
..
R
.. H
O
.. C
R1
R1
O O
+R
-HR
+. O
O.
+R
.. H
O C
..
H
R
.. H
O C.
..
R
R1
R1
.. H
O C
..
R1
O O
R
.. H
O C
..
R1
O OH
+R
.. H
O C
.
..
R1
Гидропероксиды легко детонируют при нагревании и ударе.
68
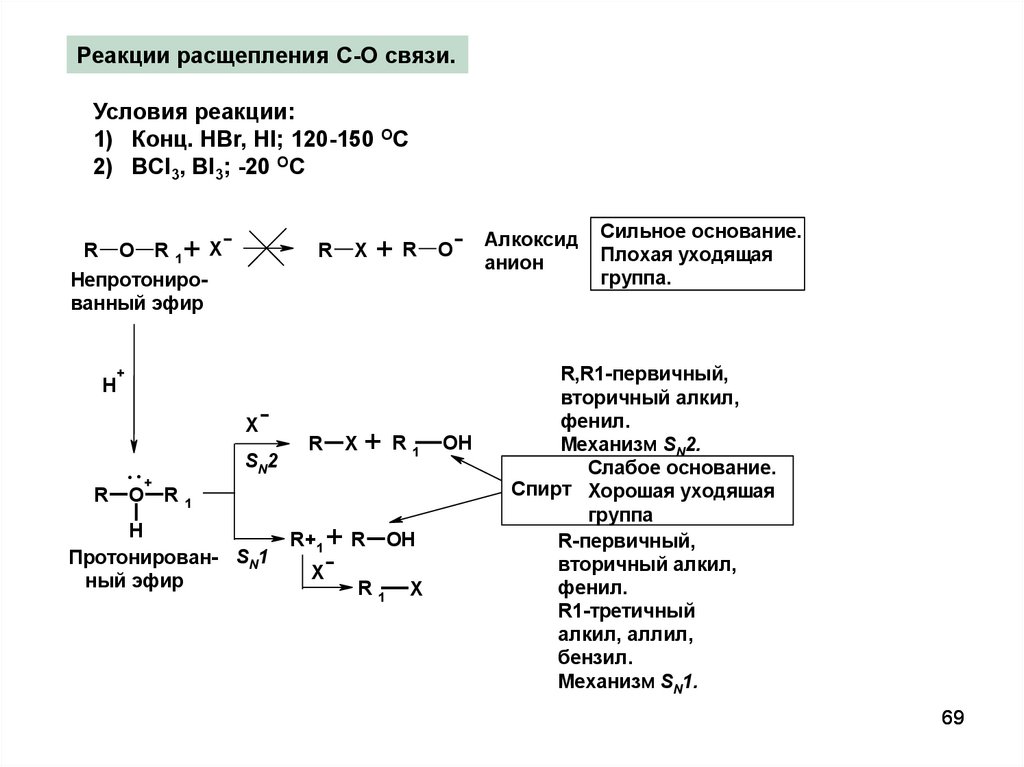
69.
Реакции расщепления С-О связи.Условия реакции:
1) Конц. HBr, HI; 120-150 OC
2) BCl3, BI3; -20 ОC
+
R O R1 X
Непротонированный эфир
H
R
+R
O
+
X
R
X
..
+
O
SN2
R
X
+ R1
R1
H
Протонирован- SN1
ный эфир
R+1
X
+R
R1
OH
X
OH
Алкоксид
анион
Сильное основание.
Плохая уходящая
группа.
R,R1-первичный,
вторичный алкил,
фенил.
Механизм SN2.
Слабое основание.
Спирт Хорошая уходяшая
группа
R-первичный,
вторичный алкил,
фенил.
R1-третичный
алкил, аллил,
бензил.
Механизм SN1.
69
70.
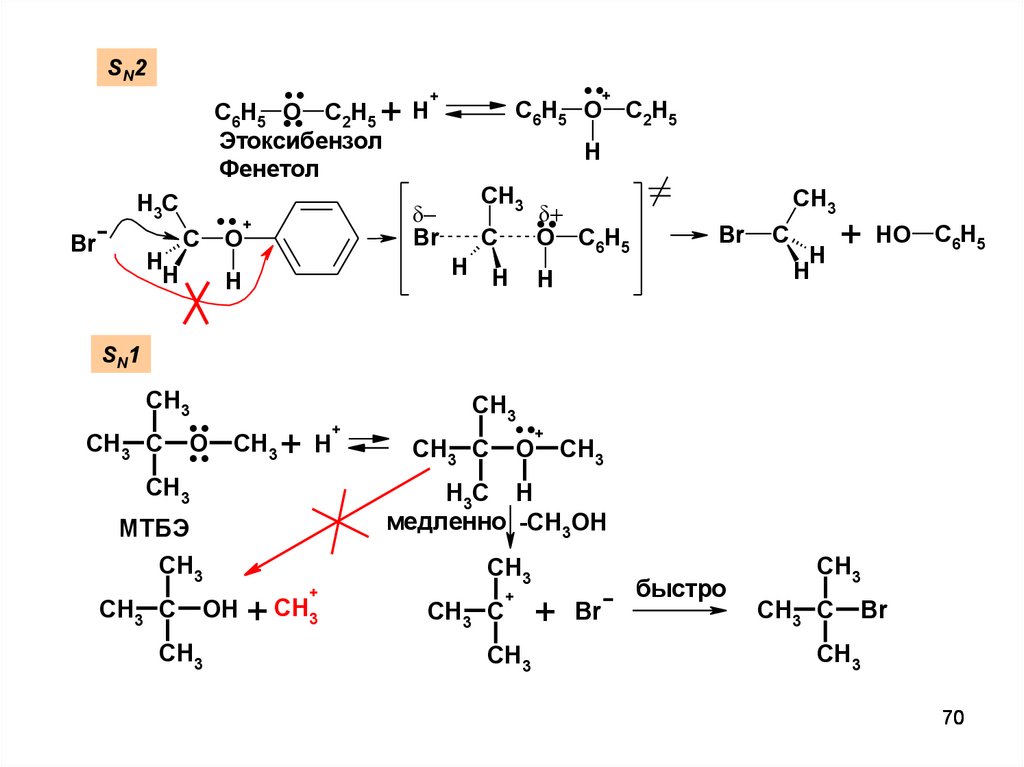
....SN2
+H
C6H5 O C2H5
Этоксибензол
Фенетол
..
H3C
Br
H
H
C
..
+
+
C6H5 O
H
CH3
Br
+
O
C
H
H
C2H5
..
O C6H5
H
CH3
Br
H
C
H
H
+
HO
C6H5
SN1
....
CH3
CH3 C
O
CH3
+
H
CH3
..
CH3 C
O
+
CH3
H3C H
медленно -CH3OH
МТБЭ
CH3
CH3 C
+
CH3
OH
CH3
+
+ CH3
CH3
CH3 C
+
CH3
+
Br
быстро
CH3
CH3 C
Br
CH3
70
71.
Простые эфиры не реагируют с Na при низких температурах.При повышенной температуре простые эфиры (особенно высшие гомологи)
расщепляются по уравнению
R
O
R1
+ 2 Na
R ONa
алкоксид Na
+
R1 Na
алкилнатрий
Активный алкилнатрий может вступать в реакцию
с диэтиловым эфиром (П.П.Шорыгин)
H5C2
O
C2H5
+HC
5
2
Na
H5C2 ONa
этоксид Na
+
C2H6
+
C2H4
Применение простых эфиров.
Растворители. Синтез различных комплексов. Антидетонационные добавки
к топливу.
71
72.
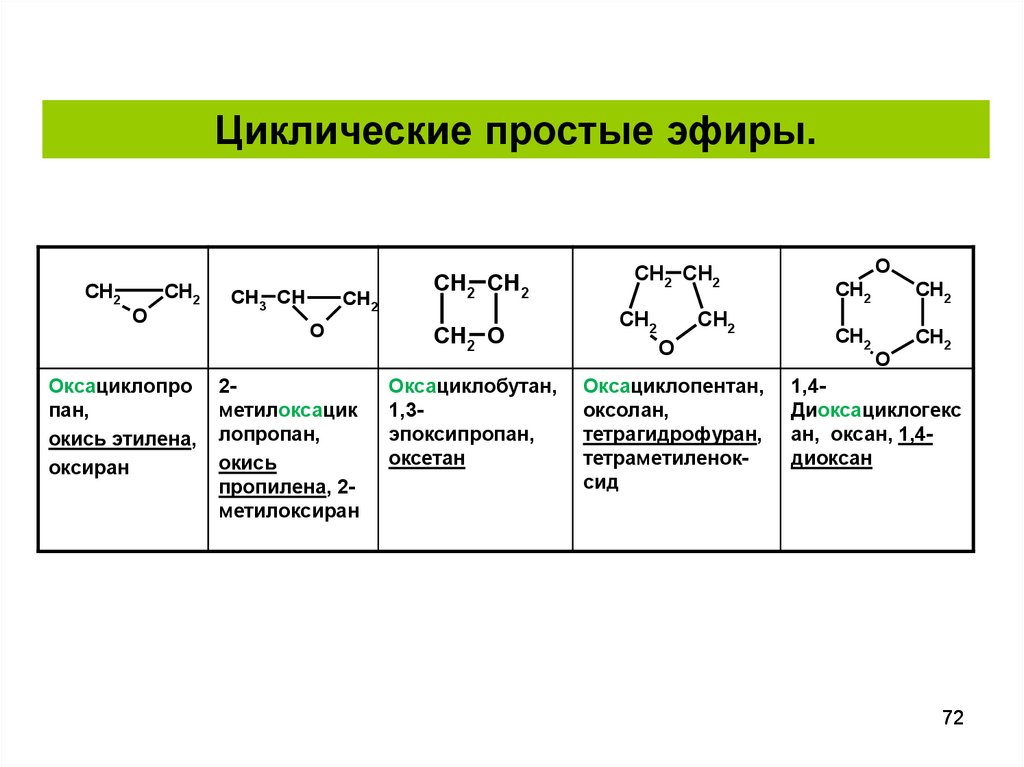
Циклические простые эфиры.CH2
CH2
O
Оксациклопро
пан,
окись этилена,
оксиран
CH3 CH
CH2
O
2метилоксацик
лопропан,
окись
пропилена, 2метилоксиран
CH2 CH2
CH2 O
Оксациклобутан,
1,3эпоксипропан,
оксетан
CH2 CH2
CH2
CH2
O
Оксациклопентан,
оксолан,
тетрагидрофуран,
тетраметиленоксид
O
CH2
CH2
CH2
CH2
O
1,4Диоксациклогекс
ан, оксан, 1,4диоксан
72
73.
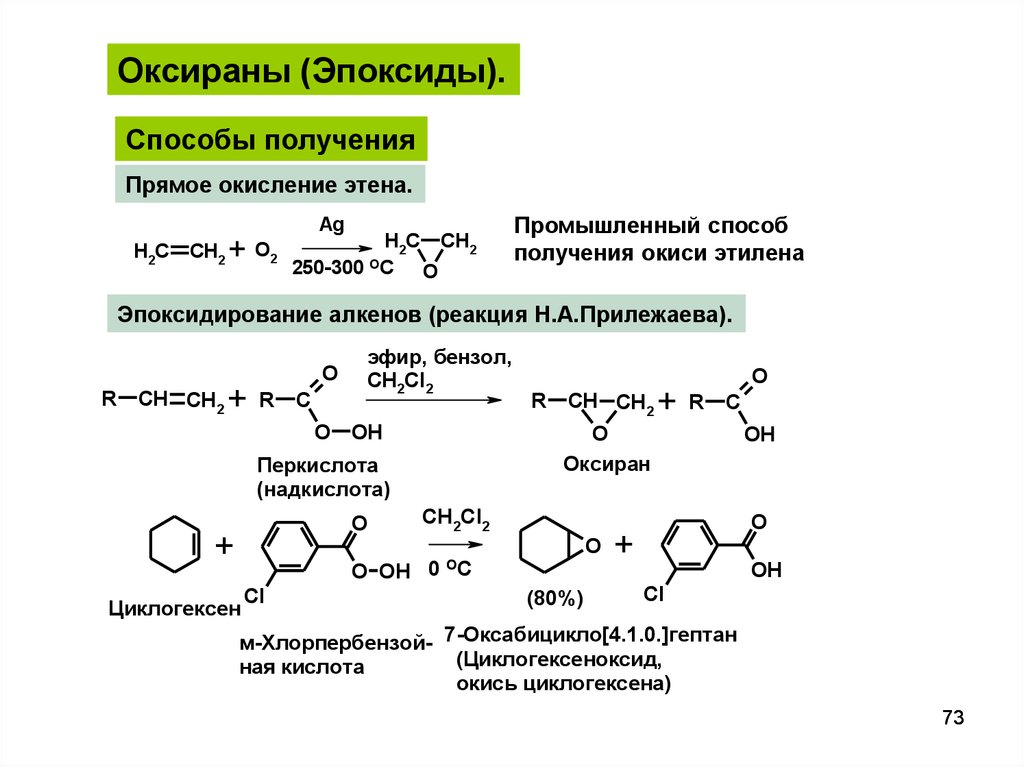
Оксираны (Эпоксиды).Способы получения
Прямое окисление этена.
H2C
CH2
+ O2
Ag
H2C CH2
250-300 OC
O
Промышленный способ
получения окиси этилена
Эпоксидирование алкенов (реакция Н.А.Прилежаева).
R
CH CH2
+
O
R
C
O
эфир, бензол,
CH2Cl2
OH
+
CH2Cl2
O OH 0
Циклогексен
Cl
CH CH2
+
R
C
O
Оксиран
Перкислота
(надкислота)
O
R
O
O
OC
(80%)
OH
O
+
OH
Cl
м-Хлорпербензой- 7-Оксабицикло[4.1.0.]гептан
(Циклогексеноксид,
ная кислота
окись циклогексена)
73
74.
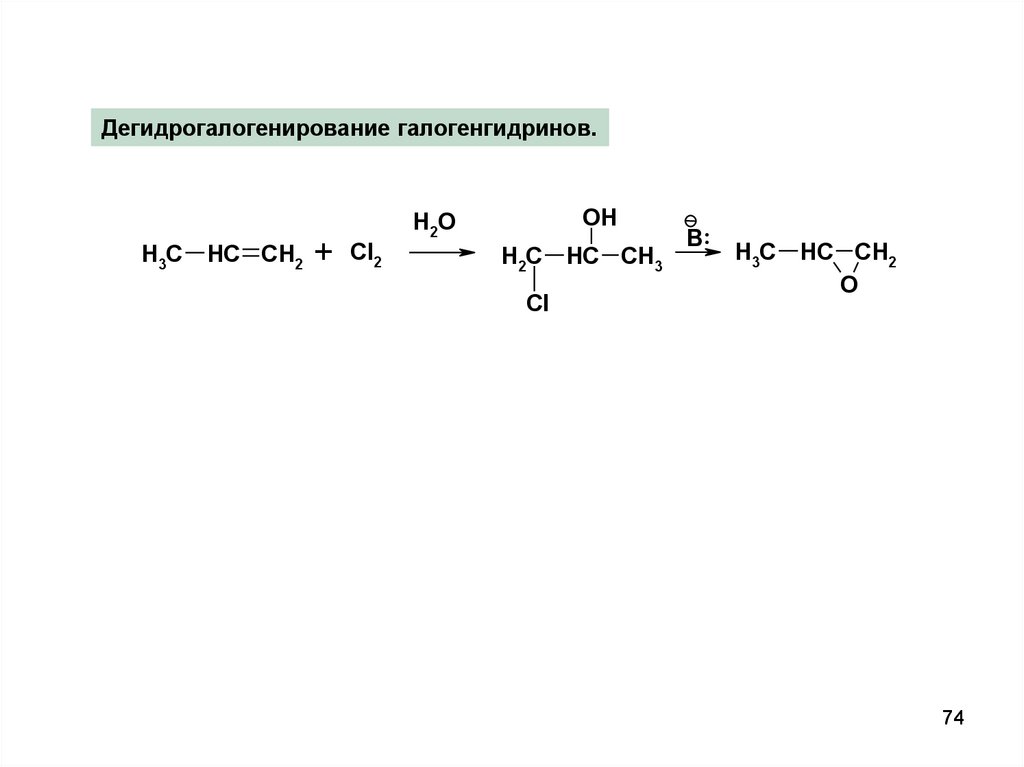
Дегидрогалогенирование галогенгидринов.H3C
HC CH2
+
Cl2
OH
H 2O
H2C
Cl
HC CH3
B ..
H3C
HC CH2
O
74
75.
Строение молекулыH
0,150 нм
H
C
H
C
O
61О
H
0,146 нм
Энергия
напряжения
105 кДж/моль
(25 ккал/моль)
H2C
CH2
..O..
H
Атака
нуклеофила
+
75
76.
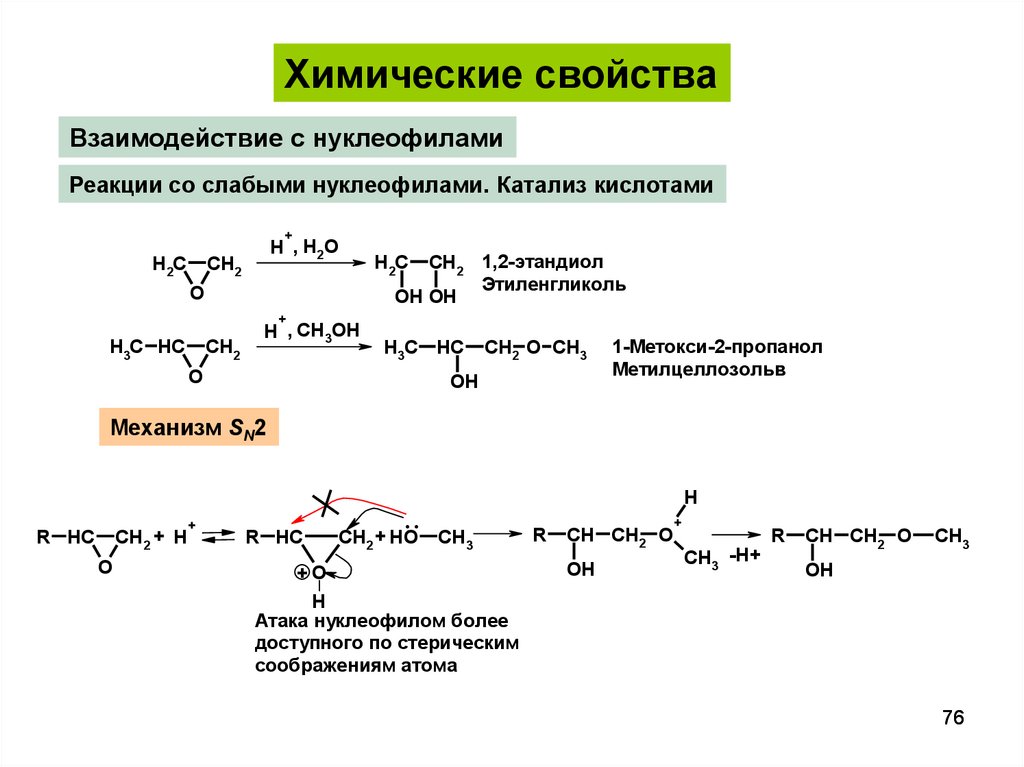
Химические свойстваВзаимодействие с нуклеофилами
Реакции со слабыми нуклеофилами. Катализ кислотами
+
H2C
H , H 2O
CH2
O
CH2 1,2-этандиол
Этиленгликоль
OH OH
H2C
+
H3C HC
CH2
H , CH3OH
H3C HC
O
CH2 O CH3
OH
1-Метокси-2-пропанол
Метилцеллозольв
Механизм SN2
CH2 + H
R HC
O
+
R HC
..
CH2 + HO
H
CH3
+O
H
Атака нуклеофилом более
доступного по стерическим
соображениям атома
R
+
CH CH2 O
OH
CH3 -H+
R
CH CH2 O
CH3
OH
76
77.
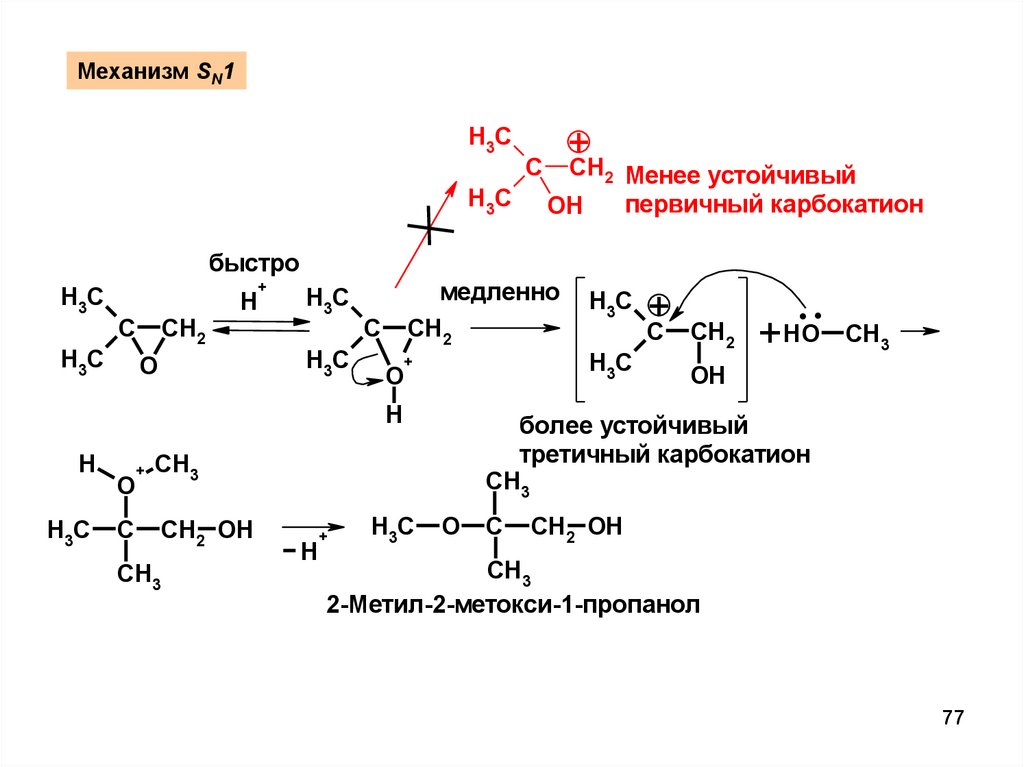
Механизм SN1H3C
H3C
+
CH
C
2
OH
Менее устойчивый
первичный карбокатион
быстро
H3C
C
CH2
H3C
H
O
+
H3C
H3C
медленно
CH2
C
H3C
+
O
H
H
H3C
+
O
C
CH3
H
+
H3C
+
C
CH2
+
.
.
HO
CH3
OH
более устойчивый
третичный карбокатион
CH3
CH3
CH2 OH
H3C
O
C
CH2 OH
CH3
2-Метил-2-метокси-1-пропанол
77
78.
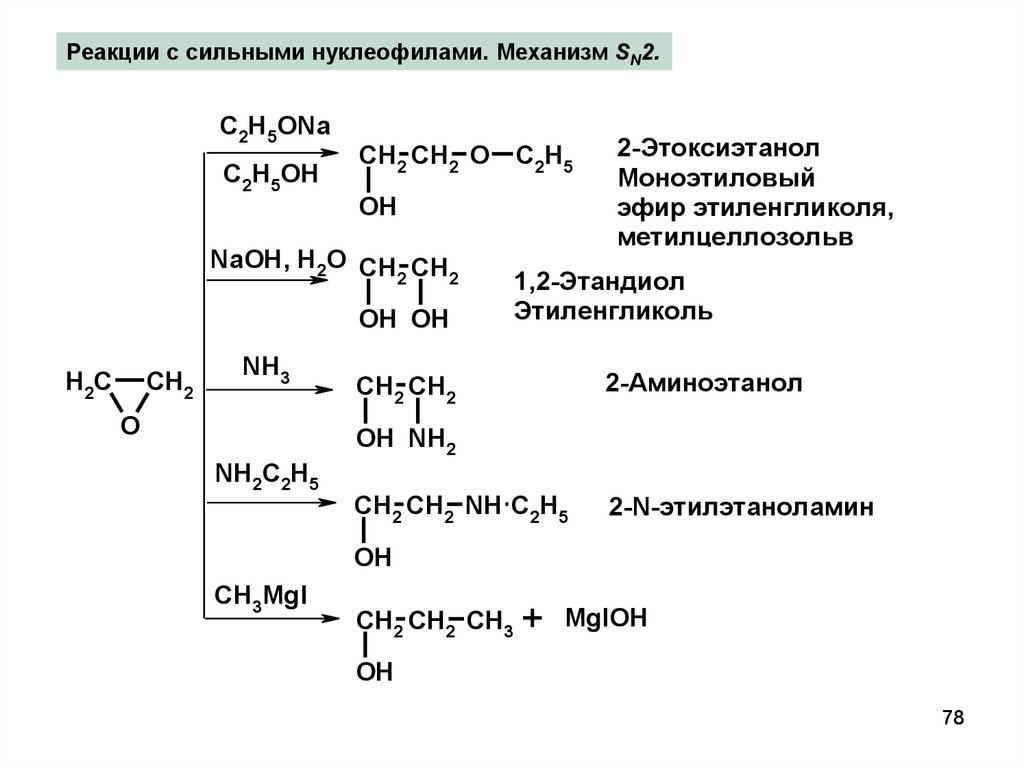
Реакции с сильными нуклеофилами. Механизм SN2.C2H5ONa
C2H5OH
CH2 CH2 O
C2H5
OH
NaOH, H2O CH CH
2
2
OH OH
H2C
CH2
NH3
O
2-Этоксиэтанол
Моноэтиловый
эфир этиленгликоля,
метилцеллозольв
1,2-Этандиол
Этиленгликоль
CH2 CH2
2-Аминоэтанол
OH NH2
NH2C2H5
CH2 CH2 NH C2H5
2-N-этилэтаноламин
OH
CH3MgI
CH2 CH2 CH3 + MgIOH
OH
78
79.
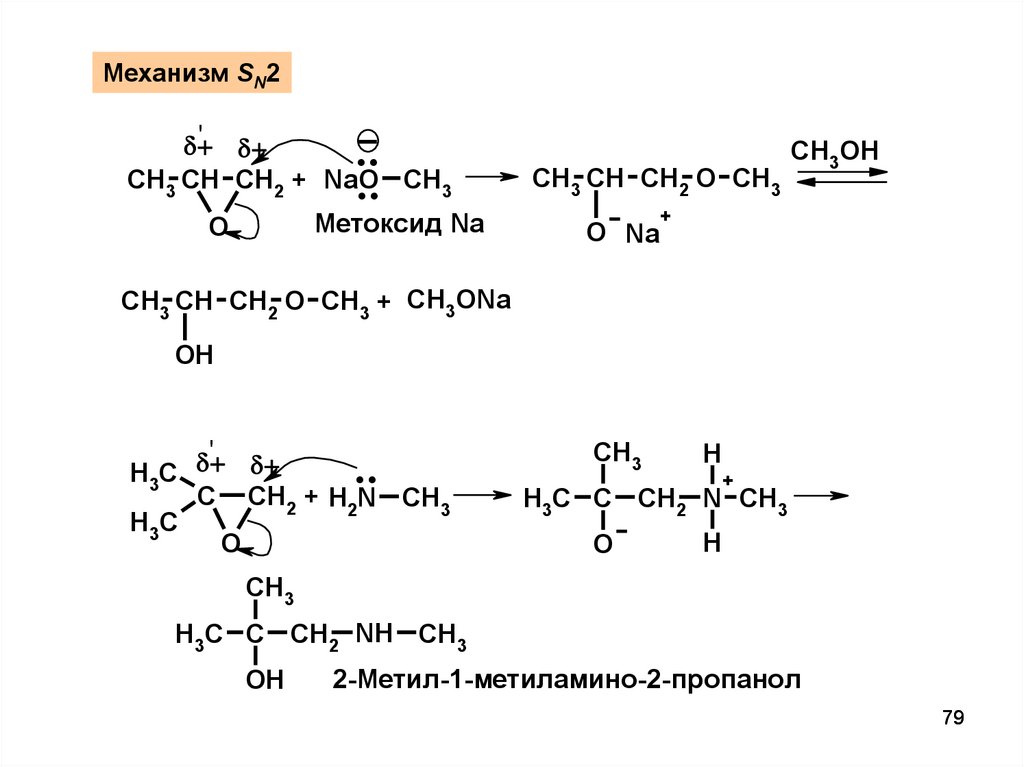
Механизм SN2..
..
'
CH3 CH CH2 + NaO CH3
Метоксид Na
O
CH3 CH CH2 O CH3
O Na
CH3OH
+
CH3 CH CH2 O CH3 + CH3ONa
OH
..
'
H3C
C CH2 + H2N CH3
H3C
O
CH3
H
+
H3C C CH2 N CH3
O
H
CH3
H3C C CH2 NH CH3
OH
2-Метил-1-метиламино-2-пропанол
79
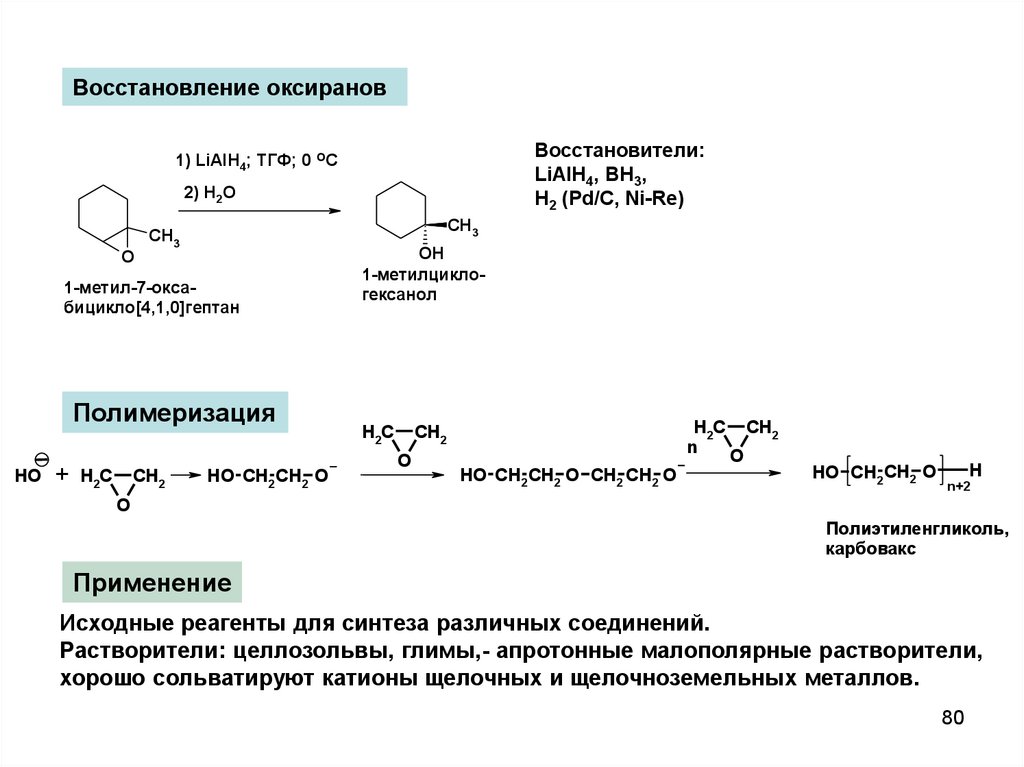
80.
Восстановление оксирановВосстановители:
LiAlH4, BH3,
H2 (Pd/C, Ni-Re)
1) LiAlH4; ТГФ; 0 OC
2) H2O
O
CH3
CH3
1-метил-7-оксабицикло[4,1,0]гептан
Полимеризация
HO
+
H2C
CH2
HO CH2 CH2 O
OH
1-метилциклогексанол
H2C
H2C
n
CH2
O
HO CH2 CH2 O CH2 CH2 O
CH2
O
HO CH2 CH2 O
H
n+2
O
Полиэтиленгликоль,
карбовакс
Применение
Исходные реагенты для синтеза различных соединений.
Растворители: целлозольвы, глимы,- апротонные малополярные растворители,
хорошо сольватируют катионы щелочных и щелочноземельных металлов.
80
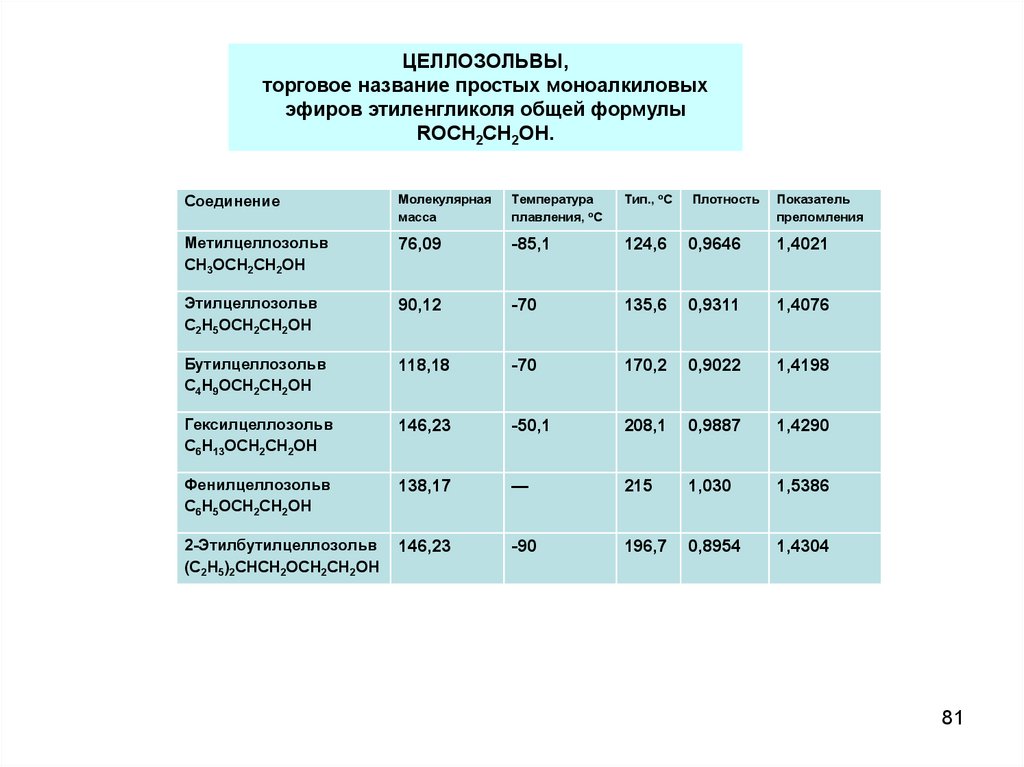
81.
ЦЕЛЛОЗОЛЬВЫ,торговое название простых моноалкиловых
эфиров этиленгликоля общей формулы
ROCH2CH2OH.
Соединение
Молекулярная
масса
Температура
плавления, оС
Тип., оС
Плотность
Показатель
преломления
Метилцеллозольв
СH3OCH2CH2OH
76,09
-85,1
124,6
0,9646
1,4021
Этилцеллозольв
C2H5OCH2CН2OH
90,12
-70
135,6
0,9311
1,4076
Бутилцеллозольв
C4Н9OCH2CH2OH
118,18
-70
170,2
0,9022
1,4198
Гексилцеллозольв
C6Н13OCH2CH2OH
146,23
-50,1
208,1
0,9887
1,4290
Фенилцеллозольв
C6H5OCH2CH2OH
138,17
—
215
1,030
1,5386
2-Этилбутилцеллозольв
(С2Н5)2СНСН2ОСН2СН2ОН
146,23
-90
196,7
0,8954
1,4304
81







 chemistry
chemistry








