Similar presentations:
Спирты. Многоатомные спирты
1.
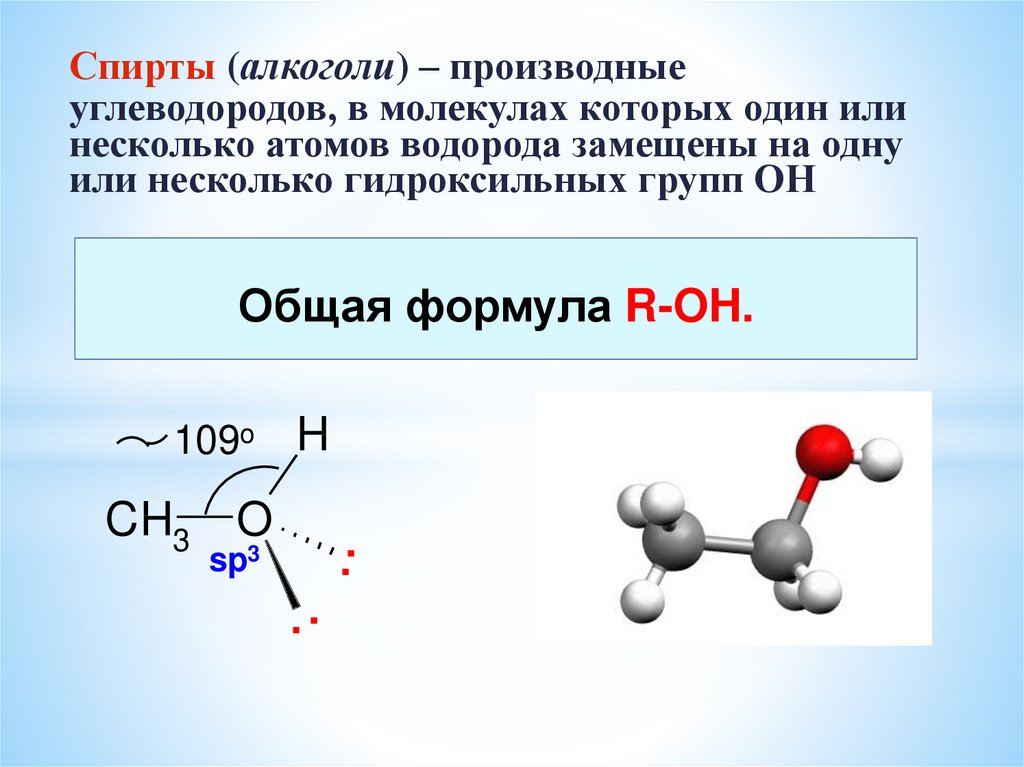
Спирты (алкоголи) – производныеуглеводородов, в молекулах которых один или
несколько атомов водорода замещены на одну
или несколько гидроксильных групп ОН
Общая формула R-OH.
109o
H
CH3 O
sp3
..
..
2.
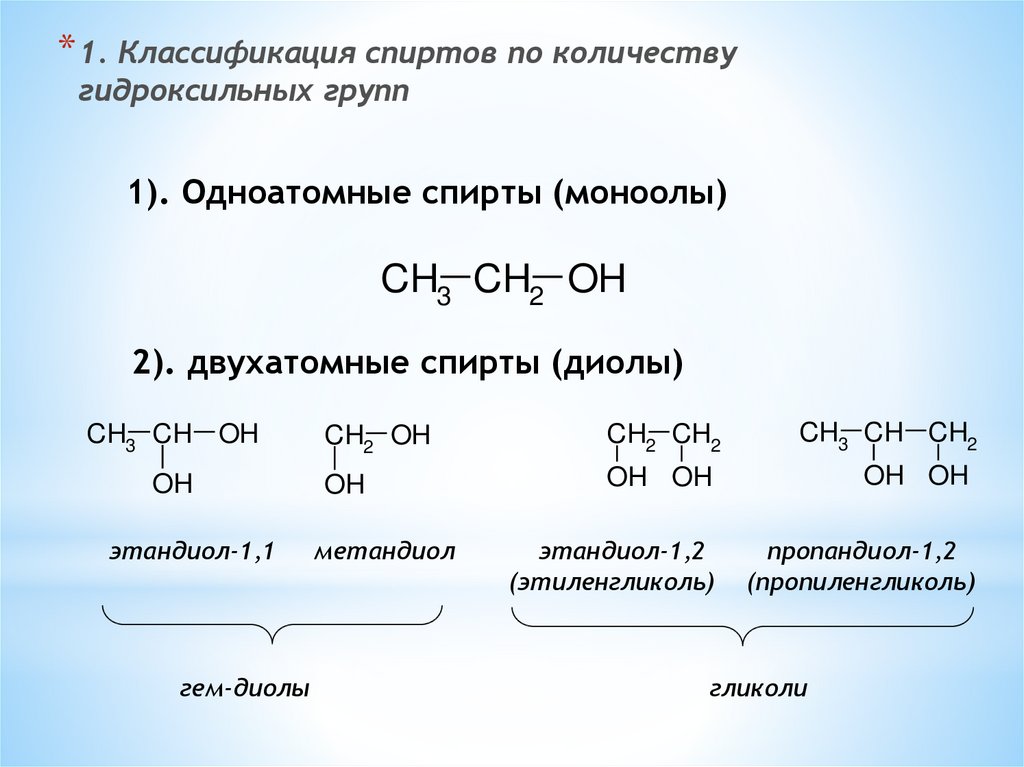
* 1. Классификация спиртов по количествугидроксильных групп
1). Одноатомные спирты (моноолы)
CH3 CH2 OH
2). двухатомные спирты (диолы)
CH3 CH OH
OH
этандиол-1,1
гем-диолы
CH3 CH CH2
CH2 OH
CH2 CH2
OH
OH OH
OH OH
этандиол-1,2
(этиленгликоль)
пропандиол-1,2
(пропиленгликоль)
метандиол
гликоли
3.
3). Многоатомные спиртыCH2 CH CH2
CH2 CH CH CH2
OH OH OH
OH OH OH OH
пропантриол-1,2,3
(глицерин)
бутантетраол-1,2,3,4
(эритрит)
4.
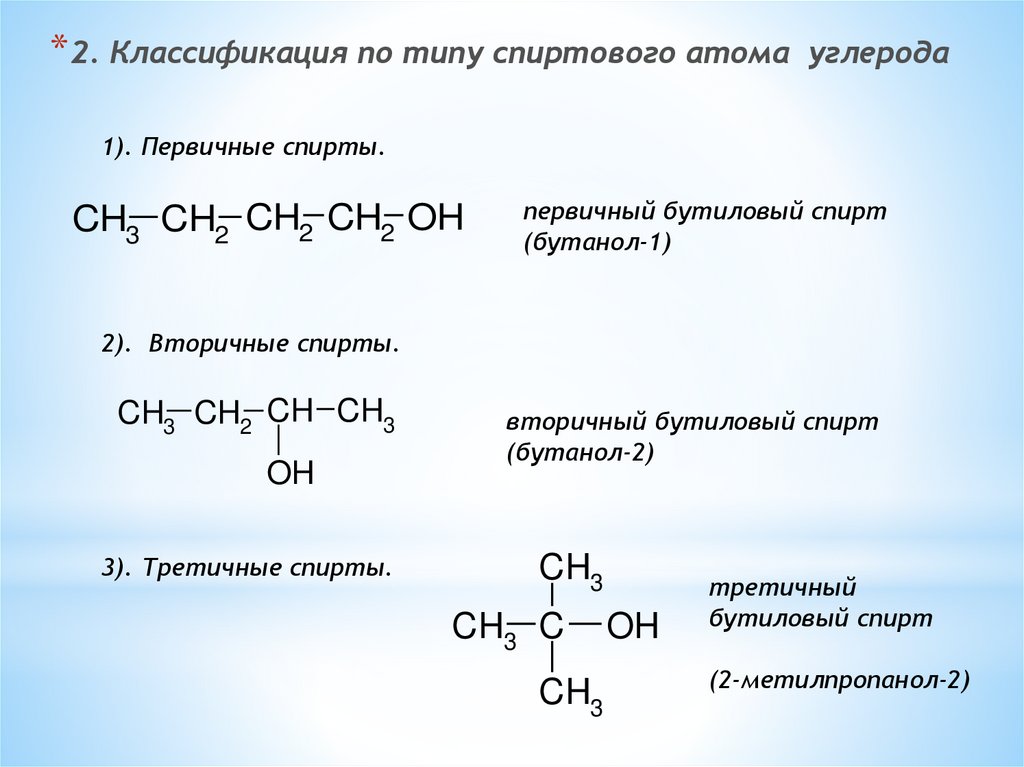
* 2. Классификация по типу спиртового атомауглерода
1). Первичные спирты.
CH3 CH2 CH2 CH2 OH
первичный бутиловый спирт
(бутанол-1)
2). Вторичные спирты.
CH3 CH2 CH CH3
OH
3). Третичные спирты.
вторичный бутиловый спирт
(бутанол-2)
CH3
CH3 C
CH3
OH
третичный
бутиловый спирт
(2-метилпропанол-2)
5.
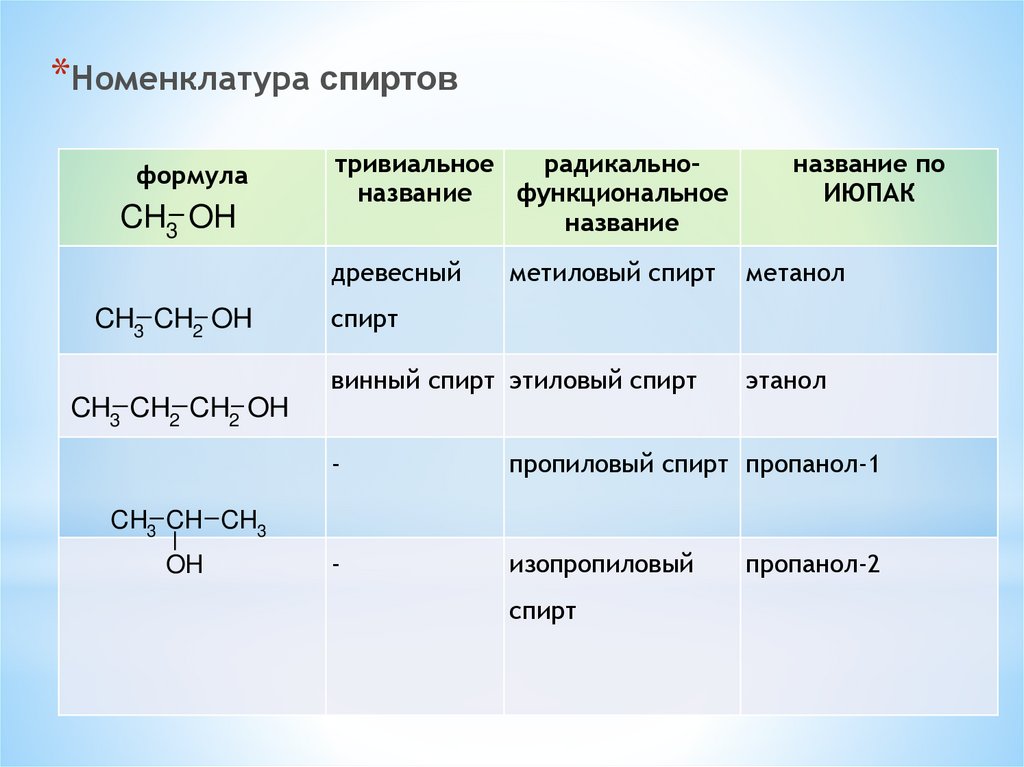
*Номенклатура спиртовформула
CH3 OH
тривиальное
радикальноназвание
функциональное
название
древесный
CH3 CH2 OH
метиловый спирт
название по
ИЮПАК
метанол
спирт
винный спирт этиловый спирт
этанол
CH3 CH2 CH2 OH
-
пропиловый спирт пропанол-1
-
изопропиловый
CH3 CH CH3
OH
спирт
пропанол-2
6.
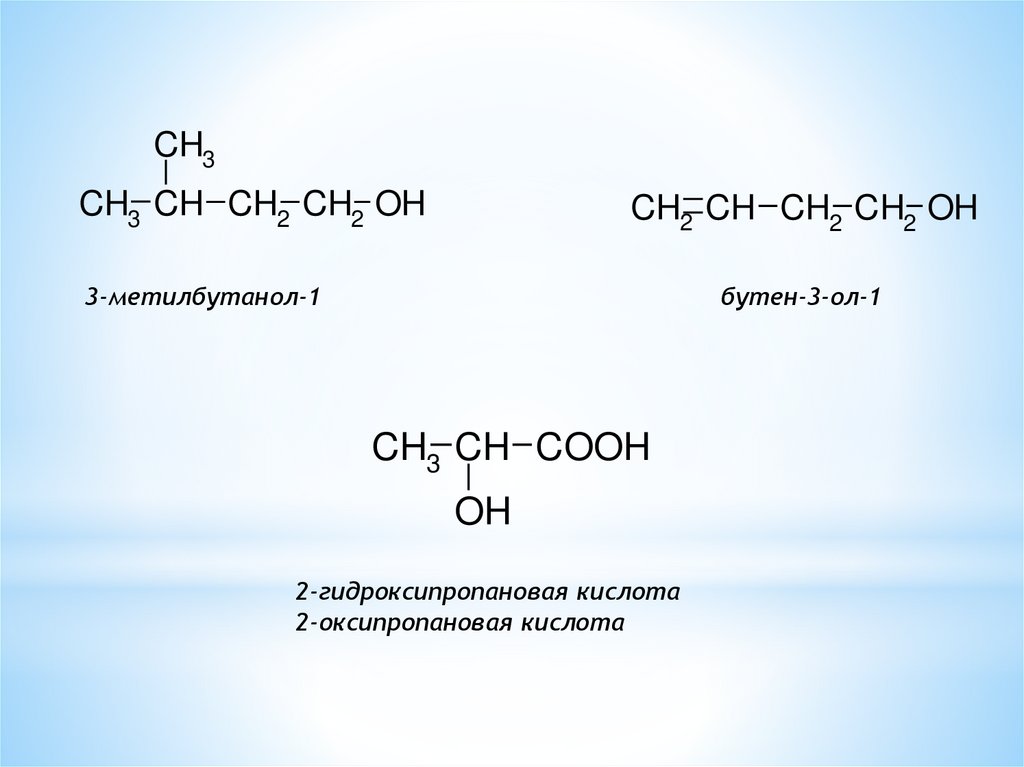
CH3CH3 CH CH2 CH2 OH
CH2 CH CH2 CH2 OH
3-метилбутанол-1
бутен-3-ол-1
CH3 CH COOH
OH
2-гидроксипропановая кислота
2-оксипропановая кислота
7.
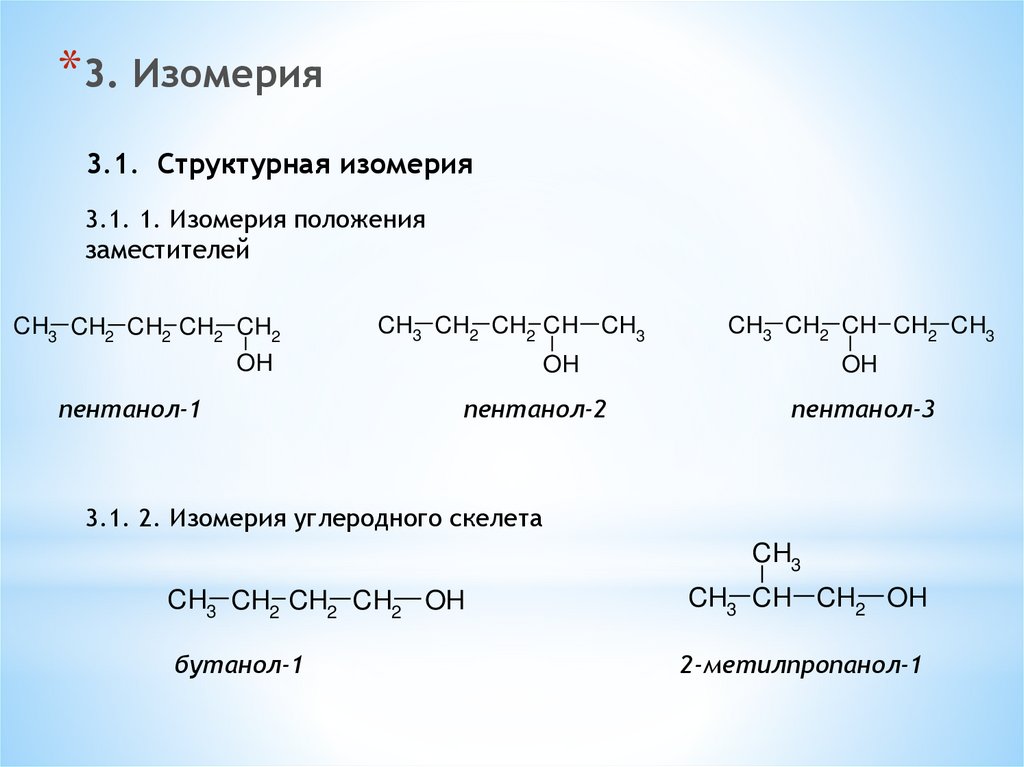
*3. Изомерия3.1. Cтруктурная изомерия
3.1. 1. Изомерия положения
заместителей
CH3 CH2 CH2 CH2 CH2
CH3 CH2 CH2 CH CH3
OH
пентанол-1
CH3 CH2 CH CH2 CH3
OH
OH
пентанол-2
пентанол-3
3.1. 2. Изомерия углеродного скелета
CH3
CH3 CH2 CH2 CH2 OH
бутанол-1
CH3 CH CH2 OH
2-метилпропанол-1
8.
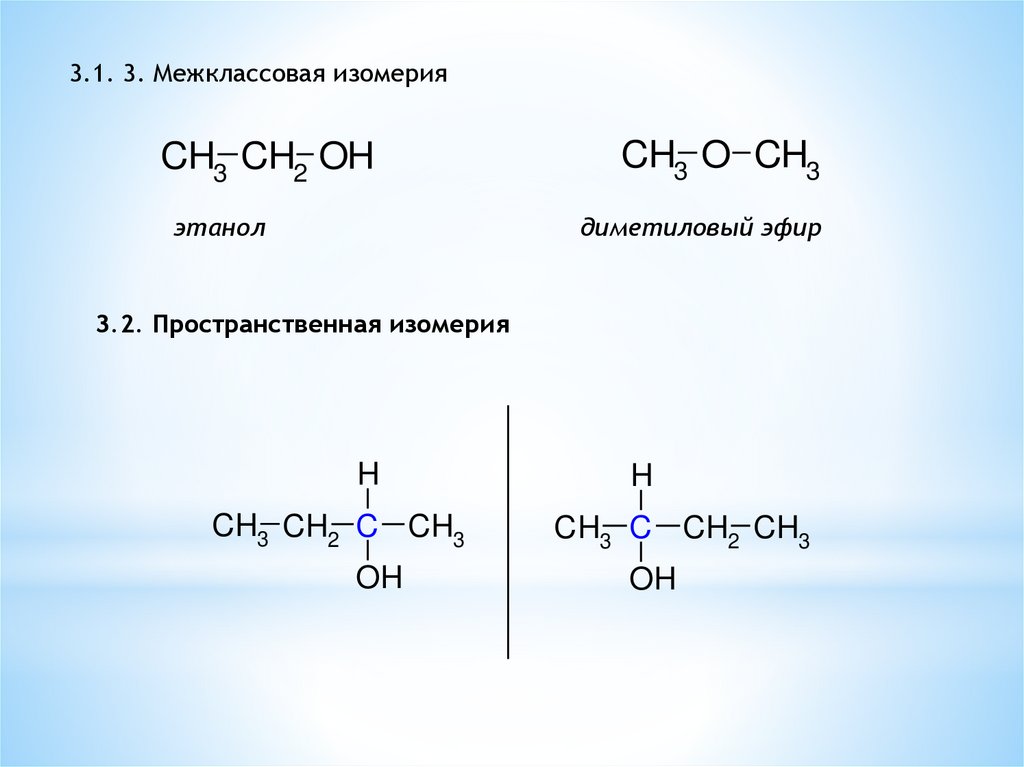
3.1. 3. Межклассовая изомерияCH3 CH2 OH
этанол
CH3 O CH3
диметиловый эфир
3.2. Пространственная изомерия
H
CH3 CH2 C CH3
OH
H
CH3 C CH2 CH3
OH
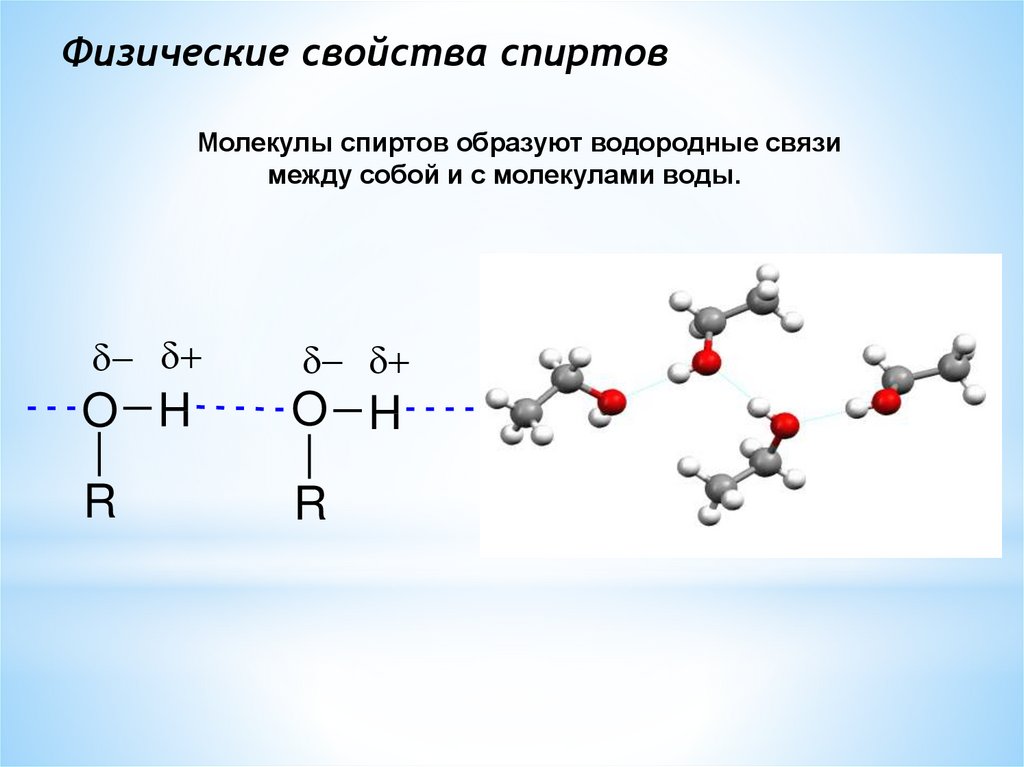
9. Физические свойства спиртов
Молекулы спиртов образуют водородные связимежду собой и с молекулами воды.
O H
O H
O H
O H
R
R
R
R
10.
Гидроксигруппа является сильно полярной группой, поэтомунизшие спирты растворяются в воде неограниченно:
метанол, этанол, пропанол смешиваются с водой во всех
отношениях.
*С увеличением количества атомов углерода спирты всё
более начинают напоминать углеводороды.
*Температуры кипения спиртов являются аномально
высокими по сравнению с температурами кипения
изомерных им простых эфиров.
спирт
формула
Т. кип. оС
Эфир
формула
Т. кип. оС
этиловый
C2H5OH
78
диметиловый
CH3OCH3
-24
бутиловый
C4H9OH
118
диэтиловый
C2H5OC2H5
+34.6
11.
Химические свойстваХимические свойства спиртов определяются гидроксильной
группой и строением связанного с ней радикала. Реакции, идущие с
участием гидроксильной группы, могут протекать с разрывом связи
О −Н или С − ОН.
1. Кислотные свойства спиртов
Спирты являются очень слабыми кислотами, даже вода является
более сильной кислотой, чем спирты.
Спирты взаимодействуют с активными Ме, их гидридами или амидами:
2 С2Н5ОН + 2Na → 2 С2Н5ОNa + H2
С2Н5ОН + NaН → С2Н5ONa + H2
С2Н5ОН + NaNH2 → 2 С2Н5ONa + NH3
С2Н5ОН + CH3–MgI → С2Н5OMgI +CH4
C2H5ONa + Н2О С2Н5ОН + NaOH
12.
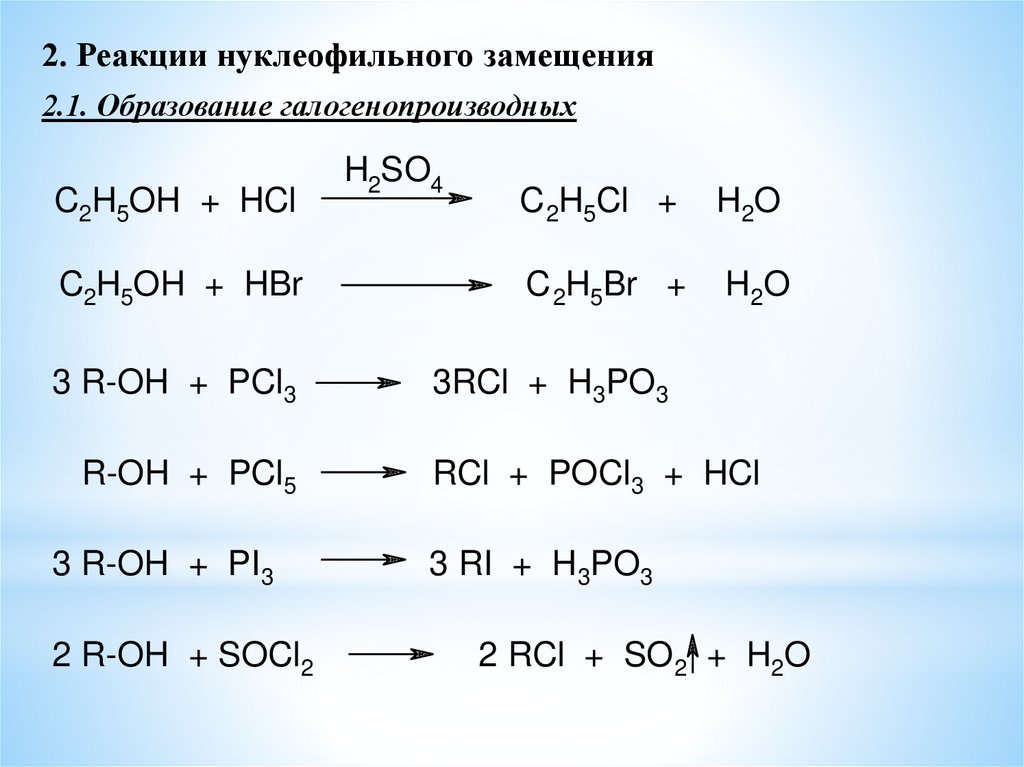
2. Реакции нуклеофильного замещения2.1. Образование галогенопроизводных
C2H5OH + HCl
C2H5OH + HBr
3 R-OH + PCl3
R-OH + PCl5
3 R-OH + PI3
2 R-OH + SOCl2
H2SO4
C 2H5Cl +
H2O
C 2H5Br +
H2O
3RCl + H3PO3
RCl + POCl3 + HCl
3 RI + H3PO3
2 RCl + SO 2 + H2O
13.
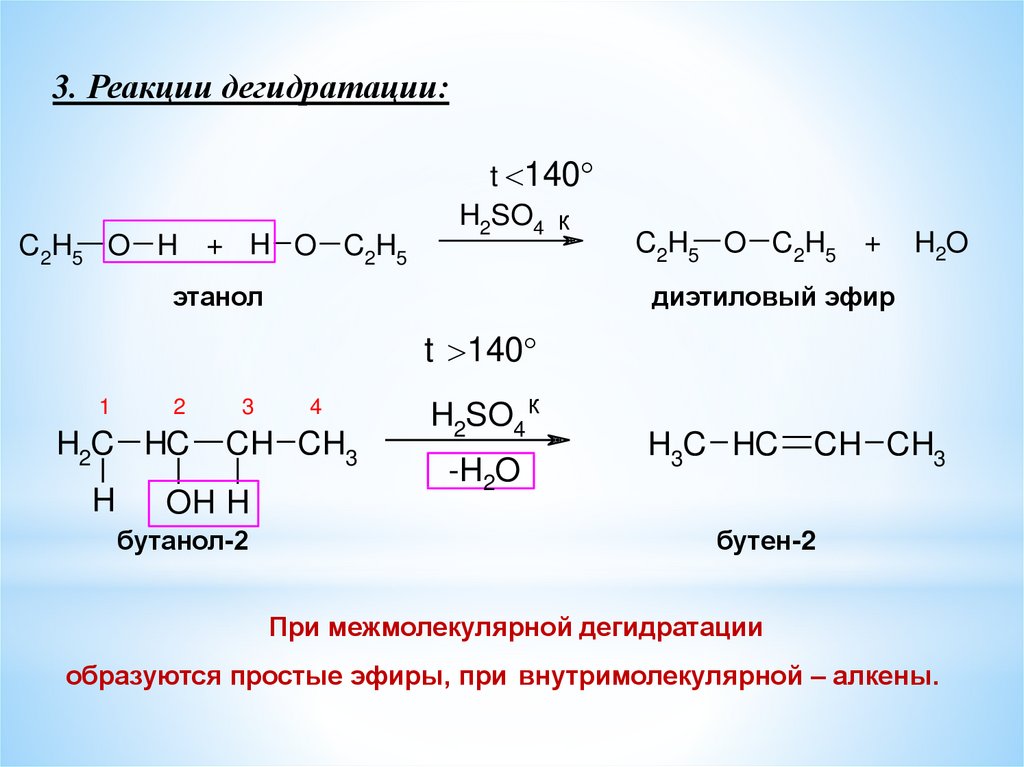
3. Реакции дегидратации:C2H5 O H + H O C2H5
t 140
H2SO4 к
этанол
C2H5 O C2H5 +
H2O
диэтиловый эфир
t 140
1
2
H2C HC
H
3
4
CH CH3
OH H
бутанол-2
H2SO4 к
-H2O
H3C HC
CH CH3
бутен-2
При межмолекулярной дегидратации
образуются простые эфиры, при внутримолекулярной – алкены.
14.
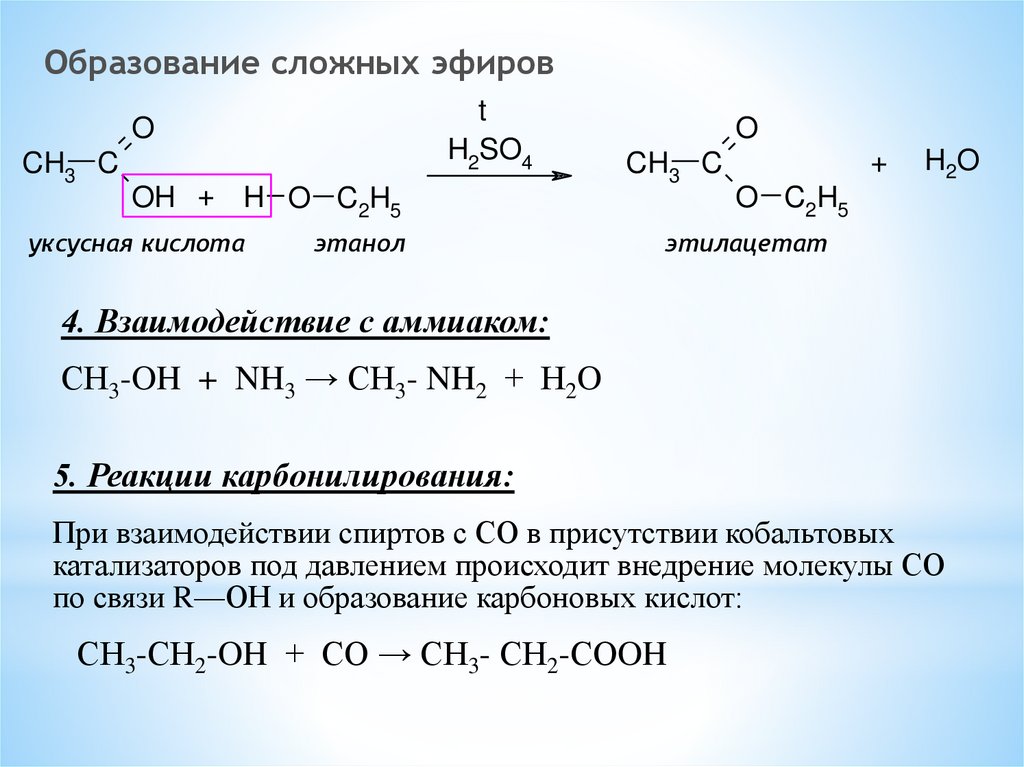
Образование сложных эфировt
H2SO4
O
CH3 C
OH + H O C2H5
уксусная кислота
этанол
O
CH3 C
+
H2O
O C2H5
этилацетат
4. Взаимодействие с аммиаком:
СН3-OH + NH3 → СН3- NH2 + Н2O
5. Реакции карбонилирования:
При взаимодействии спиртов с СО в присутствии кобальтовых
катализаторов под давлением происходит внедрение молекулы СО
по связи R—ОН и образование карбоновых кислот:
СН3-СН2-OH + СО → СН3- СН2-СОOH
15.
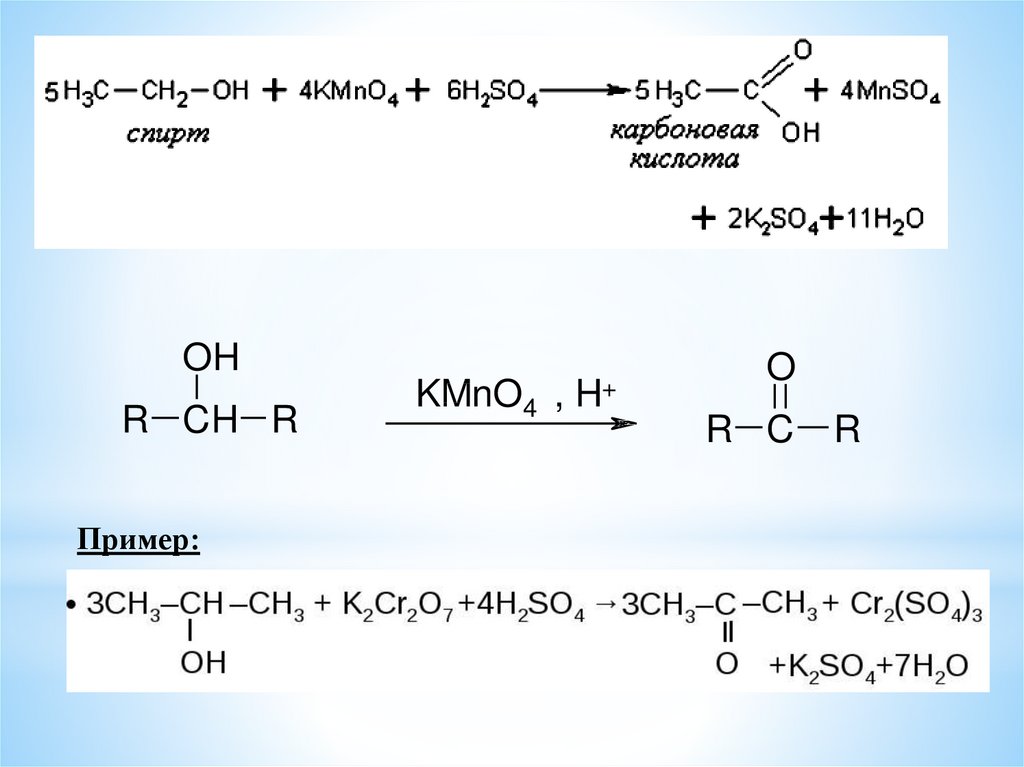
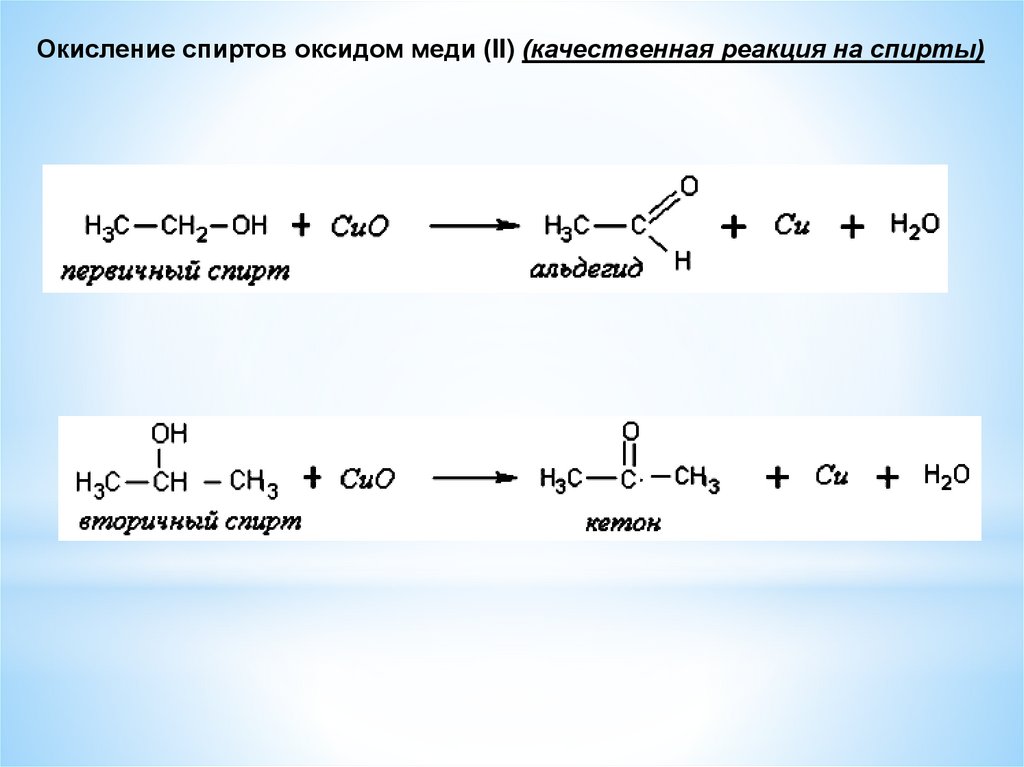
*6. Реакции окисления спиртов* Мягкие окислители окисляют первичные спирты в альдегиды, а
вторичные спирты в кетоны.
* В жёстких условиях окисление идёт до карбоновых кислот.
* Третичные спирты окисляются в жёстких условиях с разрывом
связи C-C
R CH2 OH
Пример:
KMnO4 , H+
O
R C
H
KMnO4 , H+
O
R C
OH
16.
OHR CH R
Пример:
KMnO4 ,
H+
O
R C
R
17.
Третичные спирты наиболее стойки к действию окислителей.Углеродный атом, связанный с гидроксилом, у третичных спиртов
не содержит ни одного водородного атома, поэтому при их
окислении (под действием энергичных окислителей или высокой
температуры) происходит разрушение молекулы с образованием
смеси кислот и кетонов.
18.
Окисление спиртов оксидом меди (II) (качественная реакция на спирты)19.
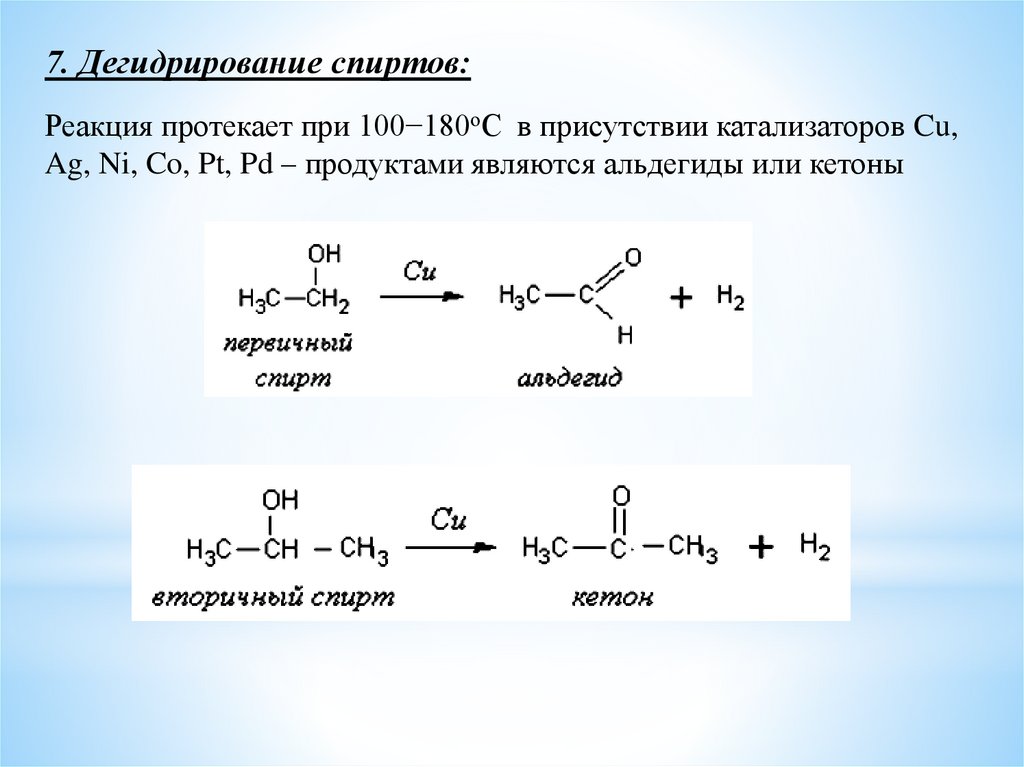
7. Дегидрирование спиртов:Реакция протекает при 100−180оС в присутствии катализаторов Cu,
Ag, Ni, Co, Pt, Pd – продуктами являются альдегиды или кетоны
20.
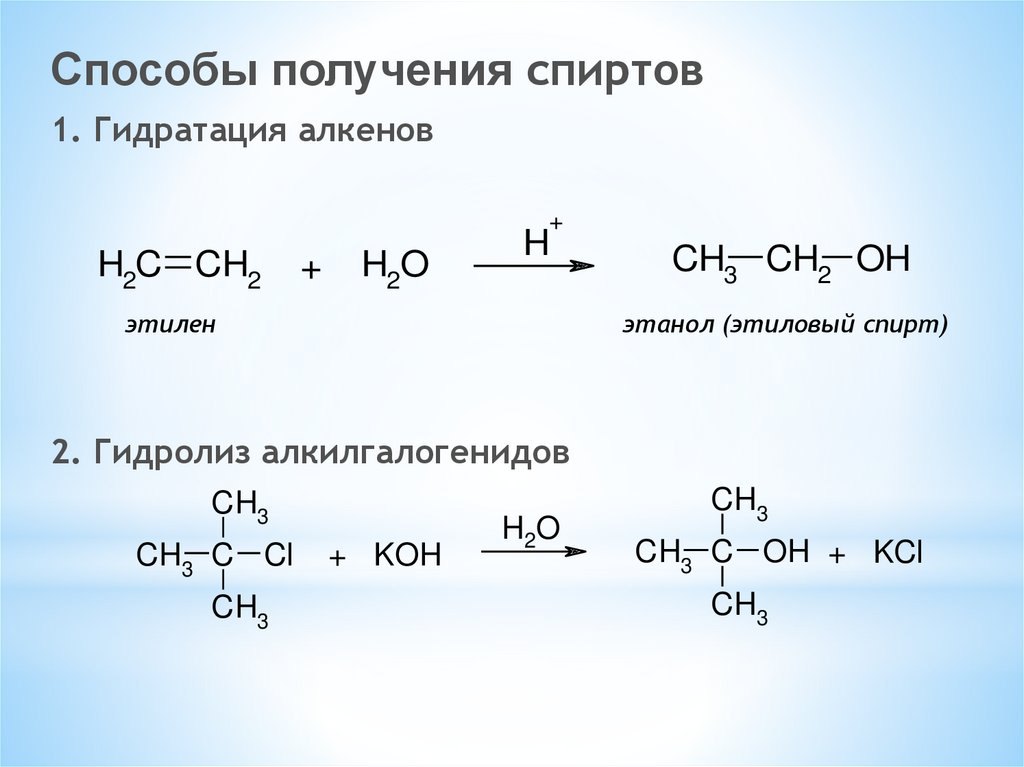
Способы получения спиртов1. Гидратация алкенов
+
H2C CH2
+
H2O
H
этилен
CH3 CH2 OH
этанол (этиловый спирт)
2. Гидролиз алкилгалогенидов
CH3
CH3 C Cl
CH3
+ KOH
H2O
CH3
CH3 C OH + KCl
CH3
21.
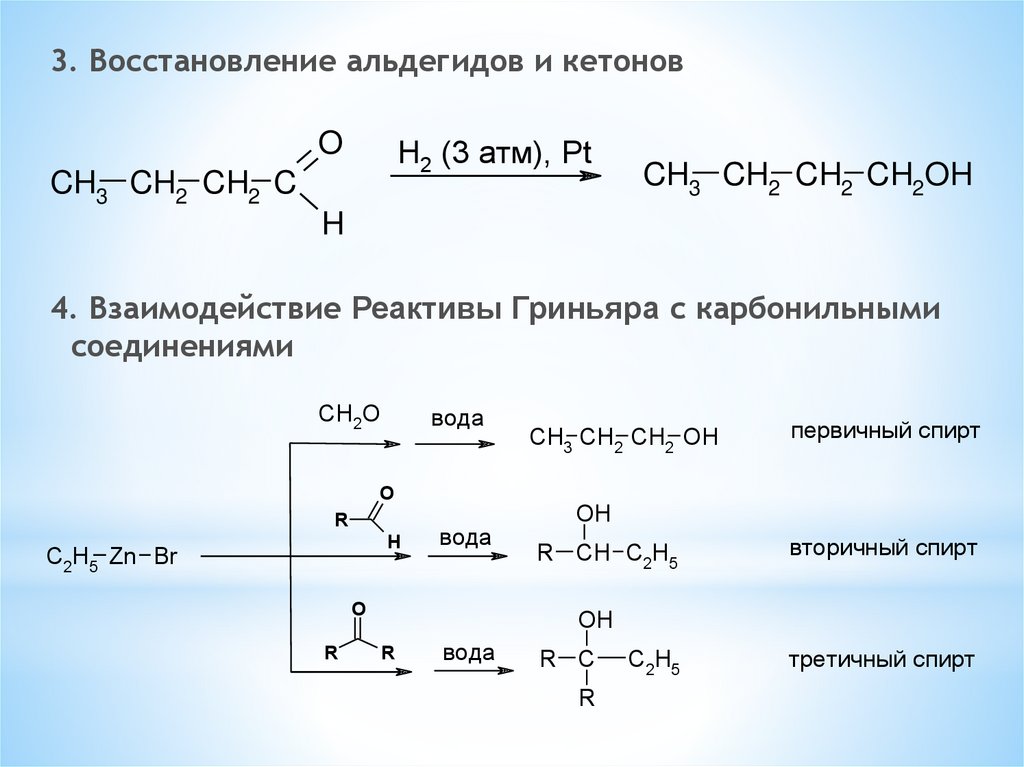
3. Восстановление альдегидов и кетоновO
H2 (3 атм), Pt
CH3 CH2 CH2 C
CH3 CH2 CH2 CH2OH
H
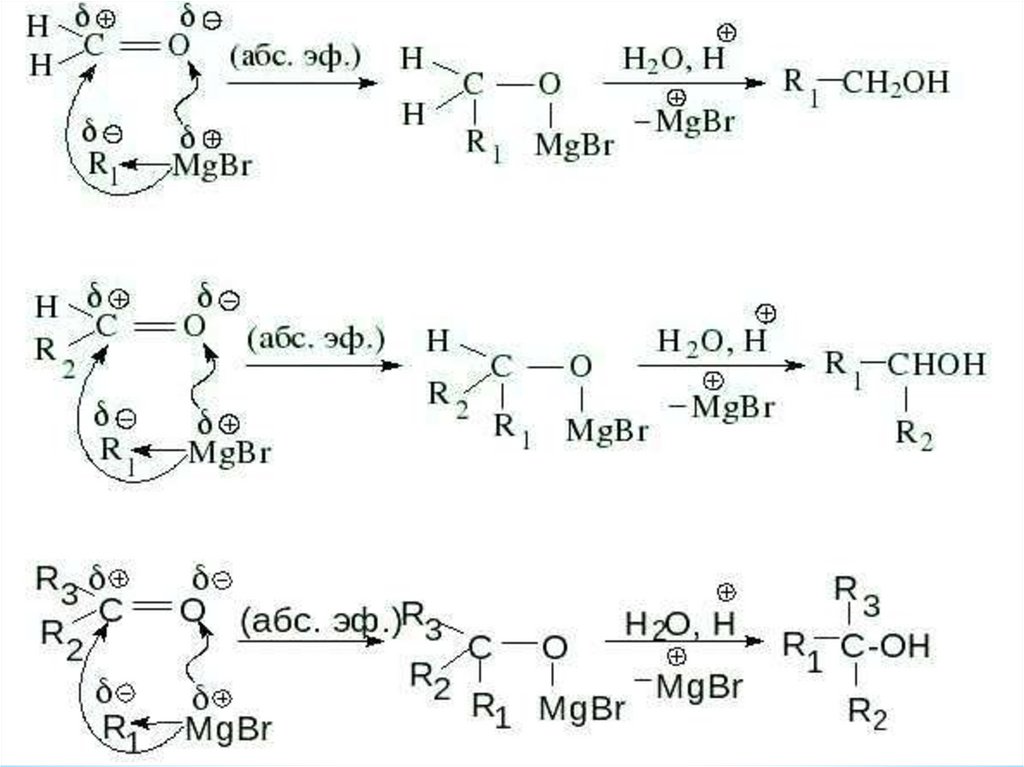
4. Взаимодействие Реактивы Гриньяра с карбонильными
соединениями
CH2O
вода
O
R
H
C2H5 Zn Br
вода
O
R
CH3 CH2 CH2 OH
пeрвичный спирт
OH
R CH C2H5
вторичный спирт
OH
R
вода
R C
R
C2H5
трeтичный спирт
22.
23.
5. Промышленное получение спиртовДо 1925 года метанол получали пиролизом древесины. В
настоящее время его получают присоединением водорода к
угарному газу (Баденская фабрика; Патар). Для проведения
процесса требуются высокие температуры (около 450оС),
давление (200 атм) и катализатор (ZnO, Cr2O3) :
CO + 3 H2
CH3OH
6. Ферментативное брожение глюкоза
C6H12O6
2 C2H5OH + 2 CO2
24.
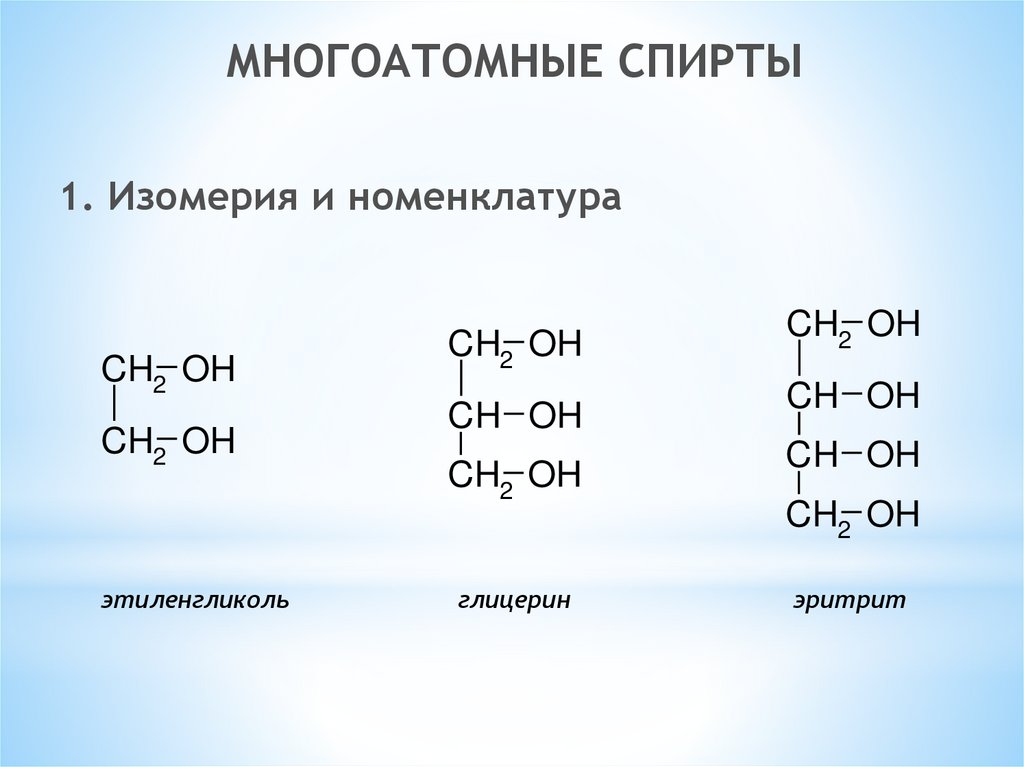
МНОГОАТОМНЫЕ СПИРТЫ1. Изомерия и номенклатура
CH2 OH
CH2 OH
этиленгликоль
CH2 OH
CH OH
CH2 OH
глицерин
CH2 OH
CH OH
CH OH
CH2 OH
эритрит
25.
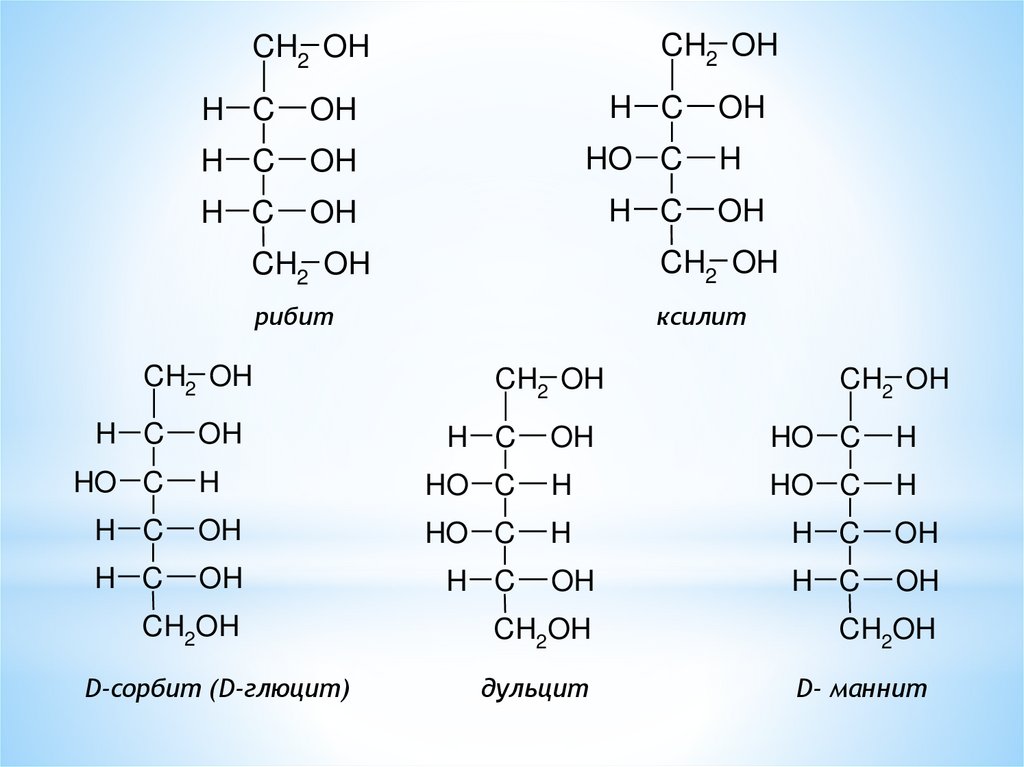
CH2 OHCH2 OH
H C
OH
H C
H C
OH
HO C
H C
OH
H C
HO C
H
OH
CH2 OH
CH2 OH
рибит
ксилит
CH2 OH
H C
OH
OH
CH2 OH
H C
CH2 OH
OH
HO C
H
H
H
HO C
H
HO C
H C
OH
HO C
H
H C
OH
H C
OH
H C
OH
H C
OH
CH2OH
D-сорбит (D-глюцит)
CH2OH
дульцит
CH2OH
D- маннит
26.
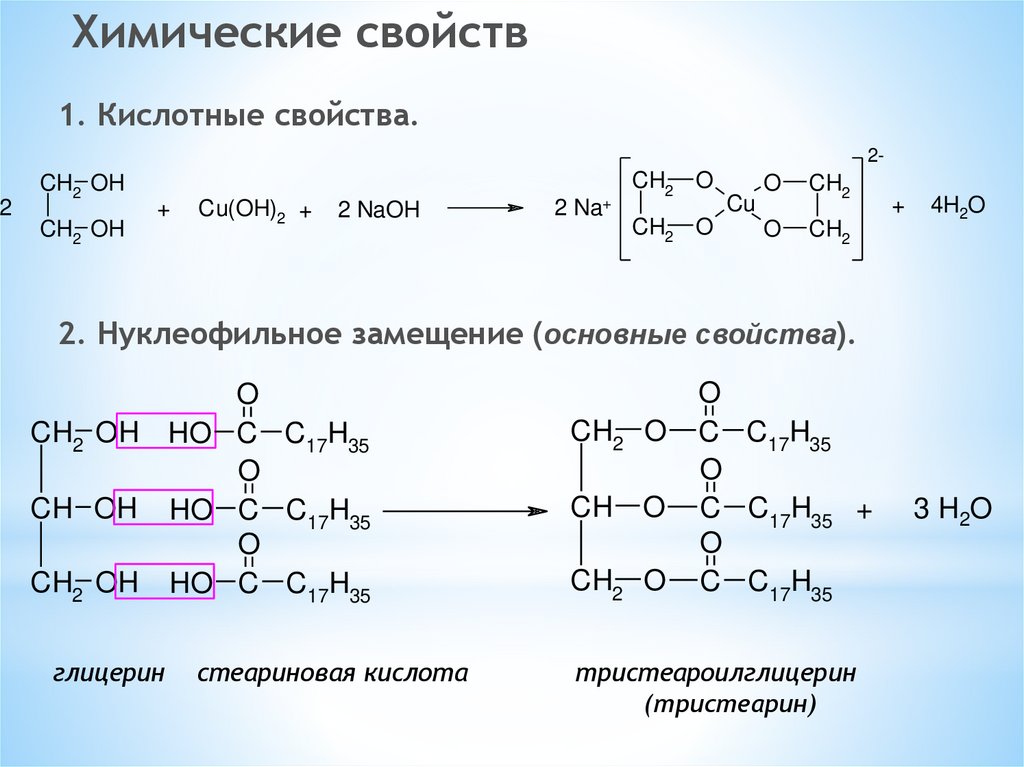
Химические свойств1. Кислотные свойства.
2-
2
CH2 OH
CH2 OH
+
Cu(OH)2 +
2 NaOH
2
Na+
CH2 O
CH2 O
Cu
O
O
CH2
CH2
+
4H2O
2. Нуклеофильное замещение (основные свойства).
CH2 OH
CH OH
CH2 OH
глицерин
O
HO C C17H35
O
HO C C17H35
O
HO C C17H35
стеариновая кислота
CH2 O
CH
O
CH2 O
O
C C17H35
O
C C17H35 +
O
C C17H35
тристеароилглицерин
(тристеарин)
3 H2O
27.
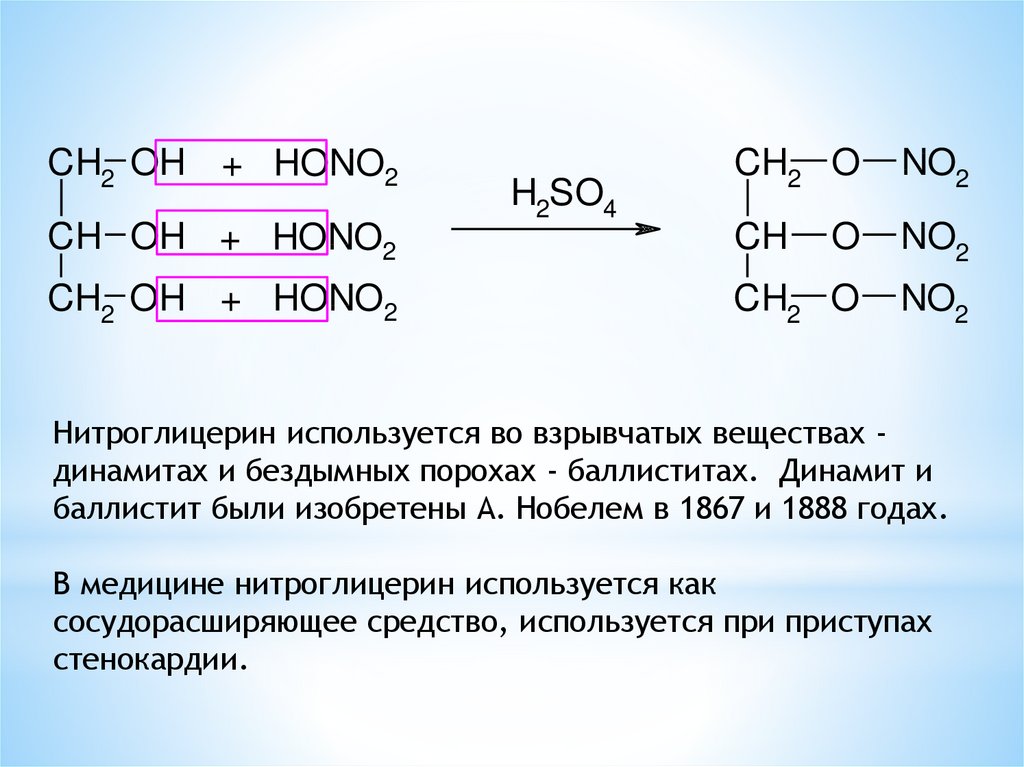
CH2 OH + HONO2CH2 O
NO2
CH OH + HONO2
CH
O
NO2
CH2 OH + HONO2
CH2 O
NO2
H2SO4
Нитроглицерин используется во взрывчатых веществах динамитах и бездымных порохах - баллиститах. Динамит и
баллистит были изобретены А. Нобелем в 1867 и 1888 годах.
В медицине нитроглицерин используется как
сосудорасширяющее средство, используется при приступах
стенокардии.
28.
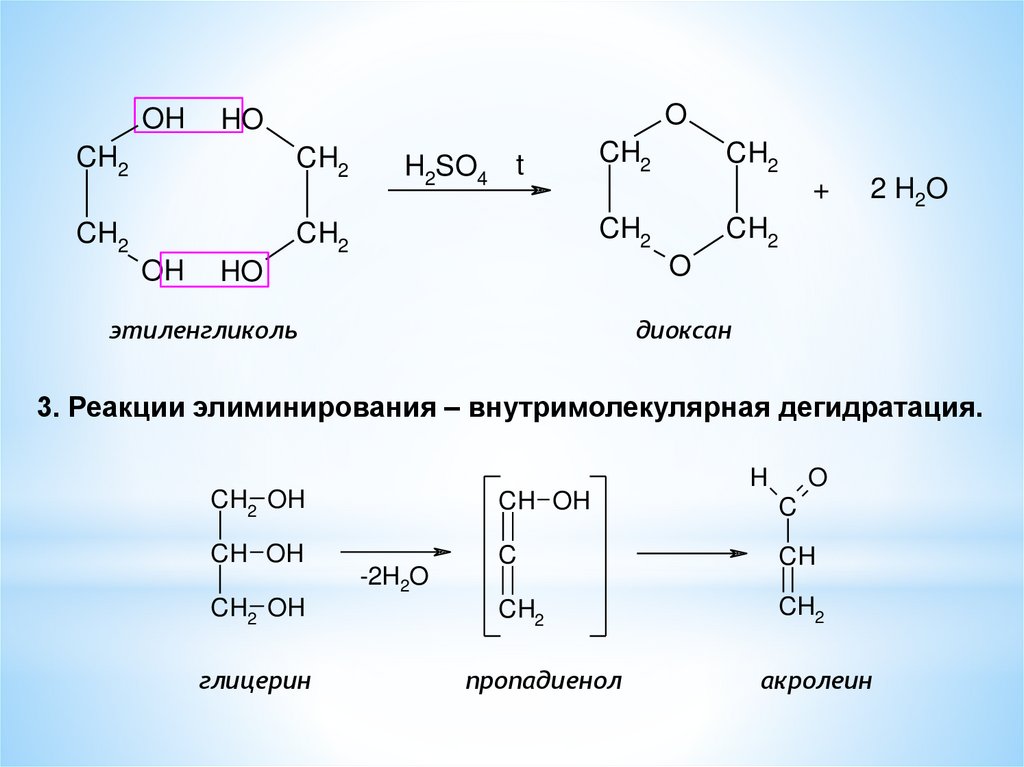
OHO
HO
CH2
CH2
CH2
CH2
OH
H2SO4
t
CH2
CH2
+
CH2
2 H2O
CH2
O
HO
этиленгликоль
диоксан
3. Реакции элиминирования – внутримолекулярная дегидратация.
H
O
CH2 OH
CH OH
C
CH OH
C
CH
CH2
CH2
CH2 OH
глицерин
-2H2O
пропадиенол
акролеин
29.
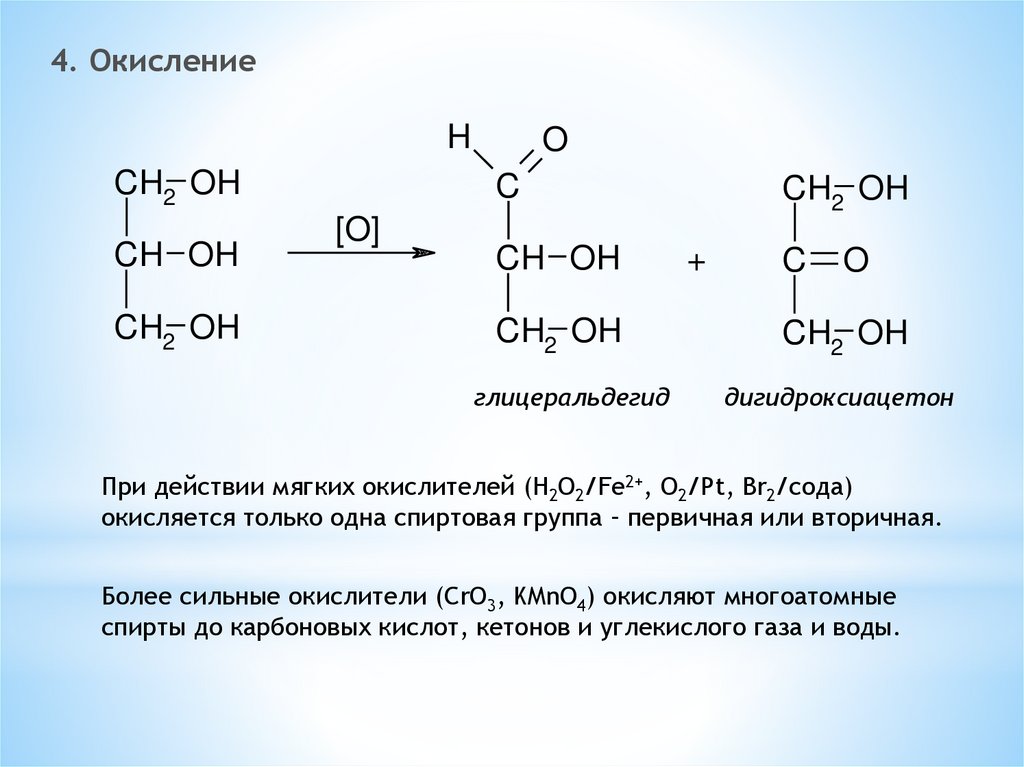
4. ОкислениеH
CH2 OH
CH OH
CH2 OH
O
C
[O]
CH OH
CH2 OH
глицеральдегид
CH2 OH
+
C
O
CH2 OH
дигидроксиацетон
При действии мягких окислителей (H2O2/Fe2+, O2/Pt, Br2/сода)
окисляется только одна спиртовая группа – первичная или вторичная.
Более сильные окислители (CrO3, KMnO4) окисляют многоатомные
спирты до карбоновых кислот, кетонов и углекислого газа и воды.
30.
C OHHIO4
C OH
-HIO3
C O
+
C O
периодатное окисление –
окисление йодной кислотой
31.
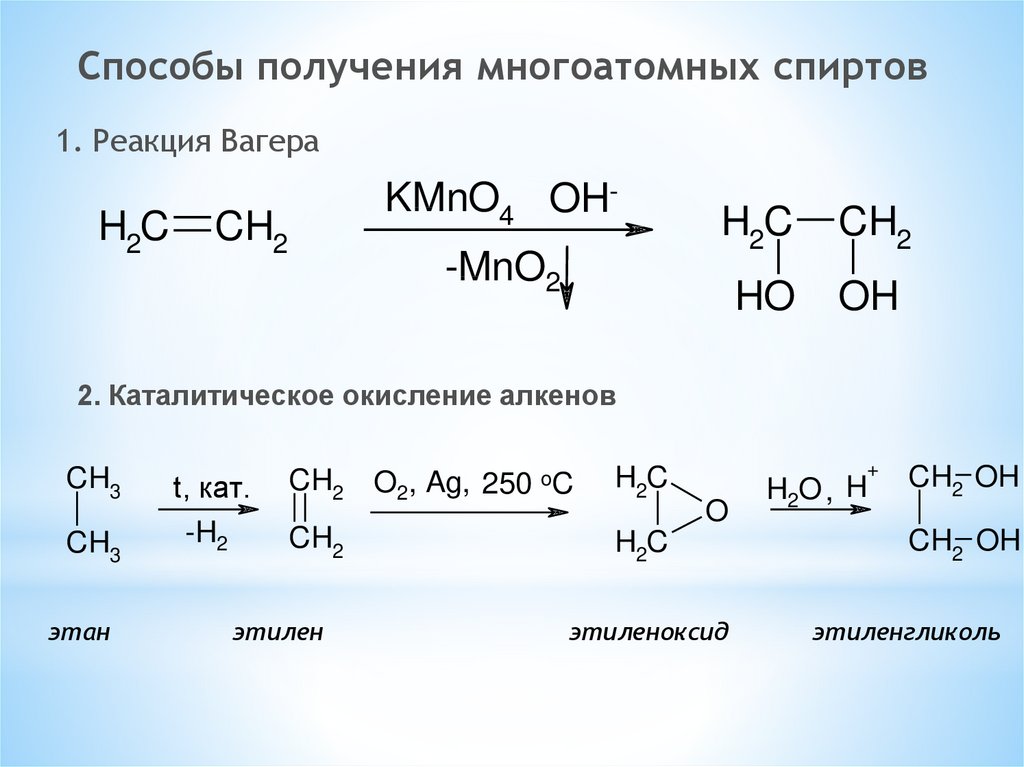
Способы получения многоатомных спиртов1. Реакция Вагера
H2C
KMnO4 OH-
CH2
-MnO2
H2C
CH2
HO
OH
2. Каталитическое окисление алкенов
CH3
t, кат.
CH2
CH3
-H2
CH2
этан
этилен
O2, Ag, 250 oC
H2C
+
O
H2C
этиленоксид
H2O , H
CH2 OH
CH2 OH
этиленгликоль
32.
3. Гидролиз жировCH2 O
CH
O
CH2 O
O
C C17H35
O
C C17H35 +
O
C C17H35
CH2 OH
CH OH
3 H2O
O
+
C17H35 C OH
CH2 OH
жир (тристеароилглицерин)
глицерин
стеариновая кислота
4. Получение глицерина в промышленности
CH2
CH
CH3
CH2
Cl2, 500oC
CH
CH2 Cl
CH2 Cl
HOCl
CH OH
CH2 Cl
гидролиз
CH2 OH
CH OH
CH2 OH
33.
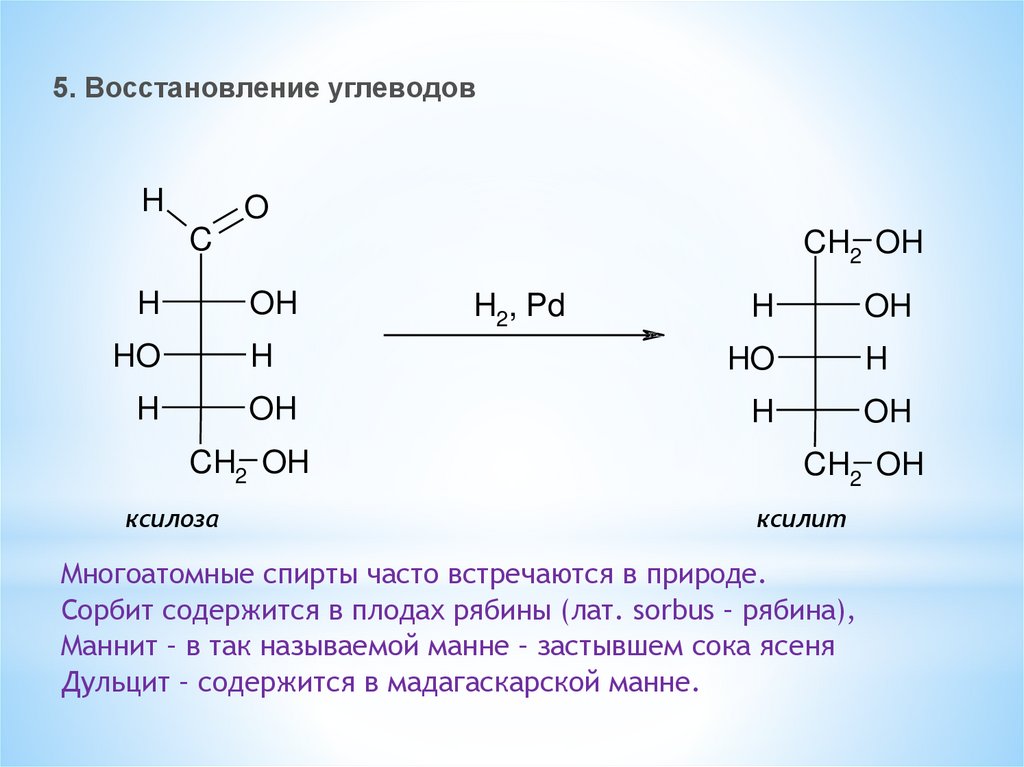
5. Восстановление углеводовH
O
C
H
CH2 OH
OH
HO
H
H
OH
CH2 OH
ксилоза
H2, Pd
H
OH
HO
H
H
OH
CH2 OH
ксилит
Многоатомные спирты часто встречаются в природе.
Сорбит содержится в плодах рябины (лат. sorbus – рябина),
Маннит – в так называемой манне – застывшем сока ясеня
Дульцит – содержится в мадагаскарской манне.








 chemistry
chemistry








