Similar presentations:
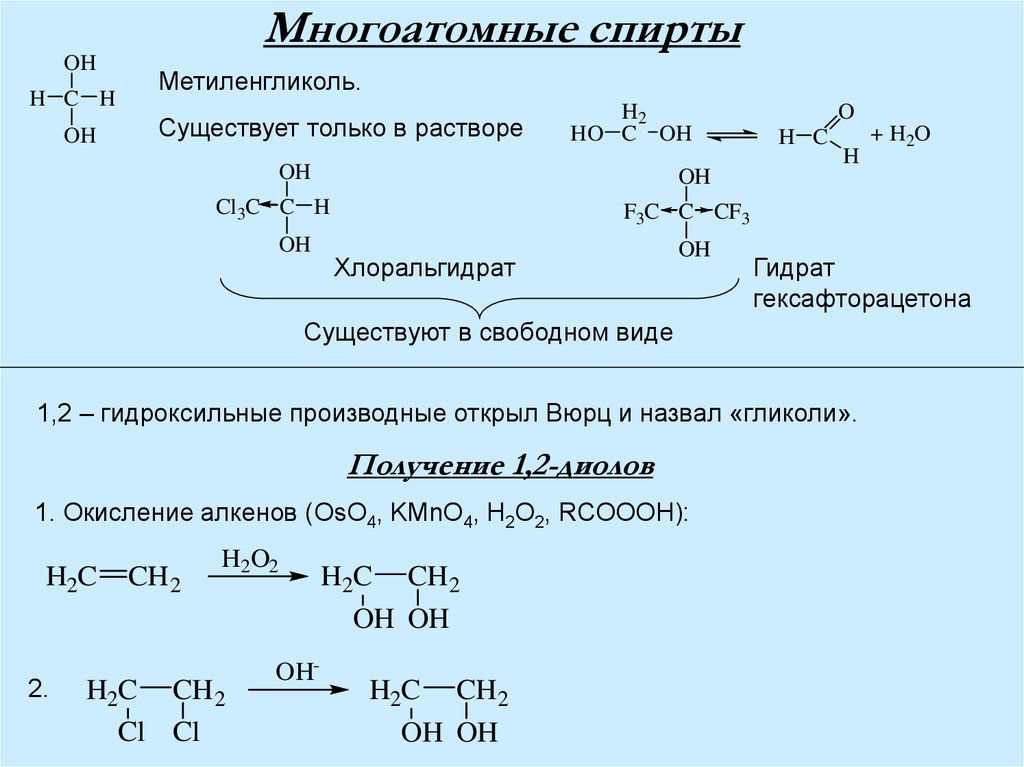
Многоатомные спирты
1.
Многоатомные спиртыOH
H C H
OH
Метиленгликоль.
Существует только в растворе
H2
HO C OH
OH
H C
H
F3C C CF3
Хлоральгидрат
OH
Гидрат
гексафторацетона
Существуют в свободном виде
1,2 – гидроксильные производные открыл Вюрц и назвал «гликоли».
Получение 1,2-диолов
1. Окисление алкенов (OsO4, KMnO4, H2O2, RCOOOH):
H2C
2.
CH2
H2O2
H2C CH 2
Cl Cl
OH-
+ H2O
OH
Cl3C C H
OH
O
H2C CH 2
OH OH
H2C CH 2
OH OH
2.
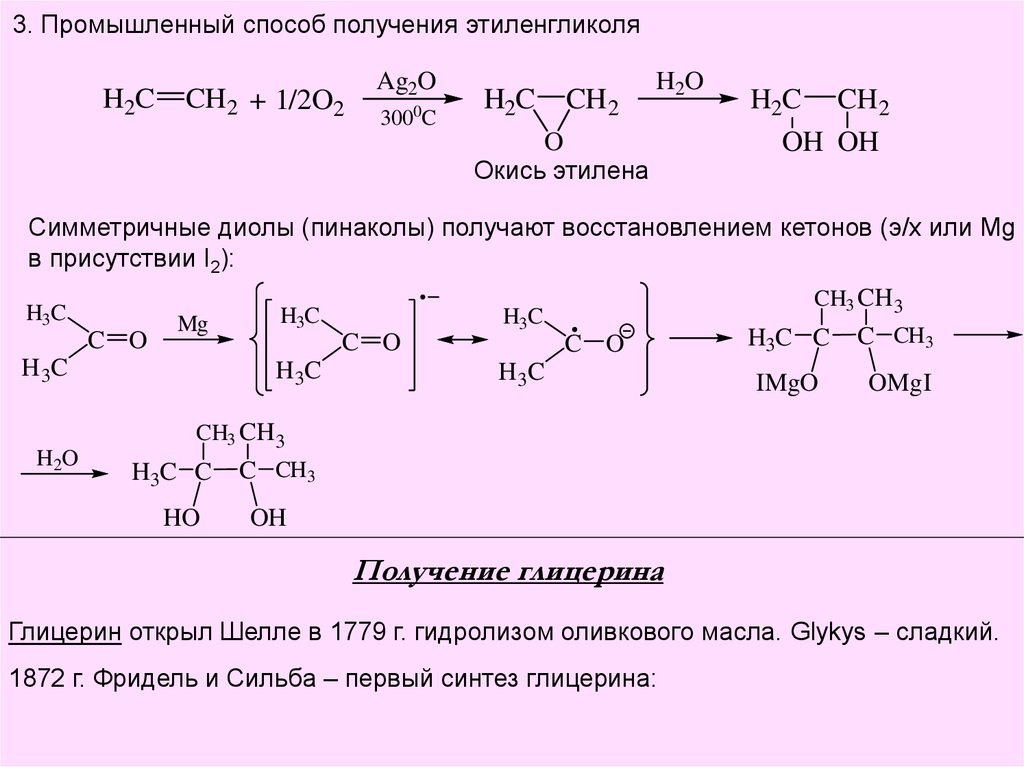
3. Промышленный способ получения этиленгликоляH2C
CH2 + 1/2O2
Ag2O
3000C
H2C
CH2
H2O
O
Окись этилена
H2C CH 2
OH OH
Симметричные диолы (пинаколы) получают восстановлением кетонов (э/х или Mg
в присутствии I2):
H3C
C O
Mg
H 3C
H2O
H3C
H3C
C O
H 3C
CH3 CH 3
C O
H 3C
H3C C
C CH3
IMgO
OMgI
CH3 CH 3
H3C C
HO
C CH3
OH
Получение глицерина
Глицерин открыл Шелле в 1779 г. гидролизом оливкового масла. Glykys – сладкий.
1872 г. Фридель и Сильба – первый синтез глицерина:
3.
HCl2,
H2C C CH 3
Cl
ClH2C C CH 3
H
hν
OH
Cl
H2O; OHHOH 2C C CH 2OH
ClH2C C CH2Cl
H
H
1938 г. фирма Shell Chemical (из нефтяного сырья):
CH3
HC
CH2Cl
Cl2, 400-5000C
HC
CH2
CH2
Пропилен
Хлористый
аллил
CH2OH
OH-
HC
CH2OH
CH2OH
HOCl
CH2
CHOH
NaOH
CH2Cl
Аллиловый
спирт
Свойства многоатомных спиртов
tкип этиленгликоля = 197,60С, tпл = -12,70С, токсичен
tкип глицерина = 2900С, tпл = 17,90С
Высокая температура кипения – результат образования внутри и
межмолекулярных водородных связей.
O
H 2C OH
HO CH2
H 2C
CH2
H2SO4 (конц.)
+
- 2H2O
H 2C OH
HO CH 2
1,4-диоксан
H 2C
CH 2
O
CHOH
CH2OH
4.
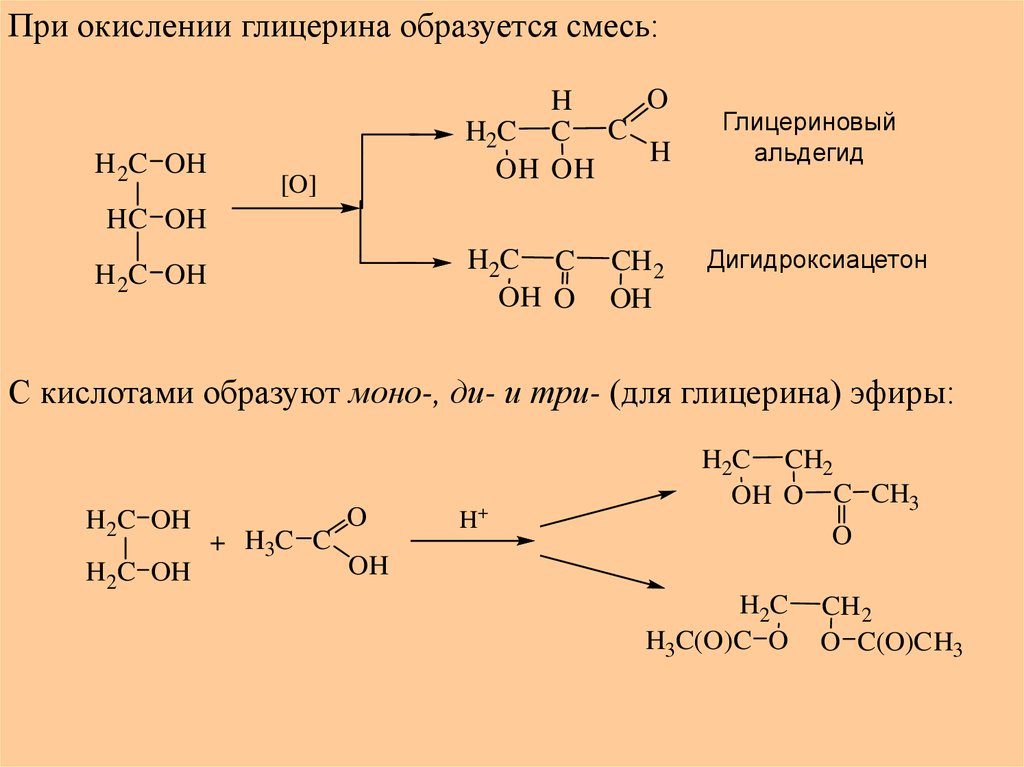
При окислении глицерина образуется смесь:H 2C OH
O
H
H2C C C
H
OH OH
[O]
Глицериновый
альдегид
HC OH
H2C C
OH O
H 2C OH
CH2
OH
Дигидроксиацетон
С кислотами образуют моно-, ди- и три- (для глицерина) эфиры:
H2C OH
H2C OH
+ H3C C
O
H+
H2C CH2
OH O C CH3
O
OH
H2C
H3C(O)C O
CH 2
O C(O)CH3
5.
Для 1,2-диолов характерно образованиеC OH
HO C
+ B(OH)3 +
C OH
HO C
H+
C
O
C
O
B
O
C
O
C
Сильная кислота –
можно титровать
5. Эфиры полиолов с азотной кислотой – нитроглицерин и нитрогликоль –
взрывчатые вещества. В 1847 г. Асканио Собреро впервые получил нитроглицерин.
А. Нобель начал производство:
CH2OH
CHOH + 3HONO2
CH2OH
CH2ONO2
H2SO4, 94%
10-200C
CHONO2
CH2ONO2
1856 г. - динамит (Нобель); нитроглицерин + кизельгур SiO2 (1:3) + NaNO3 или
NH4NO3 – для улучшения сгорания.
1863 г. – применение детонаторов:
C N O Hg O N C
Фульминат ртути
N N N Pb N N N
Азид свинца
6.
Взрыв нитроглицеринаCH2NO 2
3/2N2 + 3CO2 + 5/2H2O + 1/2O2
CHNO 2
CH2NO2
Взрывная волна
Качественная реакция на многоатомные спирты
CH 2OH
H2C O
O
2
+ Cu(OH)2 + 2NaOH
Cu
CH 2OH
H2C O
O
Пинаколиновая перегруппировка:
CH3 CH3
H 3C C
C CH3
OH OH
H3C
H 3C
H3
C
C
C CH3
OH
H
CH3 CH3
+
H 3C C
C CH3
-H2O
H3C
+ 2Na +4H2O
CH2
H3C
CH3
C
H 3C
C CH
3
OH
CH 3
CH 3
H 3C C
CH2
Темно-синий
OH
H2O
2-
C CH3
OH
-H+
H 3C C
CH 3
CH3
C
O
пинаколин




 chemistry
chemistry