Similar presentations:
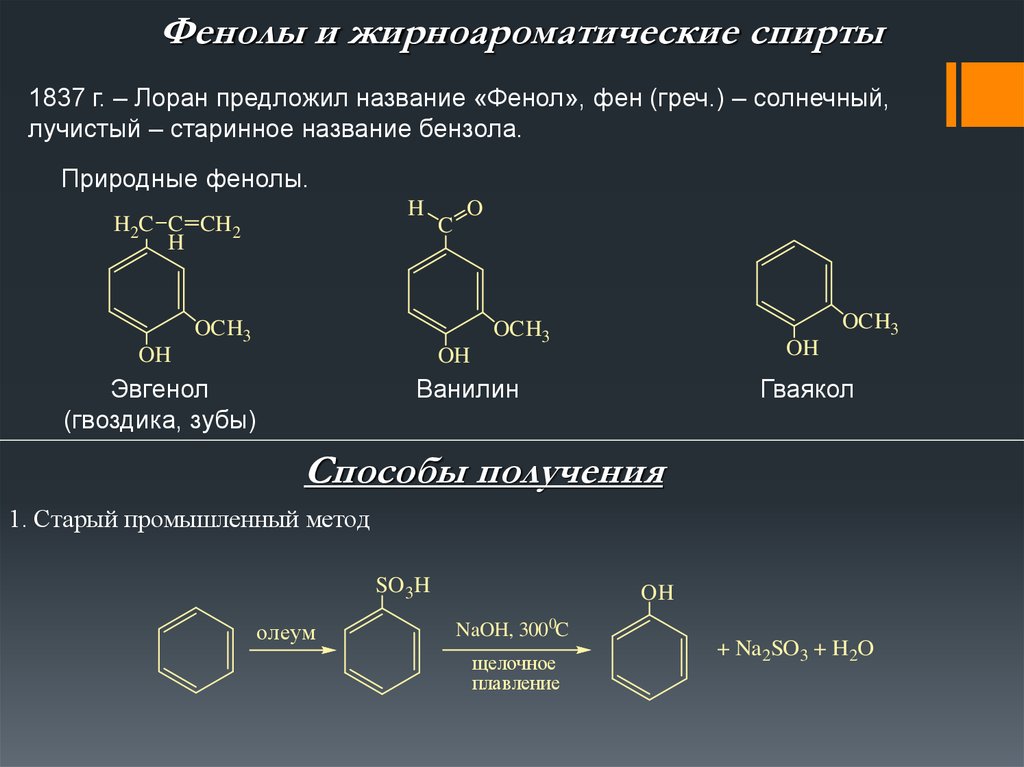
Фенолы и жирноароматические спирты
1.
Фенолы и жирноароматические спирты1837 г. – Лоран предложил название «Фенол», фен (греч.) – солнечный,
лучистый – старинное название бензола.
Природные фенолы.
H
H2C C CH 2
H
C
O
OCH3
OCH3
OCH3
OH
OH
OH
Эвгенол
(гвоздика, зубы)
Ванилин
Гваякол
Способы получения
1. Старый промышленный метод
SO 3H
олеум
OH
NaOH, 3000C
щелочное
плавление
+ Na2SO3 + H2O
2.
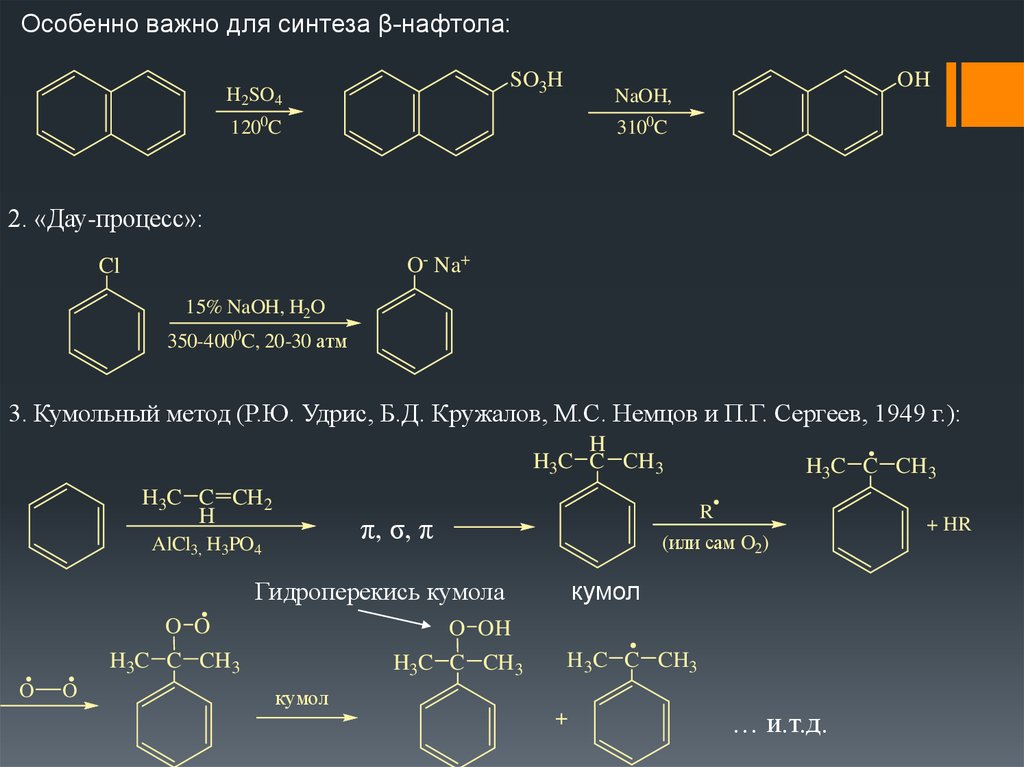
Особенно важно для синтеза β-нафтола:SO3H
H2SO4
OH
NaOH,
1200C
3100C
2. «Дау-процесс»:
O- Na+
Cl
15% NaOH, H2O
350-4000C, 20-30 атм
3. Кумольный метод (Р.Ю. Удрис, Б.Д. Кружалов, М.С. Немцов и П.Г. Сергеев, 1949 г.):
H
H3C C CH 3
H3C C CH 2
H
R
π, σ, π
AlCl3, H3PO4
(или сам O2)
кумол
Гидроперекись кумола
O O
O OH
H3C C CH 3
O
O
H3C C CH 3
H3C C CH 3
H 3C C CH3
кумол
+
… и.т.д.
+ HR
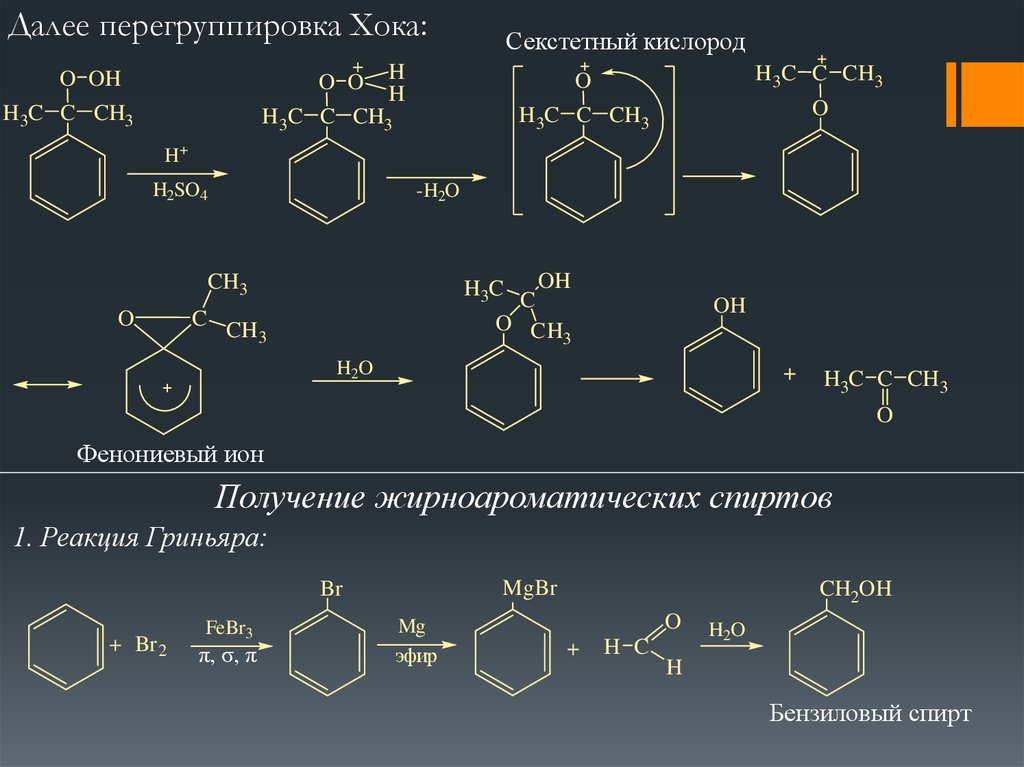
3.
Далее перегруппировка Хока:O OH
O O
H 3C C CH3
Секстетный кислород
H
H
H 3C C CH3
O
H 3C C CH3
H 3C C CH3
O
H+
H2SO4
-H2O
CH3
O
C
H3C
OH
C
O CH
3
CH 3
OH
H2O
+
H3C C CH3
O
Фенониевый ион
Получение жирноароматических спиртов
1. Реакция Гриньяра:
MgBr
Br
+ Br 2
FeBr3
π, σ, π
Mg
эфир
CH2OH
O
+
H C
H2O
H
Бензиловый спирт
4.
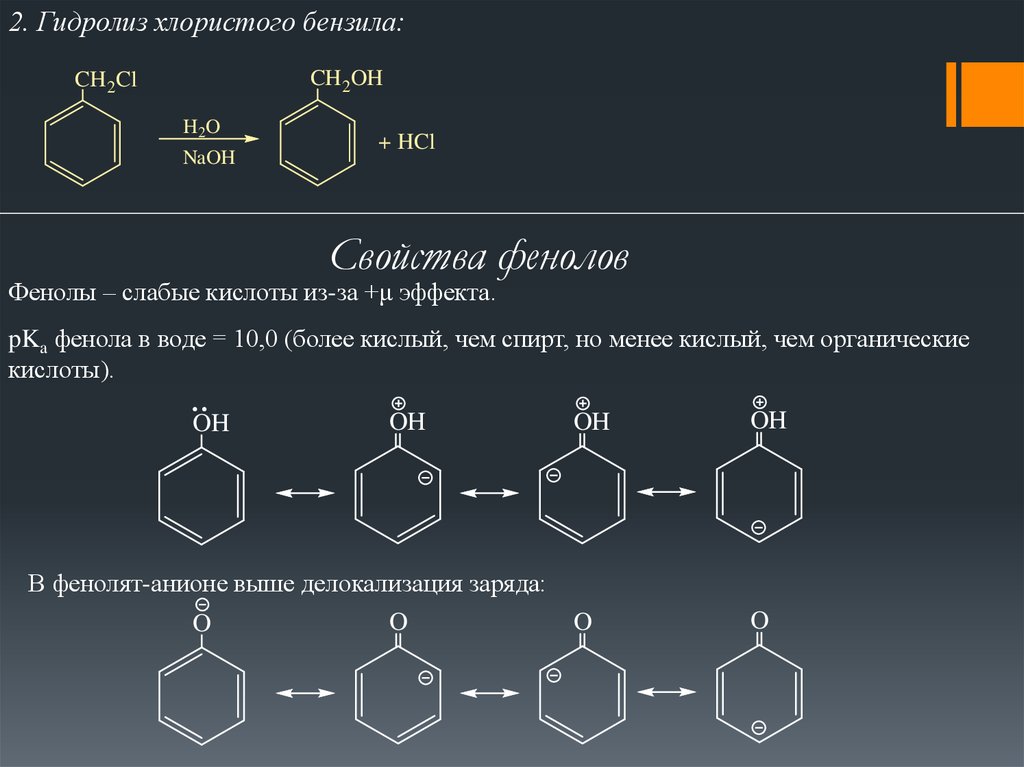
2. Гидролиз хлористого бензила:CH 2OH
CH 2Cl
H2O
NaOH
+ HCl
Свойства фенолов
Фенолы – слабые кислоты из-за +μ эффекта.
pKa фенола в воде = 10,0 (более кислый, чем спирт, но менее кислый, чем органические
кислоты).
OH
OH
В фенолят-анионе выше делокализация заряда:
O
O
OH
OH
O
O
5.
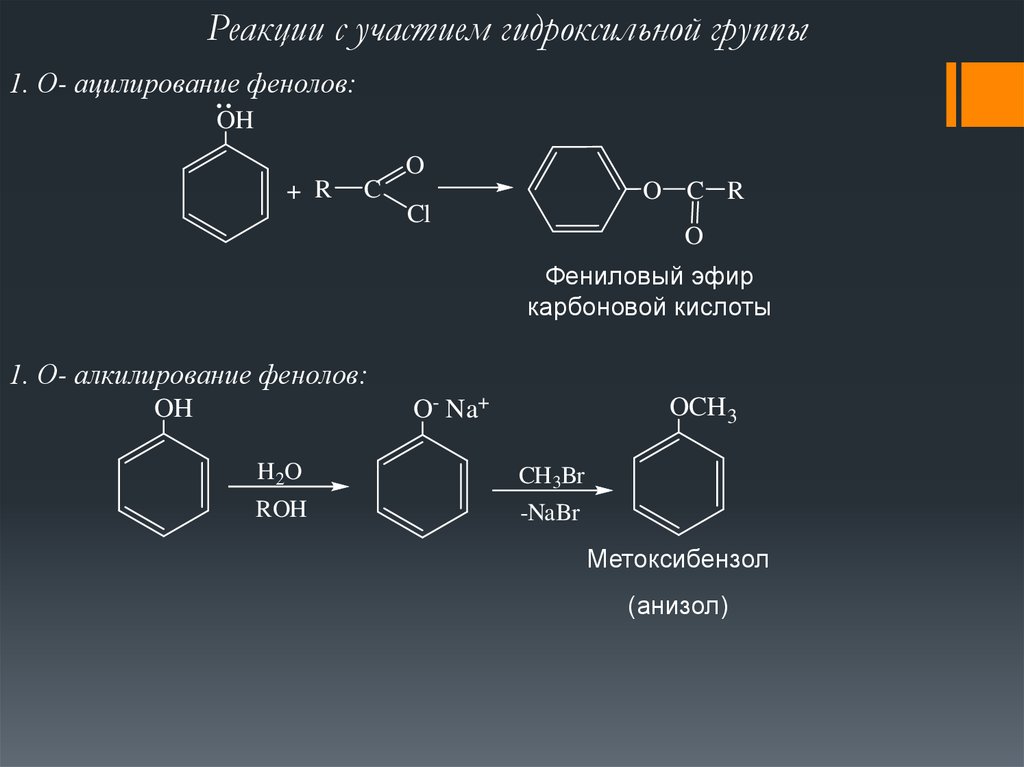
Реакции с участием гидроксильной группы1. О- ацилирование фенолов:
OH
O
+ R
C
O C R
Cl
O
Фениловый эфир
карбоновой кислоты
1. О- алкилирование фенолов:
O- Na+
OH
OCH 3
H2O
CH3Br
ROH
-NaBr
Метоксибензол
(анизол)
6.
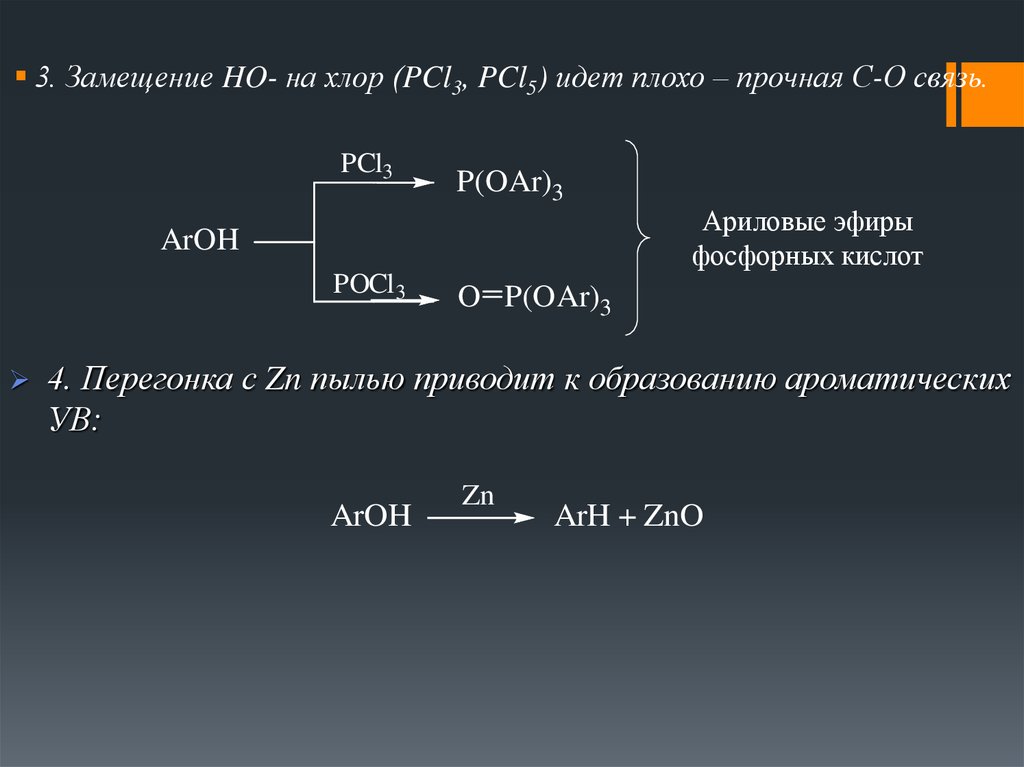
3. Замещение HO- на хлор (PCl3, PCl5) идет плохо – прочная С-О связь.PCl3
P(OAr)3
ArOH
POCl 3
Ариловые эфиры
фосфорных кислот
O P(OAr)3
4. Перегонка с Zn пылью приводит к образованию ароматических
УВ:
ArOH
Zn
ArH + ZnO
7.
5. Антиокислительные свойства фенолов.Фенолы – антиоксиданты и антисептики.
OH
OH
O
O
O
O
-e
-H+
2O
O
H
O
HO
O
H
O
O
H
HO
OH
8.
O- стабильный ароксил (общее название фенольных радикалов)
O
OH
+R
+ RH
Стабильный – цепь
обрывается
Реакции с участием ароматического ядра
1. Классические реакции электрофильного замещения –
рассматривали ранее (галогенирование, нитрование,
сульфироание).
9.
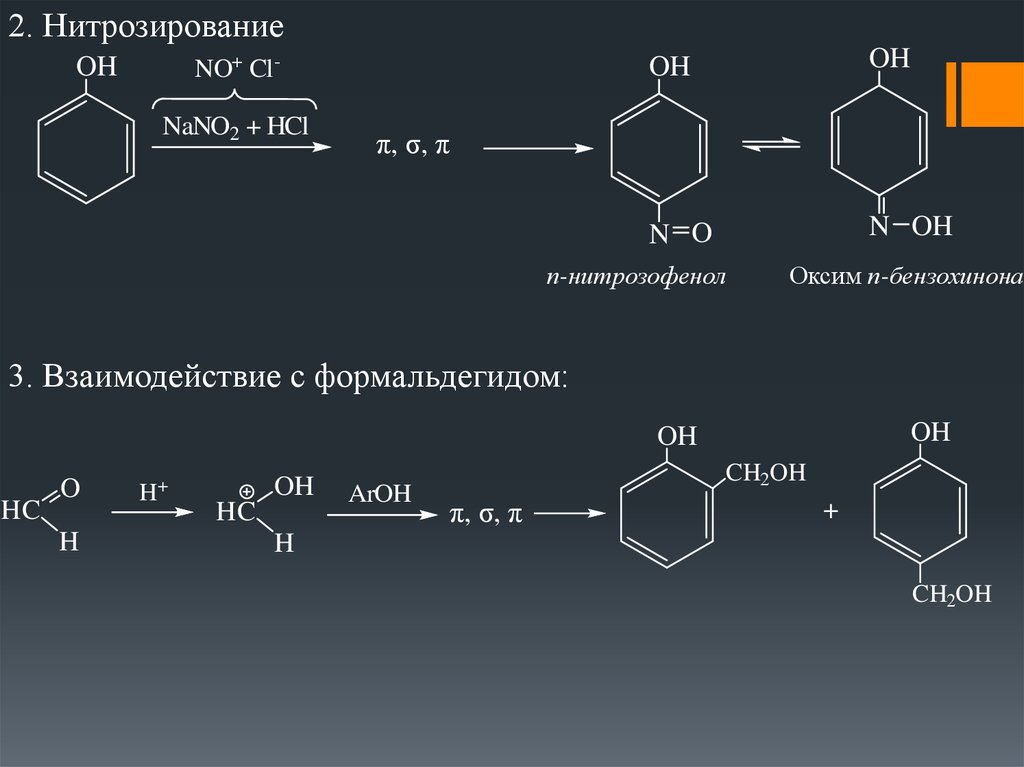
2. НитрозированиеNO+ Cl -
OH
NaNO2 + HCl
OH
OH
N O
N OH
π, σ, π
п-нитрозофенол
Оксим п-бензохинона
3. Взаимодействие с формальдегидом:
OH
OH
HC
O
H
H+
OH
HC
ArOH
CH2OH
π, σ, π
+
H
CH2OH
10.
OHOH
OH
OH
CH2OH
CH2
+
H
-H2O
CH2OH
H2
C
CH2OH
H+
-H2O
HO
OH
OH
OH
H2
C
H2
C
H2
C
HO
HO
CH2
CH2OH
HO
CH2
Реакция поликонденсации. Сшивки самые разные.
Реакция Раймера-Тимана:
CHCl3
OH-
O
CCl3 + H2O
OH
O
O
H
CCl2
CCl2 + Cl-
CCl2
CHCl2
H2O, OH-
C
O
H



 chemistry
chemistry