Similar presentations:
Фенолы. Физические свойства
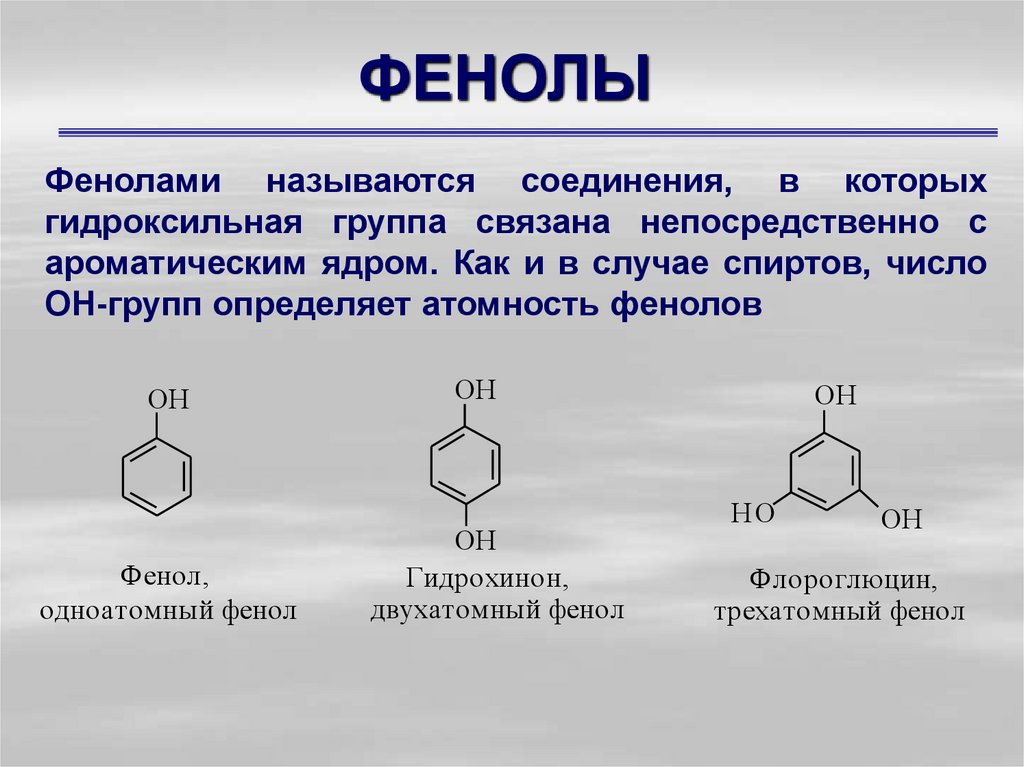
1. ФЕНОЛЫ
Фенолами называются соединения, в которыхгидроксильная группа связана непосредственно с
ароматическим ядром. Как и в случае спиртов, число
ОН-групп определяет атомность фенолов
OH
Фенол,
одноатомный фенол
OH
OH
Гидрохинон,
двухатомный фенол
OH
HO
OH
Флороглюцин,
трехатомный фенол
2. ФЕНОЛЫ
Следует выделить особенности строения исвойства фенолов, в которых проявляются, с
одной стороны сходство со свойствами спиртов,
а с другой – влияние ароматического кольца на
реакционную способность гидроксильной группы
и влияние гидроксильной группы на реакционную
способность кольца.
3.
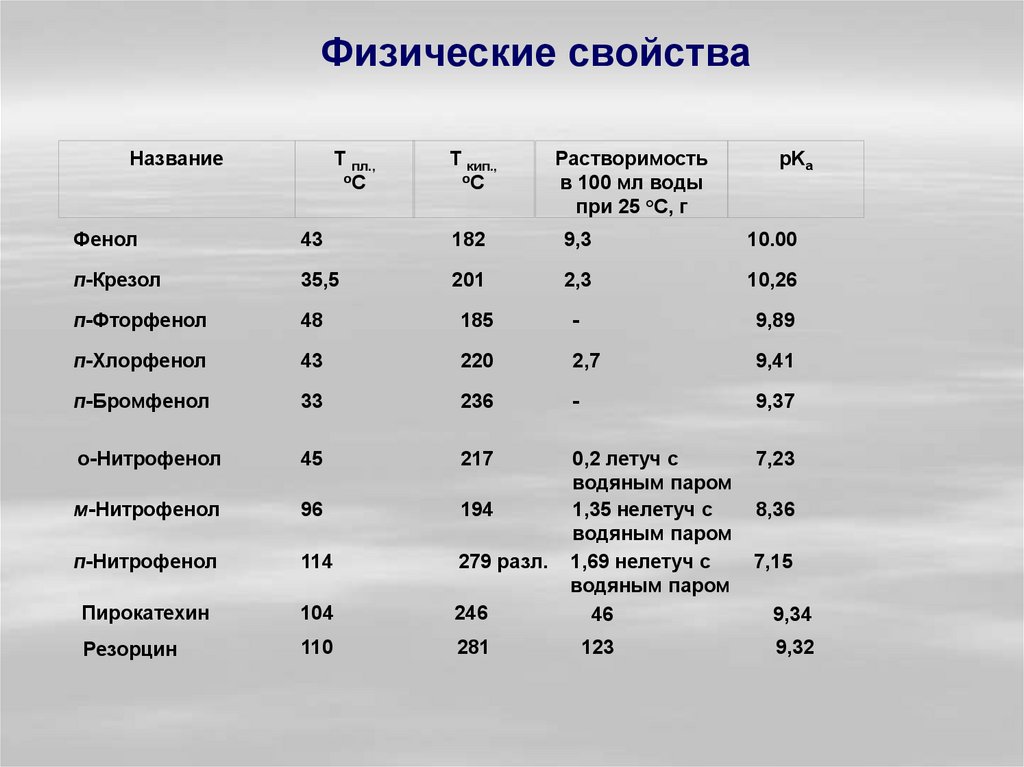
Физические свойстваНазвание
Т пл.,
оС
Т кип.,
оС
Растворимость
в 100 мл воды
при 25 °С, г
pKa
Фенол
43
182
9,3
10.00
п-Крезол
35,5
201
2,3
10,26
п-Фторфенол
48
185
-
9,89
п-Хлорфенол
43
220
2,7
9,41
п-Бромфенол
33
236
-
9,37
о-Нитрофенол
45
217
7,23
м-Нитрофенол
96
194
п-Нитрофенол
114
279 разл.
Пирокатехин
104
246
0,2 летуч с
водяным паром
1,35 нелетуч с
водяным паром
1,69 нелетуч с
водяным паром
46
Резорцин
110
281
123
8,36
7,15
9,34
9,32
4.
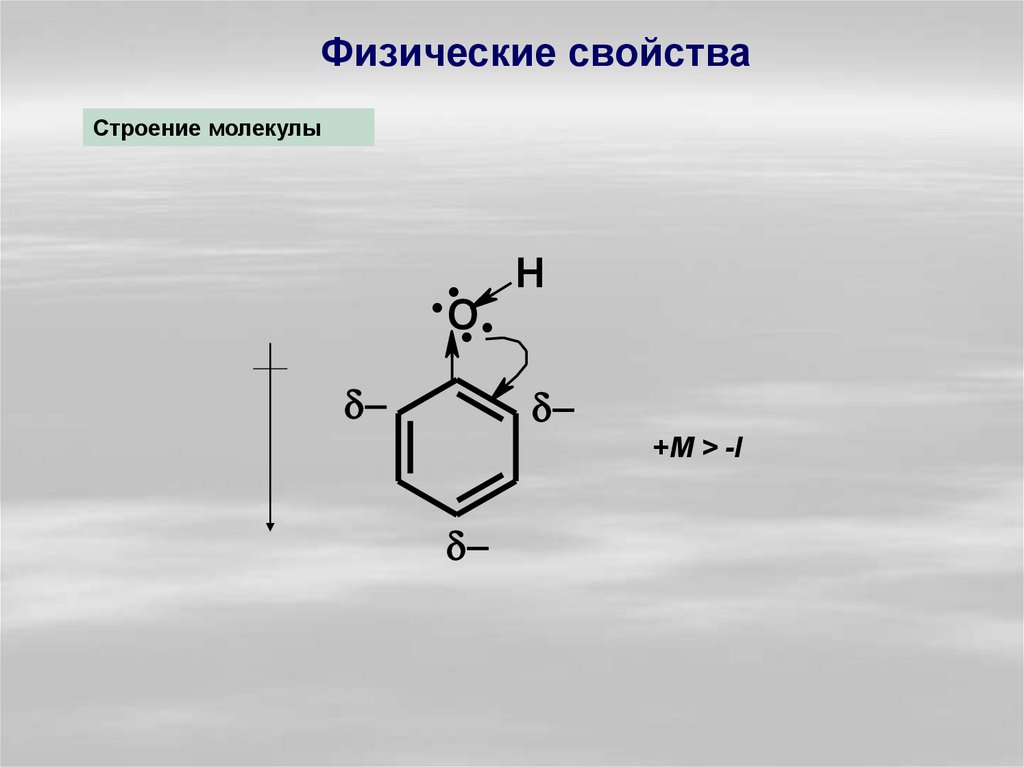
Физические свойстваСтроение молекулы
..O. H
.
+M > -I
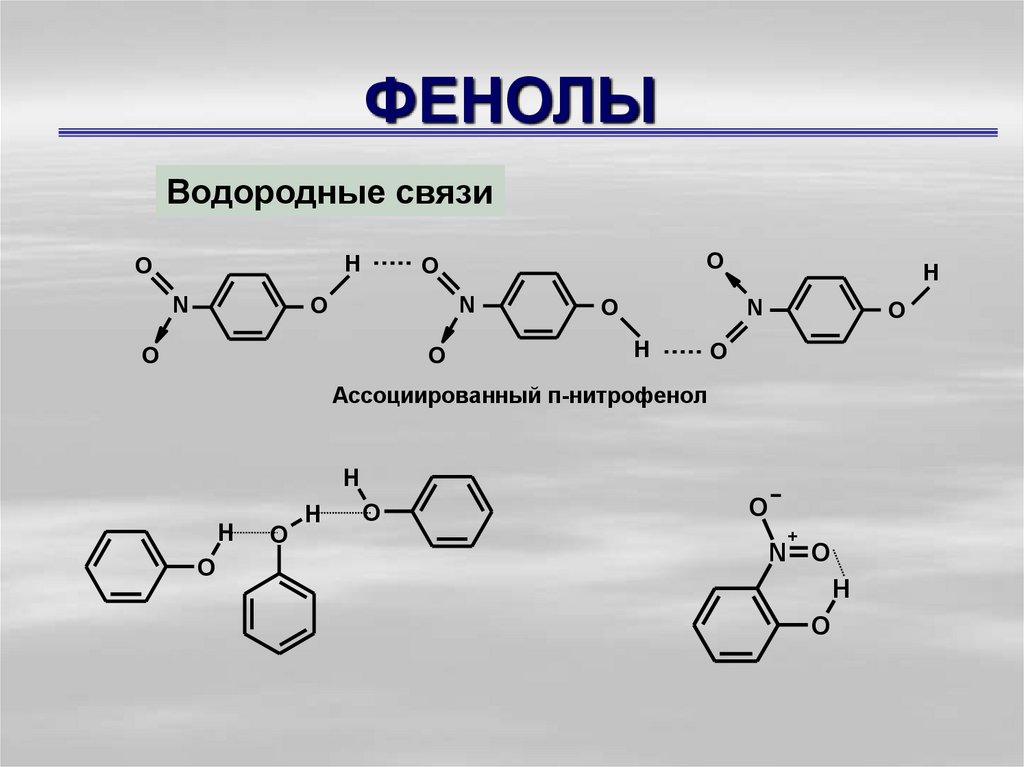
5. ФЕНОЛЫ
Водородные связиH
O
N
O
O
N
O
O
O
O
H
N
H
O
O
Ассоциированный п-нитрофенол
H
H
O
O
H
O
O
+
N O
H
O
6. ФЕНОЛЫ
Кислотные свойства феноловФенолы более сильные кислоты чем вода
(рКа=15,70) и спирты (рКа~16-17), но значительно
более слабые чем карбоновые кислоты (рКа~5).
Большинство фенолов имеют рКа~10.
Гидроксигруппа, связанная с ароматическим ядром,
является более кислой, чем группа ОН в воде и
спирте вследствие делокализации электронной пары
фенолят-иона, изображенной с помощью граничных
структур II – IV
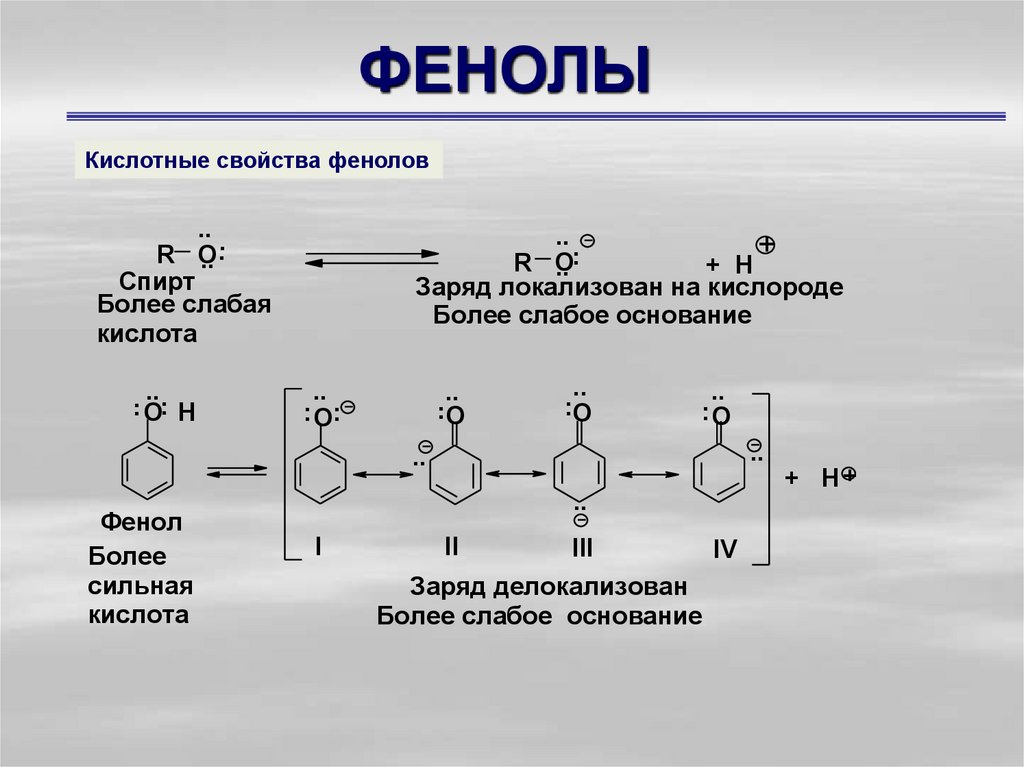
7. ФЕНОЛЫ
Кислотные свойства фенолов..
.
R O
.. .
Спирт
Более слабая
кислота
.. ....
O H
.. .
+
R O
+ H
.. .
Заряд локализован на кислороде
Более слабое основание
.. .. ..
O
....
O
....
O
.. ..
O
..
..
Фенол
Более
сильная
кислота
+ H+
..
I
II
III
Заряд делокализован
Более слабое основание
IV
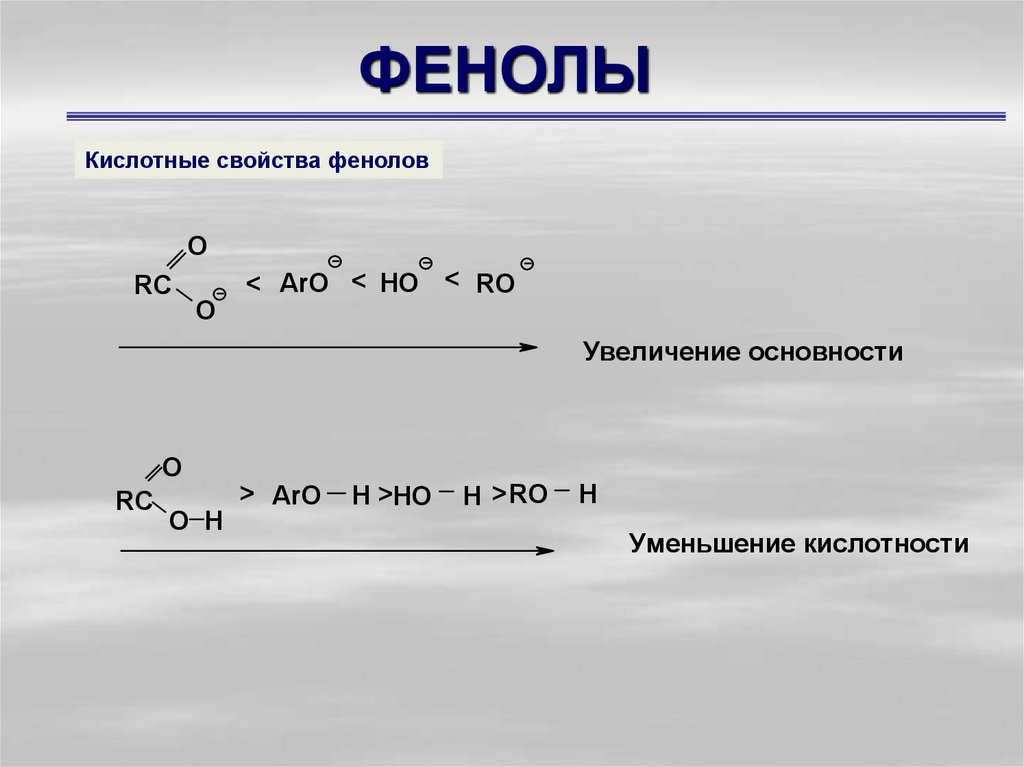
8. ФЕНОЛЫ
Кислотные свойства феноловO
< ArO < HO < RO
RC
O
Увеличение основности
O
RC
> ArO
O H
H >HO
H > RO
H
Уменьшение кислотности
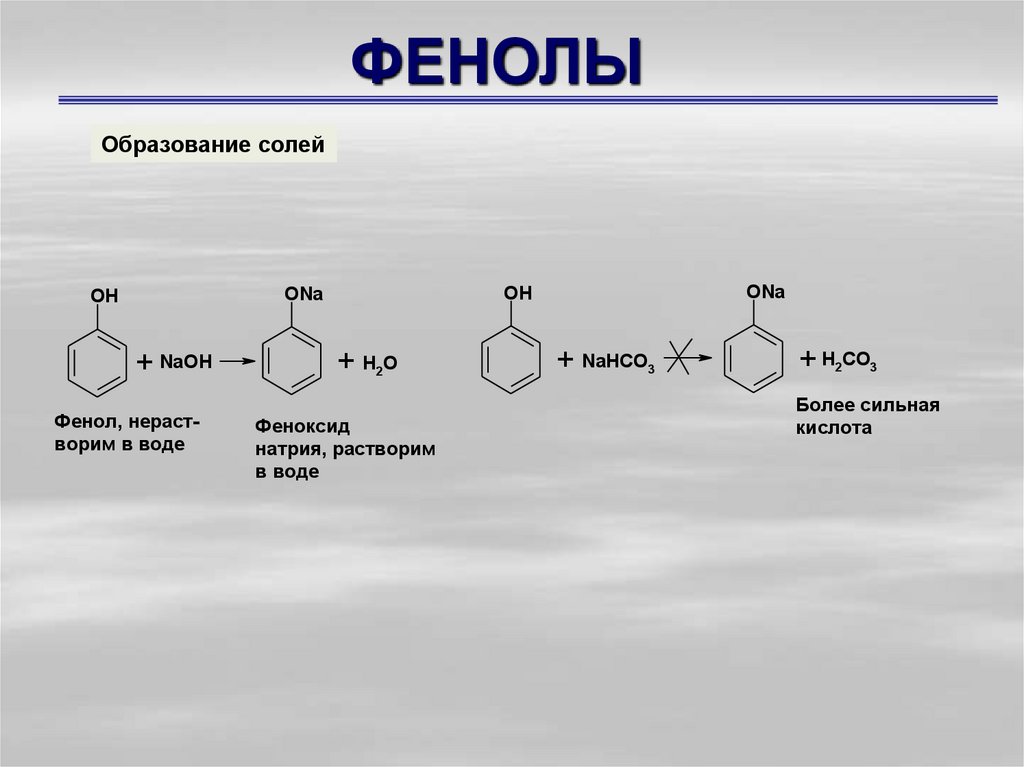
9. ФЕНОЛЫ
Образование солей+ NaOH
Фенол, нерастворим в воде
ONa
OH
ONa
OH
+ H2O
Феноксид
натрия, растворим
в воде
+ NaHCO3
+ H2CO3
Более сильная
кислота
10. ФЕНОЛЫ
OHOH
D
Кислотные
свойста
возрастают
A
Кислотные
свойста
ослабевают
Электроноакцепторные
заместители
в
ароматическом
ядре
рассредоточивают отрицательный заряд фенолят-иона и тем самым
увеличивают кислотность фенолов, а электронодонорные заместители
затруднят делокализацию отрицательного заряда, способствуют
увеличению электронной плотности и таким образом уменьшают
кислотность фенолов.
11. ФЕНОЛЫ
Качественная реакция на фенолы.Образование окрашенных комплексных
соединений с FeCl3:
Фенол - красно-фиолетовый
Крезол – синий
Резорцин – темно-фиолетовый
Салициловая кислота - красный
Относительно высокая кислотность фенолов определяется:
1. p-p-сопряжением n-электронов кислорода и p-электронов ароматического
ядра. Заряд делокализуется.
2. . .
sp2-гибридизации.
12. ФЕНОЛЫ
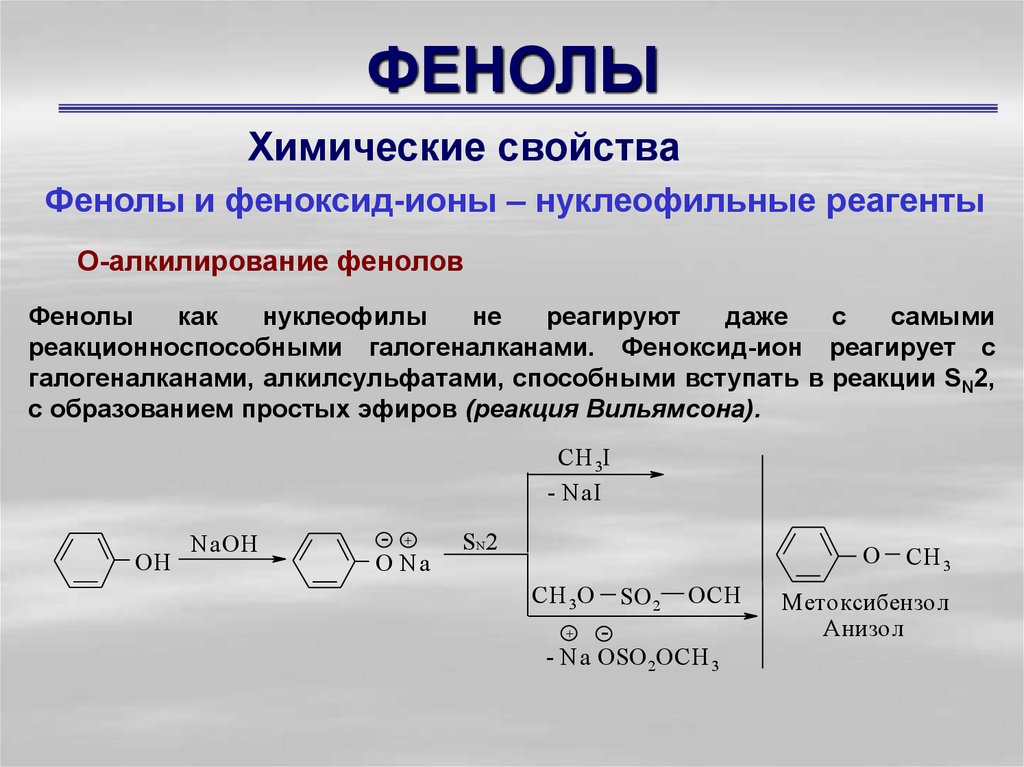
Химические свойстваФенолы и феноксид-ионы – нуклеофильные реагенты
О-алкилирование фенолов
Фенолы
как
нуклеофилы
не
реагируют
даже
с
самыми
реакционноспособными галогеналканами. Феноксид-ион реагирует с
галогеналканами, алкилсульфатами, способными вступать в реакции SN2,
с образованием простых эфиров (реакция Вильямсона).
CH 3I
- NaI
ОН
NaOH
- +
О Na
SN 2
О
CH 3O
SO 2
ОСН
3
- Nа OSO 2OCH 3
+
СН 3
М етоксибензол
Анизол
13. ФЕНОЛЫ
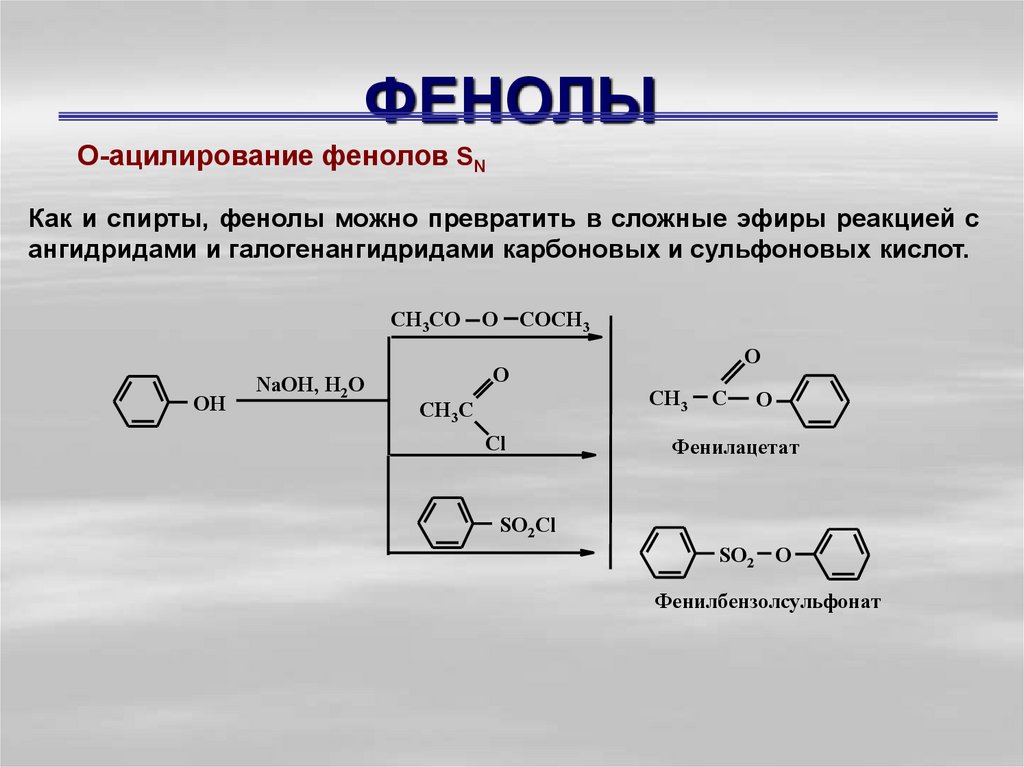
О-ацилирование фенолов SNКак и спирты, фенолы можно превратить в сложные эфиры реакцией с
ангидридами и галогенангидридами карбоновых и сульфоновых кислот.
CH3СO
ОН
NaOH, Н2О
О
СОСН3
O
О
CH3
СН3С
Сl
C
O
Фенилaцетат
SO2Cl
SO2
O
Фенилбензолсульфонат
14. ФЕНОЛЫ
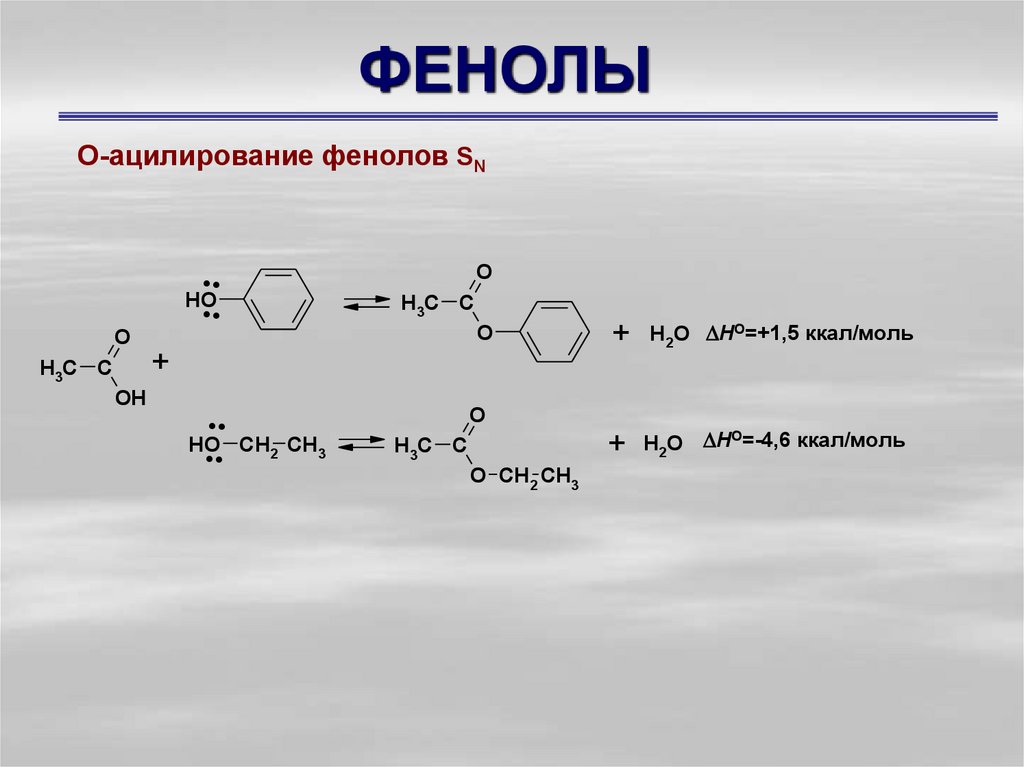
О-ацилирование фенолов SNO
H3C C
OH
..
HO
..
O
H3C C
O
+
..
HO
.. CH CH
2
O
3
H3C C
O CH2 CH3
+ H2O HO=+1,5 ккал/моль
+ H2O HO=-4,6 ккал/моль
15. ФЕНОЛЫ
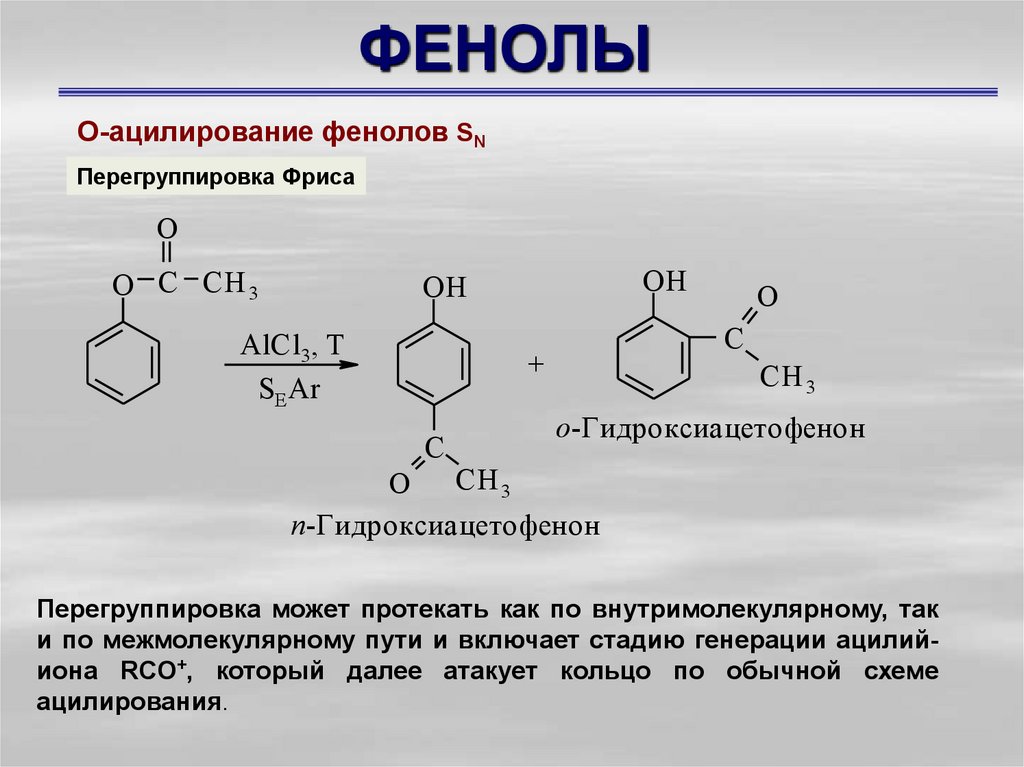
О-ацилирование фенолов SNПерегруппировка Фриса
O
O C CH 3
OH
OH
AlCl3, Т
SE Ar
C
+
C
O
CH 3
о-Гидроксиацетофенон
CH 3
O
п-Гидроксиацетофенон
Перегруппировка может протекать как по внутримолекулярному, так
и по межмолекулярному пути и включает стадию генерации ацилийиона RCO+, который далее атакует кольцо по обычной схеме
ацилирования.
16. ФЕНОЛЫ
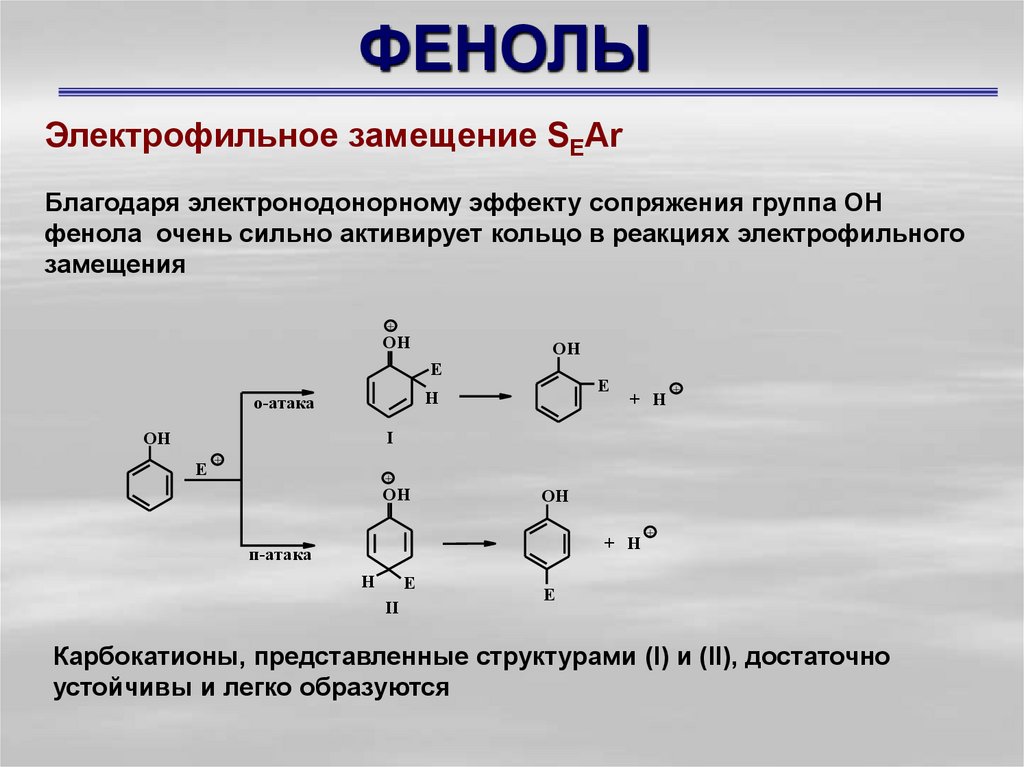
Электрофильное замещение SEArБлагодаря электронодонорному эффекту сопряжения группа ОН
фенола очень сильно активирует кольцо в реакциях электрофильного
замещения
+
OН
OH
Е
Е
Н
о-атака
+ Н
+
I
OH
Е
+
+
OН
OH
+ Н
п-атака
Н
Е
II
+
Е
Карбокатионы, представленные структурами (I) и (II), достаточно
устойчивы и легко образуются
17. ФЕНОЛЫ
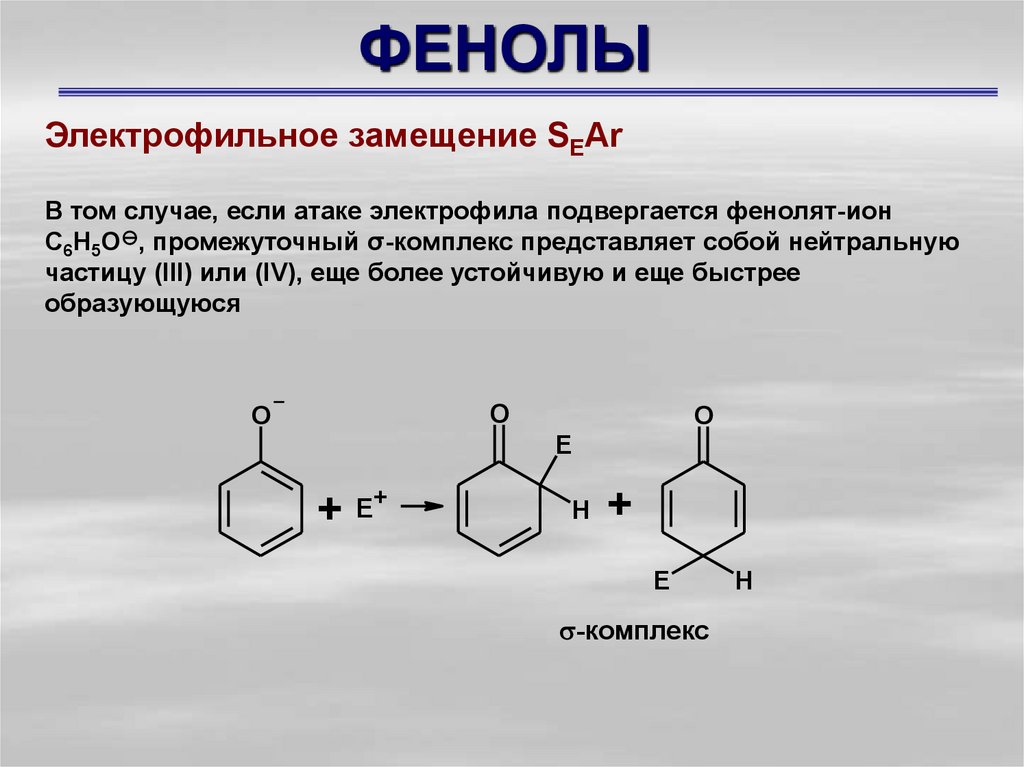
Электрофильное замещение SEArВ том случае, если атаке электрофила подвергается фенолят-ион
С6Н5О , промежуточный σ-комплекс представляет собой нейтральную
частицу (III) или (IV), еще более устойчивую и еще быстрее
образующуюся
O
O
O
E
+
E+
H
+
E
-комплекс
H
18. ФЕНОЛЫ
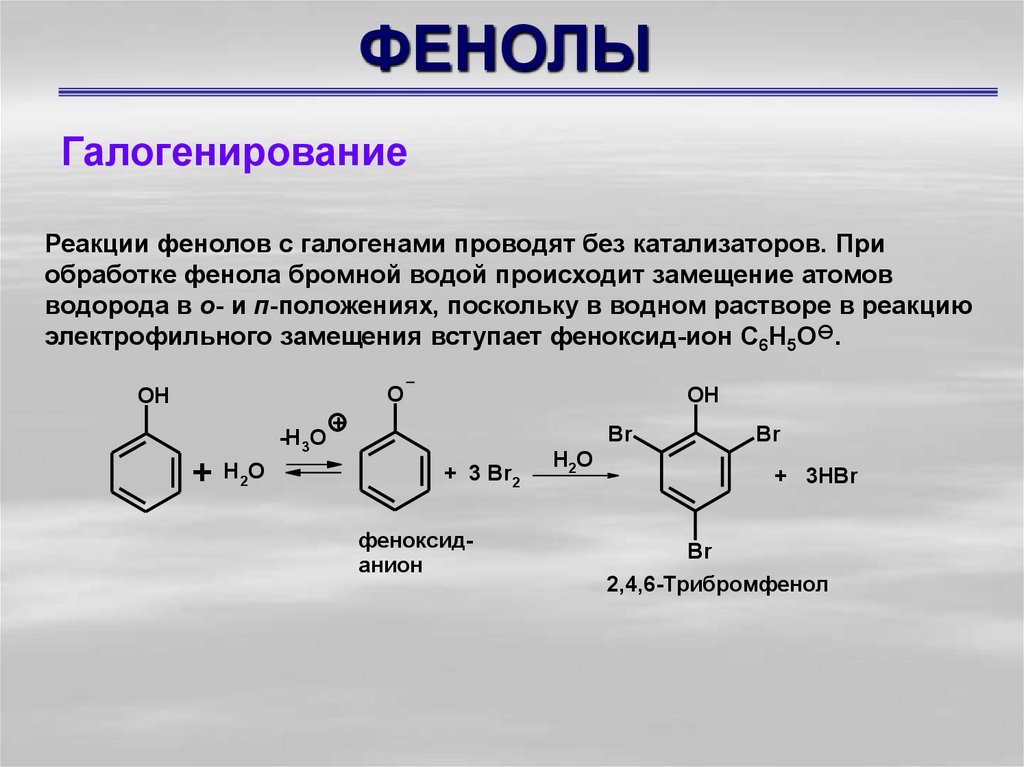
ГалогенированиеРеакции фенолов с галогенами проводят без катализаторов. При
обработке фенола бромной водой происходит замещение атомов
водорода в о- и п-положениях, поскольку в водном растворе в реакцию
электрофильного замещения вступает феноксид-ион С6Н5О .
O
OH
+ H2O
-H3O
OH
+
Br
+ 3 Br2
феноксиданион
Br
H2O
+ 3HBr
Br
2,4,6-Трибромфенол
19. ФЕНОЛЫ
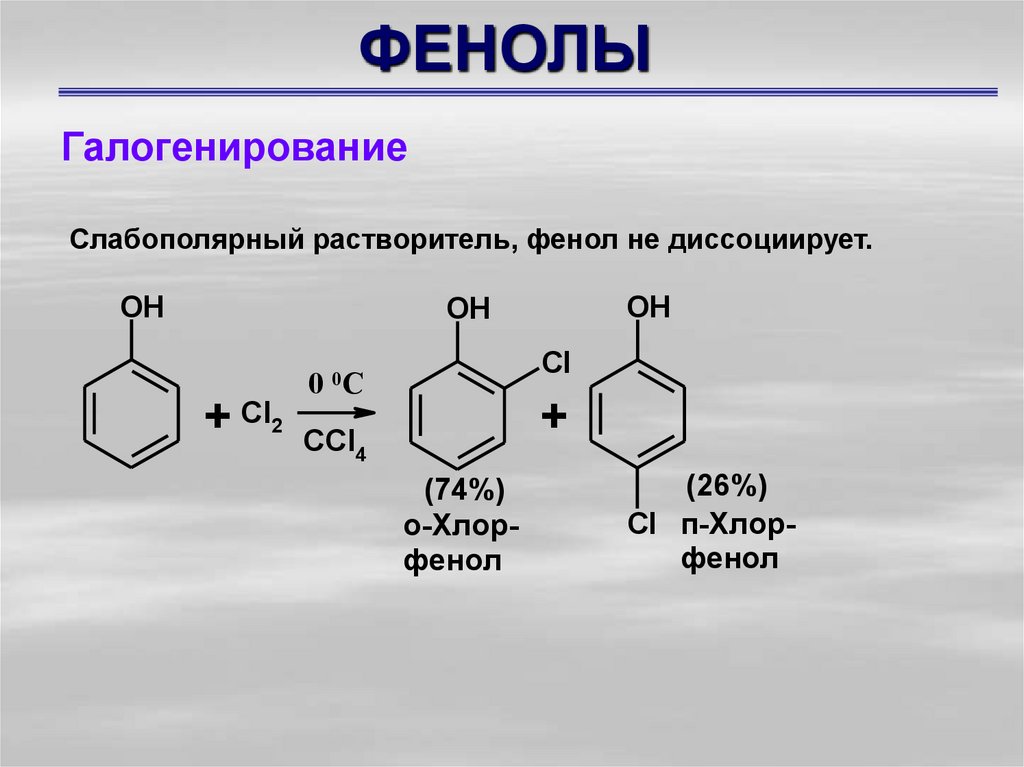
ГалогенированиеСлабополярный растворитель, фенол не диссоциирует.
OH
OH
OH
Cl
0 0С
+ Cl2 CCl
+
4
(74%)
о-Хлорфенол
(26%)
Cl п-Хлорфенол
20. ФЕНОЛЫ
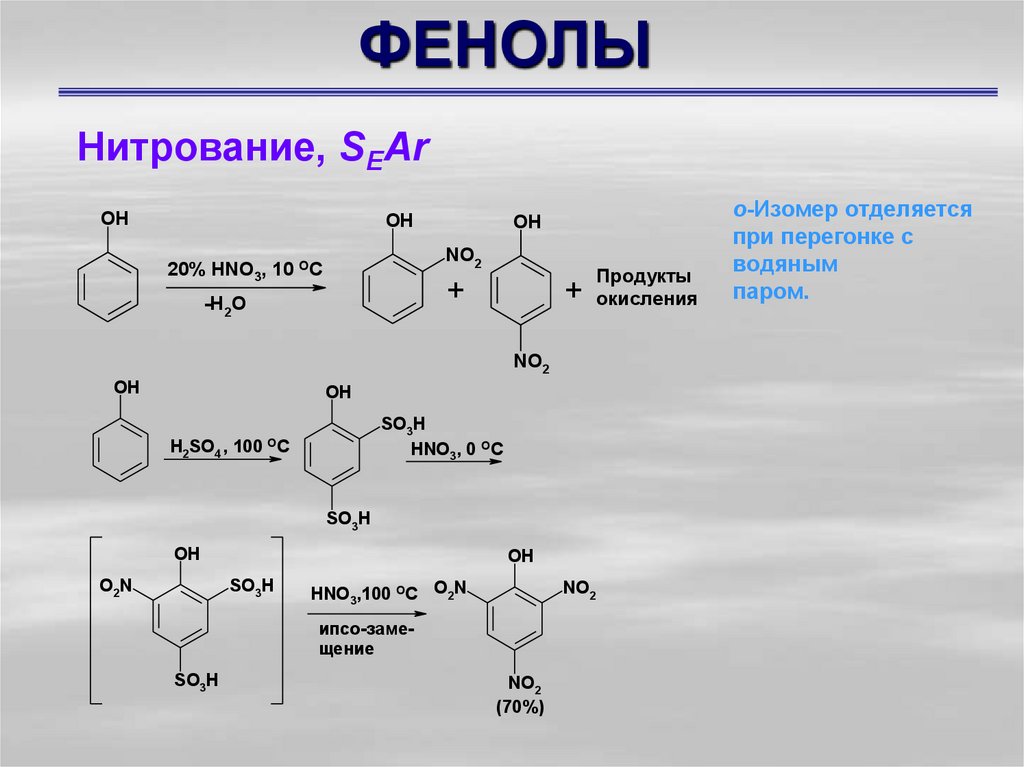
Нитрование, SEArOH
OH
OH
NO2
20% HNO3, 10 OC
+
-H2O
+
NO2
OH
OH
H2SO4
SO3H
HNO3, 0 OC
, 100 OC
SO3H
OH
O2N
OH
SO3H
HNO3,100 OC O2N
NO2
ипсо-замещение
SO3H
NO2
(70%)
Продукты
окисления
о-Изомер отделяется
при перегонке с
водяным
паром.
21. ФЕНОЛЫ
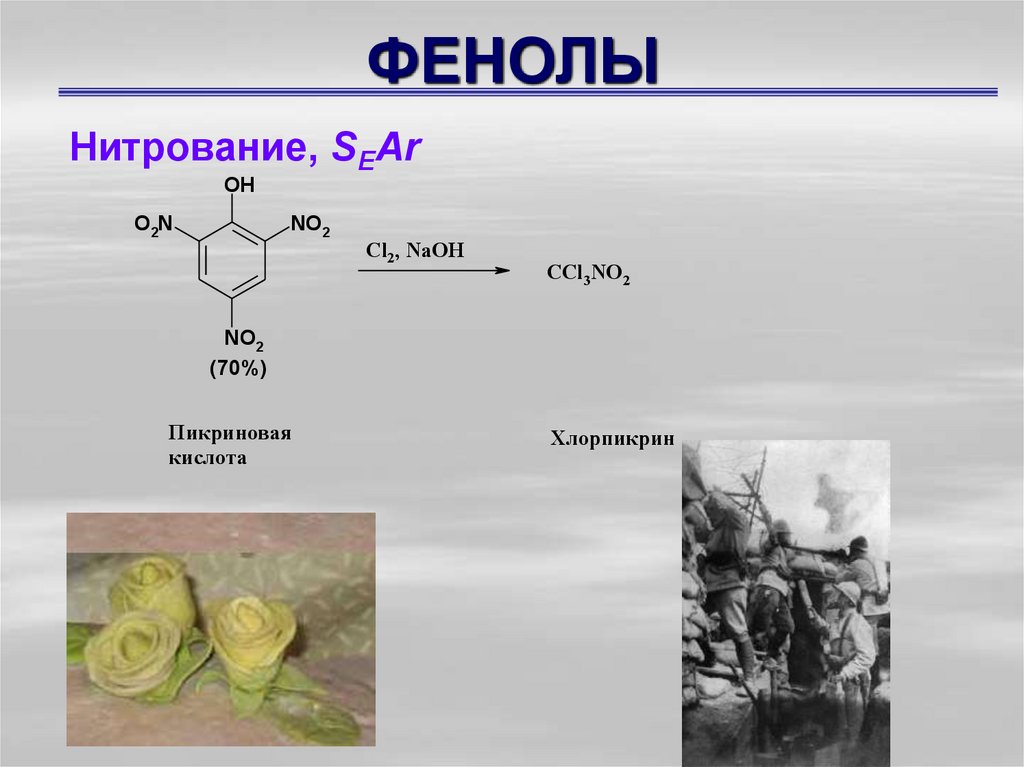
Нитрование, SEArOH
O2N
NO2
Cl2, NaOH
CCl3NO2
NO2
(70%)
Пикриновая
кислота
Хлорпикрин
22. ФЕНОЛЫ
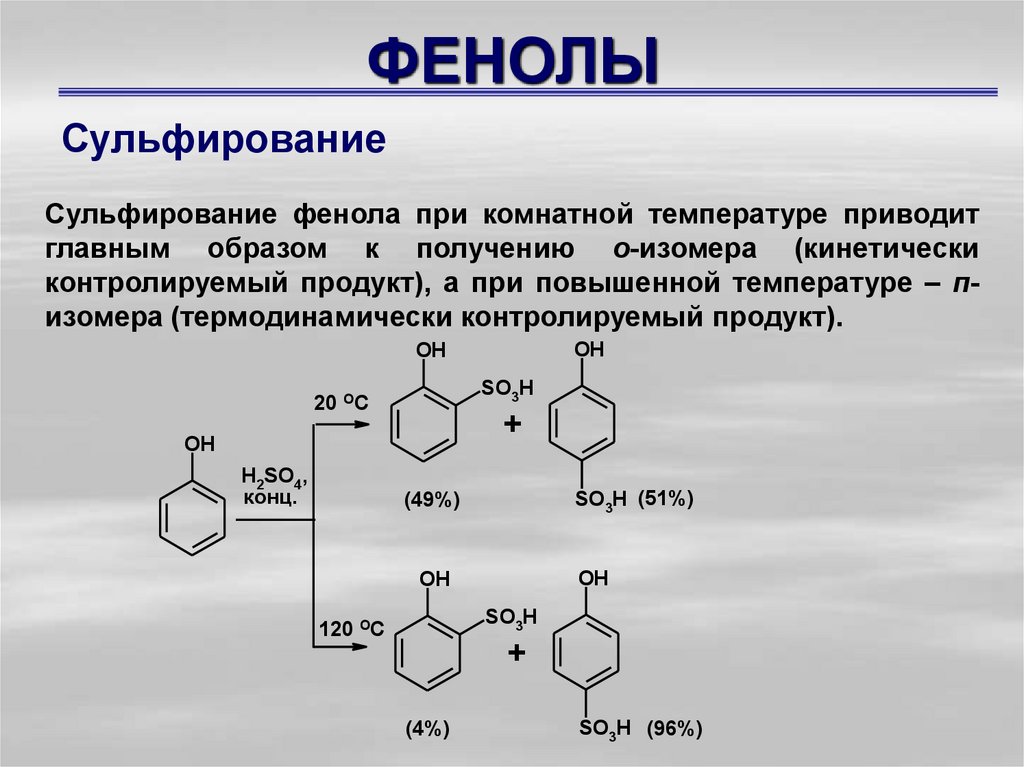
СульфированиеСульфирование фенола при комнатной температуре приводит
главным образом к получению о-изомера (кинетически
контролируемый продукт), а при повышенной температуре – пизомера (термодинамически контролируемый продукт).
OH
OH
SO3H
20 OC
+
OH
H2SO4,
конц.
SO3H (51%)
(49%)
OH
OH
SO3H
120 OC
+
(4%)
SO3H (96%)
23. ФЕНОЛЫ
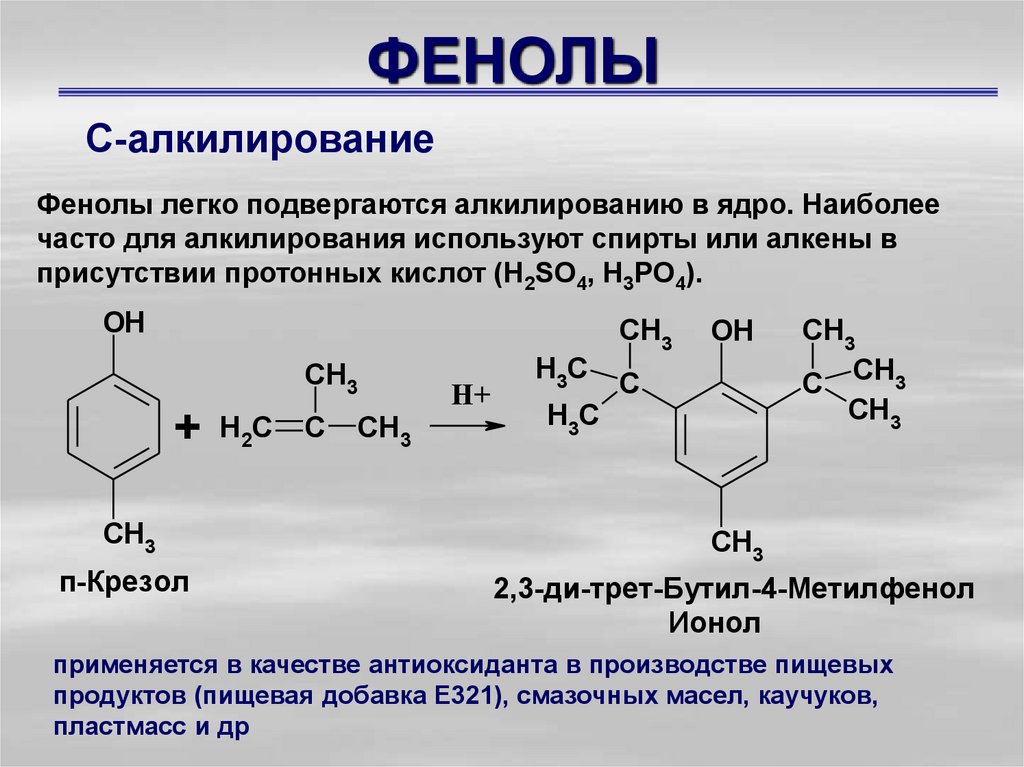
С-алкилированиеФенолы легко подвергаются алкилированию в ядро. Наиболее
часто для алкилирования используют спирты или алкены в
присутствии протонных кислот (Н2SO4, Н3РO4).
OH
CH3
+ H2C C CH3
CH3
п-Крезол
H+
H3C
H3C
CH3
OH
C
CH3
C CH3
CH3
CH3
2,3-ди-трет-Бутил-4-Метилфенол
Ионол
применяется в качестве антиоксиданта в производстве пищевых
продуктов (пищевая добавка E321), смазочных масел, каучуков,
пластмасс и др
24. ФЕНОЛЫ
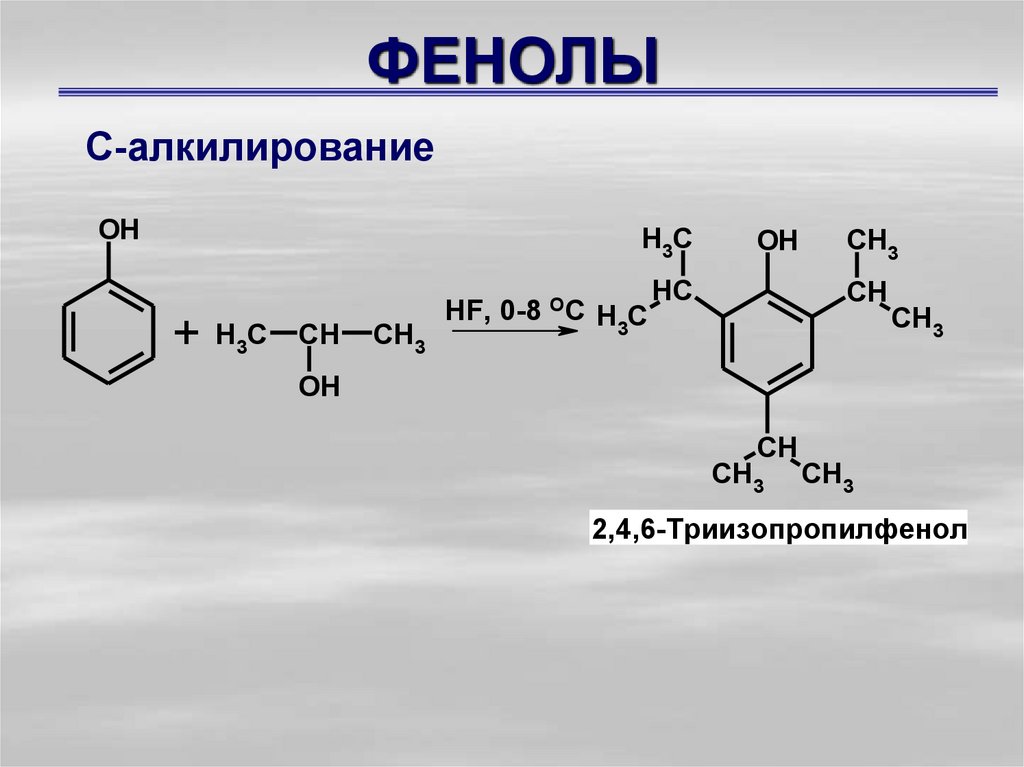
С-алкилированиеOH
H3C
+
H3C
CH
CH3
HF, 0-8 OC
H3C
OH
HC
CH3
CH
CH3
OH
CH
CH3
CH3
2,4,6-Триизопропилфенол
25. ФЕНОЛЫ
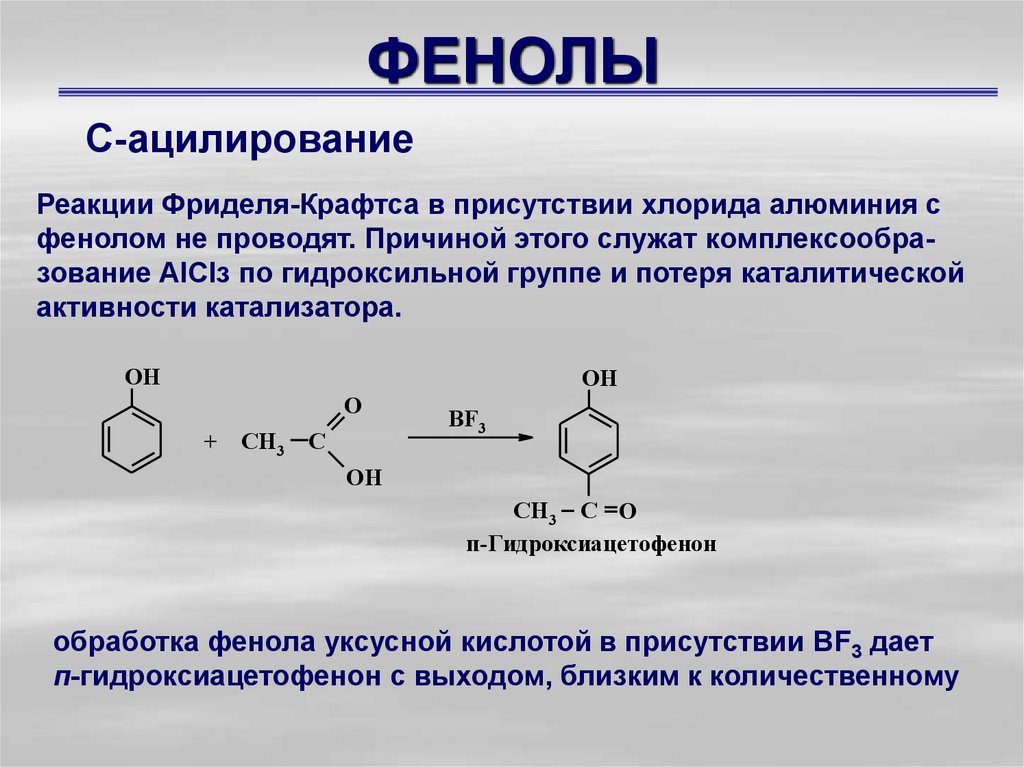
С-ацилированиеРеакции Фриделя-Крафтса в присутствии хлорида алюминия с
фенолом не проводят. Причиной этого служат комплексообразование АlСlз по гидроксильной группе и потеря каталитической
активности катализатора.
OH
OH
O
+
CH3
C
BF3
OH
CH3 C O
п-Гидроксиацетофенон
обработка фенола уксусной кислотой в присутствии ВF3 дает
п-гидроксиацетофенон с выходом, близким к количественному
26. ФЕНОЛЫ
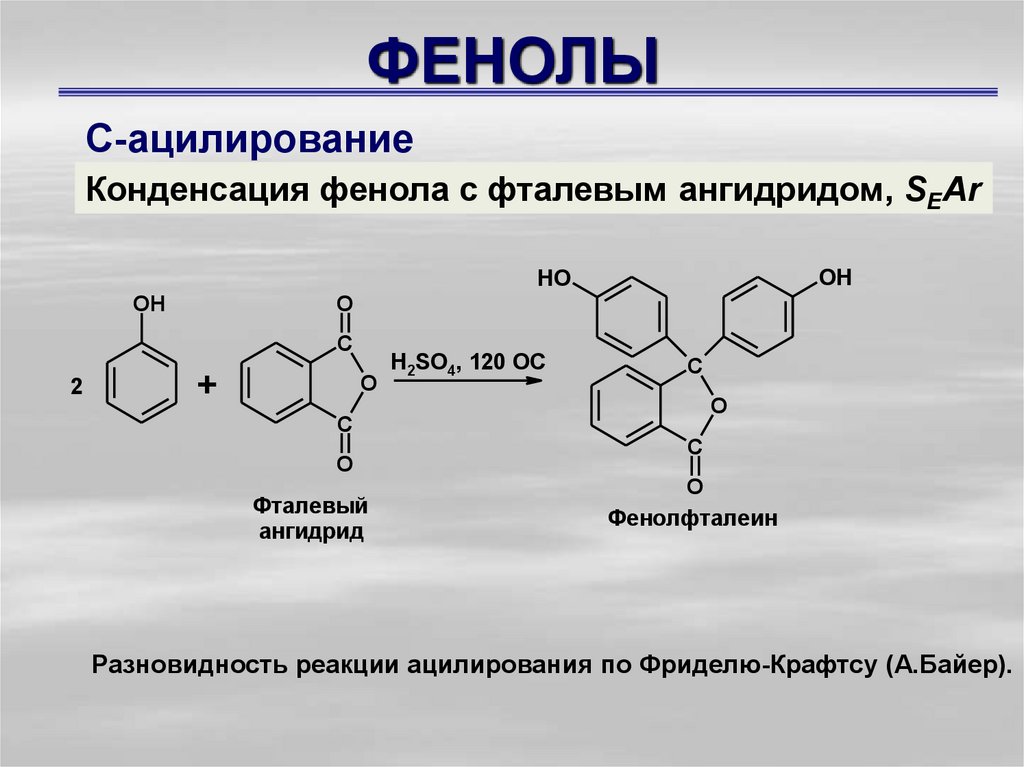
С-ацилированиеКонденсация фенола с фталевым ангидридом, SEAr
OH
HO
O
OH
C
2
+
O
C
O
Фталевый
ангидрид
H2SO4, 120 OC
C
O
C
O
Фенолфталеин
Разновидность реакции ацилирования по Фриделю-Крафтсу (А.Байер).
27. ФЕНОЛЫ
Фенолфталеин28. ФЕНОЛЫ
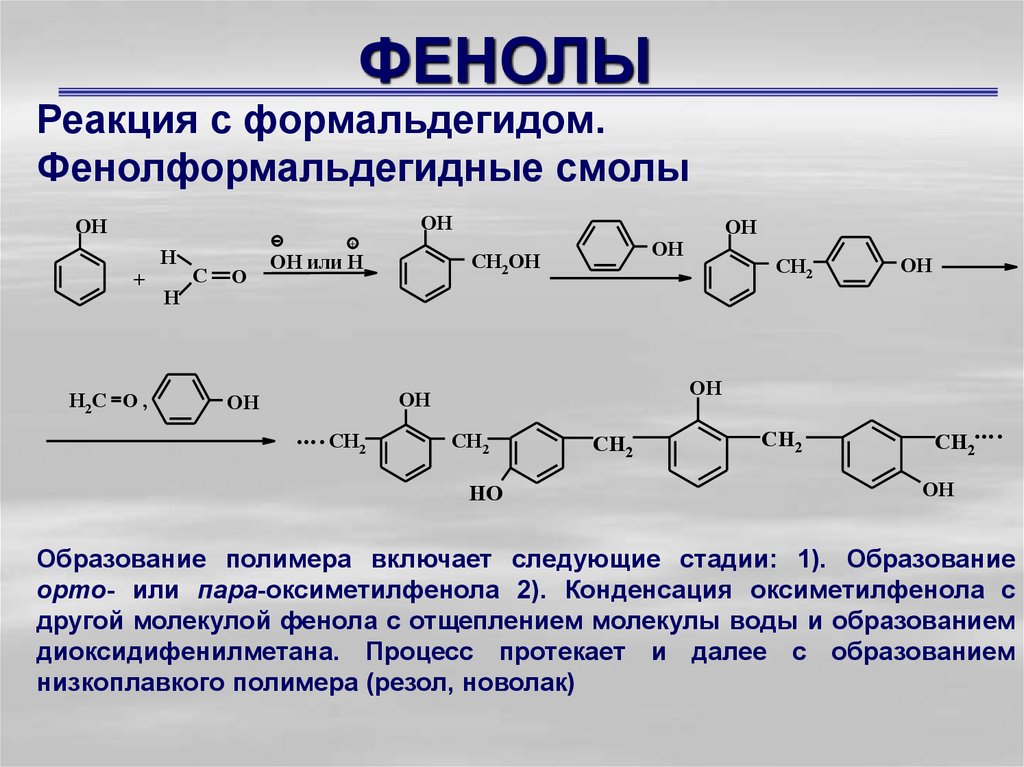
Реакция с формальдегидом.Фенолформальдегидные смолы
К числу старейших синтетических полимеров относятся
полимеры,
образующиеся
при
реакции
фенола
с
формальдегидом в присутствии щелочи или кислоты. При
кислотном катализе атакующей электрофильной частицей
является карбокатион, возникающий при протонировании
карбонильного соединения. Первая стадия реакции может
трактоваться как электрофильное замещение в кольце под
действием
электронодефицитного
атома
углерода
формальдегида.
29. ФЕНОЛЫ
Реакция с формальдегидом.Фенолформальдегидные смолы
ОН
ОН
+
Н 2С O ,
Н
Н
+
С
O
ОН
СН2ОН
ОН или Н
.... СН2
СН2
ОН
OH
ОН
ОН
ОН
СН2
HO
CH2
CH2
CH2....
OH
Образование полимера включает следующие стадии: 1). Образование
орто- или пара-оксиметилфенола 2). Конденсация оксиметилфенола с
другой молекулой фенола с отщеплением молекулы воды и образованием
диоксидифенилметана. Процесс протекает и далее с образованием
низкоплавкого полимера (резол, новолак)
30. ФЕНОЛЫ
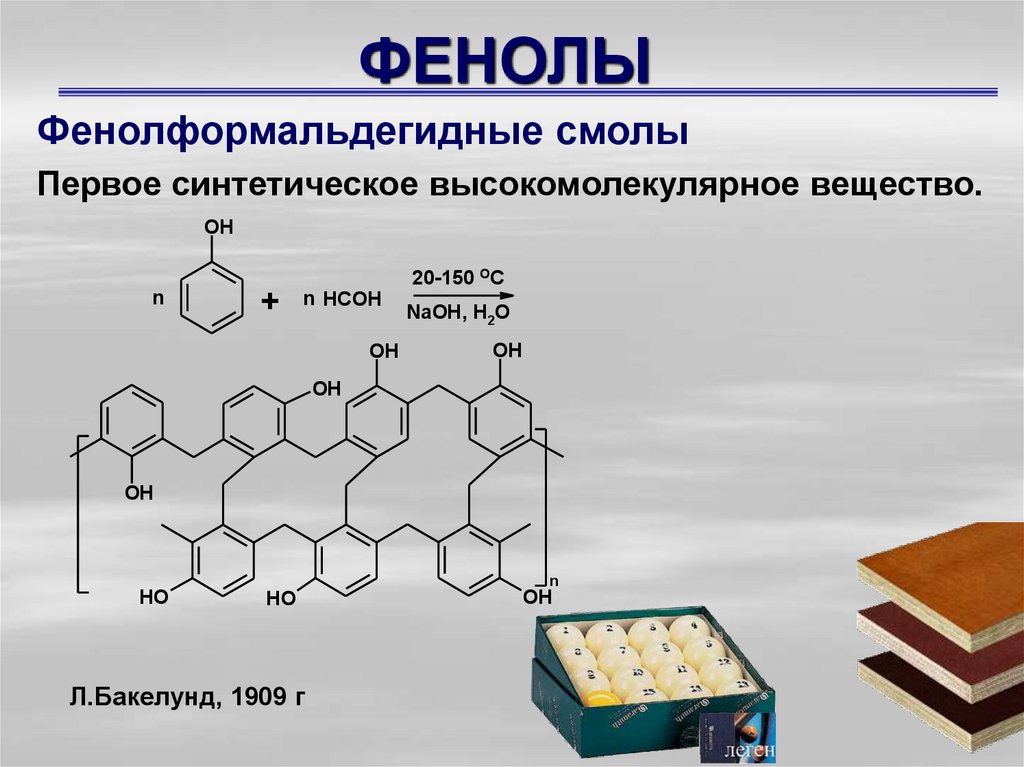
Фенолформальдегидные смолыПервое синтетическое высокомолекулярное вещество.
OH
n
+
n HCOH
OH
20-150 OC
NaOH, H2O
OH
OH
OH
HO
HO
Л.Бакелунд, 1909 г
n
OH
31. ФЕНОЛЫ
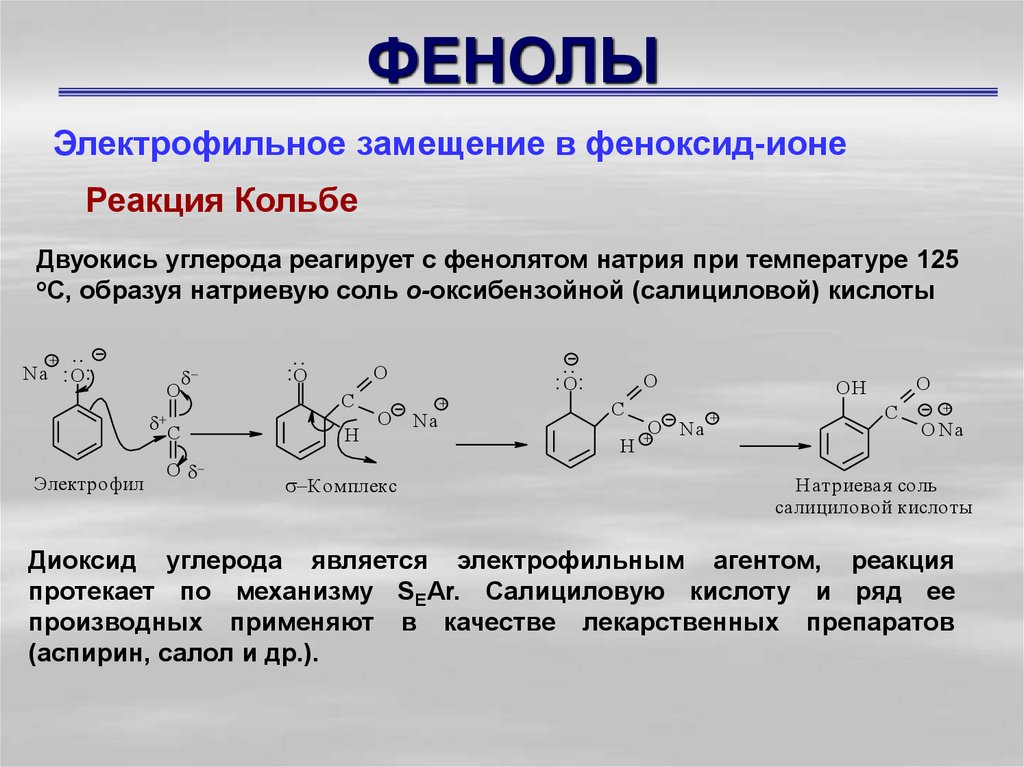
Электрофильное замещение в феноксид-ионеРеакция Кольбе
Двуокись углерода реагирует с фенолятом натрия при температуре 125
оС, образуя натриевую соль о-оксибензойной (салициловой) кислоты
Na
+
...
.. O
.
O
C
Электрофил
O
....
O
.. ..
О..
O
C
H
O
Комплекс
Na
+
O
C
O Na
H +
O
OH
+
C
+
O Na
Натриевая соль
салициловой кислоты
Диоксид углерода является электрофильным агентом, реакция
протекает по механизму SEAr. Салициловую кислоту и ряд ее
производных применяют в качестве лекарственных препаратов
(аспирин, салол и др.).
32. ФЕНОЛЫ
КольбеАдольф Вильгельм
Герман
1818 - 1884
33. ФЕНОЛЫ
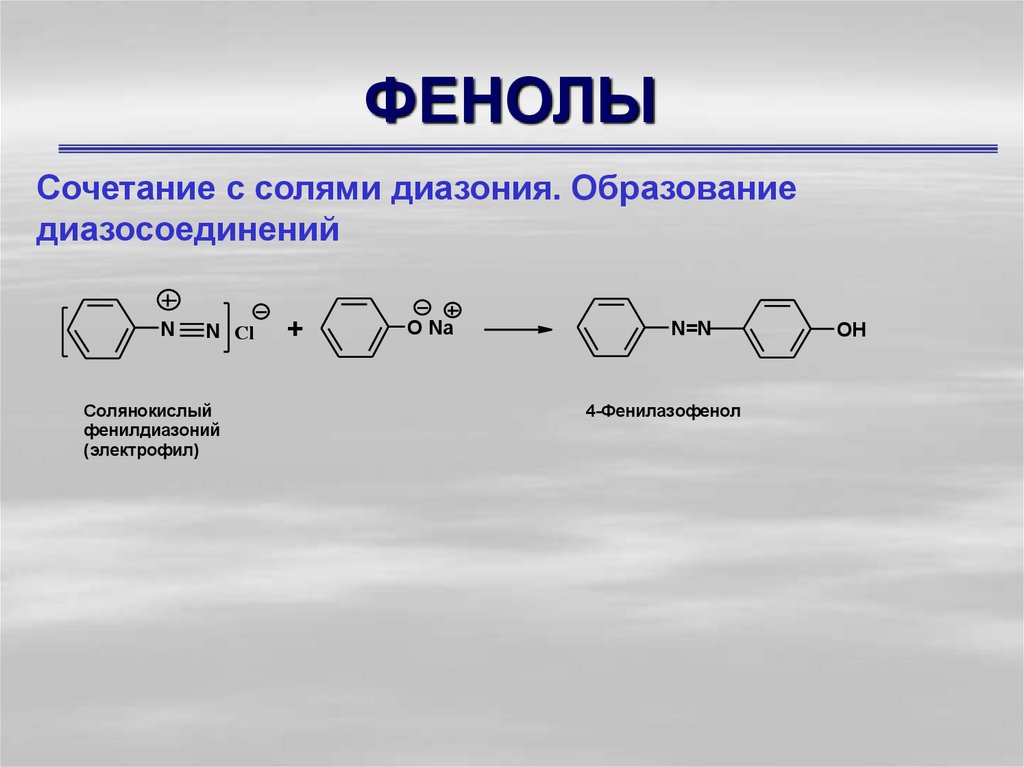
Сочетание с солями диазония. Образованиедиазосоединений
N
N Cl
Солянокислый
фенилдиазоний
(электрофил)
+
O Na
N=N
4-Фенилазофенол
OH
34. ФЕНОЛЫ
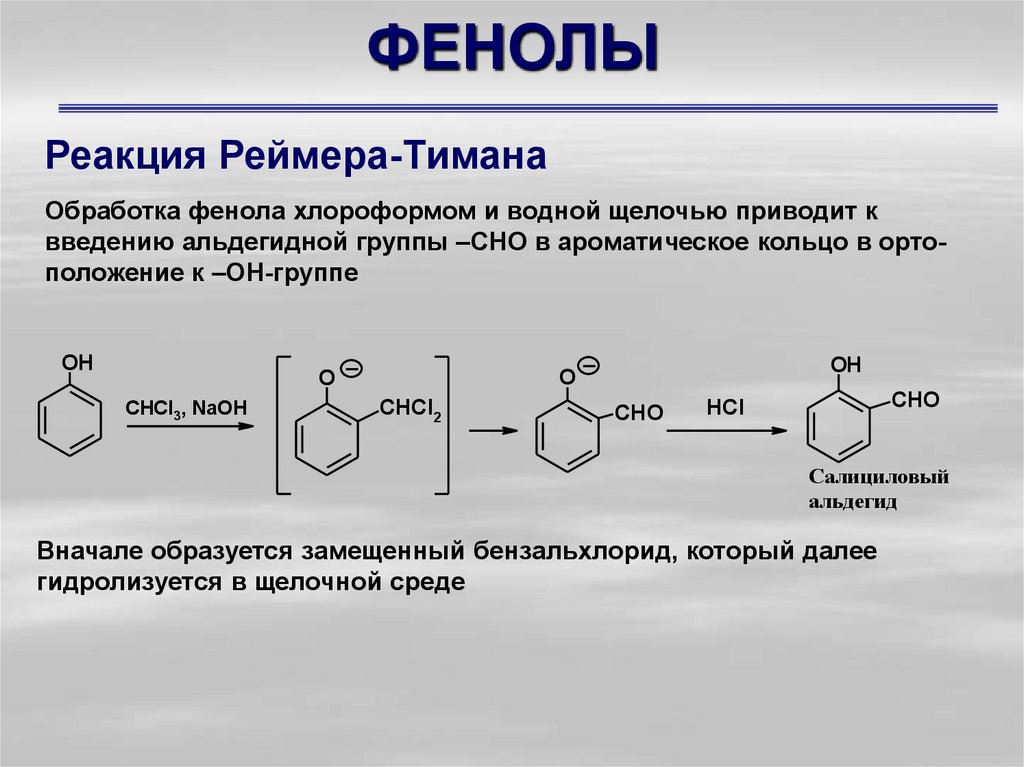
Реакция Реймера-ТиманаОбработка фенола хлороформом и водной щелочью приводит к
введению альдегидной группы –СНО в ароматическое кольцо в ортоположение к –ОН-группе
OH
CHCl3, NaOH
OH
O
O
CHCl2
CHO
CHO
HCl
Салициловый
альдегид
Вначале образуется замещенный бензальхлорид, который далее
гидролизуется в щелочной среде
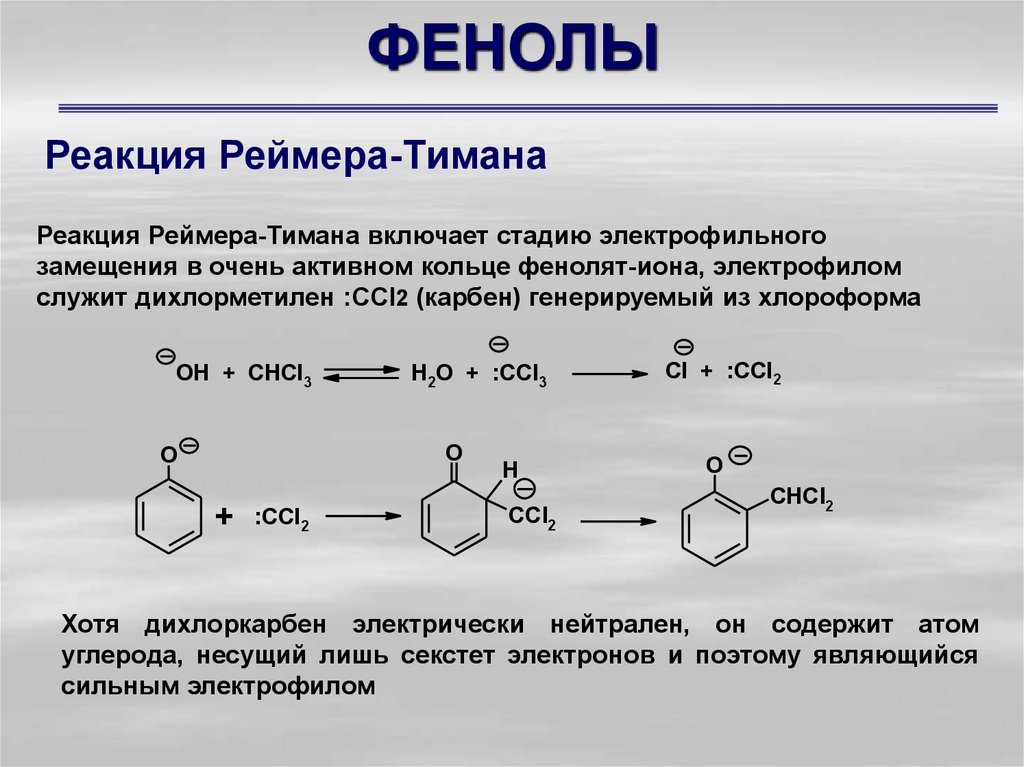
35. ФЕНОЛЫ
Реакция Реймера-ТиманаРеакция Реймера-Тимана включает стадию электрофильного
замещения в очень активном кольце фенолят-иона, электрофилом
служит дихлорметилен :СCl2 (карбен) генерируемый из хлороформа
OH + CHCl3
H2O + :CCl3
O
O
+ :CCl2
H
CCl2
Cl + :CCl2
O
CHCl2
Хотя дихлоркарбен электрически нейтрален, он содержит атом
углерода, несущий лишь секстет электронов и поэтому являющийся
сильным электрофилом
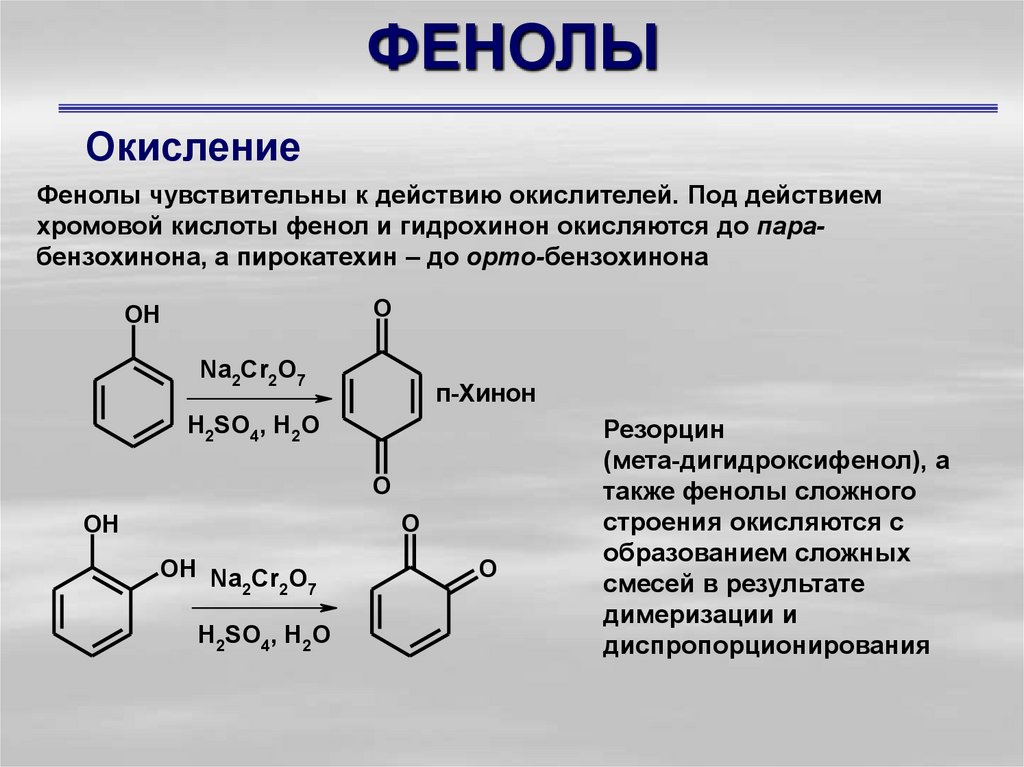
36. ФЕНОЛЫ
ОкислениеФенолы чувствительны к действию окислителей. Под действием
хромовой кислоты фенол и гидрохинон окисляются до парабензохинона, а пирокатехин – до орто-бензохинона
O
OH
Na2Cr2O7
п-Хинон
H2SO4, H2O
O
O
OH
OH Na Cr O
2
2
7
H2SO4, H2O
O
Резорцин
(мета-дигидроксифенол), а
также фенолы сложного
строения окисляются с
образованием сложных
смесей в результате
димеризации и
диспропорционирования
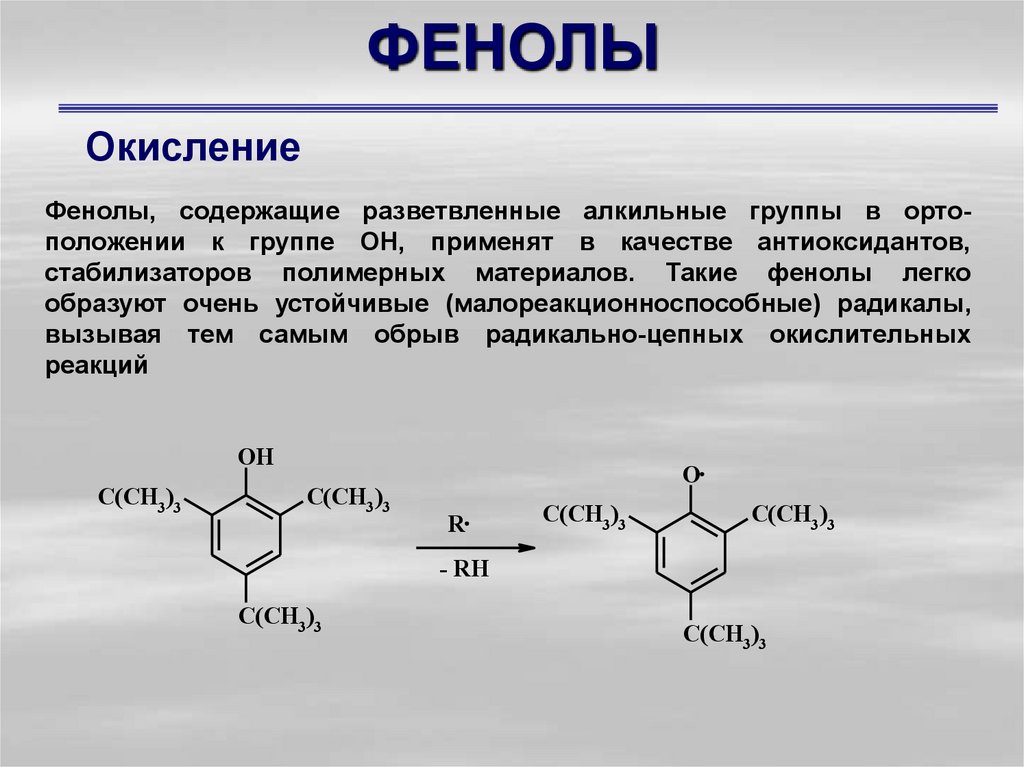
37. ФЕНОЛЫ
ОкислениеФенолы, содержащие разветвленные алкильные группы в ортоположении к группе ОН, применят в качестве антиоксидантов,
стабилизаторов полимерных материалов. Такие фенолы легко
образуют очень устойчивые (малореакционноспособные) радикалы,
вызывая тем самым обрыв радикально-цепных окислительных
реакций
OH
C(CH3)3
C(CH3)3
O
R
C(CH3)3
C(CH3)3
- RH
C(CH3)3
C(CH3)3
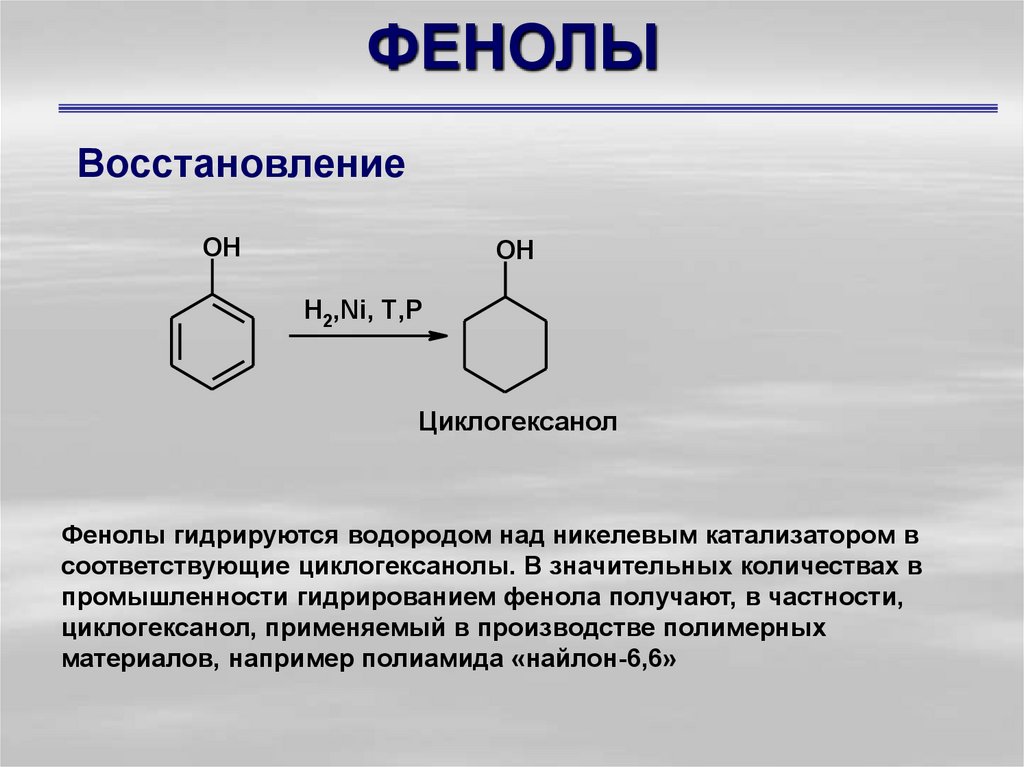
38. ФЕНОЛЫ
ВосстановлениеOH
OH
H2,Ni, T,P
Циклогексанол
Фенолы гидрируются водородом над никелевым катализатором в
соответствующие циклогексанолы. В значительных количествах в
промышленности гидрированием фенола получают, в частности,
циклогексанол, применяемый в производстве полимерных
материалов, например полиамида «найлон-6,6»
39. ФЕНОЛЫ
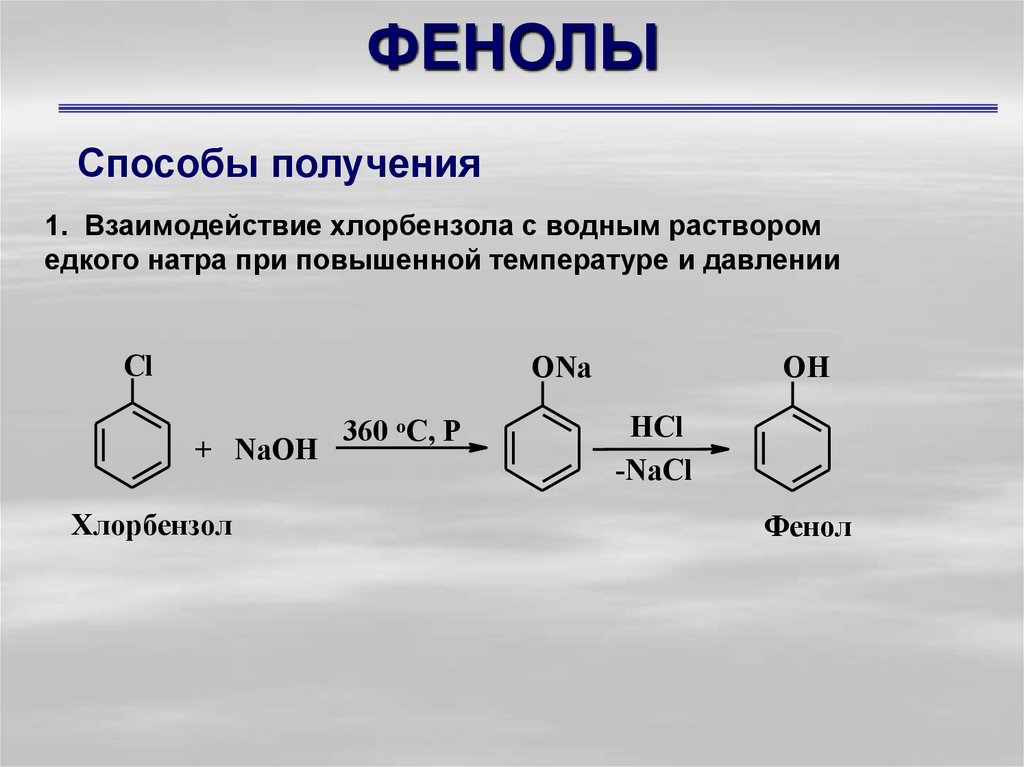
Способы получения1. Взаимодействие хлорбензола с водным раствором
едкого натра при повышенной температуре и давлении
Cl
ONa
+ NaOH
Хлорбензол
360 oC, P
OH
HCl
-NaCl
Фенол
40. ФЕНОЛЫ
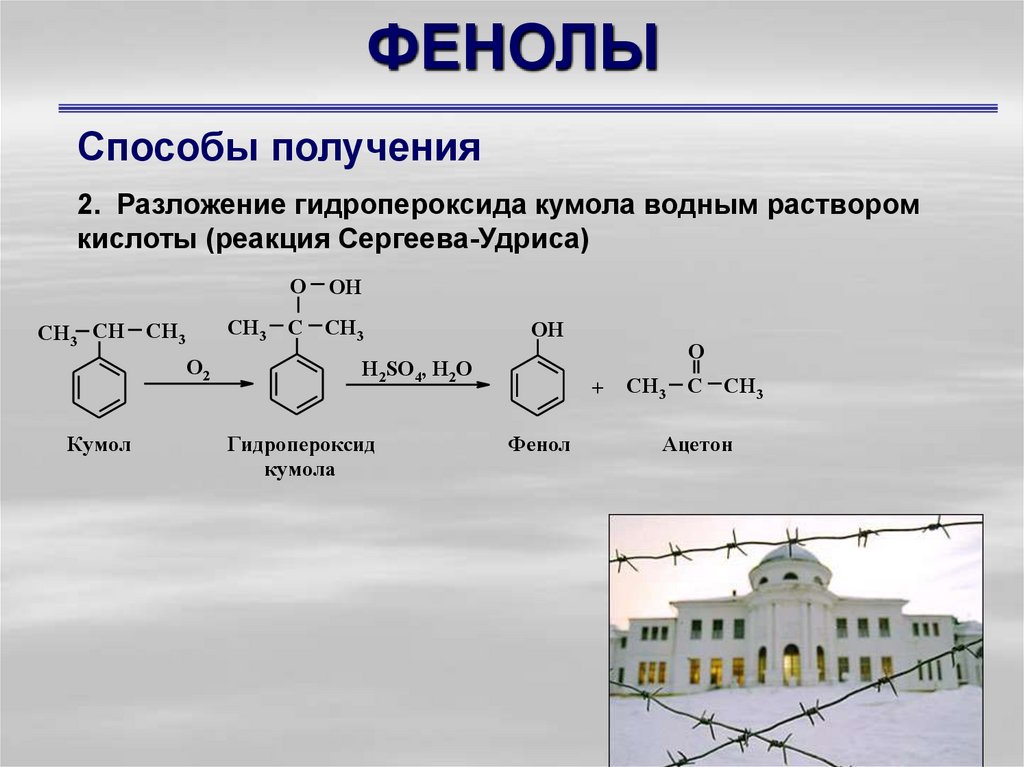
Способы получения2. Разложение гидропероксида кумола водным раствором
кислоты (реакция Сергеева-Удриса)
О
СН3 СН
СН3
СН3
О2
Кумол
ОН
C CH3
OH
Н2SO4, H2O
Гидропероксид
кумола
O
+
Фенол
СН3
C CH3
Ацетон
41. ФЕНОЛЫ
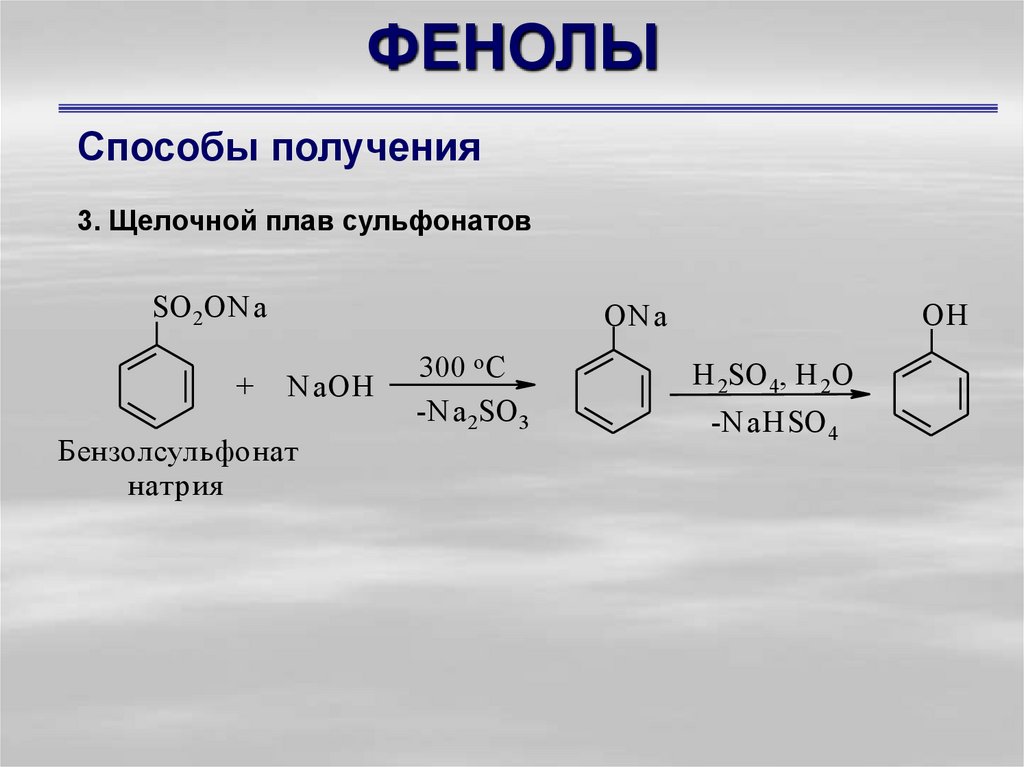
Способы получения3. Щелочной плав сульфонатов
SO 2ONa
+
OH
ONa
N aOH
Бензолсульфонат
натрия
300 o C
-Na 2SO 3
H 2SO 4, Н 2О
-NaHSO 4
42. ФЕНОЛЫ
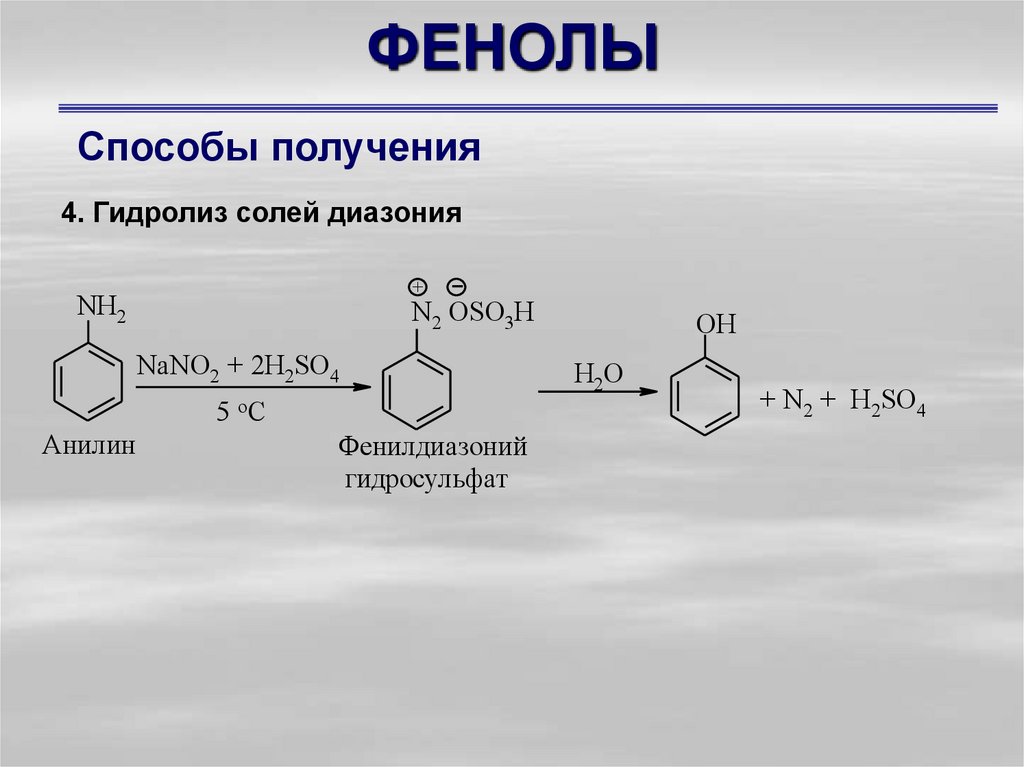
Способы получения4. Гидролиз солей диазония
+
NН2
N2 OSO3H
NaNO2 + 2H2SO4
5 oC
Анилин
Фенилдиазоний
гидросульфат
OН
H2O
+ N2 + H2SO4
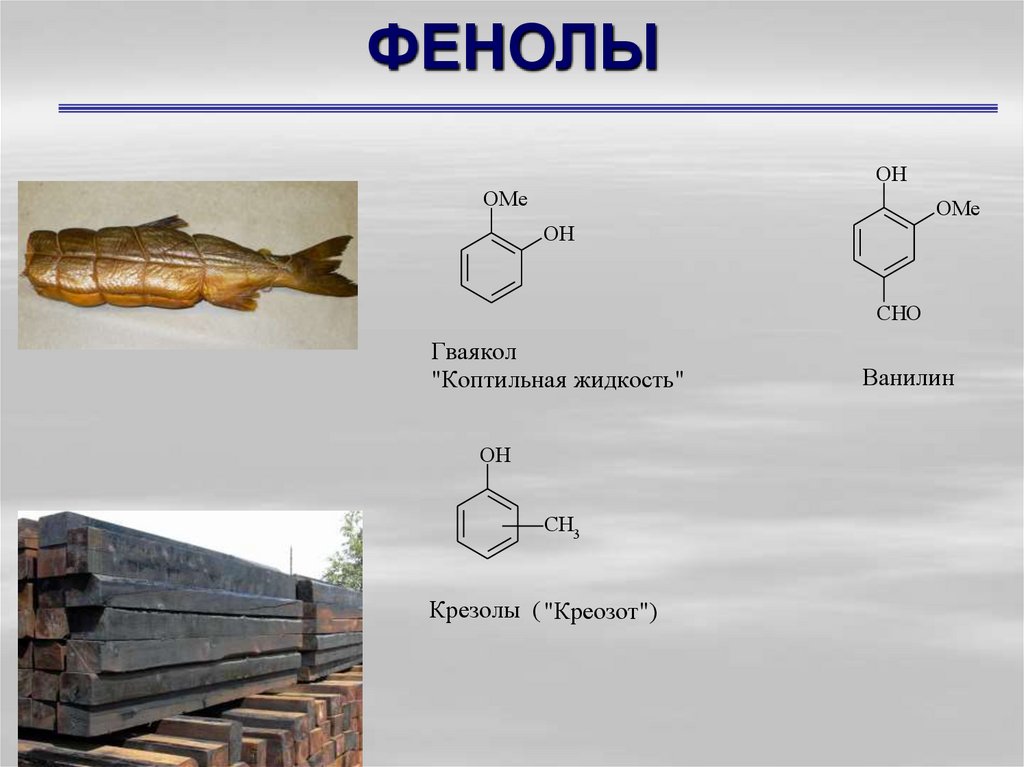
43. ФЕНОЛЫ
OHOMe
OMe
OH
CHO
Гвая кол
"Коптильная жидкость"
OH
CH3
Крезолы ( "Креозот")
Ванилин







 chemistry
chemistry