Similar presentations:
Фенолы. Физические свойства
1. Фенолы
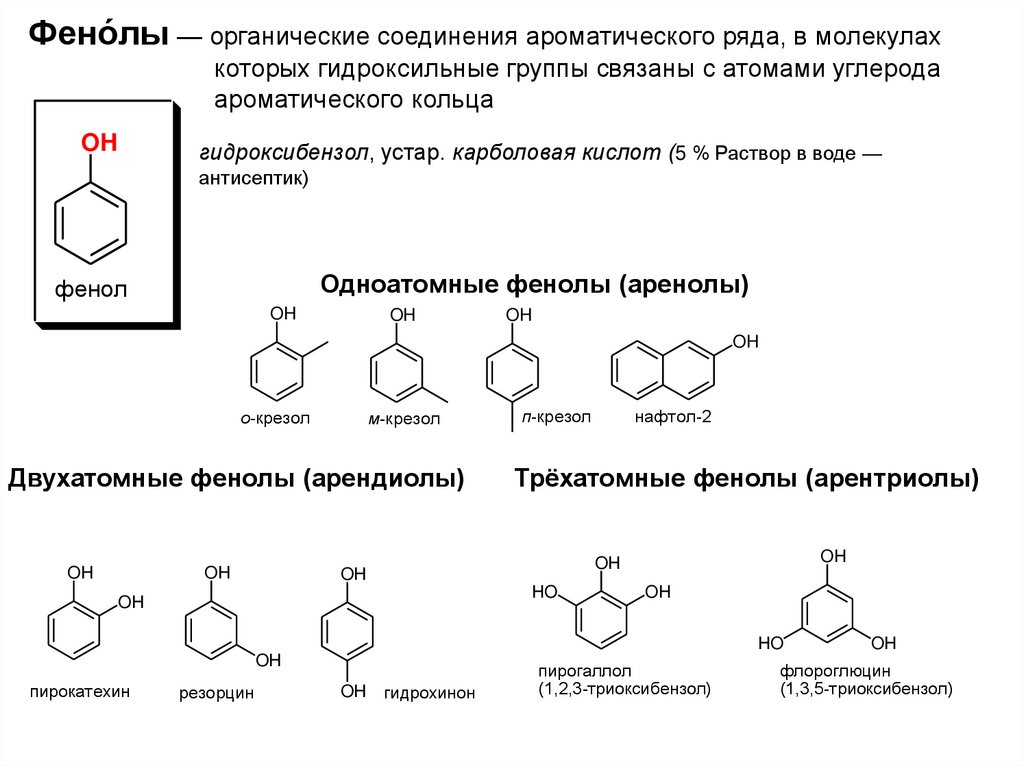
2. Фено́лы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода
ароматического кольцаOH
гидроксибензол, устар. карболовая кислот (5 % Раствор в воде —
антисептик)
Одноатомные фенолы (аренолы)
фенол
OH
OH
OH
OH
о-крезол
м-крезол
Двухатомные фенолы (арендиолы)
OH
OH
п-крезол
Трёхатомные фенолы (арентриолы)
OH
OH
OH
HO
OH
нафтол-2
OH
HO
OH
пирокатехин
резорцин
OH гидрохинон
пирогаллол
(1,2,3-триоксибензол)
OH
флороглюцин
(1,3,5-триоксибензол)
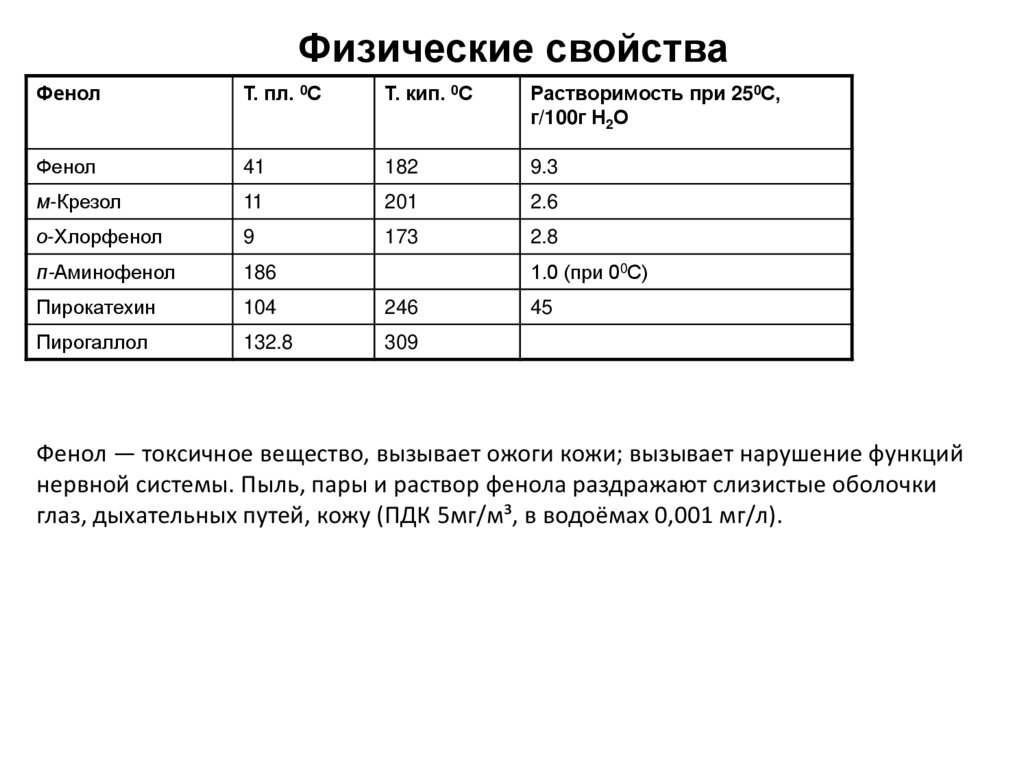
3. Физические свойства
ФенолТ. пл. 0С
Т. кип. 0С
Растворимость при 250С,
г/100г Н2О
Фенол
41
182
9.3
м-Крезол
11
201
2.6
о-Хлорфенол
9
173
2.8
п-Аминофенол
186
Пирокатехин
104
246
Пирогаллол
132.8
309
1.0 (при 00С)
45
Фенол — токсичное вещество, вызывает ожоги кожи; вызывает нарушение функций
нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки
глаз, дыхательных путей, кожу (ПДК 5мг/м³, в водоёмах 0,001 мг/л).
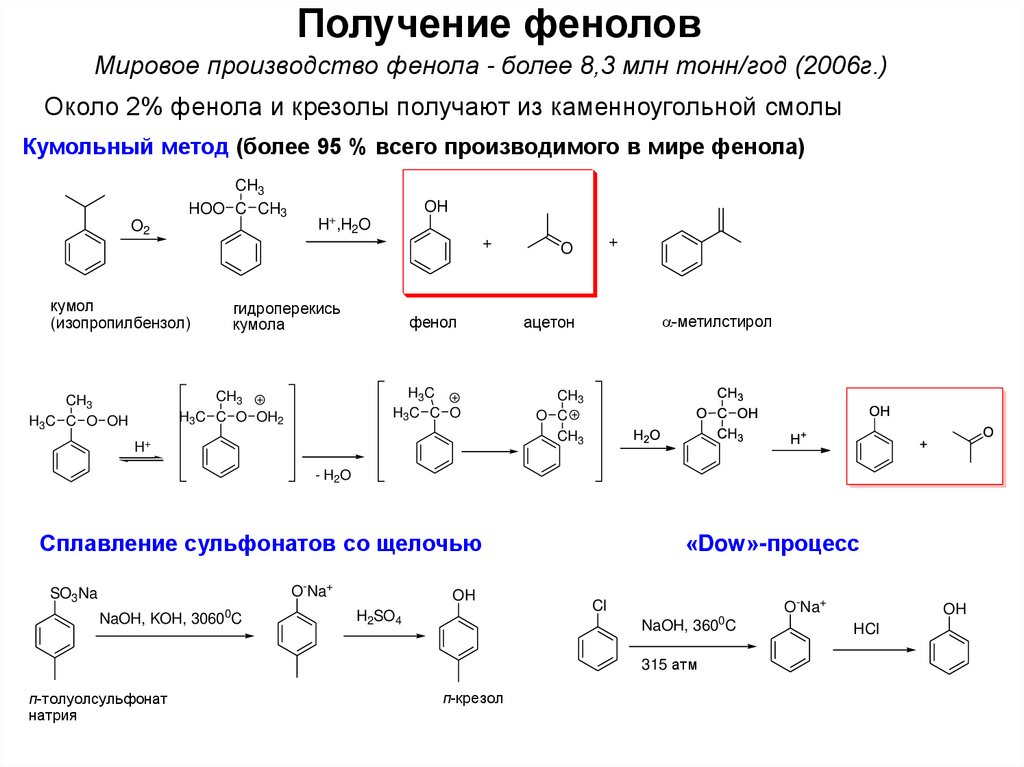
4. Получение фенолов
Мировое производство фенола - более 8,3 млн тонн/год (2006г.)Около 2% фенола и крезолы получают из каменноугольной смолы
Кумольный метод (более 95 % всего производимого в мире фенола)
CH3
HOO C CH3
O2
+
кумол
(изопропилбензол)
гидроперекись
кумола
CH3
H3C C O OH2
CH3
H3C C O OH
OH
H+,H2O
фенол
ацетон
H3C
H3C C O
CH3
O C
CH3
H+
+
O
-метилстирол
- H2O
Сплавление сульфонатов со щелочью
O-Na+
SO3Na
0
NaOH, KOH, 3060 C
OH
H2SO4
«Dow»-процесс
O-Na+
Cl
0
NaOH, 360 C
315 атм
п-толуолсульфонат
натрия
п-крезол
OH
HCl
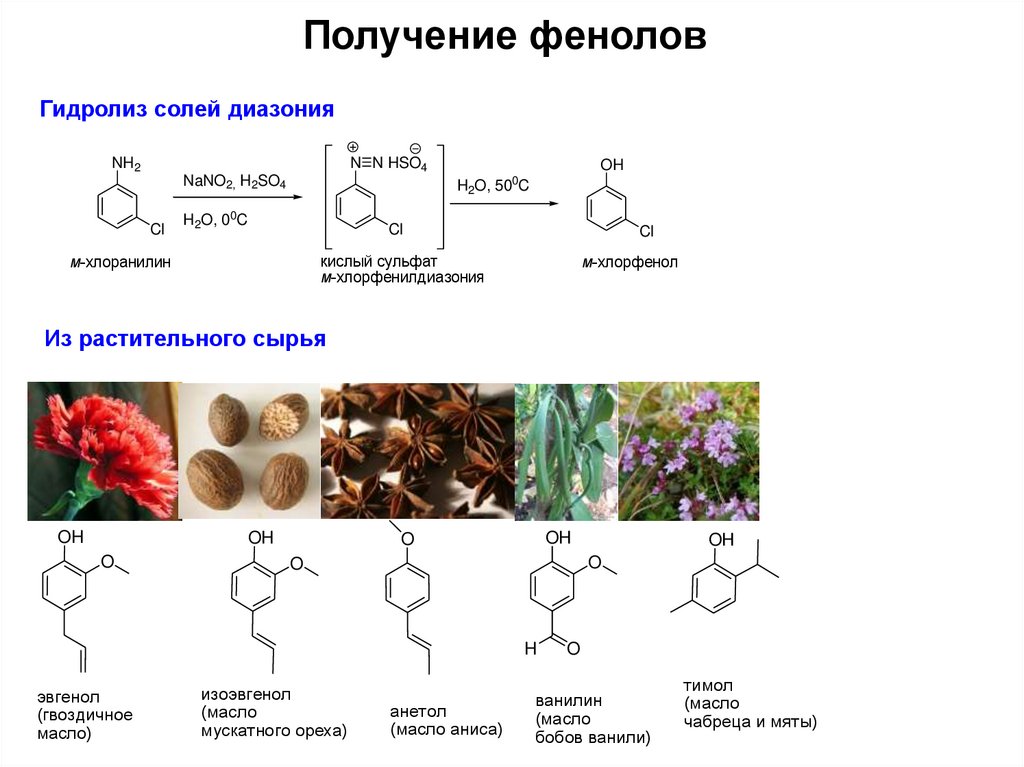
5. Получение фенолов
Гидролиз солей диазонияNH2
N N HSO4
NaNO2, H2SO4
Cl
OH
H2O, 500C
H2O, 00C
Cl
Cl
кислый сульфат
м-хлорфенилдиазония
м-хлоранилин
м-хлорфенол
Из растительного сырья
OH
OH
O
OH
O
O
O
H
эвгенол
(гвоздичное
масло)
изоэвгенол
(масло
мускатного ореха)
OH
анетол
(масло аниса)
O
ванилин
(масло
бобов ванили)
тимол
(масло
чабреца и мяты)
6. Реакции фенолов
1. Реакции по гидроксильной группеКислотные свойства
OH
O
O
Ka 10-10
R
H2O
R + H3O
R
O
O
O
R
R
R
R-OH < Ar-OH < R-COOH
Ка карбоновых кислот ~ 10-5
OH
OK
KOH
H2O
плохо
растворим в воде
хорошо растворим
в воде
В отличие от карбоновых кислот не
растворимы в водном растворе Na2CO3
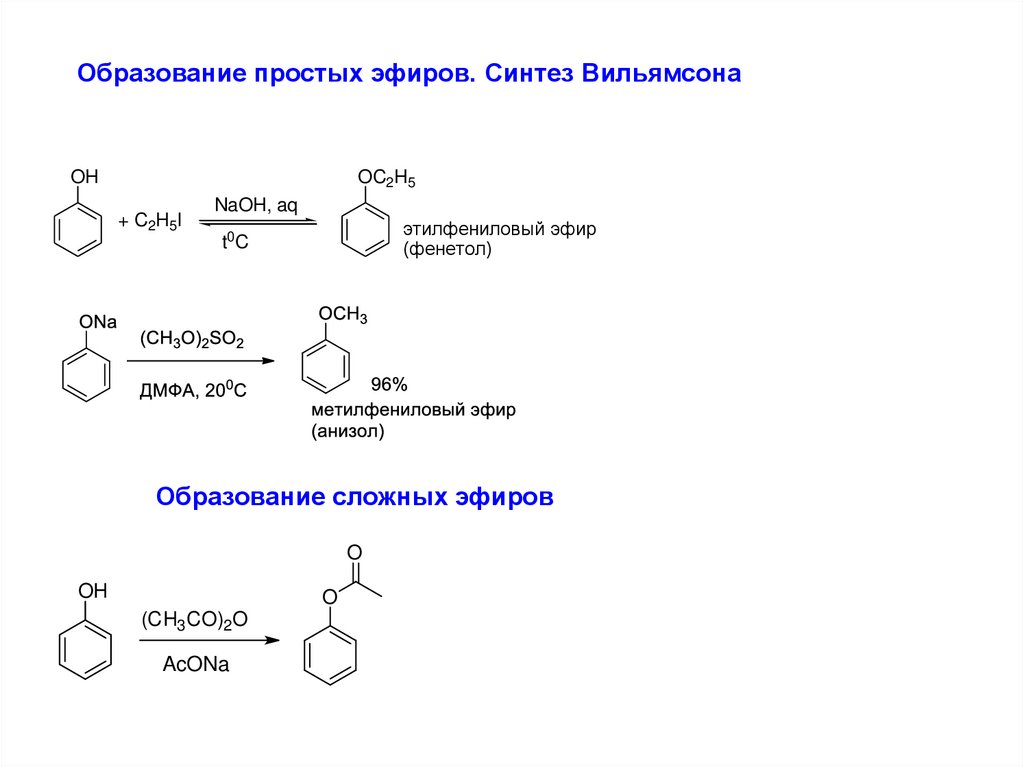
7.
Образование простых эфиров. Синтез ВильямсонаOH
OC2H5
+ C2H5I
NaOH, aq
этилфениловый эфир
(фенетол)
t0C
Образование сложных эфиров
O
OH
O
(CH3 CO)2 O
AcONa
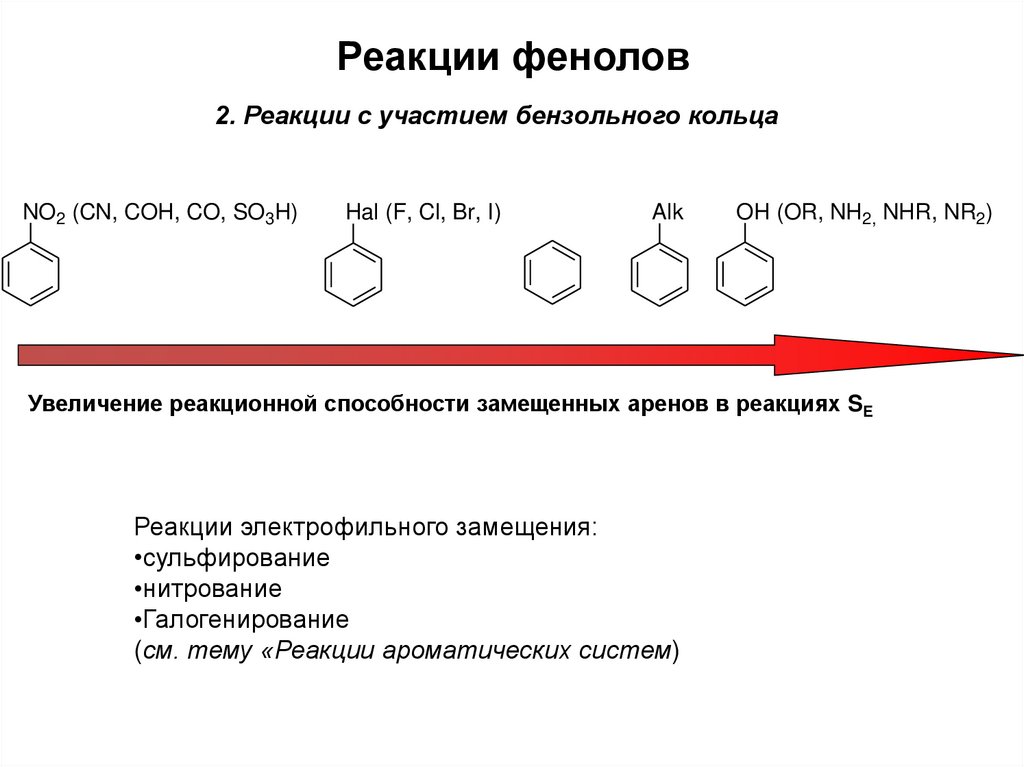
8. Реакции фенолов
2. Реакции с участием бензольного кольцаNO2 (CN, COH, CO, SO3H)
Hal (F, Cl, Br, I)
Alk
OH (OR, NH2, NHR, NR2)
Увеличение реакционной способности замещенных аренов в реакциях SE
Реакции электрофильного замещения:
•сульфирование
•нитрование
•Галогенирование
(см. тему «Реакции ароматических систем)
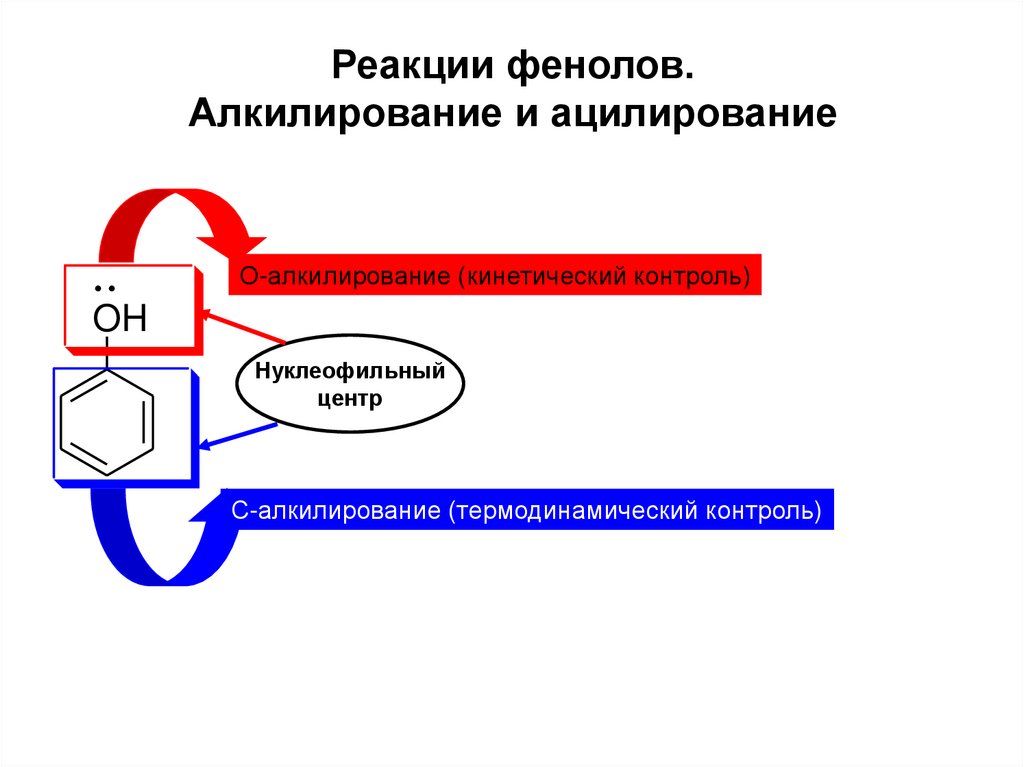
9. Реакции фенолов. Алкилирование и ацилирование
О-алкилирование (кинетический контроль)OH
Нуклеофильный
центр
С-алкилирование (термодинамический контроль)
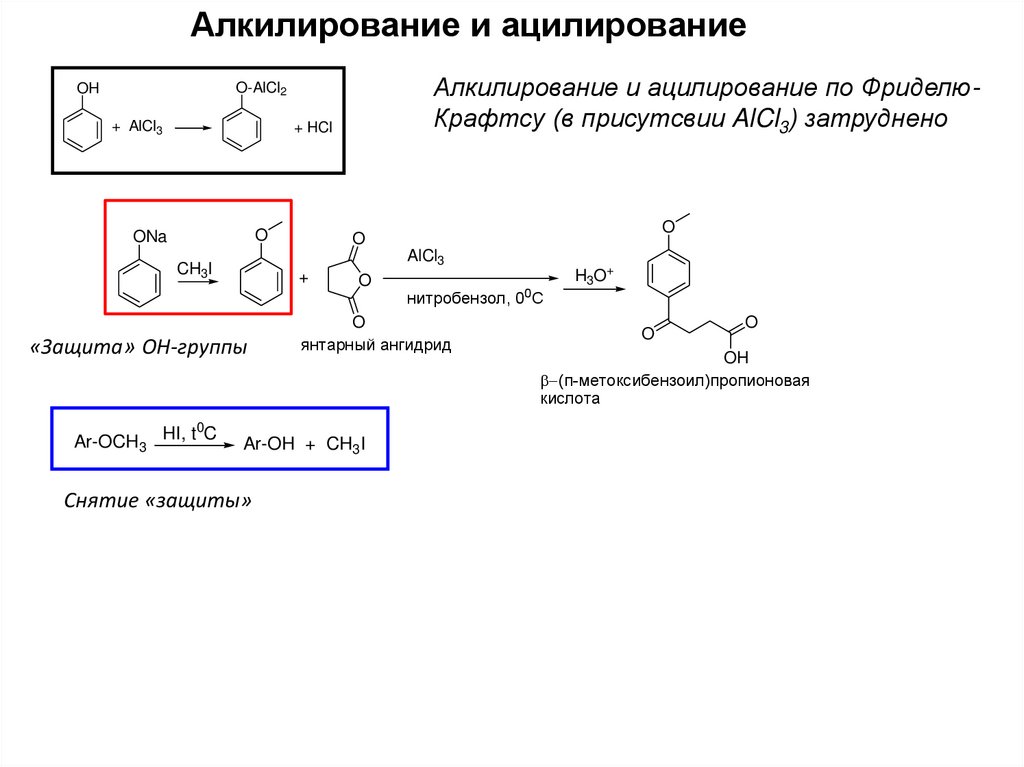
10.
Алкилирование и ацилированиеАлкилирование и ацилирование по ФриделюКрафтсу (в присутсвии AlCl3) затруднено
O-AlCl2
OH
+ AlCl3
+ HCl
O
ONa
AlCl3
CH3I
+
«Защита» ОН-группы
0
Ar-OCH3 HI, t C
O
O
O
O
янтарный ангидрид
Ar-OH + CH3I
Снятие «защиты»
нитробензол, 00С
H3O+
O
O
OH
(п-метоксибензоил)пропионовая
кислота
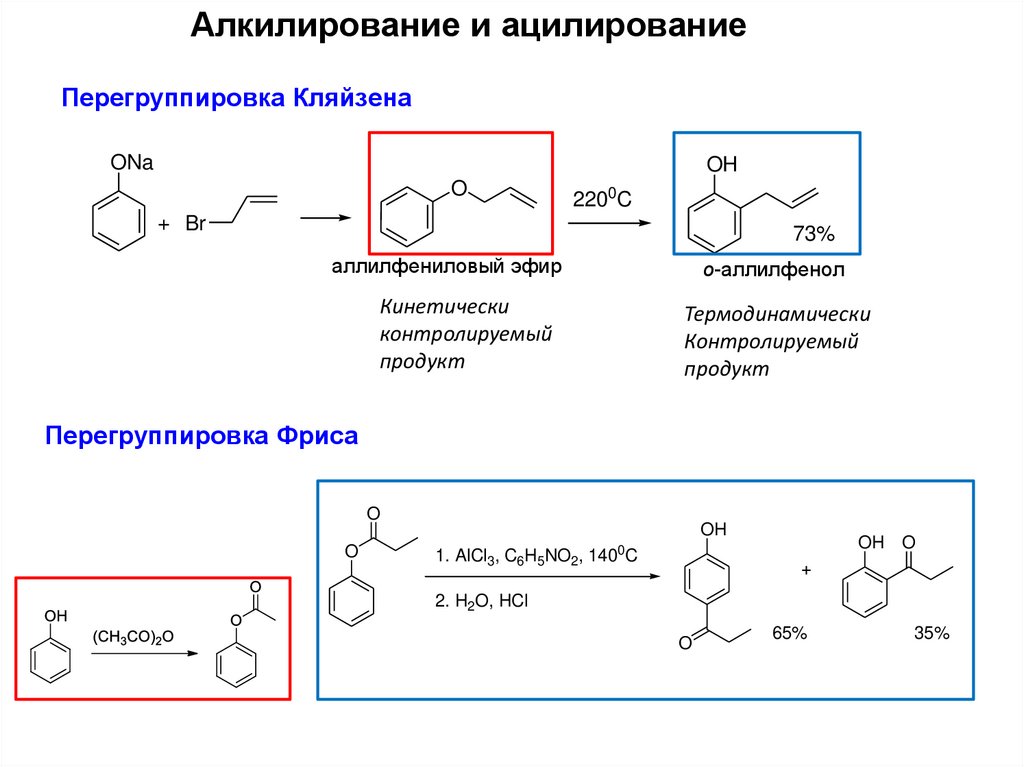
11.
Алкилирование и ацилированиеПерегруппировка Кляйзена
ONa
OH
O
2200C
+ Br
73%
аллилфениловый эфир
о-аллилфенол
Кинетически
контролируемый
продукт
Термодинамически
Контролируемый
продукт
Перегруппировка Фриса
O
O
OH
OH O
0
1. AlCl3, C6H5NO2, 140 C
+
2. H2O, HCl
O
65%
35%
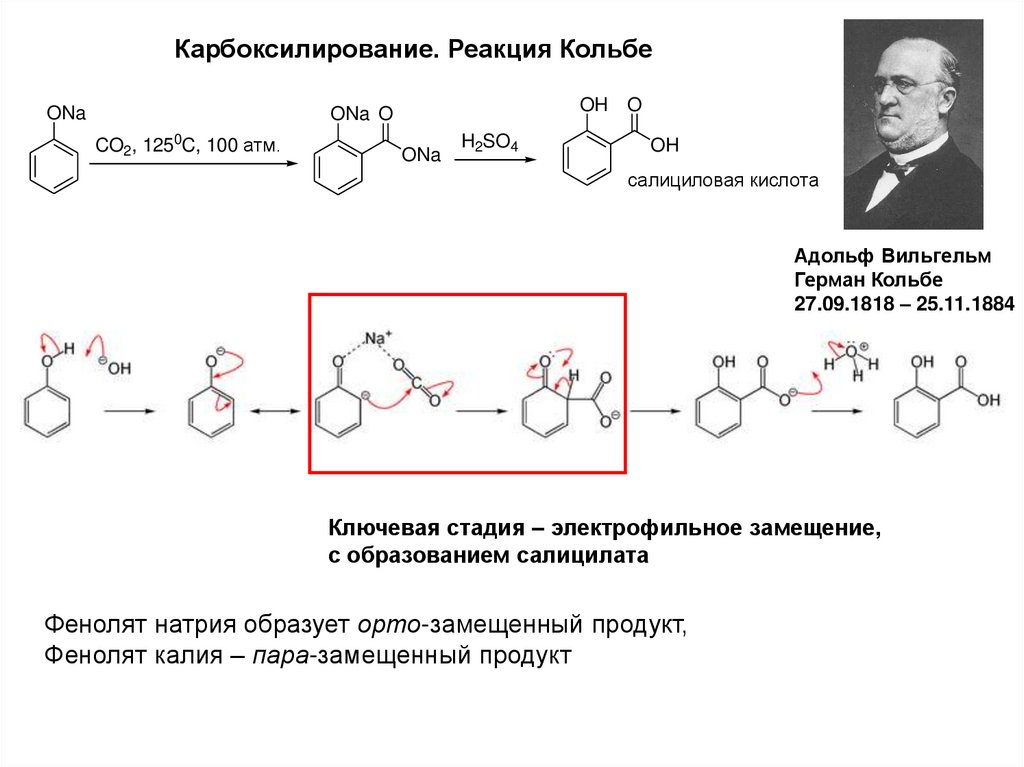
12.
Карбоксилирование. Реакция КольбеONa
OH O
ONa O
CO2, 1250C, 100 атм.
ONa
H2SO4
OH
салициловая кислота
Адольф Вильгельм
Герман Кольбе
27.09.1818 – 25.11.1884
Ключевая стадия – электрофильное замещение,
с образованием салицилата
Фенолят натрия образует орто-замещенный продукт,
Фенолят калия – пара-замещенный продукт
13.
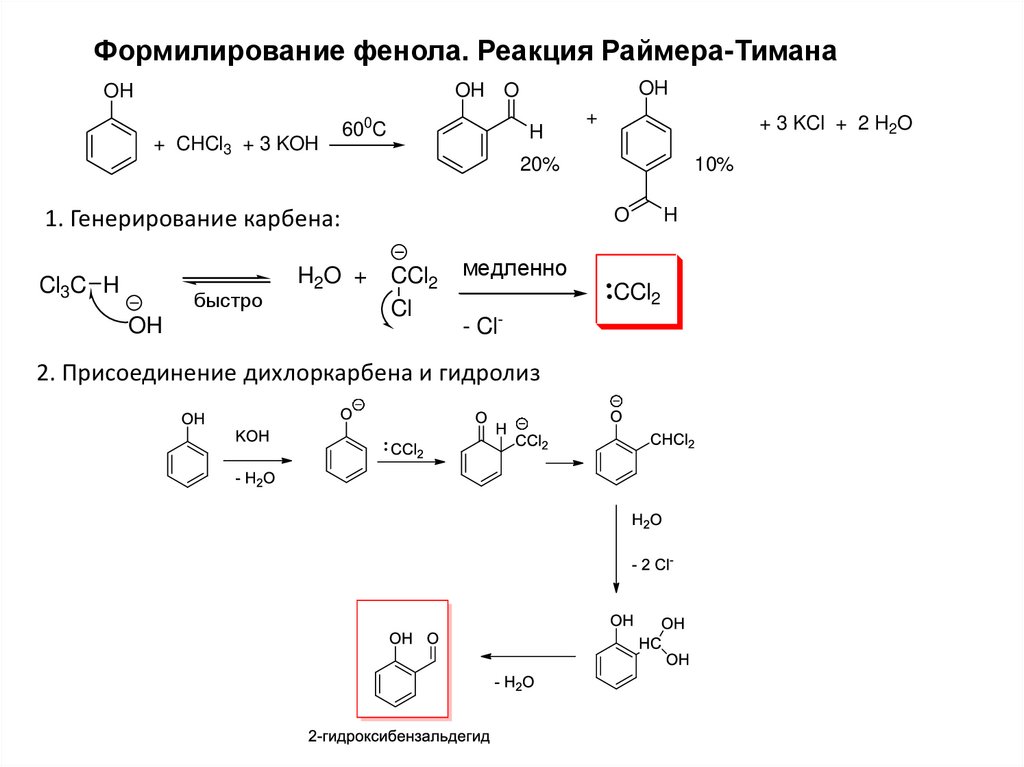
Формилирование фенола. Реакция Раймера-ТиманаOH
OH O
OH
+ CHCl3 + 3 KOH
600C
H
быстро
OH
H2O +
+ 3 KCl + 2 H2O
20%
10%
O
1. Генерирование карбена:
Cl3C H
+
CCl2
Cl
медленно
CCl2
- Cl-
2. Присоединение дихлоркарбена и гидролиз
H
14.
Реакция с формальдегидом. Фенолформальдегидные смолыOH
OH
OH
HCHO
OH
C6H5OH
OH
H+, или OH- 2-(гидроксиметил)фенол
HCHO
H+, или OH-
H2C
OH
CH2
CH2
CH2
HO
OH
CH2
H2C
CH2
Основный катализ
Кислотный катализ
15. Применение
Мировое потребление фенола (2006 г.):CH3
HO
44 % - на производство бисфенола А, который, в свою очередь,
используется для производства эпоксидных смол,
антиоксидпнтов, гербицидов.
30 % - производство фенолформальдегидных смол
12 % фенола гидрированием превращается в циклогексанол
(используемый для получения нейлона и капрона)
14 % - на другие нужды, в том числе на производство
антиоксидпнтов (ионол), неионогенных ПАВ —
полиоксиэтилированных алкилфенолов (неонолы), других
фенолов (крезолов), лекарственных препаратов (аспирин),
антисептиков (ксероформа) и пестицидов.
Раствор 1,4 % фенола применяется в медицине (орасепт), как
обезболивающее и антисептическое средство.
Фенол и его производные обуславливают консервирующие
свойства коптильного дыма.Также фенол используют в
качестве консерванта в вакцинах.
OH
CH3
бисфенол А



 chemistry
chemistry