Similar presentations:
Спирты. Классификация спиртов
1. СПИРТЫ
26.11.20182.
I.Классификация спиртов1.
В зависимости от количества –ОН групп спирты бывают:
а) одноатомные
СН3ОН,
С2Н5ОН,
СН3–СН2 – СН2ОН
б) двухатомные (диолы, гликоли)
СН2–СН2 ,
|
|
ОН ОН
СН2–СН2–СН2 ,
|
|
ОН
ОН
СН3–СН–СН2
|
|
ОН ОН
в) трёхатомные (триолы)
СН2–СН–СН2
|
|
|
ОН ОН ОН
г) многоатомные
26.11.2018
CH2–CH–CH–CH–CH–CH2
|
|
|
| |
|
OH OH OH OH OH OH
2
3.
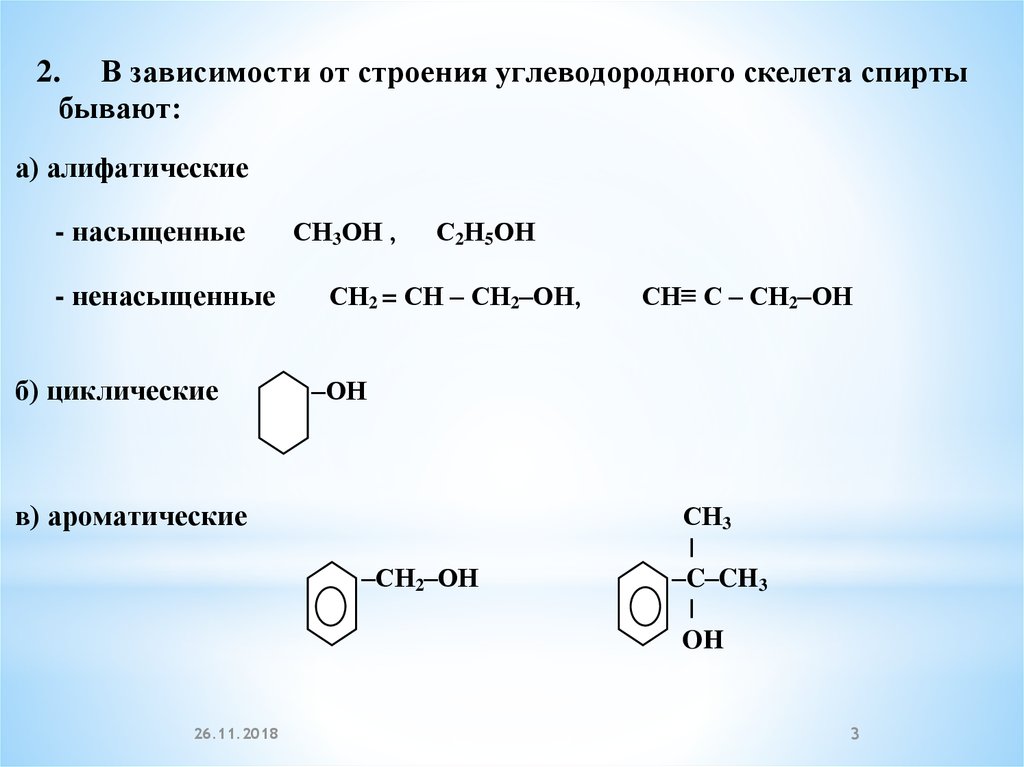
2. В зависимости от строения углеводородного скелета спиртыбывают:
а) алифатические
- насыщенные
- ненасыщенные
б) циклические
СН3ОН ,
С2Н5ОН
СН2 = СН – СН2–ОН,
–ОН
в) ароматические
–СН2–ОН
26.11.2018
СН≡ С – СН2–ОН
СН3
|
–C–CH3
|
OH
3
4.
3. В зависимости от характера углеродного атома,несущего гидроксильную группу, спирты бывают:
1)
первичные
СН3 – СН2 – ОН
2)
вторичные
СН3 – СН – СН3
|
OH
3)
третичные
ОН
|
CH3–C–CH3
|
CH3
26.11.2018
4
5.
II.Изомерия и номенклатура1. Тривиальная номенклатура:
CH3–OH
древесный спирт
CH3–CH2–OH
винный спирт
CH2–CH–CH2
глицирин
|
|
|
OH OH OH
CH2–CH2 этиленгликоль
|
|
OH OH
CH2–CH–CH–CH–CH–CH2 сорбит
|
|
|
| |
|
OH OH OH OH OH OH
2. Рациональная номенклатура:
CH3–OH метиловый спирт
CH3–CH2–OH этиловый спирт
CH3
|
CH3–C–CH3 третбутиловый спирт
|
OH
26.11.2018
5
6.
3. Систематическая номенклатура IUPAC:CH3–CH2–OH
этанол
CH3
1
|2 3
CH3 – C – CH3 2-метилпропанол-2
|
OH
6
5
4
3
2
1
CH3–CH –CH–CH2–CH–CH3
|
|
|
Cl CH2
OH
|
CH2
|
CH3
3
2
4-пропил-5-хлорогексанол-2
1
CH2 = C – CH2
| |
CH3 OH
26.11.2018
2-метилпропен-2-ол-1
6
7.
4.Карбинольная номенклатура:
За основу принимается карбинол CH3 - OH , остальные соединения
рассматриваются как алкил- и арилзамещенные карбинола
CH3–CH2–OH
метилкарбинол
CH3–CH2–CH2–OH
CH3
CH3
|
|
CH3–CH–C–CH2–CH–CH3
|
|
CH3 OH
26.11.2018
этилкарбинол
метилизопропилизобутилкарбинол
7
8.
III. Способы полученияЕсли в результате химической реакции образуется двухатомный спирт и две
гидроксильные группы находятся при одном С атоме, то происходит
выделение воды и образование альдегида или кетона
Cl
|
CH3–CH
|
Cl
+ 2H2O
-2HCl
OH
|
CH3–CH
|
OH
O
||
CH3–C–H
-H2O
Если в результате химической реакции образуется трёхатомный спирт и
три гидроксильные группы находятся при одном С атоме, то происходит
выделение воды и образование кислоты
Cl
|
CH3–C – Cl
|
Cl
+ 3H2O
-3HCl
26.11.2018
OH
|
CH3–C – OH
|
OH
O
||
CH3–C–OH
-H2O
9.
Если гидроксильная группа находится при углероде c ненасыщеннойсвязью, то происходит кетоенольная таутомерия
(правило Эльтекова)
СН≡СН
+
СН≡С–СН3
Н2О
+
СН2=СН
|
ОН
Н2О
26.11.2018
СН3–С=О
|
Н
СН2=С–СН3
|
OH
СН3–С–СН3
||
O
9
10.
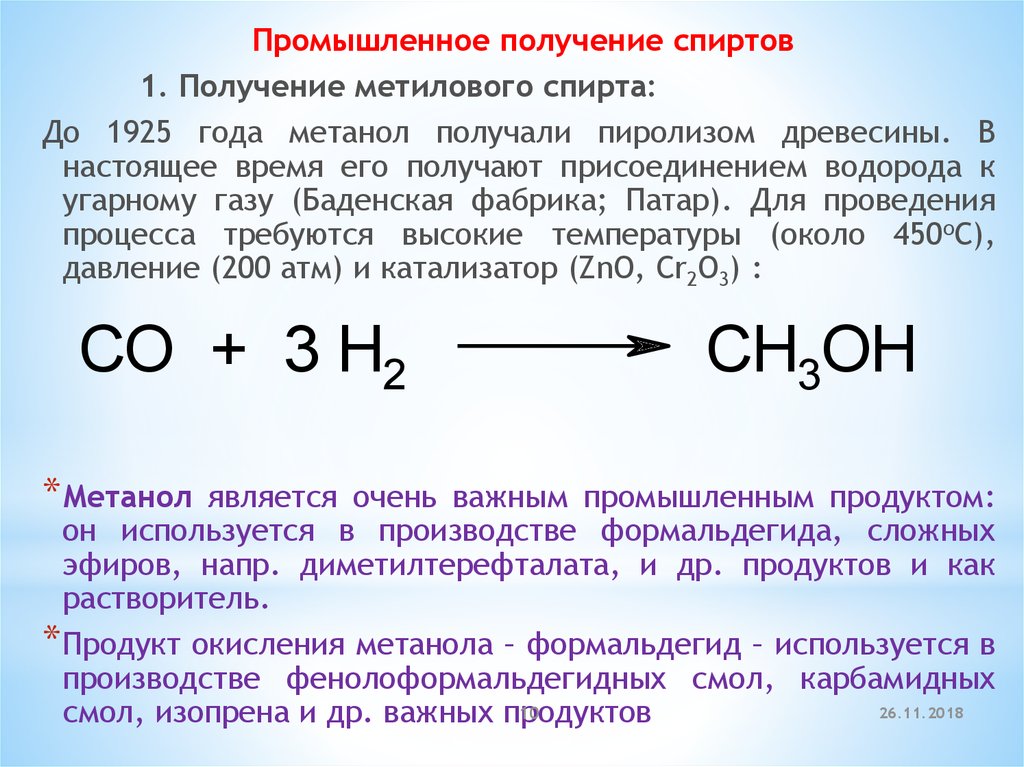
Промышленное получение спиртов1. Получение метилового спирта:
До 1925 года метанол получали пиролизом древесины. В
настоящее время его получают присоединением водорода к
угарному газу (Баденская фабрика; Патар). Для проведения
процесса требуются высокие температуры (около 450оС),
давление (200 атм) и катализатор (ZnO, Cr2O3) :
CO + 3 H2
* Метанол
CH3OH
является очень важным промышленным продуктом:
он используется в производстве формальдегида, сложных
эфиров, напр. диметилтерефталата, и др. продуктов и как
растворитель.
* Продукт окисления метанола – формальдегид – используется в
производстве фенолоформальдегидных смол, карбамидных
26.11.2018
10
смол, изопрена и др. важных продуктов
11.
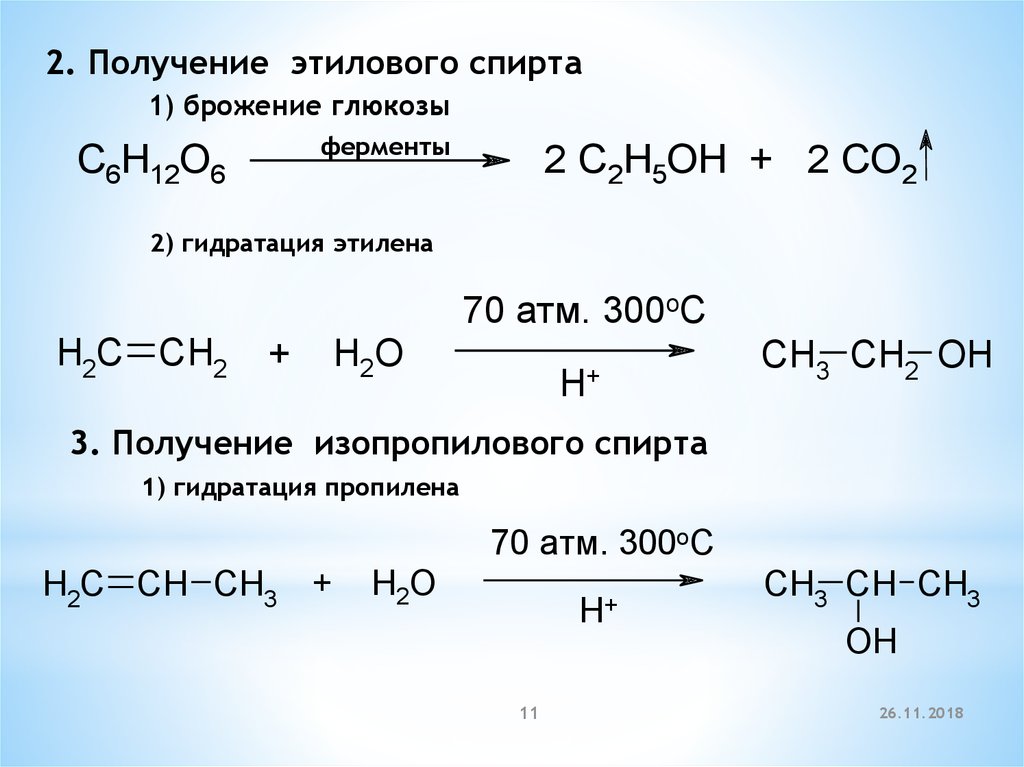
2. Получение этилового спирта1) брожение глюкозы
ферменты
C6H12O6
2 C2H5OH + 2 CO2
2) гидратация этилена
70 атм. 300oC
H2C CH2
+
H2O
H+
CH3 CH2 OH
3. Получение изопропилового спирта
1) гидратация пропилена
70 атм. 300oC
H2C CH CH3
+
H2O
H+
11
CH3 CH CH3
OH
26.11.2018
12.
Лабораторные способы получения1.Гидролиз галогенопроизводных углеводородов:
CH3–CH2–Cl + H2O
CH3–CH2–OH
CH3–CH2–Cl + NaOH
вод.р.
+ HCl
CH3–CH2–OH + NaCl
2. Гидратация олефинов:
H+ Al2O3
CH2 = CH2 + H2O
CH3–CH2–OH (по правилу Марковникова)
Механизм реакции:
+ HOH
CH2 = CH–CH3
+
H–O+–H
|
CH3–CH–CH3
протонированный
спирт
26.11.2018
H
+
CH3–CH –CH3
+
OH
|
CH3–CH–CH3 + H+
12
13.
3. Синтез спиртов из карбонильных соединений при помощиреактива Гриньяра
1)
синтез из альдегидов:
а) синтез первичных спиртов
используется только муравьиный альдегид
HC∂+=O∂- +
|
H
R- Mg2+ Cl-
HC∂+=O∂- +
|
H
СН3 Mg2+ Cl26.11.2018
R
R
|
+H2O
|
HC–O–MgCl
HCH–OH
|
- MgOHCl
H
СН3
СН3
|
+H2O
|
HC–O–MgCl
HCH–OH
|
- MgOHCl
H
13
14.
б) синтез вторичных спиртовиспользуется любой альдегид
CH3–C∂+=O∂- + R- Mg2+ Cl|
H
CH3–C∂+=O∂- + CH3Mg2+ Cl|
H
26.11.2018
R
R
|
+H2O
|
CH3–C–O–MgCl
CH3–CH–OH
|
- MgOHCl
H
CH3
CH3
|
+H2O
|
CH3–C–O–MgCl
CH3–CH–OH
|
- MgOHCl
H
14
15.
2) синтез из кетонов (синтез третичных спиртов):O
||
CH3–C–CH3
O
||
CH3–C–CH3
+
+
26.11.2018
RMgCl
CH3MgCl
OMgCl
OH
|
+H2O
|
CH3–C–CH3
CH3–C–CH3
|
- MgOHCl
|
R
R
OMgCl
OH
|
+H2O
|
CH3–C–CH3
CH3–C–CH3
|
- MgOHCl
|
CH3
CH3
15
16.
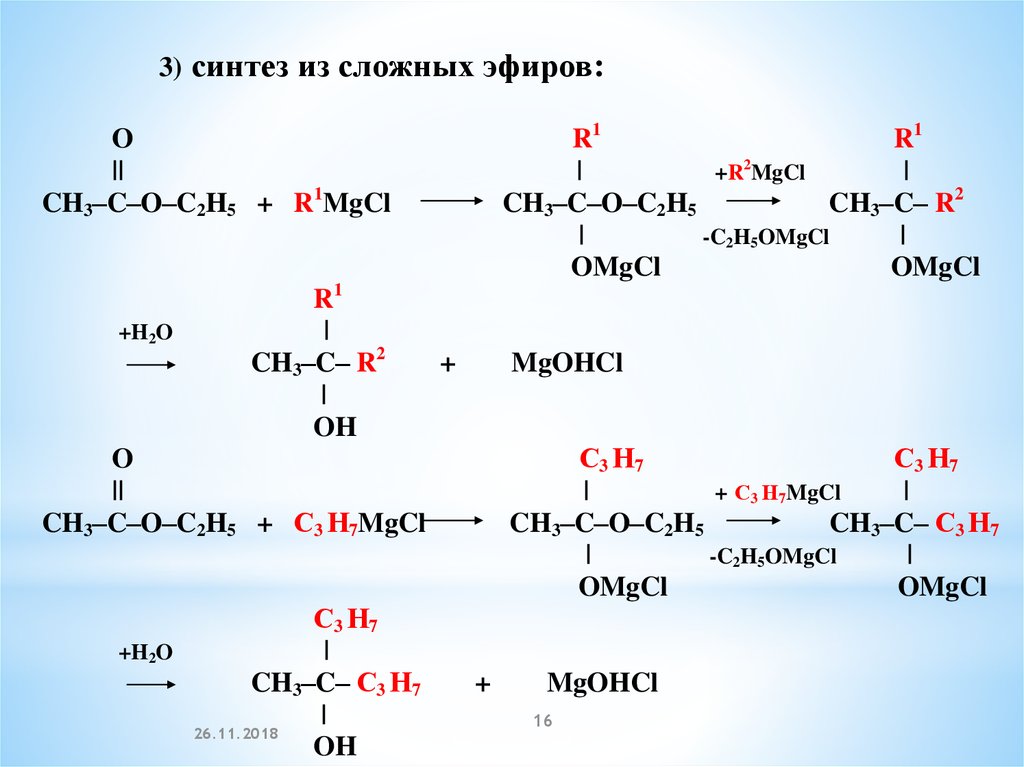
3) синтез из сложных эфиров:R1
R1
|
+R2MgCl
|
CH3–C–O–C2H5
CH3–C– R2
|
-C2H5OMgCl
|
OMgCl
OMgCl
O
||
CH3–C–O–C2H5 + R1MgCl
+H2O
R1
|
CH3–C– R2
|
OH
+
MgOHCl
С 3 Н7
С 3 Н7
|
+ С3 Н7MgCl
|
CH3–C–O–C2H5
CH3–C– С3 Н7
|
-C2H5OMgCl
|
OMgCl
OMgCl
O
||
CH3–C–O–C2H5 + С3 Н7MgCl
+H2O
С 3 Н7
|
CH3–C– С3 Н7
|
26.11.2018
OH
+
MgOHCl
16
17. IV. Электронное строение атома кислорода
O26.11.2018
1s2
2s2
2p4
17
18.
109oCH3
H
O
sp3
..
..
1826.11.2018
19.
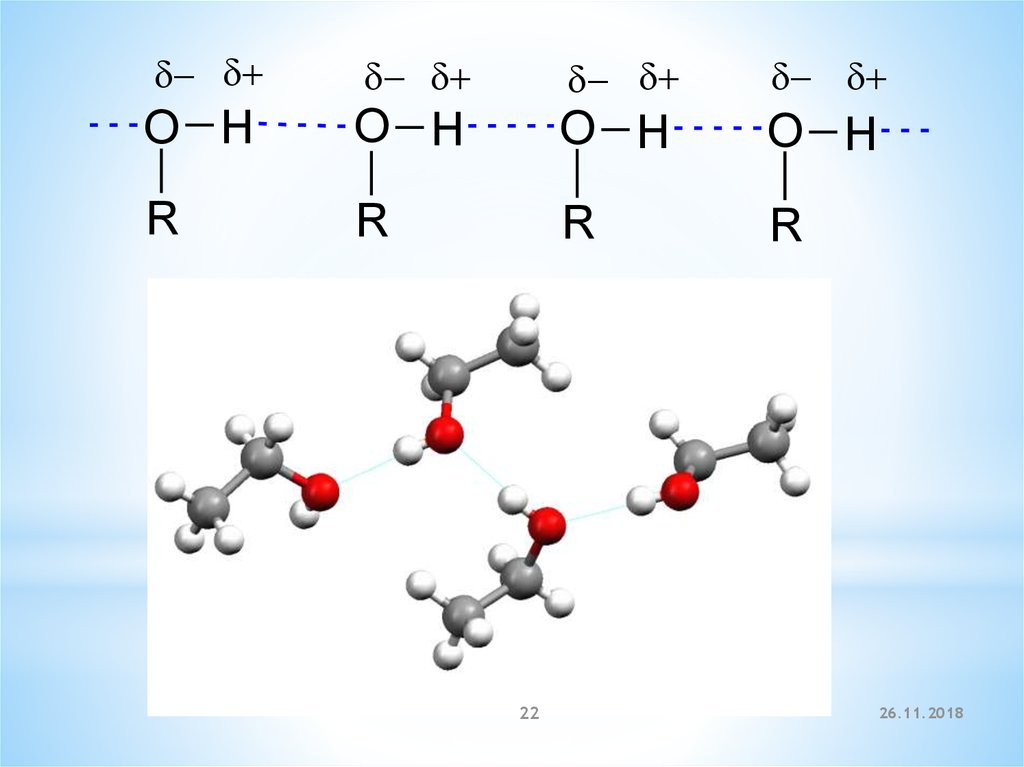
V. Физические свойства*Гидроксигруппа является сильно полярной
группой, поэтому низшие спирты растворяются
в воде неограниченно: метанол, этанол,
пропанол смешиваются с водой во всех
отношениях.
*С увеличением количества атомов углерода
спирты всё более начинают напоминать
углеводороды.
*Растворимость амилового спирта (пентанола-1)
– 2,7 г/ 100 мл,
*растворимость октанола-1 – 0,059 г/ 100 г.
19
26.11.2018
20.
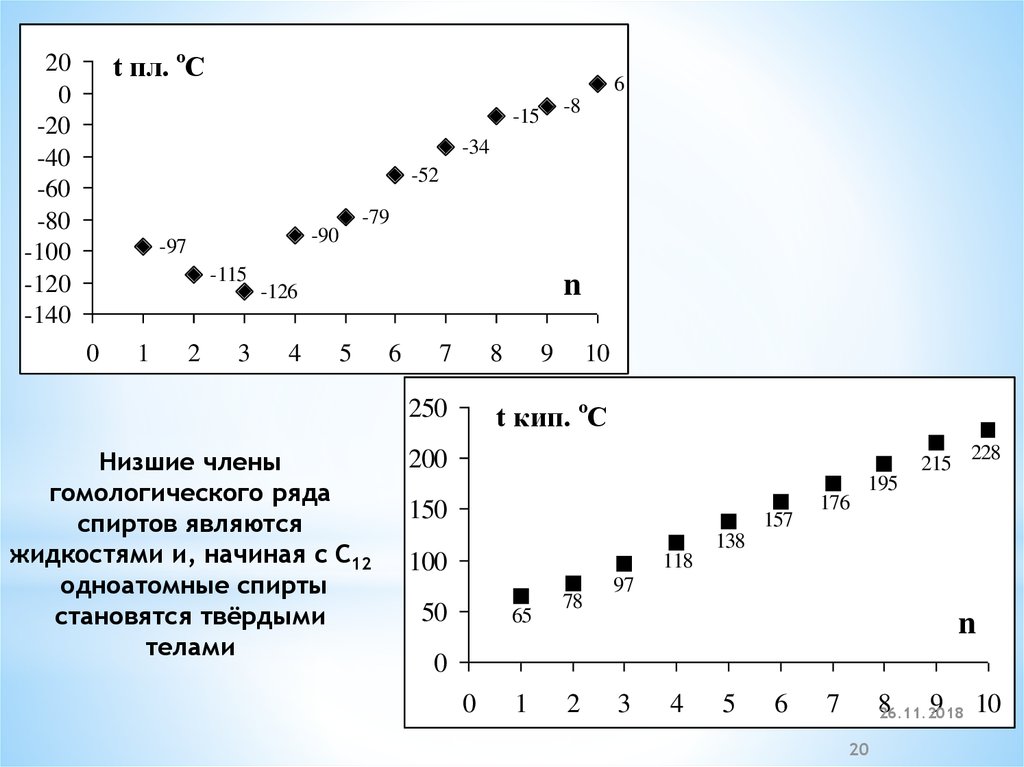
t пл. оС20
0
-20
-40
-60
-80
-100
-120
-140
6
-8
-15
-34
-52
-97
-115
0
1
-79
-90
2
3
n
-126
4
5
6
7
8
10
t кип. оС
250
Низшие члены
гомологического ряда
спиртов являются
жидкостями и, начиная с C12
одноатомные спирты
становятся твёрдыми
телами
9
200
215
228
195
150
157
176
138
100
118
50
65
78
97
*
n
0
0
1
2
3
4
5
6
7
826.11.2018
9 10
20
21.
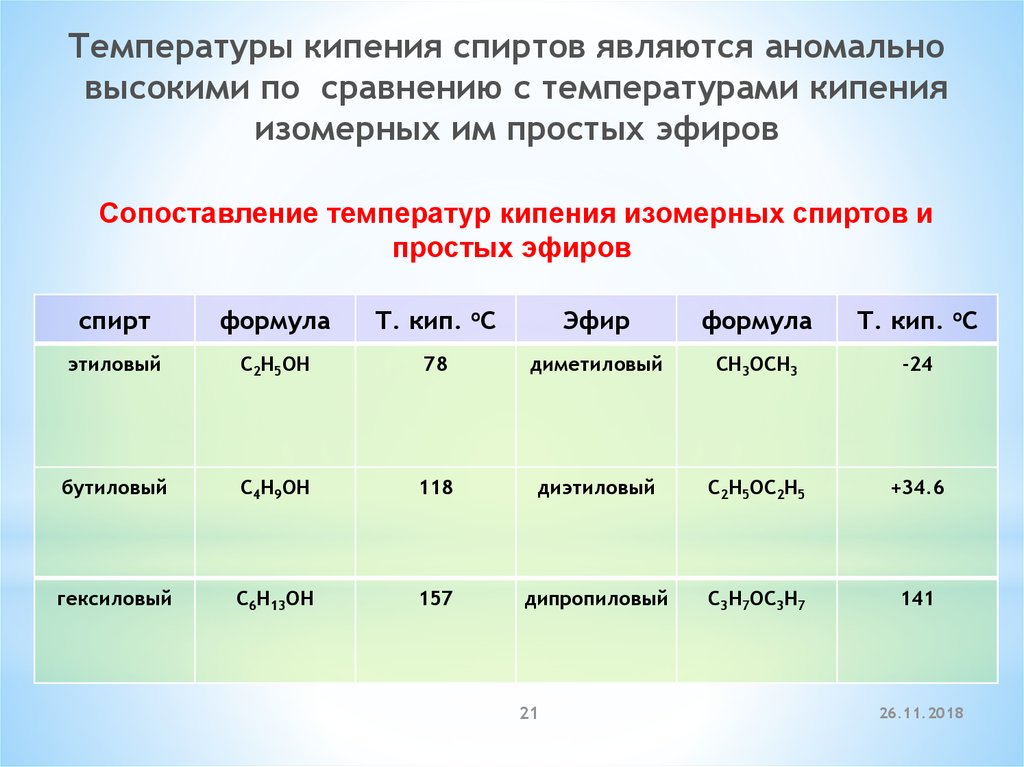
Температуры кипения спиртов являются аномальновысокими по сравнению с температурами кипения
изомерных им простых эфиров
Сопоставление температур кипения изомерных спиртов и
простых эфиров
спирт
формула
Т. кип. оС
Эфир
формула
Т. кип. оС
этиловый
C2H5OH
78
диметиловый
CH3OCH3
-24
бутиловый
C4H9OH
118
диэтиловый
C2H5OC2H5
+34.6
гексиловый
C6H13OH
157
дипропиловый
C3H7OC3H7
141
21
26.11.2018
22.
O HO H
O H
O H
R
R
R
R
22
26.11.2018
23.
Метиловый спирт —сильный яд
(особенно при
приеме внутрь)
нервного и сердечнососудистого
действия; поражает
органы зрения вплоть
до полной слепоты. В
больших дозах (30
грамм и более)
вызывает смерть
23
26.11.2018
24.
Этиловый спирт обладаеттоксическим эффектом. Быстро Аллиловый спирт — вызывает
острое отравление, в больших
всасывается через слизистую
количествах при приеме внутрь
оболочку желудка и тонкого
— потеря сознания, тяжёлая
кишечника, достигая
кома и смерть.
максимальной концентрации в
крови через 20—60 минут после
его приёма, вызывая вначале
возбуждение, а затем резкое
угнетение центральной нервной
Изопропиловый спирт по своему
системы (в том числе разрушает
токсическому воздействию
мозговую оболочку)
напоминает этанол, вызывая
угнетение центральной нервной
системы и поражая внутренние
Этиленгликоль — очень
органы. В высокой концентрации
токсичен при попадании в
приводит к коме, конвульсиям и
организм; поражает ЦНС и
летальному исходу
почки, вызывает гемолиз
эритроцитов; обладает
мутагенным действием
26.11.2018
24
25.
VI. Химические свойстваКислотные свойства спиртов
Реакции элиминирования
Реакции нуклеофильного
замещения
Реакции окисления
Реакции поликонденсации
26.11.2018
25
26.
1. Кислотные свойства спиртовСпирты подобно воде способны проявлять как кислотные,
так и основные свойства.
Как слабые кислоты, спирты способны диссоциировать по
связи O−H с образованием алкоксид-иона:
R – OH
+
H2O
R – O-
+ H3O+
Кислотные характеристики спиртов оценивают по
константе кислотности :
[ R – O-] [H3O]+
Ka =
[R – OH]
26.11.2018
26
27.
1) реакции со щелочными металлами:2CH3OH + 2Na
2CH3ONa + H2
алкоголят натрия,
метилат натрия
26.11.2018
27
28.
Опыт 1. Взаимодействие спиртов с металлическимнатрием
1. 2CH3OH
+
2. 2C2H5OH
+
3. 2C4H9OH
+
2Na
метанол
+
H2
2C2H5ONa
+
H2
2C4H9ONa
+
H2
метилат натрия
2Na
этанол
бутанол
2CH3ONa
этилат натрия
2Na
бутилат натрия
С увеличением количества атомов углерода кислотные
свойства спиртов уменьшаются
26.11.2018
28
29.
30.
2) реакции этерификации (реакции взаимодействия с карбоновымикислотами):
ОН
|
CH3–C=O
+
уксусная кислота
Механизм реакции:
OH
|
CH3–C∂+= O∂- + H+
OH
|
CH3–C+–OCH3
-H2O
26.11.2018
+H+
CH3OH
O
||
CH3–C–O–CH3
OH
|
CH3–C+–OH + CH3OH
-H+
+
H 2O
OH
|
CH3–C–OH
|
CH3–O+–H
O
||
CH3–C–OCH3
30
31.
Кислотные свойства спиртов изменяются в следующем ряду:H2O > CH3–OH > CH3–CH2–OH > CH3–CH–CH3
|
ОН
26.11.2018
CH3
|
> CH3–C–OH
|
CH3
31
32.
2.Реакции нуклеофильного замещения
Реакционная способность спиртов в реакциях
нуклеофильного замещения
аллиловый спирт, бензиловый спирт > третичный спирт >
>вторичный спирт > первичный спирт > метиловый спирт
Реакционная способность галогеноводородов в
реакциях нуклеофильного замещения
HJ > HBr > HCl > HF
26.11.2018
32
33.
1) CH3OH + HСl2) 3 CH3OH
3)
CH3Cl
+ H2O
+ PCl3
3CH3Cl
CH3OH + PCl5
CH3Cl
+
POCl3
CH3Cl
+
SO2
4) CH3OH + SOCl2
26.11.2018
+
H3PO3
+
+
HCl
HCl
33
34.
Опыт 2. Взаимодействие этилового спирта сбромоводородом
1. NaBr + H2SO4
NaHSO4
+
2. HBr + C2H5OH
C2H5Br
+
этанол
26.11.2018
бромоэтан
HBr
H2O
34
35.
36.
3.Реакции элиминирования (реакции отщепления)
1) реакции внутримолекулярной дегидратации:
+H+
CH3–CH2–CH2–OH
CH2 = CH – CH3
+
H2O
Механизм реакции:
H+
CH3–CH2–CH2–OH
H– O+–H
|
CH3–CH2–CH2
CH2+–CH2–CH3
-H2O
CH2=CH–CH3 + H+
26.11.2018
36
37.
4.Реакции окисления
1)
Окисление первичных спиртов:
[O]
CH3–CH2–OH
CH3–CН=O (образуются альдегиды)
Окисление вторичных спиртов:
[O]
CH3–CH–CH3
CH3–C–CH3 (образуются кетоны)
|
||
OH
O
Окисление третичных спиртов:
Третичные спирты окисляются тяжело и только
в кислой среде (H2SO4)
2)
3)
CH3
CH3
|
+H2SO4
|
KMnO4+H2SO4
CH3–C–CH3
CH3–C=CH2
CH3–C–CH3 + H–C=O
|
-H2O
||
|
OH
O
OH
(по правилу Зайцева)
37
26.11.2018
38.
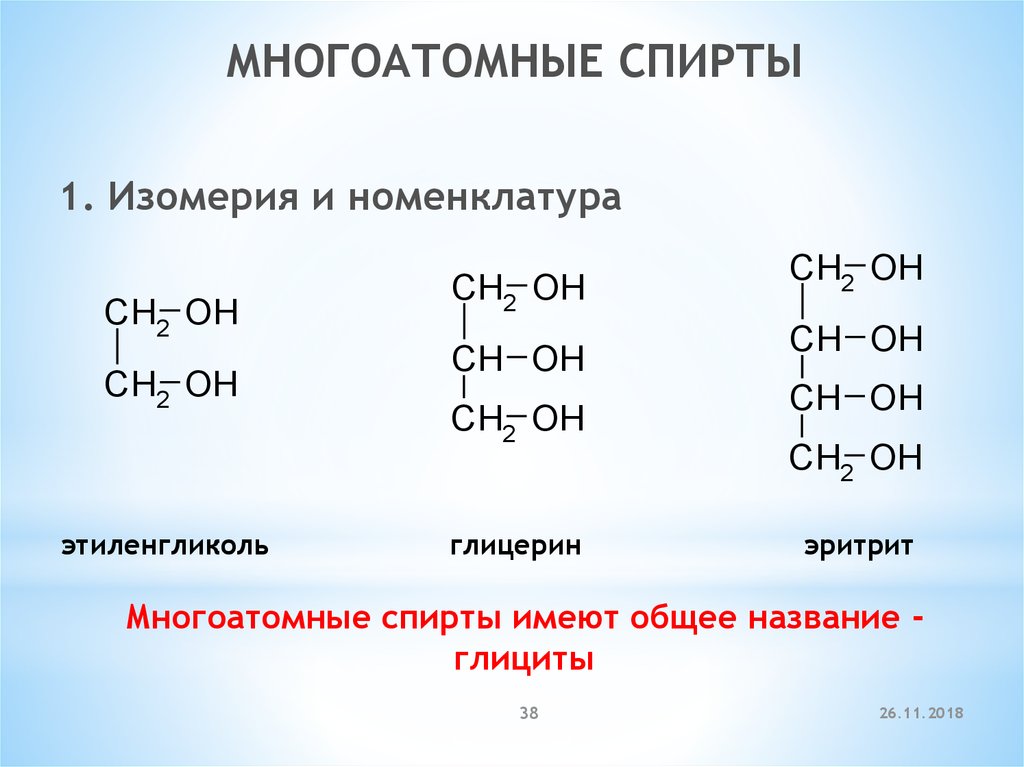
МНОГОАТОМНЫЕ СПИРТЫ1. Изомерия и номенклатура
CH2 OH
CH2 OH
этиленгликоль
CH2 OH
CH OH
CH2 OH
глицерин
CH2 OH
CH OH
CH OH
CH2 OH
эритрит
Многоатомные спирты имеют общее название глициты
38
26.11.2018
39.
CH2 OHCH2 OH
H C
OH
H C
H C
OH
HO C
H C
OH
H C
HO C
OH
H
OH
CH2 OH
CH2 OH
рибит
ксилит
CH2 OH
H C
OH
CH2 OH
H C
CH2 OH
OH
HO C
H
H
H
HO C
H
HO C
H C
OH
HO C
H
H C
OH
H C
OH
H C
OH
H C
OH
CH2OH
D-сорбит
(D-глюцит)
CH2OH
дульцит
39
CH2OH
D- маннит
26.11.2018
40.
Многоатомные спирты часто встречаются вприроде.
Сорбит содержится в плодах рябины (лат.
sorbus – рябина),
Маннит
–
в
так
называемой
манне
–
застывшем сока ясеня
Дульцит – содержится в мадагаскарской
манне.
40
26.11.2018
41.
2. Физические и биологические свойства* Этиленгликоль
и
пропиленгликоль
являются
высококипящими жидкостями, глицерин представляет
собой очень вязкую жидкость. Многоатомные спирты с
количеством гидроксигрупп больше трёх являются
твёрдыми телами.
* Многоатомные
спирты прекрасно растворяются в
воде.Это обусловлено наличием нескольких полярных
групп -OH. Водные растворы этиленгликоля не замерзают
при очень низкой температуре, поэтому используются
как антифризы в системах охлаждения двигателей
внутреннего сгорания.
* Почти
все многоатомные спирты обладают сладким
вкусом. Поэтому ксилит и сорбит используются в питании
больных диабетом.
41
26.11.2018
42.
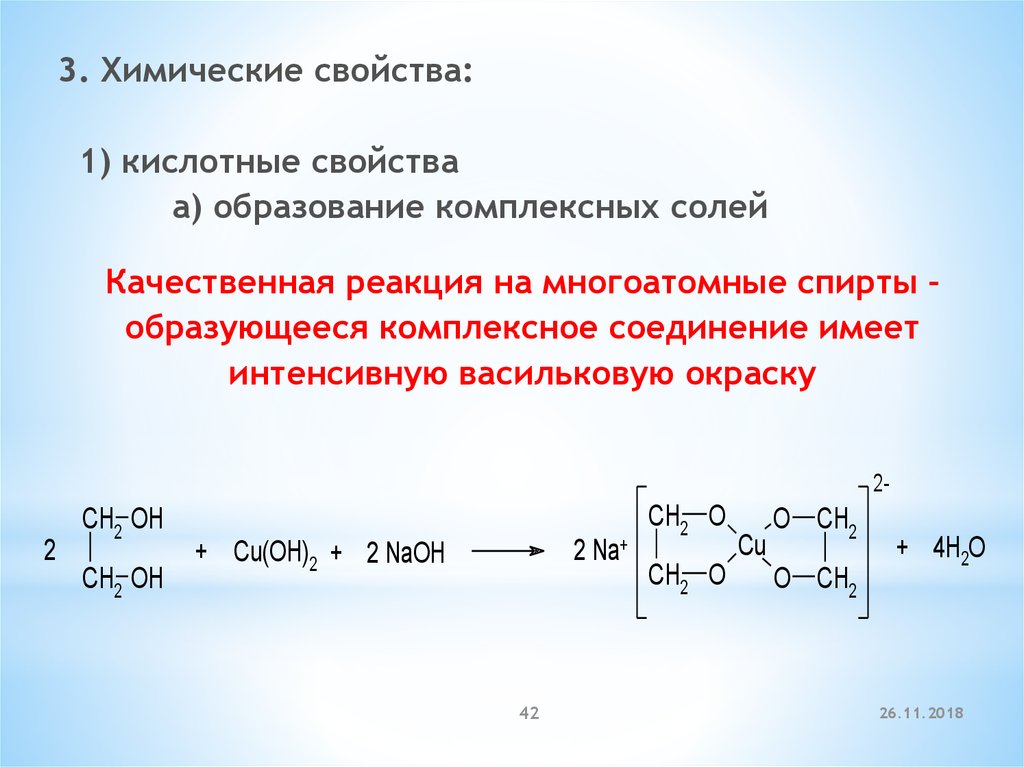
3. Химические свойства:1) кислотные свойства
а) образование комплексных солей
Качественная реакция на многоатомные спирты –
образующееся комплексное соединение имеет
интенсивную васильковую окраску
2-
2
CH2 OH
CH2 OH
2 Na+
+ Cu(OH)2 + 2 NaOH
42
CH2 O
CH2 O
Cu
O CH2
O CH2
+ 4H2O
26.11.2018
43.
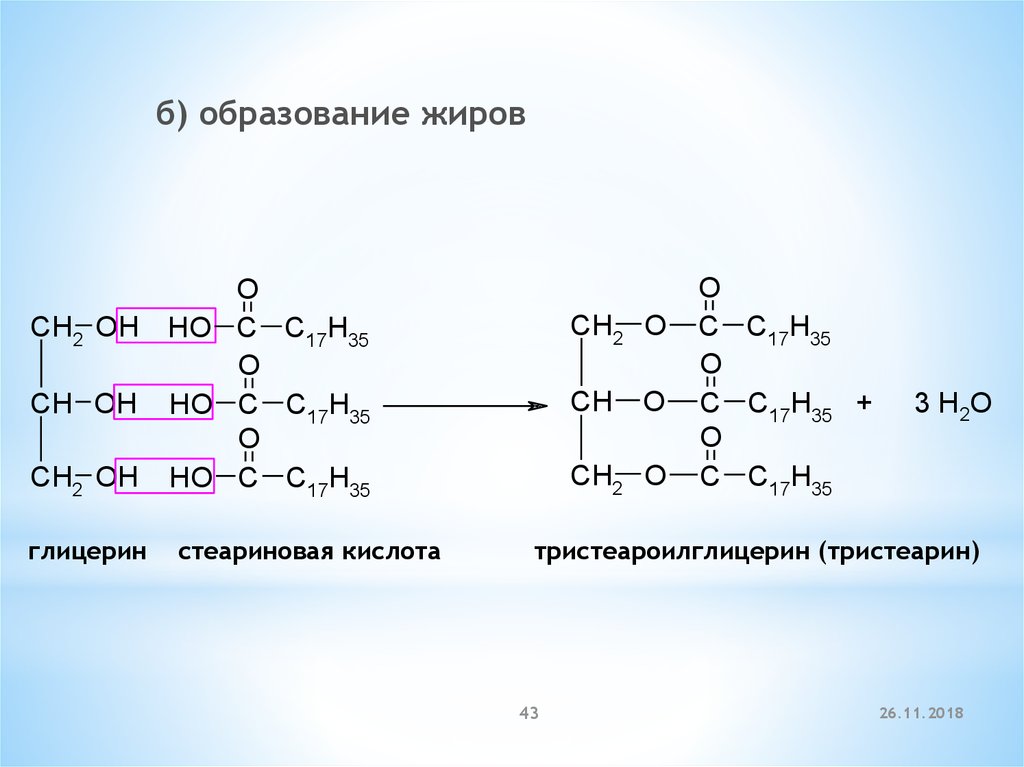
б) образование жировCH2 OH
CH OH
CH2 OH
глицерин
O
HO C C17H35
O
HO C C17H35
O
HO C C17H35
стеариновая кислота
CH2 O
CH
O
CH2 O
O
C C17H35
O
C C17H35 +
O
C C17H35
3 H2O
тристеароилглицерин (тристеарин)
43
26.11.2018
44.
в) образование нитратовCH2 OH + HONO2
CH2 O
NO2
CH OH + HONO2
CH
O
NO2
CH2 OH + HONO2
CH2 O
NO2
H2SO4
нитроглицерин
44
26.11.2018
45.
Нитроглицерин используется вовзрывчатых веществах - динамитах
и
бездымных
порохах
баллиститах. Динамит и баллистит
были изобретены А. Нобелем в
1867 и 1888 годах.
В
медицине
нитроглицерин
используется
как
сосудорасширяющее
средство,
используется
при
приступах
стенокардии.
А. Нобель (1833 –1896)
45
26.11.2018
46.
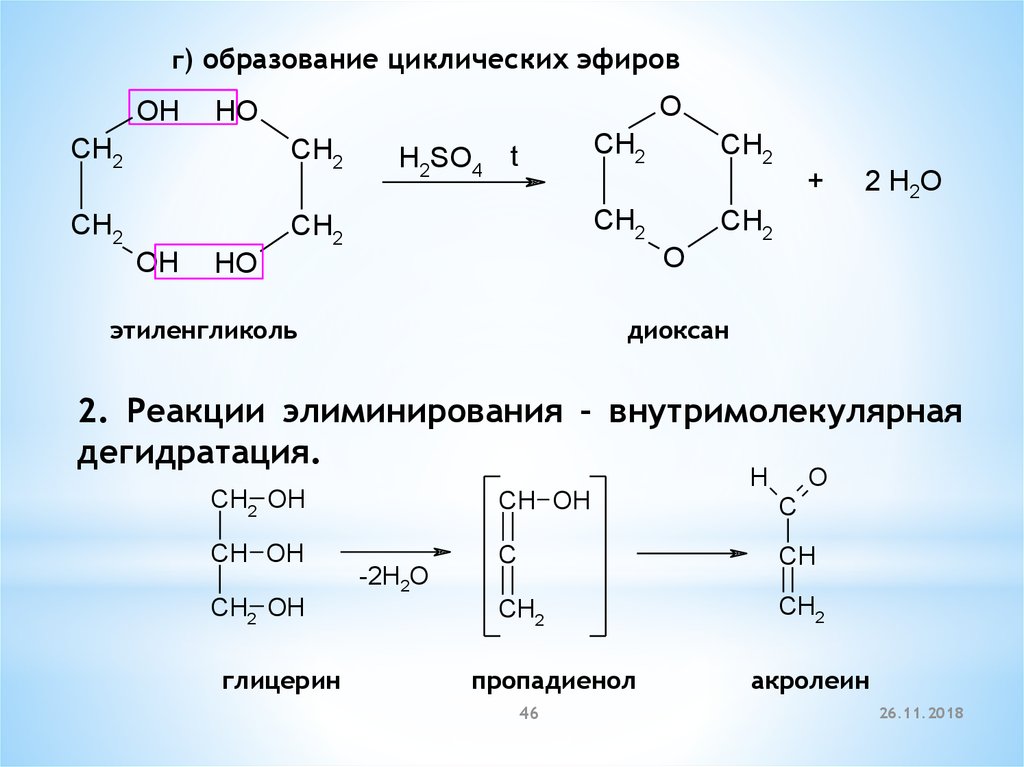
г) образование циклических эфировOH
O
HO
CH2
CH2
CH2
CH2
OH
H2SO4
CH2
t
CH2
+
CH2
2 H2O
CH2
O
HO
этиленгликоль
диоксан
2. Реакции элиминирования – внутримолекулярная
дегидратация.
H
O
CH2 OH
CH OH
C
CH OH
C
CH
CH2
CH2
CH2 OH
глицерин
-2H2O
пропадиенол
46
акролеин
26.11.2018
47.
3. Реакции окисленияH
CH2 OH
CH OH
CH2 OH
O
C
[O]
CH OH
CH2 OH
глицеральдегид
CH2 OH
+
C
O
CH2 OH
дигидроксиацетон
При действии мягких окислителей (H2O2/Fe2+, O2/Pt,
Br2/сода) окисляется только одна спиртовая группа –
первичная или вторичная.
Более сильные окислители (CrO3, KMnO4) окисляют
многоатомные спирты до карбоновых кислот, кетонов и
углекислого газа и воды.
47
26.11.2018
48.
4. Реакции поликонденсацииРеакции поликонденсации - процессы образования
высокомолекулярных соединений за счет наличия двух и
более функциональных групп.
n CH2–CH2 + n HOOC–CH2–CH2–CH2–CH2–COOH
|
|
OH OH
адипиновая кислота
этиленгликоль
CH2–CH2
+ |
|
OH OH
O
||
CH2–CH2–O–C–CH2–CH2–CH2–CH2–COOH
|
OH
26.11.2018
48
49.
+HOOC–(CH2)4–COOH
CH2–CH2–O–C–(CH2)4–C=O
|
||
|
OH
O
O
|
CH2
|
CH2
|
OH
O
O
O
O
||
||
||
||
CH2–CH2–O–C–(CH2)4–C– O–CH2–CH2–O–C–(CH2)4–C– O–CH2–CH2–O –
|
мономер
n
OH
ВМС линейного строения - легкоплавкий и хорошо
растворимый полимер в различных растворителях
26.11.2018
49
50.
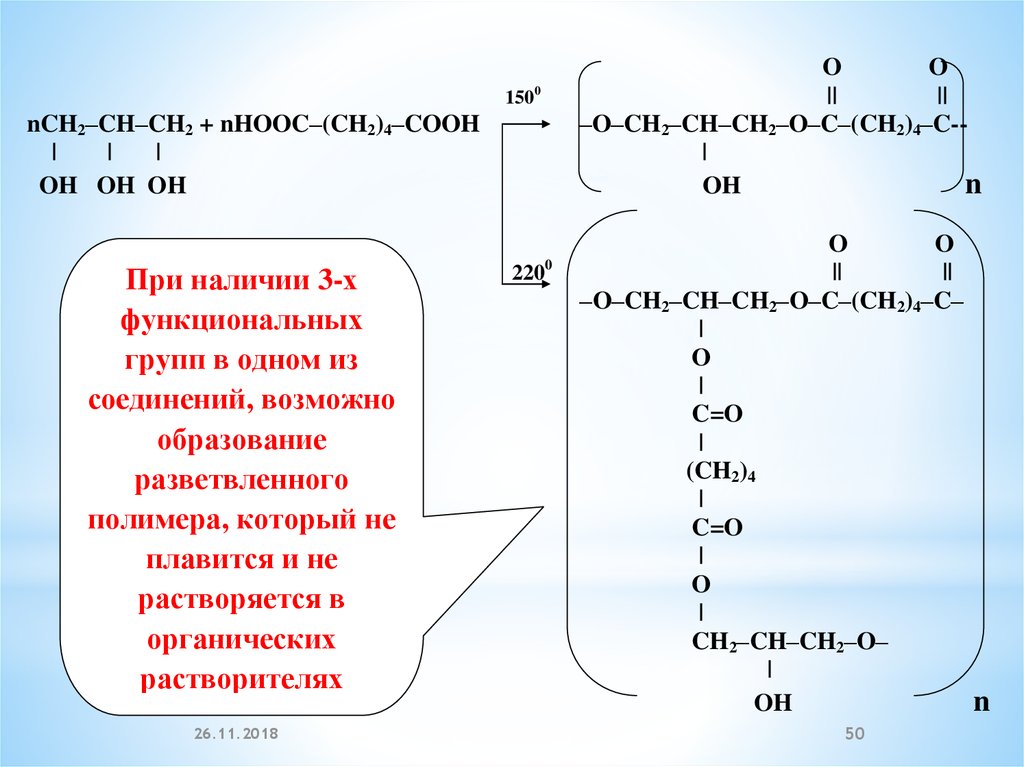
150O
O
||
||
–O–CH2–CH–CH2–O–C–(CH2)4–C-|
OH
n
0
nCH2–CH–CH2 + nHOOC–(CH2)4–COOH
|
|
|
OH OH OH
При наличии 3-х
функциональных
групп в одном из
соединений, возможно
образование
разветвленного
полимера, который не
плавится и не
растворяется в
органических
растворителях
26.11.2018
220
0
O
O
||
||
–O–CH2–CH–CH2–O–C–(CH2)4–C–
|
O
|
C=O
|
(CH2)4
|
C=O
|
O
|
CH2–CH–CH2–O–
|
OH
50
n
51. Спасибо за Ваше внимание!
5126.11.2018






































 chemistry
chemistry








