Similar presentations:
Спирты. Классификация спиртов
1.
СПИРТЫ2.
Классификация спиртовСпирты классифицируют по различным
структурным признакам
1. По числу гидроксильных групп спирты подразделяются на
одноатомные (одна группа -ОН),
CH3CH2OH этиловый спирт
(этанол)
многоатомные (две и более групп -ОН).
HO–СH2–CH2–OH
двухатомный спирт – этиленгликоль
(этандиол)
Современное название
многоатомных спиртов –
полиолы (диолы, триолы
HO–СH2–СН(ОН)–CH2–OH
трехатомный спирт – глицерин
(пропантриол-1,2,3)
Двухатомные спирты R–CH(OH)2 неустойчивы и, отщепляя воду, превращаются
в альдегиды R–CH=O.
Спирты R–C(OH)3 не существуют.
3.
Классификация спиртовВ зависимости от того, с каким атомом углерода (первичным, вторичным
или третичным) связана гидроксигруппа, различают спирты:
первичные R–CH2–OH, вторичные R2CH–OH, третичные R3C–OH
Пропан-2-ол
2-метилпропан-2-ол
В многоатомных спиртах различают первично-, вторично- и третичноспиртовые
группы. Молекула глицерина содержит две первичноспиртовые (HO–СH2–)
и одну вторичноспиртовую (–СН(ОН)–) группы.
4.
Классификация спиртовПо строению радикалов, связанных с атомом кислорода,
спирты подразделяются на:
предельные, или алканолы
R-CH2–OH
непредельные, или алкенолы R-CH=CH–CH2–OH
алкинолы R-≡-CH2-OH
ароматические
C6H5CH2–OH
Непредельные спирты с ОН-группой при атоме углерода, соединенном
с другим атомом двойной связью, очень неустойчивы и сразу же
изомеризуются в альдегиды или кетоны:
CH2=CH–OH → CH3–CH=O
виниловый
спирт
уксусный
альдегид
5.
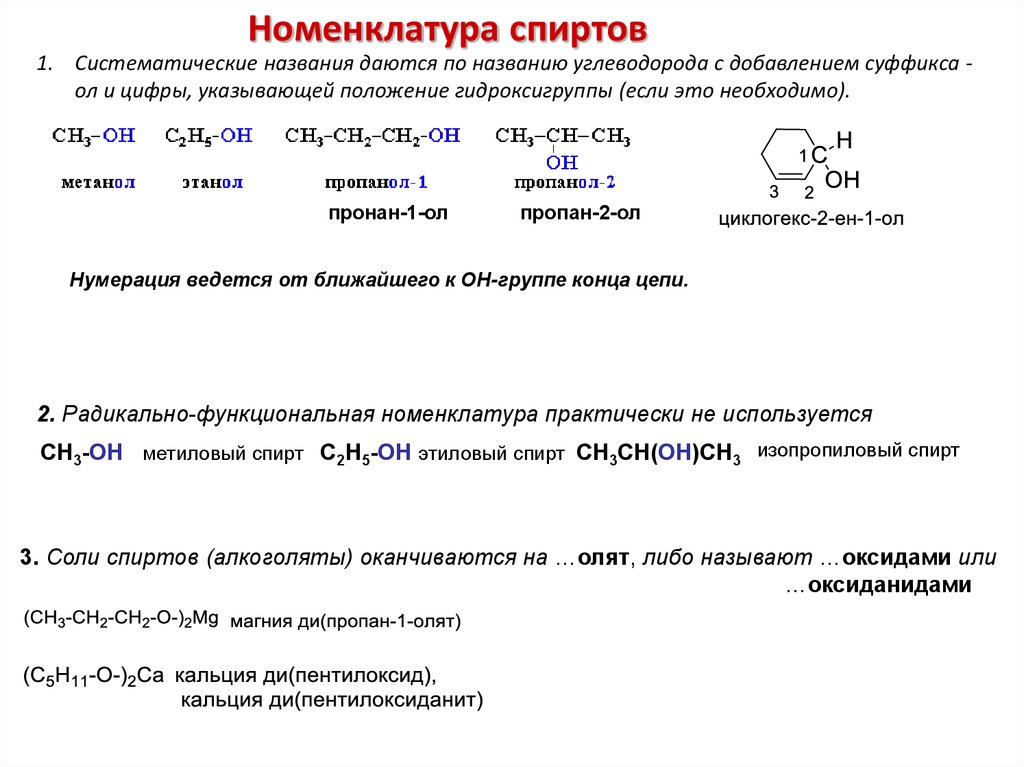
Номенклатура спиртов1. Систематические названия даются по названию углеводорода с добавлением суффикса ол и цифры, указывающей положение гидроксигруппы (если это необходимо).
пронан-1-ол
пропан-2-ол
Нумерация ведется от ближайшего к ОН-группе конца цепи.
2. Радикально-функциональная номенклатура практически не используется
СH3-OH метиловый спирт C2H5-OH этиловый спирт CH3CH(OH)CH3 изопропиловый спирт
3. Соли спиртов (алкоголяты) оканчиваются на …олят, либо называют …оксидами или
…оксиданидами
6.
Изомерия спиртовДля спиртов характерна структурная изомерия:
1. Изомерия положения ОН-группы (начиная с С3):
2. Изомерия углеродного скелета (начиная с С4)
Формуле C4H9OH
соответствует
4 структурных
изомера
7.
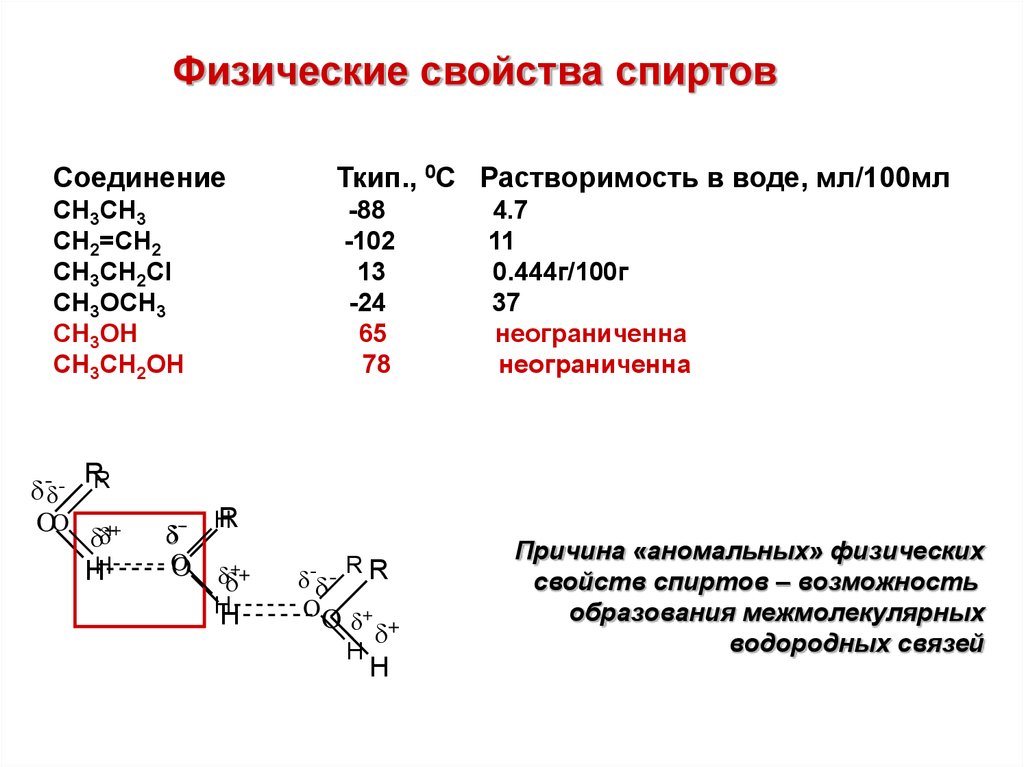
Физические свойства спиртовСоединение
CH3CH3
CH2=CH2
CH3CH2Cl
CH3OCH3
CH3OH
СH3CH2OН
R
- - R
OO ++
HH
R
H
-O
O ++
HH
Ткип., 0С Растворимость в воде, мл/100мл
-88
-102
13
-24
65
78
R
- - R
OO +
+
H
H
4.7
11
0.444г/100г
37
неограниченна
неограниченна
Причина «аномальных» физических
свойств спиртов – возможность
образования межмолекулярных
водородных связей
8.
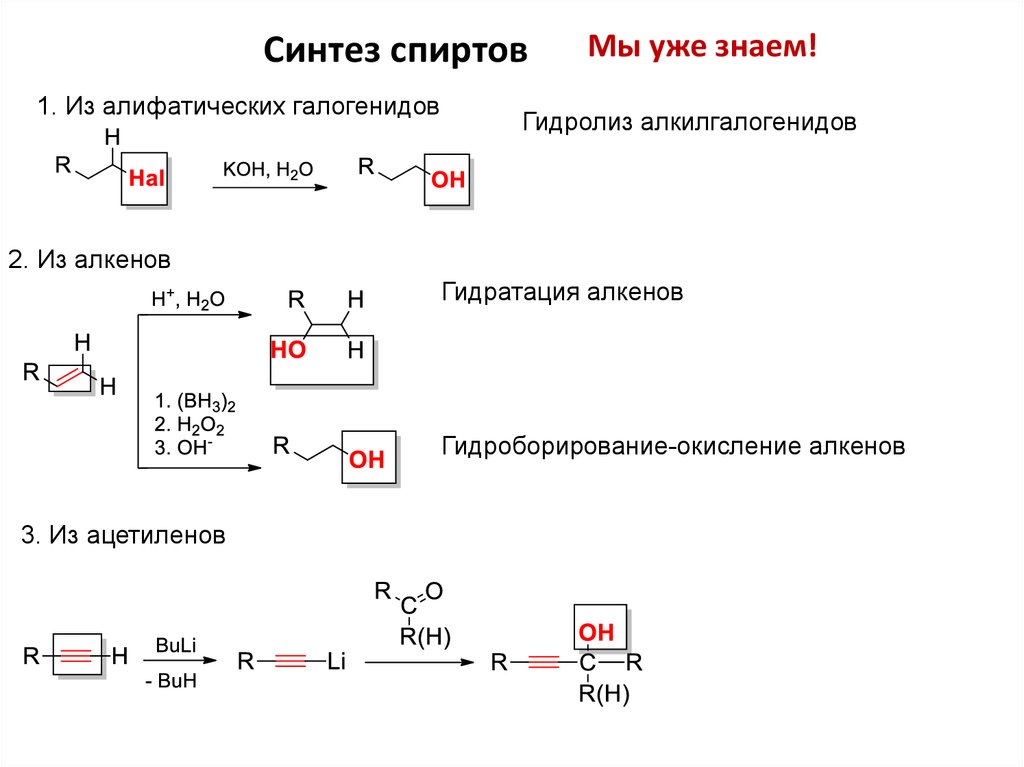
Синтез спиртов1. Из алифатических галогенидов
Мы уже знаем!
Гидролиз алкилгалогенидов
2. Из алкенов
Гидратация алкенов
Гидроборирование-окисление алкенов
3. Из ацетиленов
9.
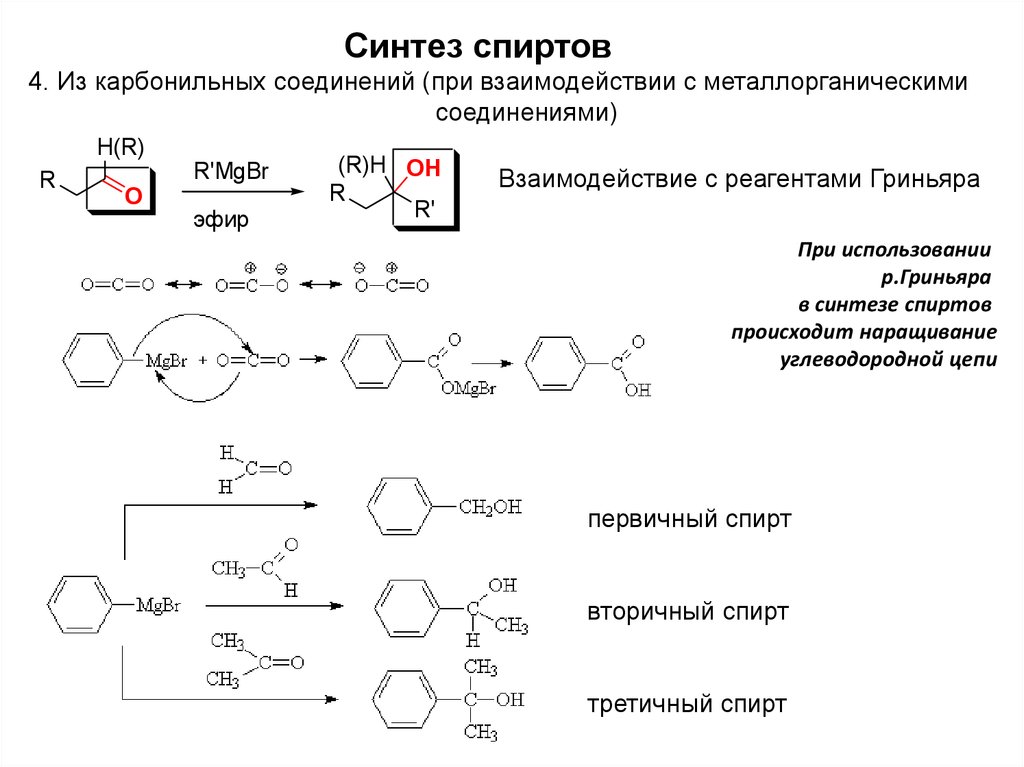
Синтез спиртов4. Из карбонильных соединений (при взаимодействии с металлорганическими
соединениями)
H(R)
R
R'MgBr
O
эфир
(R)H OH
R
R'
Взаимодействие с реагентами Гриньяра
При использовании
р.Гриньяра
в синтезе спиртов
происходит наращивание
углеводородной цепи
первичный спирт
вторичный спирт
третичный спирт
10.
H(R)R
R'MgBr
O
эфир
(R)H OH
R
R'
O
NO2
I
PhMgCl
-400C
NO2
C
MgX
H
C
O
NO2
NO2 OH
H
MgX
NO2 OMgX
C
H
H2O
NO2 OH
Первичные спирты можно синтезировать, используя окись пропилена
окись этилена
11.
Кислотно-основные свойства спиртовC O H
+
Ka
O H
H
C O + H O H
H
Kb
CH3CH2-O-H
+
H O H
H
ROH
pKa
(CH3)3C-OH
18.0
CH3CH2OH
15.9
CH3OH
15.5
ClCH2CH2OH
14.3
FCH2CH2OH
13.9
(CF3)3C-OH
5.4
CH3CH2-O-H + O H
H
H
Формула
pKa
Уксусная
кислота
CH3COOH
4.8
метанол
CH3OH
15.5
вода
H2O
15.7
этанол
CH3CH2OH
15.9
возрастание кислотных свойств
Спирты - амфотерные соединения!
Соединение
12.
Взаимодействие спиртов с металлами.Синтез алкоголятов
CH3CH2OH
C
O
EtOH
H
CH3
H3C C O H
CH3
+K
трет-бутиловый спирт
t-BuOH
OH
+ Na
+ Al
изо-пропиловый спирт
C OK
CH3CH2ONa + H2
этанолят натрия,
натрия этоксид
EtO-Na+
+ H2
трет-бутилат калия,
калия трет-бутоксид
t-BuO-K+
O
Al O
O
изо-пропилат алюминия
13.
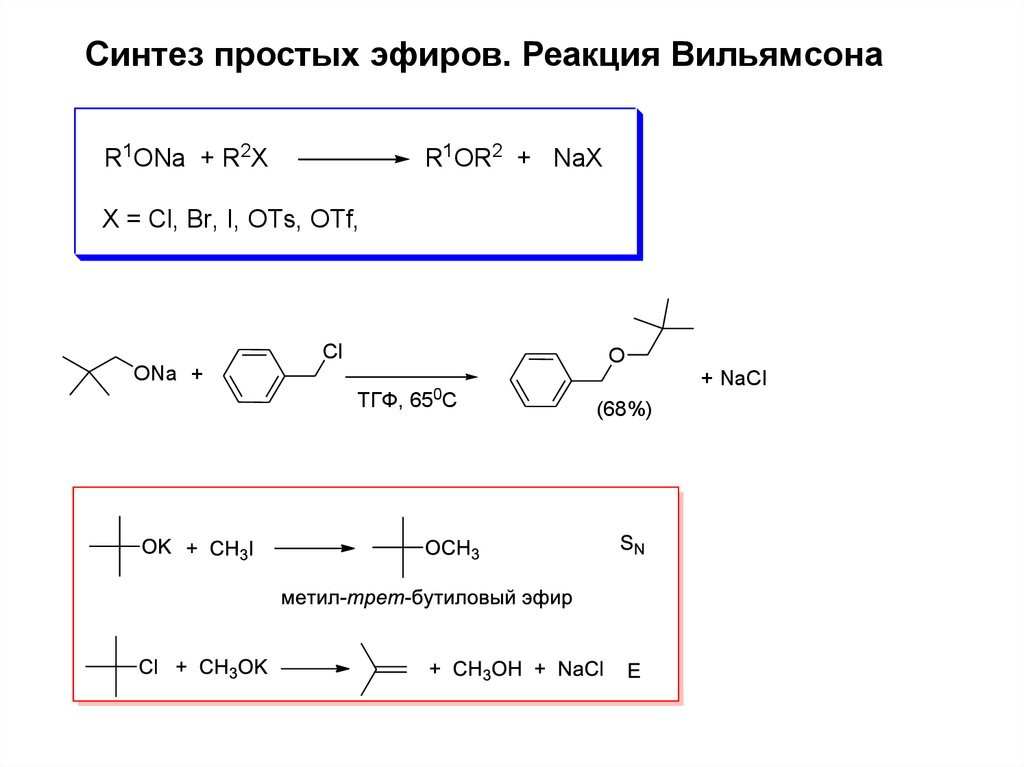
Синтез простых эфиров. Реакция ВильямсонаR1ONa + R2X
R1OR2 + NaX
X = Cl, Br, I, OTs, OTf,
Cl
O
ONa +
0
ТГФ, 65 C
+ NaCl
(68%)
14.
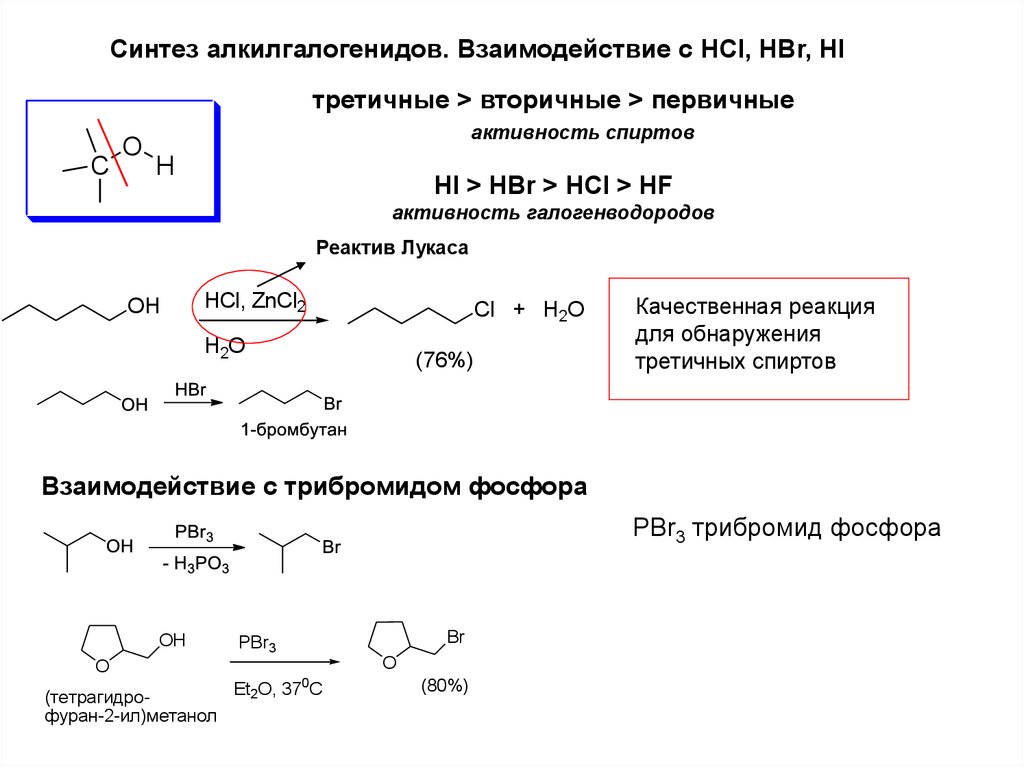
Синтез алкилгалогенидов. Взаимодействие с HCl, HBr, HIтретичные > вторичные > первичные
C
O
активность спиртов
H
HI > HBr > HCl > HF
активность галогенводородов
Реактив Лукаса
OH
HCl, ZnCl2
Cl + H2O
H2O
(76%)
Качественная реакция
для обнаружения
третичных спиртов
Взаимодействие с трибромидом фосфора
PBr3 трибромид фосфора
OH
Br
PBr3
O
O
0
Et2O, 37 C
(тетрагидрофуран-2-ил)метанол
(80%)
15.
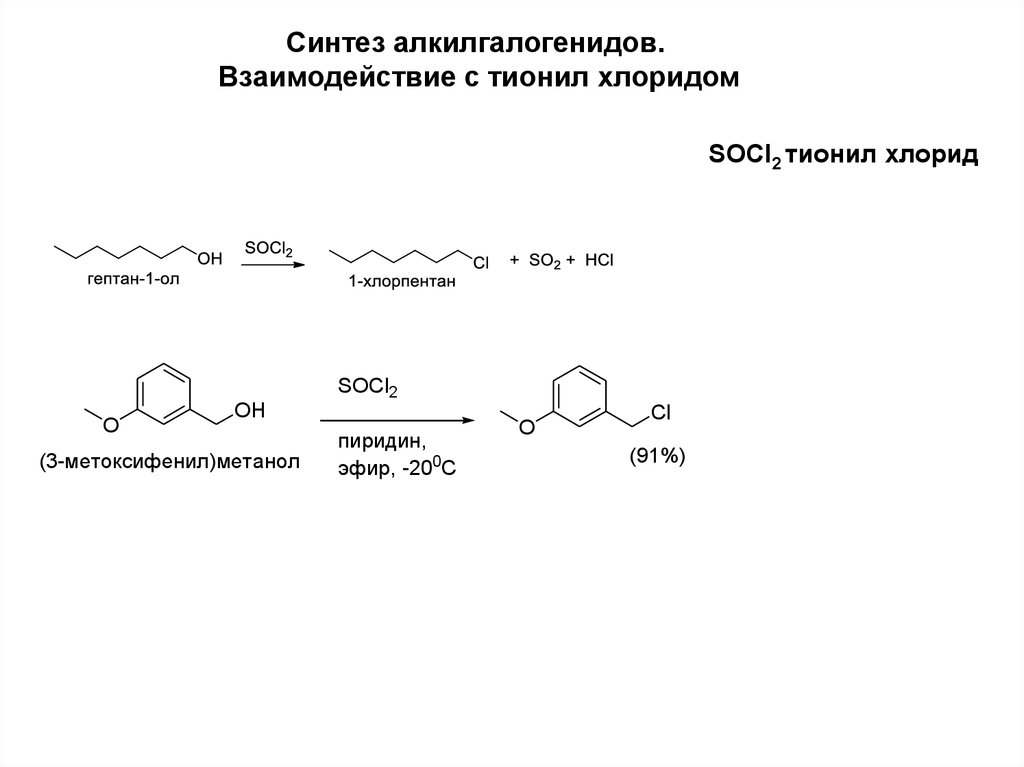
Синтез алкилгалогенидов.Взаимодействие с тионил хлоридом
SOCl2 тионил хлорид
SOCl2
O
OH
(3-метоксифенил)метанол
пиридин,
эфир, -200С
O
Cl
(91%)
16.
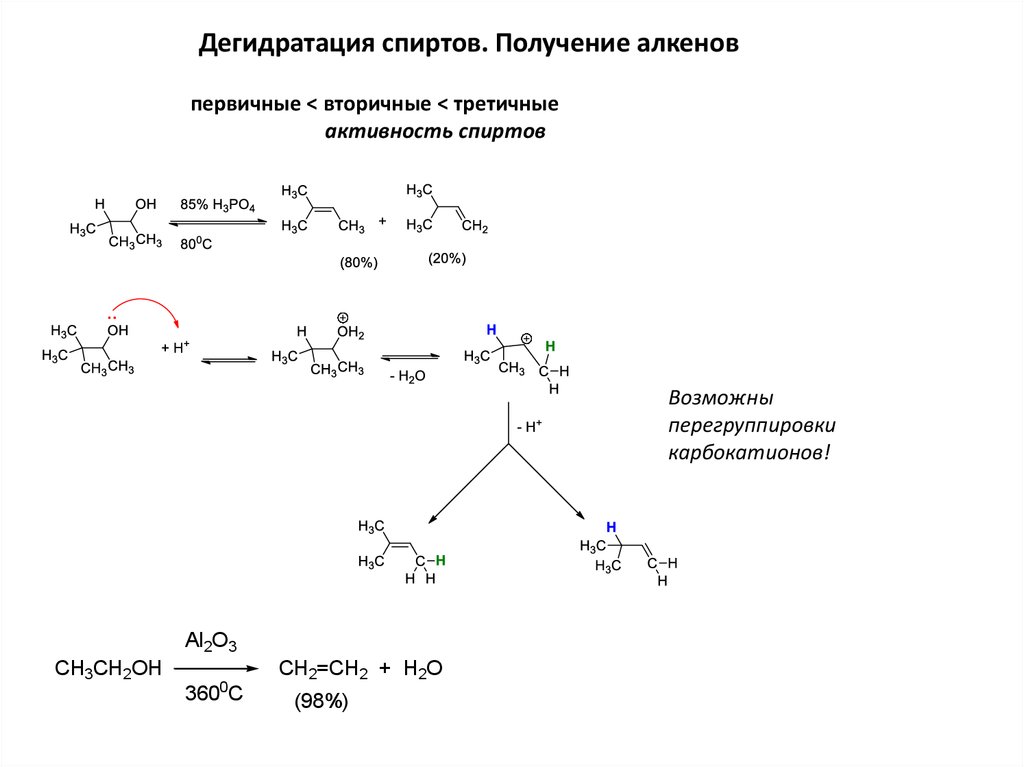
Дегидратация спиртов. Получение алкеновпервичные < вторичные < третичные
активность спиртов
Возможны
перегруппировки
карбокатионов!
Al2O3
CH3CH2OH
0
360 C
CH2=CH2 + H2O
(98%)
17.
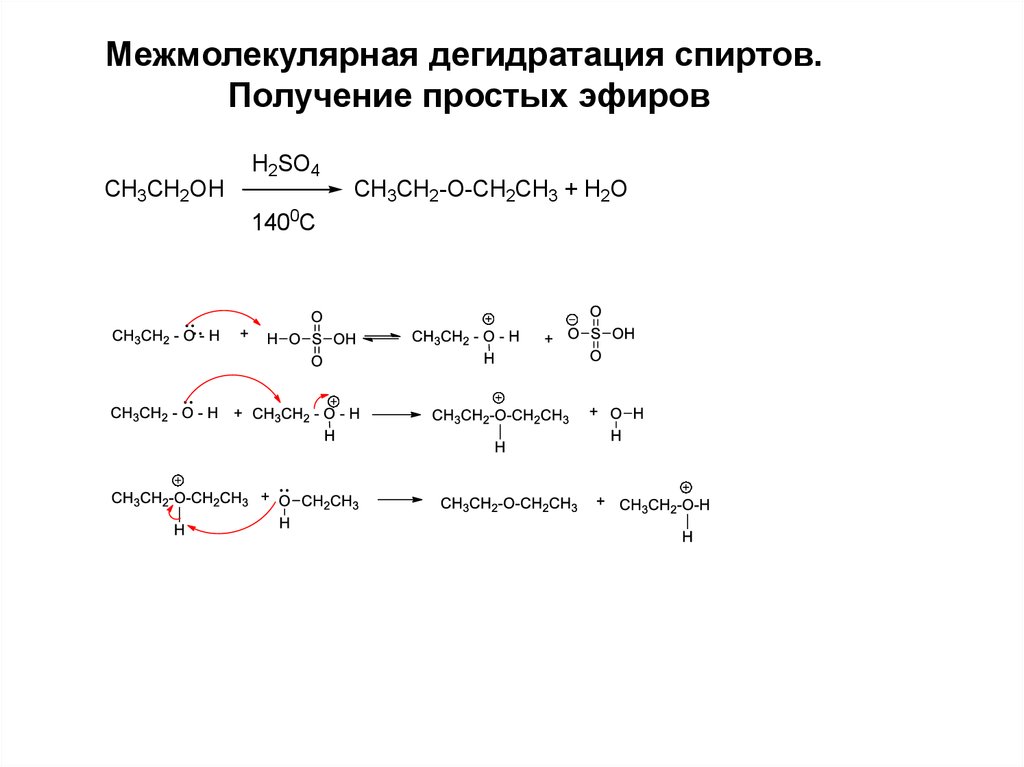
Межмолекулярная дегидратация спиртов.Получение простых эфиров
CH3CH2OH
H2SO4
1400C
CH3CH2-O-CH2CH3 + H2O
18.
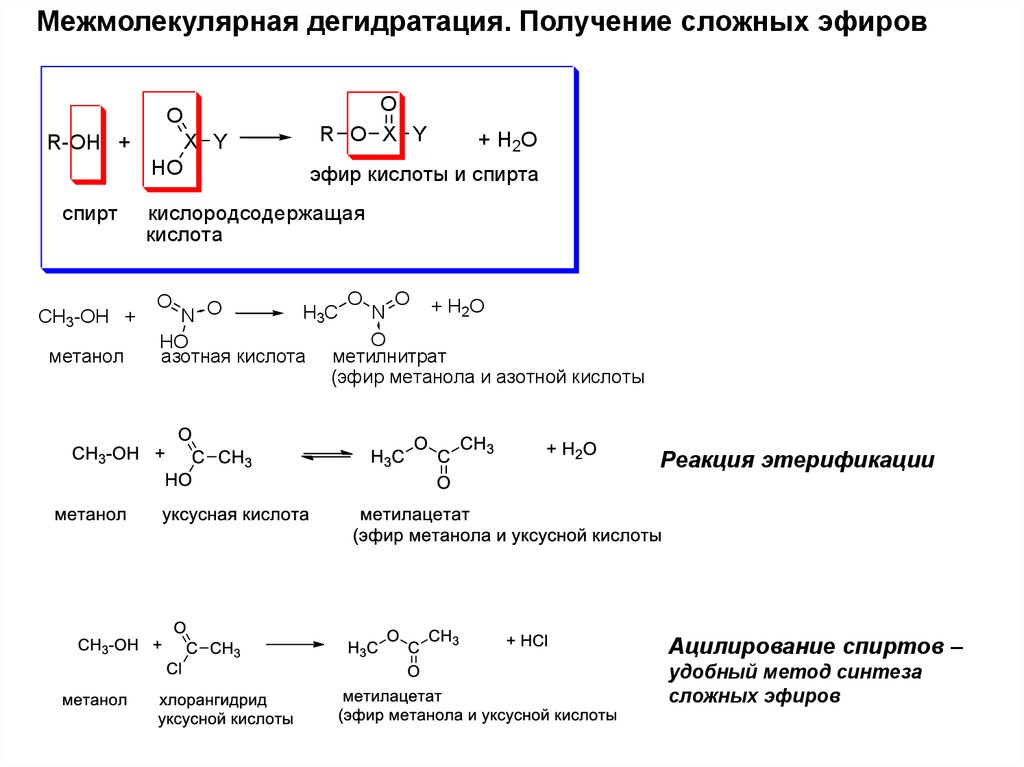
Межмолекулярная дегидратация. Получение сложных эфировO
X Y
R-OH +
HO
спирт
CH3-OH +
метанол
O
R O X Y
+ H2O
эфир кислоты и спирта
кислородсодержащая
кислота
O
O +H O
2
H3C
N
N O
O
HO
азотная кислота метилнитрат
(эфир метанола и азотной кислоты
O
Реакция этерификации
Ацилирование спиртов –
удобный метод синтеза
сложных эфиров
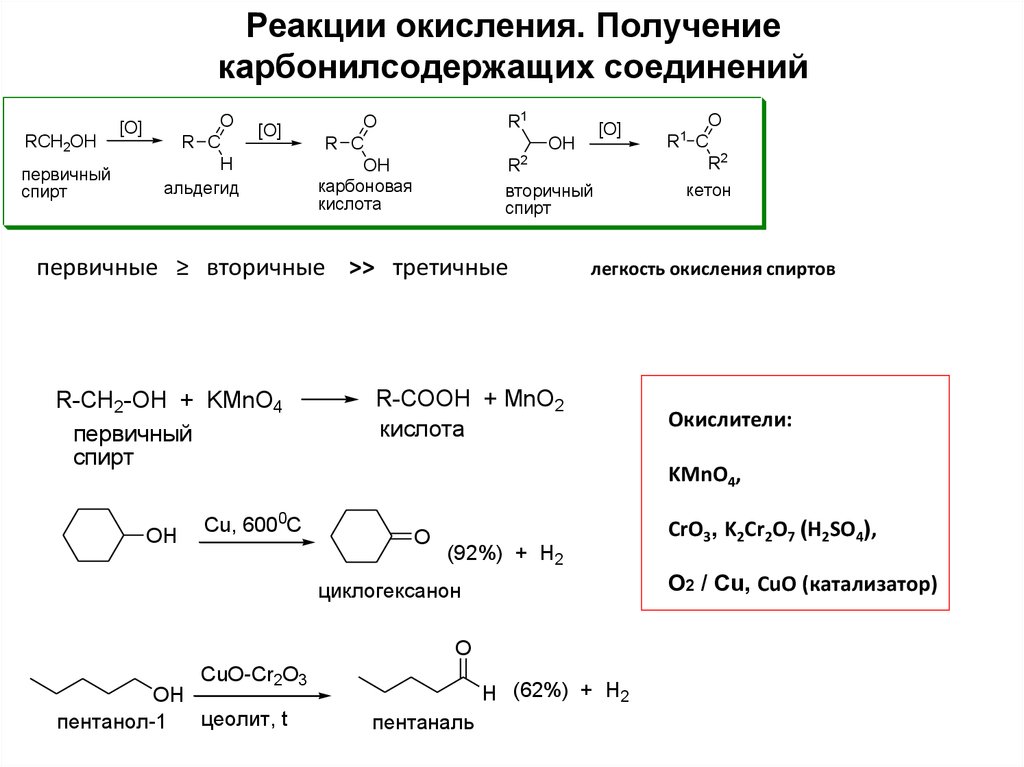
19. Реакции окисления. Получение карбонилсодержащих соединений
RCH2OHпервичный
спирт
[O]
O
R C
H
альдегид
[O]
R1
O
R C
OH
карбоновая
кислота
OH
2
R
вторичный
спирт
первичные ≥ вторичные >> третичные
R-CH2-OH + KMnO4
первичный
спирт
OH
Cu, 6000C
[O]
кетон
легкость окисления спиртов
R-COOH + MnO2
кислота
Окислители:
KMnO4,
O
(92%) + H2
O
CuO-Cr2O3
H (62%) + H2
пентаналь
CrO3, K2Cr2O7 (H2SO4),
О2 / Сu, CuO (катализатор)
циклогексанон
OH
цеолит, t
пентанол-1
O
R C
R2
1
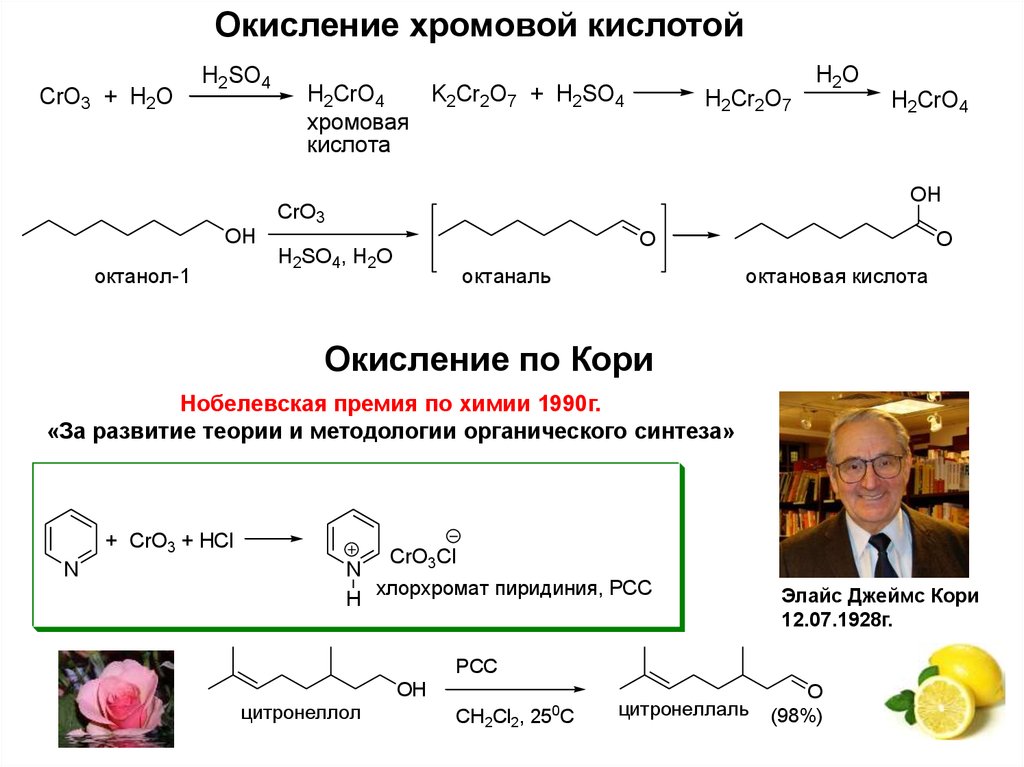
20. Окисление по Кори
Окисление хромовой кислотойCrO3 + H2O
H2SO4
H2CrO4
K2Cr2O7 + H2SO4
хромовая
кислота
H2Cr2O7
H2O
OH
CrO3
OH
октанол-1
H2CrO4
O
H2SO4, H2O
октаналь
O
октановая кислота
Окисление по Кори
Нобелевская премия по химии 1990г.
«За развитие теории и методологии органического синтеза»
+ CrO3 + HCl
N
CrO3Cl
N
хлорхромат пиридиния, PCC
H
Элайс Джеймс Кори
12.07.1928г.
PCC
OH
цитронеллол
0
CH2Cl2, 25 C
цитронеллаль
O
(98%)







 chemistry
chemistry