Similar presentations:
Спирты (алканолы). Классификация
1.
Спирты2.
Спирты (алканолы) – это органическиевещества, молекулы которых содержат одну
или несколько гидроксильных групп (групп –
OH),
соединенных
с
углеводородным
радикалом.
общая формула
СnH2n+1OH;
СnH2n+2O;
R-OH
3.
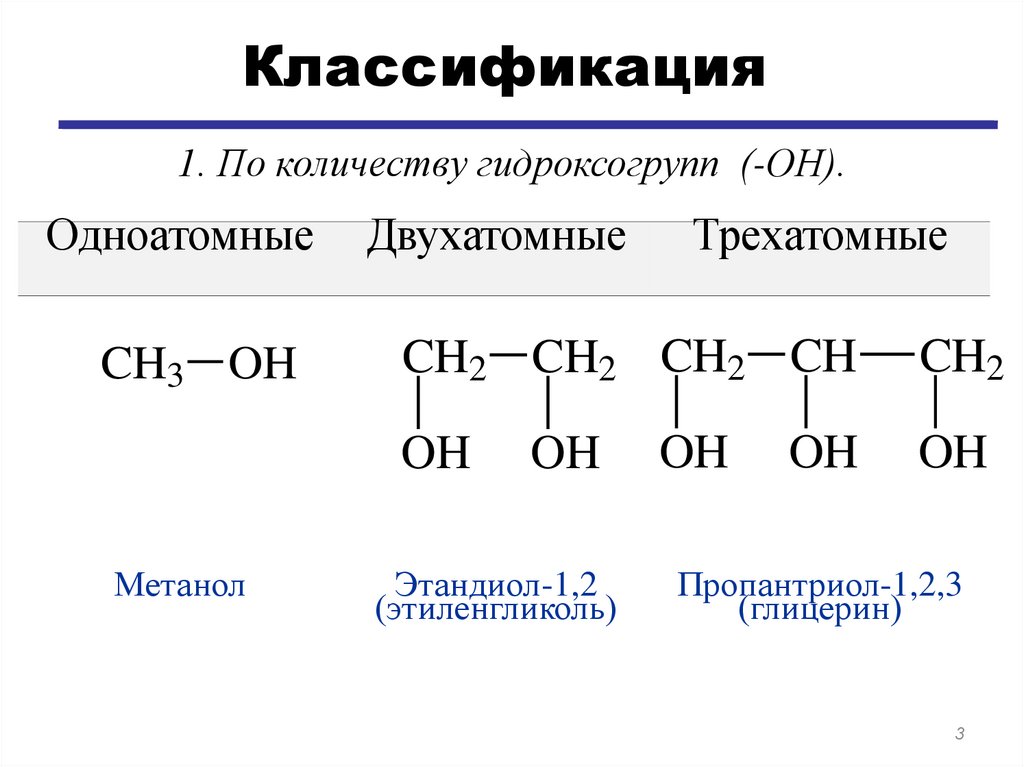
Классификация1. По количеству гидроксогрупп (-ОН).
Одноатомные
CH3 OH
Двухатомные
CH2 CH2 CH2 CH
OH
Метанол
Трехатомные
OH
Этандиол-1,2
(этиленгликоль)
OH
OH
CH2
OH
Пропантриол-1,2,3
(глицерин)
3
4.
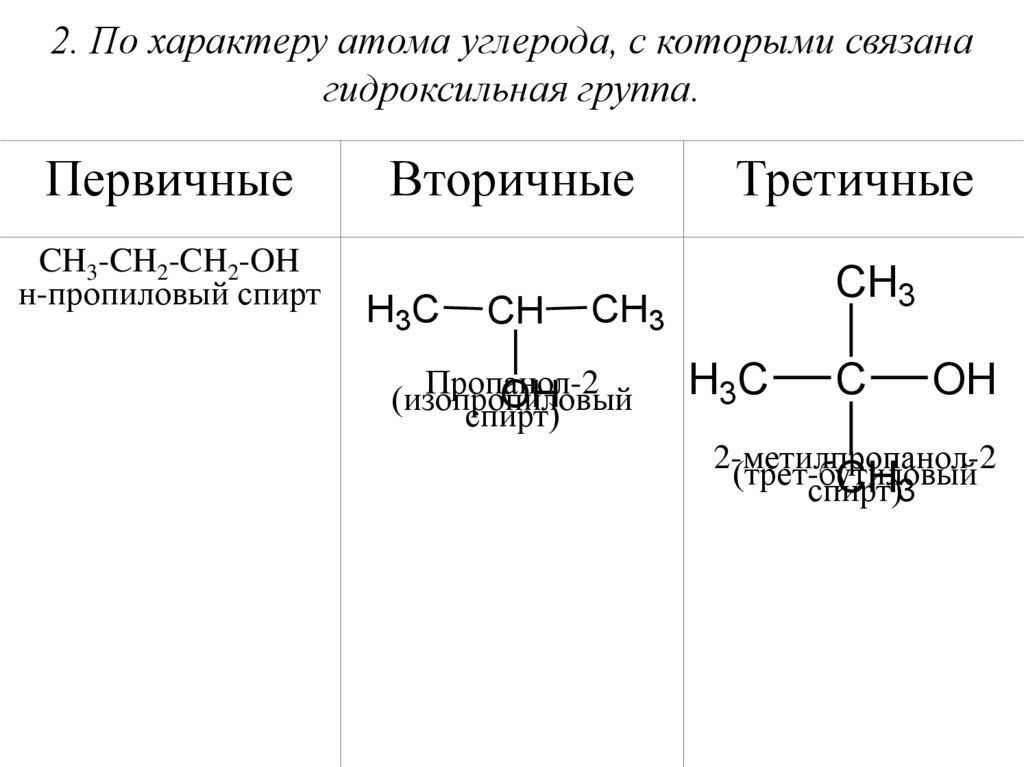
2. По характеру атома углерода, с которыми связанагидроксильная группа.
Первичные
CH3-CH2-CH2-OH
н-пропиловый спирт
Вторичные
H3C
CH
Третичные
CH3
CH3
Пропанол-2
OH
(изопропиловый
спирт)
H3C
C
OH
2-метилпропанол-2
(трет-бутиловый
CH3
спирт)
5.
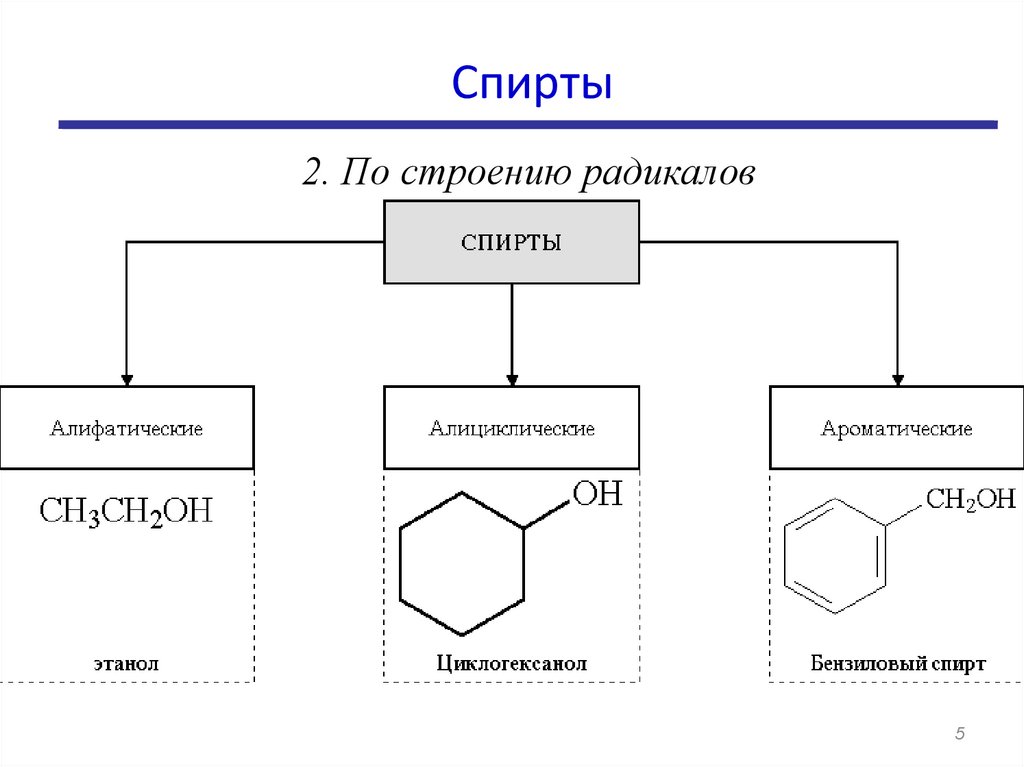
Спирты2. По строению радикалов
5
6.
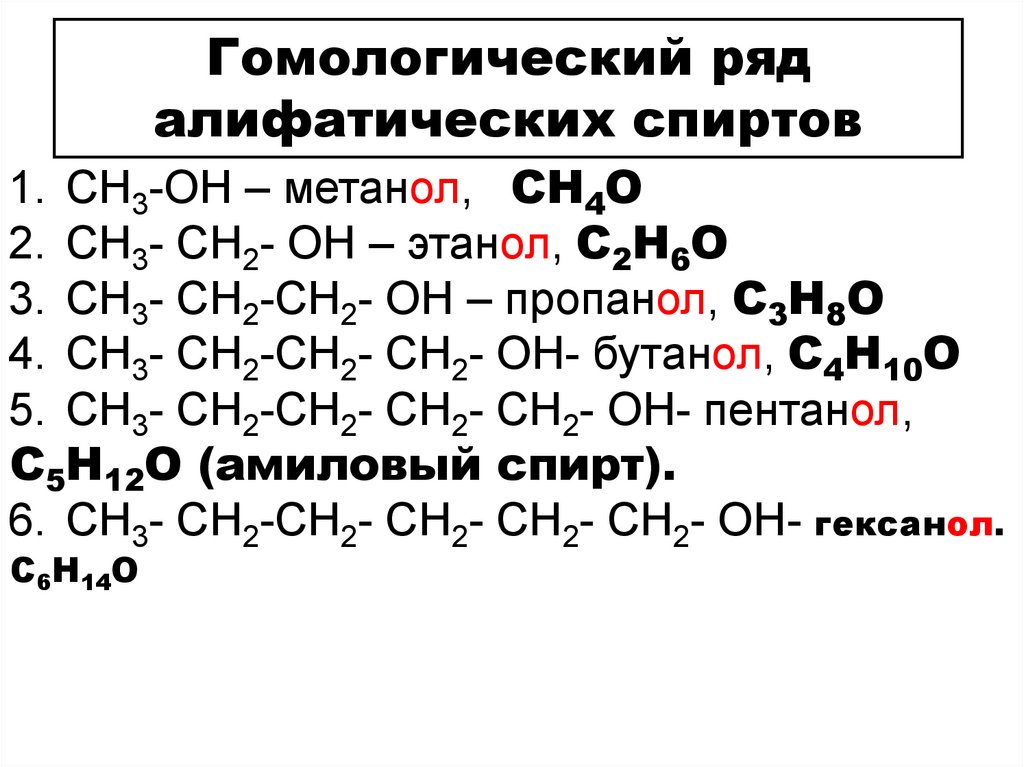
Гомологический рядалифатических спиртов
1. CH3-OH – метанол, СH4O
2. СH3- CH2- OH – этанол, С2H6O
3. СH3- CH2-СH2- OH – пропанол, С3H8O
4. СH3- CH2-СH2- СH2- OH- бутанол, С4H10O
5. СH3- CH2-СH2- СH2- СH2- OH- пентанол,
С5H12O (амиловый спирт).
6. СH3- CH2-СH2- СH2- СH2- СH2- OH- гексанол.
С6H14O
7.
Номенклатура спиртовПри образовании названия спиртов к названию
углеводорода,
соответствующего
спирта
добавляют суффикс – ол.
CH3-OH
CH3-CH2-OH
HO-CH2-CH2-OH
Метанол
этанол
этандиол-1,2
H2
C
H2
C
OH
HC
2-фенилэтанол
C
H
C
OH
бутин-3-ол-2
CH3
8.
ЗаданиеНапишите
структурные
формулы
следующих одноатомных спиртов:
а) 2-метилпропанол-2
б)2.3-диметилпентанол-3
в) 2,4,4-триметилпентанол- 2
г)2,3-диметилбутанол-2
9.
Изомерия спиртов•Углеродного скелета (начиная с С4):
10.
Изомерия спиртов• Изомерия положения OH-группы (начиная с С3):
11.
Изомерия спиртов• Межклассовая изомерия с простыми эфирами:
12.
Физические свойства спиртовАлканолы являются:
1. Бесцветными жидкостями или кристаллическими веществами с
характерным запахом.
2. Первые члены гомологического ряда имеют приятный запах,
3. Для бутанолов и пентанолов запах становится неприятным и
раздражающим.
4. Высшие алканолы имеют приятный ароматный запах.
13.
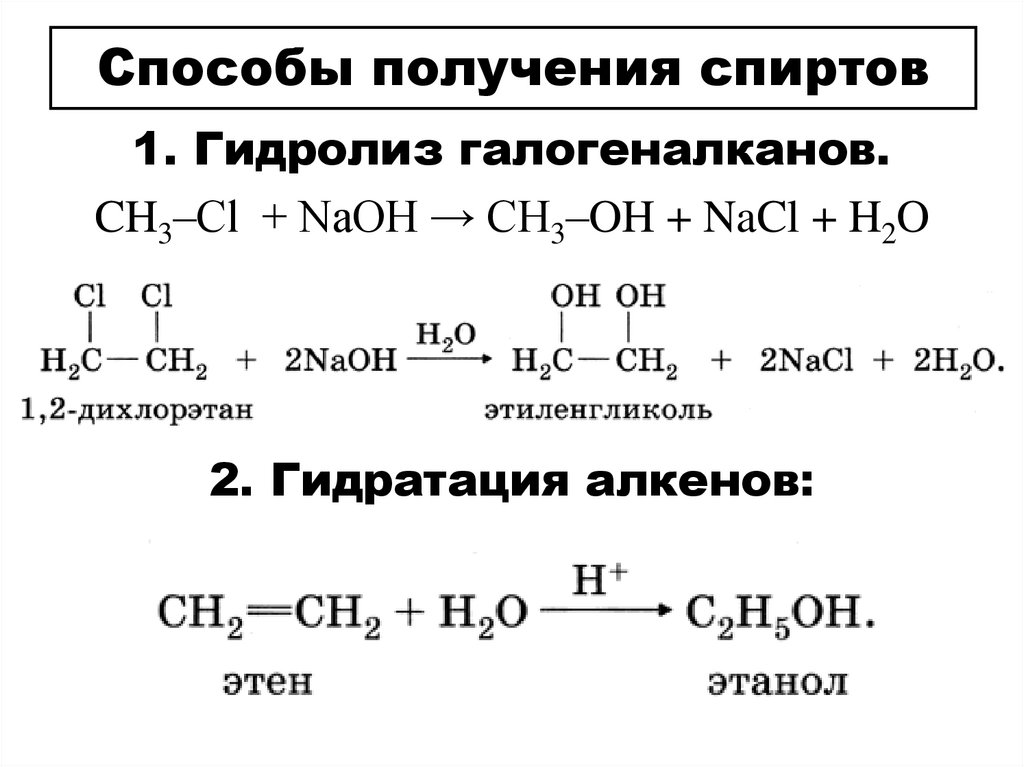
Способы получения спиртов1. Гидролиз галогеналканов.
CH3–Cl + NaOH → CH3–OH + NaCl + H2O
2. Гидратация алкенов:
14.
3. Гидрирование альдегидов:4. Окисление алкенов:
15.
5. Специфические способыполучения спиртов:
6. Брожение глюкозы
16.
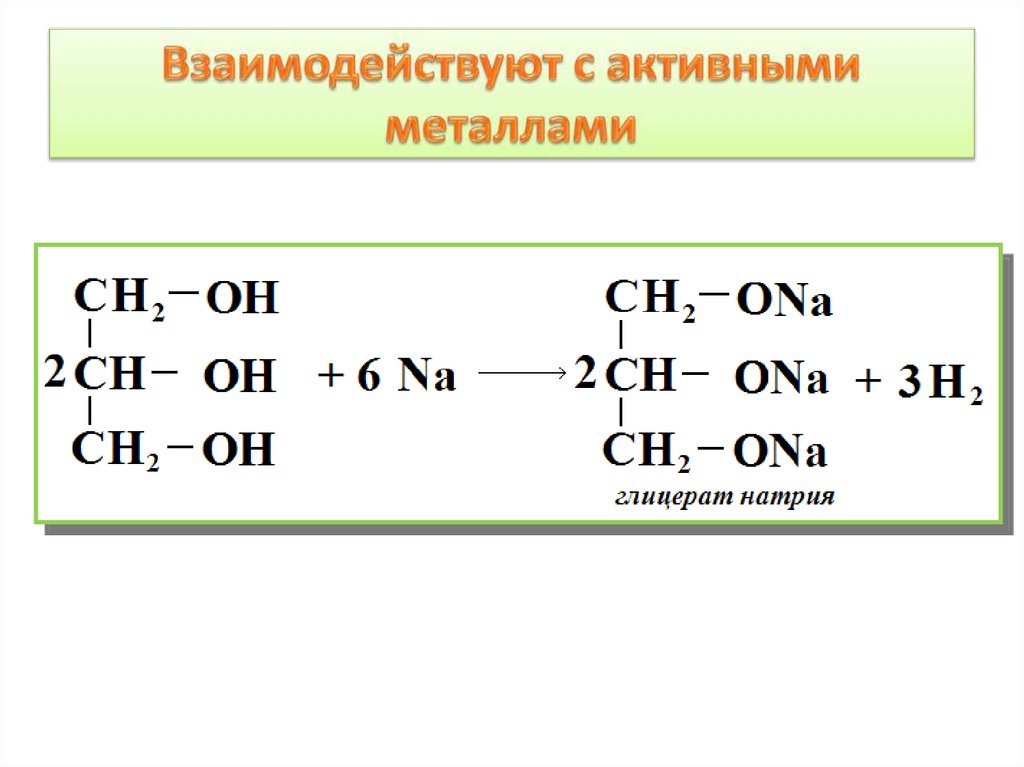
Химические свойства спиртов1. Взаимодействие спиртов со щелочными и
щелочноземельными металлами:
2Na + 2C2H5OH → 2C2H5ONa + H2
2. Взаимодействие спиртов с
галогеноводородами:
C2H5OH + HBr → C2H5Br + H2O
3. Межмолекулярная дегидратация спиртов:
H2SO4
CH3OH + HOCH3 → CH3 – O – CH3 + H2O
17.
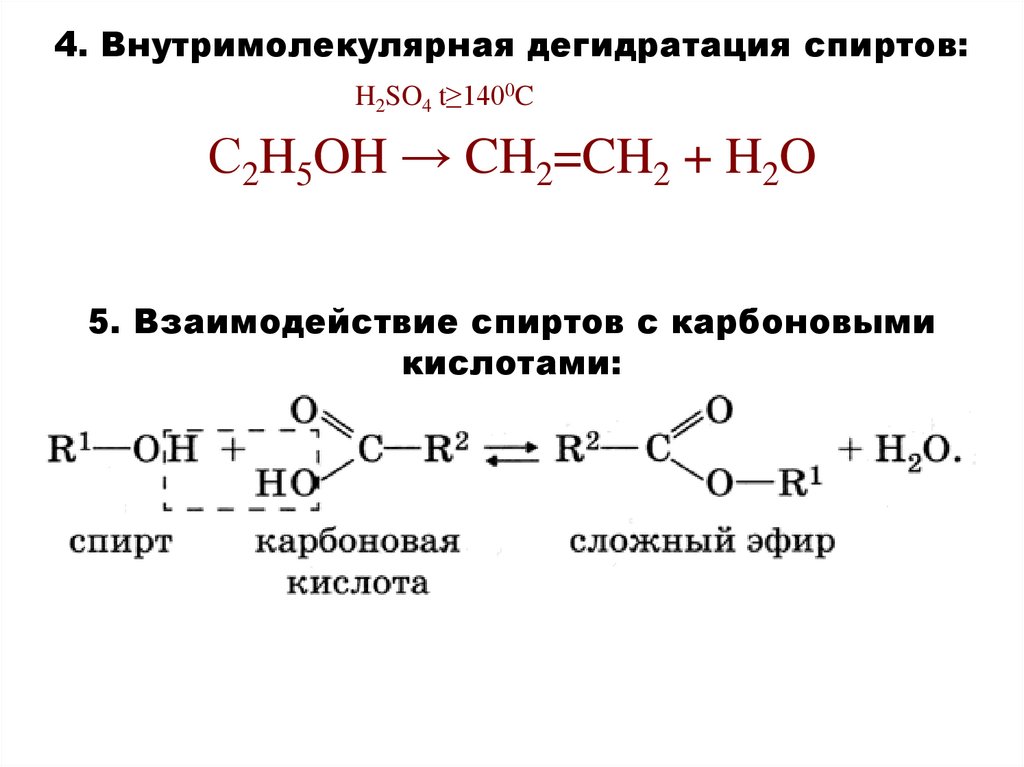
4. Внутримолекулярная дегидратация спиртов:H2SO4 t≥1400C
С2H5OH → CH2=CH2 + H2O
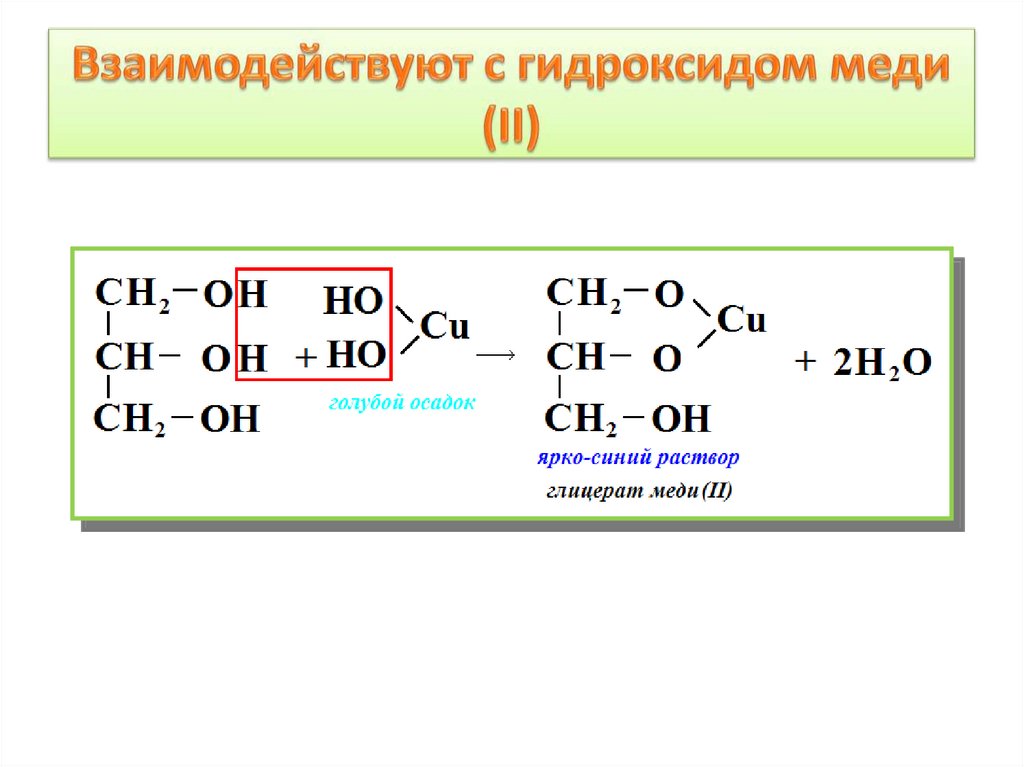
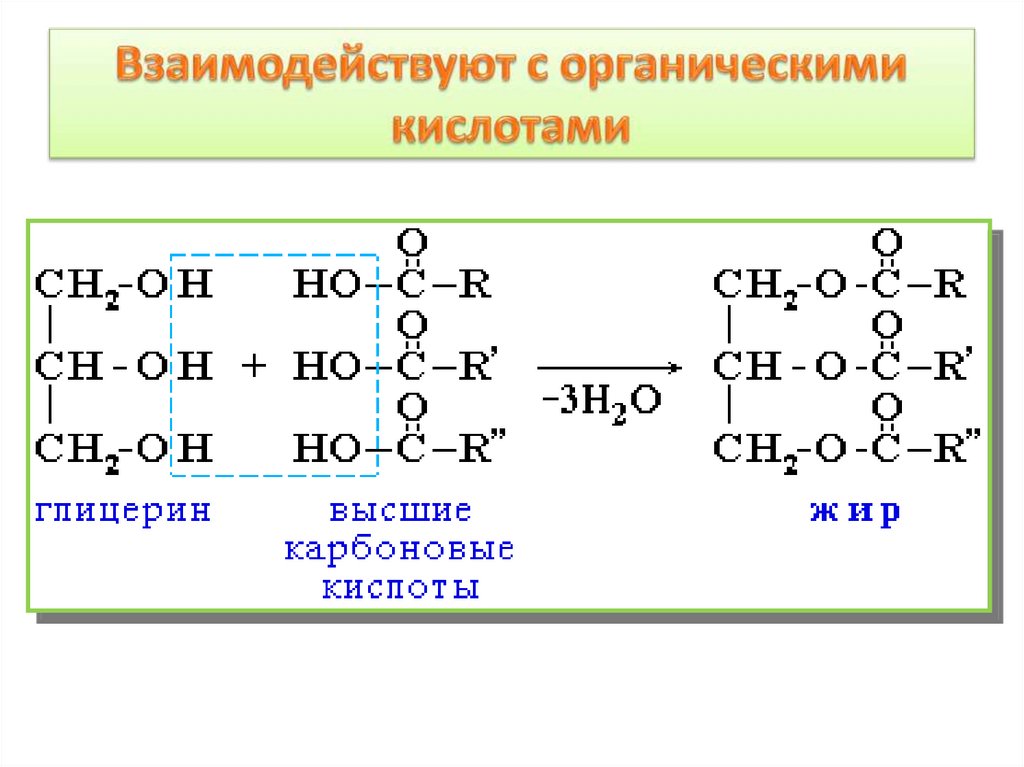
5. Взаимодействие спиртов с карбоновыми
кислотами:
18.
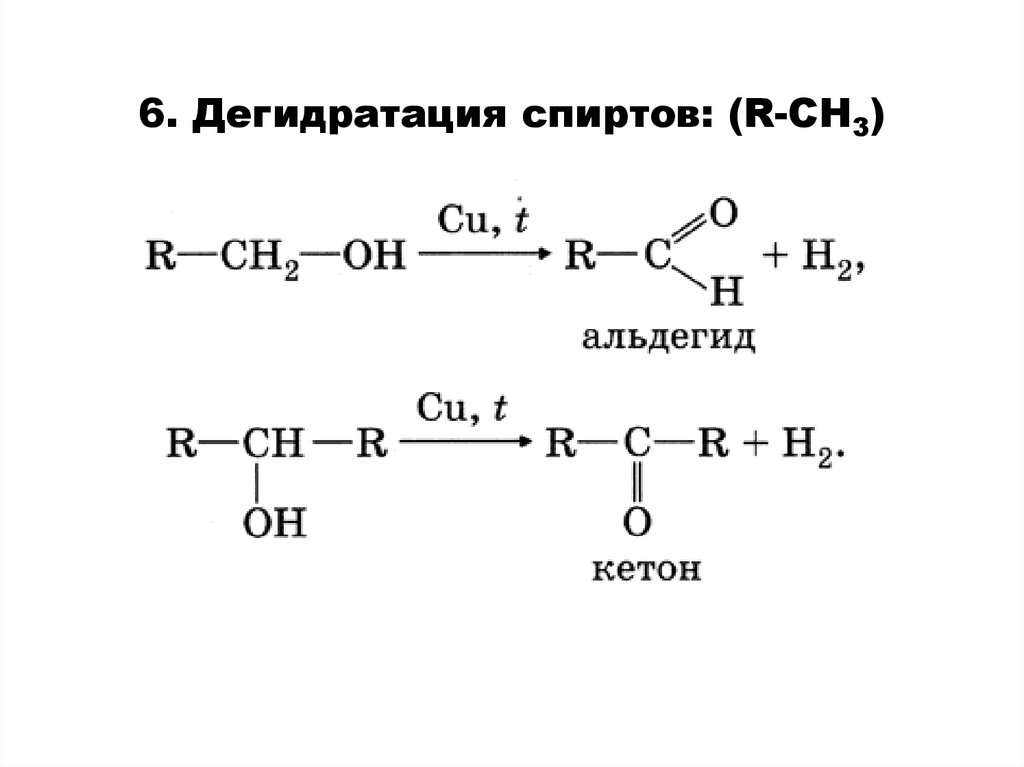
6. Дегидратация спиртов: (R-СH3)19.
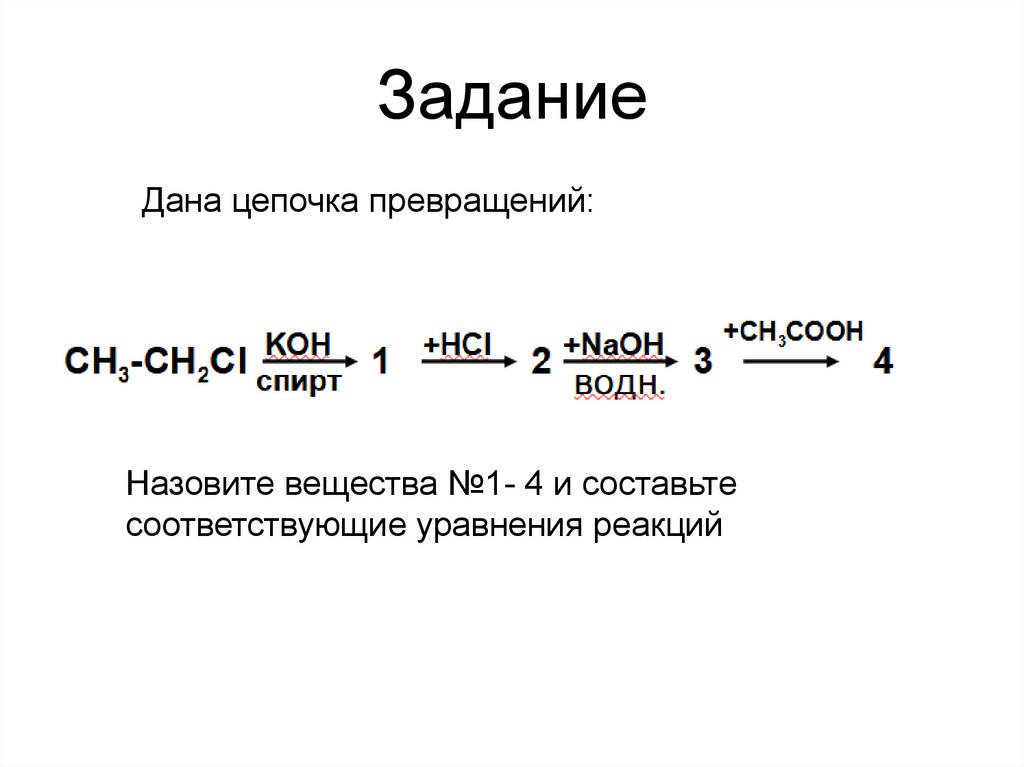
ЗаданиеДана цепочка превращений:
KOH
CH3-CH2Cl спирт
1
+HCl
2
+NaOH
водн.
3
+CH3COOH
4
Назовите вещества №1- 4 и составьте
соответствующие уравнения реакций
20.
Домашняя работа1.Состав этилового спирта C2H6O. Напишите
структурную формулу этого вещества. Укажите, какая
группа атомов обусловливает химические свойства
спиртов.
2.Составьте структурные формулы следующих спиртов:
а) 2-метил-1-пропанол;
б) 2-метил-1-бутанол;
в) 2-метил-2-пропанол;
г) 1,2,3-бутантриол;
д) 3-пентанол;
е) 3-метил-2-пентанол;
ж) 2,3,4-триметилпентанол;
3. С помощью каких химических реакций можно
осуществить следующие превращения:
а) этан→этилен→этанол→вода;
б)пропан→пропен→пропанол→оксид углерода (IV)?
21.
22.
Многоатомные спирты – этопроизводные
углеводородов,
молекулы
которых содержат несколько гидроксильных
групп, связанных с разными атомами
углерода.
23.
Посистематической
номенклатуре
название многоатомных спиртов дается
следующим образом:
24.
ЭтиленгликольГлицерин
б/ц, б/з вязкая
сладковатая жидкость
б/ц, б/з вязкая
сладковатая жидкость
Неограниченно
растворим в воде
Неограниченно
растворим в воде
t0кип= -120С
t0кип= - 170С
t0пл = 1970С
t0пл = 2900С
ρ = 1,43г/см3
ρ = 1,26г/см3
25.
26.
27.
28.
29.
Не относится книтросоединениям!!!
30.
Его производство разработал русский ученый Н.Н.Зининв 1853г., но предложения о строительстве промышленных
предприятий по изготовлению снарядов и мин не
заинтересовали царское правительство. Только в 1863-1867
гг. нитроглицерин начали успешно применять для
подземных и подводных взрывов. Ученик Н.Н.Зинина
Альфред Нобель продолжил работы своего учителя и
запатентовал способ производства динамита в 1867г.
31.
О нитроглицеринеОказывает антиангинальное и спазмолитическое
действие,
расслабляет
гладкую
мускулатуру
сосудистых
стенок,
бронхов,
желудочно-кишечного
тракта, желчевыводящих путей, мочеточников.
32.
33.
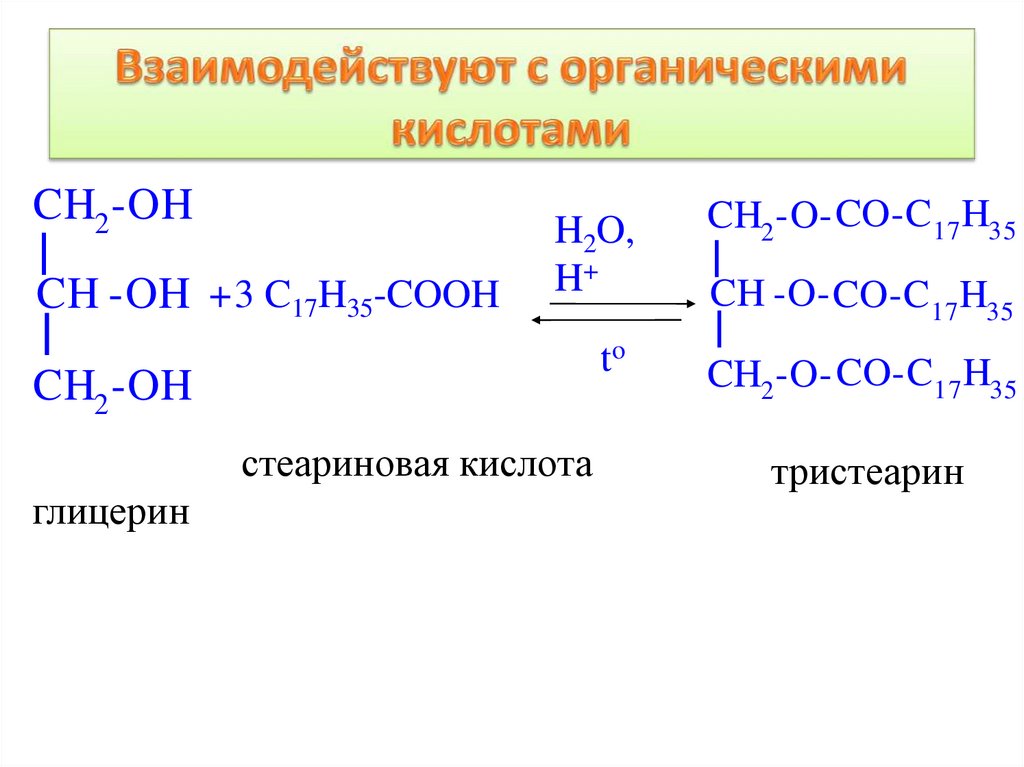
CH2 -OHCH -OH +3 C17H35-COOH
H2O,
H+
CH2 -O- CO-C17 H35
to
CH2 -O- CO-C17 H35
CH2 -OH
стеариновая кислота
глицерин
CH -O- CO-C17 H35
тристеарин
34.
35.
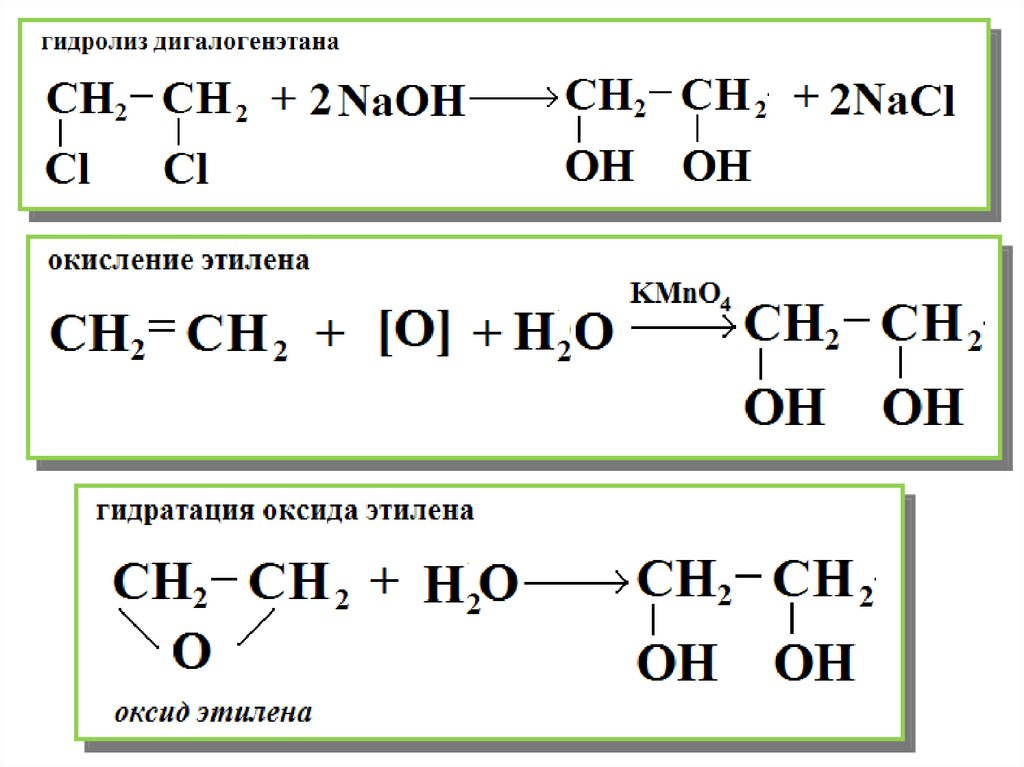
Гидролиз дигалогенэтанаОкисление этилена
Гидратация оксида этилена
36.
37.
Гидролиз жировВ зависимости от условий бывает:
А) водный (без катализатора, при высоких
температуре и давлении)
Б) кислотный (в присутствии кислоты в
качестве катализатора)
В) ферментативный (происходит в живых
клетках)
Г) щелочной (под действием щелочей).
38.
Реакции кислотного гидролизаCH2 -O- CO-C17 H35
CH -O- CO-C17 H35
CH2 -O- CO-C17 H35
тристеарин
H2O, H+
to
CH2 -OH
CH -OH
CH2 -OH
глицерин
+ 3 C17H35-COOH
стеариновая кислота
39.
Взаимосвязь органическихвеществ
C3. Напишите уравнения реакций, с помощью которых можно
осуществить превращения:
Пропанол-1
H2SO4(конц.),t
Х1
Br2
Х2
пропин
H2O, Hg2+
Х3
РЕШЕНИЕ:
CH3–CH2–CH2–OH CH3–CH=CH2 + H2O
CH3–CH=CH2 + Br2 CH3–CHBr–CH2Br
CH3–CHBr–CH2Br + 2KOH 2KBr + 2H2O + CH3–C CH
CH3–C CH + HOH CH3–CO–CH3
CH3–CO–CH3 + H2 CH3–CHOH–CH3
H2, кат.
Х4


























 chemistry
chemistry








