Similar presentations:
Углеводы. Моносахариды
1. УГЛЕВОДЫ
Углеводами называют группу природныхвеществ, которые в соответствии с
химической классификацией являются
полигидроксиальдегидами или
полигидроксикетонами, либо
продуктами их поликонденсации.
2.
Функции углеводов:структурная (целлюлоза в растениях, хитин в
грибах);
энергетическая (крахмал в растениях, гликоген в
животных организмах).
Углеводы входят в состав жизненно
важных веществ:
нуклеиновых кислот,
коферментов,
витаминов,
лекарственных средств.
3.
• Углеводы составляют до 80% сухого вещества массырастений и 2% сухого вещества массы животных, на
долю углеводов приходится около 0,5% массы
человека.
• Животные организмы не способны синтезировать
углеводы и получают их с различными пищевыми
продуктами растительного происхождения.
• В растениях углеводы образуются в процессе реакции
фотосинтеза, осуществляемого за счет солнечной
энергии с участием зеленого пигмента растений
хлорофилла:
• В результате накапливается огромное количество
гомополисахаридов целлюлозы и крахмала.
4.
• В общем виде полигидроксиальдегиды иполигидроксикетоны можно представить
следующим образом:
O
H
C
CH2OH
C
O
(CHOH)n
(CHOH)n
CH2OH
CH2OH
Название «углеводы» эти соединения получили потому, что
первые из известных представителей имели состав
Сn(H2O)m.
Например:
глюкоза С6Н12О6=6С•6Н2О,
сахароза С12Н22О11=12С•11Н2О,
крахмал (С6Н10О5)n=(6С•5Н2О)n.
Углеводы имеют и другие название – «сахара» или
«сахариды»
5.
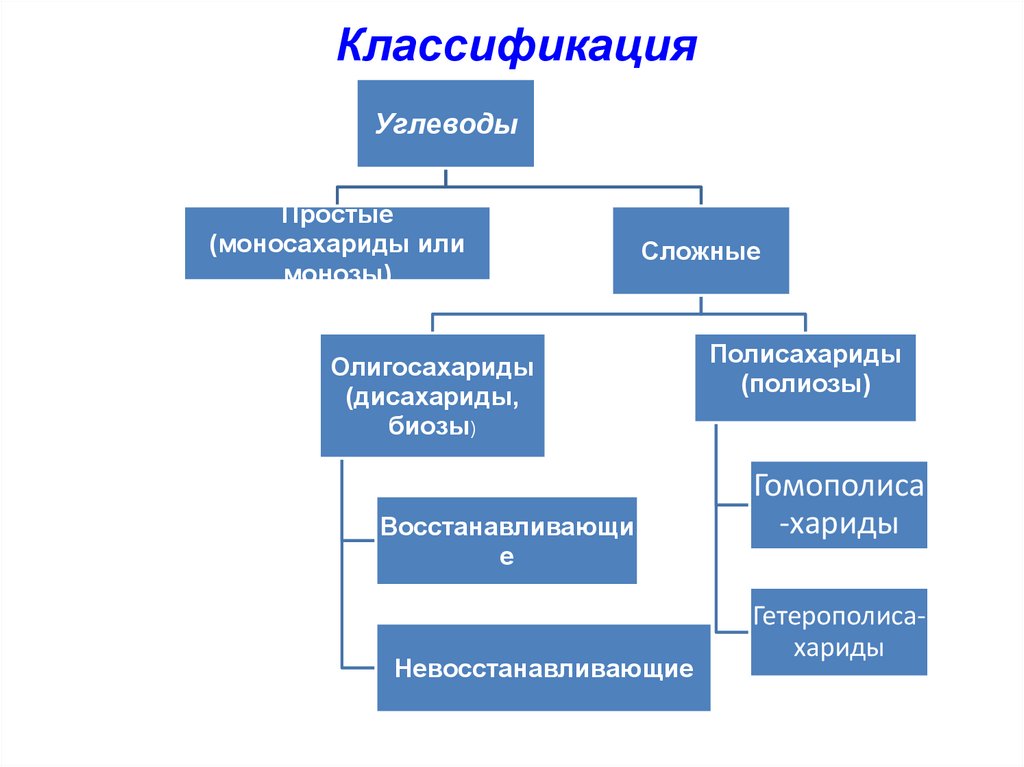
КлассификацияУглеводы
Простые
(моносахариды или
монозы)
Сложные
Олигосахариды
(дисахариды,
биозы)
Восстанавливающи
е
Невосстанавливающие
Полисахариды
(полиозы)
Гомополиса
-хариды
Гетерополисахариды
6.
Простые углеводы (моносахариды илимонозы, гликозы) -
• - полигидроксиальдегиды или полигидроксикетоны, которые
не гидролизуются до более простых углеводов
Сложные (олигосахариды и полисахариды
или полиозы) – являются продуктами поликонденсации моноз и
способны гидролизоваться до более простых
C12H22O11 + H2O
углеводов (моноз):
сахароза
C6H12O6 + C6H12O6
глюкоза фруктоза
(C6H10O5)n + nH2O
целлюлоза
nC6H12O6
глюкоза
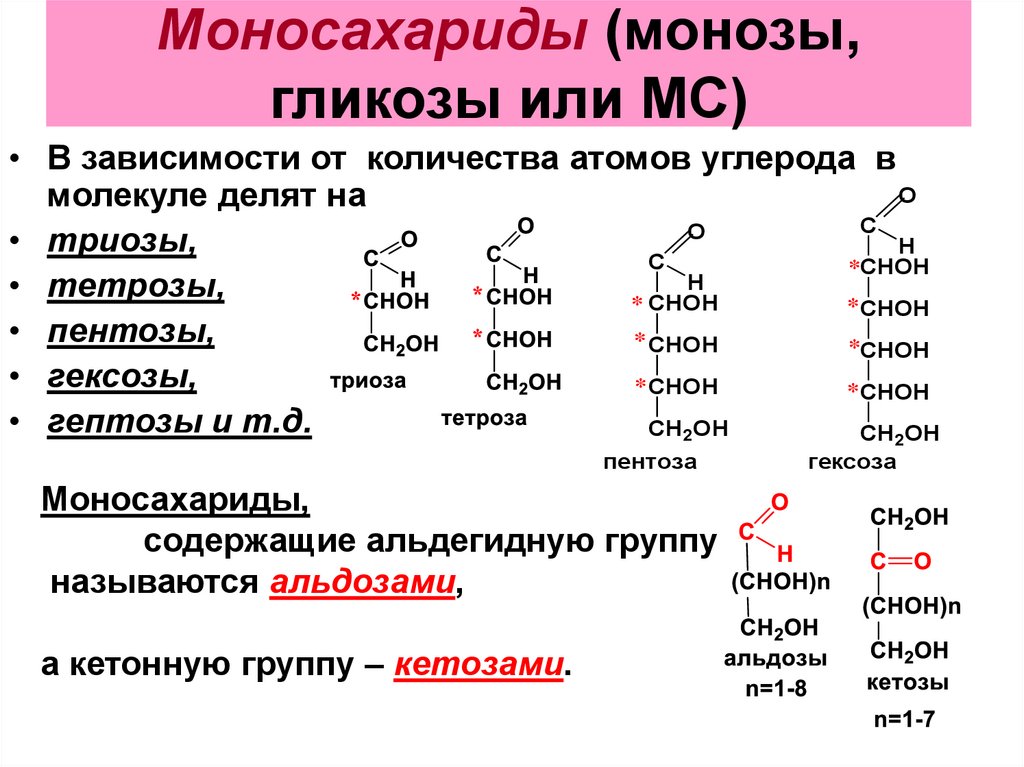
7. Моносахариды (монозы, гликозы или МС)
• В зависимости от количества атомов углерода вO
молекуле делят на
C
O
• триозы,
H
C
*CHOH
H
• тетрозы,
* CHOH
*CHOH
• пентозы,
* CHOH
*CHOH
• гексозы,
* CHOH
*CHOH
• гептозы и т.д.
CH2OH
CH2OH
пентоза
Моносахариды,
содержащие альдегидную группу
называются альдозами,
а кетонную группу – кетозами.
гексоза
8.
9.
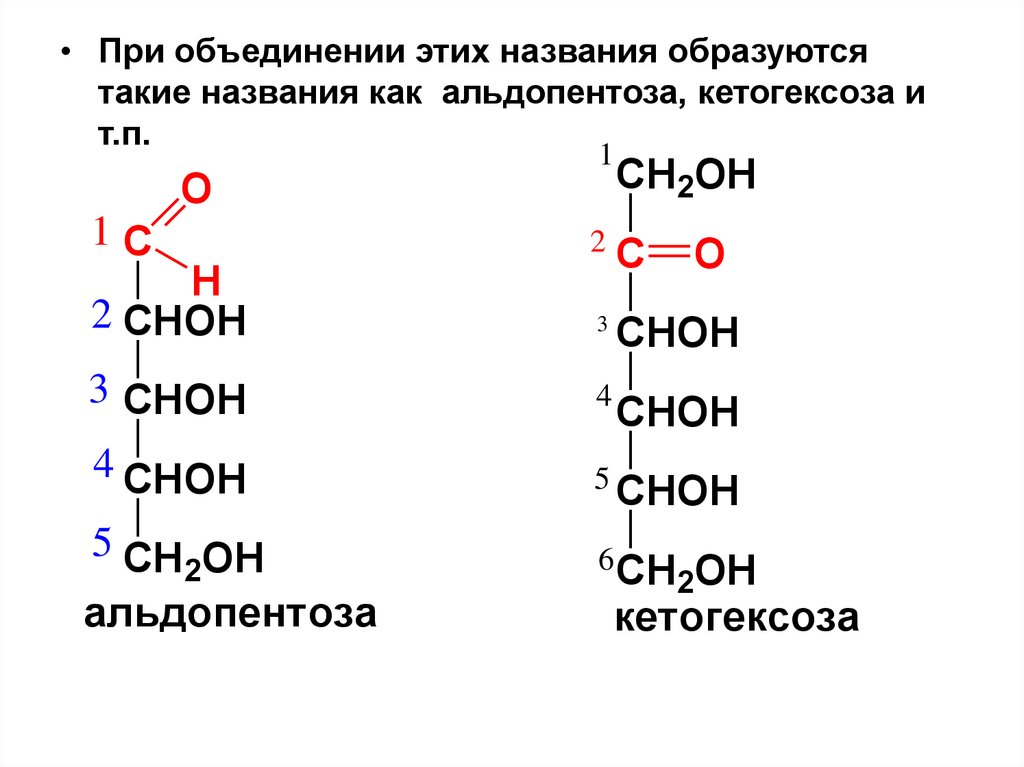
• При объединении этих названия образуютсятакие названия как альдопентоза, кетогексоза и
т.п.
1
CH2OH
1C
2
H
2 CHOH
C
3
CHOH
O
3 CHOH
4 CHOH
5 CH OH
2
альдопентоза
O
4
CHOH
5
CHOH
6 CH OH
2
кетогексоза
10.
• По химической природе моносахариды делят на:• А) Нейтральные сахара, содержащие только
карбонильную (альдегидную или кетонную) группу и
гидроксильные группы –
• альдегидо- или кетоноспирты.
• Они в большинстве своем имеют состав,
соответствующий общей формуле СnH2nOn, т. е. число
атомов С равно числу атомов О
•В природе известны и такие нейтральные
моносахариды, у которых число атомов О меньше, чем
число атомов С (напр. СnH2nOn-1 – одна из НО-групп
замещена на атом
O
C
водорода). Такие сахара
H
CH2
называют дезоксисахарами:
CHOH
CHOH
CH2OH
11.
•Б) Аминосахара (точнее дезоксиаминосахара),содержащие вместо НО-группы аминогруппу,
которая
придает этим соединениям
основные свойства
:
O
C
H
CHNH2
CHOH
CHOH
CHOH
CH2OH
В) Кислые сахара, содержащие кроме карбонильной
и гидроксильных групп карбоксильную группу,
O
напр., уроновые кислоты:
C
H
CHOH
CHOH
CHOH
CHOH
COOH
12.
• Наиболее распространены вприроде нейтральные простые
сахара – моносахариды.
• Моносахариды, которые
содержат 7 и более С-атомов
называют высшими сахарами.
13. Номенклатура
• Как следует из структурных формул моносахаридов, онисодержат асимметрические атомы углерода и потому существуют
в виде нескольких оптических (стерео) изомеров.
• Каждый стереоизомер имеет свое название.
• Все названия моносахаридов образуются в соответствии с их
классификацией и имеют суффикс «оза».
• Отдельные представители имеют тривиальные названия. Наиболее
распространены
• альдопентозы: рибоза, ксилоза, арабиноза CHO
CHO
H
OH
H
H
OH
HO
H
OH
H
OH
CHO
OH
H
H
H
OH
OH
H
OH
CH2OH
CH2OH
CH2OH
рибоза
ксилоза
арабиноза
• альдогексозы: глюкоза, манноза,
• галактоза -
CHO
H
HO
CHO
CHO
OH
HO
H
H
H
HO
H
HO
H
H
H
OH
H
OH
HO
H
OH
H
OH
H
CH2OH
глюкоза
CH2OH
манноза
OH
OH
CH2OH
галактоза
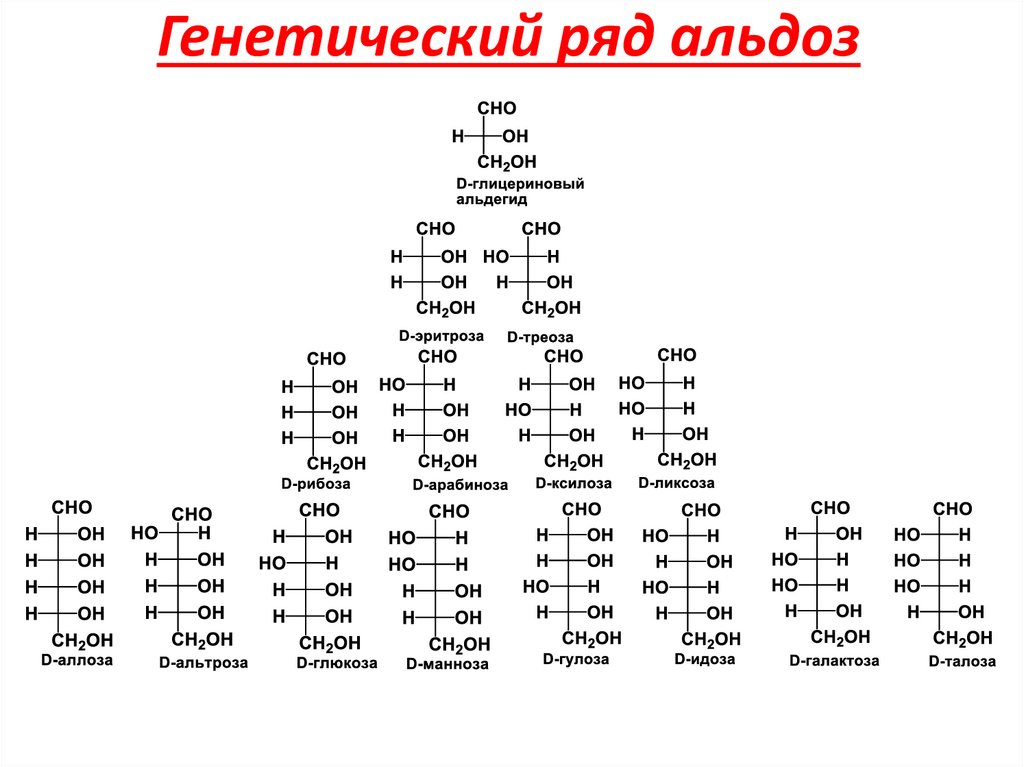
14. Генетический ряд альдоз
15.
• Названия кетоз образуют из названийсоответствующих альдоз, заменяя суффикс «оза» на
«улоза». Исключение составляет, например, название
«фруктоза» и др., которые не имеют взаимосвязи с
названием соответствующей монозы:
• кетогексозы: фруктоза, рибулоза, ксилулоза.
CH2OH
CH2OH
CH2OH
C
C
O
H
OH
OH
H
OH
H
CH2OH
рибулоза
C
O
O
HO
H
H
OH
OH
H
OH
CH2OH
ксилулоза
H
CH2OH
фруктоза
16.
• От тривиальных названий альдоз образуютназвания дезоксисахаров, аминосахаров,
карбоксилсодержащих сахаров, некоторых
многоатомных спиртов и других
производных.
17.
• При образовании названия моноз1) С-атомы нумеруют, начиная с того конца, к
которому ближе
карбонильная группа;
2) цифрами указывают положение заместителей;
3) если заместитель связан не с атомом С, то
указывают атом, с которым заместитель связан
непосредственно.
Например:
1
CHO
1 CHO
2
СH2
H
3
H
4
OH
OH
5
CH2OH
2-дезоксирибоза
H
HO
2
3
H
4
H
5
NH2
H
OH
OH
6
CH2OH
2-амино2-дезоксиглюкоза
1 CHO
1 CHO
H
HO
H
H
2
3
4
5
6
NHCOCH3
H
H
H3CO
OH
H
OH
H
CH2OH
2-N-ацетиламино2-дезоксиглюкоза
2
OCH3
3
H
4
5
6
OCH3
OH
CH2OH
2,3,4-три-Ометилглюкоза
18.
•Названия кислых сахаров (группаВ) образуют следующим образом:
•производные моносахаридов,
содержащие СООН-группу в 1-ом
положении называют альдоновыми
(гликоновыми) кислотами –
суффикс «оза» в названии монозы
заменяют на «оновая кислота» Если СООН-группа находится в
конце цепи, то такие кислоты
называют уроновыми
кислотами – суффикс «оза» в
названии монозы заменяют на
«уроновая кислота» (при
нумерации отсчет ведут от
альдегидной группы)
19.
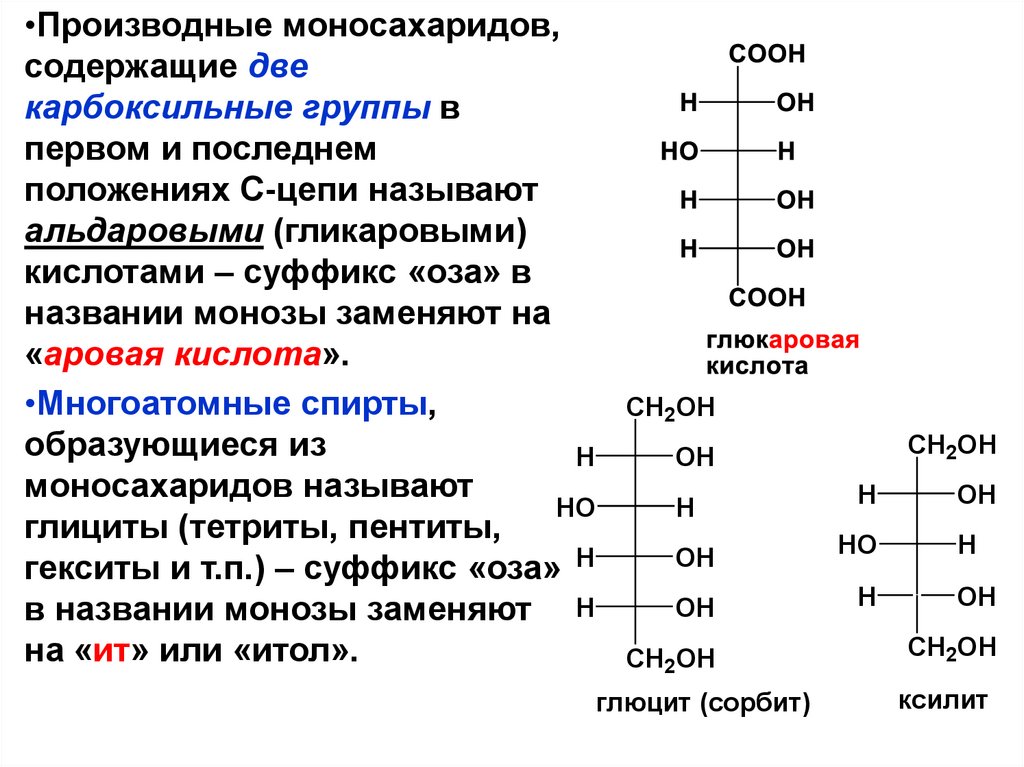
•Производные моносахаридов,содержащие две
карбоксильные группы в
первом и последнем
положениях С-цепи называют
альдаровыми (гликаровыми)
кислотами – суффикс «оза» в
названии монозы заменяют на
«аровая кислота».
•Многоатомные спирты,
образующиеся из
H
моносахаридов называют
HO
глициты (тетриты, пентиты,
гекситы и т.п.) – суффикс «оза» H
в названии монозы заменяют H
на «ит» или «итол».
CH2OH
CH2OH
OH
H
H
OH
HO
OH
H
CH2OH
глюцит (сорбит)
OH
H
OH
CH2OH
ксилит
20. Химическое строение
•Моносахариды по химическойприроде являются
полигидроксиальдегидами,
• либо
полигидроксикетонами.
21.
• Большинство моносахаридов имеют неразветвленнуюцепь С-атомов, Иногда пентозы и гексозы с
разветвленным С-скелетом. Напр., апиоза –
HOH2C
HOH2C
O
COH
CHOH
C
H
•Рассмотрим строение моносахаридов на примере
гексозы глюкозы.
•Все гексозы имеют молекулярную формулу С6Н12О6 и
общий вид
Это так называемая открытая
форма («оксо-форма»). Эта
форма существует только в
растворах в равновесии с
циклической
полуацетальной формой.
22.
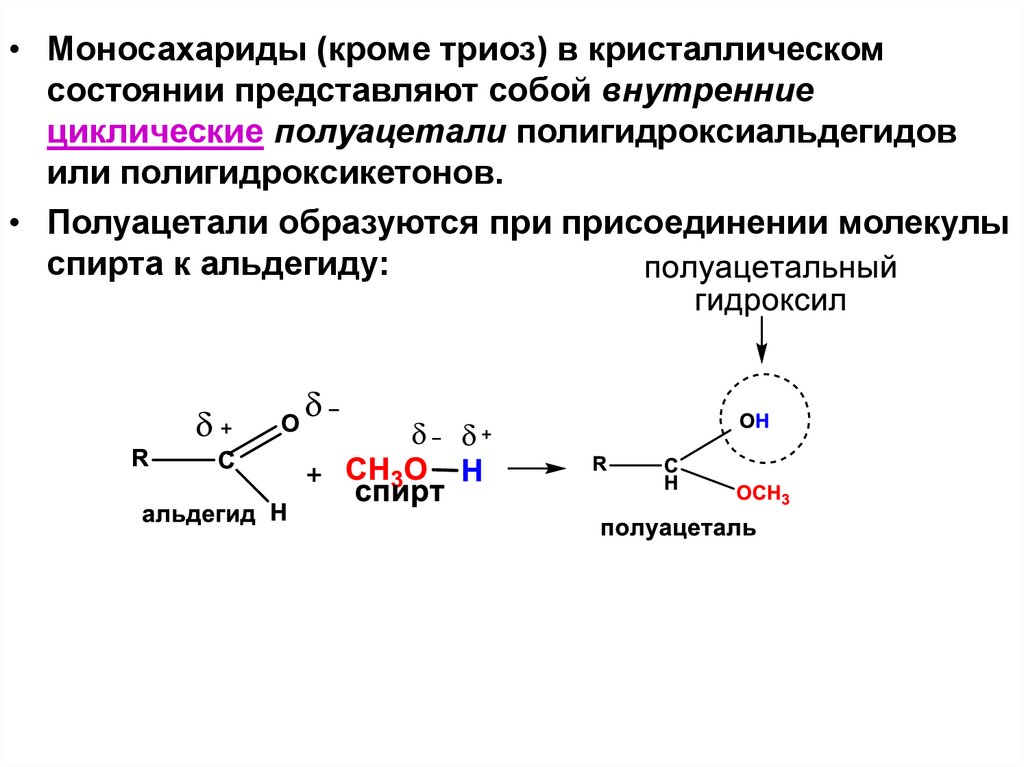
• Моносахариды (кроме триоз) в кристаллическомсостоянии представляют собой внутренние
циклические полуацетали полигидроксиальдегидов
или полигидроксикетонов.
• Полуацетали образуются при присоединении молекулы
спирта к альдегиду:
23.
В результате внутримолекулярноговзаимодействия НО-группы с
карбонильной группой
образуются циклические
полуацетали:
24.
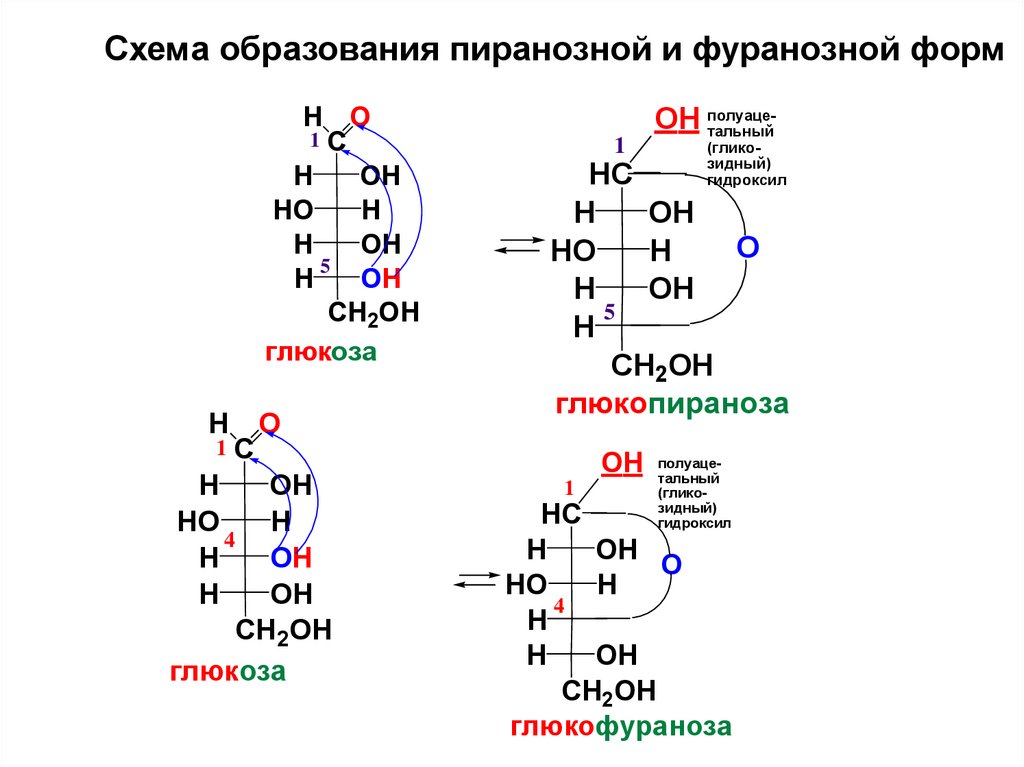
• Циклические формы альдогексоз образуются врезультате внутримолекулярного взаимодействия
альдегидной группы с НО-группой у С5 или С4 –атома:
• О-атом НО-группы образует связь с карбонильным Сатомом, а Н-атом НО-группы присоединяется к О-атому
карбонильной группы. В результате образуются
устойчивые циклические полуацетальные формы:
• – пиранозная - (6-членный цикл),
• – фуранозная - (5-членный цикл).
Эти формы получили название от
соответствующих гетероциклических
соединений:
O
пиран
O
фуран
Для указания размера колец циклических форм
для 6-членного цикла две последние буквы в
названии моносахарида «oза» заменяют
суффиксом «пираноза»,
для 5-членного цикла суффиксом «фураноза».
25.
Схема образования пиранозной и фуранозной формH O
1C
H
OH
HO
H
H
OH
5
H
OH
CH2OH
глюкоза
H O
1C
H
OH
HO
H
4
H
OH
H
OH
CH2OH
глюкоза
1
OH полуацетальный
(гликозидный)
гидроксил
HC
H
OH
O
HO
H
H
OH
5
H
CH2OH
глюкопираноза
OH
1
полуацетальный
(гликозидный)
гидроксил
HC
H
OH
O
HO
H
4
H
H
OH
CH2OH
глюкофураноза
26.
• Образование фуранозной формы на примерекетогексозы фруктозы
27.
• Анализ строения циклических форм• Образование
циклической
формы
вызывает
появление
дополнительного
асимметрического
атома С и ещё одной гидроксильной группы, которая
называется полуацетальной или гликозидной.
• В циклической форме альдогексозы имеются только
гидроксильные группы, причем они разные:
• один ОН полуацетальный (гликозидный) – появился
в результате внутримолекулярного взаимодействия
карбонильной и спиртовой групп; другие НО-группы
– спиртовые: один первичный, остальные
вторичные.
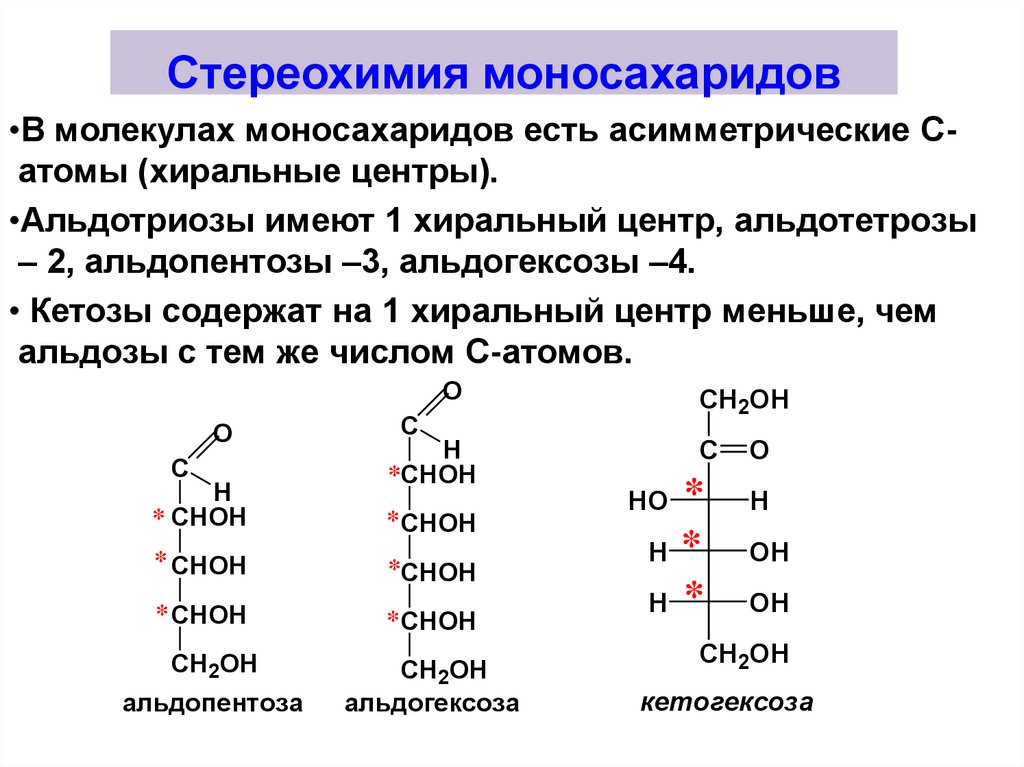
28. Стереохимия моносахаридов
•В молекулах моносахаридов есть асимметрические Сатомы (хиральные центры).•Альдотриозы имеют 1 хиральный центр, альдотетрозы
– 2, альдопентозы –3, альдогексозы –4.
• Кетозы содержат на 1 хиральный центр меньше, чем
альдозы с тем же числом С-атомов.
O
O
C
C
H
*CHOH
H
* CHOH
*CHOH
* CHOH
*CHOH
* CHOH
*CHOH
CH2OH
альдопентоза
CH2OH
CH2OH
альдогексоза
C
HO
H
H
*
*
*
O
H
OH
OH
CH2OH
кетогексоза
29.
Для изображения стереоизомеров пользуютсяформулами Фишера.
С-цепь моносахарида изображают вертикальной линией
с оксогруппой расположенной в верхней части цепи.
Асимметрические С-атомы находятся на
перекрещивании прямых линий, указывающих связи их
с Н и НО-группой, которые пишут слева или справа в
соответствии с пространственным расположением.
Все асимметрические С-атомы находятся в заслоненной
конформации и группы Н и ОН направлены к
Количество стереоизомеров
наблюдателю.
OH
OHC
C
C
HOH2C
H
OH
H
согласно формуле Фишера равно:
N=2n,
где n – число асимметрических
атомов углерода.
Для каждого из оптических
изомеров существует один его
оптический антипод –
энантиомер, остальные
являются диастереомерами.
30.
Триозы – 2 стереоизомера (пара антиподов);Тетрозы – 4 стереоизомера или 2 пары антиподов;
Пентозы – 8 стереоизомеров или 4 пары антиподов;
Гексозы – 16 стереоизомеров или 8 пар антиподов.
Все монозы относятся к 2 рядам: правому (D-ряд) и
левому (L-ряд).
Родоначальником семейства альдоз является
глицериновый альдегид, семейства кетоз –
дигидроксиацетон: H
O
С
* OH
HC
CH2OH
глицериновый
альдегид
CH2OH
C
O
CH2OH
дигидроксиацетон
31.
Для всех альдоз установлены относительныеконфигурации, т.е. пространственное расположение
заместителей у асимметрических атомов.
H
O
С
Их конфигурации определены относительно
H
* OH
конфигурации D-глицеринового альдегида.
CH2OH
D-глицериновый
• В соответствии с таким отнесением все
альдегид
моносахариды разделены на принадлежащие к Dили L- рядам (генетическим рядам).
• Принадлежность моносахарида к D- или L-
ряду определяется по
конфигурации его последнего
(считая от альдегидной группы)
асимметрического атома углерода.
32.
•Если она соответствует конфигурации Dглицеринового альдегида, т.е. если НО-группа стоитсправа, то моноза относится к D-ряду.
H
H
С
O
* OH
CH2OH
D-глицериновый
альдегид
Если НО-группа стоит слева, то конфигурация
наиболее удаленного от карбонильной группы атома
С соответствует конфигурации L-глицеринового
альдегида, и моноза относится к L –ряду.
H
HO
С
O
*H
CH2OH
L-глицериновый
альдегид
33.
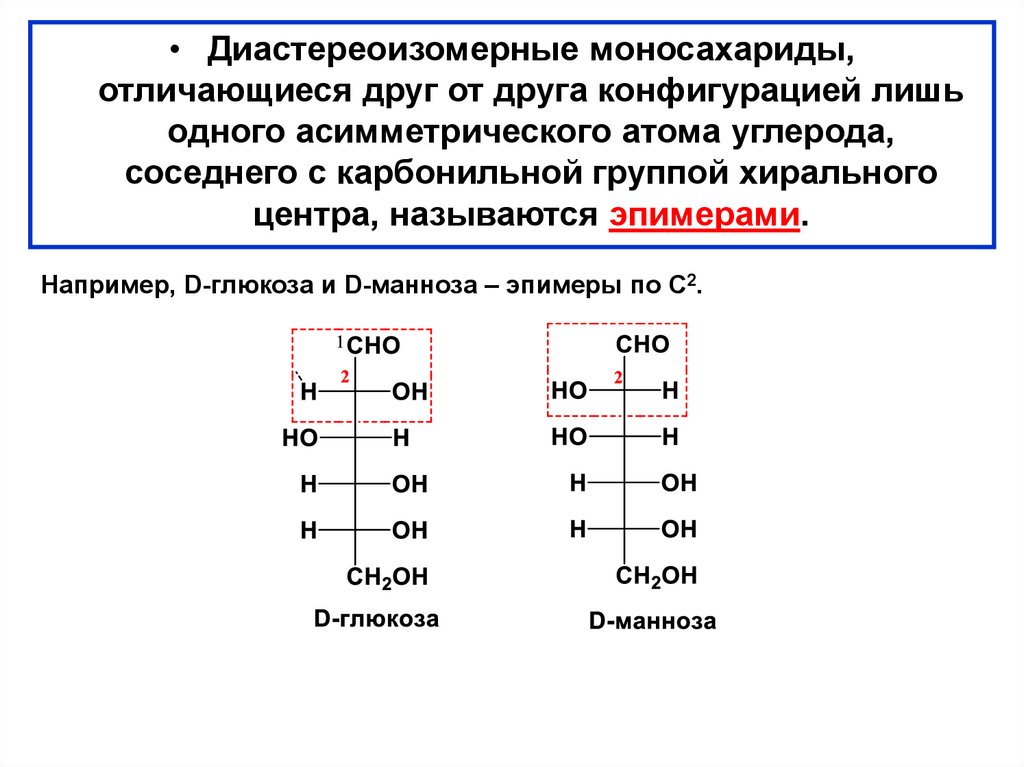
• Диастереоизомерные моносахариды,отличающиеся друг от друга конфигурацией лишь
одного асимметрического атома углерода,
соседнего с карбонильной группой хирального
центра, называются эпимерами.
Например, D-глюкоза и D-манноза – эпимеры по С2.
34.
• Например, D-глюкоза и D-манноза –эпимеры по С2).
CHO
CHO
H
HO
OH
HO
H
H
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D-глюкоза
CH2OH
D-манноза
35. Стереохимия цииклических форм
• В циклических формах моносахаридов независимо отразмера кольца (фуранозное или пиранозное) С-атом
карбонильной группы становится асимметрическим и
также имеет 2 зеркальные конфигурации, т. е. в
циклической форме у альдоз появился новый С1
хиральный центр. Называется он аномерный атом.
Две стереоизомерные формы альдоз, отличающиеся
только конфигурацией С1 (кетоз – С2) называются
аномерами.
Для указания его конфигурации используют аномерные
префиксы
α и β,
связанные с взаимным расположением заместителей у
аномерного центра и у С-атома, определяющего
принадлежность монозы к D- или L-ряду.
36.
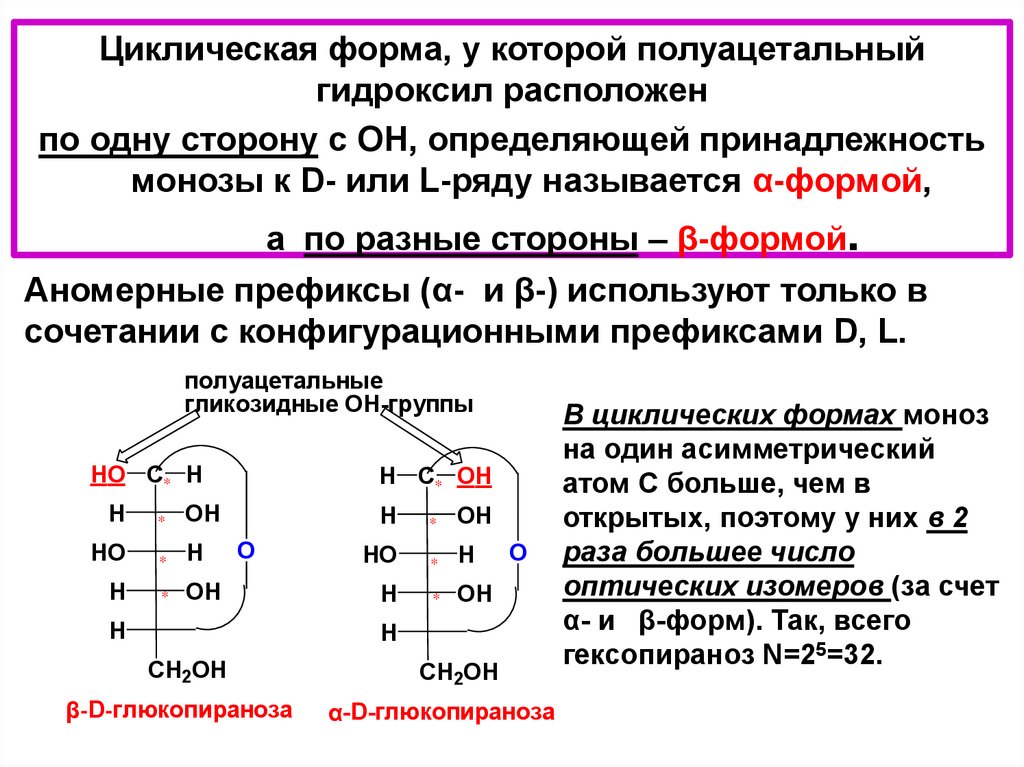
Циклическая форма, у которой полуацетальныйгидроксил расположен
по одну сторону с ОН, определяющей принадлежность
монозы к D- или L-ряду называется α-формой,
а по разные стороны – β-формой.
Аномерные префиксы (α- и β-) используют только в
сочетании с конфигурационными префиксами D, L.
полуацетальные
гликозидные ОН-группы
HO C* H
H
*
OH
HO
*
H
H
*
OH
H C* OH
O
H
H
*
OH
HO
*
H
H
*
OH
O
H
CH2OH
β-D-глюкопираноза
CH2OH
α-D-глюкопираноза
В циклических формах моноз
на один асимметрический
атом С больше, чем в
открытых, поэтому у них в 2
раза большее число
оптических изомеров (за счет
α- и β-форм). Так, всего
гексопираноз N=25=32.
37. Перспективные формулы Хеуорса
Представляют собой плоские многоугольники,изображенные в перспективе :
-цикл лежит в горизонтальной плоскости,
- связи, расположенные ближе к наблюдателю,
изображаются жирно.
- О-атом в пиранозном цикле распо-лагается в правом
верхнем углу, в фуранозном – за плоскостью цикла.
С-атомы, входящие в цикл, как правило, не пишутся,
располагаются от О-атома по часовой стрелке.
5
O
O
1
4
3
пираноза
2
1
4
3
фураноза
2
38.
Через С-атомы проводят вертикальные линии, наконцах которых пишут НО- и Н-группы в соответствии
с их пространственным расположением. Таким
образом Н, НО- и другие группы располагают условно
над или под плоскостью цикла.
Группы, которые находятся слева от углеродной цепи
в проекционной формуле Фишера, располагают над
плоскостью цикла, справа – под плоскостью цикла.
В формулах Хеуорса группа СН2ОН у альдогексоз D-ряда
в пиранозной форме и у альдопентоз в фуранозной
форме располагается над плоскостью цикла.
6 CH2OH
HO C* H
H
*
OH
HO
*
H
H
*
OH
H
O
H
CH2OH
β -D-глюкопираноза
4
OH
OH
O
5
H OH H
1
2
3
H
OH
H
39.
• Гликозидная НО-группа у альдоз D-ряда в α-форменаходится под плоскостью цикла,
• а в β –форме – над плоскостью цикла.
Н-атом у С5 в формуле Хеуорса оказался под
плоскостью цикла, хотя в формуле Фишера находится
слева. Это объясняется тем, что при этом
асимметрическом С-атоме НО-группа принимает
участие в образовании оксидного цикла, для чего
необходимы две перестановки заместителей:
H
H
5
HO
4
OH
OH
3
H
6
CH2OH
6CH OH
2
H
O
C
1 H
H
2
OH
H
4
OH
5
H
OH
4
OH
3
H
6CH OH
2
5
H
OH
H
2
OH
O
OH
H
3
H
2
OH
H, OH
1
O
C
1
2
H
HO
C
HO
3
H
4
6
HOH2C
5
1
6
CH2OH
H
OH
H
O
HOH2C
O
5
H
H
4
OH
OH
OH
3
H
2
CH2OH
1
- D-фруктофураноза
В формулах Хеуорса для изображения смеси аномеров расположение Н и
гликозидной НО-группы показывают волнистой линией
40.
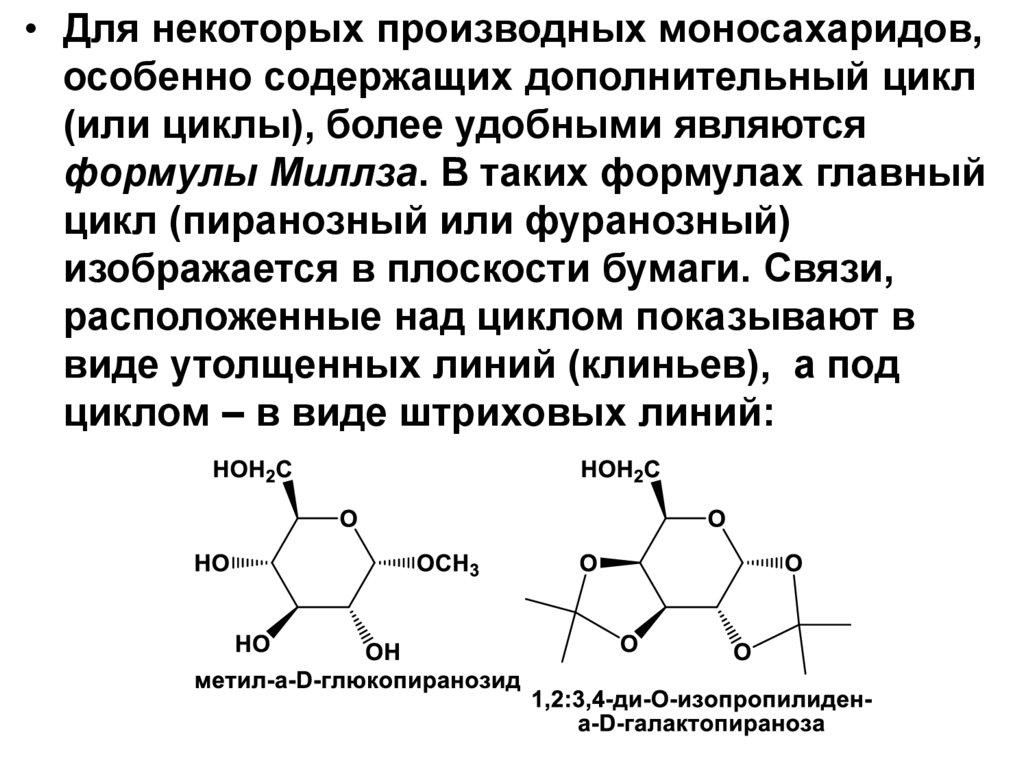
• Для некоторых производных моносахаридов,особенно содержащих дополнительный цикл
(или циклы), более удобными являются
формулы Миллза. В таких формулах главный
цикл (пиранозный или фуранозный)
изображается в плоскости бумаги. Связи,
расположенные над циклом показывают в
виде утолщенных линий (клиньев), а под
циклом – в виде штриховых линий:
41. Конформационная изомерия
Формулы Хеуорса и Миллза предполагают плоское строениекольца. На самом деле циклические пяти- и шестичленные формы
моносахаридов могут существовать в геометрически различных
формах, обусловленных различным расположением в пространстве
С-атомов цикла, для них характерна конформационная изомерия.
В отличие от циклогексана, для которого известно 3
конформации - кресла, ванны и твист, для пиранозного цикла
моноз вследствие его несимметричности из-за наличия О-атома
возможно большее число конформаций.
Выделяют 8, 6 из них кресла, 2 – ванны. Предпочтительность
той или иной конформации для конкретного моносахарида или его
производного определяется соотношением размера и числа
заместителей в цикле и их пространственным расположением.
42.
• Установлено, что пиранозные формымоносахаридов существуют преимущественно в
виде конформации кресла, в которой наибольшее
число объемных заместителей расположены
экваториально.
H
H
CH2OH
CH2OH
HO
H
O
H
HO
OH
H
HO
H
OH
α-D-глюкопираноза
Шаростержневая модель молекулы
H
O
H
HO
OH
OH
H
H
β-D-глюкопираноза
43.
•У α-аномеров полуацетальный ОН располагается ваксиальном положении, а у β-аномеров – в
экваториальном.
•У β-аномера D-глюкопиранозы все объемные
заместители, включая полуацетальный ОН, находятся в
более выгодном экваториальном положении, поэтому в
смеси преобладает β-аномер (64%).
44.
Физические свойстваМоноcахариды (МС) представляют собой твердые
кристаллические вещества, сладкие на вкус,
гигроскопичны, хорошо растворимы в воде. МС легко
образуют сиропы, выделение их из которых в
кристаллическом состоянии представляет
определенные трудности.
Растворимость в спирте МС низкая, в эфире они
практически нерастворимы. Растворы МС обладают
оптической активностью.
45. Физические свойства
Химические свойстваТаутомерия. Мутаротация
В кристаллическом состоянии МС находятся в
циклической форме (α-или β) в зависимости от
растворителя, из которого они были
перекристаллизованы.
α- и β-формы МС различаются растворимостью, Т. пл. и
величиной удельного вращения [α]D.
В кристаллическом состоянии эти формы достаточно
устойчивы и не подвергаются взаимопревращению.
В водных растворах МС претерпевают кольчатоцепную
таутомерию (цикло-оксо-таутомерию) – один аномер
переходит в другой через открытую оксоформу.
• Взаимное превращение α- и β-форм МС называют
аномеризацией.
46. Химические свойства
47.
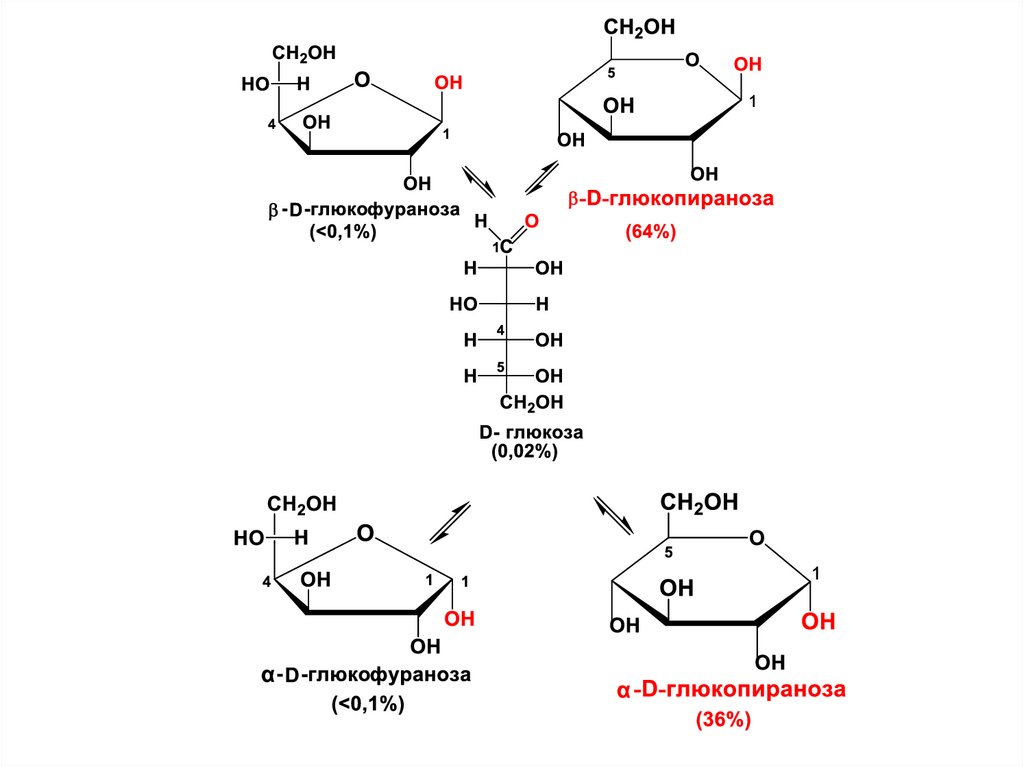
• Как правило, циклические формы МС в растворахпреобладают над открытой оксоформой, причем одна
из циклических форм присутствует в большем
количестве, чем другие.
• Для фруктозы наиболее характерен фуранозный цикл,
в основном же для других МС пиранозные формы
преобладают над фуранозными.
• Если не учитывать небольшое количество фуранозных
форм в растворах глюкозы, весь равновесный процесс
можно представить –
α-D- глюкопираноза
[α] D
=
+112o
оксоформа
-D- глюко-
пираноза
[α] D
=
+18,7o
• Поскольку α- и β-формы глюкозы имеют различную
оптическую активность, а концентрация их
изменяется до установления равновесия, то
изменяется и угол вращения.
48.
Свежеприготовленный раствор α-аномера D-глюкозыимеет удельное вращение +112о.
При стоянии раствора эта величина постепенно
снижается и достигает величины +52,5о.
При растворении в воде кристаллических циклических
форм D-глюкозы происходит раскрытие цикла с
образованием открытой оксоформы, которая вновь
превращается в циклические формы α- и β, вплоть до
установления равновесия.
Явление самопроизвольного изменения угла
вращения плоскости поляризации света при
стоянии свежеприготовленного раствора
углеводов получило название
«мутаротация»
(мультиротация – от латинского multum-много,
rotario-круговращение).
49.
МС в соответствии состроением могут проявлять
как свойства карбонильных
соединений,
так и свойства спиртов
и полуацеталей.
50.
I.Реакции по оксоформе• 1.Восстановление НI.
C6H12O6 + HI
гексоза
CH3 CHI CH2 CH2 CH2 CH3
2-иодгексан
• Эта реакция доказывает линейное строение
глюкозы
51. I.Реакции по оксоформе
II.Реакции по карбонильной группеДля МС характерны не все реакции по карбонильной
группе, т.к. содержание открытой формы в растворе
невелико. Напр., глюкоза в обычных условиях не дает
кристаллического осадка с NaHSO3, не окрашивает
фуксинсернистую кислоту.
• а) Восстановление.
• При восстановлении МС образуются многоатомные
спирты глицитолы. Восстановители: водород в
присутствии катализаторов Ni или Pd, NaBH4, Na/Hg.
52. II.Реакции по карбонильной группе
• б). Окисление• Мягкие окислители:
• 1) реактив Толленса – аммиачный раствор оксида
серебра;
• 2) проба Троммера – СuSO4/NaOH;
• реактив Фелинга (фелингова жидкость) – раствор
Cu(OH)2 в калиево-натриевой соли винной кислоты;
• 3) бромная вода.
При окислении реактивами 1),2) образуется смесь
продуктов, т.к. МС в щелочной среде
неустойчивы.
Суть реакций – окисление альдегидной группы до
карбоксильной, восстановление реактивов Толленса
и Фелинга, поэтому в упрощенном виде их можно
выразить следующей схемой:
53.
Кетозы тоже дают положительные реакции среактивами Толленса и Фелинга, т. к. в щелочной
среде происходит их изомеризация (эпимеризация) в
альдозы (cм. ниже д ).Отношение МС к основаниям).
54.
• Окисление бромной водой приводит к образованиюH
O
HO
O
альдоновых кислот:
C
C
H
HO
OH
H
H
Br2/H2O
-HBr
OH
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D- глюкоза
CH2OH
D- глюконовая кислота
Образование альдоновых кислот
идет через образование γ- или HO O
δ-лактонов (внутримолекулярные C
OH
циклические сложные эфиры), H
HO
H
т.к. альдоновые кислоты
H
OH -H O
представляют собой гидрокси- H
OH
CH2OH
кислоты.
CH2OH
HO
O
OH
OH
-лактон
D-глюконо-
CH2OH
2
D- глюконовая
кислота
O
H
O
O
OH
OH
OH
D-глюконо- -лактон
55.
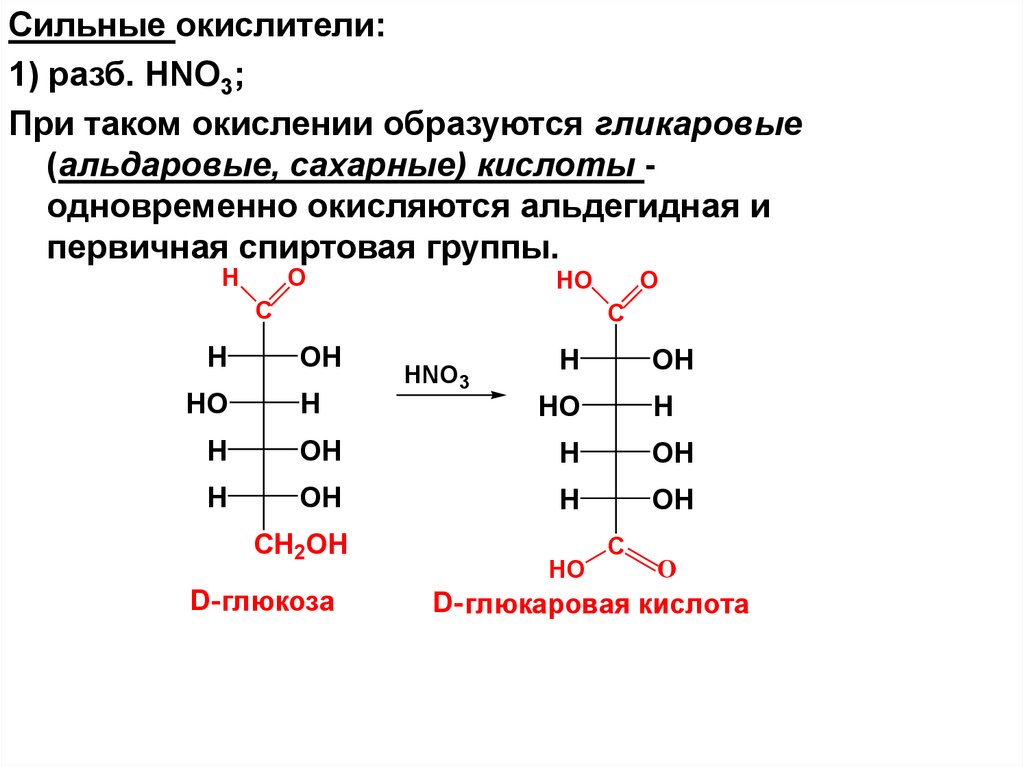
Сильные окислители:1) разб. HNO3;
При таком окислении образуются гликаровые
(альдаровые, сахарные) кислоты одновременно окисляются альдегидная и
первичная спиртовая группы.
H
O
HO
C
H
HO
O
C
OH
H
HNO3
H
OH
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D- глюкоза
C
HO
O
D- глюкаровая кислота
56.
в). Присоединение HCNЭту реакцию в химии углеводов используют для
увеличения углеродной цепи МС – метод КилианиФишера.
CH2OH
CH2OH
O
O
O
OH
OH
OH
O
OH
OH
OH
D-глюконо- -лактон
D-манноно- -лактон
57.
г). Реакции с азотистыми основаниями1) Реакция с гидроксиламином – используется для
установления строения МС и для перехода от высших
сахаров к низшим
H
O
C
H
HO
H
H
H
NOH
C
OH
H
H
NH2OH HO
_
OH H2O
H
OH
H
CH2OH
D- глюкоза
OH
H
OH
H+
_H O
2
OH
CH2OH
оксим D- глюкозы
58.
2) Реакция с фенилгидразиномВ мягких условиях МС образуют с фенилгидразином
фенилгидразоны. При нагревании МС с избытком
фенилгидразина образуются фенилозазоны
H
O
C
H
HO
CH
OH
H
C6H5NHNH2
H
HO
N
OH
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D- Glc
NHC6H5
C6H5NHNH2
_
_
NH3, NH2C6H5
CH2OH
фенилгидразон
D- Glc
• Эпимеры (например, глюкоза, манноза,
фруктоза) дают один и тот же
арилозазон, т.к. при его образовании
затрагиваются только атомы С1 и С2.
59.
3) Реакция с о-толуидиновым реагентом (ОТР)При взаимодействии МС с ОТР образуются окрашенные
основания Шиффа (альдимины), причем гексозы дают
зеленую окраску, а пентозы желтую.
Эту реакцию используют для количественного
определения сахаров.
60.
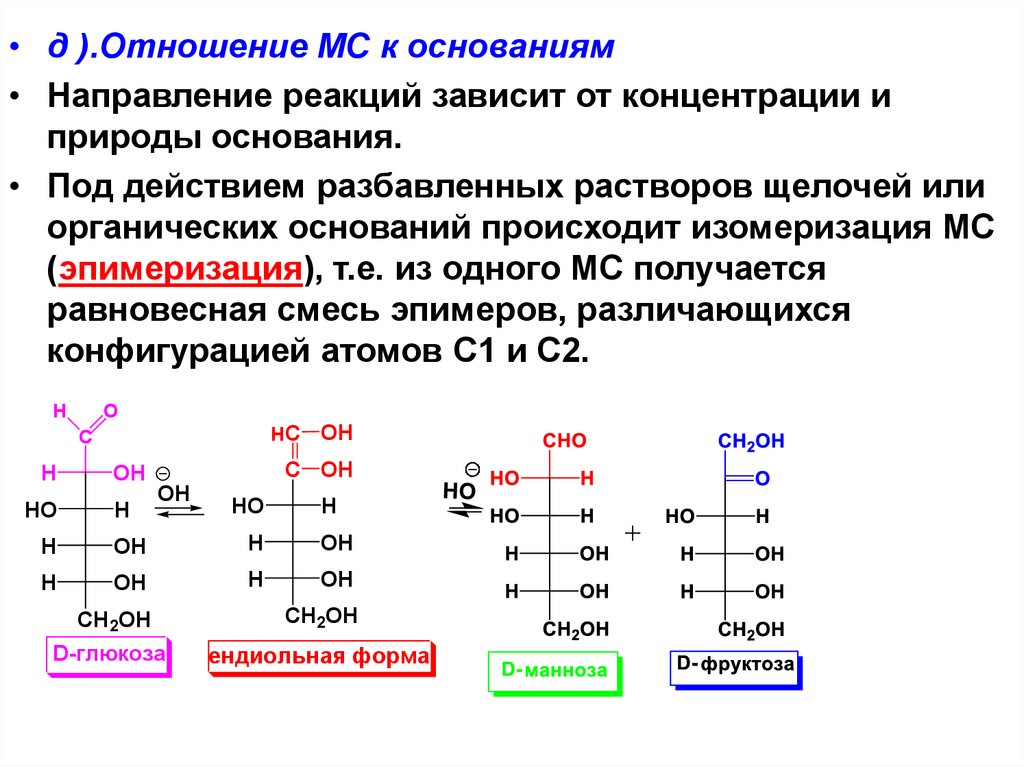
• д ).Отношение МС к основаниям• Направление реакций зависит от концентрации и
природы основания.
• Под действием разбавленных растворов щелочей или
органических оснований происходит изомеризация МС
(эпимеризация), т.е. из одного МС получается
равновесная смесь эпимеров, различающихся
конфигурацией атомов С1 и С2.
H
O
HC
C
H
HO
OH
H
OH
OH
C OH
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2OH
D-глюкоза
ендиольная форма
61.
Действие концентрированных щелочей приводит кглубоким превращениям МС – происходит их
разложение с образованием смеси продуктов
(ретроальдольный распад).
Процесс сопровождается конденсацией с
образованием смолоподобных продуктов бурого цвета
с запахом жженого сахара. Это превращение
используется как качественный тест для обнаружения
МС.
62.
III.Реакции по спиртовым гидроксигруппама).Образование гликолятов (сахаратов меди)
Реагируют с Сu(OH)2 в щелочной среде, образуя
комплексную соль, интенсивно-синего цвета,
растворимую в воде (реакция продолжается при
нагревании – см. окисление альдоз).
CHO
CHO
CHO
CHOH
CHOH
2
+ Cu(OH)2
HC OH
HC OH
CH2OH
HO
CHOH
CHOH
CHOH
CHOH
HC
O
H
Cu
HC O H
CH2OH
O CH
O CH
CH2OH
63. III.Реакции по спиртовым гидроксигруппам
б).Отношение МС к кислотамПри нагревании с минеральными кислотами и кислотами
Льюиса МС претерпевают дегидратацию и
циклизацию.
Пентозы при этом образуют фурфурол,
гексозы – 5-гидроксиметил-фурфурол, причем последний
кетогексозы образуют быстрее, чем альдогексозы.
HO
H H
C C
H
C
H
OH
H
C
OH HO
CHO
HC
H+
CH
HC
_3H O
2
C
CHO
O
фурфурол
альдопентоза
HO
H H
C C
H
C
HOH2C
OH
H
C
OH HO
альдогексоза
CHO
H+
HC
_3H O
2
C
HOH2C
CH
C
O
CHO
5-гидроксиметилфурфурол
64.
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА УГЛЕВОДЫ(стр. 49-50)
• РЕАКЦИЯ МОЛИША
Реакция с α-нафтолом положена в основу идентификации углеводов (МС и ПС), т.к. они гидролизуются до
МС в условиях анализа. При добавлении конц. H2SO4 к
раствору углеводсодержащего вещества с α-нафтолом
образуется фиолетовое кольцо.
H
H
HO
H
H
C
O
OH
H
OH H2SO4
OH -H2O
CH2OH
УГЛЕВОД
O
CH2
C
O
H
OH
ГИДРОКСИМЕТИЛO ФУРФУРОЛ
SO3H
[O]
CH2
OH
OH
O
C
OH
65. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА УГЛЕВОДЫ (стр. 49-50)
РЕАКЦИЯ СЕЛИВАНОВА• Кетогексозы обнаруживают по появлению розовомалинового окрашивания при взаимодействии с HСl и
резорцином:
CH2OH
C O
HO H
H OH
H OH
CH2OH
HCl
HOCH2
O
O
C
H
5-гидроксиметилфурфурол
КЕТОЗА
HO
OH
резорцин
[O]
HO
HOCH2
O
CH
O
66.
• Пентозы определяют по появлению красномалинового окрашивания при взаимодействиипродукта подкисления раствора пентозы с
последующим взаимодействием с анилином, т. к.
фурфурол дает окрашивание с анилином:
HC
H2N
CH
HC
C
O
CHO
HC
- H2O
CH
HC
C CH
O
N
67.
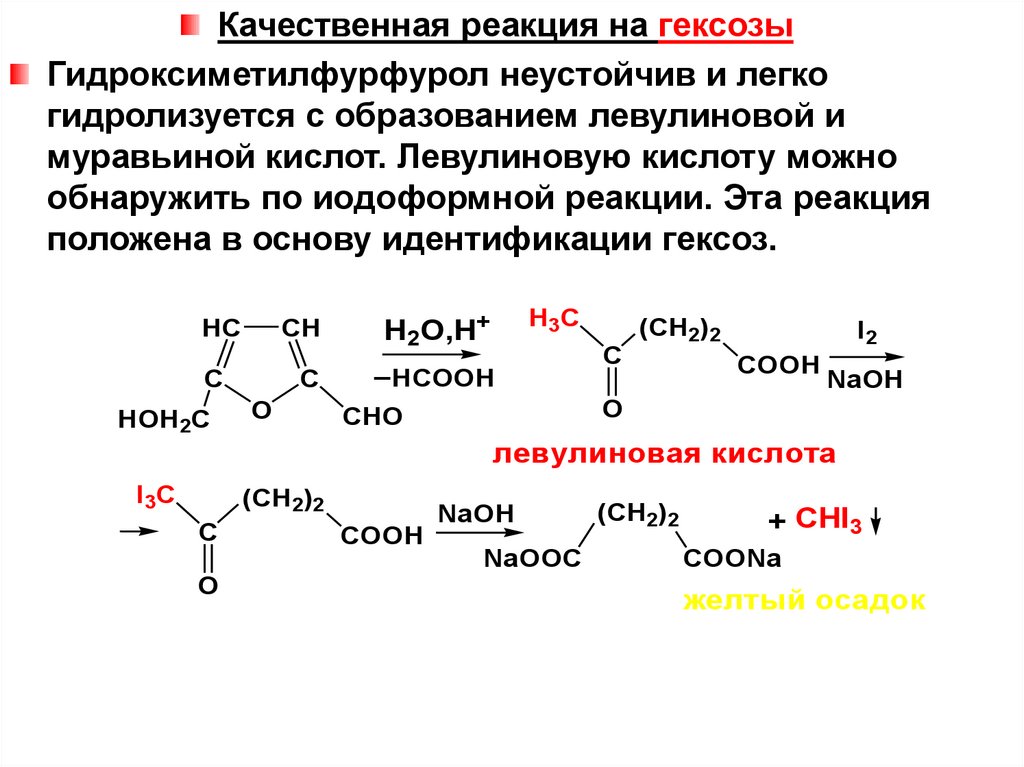
Качественная реакция на гексозыГидроксиметилфурфурол неустойчив и легко
гидролизуется с образованием левулиновой и
муравьиной кислот. Левулиновую кислоту можно
обнаружить по иодоформной реакции. Эта реакция
положена в основу идентификации гексоз.
HC
C
HOH2C
H3C
CH
H2O,H+
C
_ HCOOH
O
(CH2)2
C
I2
COOH
NaOH
O
CHO
левулиновая кислота
I3C
(CH2)2
C
O
COOH
NaOH
NaOOC
(CH2)2
+ CHI3
COONa
желтый осадок
68.
IV. Брожение МСБрожение это сложный процесс расщепления МС под
действием ферментов.
Брожению подвергаются МС, у которых число атомов
углерода кратно 3 (гексозы).Причем не все гексозы
сбраживаются одинаково – одни легче, другие труднее.
Известны разные виды брожения,
в зависимости от условий и
вида фермента. Напр.,
спиртовое (1),
молочнокислое (2),
лимоннокислое (3),
маслянокислое (4),
ацетонбутанольное (5) и т.п.
(стр. 51)
69. IV. Брожение МС
Известны разные виды брожения, в зависимостиот условий и вида фермента. Напр.,
спиртовое (1),
2C2H5OH + 2CO2 (1)
молочнокислое (2),
2CH3CH(OH)COOH (2)
лимоннокислое (3),C H O
H2
H2
6 12 6
_
маслянокислое (4),
2H2O HOOC C CH(OH) C COOH
(3)
ацетонбутанольное (5)
COOH
и т.п. (стр. 51)
C3H7COOH + 2H2 + 2CO2 (4)
C4H9OH + CH3CCH3 + 4H2 + 5CO2
(5)
O
70.
V. Реакции по циклической формеА) Реакции по ОН-группам.
Все ОН разные по реакционной способности:
у С1 – гликозидный - наиболее реакционноспособный,
у С6 – первичный спиртовый,
у С2-С4 – вторичные спиртовые.
6
H
CH2OH
O
5
H
OH
4
OH
3
H
H
2
OH
H
1
OH
71. V. Реакции по циклической форме
• 1. Реакции по гликозидному гидроксилу.При действии мягких алкилирующих средств (спирты в
условиях кислотного катализа) алкилируется только
гликозид-ный ОН. В результате образуются производные
циклической формы по гликозидному ОН – циклические
ацетали, называемые
гликозидами.
Названия гликозидов образуют
CH2OH
из названия соответствующего
O OCH3
CH2OH
OH
МС с заменой суффикса
OH
O
OH
OH
OH
«оза» на «озид», причем
CH3OH
HCl метил- β -D-глюкопиранозид
OH
сначала называют
OH
CH2OH
соединенный с кислородом β-D-глюкопираноза
O
гликозидной группы
OH
OH
OCH3
радикал (агликон).
OH
-D-глюкопиранозид
метил-
72.
• Реакцию алкилирования по гликозидному ОН(получение гликозидов) используют для защиты
альдегидной группы.
• Таким образом можно из МС получить окислением
соответствующую уроновую кислоту:
CH2OH
COOH
O OCH3
OH
O OCH3
HNO3
OH
OH
H2O ,H+
_ CH OH
3
OH
OH
метил- β -D-глюкопиранозид
COOH
OH
O
C
O
OH
H
OH
HO
OH
OH
D-глюкуроновая кислота
H
OH
H
H
OH
H
OH
COOH
73.
CH2OHСвойства гликозидов
O
OR
OH
OH
гликозид
OH
Поскольку в гликозидах отсутствует полуацетальный
(гликозидный) ОН, то они существуют только в
циклической форме.
Т.к. раскрытие цикла невозможно, то не образуется
оксоформа и аномерная циклическая форма.
Гликозиды не мутаротируют, не дают реакции на
карбонильную группу.
Гликозиды являются ацеталями – простыми эфирами
гемдиолов, поэтому они, как и обычные простые
эфиры, устойчивы к действию щелочей, но в отличие
от простых эфиров легко гидролизуются в кислой
среде с образованием МС и неуглеводной компоненты
(агликона).
74. Свойства гликозидов
Гидролиз гликозидовCH2OH
O
OH
OH
CH2OH
OR
H2O ,H+
OH
OH
гликозид
( по механизму SN1)
O
OH
OH
моносахарид
OH
+ ROH
спирт
(агликон)
Гликозиды подвергаются также ферментативному
гидролизу. Причем можно подобрать специфические
ферменты, расщепляющие только α-гликозидную
связь (α-гликозидазы) или
только β-гликозидную связь
(β-гликозидазы).
75.
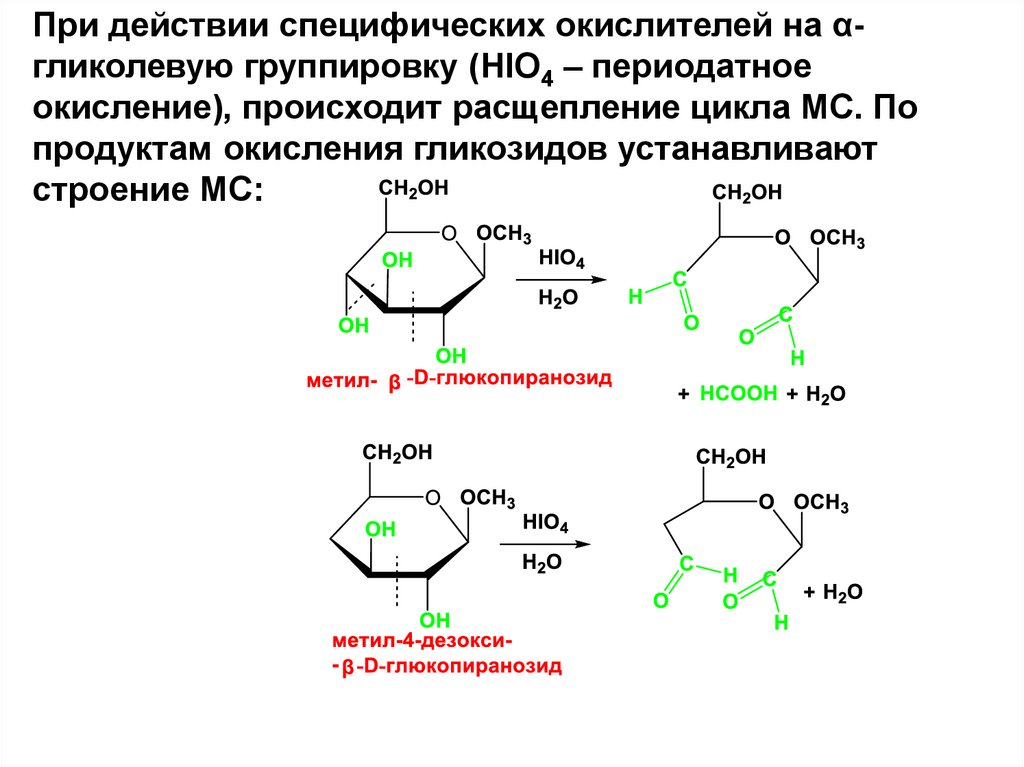
При действии специфических окислителей на αгликолевую группировку (HIO4 – периодатноеокисление), происходит расщепление цикла МС. По
продуктам окисления гликозидов устанавливают
строение МС:
76.
2. Реакции с участием всех гидроксильных групп2.1.Образование солей
При действии на моносахариды алкоголятов некоторых
металлов (щелочных, щелочно-земельных, меди, бора
и др.) атом Н замещается на ионы металлов
(в первую очередь реагирует полуацетальный НО).
Образуются алкоголяты МС, называемые САХАРАТАМИ.
77.
2.2. АлкилированиеПри действии избытка сильных алкилирующих средств алкилгалогенидов
R –Х и алкилсульфатов R2SO4 в щелочной среде
(алкилирование по Вильямсону) алкилируются все ОНCH2OH
CH2OCH3
группы:
O
OH
OH
CH3I (избыток)
OH
O
OCH3
OCH3
HOH
OCH3
OH
D-глюкопираноза
CH2OCH3
O
OCH3
OCH3
OCH3
H
β- (метил-2,3,4,6-тетра-О-метилD-глюкопиранозид
+
метил-2,3,4,6-тетра-О-метилOH
D-глюкопиранозид)
+ CH3OH
OCH3
2,3,4,6-тетра-О-метил , D-глюкопиранозà
В полностью алкилированных МС также как и в молекулах
гликозидов отсутствует свободный гликозидный ОН и нет
возможности для раскрытия цикла, поэтому они не способны к
мутаротации и не дают реакции на карбонильную группу.
78.
2.3. АцилированиеАцилирование МС происходит под действием
ангидридов в слабощелочной среде (ацетат натрия,
пиридин) с участием всех ОН:
CH2OH
O
OH
(CH3CO)2O (изб.)
OH
OH
OH
D-глюкопираноза
CH2OCOCH3
O
OCOCH3
OCOCH3
CH3COO
OCOCH3
1,2,3,4,6-пента-О-ацетил-D-глюкопираноза (пентаацетилглюкоза)
Ацетоксигруппа (OCOCH3) у гликозидного центра
отличается по свойствам от остальных групп – она
склонна к участию в некоторых SN-реакций
79.
Важнейшие представителиТриозы
•D-,L-глицериновые альдегиды, и 1,3-дигидроксиацетон.
Их эфиры с фосфорной кислотой играют важную роль в
деструцкии углеводов в живых организмах.
Пентозы
•L-Ara и D-Xyl входят в состав ПС пентозанов. L-Ara
содержится в вишневом клее и аравийской камеди. Ara
выделяют также из свеклы. D-Xyl получают гидроли-зом
ПС ксилана, который в боль-шом количестве содержится
в соломе, отрубях, подсолнечной лузге, хлопковой
шелухе, древесине.
•Восстановлением ксилозы получают ксилит –
заменитель сахара для диабетиков. На гидролизатах,
содержащих ксилозу выращивают некоторые виды
дрожжей, которые используют в качестве белковой
кормовой добавки для с/х животных.
80. Важнейшие представители
•D-Ryb играет значительную биологическую роль. Онавстречается в природе как составная часть
рибонуклеиновых кислот, некоторых витаминов,
коэнзимов.
•Ryb получают эпимеризацией арабинозы.
Гексозы
• В природе распространены только 4 из 16
стереоизомерных альдогексоз: D-Glc, D-Man, D-Gal, DTal.
• D-Glc виноградный сахар, широко распространена в
природе, содержится в соке винограда и др. сладких
плодов, в небольшом количестве в организме человека
и животных.
81.
Гексозы• В природе распространены только 4 из 16
стереоизомерных альдогексоз: D-Glc, D-Man, D-Gal, D-Tal.
• D-Glc виноградный сахар, широко распространена в
природе, содержится в соке винограда и др. сладких
плодов, в небольшом количестве в организме человека
и животных. Входит в состав важнейших ДС и ПС –
тростниковый и свекловичный сахар, молочный сахар,
крахмал, гликоген, целлюлоза. Главный способ
получения – гидролиз крахмала и целлюлозы. Глюкоза
применяется в пищевой, текстильной промышленности,
в медицине.
82.
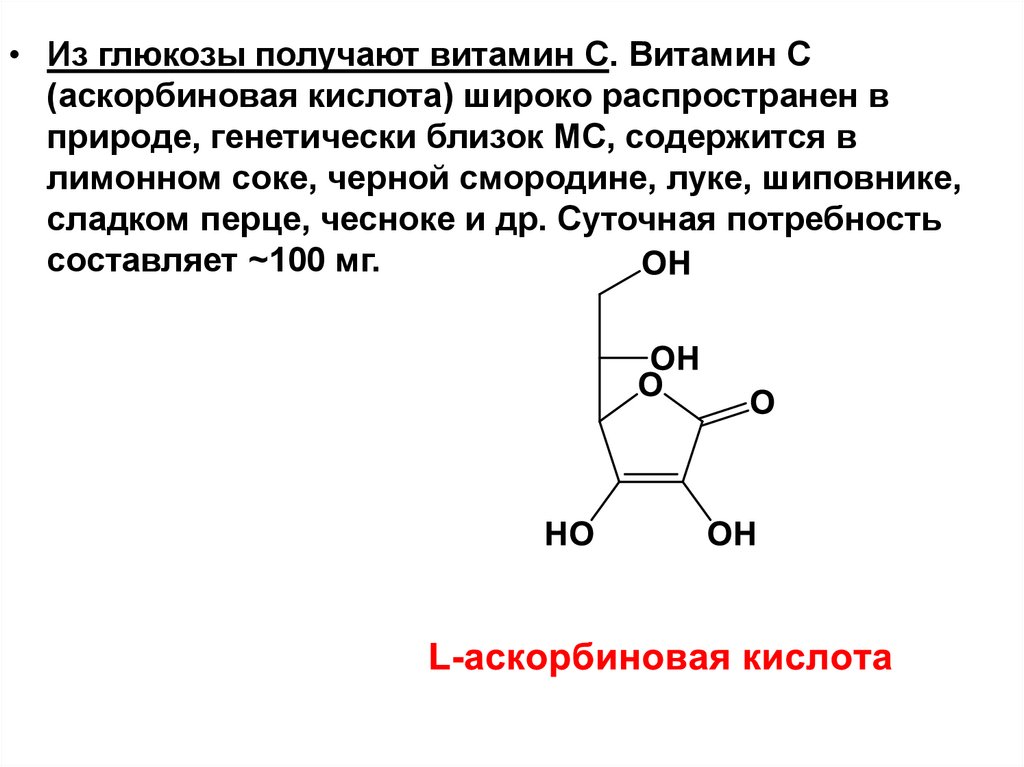
• Из глюкозы получают витамин С. Витамин С(аскорбиновая кислота) широко распространен в
природе, генетически близок МС, содержится в
лимонном соке, черной смородине, луке, шиповнике,
сладком перце, чесноке и др. Суточная потребность
составляет ~100 мг.
83.
•D-Gal входит в состав некоторых ПС и гликозидов.Остатки галактозы входят в состав сложнейших
биополимеров ганглиозидов. Получают галактозу
гидролизом лактозы (молочного сахара).
•D-Man содержится в ячмене, корке апельсина.
Получают гидролизом ПС маннана, содержащегося в
грибах, дрожжах.
•Кетогексоза D-Fru (фруктовый сахар) содержится в
свободном состоянии в фруктах, меде. Входит в
состав многих сладких соков, ДС сахарозы. Входит в
состав ПС инулина, содержащегося в некоторых
растениях. Фруктозу также получают из инулина.
84.
Дезокси- аминосахара.• 2-дезокси-D-Ryb входит в состав нуклеотидов.
• L-рамноза (6-дезокси-L-манноза) является
структурным фрагментом природных гликозидов.
• L-фукоза (6-дезокси-L-галактоза) является важным
компонентом клеточных стенок некоторых бактерий.
N-метил-L-глюкозамин является структурным
элементом антибиотика стрептомицина.
Аминосахара также содержатся в веществах,
определяющих принадлежность крови к определенным
группам.
85.
Сложные эфиры МСФосфорные эфиры. Фосфаты содержатся во всех
растительных и животных организмах, они принимают
самое активное участие в биохимических процессах,
протекающих в живых организмах.
O
HO
CH2OH
OH
CH2
OH
O
OH
OH
O
O
O
OH
P
OH
P
P
O
CH2 OH
O
OH
O
OH
OH
1-фосфат
α- D-глюкопиранозы
OH
1,6-дифосфат
α - D-фруктофурaнозы
Сульфаты входят в состав ПС соединительной ткани,
протеогликанов – гепарина и гепаритинсульфата.
Гликозиды широко распространены в природе. Почти
все гликозиды являются β-глюкозидами.
86.
• В природных гликозидах в качестве агликонавстречаются многие радикалы, часто весьма сложные.
• Причем многие гликозиды обладают физиологическим
действием, что используют в медицинских целях.
Природные гликозиды классифицируются по
агликоновой компоненте.
О-гликозиды – кониферин и сирингин являются
предшественниками одного из полимерных компонентов
древесины - лигнина.
87.
Гликозиды классифицируются по агликоновойкомпоненте.
О-гликозиды – кониферин и сирингин являются
предшественниками одного из полимерных
компонентов древесины - лигнина.
CH2OH
O
OH
O
CH
CH
CH2OH
OCH3
OH
OH
кониферин
H3CO
CH2OH
O
OH
O
CH
OCH3
OH
OH
сирингин
CH
CH2OH
88.
Важное значение имеютN-гликозиды:
Нуклеозиды
NH2
NH2
N
N
N
N
N
N
HO
HO
O
H
H
H
OH
H
O
H
H
Аденозин
NH
N
HO
N
NH2
HO
O
O
H
H
H
OH
H
H
Гуанозин
OH
H
Цитидин
NH
N
H
O
O
N
H
H
H
H
OH
H
Тимин
H
O
H
O







































































 chemistry
chemistry








