Similar presentations:
Углеводы. Моносахариды
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙМЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Кафедра химии
Углеводы. Моносахариды
1. Классификация
2. Моносахариды. Строение
3. Моносахариды. Химические свойства
4. Производные моносахаридов,
строение
Лектор: доктор биологических наук, профессор,
зав. кафедрой химии Ирина Петровна Степанова
2.
ЦЕЛИ ЛЕКЦИИОБУЧАЮЩАЯ: сформировать знания о
классификации моносахаридов, их физических и
химических свойствах.
РАЗВИВАЮЩАЯ: расширить кругозор
обучающихся на основе интеграции знаний, развить
логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать формированию
у обучающихся устойчивого интереса к изучению
дисциплины.
3.
Медико-биологическоезначение темы
Зерна крахмала в клетках
картофеля: амилопласты
Углеводы входят в
состав клеток и тканей
всех растительных и
животных организмов, где
соответственно
составляют 80% и 2% от
массы сухого остатка.
4. Биологические функции углеводов
1. Энергетическая. Углеводы –главный вид клеточного топлива.
При сгорании 1 моль глюкозы
выделяется 3060 Дж энергии,
которая расходуется в
эндотермических биологических
процессах и частично
аккумулируется в АТФ.
5.
Биологические функции углеводов2. Пластическая.
Гепарансульфат
Хондроитинсульфат
Снаружи
Внутри
Углеводы являются обязательным компонентом
внутриклеточных структур и мембран растительного
и животного происхождения.
6.
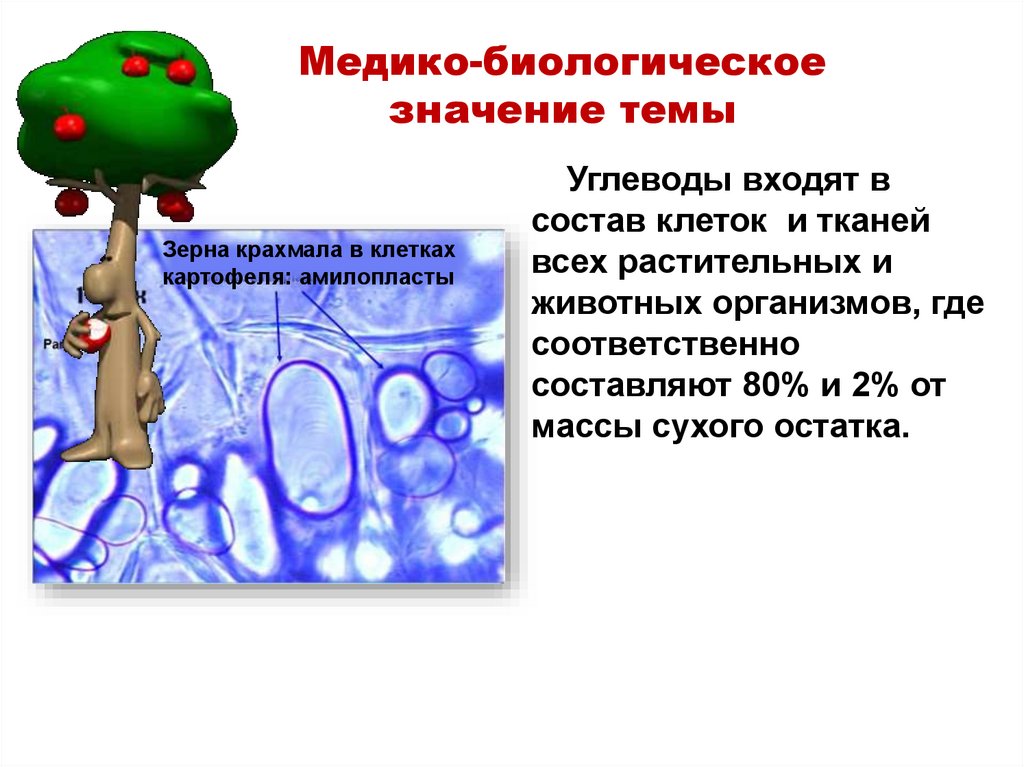
Биологические функции углеводовГиалуроновая
кислота
Основную
субстанцию
межклеточного
матрикса
соединительной
ткани
составляют
протеогликаны –
углеводобелковые
компоненты.
Кератансульфат
Хондроитинсульфат
Связующие белки
Сердцевидный
белок
7.
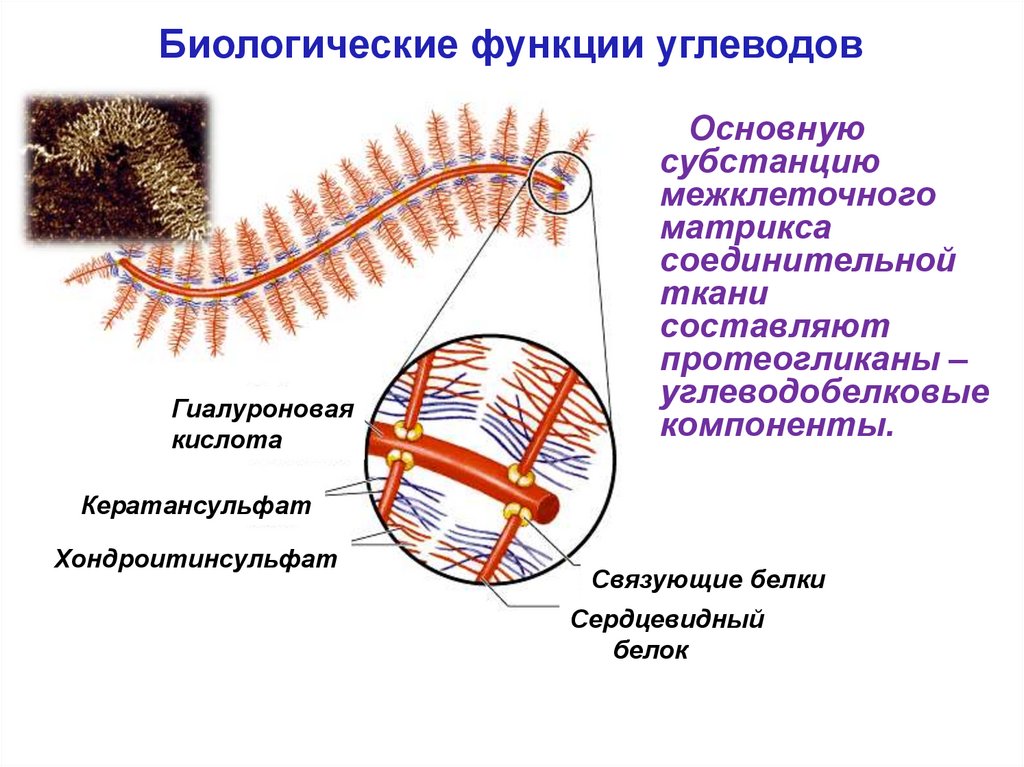
Биологические функции углеводовАктиновые
филаменты
В состав внеклеточного
матрикса также входят
Интегрины
гликопротеины и
гиалуроновая кислота.
Протеогликаны
и гиалуроновая кислота
Фибронектин
Коллаге
н
Плазменная мембрана
8. Биологические функции углеводов
Полисахарид хитин (C8H13NO5)n(от греч. χιτών: хитон – одежда,
кожа, оболочка) – основной
компонент кутикулы
членистоногих и ряда других
беспозвоночных, входит в состав
клеточной стенки грибов и
бактерий.
9.
Биологические функции углеводов3. Синтетическая.
Углеводы участвуют в
синтезе нуклеиновых кислот,
входят в состав коферментов,
гликолипидов,
гликопротеинов.
β2-Гликопротеин I
10.
Биологические функции углеводов4. Защитная. Углеводы
участвуют в поддержании
иммунитета организма.
Например, тиреотропный
гормон, контролирующий
функцию и развитие
щитовидной железы,
является гликопротеином.
Тиреотропный гормон
11.
Биологические функции углеводов5. Специфическая. Отдельные углеводы
участвуют в проведении нервных импульсов,
образовании антител, обеспечении специфичности
группы крови.
Например,
гликолипиды
входят в состав
миелиновой
оболочки аксона.
12.
Биологические функции углеводов6. Регуляторная. Растительная пища содержит
полисахарид целлюлозу, которая улучшает
работу кишечника и повышает секрецию в
желудке.
13.
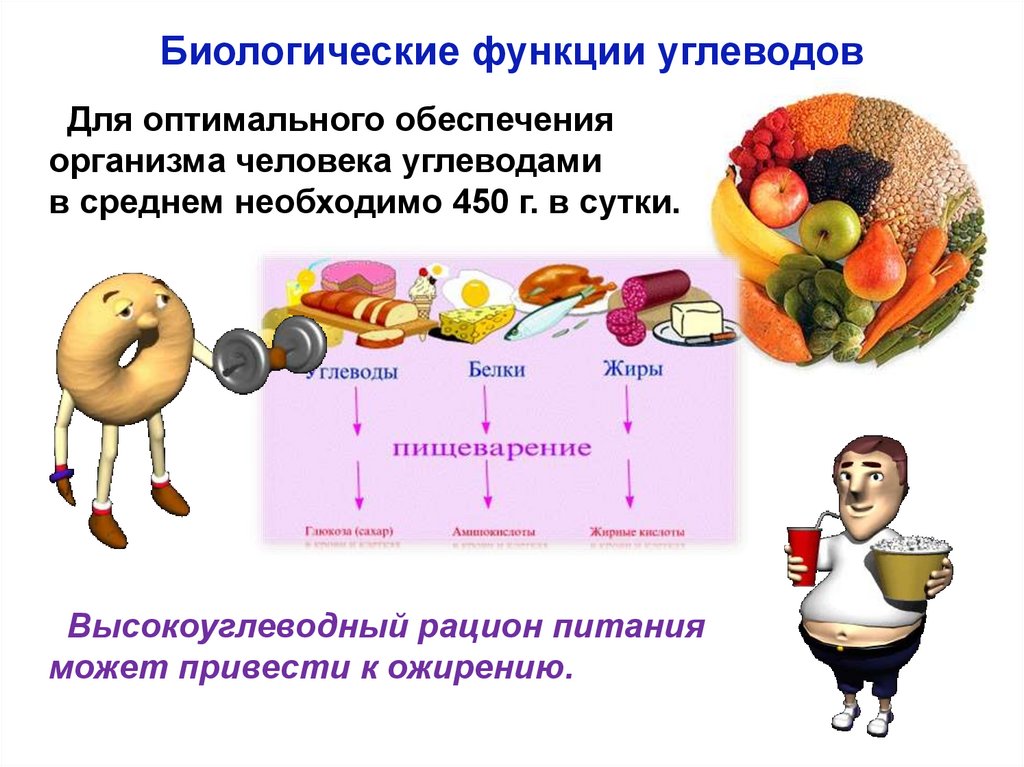
Биологические функции углеводовДля оптимального обеспечения
организма человека углеводами
в среднем необходимо 450 г. в сутки.
Высокоуглеводный рацион питания
может привести к ожирению.
14.
Медико-биологическое значение темыНекоторые
углеводы входят в
состав фарм.
препаратов и БАДов.
15.
Медико-биологическое значение темы16.
Медико-биологическое значение темыЧайный гриб – симбиоз
дрожжеподобного
гриба Saccharomycodes ludwigii
и бактерий Acetobacter xylinum
17.
Получение углеводов1. Углеводы образуются в
Хлоропласты
в клетках листа
процессе фотосинтеза в
хлоропластах клеток
растений (от греч. Φωτο –
свет и σύνθεσις – синтез,
совмещение, помещение
вместе) из углекислого газа и
воды на свету при участии
фотосинтетических
пигментов.
6CO2 + 6H2O → C6H12O6 + 6O2
18.
Получение углеводовElysia chlorotica – вид морских
слизней, относящийся к морским
брюхоногим моллюскам, способным
к осуществлению фотосинтеза.
Elysia chlorotica
Моллюск использует
хлоропласты
морской водоросли
Vaucheria litorea,
которую
употребляет в пищу.
Геном молюска кодирует некоторые белки,
необходимые хлоропластам для фотосинтеза.
19. 2. Углеводы образуются в результате гидролиза дисахаридов, олигосахаридов и полисахаридов в присутствии кислот или ферментов.
Получение углеводов2. Углеводы образуются в результате гидролиза
дисахаридов, олигосахаридов и полисахаридов в
присутствии кислот или ферментов.
CH2OH
H
O
H
OH H
H
HO
H
O H
H
OH H
O
H
CH2OH
CH2OH
OH
Мальтоза
+
OH
H
H
OH
H2O
2
O H
H
OH H
HO
OH
H
OH
D-глюкоза
20. Моносахариды
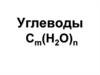
УглеводыМоносахариды
Углеводы – гетерофункциональные
соединения полигидроксикарбонильного
ряда и их производные.
Общая формула простых моносахаридов:
Cn(H2O)m
Ранее сахара считали гидратированными
формами углерода, что объясняет этимологию
слова “углевод”.
Англ. Carbohydrate происходит от carbon (углерод) и
гидрат (от греч. udor – вода).
21.
Классификация углеводовПо способности к гидролизу углеводы
делятся на 2 класса:
1. простые (греч. mono – один) –
не подвергаются гидролизу;
2. сложные – гидролизуются с образованием
простых углеводов.
22.
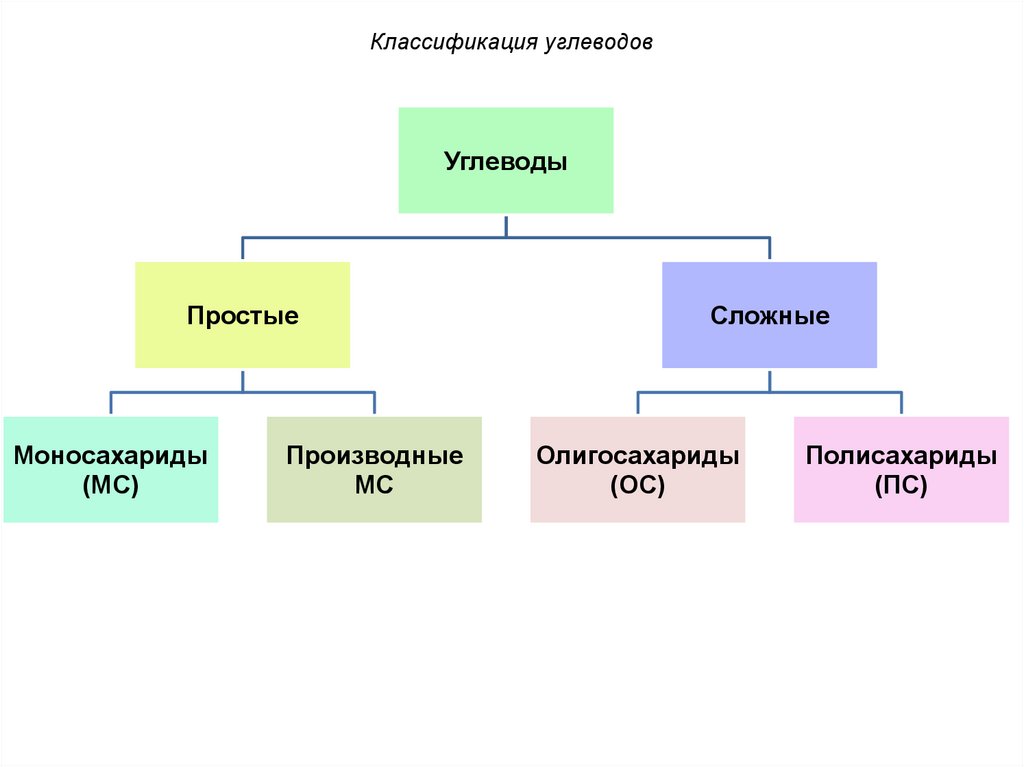
Классификация углеводовУглеводы
Простые
Моносахариды
(МС)
Производные
МС
Сложные
Олигосахариды
(ОС)
Полисахариды
(ПС)
23. Классификация углеводов
Олигосахариды содержат от 2 до 10 остатковмоносахаридов, а полисахариды – несколько
десятков тысяч. И те, и другие являются
продуктами поликонденсации моносахаридов.
Полисахариды по составу подразделяются на 2
группы:
- гомополисахариды – однородные по составу
сложные углеводы;
- гетерополисахариды – сложные углеводы,
включающие остатки разных моносахаридов.
24.
Классификация моносахаридовМоносахариды делят по функциональной
принадлежности на 2 группы:
1. альдозы – полигидроксиальдегиды;
2. кетозы – полигидроксикетоны.
По числу атомов углерода в цепи различают 5 групп:
1. триозы;
2. тетрозы;
3. пентозы;
4. гексозы;
5. высшие сахара.
25.
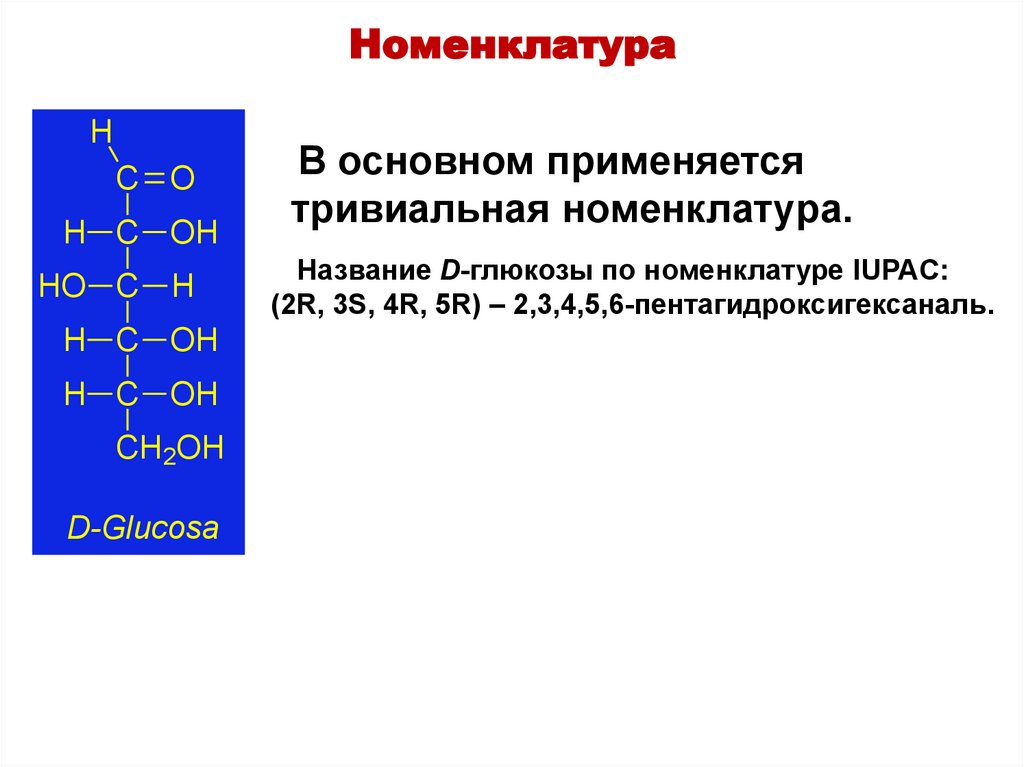
НоменклатураH
C O
H C OH
HO C H
H C OH
H C OH
CH2OH
D-Glucosa
В основном применяется
тривиальная номенклатура.
Название D-глюкозы по номенклатуре IUPAC:
(2R, 3S, 4R, 5R) – 2,3,4,5,6-пентагидроксигексаналь.
26.
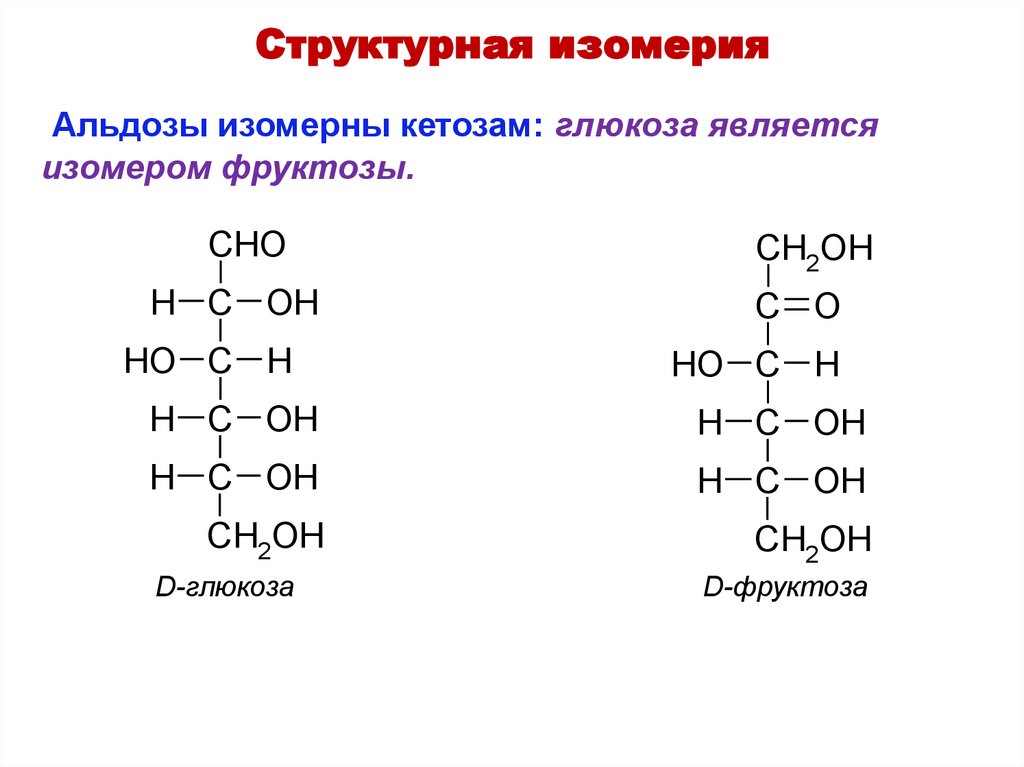
Структурная изомерияАльдозы изомерны кетозам: глюкоза является
изомером фруктозы.
CHO
CH2OH
H C OH
C O
HO C H
HO C H
H C OH
H C OH
H C OH
H C OH
CH2OH
CH2OH
D-глюкоза
D-фруктоза
27.
СтереоизомерияМолекулы моносахаридов имеют несколько центров
хиральности (от греч. сhiro – рука).
Хиральным центром называют
sp3-гибридный атом углерода,
соединенный с 4-мя разными
заместителями.
1
4
2
3
28.
Энантиомерияa 1
4
2
1
3
Энантиомеры – это
изомеры, которые относятся
друг к другу как предмет и
несовместимое с ним в
пространстве зеркальное
отражение.
4
3
2
b 1
3
4
2
29.
ЭнантиомерияПроекции Фишера
30. Энантиомерия
В зависимости от конфигурации хиральногоцентра различают D- и L- конфигурации
(формы).
В D-форме гидроксильная (-ОН)
функциональная группа хирального центра
располагается справа от углеродной цепи;
В L-форме – функциональная
гидроксильная (-ОН) группа хирального
центра располагается слева от углеродной
цепи.
31. Конфигурационный стандарт – глицеральдегид.
ЭнантиомерияКонфигурационный стандарт – глицеральдегид.
CHO
H C OH
CH2OH
D-глицеральдегид
D-Gliceraldehido
CHO
HO C H
CH2OH
L-глицеральдегид
L-Gliceraldehido
32.
ЭнантиомерияПринадлежность к D- или L-ряду у моносахаридов
определяется по нижнему крайнему хиральному центру.
CHO
CHO
H
OH
HO
H
HO
H
H
OH
H
OH
H
OH
H
OH
H
OH
H
OH
CHO
CHO
H
OH
CH2OH
CH2OH
CH2OH
CH2OH
D-глюкоза
D-арабиноза
D-эритроза
D-глицериновый
альдегид
33. Энантиомерия
Энантиомерам D-ряда углеводов соответствуетэнантиомер L-ряда с противоположной конфигурацией
всех центров хиральности. Большинство природных
моносахаридов принадлежат D-ряду.
Пример: энантиомеры глюкозы
CHO
CHO
H
OH
HO
H
HO
H
H
OH
H
OH
HO
H
H
OH
HO
H
[ ] =
CH2OH
CH2OH
D-глюкоза
L-глюкоза
+52.5o
-52.5o
34.
ЭнантиомерияУгол вращения плоскости
поляризованного света определяется с
помощью поляриметра.
+ °
25°C
[ ]D – удельное вращение
25°C
D
[ ]
=
l•c
Поляризованный свет
Поляриметр
Обычный свет
35. Энантиомерия
Энантиомеры обладают одинаковымифизическими и химическими свойствами, но
являются оптическими антиподами и имеют
различную физиологическую активность.
36.
σ-Диастереомерияσ-Диастереомерия возникает в молекулах с 2 и
более центрами хиральности.
σ- Диастереомеры – оптические изомеры, не
являющиеся зеркальным изображением друг друга.
37.
σ-ДиастереомерияЧисло стереоизомеров рассчитывают по
формуле Фишера:
Z =2n ,
где n-число центров хиральности.
σ-Диастереомеры имеют разные физические и
химические свойства и физиологическое действие.
38.
σ-Диастереомериядиастереомеры,
но не эпимеры
эпимеры
CHO
CHO
CHO
H
OH
HO
H
H
OH
HO
H
HO
H
HO
H
H
OH
H
OH
HO
H
H
OH
H
OH
H
OH
CH2OH
CH2OH
CH2OH
D-глюкоза
D-манноза
D-галактоза
4-эпимеры
σ-Диастереомеры
углеводов,
различающиеся
конфигурацией
только одного
центра
хиральности,
называются
эпимерами.
39. Альдогексозы
OH
C
1. D-глюкоза (виноградный
сахар). Содержится
практически во всех
растительных организмах. В
свободном состоянии
регулирует осмотическое
давление крови.
H
C* OH
HO
C* H
H
C*
H
C* OH D,L определяющий гидроксил
OH
H2C OH
D-глюкоза
40. Альдогексозы
ГлюкозаМеждународное наименование:
Декстроза (Dextrose)
5% раствор глюкозы оказывает
дезинтоксикационное,
метаболическое действие,
является источником энергии.
Гипертонические растворы (10%, 20%, 40%)
повышают осмотическое давление крови, улучшают
обмен веществ; повышают сократимость миокарда;
улучшают антитоксическую функцию печени,
расширяют сосуды, увеличивают диурез.
41. Альдогексозы
HO
C
H
C* OH
HO
C* H
HO
C* H
H
C* OH
H2C OH
D-галактоза
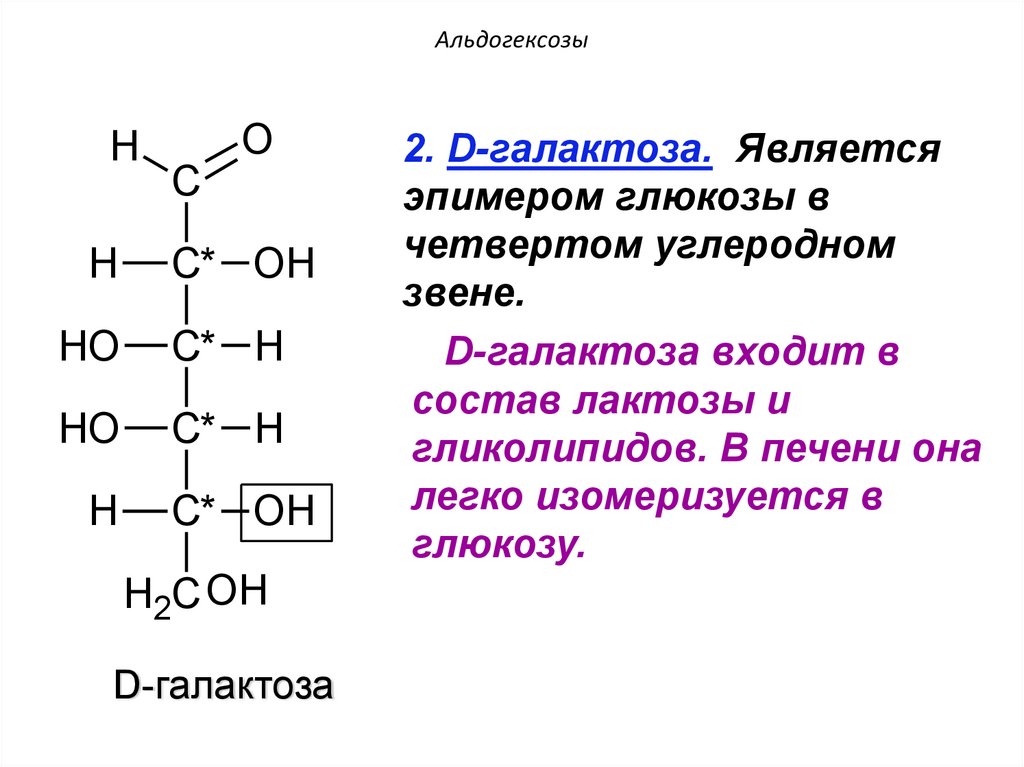
2. D-галактоза. Является
эпимером глюкозы в
четвертом углеродном
звене.
D-галактоза входит в
состав лактозы и
гликолипидов. В печени она
легко изомеризуется в
глюкозу.
42. Альдогексозы
Галактоза (Galactose) –ультразвуковое
контрастнодиагностическое
средство.
43. Альдогексозы
3. D-манноза. Является эпимеромглюкозы во втором углеродном звене.
H
O
C
HO
C
H
HO
C
H
H
C
OH
H
C
OH
H2C OH
D-манноза
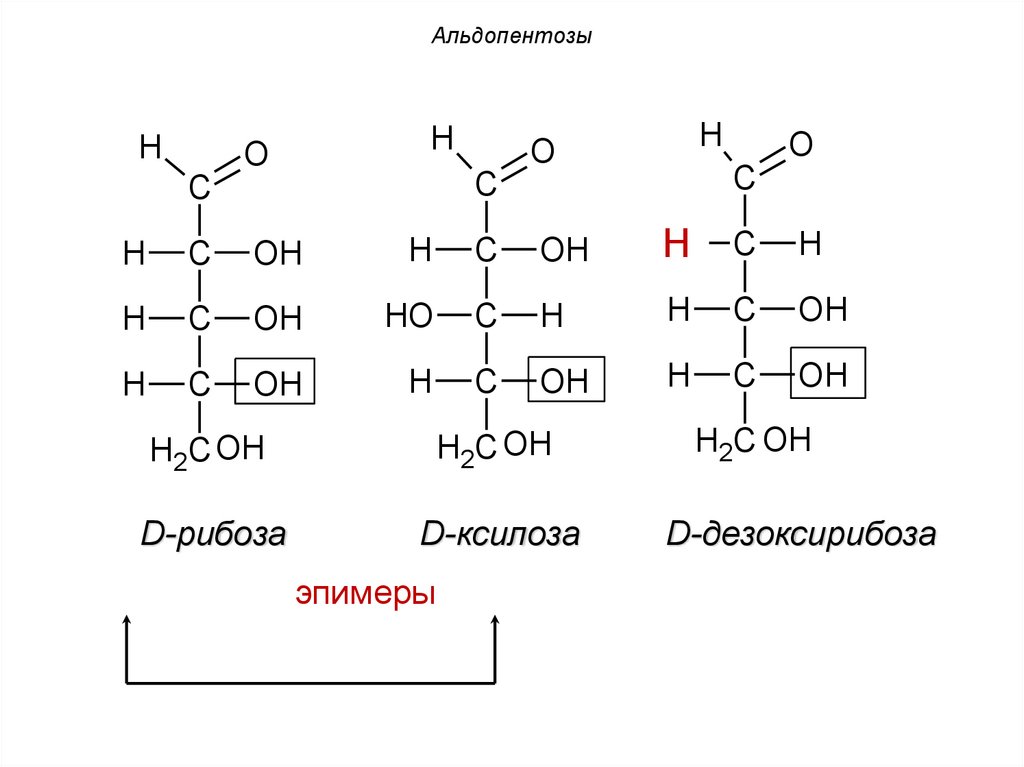
44. Альдопентозы
1. D-рибоза. Входит в состав РНК.2. D-ксилоза – эпимер рибозы в третьем
углеродном звене.
3. Производным рибозы является
дезоксисахар –2-дезокси-D-рибоза
(D-дезоксирибоза) – входит в состав ДНК.
45.
АльдопентозыH
O
H
H
O
C
C
C
O
H
C
OH
H
C
OH
HH
O
C
H
H
C
OH
HO
C
H
H
C
OH
H
C
OH
H
C
OH
H
C
OH
H2C OH
H2C OH
D-рибоза
D-ксилоза
эпимеры
H2C OH
D-дезоксирибоза
46. Кетогексозы
H2COHC
O
HO
C
H
H
C
OH
H
C
OH
H2C OH
D-фруктоза
D-фруктоза. Содержится
в мёде, фруктах, входит в
состав сахарозы, в организме
легко изомеризуется в глюкозу.
47.
Кетогексозы«Открытие меда» – Пье́ро ди Ко́зимо (1462).
(Вустерский «Музей искусств»)
48.
КетогексозыD-фруктоза –
парентеральное средство
для регидратации и
дезинтоксикации.
49. Циклические формы моносахаридов
Образование циклических форм связано соспособностью углеродной цепи принимать выгодную
клешневидную конформацию и с дальнейшим
взаимодействием внутри одной молекулы карбонильной
группы с гидроксильной группой. Это взаимодействие
приводит к образованию циклического полуацеталя.
Устойчивыми являются 5- и 6-членные циклы.
O H
+
O
H
R C OC2H5
R C
+ C2H5OH
H
H
OH
O
C
H
O
O H
C
H
50.
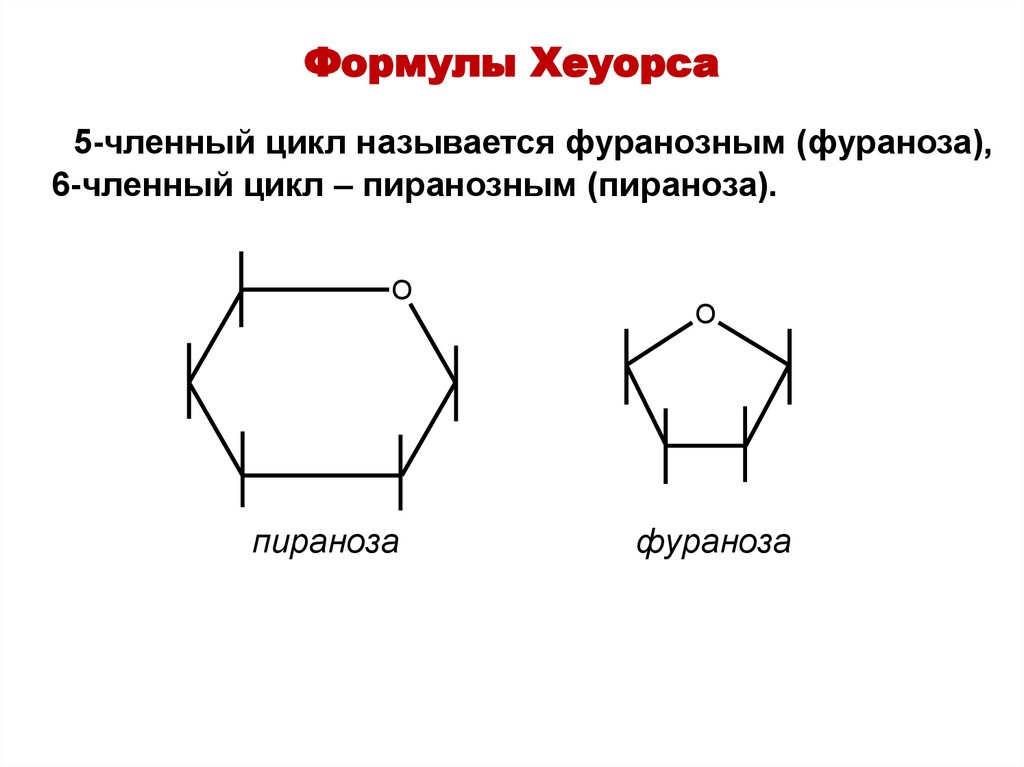
Формулы Хеуорса5-членный цикл называется фуранозным (фураноза),
6-членный цикл – пиранозным (пираноза).
O
пираноза
O
фураноза
51.
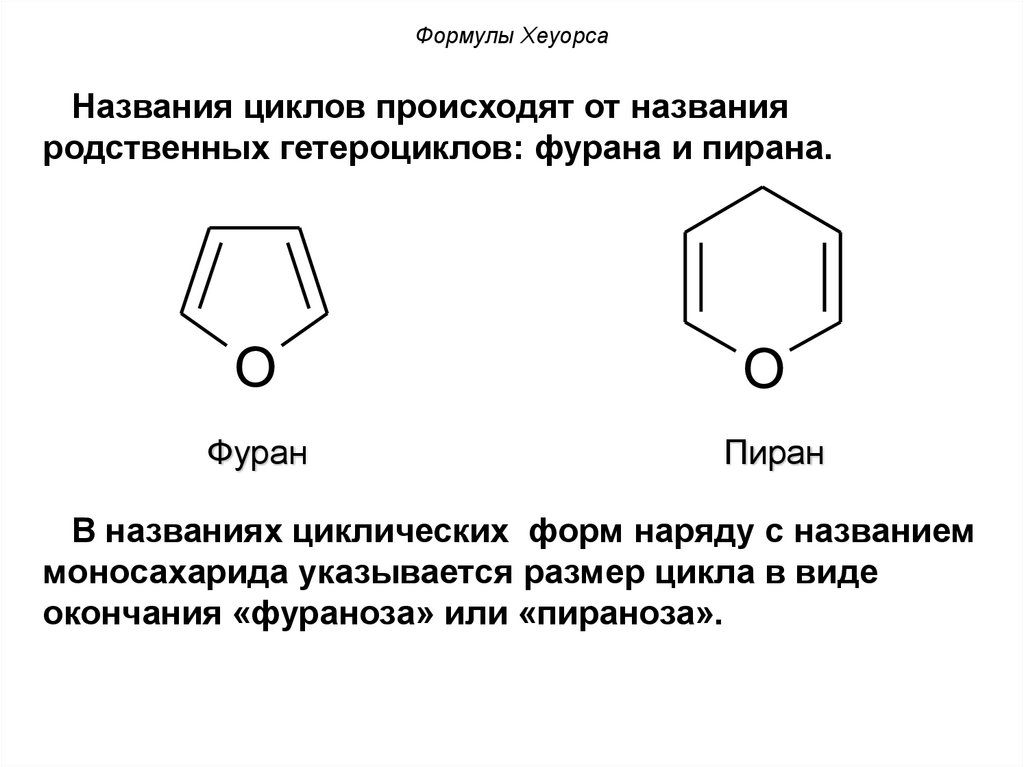
Формулы ХеуорсаНазвания циклов происходят от названия
родственных гетероциклов: фурана и пирана.
O
O
Фуран
Пиран
В названиях циклических форм наряду с названием
моносахарида указывается размер цикла в виде
окончания «фураноза» или «пираноза».
52.
Формулы ХеуорсаДля альдоз образование фуранозного цикла
происходит при взаимодействии карбонильного
звена С1 с гидроксигруппой С4, а пиранозный цикл
образуется между С1 и С5.
Для кетоз, т.е. фруктозы, в образовании цикла
участвует карбонильное звено С2 и гидроксигруппа
С5, что приводит к образованию фуранозы, или
гидроксильной группы С6, что приводит к
образованию пиранозы.
53.
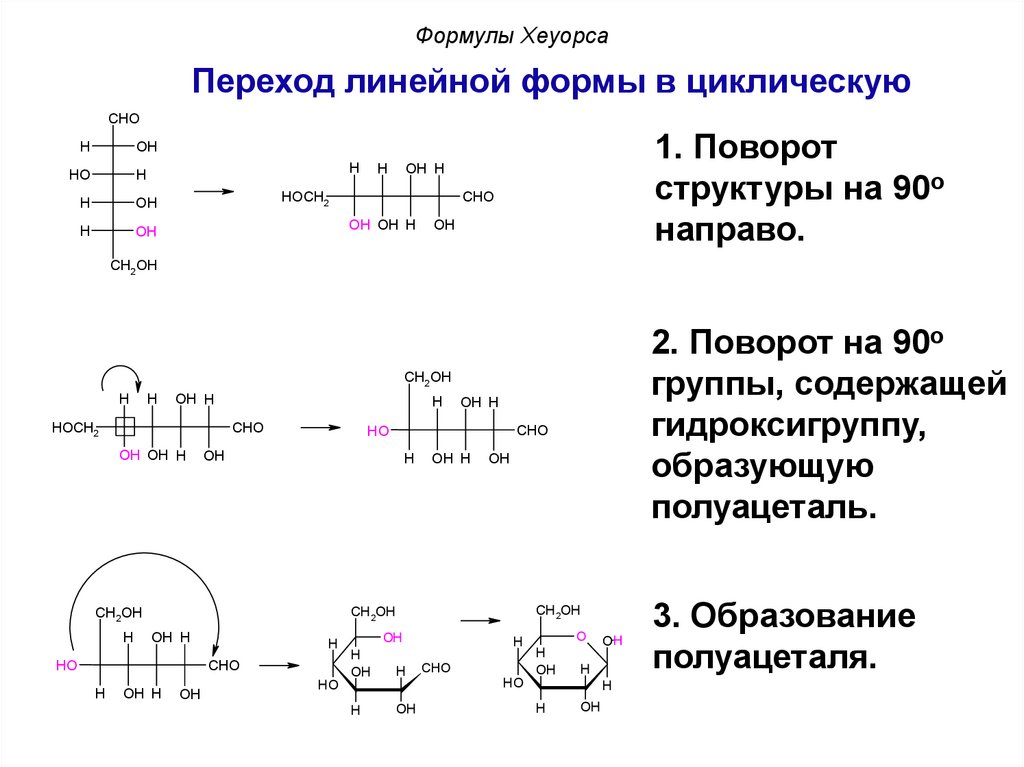
Формулы ХеуорсаПереход линейной формы в циклическую
CHO
H
OH
HO
H
H
OH
H
OH
H
H
1. Поворот
структуры на 90o
направо.
OH H
HOCH2
CHO
OH OH H
OH
CH2OH
2. Поворот на 90o
группы, содержащей
гидроксигруппу,
образующую
полуацеталь.
CH2OH
H
H
OH H
HOCH2
H
CHO
OH OH H
OH
H
OH H
OH
CH2OH
CH2OH
OH H
H
CHO
HO
H
CHO
HO
CH2OH
H
OH H
OH H
OH
OH
H
OH
H
HO
H
OH
H
CHO
O
H
OH
H
H
OH
HO
OH
H
3. Образование
полуацеталя.
54.
Формулы ХеуорсаВ случае образования циклического полуацеталя
появляется дополнительный центр хиральности,
который называется аномерным атомом углерода.
Два образующихся σ-диастереомера называются
аномерами. Если полуацетальный гидроксил
расположен под плоскостью цикла, то это -аномер,
над плоскостью цикла – -аномер.
-аномер
-аномер
55.
Формулы ХеуорсаПример: схема образования пиранозных
α- и β-форм D-глюкозы
CH2OH
arrows show
O H form
H
electron movement
H
(alpha)
OH H
CH2OH
HO
O
H
OH
H
H OH
H
H
OH H O
CH2OH
HO
O
H
OH
H OH
H
form
OH H
HO
H (beta)
H OH
56.
Формулы ХеуорсаCH2OH
H
CH2OH
OH
H
OH
H C
HO
H
OH
D-глюкоза
O
H
H
H
OH
CH2OH
O OH
или
H
HO
H
H
OH
-аномeр
H
H
OH
O H
H
HO
OH
H
OH
-аномeр
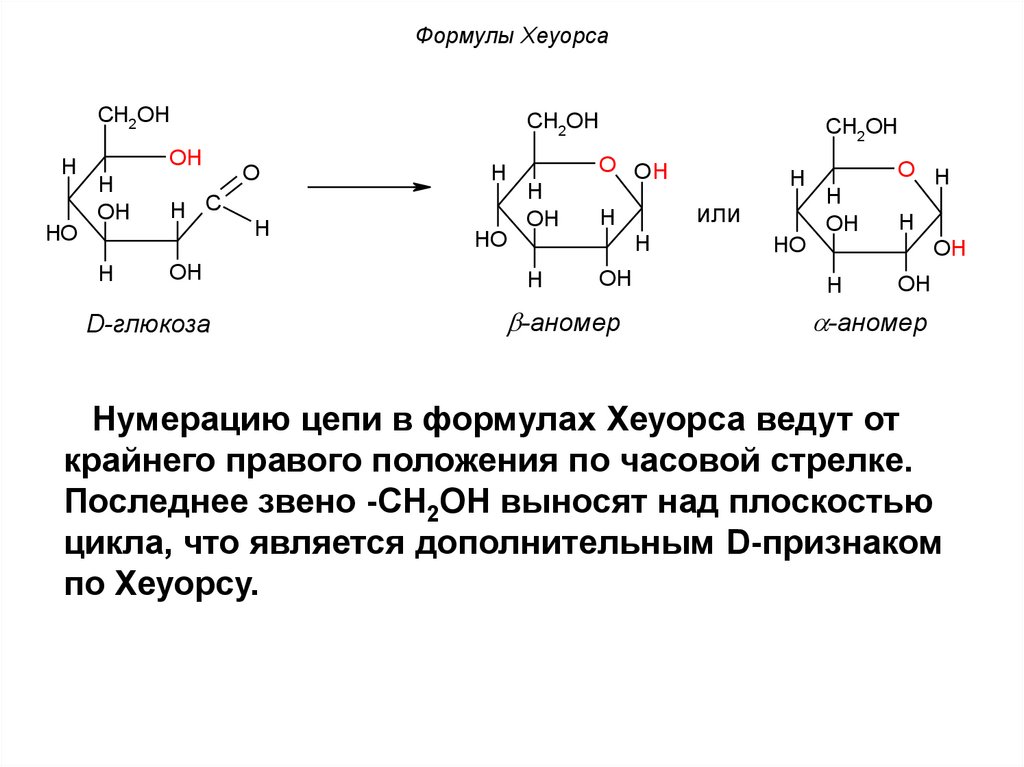
Нумерацию цепи в формулах Хеуорса ведут от
крайнего правого положения по часовой стрелке.
Последнее звено -СН2ОН выносят над плоскостью
цикла, что является дополнительным D-признаком
по Хеуорсу.
57.
Формулы ХеуорсаПример: схема образования β-D-рибофуранозы
arrows show
electron movement
CH2OH
O H
H
H
H
H
OH
OH
D-ribose
D-ribofuranose
(furanose ring form)
CH2OH
O H
O
O
H
H
OH
OH
H
H
58. Фуранозные α- и β-формы D-рибозы
Формулы ХеуорсаФуранозные α- и β-формы D-рибозы
CH2OH O
H
H
H
H
CHO
OH
OH
OH
H C OH
H C OH
-D-Ribofuranosa
H C OH
CH2OH
CH2OH O
D-Ribosa
(forma abierta)
H
H
OH
H
H
OH
OH
-D-Ribofuranosa
59.
Формулы ХеуорсаПиранозные α-формы D-маннозы и D-галактозы
CH2OH
CH2OH
O
O
H
OH
H
H
OH
OH
H
H
OH
D-Manosa
( -D-Manopiranosa)
OH
H
H
H
OH
H
H
OH
OH
D-Galactosa
( -D-Galactopiranosa)
60.
Формулы ХеуорсаФуранозные α- и β-формы D-фруктозы
CH2OH O
H
CH2OH
HO
H
OH
OH
C O
HO C H
CH2OH
H
-D-Fructofuranosa
H C OH
H C OH
CH2OH
CH2OH O
D-Fructosa
H
OH
HO
H
CH2OH
OH
H
-D-Fructofuranosa
61.
Формулы ХеуорсаВ растворе моносахариды присутствуют в открытых
и циклических формах, способных свободно
переходить друг в друга. Такой вид изомерии
называется цикло-оксо-таутомерией (кольчато-цепной
таутомерией).
Изомеры, взаимно переходящие друг в друга и
находящиеся в состоянии динамического равновесия,
называются таутомерами.
62.
Кольчато-цепная таутомерияCH2OH
CH2OH
H
32%
H
OH
OH
H
-D-глюкопираноза
CH2OH
68%
OH
H
HO
H
H
CHO
H
OH
HO
H
H
OH
H
OH
CH2OH
O OH
OH
-D-глюкопираноза
H
O
OH
H
OH
H
H
HO
H
HO
O H
H
H
OH
H
OH
-D-глюкофураноза
CH2OH
HO
H
OH
O
0,02%
OH
H
H
H
H
OH
-D-глюкофураноза
63.
МутаротацияКольчато-цепная таутомерия сопровождается
закономерным явлением – мутаротацией.
Мутаротация (от лат. mutare – изменять, rotatio –
вращение) в данном случае – это изменение вращения
плоскости поляризации света свежеприготовленными
растворами разных аномеров.
Например, α-D-глюкопираноза имеет удельное
вращение [α] = +112o, а b-D-глюкопираноза имеет
[α] = +19o. При стоянии свежеприготовленных
растворов каждого из аномеров удельное вращение
изменяется и достигает значения +52,5o,
соответствующего равновесию.
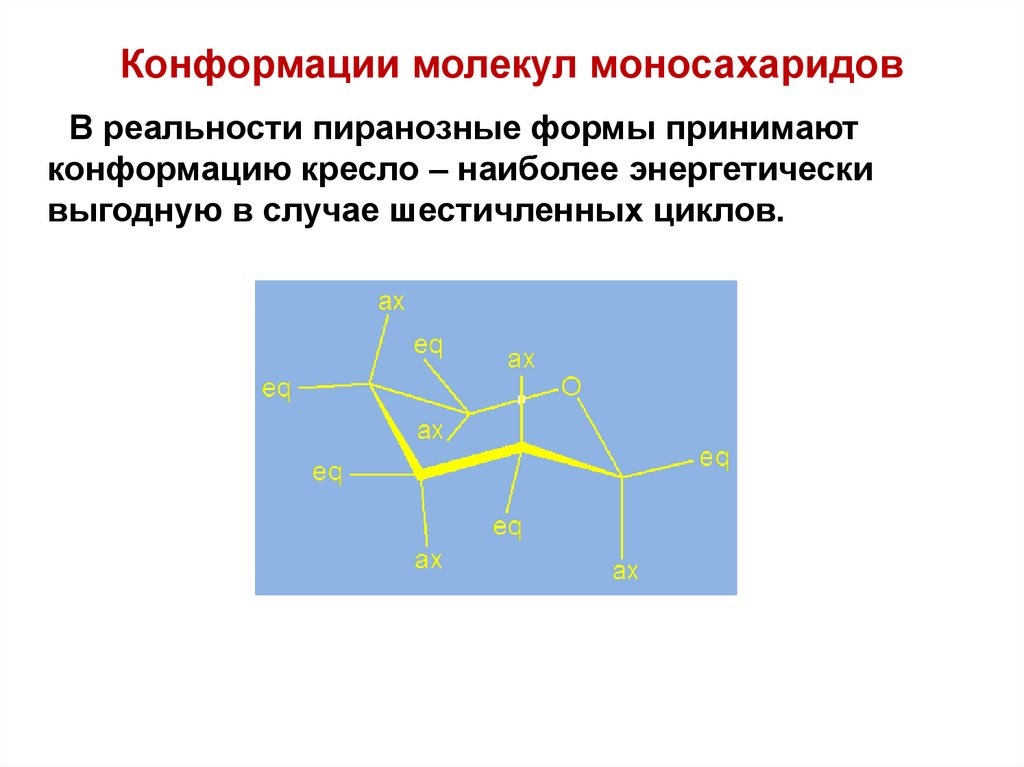
64. Конформации молекул моносахаридов
В реальности пиранозные формы принимаютконформацию кресло – наиболее энергетически
выгодную в случае шестичленных циклов.
65.
Конформации молекул моносахаридовВ случае β-аномера все объемные заместители
занимают экваториальные положения, что
энергетически выгодно.
H
CH2OH
H
O H
H
OH
OH
H
H
OH
H
H
HO
H
H
OH
-D-маннопираноза
OH
-D-глюкопираноза
CH2OH
H
OH
H
-D-глюкопираноза
O OH
H
H
HO
OH
O
H
HO
H
HO
CH2OH
CH2OH
O
H
HO
OH
H
HO
H
OH
H
-D-глюкопираноза
66.
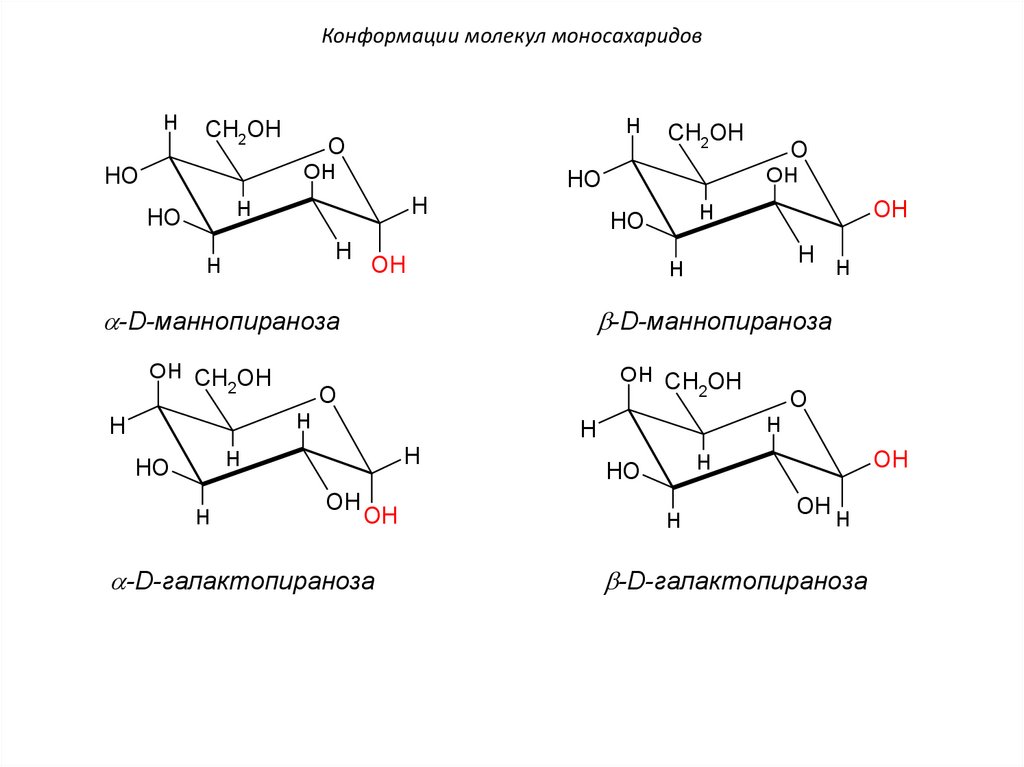
Конформации молекул моносахаридовH
H
CH2OH
O
OH
HO
H
H
H
OH
2
OH CH OH
2
O
H
H
OH
H
OH
-D-галактопираноза
O
H
H
H
HO
H
H
-D-маннопираноза
H
H
OH
H
HO
-D-маннопираноза
OH CH OH
O
OH
HO
H
HO
CH2OH
OH
H
HO
H
OH
H
-D-галактопираноза
67. Физические свойства
Моносахариды представляют собой бесцветныекристаллические
вещества
очень
хорошо
растворимые в воде. Моносахариды трудно
растворяются
в
спирте,
очень
плохо
в
гидрофобных растворителях.
Концентрированные растворы сахаров в воде
называются сиропами.
68.
Физические свойстваВещество
Относительная
сладость
Фруктоза
173
Сахароза (дисахарид)
100
Глюкоза
74
Мальтоза (дисахарид)
32
Галактоза
32
Лактоза (дисахарид)
16
69.
Физические свойстваO
C
NH
Сахарин (E954), 500 раз
S
O
O
Этоксифенилмочевина (дульцин), 200 раз
Ацесульфам (E950), 200 раз
Аспартам (метиловый эфир L-аспартил-Lфенилаланина, E951), 200 раз
Метилфенхиловый эфир L-аспартиламиномалоновой
кислоты, 33000 раз
Сукроновая кислота, 200000 раз.
70.
Физические свойстваБелок монеллин из
тропического растения
Dioscoreophyllum cumminsii в
3000 раз слаще сахарозы.
71.
Физические свойстваБелок тауматин (E957) из
тропического растения
Thaumacoccus daniellii слаще
сахарозы в 750-1000 раз, а
его комплекс с ионами
алюминия – талин – уже в
35000 раз.
Thaumacoccus daniellii
72.
Физические свойстваSynsepalum dulcificum
Белок миракулин из
Synsepalum dulcificum
имеет уникальное
свойство воздействовать
на вкусовые рецепторы,
отключая на время
восприятие кислого и
горького вкусов, при этом
все остальные вкусовые
ощущения остаются.
73.
Физические свойстваФрукт Synsepalum
dulcificum сам по себе не
сладкий, но может
использоваться как
натуральный
подсластитель.
74. Химические свойства моносахаридов
Исходя из функционального состава,моносахариды
проявляют
свойства
многоатомных
спиртов,
карбонильных
соединений,
полуацеталей
и
специфические свойства.
75.
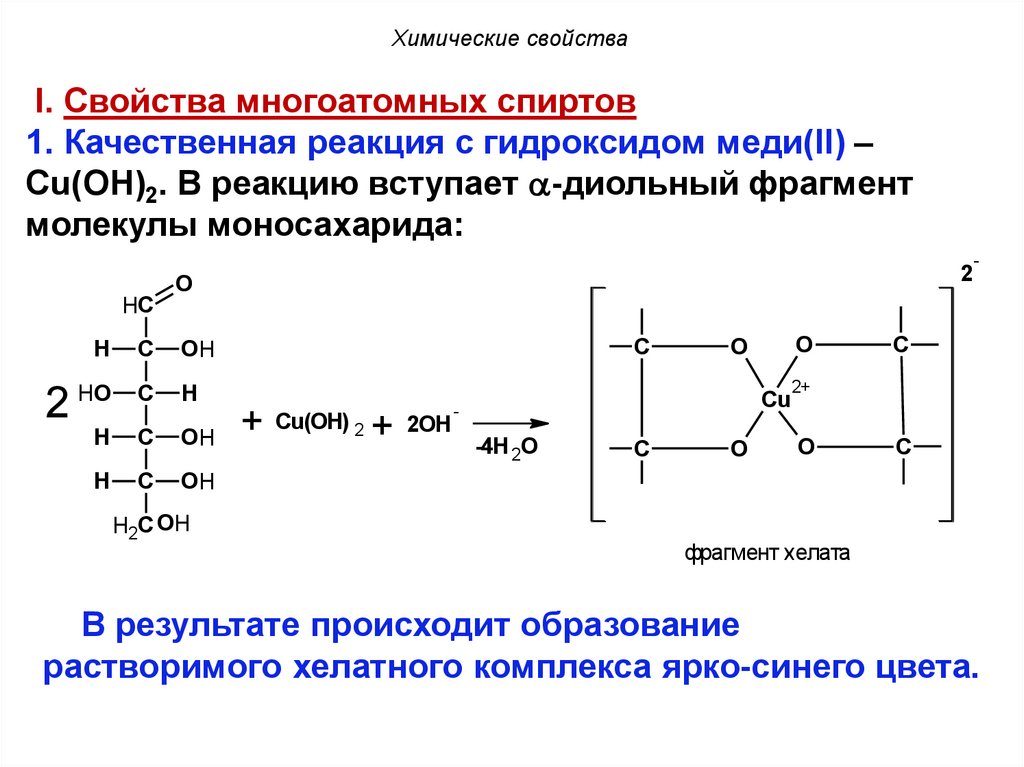
Химические свойстваI. Свойства многоатомных спиртов
1. Качественная реакция с гидроксидом меди(II) –
Сu(OH)2. В реакцию вступает -диольный фрагмент
молекулы моносахарида:
2
O
-
HC
2
H
C
OH
HO
C
H
C
Cu(OH) 2 + 2OH
+
H C OH
-4H O
2
H
C
O
O
Cu
C
O
C
2+
O
C
OH
H2C OH
фрагмент хелата
В результате происходит образование
растворимого хелатного комплекса ярко-синего цвета.
76.
Химические свойства2. Алкилирование (образование простых эфиров):
CH2OH
H
H
OH
OCH3
O OH
H
HO
H
H
CH3 I
KOH
- HI
OH
H
CH3O
O
H
OCH3 H
O-метил-2,3,4,6-тетраметил-Dглюкопиранозид
OCH3
H
CH3O
OCH3
O
H
OCH3 H
H
OCH3
H
-D-глюкопираноза
~ O CH3
~ O CH3
H2O, H+
-CH3OH
OCH3
O-метил-2,3,4,6-тетраметилD-глюкопиранозид
H
CH3O
O
H
OCH3 H
H
~ OH
OCH3
2,3,4,6-тетраметилD-глюкопираноза
77.
Химические свойства3. Ацилирование:
O
Ac =
CH2OH
H
C CH3
O
H
OH
H
HO
H
OH
D-глюкопираноза
~ OH
Ac2O
-AcOH
CH2 O Ac
H
O H
H
O Ac H
Ac O
O Ac
H
O Ac
1,2,3,4,6-пентаацетал-D-глюкопираноза
78.
Химические свойства4. Фосфорилирование:
,D-глюкопираноза
6-фосфат- ,D-глюкопиранозы
Биологическое значение имеют эфиры
фосфорной кислоты – фосфаты, образующиеся
обычно по месту последнего звена с участием
фермента фосфорилазы.
79.
Химические свойстваII. Свойства карбонильных соединений
1. Окисление альдоз
а) Гликоновые кислоты образуются при окислении
альдегидной группы до карбоксильной:
COOH
CHO
H
OH
HO
H
OH
H
OH
OH
H
OH
H
OH
HO
H
H
H
CH2OH
D-глюкоза
Br2
CH2OH
D-глюконовая кислота
80.
Химические свойстваКачественная реакция с мягкими окислителями –
Сu(OH)2 и [Ag(NH3)2]OH и при повышенной температуре.
Реакция с Сu(OH)2 называется пробой Троммера:
O
O
HO
HC
C
H
C
OH
HO
C
H
H
C
OH
H
C
OH
H2C OH
Д-глюкоза
+ 2Cu(OH) 2
t°
H
C
OH
HO
C
H
H
C
OH +
H
C
OH
2CuOH + HOH
Cu2O
H2C OH
Д-глюконовая кислота
HOH
81.
Химические свойстваПроба Троммера используется для обнаружения
глюкозы в моче.
82.
Химические свойстваб) Гликаровые кислоты образуются при жёстком
окислении. При этом окисляется и альдегидная и
первичная спиртовая группы:
COOH
CHO
H
OH
HO
H
H
HO
H
OH
H
OH
H
OH
HO
H
HO
H
CH2OH
D-галактоза
HNO3
COOH
D-галактаровая кислота
83.
Химические свойствав) Гликуроновые (уроновые) кислоты образуются при
окислении первичной спиртовой группы, не затрагивая
альдегидную группу:
CHO
CHO
CHO
H
OH
H
OH
HO
H
HO
H
HO
H
HO
H
H
OH
HO
H
H
OH
H
OH
H
OH
H
OH
COOH
D- глюкуроновая
кислота
COOH
D-галактуроновая
кислота
COOH
D-маннуроновая
кислота
84.
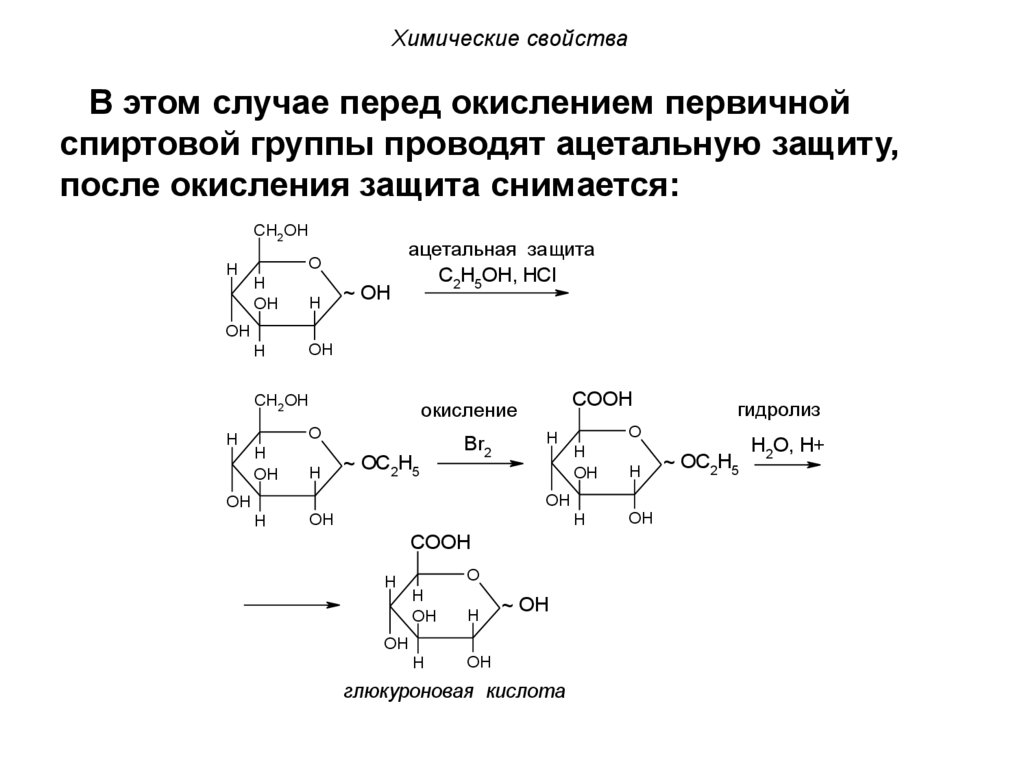
Химические свойстваВ этом случае перед окислением первичной
спиртовой группы проводят ацетальную защиту,
после окисления защита снимается:
CH2OH
H
O
H
OH
H
H
OH
~ OH
ацетальная защита
C2H5OH, HCl
OH
CH2OH
H
O
H
OH
COOH
окисление
H
~ OC2H5
Br2
H
H
OH
H
H
OH
OH
OH
H
OH
COOH
H
O
H
OH
H
H
OH
~ OH
OH
глюкуроновая кислота
гидролиз
O
~ OC2H5
H2O, H+
85.
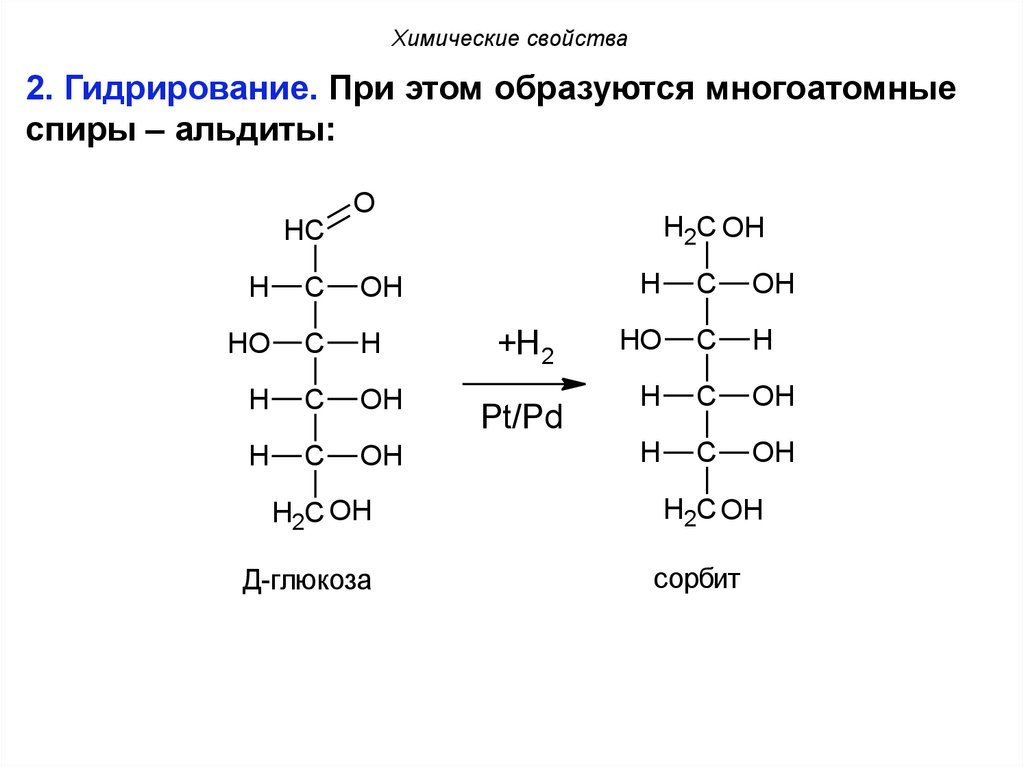
Химические свойства2. Гидрирование. При этом образуются многоатомные
спиры – альдиты:
O
H2C OH
HC
H
C
OH
HO
C
H
H
C
OH
H
C
OH
+H 2
Pt/Pd
H
C
OH
HO
C
H
H
C
OH
H
C
OH
H2C OH
H2C OH
Д-глюкоза
сорбит
86.
Химические свойстваD-глюкоза образует глицит (сорбит, E420),
D-манноза – маннит, D-ксилоза – ксилит (E967),
D-галактоза – дульцит.
87.
Химические свойстваИз D-глюкозы в фармацевтической промышлености
получают аскорбиновую кислоту.
CH2OH
CHO
CH2OH
H
OH
HO
H
OH
H
OH
OH
H
OH
H
OH
HO
H
H
H
CH2OH
D-глюкоза
H2, Pd
Acetobacter
suboxydans
CH2OH
HO
H
H
OH
HO
H
L-сорбоза
CH2OH
OH
O
O
H
OH
O
CH2OH
D-глицит (L- сорбит)
H
C
OH
аскорбиновая кислота
88.
Химические свойстваАскорбиновая кислота
(а – отрицающая
частица и scorbutus –
цинга) (витамин С) –
водорастворимый
витамин.
89.
Химические свойстваАскорбиновая кислота также
используется в аналитической
химии в аскорбинометрии,
которую применяют для
определения Fe(III), Hg(II), Au(III),
Pt(IV), Ag(I), Ce(IV), Mo(VI), W(VI),
I2, Br2, хлоратов, броматов,
иодатов, ваданатов, дихроматов,
а также нитро- нитрозо-, азо- и
иминогрупп в органических
соединениях.
90.
Химические свойстваIII. Свойства полуацеталей проявляются во
взаимодействии циклических форм моносахаридов
со спиртами. При этом образуются гликозиды.
H2C OH
H2C OH
O
O
OH
+
OH
OH
O
F
HO
CH3
-H2O
CH3
OH
OH
OH
,D-глюкопираноза
OH
O-метил- -D-глюкопиранозид
91.
Химические свойстваГликозиды
фуранозиды
пиранозиды
CH2OH
CH2OH
OC2H5
O
H
H
HO
CH2OH
OH
H
H
O-этил- -D-фруктофуранозид
HO
H
OH
O OCH3
H
H
H
OH
O-метил- -D-глюкопиранозид
92.
Химические свойстваи т.д.
Гликозиды
галактозиды
фруктозиды
рибозиды
глюкозиды
93.
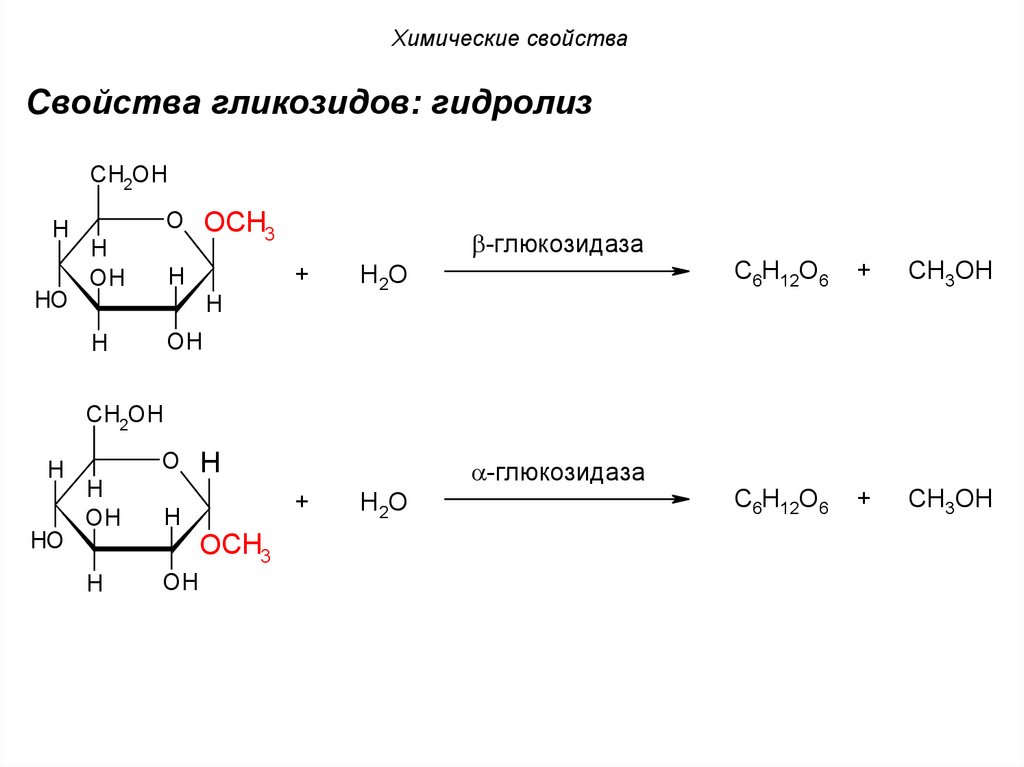
Химические свойстваСвойства гликозидов: гидролиз
CH2OH
H
O OCH
3
H
OH
-глюкозидаза
+
H
HO
H2O
C6H12O6
+
CH3OH
C6H12O6
+
CH3OH
H
OH
H
CH2OH
H
O H
H
OH
+
H
HO
OCH3
H
OH
-глюкозидаза
H2O
94.
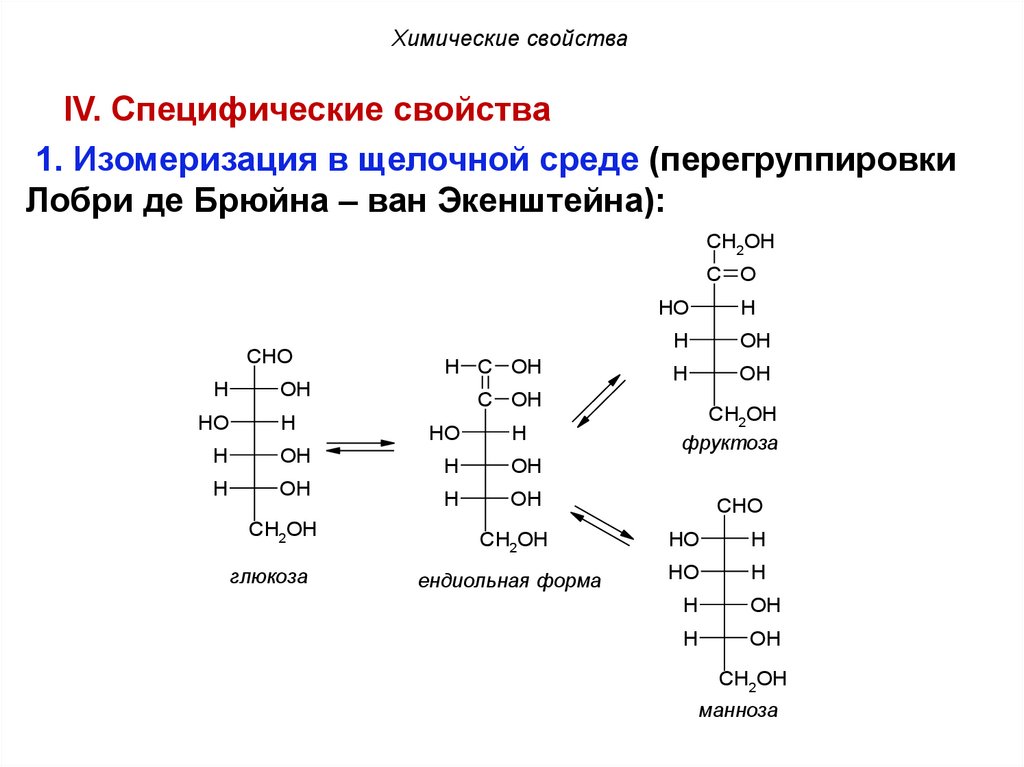
Химические свойстваIV. Специфические свойства
1. Изомеризация в щелочной среде (перегруппировки
Лобри де Брюйна – ван Экенштейна):
CH2OH
C O
CHO
H
OH
HO
H
H
OH
H
OH
CH2OH
глюкоза
H C OH
C OH
HO
H
H
OH
H
OH
HO
H
H
OH
H
OH
CH2OH
фруктоза
CHO
CH2OH
HO
H
ендиольная форма
HO
H
H
OH
H
OH
CH2OH
манноза
95.
Химические свойства2. Дегидратация
Альдопентозы образуют фурфурол:
CHO
H
OH
HO
H
H
OH
HCl, t
CHO
O
CH2 OH
Фурфурол (фурфураль) – светло-желтая
жидкость с запахом ржаного хлеба, tкип 161,5 °С.
Сырье для получения фурана, тетрагидрофурана,
фурфурилового спирта, лекарственных препаратов
(фурацилин, фуразолидон).
96.
Химические свойстваАльдо- и кетогексозы образуют
5-гидроксиметилфурфурол, который дает вишневокрасное окрашивание с резорцином (реакция
Селиванова на фруктозу).
97. 3. Брожение
Химические свойства3. Брожение
1) Спиртовое брожение
98.
Химические свойства2) Молочнокислое брожение
O
C66HH122O66
C
глюкоза
ферменты
2 CH3 CH C
OH
OH
Молочная кислота
99.
Производные моносахаридовДезоксисахара – моносахариды, содержащие в
молекуле один или несколько атомов водорода
вместо гидроксильных групп.
CHO
CHO
CH2OH
O
H
OH
H
H
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2OH
D-рибоза
2-дезокси-D-рибоза
H
H
OH
H
H
OH
H
-2-дезокси-D-рибофураноза
100.
Производные моносахаридовАминосахара образуются на основе
моносахаридов, в молекулах которых OH-группа
второго звена замещена аминогруппой -NH2.
CH2 OH
O
H
H
H
OH H
HO
OH
H
+
NH3
-D-glucosamine
101.
Производные моносахаридовCHO
CHO
CHO
H
NH2
H
NH2
H2N
H
HO
H
HO
H
HO
H
H
OH
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2OH
H
H
OH
HO
CH2OH
CH2OH
O OH
HO
H
H
H
CH2OH
CH2OH
NH2
D-глюкозамин
(2-амино-2-дезоксиβ-D-глюкопираноза)
H
OH
H
O OH
H
H
H
H
NH2
D-галактозамин
HO
O OH
H
OH H2 N
H
H
H
D-маннозамин
102.
Производные моносахаридовГлюкозамин применяется в
качестве лекарственного
средства группы
нестероидных
противовоспалительных
препаратов для восполнения
его эндогенного дефицита.
103.
Производные моносахаридовCH2 OH
O
H
H
H
OH H
HO
OH
H
NH
CH3C O
N-acetyl- -D-glucosamine
N-ацетил-α-D-глюкозамин
2-ацетамидо-2-дезоксиα-D-глюкопираноза
Аминогруппа часто
ацилирована остатком
уксусной кислоты, при этом
образуется амидная
группировка: -NH-CO-.
104.
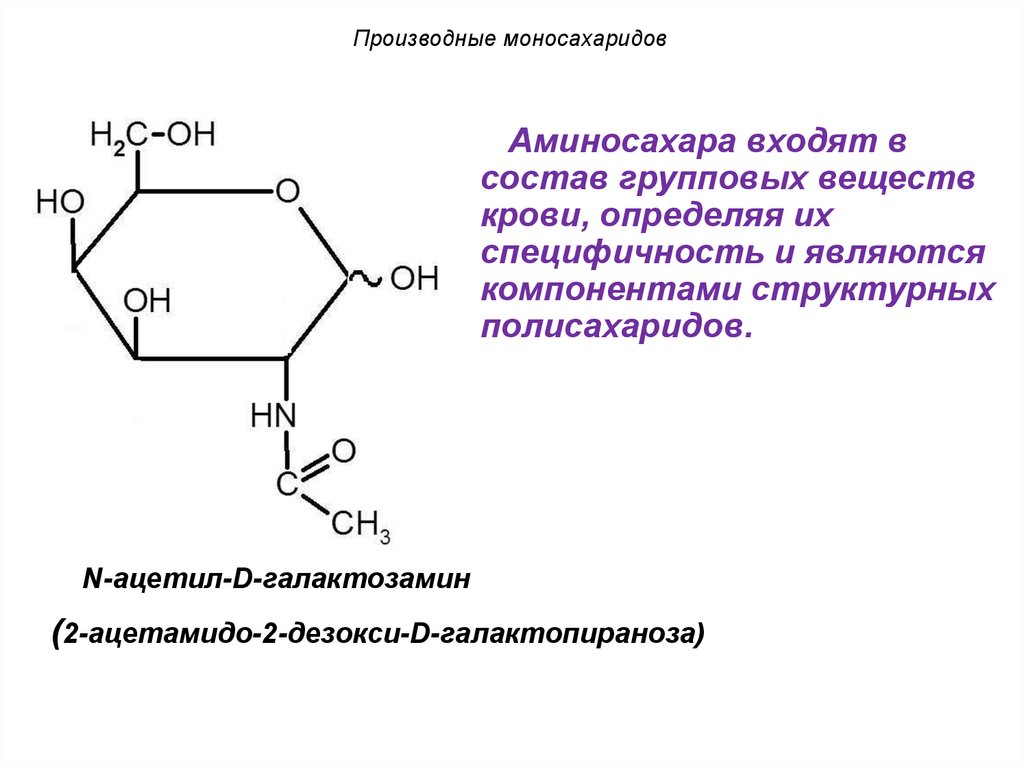
Производные моносахаридовАминосахара входят в
состав групповых веществ
крови, определяя их
специфичность и являются
компонентами структурных
полисахаридов.
N-ацетил-D-галактозамин
(2-ацетамидо-2-дезокси-D-галактопираноза)
105. Уроновые (сахарные) кислоты
Производные моносахаридовУроновые (сахарные) кислоты
Представителем
является
D-глюкуроновая
кислота, образующаяся окислением глюкозы в
шестом углеродном звене.
COOH
O
OH
OH
HO
OH
Глюкуроновая
кислота является
структурным
компонентом
полисахаридов.
106.
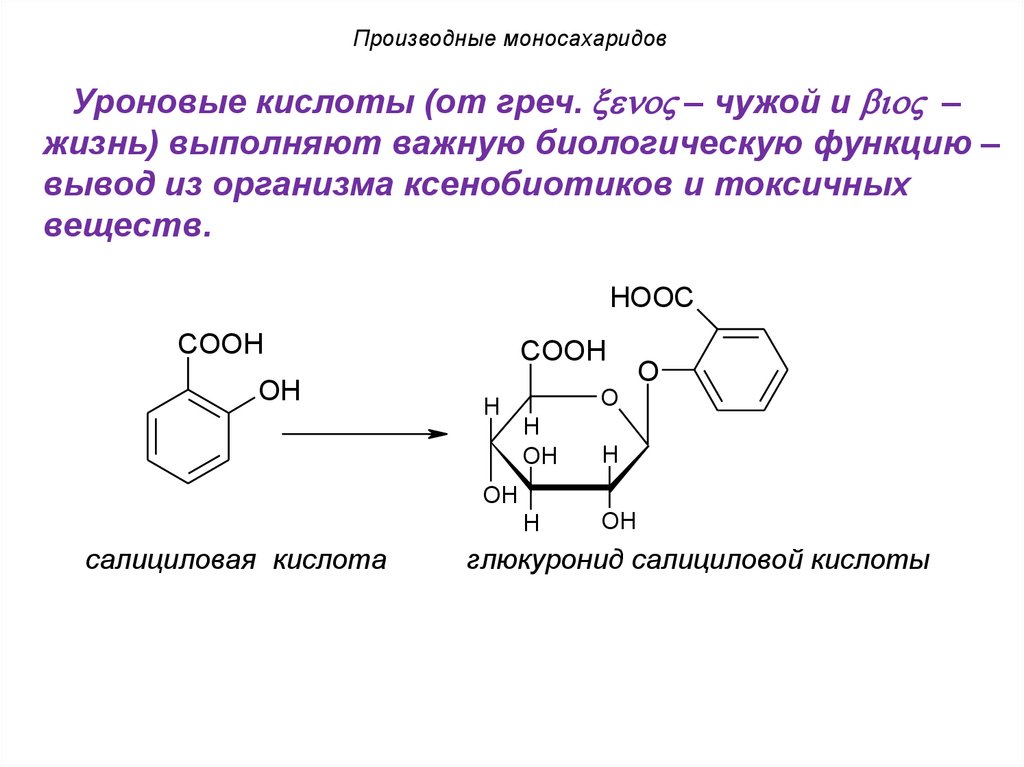
Производные моносахаридовУроновые кислоты (от греч. eno – чужой и io –
жизнь) выполняют важную биологическую функцию –
вывод из организма ксенобиотиков и токсичных
веществ.
HOOC
COOH
OH
COOH
H
O
O
H
OH
H
H
OH
OH
салициловая кислота
глюкуронид салициловой кислоты
107.
Производные моносахаридовНейраминовая кислота
Получается в
результате
альдольной
конденсации ПВК и
D-маннозамина.
108.
Производные моносахаридов1
COOH
2C
O
3
CH2
4
HC
H3C
C
O
5
NH C
HO
H
H
6
C
7
C
8
C
9
H2C
OH
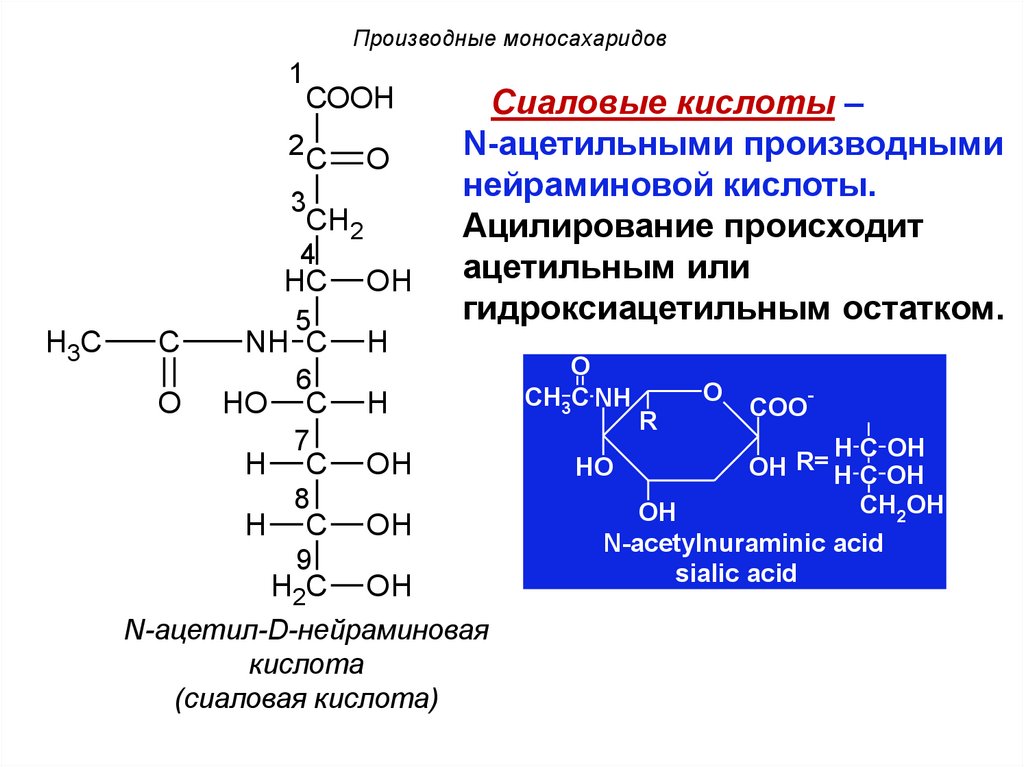
Сиаловые кислоты –
N-ацетильными производными
нейраминовой кислоты.
Ацилирование происходит
ацетильным или
гидроксиацетильным остатком.
H
H
O
CH3C NH
OH
HO
OH
OH
N-ацетил-D-нейраминовая
кислота
(сиаловая кислота)
O
R
-
COO
H C OH
OH R= H C OH
CH2OH
OH
N-acetylnuraminic acid
sialic acid
109.
Производные моносахаридовНейраминовые и сиаловые кислоты в свободном
состоянии содержатся в спиномозговой
жидкости. Сиаловая кислота является
компонентом специфических веществ крови,
входит в состав ганглиозидов мозга и участвует
в проведении нервных импульсов.
110. Вопросы для самоконтроля
1. Перечислите биологически важныеальдопентозы, альдогексозы и
кетогексозы.
2. Охарактеризуйте кольчато-цепную
таутомерию.
3. Охарактеризуйте химические
свойства моносахаридов.
4. Перечислите биологически важные
производные моносахаридов.
111.
СПАСИБО ЗАВАШЕ
ВНИМАНИЕ!























































































 chemistry
chemistry