Similar presentations:
Углеводы. Функции углеводов
1.
УГЛЕВОДЫ2.
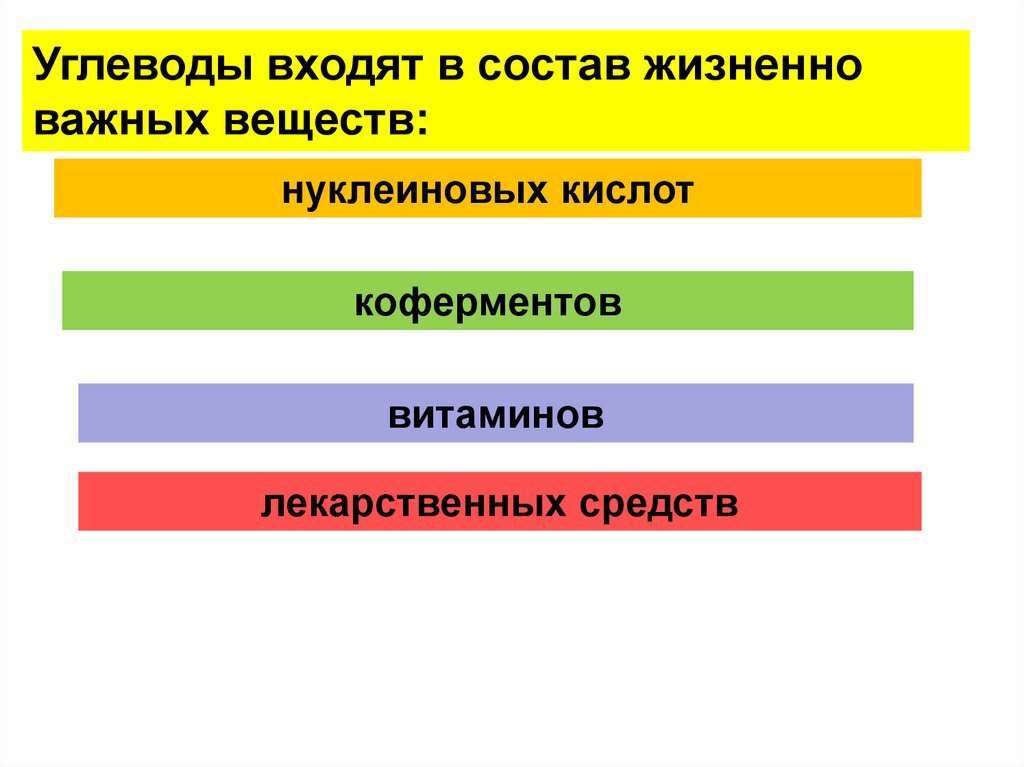
Углеводы входят в состав жизненноважных веществ:
нуклеиновых кислот
коферментов
витаминов
лекарственных средств
3.
Углеводы составляют до 80% сухого вещества массырастений и 2% сухого в-ва массы животных.
В растениях углеводы образуются в процессе
фотосинтеза, осуществляемого за счет солнечной энергии с
участием зеленого пигмента растений хлорофилла
В результате накапливается огромное количество
полисахаридов целлюлозы и крахмала.
Некоторые растения накапливают уникальный дисахарид
сахарозу (сахар).
Запасы углеводов восполняются в живой природе
ежегодно в отличие от невозобновляемых сырьевых
источников органических веществ (нефть, газ, каменный
уголь)
4.
Функции углеводов:• структурная (целлюлоза в
растениях, хитин в грибах);
• энергетическая (крахмал в
растениях, гликоген в
животных организмах).
5.
Классификация• Углеводами называют группу природных
в-в, которые в соответствии с хим.
классификацией явл-ся
полигидроксиальдегидами или
полигидроксикетонами, либо
продуктами их поликонденсации.
• Название «углеводы» эти соединения получили
потому, что первые из известных представителей
имели состав
Сn(H2O)m.
6.
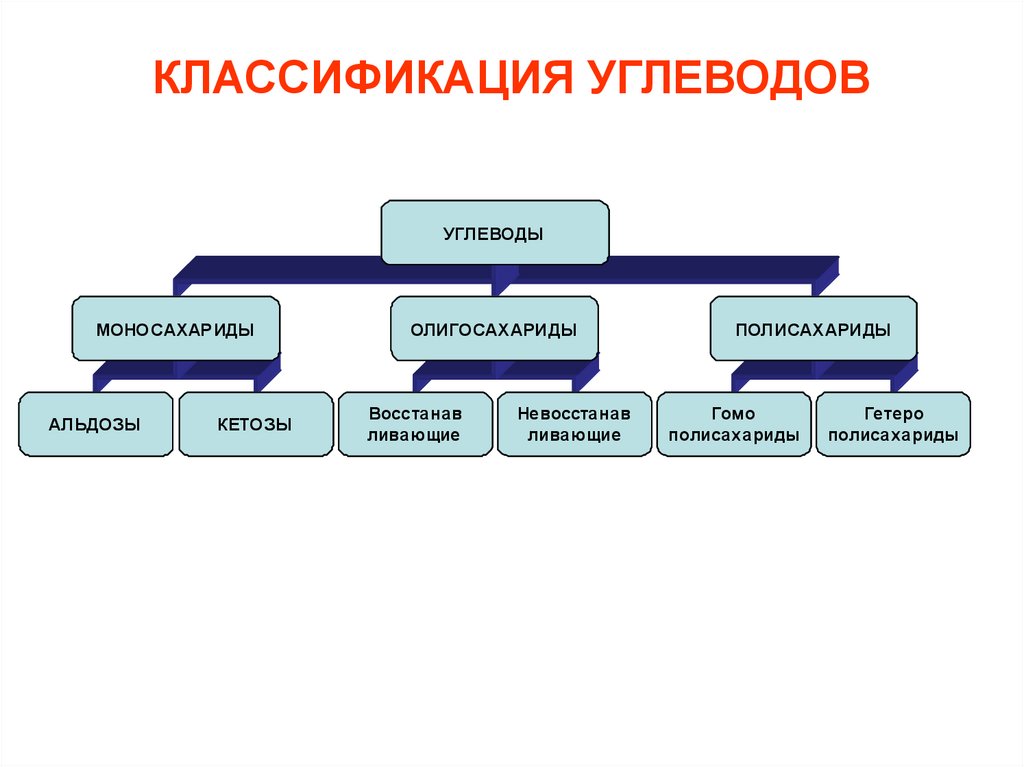
КЛАССИФИКАЦИЯ УГЛЕВОДОВУГЛЕВОДЫ
МОНОСАХАР ИДЫ
АЛЬДОЗЫ
КЕТОЗЫ
ОЛИГОСАХ АРИДЫ
Восстанав
ливающие
Невосстанав
ливающие
ПОЛИСАХ АРИДЫ
Гомо
полисахариды
Гетеро
полисахариды
7.
Простые (моносахариды илимонозы)
- не гидролизуются до более
простых углеводов
Сложные (олигосахариды и
полисахариды или полиозы)
– способны гидролизоваться до более
простых углеводов.
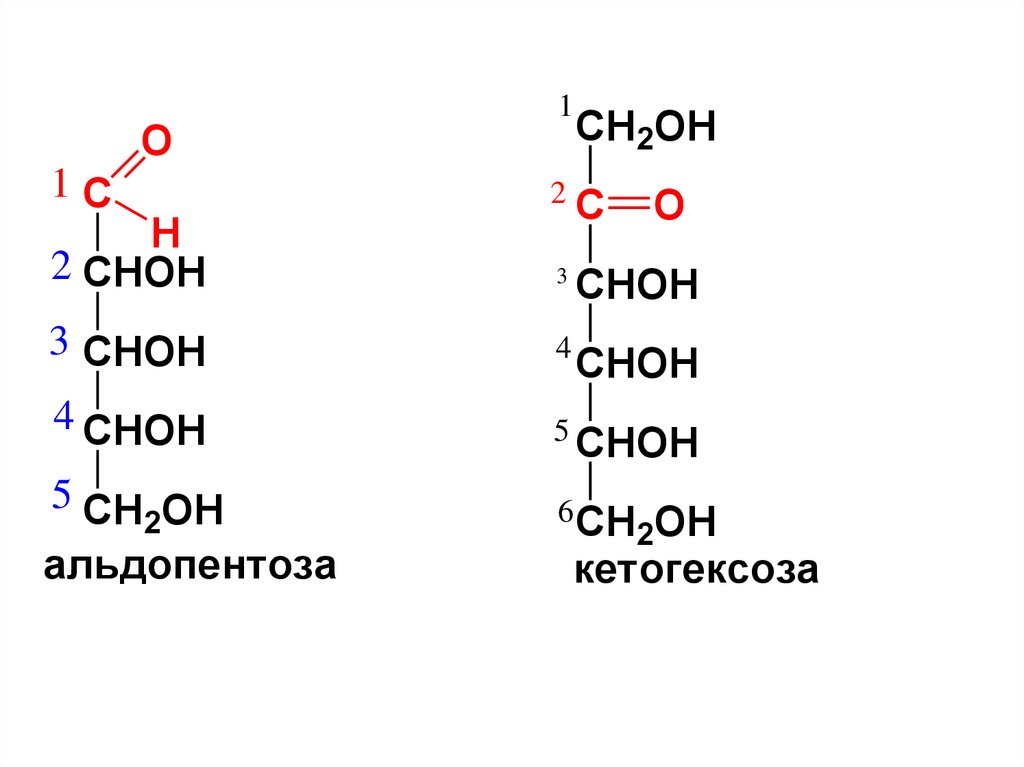
8. Моносахариды (МС)
В зависимости от кол-ва C-атомов вмолекуле делят на:
триозы, тетрозы, пентозы, гексозы и т.д.
МC, содержащие
альдегидную гр. называются альдозами,
а кетонную гр. – кетозами.
9.
1CH2OH
1C
2
H
2 CHOH
C
3
CHOH
3 CHOH
4
CHOH
4 CHOH
5
CHOH
O
5 CH OH
2
альдопентоза
O
6 CH OH
2
кетогексоза
10.
*O
O
O
C
O
H
* CHOH
CH2OH
C
C
H
*CHOH
C
H
*CHOH
H
* CHOH
*CHOH
* CHOH
*CHOH
* CHOH
* CHOH
*CHOH
CH2OH
CH2OH
CH2OH
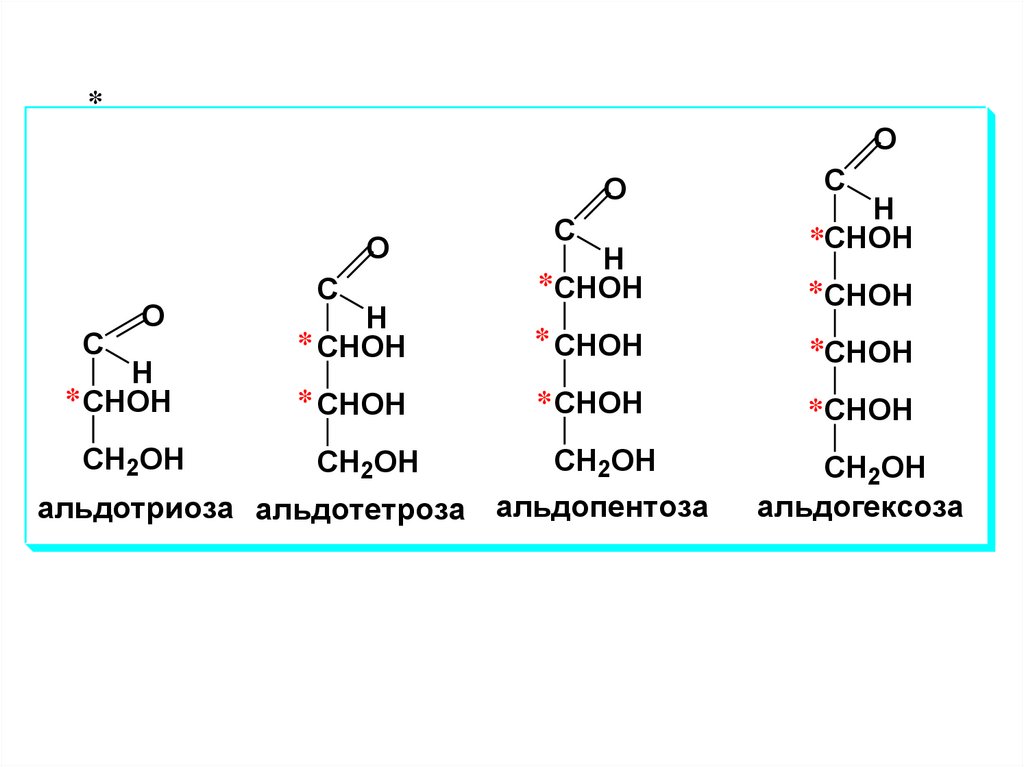
альдогексоза
альдотриоза альдотетроза альдопентоза
11.
Все альдозы содержат асимметрическиеC-атомы и существуют в виде нескольких
оптических изомеров.
Согласно формуле Фишера:N=2n,
где n – число асимметрических C-атомов.
Для каждого из оптических изомеров
существует один его оптический антипод –
энантиомер, остальные являются
диастереомерами.
Триозы – 2 стереоизомера (пара антиподов);
Тетрозы – 4 стереоизомера или 2 пары антиподов;
Пентозы – 8 стереоизомеров или 4 пары антиподов;
Гексозы – 16 стереоизомеров или 8 пар антиподов.
12.
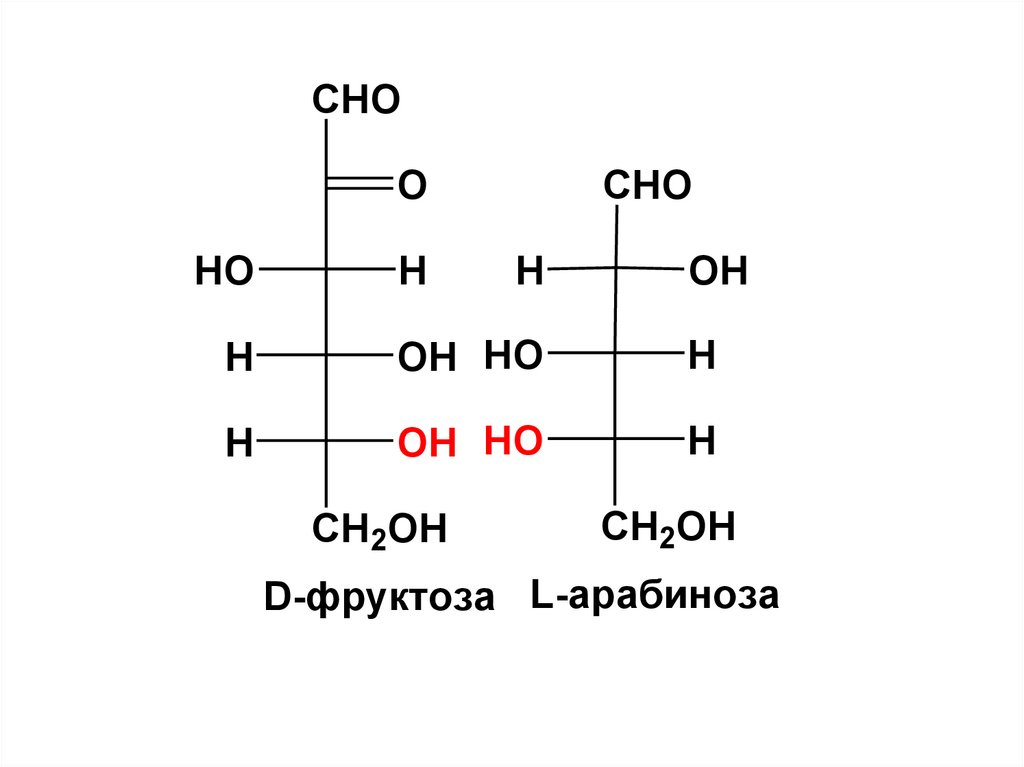
Эти антиподы относятся к 2 рядам:D- и L-ряду.
Принадлежность МС к тому или иному
генетическому ряду определяется
по конфигурации его последнего
(считая от C=O гр.) асимметрического атома C.
Если НО-гр. справа, то моноза относится к
D-ряду, если НО-гр. слева, то к L-ряду.
Конфигурацию моноз обозначают большими
буквами D- или L, а направление вращения
знаками (+) - вправо или (-) – влево.
13.
CHOO
HO
H
CHO
H
OH
H
OH HO
H
H
OH HO
H
CH2OH
CH2OH
D-фруктоза L-арабиноза
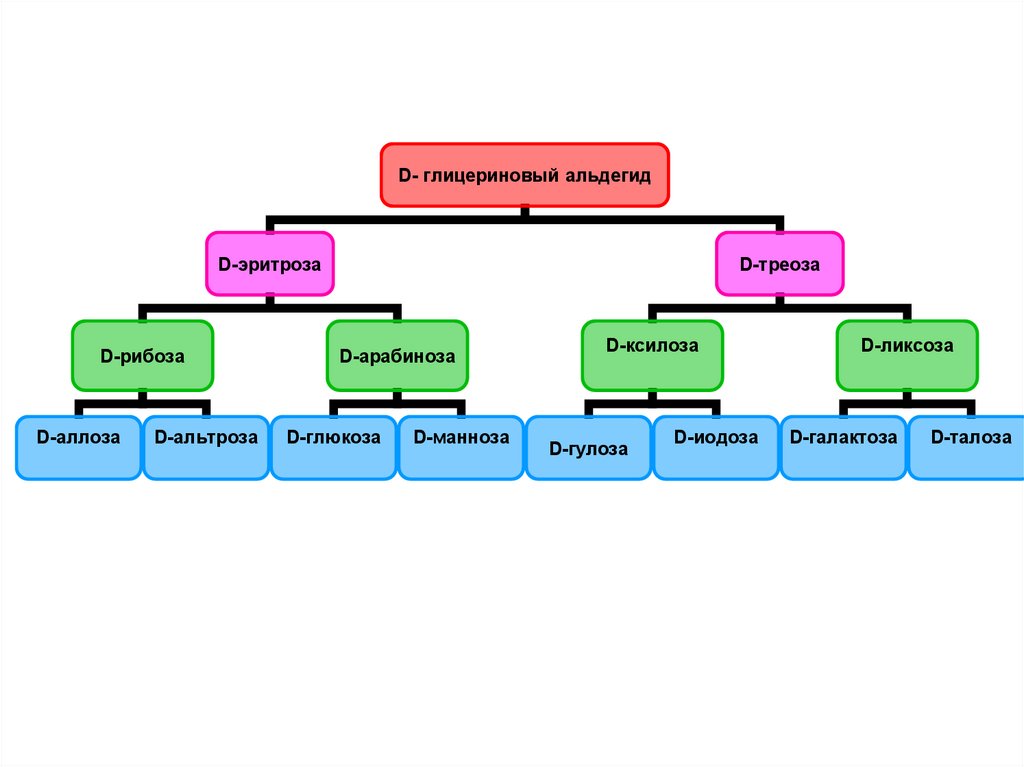
14.
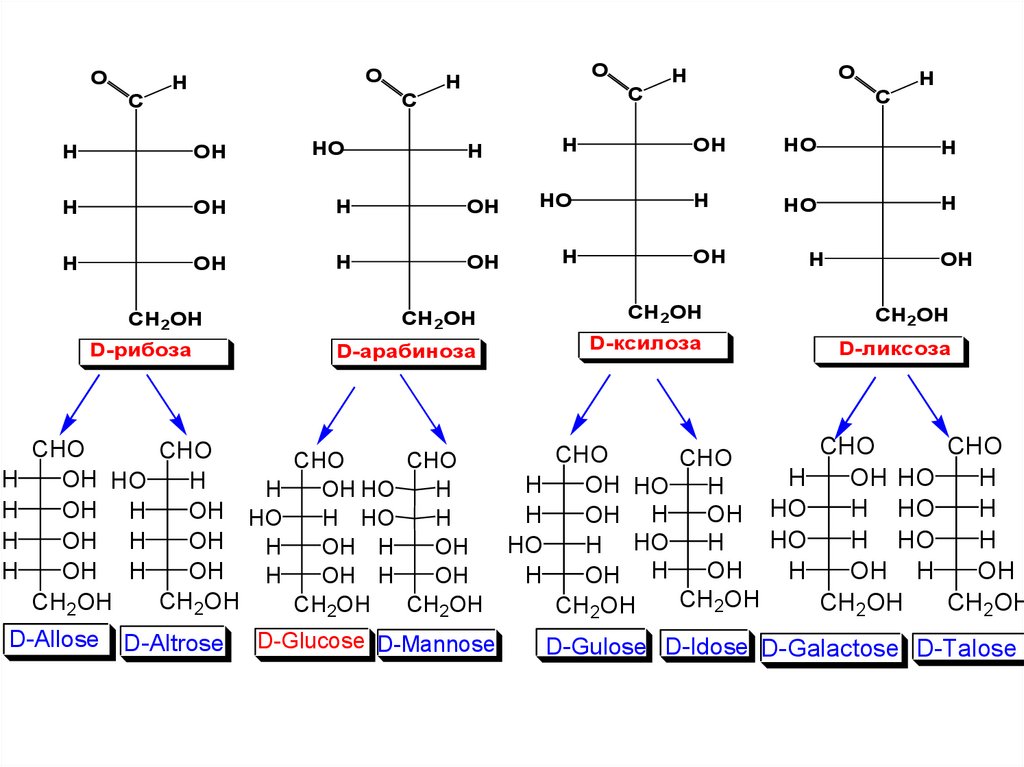
D- глицериновый альдегидD-эритроза
D-рибоза
D-аллоза
D-альтроза
D-треоза
D-арабиноза
D-глюкоза
D-манноза
D-ксилоза
D-гулоза
D-иодоза
D-ликсоза
D-галактоза
D-талоза
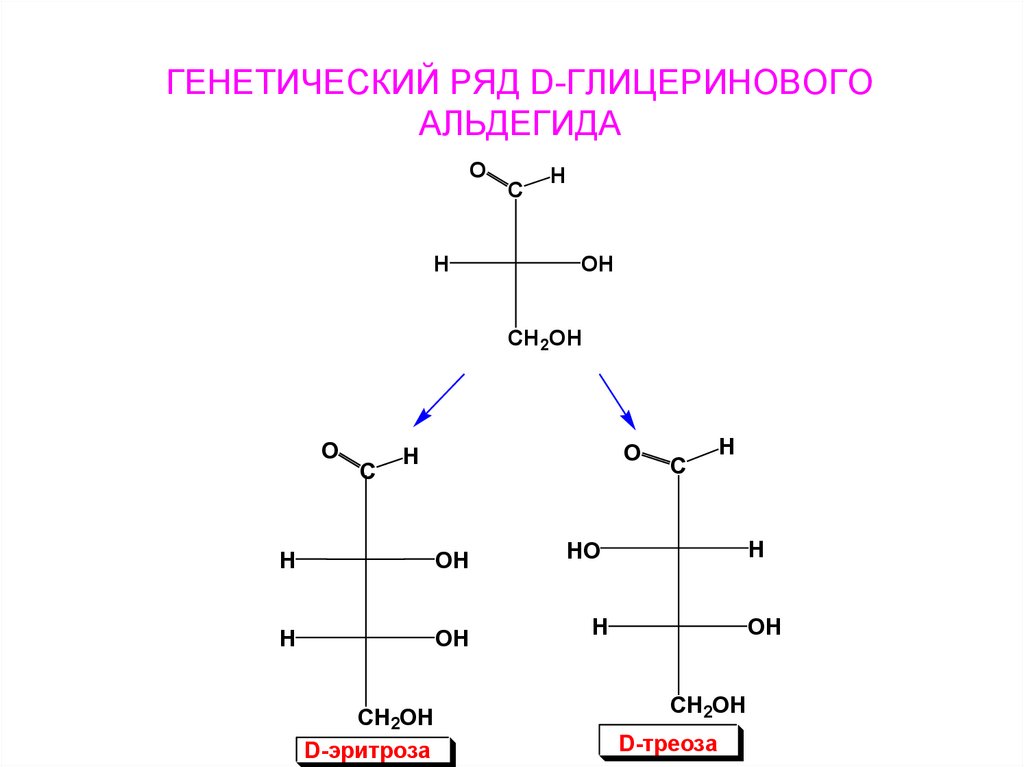
15. ГЕНЕТИЧЕСКИЙ РЯД D-ГЛИЦЕРИНОВОГО АЛЬДЕГИДА
OH
C
H
OH
CH2OH
O
C
O
H
H
OH
H
OH
CH2OH
D-эритроза
C
H
H
HO
H
OH
CH2OH
D-треоза
16.
OC
H
O
H
OH
OH
H
H
OH
H
OH
CH2OH
D-эритроза
O
C
O
H
C
CH2OH
D-треоза
O
H
C
H
OH OH
H
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D-рибоза
H
C
CH2OH
D-арабиноза
O
H
C
H
OH OH
H
OH
H
OH
H
H
OH
H
OH
CH2OH
CH2OH
D-ксилоза
D-ликсоза
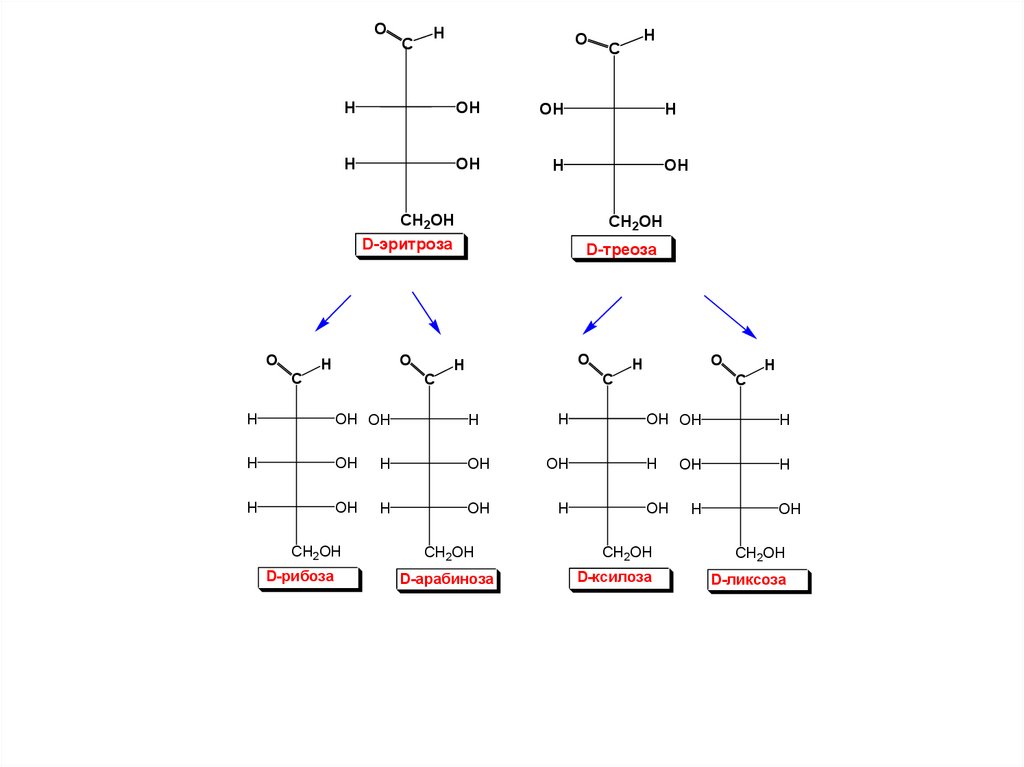
17.
OC
O
H
C
O
H
C
H
H
H
OH
HO
H
OH
H
OH
HO
H
OH
H
OH
H
O
H
C
H
OH
HO
H
H
HO
H
OH
H
OH
CH2OH
CH2OH
CH2OH
CH2OH
D-рибоза
D-арабиноза
D-ксилоза
D-ликсоза
CHO
CHO
CHO
CHO
CHO
CHO
CHO
CHO
H
OH HO
H
H
OH HO
H
H
OH HO
H
H
OH HO
H
H HO
H
H
OH H
OH HO
OH HO
H
OH H
H HO
H
HO
H HO
H
H
OH H
OH
H
HO
H HO
H
OH H
OH
OH
H
OH H
OH
H
OH H
OH
H
OH H
OH
H
OH H
CH2OH
CH2OH
CH2OH
CH2OH
CH2OH
CH2OH
CH2OH
CH2OH
D-Allose D-Altrose D-Glucose D-Mannose
D-Gulose D-Idose D-Galactose D-Talose
18.
•Названия МС образуют в соответствии сих классификацией с суффиксом «оза».
•Отдельные представители имеют
тривиальные названия. (см. уч.)
Наиболее распространены
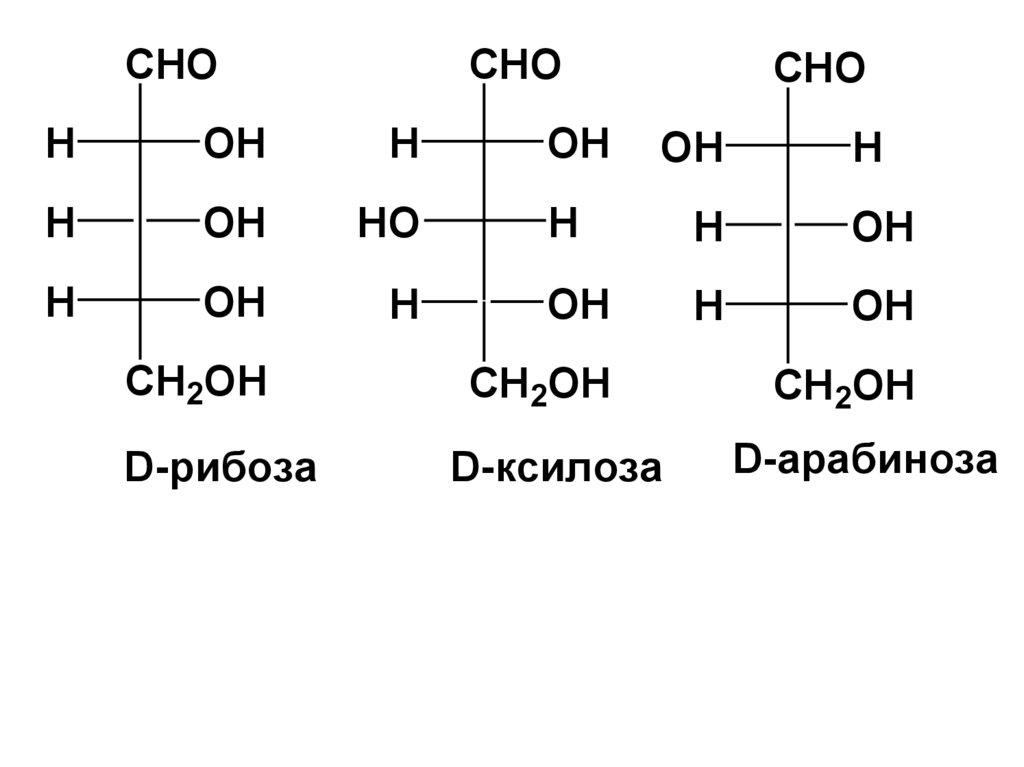
альдопентозы: рибоза, ксилоза, арабиноза;
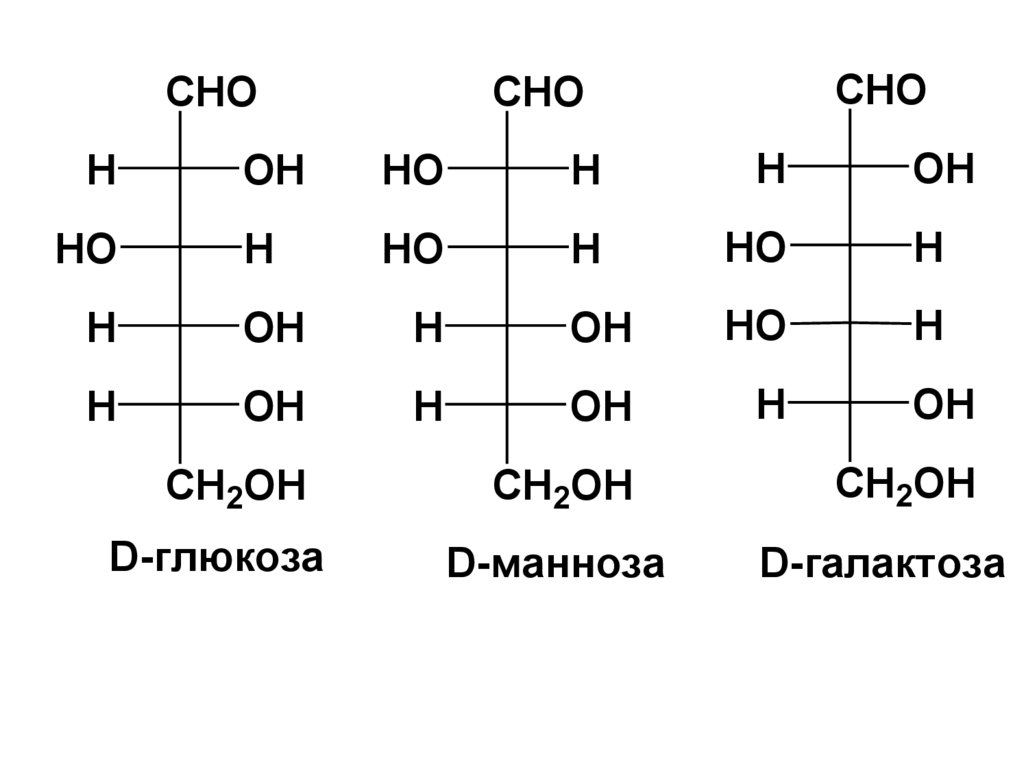
альдогексозы: глюкоза, манноза, галактоза;
19.
CHOCHO
CHO
H
OH
H
OH
OH
H
H
OH
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2OH
CH2OH
D-рибоза
D-ксилоза
D-арабиноза
20.
CHOCHO
CHO
H
OH
HO
H
H
OH
HO
H
HO
H
HO
H
H
OH
H
OH
HO
H
H
OH
H
OH
H
OH
CH2OH
CH2OH
CH2OH
D-глюкоза
D-манноза
D-галактоза
21.
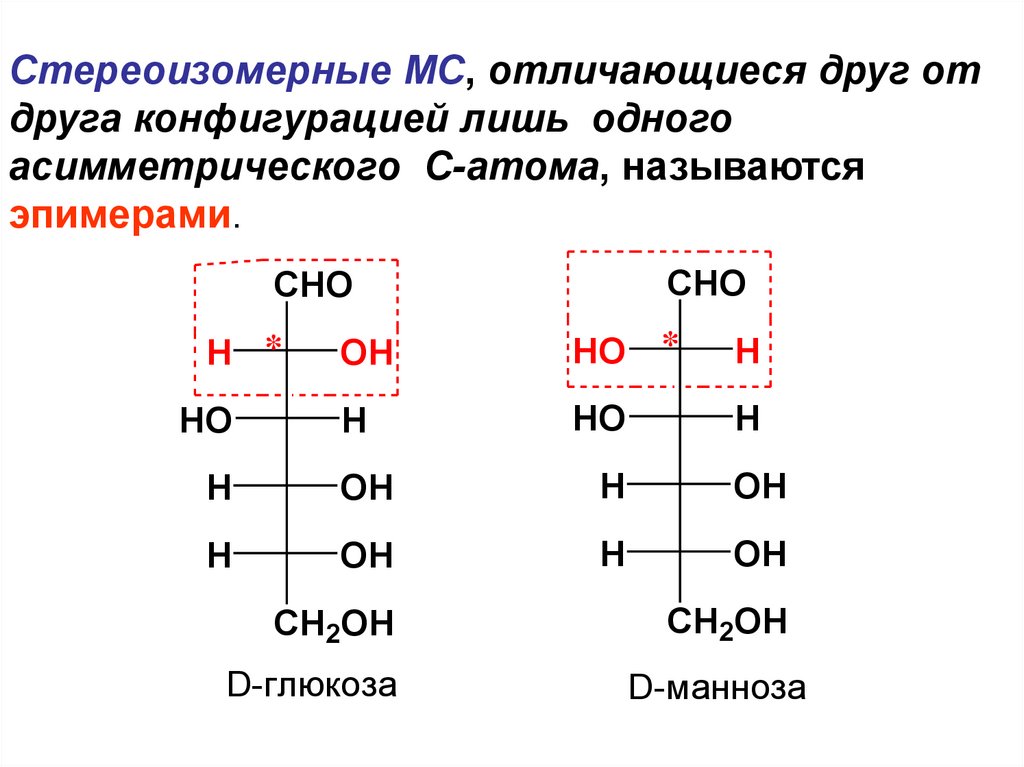
Cтереоизомерные МС, отличающиеся друг отдруга конфигурацией лишь одного
асимметрического С-атома, называются
эпимерами.
CHO
CHO
OH
HO *
H
HO
H
HO
H
H
OH
H
OH
H
OH
H
OH
H *
CH2OH
CH2OH
D-глюкоза
D-манноза
22.
Циклические формыМС существуют не только в виде
открытых цепных форм (оксоформ), но и
в виде циклических полуацетальных.
В крист. состоянии МС имеют циклическое
строение, а в р-рах представлены циклическими и
открытыми оксо-формами, находящимися в
динамическом равновесии – цикло-цепная таутомерия.
23.
Циклические формы альдогексозобразуются в результате
внутримолекулярного взаимодействия
альдегидной гр.с НО-гр. у С5 или С4 –
атома.
В результате образуются
устойчивые циклические
полуацетальные формы –
пиранозная (6-членный цикл),
либо фуранозная (5-членный цикл),
в которых отсутствует карбонильная гр. и
появляется полуацетальный гидроксил.
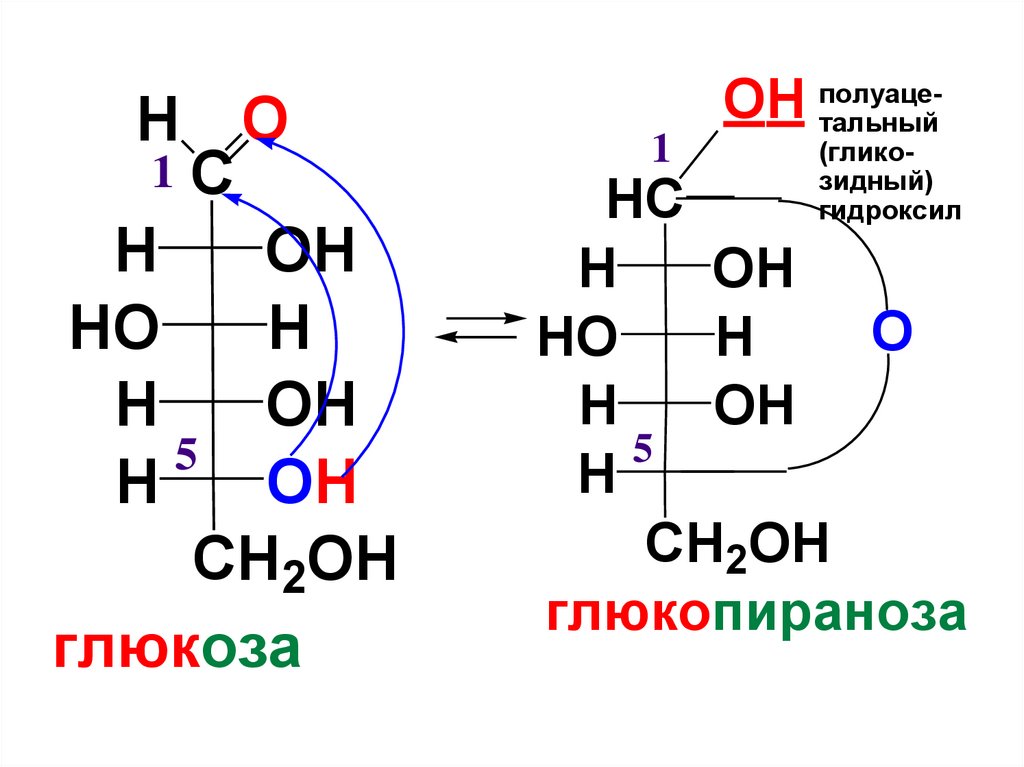
24.
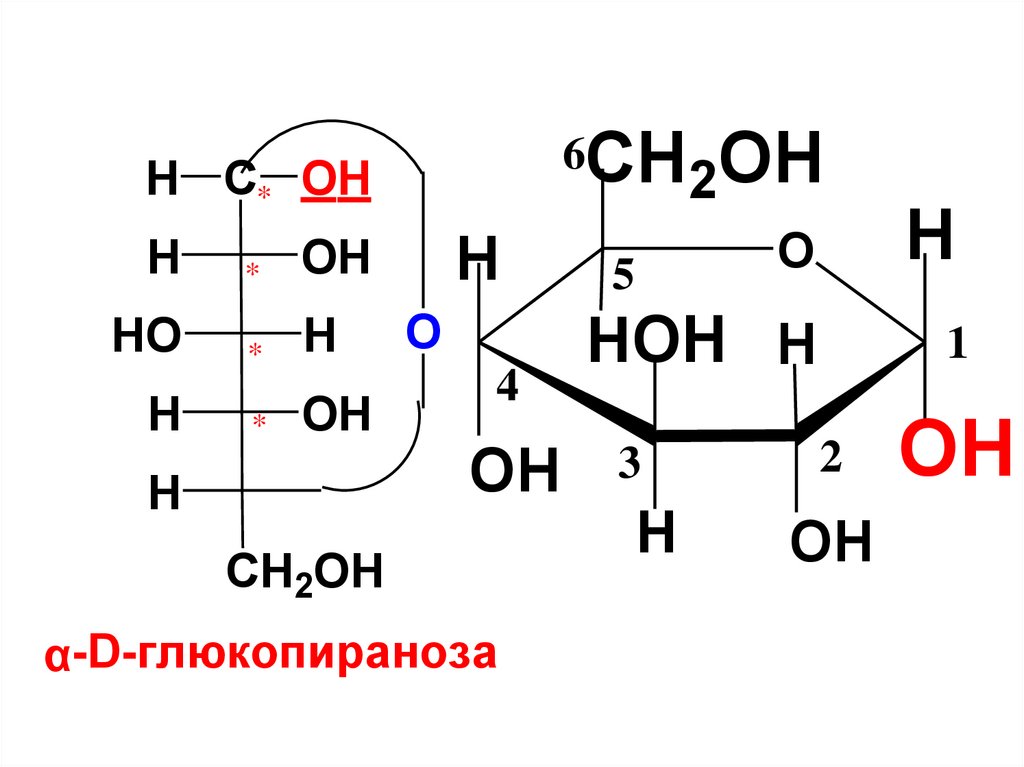
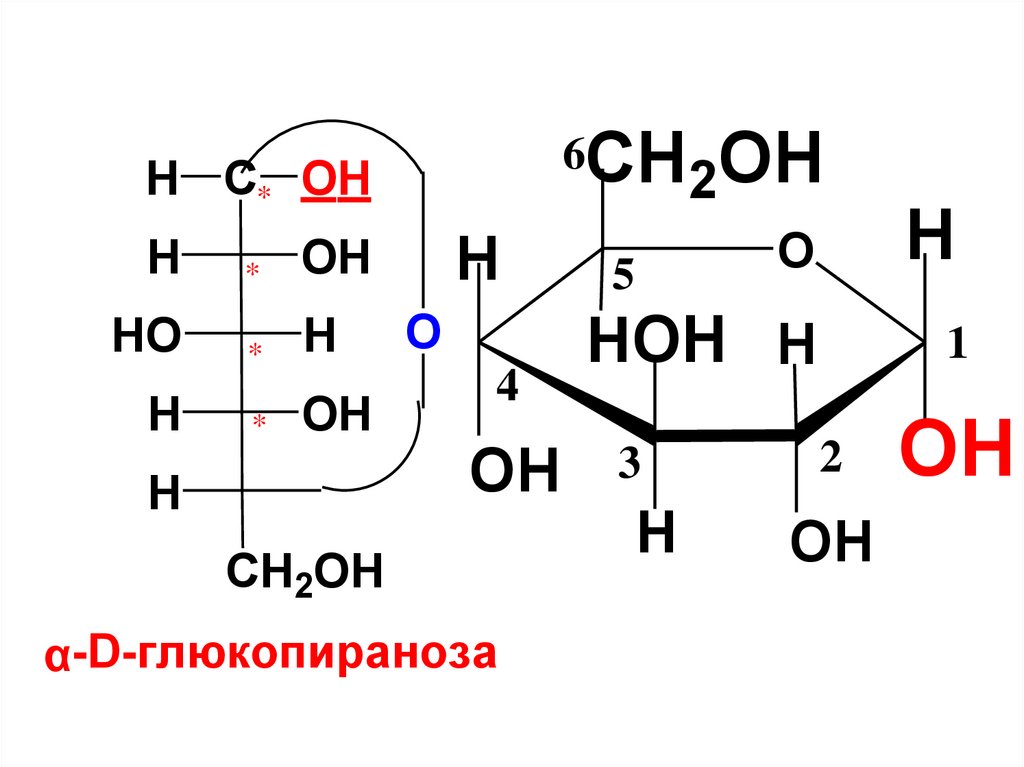
H O1C
OH
H
H
HO
OH
H
5
OH
H
CH2OH
глюкоза
1
OH полуацетальный
(гликозидный)
гидроксил
HC
H
OH
O
HO
H
H
OH
5
H
CH2OH
глюкопираноза
25.
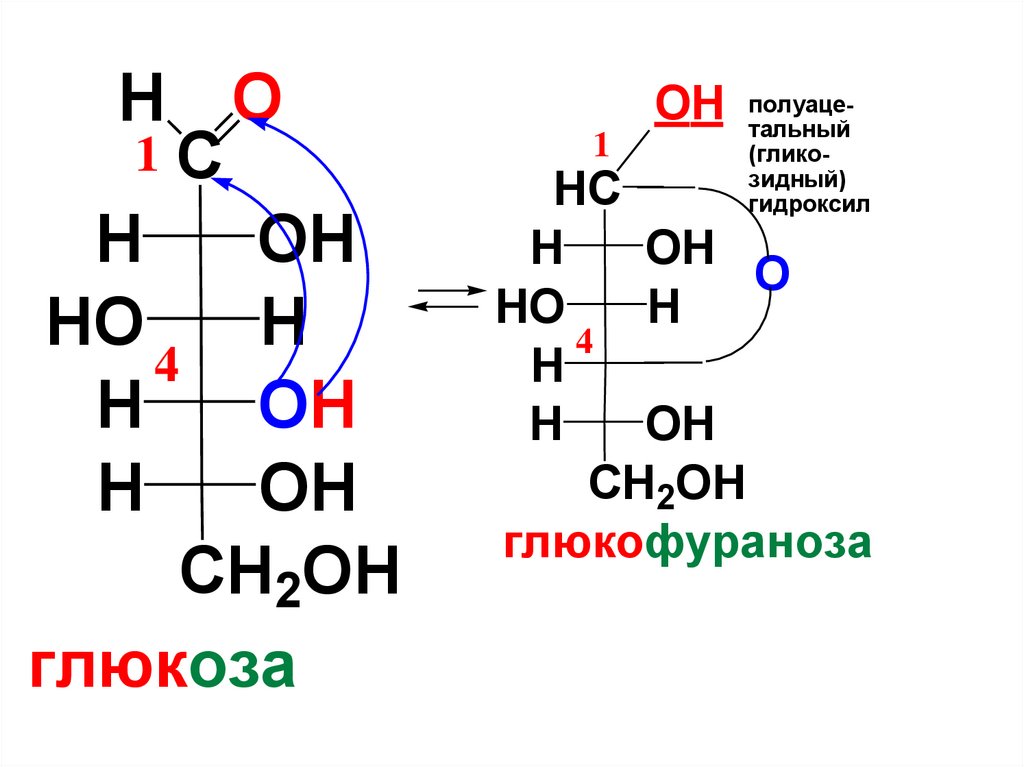
H O1C
H
OH
HO
H
4
H
OH
H
OH
CH2OH
глюкоза
1
OH полуацетальный
(гликозидный)
гидроксил
HC
H
OH
O
HO
H
4
H
H
OH
CH2OH
глюкофураноза
26.
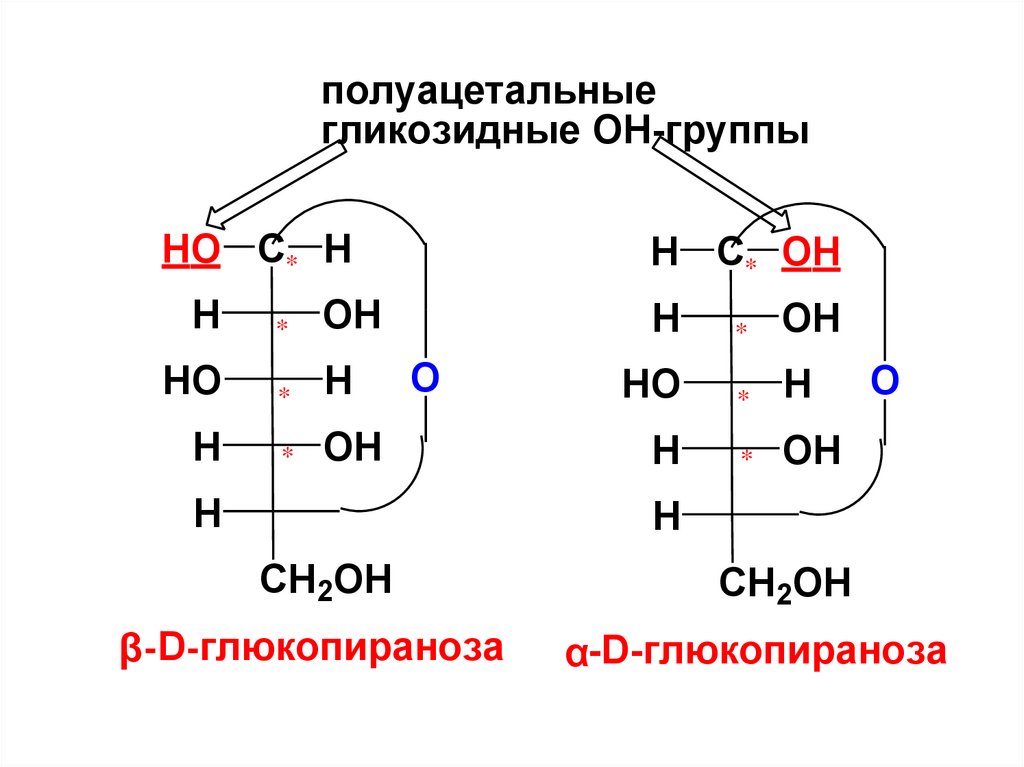
Вновь возникший асимметрическийатом С1 может иметь две антиподные
конфигурации,
т. е. возможно существование 2-х
циклических изомеров (аномеров),
называемых α- и β-формами.
27.
полуацетальныегликозидные ОН-группы
HO C* H
H
*
OH
HO
*
H
H
*
OH
H C* OH
O
H
H
*
OH
HO
*
H
H
*
OH
O
H
CH2OH
β-D-глюкопираноза
CH2OH
α-D-глюкопираноза
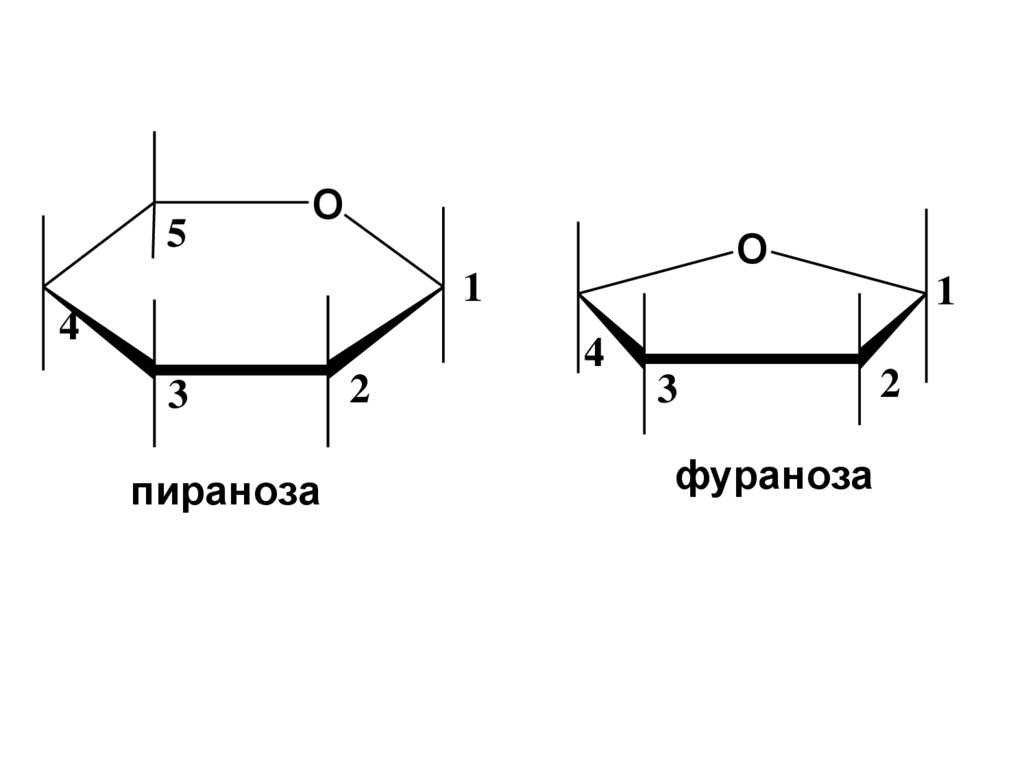
28. Перспективные формулы Хеуорса
Представляют собой плоскиемногоугольники, изображенные в перспективе :
•цикл лежит в горизонтальной плоскости,
• связи, расположенные ближе к наблюдателю,
изображаются жирно.
• О-атом в пиранозном цикле располагается в
правом верхнем углу, в фуранозном – за
плоскостью цикла.
•С-атомы, входящие в цикл, как правило, не
пишутся, располагаются от О-атома по часовой
стрелке.
29.
• Через С-атомы проводят вертикальныесвязи, на концах которых пишут НО- и Нгр. в соответствии с их пространственным
расположением.
• Т. о. Н, НО- и другие гр. располагают над и
под плоскостью цикла.
• Группы, которые находятся слева от Сцепи в проекционной формуле Фишера,
располагают над плоскостью цикла,
справа – под плоскостью цикла.
30.
5O
O
1
4
3
пираноза
2
1
4
3
фураноза
2
31.
6CH OH2
H C* OH
H
*
OH
HO
*
H
*
OH
H
H
H
O
4
OH
CH2OH
α-D-глюкопираноза
O
H
HOH H
1
5
3
2
H
OH
OH
32.
6CH OH2
H C* OH
H
*
OH
HO
*
H
*
OH
H
H
H
O
4
OH
CH2OH
α-D-глюкопираноза
O
H
HOH H
1
5
3
2
H
OH
OH
33.
Гликозидная НО-группа уальдоз D-ряда
• в α-форме находится под
плоскостью цикла,
• а в β –форме – над
плоскостью цикла.
34.
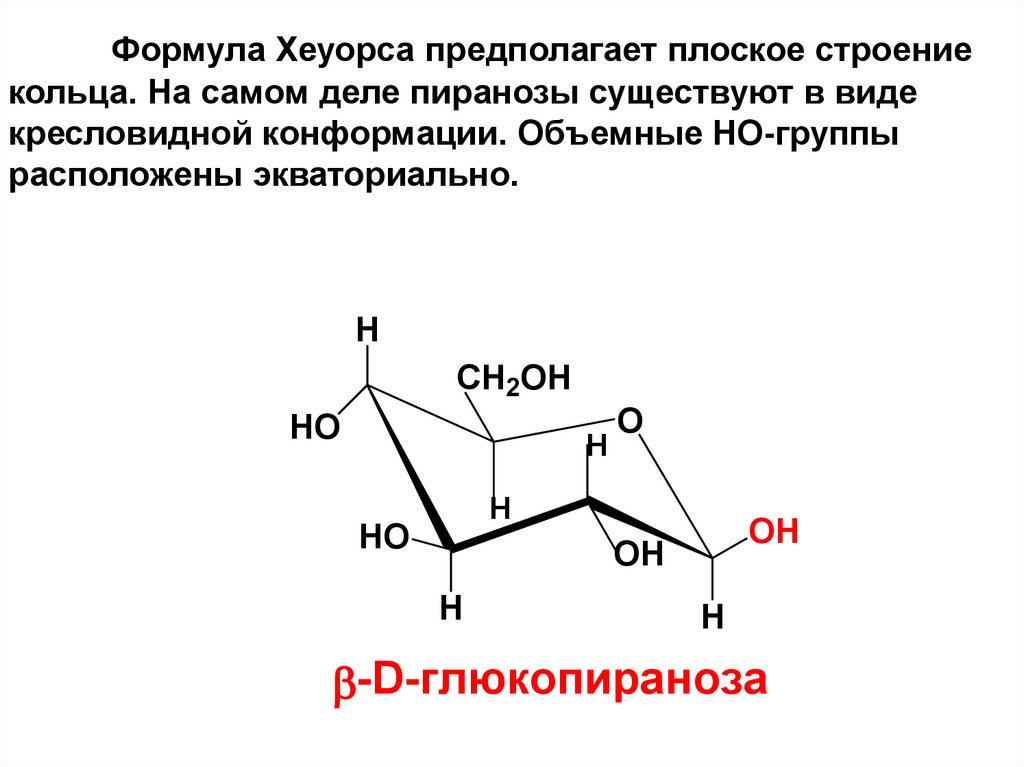
Формула Хеуорса предполагает плоское строениекольца. На самом деле пиранозы существуют в виде
кресловидной конформации. Объемные НО-группы
расположены экваториально.
H
CH2OH
HO
H
O
H
HO
OH
OH
H
H
-D-глюкопираноза
35. Химические свойства
Таутомерия. МутаротацияВ кристал. состоянии МС находятся в
циклической форме (α-или β).
α- и β-формы
МС различаются растворимостью, Т. пл. и
величиной удельного вращения [α]D.
В водных растворах МС претерпевают
кольчато-цепную таутомерию (цикло-оксотаутомерию) – один аномер переходит в другой
через открытую оксоформу.
Взаимное превращение α- и β-форм МС
называют аномеризацией.
36.
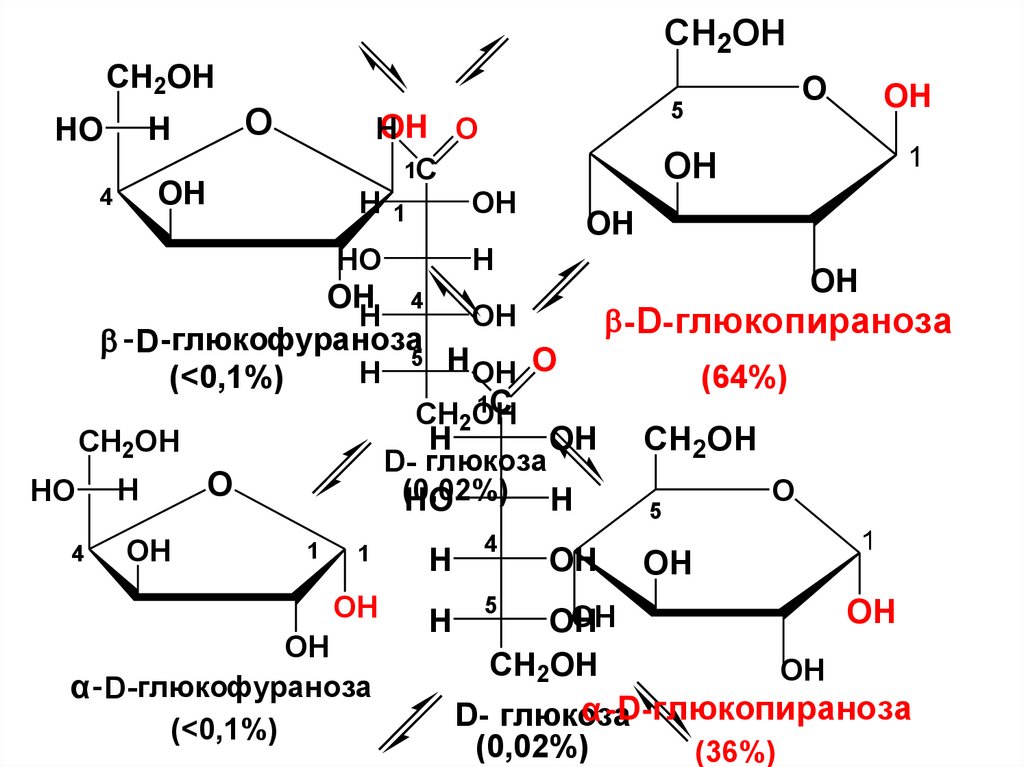
CH2OHCH2OH
O
H
HO
5
OH O
H
1C
H 1
OH
OH
4
HO
O
OH
1
OH
OH
H
OH
OH 4
H
OH
-D-глюкопираноза
- D -глюкофураноза5
H OH O
H
(<0,1%)
(64%)
1C
CH2OH
H
OH CH2OH
CH2OH
HO
4
H
OH
D- глюкоза
(0,02%)
HO
H
O
1
1
H
4
OH
H
5
OH
α - D -глюкофураноза
(<0,1%)
OH
OH
OH
CH2OH
5
O
1
OH
OH
OH
α -D-глюкопираноза
D- глюкоза
(0,02%)
(36%)
37.
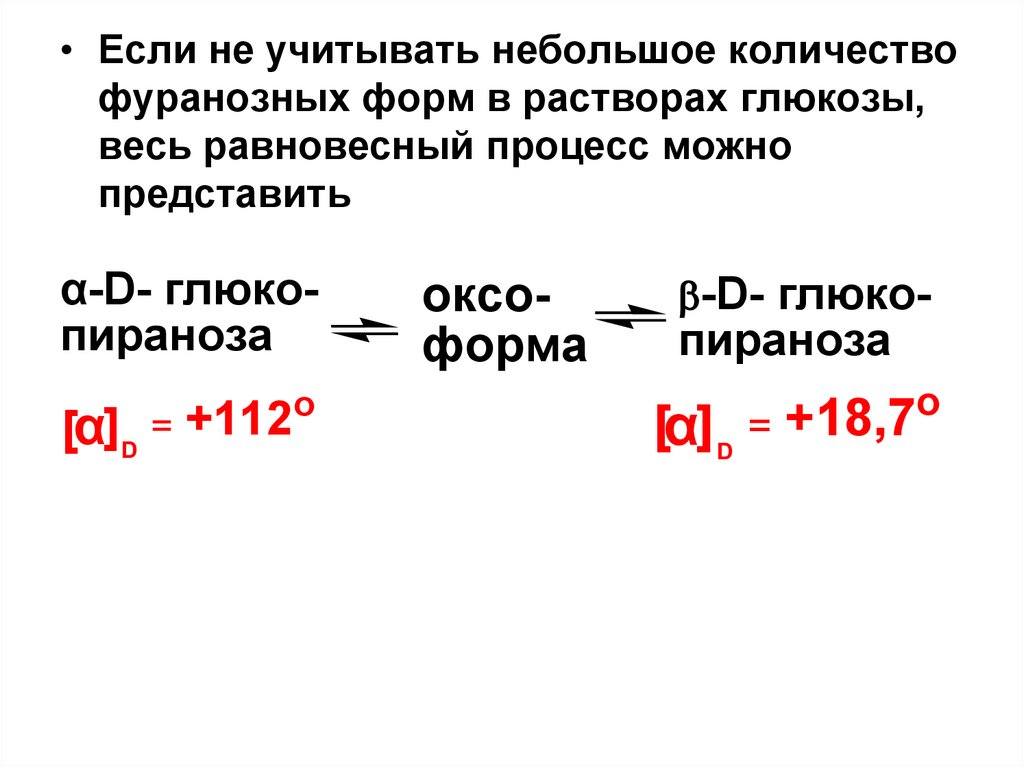
• Если не учитывать небольшое количествофуранозных форм в растворах глюкозы,
весь равновесный процесс можно
представить
α-D- глюкопираноза
[α]D = +112
o
оксоформа
-D- глюко-
пираноза
o
[α] D = +18,7
38.
Поскольку α- и β-формы глюкозы имеютразличную оптическую активность, а
концентрация их изменяется до
установления равновесия, то изменяется и
угол вращения.
Явление самопроизвольного изменения
угла вращения плоскости поляризации
света при стоянии свежеприготовленного
раствора углеводов получило название
«мутаротация»
39.
МС в соответствии состроением могут проявлять
как свойства карбонильных
соединений,
так и свойства спиртов
и полуацеталей.
40.
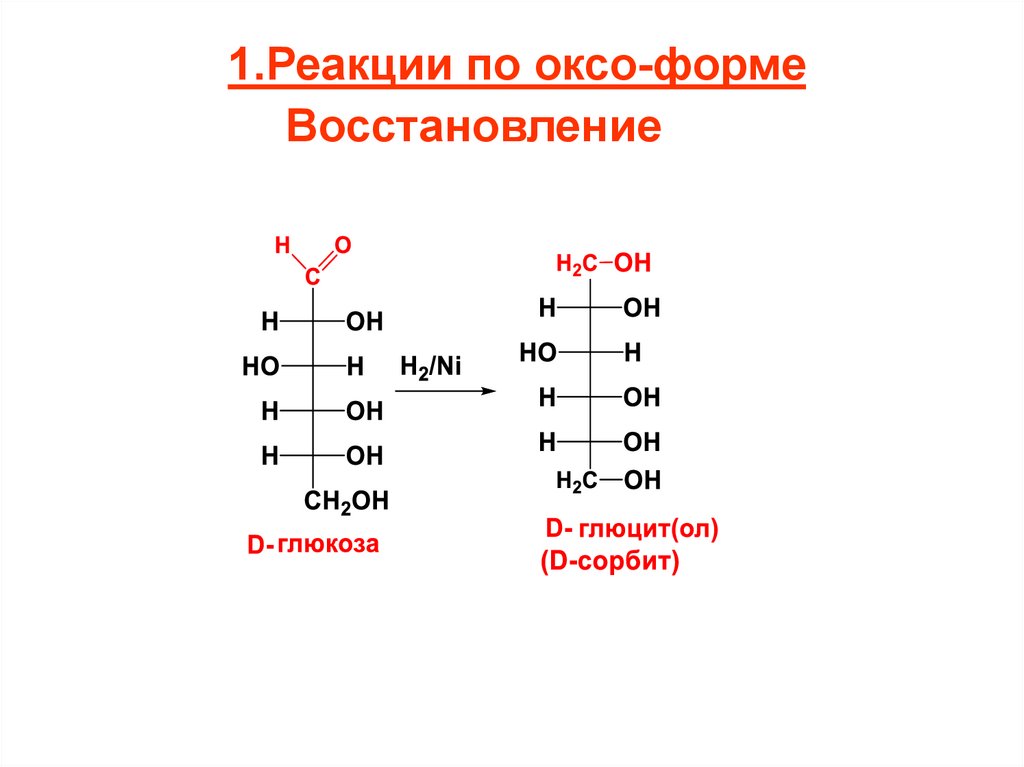
1.Реакции по оксо-формеВосстановление
41.
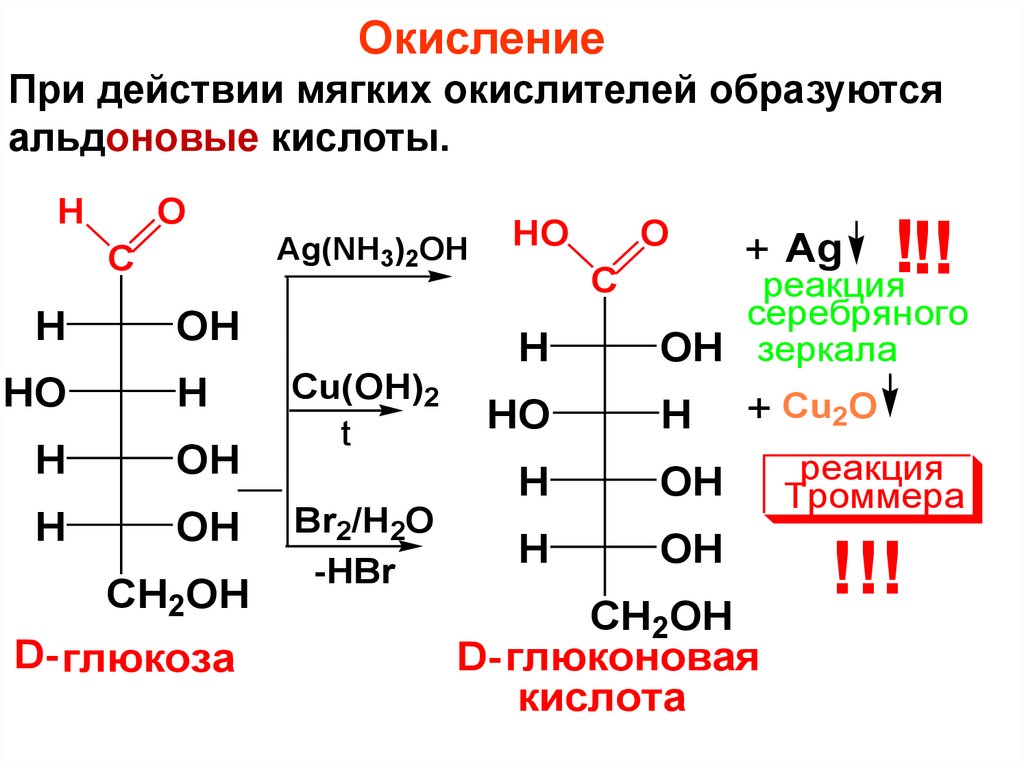
ОкислениеПри действии мягких окислителей образуются
альдоновые кислоты.
H
O
Ag(NH3)2OH
C
H
OH
HO
H
H
OH
H
OH
CH2OH
D- глюкоза
HO
C
H
Cu(OH)2
t
Br2/H2O
-HBr
O
!
!!
реакция
+ Ag
серебряного
OH зеркала
HO
H
H
OH
H
OH
+ Cu2O
CH2OH
D- глюконовая
кислота
реакция
Троммера
!!!
42.
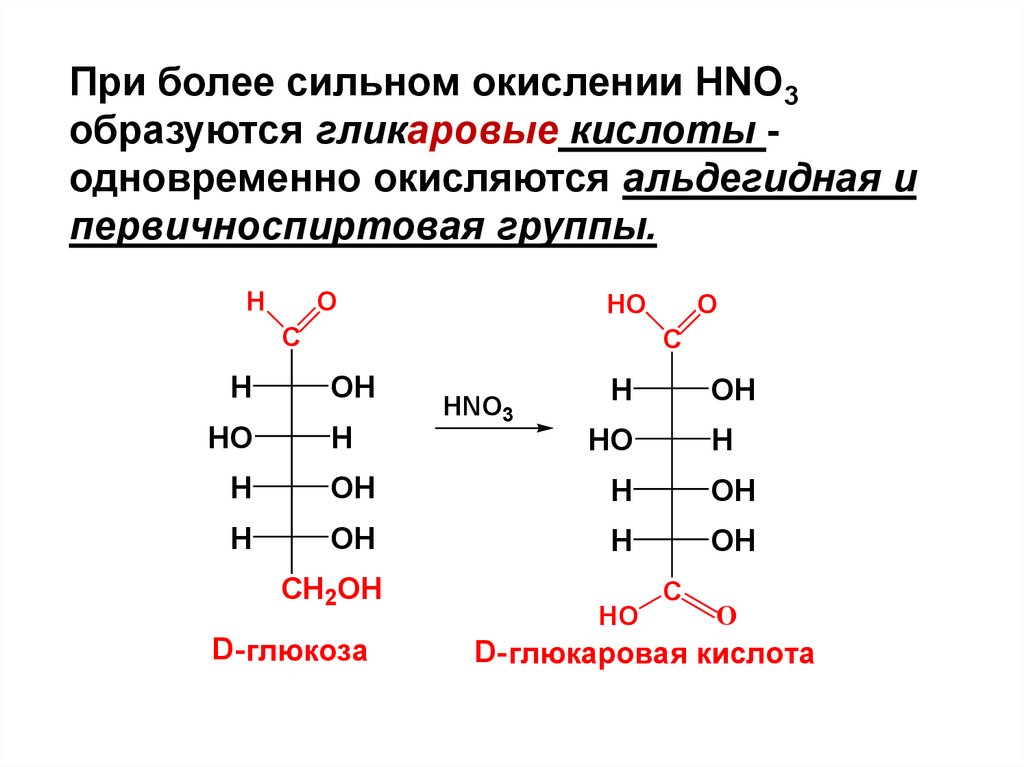
При более сильном окислении HNO3образуются гликаровые кислоты одновременно окисляются альдегидная и
первичноспиртовая группы.
H
O
HO
C
O
C
H
OH
HO
H
OH
H
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D- глюкоза
HNO3
C
HO
O
D- глюкаровая кислота
43.
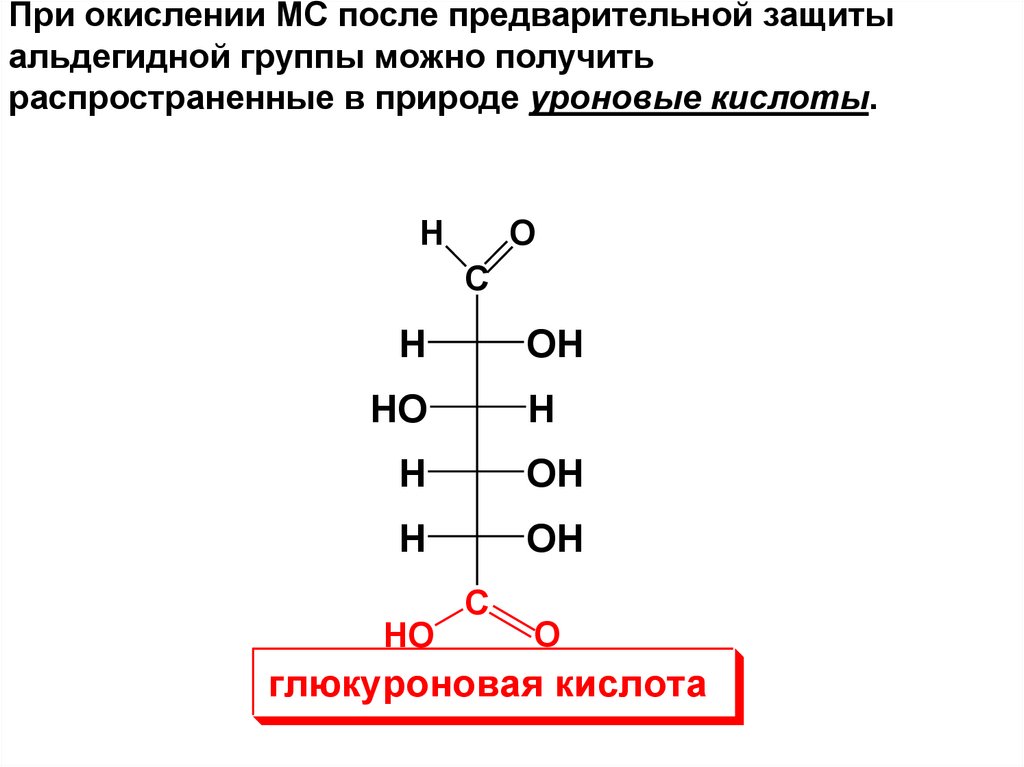
При окислении МС после предварительной защитыальдегидной группы можно получить
распространенные в природе уроновые кислоты.
H
O
C
H
OH
HO
H
H
OH
H
OH
C
HO
O
глюкуроновая кислота
44.
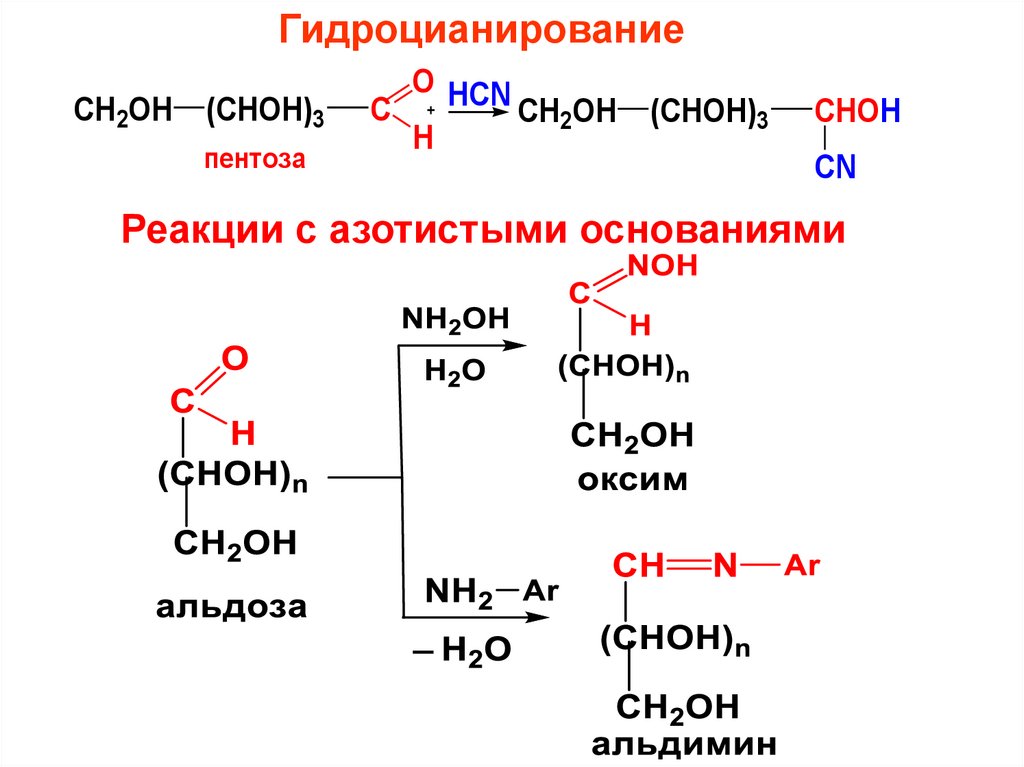
ГидроцианированиеCH2OH (CHOH)3
пентоза
C
O HCN
H
CH2OH (CHOH)3
CHOH
CN
Реакции с азотистыми основаниями
45.
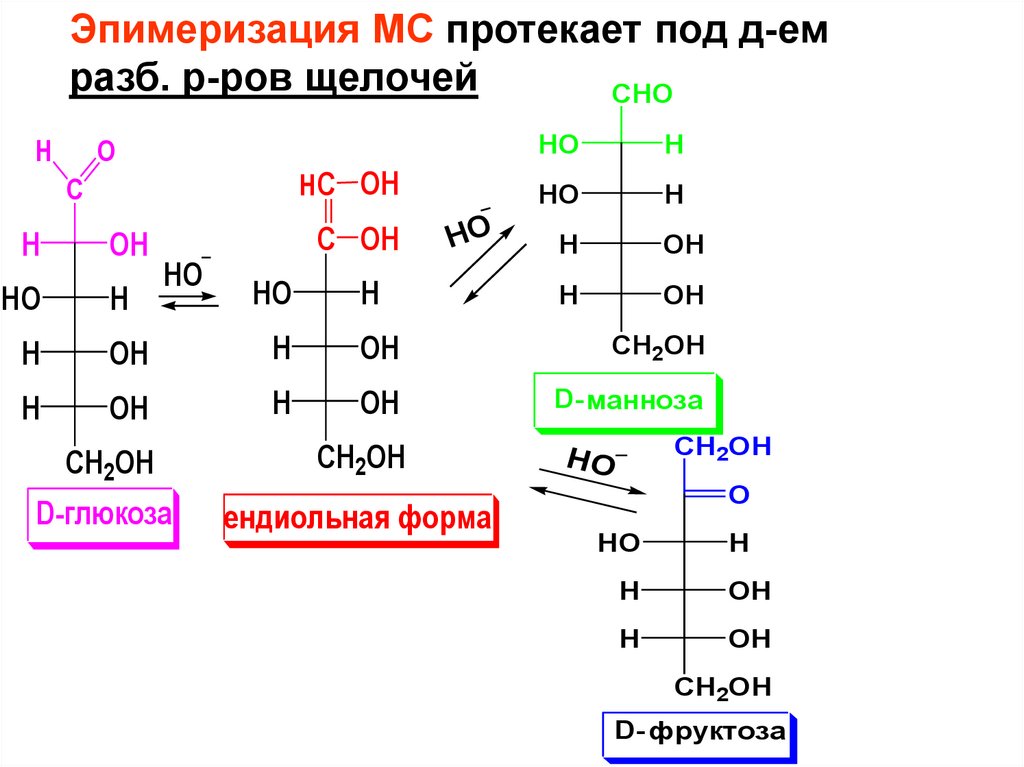
Эпимеризация МС протекает под д-емразб. р-ров щелочей
CHO
H
O
HC OH
C
H
OH
HO
H
H
H
HO
C OH
HO
HO
H
HO
H
H
OH
H
OH
HO
H
OH
H
OH
CH2OH
OH
H
OH
D- манноза
CH2OH
CH2OH
D-глюкоза
ендиольная форма
CH2OH
HO
O
HO
H
H
OH
H
OH
CH2OH
D- фруктоза
46.
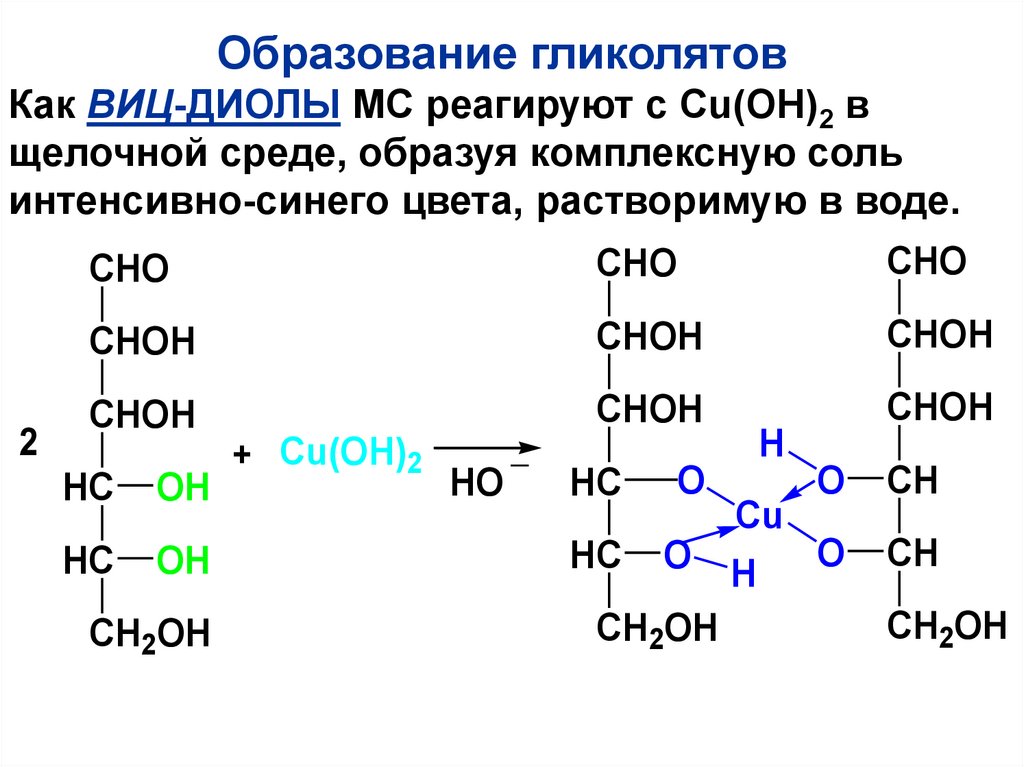
Образование гликолятовКак ВИЦ-ДИОЛЫ МС реагируют с Сu(OH)2 в
щелочной среде, образуя комплексную соль
интенсивно-синего цвета, растворимую в воде.
2
CHO
CHO
CHO
CHOH
CHOH
CHOH
CHOH
CHOH
CHOH
HC
OH
HC
OH
CH2OH
+ Cu(OH)2
HO
_
HC
O
HC
O
CH2OH
H
Cu
H
O
CH
O
CH
CH2OH
47.
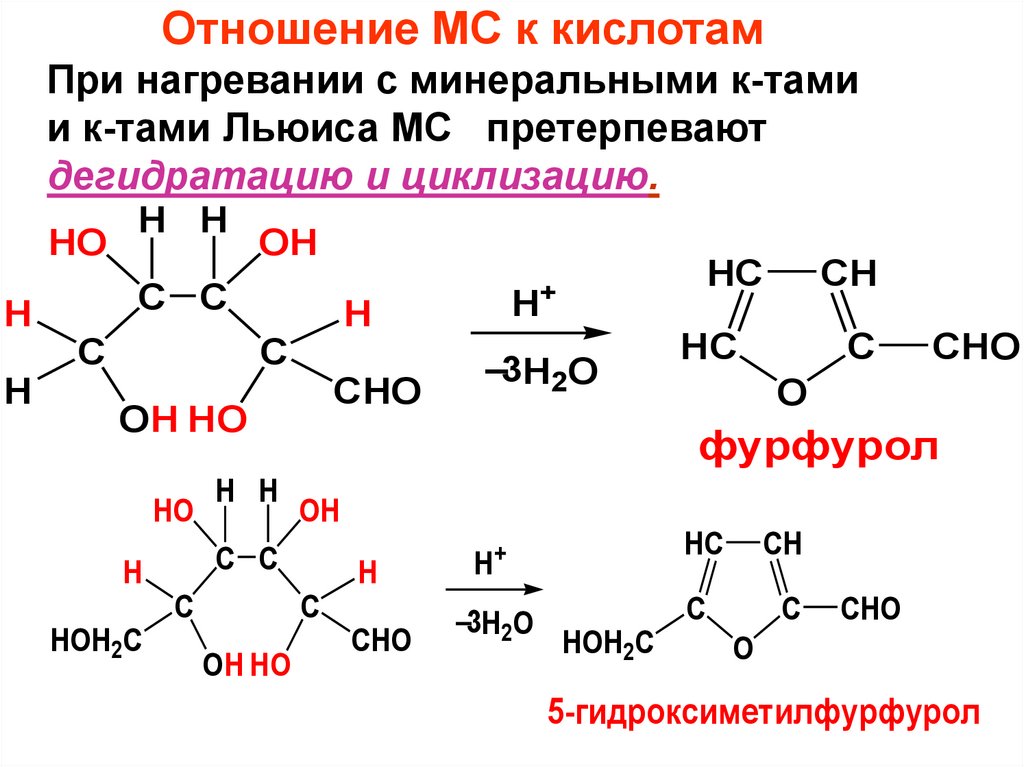
Отношение МС к кислотамПри нагревании с минеральными к-тами
и к-тами Льюиса МС претерпевают
дегидратацию и циклизацию.
HO
H H
C C
H
C
H
OH
H
H
CHO
_3H O
2
C
OH HO
HO
H H
C
HOH2C
HC
C
CHO
O
OH
H
H+
HC
CH
C
C
CHO
_3H O
2
C
OH HO
CH
фурфурол
C C
H
HC
+
HOH2C
CHO
O
5-гидроксиметилфурфурол
48.
2. РЕАКЦИИ ПО ОН- группамОН разные по реакционной способности:
у С1 – гликозидный наиболее
реакционноспособный,
у С6 – первичный спиртовый,
у С2-С4 – вторичные спиртовые.
49.
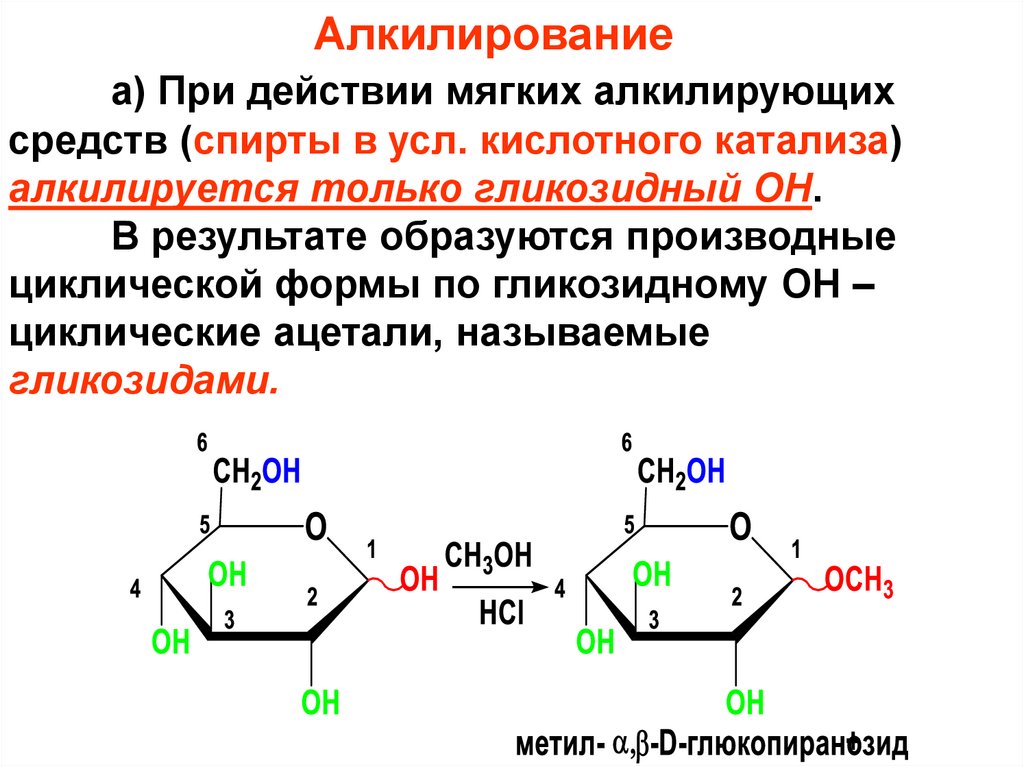
Алкилированиеа) При действии мягких алкилирующих
средств (спирты в усл. кислотного катализа)
алкилируется только гликозидный ОН.
В результате образуются производные
циклической формы по гликозидному ОН –
циклические ацетали, называемые
гликозидами.
50.
Свойства гликозидовПоскольку в гликозидах отсутствует
полуацетальный (гликозидный) ОН, то они
существуют только в циклической форме.
Гликозиды не дают р-ции на
карбонильную группу.
Гликозиды являются ацеталями – простыми
эфирами гемдиолов, поэтому они, как и
обычные простые эфиры, устойчивы к
действию щелочей,
но в отличие от простых эфиров легко
гидролизуются в кислой среде с образованием
МС и неуглеводной компоненты ( агликона).
51.
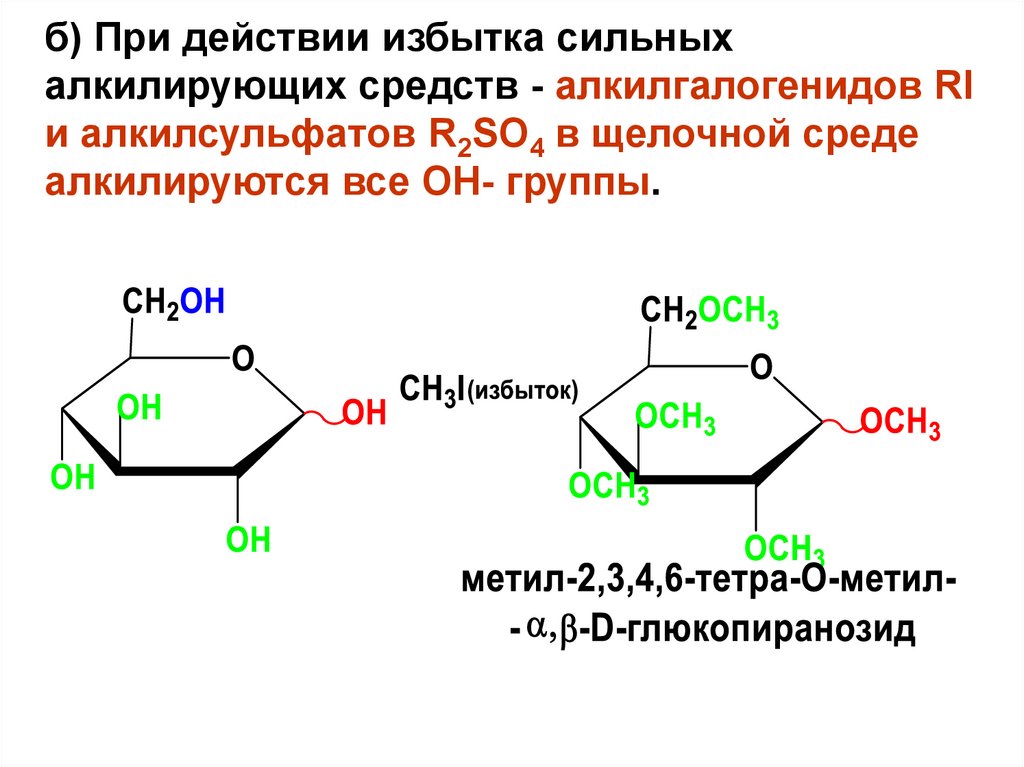
б) При действии избытка сильныхалкилирующих средств - алкилгалогенидов RI
и алкилсульфатов R2SO4 в щелочной среде
алкилируются все ОН- группы.
52.
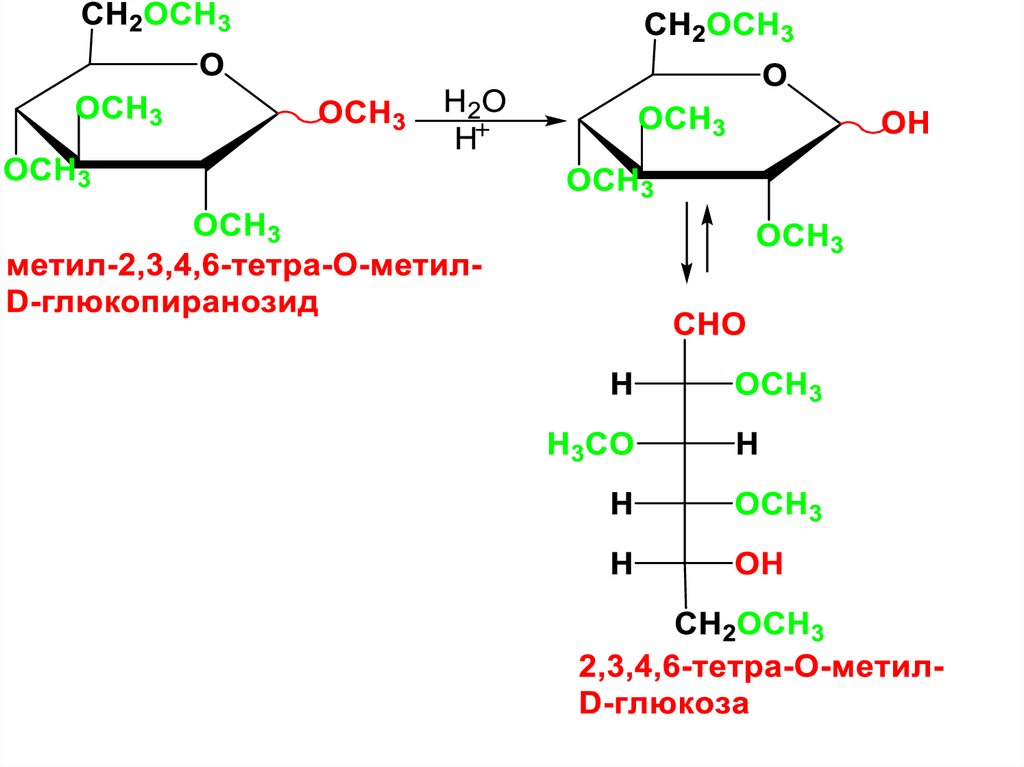
Свойства алкильных производныхПоскольку производные у С2-С4,С6 –
простые эфиры, то они не подвергаютя
гидролизу в разб. кислотах.
Производное у С1 – гликозид,
гидролизуется.
При этом, высвобождается
гликозидный ОН и появляется
возможность для раскрытия цикла с
образованием оксоформы .
53.
54.
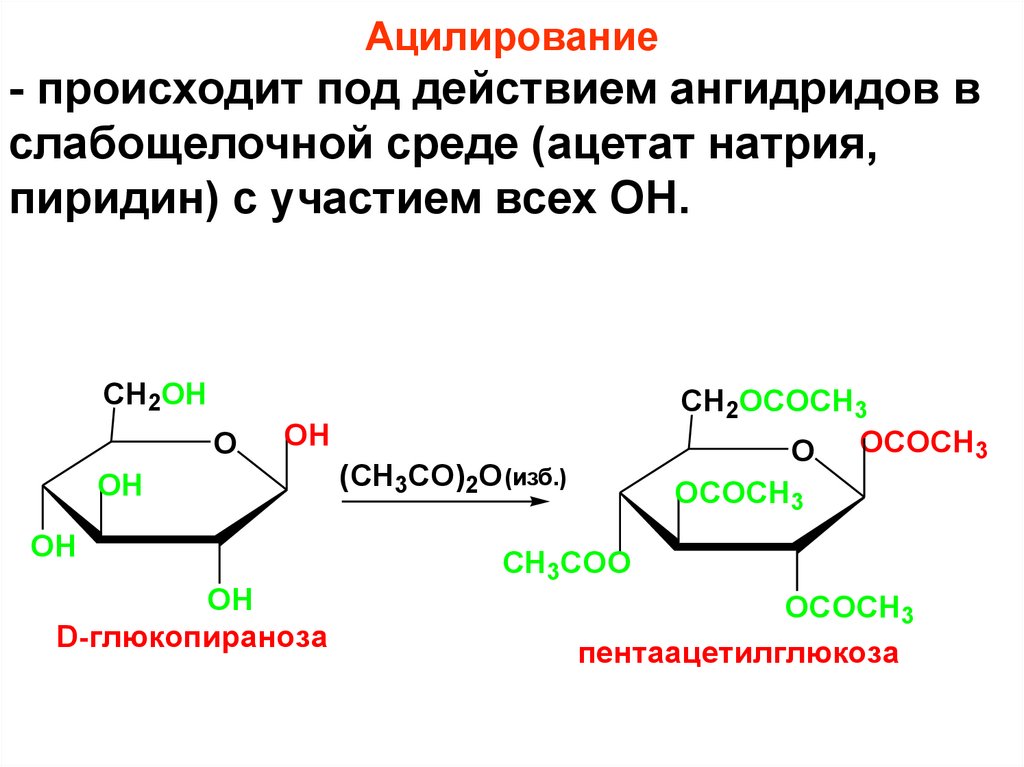
Ацилирование- происходит под действием ангидридов в
слабощелочной среде (ацетат натрия,
пиридин) с участием всех ОН.
CH2OH
O
CH2OCOCH3
O OCOCH3
OH
OH
OH
OH
D-глюкопираноза
(CH3CO)2O (изб.)
OCOCH3
CH3COO
OCOCH3
пентаацетилглюкоза
55.
ДИСАХАРИДЫВозможно 2 типа связывания остатков МС в ДС
В образовании связи между МС
принимают участие обязательно
гликозидный ОН от одной молекулы,
а от второй – спиртовый(1)
или гликозидный (2).
В 1-ом варианте связь между МС
называют моногликозидной, а образующийся
ДС – восстанавливающим
во 2-ом – связь между МС называют
дигликозидной, а ДС –невосстанавливающим
56.
Химические свойства- обусловлены наличием
• спиртовых ОН
• гликозидной связи
• для восстанавливающих ДС - и
полуацетального ОН.
57.
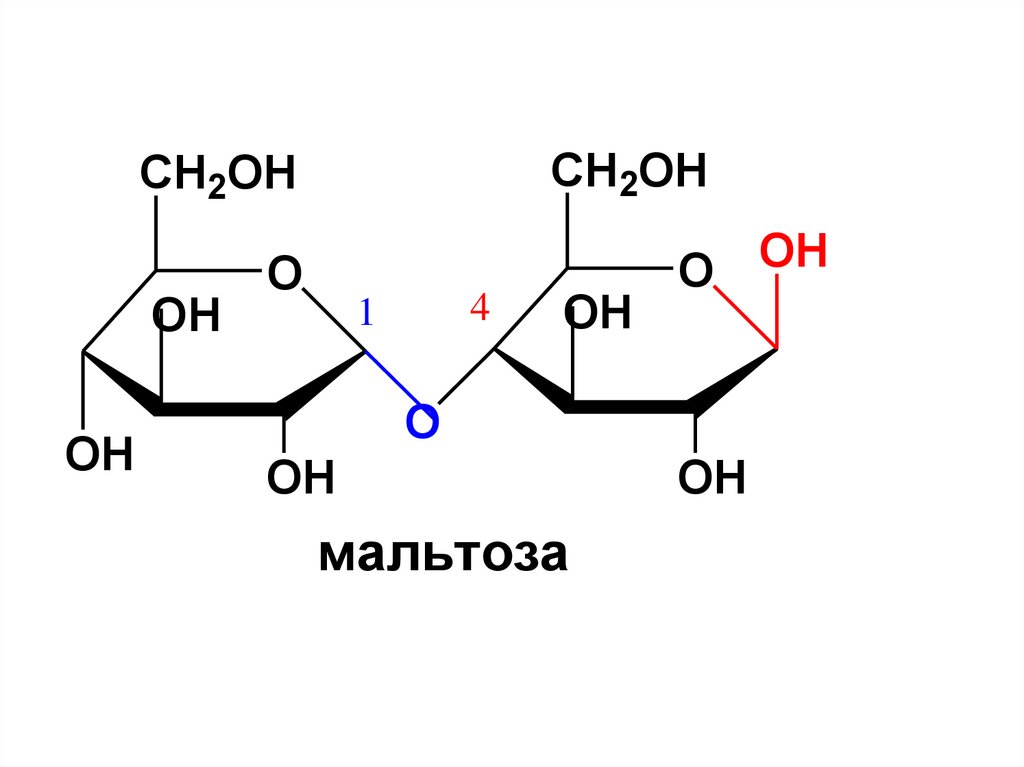
Восстанавливающие ДСМальтоза (солодовый сахар).
Образуется при частичном кислотном и
ферментативном гидролизе крахмала.
Мальтоза состоит из остатков
α-D-глюкопиранозы, соединенных между
собой 1,4- α-гликозидной связью, т. е. в
образовании связи участвует гликозидный ОН у С1
атома одной молекулы глюкозы и спиртовый ОН у С4
второй молекулы глюкозы.
58.
CH2OHCH2OH
OH
OH
O
4
1
OH
O OH
O
OH
мальтоза
OH
59.
Мальтоза подобно МСблагодаря наличию гликозидного ОН:
мутаротирует в р-рах,
дает типичные реакции по альдегидной
гр., в том числе восстанавливает
оксиды серебра и меди.
Отсюда и название –
восстанавливающие ДС.
60.
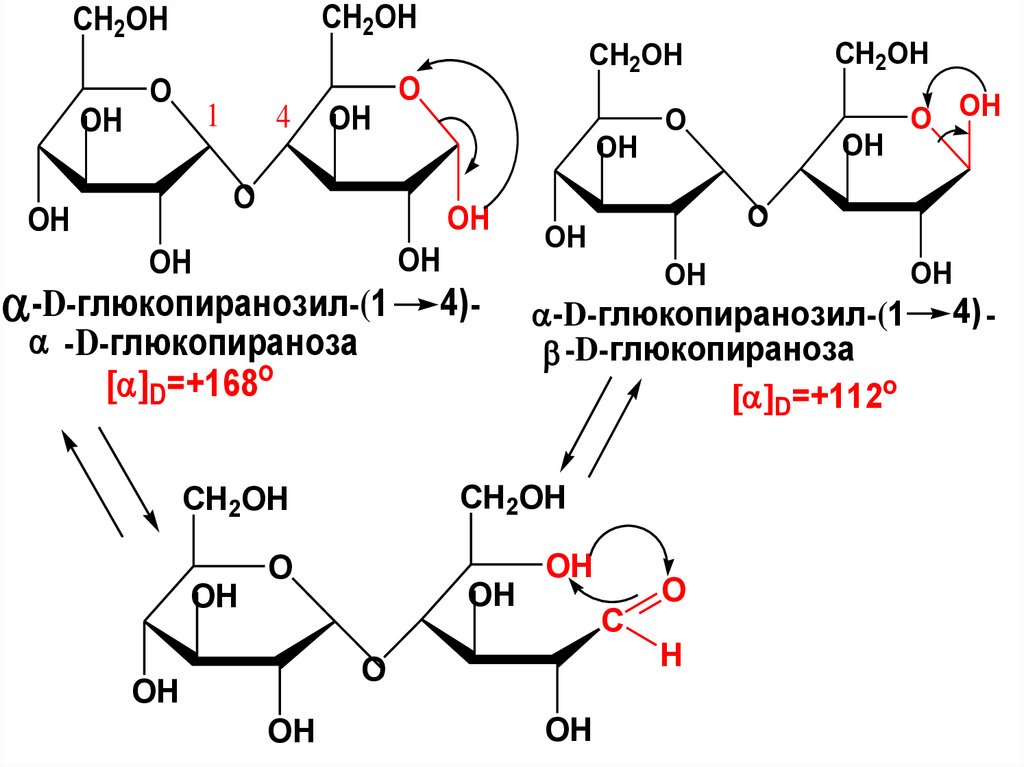
CH2OHCH2OH
OH
O
1
4
OH
O
OH
O
OH
OH
OH
-D-глюкопиранозил-(1
-D-глюкопираноза
D=+168o
OH
OH
4) -
O
OH
OH
OH
OH
-D-глюкопиранозил-(1
-D-глюкопираноза
D=+112o
OH
O
C
H
OH
O OH
O
OH
O
OH
O
CH2OH
CH2OH
CH2OH
CH2OH
OH
4) -
61.
Гидроксильные гр. мальтозыучаствуют в р-циях алкилирования,
ацилирования, причем под действием
спиртов в усл. кислотного катализа
алкилируется только гликозидный ОН.
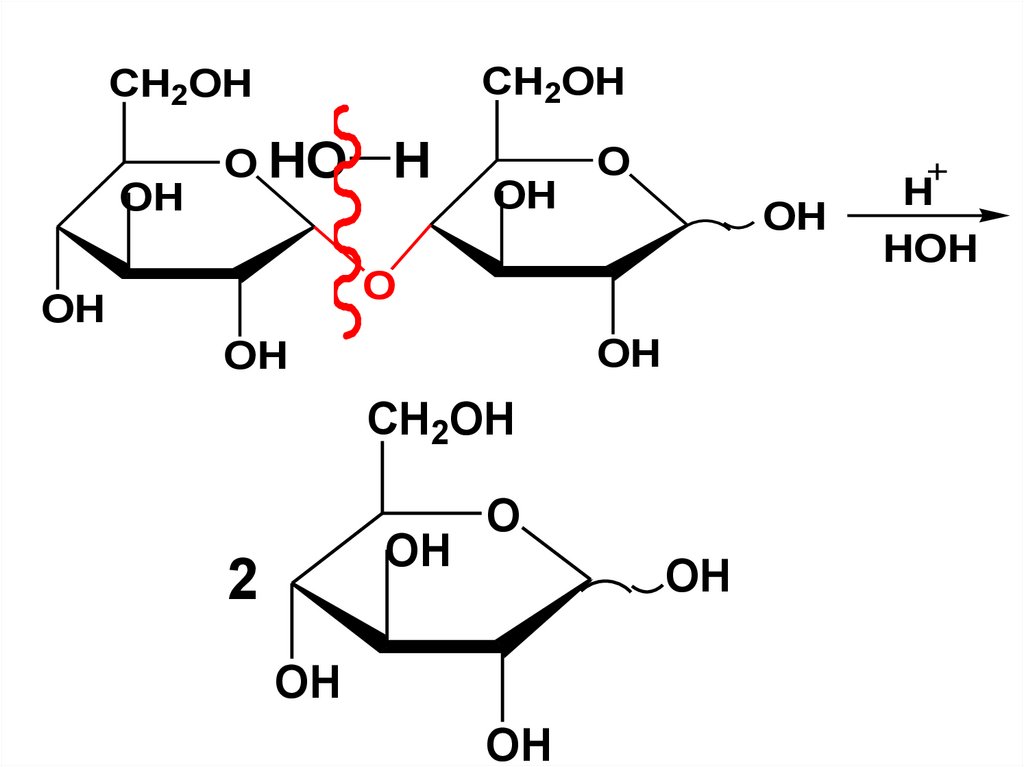
Мальтоза подвергается кислотному
гидролизу с расщеплением гликозидной
связи с образованием 2 молекул Dглюкозы.
62.
CH2OHCH2OH
OH
O HO
H
OH
O
OH
O
OH
OH
OH
CH2OH
OH
2
O
OH
OH
OH
H
HOH
63.
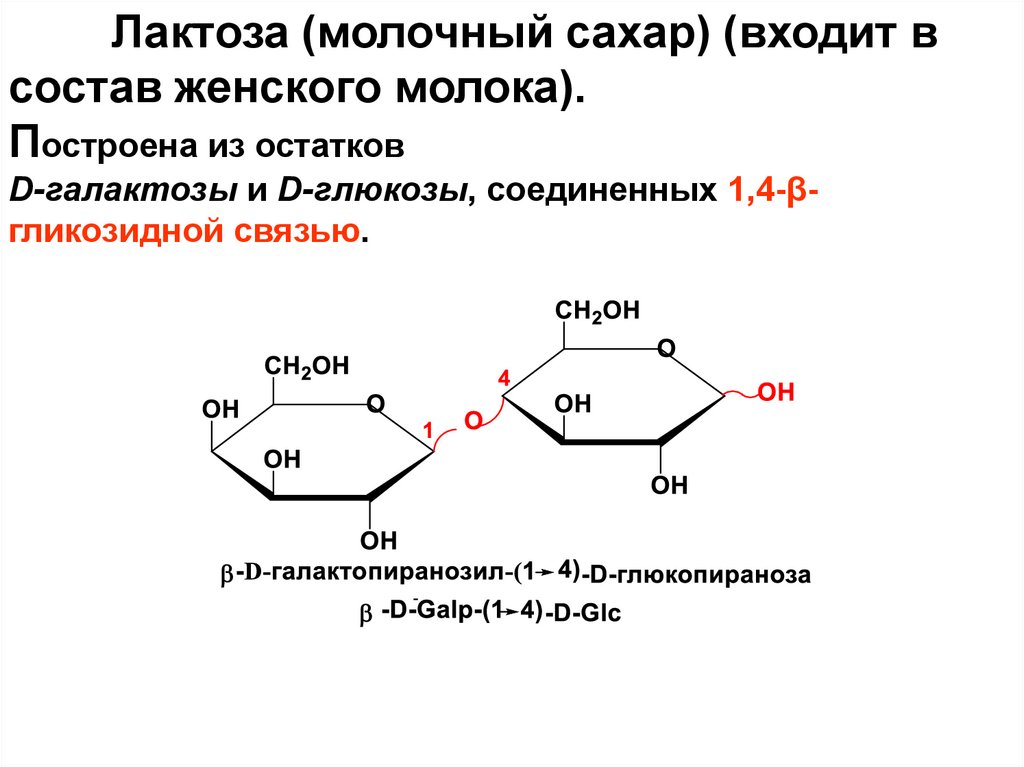
Лактоза (молочный сахар) (входит всостав женского молока).
Построена из остатков
D-галактозы и D-глюкозы, соединенных 1,4-βгликозидной связью.
64.
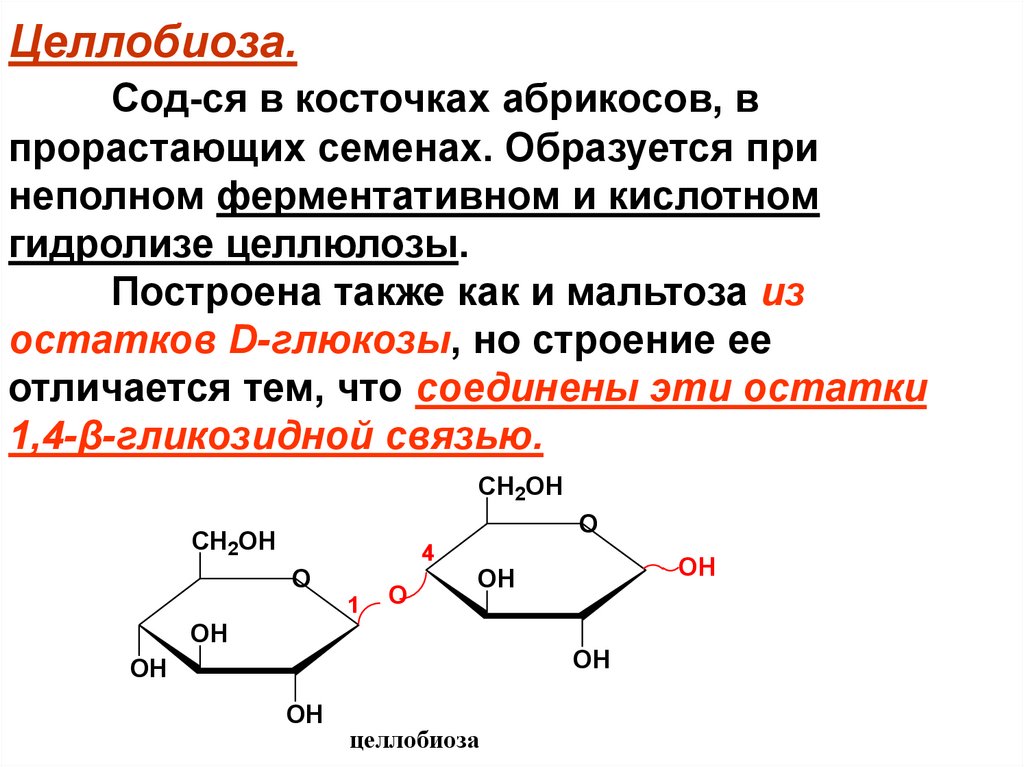
Целлобиоза.Сод-ся в косточках абрикосов, в
прорастающих семенах. Образуется при
неполном ферментативном и кислотном
гидролизе целлюлозы.
Построена также как и мальтоза из
остатков D-глюкозы, но строение ее
отличается тем, что соединены эти остатки
1,4-β-гликозидной связью.
CH2OH
O
CH2OH
4
O
1
O
OH
OH
OH
OH
OH
OH
целлобиоза
65.
Целлобиоза также являетсявосстанавливающим ДС, подвергается
мутаротации.
Гидролизуется с образованием 2
молекул глюкозы.
66.
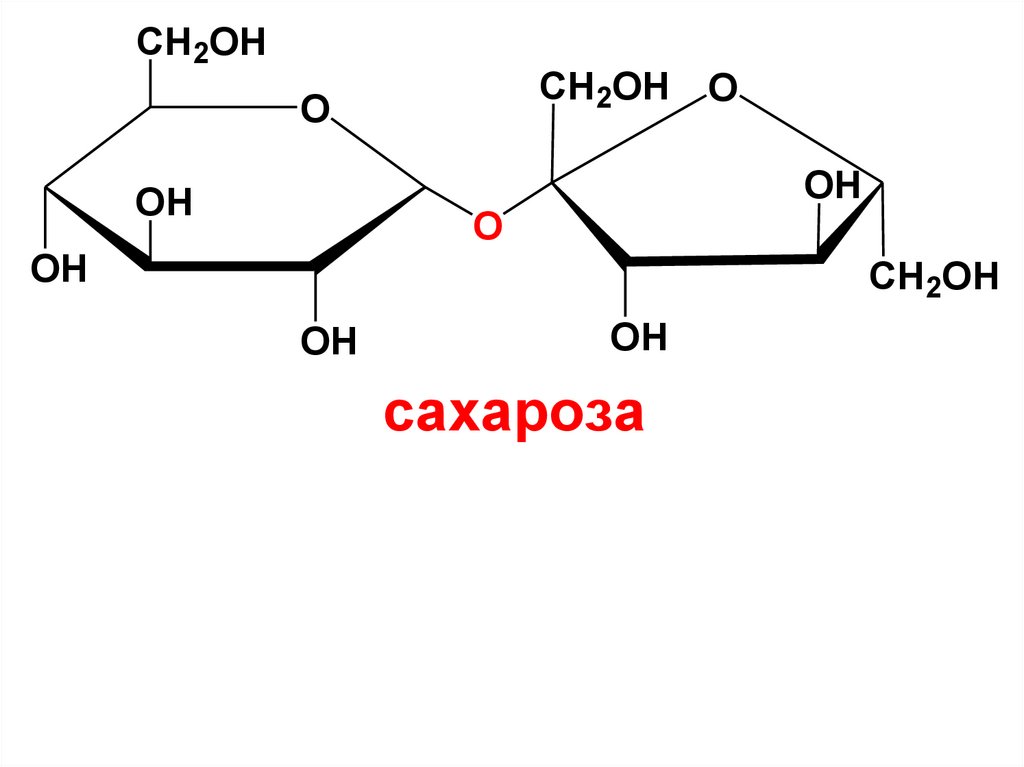
Невосстанавливающие ДССахароза. Это обычный сахар, который
получают из сахарной свеклы и тростника.
Содержится в плодах, семенах, листьях и соке
многих растений. Х.р. в воде, незначительно в
спирте.
Молекула сахарозы состоит из остатков
α- D-глюкопиранозы и
β- D-фруктофуранозы,
соединенных между собой
α, β-дигликозидной связью
67.
CH2OHCH2OH O
O
OH
OH
O
OH
CH2OH
OH
OH
сахароза
68.
В молекуле сахарозы отсутствуетгликозидный ОН, поэтому невозможно
таутомерное превращение циклических форм в
открытые оксоформы.
По этой причине сахароза
не способна мутаротировать, восстанавливать
реактивы Фелинга и Толленса и не дает др.
реакций по карбонильной группе.
Сахароза вступает в реакции
по спиртовым ОН, образуя ряды простых и
сложных эфиров.
Сахароза гидролизуется по гликозидной
связи с образованием фруктозы и глюкозы.
69.
ПОЛИСАХАРИДЫКрахмал
Крахмал – главное запасное питательное
в-во растений. Образуется в растениях в
процессе фотосинтеза и откладывается в запас
преимущественно в корнях, клубнях, зернах, а
также в стеблях и листьях.
По составу крахмал неоднороден. ПС
крахмала делятся на 2 фракции: амилозу (1525%) и амилопектин (75-85%).
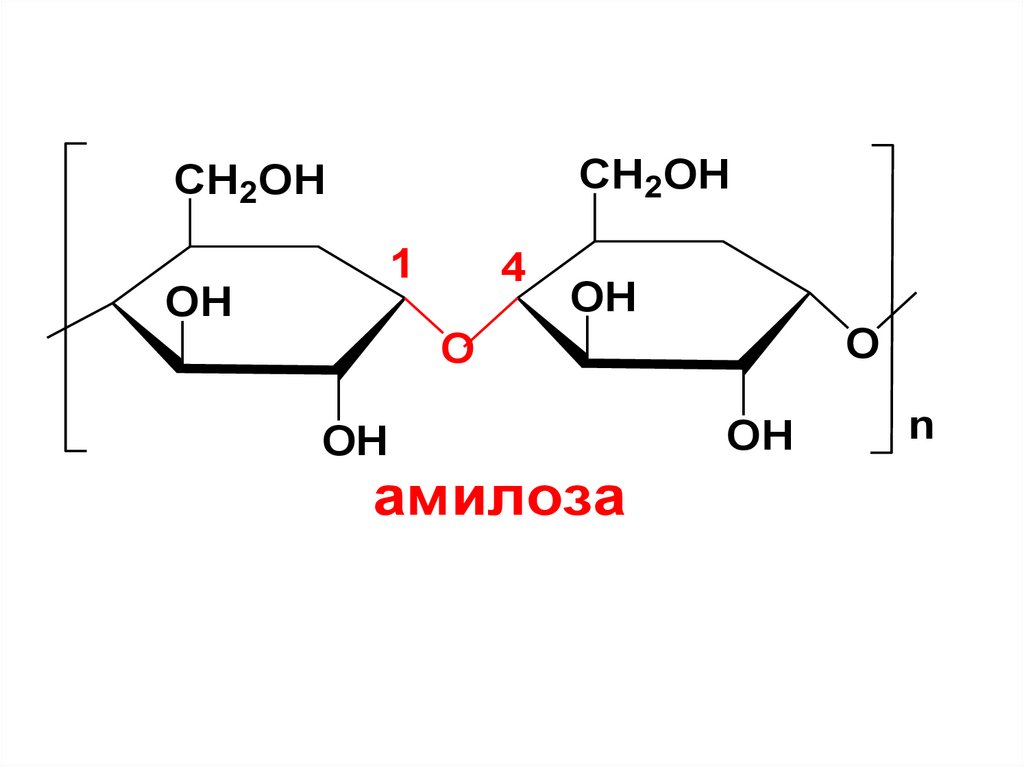
Амилоза – это линейный полимер D-глюкозы,
остатки которой соединены между собой 1,4- гликозидной связью.
70.
CH2OHCH2OH
1
4
OH
OH
O
O
OH
амилоза
OH
n
71.
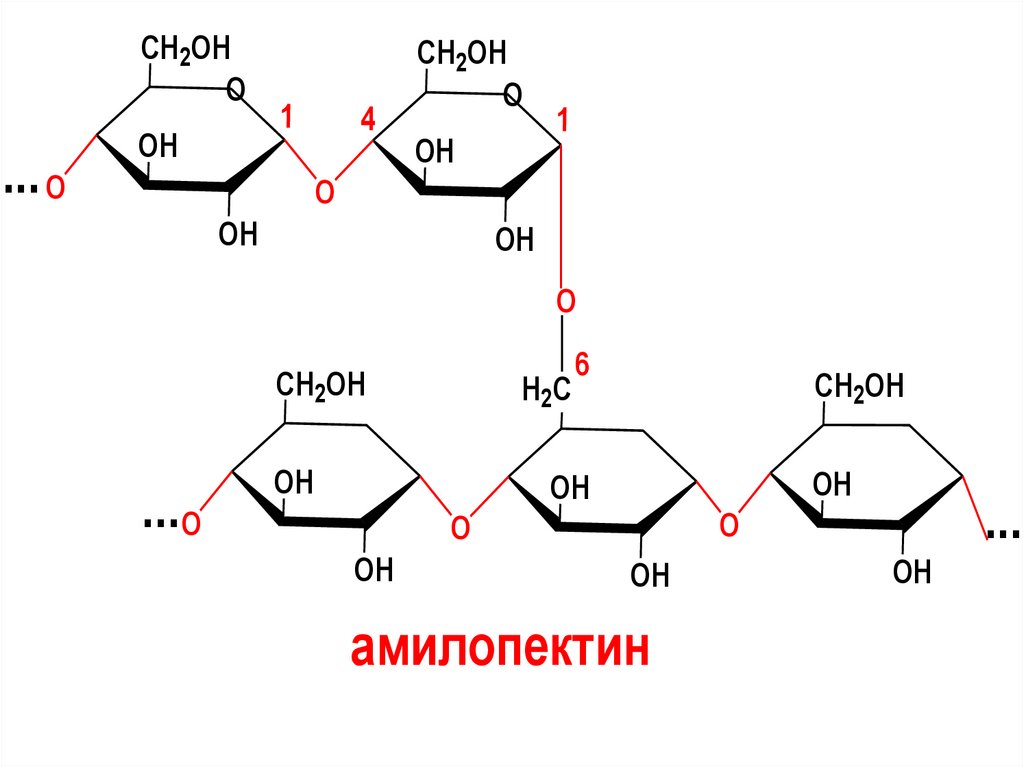
Амилопектин, как и амилоза построен изостатков D-глюкозы, связанных 1,4- гликозидной связью .
Однако молекулы амилопектина сильно
разветвлены . Цепи короткие, содержат
около 12-25 элементарных звеньев. Один
из концов каждой из этих цепей связан
гликозидной связью с С6 атомом другой
цепи.
72.
CH2OHO
... O
OH
1
4
CH2OH
O
1
OH
O
OH
OH
O
CH2OH
...O
H2C
OH
6
CH2OH
OH
OH
OH
...
O
O
OH
амилопектин
OH
73.
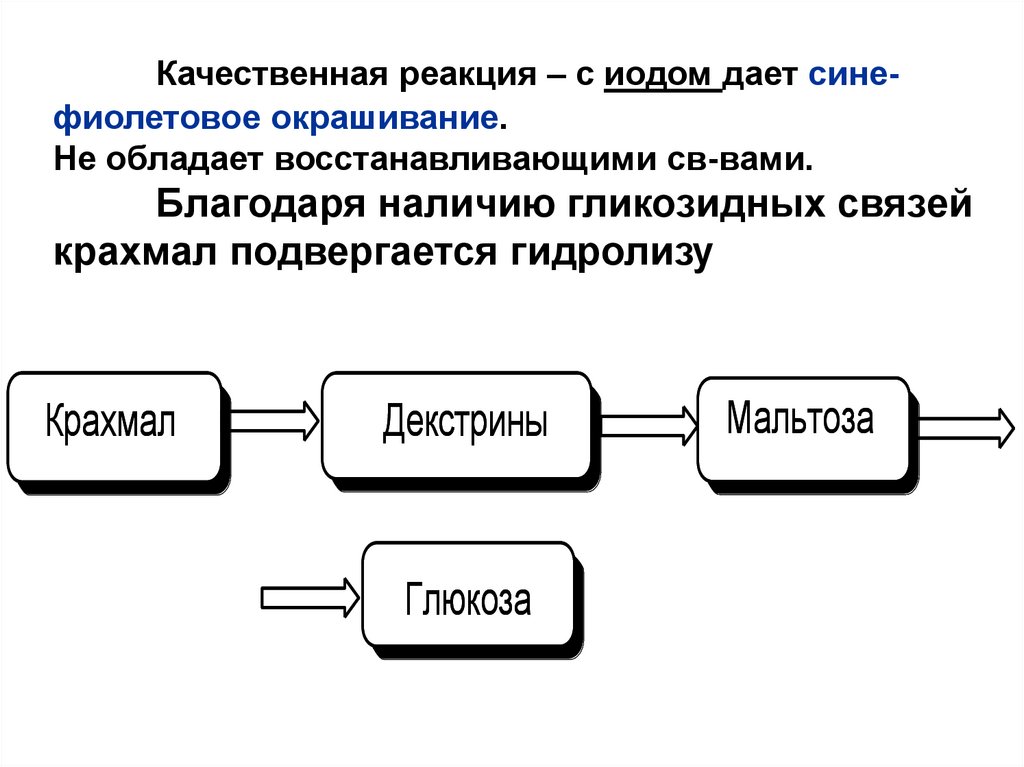
Качественная реакция – с иодом дает синефиолетовое окрашивание.Не обладает восстанавливающими св-вами.
Благодаря наличию гликозидных связей
крахмал подвергается гидролизу
Крахмал
Декстрины
Глюкоза
Мальтоза
74.
ЦЕЛЛЮЛОЗА (КЛЕТЧАТКА)(С6Н10О5)n
Один из наиболее распространенных
растительных полимеров, является
основной составной частью клеточных
стенок растений. Сод-ие Ц в древесине
составляет 50-70%.
Ц представляет собой линейный
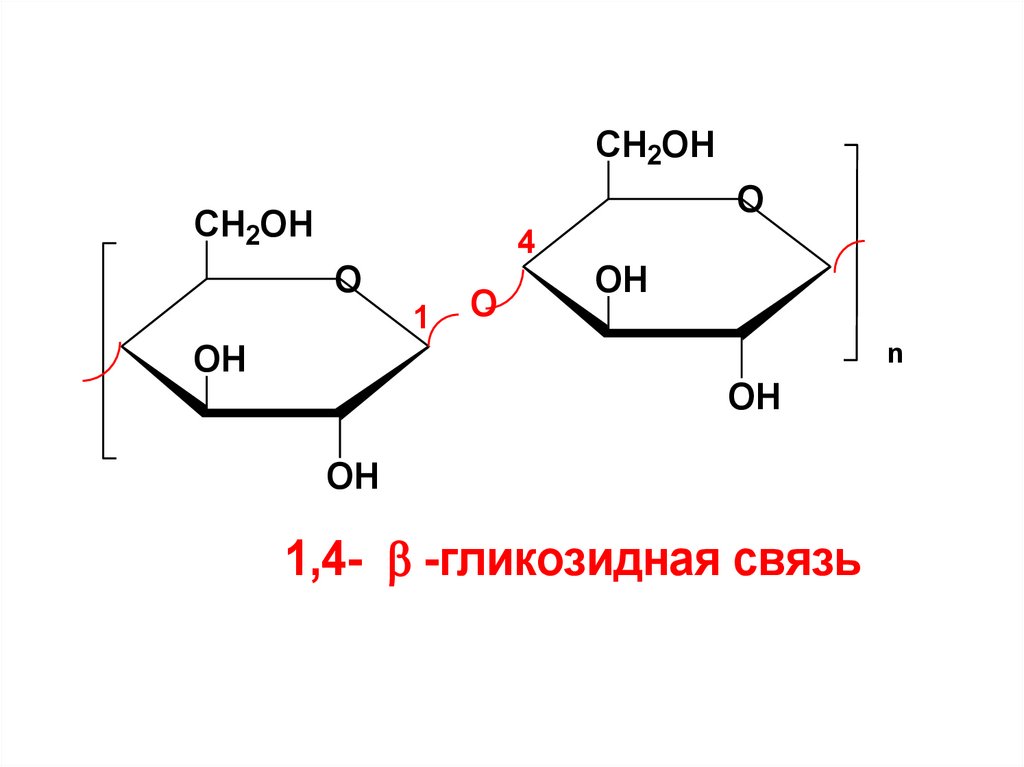
гомополисахарид, построенный из
остатков -D-глюкопиранозы,
соединенных между собой 1,4- гликозидной связью.
75.
CH2OHO
CH2OH
4
O
1
O
OH
n
OH
OH
OH
1,4- -гликозидная связь
76.
CH2OH.. O
O
HO
... H
OH
O
...
OH
O
CH2OH
O
77.
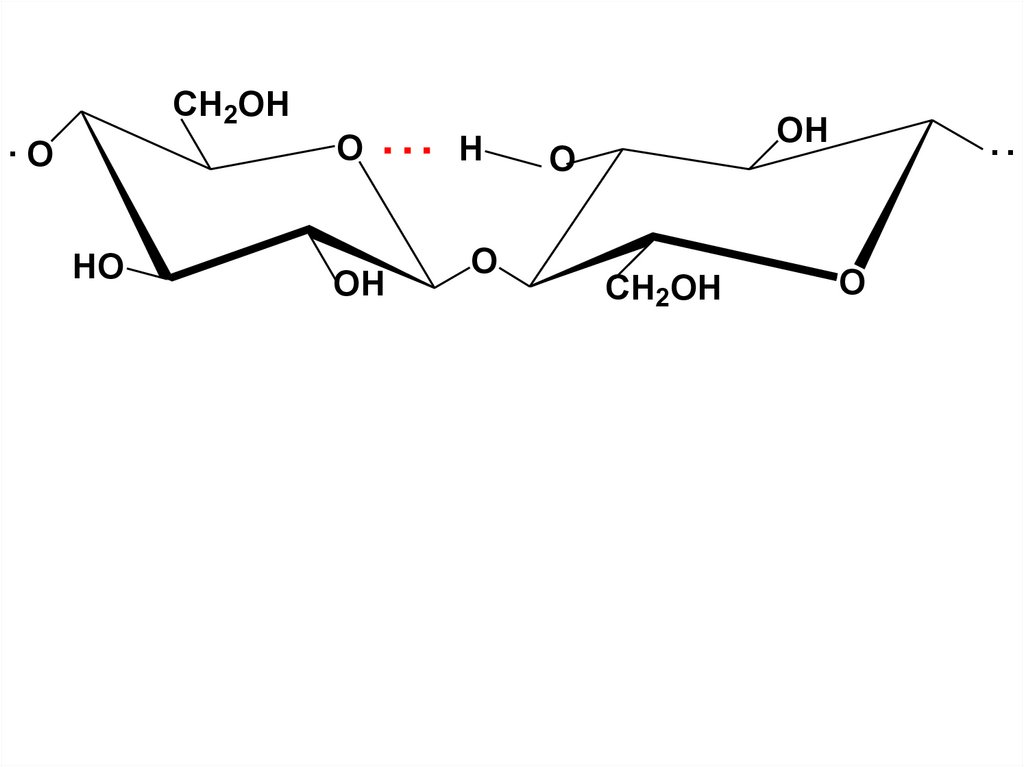
Макромолекула Ц имеет вид нити,спиралеобразно закрученной вокруг своей оси
и удерживаемой в таком положении
межмолекулярными Н-связями в пучки,
имеющие характер волокон. Это обеспечивает
особые механические св-ва Ц – ее высокую
прочность. Ц представляет собой белое в-во
волокнистого строения без вкуса и запаха. При
нагревании до 350оС подвергается
термическому разложению.
Ц не растворяется в воде, водных р-рах
щелочей, в разб. минеральных кислотах и в
обычных орг. растворителях.
Ц легко гидролизуется кислотами.
Продуктами гидролиза явл-ся:
78.
ЦеллюлозаЦеллодекстрины
Глюкоза
Применение Ц (см. уч.)
Целлобиоза

































 chemistry
chemistry








