Similar presentations:
Углеводы. Функции углеводов. Классификация
1.
УГЛЕВОДЫ2.
Функции углеводов:структурная (целлюлоза в
растениях, хитин в грибах);
энергетическая (крахмал в
растениях, гликоген в животных
организмах).
3.
Углеводы входят в состав жизненноважных веществ:
нуклеиновых кислот,
коферментов,
витаминов,
лекарственных средств.
4.
• Углеводы составляют до 80% сухоговещества массы растений и 2%
сухого вещества массы животных,
на долю углеводов приходится
около 0,5% массы человека.
• Животные организмы не способны
синтезировать углеводы и
получают их с различными
пищевыми продуктами
растительного происхождения.
5.
• В растениях углеводы образуются впроцессе реакции фотосинтеза,
• осуществляемого за счет солнечной
энергии с участием зеленого
пигмента растений хлорофилла
hv
6CO2 + 6H2O
C6H12O6 + 6O2
2867 кДж/моль
В результате накапливается
огромное количество
гомополисахаридов целлюлозы и
крахмала.
6.
• Некоторые растения накапливаютуникальный дисахарид сахарозу
(сахар), который в настоящее время
выделяют в очень больших
количествах.
• Моносахарид глюкоза содержится в
соках растений, плодах, фруктах.
• Запасы углеводов восполняются в
живой природе ежегодно в отличие
от невозобновляемых сырьевых
источников органических веществ
(нефть, газ, каменный уголь)
7.
Классификация• Углеводами называют группу природных
веществ, которые в соответствии с
химической классификацией являются
полигидроксиальдегидами или
полигидроксикетонами, либо
продуктами их поликонденсации.
8.
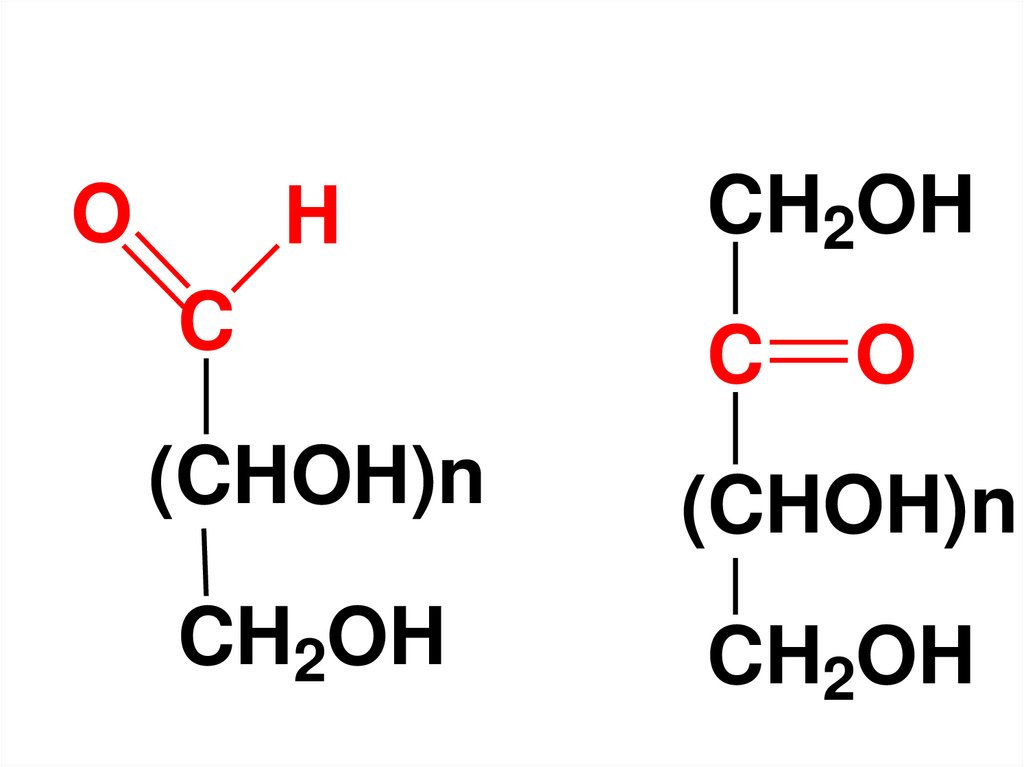
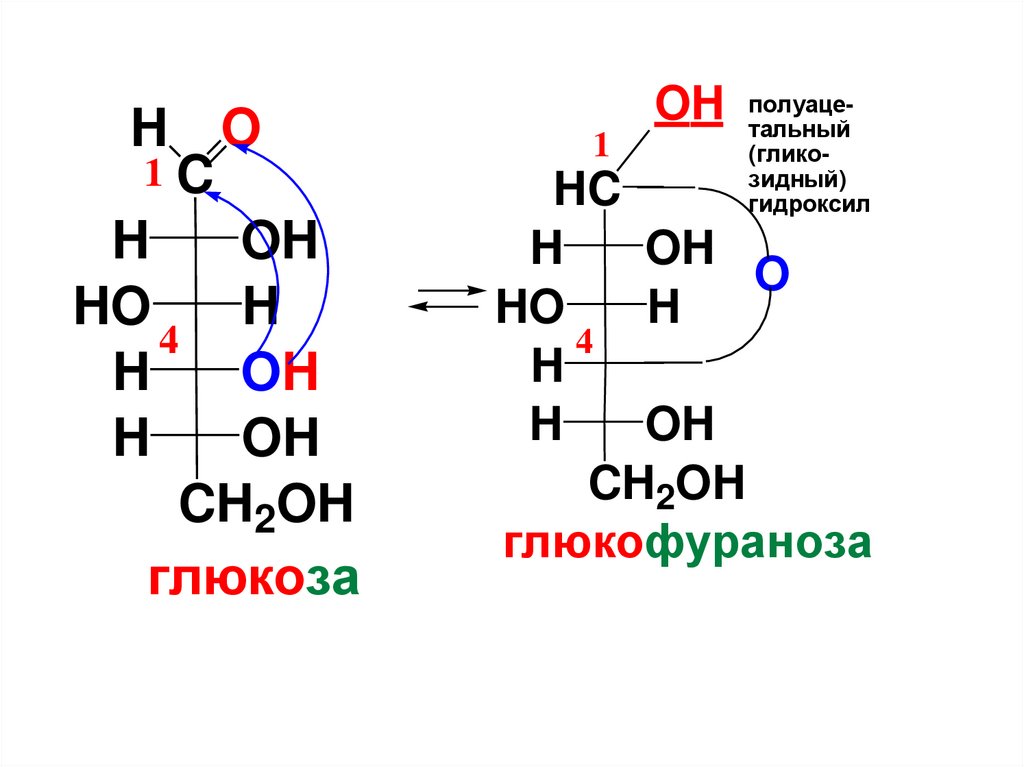
OH
CH2OH
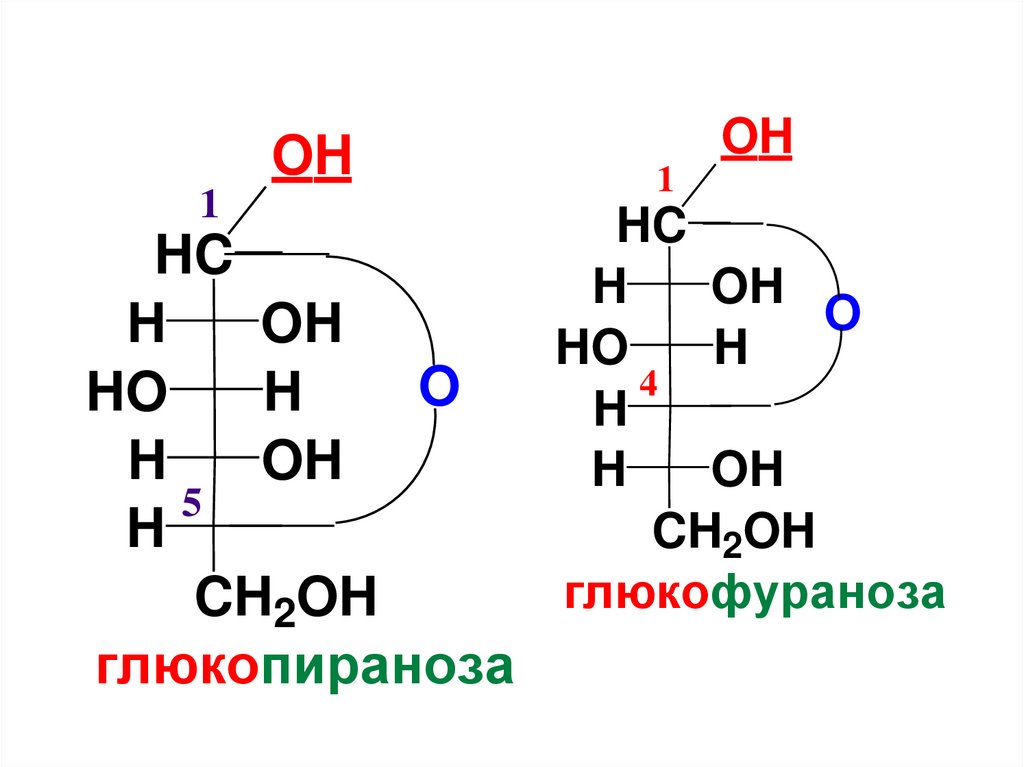
C
C
(CHOH)n
(CHOH)n
CH2OH
CH2OH
O
9.
• Название «углеводы» этисоединения получили потому, что
первые из известных
представителей имели состав
Сn(H2O)m.
Например:
• глюкоза С6Н12О6=6С•6Н2О,
• сахароза С12Н22О11=12С•11Н2О,
• крахмал (С6Н10О5)n=(6С•5Н2О)n.
10.
• Углеводы имеют и другие названия– «сахара» или «сахариды»
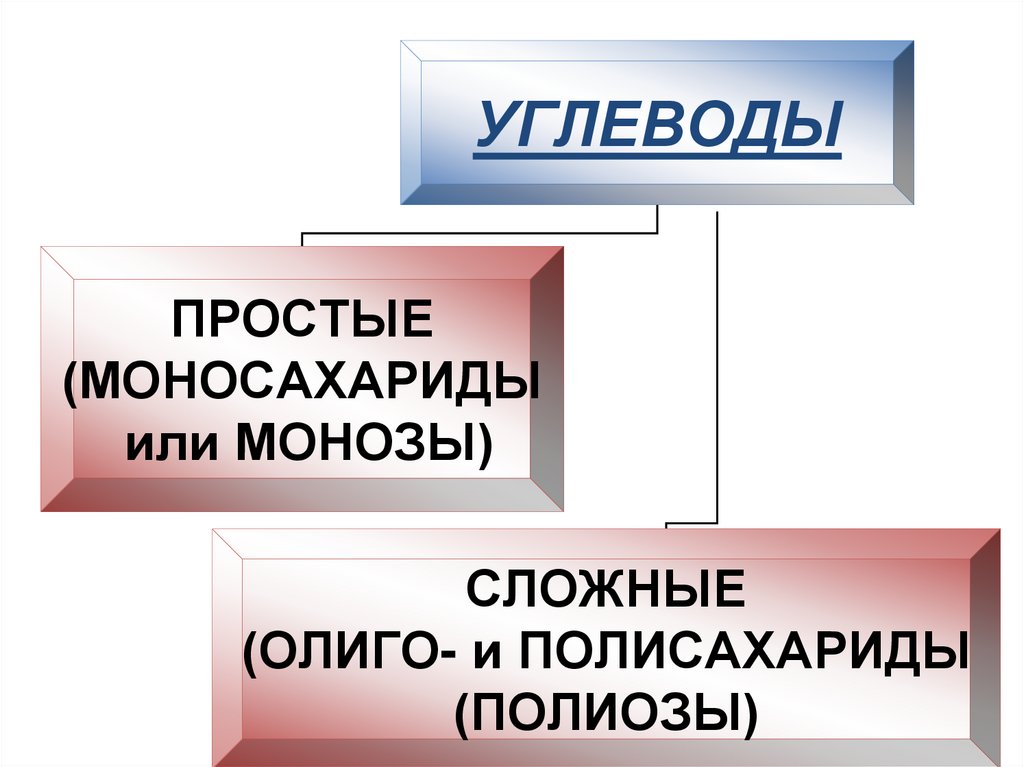
• Углеводы делят на 2 группы:
11.
УГЛЕВОДЫПРОСТЫЕ
(МОНОСАХАРИДЫ
или МОНОЗЫ)
СЛОЖНЫЕ
(ОЛИГО- и ПОЛИСАХАРИДЫ
(ПОЛИОЗЫ)
12.
I. Простые (моносахаридыили монозы)
• Моносахариды или монозы - не
гидролизуются до более простых
углеводов
13.
• II. Сложные (олигосахариды иполисахариды или полиозы)
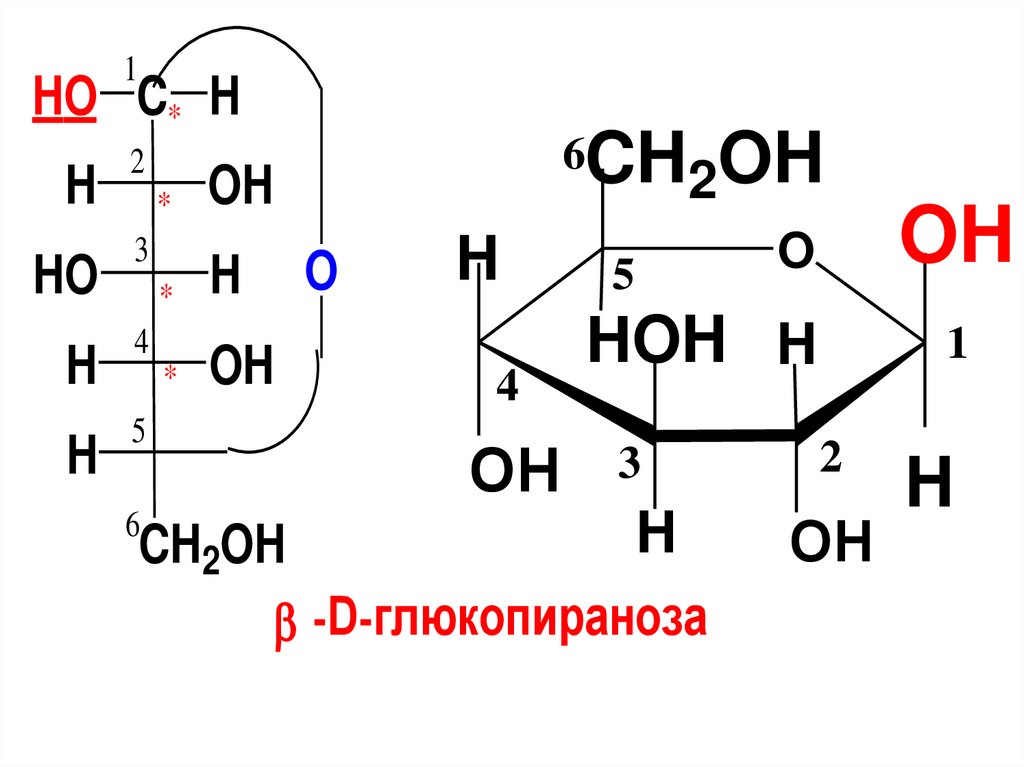
• Олигосахариды и
полисахариды (полиозы) –
способны гидролизоваться до более
простых углеводов.
14.
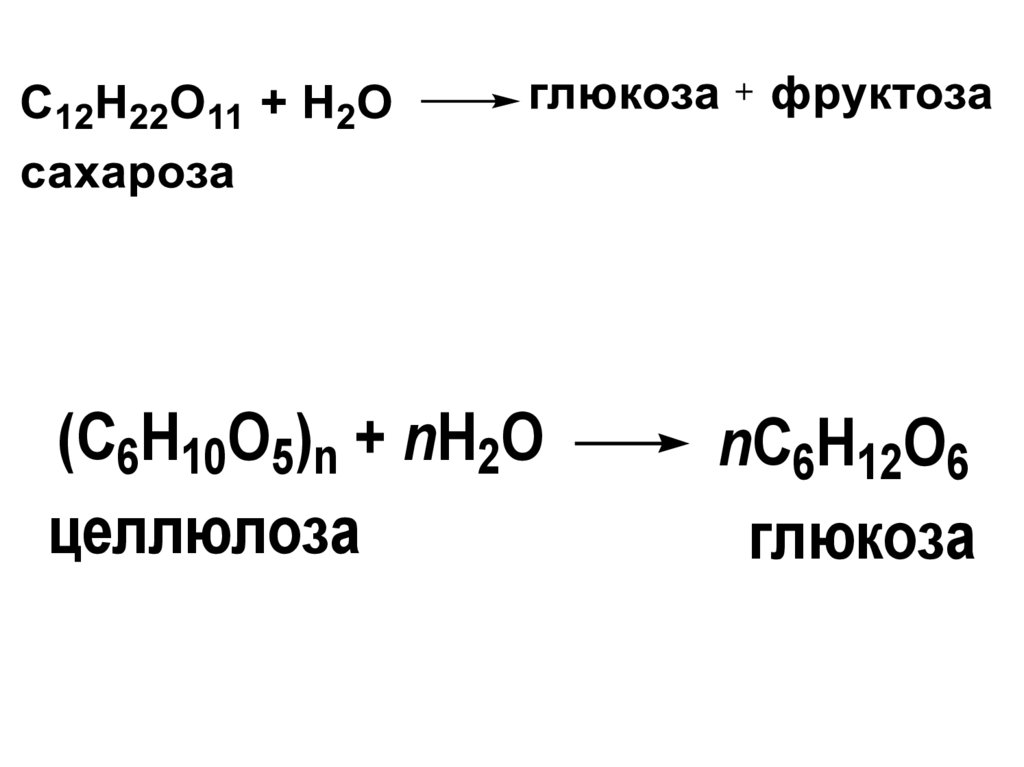
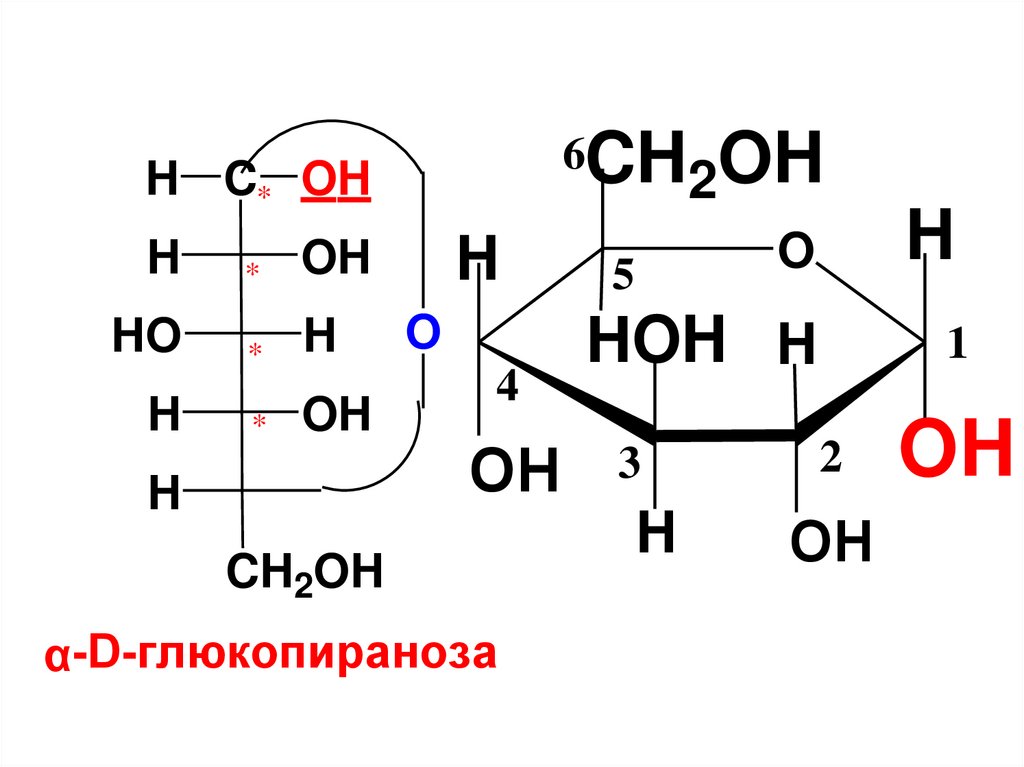
(C6H10O5)n + nH2Oцеллюлоза
nC6H12O6
глюкоза
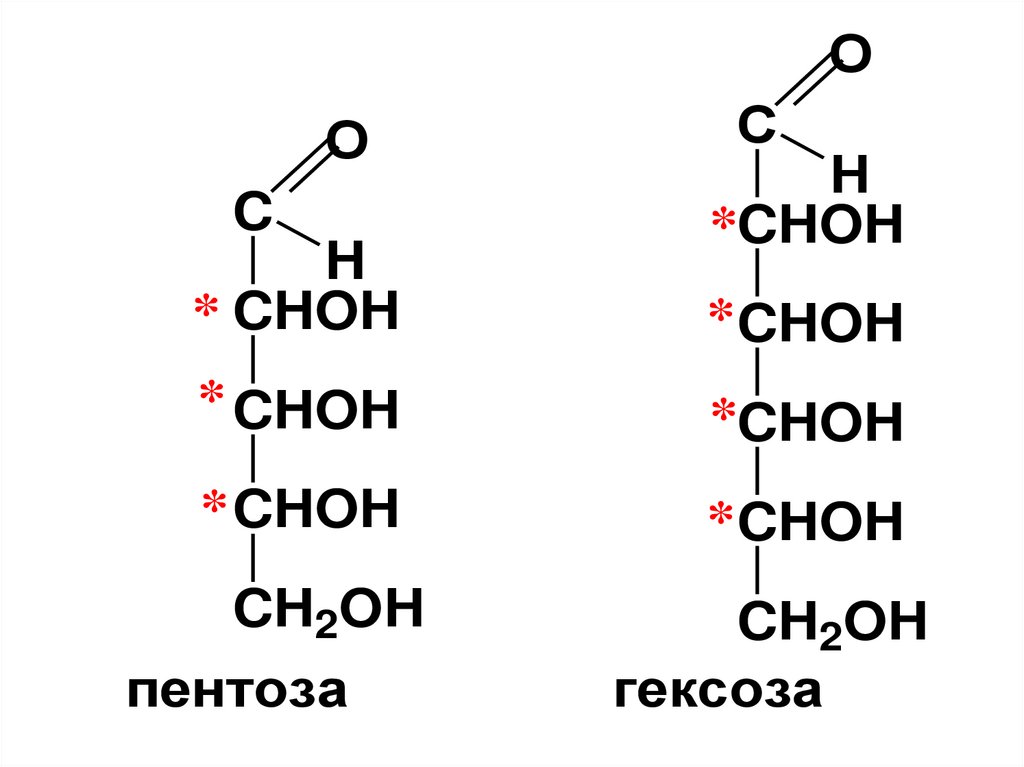
15. Моносахариды (МС)
• В зависимости от количестваатомов углерода в молекуле делят
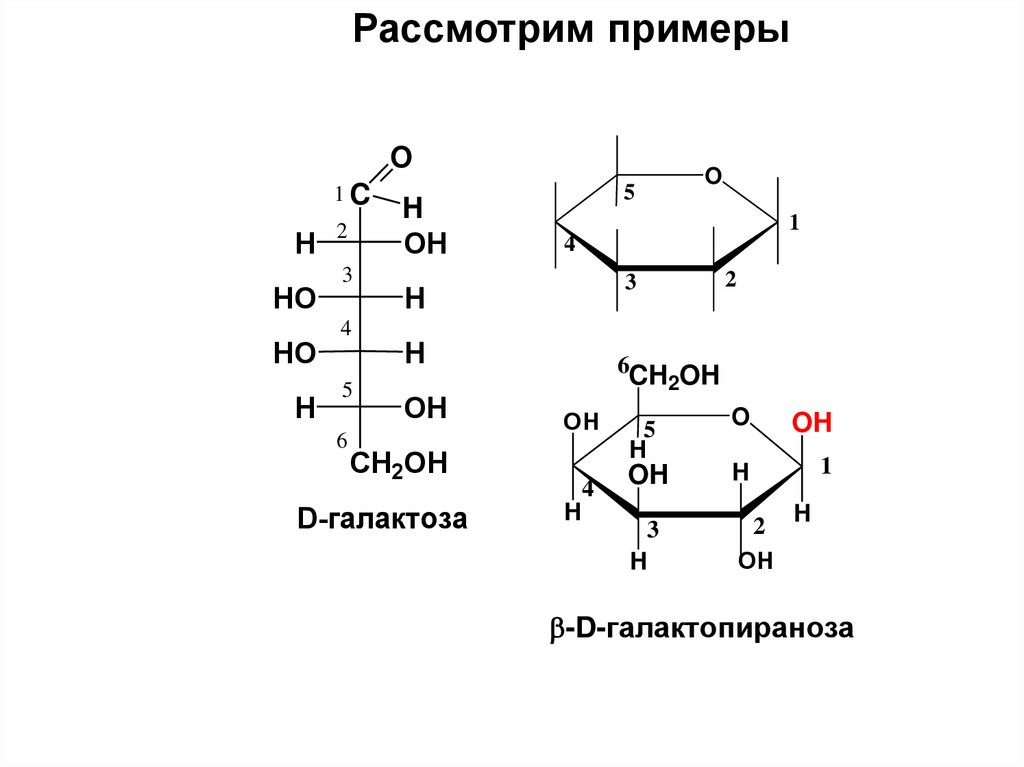
на
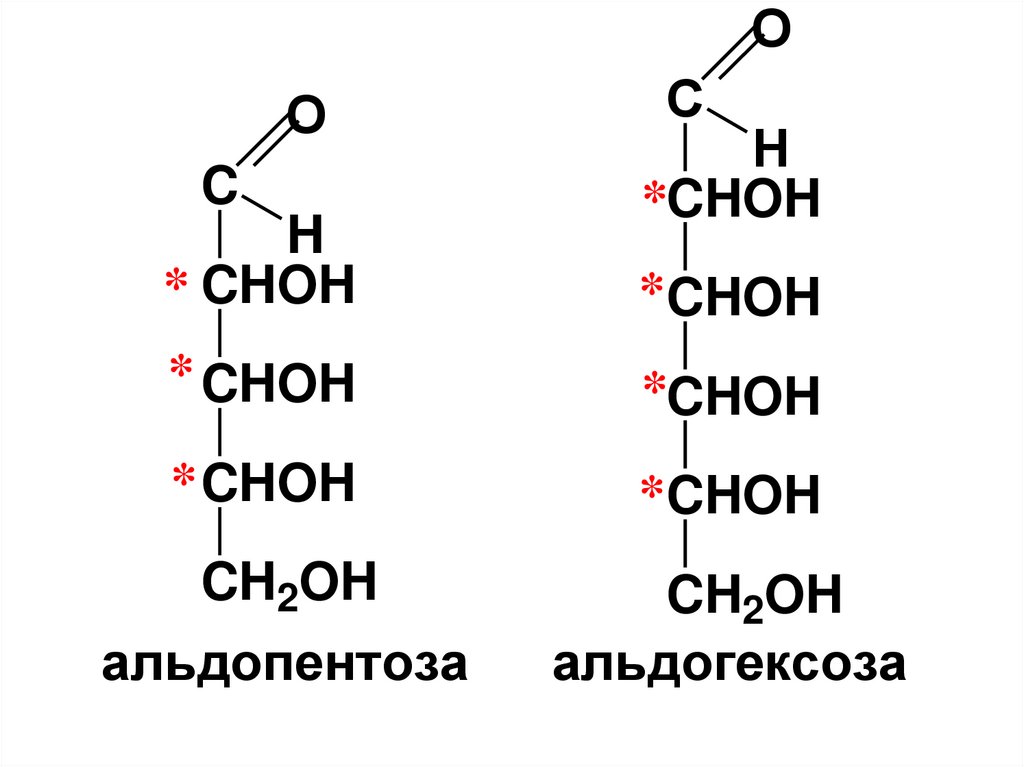
• триозы,
• тетрозы,
• пентозы,
• гексозы,
• гептозы и т.д.
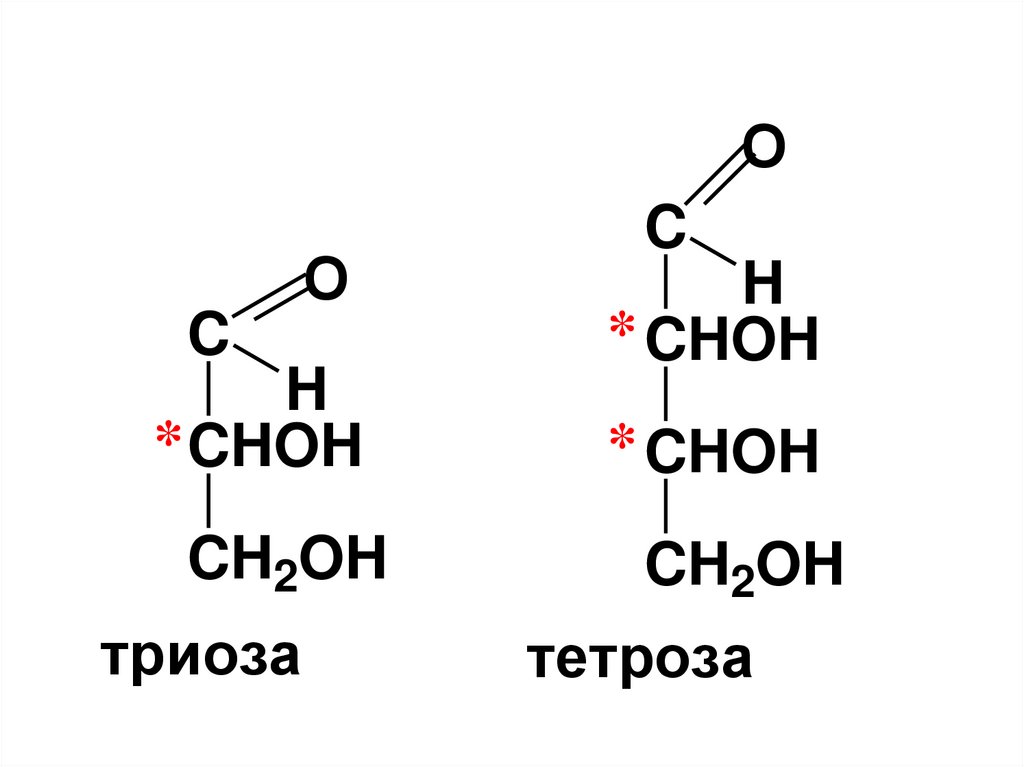
16.
OC
O
H
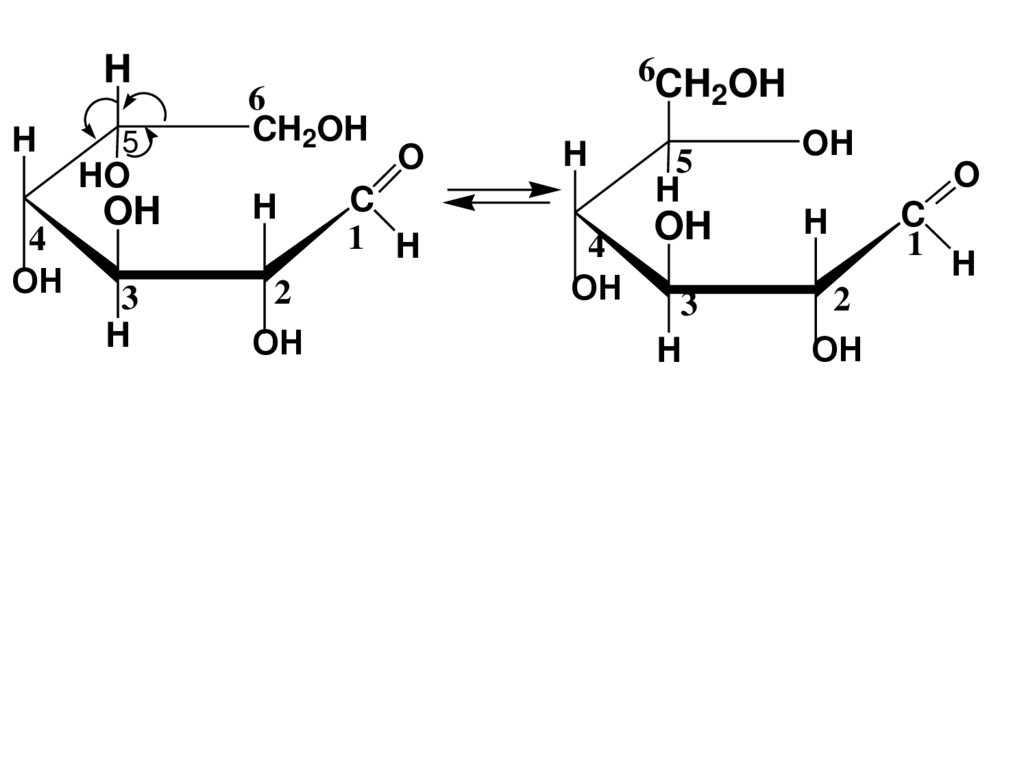
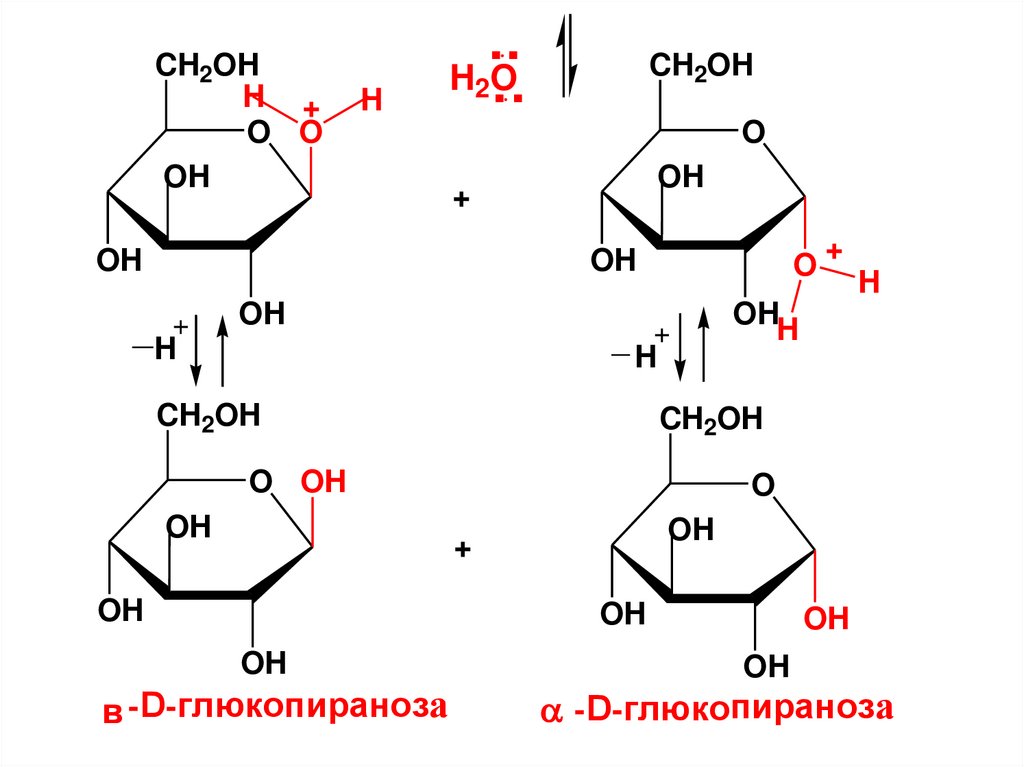
* CHOH
CH2OH
триоза
C
H
* CHOH
* CHOH
CH2OH
тетроза
17.
OO
C
C
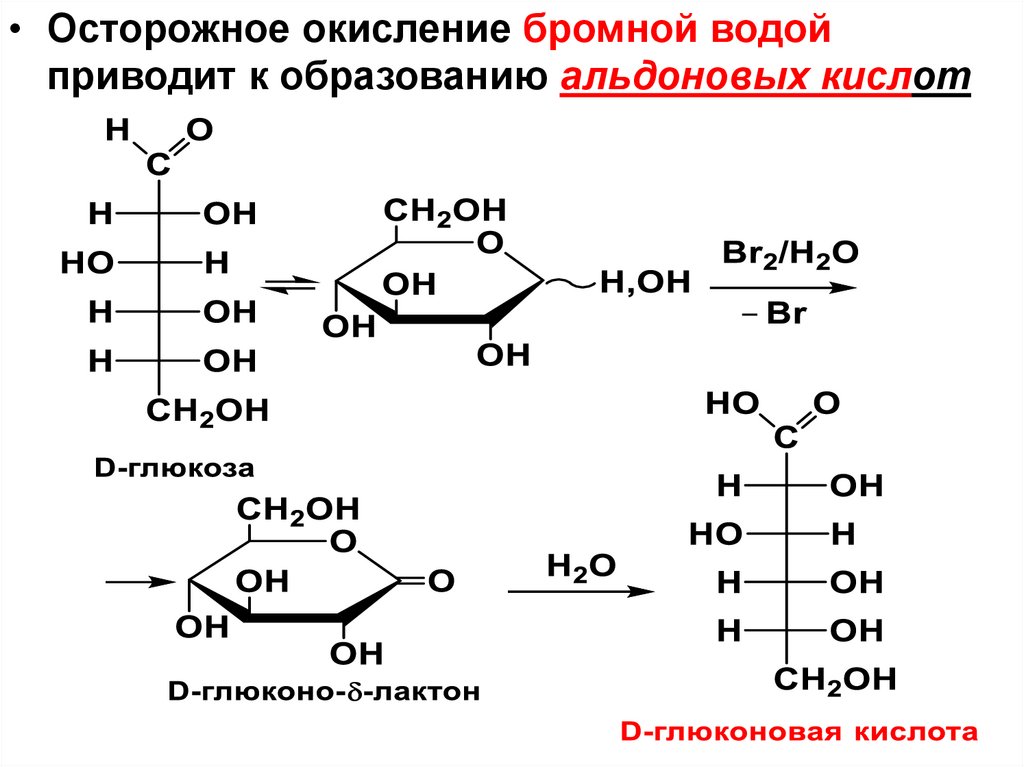
H
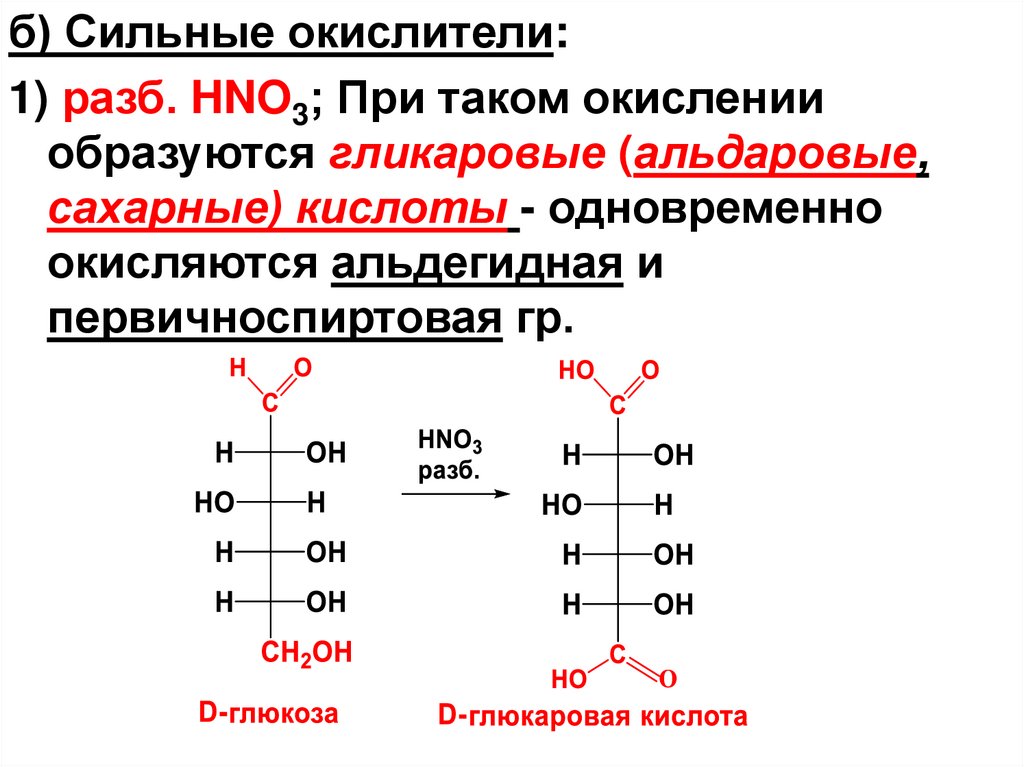
*CHOH
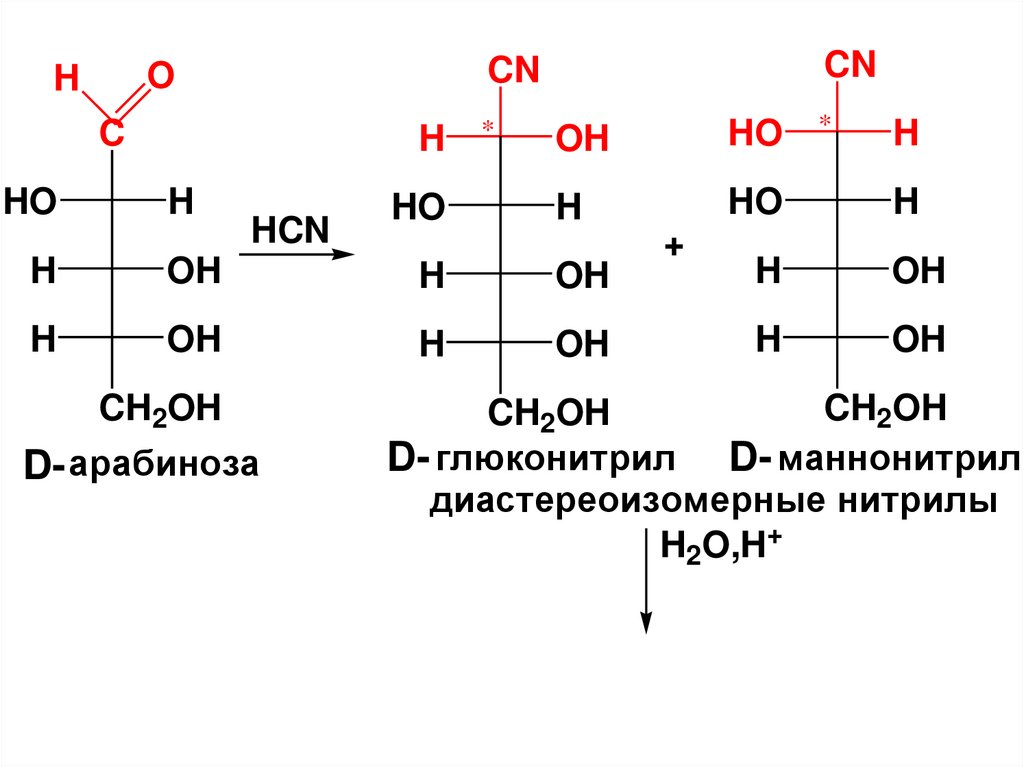
H
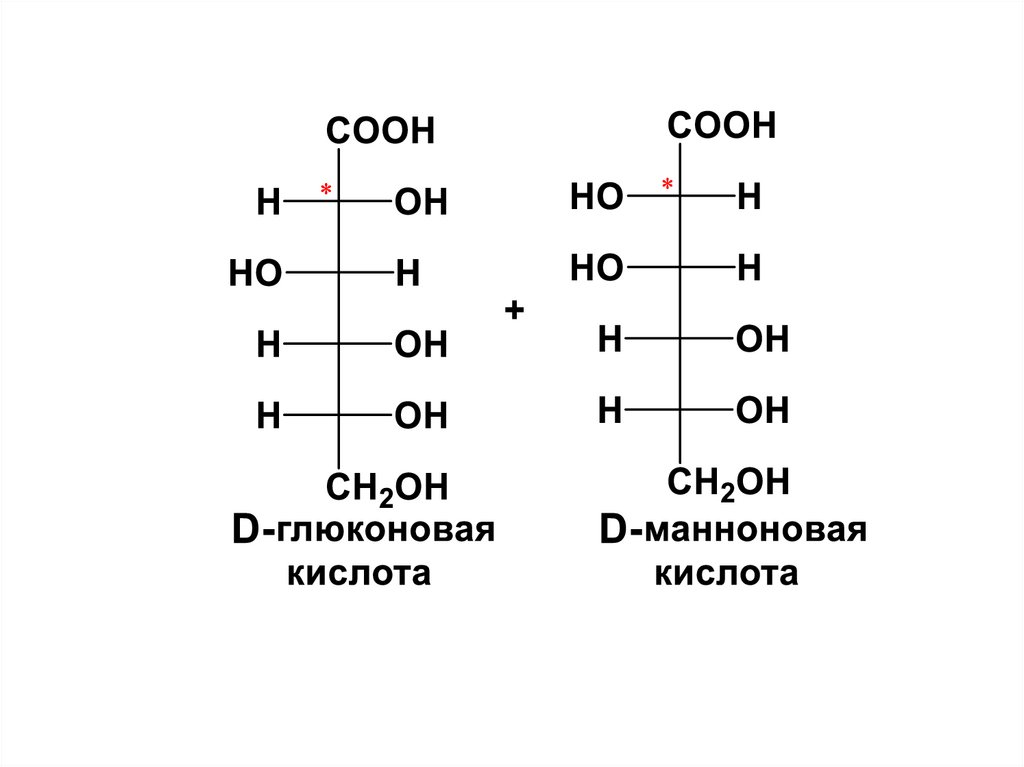
* CHOH
*CHOH
* CHOH
*CHOH
* CHOH
*CHOH
CH2OH
CH2OH
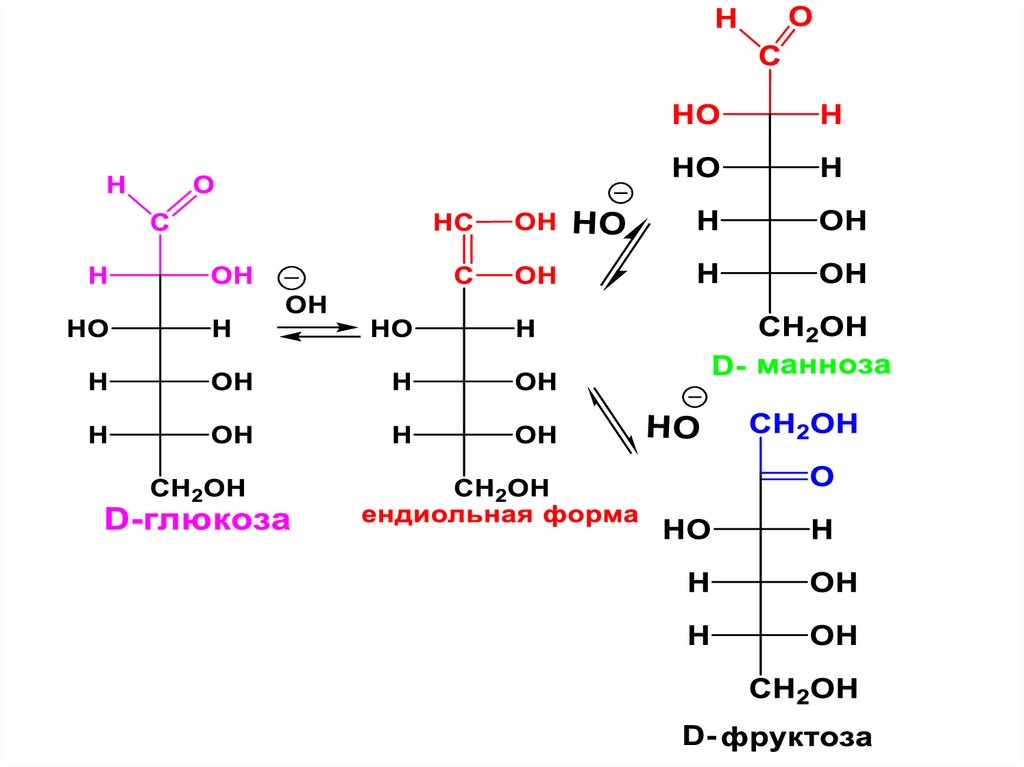
гексоза
пентоза
18.
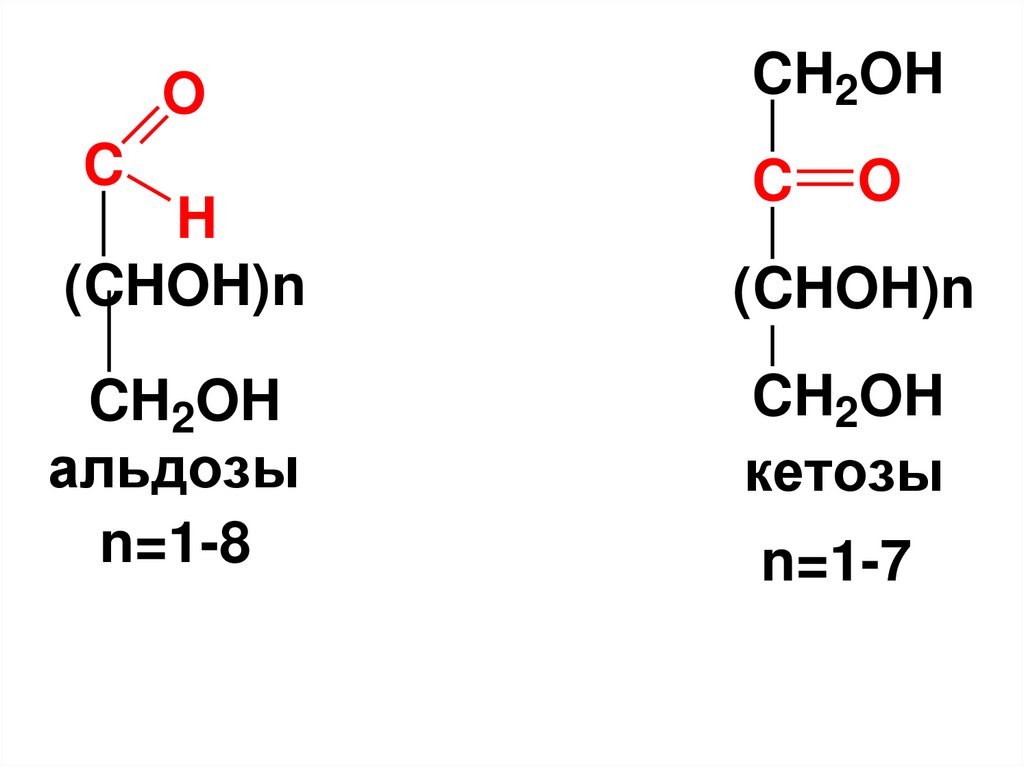
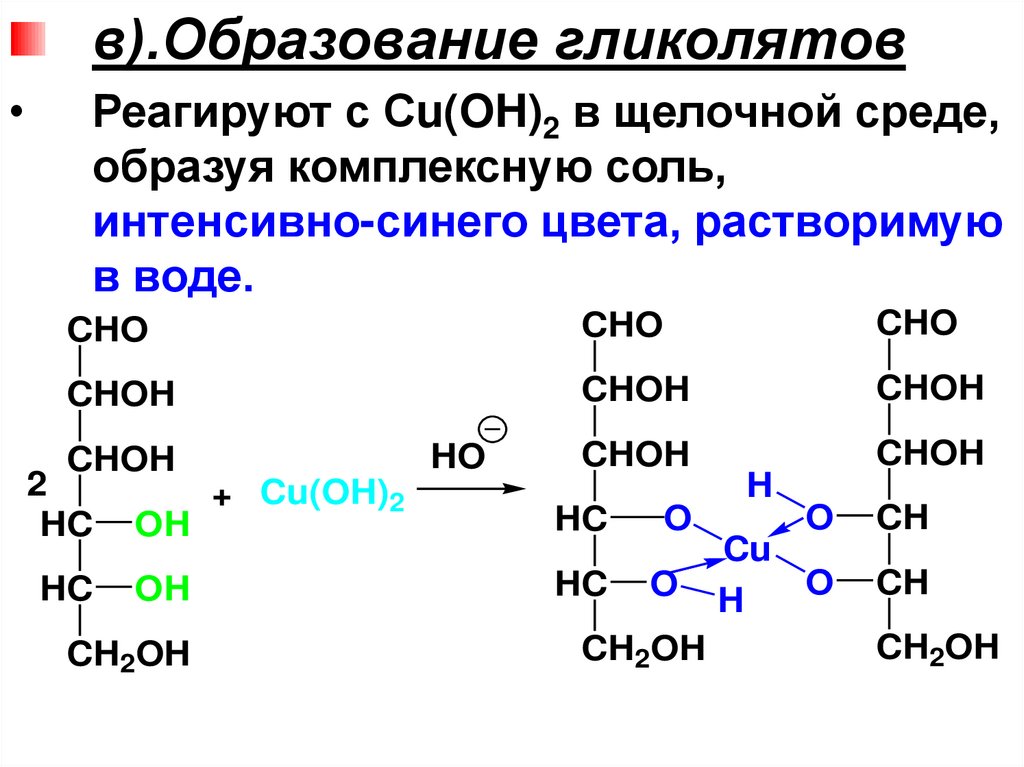
• МC, содержащиеальдегидную группу
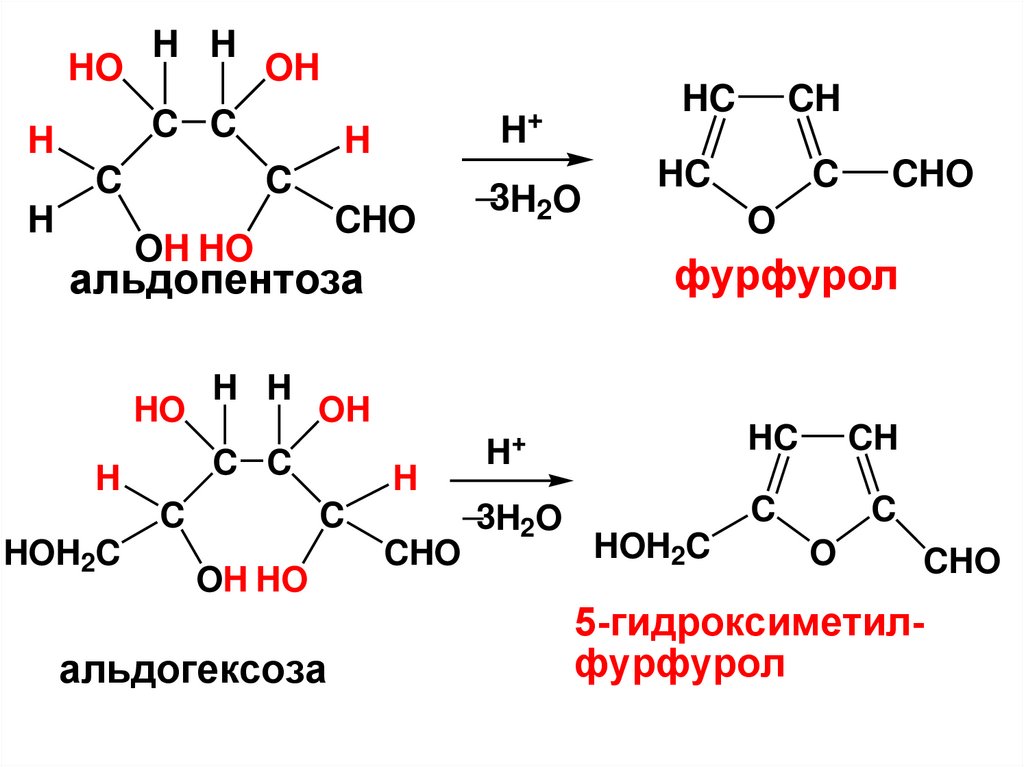
называются альдозами,
• а кетонную группу –
кетозами.
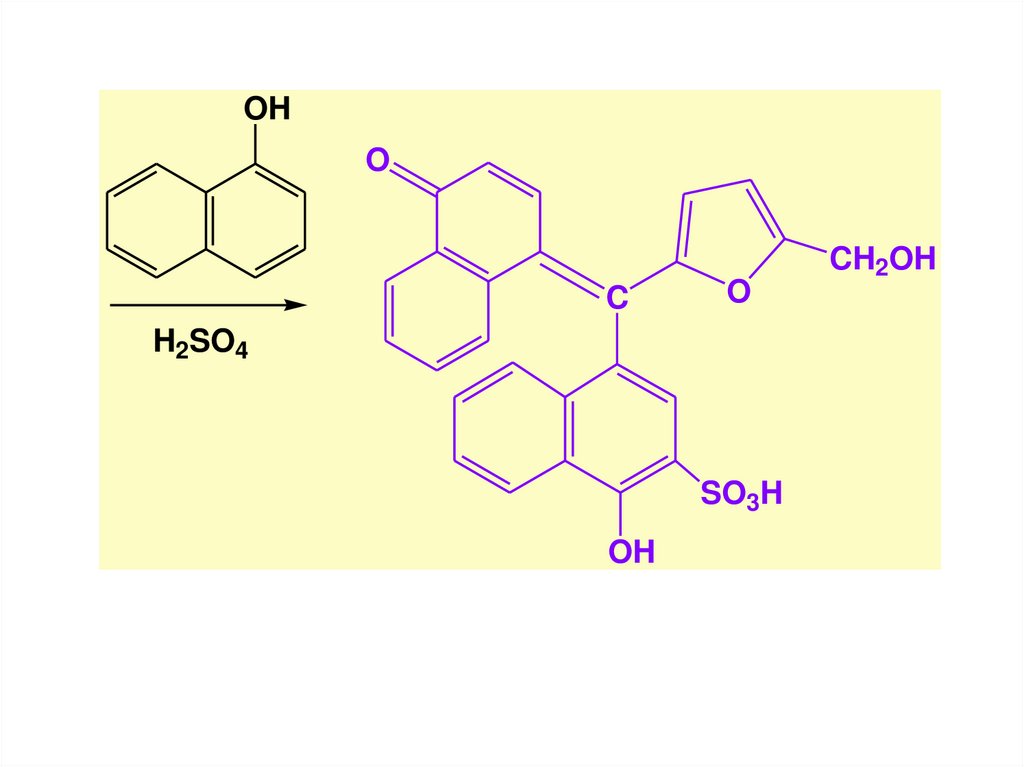
19.
OC
H
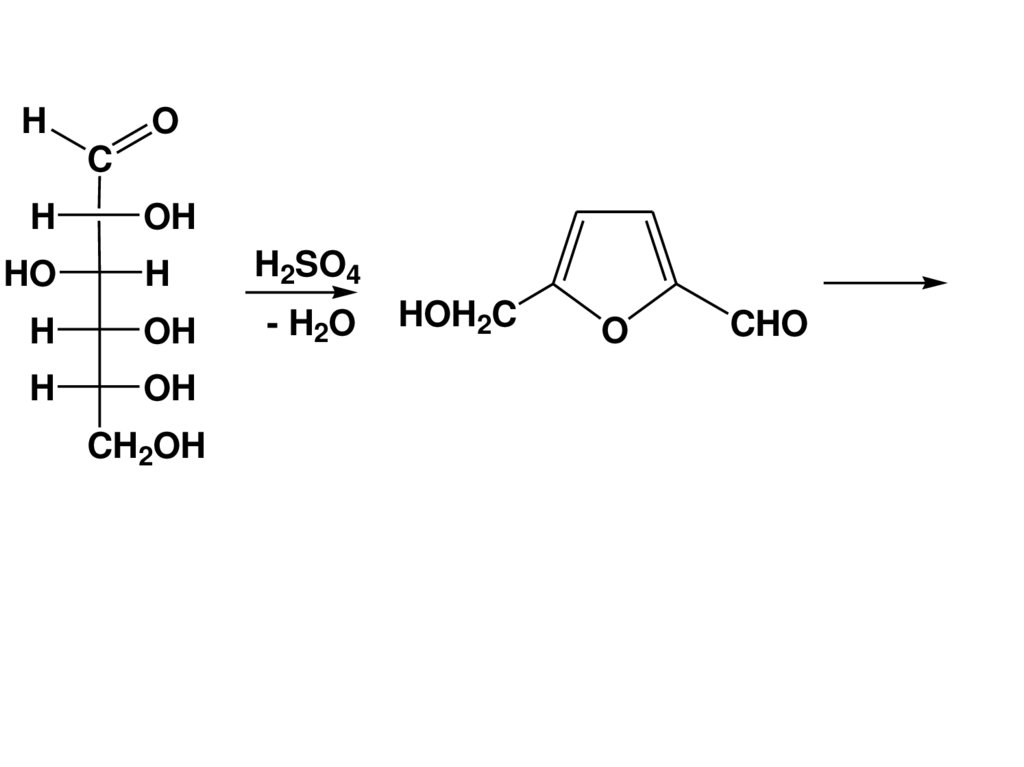
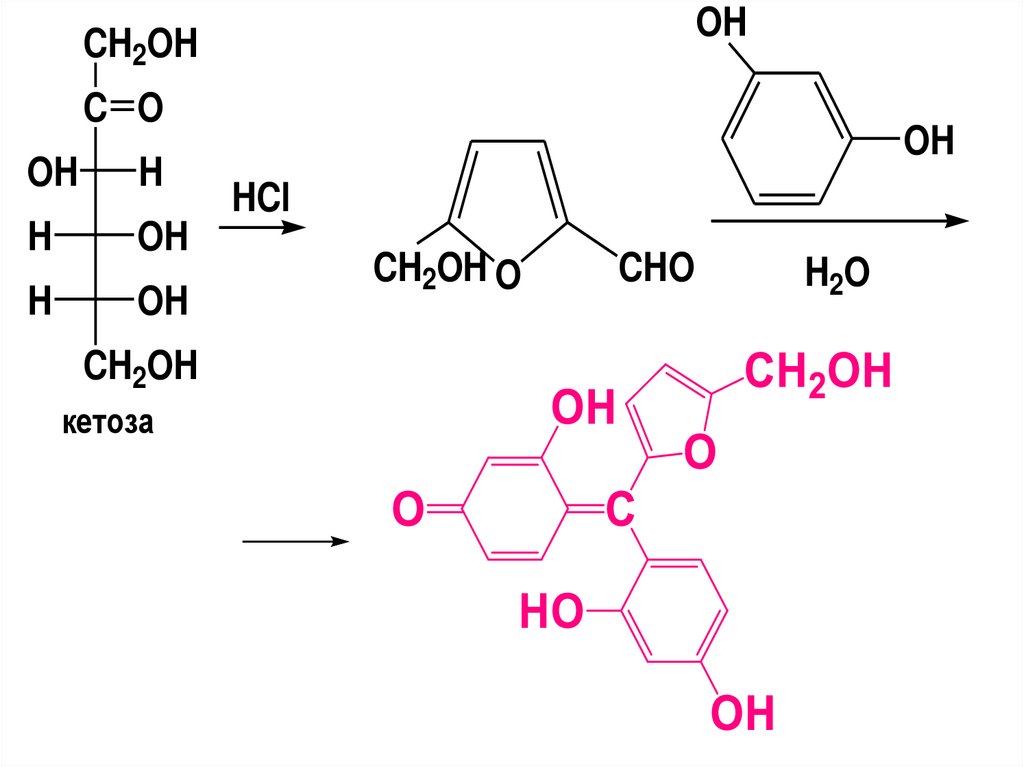
(CHOH)n
CH2OH
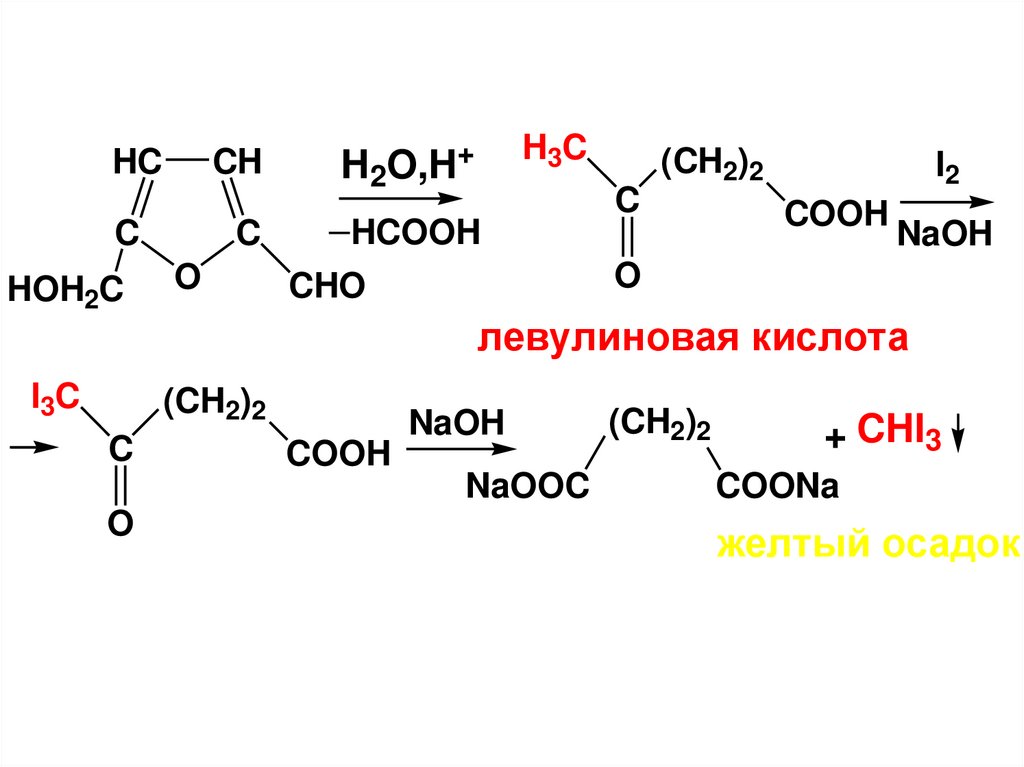
альдозы
n=1-8
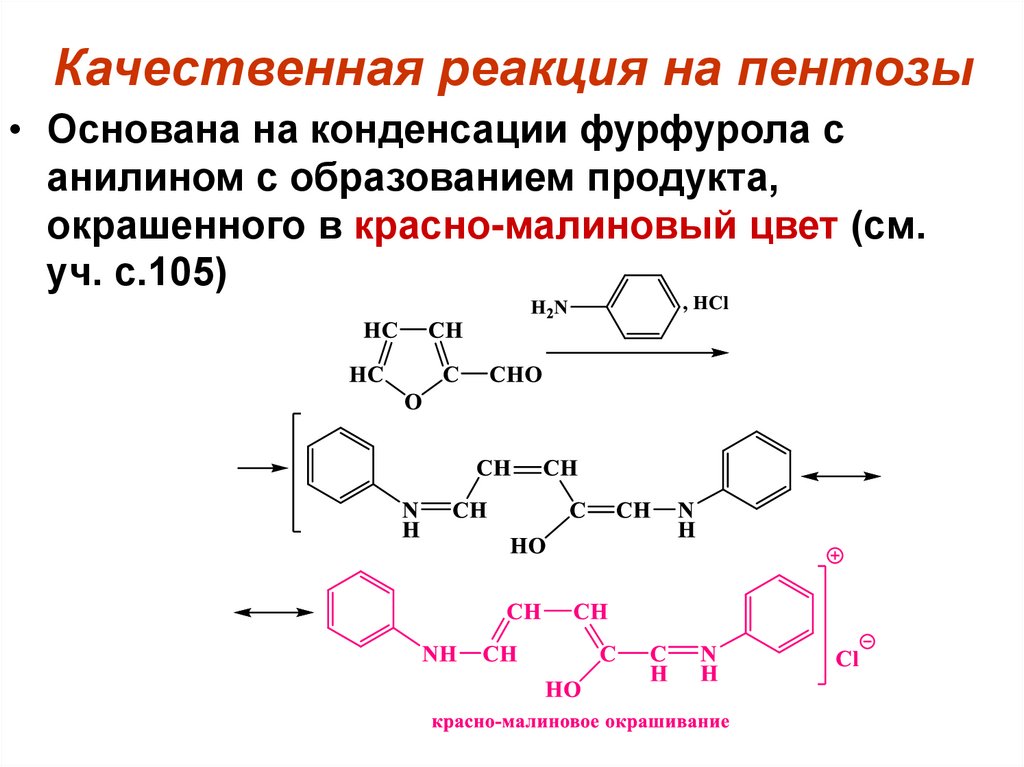
CH2OH
C
O
(CHOH)n
CH2OH
кетозы
n=1-7
20.
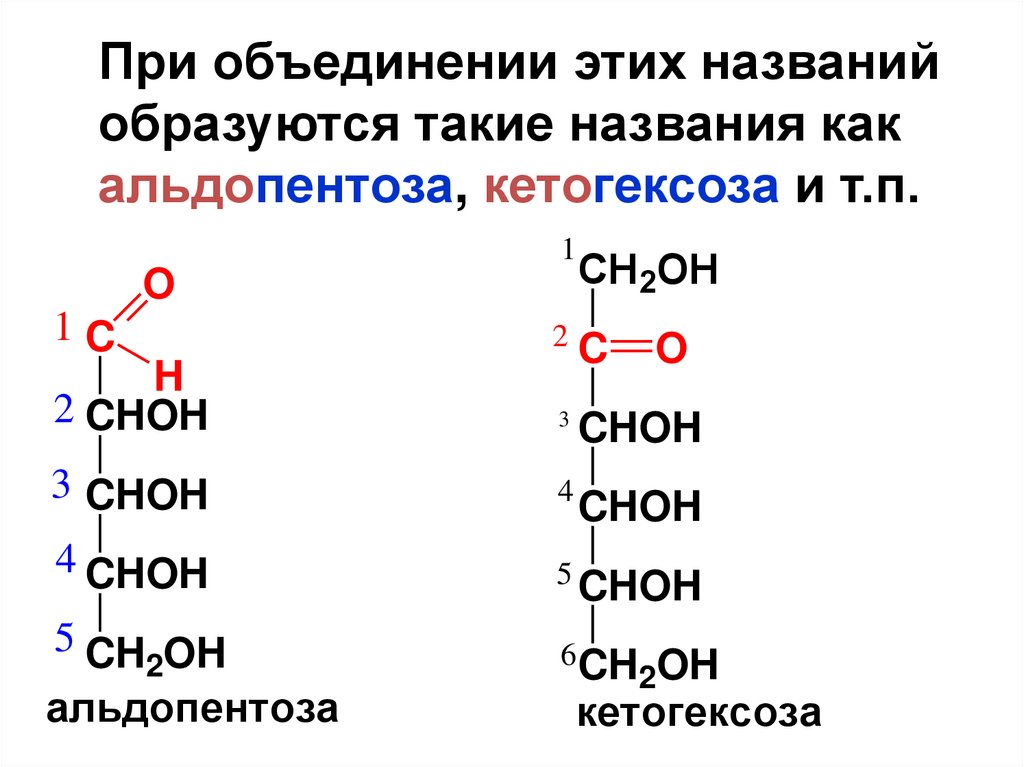
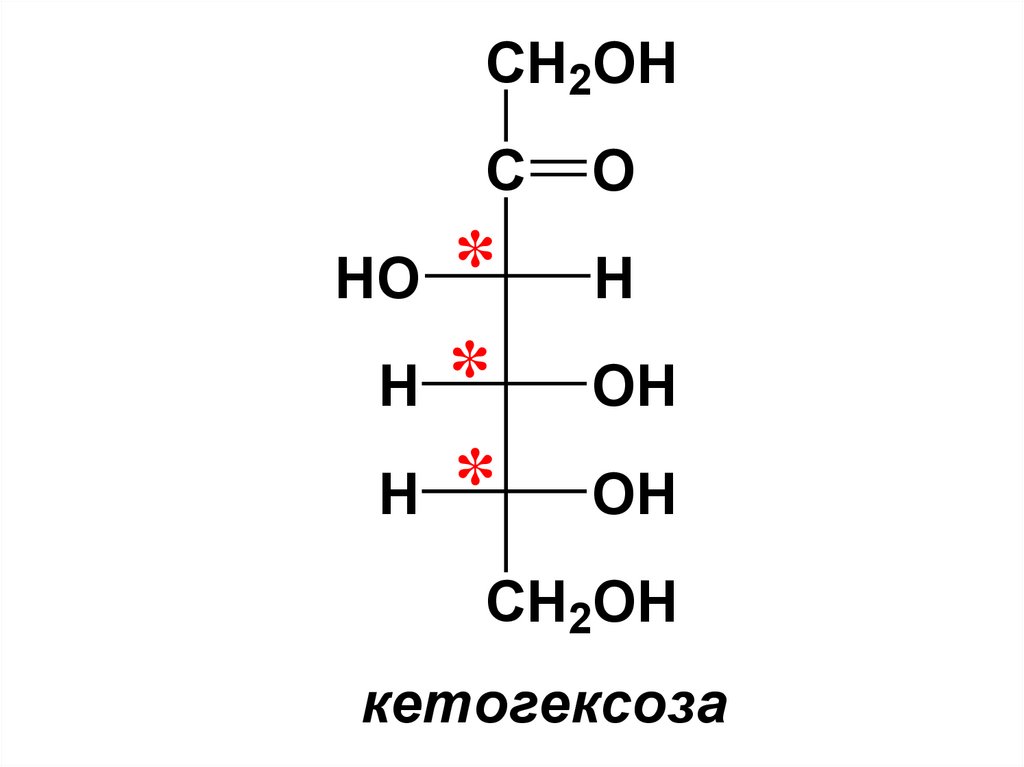
При объединении этих названийобразуются такие названия как
альдопентоза, кетогексоза и т.п.
1
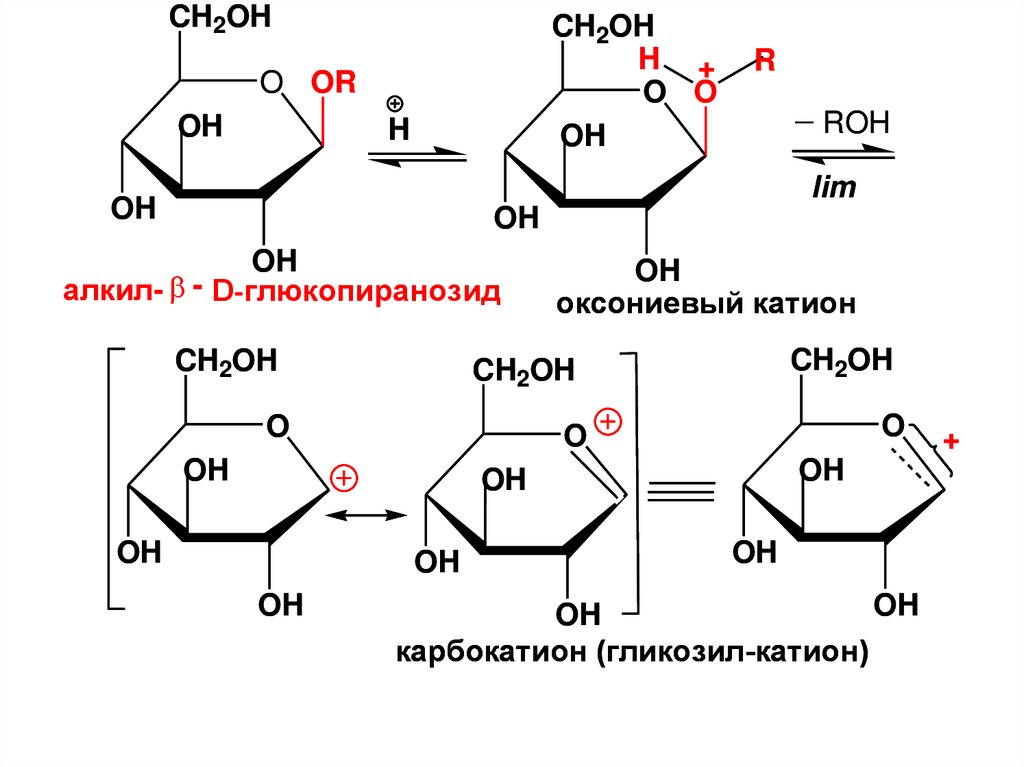
CH2OH
1C
2
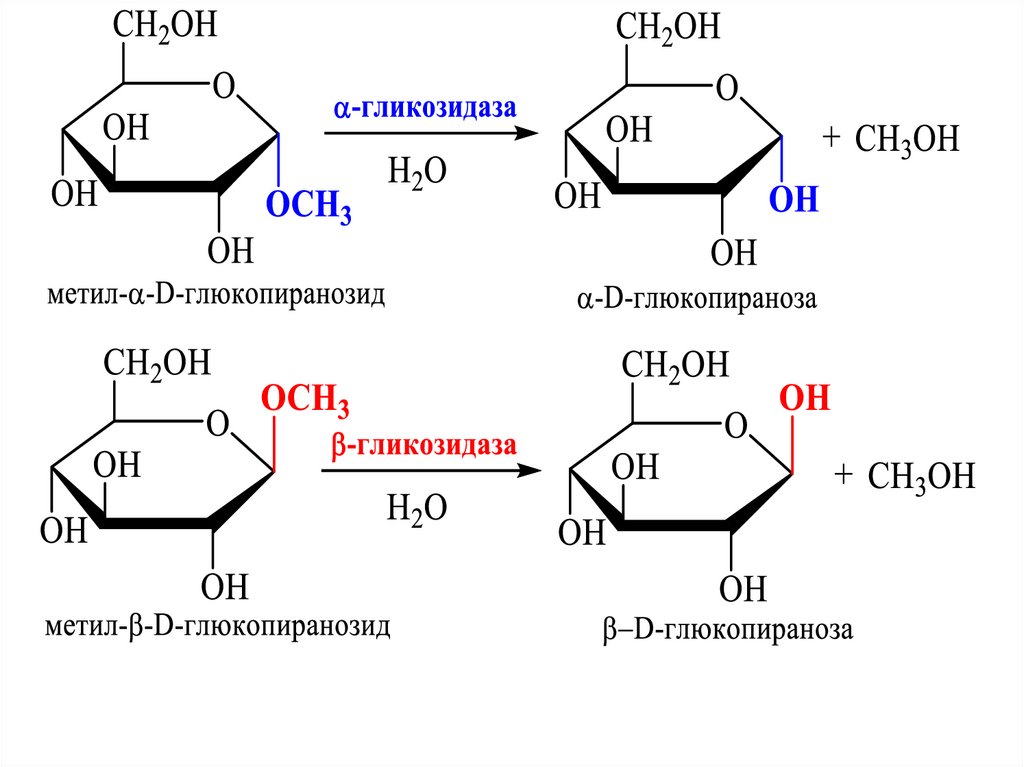
H
2 CHOH
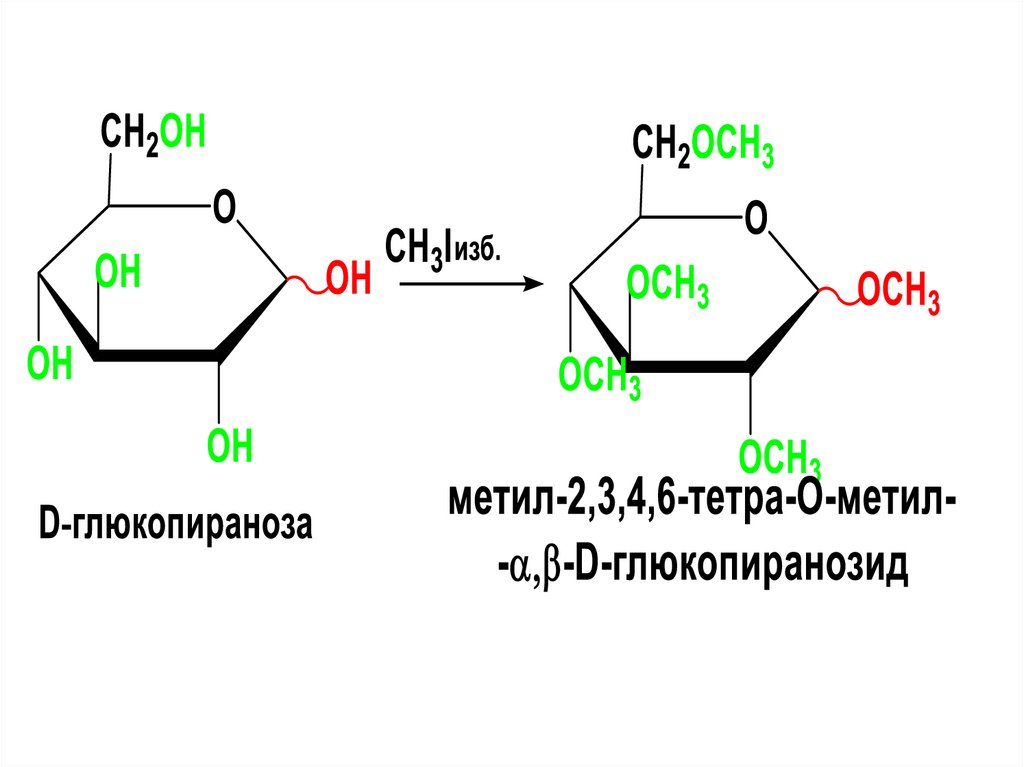
C
3
CHOH
3 CHOH
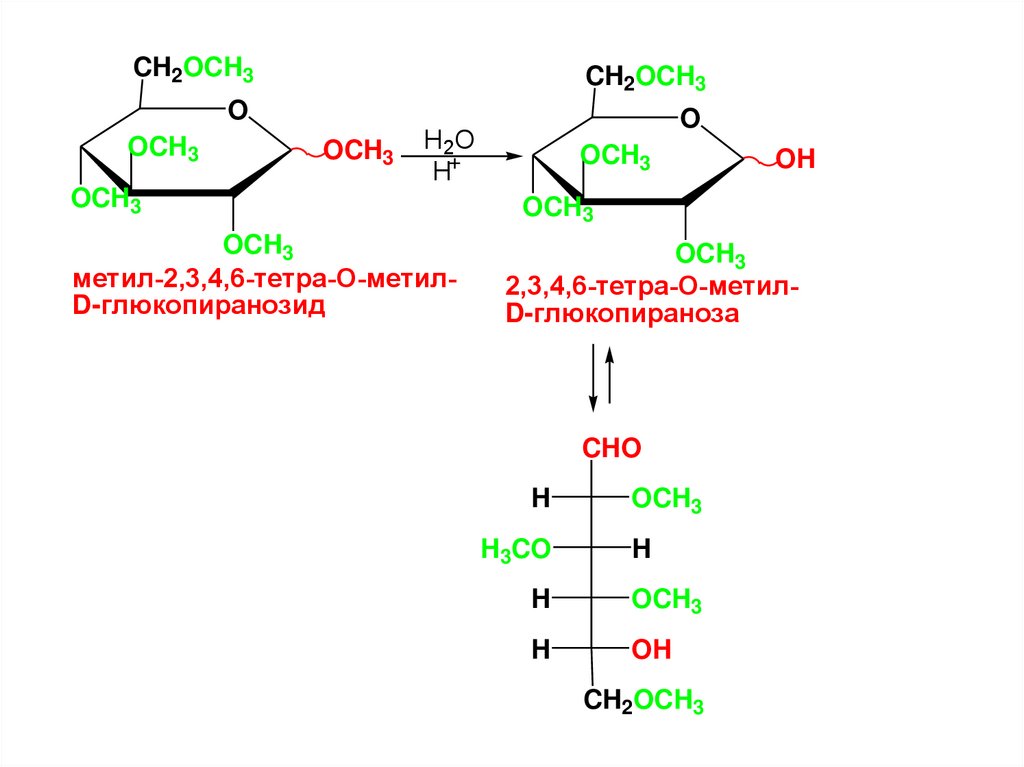
4
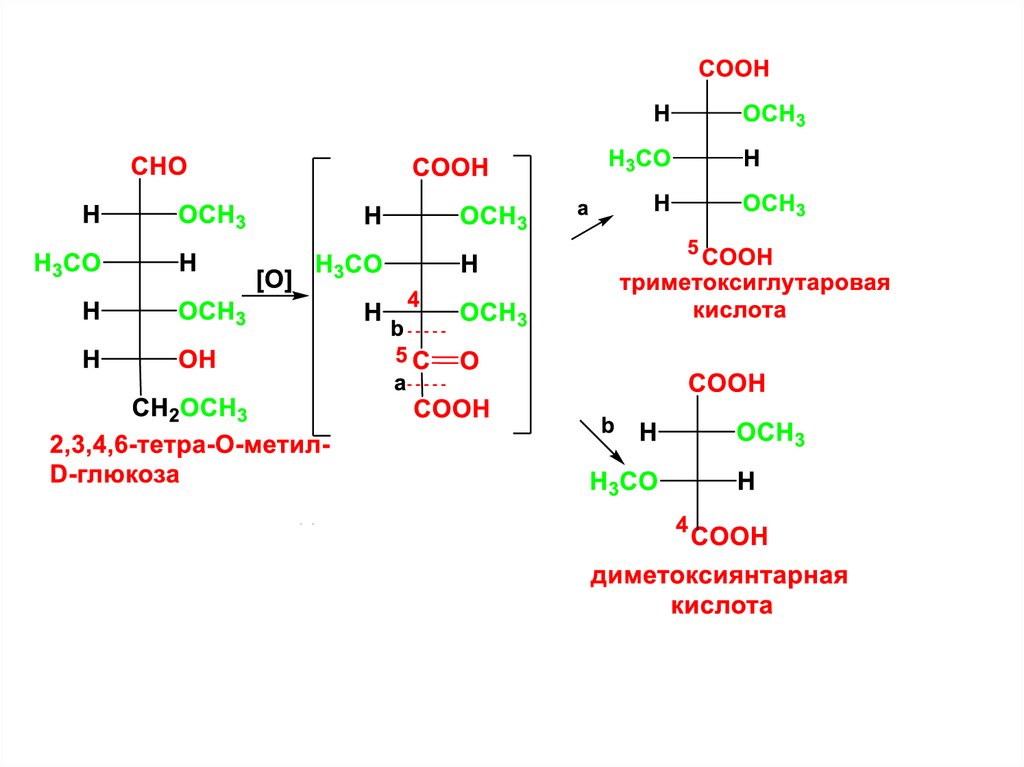
CHOH
4 CHOH
5
CHOH
O
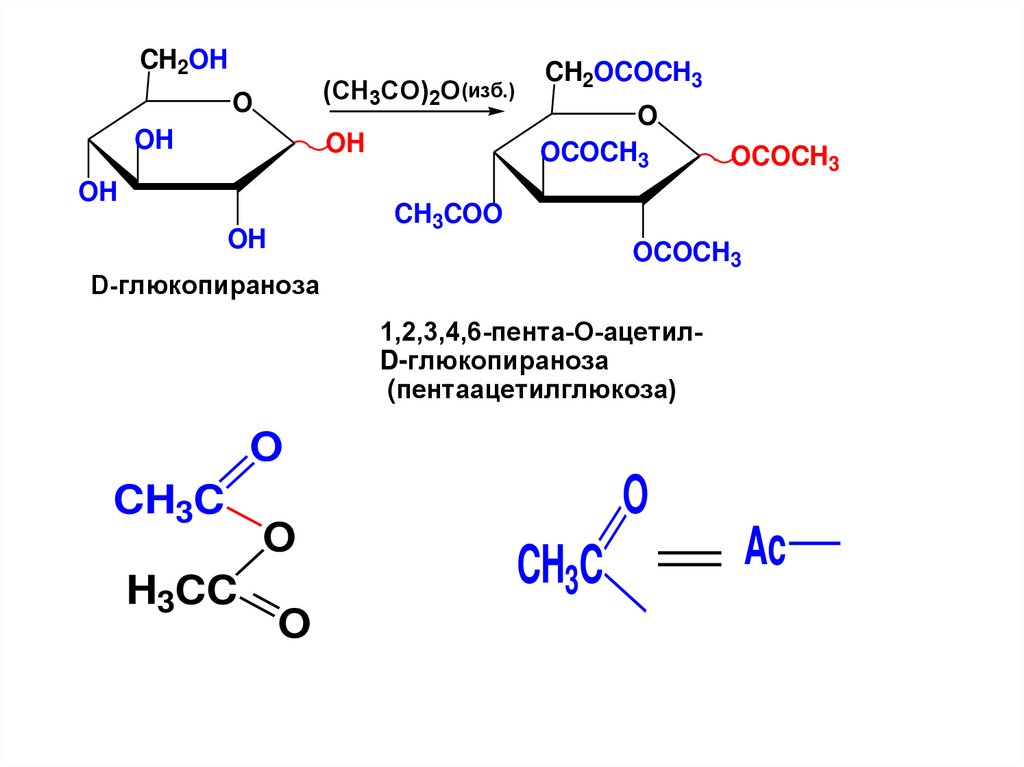
5 CH OH
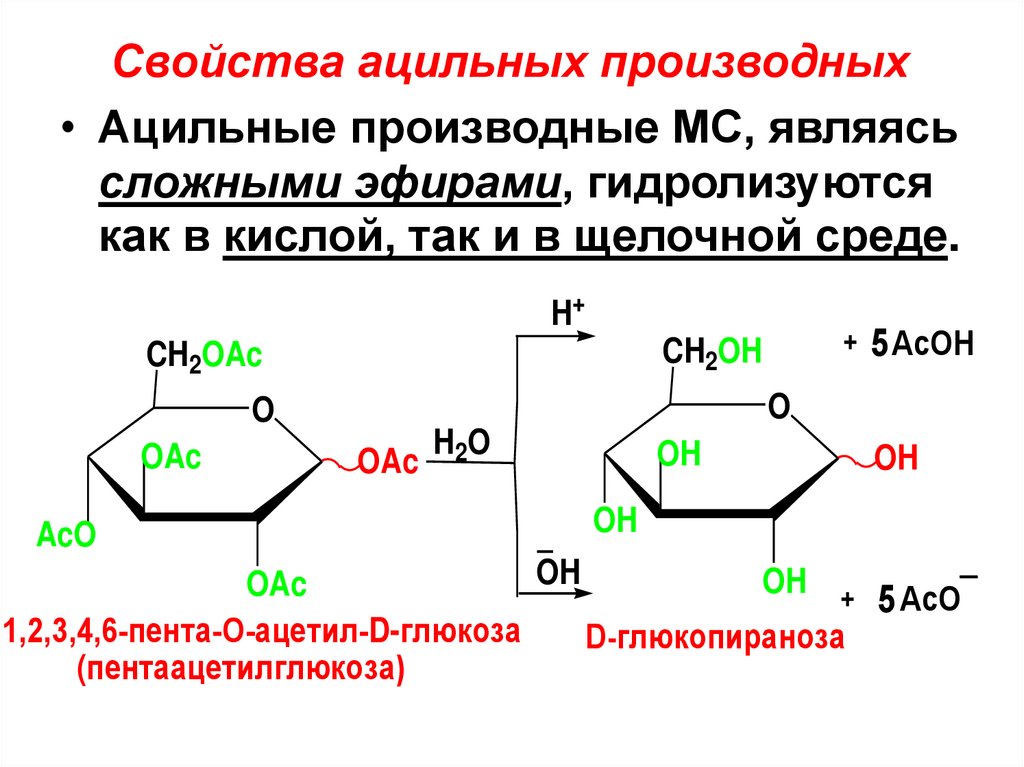
2
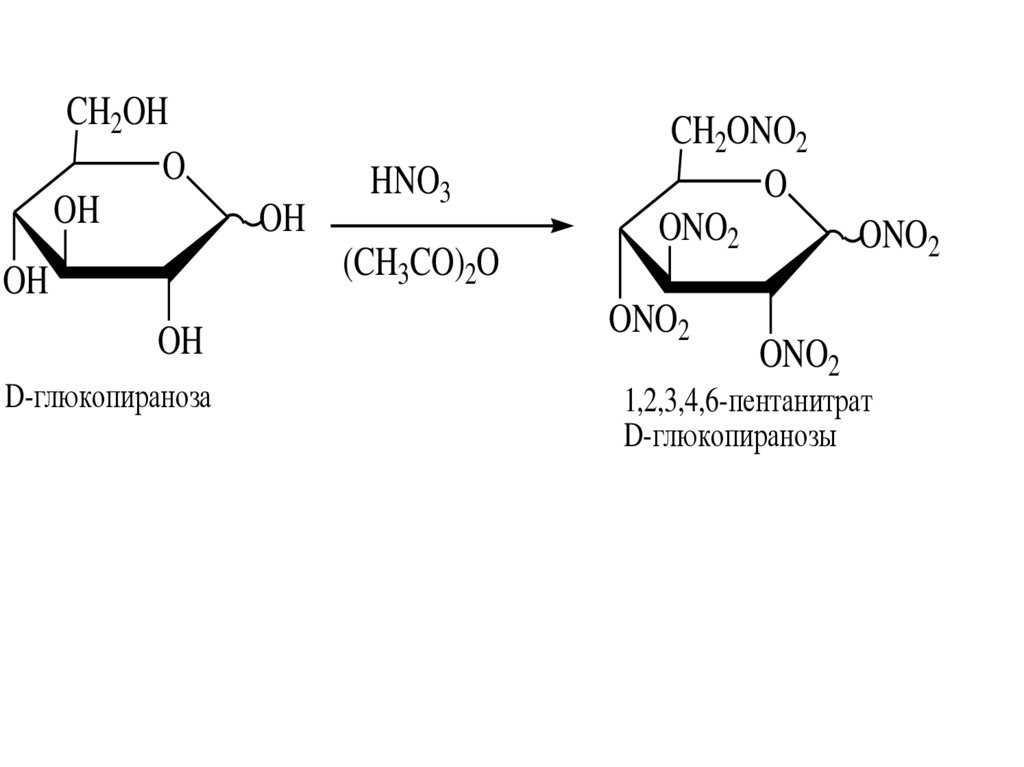
альдопентоза
O
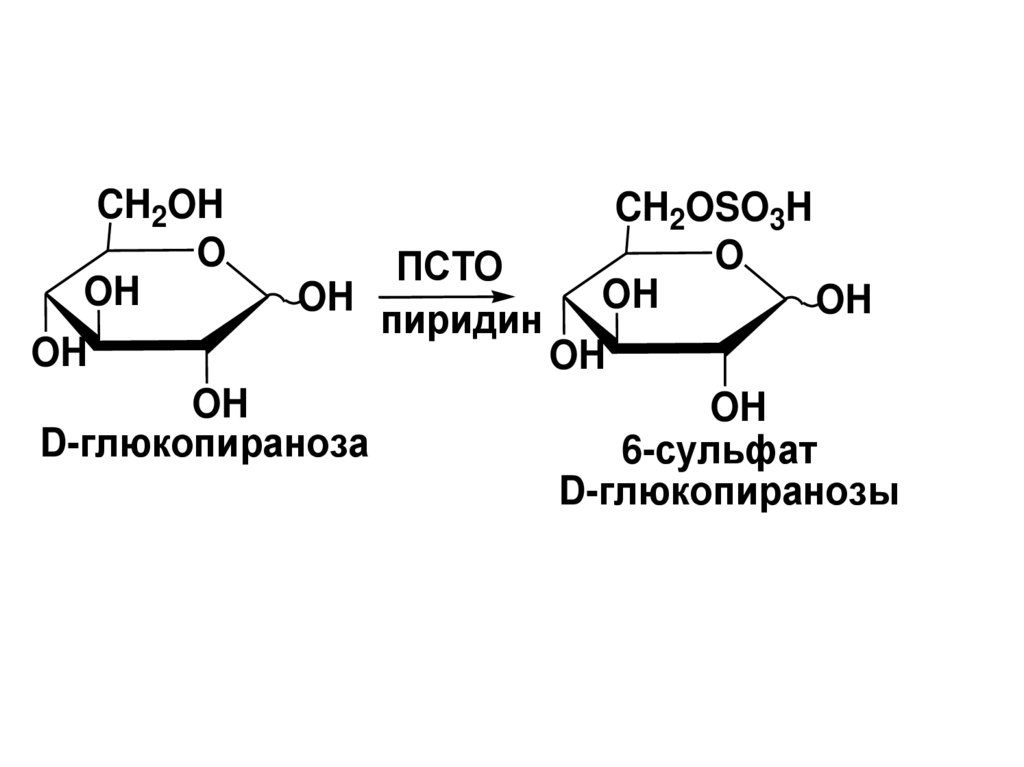
6 CH OH
2
кетогексоза
21.
• По химической природе МС делят на:• А) Нейтральные сахара, содержащие
только карбонильную (альдегидную
или кетонную) группу и
гидроксильные группы –
альдегидо- или кетоноспирты.
Они в большинстве своем имеют
состав, соответствующий общей
формуле СnH2nOn, т. е. число
атомов С равно числу атомов O.
22.
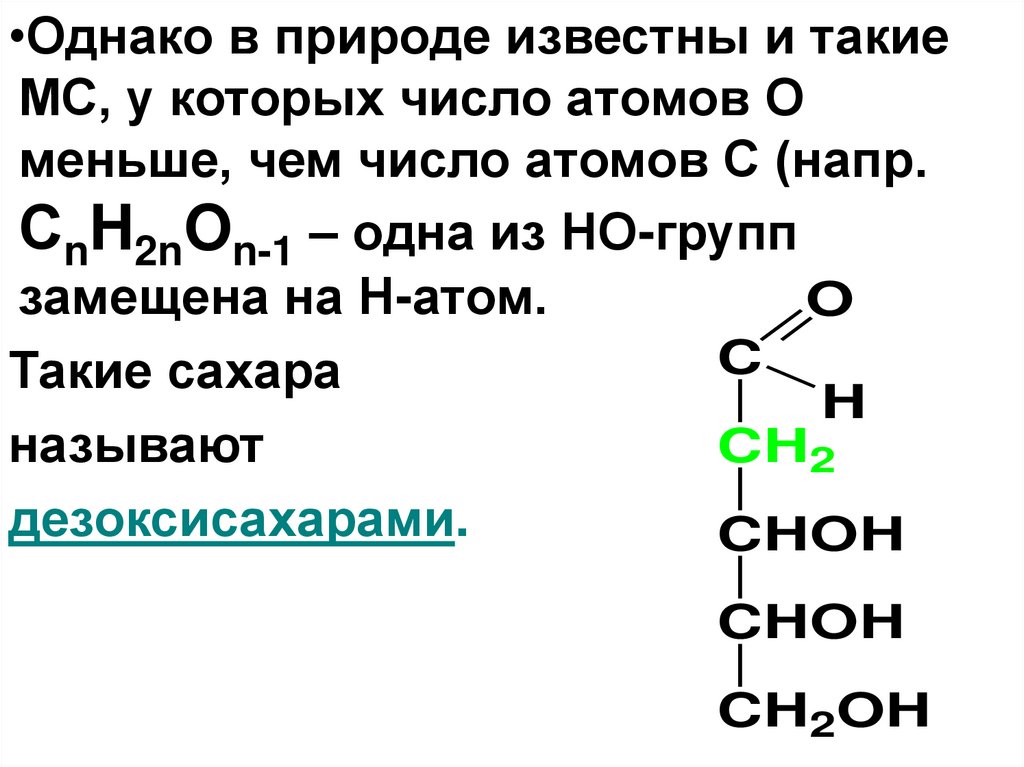
•Однако в природе известны и такиеМС, у которых число атомов О
меньше, чем число атомов С (напр.
СnH2nOn-1 – одна из НО-групп
замещена на Н-атом.
O
C
Такие сахара
H
называют
CH2
дезоксисахарами.
CHOH
CHOH
CH2OH
23.
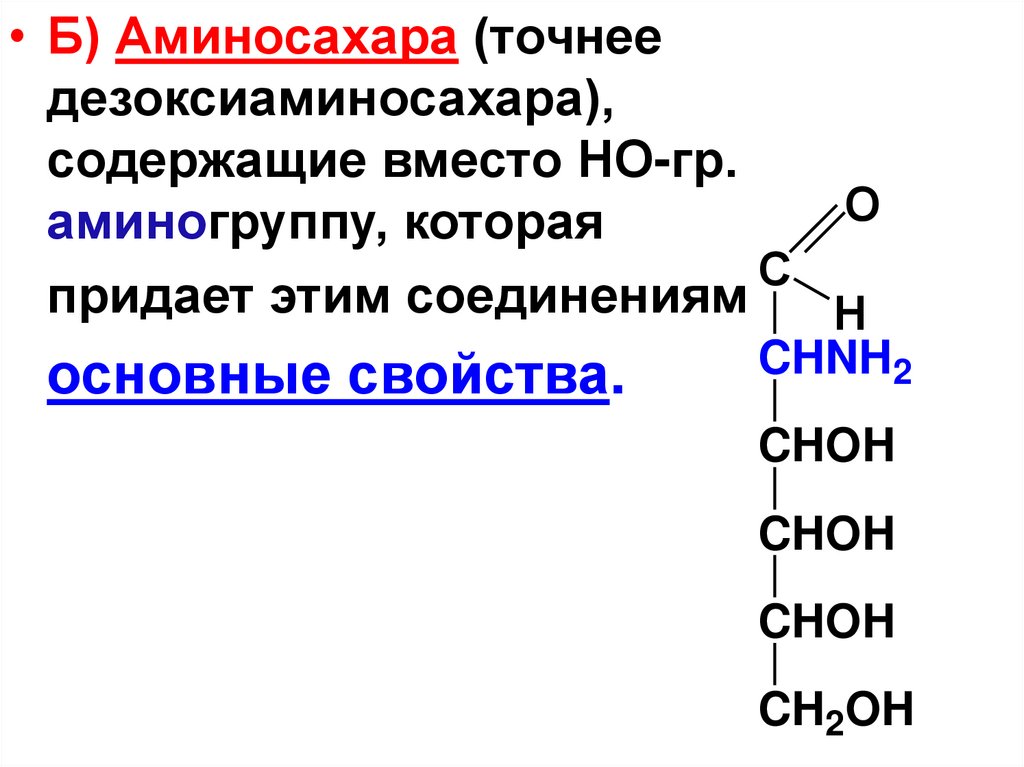
• Б) Аминосахара (точнеедезоксиаминосахара),
содержащие вместо НО-гр.
O
аминогруппу, которая
C
придает этим соединениям
H
основные свойства.
CHNH2
CHOH
CHOH
CHOH
CH2OH
24.
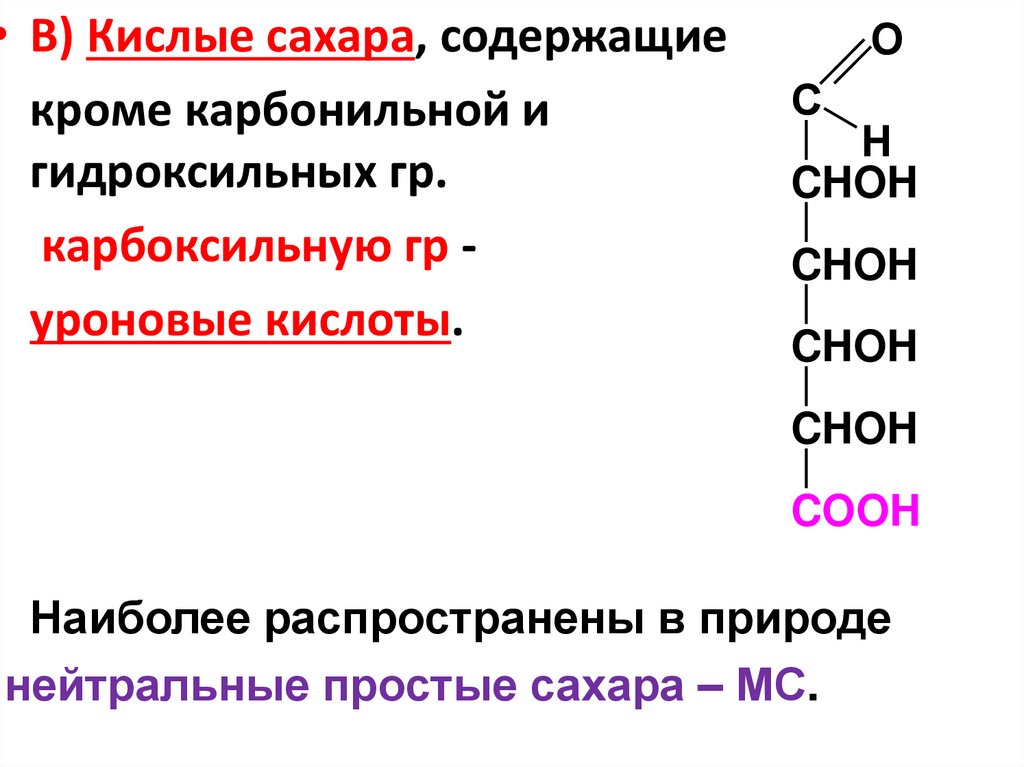
• В) Кислые сахара, содержащиекроме карбонильной и
гидроксильных гр.
карбоксильную гр уроновые кислоты.
O
C
H
CHOH
CHOH
CHOH
CHOH
COOH
Наиболее распространены в природе
нейтральные простые сахара – МС.
25. Номенклатура
• Как следует из структурныхформул МС, они содержат
асимметрические С-атомы и потому
существуют в виде нескольких
оптических изомеров.
• Каждый изомер имеет свое название.
26.
•Названия МС образуют в соответствии с ихклассификацией с суффиксом «оза».
•Отдельные представители имеют
тривиальные названия. Наиболее
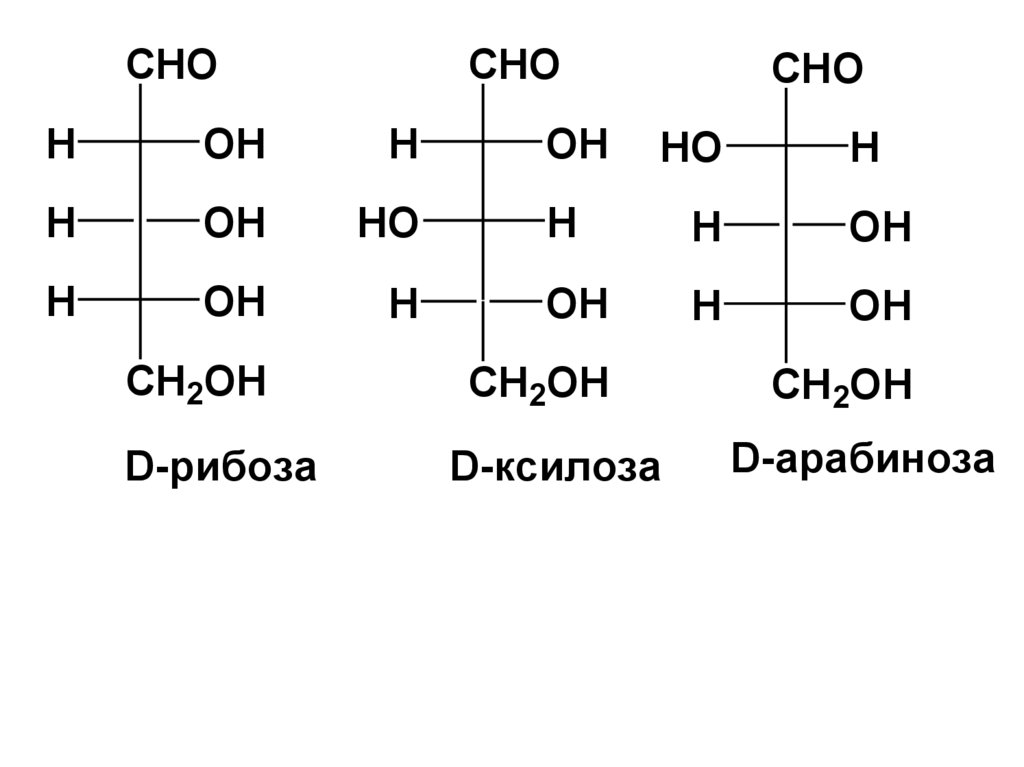
распространены
• альдопентозы: рибоза, ксилоза,
арабиноза;
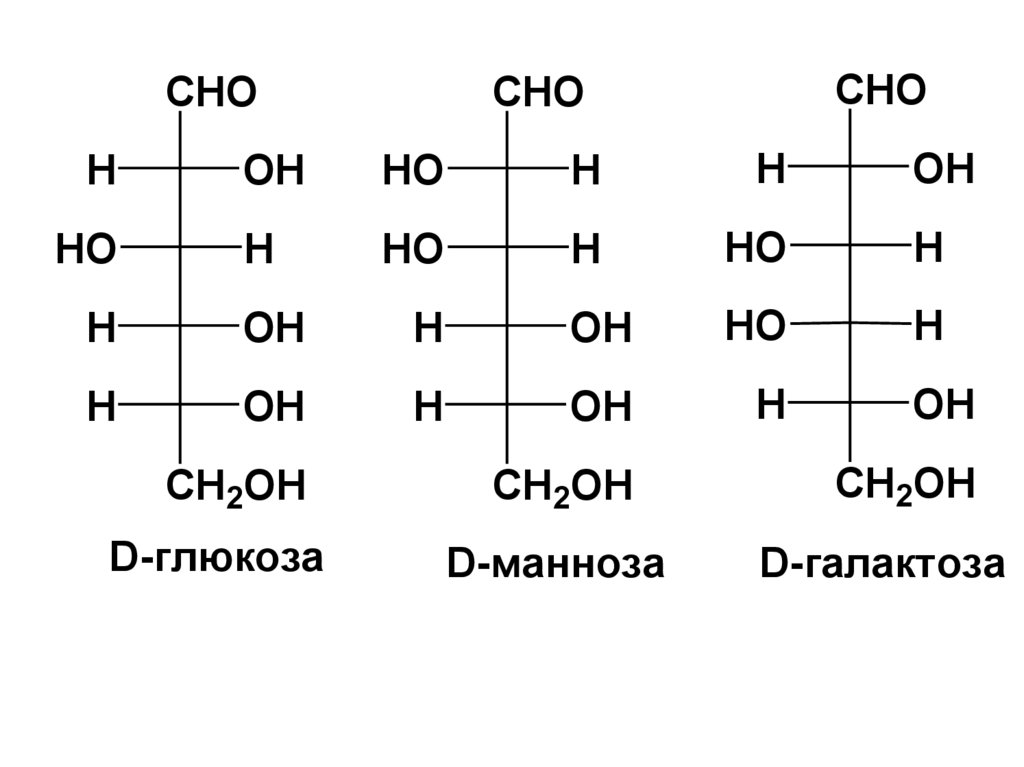
•альдогексозы: глюкоза, манноза,
галактоза;
27.
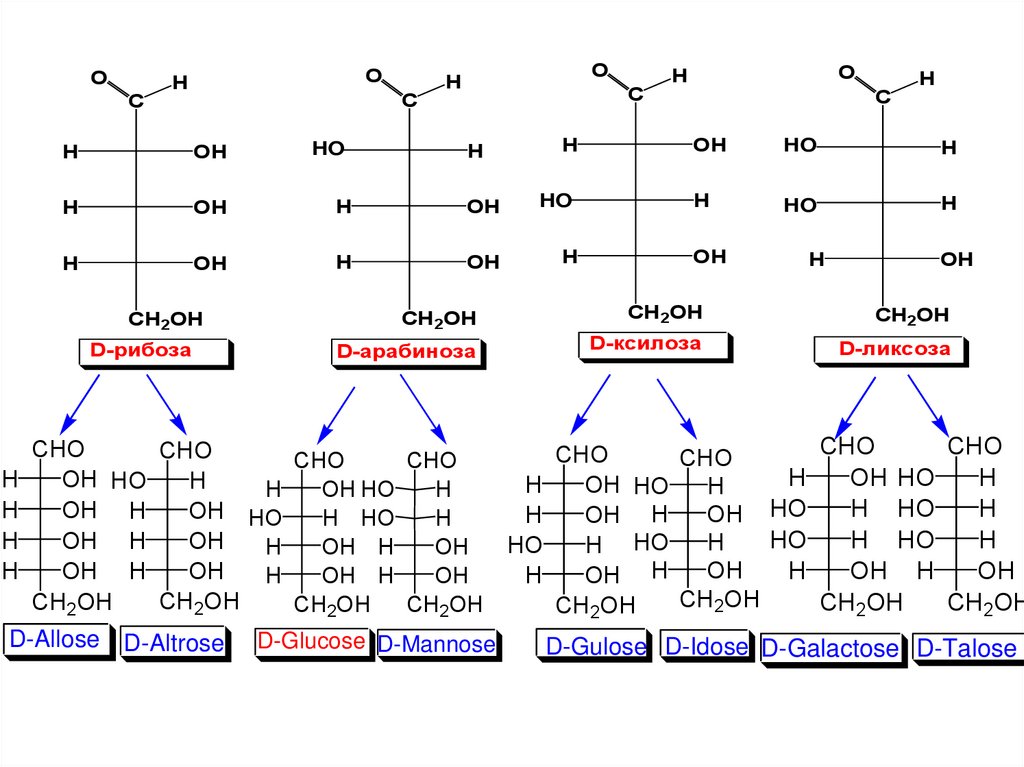
CHOCHO
CHO
H
OH
H
OH
HO
H
H
OH
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2OH
CH2OH
D-рибоза
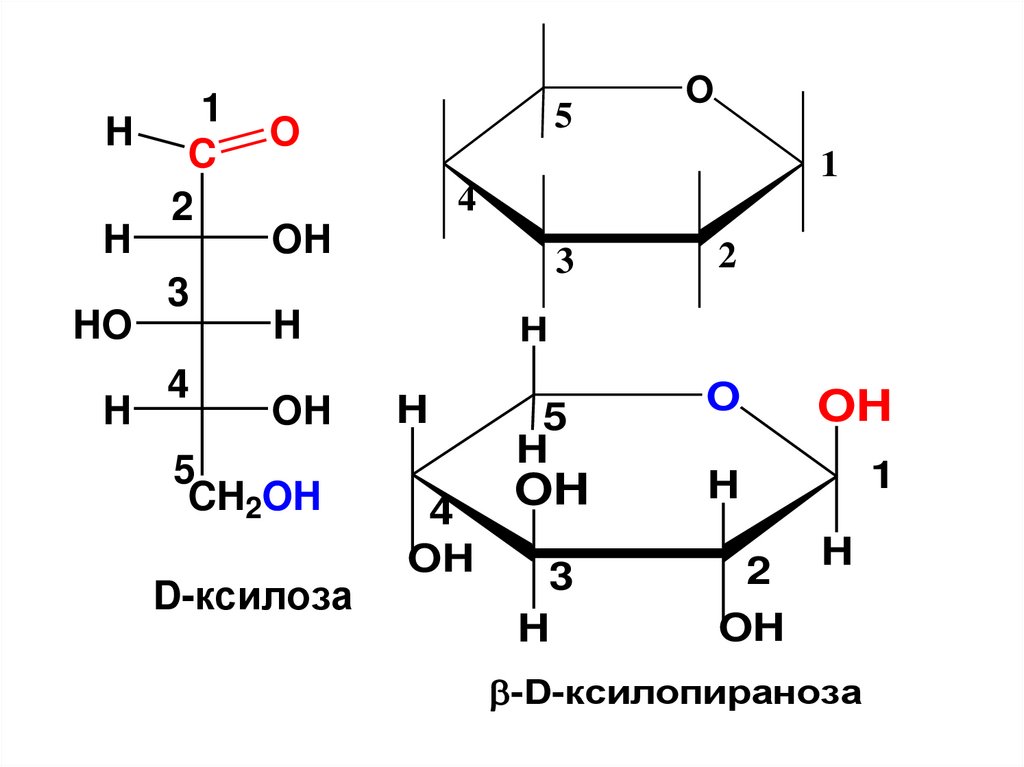
D-ксилоза
D-арабиноза
28.
CHOCHO
CHO
H
OH
HO
H
H
OH
HO
H
HO
H
HO
H
H
OH
H
OH
HO
H
H
OH
H
OH
H
OH
CH2OH
CH2OH
CH2OH
D-глюкоза
D-манноза
D-галактоза
29.
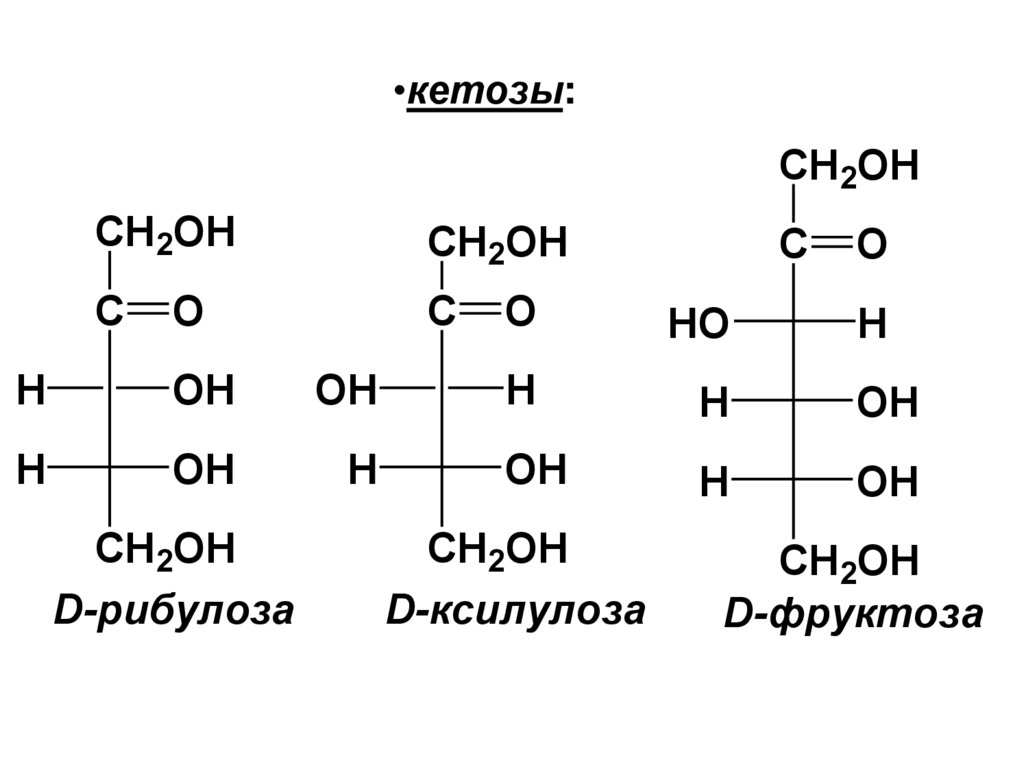
• Названия кетоз образуют из названийсоответствующих альдоз, заменяя
суффикс «оза» на «улоза». Некоторые
кетозы имеют тривиальные названия,
например «фруктоза».
30.
•кетозы:CH2OH
CH2OH
CH2OH
C
C
O
C
O
O
HO
H
H
OH
OH
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D-рибулоза
CH2OH
D-ксилулоза
CH2OH
D-фруктоза
31.
• От тривиальных названийобразуют названия
дезоксисахаров, аминосахаров,
карбоксилсодержащих сахаров,
многоатомных спиртов и других
производных.
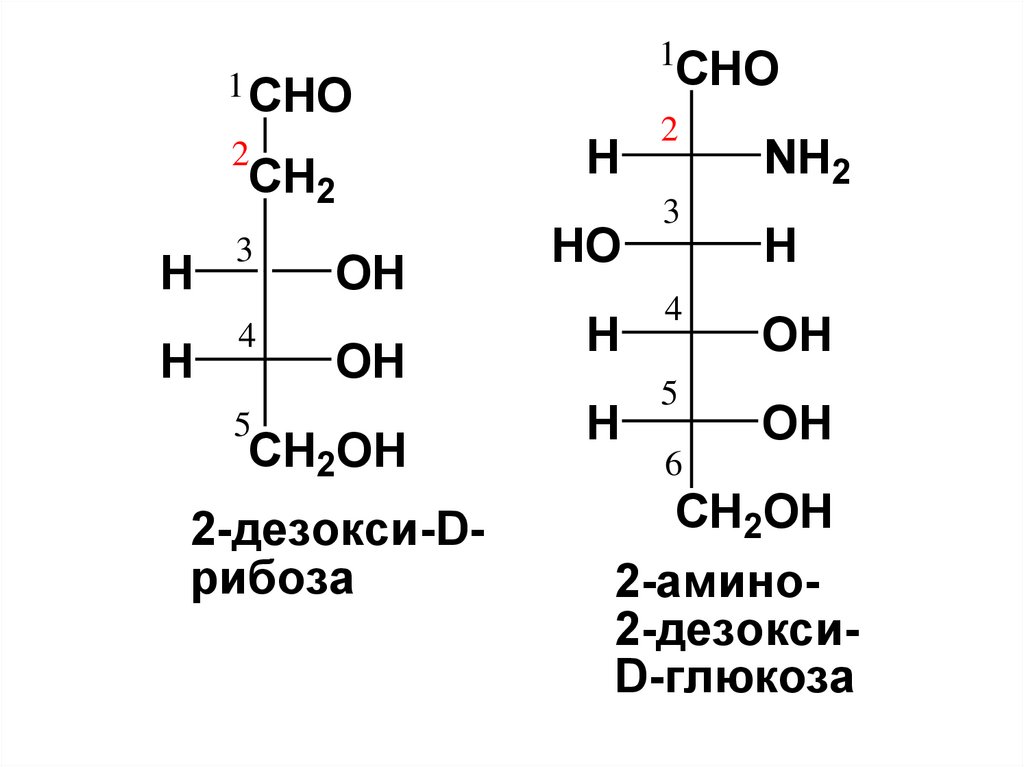
32.
• При этом:1) С-атомы нумеруют, начиная с того
конца, к которому ближе
карбонильная группа;
2) цифрами указывают положение
заместителей в С-цепи;
3) если заместитель связан не с Сатомом монозы, то указывают атом, с
которым заместитель связан
непосредственно.
33.
1CHO
1 CHO
2
СH2
H
3
H
4
OH
OH
5
CH2OH
2-дезокси-Dрибоза
H
HO
2
3
NH2
H
H
4
OH
H
5
OH
6
CH2OH
2-амино2-дезоксиD-глюкоза
34.
HHO
H
H
1 CHO
1 CHO
2
H
2
OCH3
H3CO
3
H
3
4
5
6
NHCOCH3
H
OH
OH
CH2OH
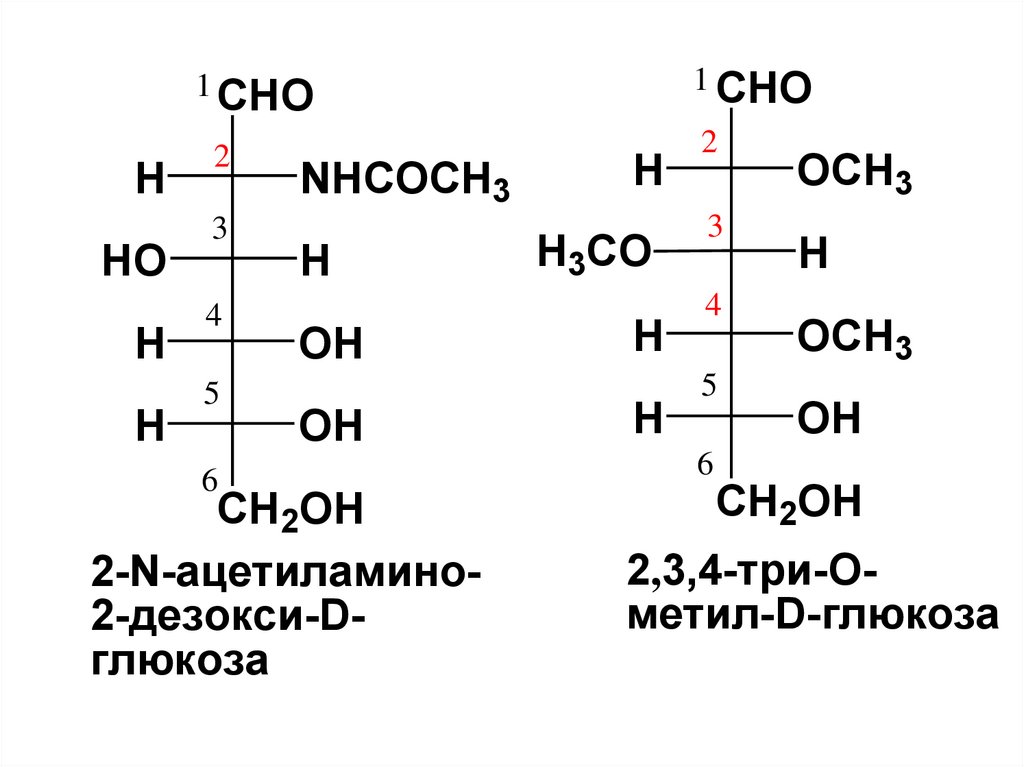
2-N-ацетиламино2-дезокси-Dглюкоза
H
H
4
5
6
OCH3
OH
CH2OH
2,3,4-три-Ометил-D-глюкоза
35.
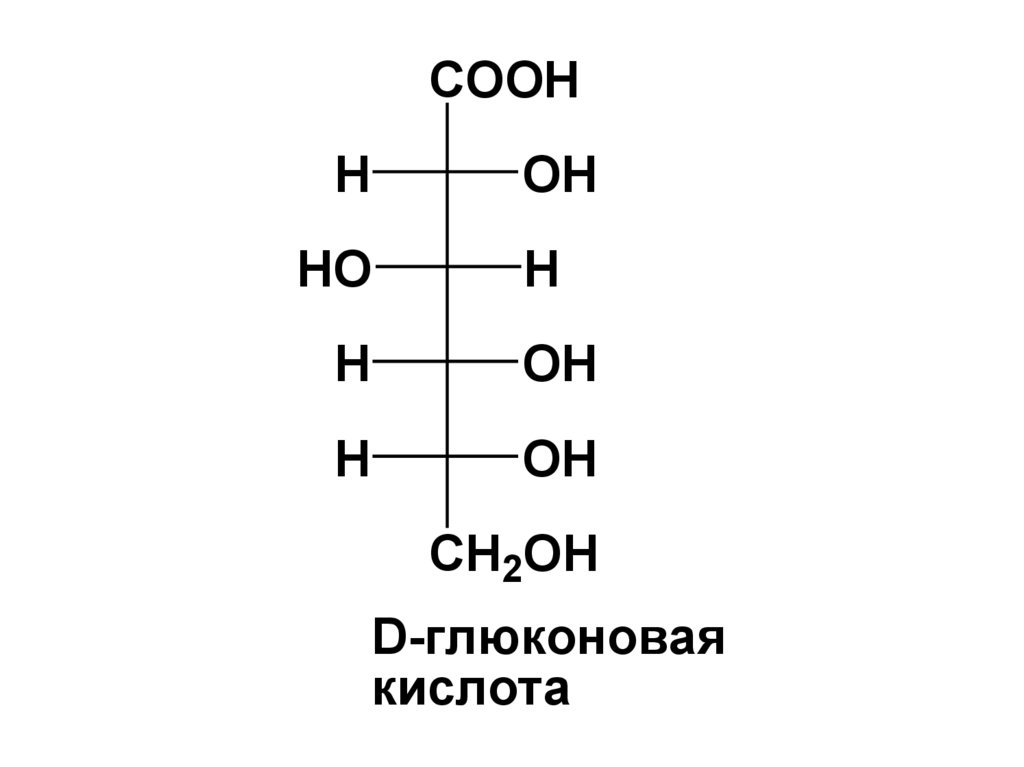
• Названия кислых сахаров образуютследующим образом:
• производные МС, содержащие
СООН-группу в 1-ом положении
называют альдоновыми
(гликоновыми) кислотами –
суффикс «оза» в названии
монозы заменяют на «оновая
кислота»;
36.
COOHH
OH
HO
H
H
OH
H
OH
CH2OH
D-глюконовая
кислота
37.
• Если СООН-группа находится в концецепи, то такие кислоты называют
уроновыми кислотами – суффикс
«оза» в названии монозы заменяют
на «уроновая кислота» (при
нумерации отсчет ведут
• ! от альдегидной группы, несмотря на
присутствие более старшей СООН-гр.)
38.
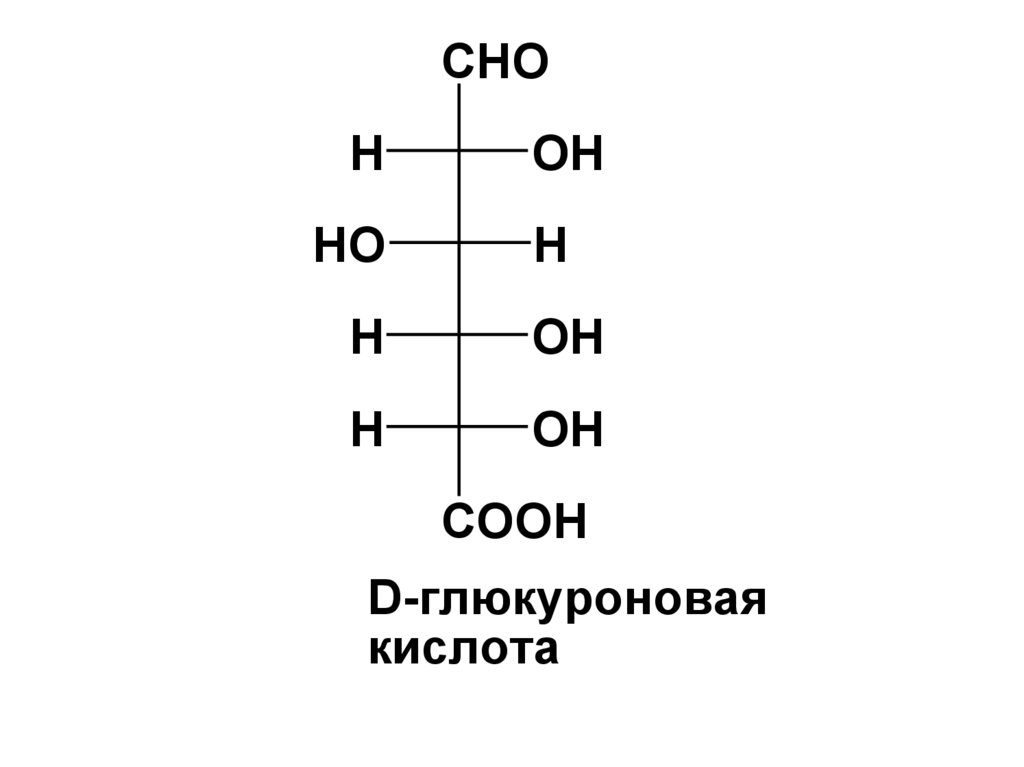
CHOH
OH
HO
H
H
OH
H
OH
COOH
D-глюкуроновая
кислота
39.
• Производные МС, содержащие двекарбоксильные группы в первом и
последнем положениях С-цепи называют
альдаровыми (гликаровыми) кислотами –
суффикс «оза» в названии монозы
заменяют на «аровая кислота».
• Локант 1 получает С-атом
потенциальной карбонильной
группы соответствующей монозы,
что важно для названия
производных гликаровых кислот.
40.
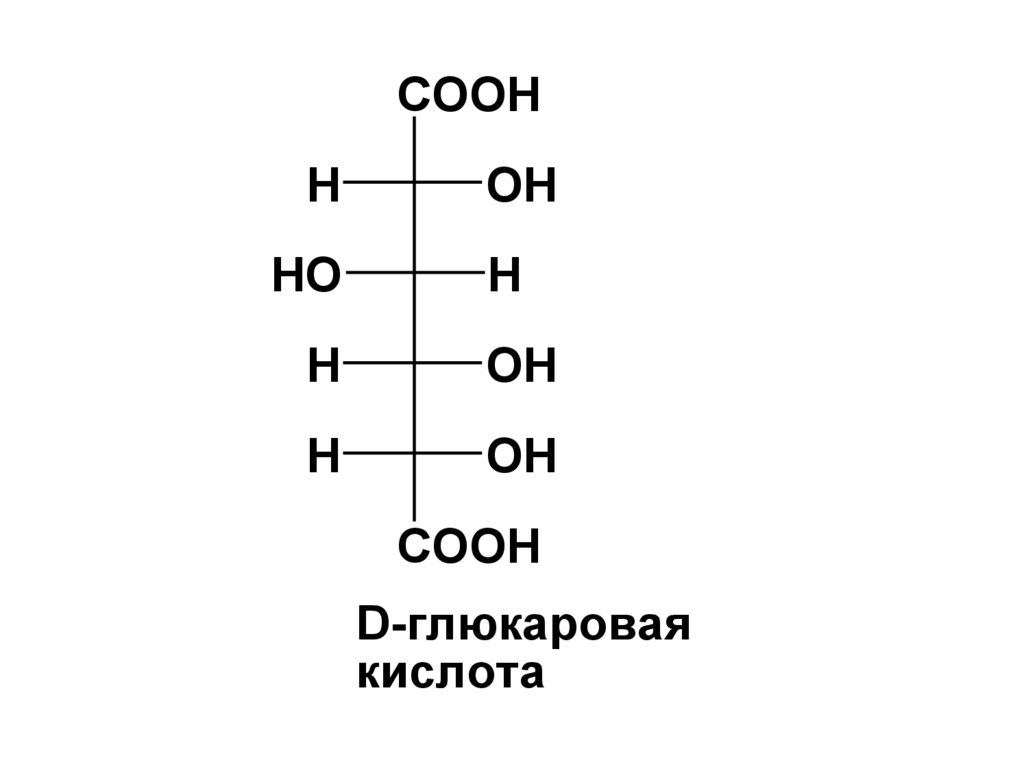
COOHH
OH
HO
H
H
OH
H
OH
COOH
D-глюкаровая
кислота
41.
COOHH
OH
H3CO
H
HO
H
H
OH
COOH
3-O-метил-D-галактаровая
кислота
42.
• Многоатомные спирты,образующиеся из МС называют
глициты (глицитолы) – суффикс «оза»
в названии монозы заменяют на «ит»
( «итол»)
“itol”
43.
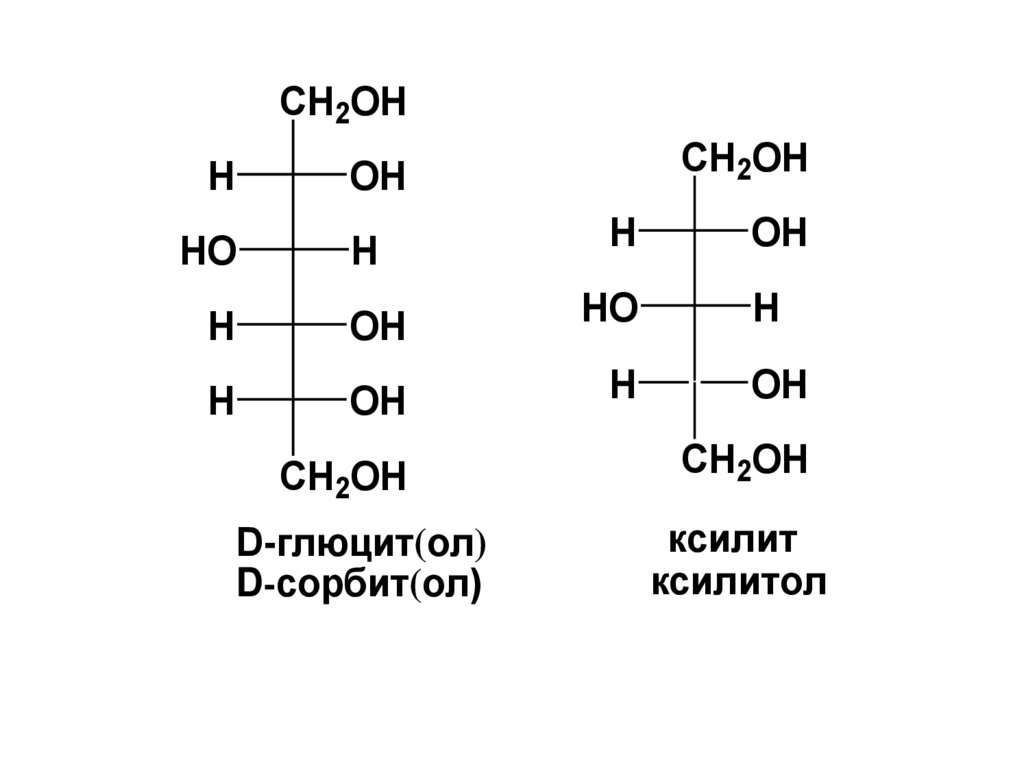
CH2OHCH2OH
H
OH
HO
H
H
OH
H
OH
HO
H
H
OH
H
OH
CH2OH
CH2OH
D-глюцит(ол)
D-сорбит(ол)
ксилит
ксилитол
44.
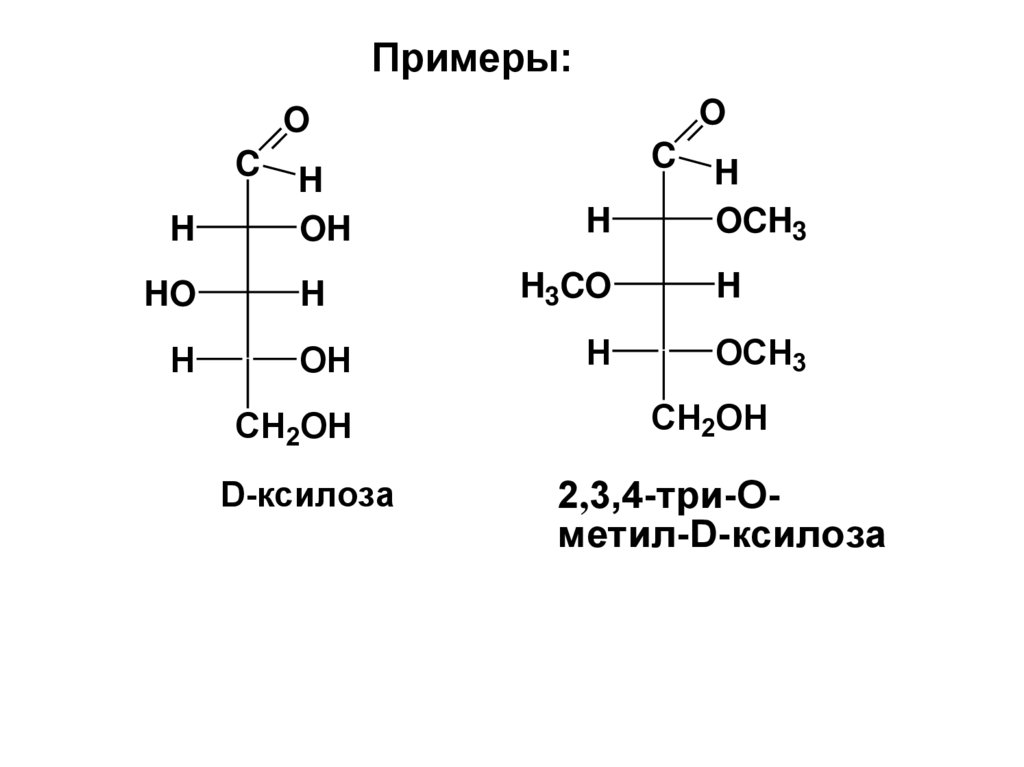
Примеры:O
O
C
H
H
OH
HO
H
H
OH
C
H
H3CO
H
H
OCH3
H
OCH3
CH2OH
CH2OH
D-ксилоза
2,3,4-три-Ометил-D-ксилоза
45.
OC
O
C
H
H
H
OH
H
OH
H
OH
H
OH
HO
H
HO
H
HO
H
HO
H
CH2OH
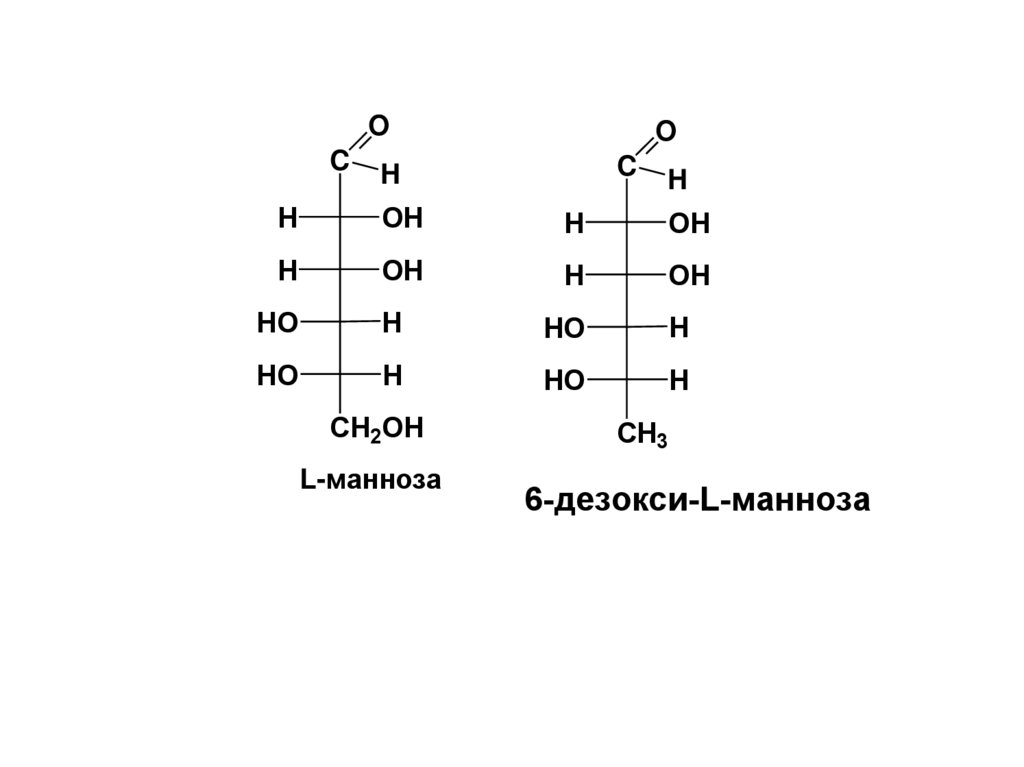
L-манноза
CH3
6-дезокси-L-манноза
46.
OO
C
C
H
H
OH
H
H
OH
HO
H
HO
H
HO
H
HO
H
H
OH
H
OH
CH2OH
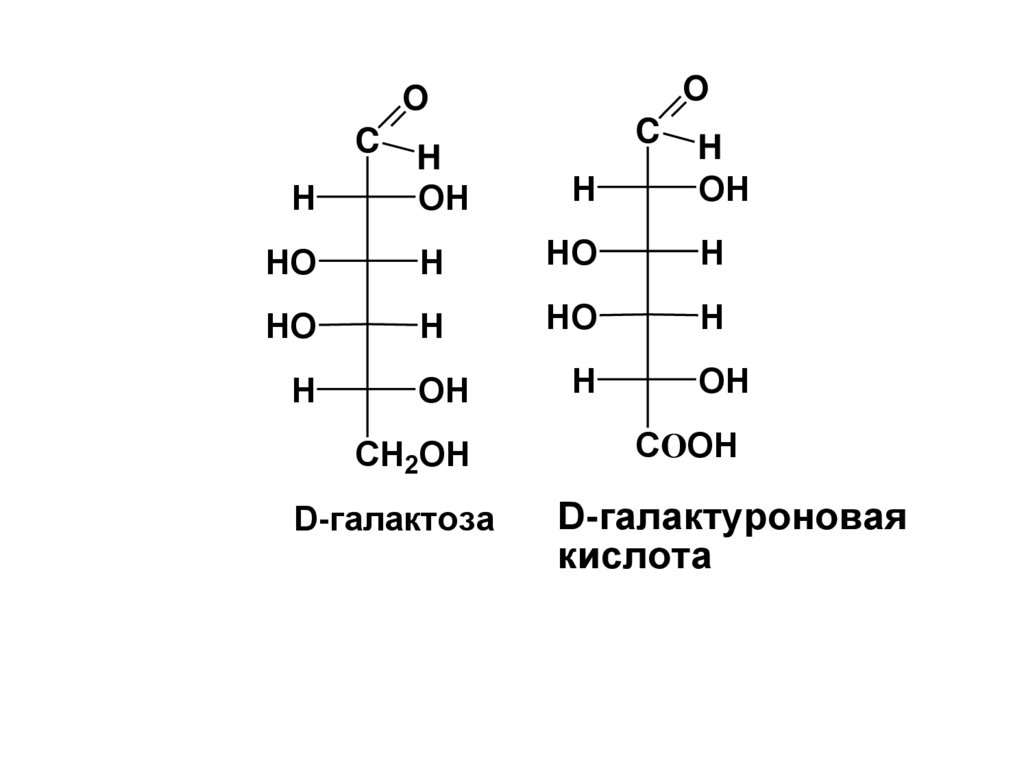
D-галактоза
COOH
D-галактуроновая
кислота
47.
OO
C
C
COOH
CH2OH
HO
OH
H
HO
H
HO
H
OH
H
OH
H
OH
H
OH
OH
H
OH
H
OH
H
OH
HO
H
H
H
H
CH2OH
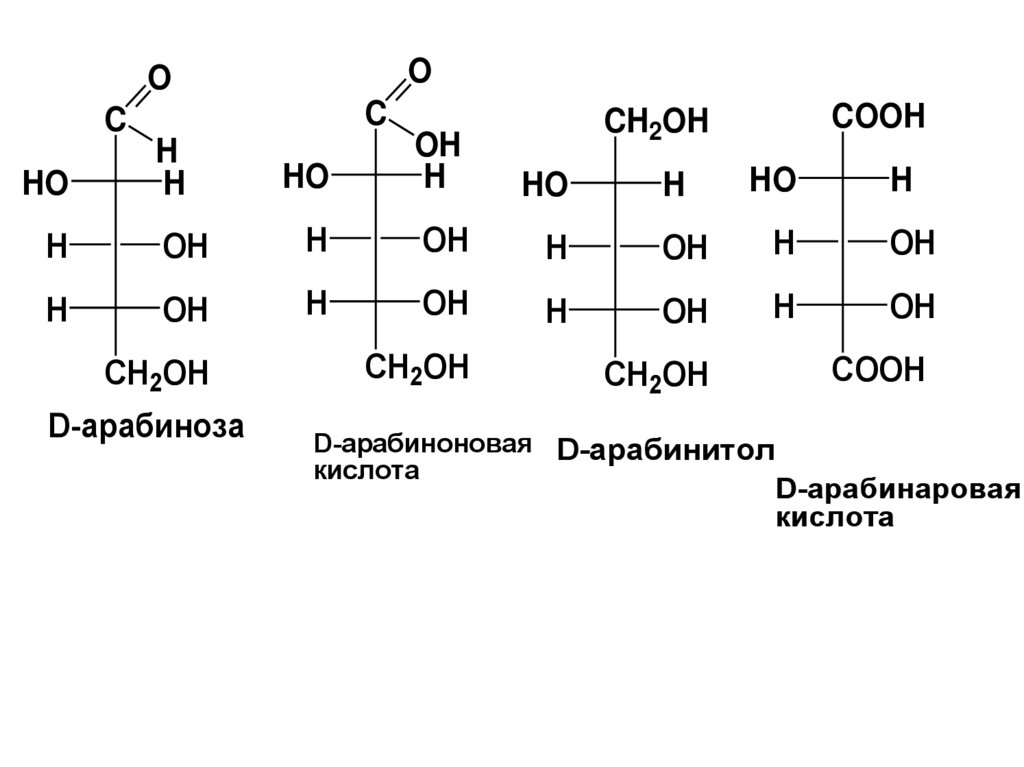
D-арабиноза
CH2OH
CH2OH
D-арабиноновая D-арабинитол
кислота
COOH
D-арабинаровая
кислота
48. Химическое строение
МС по химической природеявляются
полигидроксиальдегидами, либо
полигидроксикетонами.
49.
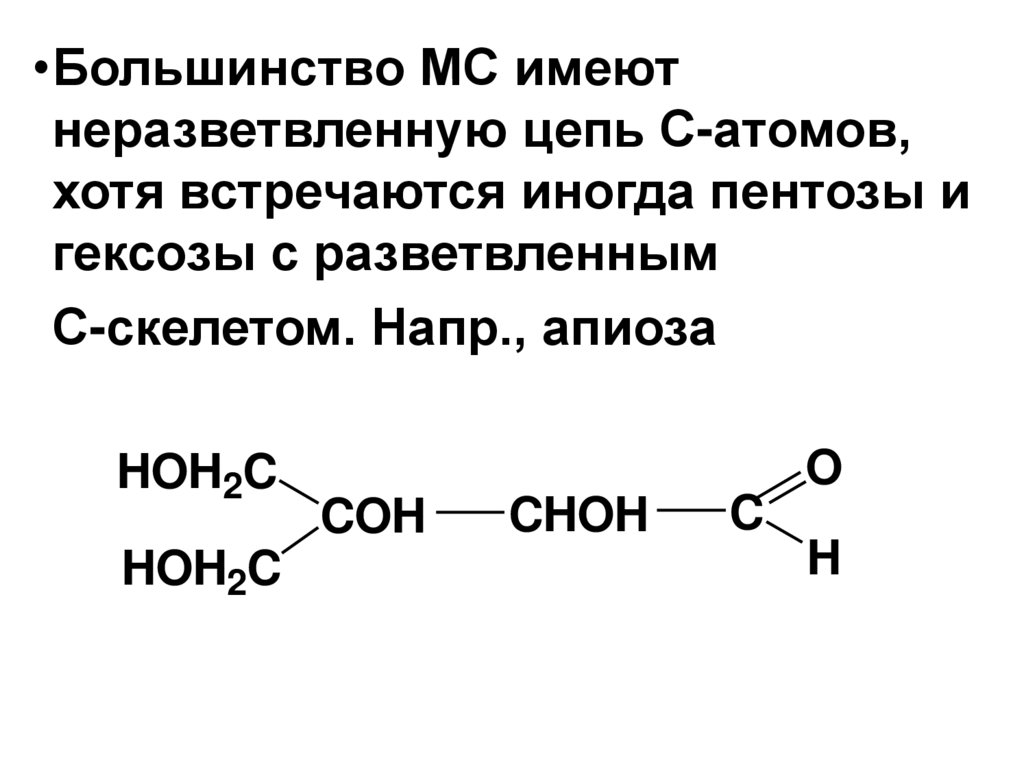
•Большинство МС имеютнеразветвленную цепь С-атомов,
хотя встречаются иногда пентозы и
гексозы с разветвленным
С-скелетом. Напр., апиоза
HOH2C
HOH2C
O
COH
CHOH
C
H
50.
• Рассмотрим строение МС напримере гексозы глюкозы. Гексозы
имеют молекулярную формулу
С6Н12О6.
• 6 атомов С глюкозы имеют
неразветвленную цепь.
CH2(OH)
CH(OH)
CH(OH)
O
CH(OH)
CH(OH)
C
H
51.
• Это так называемая открытаяформа («оксо-форма»). Она
представляет собой
пятиатомный альдегидоспирт.
Эта форма существует только в
растворах в равновесии с
циклической
полуацетальной
формой.
52.
• МС (кроме триоз) в кристаллическомсостоянии представляют собой
внутренние циклические
полуацетали
полигидроксиальдегидов или
полигидроксикетонов.
• Полуацетали образуются при
присоединении молекулы спирта к
альдегиду:
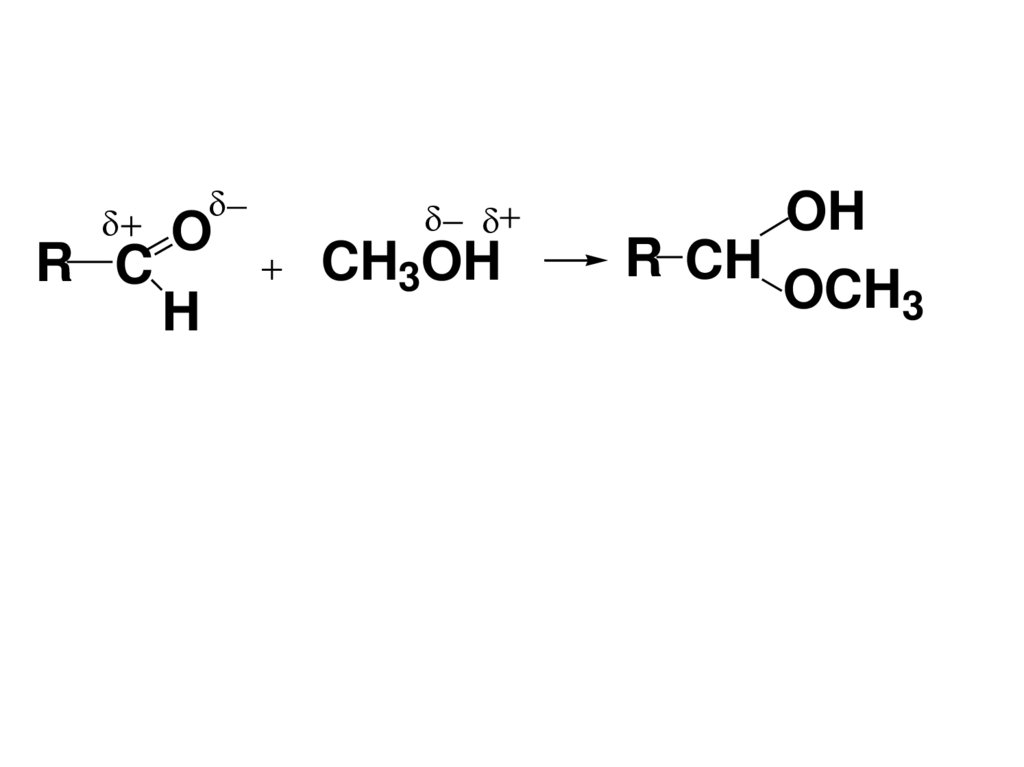
53.
R CO
H
CH3OH
OH
R CH
OCH3
54.
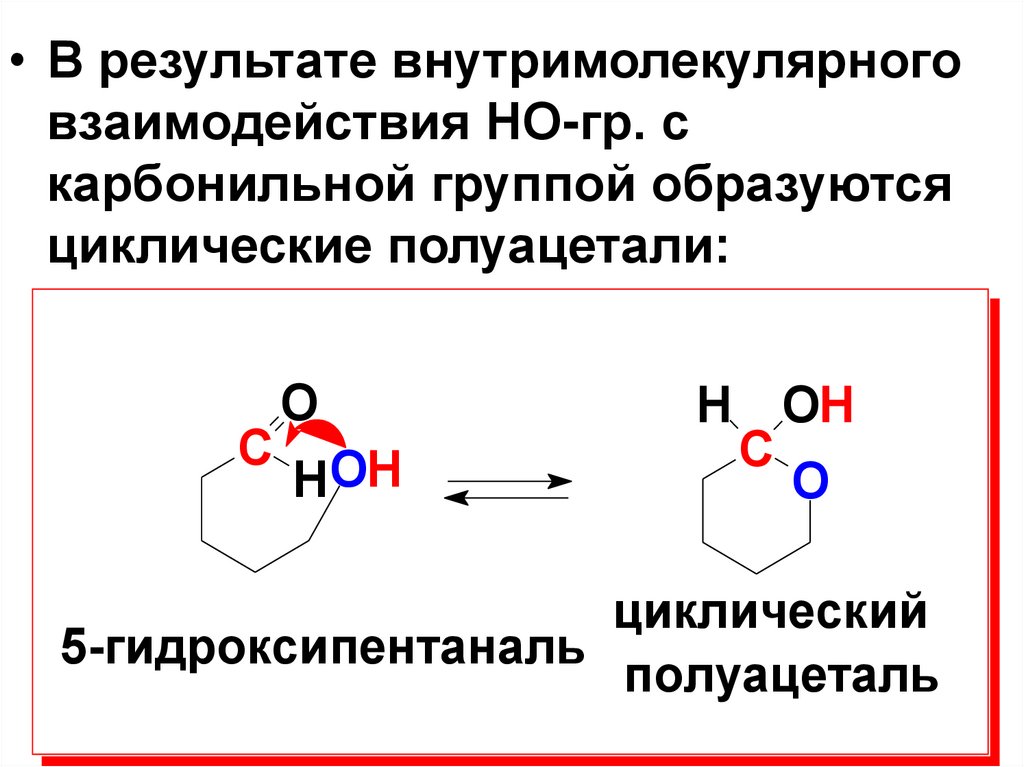
• В результате внутримолекулярноговзаимодействия НО-гр. с
карбонильной группой образуются
циклические полуацетали:
С
O
HOH
H OH
C
O
циклический
5-гидроксипентаналь
полуацеталь
55.
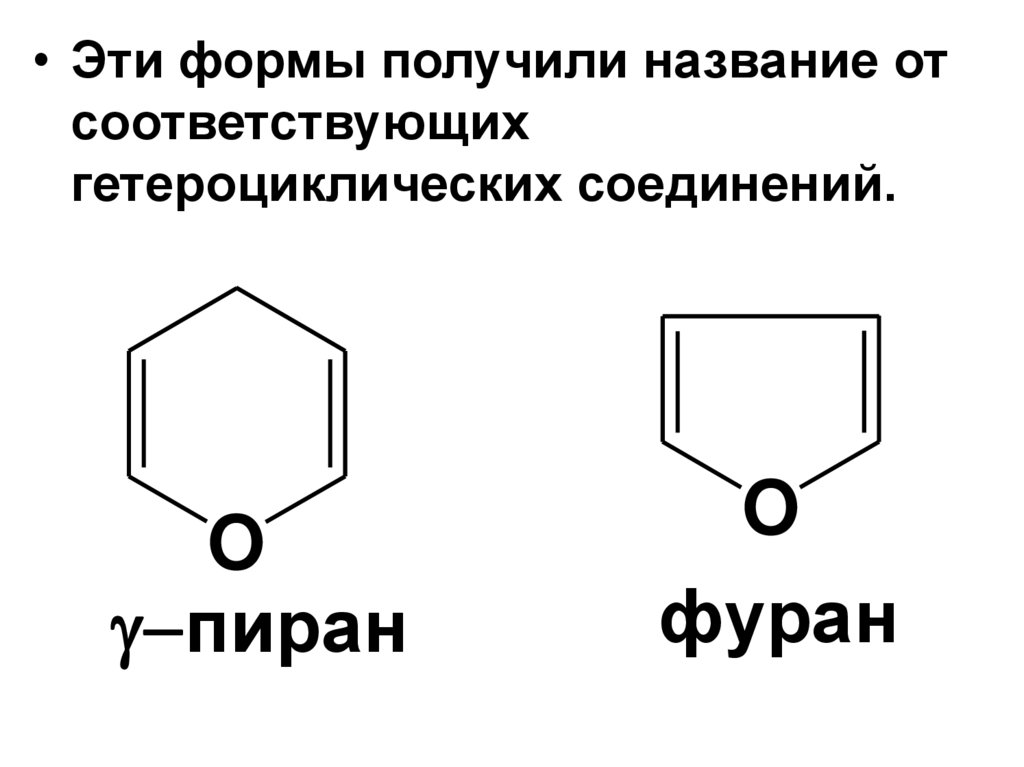
• Циклические формы альдогексозобразуются в результате
внутримолекулярного
взаимодействия альдегидной
группы с НО-группой у С5 или С4 –
атома:
О-атом НО-группы образует связь с
карбонильным С-атомом, а Н-атом
НО-группы - c О-атомом
карбонильной группы
56.
• В результате образуютсяустойчивые циклические
полуацетальные формы
• – пиранозная
(6-членный цикл),
• – фуранозная
(5-членный цикл).
57.
• Эти формы получили название отсоответствующих
гетероциклических соединений.
O
пиран
O
фуран
58.
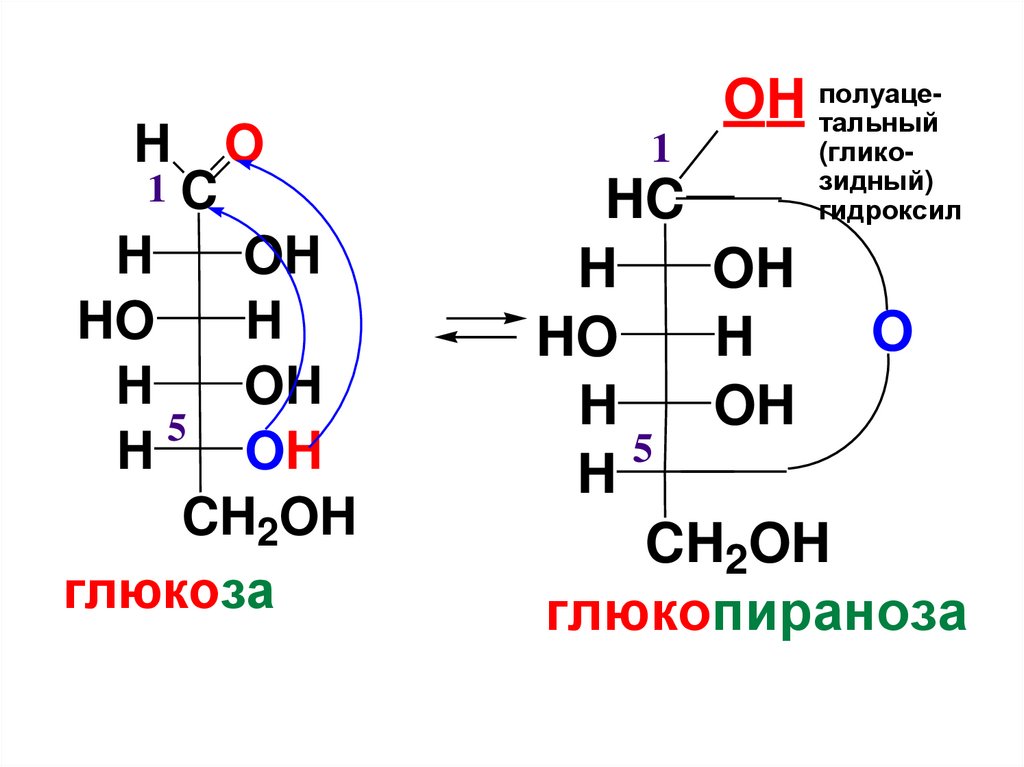
H1C
O
H
OH
HO
H
H
OH
5
H
OH
CH2OH
глюкоза
1
OH полуацетальный
(гликозидный)
гидроксил
HC
H
OH
O
HO
H
H
OH
5
H
CH2OH
глюкопираноза
59.
H O1C
H
OH
HO
H
4
H
OH
H
OH
CH2OH
глюкоза
1
OH полуацетальный
(гликозидный)
гидроксил
HC
H
OH
O
HO
H
4
H
H
OH
CH2OH
глюкофураноза
60.
• Для указания размера колецциклических форм
• для 6-членного цикла две
последние буквы в названии МС
«за» заменяют суффиксом
«пираноза»,
• для 5-членного цикла
суффиксом «фураноза».
61.
Необходимо подчеркнуть, что6-членный цикл включает
5 атомов C и 1 атом O,
5-членный – 4 и 1 соответственно.
62.
OH1
HC
H
OH
O
HO
H
H
OH
5
H
CH2OH
глюкопираноза
OH
1
HC
H
OH
O
HO
H
4
H
H
OH
CH2OH
глюкофураноза
63.
• Образование циклическойформы вызывает появление
дополнительного
асимметрического атома С и
ещё одной гидроксильной
группы, которая называется
полуацетальной или
гликозидной
64.
• В циклической форме альдогексозы имеются только гидроксильные группы, причем они разные:один ОН полуацетальный
(гликозидный) – появился в
результате внутримолекулярного
взаимодействия карбонильной и
спиртовой групп; другие НО-группы
– спиртовые:
• один первичный,
• остальные вторичные.
65. Стереохимия моносахаридов
• В молекулах МС естьасимметрические С-атомы
(хиральные центры).
• Альдотриозы имеют 1 хиральный
центр, альдотетрозы – 2,
альдопентозы –3, альдогексозы –4.
• Кетозы содержат на 1 хиральный
центр меньше, чем альдозы с тем
же числом С-атомов.
66.
OO
C
C
H
*CHOH
H
* CHOH
*CHOH
* CHOH
*CHOH
* CHOH
*CHOH
CH2OH
CH2OH
альдогексоза
альдопентоза
67.
CH2OHC
O
HO *
H
H *
OH
H *
OH
CH2OH
кетогексоза
68.
• Для изображения стереоизомеровпользуются формулами Фишера.
• С-цепь МС изображают
вертикальной линией с оксогруппой
расположенной в верхней части
цепи.
• Асимметрические С-атомы
находятся на перекрещивании
прямых линий, указывающих связи
их с Н и НО-группой, которые пишут
слева или справа в соответствии с
пространственным расположением.
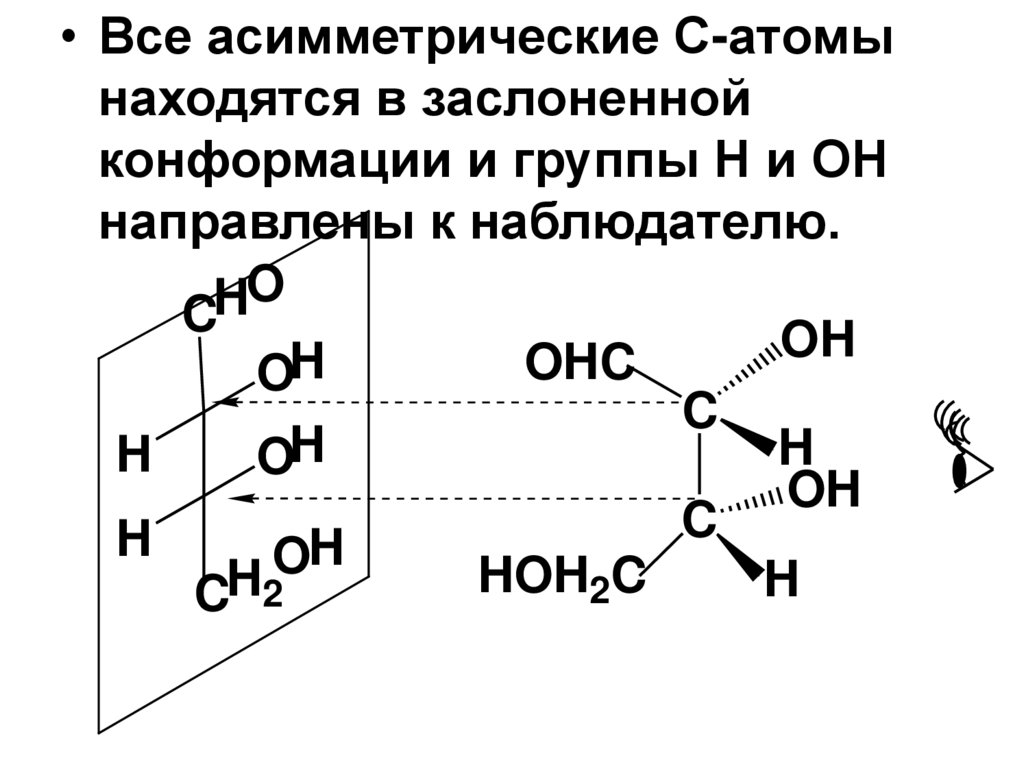
69.
• Все асимметрические С-атомынаходятся в заслоненной
конформации и группы Н и ОН
направлены к наблюдателю.
O
H
C
OH
OHC
OH
C
H
H
OH
OH
C
H
H
O
HOH2C
H
CH2
70.
• Количество стереоизомеровсогласно формуле Фишера равно:
n
N=2 ,
• где n – число асимметрических
атомов С.
• Для каждого из оптических изомеров
существует один его оптический
антипод – энантиомер, который имеет
противоположную конфигурацию
всех асимметрических С-атомов.
Напр.:
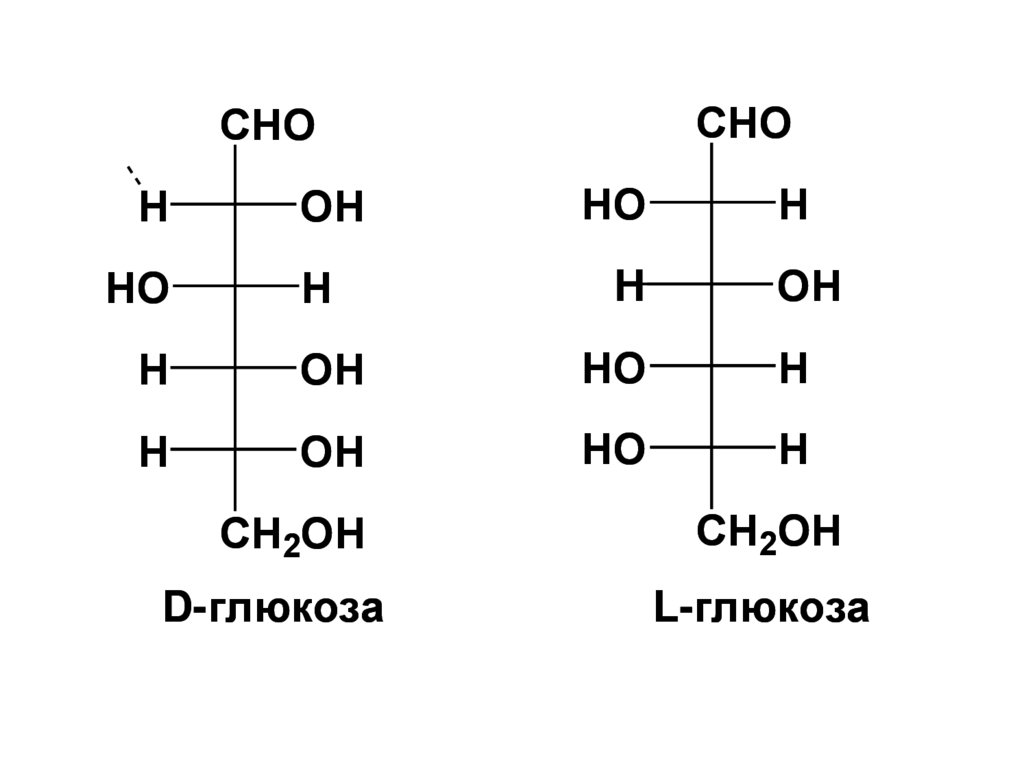
71.
CHOCHO
H
OH
HO
H
HO
H
H
OH
H
OH
HO
H
H
OH
HO
H
CH2OH
CH2OH
D-глюкоза
L-глюкоза
72.
• Триозы – 2 стереоизомера (параантиподов);
• Тетрозы – 4 стереоизомера или 2
пары антиподов;
• Пентозы – 8 стереоизомеров или 4
пары антиподов;
• Гексозы – 16 стереоизомеров или 8
пар антиподов.
• Эти антиподы относятся к 2 рядам:
правому (D-ряд) и левому (L-ряд).
73.
• Стереоизомеры из разных парэнантиомеров по отношению друг
к другу являются
диастереомерами (отличаются
конфигурацией хотя бы одного
асимметрического С-атома, т. е. не
являются зеркальным
отображением друг друга).
74.
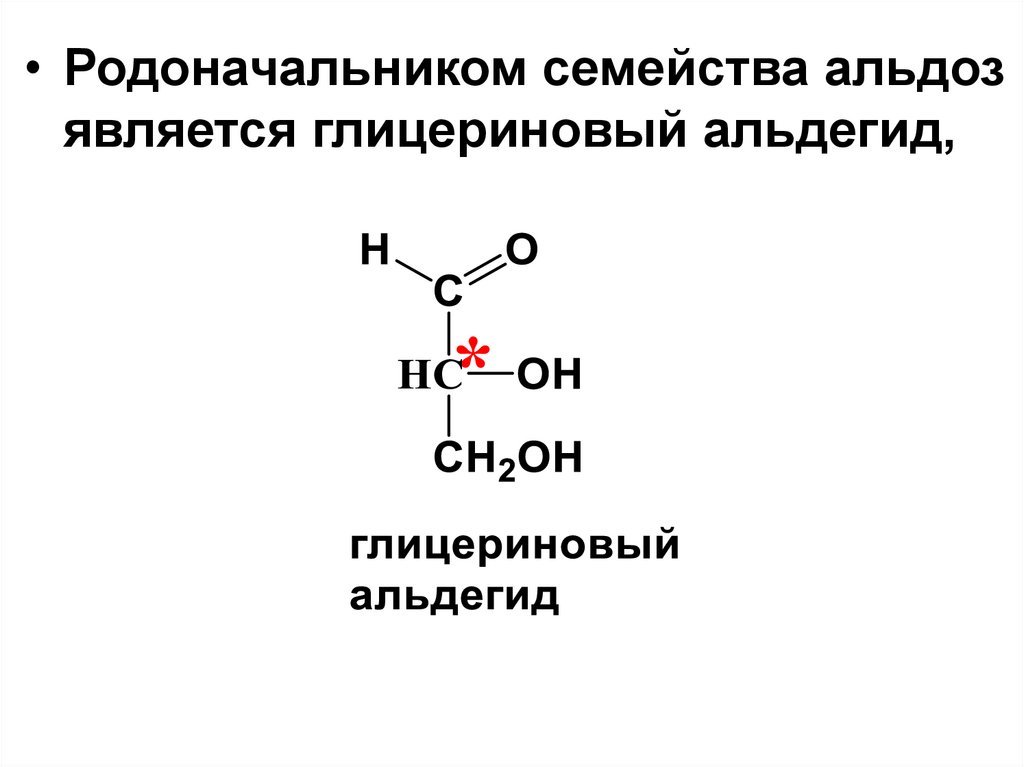
• Родоначальником семейства альдозявляется глицериновый альдегид,
75.
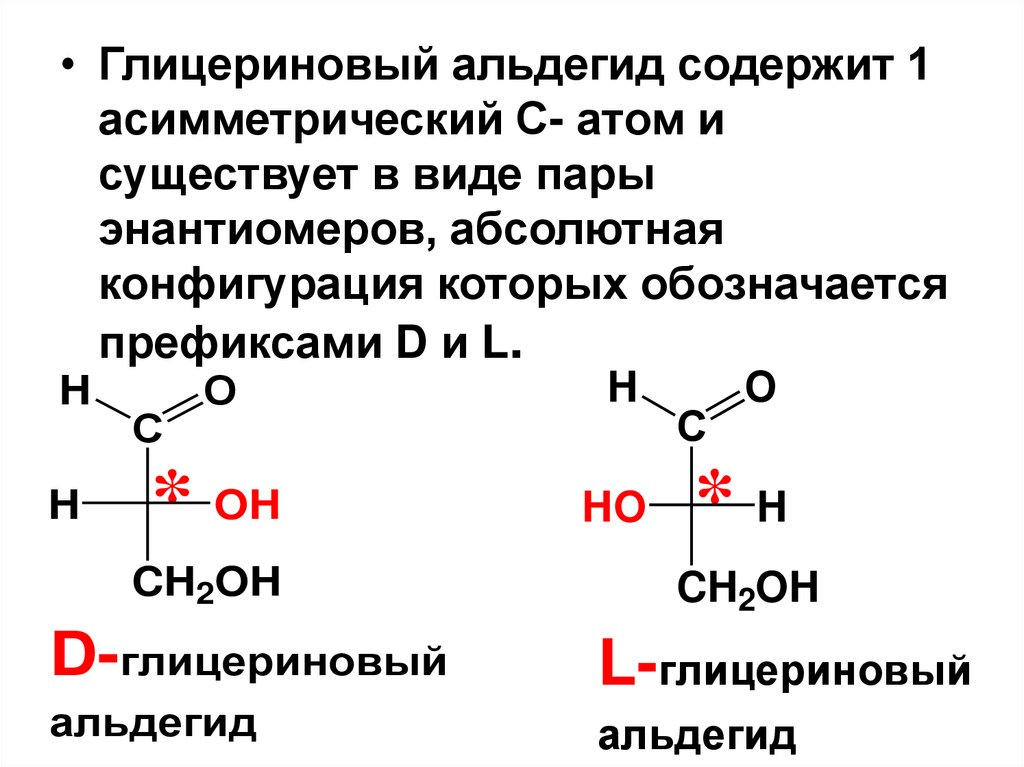
• Глицериновый альдегид содержит 1асимметрический С- атом и
существует в виде пары
энантиомеров, абсолютная
конфигурация которых обозначается
префиксами D и L.
H
H
O
H
* OH
HO
С
CH2OH
С
O
*H
CH2OH
D-глицериновый
L-глицериновый
альдегид
альдегид
76.
• В соответствии с таким отнесением всеМС разделены на принадлежащие к Dили L- рядам (генетическим рядам).
• Принадлежность МС к D- или L- ряду
определяется по
конфигурации его последнего
(считая от альдегидной группы)
асимметрического атома углерода.
• Этот атом С называют
конфигурационным атомом.
77.
• Если ОН гр. или другой заместитель,или О-атом, образующий циклическую
форму у конфигурационного атома в
формуле Фишера МС находится
справа, как в формуле
• D-глицеринового альдегида, то
моноза относится к D-ряду,
• если слева, как у L- глицеринового
альдегида, то к L-ряду.
Например:
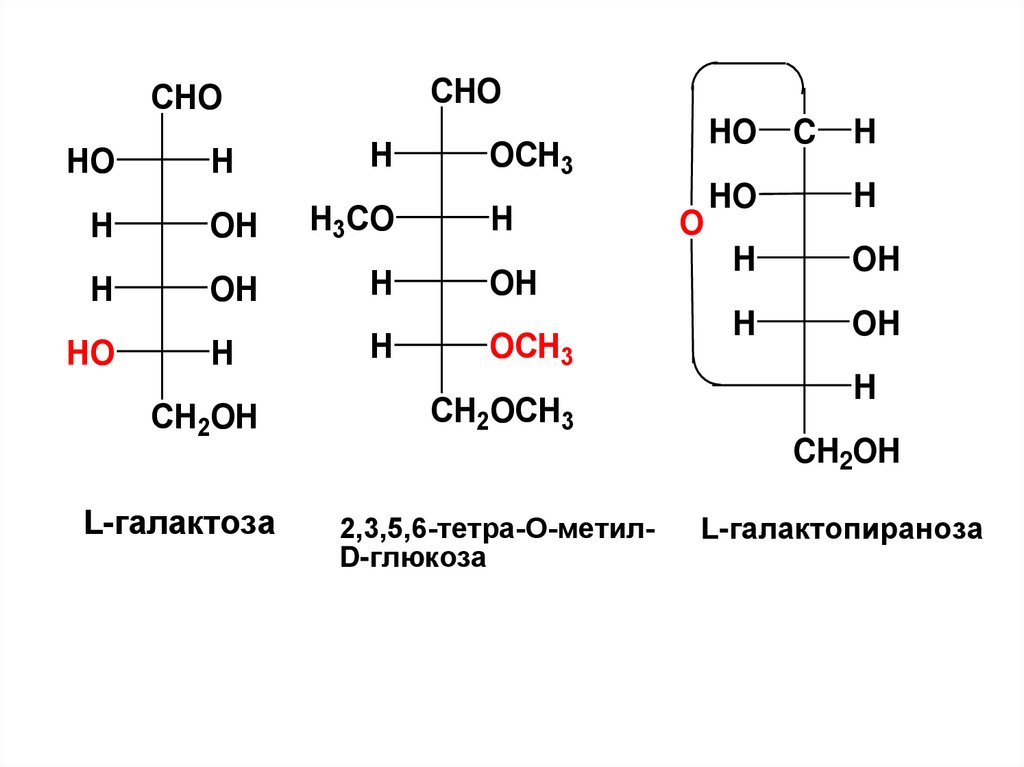
78.
CHOCHO
HO
H
H
HO
H
OH
OH
H
CH2OH
L-галактоза
H
H3CO
H
H
HO
OСH3
H
OH
OСH3
CH2OCH3
O
C
H
HO
H
H
OH
H
OH
H
CH2OH
2,3,5,6-тетра-О-метилD-глюкоза
L-галактопираноза
79.
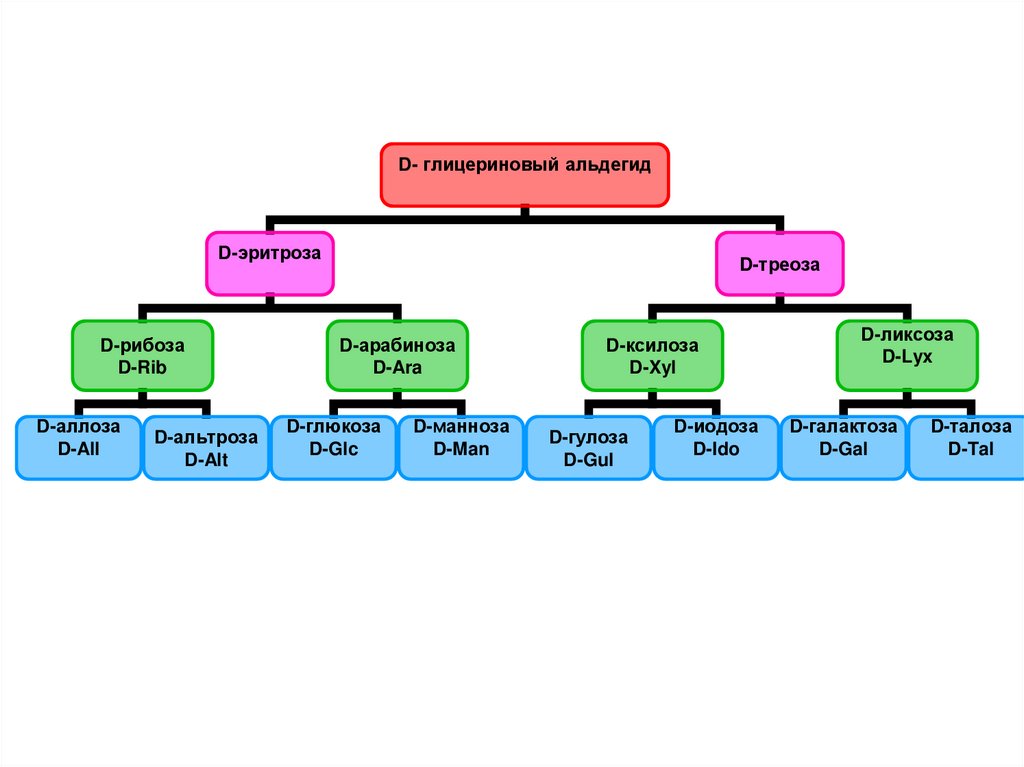
• Большинство природных МСотносится к D-ряду.
80.
D- глицериновый альдегидD-эритроза
D-рибоза
D-Rib
D-аллоза
D-All
D-альтроза
D-Alt
D-треоза
D-арабиноза
D-Ara
D-глюкоза
D-Glc
D-манноза
D-Man
D-ксилоза
D-Xyl
D-гулоза
D-Gul
D-иодоза
D-Ido
D-ликсоза
D-Lyx
D-галактоза
D-Gal
D-талоза
D-Tal
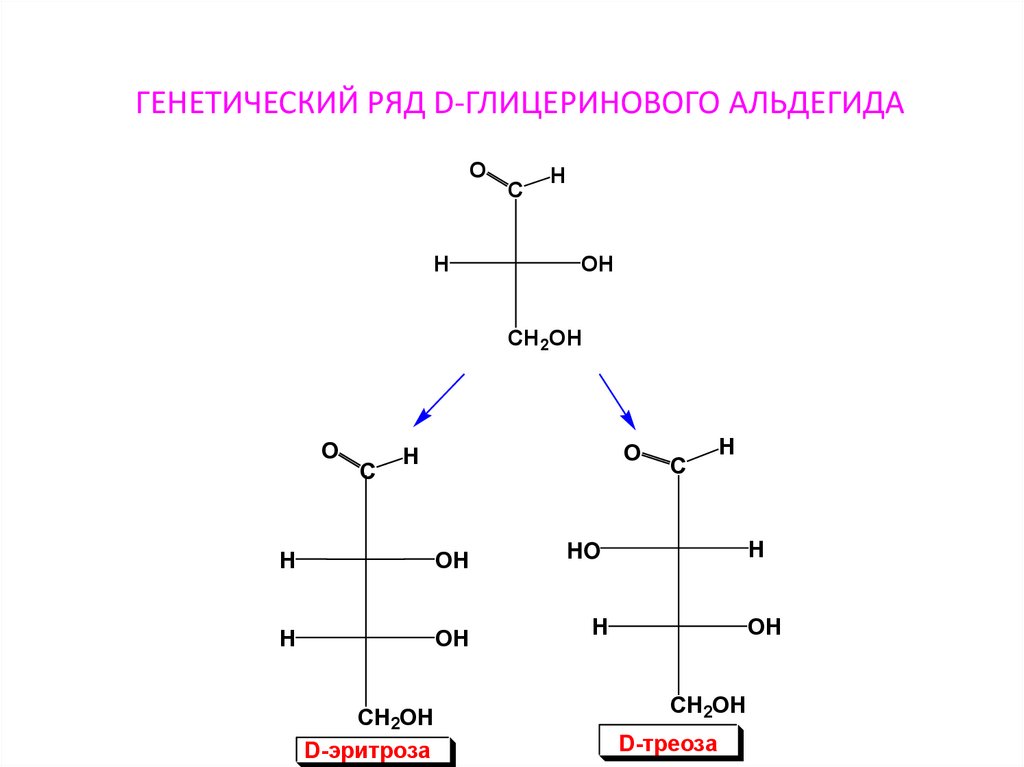
81. ГЕНЕТИЧЕСКИЙ РЯД D-ГЛИЦЕРИНОВОГО АЛЬДЕГИДА
OH
C
H
OH
CH2OH
O
C
O
H
H
OH
H
OH
CH2OH
D-эритроза
C
H
H
HO
H
OH
CH2OH
D-треоза
82.
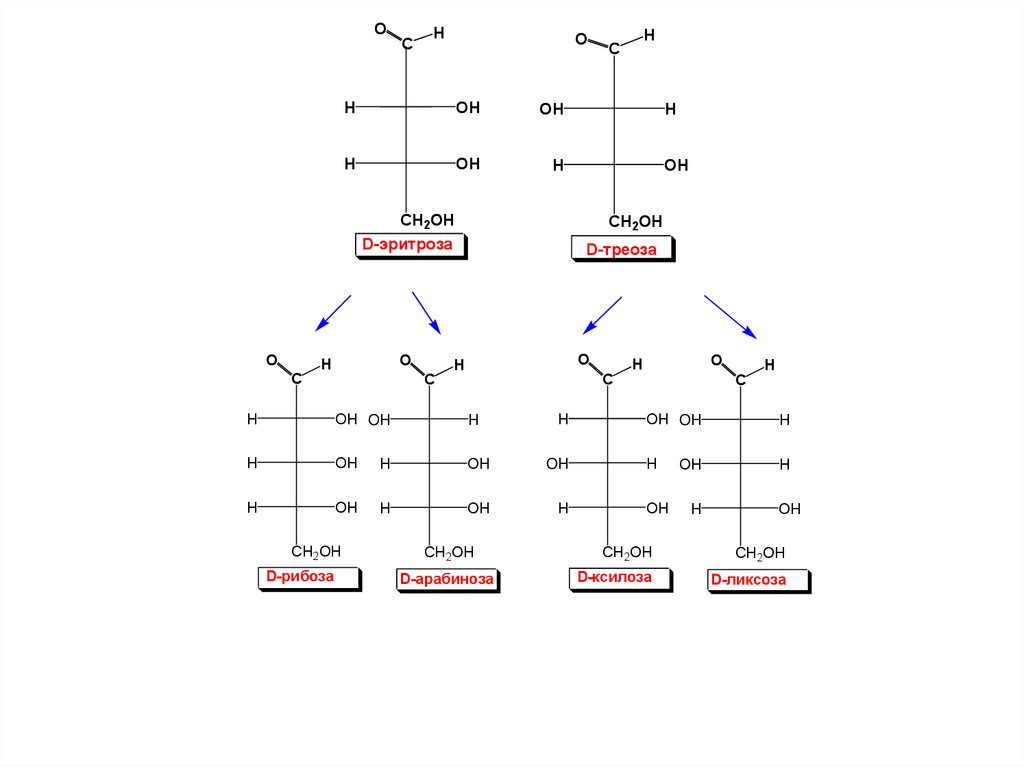
OC
H
O
H
OH
OH
H
H
OH
H
OH
CH2OH
D-эритроза
O
C
O
H
C
CH2OH
D-треоза
O
H
C
H
OH OH
H
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D-рибоза
H
C
CH2OH
D-арабиноза
O
H
C
H
OH OH
H
OH
H
OH
H
H
OH
H
OH
CH2OH
CH2OH
D-ксилоза
D-ликсоза
83.
OC
O
H
C
O
H
C
H
H
H
OH
HO
H
OH
H
OH
HO
H
OH
H
OH
H
O
H
C
H
OH
HO
H
H
HO
H
OH
H
OH
CH2OH
CH2OH
CH2OH
CH2OH
D-рибоза
D-арабиноза
D-ксилоза
D-ликсоза
CHO
CHO
CHO
CHO
CHO
CHO
CHO
CHO
H
OH HO
H
H
OH HO
H
H
OH HO
H
H
OH HO
H
H HO
H
H
OH H
OH HO
OH HO
H
OH H
H HO
H
HO
H HO
H
H
OH H
OH
H
HO
H HO
H
OH H
OH
OH
H
OH H
OH
H
OH H
OH
H
OH H
OH
H
OH H
CH2OH
CH2OH
CH2OH
CH2OH
CH2OH
CH2OH
CH2OH
CH2OH
D-Allose D-Altrose D-Glucose D-Mannose
D-Gulose D-Idose D-Galactose D-Talose
84.
• Диастереоизомерные МС,отличающиеся друг от друга
конфигурацией лишь одного
асимметрического атома C,
называются эпимерами.
• Эпимеры – частный случай
диастереоизомеров.
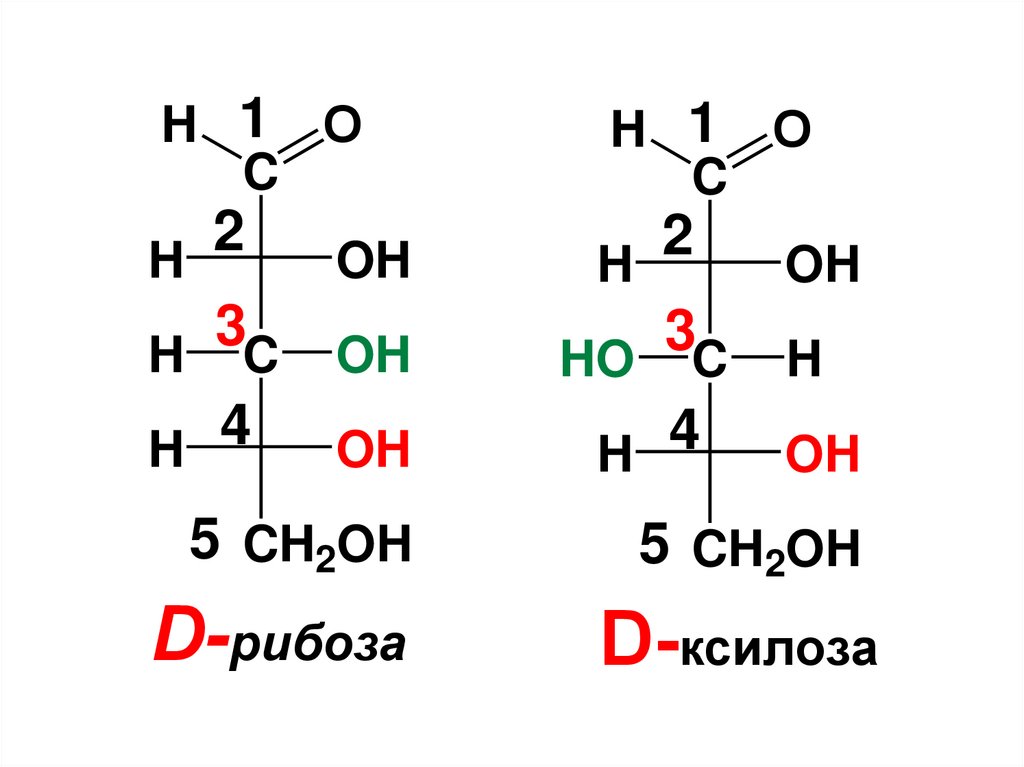
• Напр., D- рибоза и D- ксилоза
являются эпимерами по С3, т.к. они
отличаются только конфигурацией
С3.
85.
H 1 OC
H 1 O
C
2
H
2
H
OH
3
HO C
H
4
H
OH
OH
3
H C OH
4
H
OH
5 CH2OH
5 CH2OH
D-рибоза
D-ксилоза
86.
• Наиболее важными в химииуглеводов являются такие
эпимеры, которые отличаются
конфигурацией только одного,
соседнего с карбонильной
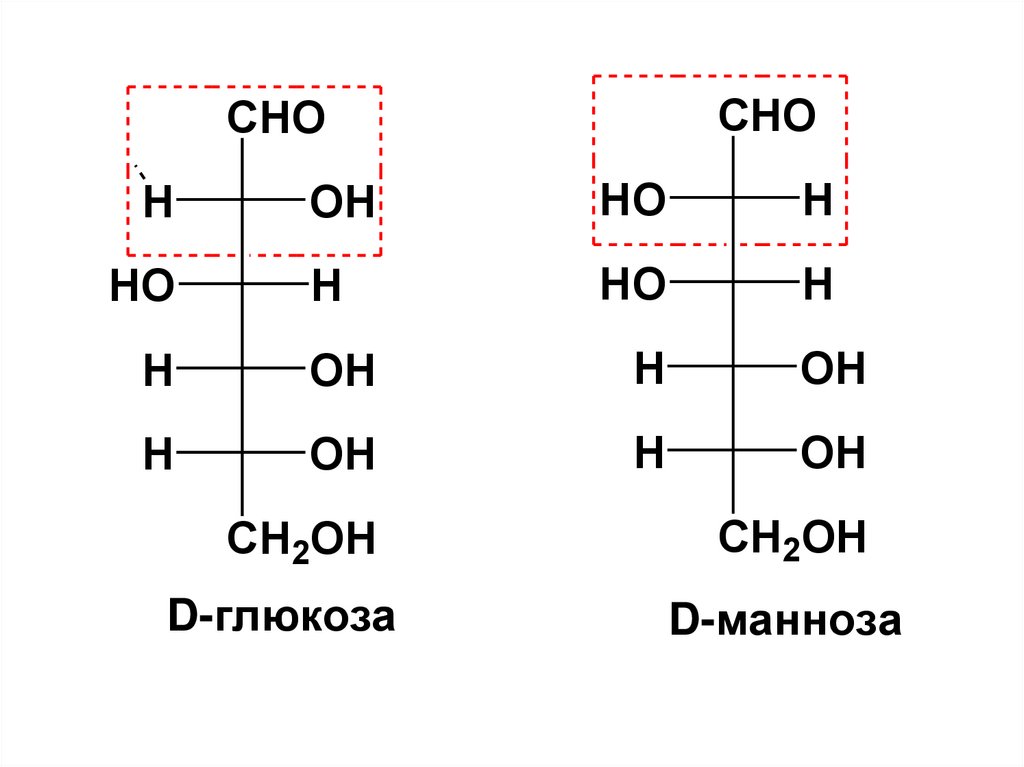
группой хирального центра (Dглюкоза, D-манноза – эпимеры
по С2).
87.
CHOCHO
H
OH
HO
H
HO
H
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2OH
D-глюкоза
D-манноза
88. Циклические формы
• В циклических формах МСнезависимо от размера кольца
(фуранозное или пиранозное) С-атом
карбонильной группы становится
асимметрическим и также имеет
2 зеркальные конфигурации, т. е. в
циклической форме у альдоз
появился новый С1 хиральный
центр (аномерный).
89.
• Две стереоизомерные формыальдоз, отличающиеся только
конфигурацией С1 (кетоз – С2)
называются аномерами.
• Они являются диастереомерами,
т.к. отличаются только
расположением гликозидного
гидроксила.
90.
• Для указания его конфигурациииспользуют аномерные
префиксы
α и β,
связанные с взаимным
расположением заместителей у
аномерного центра и у С-атома,
определяющего принадлежность
монозы к D- или L-ряду.
91.
• Циклическая форма, у которойполуацетальный гидроксил
расположен по одну сторону с
ОН, определяющей
конфигурацию монозы
(принадлежность к D- или Lряду) называется α-формой,
а по разные стороны –
β-формой.
92.
• Аномерные префиксы α- и βиспользуют только в сочетании сконфигурационными префиксами D,
L и в названии указывают перед
конфигурационными.
93.
полуацетальныегликозидные ОН-группы
HO C* H
H
*
OH
HO
*
H
H
*
OH
H
H C* OH
O
*
CH2OH
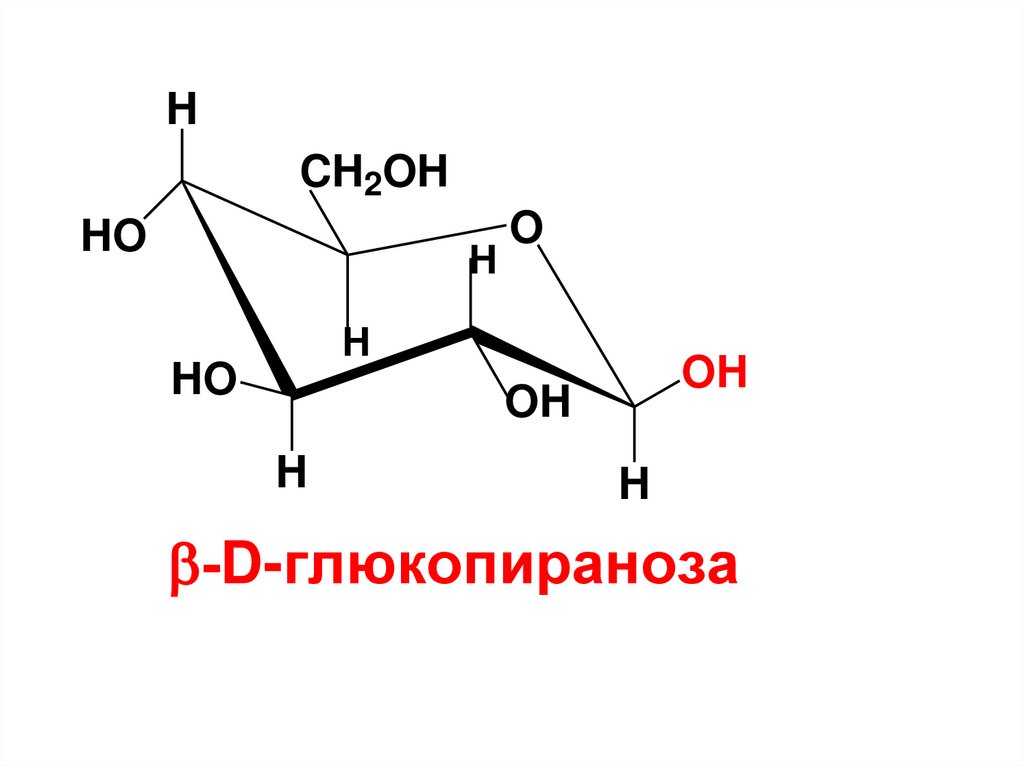
-D-глюкопираноза
H
*
OH
HO
*
H
H
*
OH
H
*
O
CH2OH
-D-глюкопираноза
94.
• В циклических формах моноз наодин асимметрический атом С
больше, чем в открытых, поэтому у
них в 2 раза большее число
оптических изомеров (за счет α- и
β-форм).
• Так, для глюкозы N=25=32.
95. Перспективные формулы Хеуорса
•Представляют собой плоские многоугольники, изображенные в перспективе :•-цикл лежит в горизонтальной плоскости,
•- связи, расположенные ближе к
наблюдателю, изображаются жирно.
•- О-атом в пиранозном цикле располагается в правом верхнем углу, в
фуранозном – за плоскостью цикла.
•С-атомы, входящие в цикл, как правило,
не пишутся, располагаются от О-атома по
часовой стрелке.
96.
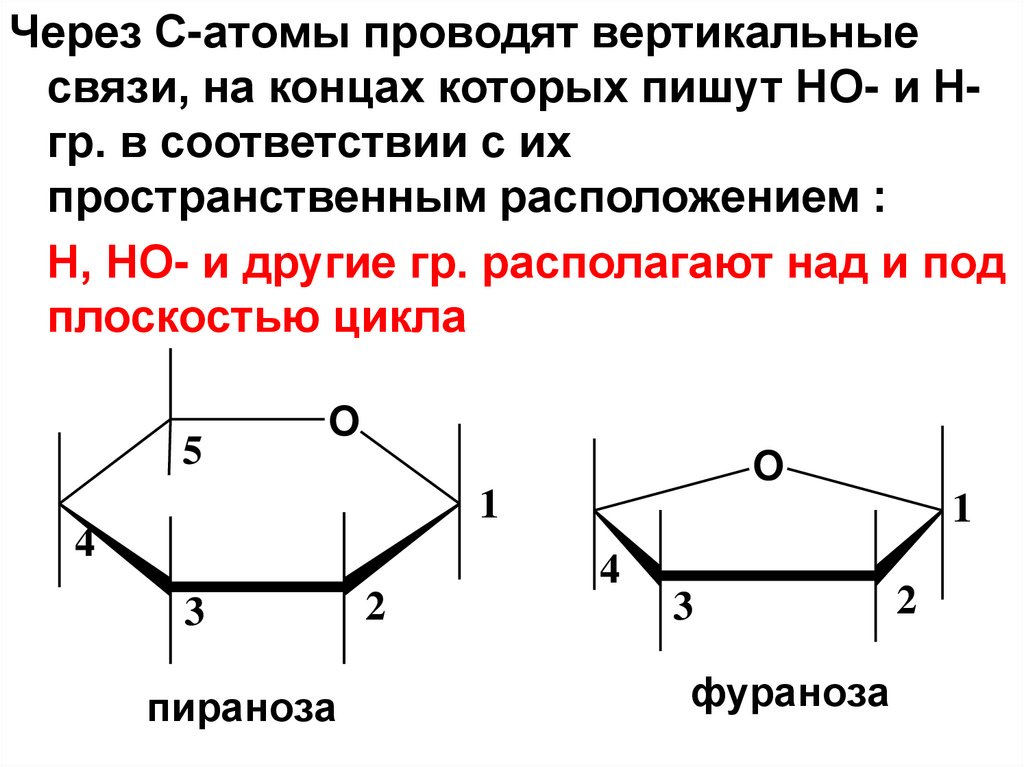
Через С-атомы проводят вертикальныесвязи, на концах которых пишут НО- и Нгр. в соответствии с их
пространственным расположением :
Н, НО- и другие гр. располагают над и под
плоскостью цикла
5
O
O
1
4
3
пираноза
2
1
4
3
фураноза
2
97.
• Группы, которые находятсяслева от С-цепи в
проекционной формуле
Фишера, располагают над
плоскостью цикла,
• справа – под плоскостью
цикла.
98.
1HO C* H
H
HO
2
*
H
H
5
2
* OH
3
4
6CH OH
*
H
OH
O
H
4
OH
5
HOH H
3
H
CH2OH
-D-глюкопираноза
6
OH
O
1
2
OH
H
99.
6CH OH2
H C* OH
H
*
OH
HO
*
H
*
OH
H
H
H
O
4
OH
CH2OH
α-D-глюкопираноза
O
H
HOH H
1
5
3
2
H
OH
OH
100.
• Гликозидная НО-группа уальдоз D-ряда в α-форме
находится под плоскостью
цикла,
• а в β –форме – над
плоскостью цикла.
101.
• Н-атом у С5 в формуле Хеуорсаоказался под плоскостью цикла,
хотя в формуле Фишера
находится слева.
• Это объясняется тем, что при
этом асимметрическом С-атоме
НО-гр. принимает участие в
образовании оксидного цикла,
для чего необходимы
2 перестановки заместителей.
102.
HH
5
6
CH2OH
HO
4
OH
OH
3
H
H
2
OH
6CH OH
2
O
C
1 H
H
4
OH
5
H
OH
3
H
OH
H
2
OH
O
C
1
H
103.
Рассмотрим примерыO
1C
H
HO
HO
H
2
3
4
5
6
H
OH
1
4
H
6CH OH
2
OH
CH2OH
D-галактоза
2
3
H
OH
O
5
4
H
O
OH
OH
H
1
3
H
2 H
OH
5
H
-D-галактопираноза
104.
1H
O
C
2
H
OH
3
HO
H
4
H
OH
5
CH2OH
D-ксилоза
5
O
1
4
3
2
H
H
4
OH
O
OH
OH
H
1
3
H
2 H
OH
5
H
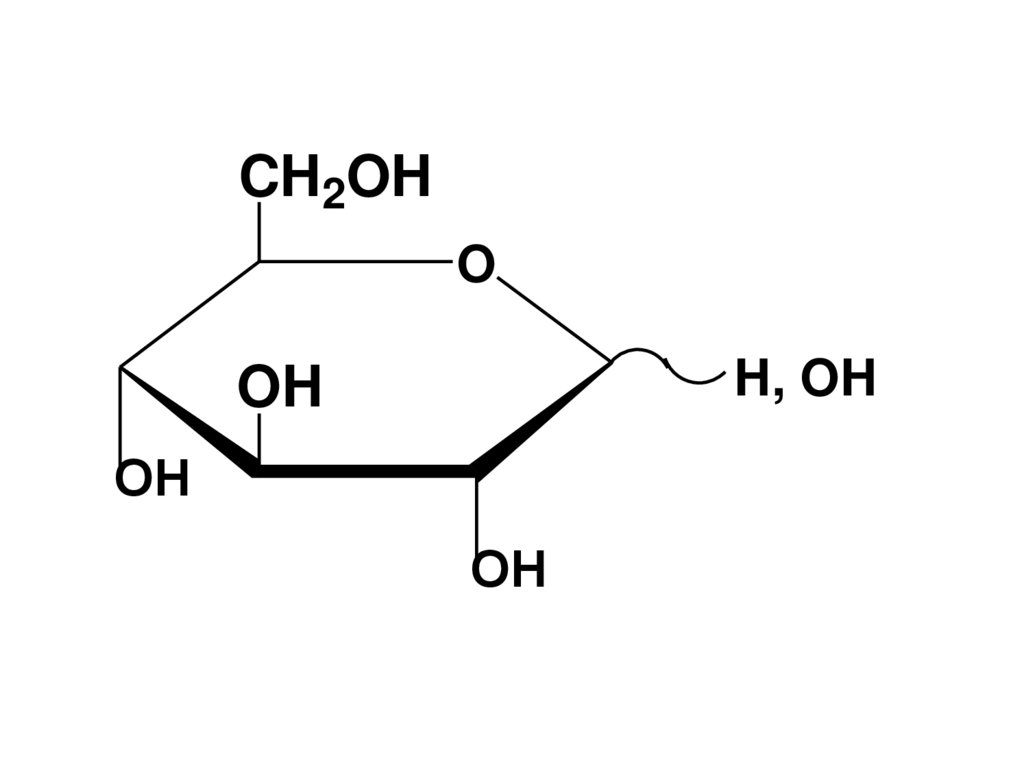
-D-ксилопираноза
105.
• В формулах Хеуорса дляизображения смеси аномеров
расположение Н и
гликозидной НО-гр.
показывают волнистой
линией
• С целью упрощения формул
допускается опускать изображение
С–Н-связей.
106.
CH2OHO
H, OH
OH
OH
OH
107. Конформационная изомерия
Формула Хеуорса предполагает плоское строение
кольца. На самом деле циклические 5- и 6-членные
формы МС могут существовать в геометрически
различных формах, обусловленных разл.
расположением в пространстве С-атомов цикла, для
них характерна конформационная изомерия.
• Для пиранозного цикла моноз возможно 8
конформаций (2 - кресла, 6 – ванны).
• Предпочтительность той или иной конформации для
конкретного МС или его производного определяется
соотношением размера и числа заместителей в цикле
и их пространственным расположением.
108.
Установлено, что пиранозные формыМС существуют преимущественно в
виде конформации кресла, в которой
наибольшее число объемных
заместителей расположены
экваториально.
Для α-аномеров полуацетальный ОН
располагается в аксиальном
положении, а для β-аномеров – в
экваториальном.
109.
HCH2OH
HO
H
O
H
HO
OH
OH
H
H
-D-глюкопираноза
110.
HCH2OH
HO
H
O
H
HO
OH
H
H
OH
-D-глюкопираноза
111.
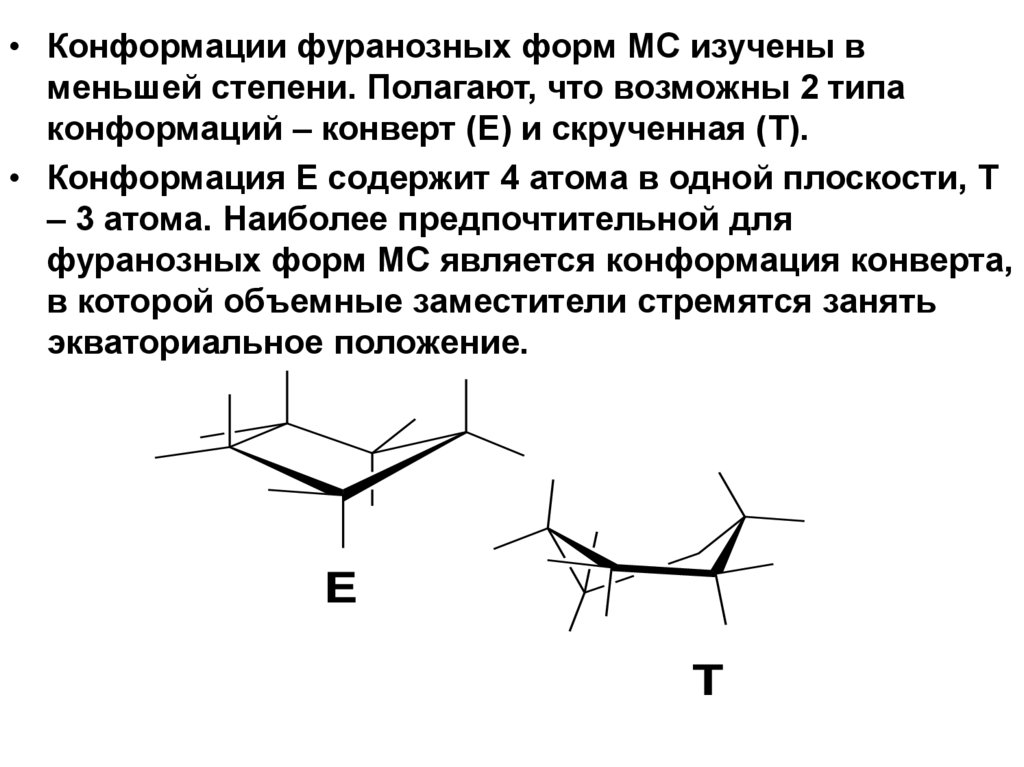
• Конформации фуранозных форм МС изучены вменьшей степени. Полагают, что возможны 2 типа
конформаций – конверт (Е) и скрученная (Т).
• Конформация Е содержит 4 атома в одной плоскости, Т
– 3 атома. Наиболее предпочтительной для
фуранозных форм МС является конформация конверта,
в которой объемные заместители стремятся занять
экваториальное положение.
E
T
112. Физические свойства
МС представляют собой твердыекристаллические в-ва, сладкие на вкус,
гигроскопичны, х. р. в воде. МС легко
образуют сиропы, выделение их из
которых в кристаллическом состоянии
представляет определенные
трудности.
Растворимость в спирте МС низкая,
в эфире они практически
нерастворимы. Р-ры МС обладают
оптической активностью.
113. Химические свойства
Таутомерия. Мутаротация• В кристаллическом состоянии МС находятся в
циклической форме (α-или β), которые
различаются растворимостью, Т. пл. и
величиной удельного вращения [α]D.
• В водных растворах МС претерпевают
кольчато-цепную таутомерию (цикло-оксотаутомерию) – один аномер переходит в другой
через открытую оксоформу.
• Взаимное превращение α- и β-форм МС
называют аномеризацией.
114.
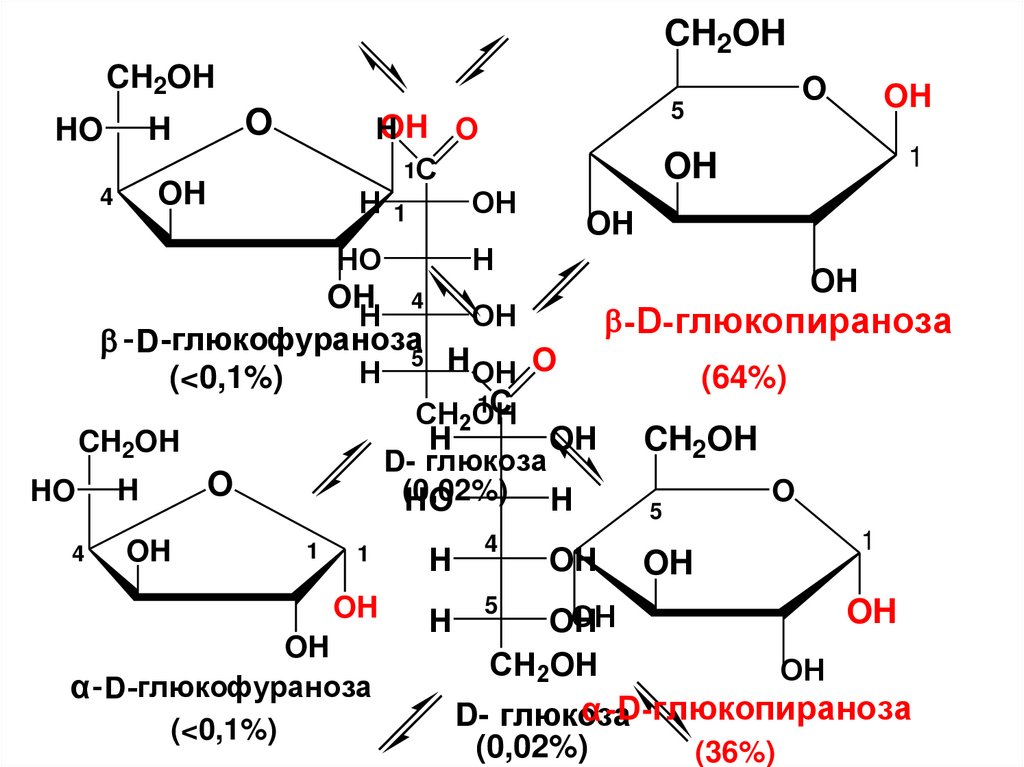
CH2OHCH2OH
O
H
HO
5
OH O
H
1C
H 1
OH
OH
4
HO
O
OH
1
OH
OH
H
OH
OH 4
H
OH
-D-глюкопираноза
- D -глюкофураноза5
H OH O
H
(<0,1%)
(64%)
1C
CH2OH
H
OH CH2OH
CH2OH
HO
4
H
OH
D- глюкоза
(0,02%)
HO
H
O
1
1
H
4
OH
H
5
OH
α - D -глюкофураноза
(<0,1%)
OH
OH
OH
CH2OH
5
O
1
OH
OH
OH
α -D-глюкопираноза
D- глюкоза
(0,02%)
(36%)
115.
• Как правило, циклические формы МС вр-рах преобладают над оксоформой,
причем одна из циклических форм
присутствует в большем кол-ве, чем
другие.
• Если не учитывать небольшое кол-во
фуранозных форм в р-рах глюкозы, весь
равновесный процесс можно
представить
α-D- глюкопираноза
[α]D = +112
o
оксоформа
-D- глюко-
пираноза
o
[α] D = +18,7
116.
Свежеприготовленный р-р α-аномераD-глюкозы имеет удельное вращение +112о.
При стоянии р-ра эта величина постепенно
снижается и достигает величины +52,5о.
При растворении в воде
кристаллических циклических форм
D-глюкозы происходит раскрытие цикла с
образованием открытой оксоформы,
которая вновь превращается в
циклические формы α- и β, вплоть до
установления равновесия.
117.
Явление самопроизвольногоизменения угла вращения
плоскости поляризации света при
стоянии свежеприготовленного
раствора углеводов получило
название
«мутаротация»
(мультиротация – от латинского multum-много,
•rotario-круговращение).
118.
МС в соответствии со строениеммогут проявлять свойства:
карбонильных соединений,
спиртов
полуацеталей.
119. .Реакции по оксоформе
• Для МС характерны не все р-ции по оксогруппе, т.к.содержание открытой формы в р-ре невелико. Напр.,
глюкоза в обычных усл. не дает кристаллического
осадка с NaHSO3, не окрашивает фуксинсернистую
кислоту.
120.
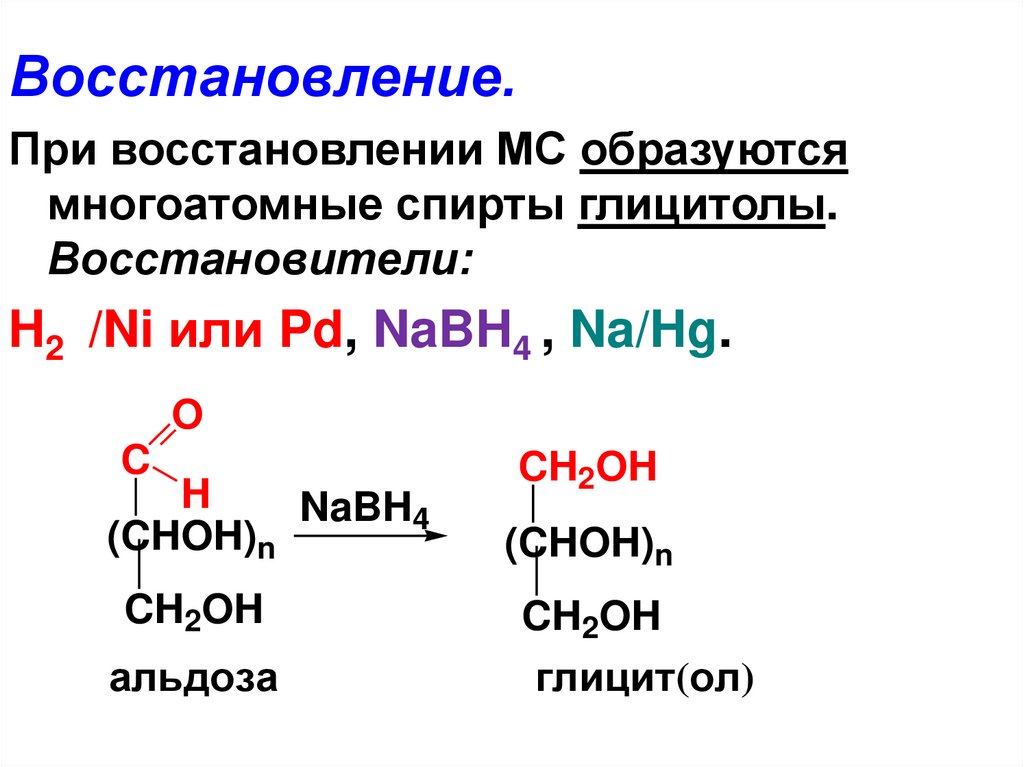
Восстановление.При восстановлении МС образуются
многоатомные спирты глицитолы.
Восстановители:
H2 /Ni или Pd, NaBH4 , Na/Hg.
O
C
CH2OH
H
NaBH4
(CHOH)n
(CHOH)n
CH2OH
CH2OH
альдозa
глицит(ол)
121.
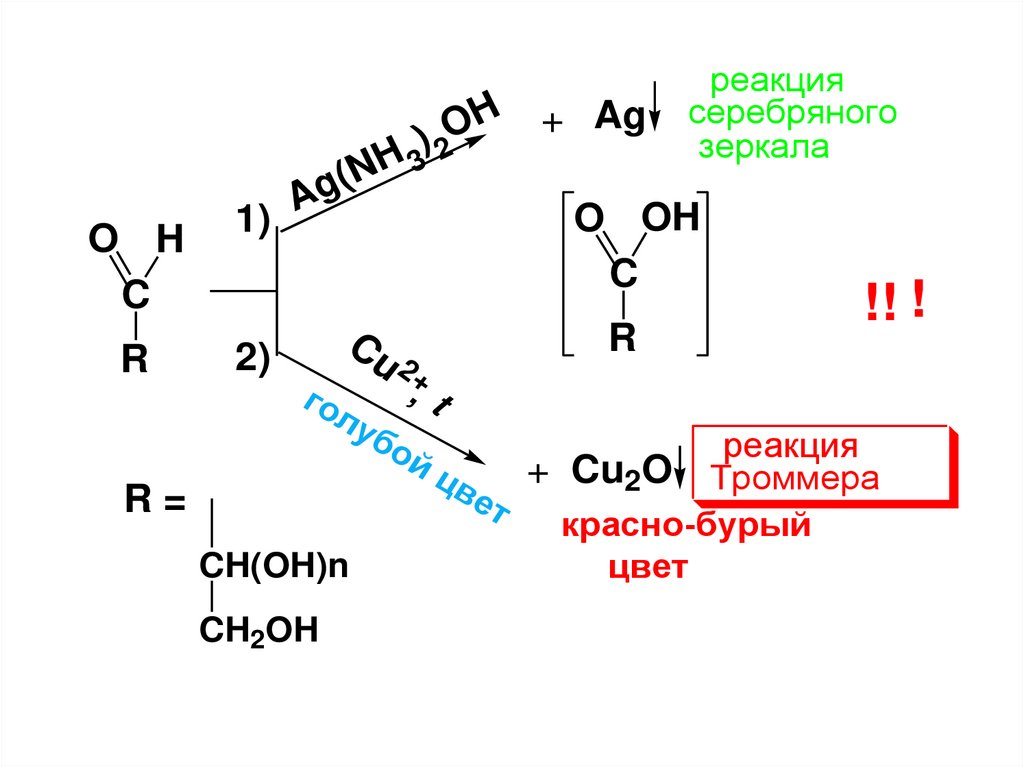
• Окисление• а) Мягкие окислители:
• 1) реактив Толленса – аммиачный раствор
оксида серебра Ag(NH3)2OH;
• 2) проба Троммера – СuSO4/NaOH;
• реактив Фелинга (фелингова жидкость) –
щелочной раствор Cu(OH)2 в калиевонатриевой соли винной кислоты;
• реактив Бенедикта – щелочной раствор
Cu(OH)2 в натриевой соли лимонной
кислоты;
• 3) бромная вода.
122.
При окислении реактивами 1),2)образуется смесь продуктов, т.к.
МС в щелочной среде неустойчивы.
Суть реакций – окисление альдегидной группы до карбоксильной,
восстановление реактивов Толленса,
Фелинга и Бенедикта, поэтому в
упрощенном виде их можно
выразить следующей схемой.
123.
H + AgO
)
O H
C
R
2
H
3
(N
g
1) A
2)
Cu
го
л
R=
CH(OH)n
CH2OH
уб
2+
реакция
серебряного
зеркала
O OH
C
R
!! !
,t
ой
реакция
+ Cu2O Троммера
цв
ет
красно-бурый
цвет
124.
• Кетозы тоже даютположительные реакции с
реактивами Толленса и Фелинга,
т. к. в щелочной среде
происходит их изомеризация
(эпимеризация) в альдозы
(cм. ниже).
125.
• Эти р-ции используются длякачественного обнаружения
альдоз и кетоз.
• Реактив Фелинга нашел
применение и для
количественного
определения
восстанавливающих сахаров
(метод Бертрана).
126.
• Осторожное окисление бромной водойприводит к образованию альдоновых кислот
127.
б) Сильные окислители:1) разб. HNO3; При таком окислении
образуются гликаровые (альдаровые,
сахарные) кислоты - одновременно
окисляются альдегидная и
первичноспиртовая гр.
128.
Реакции с нуклеофильными реагентамиГидроцианирование
Эту реакцию в химии углеводов
используют для увеличения
C-цепи МС.
129.
CHO
H
H
CN
CN
O
H
HCN
HO
*
HO
H
HO
H
H
OH
H
OH
H
OH
H
OH
H
OH
H
OH
CH2OH
D- арабиноза
*
OH
+
H
CH2OH
CH2OH
D- глюконитрил D- маннонитрил
диастереоизомерные нитрилы
H2O,H+
130.
131.
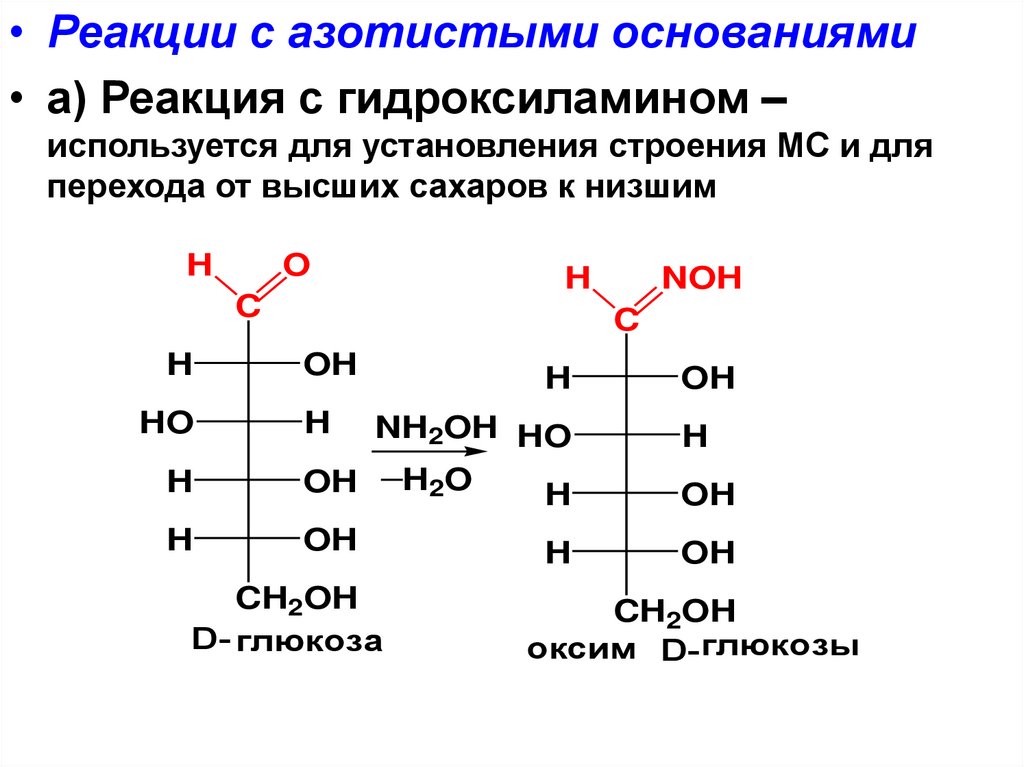
• Реакции с азотистыми основаниями• а) Реакция с гидроксиламином –
используется для установления строения МС и для
перехода от высших сахаров к низшим
H
O
C
OH
HO
H
H
NOH
C
H
H
H
H
NH2OH HO
_
OH H2O
H
OH
H
CH2OH
D- глюкоза
OH
H
OH
OH
CH2OH
оксим D- глюкозы
132.
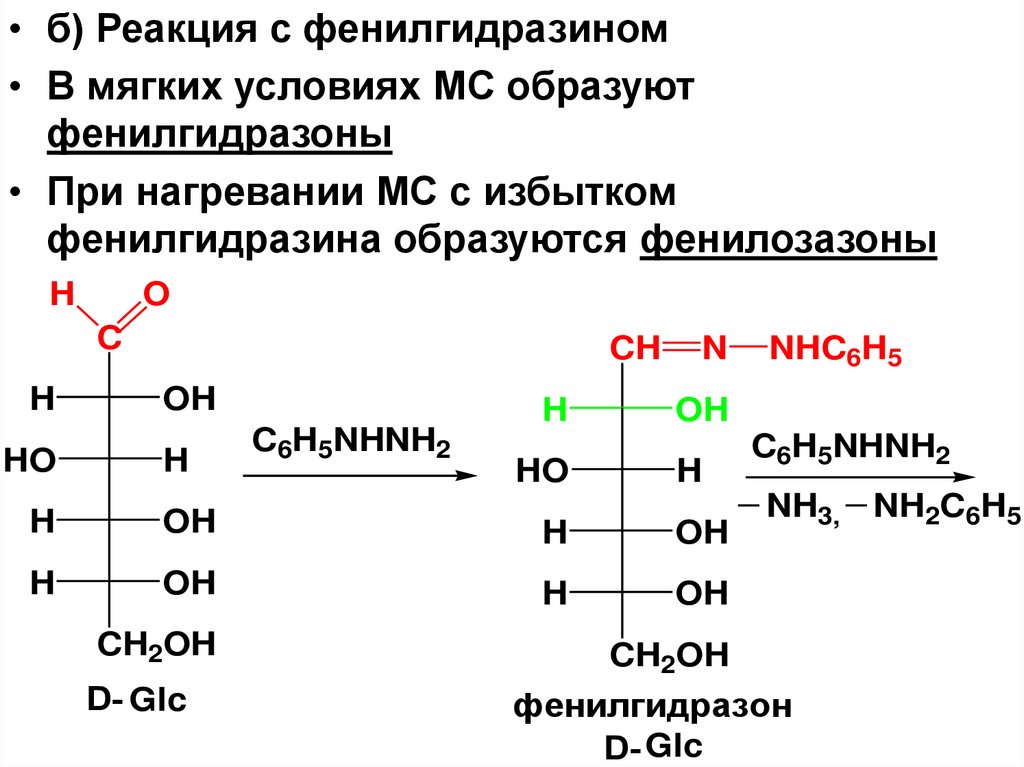
• б) Реакция с фенилгидразином• В мягких условиях МС образуют
фенилгидразоны
• При нагревании МС с избытком
фенилгидразина образуются фенилозазоны
H
O
C
CH
H
OH
HO
H
H
H
H
C6H5NHNH2
N
NHC6H5
OH
HO
H
OH
H
OH
OH
H
OH
C6H5NHNH2
_
_
NH3, NH2C6H5
CH2OH
CH2OH
D- Glc
фенилгидразон
D- Glc
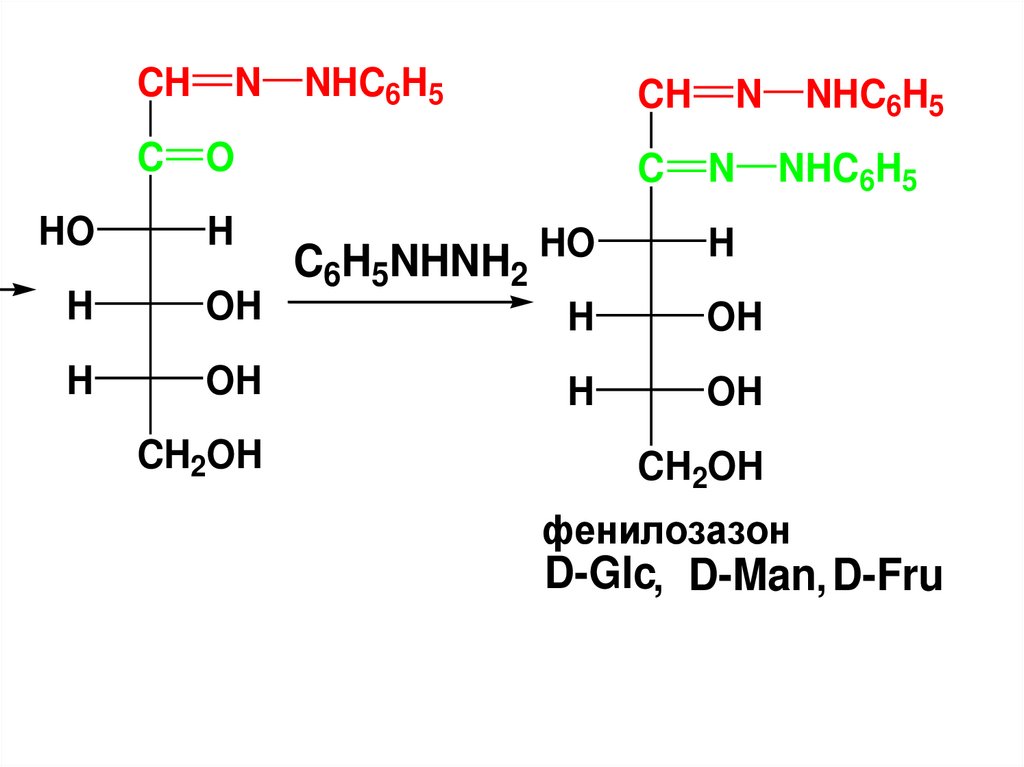
133.
CHN
C
O
HO
H
H
OH
H
OH
CH2OH
NHC6H5
CH
C
C6H5NHNH2 HO
N
N
NHC6H5
NHC6H5
H
H
OH
H
OH
CH2OH
фенилозазон
D-Glc, D-Man, D-Fru
134.
• Эпимеры (глюкоза, манноза,фруктоза) дают один и тот же
арилозазон, т.к. при его
образовании затрагиваются
только атомы С1 и С2.
135.
в) Реакция с о-толуидиновымреагентом (ОТР)
При взаимодействии МС с ОТР
образуются окрашенные
продукты, причем гексозы дают
зеленую окраску, а пентозы
желтую.
Эту р-цию используют для
количественного определения
сахаров.
136.
137.
• Отношение МС к основаниям• Направление реакций зависит от
концентрации и природы основания.
• а) Под действием разб. р-ров щелочей
или органических оснований происходит
изомеризация МС (эпимеризация),
т.е. из одного МС получается равновесная
смесь эпимеров, различающихся
конфигурацией атомов С1 и С2.
138.
139.
б) Действие крепких щелочей приводит кглубоким превращениям МС – происходит
их разложение с образованием смеси
продуктов (ретроальдольный распад).
Процесс сопровождается конденсацией с
образованием смолоподобных продуктов
бурого цвета с запахом жженого сахара.
Это превращение используется как
качественный тест для обнаружения МС и
восстанавливающих ДС.
140.
в).Образование гликолятовРеагируют с Сu(OH)2 в щелочной среде,
образуя комплексную соль,
интенсивно-синего цвета, растворимую
в воде.
CHO
CHO
CHO
CHOH
CHOH
CHOH
CHOH
CHOH
HO
CHOH
2
HC
OH
HC
OH
CH2OH
+ Cu(OH)2
HC
O
HC
O
CH2OH
H
Cu
H
O
CH
O
CH
CH2OH
141.
Отношение МС к кислотамПри нагревании с минеральными
кислотами и кислотами Льюиса МС
претерпевают дегидратацию и
циклизацию.
Пентозы при этом образуют фурфурол,
гексозы – 5-гидроксиметилфурфурол.
142.
HOH H
OH
C C
H
C
H
+
H
H
CHO
_3H O
2
C
OH HO
HO
C
HOH2C
HC
C
H
C
OH HO
альдогексоза
CHO
O
OH
C C
H
CH
фурфурол
альдопентоза
H H
HC
CHO
H+
HC
CH
_3H O
2
C
C
HOH2C
O
CHO
5-гидроксиметилфурфурол
143.
Многиекачественные
цветные
реакции на углеводы обусловлены
образованием этих производных
фурана и их реакциями конденсации
с ароматическими соединениями
144.
• РЕАКЦИЯ МОЛИШАРеакция с α-нафтолом положена в
основу идентификации углеводов
МС и ПС, т.к. последние
гидролизуются до МС в условиях
анализа. При добавлении конц.
H2SO4 к р-ру углеводсодержащего
в-ва с α-нафтолом образуется
фиолетовое кольцо.
145.
HO
C
H
OH
HO
H
H2SO4
H
OH
- H2O
H
OH
CH2OH
HOH2C
O
CHO
146.
OHO
C
O
H2SO4
SO3H
OH
CH2OH
147.
РЕАКЦИЯ СЕЛИВАНОВАКетогексозы образуют
гидроксиметилфурфурол быстрее,
чем альдогексозы, что положено в
основу качественного обнаружения кетоз
по реакции Селиванова.
Кетогексозы обнаруживают по
появлению розово-малинового
окрашивания при
взаимодействии с резорцином.
148.
OHCH2OH
C O
OH
H
H
OH
H
OH
CH2OH
кетоза
OH
HCl
CH2OH O
CHO
H2O
149.
Качественная реакция нагексозы
Гидроксиметилфурфурол неустойчив
и легко гидролизуется с
образованием левулиновой и
муравьиной кислот.
Левулиновую кислоту можно
обнаружить по иодоформной
реакции.
Эта р-ция положена в основу
идентификации гексоз.
150.
HCC
HOH2C
H3C
CH
H2O,H+
C
_ HCOOH
O
(CH2)2
C
I2
COOH
NaOH
O
CHO
левулиновая кислота
I3C
(CH2)2
C
O
COOH
NaOH
NaOOC
(CH2)2
+ CHI3
COONa
желтый осадок
151.
Качественная реакция на пентозы• Основана на конденсации фурфурола с
анилином с образованием продукта,
окрашенного в красно-малиновый цвет (см.
уч. с.105)
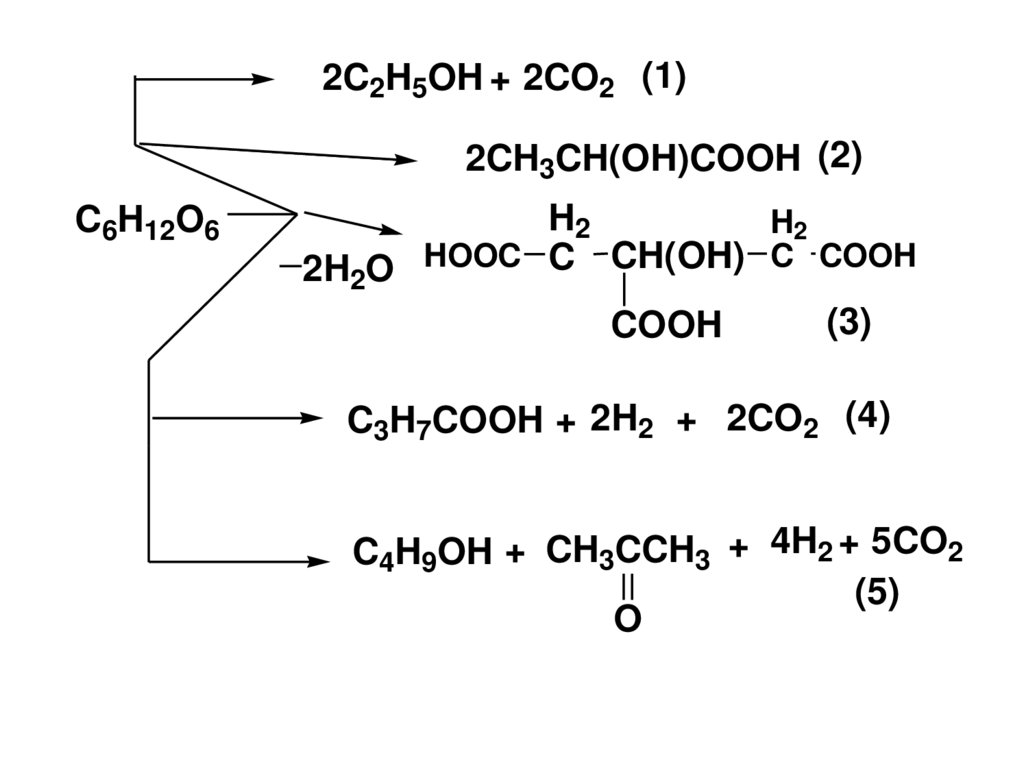
152. Брожение МС
• Брожение это сложный процесс расщепленияМС под действием ферментов.
• Брожению подвергаются МС, у которых число
атомов С кратно 3 (гексозы).Причем не все
гексозы сбраживаются одинаково – одни легче,
другие труднее.
• Известны разные виды брожения, в
зависимости от условий и вида фермента.
• Напр : спиртовое (1), молочнокислое (2),
лимоннокислое (3), маслянокислое (4),
ацетонбутанольное (5) и т.п.
153.
2C2H5OH + 2CO2 (1)2CH3CH(OH)COOH (2)
C6H12O6
H2
H2
_
2H2O HOOC C CH(OH) C COOH
(3)
COOH
C3H7COOH + 2H2 + 2CO2 (4)
C4H9OH + CH3CCH3 + 4H2 + 5CO2
(5)
O
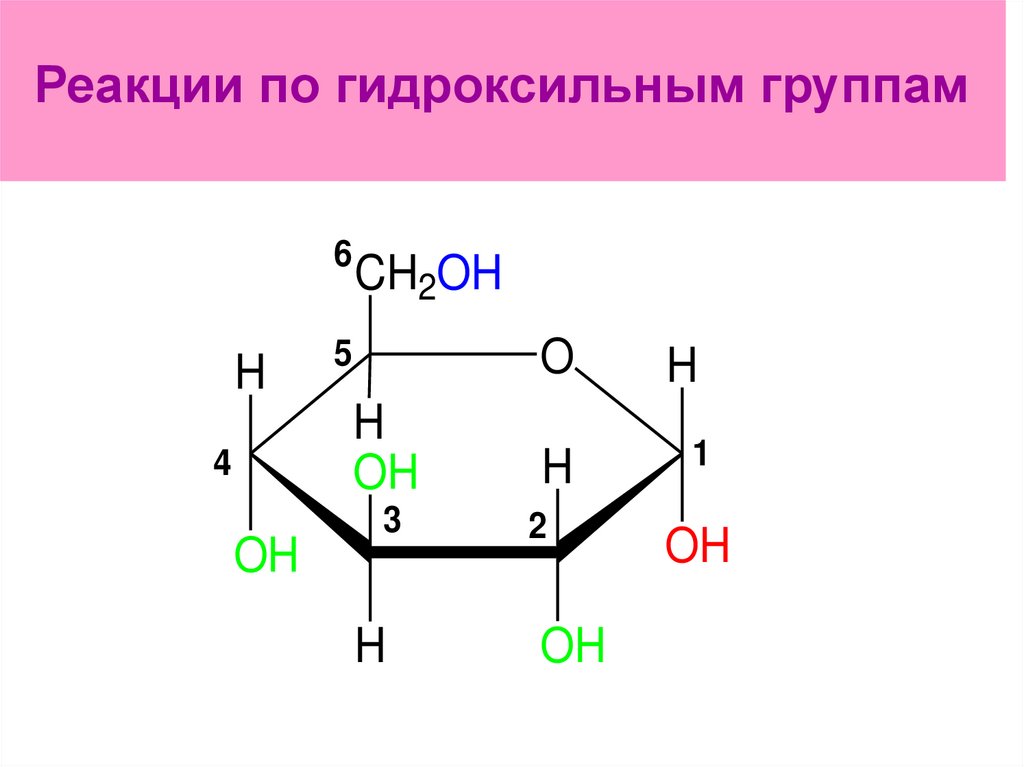
154. Реакции по гидроксильным группам
6H
4
OH
CH2OH
O
H
H
OH
H
1
3
2
OH
5
H
OH
155.
ОН разные по реакционнойспособности:
у С1 – гликозидный наиболее
реакционноспособный,
у С6 – первичный спиртовый,
у С2-С4 – вторичные
спиртовые.
156.
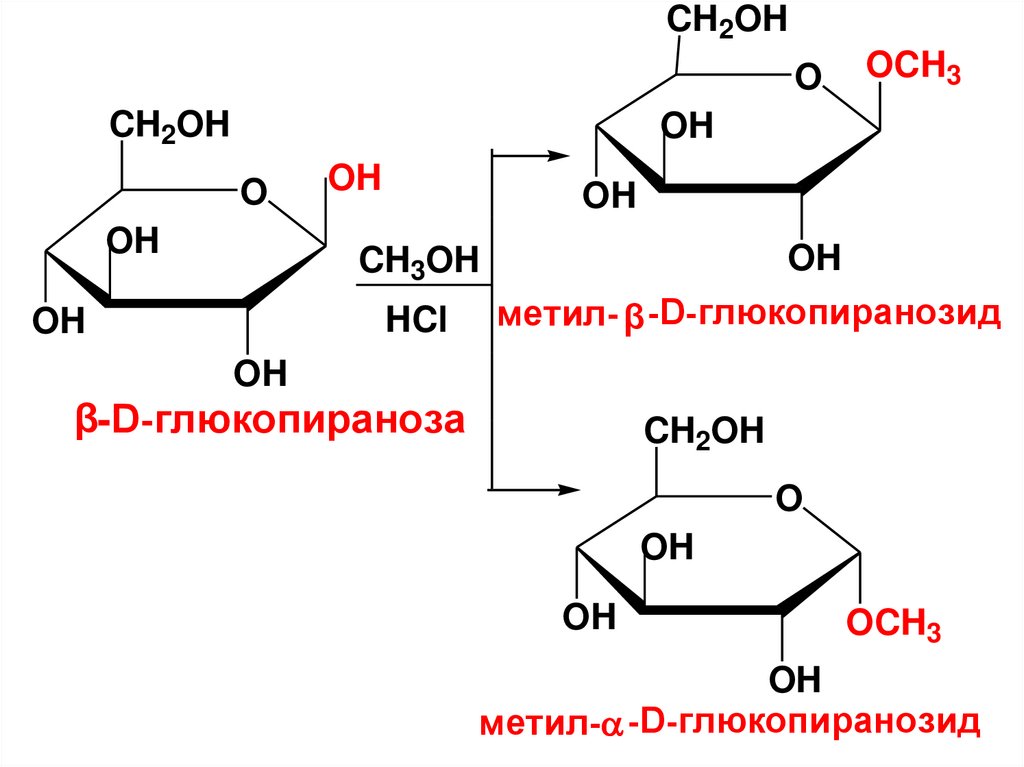
• A. Образование простых эфиров• 1).При действии мягких средств (спирты
в усл. кислотного катализа) образуются
производные циклической формы только
по гликозидному ОН – циклические
ацетали,
называемые
гликозидами.
157.
• В зависимости от размера циклагликозиды делят на пиранозиды и
фуранозиды.
• Введенный радикал (неуглеводный
фрагмент гликозида) называют
агликоном. В зависимости от природы
гетероатома, соединяющего
гликозильный остаток с агликоном,
различают О-гликозиды, N-гликозиды
и т.д.
158.
• Названия гликозидовобразуют из названия
соответствующего МС с
заменой суффикса «оза» на
«озид», причем сначала
называют агликон.
159.
CH2OHO
CH2OH
OCH3
OH
O
OH
OH
OH
OH
CH3OH
HCl
OH
метил- β -D-глюкопиранозид
OH
β-D-глюкопираноза
CH2OH
O
OH
OH
OCH3
OH
метил- -D-глюкопиранозид
160.
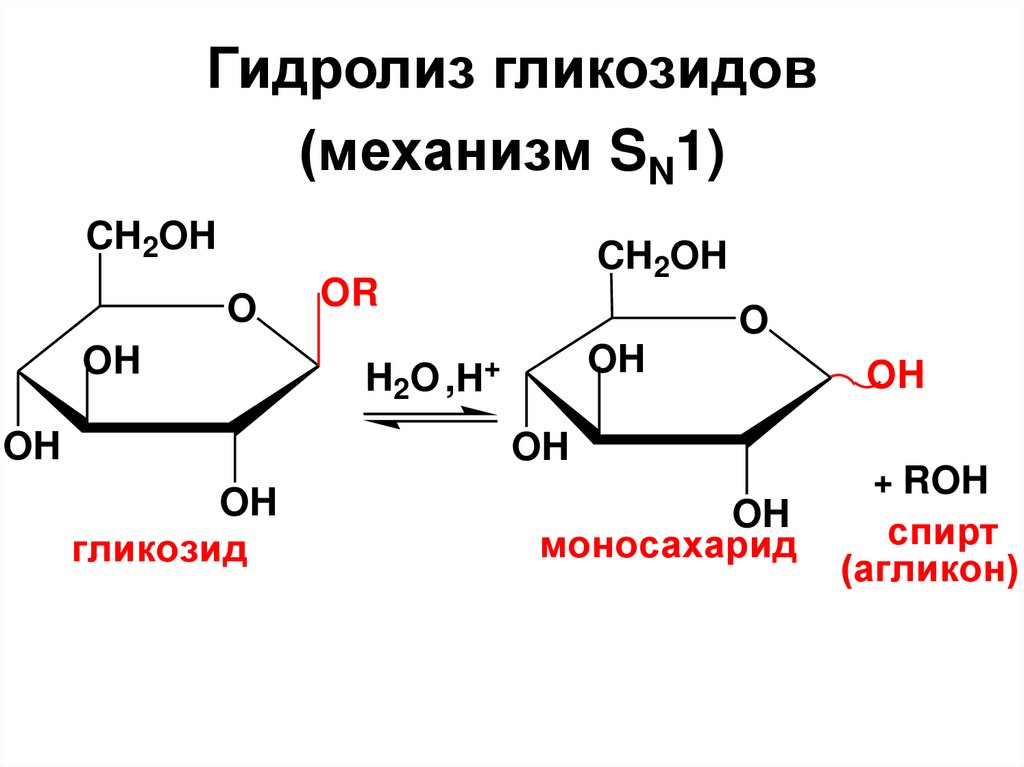
Свойства гликозидов• Поскольку в гликозидах
отсутствует полуацетальный
(гликозидный) ОН, то они
существуют только в циклической
форме.
• Т.к. раскрытие цикла невозможно, то
не образуется оксоформа и
аномерная циклическая форма.
• Гликозиды не мутаротируют, не дают
реакции на карбонильную группу.
161.
• Гликозиды являются ацеталями– простыми эфирами гемдиолов,
поэтому они, как и обычные
простые эфиры, устойчивы к
действию щелочей, но в отличие
от простых эфиров легко
гидролизуются в кислой среде с
образованием МС и агликона.
162.
Гидролиз гликозидов(механизм SN1)
CH2OH
O
OH
OH
CH2OH
OR
O
OH
H2O ,H+
OH
OH
гликозид
OH
моносахарид
OH
+ ROH
спирт
(агликон)
163.
CH2OHCH2OH
H +
O O
OH
O OR
OH
H
R
_ ROH
lim
OH
OH
OH
алкил- - D-глюкопиранозид
OH
оксониевый катион
CH2OH
CH2OH
CH2OH
O
O
O
OH
OH
OH
OH
OH
OH
OH
OH
OH
карбокатион (гликозил-катион)
+
164.
CH2OHH +
O O
OH
H
...
H2O
...
O
OH
+
OH
_H
CH2OH
OH
OH
O
_
OH
H
H
CH2OH
O
OH
+
OH
OH
OH
в -D-глюкопираноза
H
CH2OH
O OH
OH
+
OH
OH
-D-глюкопираноза
165.
Гликозиды подвергаются такжеферментативному гидролизу.
Преимущество ферментативного
гидролиза по сравнению с кислотнокаталитическим заключается в его
стереоспецифичности.
166.
167.
• 2. При действии избытка сильныхалкилирующих средств алкилгалогенидов R –Х и
алкилсульфатов R2SO4 в щелочной
среде алкилируются все ОНгруппы.
• В результате образуются простые
эфиры МС по спиртовым ОН и
гликозиды по полуацетальному
гидроксилу:
168.
169.
• В полностью алкилированныхМС также как и в молекулах
гликозидов отсутствует
свободный гликозидный ОН и
нет возможности для раскрытия
цикла, поэтому они не способны
к мутаротации и не дают р-ции на
оксо-группу.
170.
Свойства алкильных производных• Поскольку производные у С2-С4,С6 –
простые эфиры, то они не подвергаютя
гидролизу в разб. к-тах.
• Производное у С1 – гликозид,
гидролизуется.
• По этой причине при д-ии разб.
минеральных к-т происходит только
гидролиз у первого С-атома,
высвобождается гликозидный ОН и
появляется возможность для
раскрытия цикла с образованием
оксоформы .
171.
CH2OCH3CH2OCH3
O
O
OCH3
OCH3
H2O
H
OCH3
OH
OCH3
OCH3
OCH3
метил-2,3,4,6-тетра-О-метилD-глюкопиранозид
OCH3
2,3,4,6-тетра-О-метилD-глюкопираноза
CHO
H
H3CO
OCH3
H
H
OCH3
H
OH
CH2OCH3
172.
Р-ция метилирования играетважную роль для установления
строения олиго- и полисахаридов.
Метод метилирования МС с
последующим гидролизом и
окислением тетраметилпроизводного
используют для установления
размера цикла.
173.
174.
Получение в продуктах окисления при С4метоксильной группы свидетельствует о
том, что С4 исходного МС не участвует в
образовании циклической формы.
Образование СООН-группы у С5
доказывает, что у С5 был
свободный ОН. Следовательно,
исходный МС имел пиранозную
форму.
175.
• Б. ОБРАЗОВАНИЕ СЛОЖНЫХЭФИРОВ
В химии углеводов наибольшее
применение находят сложные эфиры
уксусной кислоты (ацетаты),
бензойной кислоты (бензоаты)
и неорганических кислот (нитраты,
сульфаты, фосфаты).
176.
• Ацилирование МС как правилопроисходит под действием
ангидридов карбоновых кислот в
слабощелочной среде (ацетат
натрия, пиридин) либо в условиях
кислотного катализа (H2SO4, ZnCl2) с
участием всех ОН-гр.
177.
CH2OH(CH3CO)2O (изб.)
O
OH
OH
OH
CH2OCOCH3
O
OCOCH3
OCOCH3
CH3COO
OH
OCOCH3
D-глюкопираноза
1,2,3,4,6-пента-О-ацетилD-глюкопираноза
(пентаацетилглюкоза)
O
CH3C
H3CC
O
O
O
CH3C
Ac
178.
Свойства ацильных производных• Ацильные производные МС, являясь
сложными эфирами, гидролизуются
как в кислой, так и в щелочной среде.
H+
O
O
OAc
+ 5 AcOH
CH2OH
CH2OAc
OAc
H2 O
AcO
OAc
1,2,3,4,6-пента-О-ацетил-D-глюкоза
(пентаацетилглюкоза)
OH
OH
OH
OH
OH +
5 AcO
D-глюкопираноза
179.
Нитраты МС можно получить действиембезводной
азотной
кислоты
в
уксусном
ангидриде. Образующиеся при этом полные
нитраты моноз взрывоопасны.
Нитраты частично замещенных моноз могут
быть получены д-ем оксида азота или безводной
HNO3 в хлороформе.
180.
CH2OHO
OH
OH
HNO3
(CH3CO)2O
OH
OH
D-глюкопираноза
CH2ONO2
O
ONO2
ONO2
ONO2
ONO2
1,2,3,4,6-пентанитрат
D-глюкопиранозы
181.
Сульфаты МС представляют определенныйинтерес как мономерные единицы широко
распространенных в природе сульфатов ПС,
имеющих важное биологическое значение.
Сульфаты моноз получают обычно
д-ем пиридинсульфотриоксида
(ПСТО) в пиридине или ДМФА. В
первую очередь при этом
образуются сульфаты по перв.
спиртовой гр.
182.
CH2OHO
OH
OH
ПСТО
OH
пиридин
OH
D-глюкопираноза
CH2OSO3H
O
OH
OH
OH
OH
6-сульфат
D-глюкопиранозы
183. Пример
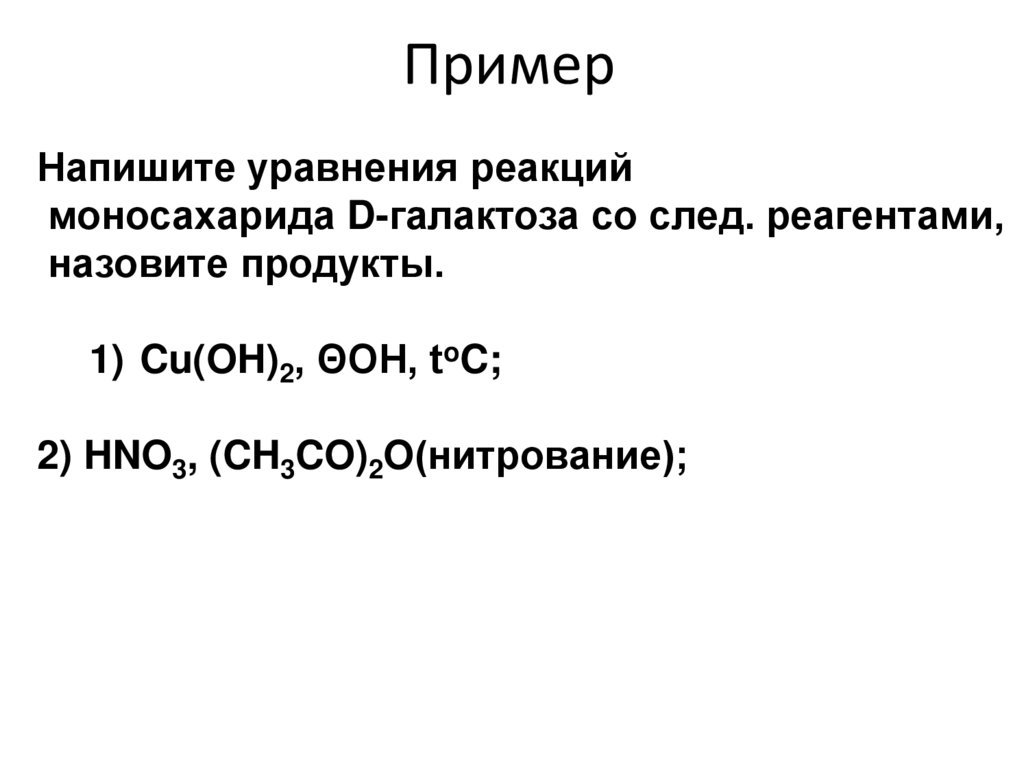
Напишите уравнения реакциймоносахарида D-галактоза со след. реагентами,
назовите продукты.
1) Cu(OH)2, ΘOH, toC;
2) HNO3, (CH3CO)2O(нитрование);
184.
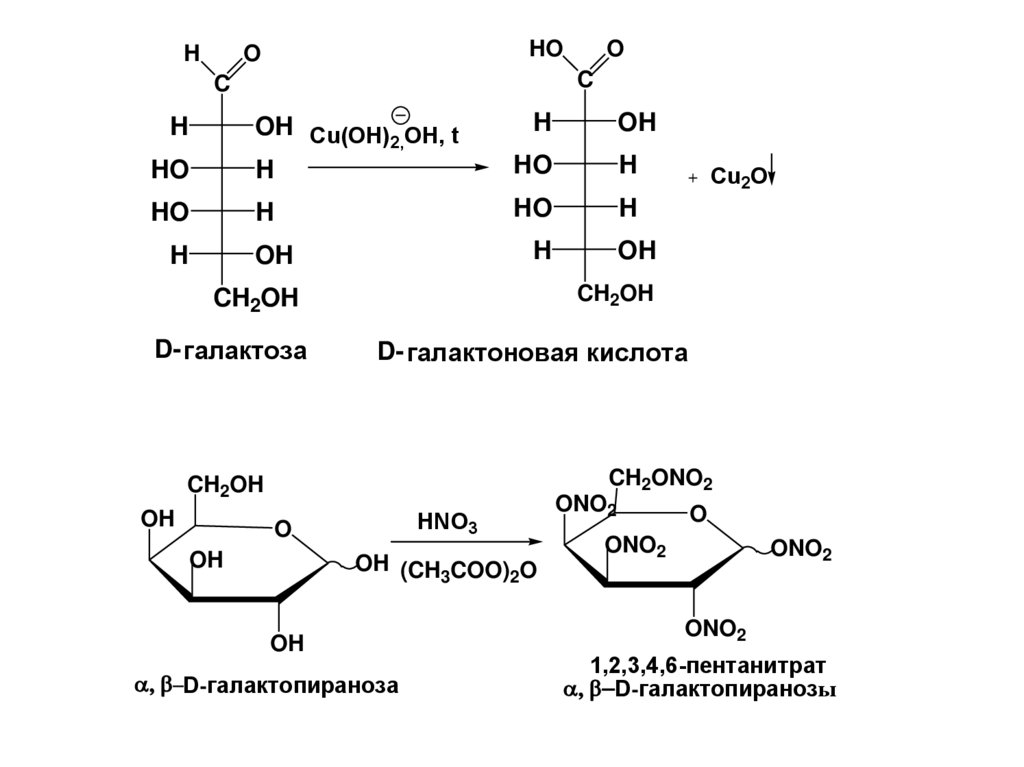
HHO
O
C
C
H
O
OH Cu(OH) OH, t
2,
H
OH
HO
H
HO
H
HO
H
HO
H
H
OH
H
OH
D- галактоновая кислота
CH2ONO2
CH2OH
OH
Cu2O
CH2OH
CH2OH
D- галактоза
+
O
OH
ONO2
HNO3
OH (CH COO) O
3
OH
D-галактопираноза
O
ONO2
ONO2
2
ONO2
1,2,3,4,6-пентанитрат
D-галактопиранозы
185. Важнейшие представители
• См. учеб.• О-гликозиды – кониферин и
сирингин являются
предшественниками одного из
полимерных компонентов
древесины - лигнина.
186.
CH2OHO
O
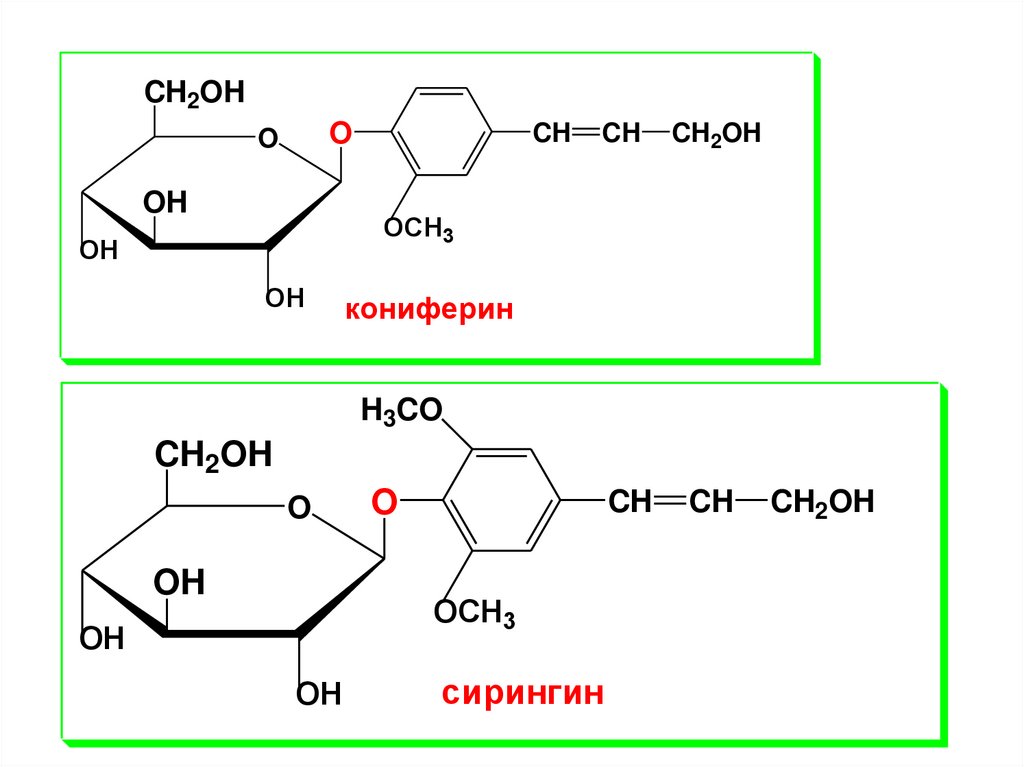
OH
CH
CH
CH2OH
CH
CH
OCH3
OH
OH
кониферин
H3CO
CH2OH
O
OH
O
OCH3
OH
OH
сирингин
CH2OH

































































































 chemistry
chemistry








