Similar presentations:
Углеводы
1. УГЛЕВОДЫ
2.
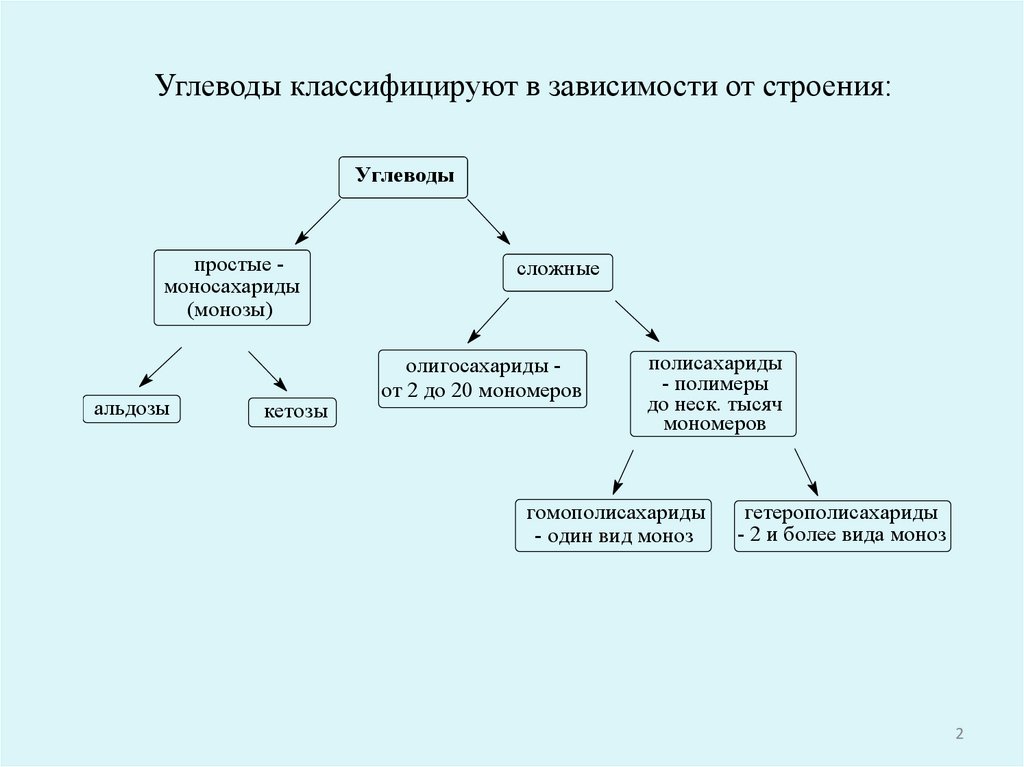
Углеводы классифицируют в зависимости от строения:Углеводы
простые моносахариды
(монозы)
альдозы
кетозы
сложные
олигосахариды от 2 до 20 мономеров
полисахариды
- полимеры
до неск. тысяч
мономеров
гомополисахариды
- один вид моноз
гетерополисахариды
- 2 и более вида моноз
2
3.
МОНОСАХАРИДЫМоносахариды
–
это
гетерофункциональные
соединения,
содержащие в молекуле одновременно карбонильную группу и несколько
спиртовых гидроксильных групп.
Они являются простейшими представителями класса углеводов и не
подвергаются гидролизу с образованием более простых соединений.
3
4.
КлассификацияВ зависимости от природы карбонильной группы их делят на альдозы и кетозы, а по
числу атомов углерода в цепи – на триозы, тетрозы, пентозы, гексозы и т.д. Наиболее
распространенными являются пентозы и гексозы.
HOCH2
CHOH
CHOH CHOH CHOH C
O
HOCH2
H
альдогексоза
Окончание «оза» означает принадлежность к классу углеводов.
CHOH
CHOH CHOH C CH2OH
кетогексоза
O
Строение и стереоизомерия
Молекулы моносахаридов содержат хиральные центры и существуют в виде большого
числа оптических изомеров, отличающихся между собой пространственным расположением
заместителей у атомов углерода.
Число изомеров, определяемое по формуле N=2n, показывает, что альдогексоза,
имеющая 4 хиральных центра, должна иметь 16 стереоизомеров, т.е. 8 пар энантиомеров.
Кетогексоза, имеющая 3 асимметрических атома углерода должна иметь 8 оптических
изомеров (4 пары энантиомеров).
4
5.
Для каждого из оптических изомеров существует только 1 антипод (энантиомер), остальныеизомеры являются диастереомерами.
Для изображения стереоизомеров используют формулы Фишера, в которых карбонильная группа
изображается сверху и имеет наименьший номер.
1
С
H
2
HO 3
O
O
С
HO
H
H
H
H
H
OH
O
O
С
С
CH2OH
CH2OH
C O
C O
H
H
OH
HO
H
H
OH
HO
H
H
OH
HO
H
H
OH
H
4
OH
HO
H
HO
H
H
OH
H
OH
HO
H
H
5
OH
HO
H
H
OH
HO
H
H
OH
HO
H
6
CH2OH
CH2OH
D-глюкоза
L-глюкоза
энантиомеры
CH2OH
CH2OH
D-галактоза
L-галактоза
энантиомеры
CH2OH
CH2OH
D- фруктоза
L- фруктоза
энантиомеры
Принадлежность к D- или L- стереохимическому ряду определяется путем сравнения конфигурации
наиболее удаленного от карбонильной группы атома углерода с конфигурацией атома углерода (D- или L-)
глицеринового альдегида.
Два диастереомера, которые различаются конфигурацией одного из нескольких асимметрических
центров, называются эпимерами. Например, D-глюкоза и D-галактоза – 4-эпимеры, т.е. различаются
конфигурацией только 4-го атома углерода.
Строение моносахаридов, выраженное вышеприведенными формулами, соответствует цепной
(открытой) форме. Эта форма содержит свободную альдегидную или кетонную группы.
5
6.
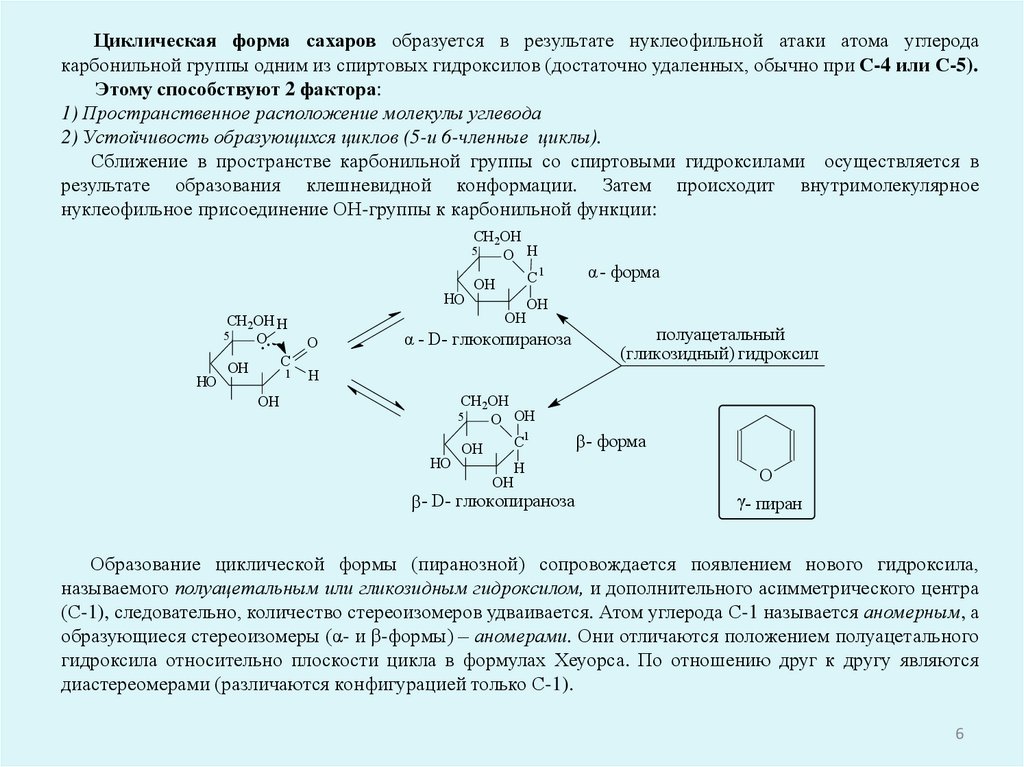
Циклическая форма сахаров образуется в результате нуклеофильной атаки атома углеродакарбонильной группы одним из спиртовых гидроксилов (достаточно удаленных, обычно при С-4 или С-5).
Этому способствуют 2 фактора:
1) Пространственное расположение молекулы углевода
2) Устойчивость образующихся циклов (5-и 6-членные циклы).
Сближение в пространстве карбонильной группы со спиртовыми гидроксилами осуществляется в
результате образования клешневидной конформации. Затем происходит внутримолекулярное
нуклеофильное присоединение ОН-группы к карбонильной функции:
CH2OH
O H
5
HO
CH2OH H
5
O
HO
С
OH
1
O
С1
OH
OH
OH
α - D- глюкопираноза
α - форма
полуацетальный
(гликозидный) гидроксил
H
CH2OH
O OH
OH
5
HO
OH
С1
H
OH
β - D- глюкопираноза
β - форма
О
γ- пиран
Образование циклической формы (пиранозной) сопровождается появлением нового гидроксила,
называемого полуацетальным или гликозидным гидроксилом, и дополнительного асимметрического центра
(С-1), следовательно, количество стереоизомеров удваивается. Атом углерода С-1 называется аномерным, а
образующиеся стереоизомеры (α- и β-формы) – аномерами. Они отличаются положением полуацетального
гидроксила относительно плоскости цикла в формулах Хеуорса. По отношению друг к другу являются
диастереомерами (различаются конфигурацией только С-1).
6
7.
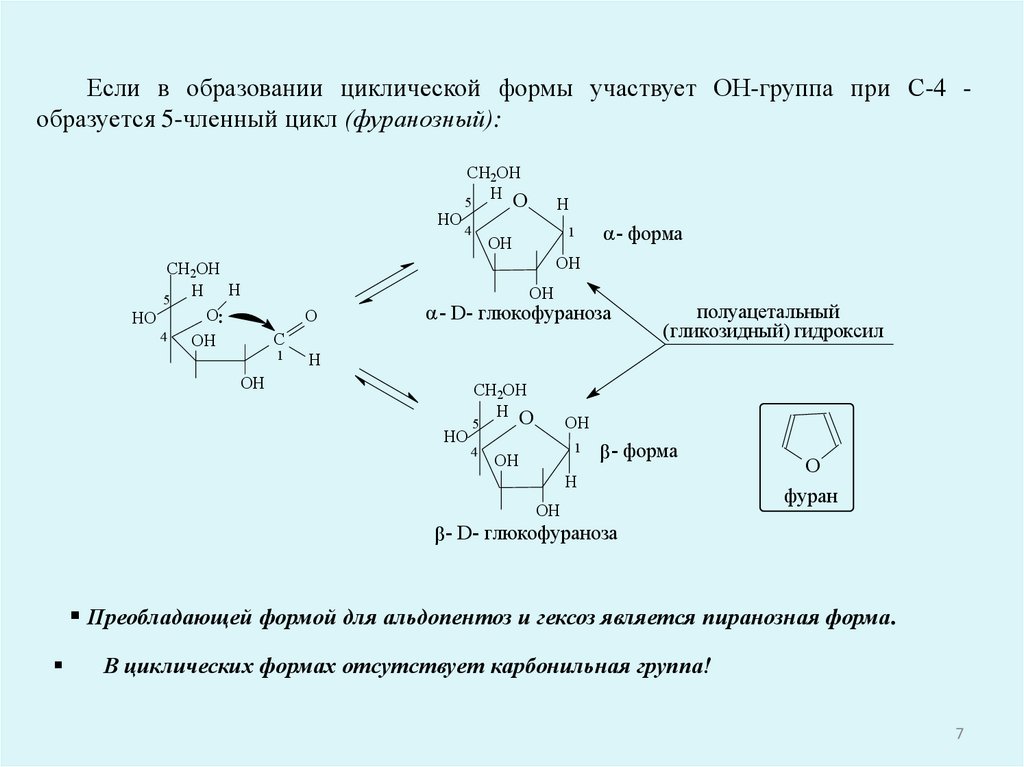
Если в образовании циклической формы участвует ОН-группа при С-4 образуется 5-членный цикл (фуранозный):HO
4
H
1
OH
α - форма
OH
CH2OH
H H
5
O
HO
4
CH2OH
H O
5
OH
O
α - D- глюкофураноза
C
OH
1
полуацетальный
(гликозидный) гидроксил
H
OH
HO
CH2OH
H O
OH
5
4
1
OH
β - форма
H
OH
О
фуран
β - D- глюкофураноза
Преобладающей формой для альдопентоз и гексоз является пиранозная форма.
В циклических формах отсутствует карбонильная группа!
7
8.
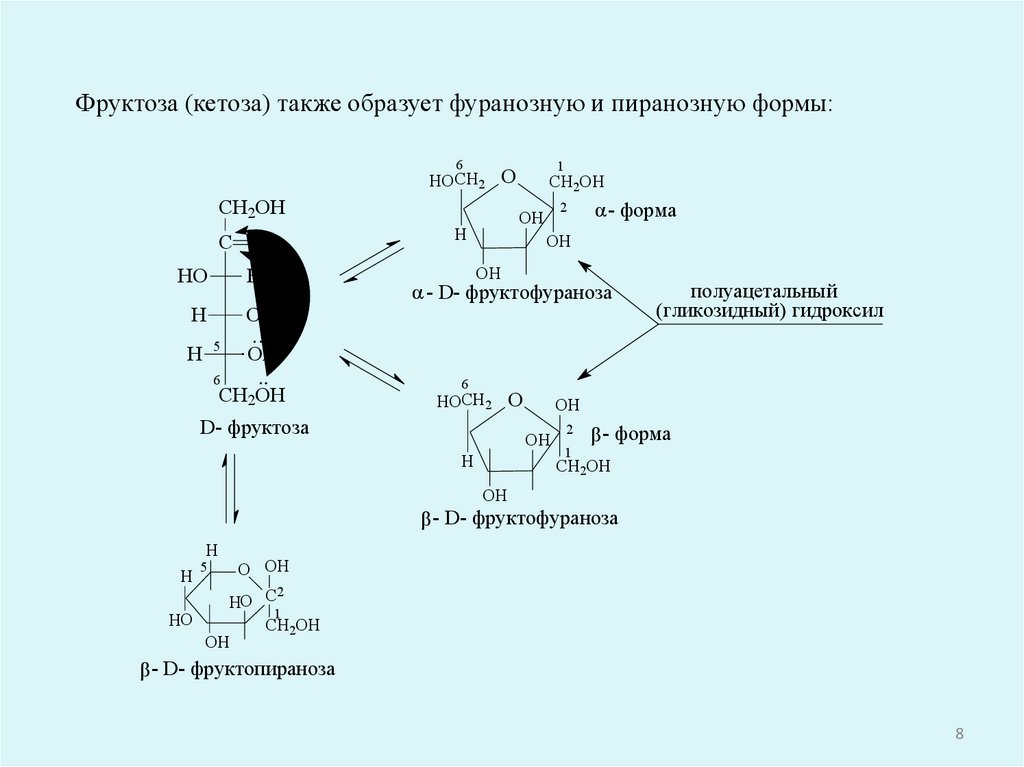
Фруктоза (кетоза) также образует фуранозную и пиранозную формы:6
HO CH2
CH2OH
C O
HO
H
H
OH
H 5
OH
6
CH2OH
1
O
СH2OH
2
OH
H
α - форма
OH
OH
α - D- фруктофураноза
6
HOCH2
D- фруктоза
O
OH
OH
H
полуацетальный
(гликозидный) гидроксил
2
1
β - форма
CH2OH
OH
β - D- фруктофураноза
H
H
5
O OH
2
HO С
1
HO
CH2OH
OH
β - D- фруктопираноза
8
9.
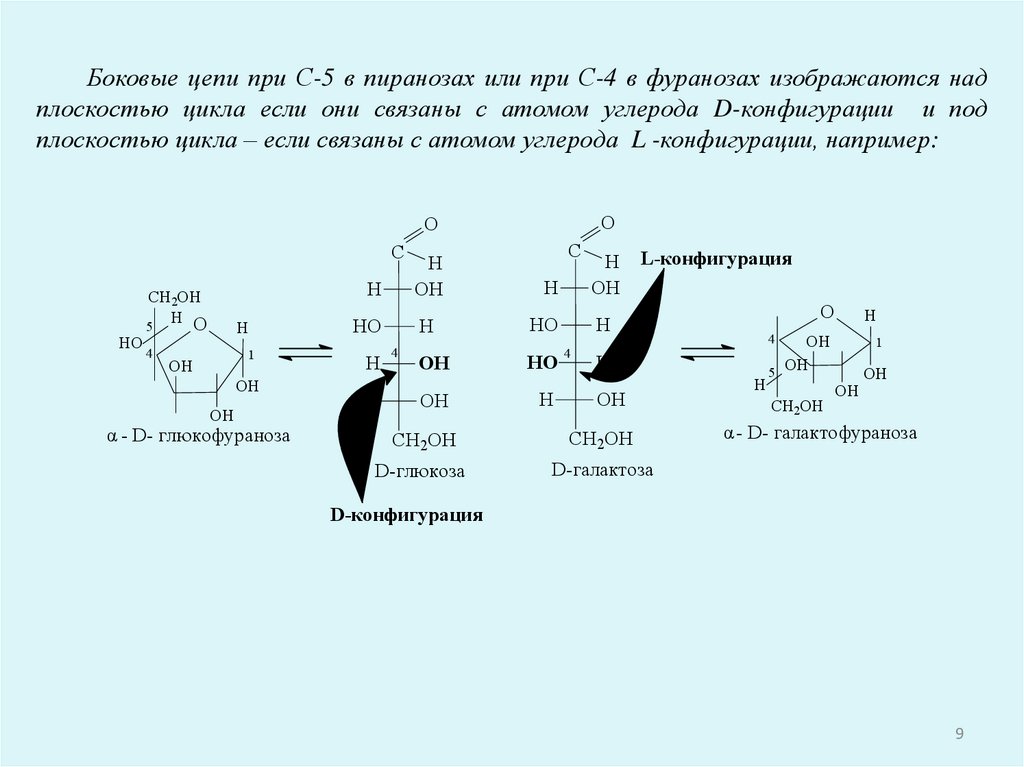
Боковые цепи при С-5 в пиранозах или при С-4 в фуранозах изображаются надплоскостью цикла если они связаны с атомом углерода D-конфигурации и под
плоскостью цикла – если связаны с атомом углерода L -конфигурации, например:
O
O
С
HO
CH2OH
H O
5
4
H
1
OH
OH
OH
α - D- глюкофураноза
С
H
H
OH
H
HO
H
HO
H
H
4
OH
OH
HO
H
H L-конфигурация
OH
H
4
CH2OH
CH2OH
D-глюкоза
D-галактоза
H
OH
OH
5
1
4
H
OH
O
H
CH2OH
OH
OH
α - D- галактофураноза
D-конфигурация
9
10.
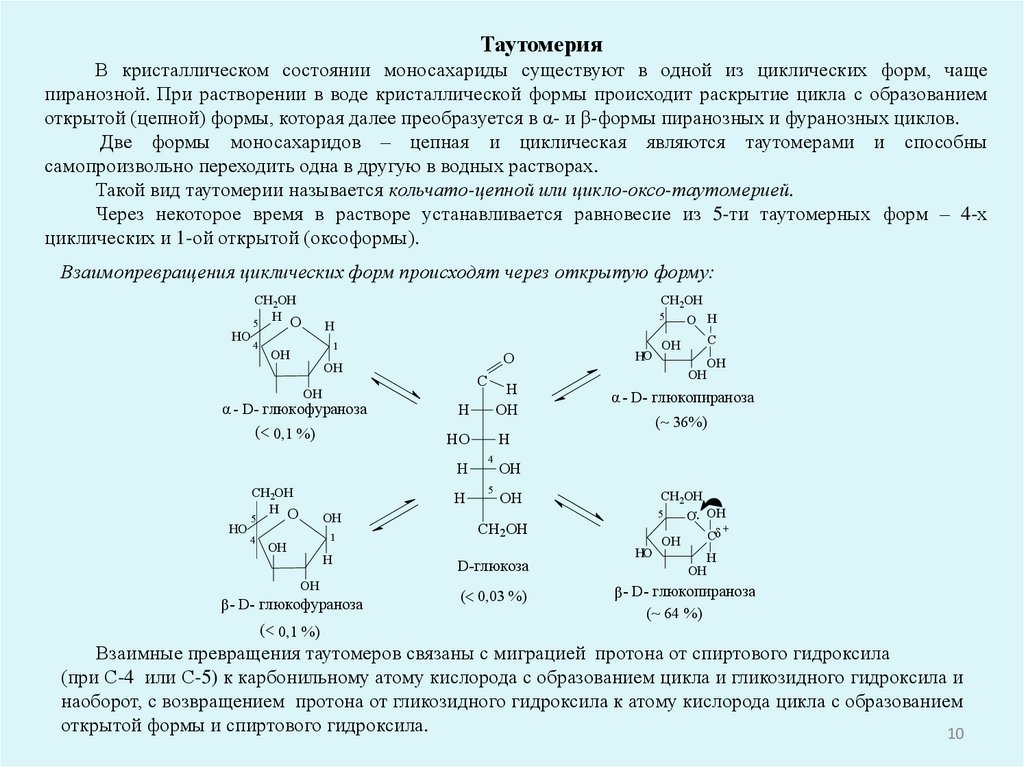
ТаутомерияВ кристаллическом состоянии моносахариды существуют в одной из циклических форм, чаще
пиранозной. При растворении в воде кристаллической формы происходит раскрытие цикла с образованием
открытой (цепной) формы, которая далее преобразуется в α- и β-формы пиранозных и фуранозных циклов.
Две формы моносахаридов – цепная и циклическая являются таутомерами и способны
самопроизвольно переходить одна в другую в водных растворах.
Такой вид таутомерии называется кольчато-цепной или цикло-оксо-таутомерией.
Через некоторое время в растворе устанавливается равновесие из 5-ти таутомерных форм – 4-х
циклических и 1-ой открытой (оксоформы).
Взаимопревращения циклических форм происходят через открытую форму:
HO
CH2OH
H O
5
4
CH2OH
5
H
1
OH
O
OH
OH
α - D- глюкофураноза
( 0,1 %)
С
H
H
OH
HO
H
H
HO
CH2OH
H O
H
OH
5
4
1
OH
H
OH
β - D- глюкофураноза
( 0,1 %)
4
5
HO
O H
С
OH
OH
OH
α - D- глюкопираноза
(~ 36%)
OH
OH
CH2OH
5
CH2OH
D-глюкоза
( 0,03 %)
HO
OH
O OH
Сδ
H
OH
β - D- глюкопираноза
(~ 64 %)
Взаимные превращения таутомеров связаны с миграцией протона от спиртового гидроксила
(при С-4 или С-5) к карбонильному атому кислорода с образованием цикла и гликозидного гидроксила и
наоборот, с возвращением протона от гликозидного гидроксила к атому кислорода цикла с образованием
открытой формы и спиртового гидроксила.
10
11.
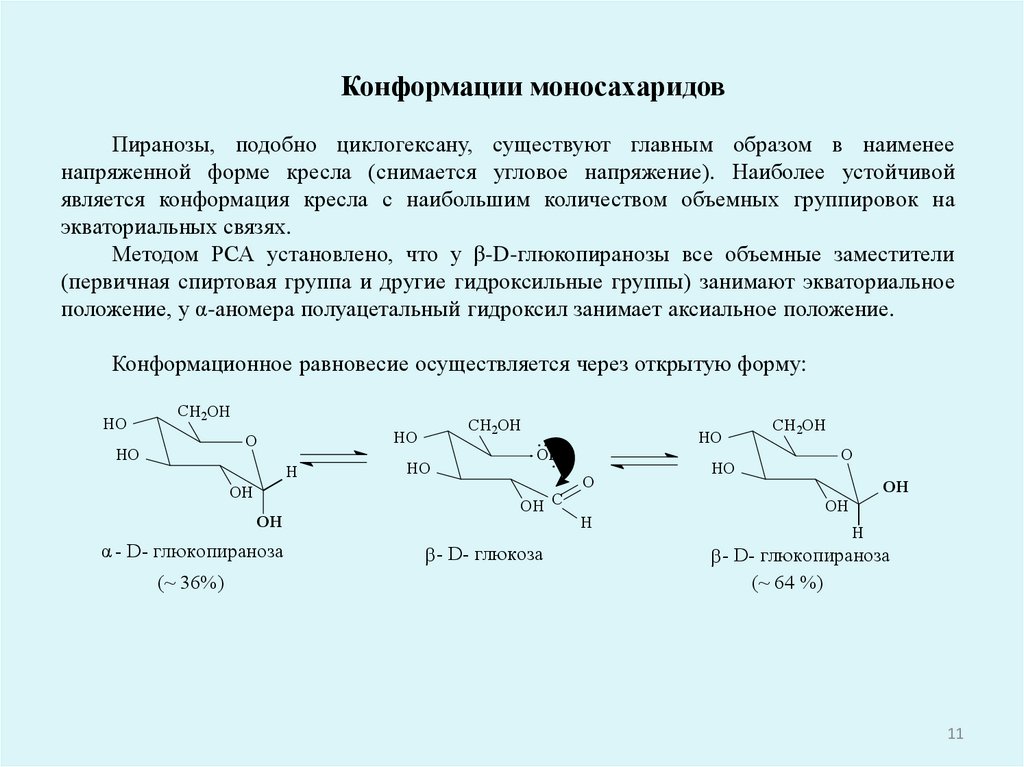
Конформации моносахаридовПиранозы, подобно циклогексану, существуют главным образом в наименее
напряженной форме кресла (снимается угловое напряжение). Наиболее устойчивой
является конформация кресла с наибольшим количеством объемных группировок на
экваториальных связях.
Методом РСА установлено, что у β-D-глюкопиранозы все объемные заместители
(первичная спиртовая группа и другие гидроксильные группы) занимают экваториальное
положение, у α-аномера полуацетальный гидроксил занимает аксиальное положение.
Конформационное равновесие осуществляется через открытую форму:
HO
C H2OH
HO
H
OH
OH
α - D- глюкопираноза
(~ 36%)
C H2OH
HO
O
HO
HO
OH
OH C
β - D- глюкоза
O
H
HO
C H2OH
O
OH
OH
H
β - D- глюкопираноза
(~ 64 %)
11
12.
Химические свойствареакции окисления
Открытая форма
Циклическая форма
реакции
карбонильных соединений
реакции
многоатомных спиртов
реакции полуацетального
гидроксила
(образование гликозидов)
Таким образом, в некоторых реакциях участвует только открытая форма, в
других – циклическая. В ряде случаев одновременно участвуют обе формы
сахаров.
Таутомерное равновесие сдвигается в сторону той формы, которая
принимает участие в реакции.
12
13.
1. Реакции гидроксильных групп1) Взаимодействие с гидроксидами металлов (свойства многоатомных спиртов)
В этих реакциях преимущественно участвует циклическая форма, которая преобладает в таутомерной
смеси:
CH2OH
O H
HO
CH2OH
O H
2
HO
OH
С1
OH
OH
α - D- глюкопираноза
OH
HO
Cu(OH)2
С1
O
Cu
- 2 H2O
O
OH
1С
H O
OH
OH
CH2OH
комплекс ярко-синего цвета
13
14.
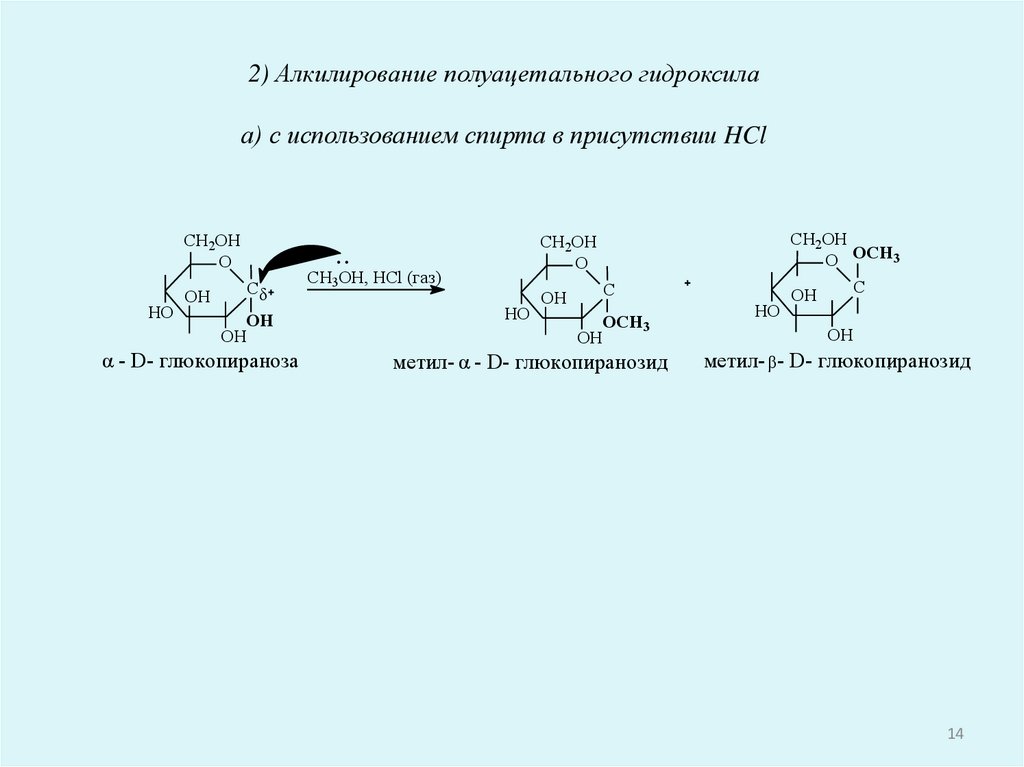
2) Алкилирование полуацетального гидроксилаа) с использованием спирта в присутствии HCl
CH2OH
O
HO
OH
Сδ
OH
OH
α - D- глюкопираноза
CH2OH
O OCH3
CH2OH
O
CH3OH, HCl (газ)
HO
OH
С
OCH3
OH
метил- α - D- глюкопиранозид
HO
С
OH
OH
метил- β- D- глюкопиранозид
14
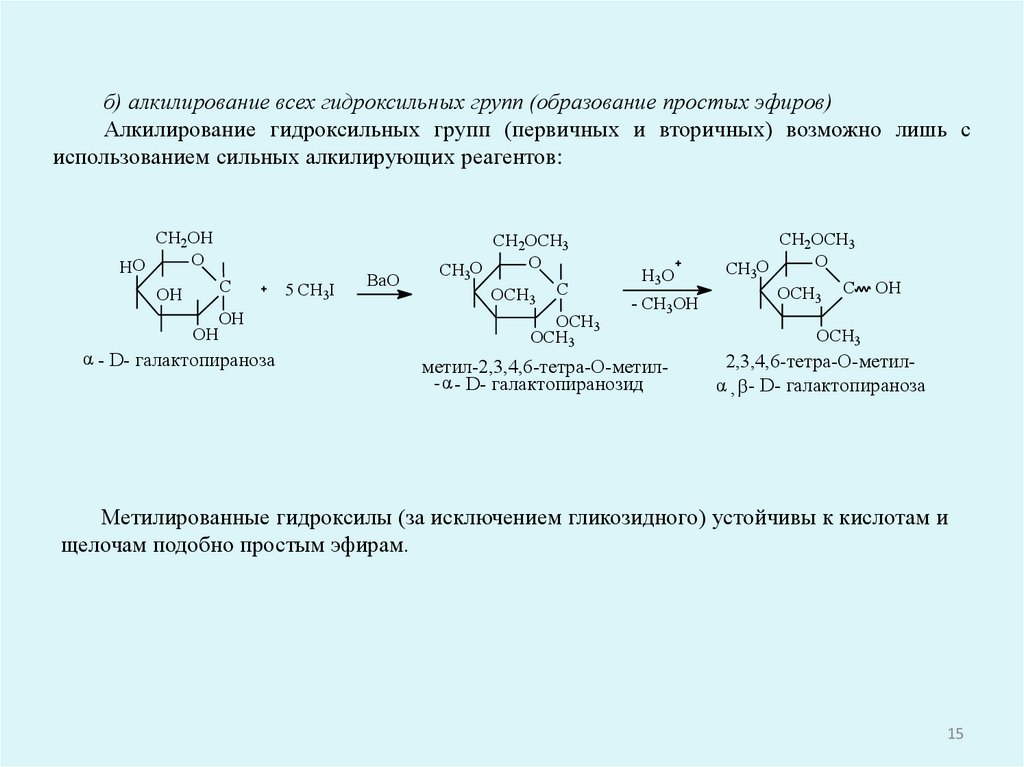
15.
б) алкилирование всех гидроксильных групп (образование простых эфиров)Алкилирование гидроксильных групп (первичных и вторичных) возможно лишь с
использованием сильных алкилирующих реагентов:
CH2OH
O
HO
OH
С
OH
OH
α - D- галактопираноза
5 CH3I
BaO
CH2OCH3
O
CH O
3
OCH3
С
OCH3
OCH3
H3O
- CH3OH
метил-2,3,4,6-тетра-O-метил-α - D- галактопиранозид
CH2OCH3
O
CH O
3
OCH3
С
OH
OCH3
2,3,4,6-тетра-O-метилα , β - D- галактопираноза
Метилированные гидроксилы (за исключением гликозидного) устойчивы к кислотам и
щелочам подобно простым эфирам.
15
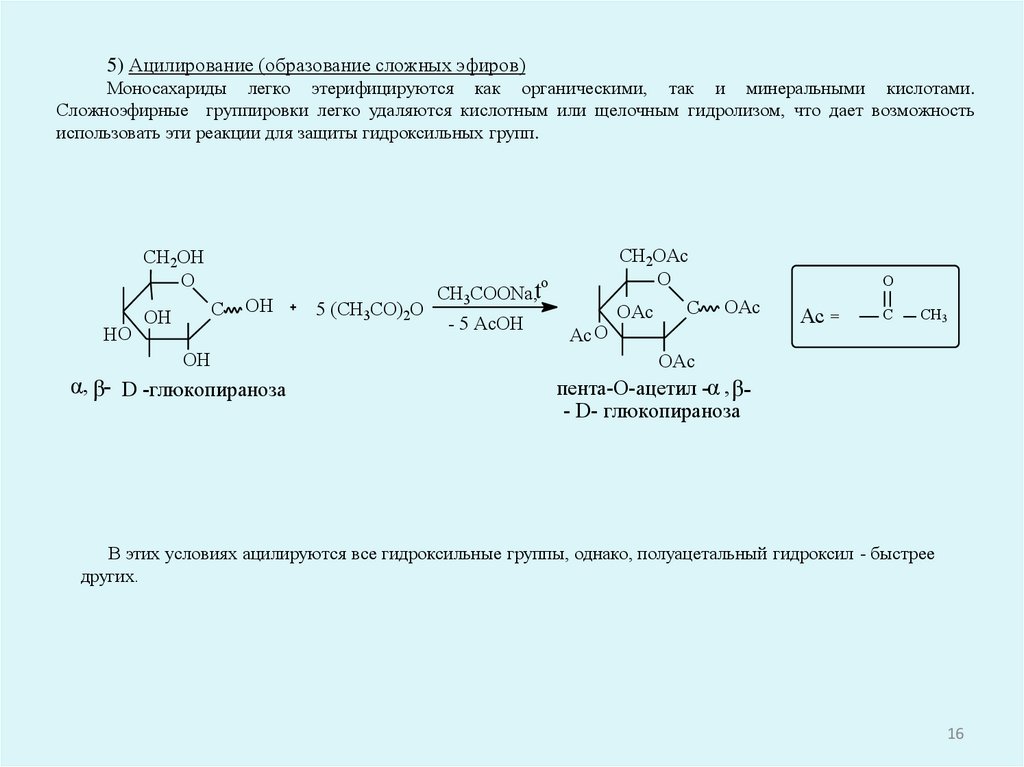
16.
5) Ацилирование (образование сложных эфиров)Моносахариды легко этерифицируются как органическими, так и минеральными кислотами.
Сложноэфирные группировки легко удаляются кислотным или щелочным гидролизом, что дает возможность
использовать эти реакции для защиты гидроксильных групп.
CH2OH
O
HO
o
С
OH
CH2OAc
O
OH
OH
α , β- D -глюкопираноза
5 (CH3CO)2O
CH3COONa,t
- 5 AcOH
Ac O
ОАс
С
O
OAc
Ac =
C
CH3
ОАс
пента-О-ацетил -α , β- D- глюкопираноза
В этих условиях ацилируются все гидроксильные группы, однако, полуацетальный гидроксил - быстрее
других.
16
17.
Важное биологическое значение имеют фосфорные эфиры. Они содержатся во всех животных и растительныхорганизмах, через них протекают процессы метаболизма углеводов.
Этерификация осуществляется по полуацетальному гидроксилу и первичным спиртовым группам:
6
O
HOCH2
OH
OH
OH
6
HOCH2
H3PO4
2
O
OH
1
CH2OH
O
P
2
OH
O
1
CH2OH
OH
OH
β - D- фруктофураноза
2-фосфат -β -D - фруктофуранозы
3 H3PO4
OH
O
P
OH
6
OCH2
OH
O
O
OH
2
1
P
OH OH
CH2O
OH
O
P
O
OH
1,2,6-трифосфат - β -D - фруктофуранозы
17
18. 2. Реакции по карбонильной группе (реакции открытой формы) В равновесной смеси таутомеров содержание открытой формы
2. Реакции по карбонильной группе(реакции открытой формы)
В равновесной смеси таутомеров содержание открытой формы моносахаридов
мало, тем не менее, этого достаточно для протекания реакций по карбонильной
группе вследствие восполнения этой формы за счет таутомерного превращения.
18
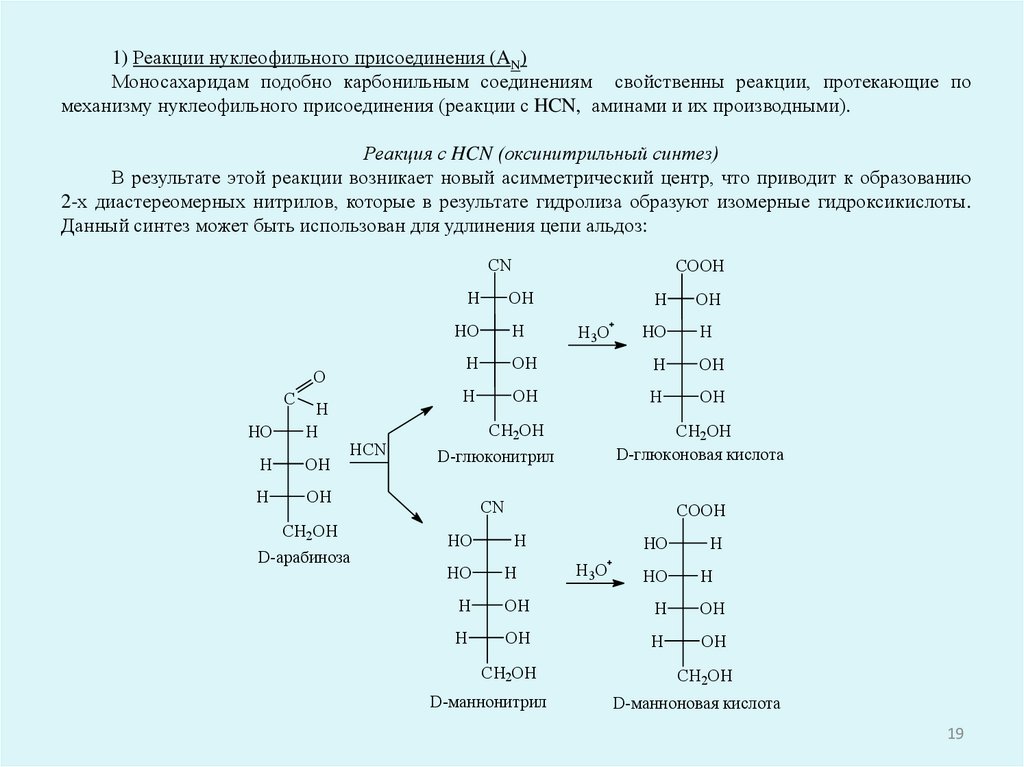
19.
1) Реакции нуклеофильного присоединения (AN)Моносахаридам подобно карбонильным соединениям свойственны реакции, протекающие по
механизму нуклеофильного присоединения (реакции с HCN, аминами и их производными).
Реакция с HCN (оксинитрильный синтез)
В результате этой реакции возникает новый асимметрический центр, что приводит к образованию
2-х диастереомерных нитрилов, которые в результате гидролиза образуют изомерные гидроксикислоты.
Данный синтез может быть использован для удлинения цепи альдоз:
СN
O
С
HO
H
H
H
OH
H
OH
HCN
CH2OH
D-арабиноза
СOOH
H
OH
HO
H
H
H
H
OH
HO
H
OH
H
OH
OH
H
OH
H3O
CH2OH
D-глюконитрил
CH2OH
D-глюконовая кислота
СN
СOOH
HO
H
HO
H
H
H
HO
H
HO
H
OH
H
OH
OH
H
OH
CH2OH
D-маннонитрил
H3O
CH2OH
D-манноновая кислота
19
20.
2) Реакции восстановленияМоносахариды восстанавливаются подобно альдегидам и кетонам, образуя многоатомные спирты –
альдиты (полиолы).
O
С
СH2OH
CH2OH
H
OH
C O
HO
H
H
H
OH
HO
H
H
OH
H
OH
H
OH
H
OH
NaBH4
CH2OH
CH2OH
D- глюкоза
D- сорбит
NaBH4
СH2OH
HO
H
HO
H
HO
H
H
OH
H
OH
H
OH
H
OH
NaBH4
CH2OH
CH2OH
D- фруктоза
D- маннит
Ксилоза восстанавливается до ксилита, а галактоза – до дульцита. Эти многоатомные спирты
имеют сладкий вкус, но не усваиваются организмом, поэтому их назначают вместо сахара больным
диабетом.
20
21.
3. Реакции с участием обеих функциональных групп(реакции открытой и циклической форм)
Окисление
Моносахариды легко окисляются благодаря наличию альдегидной группы и гидроксильных групп,
прежде всего, полуацетального гидроксила и первичных ОН-групп.
Таким образом, окислению подвергаются обе формы сахаров – открытая и циклическая. В
зависимости от характера окислителя и условий окисления образуются различные продукты.
а) Окисление в щелочной среде
Альдозы – восстанавливающие сахара. Благодаря наличию карбонильной группы они способны
восстанавливать в щелочной среде катионы металлов (Ag+, Cu2+), при этом сами окисляются до
альдоновых кислот и далее образуют продукты окисления с меньшей длиной углеродной цепи (разрыв
С-С связей).
O
O
С
H
H
OH
HO
H
H
OH
H
OH
CH2OH
D- глюкоза
С
o
H
OH
OH
HO
H
H
OH
H
OH
1) Ag(NH3)2 OH, t
(реактив Толленса)
2
2) Cu (комплекс), t o
(реактив Фелинга), син. р-р
1)
Ag
О
2)
CH2OH
продукты
деструктивного окисления
Cu2O
красн. цв.
D- глюконовая кислота
21
22.
Однако фруктоза (кетоза!) тоже дает положительную реакцию с указанными реактивами. Это можнообъяснить изомеризацией альдоз и кетоз в щелочной среде:
O
С
O
С
H
H
OH
HO
H
H
OH
H
OH
CH2OH
D- глюкоза
H
HO
H
H
HO
H
H
OH
H
OH
OH
C
C
OH
HO
H
H
OH
H
OH
CH2OH
ендиольная форма
CH2OH
D- манноза
CH2OH
C O
HO
H
H
OH
H
OH
CH2OH
D- фруктоза
В результате изомеризации образуется таутомерная смесь глюкозы, маннозы и фруктозы.
Именно альдозы этой смеси участвуют в реакции окисления.
Таким образом, с помощью вышеуказанных реактивов невозможно различить, например, глюкозу и
фруктозу.
22
23.
б) Окисление бромной водой (мягкое окисление)Окислению подвергаются обе формы сахаров.
Продуктами окисления открытой формы являются тоже альдоновые кислоты, но в
условиях данной реакции они не подвергаются деструктивному окислению.
O
O
С
С
H
OH
OH
HO
H
OH
H
OH
OH
H
OH
H
H
OH
HO
H
H
H
Br2 , H2O
CH2OH
CH2OH
D- глюкоза
D- глюконовая кислота
23
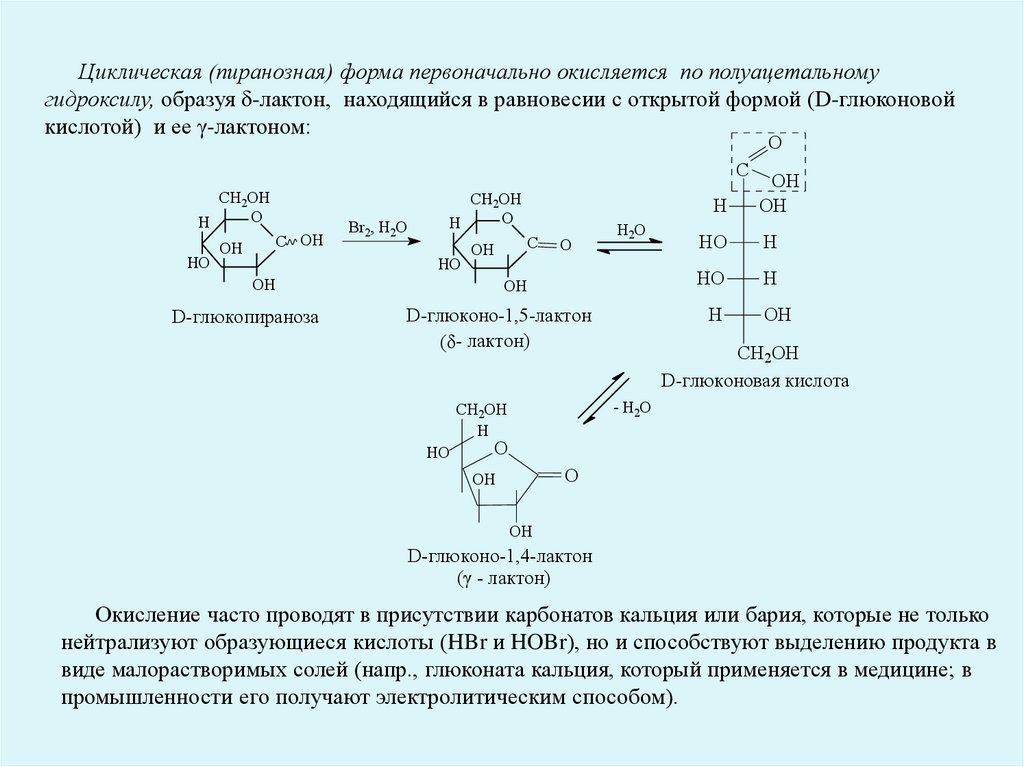
24.
Циклическая (пиранозная) форма первоначально окисляется по полуацетальномугидроксилу, образуя -лактон, находящийся в равновесии с открытой формой (D-глюконовой
кислотой) и ее -лактоном:
O
С
CH2OH
O
H
HO
С OH
OH
Br2, H2O
CH2OH
O
H
HO
С
OH
OH
D-глюкопираноза
O
H2O
OH
D-глюконо-1,5-лактон
(δ- лактон)
HO
H
HO
H
H
OH
CH2OH
D-глюконовая кислота
- H2O
CH2OH
H
HO
H
OH
OH
O
O
OH
OH
D-глюконо-1,4-лактон
(γ - лактон)
Окисление часто проводят в присутствии карбонатов кальция или бария, которые не только
нейтрализуют образующиеся кислоты (HBr и HOBr), но и способствуют выделению продукта в
виде малорастворимых солей (напр., глюконата кальция, который применяется в медицине; в
промышленности его получают электролитическим способом).
25.
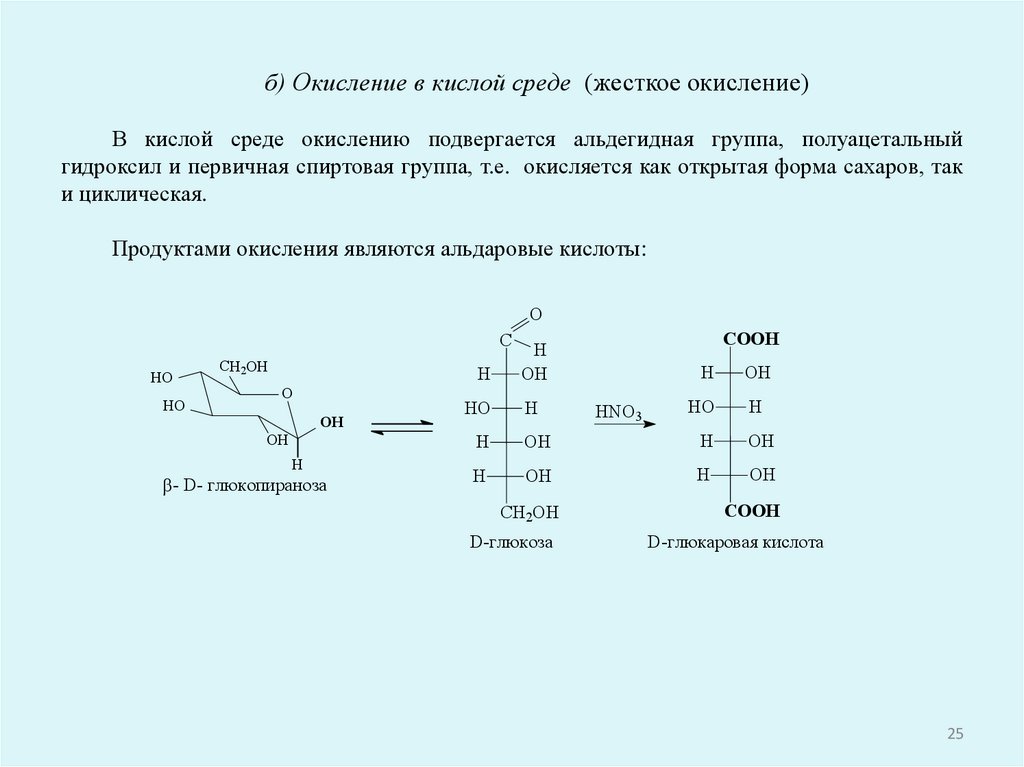
б) Окисление в кислой среде (жесткое окисление)В кислой среде окислению подвергается альдегидная группа, полуацетальный
гидроксил и первичная спиртовая группа, т.е. окисляется как открытая форма сахаров, так
и циклическая.
Продуктами окисления являются альдаровые кислоты:
O
С
HO
HO
C H2OH
O
OH
OH
H
β - D- глюкопираноза
H
H
OH
HO
H
H
H
СOOH
H
OH
HO
H
OH
H
OH
OH
H
OH
CH2OH
D-глюкоза
HNO3
COOH
D-глюкаровая кислота
25
26.
Окисление только первичной спиртовой группы возможно лишь при условии защитыальдегидной группы и полуацетального гидроксила, которые наиболее чувствительны к
окислительным реагентам.
С этой целью получают гликозид, т.е. циклическую форму с алкилированным полуацетальным
гидроксилом, которая не способна образовать открытую форму.
CH2OH
O
HO
OH
СH3OH, HCl
С
CH2OH
O
H
HO
OH
OH
α - D- глюкопираноза
С
OH
OCH3
OH
метил- α - D- глюкопиранозид
O
С
COOH
O
H
HO
С OH
OH
OH
α, β - D-глюкуроновая
кислота
HNO3
H
H
OH
HO
H
H
OH
H
OH
H
HO
COOH
O
OH
С
H2O (H )
OCH3
OH
- CH3OH
метил- α - D- глюкопирануронид
COOH
D-глюкуроновая
кислота
Уроновые кислоты, образующиеся при окислении первичной спиртовой группы, являются
структурными единицами сложных углеводов (полисахаридов), гепарина (препарата свертывания
крови), пектиновых веществ (компонентов растительных клеток) и лекарственных веществ. Они
образуют с лекарственными веществами, их метаболитами, а также токсикантами водорастворимые
комплексы, которые выводятся из организма с мочой.
26
27.
ПРОИЗВОДНЫЕ МОНОСАХАРИДОВК ним относят соединения, имеющие моносахаридную природу и содержащие
вместо одной или нескольких гидроксильных групп другие функциональные группы или
атом водорода (дезоксисахара, аминосахара и гликозиды).
1) Дезоксисахара (одна или две ОН-группы замещены на ат. Н)
O
C
H
CH2
H
OH
H
OH
CH2OH
2- дезокси-D-рибоза
HOCH2
O
CH3
O
OH
С OH
HO
OH
2- дезокси-D-рибофураноза
(структурный фрагмент
нуклеиновых кислот)
OH
D- дигитоксоза
(структурный фрагмент
углеводной части сердечных гликозидов)
27
28.
2) Аминосахара (ОН-группа, обычно при С2, замещена на аминогруппу)Важнейшими аминосахарами являются производные глюкозы и галактозы, которые
входят в состав соединительной ткани, в структуру ферментов, являются компонентами
плазмы крови и структурными компонентами многих антибиотиков.
В природных аминосахарах аминогруппа часто бывает алкилирована или ацилирована.
CH2OH
O
HO
OH
С
CH2OH
O
OH
NH2
D-глюкозамин
(2-амино-2-дезокси - D- глюкопираноза)
HO
OH
С
OH
NHR
R= - CH3,
C
CH3
O
28
29.
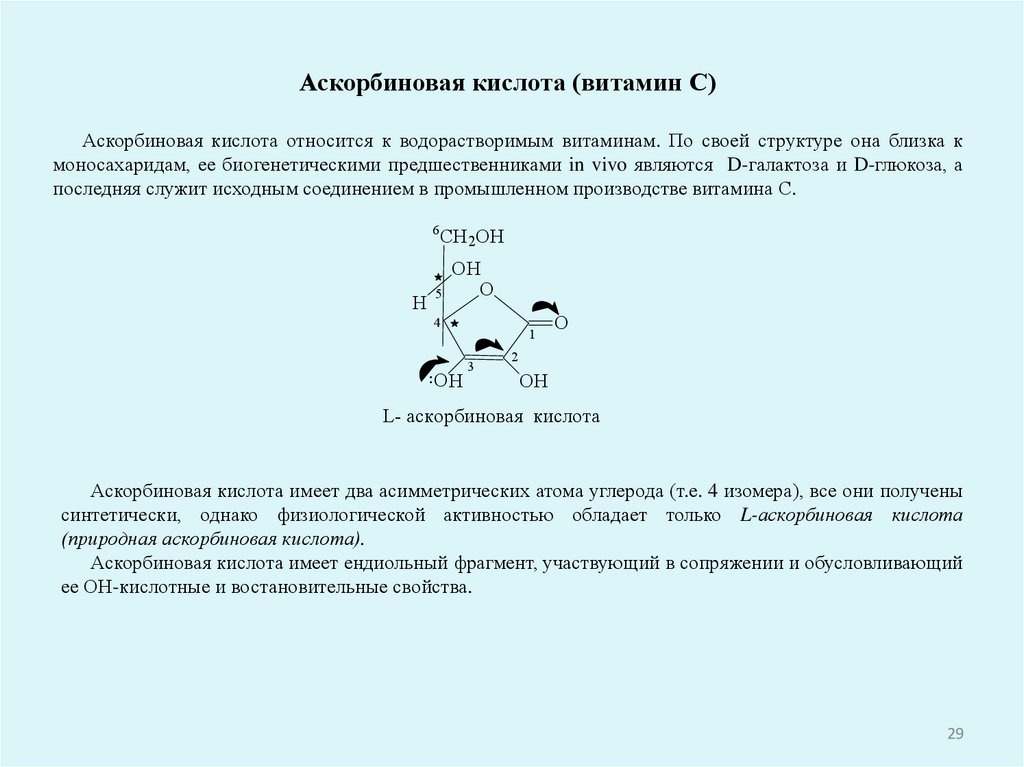
Аскорбиновая кислота (витамин С)Аскорбиновая кислота относится к водорастворимым витаминам. По своей структуре она близка к
моносахаридам, ее биогенетическими предшественниками in vivo являются D-галактоза и D-глюкоза, а
последняя служит исходным соединением в промышленном производстве витамина С.
6
H
CH2OH
OH
O
5
4
OH
1
3
O
2
OH
L- аскорбиновая кислота
Аскорбиновая кислота имеет два асимметрических атома углерода (т.е. 4 изомера), все они получены
синтетически, однако физиологической активностью обладает только L-аскорбиновая кислота
(природная аскорбиновая кислота).
Аскорбиновая кислота имеет ендиольный фрагмент, участвующий в сопряжении и обусловливающий
ее ОН-кислотные и востановительные свойства.
29















 chemistry
chemistry








