Similar presentations:
Гетерофункциональные органические соединения
1.
2.
• Соединения, содержащие в своемсоставе различные функциональные
группы, называются
гетерофункциональными
соединениями.
• Подавляющее большинство веществ,
участвующих в метаболизме, являются
полифункциональными или
гетерофункциональными.
3.
• Химические свойства гетерофункциональныхсоединений сочетают в себе свойства тех
функциональных групп, которые входят в
молекулу. Однако наличие в молекуле различных
функциональных групп приводит к тому, что
проявляется взаимное влияние, что несколько
видоизменяет их свойства.
• Свойства гетерофункциональных органических
веществ со смешанными функциями не
являются механической суммой свойств
отдельных функциональных групп, а
отличаются особенностями
4.
Классификация• Соединения, содержащие в молекуле
гидроксильные и карбоксильные группы
делятся на:
оксикарбоновые (содержат ОН-группу,
связаны с алифатической цепью или боковой цепью
ароматического соединения)
фенолкарбоновые (с ОН-руппами,
непосредственно связанными с ароматическим
ядром)
Каждая из этих групп подразделяется на несколько
подгрупп: монооксимонокарбоновые (молочная
кислота), полиоксимонокарбоновые,
монооксидикарбоновые и т.д.
5. Гидрокси(окси) кислоты.
6.
Гидрокси(окси) кислоты.CH3
СOOH
СOOH
СOOH
CHOH
CH2
CHOH
CH2
CHOH
CHOH
CHOH
C
Молочная
COOH
COOH
2-гидроксипропановая
яблочная
винная
α-оксипропионовая
OH
COOH
CH2
COOH
лимонная
Соли:
лактаты
малаты
тартраты
цитраты
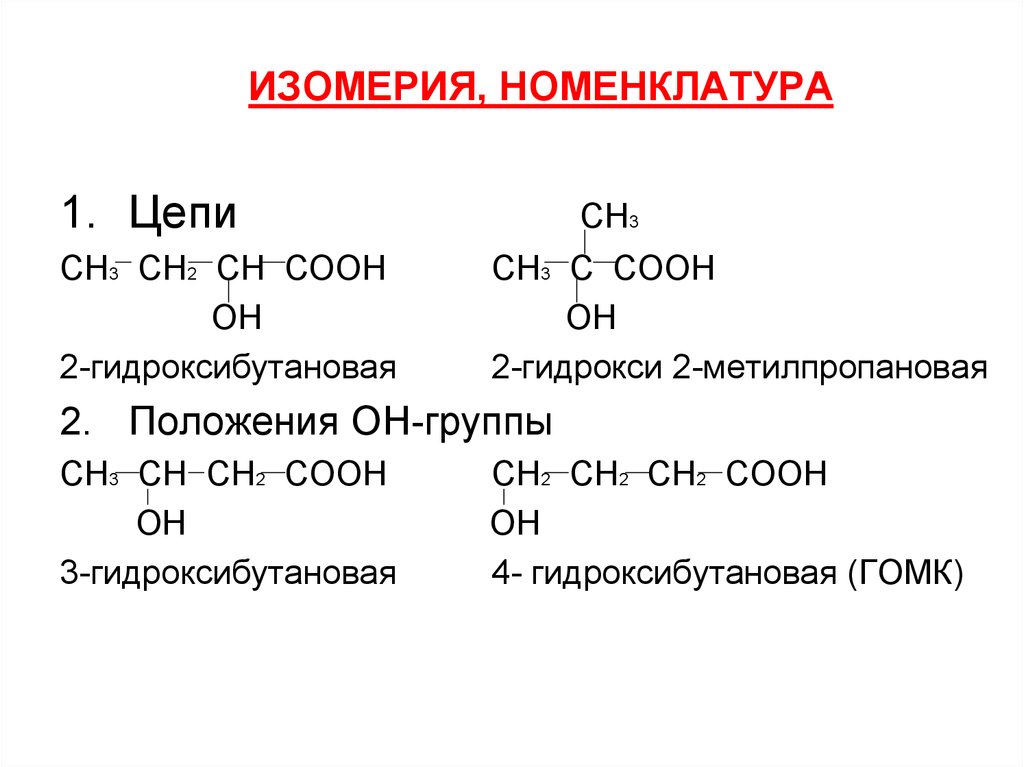
7. ИЗОМЕРИЯ, НОМЕНКЛАТУРА
1. ЦепиСН3 СН2 СН СООН
ОН
2-гидроксибутановая
СН3
СН3 С СООН
ОН
2-гидрокси 2-метилпропановая
2. Положения ОН-группы
СН3 СН СН2 СООН
ОН
3-гидроксибутановая
СН2 СН2 СН2 СООН
ОН
4- гидроксибутановая (ГОМК)
8.
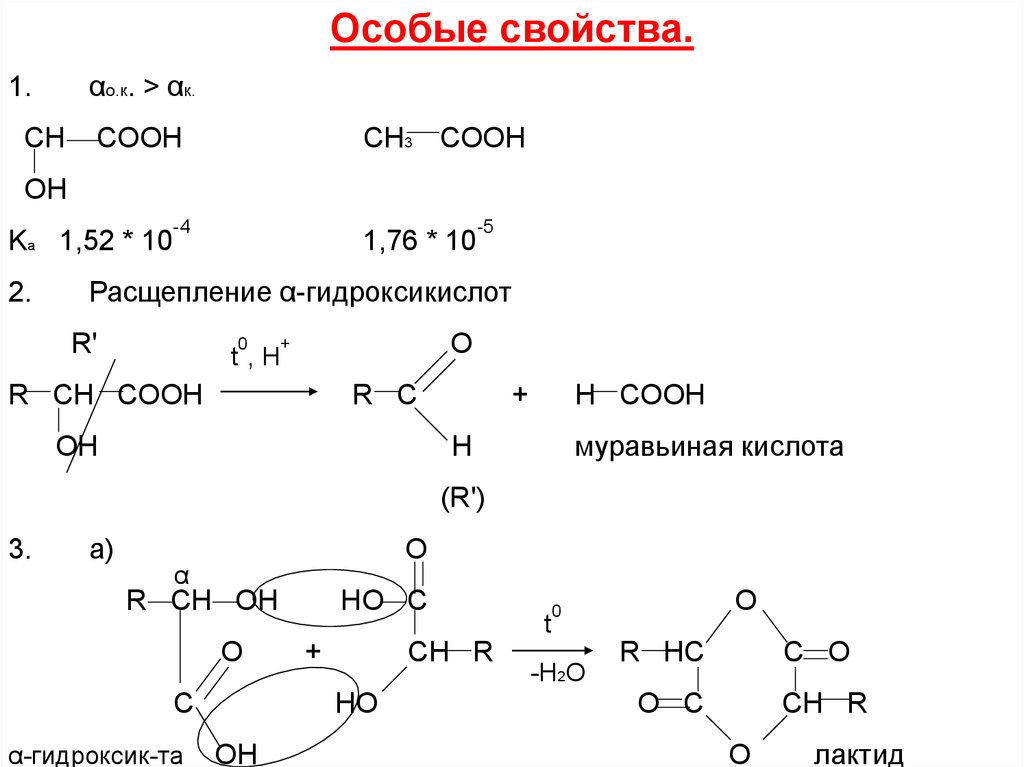
Особые свойства.αо.к. > αк.
1.
CH
СH3 COOH
COOH
OH
Ka 1,52 * 10
2.
-4
1,76 * 10
-5
Расщепление α-гидроксикислот
R'
0
O
+
t ,Н
R CH COOH
R C
OH
+
H COOH
муравьиная кислота
H
(R')
3.
а)
O
α
R CH OH
O
C
α-гидроксик-та
HO C
+
CH R
HO
ОН
t
O
0
-H2O
R HC
C O
O C
CH R
O
лактид
9.
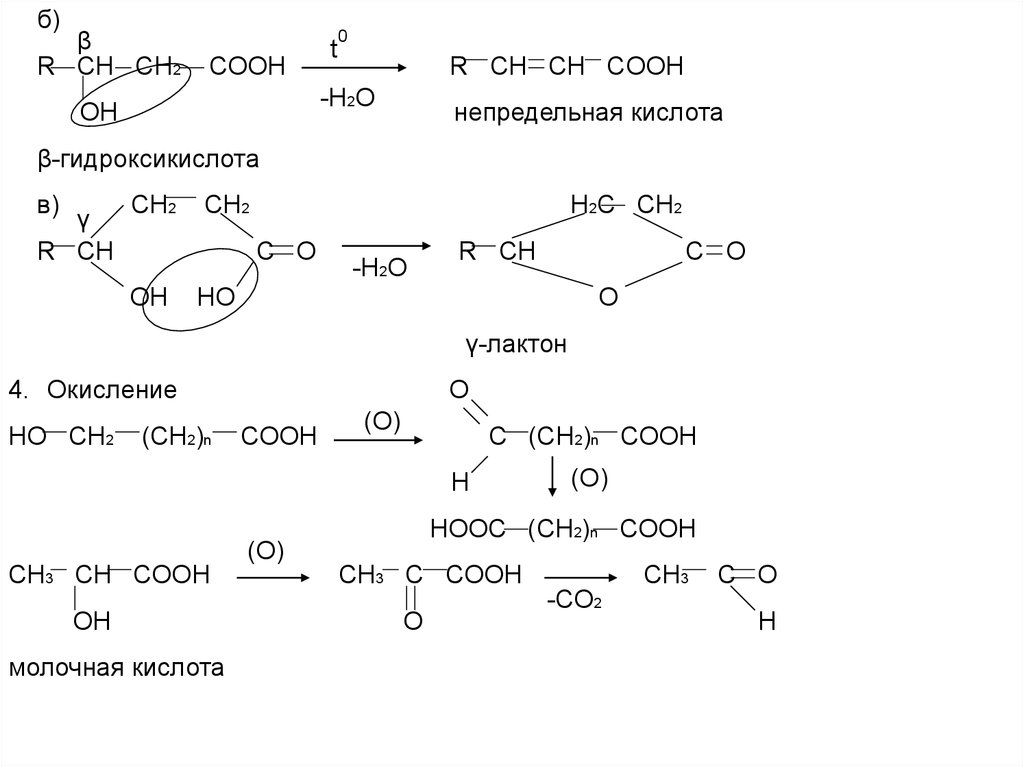
б)β
R CH CH2
COOH
t
0
R CH CH COOH
-H2O
ОН
непредельная кислота
β-гидроксикислота
в)
γ
R CH
CH2
CH2
H2C CH2
C O
OH
-H2O
R CH
C O
HO
O
γ-лактон
4. Окисление
HO CH2
(CH2)n
O
COOH
(O)
C (CH2)n COOH
H
HOOC (CH2)n COOH
(O)
CH3 CH COOH
OH
молочная кислота
(O)
CH3 C COOH
O
CH3
-CO2
C O
H
10.
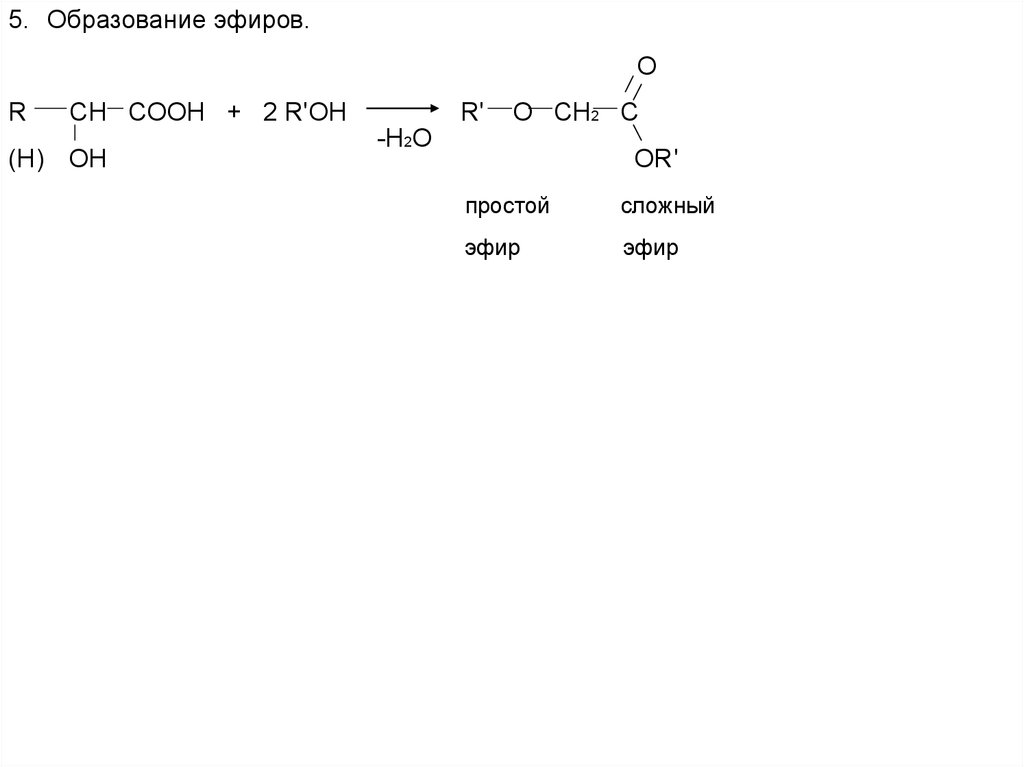
5. Образование эфиров.O
R
CH COOH + 2 R'OH
(H) OH
R'
O CH2 C
-H2O
OR'
простой
сложный
эфир
эфир
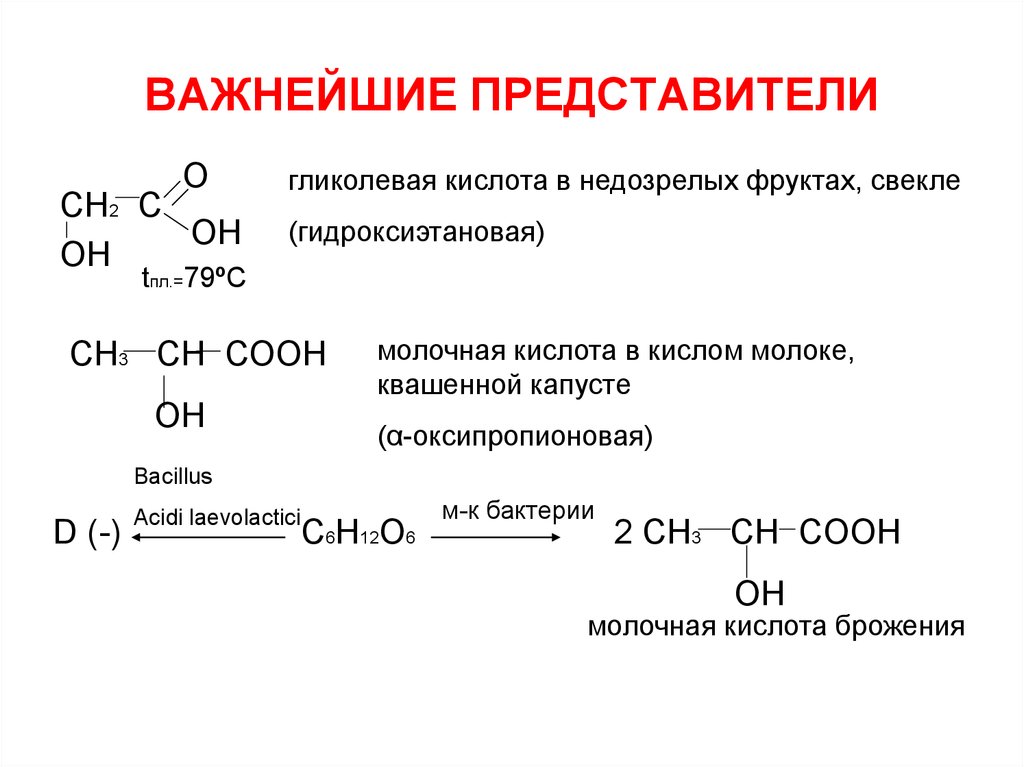
11. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ
ОСН2 С
ОН
ОН
гликолевая кислота в недозрелых фруктах, свекле
(гидроксиэтановая)
tпл.=79ºС
СН3 СН СООН
ОН
молочная кислота в кислом молоке,
квашенной капусте
(α-оксипропионовая)
Bacillus
D (-)
Acidi laevolactici
C6H12O6
м-к бактерии
2 CH3 CH COOH
OH
молочная кислота брожения
12.
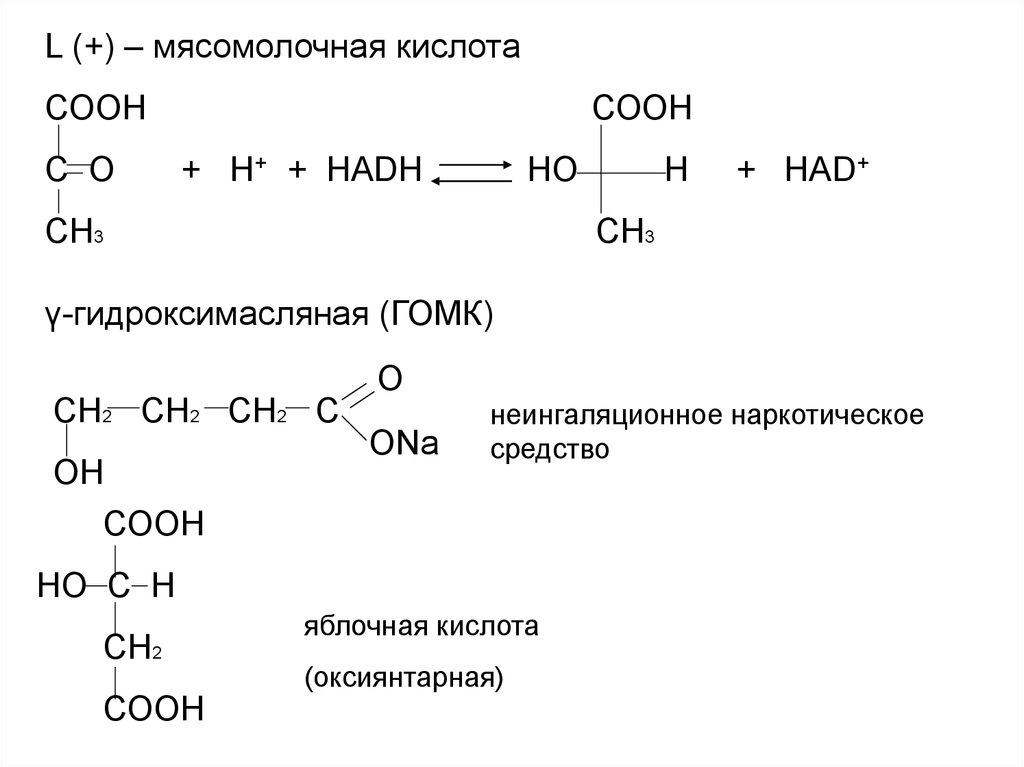
L (+) – мясомолочная кислотаСООН
С О
СООН
+ Н+ + НАDН
НО
СН3
Н
+ НАD+
СН3
γ-гидроксимасляная (ГОМК)
СН2 СН2 СН2 С
ОН
О
ОNa
неингаляционное наркотическое
средство
СООН
НО С Н
СН2
СООН
яблочная кислота
(оксиянтарная)
13.
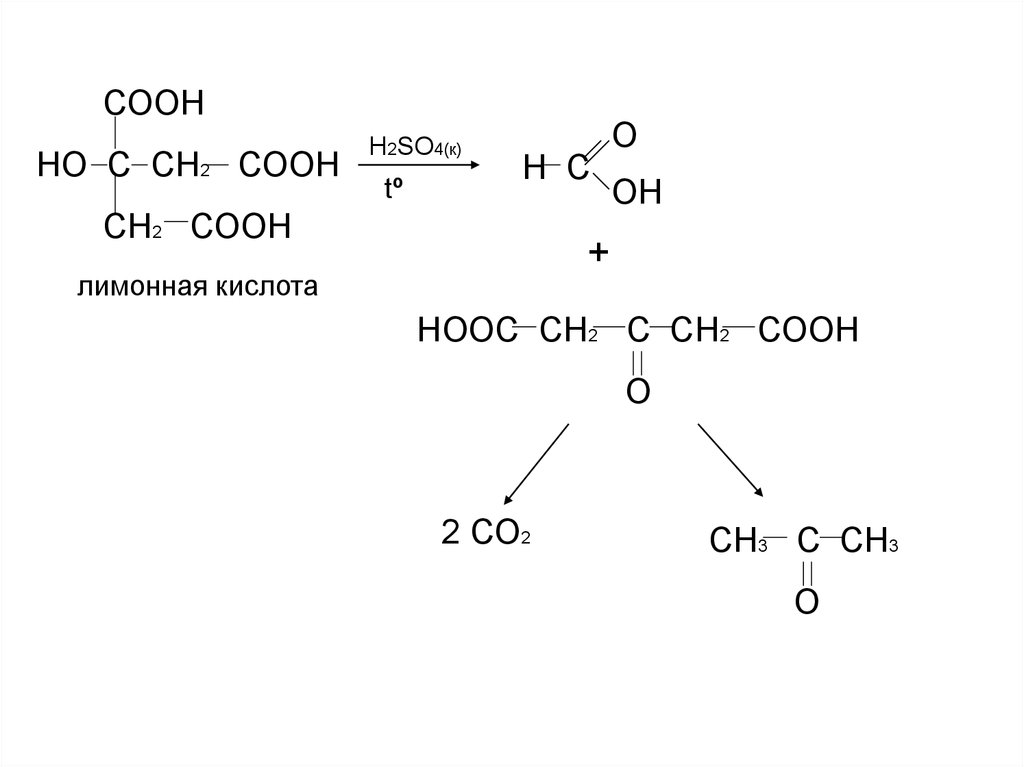
СООННО С СН2 СООН
Н2SO4(к)
tº
Н С
СН2 СООН
О
ОН
+
лимонная кислота
НООС СН2 С СН2 СООН
О
2 СО2
СН3 С СН3
О
14.
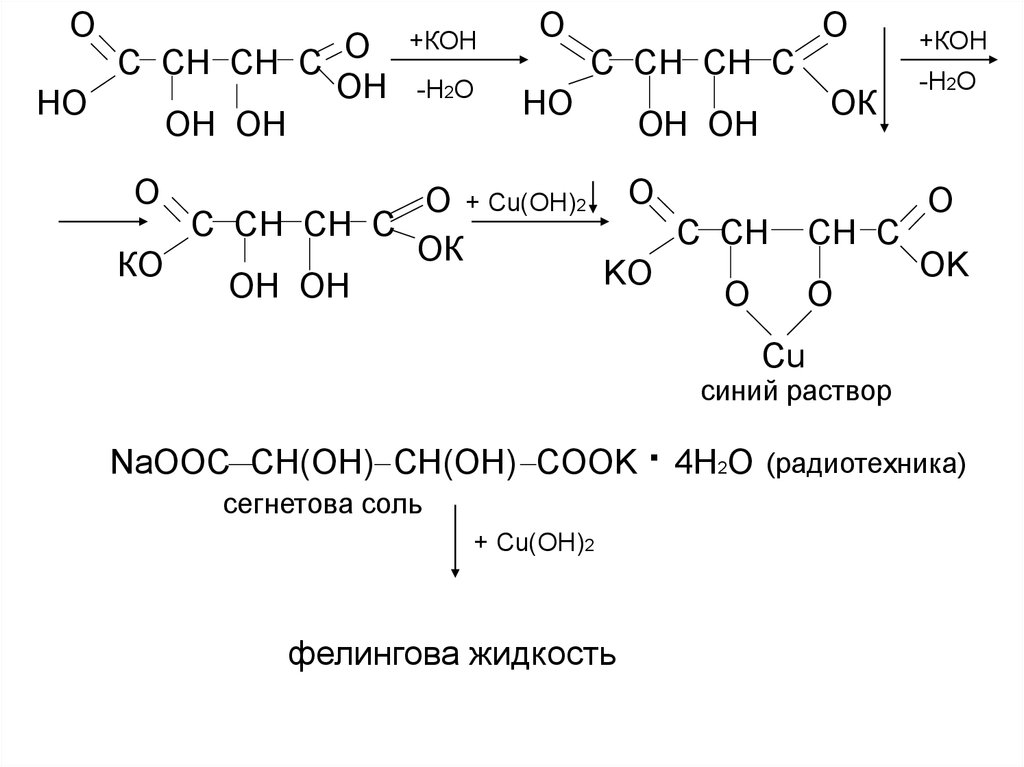
ОС СН СН С О
ОН
НО
ОН ОН
+КОН
-Н2О
О
С СН СН С
НО
О
ОК
ОН ОН
О
О + Сu(ОН)2 O
С СН СН С
С СН
ОК
КО
KO
ОН ОН
О
СН С
О
+КОН
-Н2О
O
OK
Сu
синий раствор
NaOOC CH(OH) CH(OH) COOK · 4Н2О (радиотехника)
сегнетова соль
+ Сu(ОН)2
фелингова жидкость
15.
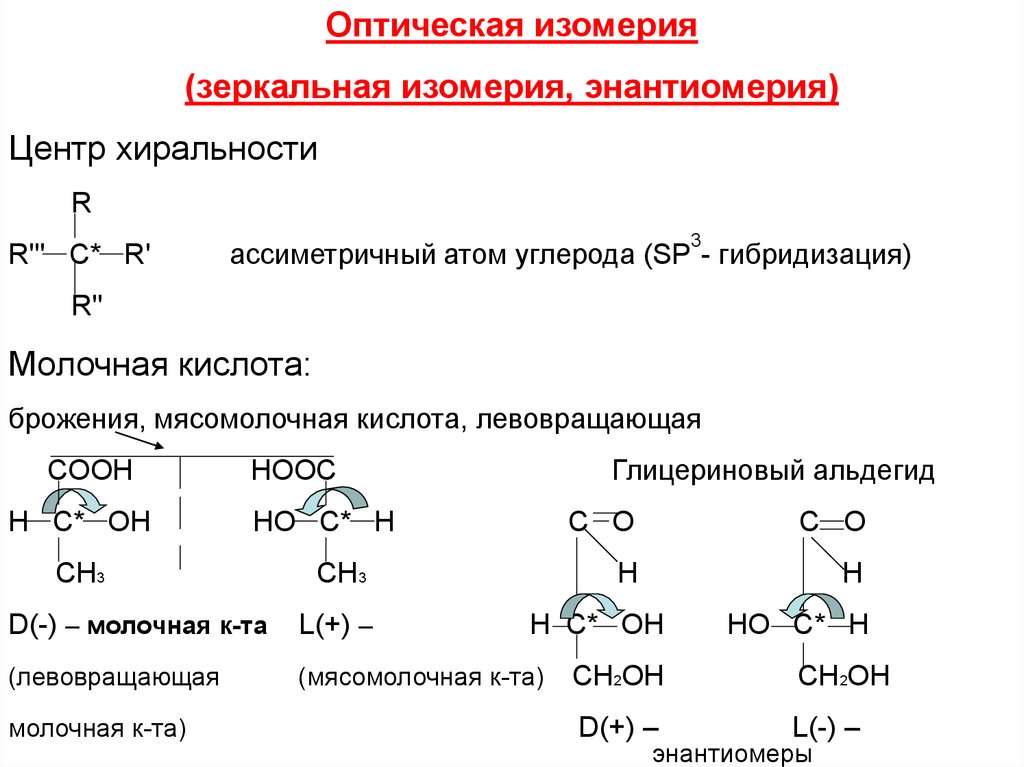
Оптическая изомерия(зеркальная изомерия, энантиомерия)
Центр хиральности
R
R''' C* R'
3
ассиметричный атом углерода (SP - гибридизация)
R''
Молочная кислота:
брожения, мясомолочная кислота, левовращающая
COOH
H C* OH
Глицериновый альдегид
HOOC
HO C* H
CH3
CH3
D(-) – молочная к-та
L(+) –
(левовращающая
(мясомолочная к-та)
молочная к-та)
C O
C O
H
H
H C* OH
НО C* H
CH2OH
CH2OH
D(+) –
L(-) –
энантиомеры
16.
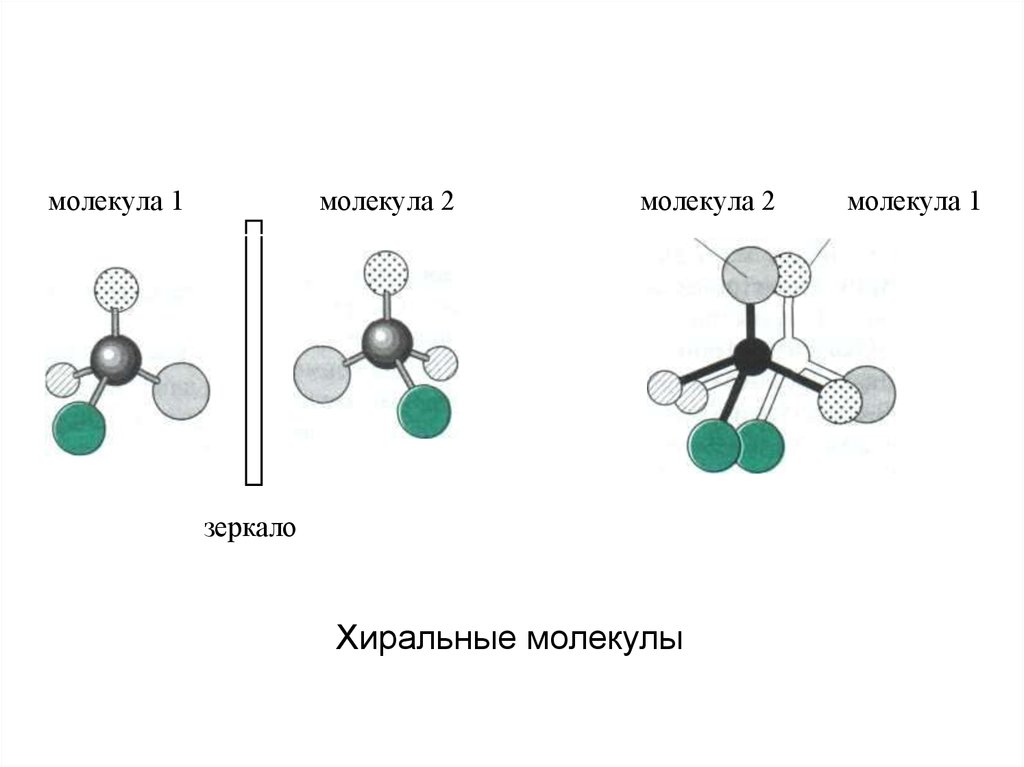
Хиральные объекты17.
молекула 1молекула 2
молекула 2
зеркало
Хиральные молекулы
молекула 1
18.
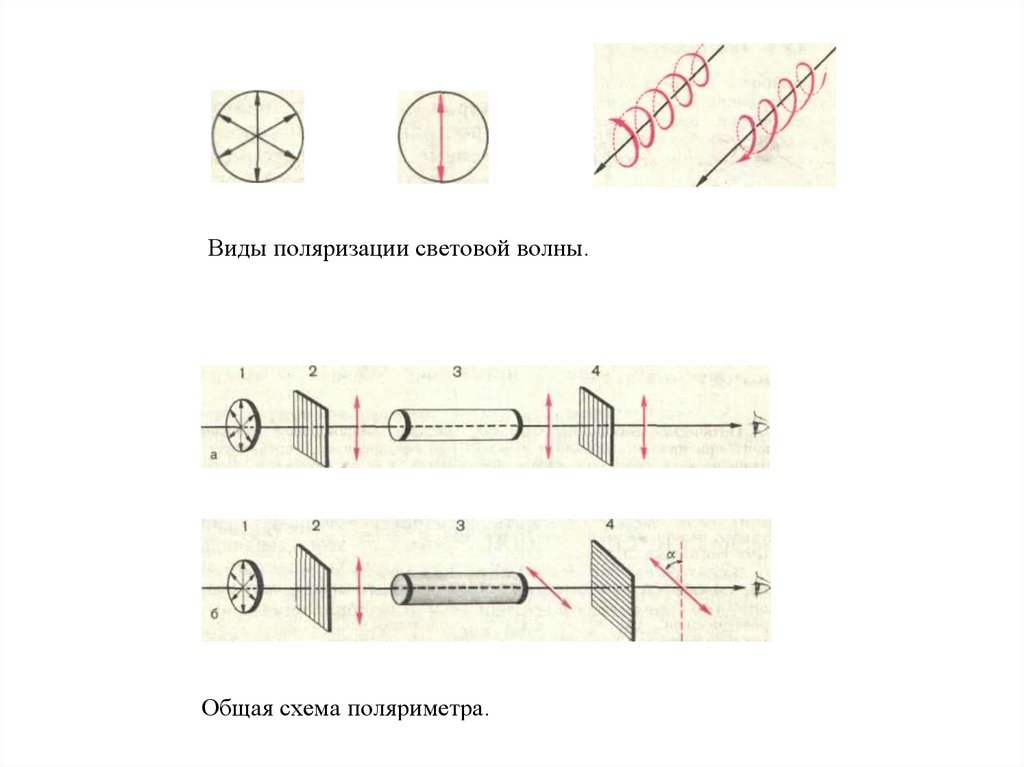
Виды поляризации световой волны.Общая схема поляриметра.
19.
соонсоон
Хиральный
атом углерода
н
н
СН3
Энантиомеры молочной кислоты
СН 3
20.
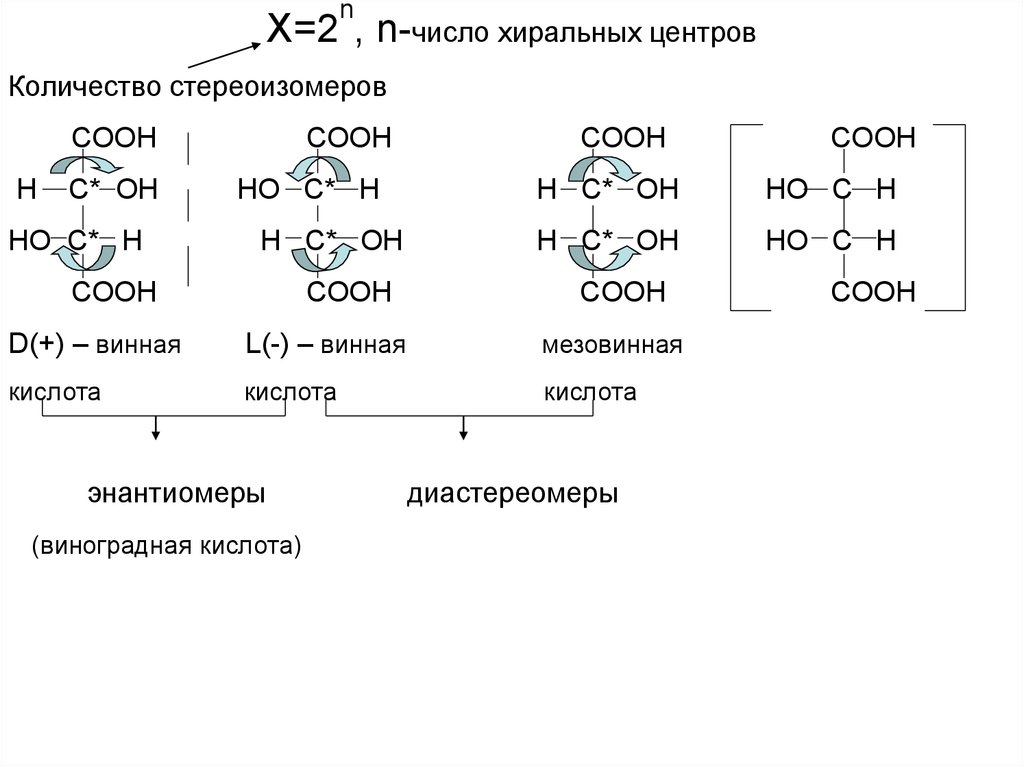
nX=2 , n-число хиральных центров
Количество стереоизомеров
COOH
H
C* OH
HO C* H
COOH
НО C* H
H C* OH
COOH
COOH
COOH
H C* OH
HO C H
H C* OH
HO C H
COOH
D(+) – винная
L(-) – винная
мезовинная
кислота
кислота
кислота
энантиомеры
(виноградная кислота)
COOH
диастереомеры
COOH
21.
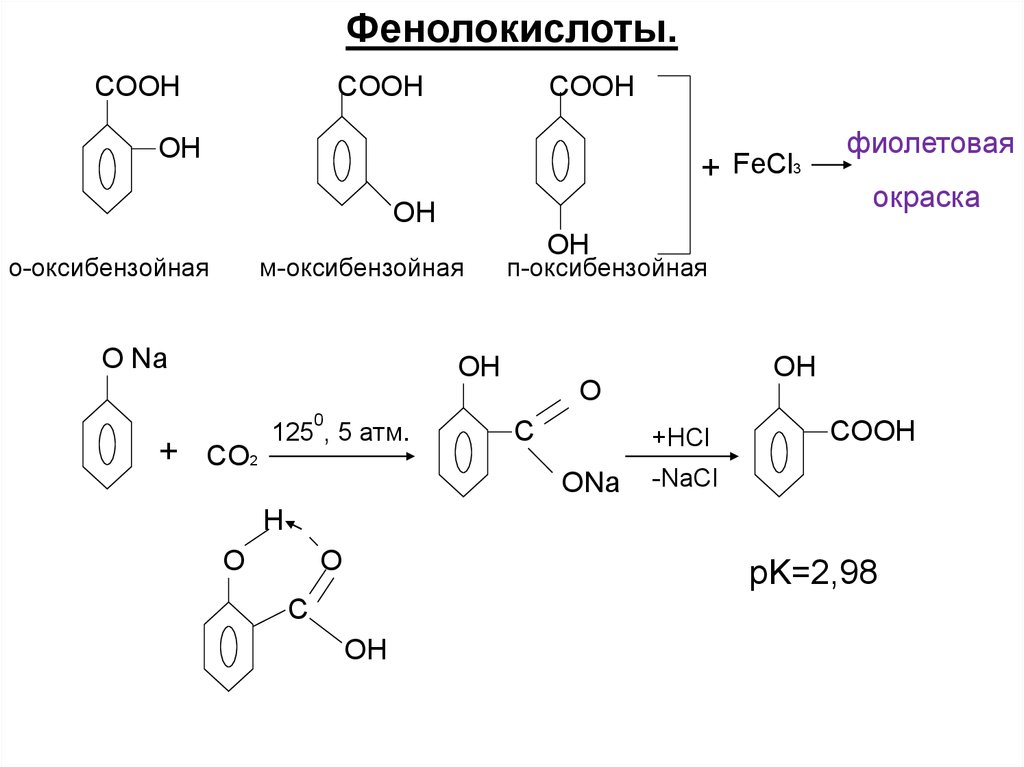
Фенолокислоты.COOH
COOH
COOH
OH
+ FeCl3
OH
о-оксибензойная
м-оксибензойная
O Na
0
+ CO2
окраска
OH
п-оксибензойная
OH
125 , 5 атм.
фиолетовая
OH
О
C
+HCl
ONa
COOH
-NaCl
H
O
O
pK=2,98
C
OH
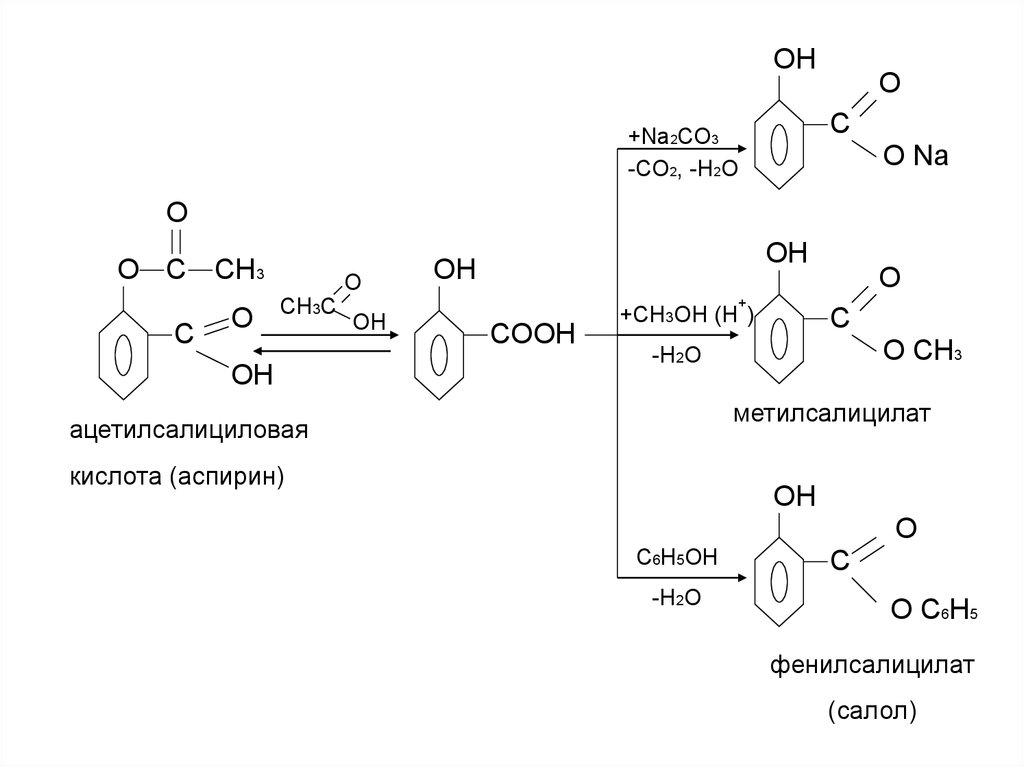
22.
OHO
C
+Na2CO3
-CO2, -H2O
O Na
O
O C CH3
C
O
O
CH3C
OH
OH
OH
+
OH
COOH
+СH3OH (H )
O
C
O CH3
-H2O
метилсалицилат
ацетилсалициловая
кислота (аспирин)
OH
O
C6H5OH
-H2O
C
O C6H5
фенилсалицилат
(салол)
23.
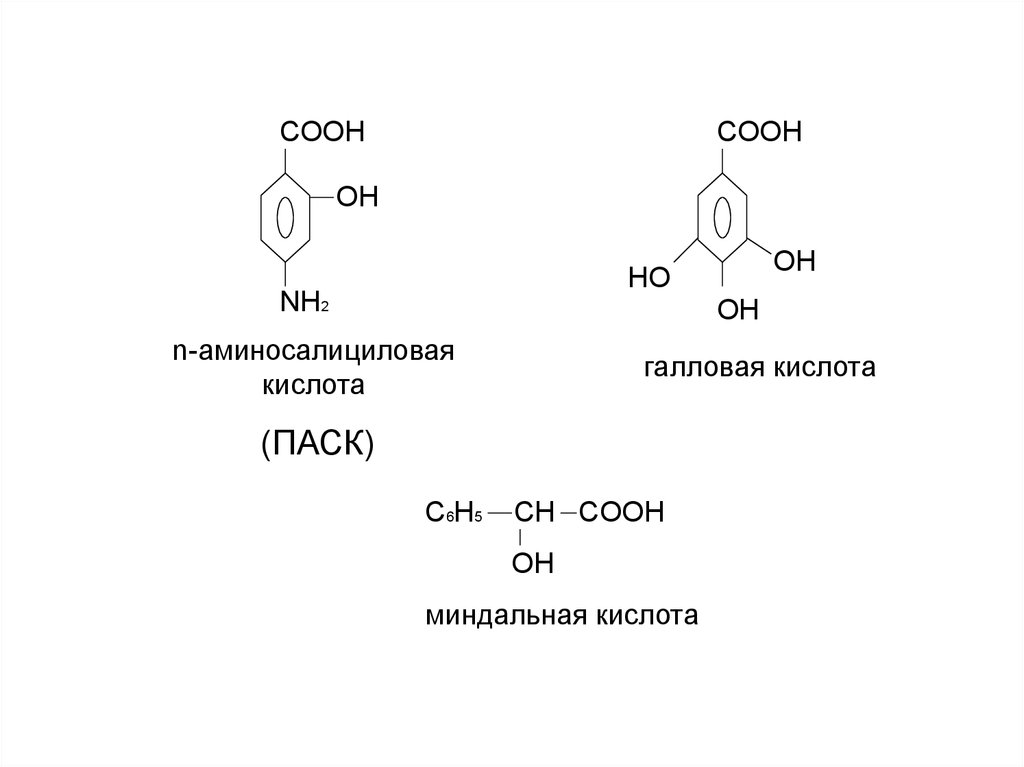
COOHCOOH
OH
OH
HO
NH2
OH
n-аминосалициловая
кислота
галловая кислота
(ПАСК)
С6H5
CH COOH
OH
миндальная кислота
24.
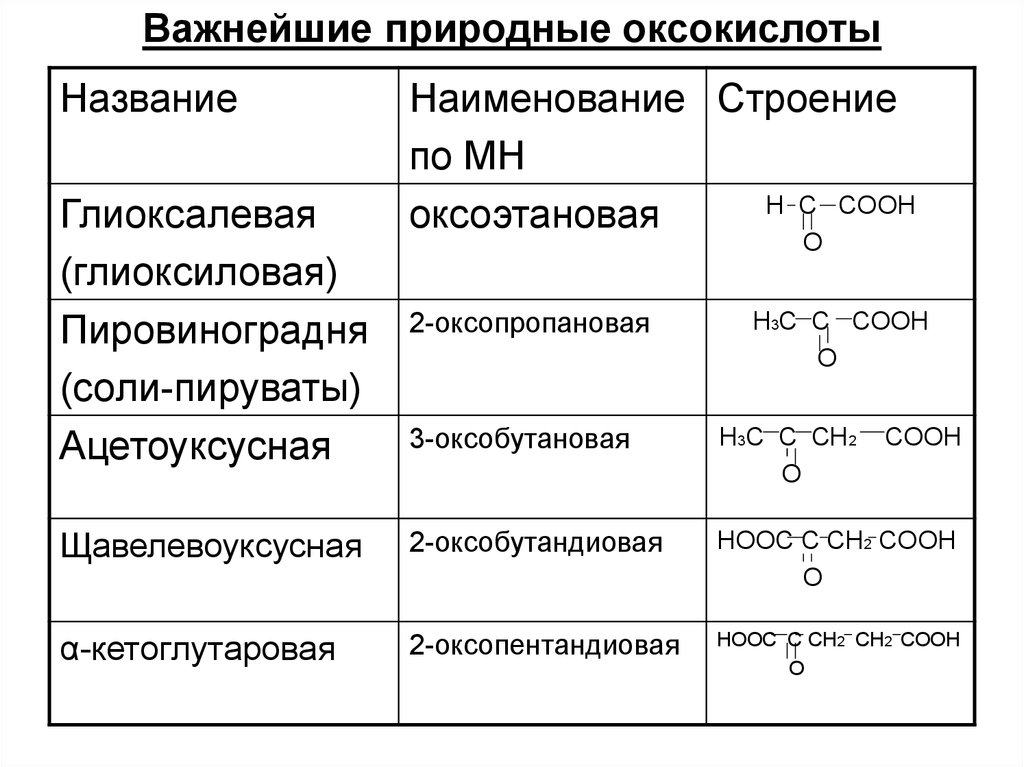
Важнейшие природные оксокислотыНазвание
Глиоксалевая
(глиоксиловая)
Пировиноградня
(соли-пируваты)
Ацетоуксусная
Наименование Строение
по МН
Н С СOOH
оксоэтановая
O
2-оксопропановая
H3C C COOH
O
3-оксобутановая
H3C C CH2
O
COOH
Щавелевоуксусная
2-оксобутандиовая
HOOC C CH2 COOH
O
α-кетоглутаровая
2-оксопентандиовая
HOOC C CH2 CH2 COOH
O
25.
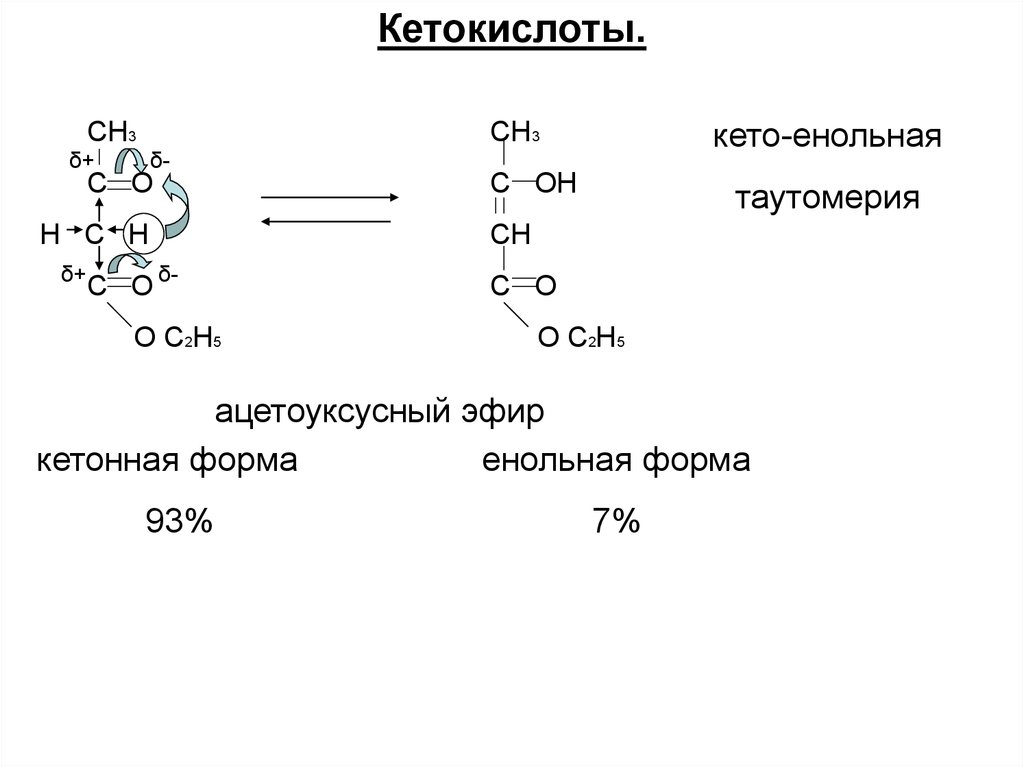
Кетокислоты.СH3
кето-енольная
CH3
δ+
δ-
C O
H C H
δ+
C O δO C2H5
C OH
таутомерия
CH
C O
O C2H5
ацетоуксусный эфир
кетонная форма
енольная форма
93%
7%
26.
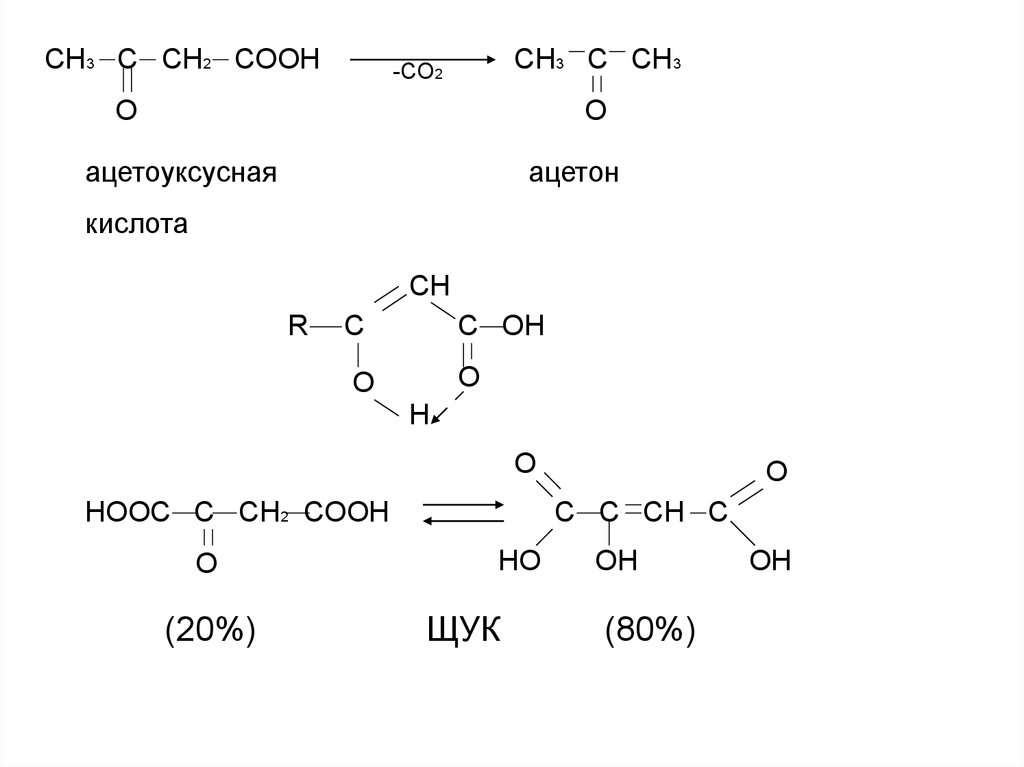
СH3 C CH2 COOHCH3 C CH3
-CO2
O
O
ацетоуксусная
ацетон
кислота
CH
R
C
C OH
O
O
H
O
HOOC C CH2 COOH
O
(20%)
O
C C CH C
HO
ЩУК
OH
(80%)
OH








 chemistry
chemistry








