Similar presentations:
Изомерия. Кислотность органических соединений
1. ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ
БИООРГАНИЧЕСКАЯ ХИМИЯЛекция 2
Изомерия. Кислотность органических
соединений
Лектор: доктор биологических наук, профессор,
зав. кафедрой химии Ирина Петровна Степанова
2.
ЦЕЛИ ЛЕКЦИИОБУЧАЮЩАЯ: сформировать знания о структурной и
пространственной изомерии и о концепции
протолитической теории кислотности и основности
органических соединений.
РАЗВИВАЮЩАЯ: расширить кругозор обучающихся на
основе интеграции знаний, развить логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать формированию у
обучающихся устойчивого интереса к изучению
дисциплины.
3.
ПЛАН ЛЕКЦИИ• Изомерия.
• Кислотность и основность органических
соединений.
4. Медико-биологическое значение темы
Для биоорганической и биологическойхимии изомерия является причиной разной
биологической активности. То есть только
определенные
изомеры
проявляют
биологическую
активность,
которая
может исчезнуть в процессе изомеризации,
что вызывает патологические изменения в
организме человека.
5.
Изомерия (от греч. isos - равный)Изомеры — это вещества, имеющие
одинаковый качественный и количественный
состав, но различное химическое строение или
разное расположение атомов в пространстве.
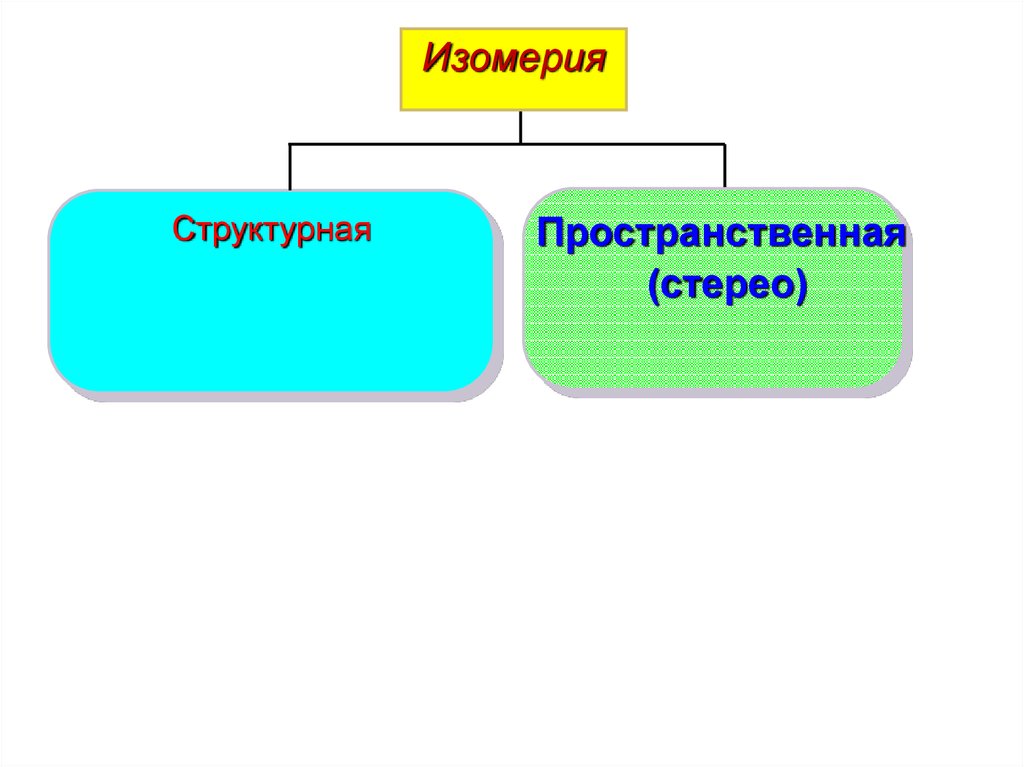
6.
ИзомерияСтруктурная
Пространственная
(стерео)
7. Структурная изомерия
Структурные изомеры отличаются друг от другахимическим строением и, следовательно,
обладают разными химическими свойствами.
8. Структурная изомерия
Различают виды структурной изомерии:• Изомерия углеродного скелета
• Изомерия положения кратной связи
• Изомерия положения функциональных групп
• Изомерия функциональной принадлежности
(межклассовая изомерия)
• Валентная изомерия
9.
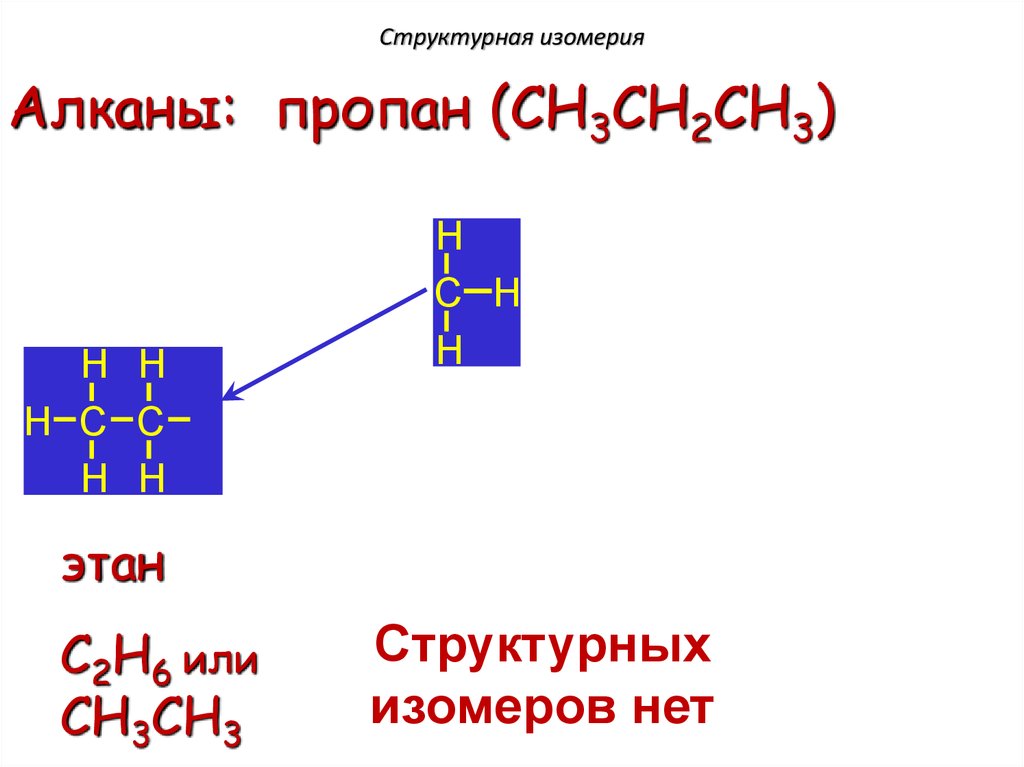
Структурная изомерияАлканы: пропан (CH3CH2CH3)
H H
H C C H
H H
H
C H
H
этан
C2H6 или
CH3CH3
Структурных
изомеров нет
10.
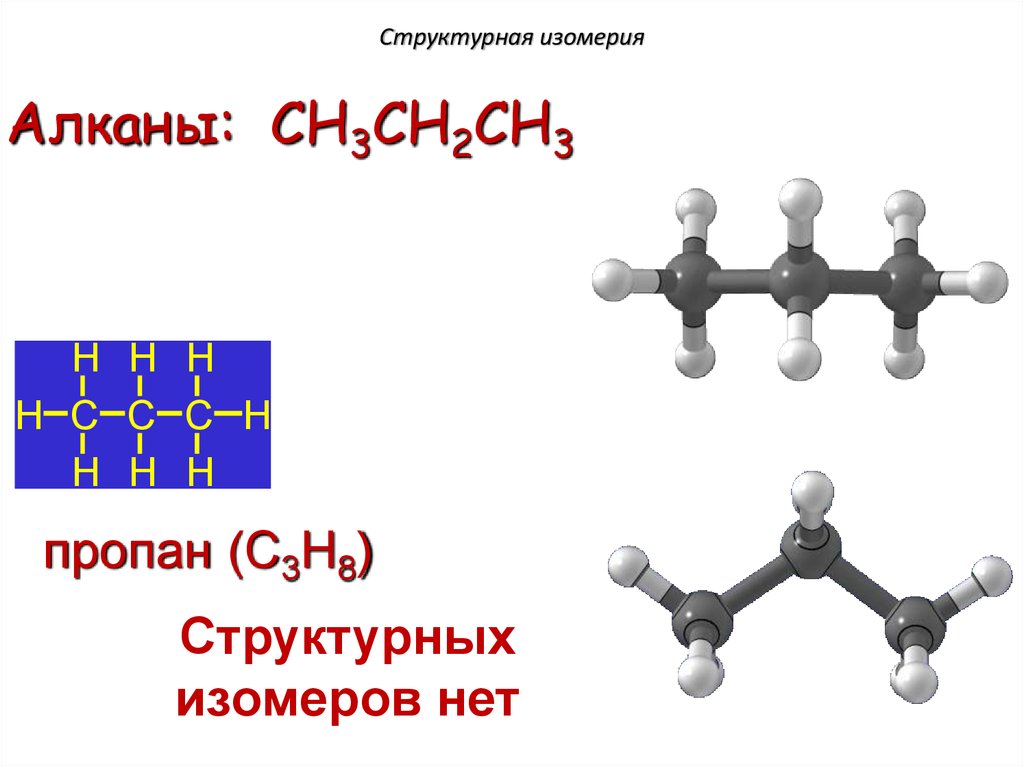
Структурная изомерияАлканы: пропан CH3CH2CH3
H H H
H C C C H
H H H
пропан (C3H8)
Структурных
изомеров нет
11.
Структурная изомерияАлканы: CH3CH2CH3
H H H
H C C C H
H H H
пропан (C3H8)
Структурных
изомеров нет
12.
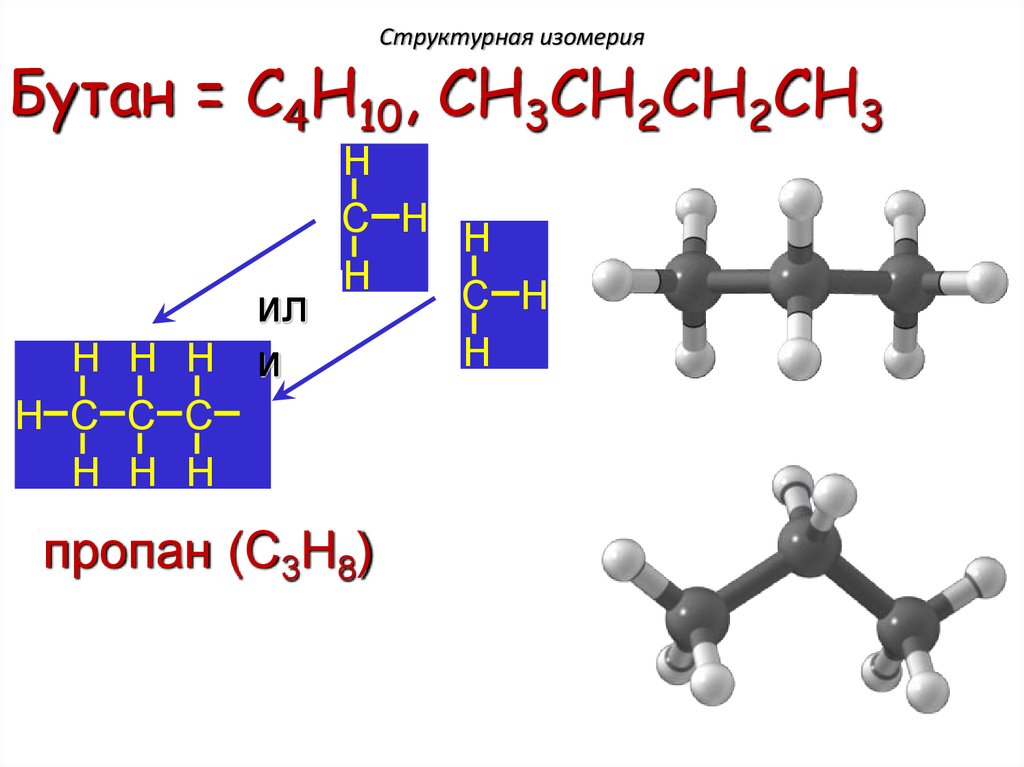
Структурная изомерияБутан = C4H10, CH3CH2CH2CH3
H
C H H
H
C H
ил
H
и
H H H
H C C C H
H H H
пропан (C3H8)
13.
Структурная изомерияБутан = C4H10, CH3CH2CH2CH3
H H H H
H C C C C H
H H H H
H H H
H C C C H
H H H
пропан
(C3H8)
бутан (C4H10)
H
H C H
H
H
H C C C H
H H H
изобутан (C4H10)
14.
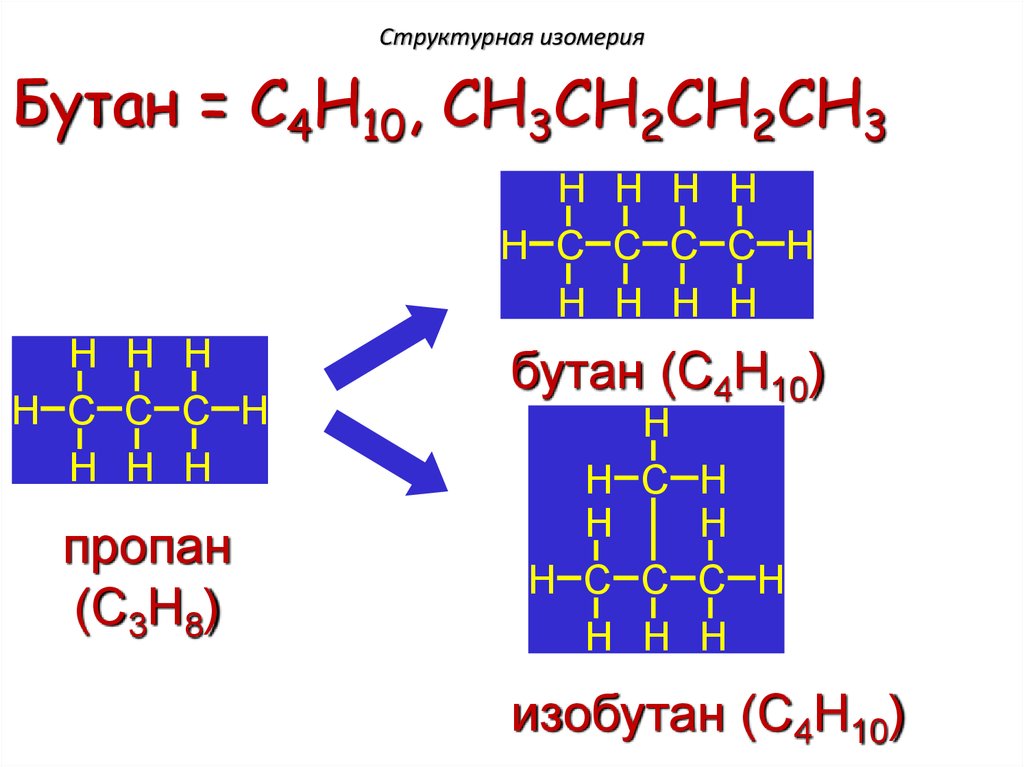
Структурная изомерияБутан = C4H10, CH3CH2CH2CH3
H H H H
H C C C C H
H H H H
H HH H
H
H
HH H H
15.
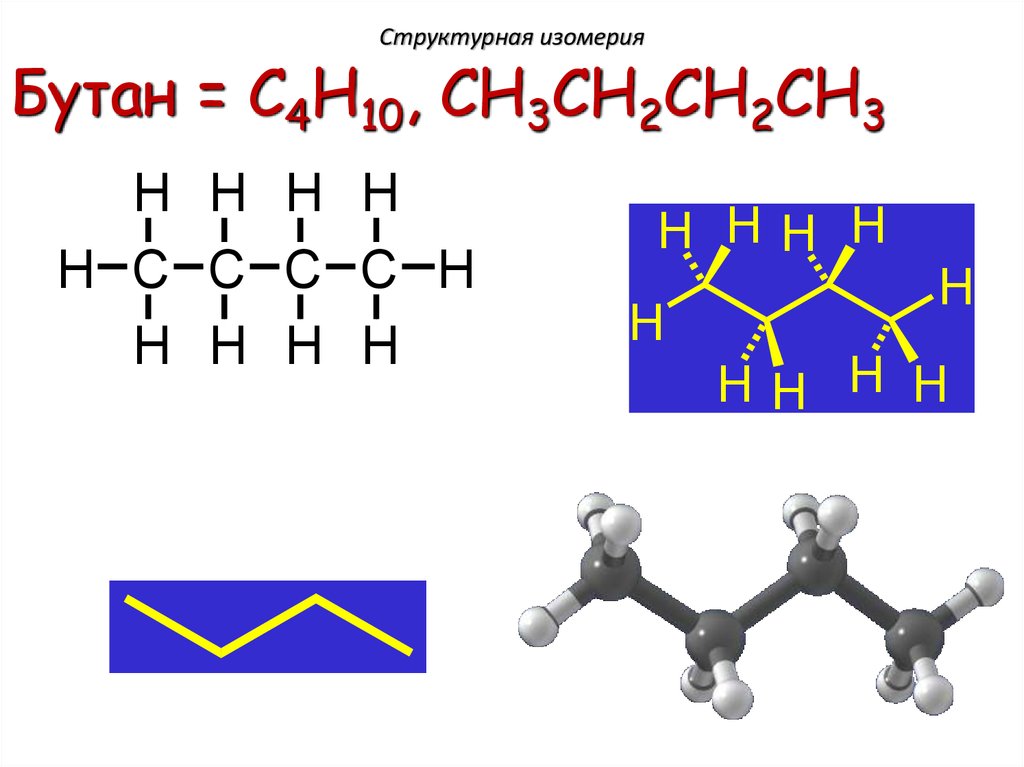
Структурная изомерияБутан = C4H10, CH3CH2CH2CH3
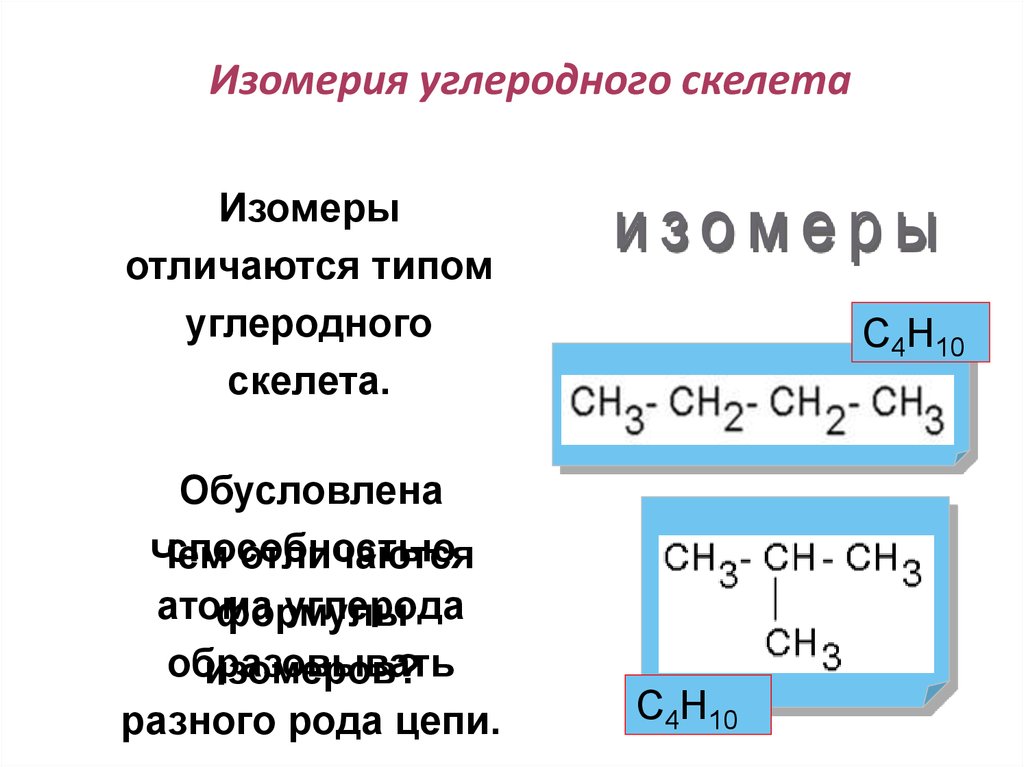
16. Изомерия углеродного скелета
Изомерыотличаются типом
углеродного
скелета.
Обусловлена
способностью
Чем
отличаются
атома
углерода
формулы
образовывать
изомеров?
разного рода цепи.
С4Н10
С4Н10
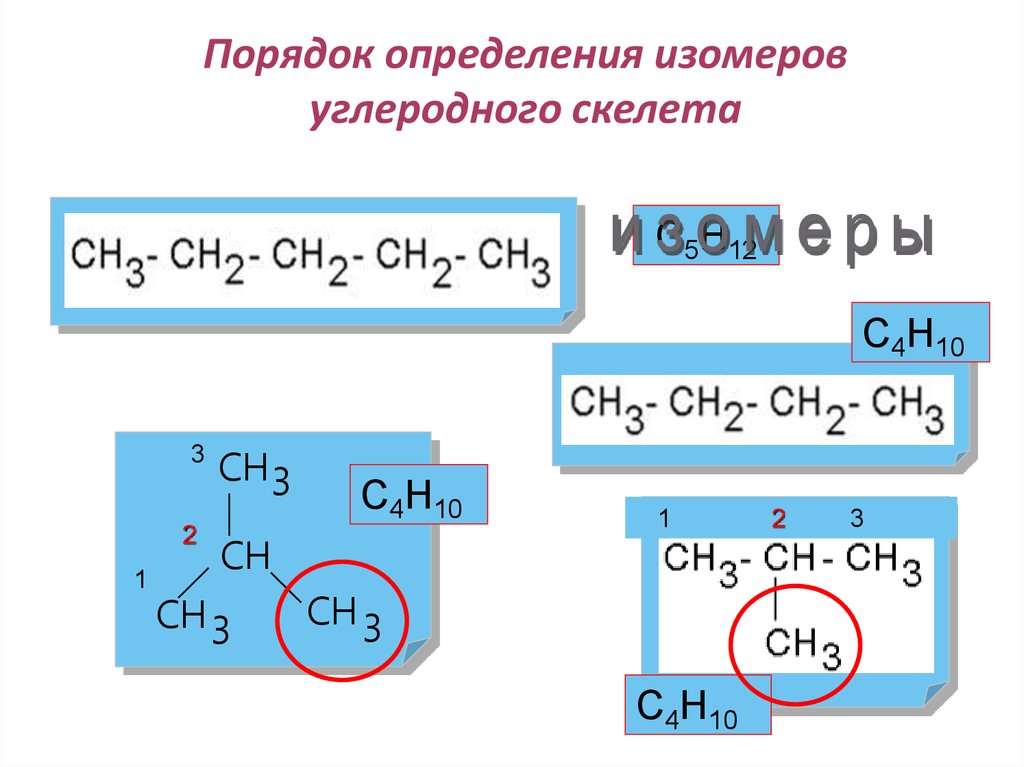
17. Порядок определения изомеров углеродного скелета
С5Н12С4Н10
3
2
1
СН3
С4Н10
СН
СН 3
1
СН 3
С4Н10
2
3
18.
Построение формул изомеров углеродногоскелета
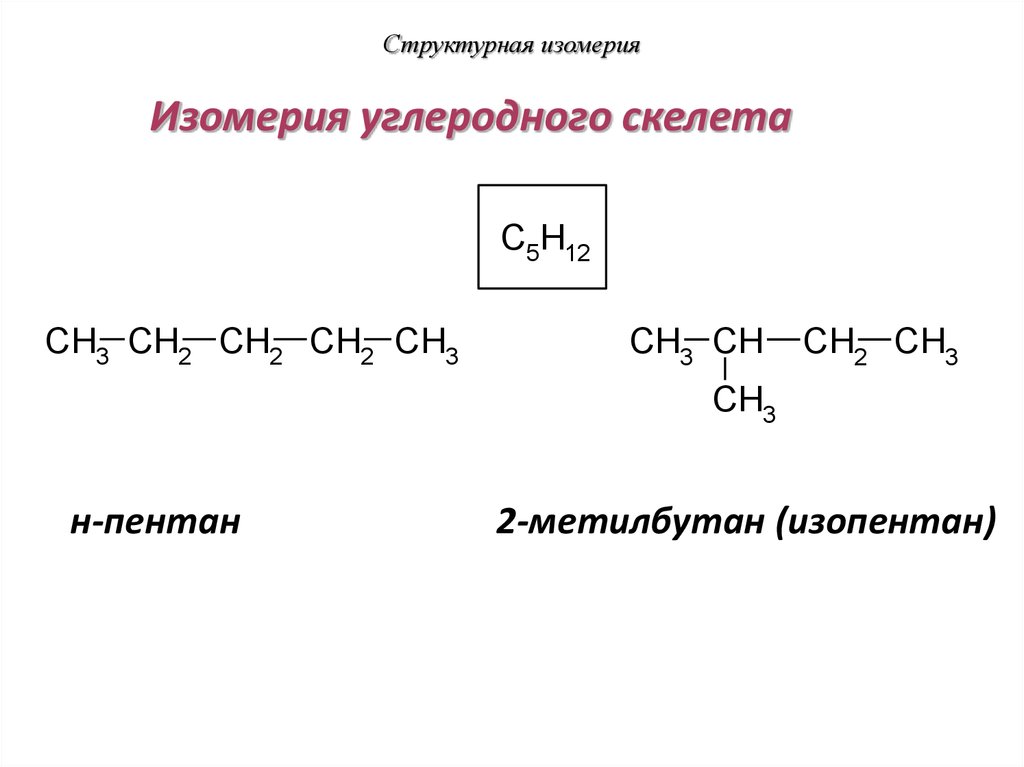
19. Структурная изомерия
Изомерия углеродного скелетаC5H12
CH3 CH2 CH2 CH2 CH3
CH3 CH
CH2 CH3
CH3
н-пентан
2-метилбутан (изопентан)
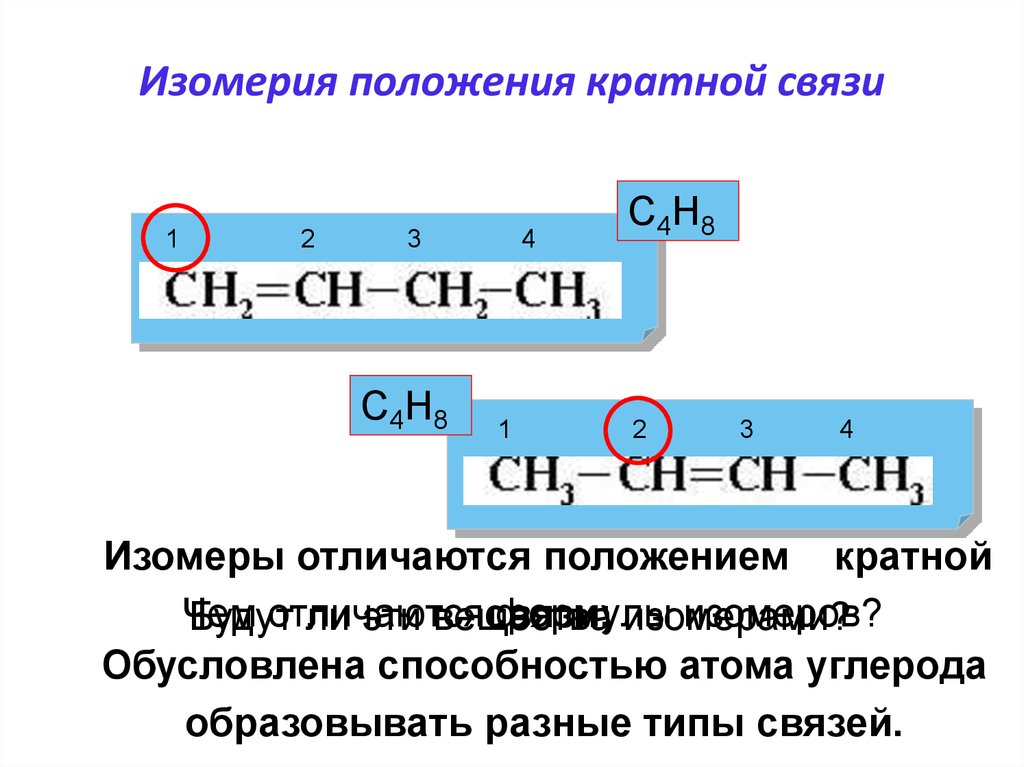
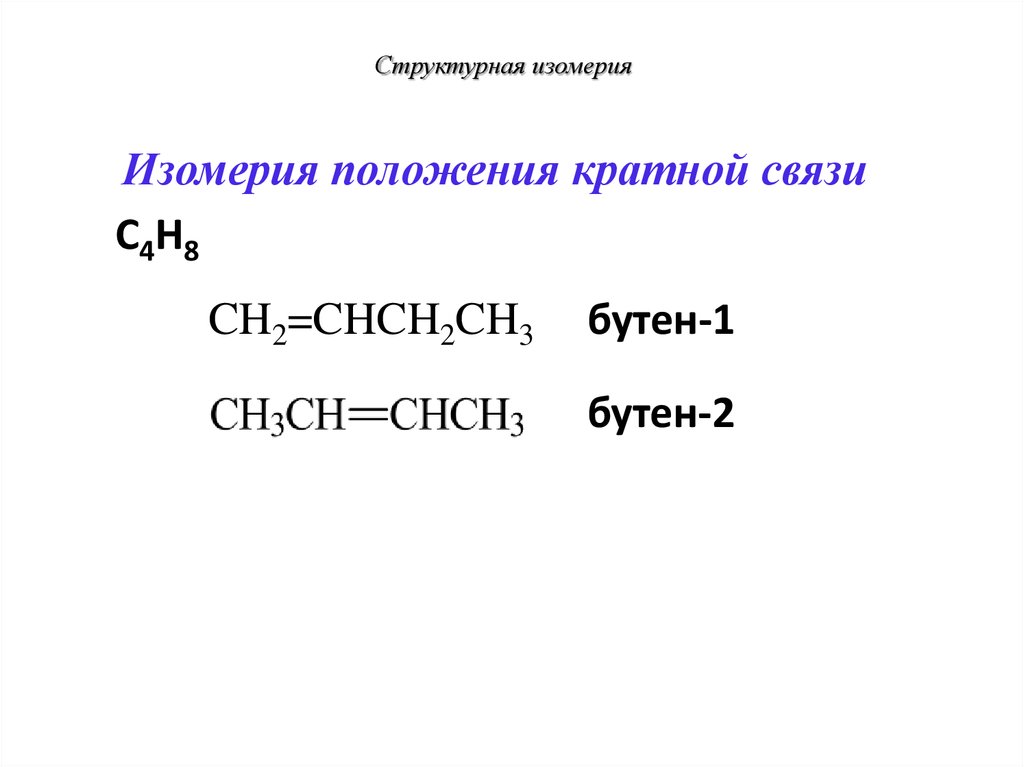
20. Изомерия положения кратной связи
12
3
С4Н8
4
1
С4Н8
2
3
4
Изомеры отличаются положением кратной
Чем
отличаются
формулы
изомеров?
связи;
Будут
ли эти вещества
изомерами?
Обусловлена способностью атома углерода
образовывать разные типы связей.
21. Структурная изомерия
Изомерия положения кратной связиС4Н8
CH2=CHCH2CH3
бутен-1
бутен-2
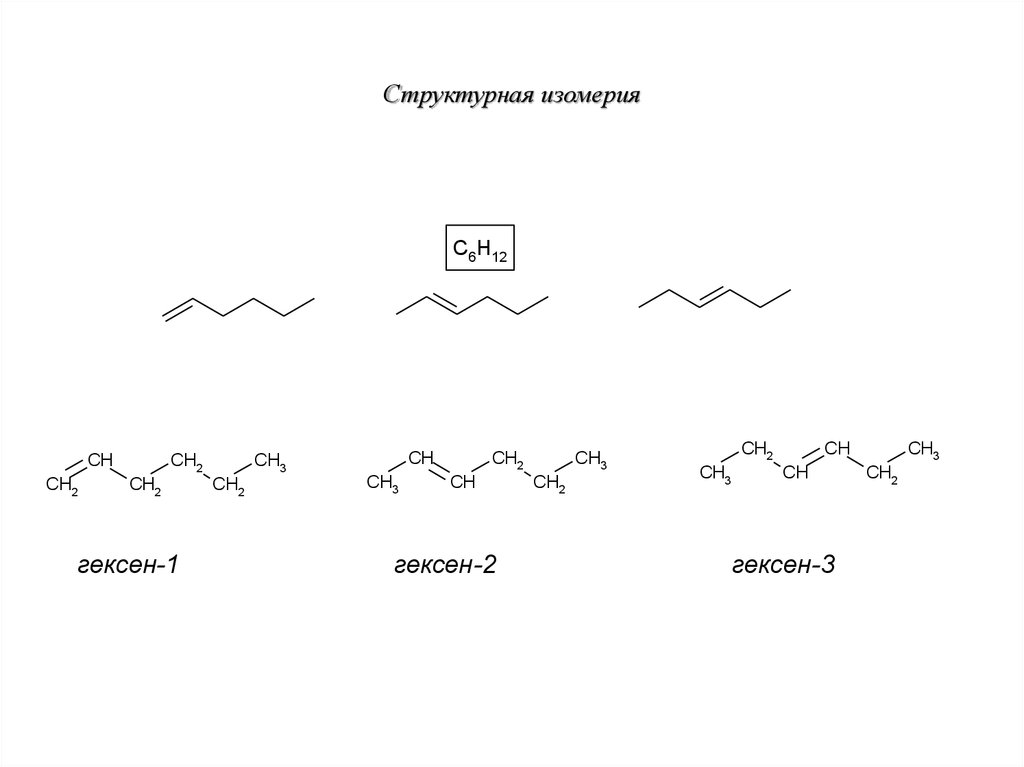
22. Структурная изомерия
C6H12CH
CH2
CH2
CH2
гексен-1
CH
CH3
CH2
CH3
CH2
CH
гексен-2
CH3
CH2
CH2
CH3
CH
CH
гексен-3
CH3
CH2
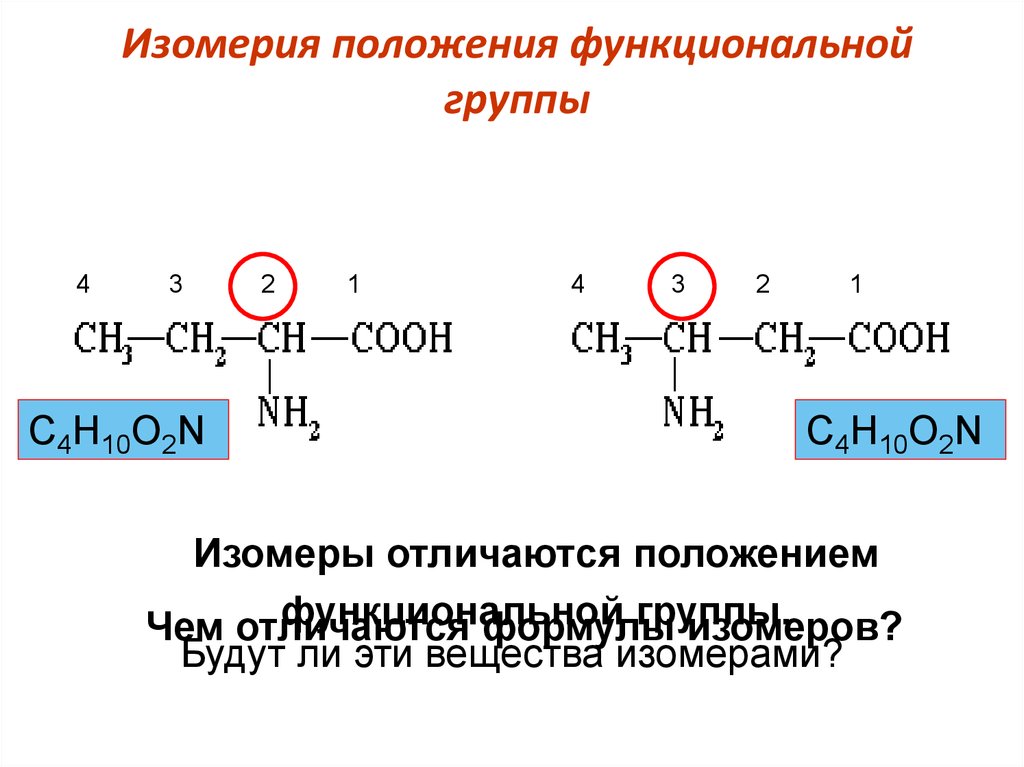
23. Изомерия положения функциональной группы
43
С4Н10О2N
2
1
4
3
2
1
С4Н10О2N
Изомеры отличаются положением
функциональной
группы.
Чем отличаются
формулы
изомеров?
Будут ли эти вещества изомерами?
24. Структурная изомерия
Изомерия положения функциональныхгрупп:
бутанол-1
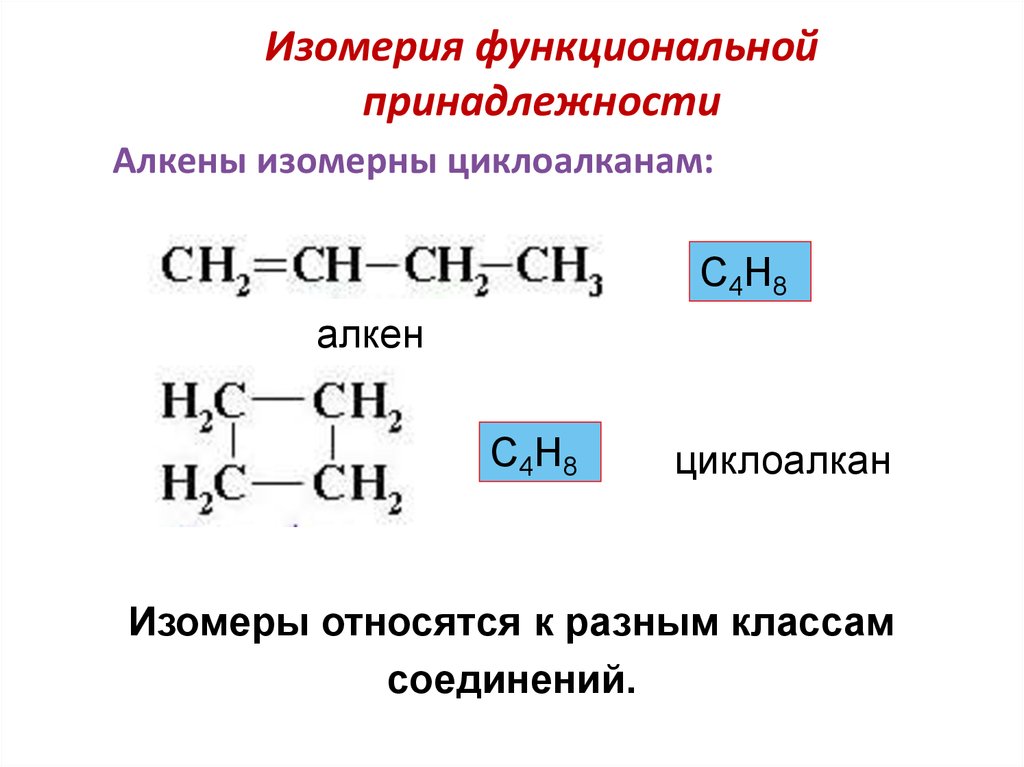
25. Изомерия функциональной принадлежности
Алкены изомерны циклоалканам:С4Н8
алкен
С4Н8
циклоалкан
Изомеры относятся к разным классам
соединений.
26. Структурная изомерия
Алкадиены изомерны алкинам:С5Н8
H2C CH CH CH CH3
пентадиен-1,3
алкадиен
С5Н8
HC C CH2 CH2 CH3
пентин-1
алкин
27.
Структурная изомерияСпирты изомерны простым эфирам.
Этиловый спирт
С 2Н 6О
Н Н
l l
Н – С – С – О –Н
l l
Н Н
С2Н6О
Диметиловый
эфир
Н
Н
l
l
Н–С–О–С–Н
l
l
Н
Н
жидкость, tкип = 780
газ, tкип = -240
растворим в воде
не растворим в воде
реагирует с Na
не реагирует с Na
28.
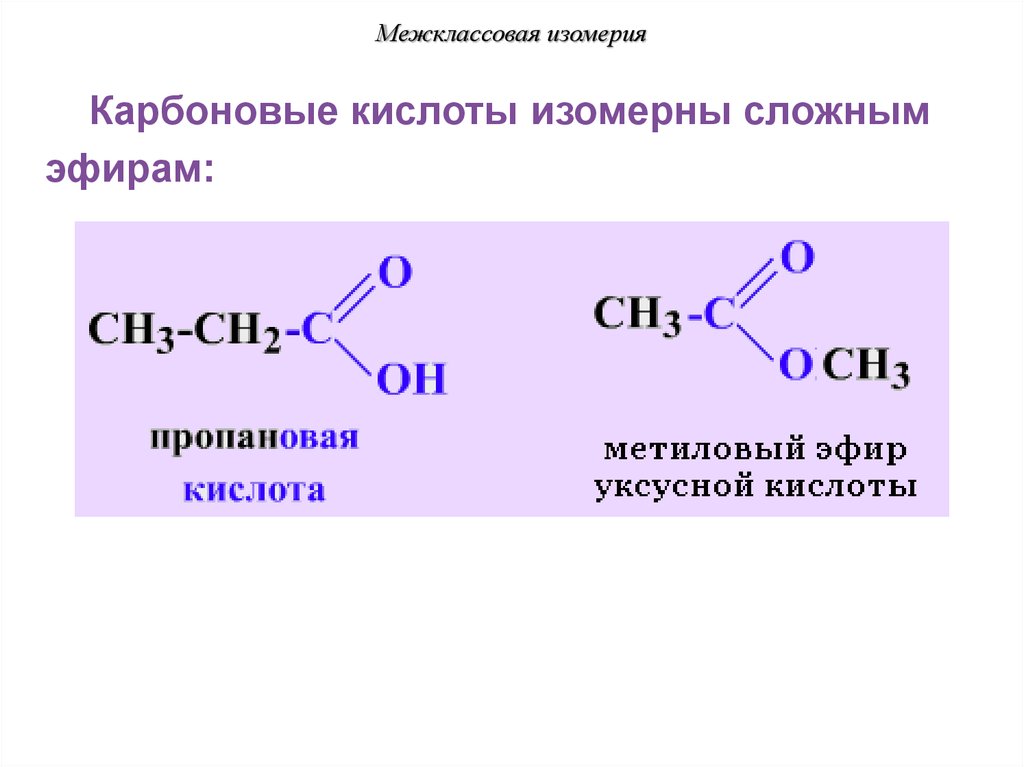
Межклассовая изомерияКарбоновые кислоты изомерны сложным
эфирам:
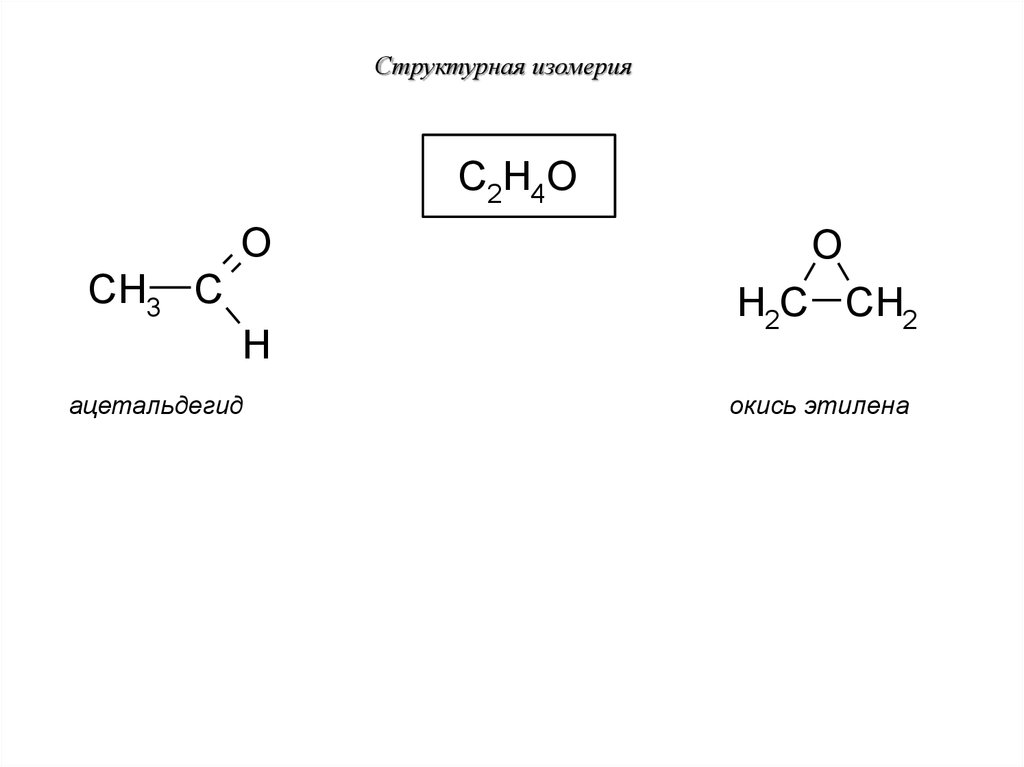
29. Структурная изомерия
C2H4OO
CH3 C
H
ацетальдегид
O
H2C CH2
окись этилена
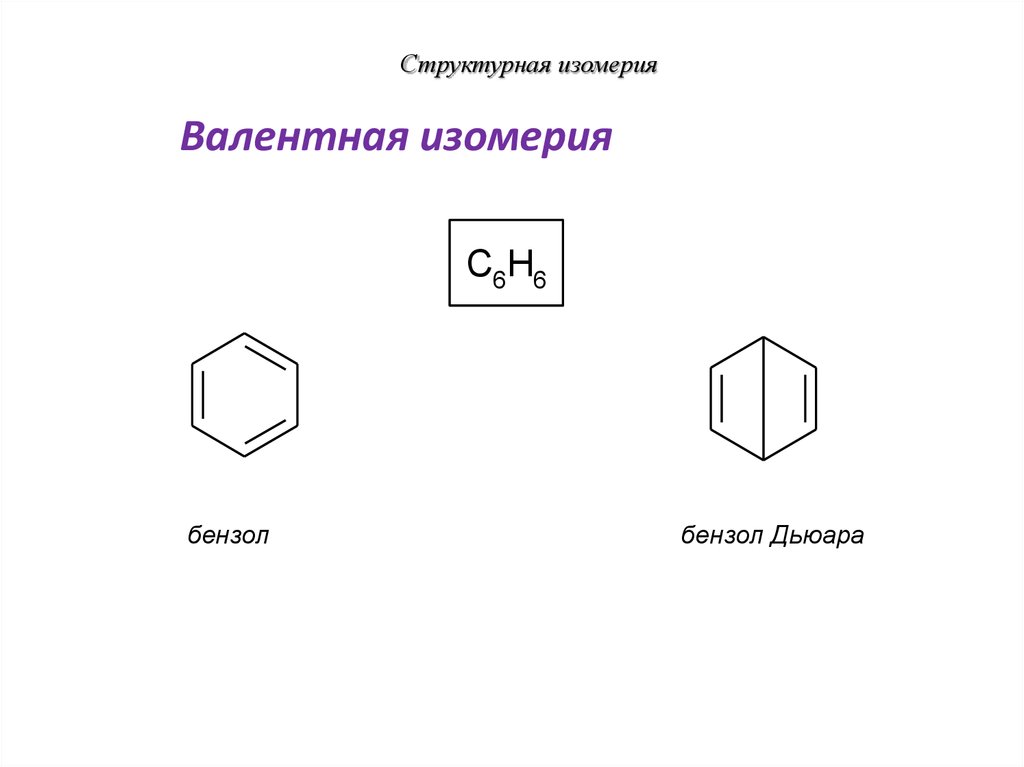
30. Структурная изомерия
Валентная изомерияC6H6
бензол
бензол Дьюара
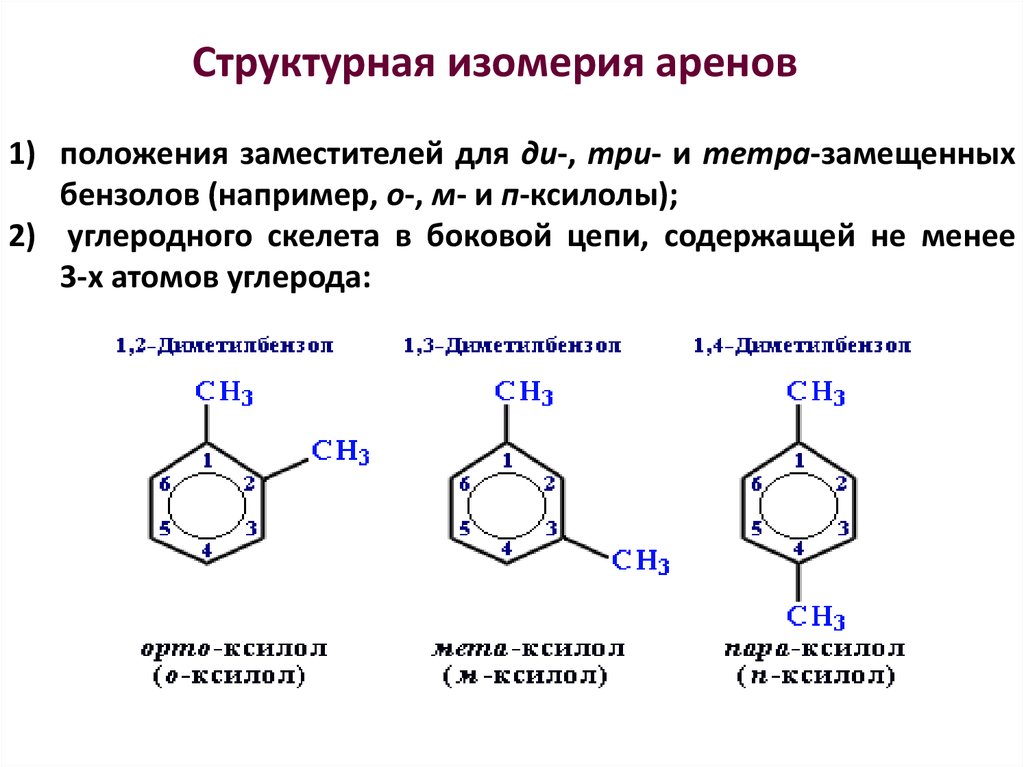
31. Структурная изомерия аренов
1) положения заместителей для ди-, три- и тетра-замещенныхбензолов (например, о-, м- и п-ксилолы);
2) углеродного скелета в боковой цепи, содержащей не менее
3-х атомов углерода:
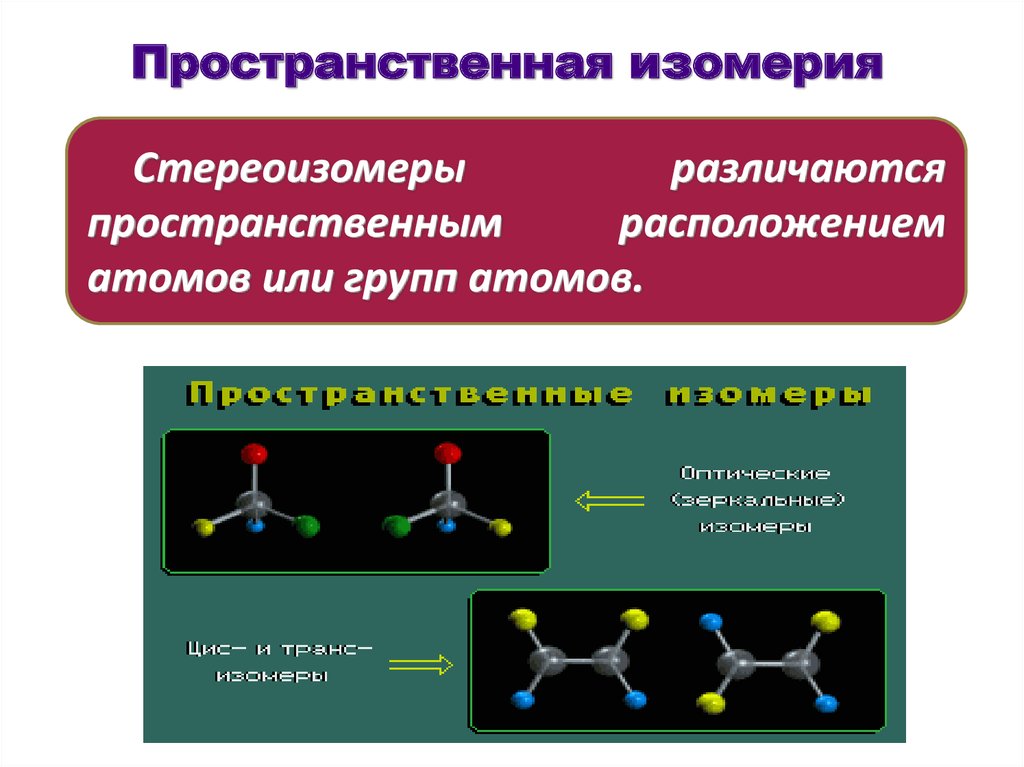
32. Пространственная изомерия
Стереоизомерыразличаются
пространственным
расположением
атомов или групп атомов.
33.
Пространственная изомерияРазличают виды стереоизомерии:
энантиомерия
σ–диастереомерия
π-диастереомерия (геометрическая)
конформационная изомерия
34.
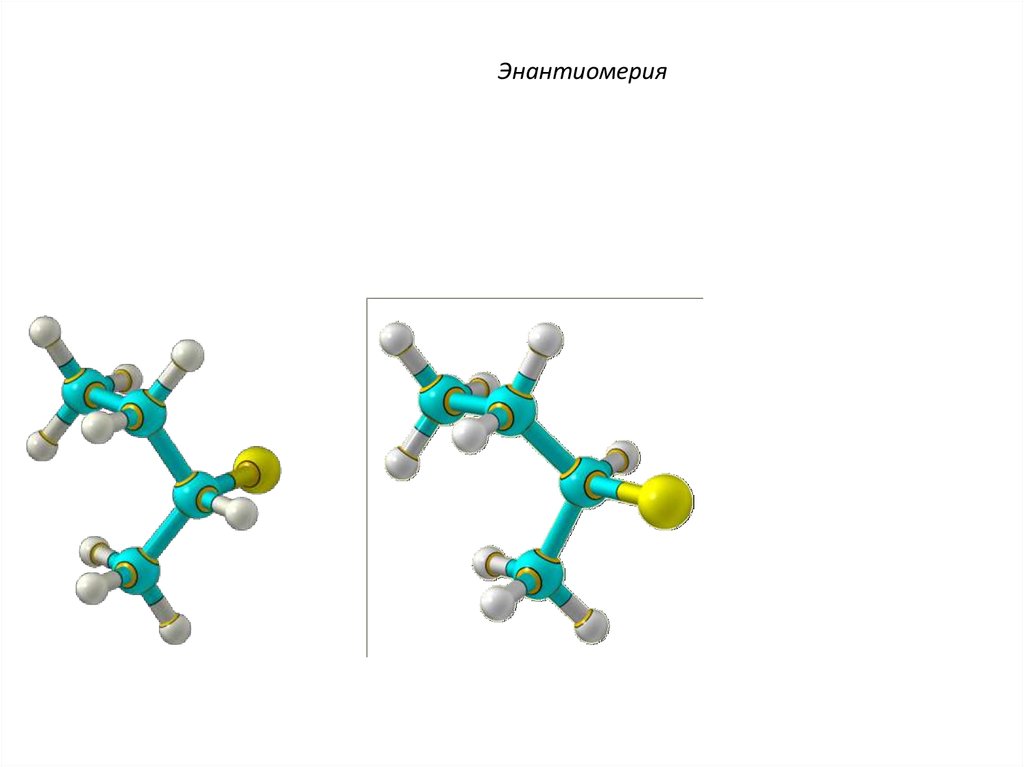
ЭнантиомерияЭнантиомеры – это
изомеры, которые
относятся друг к другу как
предмет и несовместимое
с ним в пространстве
зеркальное отражение.
Энантиомеры - близнецы
органического мира.
35.
a4
2
1
1
3
4
3
b
3
2
1
4
2
36.
ЭнантиомерияЭнантиомерия возможна у
любых органических
соединений, имеющих
центр хиральности (от
греч. сhiro – рука).
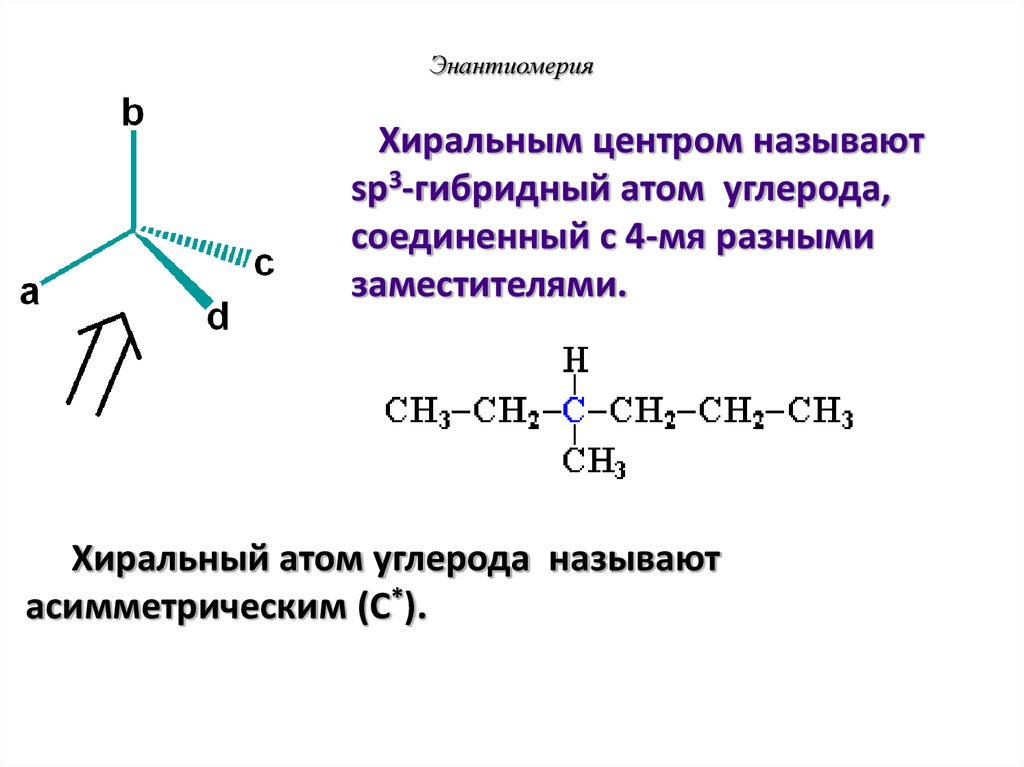
37. Энантиомерия
Хиральным центром называютsp3-гибридный атом углерода,
соединенный с 4-мя разными
заместителями.
Хиральный атом углерода называют
асимметрическим (C*).
38.
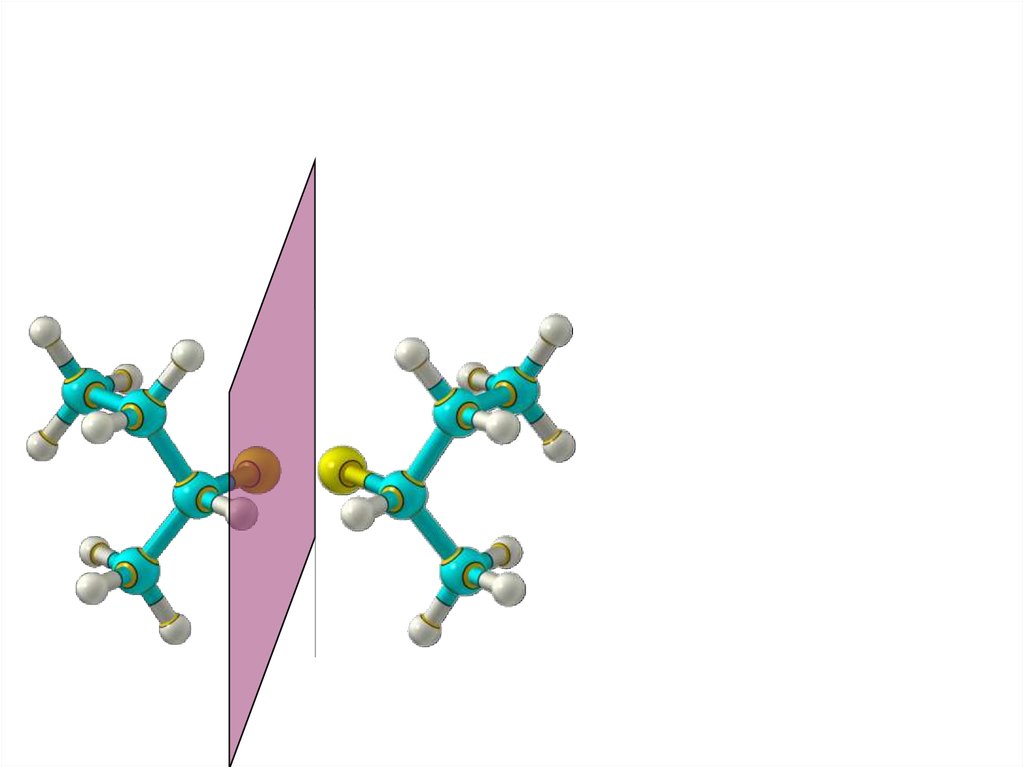
ЭнантиомерияХиральные молекулы не могут быть совмещены
в пространстве.
39.
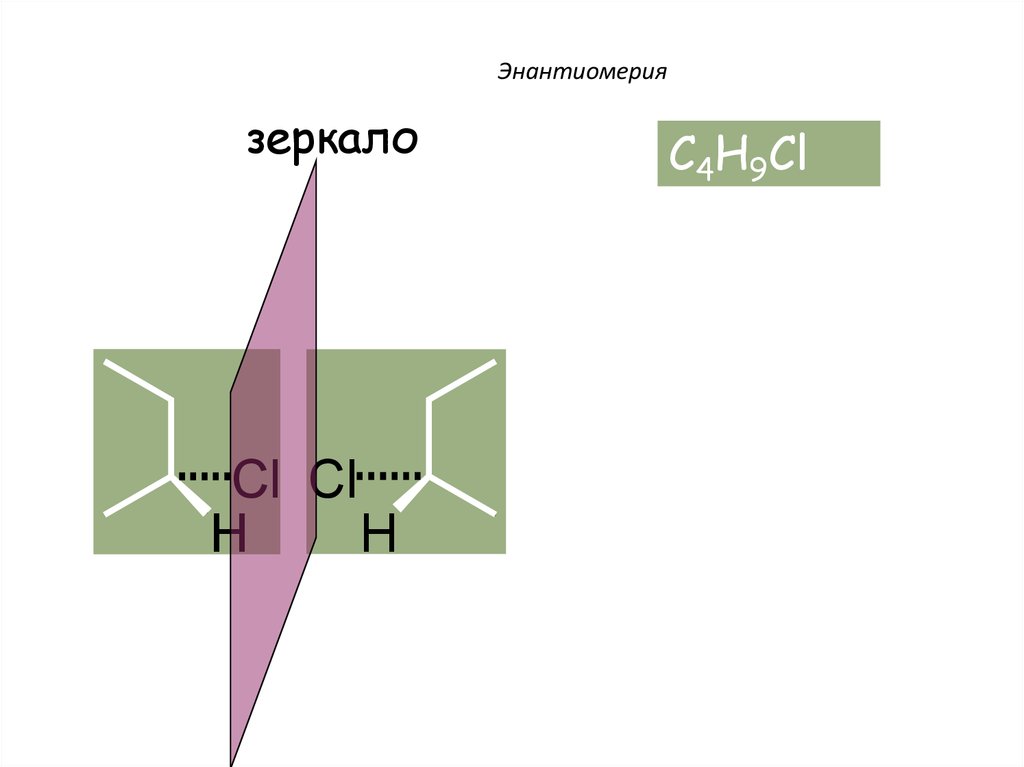
Энантиомериязеркало
Cl Cl
H
H
C4H9Cl
40.
41.
Энантиомерия42.
Энантиомерия43.
Энантиомерия44.
Энантиомерия45.
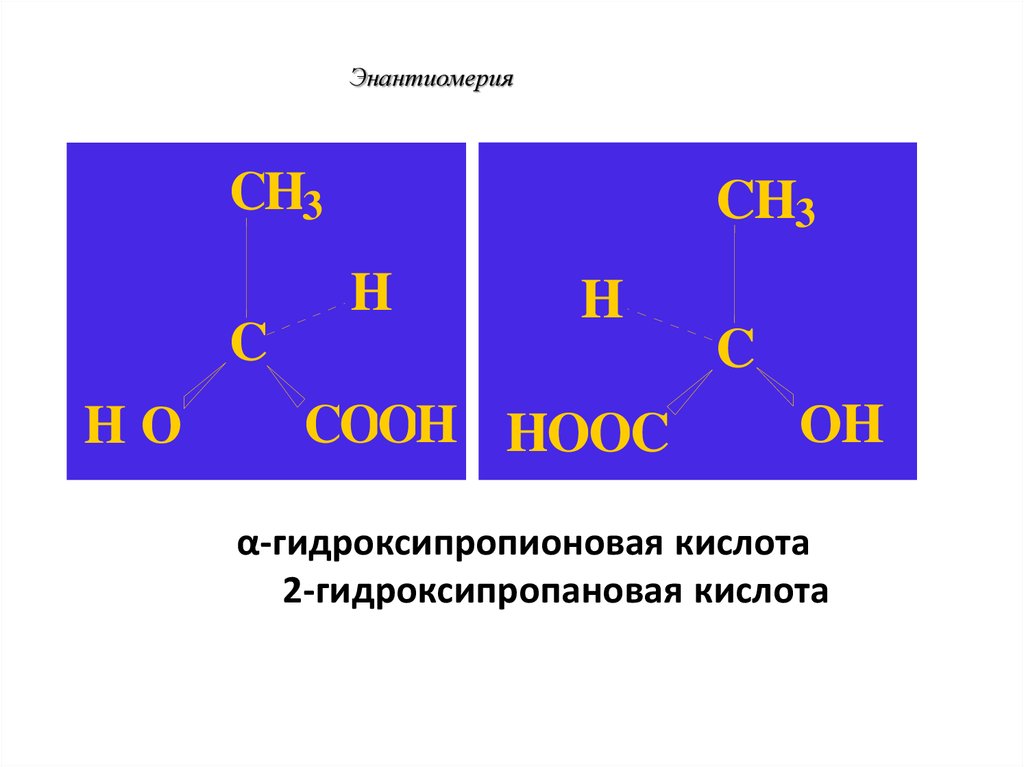
ЭнантиомерияПример: хиральная молекула
2-гидроксипропановая кислота
СН3-СН(ОН)-СООН
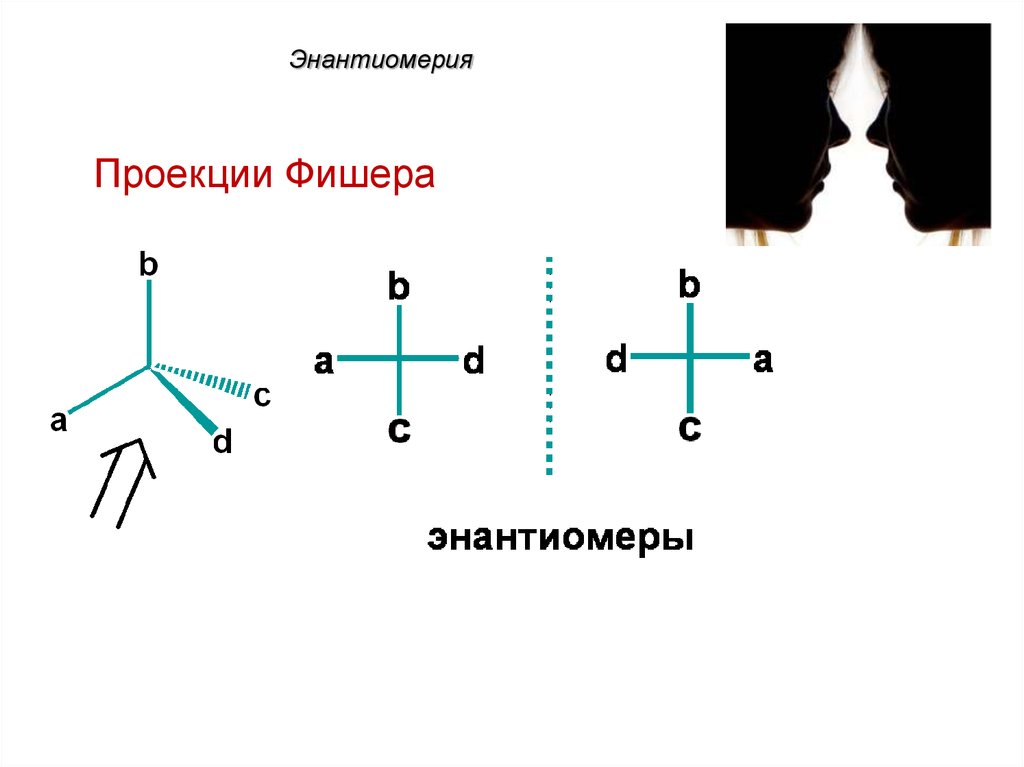
Для изображения энантиомеров на
плоскости используют проекционные
формулы Фишера.
46. Энантиомерия
Проекции Фишера47. Энантиомерия
CH3CH3
H
C
HО
H
COOH HOOC
C
ОH
α-гидроксипропионовая кислота
2-гидроксипропановая кислота
48. Энантиомерия
α-гидроксипропионовая кислота49. Энантиомерия
В зависимости от конфигурации хиральногоцентра различают D- и L- конфигурации
(формы).
В D-форме функциональная группа (-ОН)
хирального центра располагается справа от
углеродной цепи;
В L-форме –функциональная группа
хирального центра (-ОН) располагается слева
от углеродной цепи.
D- и L – это относительная конфигурация.
50. Конфигурационный стандарт - глицеральдегид
CHOH C OH
CH2OH
CHO
HO C H
CH2OH
L-глицеральдегид
D-Gliceraldehido
D-глицеральдегид
L-Gliceraldehido
51.
ЭнантиомерияСравнение конфигурации исследуемого
соединения с глицериновым альдегидом
производят путем серии химических
превращений, не затрагивающих центр
хиральности.
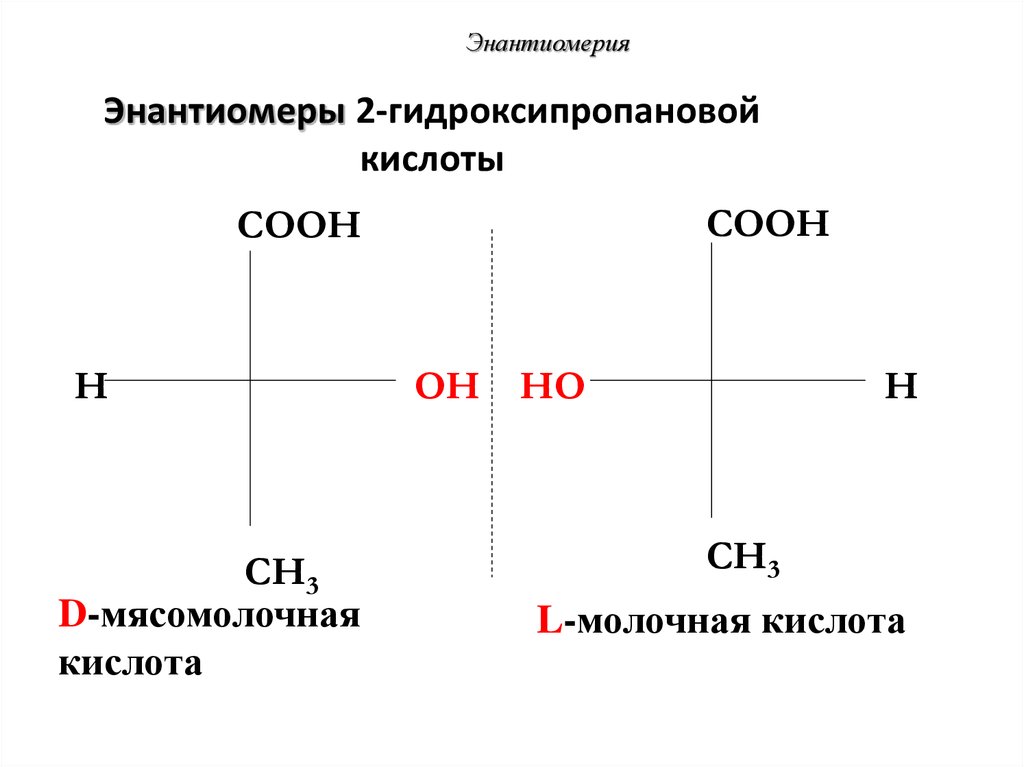
52. Энантиомеры 2-гидроксипропановой кислоты
ЭнантиомерияЭнантиомеры 2-гидроксипропановой
кислоты
COOH
COOH
H
CH3
D-мясомолочная
кислота
OH HO
H
CH3
L-молочная кислота
53. Энантиомерия
Энантиомеры обладают оптическойактивностью. Они способны вращать
плоскость поляризации света.
Оптическая активность энантиомеров
исследуется с помощью прибора –
поляриметра, в котором луч света, пройдя
через специальную призму Николя
колеблется только в одной плоскости, т,е.
становится плоскополяризованным.
54.
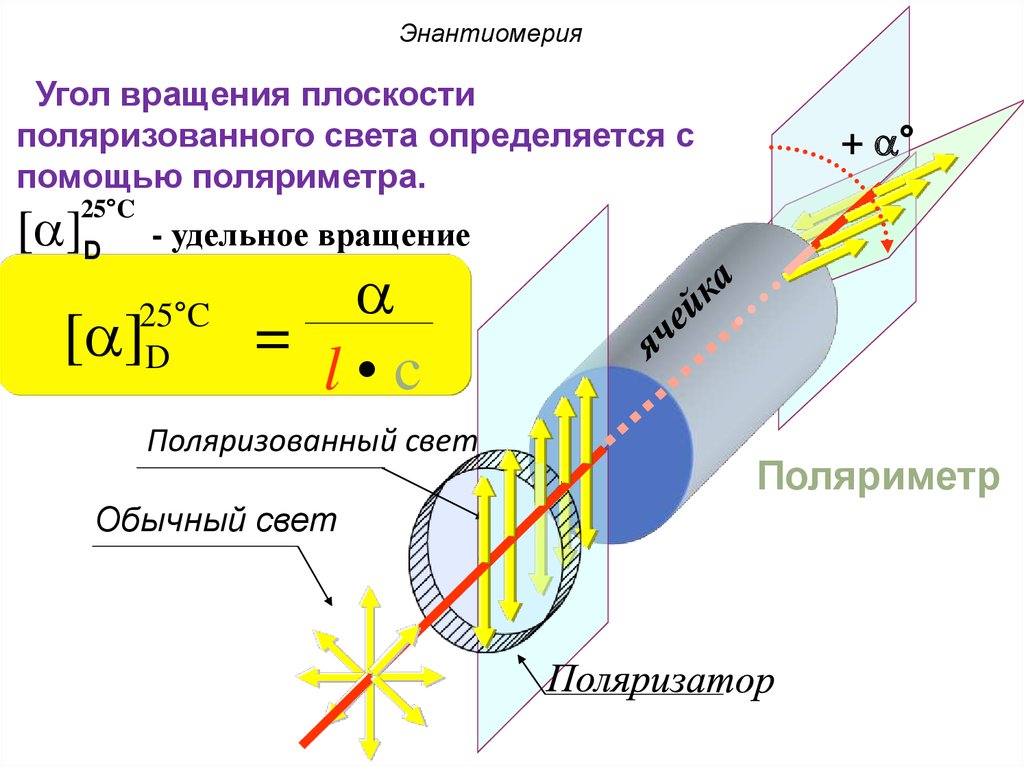
ЭнантиомерияУгол вращения плоскости
поляризованного света определяется с
помощью поляриметра.
25°C
[a]D
+ a°
- удельное вращение
25°C
D
[a]
a
=
l•c
Поляризованный свет
Обычный свет
Поляриметр
55. Энантиомерия
Энантиомеры способны отклонятьполяризованный луч либо влево, либо вправо,
т.е. они являются оптическими антиподами.
У энантиомеров угол вращения плоскости
поляризации света одинаковый, но направление
вращения противоположное.
Один энантиомер – левовращающий,знак (-),
а другой правовращающий, знак (+).
Знак вращения плоскости поляризации света
не связан с принадлежностью к D- или L-ряду. Он
определяется экспериментально.
56. Энантиомерия
У 2-гидроксипропановой кислотыD-изомер является левовращающим (-):
D (-); a= -2,6
L-изомер является правовращающим(+):
L (+); a= +2,6
Смесь энантиомеров называется
рацематом. Рацемат не обладает
оптической активностью.
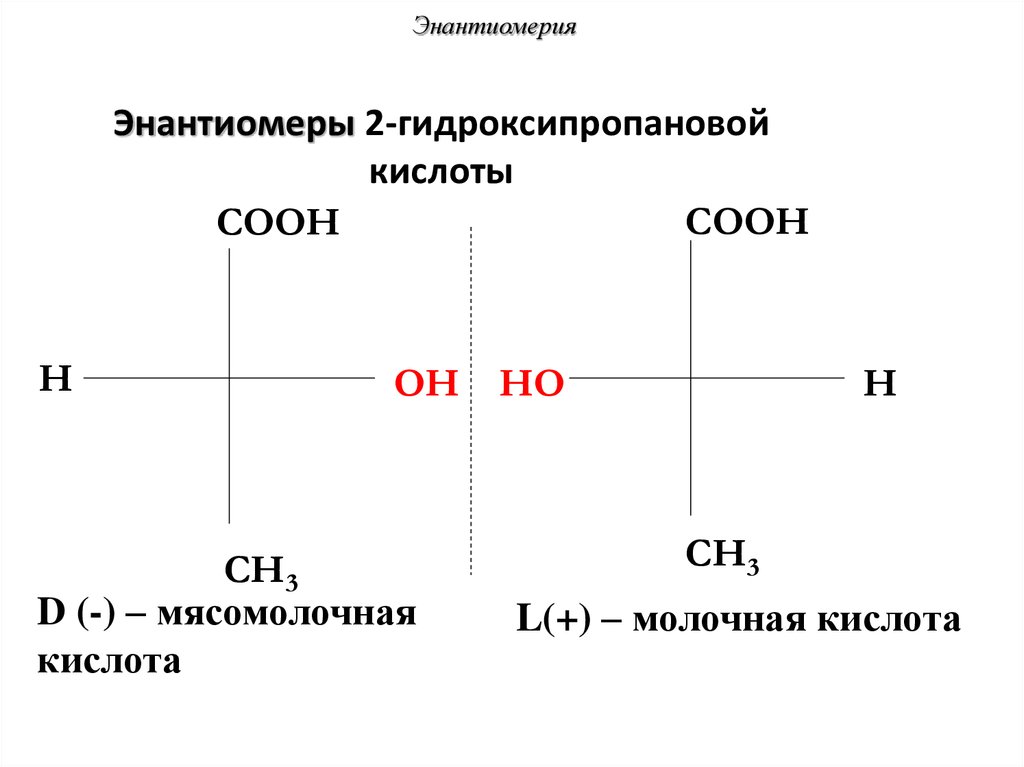
57. Энантиомеры 2-гидроксипропановой кислоты
ЭнантиомерияЭнантиомеры 2-гидроксипропановой
кислоты
COOH
COOH
H
OH HO
CH3
D (-) – мясомолочная
кислота
H
CH3
L(+) – молочная кислота
58. Энантиомерия
Энантиомеры обладают одинаковымифизическими и химическими свойствами,
но являются оптическими антиподами, т.е.
имеют противоположную оптическую
активность и имеют различную
физиологическую активность.
Биологически активными являются
D-энантимеры моносахаридов,
L-энантиомеры аминокислот.
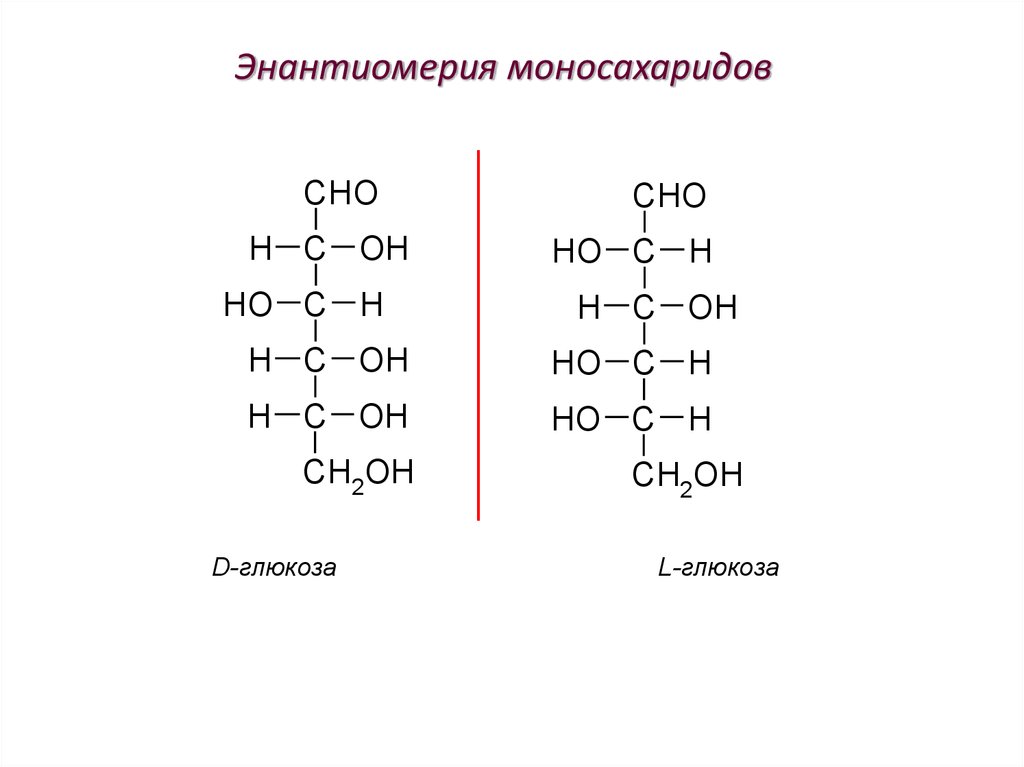
59. Энантиомерия моносахаридов
CHOH C OH
HO C H
CHO
HO C H
H C OH
H C OH
HO C H
H C OH
HO C H
CH2OH
D-глюкоза
CH2OH
L-глюкоза
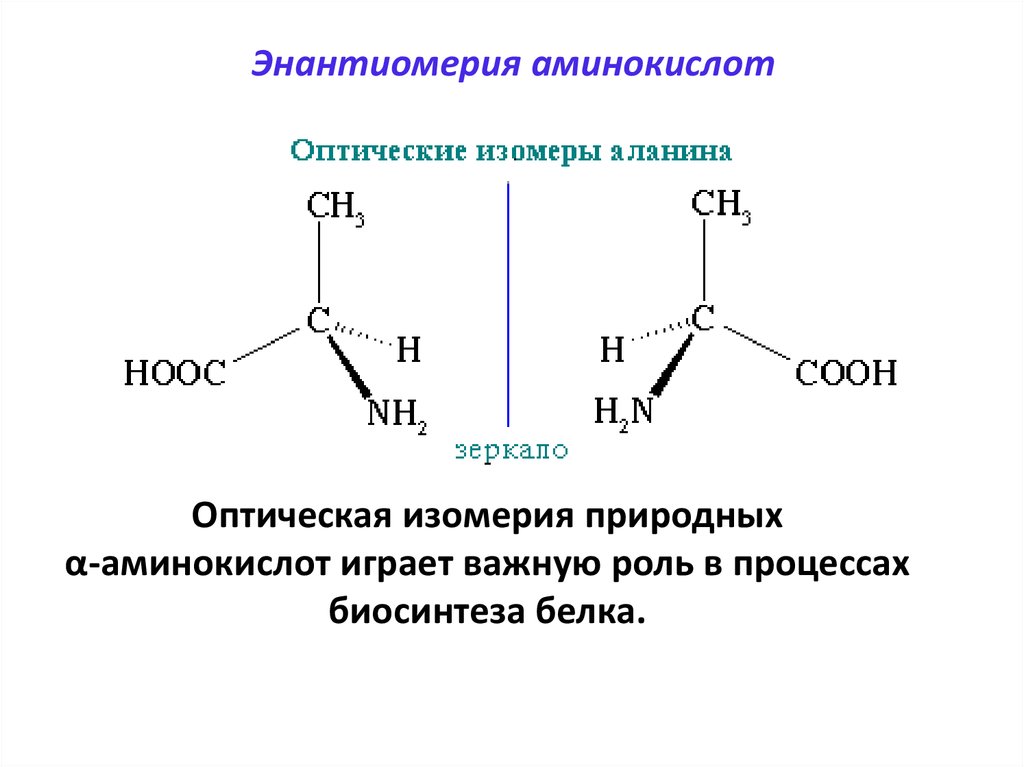
60. Энантиомерия аминокислот
Оптическая изомерия природныхα-аминокислот играет важную роль в процессах
биосинтеза белка.
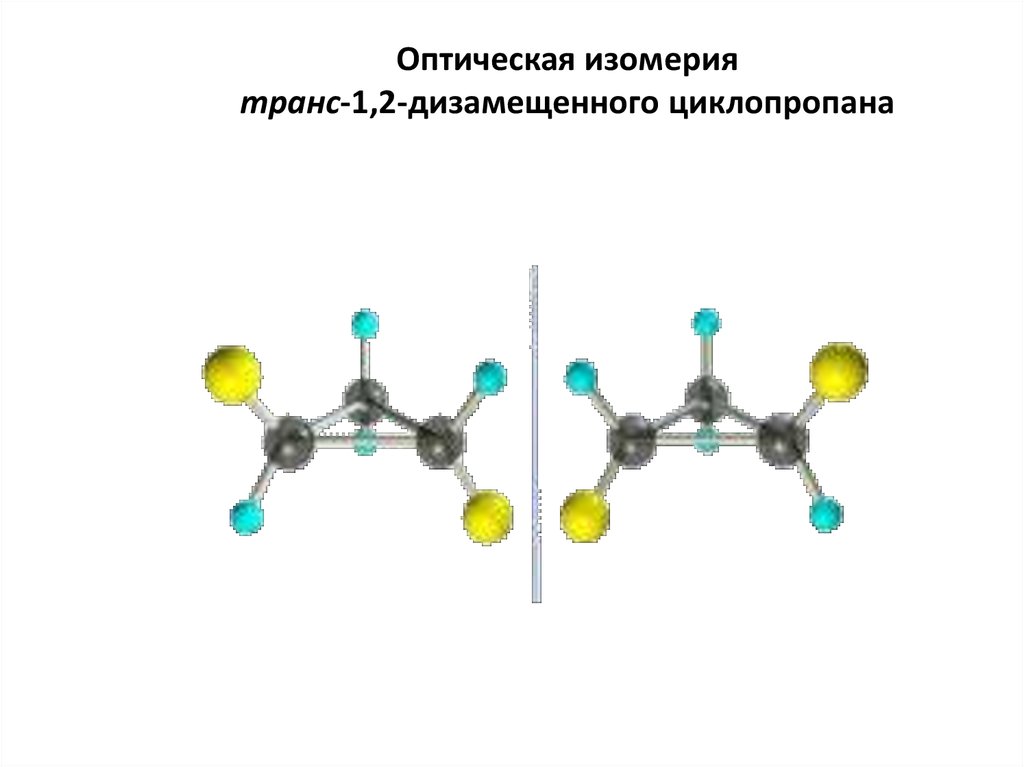
61. Оптическая изомерия транс-1,2-дизамещенного циклопропана
62. Энантиомерия
NN
O
O
O
Davron
Болеутоляющее средство
O
Norvad
Противокашлевое средство
63.
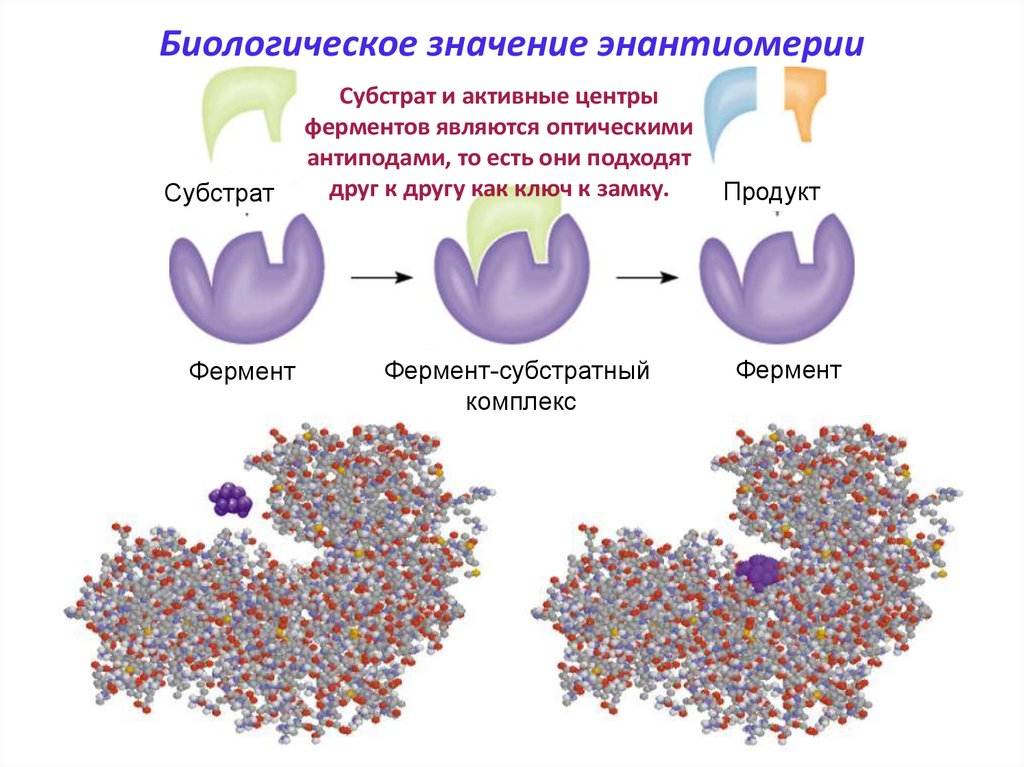
Биологическое значение энантиомерииСубстрат
Фермент
Субстрат и активные центры
ферментов являются оптическими
антиподами, то есть они подходят
друг к другу как ключ к замку.
Фермент-субстратный
комплекс
Продукт
Фермент
64.
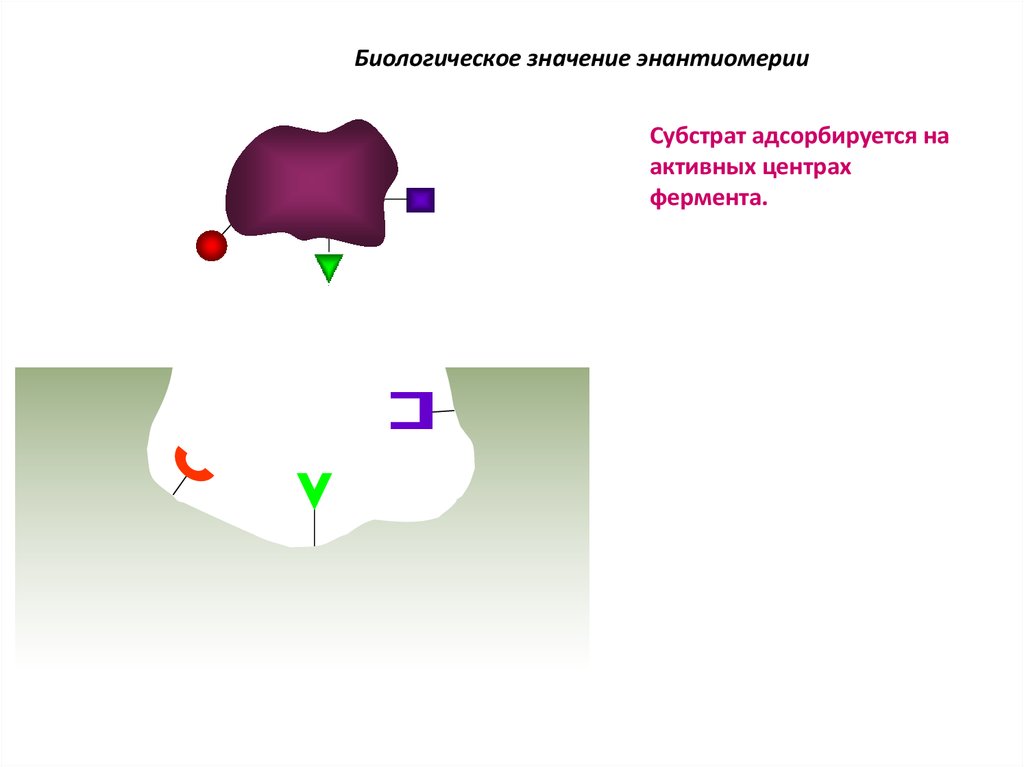
Биологическое значение энантиомерииСубстрат адсорбируется на
активных центрах
фермента.
65.
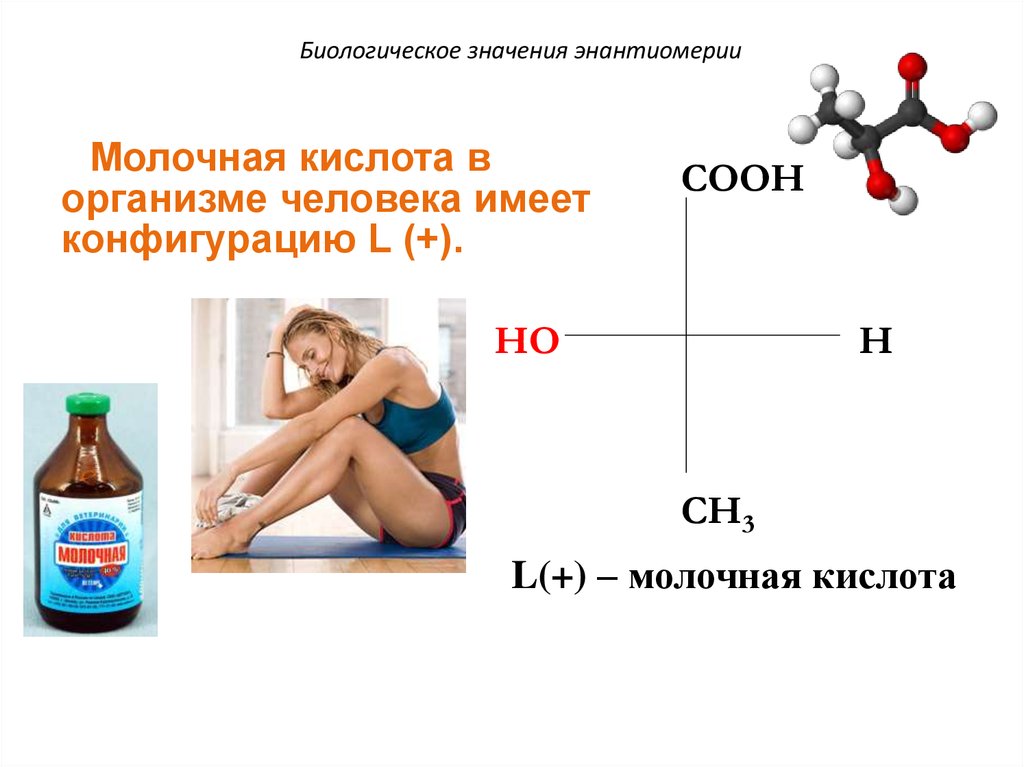
Биологическое значения энантиомерииМолочная кислота в
организме человека имеет
конфигурацию L (+).
COOH
HO
H
CH3
L(+) – молочная кислота
66. Биологическое значения энантиомерии
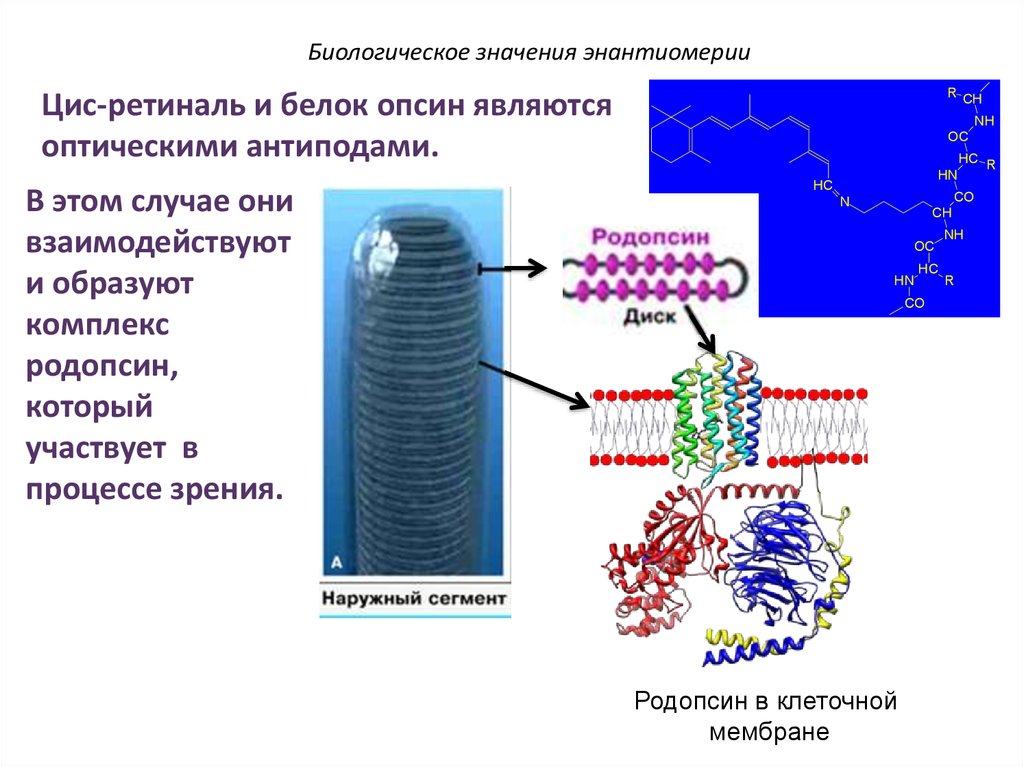
R CHЦис-ретиналь и белок опсин являются
оптическими антиподами.
В этом случае они
взаимодействуют
и образуют
комплекс
родопсин,
который
участвует в
процессе зрения.
NH
OC
HN
HC
HC R
CO
N
CH
OC
HN
HC
CO
Родопсин в клеточной
мембране
NH
R
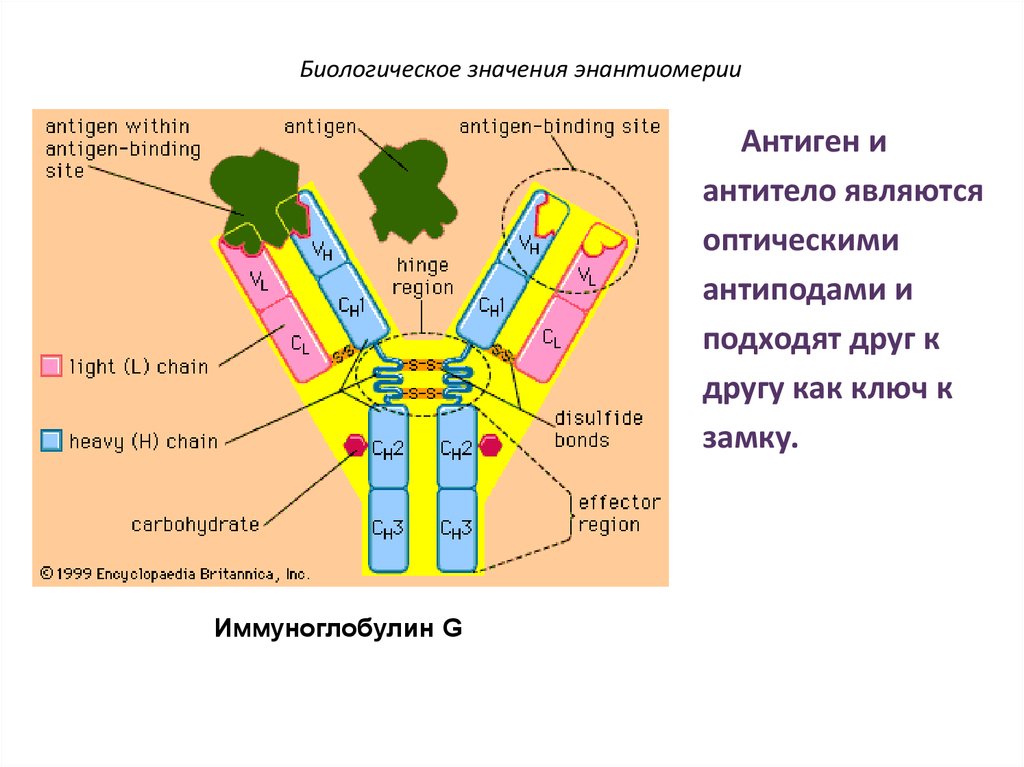
67. Биологическое значения энантиомерии
Антиген иантитело являются
оптическими
антиподами и
подходят друг к
другу как ключ к
замку.
Иммуноглобулин G
68.
σ - Диастереомерияσ-Диастереомерия
возникает в
молекулах с 2 и
более центрами
хиральности.
σ- Диастереомеры – оптические изомеры, не
являющиеся зеркальным отображение друг друга.
друг друга
69.
σ - ДиастереомерияЧисло стереоизомеров (Z)
рассчитывают по формуле Фишера:
Z =2n ,
где n-число центров хиральности.
70.
σ - ДиастереомерияD-, L-определяющим является гидроксил
при нижнем асимметрическом атоме
углерода (кроме оксикислот и аминокислот).
Если заместители находятся по одну
сторону углеродной цепи, то такой изомер
называется эритро-формой, по разные –
трео-формой.
71. σ - Диастереомерия
Пример: 2,3,4 – тригидроксибутанальСН2(ОН)-СН(ОН)-СН(ОН)-СОН
n=2; Z = 22 =4 стереоизомера,
две пары энантиомеров.
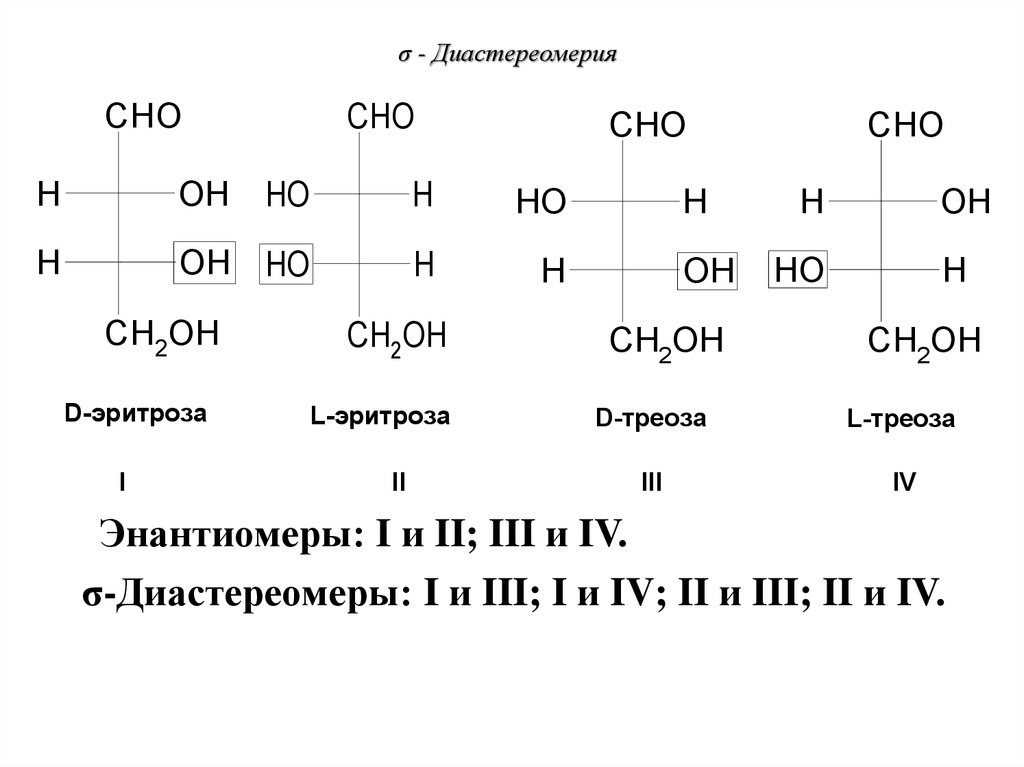
72. σ - Диастереомерия
CHOCHO
CHO
H
OH
HO
H
HO
H
OH HO
H
H
CH2OH
D-эритроза
I
CH2OH
L-эритроза
II
H
OH
CH2OH
CHO
H
OH
HO
H
CH2OH
D-треоза
L-треоза
III
IV
Энантиомеры: I и II; III и IV.
σ-Диастереомеры: I и III; I и IV; II и III; II и IV.
73. σ - Диастереомерия
σ– Диастереомеры имеют разныефизические и химические свойства,
и физиологическое действие.
74. π - Диастереомерия
π-Диастереомеры (цис- и транс-) это стереоизомеры, отличающиеся другот друга различным пространственным
расположением
одинаковых
заместителей относительно плоскости
π-связи.
75. Геометрическая изомерия
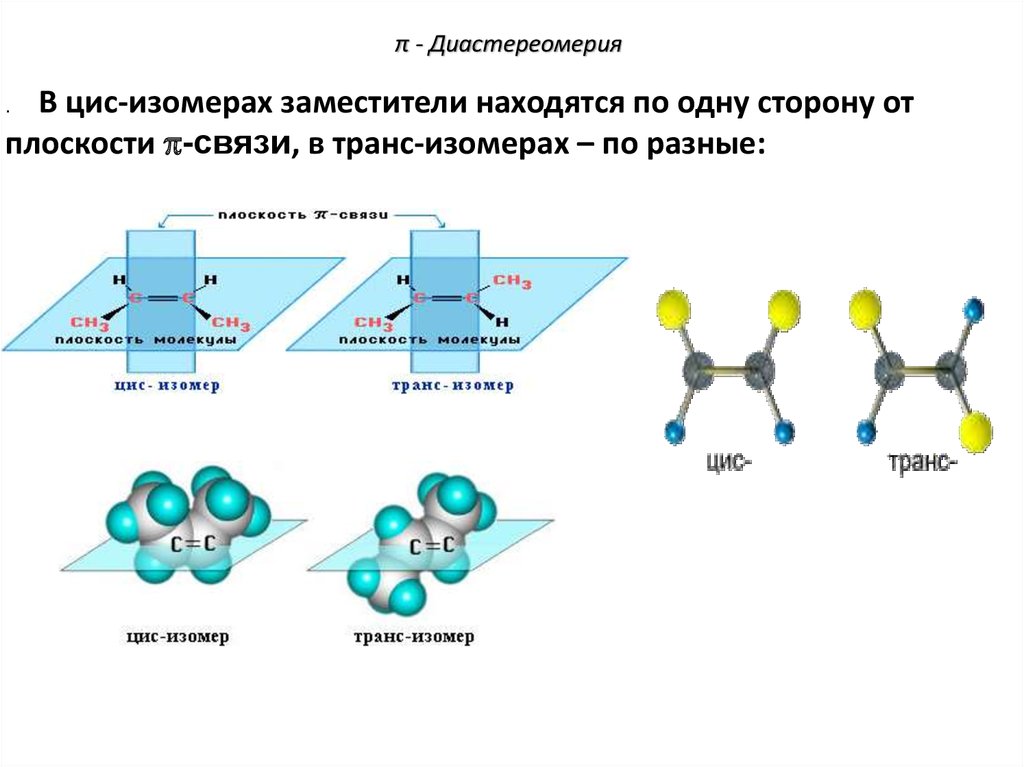
76. π - Диастереомерия
В цис-изомерах заместители находятся по одну сторону отплоскости -связи, в транс-изомерах – по разные:
.
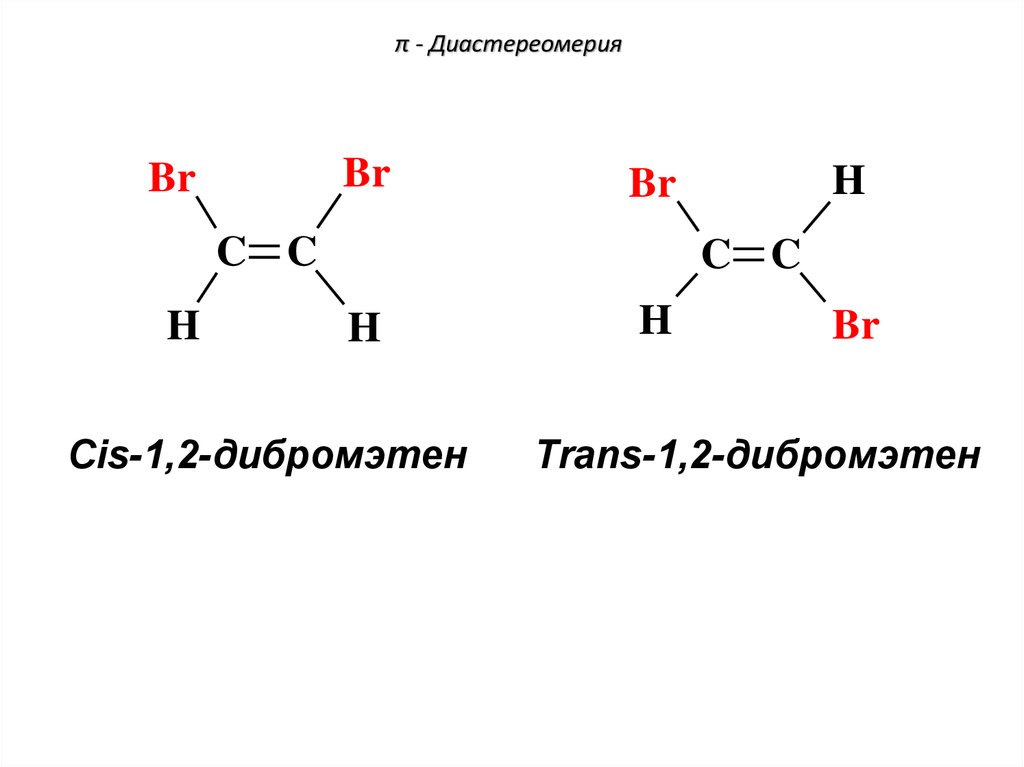
77. π - Диастереомерия
BrBr
C C
H
H
Br
C C
H
Cis-1,2-дибромэтен
H
Br
Trans-1,2-дибромэтен
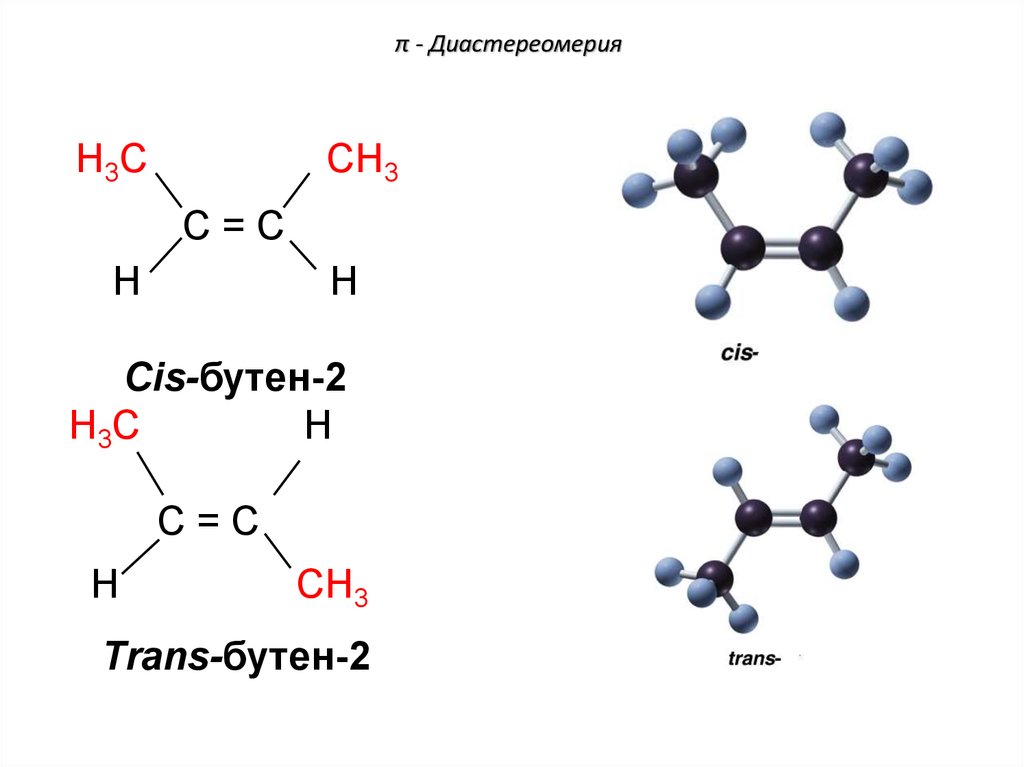
78. π - Диастереомерия
H3CCH3
C=C
H
H
Cis-бутен-2
H3C
H
C=C
H
CH3
Trans-бутен-2
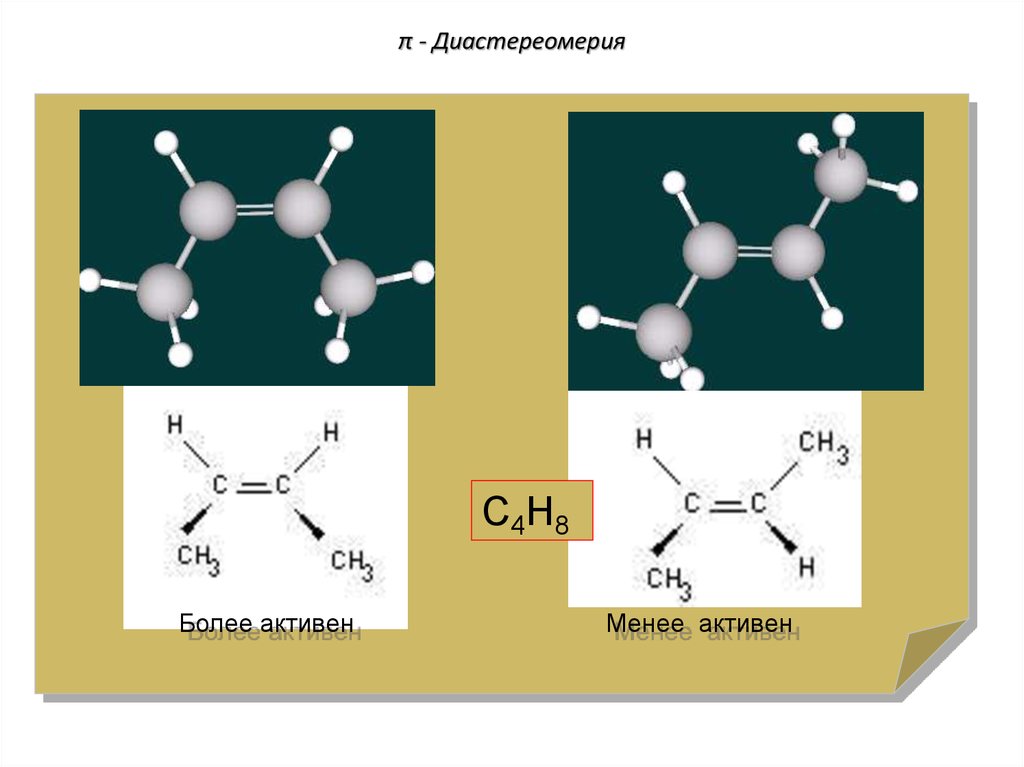
79. π - Диастереомерия
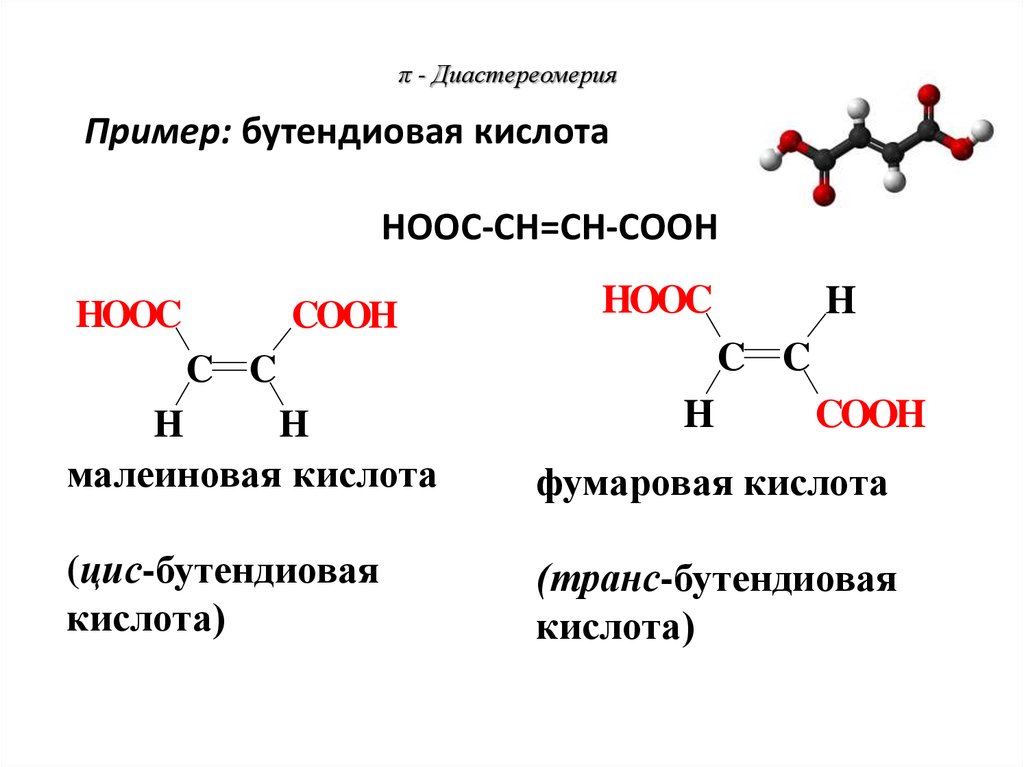
С4Н8Более активен
Менее активен
80. π - Диастереомерия
Пример: бутендиовая кислотаНООС-СН=СН-СООН
HOOC
COOH
HOOC
H
C C
C C
H
COOH
H
H
малеиновая кислота
фумаровая кислота
(цис-бутендиовая
кислота)
(транс-бутендиовая
кислота)
81. π - Диастереомерия
-Диастереомеры отличаются друг отдруга по физическим и химическим
свойствам, а также по физиологическому
действию.
Более устойчивыми являются
транс- -диастереомеры.
82. π - Диастереомерия
Фумаровая кислота содержится как врастительных, так и животных организмах,
где она образуется как промежуточный
продукт обмена углеводов в анаэробных
условиях.
Малеиновая кислота токсична, в природе
не встречается, получается синтетическим
путём.
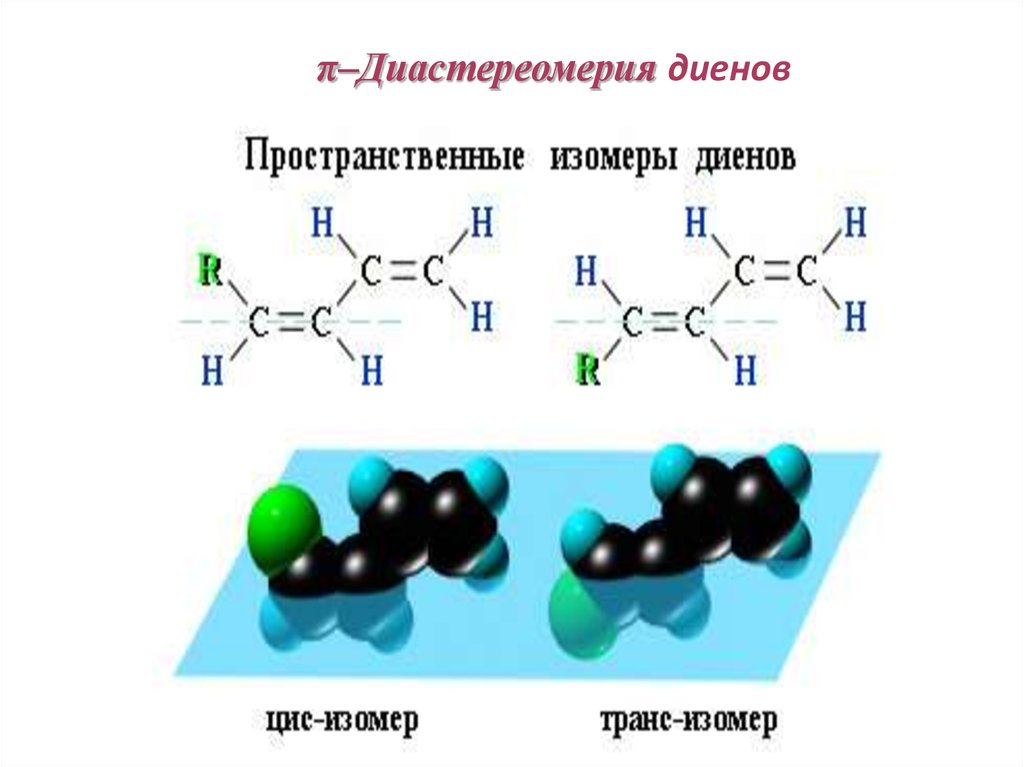
83. π–Диастереомерия диенов
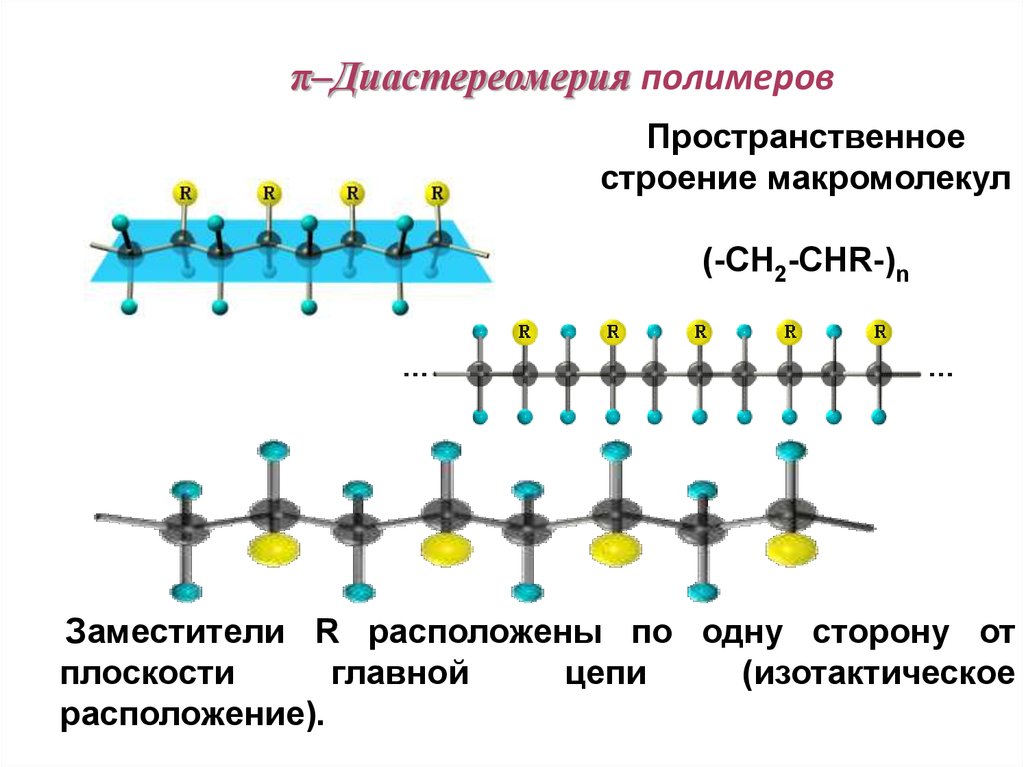
84. π–Диастереомерия полимеров
Пространственноестроение макромолекул
(-CH2-CHR-)n
Заместители R расположены по одну сторону от
плоскости
главной
цепи
(изотактическое
расположение).
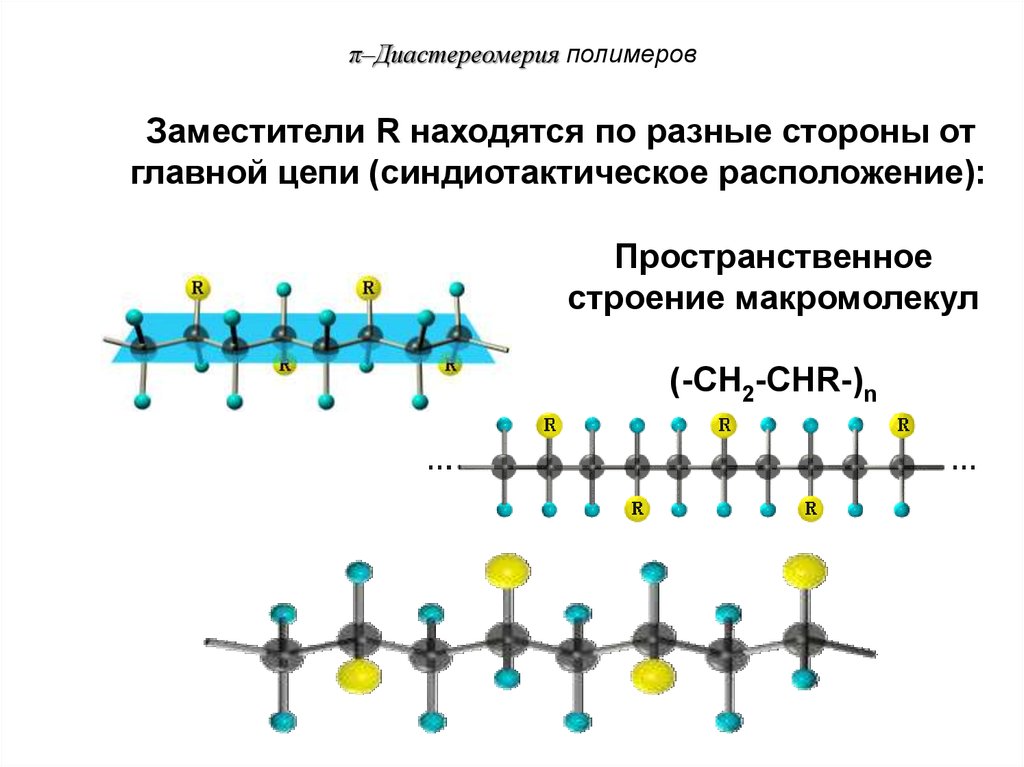
85.
π–Диастереомерия полимеровЗаместители R находятся по разные стороны от
главной цепи (синдиотактическое расположение):
Пространственное
строение макромолекул
(-CH2-CHR-)n
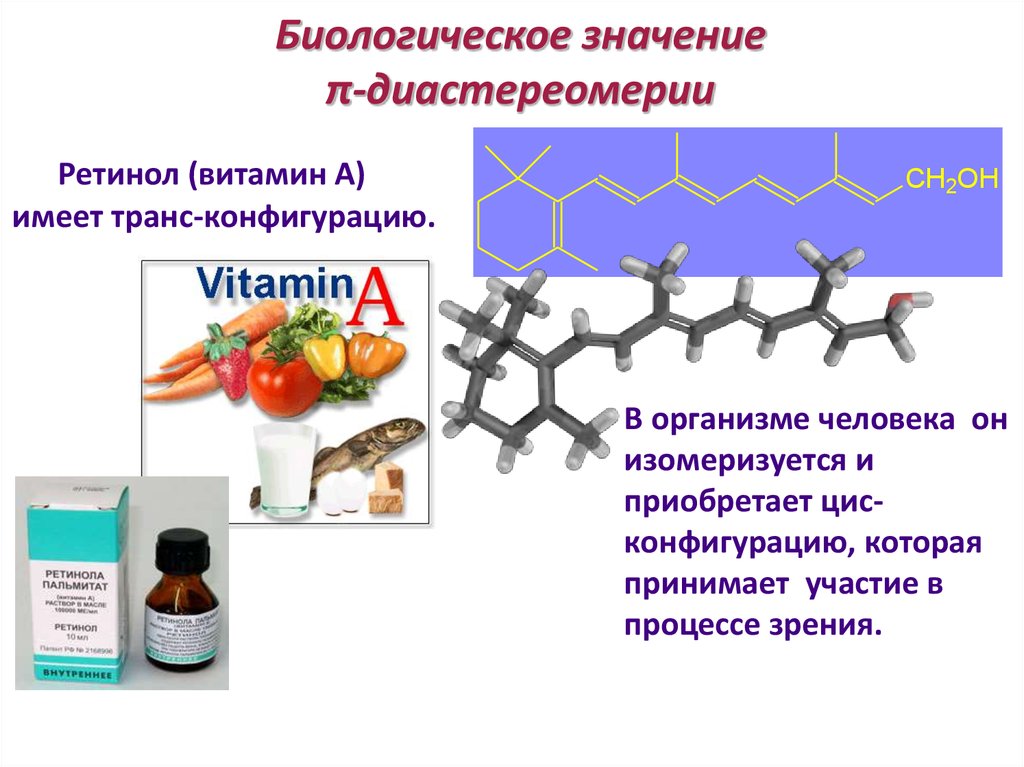
86. Биологическое значение π-диастереомерии
Ретинол (витамин А)имеет транс-конфигурацию.
CH2OH
В организме человека он
изомеризуется и
приобретает цисконфигурацию, которая
принимает участие в
процессе зрения.
87. Биологическое значение π-диастереомерии
Высшиененасыщенные
жирные кислоты в
составе липидов
имеют цисконфигурацию.
Это обусловливает их укороченный и согнутый
вид, что имеет значение для поддержания
структуры клеточной мембраны.
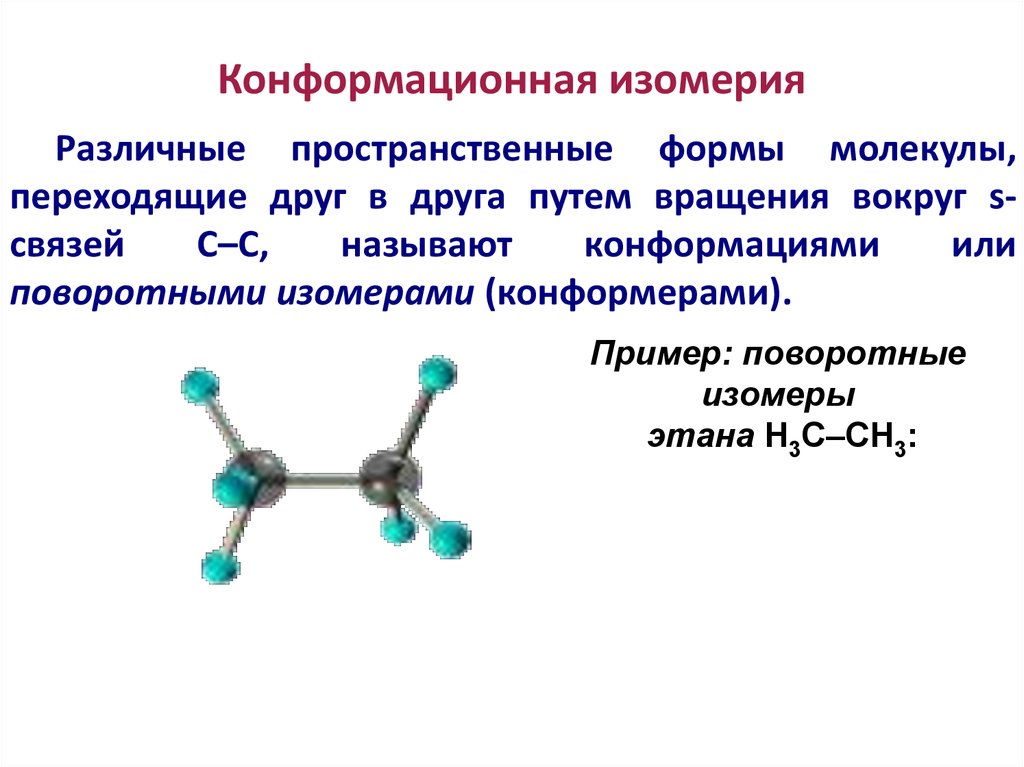
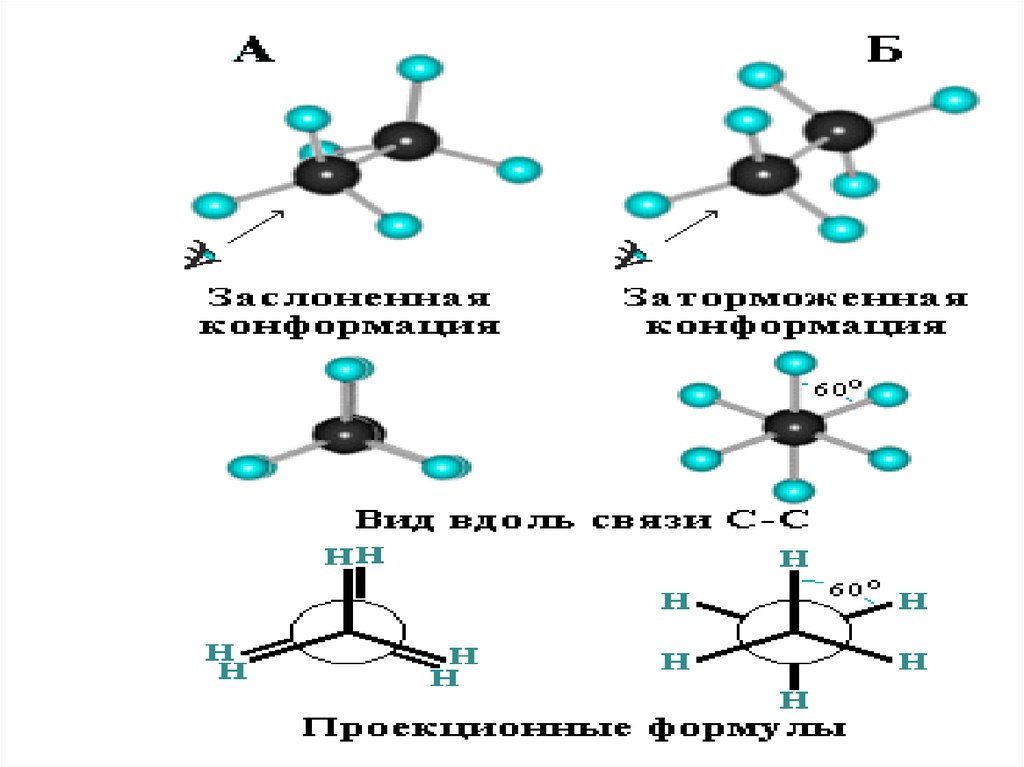
88. Конформационная изомерия
Различные пространственные формы молекулы,переходящие друг в друга путем вращения вокруг sсвязей
С–С,
называют
конформациями
или
поворотными изомерами (конформерами).
Пример: поворотные
изомеры
этана Н3С–СН3:
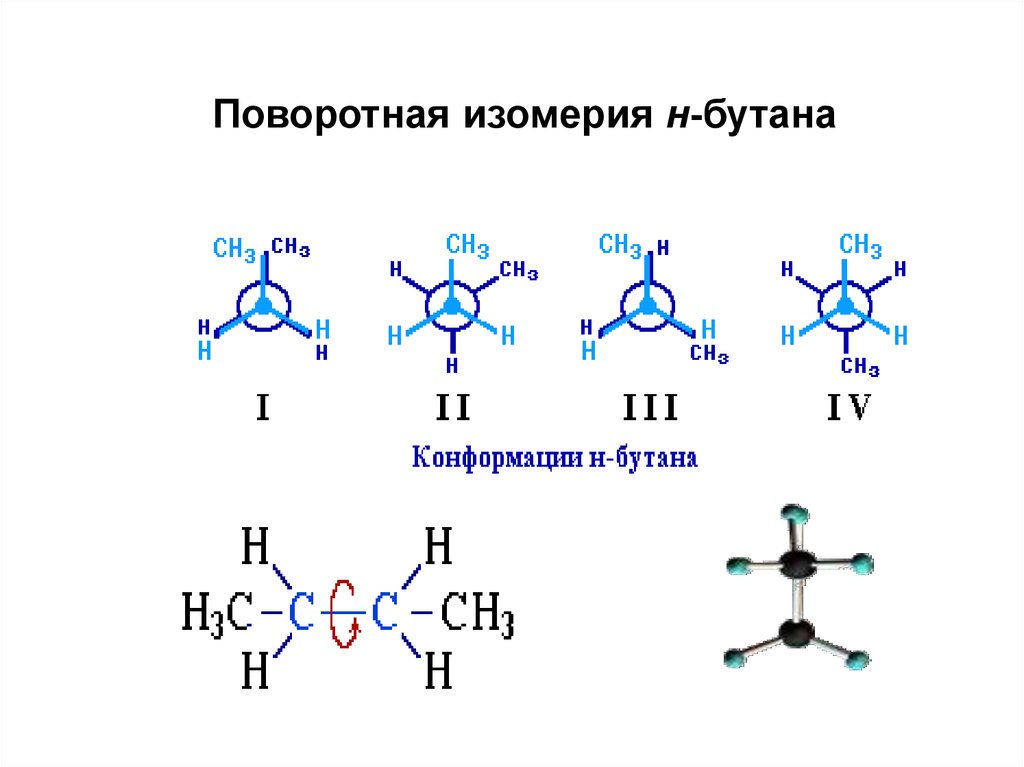
89.
90. Конформации бутана
91.
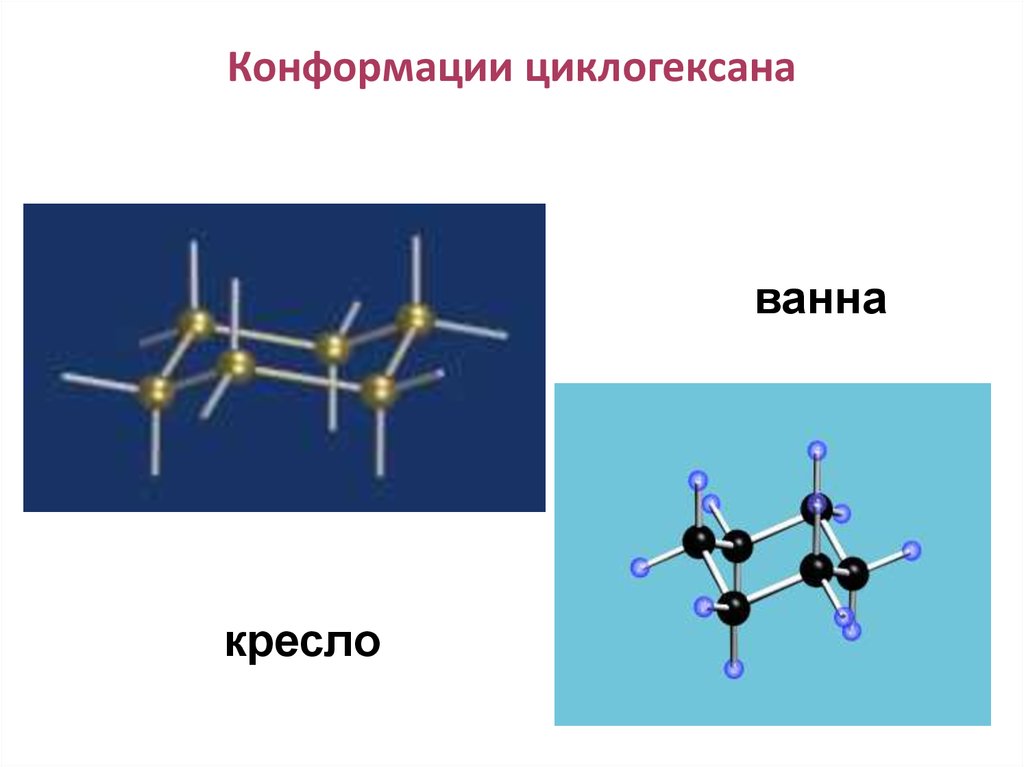
Поворотная изомерия н-бутана92. Конформации циклогексана
ваннакресло
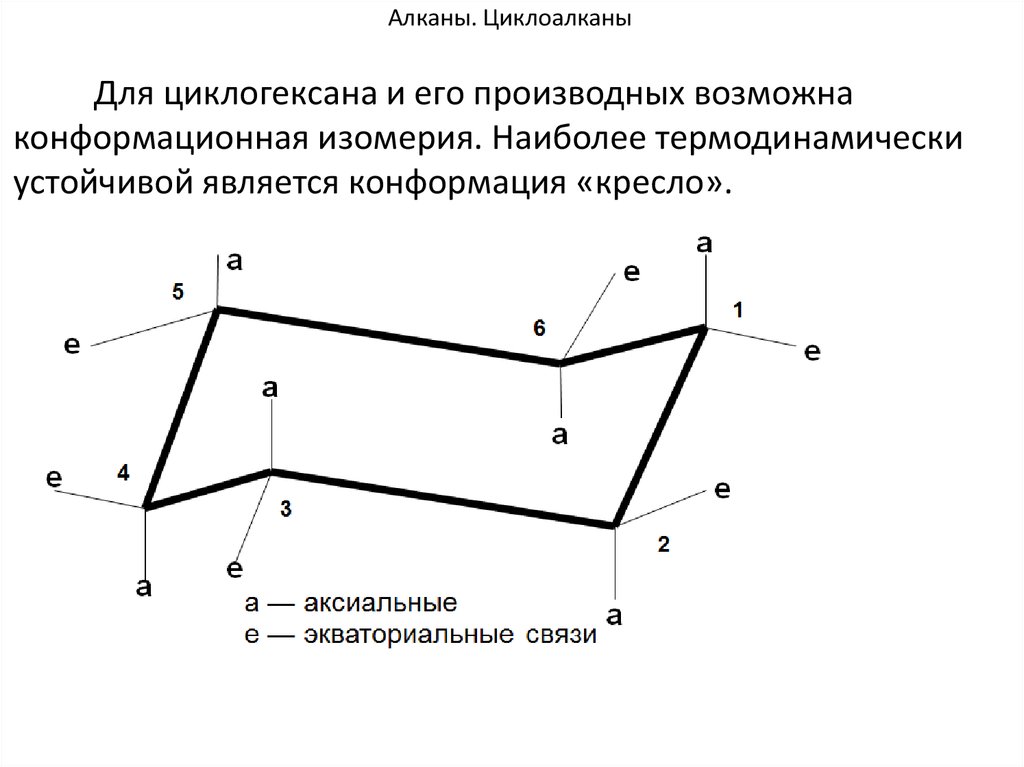
93. Алканы. Циклоалканы
Для циклогексана и его производных возможнаконформационная изомерия. Наиболее термодинамически
устойчивой является конформация «кресло».
94. Кислотность органических соединений
Кислотно-основные свойстваорганических веществ рассматривают,
основываясь на положениях протонной
теории кислот и оснований (БренстедЛоури, 1913 г.).
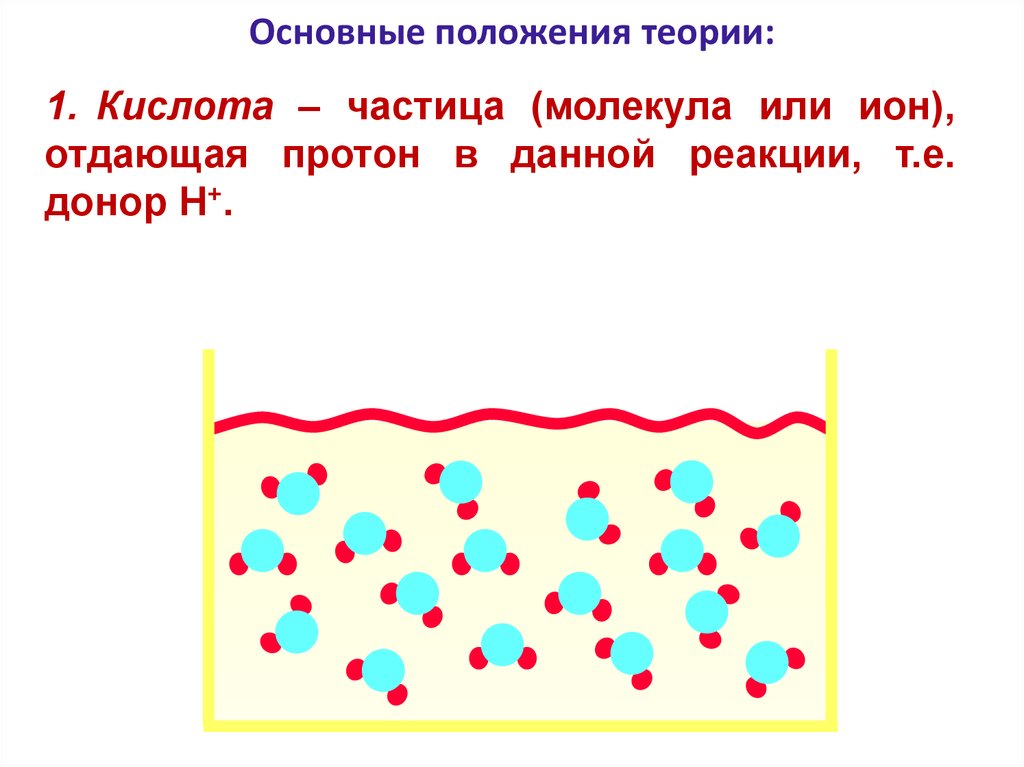
95. Протолитическая теория кислот и оснований
Основные положения теории:1. Кислота – частица (молекула или ион),
отдающая протон в данной реакции, т.е.
донор H+.
96. Основные положения теории:
1. Кислота – частица (молекула или ион),отдающая протон в данной реакции, т.е.
донор H+.
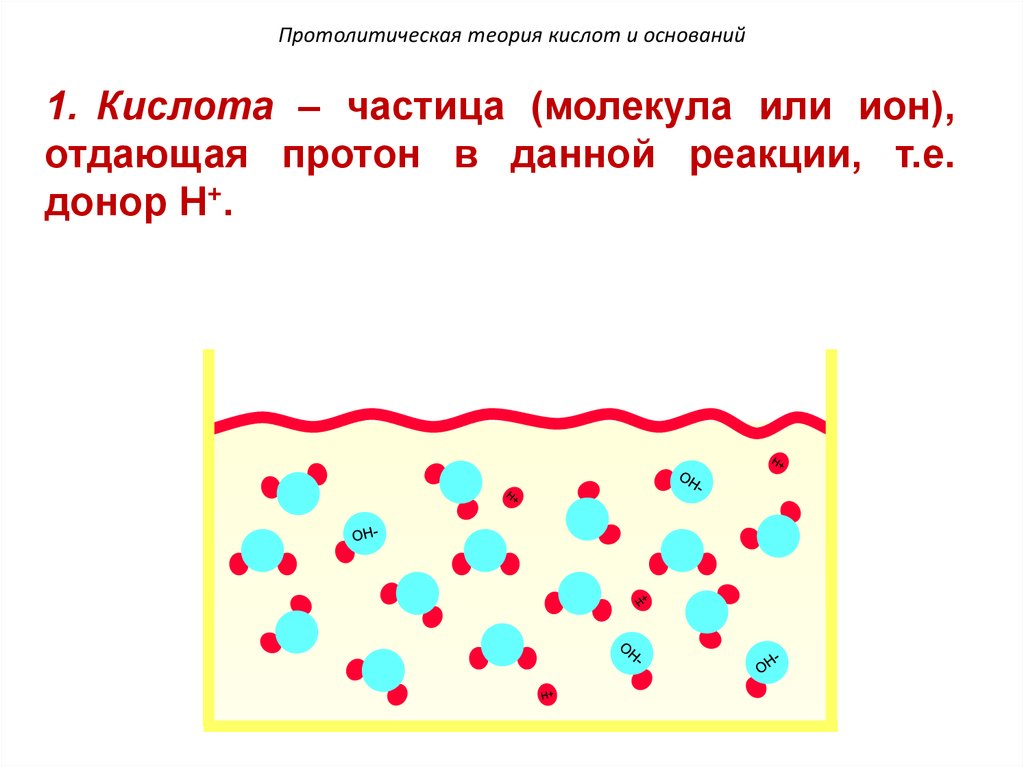
97. Протолитическая теория кислот и оснований
1. Кислота – частица (молекула или ион),отдающая протон в данной реакции, т.е.
донор H+.
98. Протолитическая теория кислот и оснований
1. Кислота – частица (молекула или ион),отдающая протон в данной реакции, т.е.
донор H+.
99. Протолитическая теория кислот и оснований
2. Основание – частица (молекула или ион),присоединяющая протон в данной реакии, т.е.
акцептор H+.
100. Протолитическая теория кислот и оснований
Основание – частица (молекула или ион),присоединяющая протон в данной
реакии, т.е. акцептор H+.
101. Протолитическая теория кислот и оснований
Основание – частица (молекула или ион),присоединяющая протон в данной
реакии, т.е. акцептор H+.
102. Протолитическая теория кислот и оснований
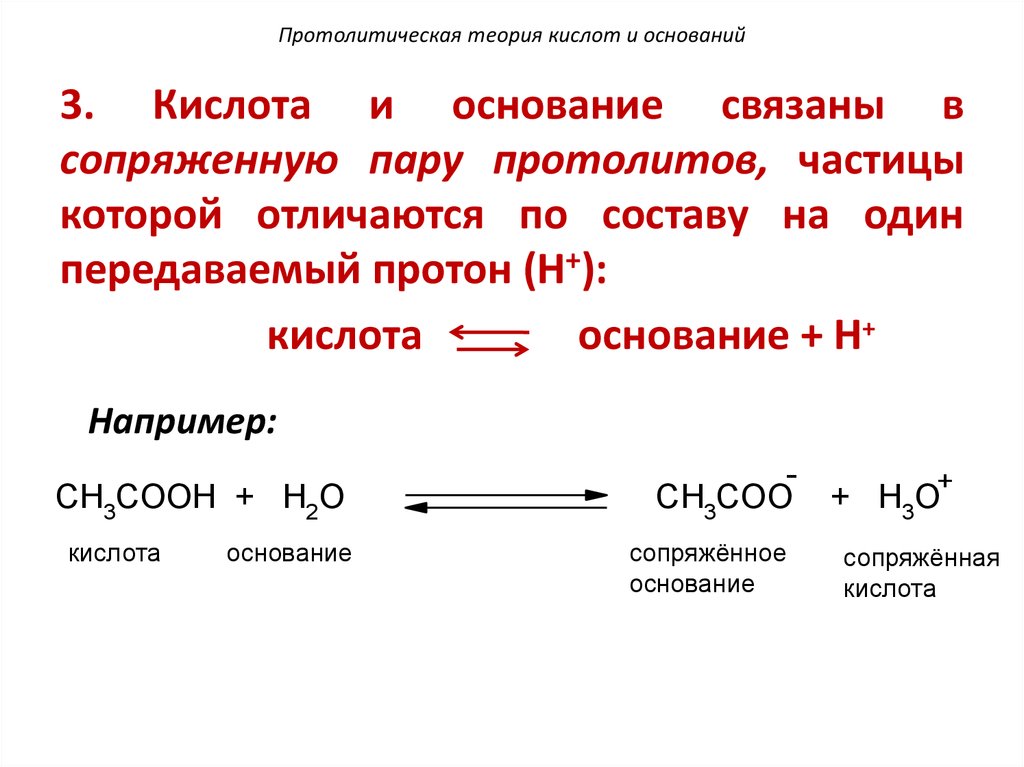
3. Кислота и основание связаны всопряженную пару протолитов, частицы
которой отличаются по составу на один
передаваемый протон (H+):
кислота
основание + Н+
Например:
CH3COOH + H2O
кислота
основание
CH3COO
сопряжённое
основание
+
+ H3O
сопряжённая
кислота
103. Протолитическая теория кислот и оснований
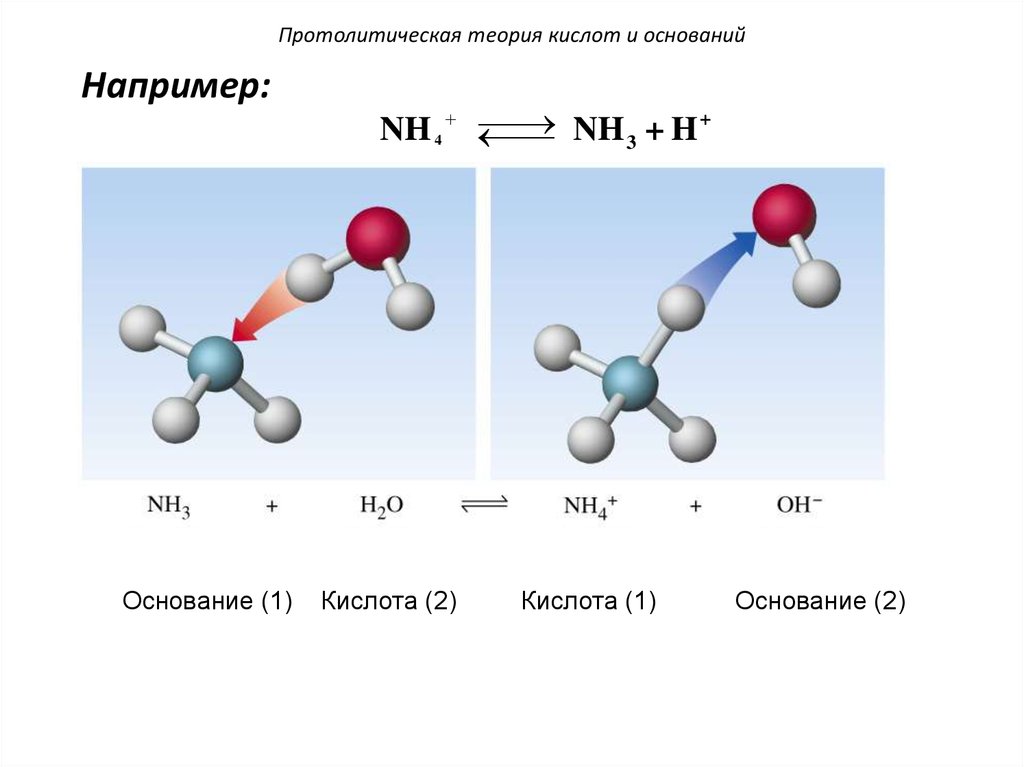
Например:Основание (1)
NH 3 + H +
NH 4
Кислота (2)
Кислота (1)
Основание (2)
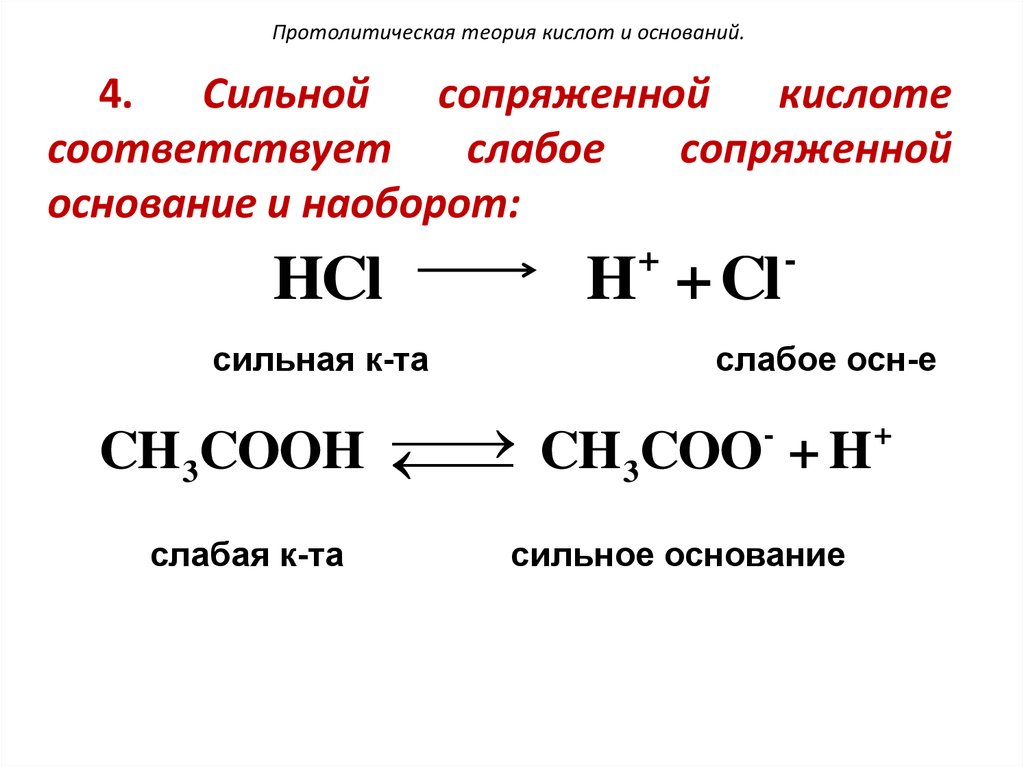
104. Протолитическая теория кислот и оснований.
4. Сильной сопряженнойкислоте
соответствует
слабое
сопряженной
основание и наоборот:
+
HCl
H + Cl
сильная к-та
слабое осн-е
+
CH3COOH
CH3COO + H
слабая к-та
сильное основание
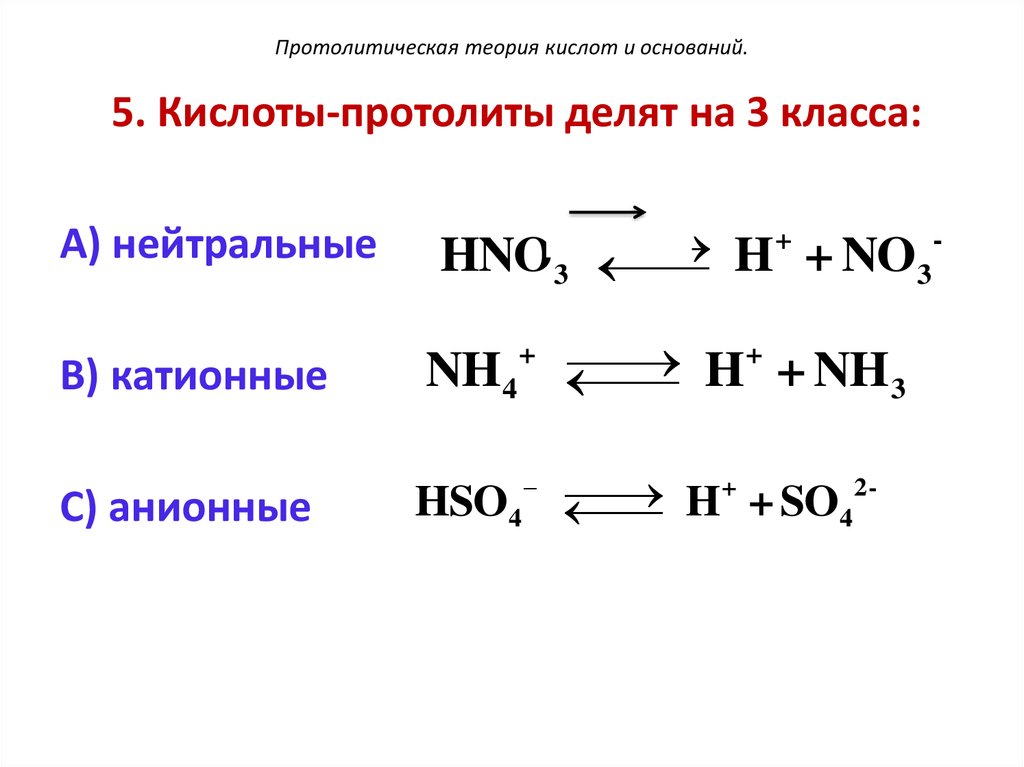
105. Протолитическая теория кислот и оснований.
5. Кислоты-протолиты делят на 3 класса:А) нейтральные
В) катионные
С) анионные
+
HNO3
H + NO3
NH4
+
+
H + NH 3
+
2
HSO4
H
+
SO
4
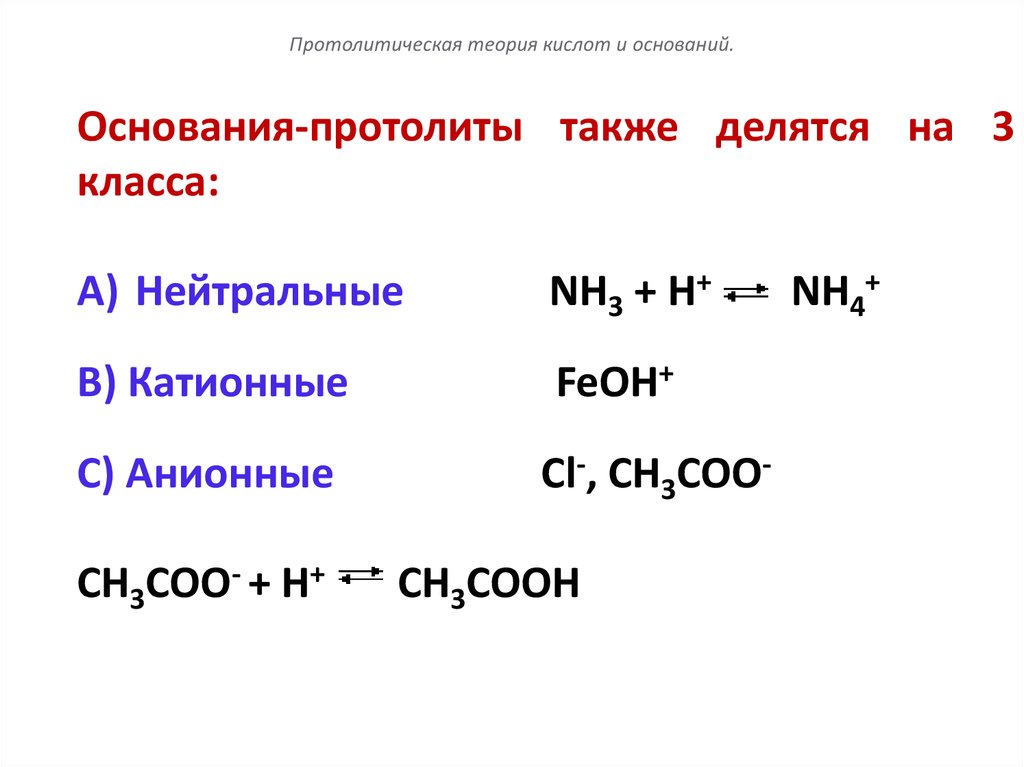
106.
Протолитическая теория кислот и оснований.Основания-протолиты также делятся на 3
класса:
A) Нейтральные
NH3 + Н+
B) Катионные
FeOH+
C) Анионные
СН3СОО- + Н+
Сl-, CH3COOСН3СООН
NH4+
107.
Протолитическая теория кислот и оснований.6.
Амфолиты
–
протолиты,
способные как принимать, так и
отдавать протоны:
+
H 2O
H
+
OH
Кислота
Основание
+
+
H2O + H
H 3O
Основание
Кислота
Кис
лота
Осно
вание
Сопряж.
осн-е
Сопряж.
К-та
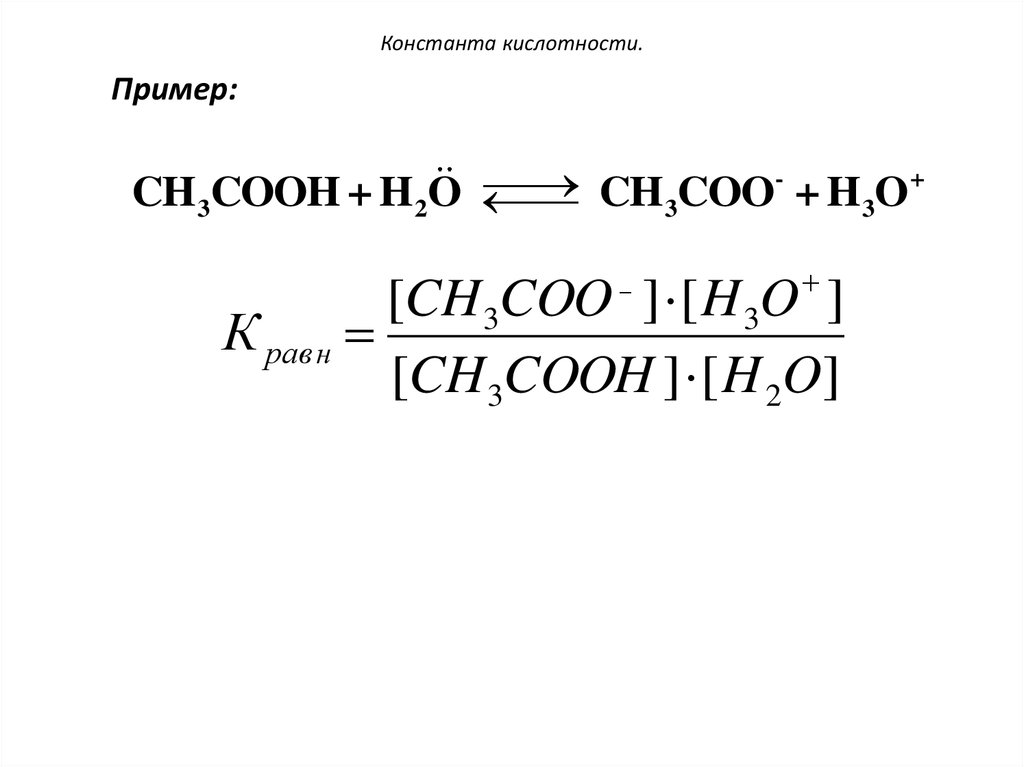
108. Константа кислотности.
7. Количественно сила кислот-протолитовоценивается
величиной
константы
кислотности (Ка).
Ка характеризует момент химического
равновесия в процессе переноса протона и
определяется
на
основании
закона
действующих масс.
109. Константа кислотности.
Пример:+
CH 3COOH + H 2O
CH 3COO + H 3O
[CH 3COO ] [ H 3O ]
К равн
[CH 3COOH ] [ H 2O]
110. Константа кислотности.
Перемножим обе части уравнениявеличину молярной концентрации воды:
на постоянную
[CH 3COO ] [ H 3O ] [ H 2O ]
К рав н [ H 2O ]
,
[CH 3COOH ] [ H 2O ]
[CH 3COO ] [ H 3O ]
К рав н [ H 2O ]
,
[CH 3COOH ]
К a K рав н H 2O
Таким образом, чем выше концентрация
сопряженных частиц продуктов протонного
переноса, тем больше значение Ка, а значит тем
сильнее кислота-протолит.
111. Протолитическая теория кислот и оснований.
На практике используют показательконстанты кислотности (pKa):
pK a = - lgK a
Чем меньше значение pKa, тем сильнее
кислота.
112. Кислотность органических соединений
Большинство органических соединений можнорассматривать как кислоты, поскольку в их
молекулах содержатся ковалентные полярные
связи атома водорода с более
электроотрицательными элементами (С, S, O, N).
Кислотным центром называется элемент и
связанный с ним атом водорода.
Органические кислоты соответственно
классифицируются по кислотному центру на
О-Н; S-H; N-H; C-H кислоты.
113. Кислотность органических соединений
Формулы и названия веществрКа
С2Н5ОН
этанол
18
С2Н5SH
этантиол
10,5
С2Н5NH2 этанамин
30
С6Н5ОН
фенол
9,9
Чем больше значение рКа, тем слабее
кислота.
Сила кислоты определяется
стабильностью аниона, образовавшегося
при диссоциации этой кислоты.
114. Кислотность органических соединений
На стабильность аниона оказывают влияниеследующие факторы:
1. Природа элемента в кислотном центре.
а) электроотрицательность элемента
Сравним кислотные свойства веществ с
одинаковыми радикалами:
СН3–СН2 –ОН (рКа=18)
СН3–СН2 –NH2 (рКа=30).
115. Кислотность органических соединений
Поскольку кислород является болееэлектроотрицательным элементом, то связь
О-Н более полярна, чем N-H, что способствует
большей подвижности иона Н+ и его более
легкой отщепляемости в О-Н кислотном центре
по сравнению с N-H центром.
Образующийся алкоксид-ион более
стабилен, чем алкил-амид-ион, так как у более
электроотрицательного атома кислорода в
большей степени выражена способность нести
отрицательный заряд.
Амины более слабые кислоты, чем спирты.
116. Кислотность органических соединений
б) поляризуемость элемента в кислотномцентре.
Сравним кислотные свойства веществ с
одинаковыми радикалами:
СН3–СН2 –ОН (рКа=18)
СН3–СН2 –SH (рКа=10,5).
117. Кислотность органических соединений
Благодаря большему радиусу и болеевысокой поляризуемости атома серы,
отрицательный заряд в анионе СН3–СН2–S(меркаптид-ион) делокализован в большем
объёме, чем в алкоксид-ионе СН3–СН2–О-.
Это обусловливает более высокую
стабильность меркаптид-иона по сравнению
с алкоксид-ионом.
Этантиол является более сильной
кислотой, чем этанол.
118. Кислотность органических соединений
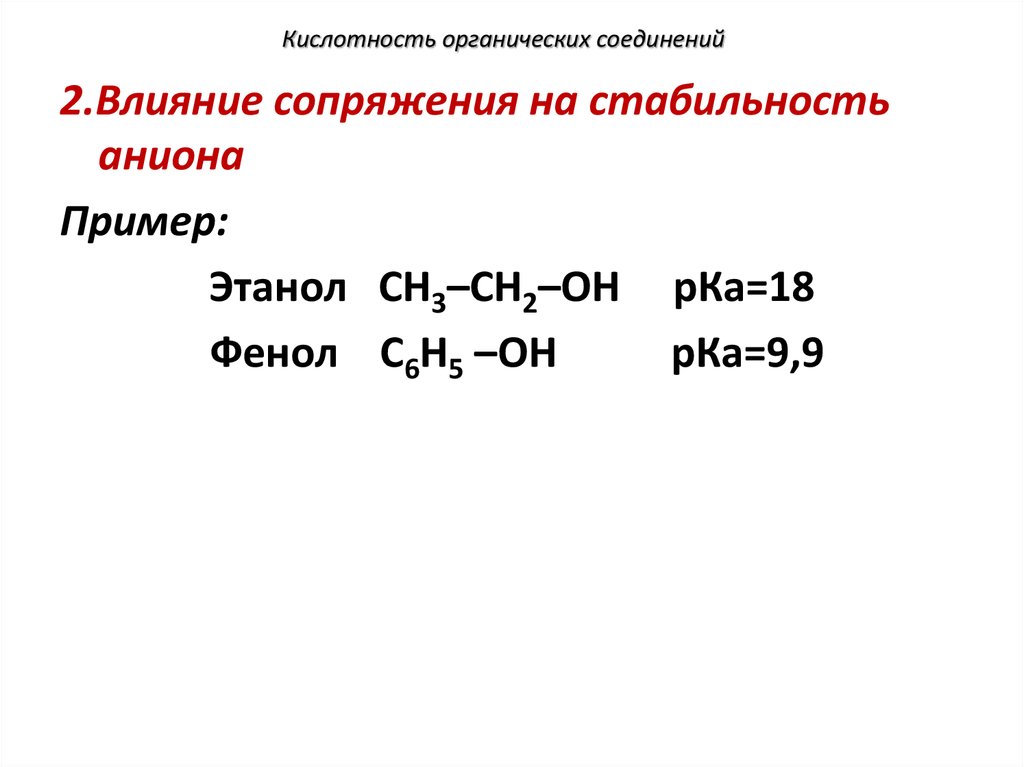
2.Влияние сопряжения на стабильностьаниона
Пример:
Этанол СН3–СН2–ОН рКа=18
Фенол С6Н5 –ОН
рКа=9,9
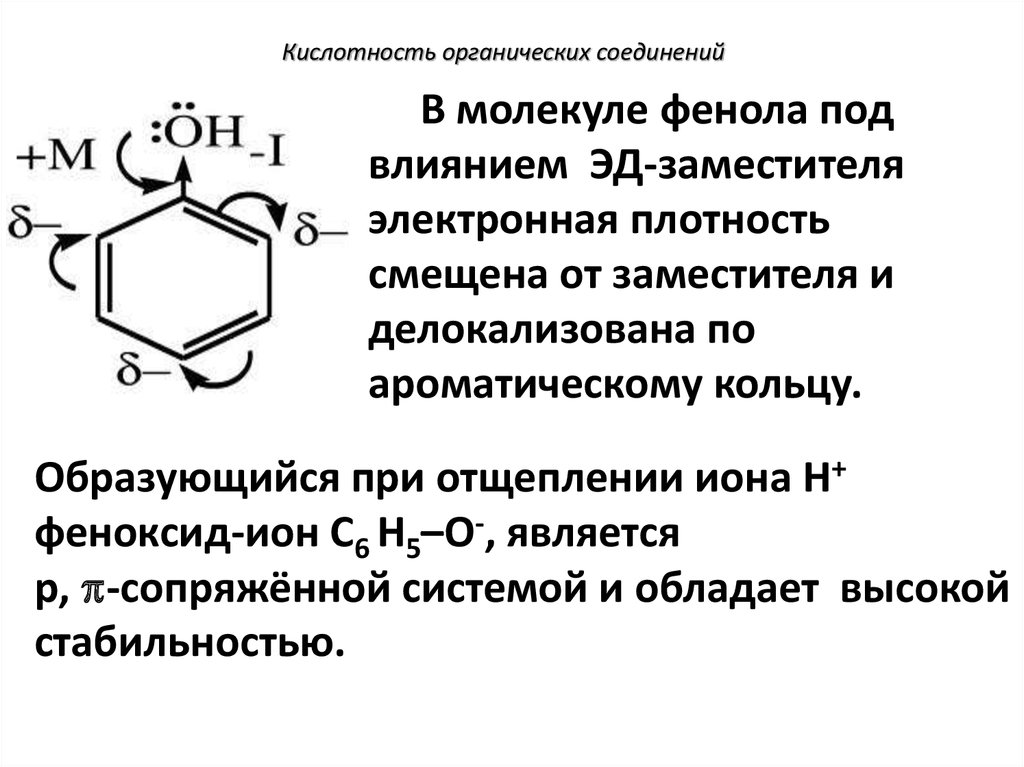
119. Кислотность органических соединений
В молекуле фенола подвлиянием ЭД-заместителя
электронная плотность
смещена от заместителя и
делокализована по
ароматическому кольцу.
Образующийся при отщеплении иона Н+
феноксид-ион С6 Н5–О-, является
р, -сопряжённой системой и обладает высокой
стабильностью.
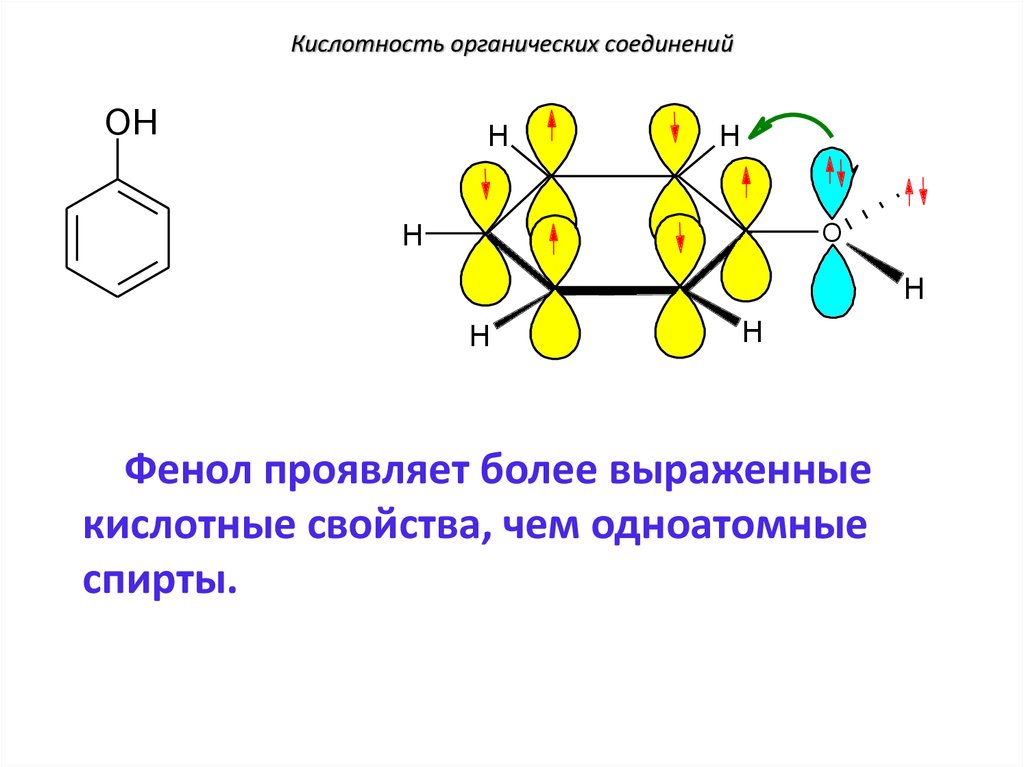
120. Кислотность органических соединений
OHH
H
.
O
H
H
H
H
Фенол проявляет более выраженные
кислотные свойства, чем одноатомные
спирты.
121. Кислотность органических соединений
3. Влияние заместителей на стабильностьаниона
Пример: СН3–СН2–СООН
рКа=4,9
пропановая к-та
СН3–СН (ОН)–СООН
рКа=3,83
2-оксипропановая к-та
Наличие в радикале кислоты ЭА заместителя –
ОН-группы способствует делокализации
отрицательного заряда в лактат-анионе, что
повышает его стабильность по сравнению с
пропионат-анионом.
ЭА-заместители усиливают кислотность, а
ЭД - снижают.
122. Кислотность органических соединений
4. Влияние растворителя на стабильностьаниона
В водных растворах анионы гидратированы, что
повышает их стабильность и усиливает кислотные
свойства веществ.
Чем меньше радикал аниона, тем он более
гидратирован и стабилен.
Муравьиная кислота
рКа=3,7
Уксусная кислота
рКа=4,76
Пропионовая кислота
рКа=4,90
Так как формиат-ион имеет малые размеры, он
наиболее гидратирован и стабилен, по сравнению
с ацетат-ионом и пропионат- ионом.
123.
Спасибо заВаше
внимание!























































 chemistry
chemistry








