Similar presentations:
Кислотность органических соединений. Типы химических реакций
1. 3. Кислотность органических соединений
Типы химических реакций3. Кислотность органических
соединений
2. 3. Кислотность органических соединений
Кислотно-основные свойстваорганических веществ
рассматривают, основываясь на
положениях протонной теории
кислот и оснований (БренстедЛоури, 1913 г.).
3. Основные положения теории:
1. Кислота – частица (молекула илиион), отдающая протон в данной
реакции, т.е. донор H+.
4.
2. Основание – частица (молекула илиион), присоединяющая протон в данной
реакии, т.е. акцептор H+.
5. Протолитическая теория кислот и оснований
Основание – частица (молекула или ион),присоединяющая протон в данной
реакии, т.е. акцептор H+.
6.
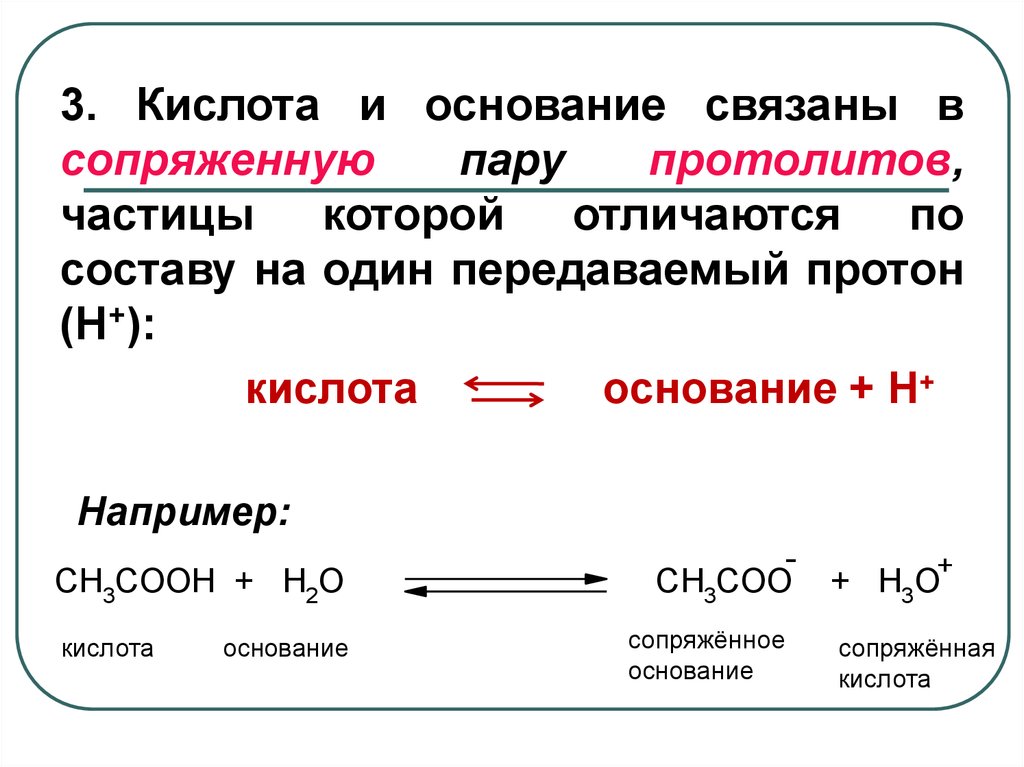
3. Кислота и основание связаны всопряженную
пару
протолитов,
частицы которой отличаются по
составу на один передаваемый протон
(H+):
кислота
основание + Н+
Например:
CH3COOH + H2O
кислота
основание
CH3COO
сопряжённое
основание
+
+ H3O
сопряжённая
кислота
7.
Например:Основание (1)
NH 3 + H +
NH 4
Кислота (2)
Кислота (1)
Основание (2)
8.
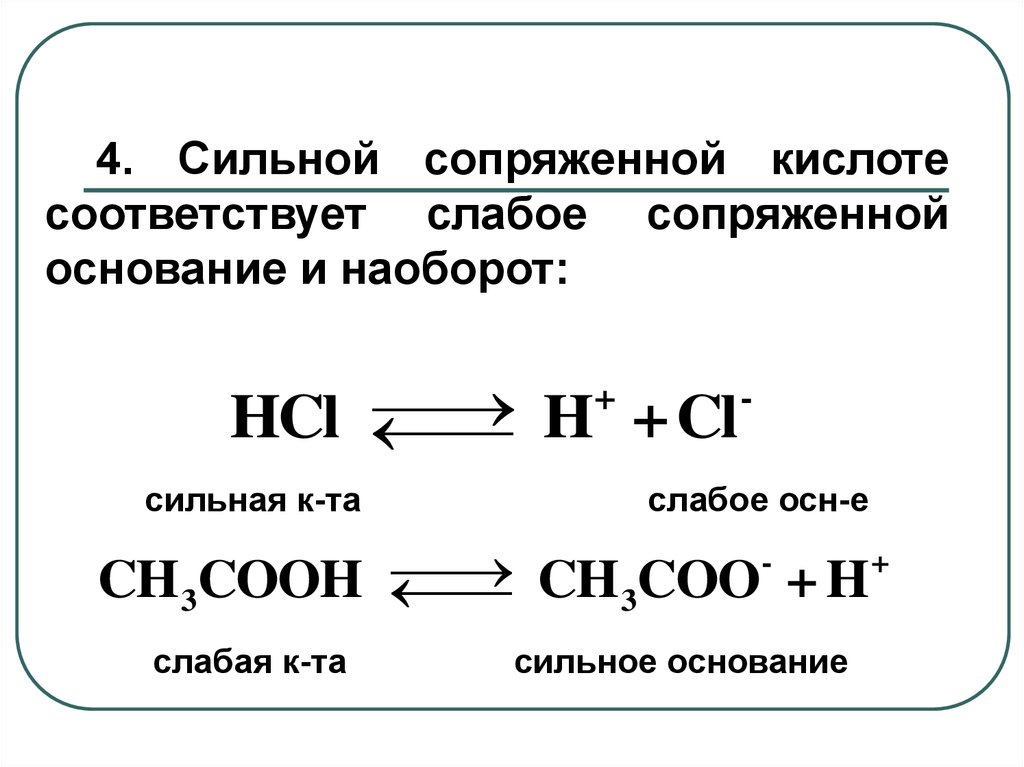
4. Сильной сопряженной кислотесоответствует слабое сопряженной
основание и наоборот:
+
HCl
H + Cl
сильная к-та
слабое осн-е
+
CH3COOH
CH 3COO + H
слабая к-та
сильное основание
9. Протолитическая теория кислот и оснований.
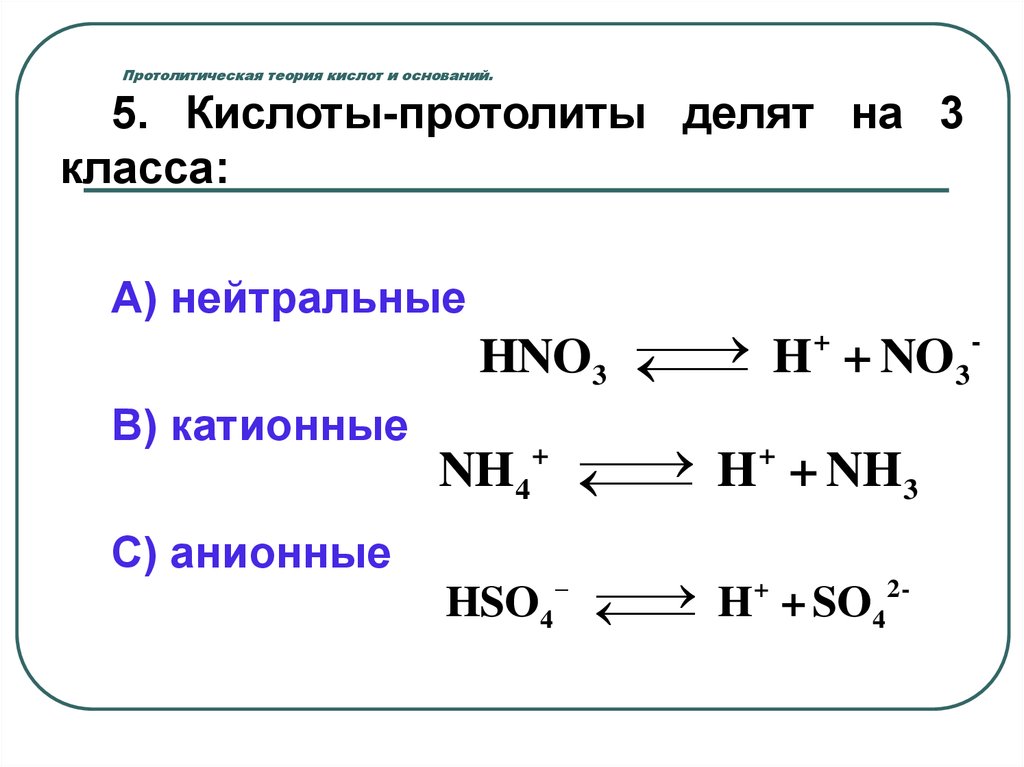
5. Кислоты-протолиты делят на 3класса:
А) нейтральные
+
HNO3
H + NO3
В) катионные
NH4
+
H + NH 3
+
С) анионные
HSO4
+
2
H + SO4
10.
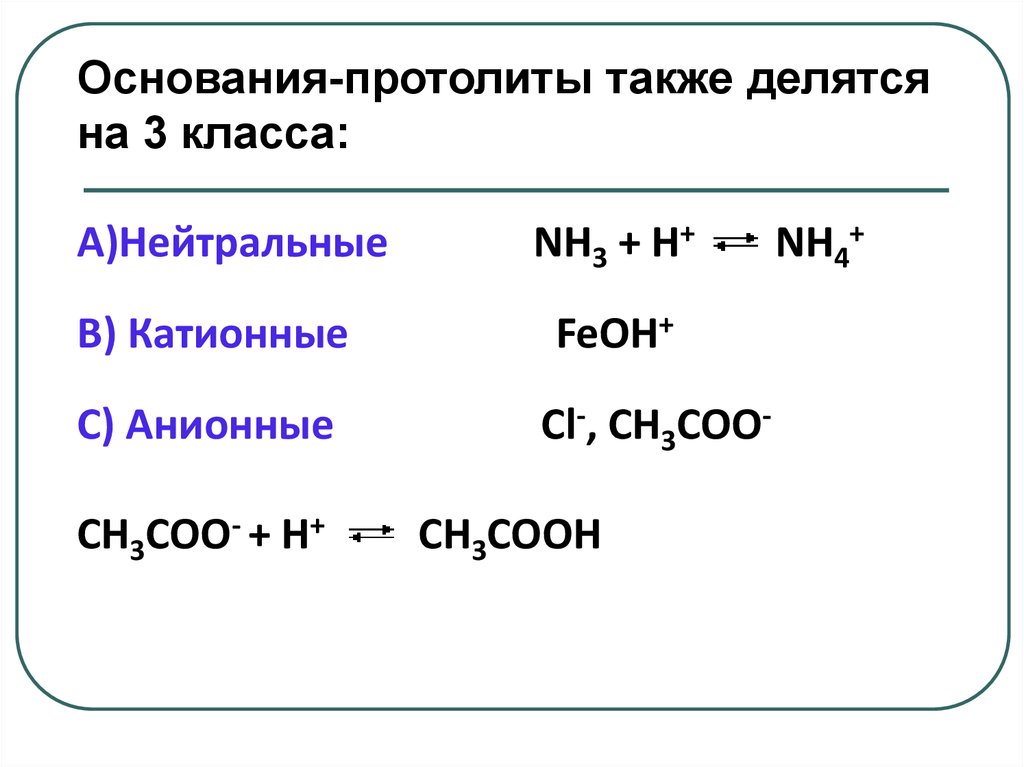
Основания-протолиты также делятсяна 3 класса:
A)Нейтральные
B) Катионные
C) Анионные
СН3СОО- + Н+
NH3 + Н+
FeOH+
Сl-, CH3COOСН3СООН
NH4+
11.
6. Амфолиты – протолиты,способные как принимать, так и
отдавать протоны:
+
H 2O
H
+
OH
Кислота
Основание
+
3
HO
H2O + H
+
Основание
Кислота
Кис
лота
Осно
вание
Сопряж.
осн-е
Сопряж.
К-та
12.
7. Количественно сила кислотпротолитов оценивается величинойконстанты кислотности (Ка).
Ка характеризует момент химического
равновесия
в
процессе
переноса
протона и определяется на основании
закона действующих масс.
13.
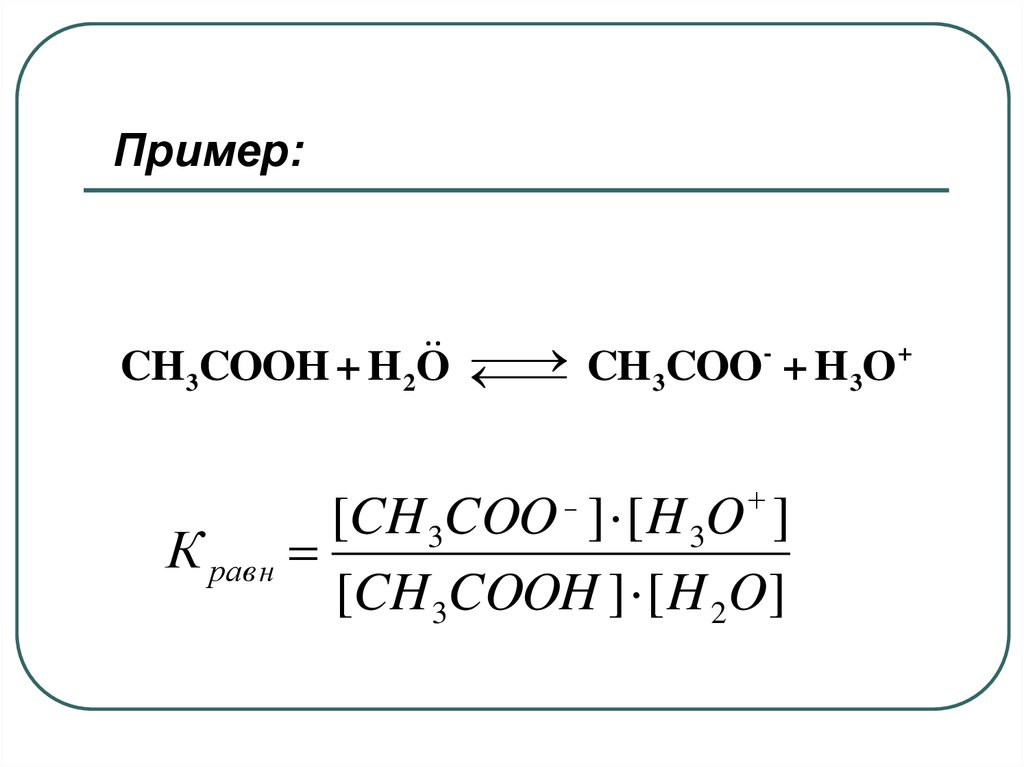
Пример:+
CH 3COOH + H 2O
CH
COO
+
H
O
3
3
[CH 3COO ] [ H 3O ]
К равн
[CH 3COOH ] [ H 2O]
14.
К а К равн [ H 2O]Таким образом, чем выше
концентрация сопряженных частиц
продуктов протонного переноса, тем
больше значение Ка, а значит тем
сильнее кислота-протолит.
15.
Напрактике
используют
показатель константы кислотности
(pKa):
pK a = - lgK a
Чем меньше значение pKa, тем
сильнее кислота.
16.
Кислотным центром называетсяэлемент (С, S, O, N) и связанный с ним
атом водорода.
Органические кислоты
соответственно классифицируются по
кислотному центру на
О-Н; S-H; N-H; C-H кислоты.
17.
Формулы и названия веществрКа
18
10,5
30
9,9
С2Н5ОН
С2Н5SH
С2Н5NH2
С6Н5ОН
этанол
этантиол
этанамин
фенол
Чем больше значение рКа, тем слабее
кислота.
18.
На стабильность аниона оказываютвлияние следующие факторы:
1. Природа элемента в кислотном
центре.
а) электроотрицательность
элемента
Сравним кислотные свойства веществ с
одинаковыми радикалами:
СН3–СН2 –ОН (рКа=18)
СН3–СН2 –NH2 (рКа=30).
19.
кислород болееэлектроотрицательный элемент
связь О-Н более полярна, чем N-H,
что способствует более легкой
отщепляемости в О-Н кислотном
центре по сравнению с N-H центром.
Амины более слабые кислоты, чем
спирты.
20.
б) поляризуемость элемента вкислотном центре.
Сравним кислотные свойства веществ с
одинаковыми радикалами:
СН3–СН2 –ОН (рКа=18)
СН3–СН2 –SH (рКа=10,5).
21.
Благодаря большему радиусу иболее высокой поляризуемости атома
серы, отрицательный заряд в анионе
СН3–СН2–S- (меркаптид-ион)
делокализован в большем объёме, чем
в алкоксид-ионе СН3–СН2–О-.
Это обусловливает более высокую
стабильность меркаптид-иона по
сравнению с алкоксид-ионом.
Этантиол является более сильной
кислотой, чем этанол.
22.
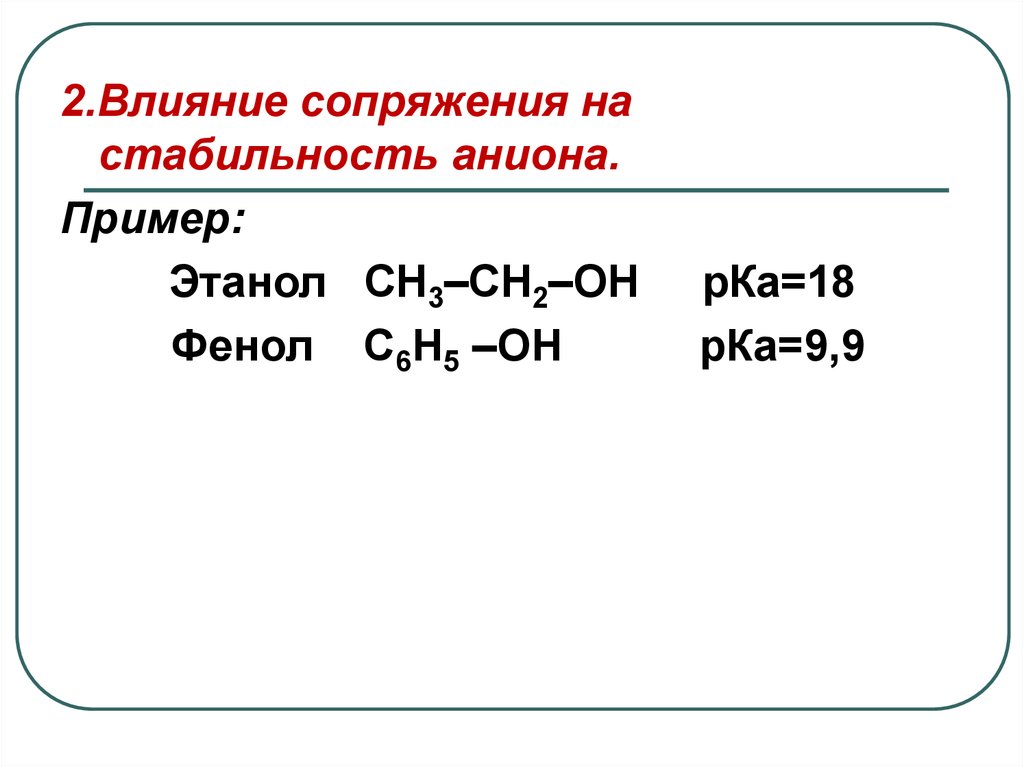
2.Влияние сопряжения настабильность аниона.
Пример:
Этанол СН3–СН2–ОН
Фенол С6Н5 –ОН
рКа=18
рКа=9,9
23.
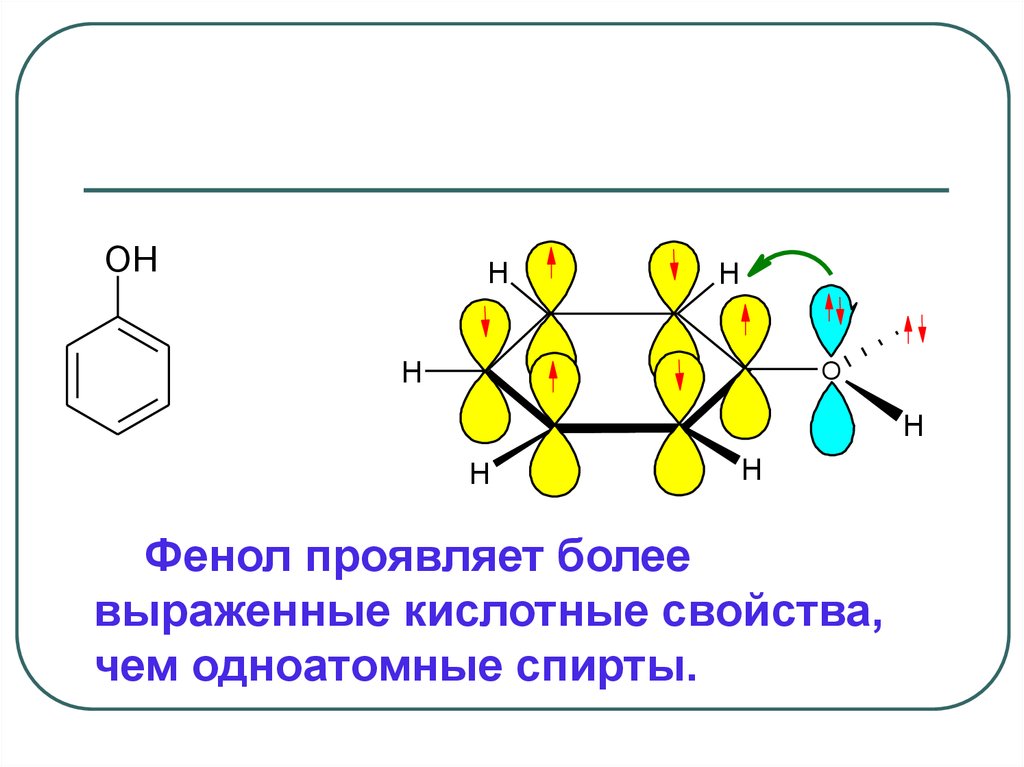
В молекуле фенола под влияниемЭД-заместителя электронная плотность
смещена от заместителя и
делокализована по ароматическому
кольцу.
Образующийся при отщеплении иона
Н+ феноксид-ион С6 Н5–О- , является
р, -сопряжённой системой и обладает
высокой стабильностью.
24.
OHH
H
.
O
H
H
H
H
Фенол проявляет более
выраженные кислотные свойства,
чем одноатомные спирты.
25.
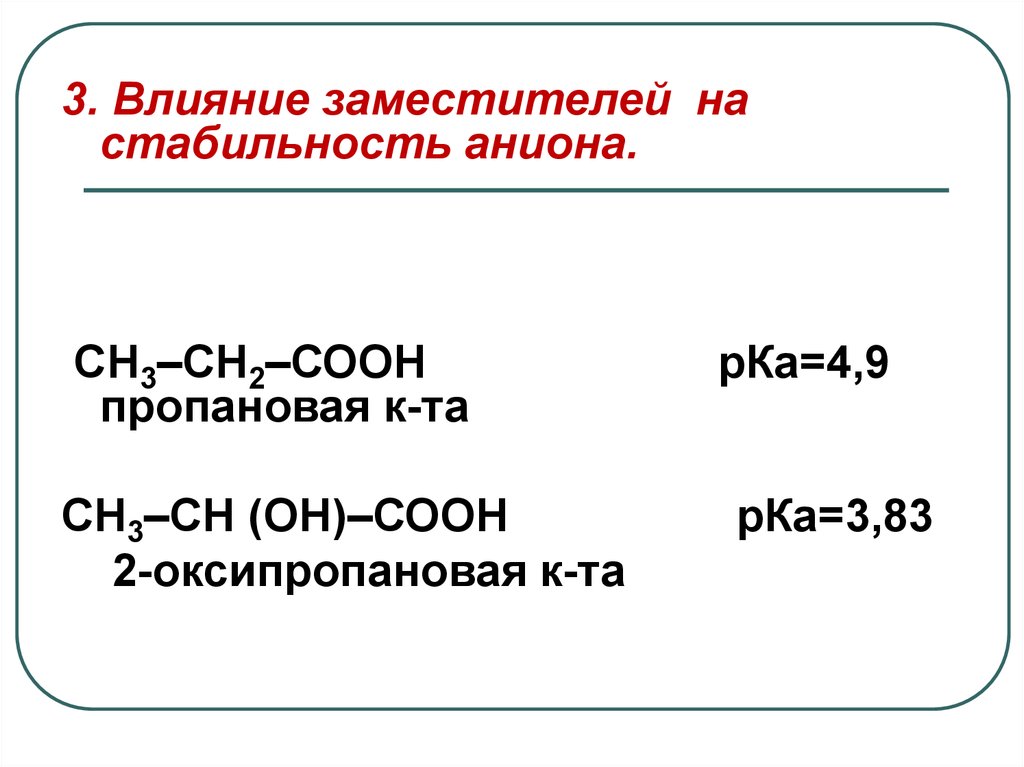
3. Влияние заместителей настабильность аниона.
СН3–СН2–СООН
пропановая к-та
СН3–СН (ОН)–СООН
2-оксипропановая к-та
рКа=4,9
рКа=3,83
26.
Наличие в радикале кислоты ЭАзаместителя –ОН-группы
способствует делокализации
отрицательного заряда в лактатанионе, что повышает его
стабильность по сравнению с
пропионат-анионом.
ЭА-заместители усиливают
кислотность, а
ЭД - снижают.
27.
4. Влияние растворителя настабильность аниона.
Чем меньше радикал аниона, тем
он более гидратирован и стабилен.
Муравьиная кислота
рКа=3,7
Уксусная кислота
рКа=4,76
Пропионовая кислота
рКа=4,90
Так как формиат-ион имеет малые
размеры, он наиболее гидратирован
и стабилен, по сравнению с ацетатионом и пропионат- ионом.
28.
Спасибо завнимание!


















 chemistry
chemistry








