Similar presentations:
Типы химических реакций
1. 1. Реакции в органической химии 2. Сопряжение. Электронные эффекты заместителей. 3. Кислотность органических соединений
Типы химических реакций1. Реакции в органической
химии
2. Сопряжение. Электронные
эффекты заместителей.
3. Кислотность органических
соединений (самостоятельно)
Лектор: кандидат биологических наук,
доцент Мицуля Татьяна Петровна
1
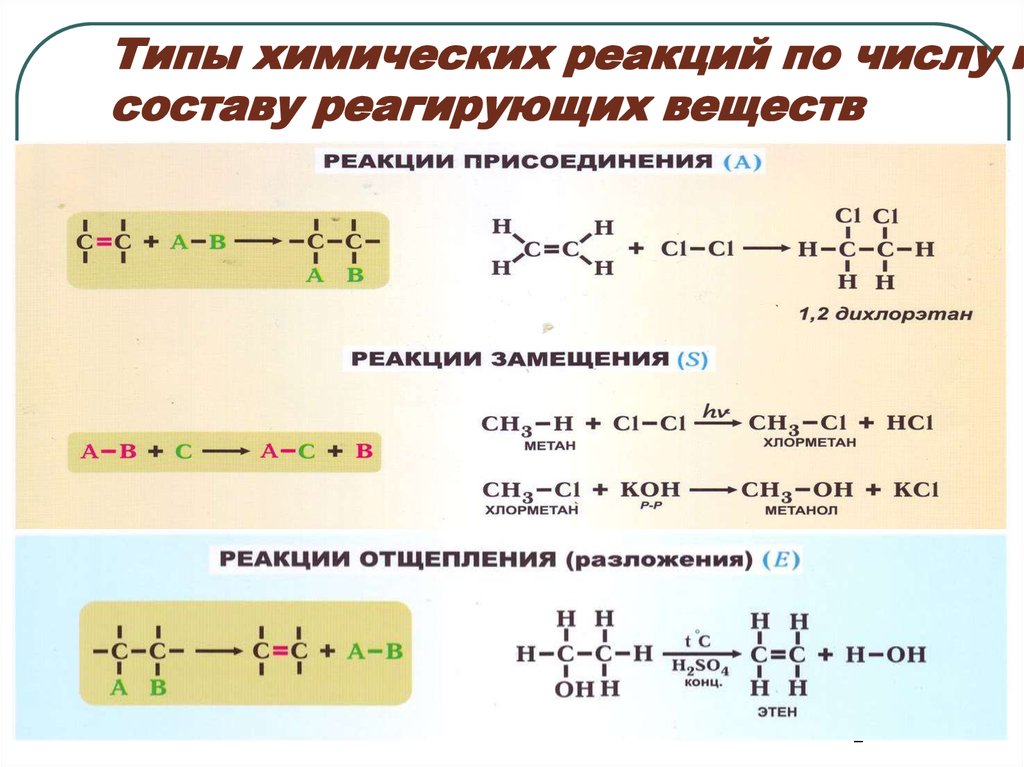
2. Типы химических реакций по числу и составу реагирующих веществ
23. Типы химических реакций по числу и составу реагирующих веществ
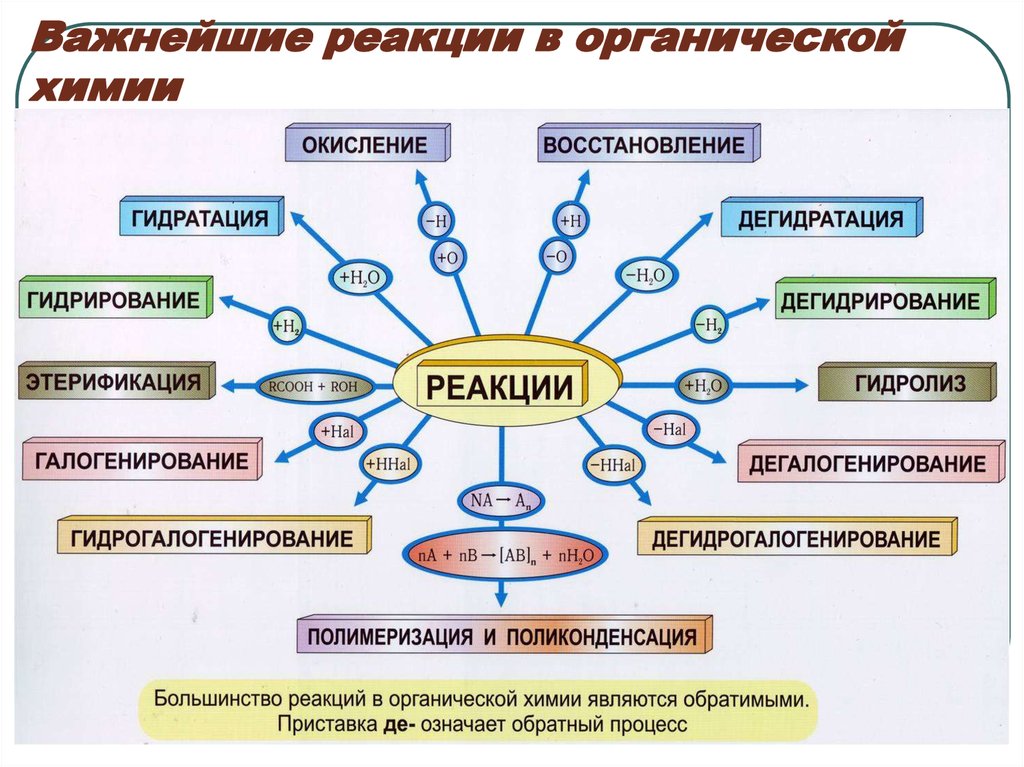
34. Важнейшие реакции в органической химии
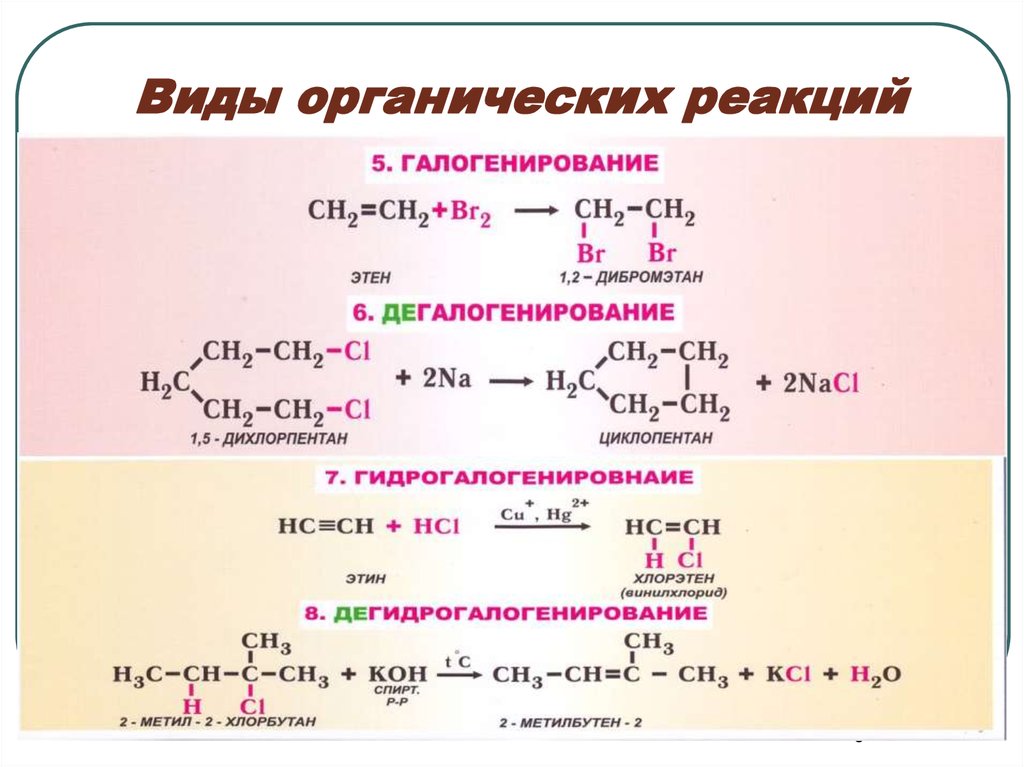
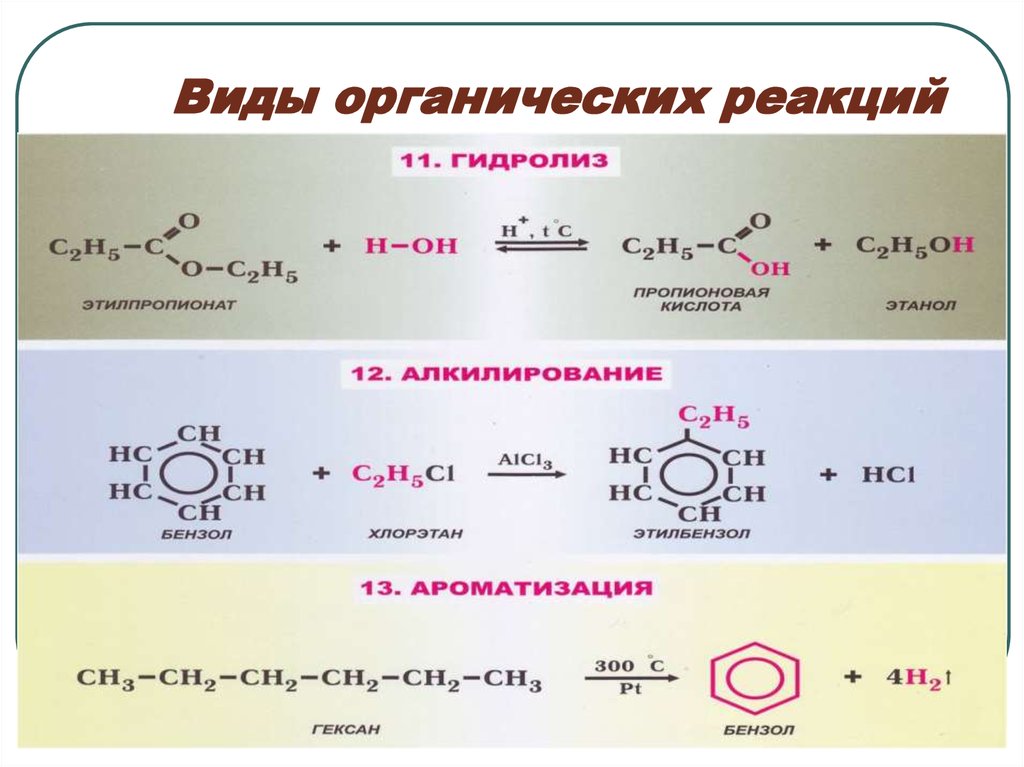
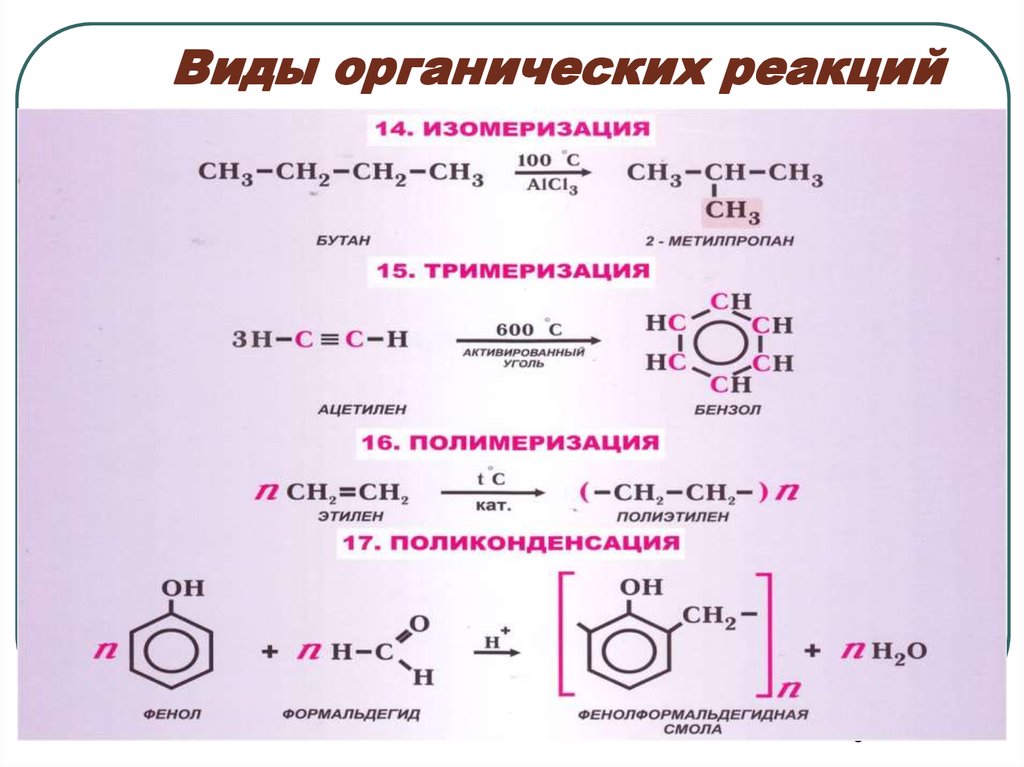
45. Виды органических реакций
56. Виды органических реакций
67. Виды органических реакций
78. Виды органических реакций
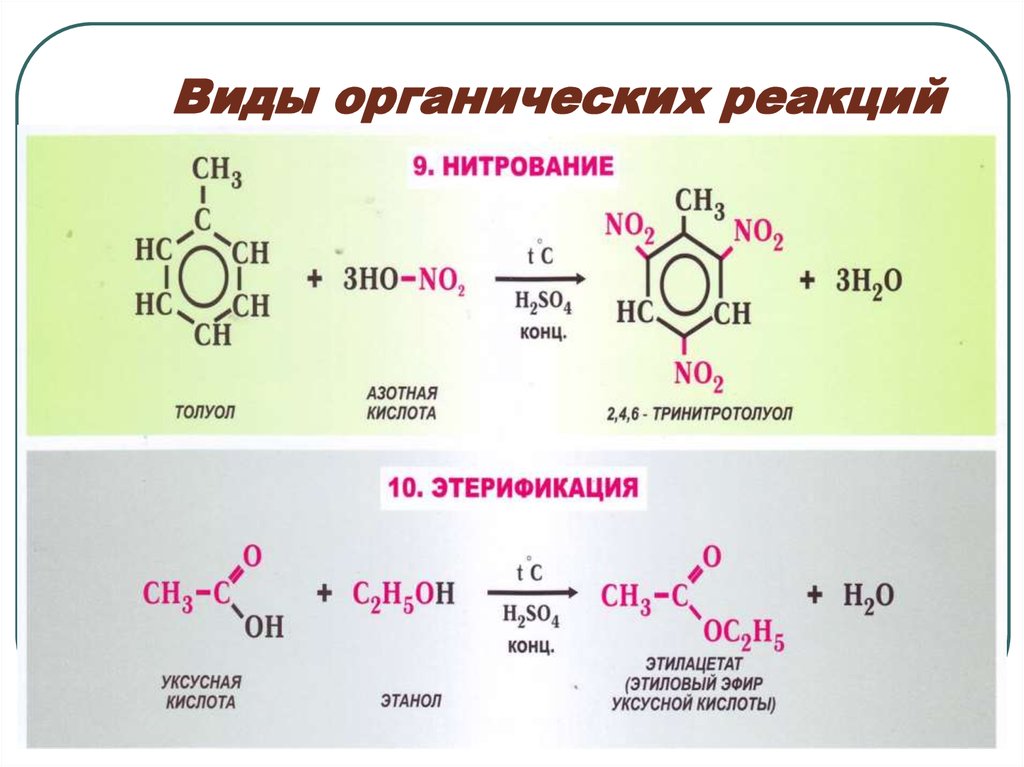
89. Виды органических реакций
910. Виды органических реакций
1011. 2. Сопряжение
В молекулах органических соединенийвозникают различные электронные эффекты,
сопровождающиеся перераспределением
электронной плотности ковалентных связей.
Сопряжение - явление выравнивания
связей и зарядов в реальной молекуле по
сравнению с идеальной, но
несуществующей структурой.
11
12.
Сопряжёнными называются системы счередующимися простыми и кратными
связями или системы, в которых у атома
соседнего с двойной связью есть pорбиталь с неподелённой парой
электронов.
В сопряженных системах возникает
делокализованная связь, молекулярная
орбиталь которой охватывает более двух
атомов.
Сопряжённые системы бывают с
открытой и замкнутой цепью сопряжения.
12
13.
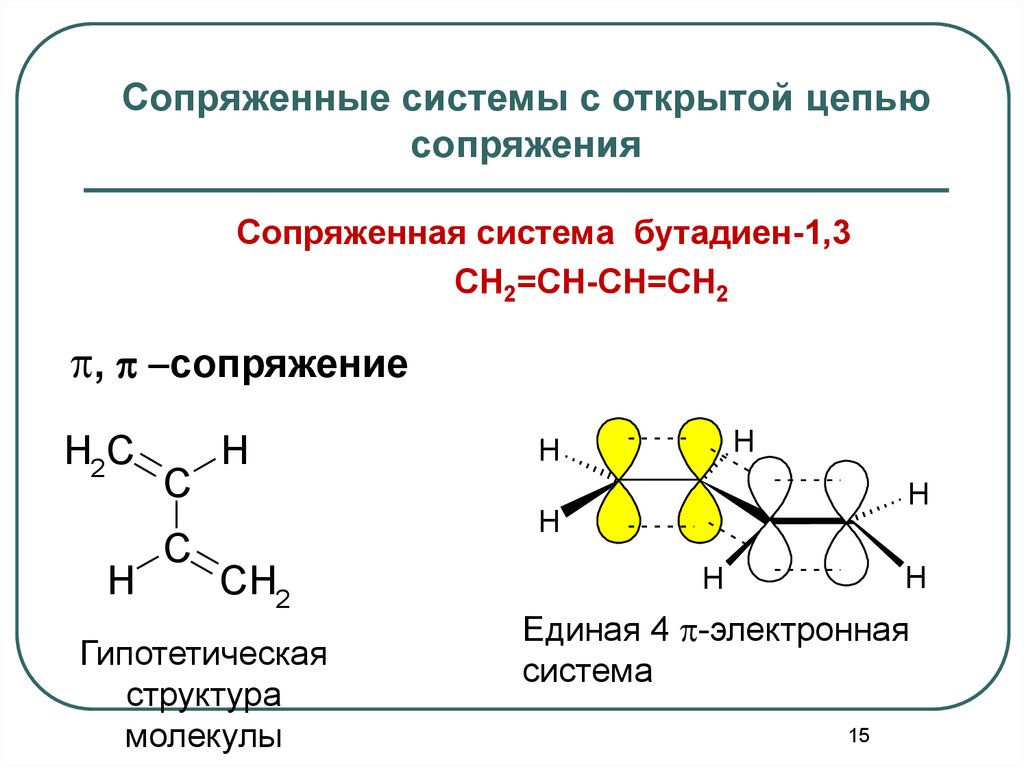
Различают 2 основных видасопряжения:
π-π - сопряжение и
p-π – сопряжение.
π-π – сопряженная система – это
система с чередующимися
одинарными и кратными связями:
CH2 = CH – CH = CH2 бутадиен-1,3
13
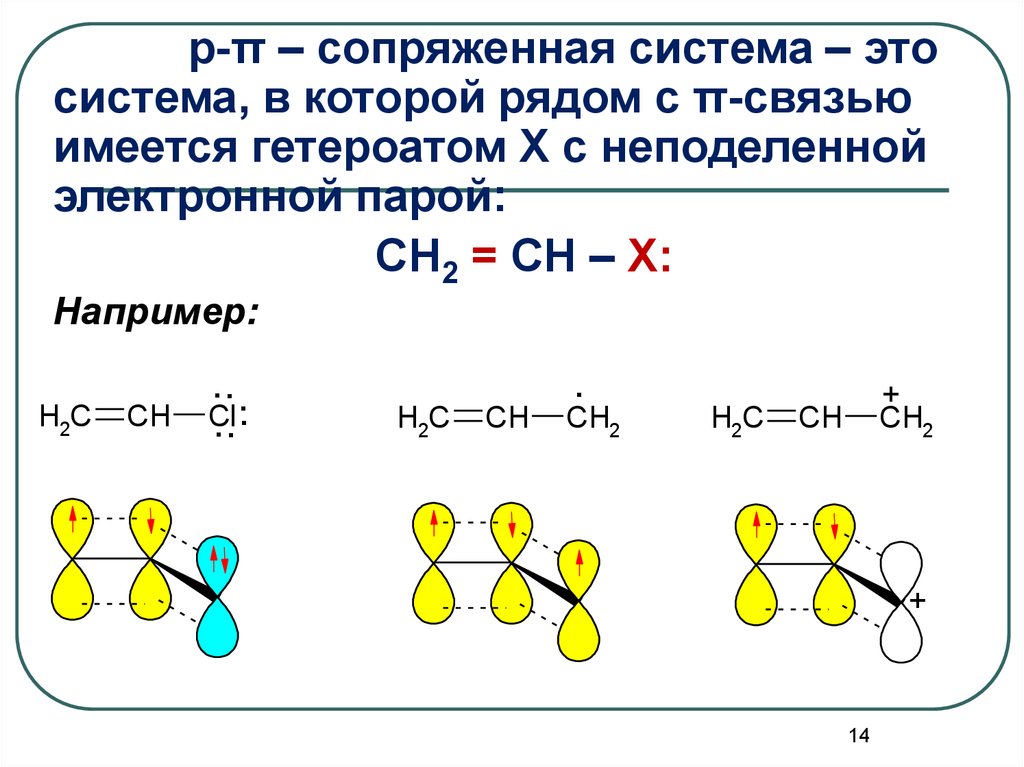
14.
p-π – сопряженная система – этосистема, в которой рядом с π-связью
имеется гетероатом X с неподеленной
электронной парой:
CH2 = CH – X:
Например:
H2C
CH
...
Cl
...
H2C
CH
.
CH2
H2C
+
CH2
CH
+
14
15.
Сопряженные системы с открытой цепьюсопряжения
Сопряженная система бутадиен-1,3
CH2=CH-CH=CH2
p, p -сопряжение
H2C
H
C
C
H
H
H
H
H
CH2
Гипотетическая
структура
молекулы
H
H
Единая 4 p-электронная
система
15
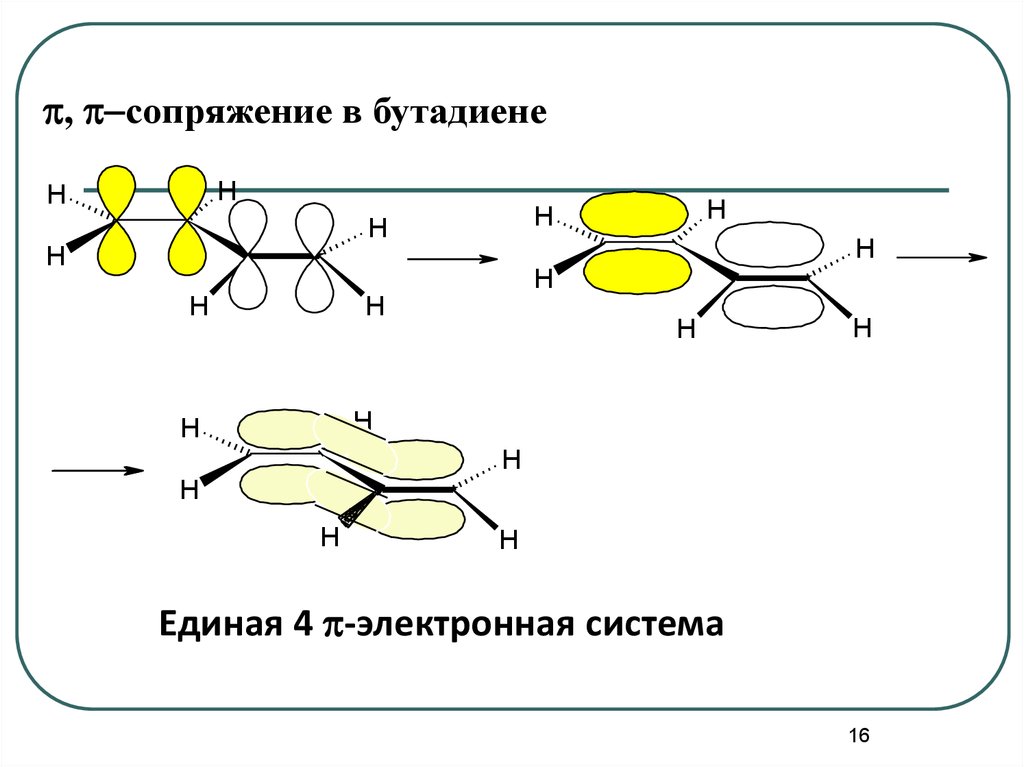
16.
p, p-сопряжение в бутадиенеH
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
Единая 4 p-электронная система
16
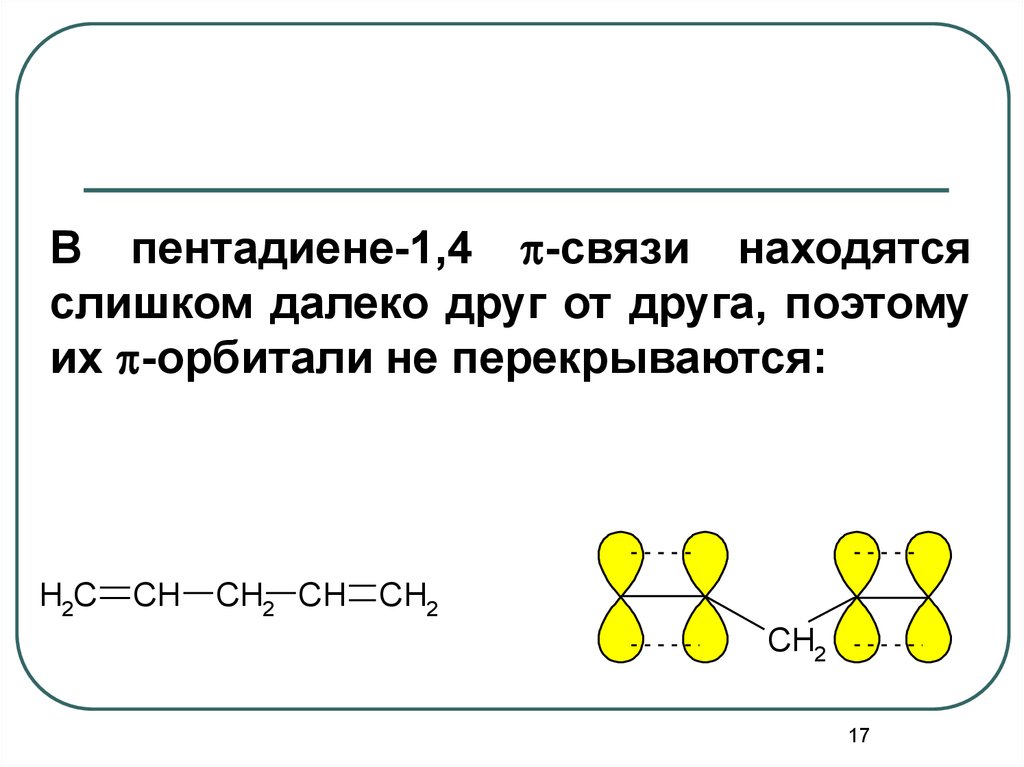
17.
В пентадиене-1,4 p-связи находятсяслишком далеко друг от друга, поэтому
их p-орбитали не перекрываются:
H2C
CH
CH2 CH
CH2
CH2
17
18.
Система сопряжения может включать игетероатом (О, N, S).
π-π-сопряжение c гетероатомом в цепи
осуществляется в карбонильных
соединениях, например акролеине:
СН2 = СН - СН= О
Цепь сопряжения включает три
sp2-гибридизированных атома углерода и
атом кислорода, каждый из которых вносит
в единую 4π-электронную систему по
одному р-электрону.
18
19.
π-π-СопряжениеH2C
π-Орбиталь
O
CHCH
19
20.
π-π-СопряжениеH2C
O
CHCH
20
π-Орбиталь карбонильной группы
21.
π-π-СопряжениеH2C
O
CHCH
21
Единая 4 π-электронная система
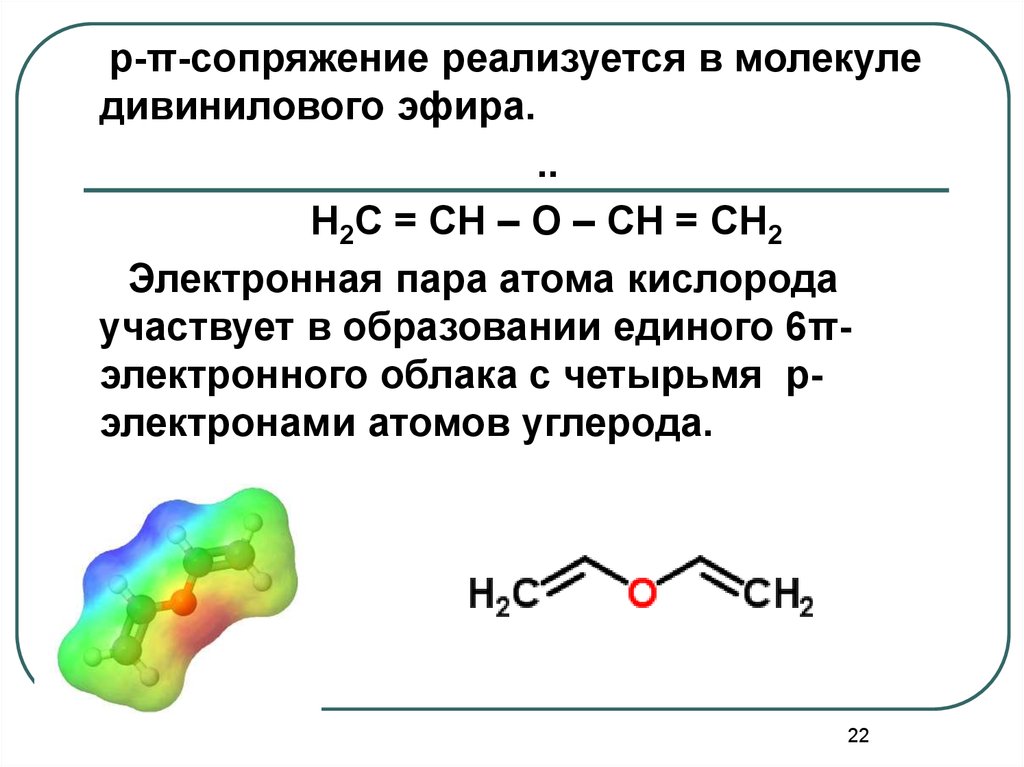
22.
p-π-сопряжение реализуется в молекуледивинилового эфира.
..
H2C = CH – O – CH = CH2
Электронная пара атома кислорода
участвует в образовании единого 6πэлектронного облака с четырьмя рэлектронами атомов углерода.
22
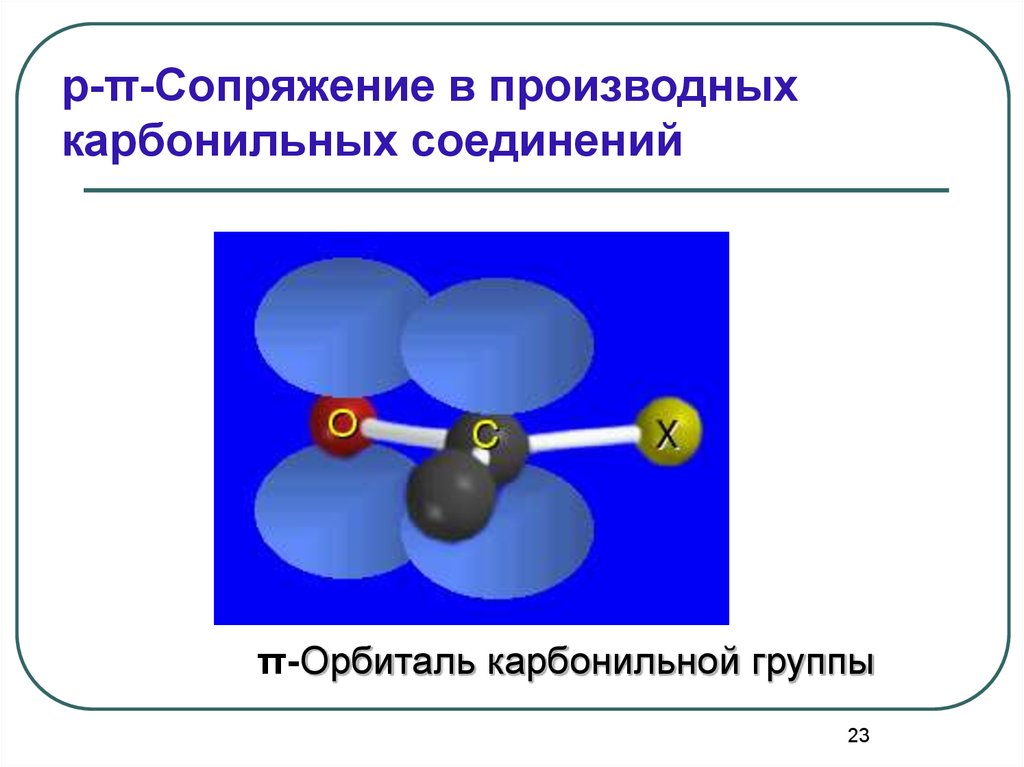
23.
p-π-Сопряжение в производныхкарбонильных соединений
π-Орбиталь карбонильной группы
23
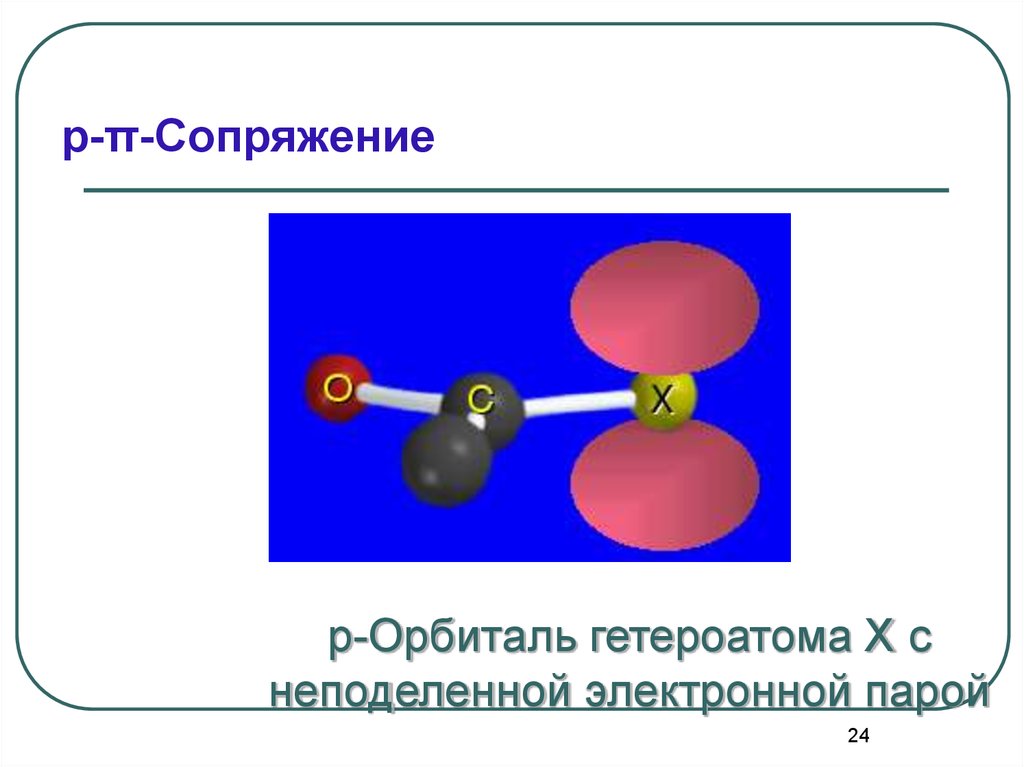
24.
p-π-Сопряжениеp-Орбиталь гетероатома X с
неподеленной электронной парой
24
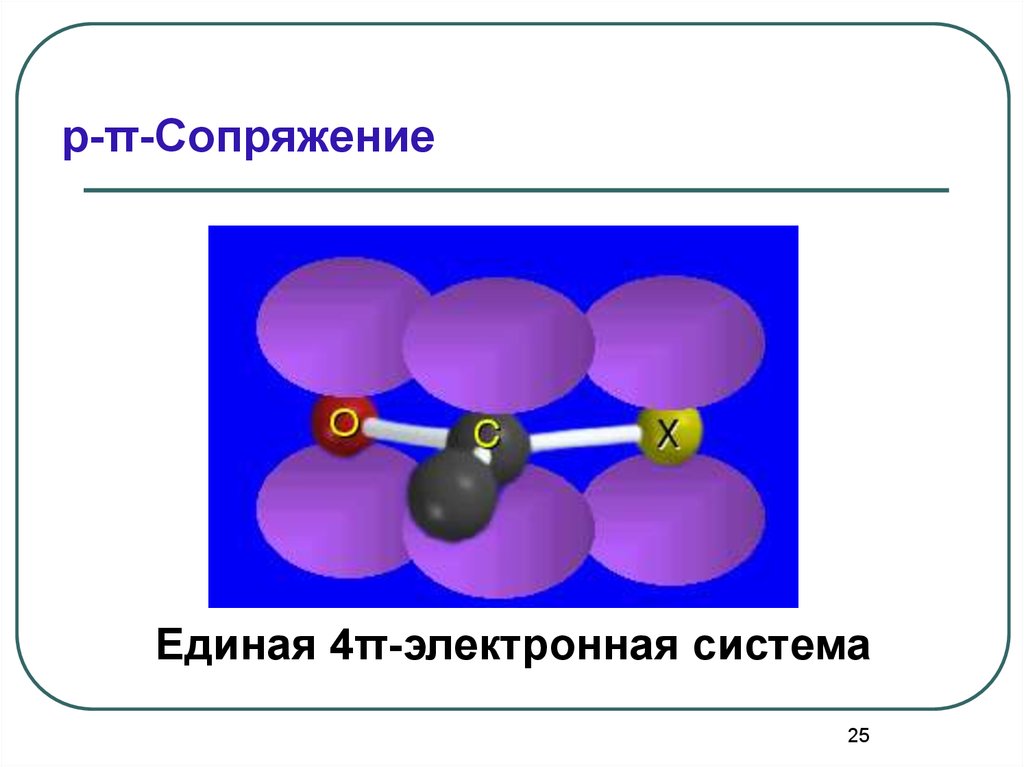
25.
p-π-СопряжениеЕдиная 4π-электронная система
25
26.
Сопряжённые системы с замкнутой цепьюсопряжения
sp2-Гибридные
π-π-сопряжение
орбитали участвуют в
реализуется в молекуле
Н
образовании σбензола.
связей.
Длина
связи С-С - 0,140нм
Н
Н
Н
Н
Н
26
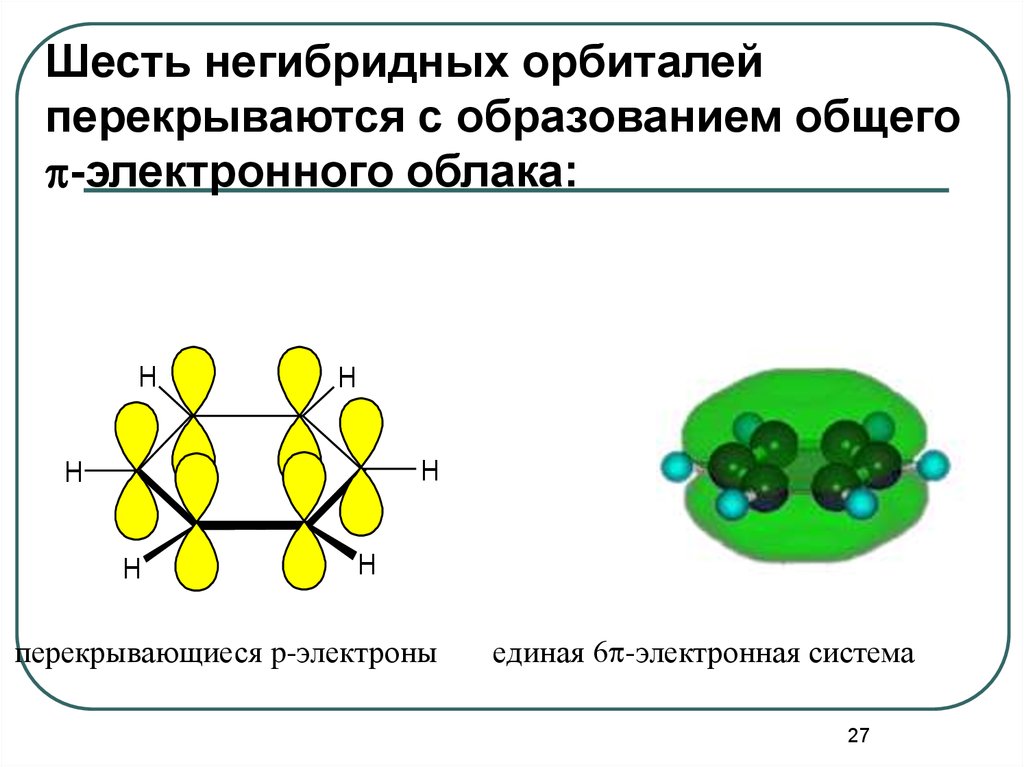
27.
Шесть негибридных орбиталейперекрываются с образованием общего
p-электронного облака:
H
H
H
H
H
H
перекрывающиеся p-электроны
единая 6p-электронная система
27
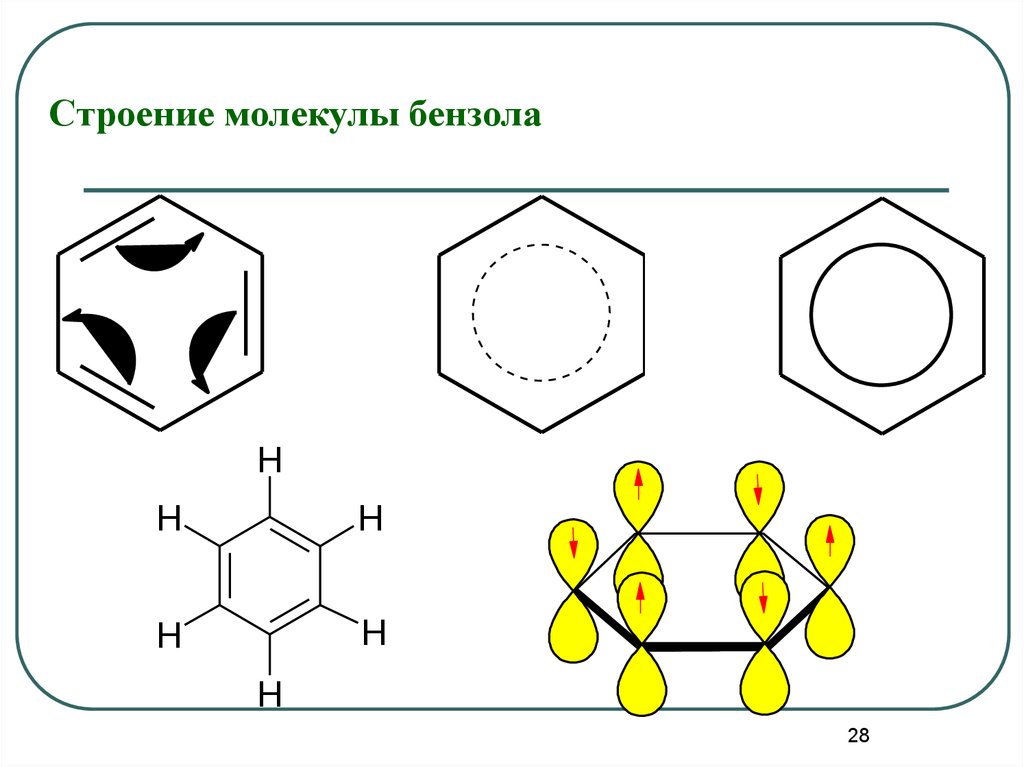
28.
Строение молекулы бензолаH
H
H
H
H
H
28
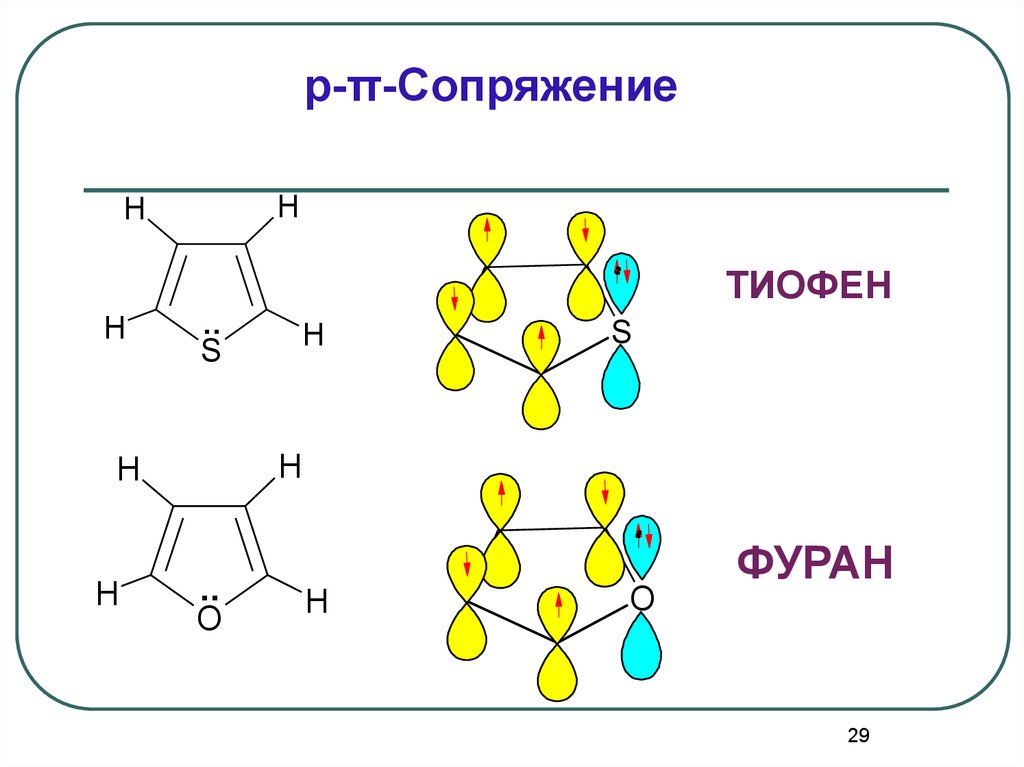
29.
p-π-СопряжениеH
H
.
H
..
S
H
ТИОФЕН
S
H
H
.
H
..
O
H
O
ФУРАН
29
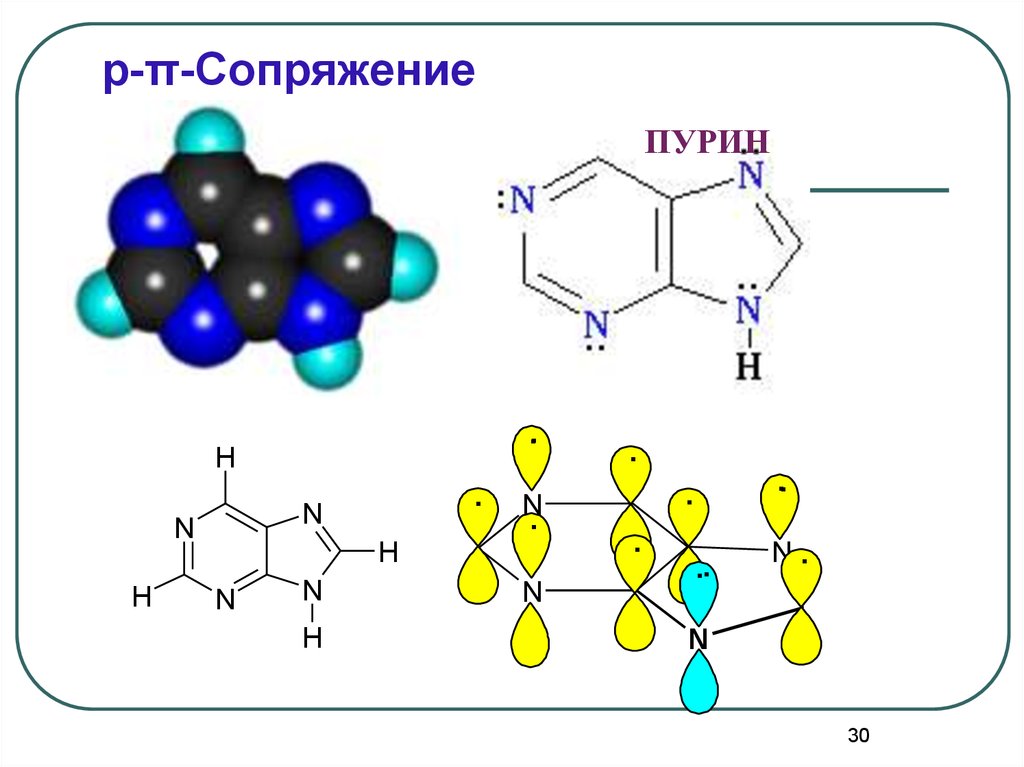
30.
p-π-СопряжениеПУРИН
.
H
N
N
H
.
N.
H
N
N
H
N
.
.
.
.
..
N.
N
30
31.
Ароматическими называютциклические
соединения, имеющие замкнутую
сопряженную
систему, единое π-электронное
облако в
которых делокализовано на всех
атомах цикла.
31
32. Ароматичность
Бензол С6Н6 являетсяароматическим соединением,
т.к. отвечает критериям
ароматичности .
Хюккель
Эрих Хюккель
1896-1980
32
33.
Критерии ароматичности1. Молекула имеет циклическое строение.
2. Все атомы цикла находятся в состоянии
sp2-гибридизации, образуя плоский σскелет молекулы, перпендикулярно к
которому располагаются р-орбитали
атомов.
3. Существует единая π-электронная
система, охватывающая все атомы
цикла и содержащая по правилу
Хюккеля (4n+2) - π электрона = 6 π е-,
где n-натуральный ряд чисел
33
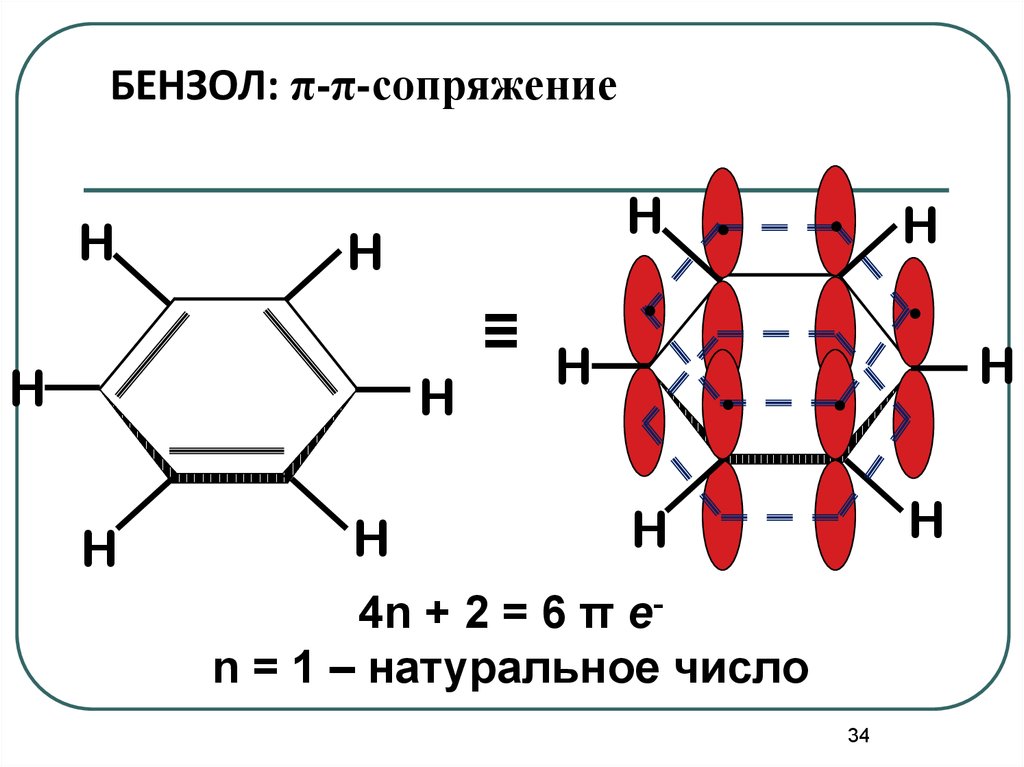
34.
БЕНЗОЛ: π-π-сопряжениеH
H
H
≡
H
H
H
H
.
.
H
.
H
.
.
H
.
H
H
4n + 2 = 6 π еn = 1 – натуральное число
34
35.
Нафталин С10Н84n+2 = 10
n=2
35
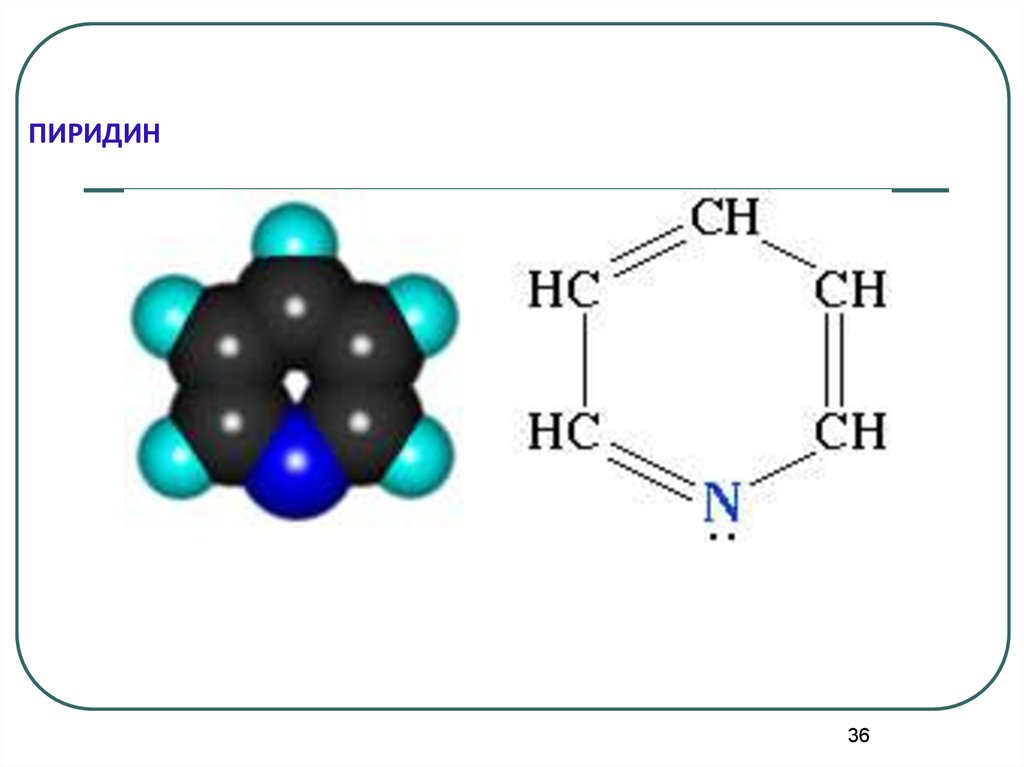
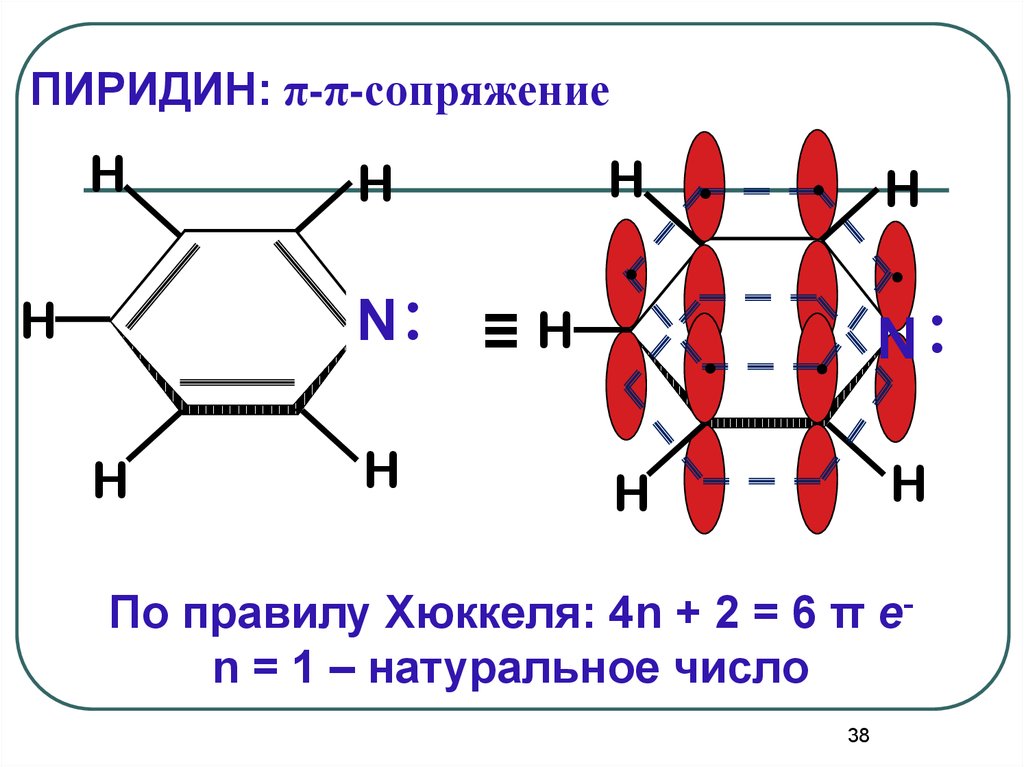
36. ПИРИДИН
3637.
Пиридин отвечает критериям ароматичности:1. Молекула имеет циклическое строение.
2. Все атомы цикла находятся в состоянии
sp2гибридизации, образуя плоский σ-скелет молекулы,
перпендикулярно к которому располагаются р-орбитали
атомов.
3. Существует единая π-электронная система,
охватывающая все атомы цикла и содержащая по
правилу Хюккеля
(4n+2) - π электрона=6 πе37
38.
ПИРИДИН: π-π-сопряжениеH
N:
H
H
H
H
H
.
.
≡H
.
H
.
.
. N:
H
H
По правилу Хюккеля: 4n + 2 = 6 π еn = 1 – натуральное число
38
39.
Атом азота поставляет всопряженную цепь один электрон и
сохраняет пару электронов вне
сопряженной цепи.
За счет этой электронной пары
пиридин проявляет свойства
органического основания-протолита,
т.к. способен присоединять протон по
донорно-акцепторному механизму с
образованием пиридиний-катиона.
39
40.
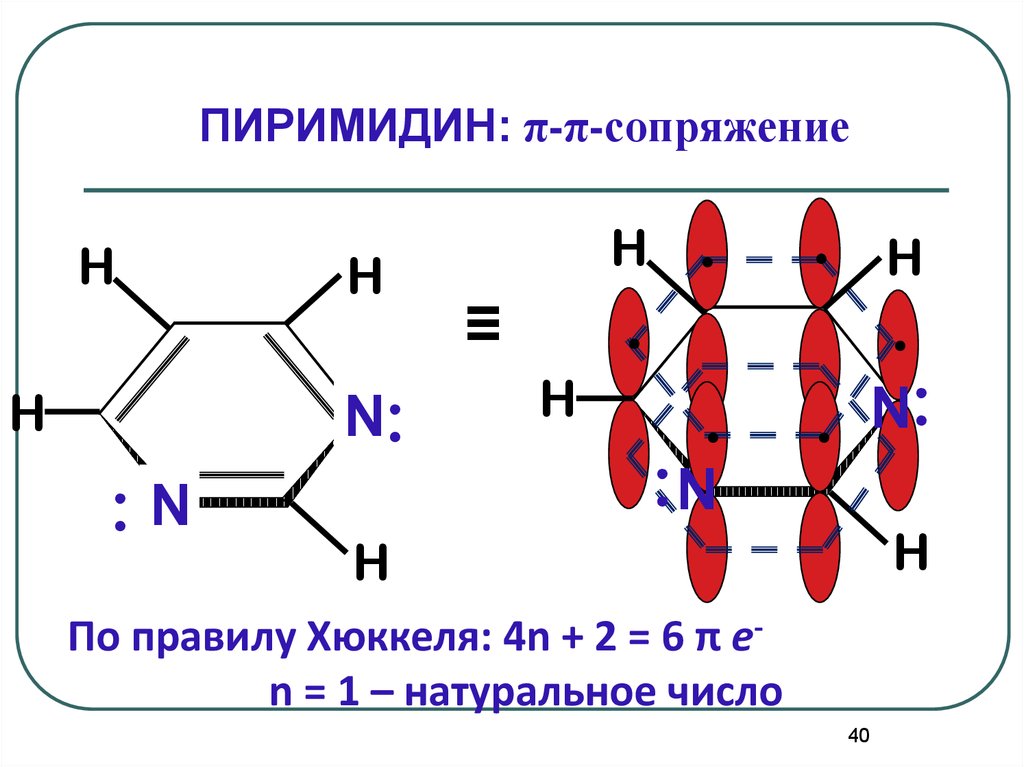
ПИРИМИДИН: π-π-сопряжениеH
H
N:
H
:N
H
.
.
.
.
. N:
.
≡
H
:N
H
H
H
По правилу Хюккеля: 4n + 2 = 6 π еn = 1 – натуральное число
40
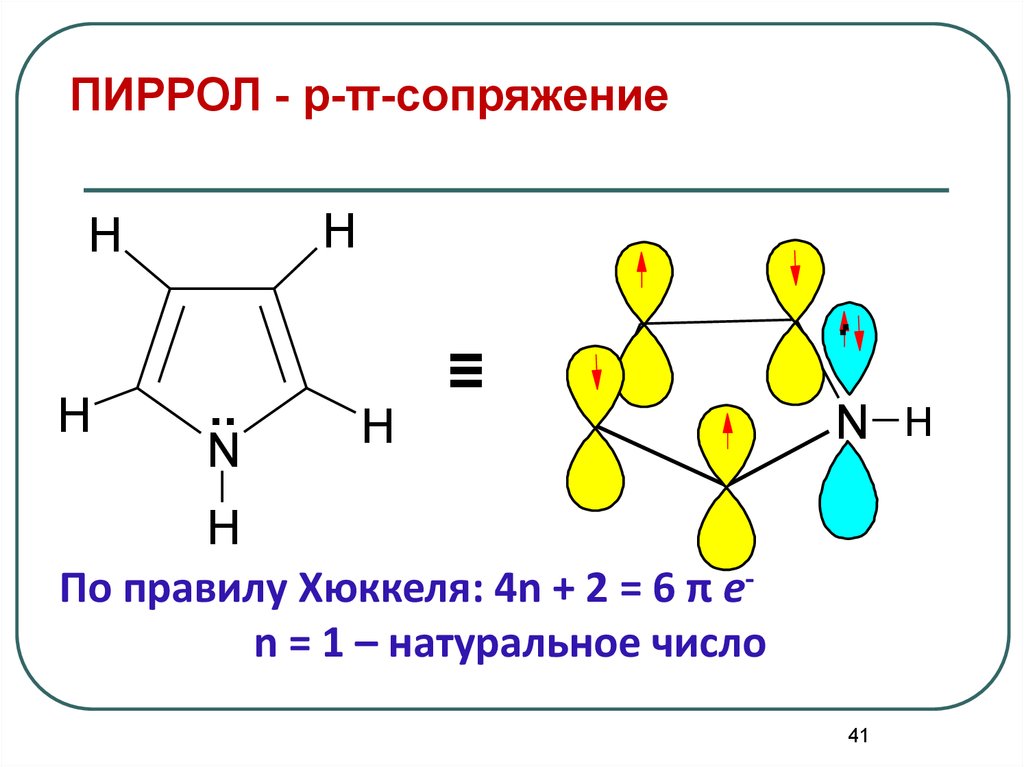
41. ПИРРОЛ - p-π-сопряжение
HH
H
..
N
≡
H
.
N H
H
По правилу Хюккеля: 4n + 2 = 6 π еn = 1 – натуральное число
41
42.
2. Электронные эффектызаместителей
Взаимное влияние атомов в молекуле
может осуществляться по системе δсвязей (индуктивный эффект), по
системе p-связей (мезомерный эффект).
42
43.
Индуктивный эффект (I-эффект) –смещение электронной плотности по
цепи δ-связей, которое обусловлено
различиями в
электроотрицательностях атомов:
H3C
CH2
CH2 CH2
CH2
43
F
44.
Индуктивный эффект обозначаютбуквой I и графически изображают
стрелкой, остриё которой направлено в
сторону более ЭО элемента.
Действие индуктивного эффекта
наиболее сильно проявляется на двух
ближайших атомах углерода, а через 3-4
связи он затухает.
44
45.
–I эффект проявляют заместители,которые содержат атомы с большей ЭО,
чем у углерода: -F, -Cl, -Br, -OH, -NH2, NO2, >C=O, -COOH и др.
Это электроноакцепторные
заместители (ЭА). Они снижают
электронную плотность в углеродной
цепи.
45
46.
+I эффект проявляют заместители,содержащие атомы с низкой
электроотрицательностью: металлы (Mg, -Li); насыщенные углеводородные
радикалы (-CH3, -C2H5) и т.п.
Это электронодонорные (ЭД)
заместители, например, радикалы метил
и этил, металлы натрий, калий и др.
46
47.
Мезомерный эффект – смещениеэлектронной
плотности
по
цепи
сопряженных p-связей. Возникает только
при наличии сопряжения связей.
Действие мезомерного эффекта
заместителей проявляется как в
открытых, так и замкнутых системах.
47
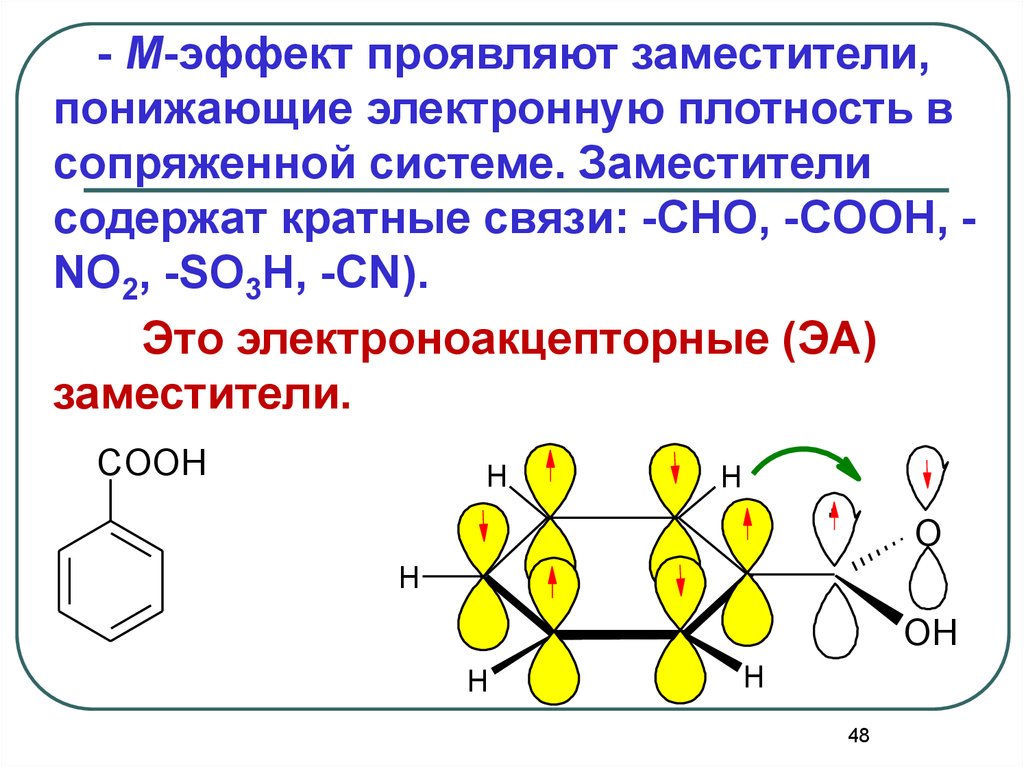
48.
- М-эффект проявляют заместители,понижающие электронную плотность в
сопряженной системе. Заместители
содержат кратные связи: -CHO, -COOH, NO2, -SO3H, -CN).
Это электроноакцепторные (ЭА)
заместители.
COOH
H
H
.
O
H
OH
H
H
48
49.
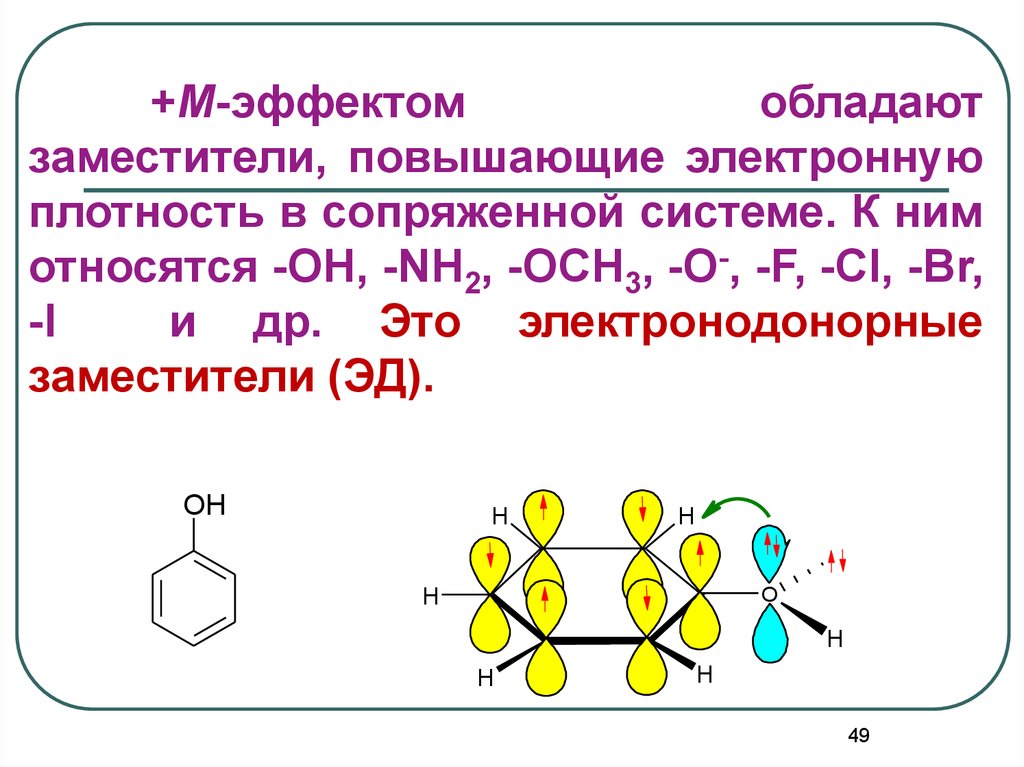
+М-эффектомобладают
заместители, повышающие электронную
плотность в сопряженной системе. К ним
относятся -OH, -NH2, -OCH3, -O-, -F, -Cl, -Br,
-I
и др. Это электронодонорные
заместители (ЭД).
OH
H
H
.
O
H
H
H
H
49
50.
В молекулах органических соединенийиндуктивный и мезомерный эффекты
заместителей, действуют
одновременно.
50
51.
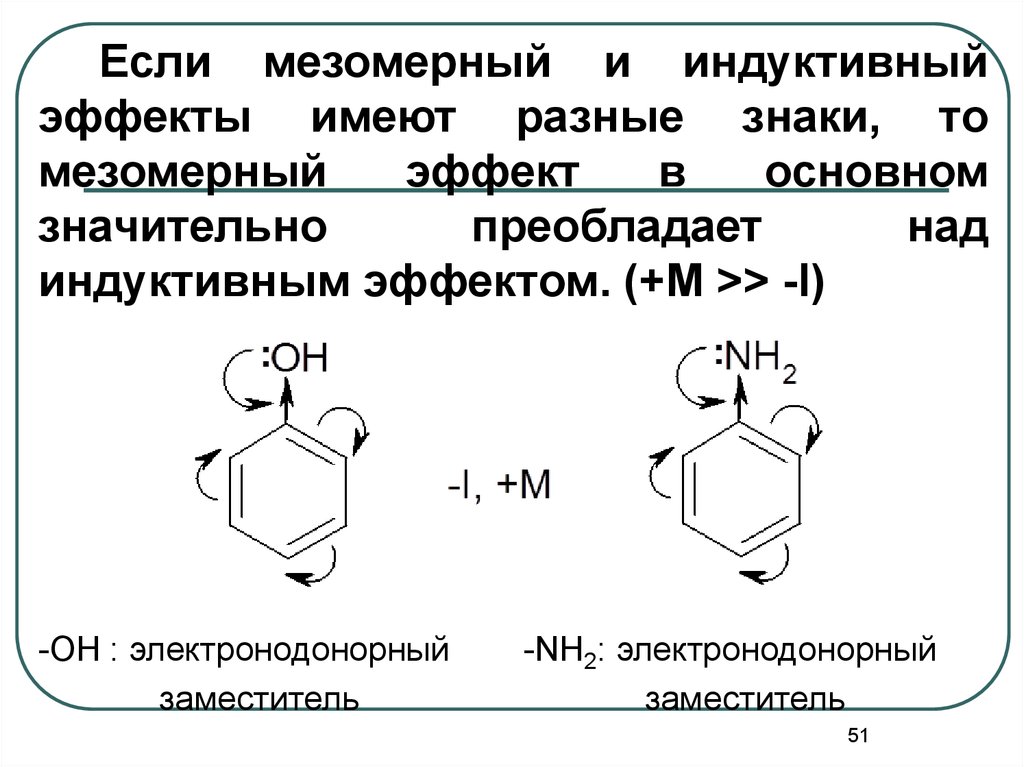
Если мезомерный и индуктивныйэффекты имеют разные знаки, то
мезомерный
эффект
в
основном
значительно
преобладает
над
индуктивным эффектом. (+M >> -I)
-ОН : электронодонорный
заместитель
-NH2: электронодонорный
заместитель
51
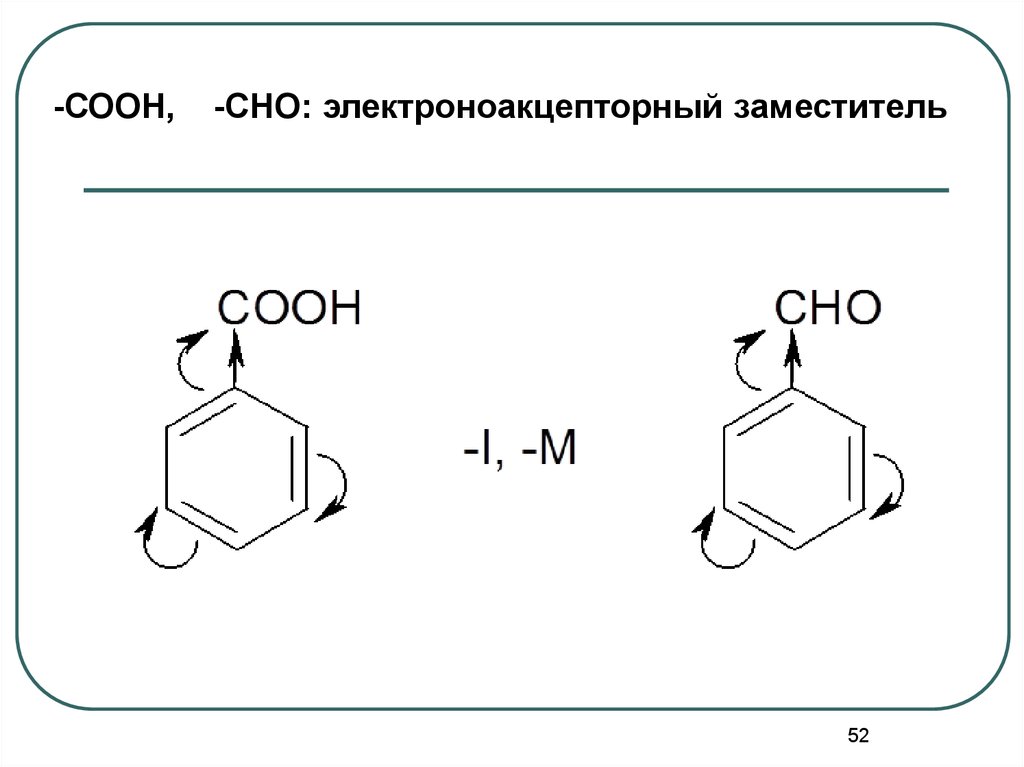
52.
-СООН,-СНО: электроноакцепторный заместитель
52
53.
Таким образом, учитываяперераспределение электронной
плотности в молекулах органических
соединений, в том числе
биологически активных веществ,
можно прогнозировать их свойства.
53
54.
Повышение реактивностиКлассификация заместителей
-NH2, -NHR, -NR2
-OH
-OR
-NHCOCH3
-C6H5
-R
-H
-X
-CHO, -COR
-SO3H
-COOH, -COOR
-CN
-NR3+
-NO2
орто/пара
ориентанты
Мета
ориентанты
54
55.
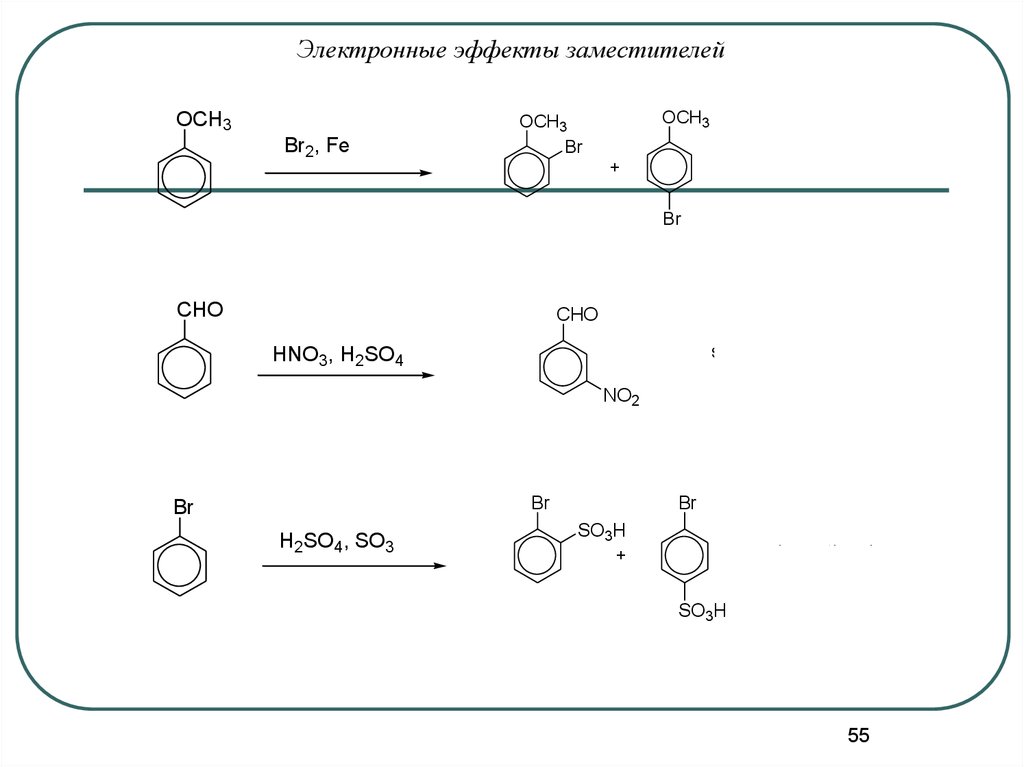
Электронные эффекты заместителейOCH3
Br2, Fe
OCH3
OCH3
Br
faster than benzene
+
Br
CHO
CHO
slower than benzene
HNO3, H2SO4
NO2
Br
Br
H2SO4, SO3
Br
SO3H
+
slower than benzene
SO3H
55
56.
Спасибо завнимание!
56
57. 3. Кислотность органических соединений
Кислотно-основные свойстваорганических веществ
рассматривают, основываясь на
положениях протонной теории
кислот и оснований (БренстедЛоури, 1913 г.).
57
58. Основные положения теории:
1. Кислота – частица (молекула илиион), отдающая протон в данной
реакции, т.е. донор H+.
58
59.
2. Основание – частица (молекула илиион), присоединяющая протон в данной
реакии, т.е. акцептор H+.
59
60. Протолитическая теория кислот и оснований
Основание – частица (молекула или ион),присоединяющая протон в данной
реакии, т.е. акцептор H+.
60
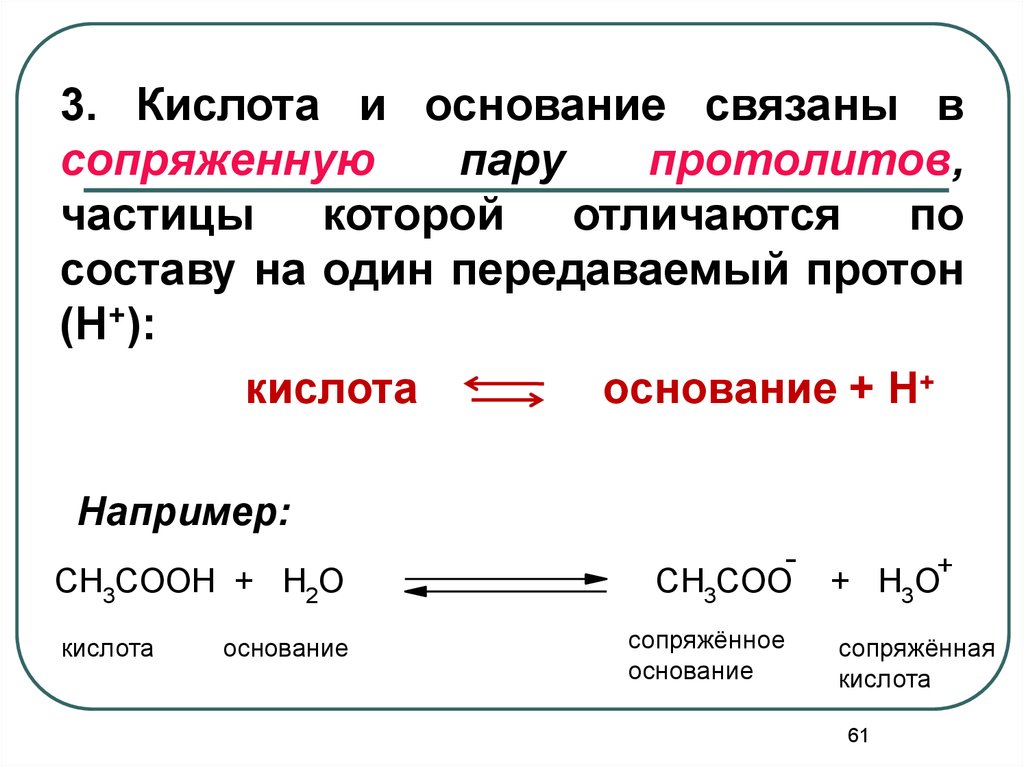
61.
3. Кислота и основание связаны всопряженную
пару
протолитов,
частицы которой отличаются по
составу на один передаваемый протон
(H+):
кислота
основание + Н+
Например:
CH3COOH + H2O
кислота
основание
CH3COO
сопряжённое
основание
+
+ H3O
сопряжённая
кислота
61
62.
Например:Основание (1)
NH 3 + H +
NH 4
Кислота (2)
Кислота (1)
Основание (2)
62
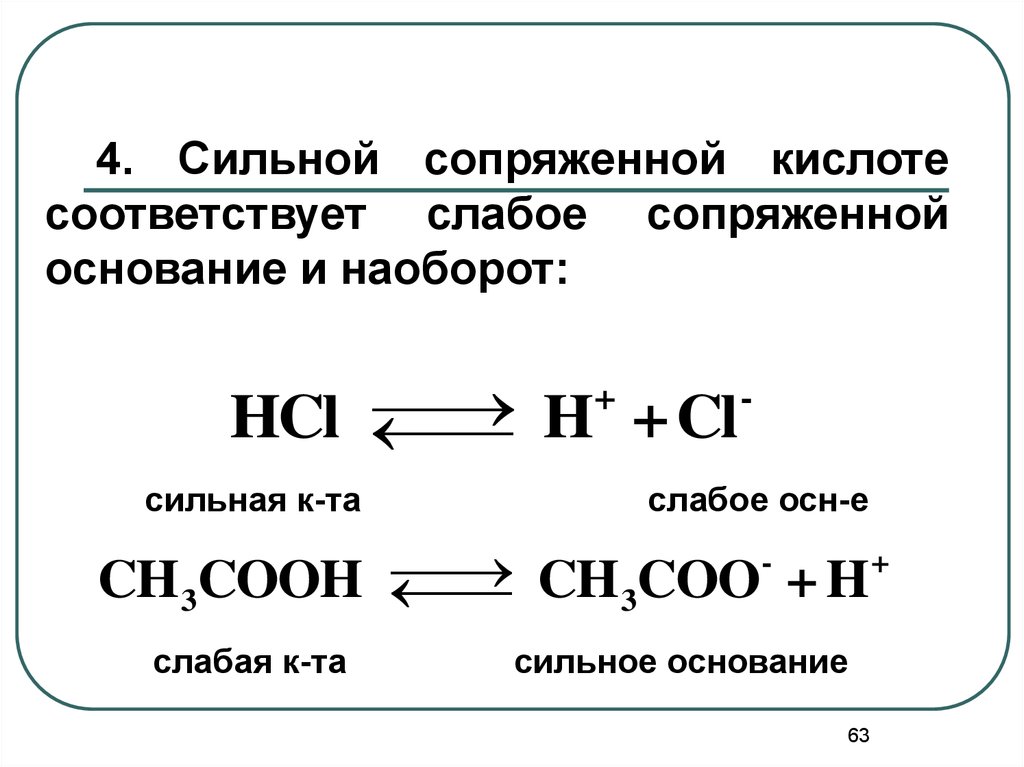
63.
4. Сильной сопряженной кислотесоответствует слабое сопряженной
основание и наоборот:
+
HCl
H + Cl
сильная к-та
слабое осн-е
+
CH3COOH
CH 3COO + H
слабая к-та
сильное основание
63
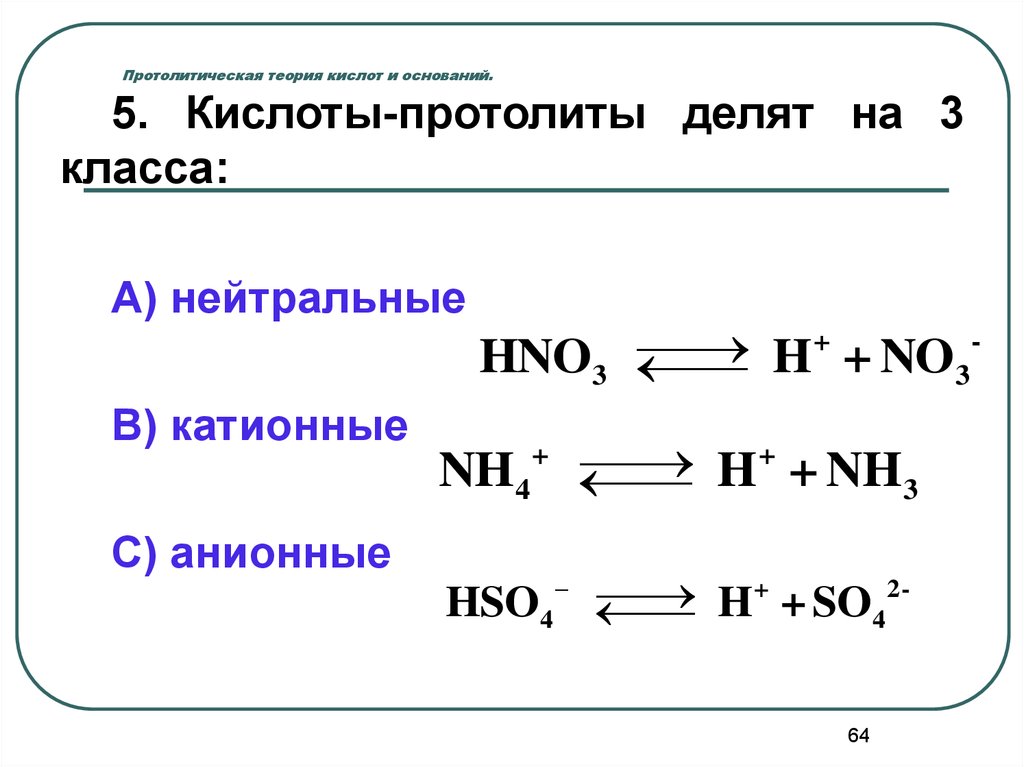
64. Протолитическая теория кислот и оснований.
5. Кислоты-протолиты делят на 3класса:
А) нейтральные
+
HNO3
H + NO3
В) катионные
NH4
+
H + NH 3
+
С) анионные
HSO4
-
+
2
H + SO4
64
65.
Основания-протолиты также делятсяна 3 класса:
A)Нейтральные
B) Катионные
C) Анионные
СН3СОО- + Н+
NH3 + Н+
NH4+
FeOH+
Сl-, CH3COOСН3СООН
65
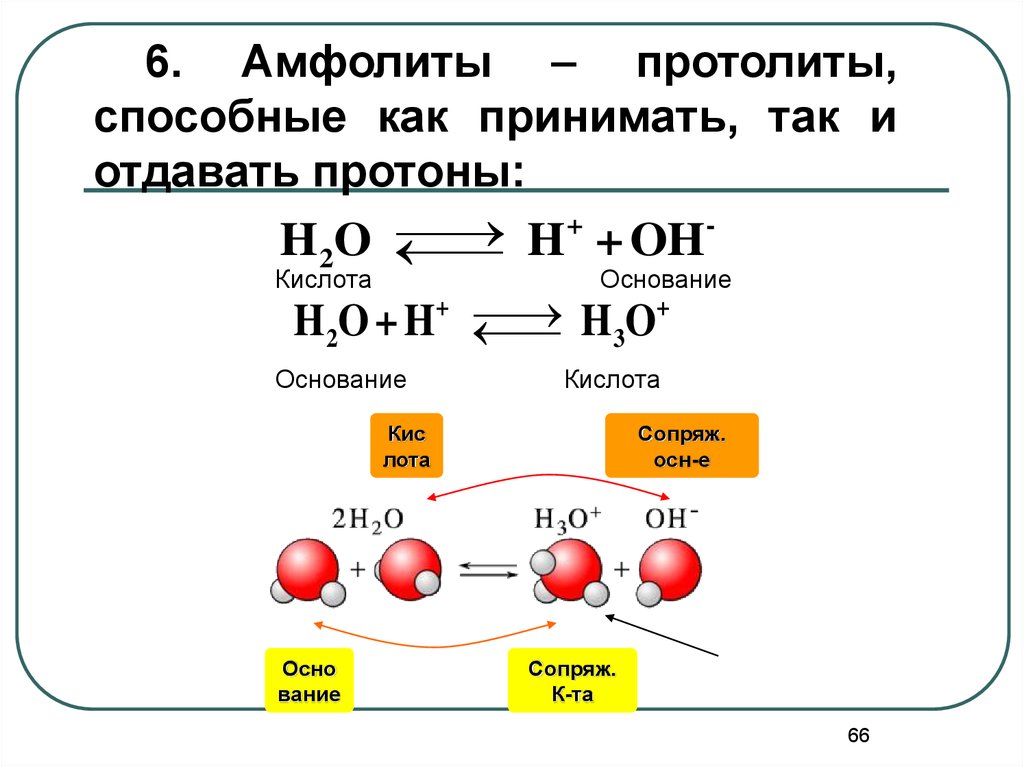
66.
6. Амфолиты – протолиты,способные как принимать, так и
отдавать протоны:
+
H 2O
H
+
OH
Кислота
Основание
+
3
HO
H2O + H
+
Основание
Кислота
Кис
лота
Осно
вание
Сопряж.
осн-е
Сопряж.
К-та
66
67.
7. Количественно сила кислотпротолитов оценивается величинойконстанты кислотности (Ка).
Ка характеризует момент химического
равновесия
в
процессе
переноса
протона и определяется на основании
закона действующих масс.
67
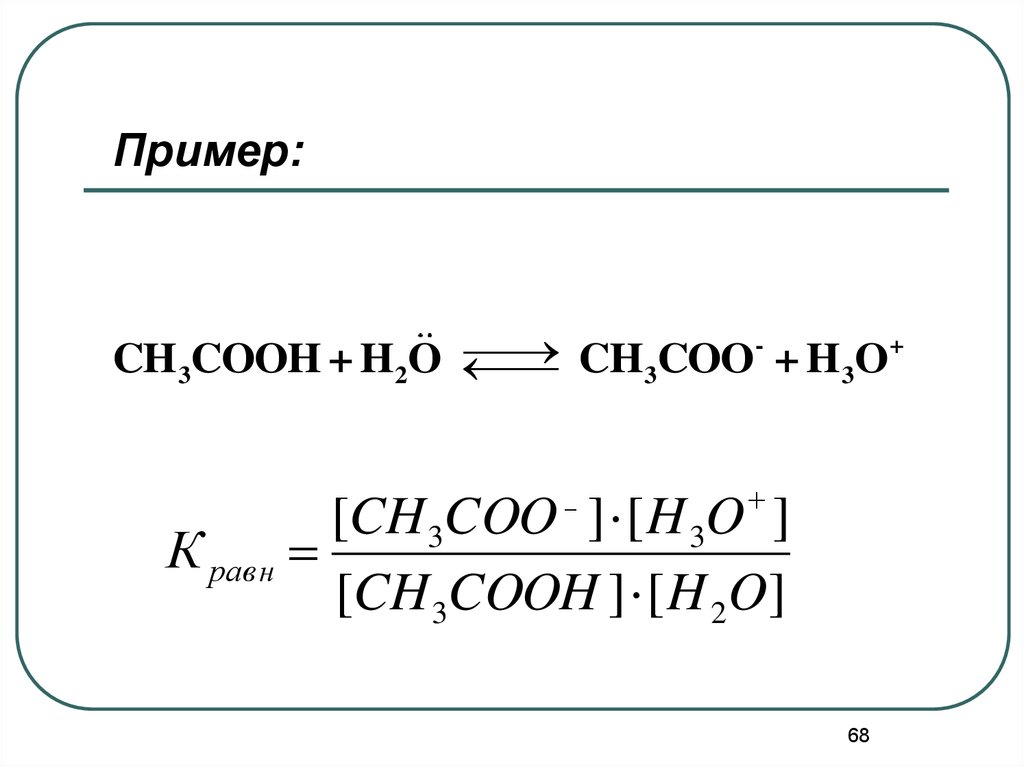
68.
Пример:+
CH 3COOH + H 2O
CH
COO
+
H
O
3
3
[CH 3COO ] [ H 3O ]
К равн
[CH 3COOH ] [ H 2O]
-
68
69.
К а К равн [ H 2O]Таким образом, чем выше
концентрация сопряженных частиц
продуктов протонного переноса, тем
больше значение Ка, а значит тем
сильнее кислота-протолит.
69
70.
Напрактике
используют
показатель константы кислотности
(pKa):
pK a = - lgK a
Чем меньше значение pKa, тем
сильнее кислота.
70
71.
Кислотным центром называетсяэлемент (С, S, O, N) и связанный с ним
атом водорода.
Органические кислоты
соответственно классифицируются по
кислотному центру на
О-Н; S-H; N-H; C-H кислоты.
71
72.
Формулы и названия веществрКа
18
10,5
30
9,9
С2Н5ОН
С2Н5SH
С2Н5NH2
С6Н5ОН
этанол
этантиол
этанамин
фенол
Чем больше значение рКа, тем слабее
кислота.
72
73.
На стабильность аниона оказываютвлияние следующие факторы:
1. Природа элемента в кислотном
центре.
а) электроотрицательность
элемента
Сравним кислотные свойства веществ с
одинаковыми радикалами:
СН3–СН2 –ОН (рКа=18)
СН3–СН2 –NH2 (рКа=30).
73
74.
кислород болееэлектроотрицательный элемент
связь О-Н более полярна, чем N-H,
что способствует более легкой
отщепляемости в О-Н кислотном
центре по сравнению с N-H центром.
Амины более слабые кислоты, чем
спирты.
74
75.
б) поляризуемость элемента вкислотном центре.
Сравним кислотные свойства веществ с
одинаковыми радикалами:
СН3–СН2 –ОН (рКа=18)
СН3–СН2 –SH (рКа=10,5).
75
76.
Благодаря большему радиусу иболее высокой поляризуемости атома
серы, отрицательный заряд в анионе
СН3–СН2–S- (меркаптид-ион)
делокализован в большем объёме, чем
в алкоксид-ионе СН3–СН2–О-.
Это обусловливает более высокую
стабильность меркаптид-иона по
сравнению с алкоксид-ионом.
Этантиол является более сильной
кислотой, чем этанол.
76
77.
2.Влияние сопряжения настабильность аниона.
Пример:
Этанол СН3–СН2–ОН
Фенол С6Н5 –ОН
рКа=18
рКа=9,9
77
78.
В молекуле фенола под влияниемЭД-заместителя электронная плотность
смещена от заместителя и
делокализована по ароматическому
кольцу.
Образующийся при отщеплении иона
Н+ феноксид-ион С6 Н5–О- , является
р, p-сопряжённой системой и обладает
высокой стабильностью.
78
79.
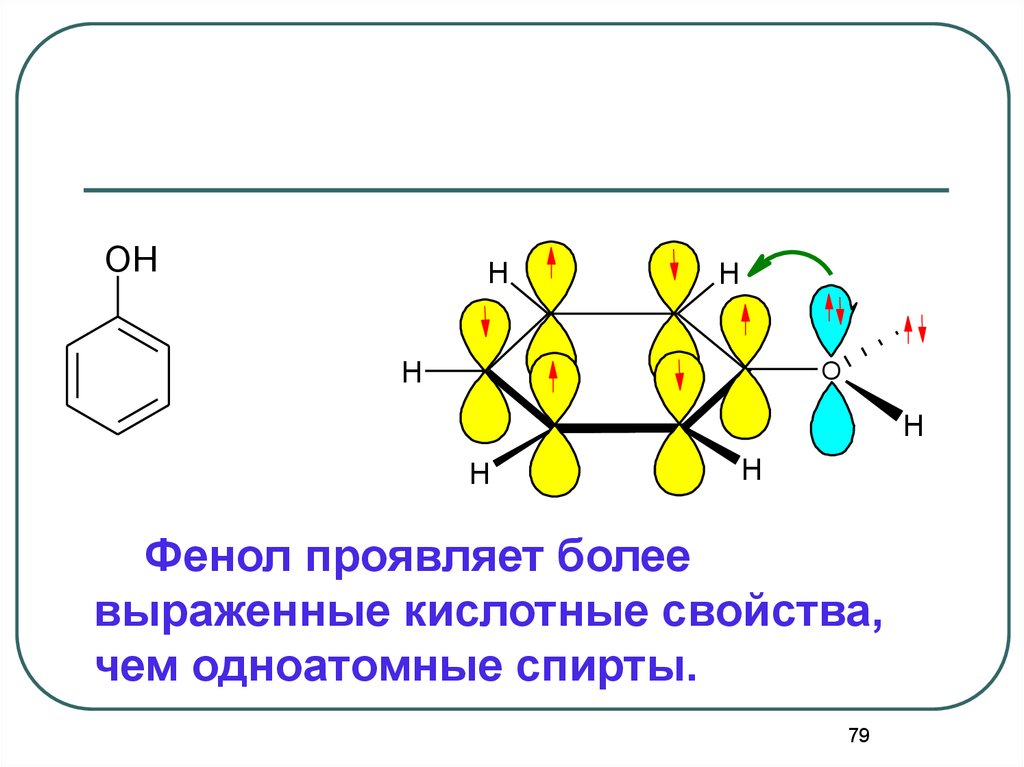
OHH
H
.
O
H
H
H
H
Фенол проявляет более
выраженные кислотные свойства,
чем одноатомные спирты.
79
80.
3. Влияние заместителей настабильность аниона.
СН3–СН2–СООН
пропановая к-та
СН3–СН (ОН)–СООН
2-оксипропановая к-та
рКа=4,9
рКа=3,83
80
81.
Наличие в радикале кислоты ЭАзаместителя –ОН-группы
способствует делокализации
отрицательного заряда в лактатанионе, что повышает его
стабильность по сравнению с
пропионат-анионом.
ЭА-заместители усиливают
кислотность, а
ЭД - снижают.
81
82.
4. Влияние растворителя настабильность аниона.
Чем меньше радикал аниона, тем
он более гидратирован и стабилен.
Муравьиная кислота
рКа=3,7
Уксусная кислота
рКа=4,76
Пропионовая кислота
рКа=4,90
Так как формиат-ион имеет малые
размеры, он наиболее гидратирован
и стабилен, по сравнению с ацетатионом и пропионат- ионом.
82
83.
Спасибо завнимание!
83














































 chemistry
chemistry








