Similar presentations:
Классификация химических реакций
1.
КЛАССИФИКАЦИЯ
ХИМИЧЕСКИХ
РЕАКЦИЙ
2. Ядерные реакции :
Расщепление ядер235
1
90
144
1
92U + 0n = 36Kr + 56Ва + 2 n
0
Термоядерный синтез
3
1
Н + 1Н = 2Не + 0n
2
4
1
Ядерный обмен
14
7
4
1
17
N + 2Не = 1Н + 8О
3. ВВЕДЕНИЕ
ВВ
Е
Д
Е
Н
И
Е
1)
2)
3)
4)
Химические реакции – химические процессы, в
результате которых из одних веществ образуются другие
отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит
изменение веществ, при котором рвутся старые и
образуются новые связи между атомами.
Признаки химических реакций:
Выделяется газ
Выпадет осадок
Происходит изменение окраски веществ
Выделяется или поглощается тепло, свет
Рассмотрим классификацию химических реакций по
различным признакам.
ОГЛАВЛЕНИЕ
4. Типы химических реакций
1.2.
3.
4.
5.
6.
7.
Классификации(стр. 115)
По числу и составу реагирующих веществ.
По изменению степеней окисления
химических элементов, образующих вещества.
По тепловому эффекту.
По агрегатному состоянию реагирующих
веществ.
По участию катализатора.
По направлению.
Другие.
5. По числу и составу реагентов
1. Реакции, идущие без изменения состававещества.
• Реакции аллотропизации
С (графит)
→ С (алмаз) 1954
←
S (ромб) →S (моноклин)
←
Р (бел)→Р(красн) 1669 г
←
Sn (белое)→Sn(серое) 1912г.
←
3О2 →2О3
←
6.
• Реакции изомеризации(перегруппировки)
С4Н10 (бутан) С4Н10 (изобутан)
Аллотропия и изомерия –
причины
многообразия веществ!
7. Реакции, идущие с изменением состава вещества.
• Реакциисоединения(присоединения)
• Реакции
разложения(отщепления)
• Реакции замещения
• Реакции обмена
8.
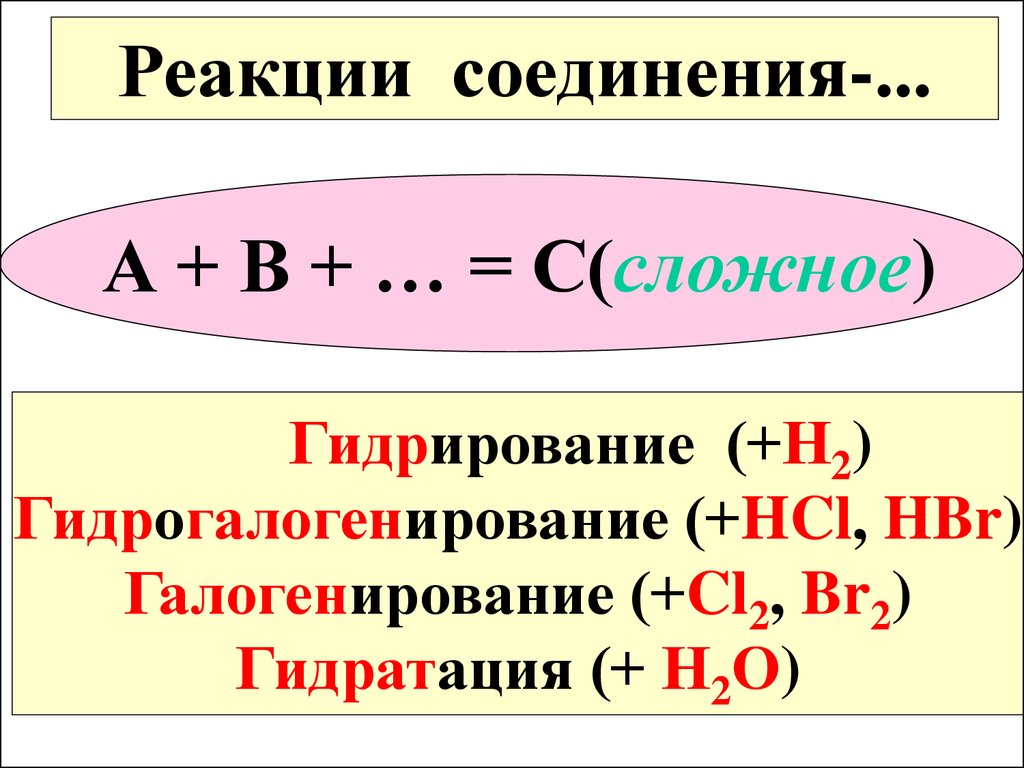
Реакции соединения-...А + В + … = С(сложное)
Гидрирование (+Н2)
Гидрогалогенирование (+HCl, HBr)
Галогенирование (+Cl2, Br2)
Гидратация (+ Н2О)
9.
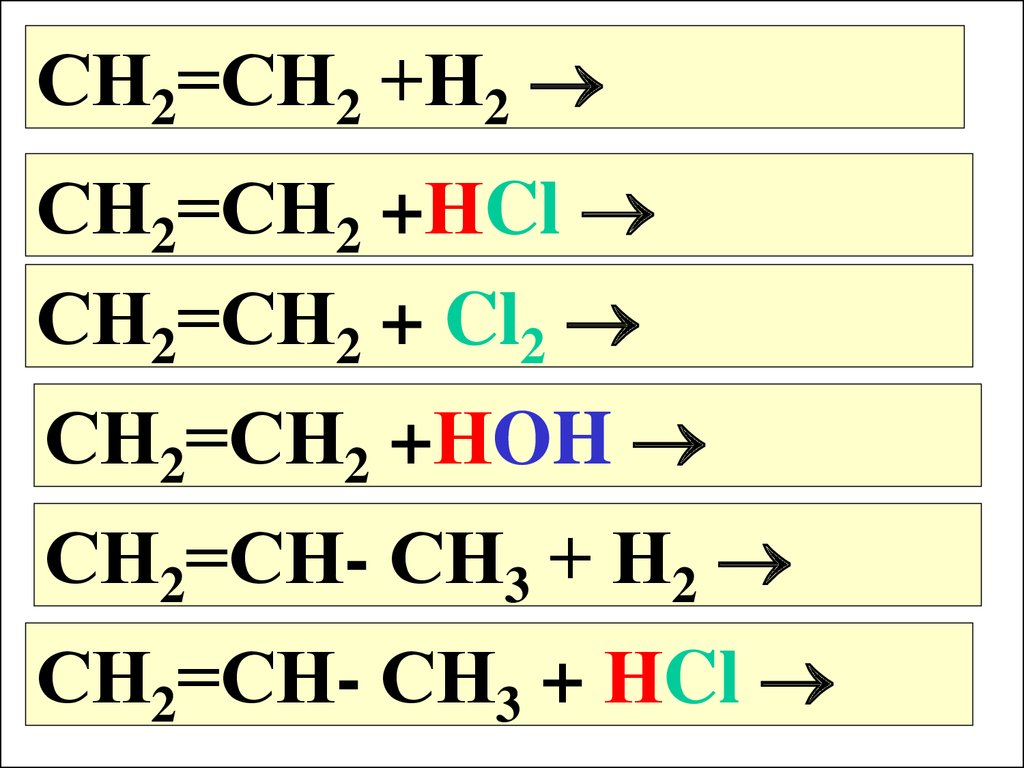
СН2=СН2 +Н2СН2=СН2 +НCl
СН2=СН2 + Cl2
СН2=СН2 +НOH
СН2=СН- СН3 + Н2
СН2=СН- СН3 + НCl
10.
СН2=СН- СН3 + Br2СН2=СН- СН3 + НOH
Реакция полимеризации-...
nСН2=СН2
nСН2=СН - СН3
11. Реакция соединения кислотного оксида фосфора(V) с водой:
Реакция соединения кислотного оксида фосфора(V) сК
водой:
л
а
с
с
и
ф
и
к
а
ц
и
я
Р2 О5 + …H2O = …
ОГЛАВЛЕНИЕ
р
е
а
к
ц
и
й
12.
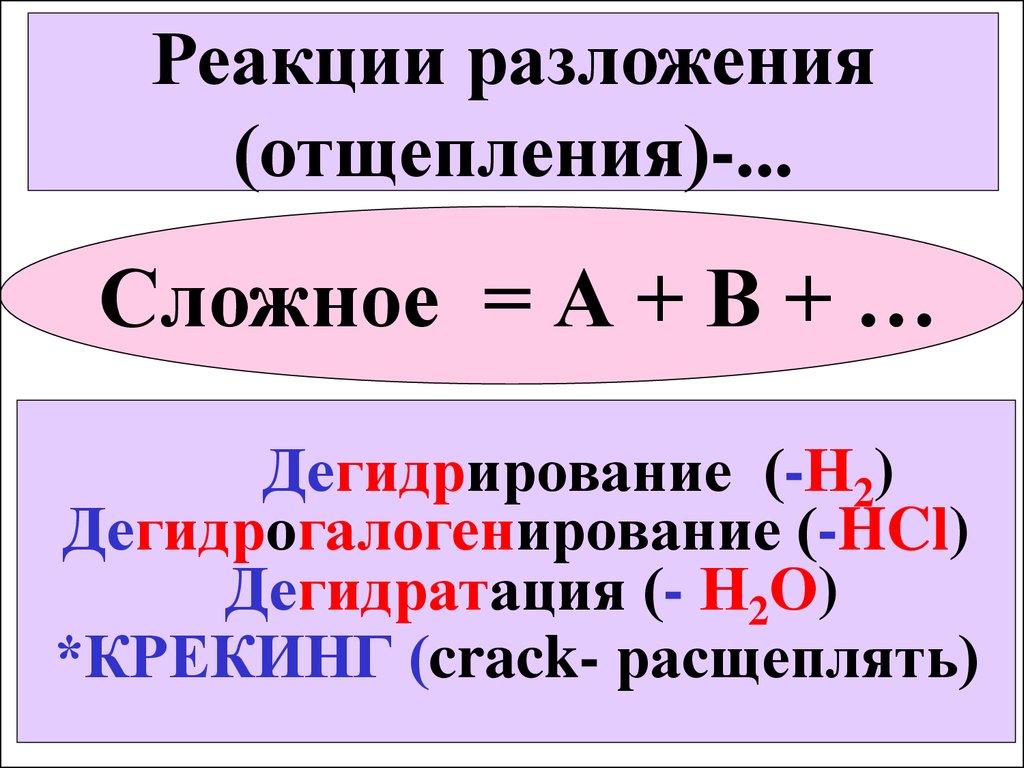
Реакции разложения(отщепления)-...
Сложное = А + В + …
Дегидрирование (-Н2)
Дегидрогалогенирование (-HCl)
Дегидратация (- Н2О)
*КРЕКИНГ (crack- расщеплять)
13. Реакция взаимодействия сахара с концентрированной серной кислотой
Ин
т
е
р
е
с
н
ы
е
р
е
а
к
ц
и
и
ОГЛАВЛЕНИЕ
14.
СН3- СН3 … + Н2СН3-СН2Cl … + НCl
СН3-СН2 OH … + НOH
СН3-СН2 -СН2 -СН3 …
СН3- СН2 -СН2 -СН3 …
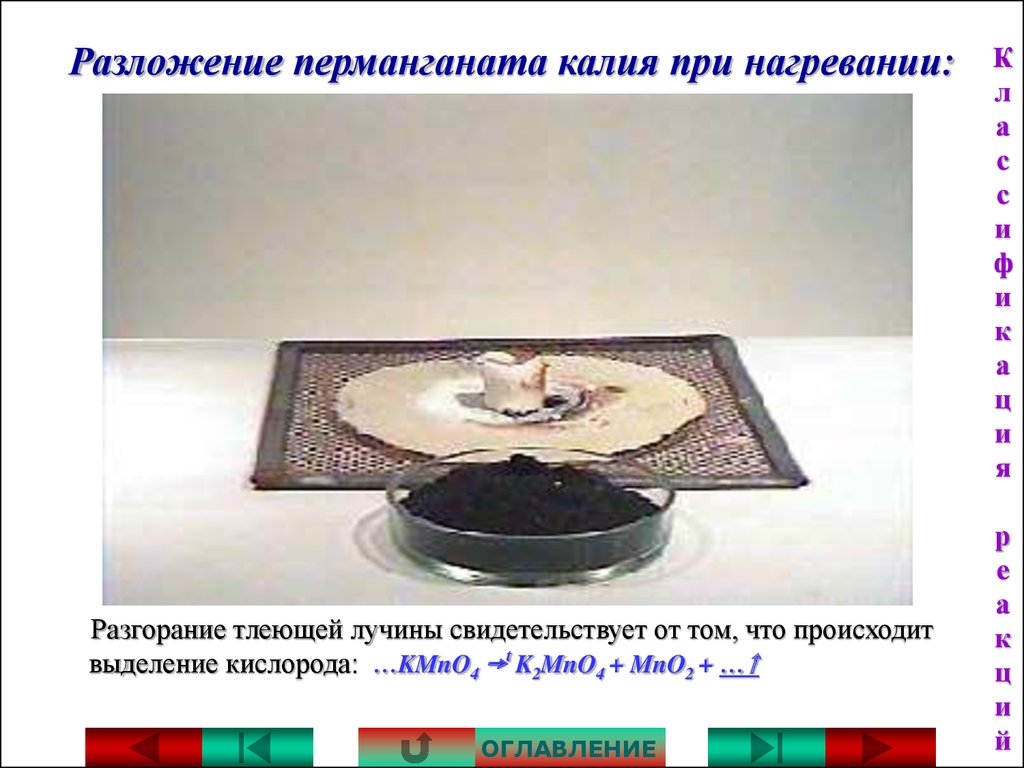
15. Разложение перманганата калия при нагревании:
Разгорание тлеющей лучины свидетельствует от том, что происходитвыделение кислорода: …KMnO4 t K2MnO4 + MnO2 + …
ОГЛАВЛЕНИЕ
К
л
а
с
с
и
ф
и
к
а
ц
и
я
р
е
а
к
ц
и
й
16.
Реакции замещения- ...1. Zn + …HCl = … + …
2. CH4 +Cl2 … + …
3. C2H6 +Cl2 … +…
17. Взаимодействие щелочного металла кальция с водой:
Взаимодействие щелочного металла кальция с водой:Кл
а
с
с
и
ф
и
к
а
ц
и
я
Са + …Н2О = … + …
ОГЛАВЛЕНИЕ
р
е
а
к
ц
и
й
18. Взаимодействие щелочного металла натрия с водой:
Кл
а
с
с
и
ф
и
к
а
ц
и
я
...Na + … = ...NaOH + …
ОГЛАВЛЕНИЕ
р
е
а
к
ц
и
й
19. Реакции обмена
• Реакции между двумя сложнымивеществами, которые обмениваются
своими составными частями.
AgNO3 + HCl Ag+Cl – + HNO3
CaCO3 +2HCl Ca2+Cl2– + H2O + CO2
NaOH + HCl Na+Cl – + H2O
• Условия протекания реакций обмена
между растворами (правило Бертолле):
1) выпадение осадка (нерастворимого
вещества)
2) выделение газа
3) образование воды H2O
20.
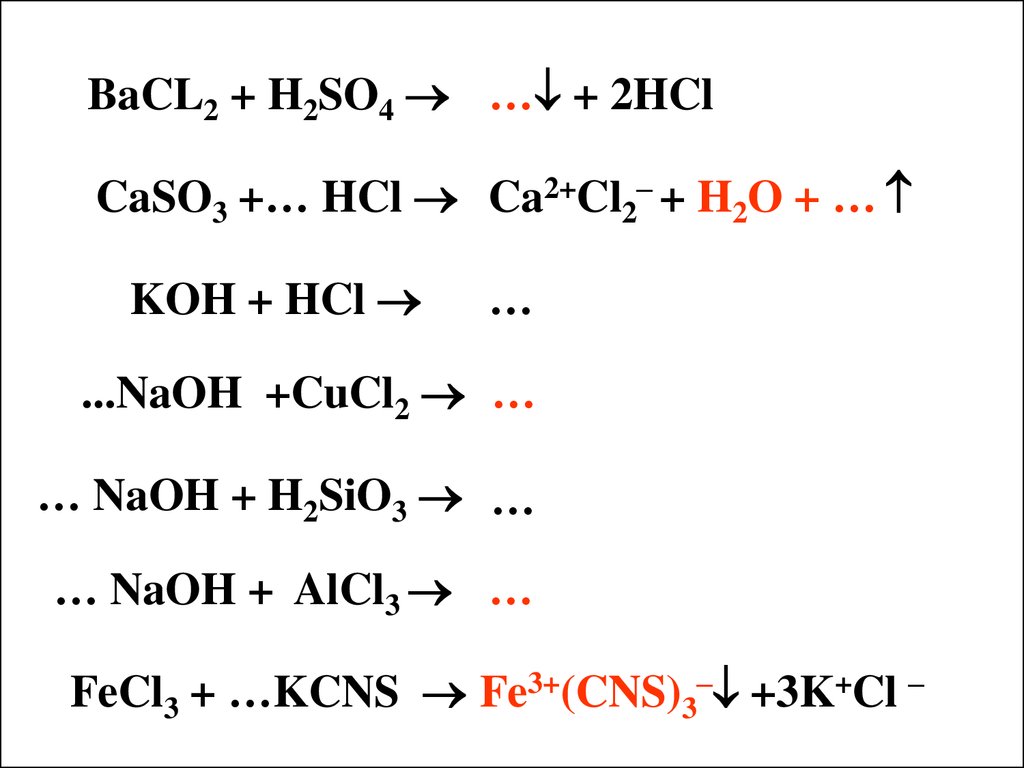
BaCL2 + H2SO4 … + 2HClCaSO3 +… HCl Ca2+Cl2– + H2O + …
KOH + HCl
…
...NaOH +CuCl2 …
… NaOH + H2SiO3 …
… NaOH + AlCl3 …
FeCl3 + …KCNS Fe3+(CNS)3– +3K+Cl –
21. Определите тип реакции ?
1)2)
3)
4)
5)
6)
7)
nCH2=CH2 → (-CH2-CH2-)n
C8H18→ C4H10 + C4H8
4 NO2 + O2+ 2H2O = 4 HNO3
2KMnO4= MnO2 + K2MnO4 +O2
C + FeO = CO + Fe
KOH + HCl = KCl + H2O
Cu + 2 AgNO3 = 2 Ag + Cu(NO3)2
22. 2. По изменению степеней окисления химических элементов, образующих вещества:
Кл
а
с
с
Окислительно-восстановительные реакции:
и
Окислительно-восстановительные реакции – реакции, идущиеф
и
к
с изменением степеней окисления элементов.
а
К ним относится множество реакций, в том числе все реакции
ц
замещения, а также те реакции соединения и разложения, в которых
и
я
участвует хотя бы одно простое вещество:
0
+1
+2
0
а) Mg + H2SO4 = MgSO4 + H2
0
+2
Mg – 2e¯ Mg – окисление
+1
0
2Н + 2e¯ H2 – восстановление
0
0
+2 -2
б) 2Мg + O2 = 2MgO
р
е
0
+2
Mg – 2e¯ Mg 2 – окисление
а
к
0
-2
O2 + 4e¯ 2O 1 – восстановлениец
и
й
ОГЛАВЛЕНИЕ
23. Окислительно-восстановительная реакция: горение магния
Кл
а
с
с
и
ф
и
к
а
ц
и
я
р
е
а
0
0
+2 -2
к
2Мg + O2 = 2MgO
Сложные окислительно-восстановительные реакции составляются с помощью ц
метода электронного баланса
и
й
ОГЛАВЛЕНИЕ
24.
Реакция взаимодействия фосфора с азотной кислотой:И
н
т
е
р
е
с
н
ы
е
р
е
а
к
ц
и
и
ОГЛАВЛЕНИЕ
25. Не окислительно-восстановительные реакции:
Кл
Не окислительно-восстановительные реакции – реакции, иду-а
щие без изменения степеней окисления элементов.
с
с
К ним относятся все реакции ионного обмена, например:
и
ф
Na2CO3 + 2HCl = 2NaCl + Н2СО3
Но т.к. угольная кислота – очень слабая, она может существовать и
к
только в разбавленных растворах, а в присутствии более сильных кислота
неустойчива и разлагается на углекислый газ и воду. Таким образом,
ц
и
окончательное уравнение имеет вид:
я
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O,
многие реакции соединения :
Li2O + H2O = 2LiOH
а также многие реакции разложения:
t
2Fe(OH)3 Fe 2O3 + 3H2O
ОГЛАВЛЕНИЕ
р
е
а
к
ц
и
й
26. 3. По участию катализатора:
ККатализаторы – это вещества, участвующие в химической реакции и л
а
изменяющие ее скорость или направление, но по окончании реакции
с
остающиеся неизменными качественно и количественно.
с
и
Некаталитические реакции:
ф
Некаталитические реакции - реакции, идущие без участия катализатора:и
t
к
2HgO 2Hg + O2
t
а
2Al + 6HCl 2AlCl3 + 3H2
ц
Каталитические реакции:
и
Каталитические реакции – реакции, идущие с участием катализатора: я
H2 O
4Al + 3I2 2AlI3
t,MnO2
2KClO3
2KCl + 3O2
P,t
CO + NaOH H-CO-ONa
ОГЛАВЛЕНИЕ
р
е
а
к
ц
и
й
27. Каталитическая реакция взаимодействия алюминия с йодом:
Каталитическая реакция взаимодействия алюминия сКл
йодом:
а
с
с
и
ф
и
к
а
ц
и
я
H2 O
4Al + 3I2 2AlI3
ОГЛАВЛЕНИЕ
р
е
а
к
ц
и
й
28. 4. По агрегатному состоянию реагирующих веществ (фазовому составу):
Кл
а
с
Гетерогенные реакции:
Гетерогенные реакции – реакции, в которых реагирующие вещества си
и
продукты реакции находятся в разных агрегатных состояниях (в разных ф
фазах):
FeO(т) + СО(г) Fe(т) + СО2(г) + Q
и
2Al(т) + 3СuСl2 (р-р) = 3Сu(т) + 2AlCl3 (р-р)
к
а
CaC2(т) + 2H2O(ж) = C2H2 + Ca(OH)2(р-р)
ц
и
я
Гомогенные реакции:
Гомогенные реакции – реакции, в которых реагирующие вещества и
р
продукты реакции находятся в одном агрегатном состоянии (в одной
е
фазе):
2С2Н6(г) + 7О2(г) 4СО2(г) + 6Н2О(г)
а
2 SO2(г) + O2(г) = 2SO3(г) +Q
H2(г) + F2(г) = 2HF(г)
ОГЛАВЛЕНИЕ
к
ц
и
й
29. 5. По тепловому эффекту:
Кл
а
Экзотермические реакции:
Экзотермические реакции – реакции, протекающие с выделением с
с
энергии во внешнюю среду. К ним относятся почти все реакции
и
соединения. Экзотермические реакции, которые протекают с выделениемф
и
света, относят к реакциям горения, например:
к
а
ц
и
я
4Р + 5О2 = 2Р2О5 + Q
ОГЛАВЛЕНИЕ
р
е
а
к
ц
и
й
30. Эндотермические реакции:
Кл
Эндотермические реакции – реакции, протекающие с поглощением а
с
энергии во внешнюю среду. К ним относятся почти все реакции
с
разложения, например:
и
t
Обжиг известняка:
СаСО3 CaO + CO2 - Q
ф
и
к
Количество выделенной или поглощенной в результате реакции
а
энергии называют тепловым эффектом реакции, а уравнение химической ц
реакции с указанием этого эффекта называют термохимическим
и
я
уравнением, например:
H2(г)+ Cl2(г) = 2HCl(г) + 92.3 кДж
N2(г) + O2(г) = 2NO – 90.4 кДж
ОГЛАВЛЕНИЕ
р
е
а
к
ц
и
й
31. 6. По направлению:
Кл
а
Необратимые реакции:
с
Необратимые реакции протекают в данных условиях только в одном с
направлении. К таким реакциям можно отнести все реакции обмена,
и
сопровождающиеся образованием осадка, газа или малодиссоциирующегоф
и
вещества (воды) и все реакции горения:
к
Горение пороха
а
ц
и
я
ОГЛАВЛЕНИЕ
р
е
а
к
ц
и
й
32. Реакция горения кальция на воздухе:
Ин
т
е
р
е
с
н
ы
е
Реакции горения протекают
очень бурно
ОГЛАВЛЕНИЕ
р
е
а
к
ц
и
и
33. Реакция горения лития:
ОГЛАВЛЕНИЕ34. Обратимые реакции:
Кл
а
Обратимые реакции в данных условиях протекают одновременно в с
с
двух противоположных направлениях. Таких реакций подавляющее
и
большинство. Например:
ф
и
2SO2 + O2 <=> 2SO3
к
а
N2 +3H2 <=> 2NH3
ц
и
я
Обратимые реакции:
ОГЛАВЛЕНИЕ
р
е
а
к
ц
и
й





























 chemistry
chemistry








