Similar presentations:
Теоретические основы биоорганической химии
1. ФГБОУ ВО БГМУ Минздрава России Кафедра общей химии ЛЕКЦИЯ 1 Теоретические основы биоорганической химии
2.
Биоорганическая химияизучает строение и своства веществ,
участвующих в процессах
жизнедеятельности, в непосредственной
связи с познанием их биологической
функции
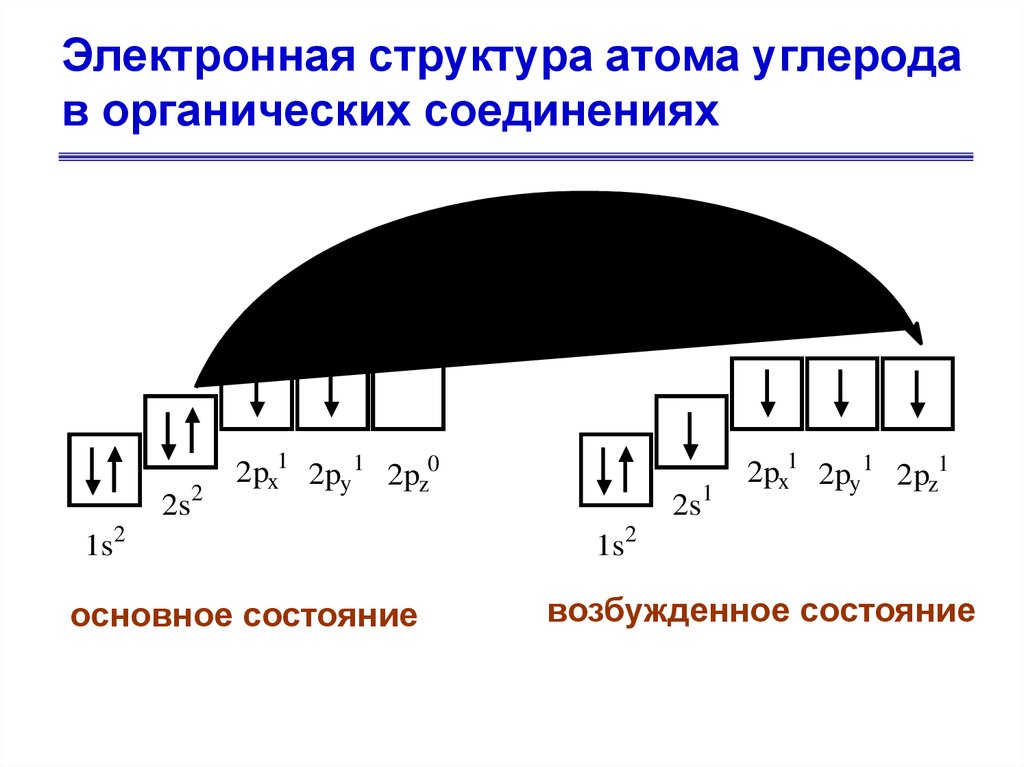
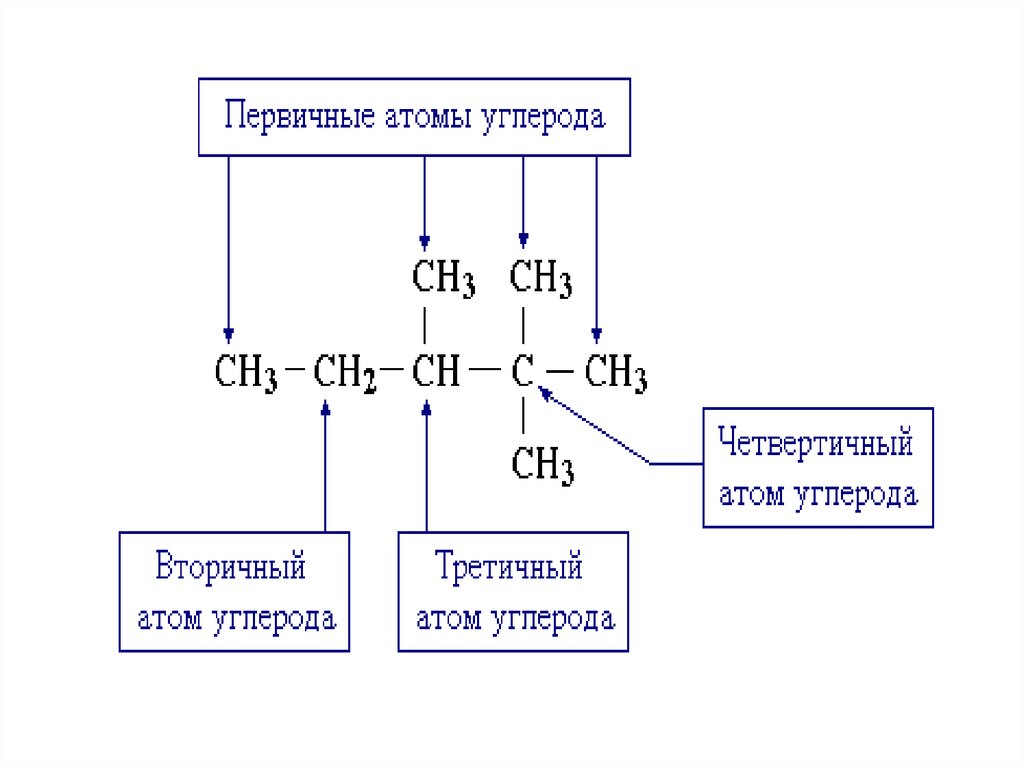
3. Электронная структура атома углерода в органических соединениях
2s22px1 2py 1 2pz0
1s2
основное состояние
2s1
2px1 2py 1 2pz1
1s2
возбужденное состояние
4.
5.
6.
7.
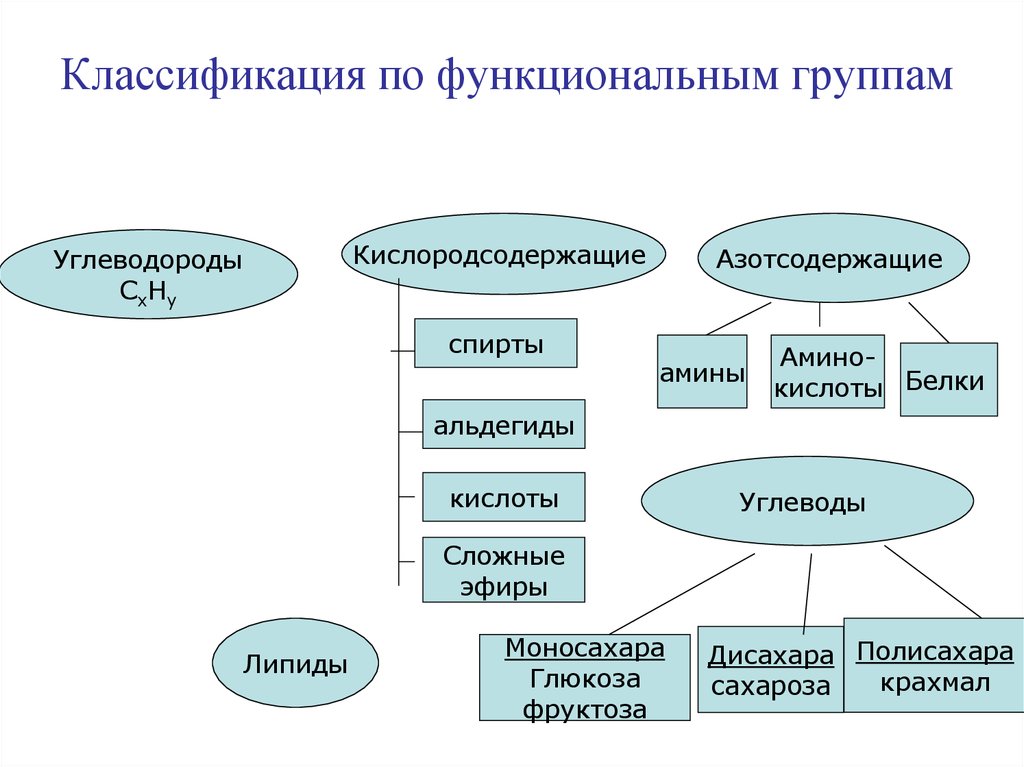
8. Классификация по функциональным группам
КислородсодержащиеУглеводороды
СхНу
спирты
Азотсодержащие
амины
Аминокислоты Белки
альдегиды
кислоты
Углеводы
Сложные
эфиры
Липиды
Моносахара
Глюкоза
фруктоза
Дисахара Полисахара
крахмал
сахароза
9.
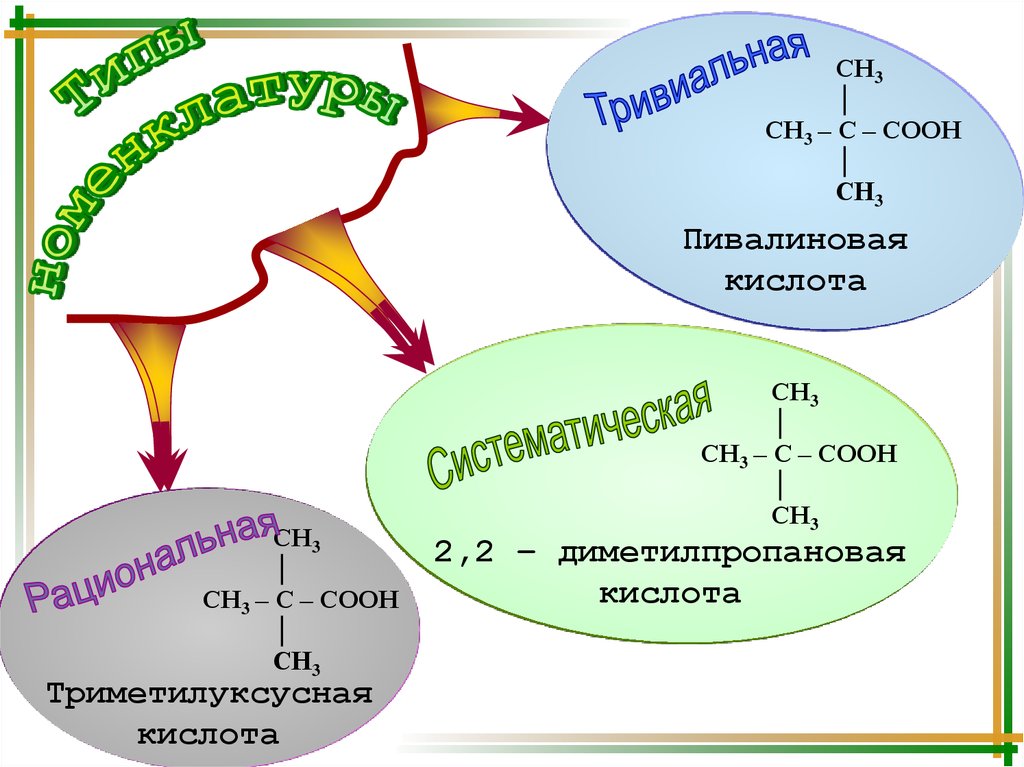
СН3│
СН3 – С – СООН
│
СН3
Пивалиновая
кислота
СН3
│
СН3 – С – СООН
│
СН3
Триметилуксусная
кислота
СН3
│
СН3 – С – СООН
│
СН3
2,2 – диметилпропановая
кислота
10.
Названиезаместителей в
алфавитном порядке и
номера атомов
углерода, к которым
они присоединены,
кроме главной
характеристической
группы
Название
главной цепи,
зависит от
количества
атомов
углерода в ней
Указывает кратность
связей или главную
характеристическую
группу
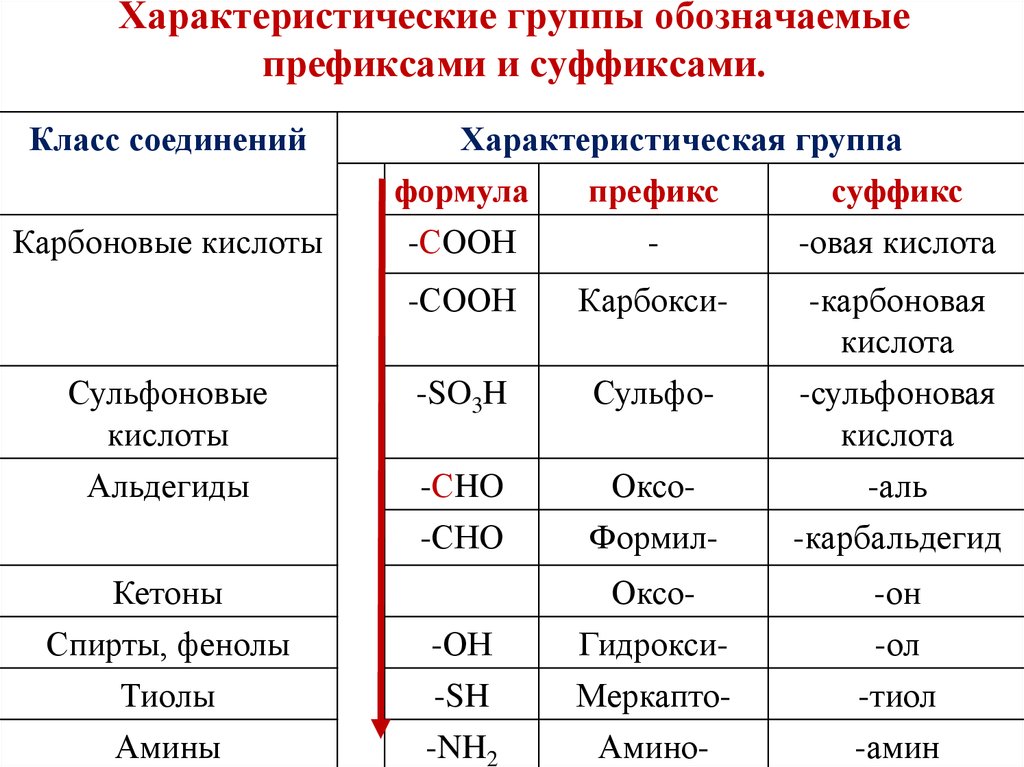
11. Характеристические группы обозначаемые префиксами и суффиксами.
Класс соединенийКарбоновые кислоты
Сульфоновые
кислоты
Альдегиды
Характеристическая группа
формула
префикс
суффикс
-СООН
-
-овая кислота
-СООН
Карбокси-
-SO3H
Сульфо-
-СHO
Оксо-
-карбоновая
кислота
-сульфоновая
кислота
-аль
-СНО
Формил-
-карбальдегид
Оксо-
-он
Кетоны
Спирты, фенолы
-ОН
Гидрокси-
-ол
Тиолы
-SH
Меркапто-
-тиол
Амины
-NH2
Амино-
-амин
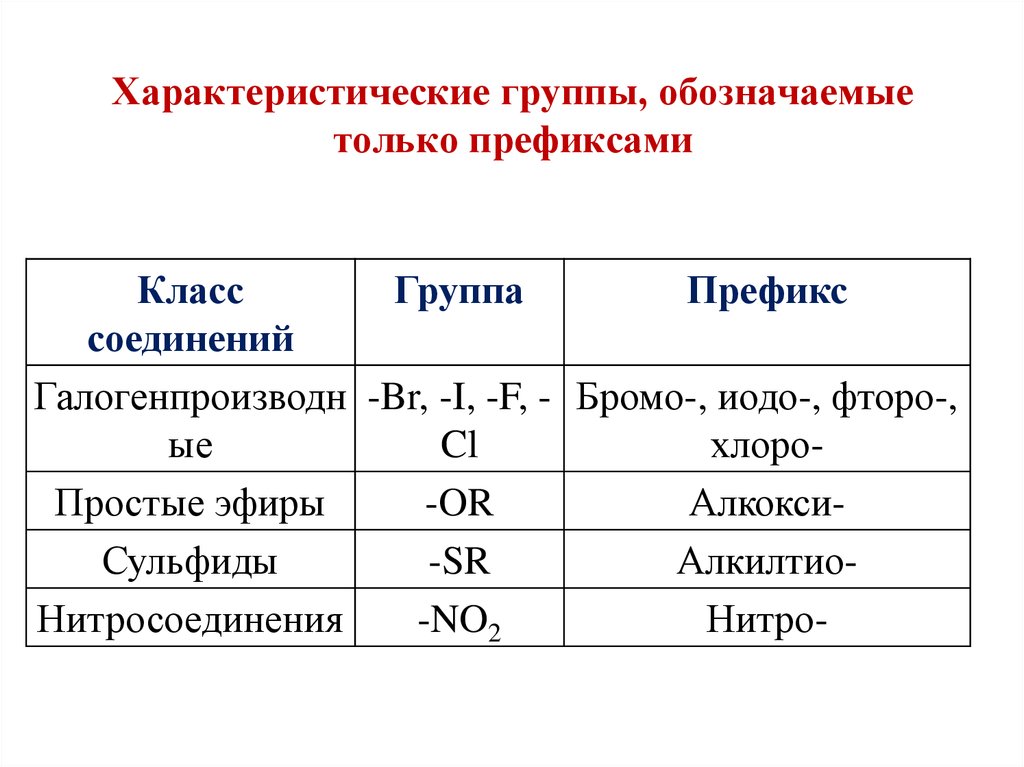
12. Характеристические группы, обозначаемые только префиксами
КлассГруппа
Префикс
соединений
Галогенпроизводн -Br, -I, -F, - Бромо-, иодо-, фторо-,
ые
Cl
хлороПростые эфиры
-OR
АлкоксиСульфиды
-SR
АлкилтиоНитросоединения
-NO2
Нитро-
13.
Важнейшие углеводородные радикалы,обозначаемыми префиксами.
Строение
СН3
СН3СН2
СН2
CH
Название*
Метил
Этил
Метилен
Метин
СН3СН2СН2СН2
CH3
CHCH2
CH3
CH3CHCH2CH3
н-Бутил
Изобутил
втор-Бутил
CH3
трет-Бутил
CH3C
CH3
CH3CH
СН3СН2СН2
CH3
CH
CH3
Этилиден
н-Пропил
Изопропил
CH3
CH3CCH2
Неопентил
CH3
CH3
CH3CH2C
CH3
трет-Пентил
14.
15.
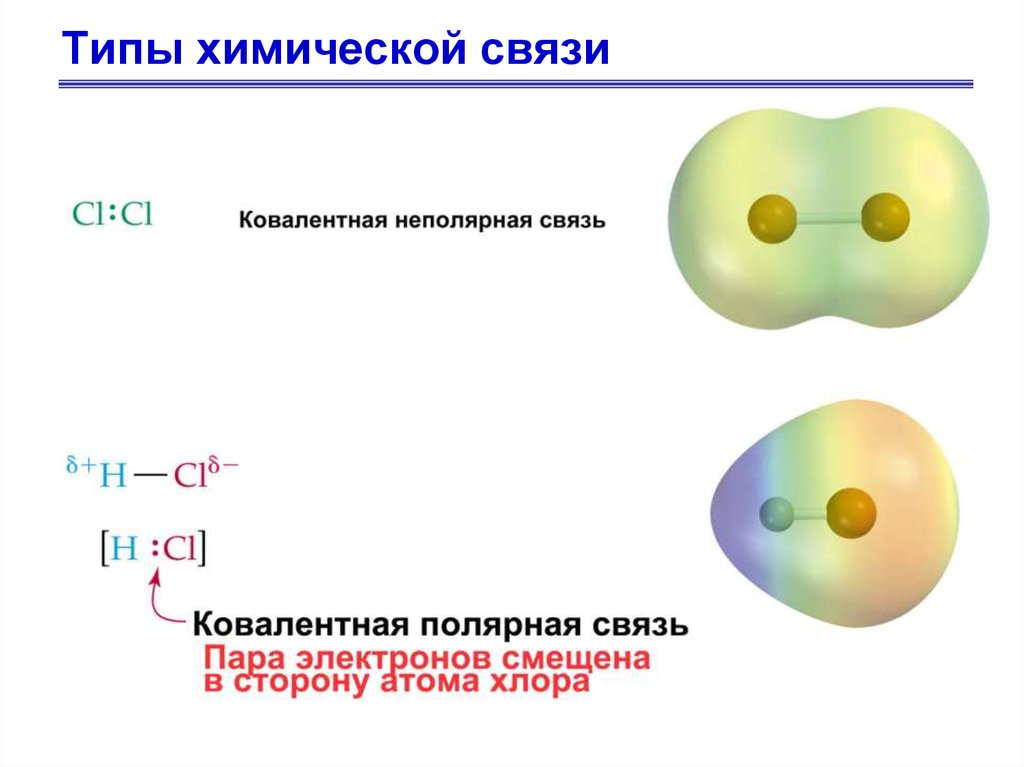
16. Типы химической связи
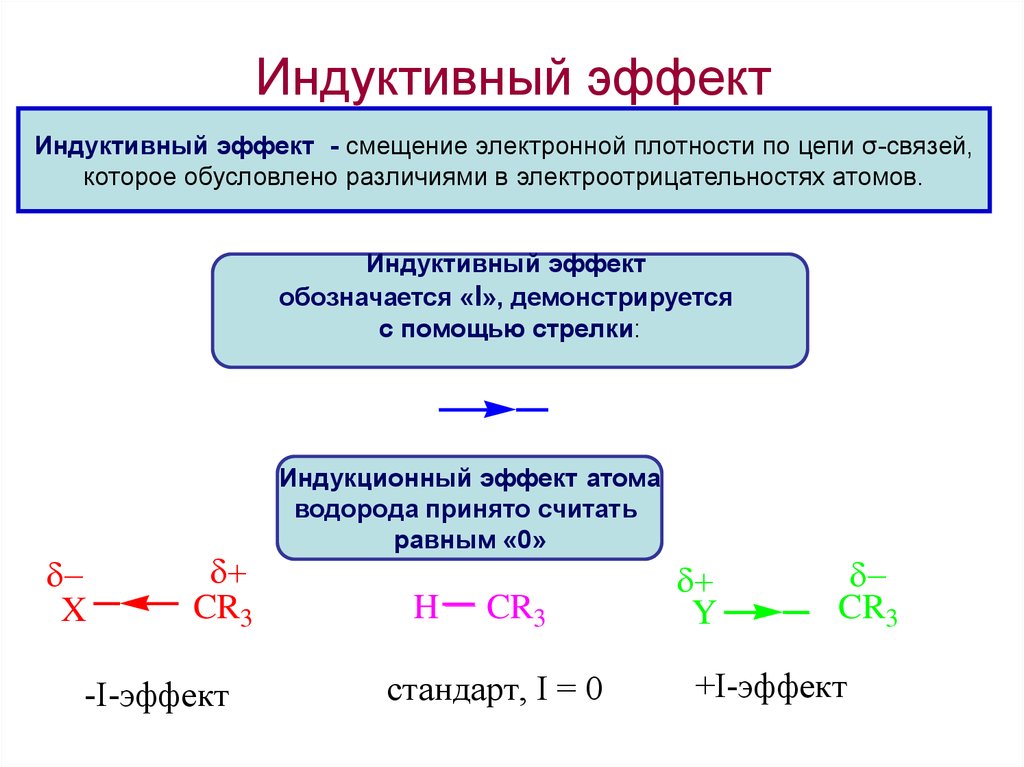
17. Индуктивный эффект
Индуктивный эффект - смещение электронной плотности по цепи σ-связей,которое обусловлено различиями в электроотрицательностях атомов.
Индуктивный эффект
обозначается «I», демонстрируется
с помощью стрелки:
X
CR3
-I-эффект
Индукционный эффект атома
водорода принято считать
равным «0»
H
CR3
стандарт, I = 0
Y
CR3
+I-эффект
18. Индуктивный эффект называют отрицательным (-I), если заместитель смещает электронную плотность ϭ-связи от атома углерода, с которым он связ
Индуктивный эффект называют отрицательным (-I), еслизаместитель смещает электронную плотность ϭ-связи от атома
углерода, с которым он связан.
При этом заместитель приобретает частичный отрицательный
заряд, атом углерода – частичный положительный заряд.
• Заместители с -I-эффектом притягивают
электроны и называют электроноакцепторными.
• Их электроотрицательность выше, чем
электроотрицательность атома углерода в
метильном радикале.
Примеры:
• F-; Cl-; Br-;
• -OH; -ОR; -COOH; -CH=O; -COOR;
• -CN; -NO2; -NH2; SH, -SR, -SO3H
• СН2=СН-; С6Н5-; СН С-
19.
HCCH2
<
< NH2< OH < COOOCH3 < Cl < F < CN < NO2
Увеличение электроноакцепторных свойств (рост
отрицательного индуктивного эффекта "-I-эффект")
20. Индуктивный эффект называют положительным (+ I), если заместитель увеличивает электронную плотность на атоме углерода, индуцируя на нем час
Индуктивный эффект называют положительным (+ I), еслизаместитель увеличивает электронную плотность на атоме
углерода, индуцируя на нем частичный отрицательный заряд, сам
при этом приобретая – частичный положительный заряд.
Заместители с +I-эффектом отдают
электроны и называют
электронодонорами.
Их электроотрицательность ниже, чем
электроотрицательность атома углерода.
Примеры:
Металлы: -Na, -Li, -MgX и т.п.,
-CH3, -C2H5 и др. алкилы
21.
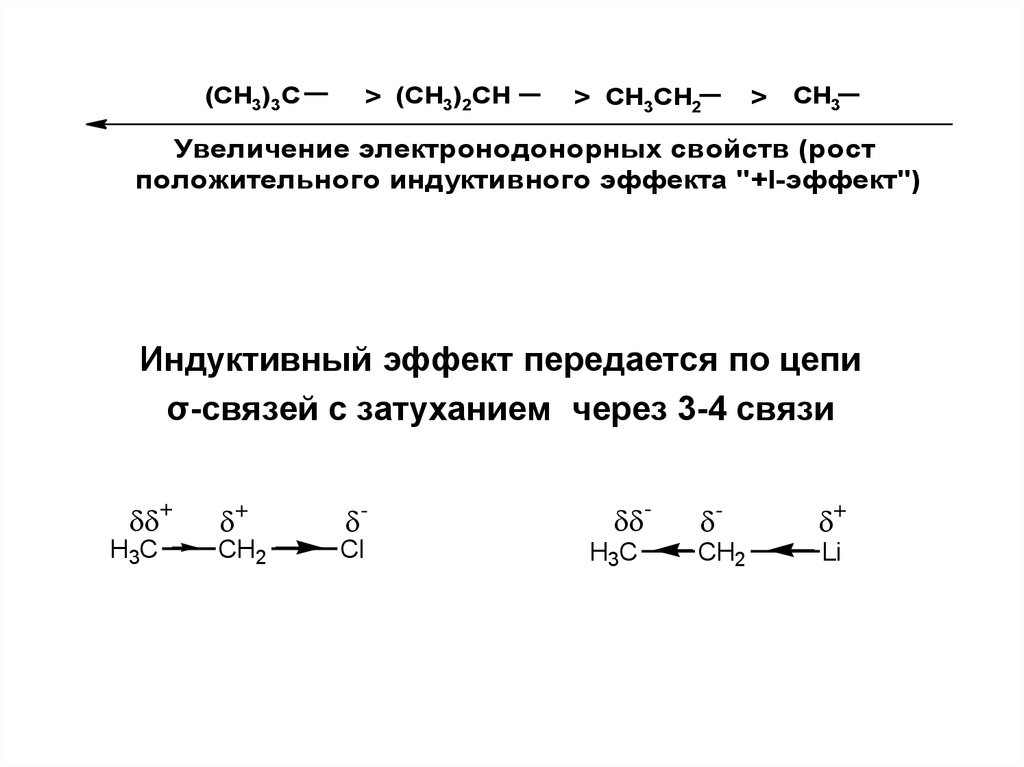
(CH3)3C> (CH3)2CH
> CH3CH2
> CH3
Увеличение электронодонорных свойств (рост
положительного индуктивного эффекта "+I-эффект")
Индуктивный эффект передается по цепи
σ-связей с затуханием через 3-4 связи
+
H3C
+
-
CH2
Cl
H3C
-
+
CH2
Li
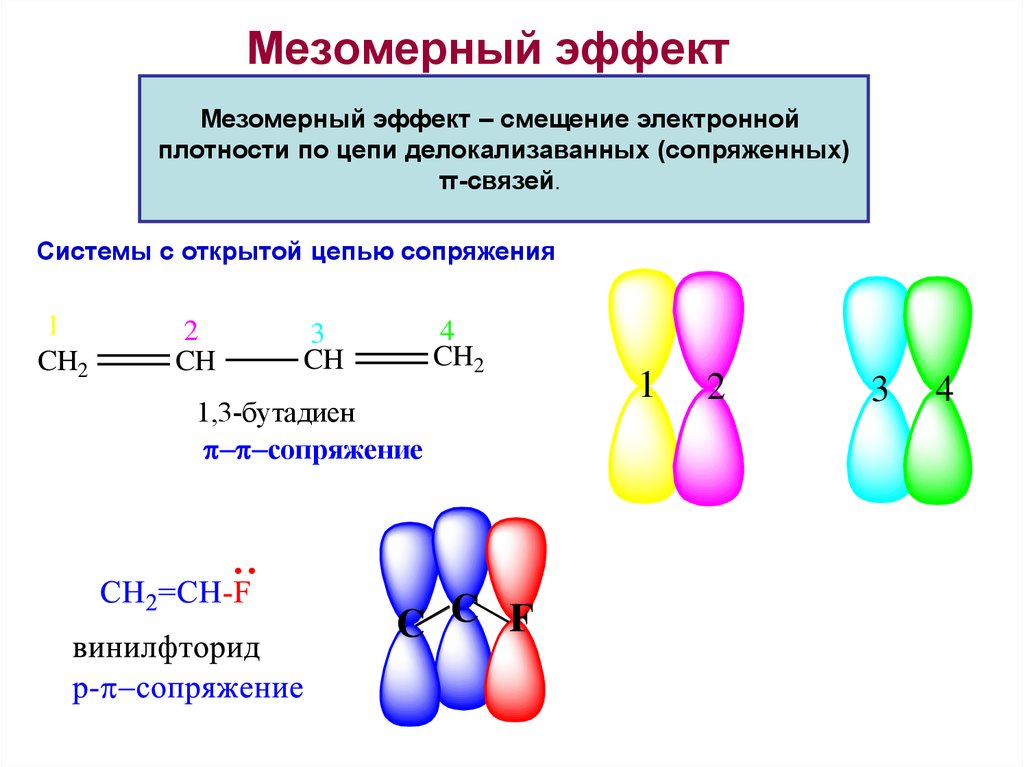
22. Мезомерный эффект
Мезомерный эффект – смещение электроннойплотности по цепи делокализаванных (сопряженных)
π-связей.
Системы с открытой цепью сопряжения
1
CH2
2
CH
4
CH2
3
CH
1,3-бутадиен
сопряжение
C C F
1
2
3
4
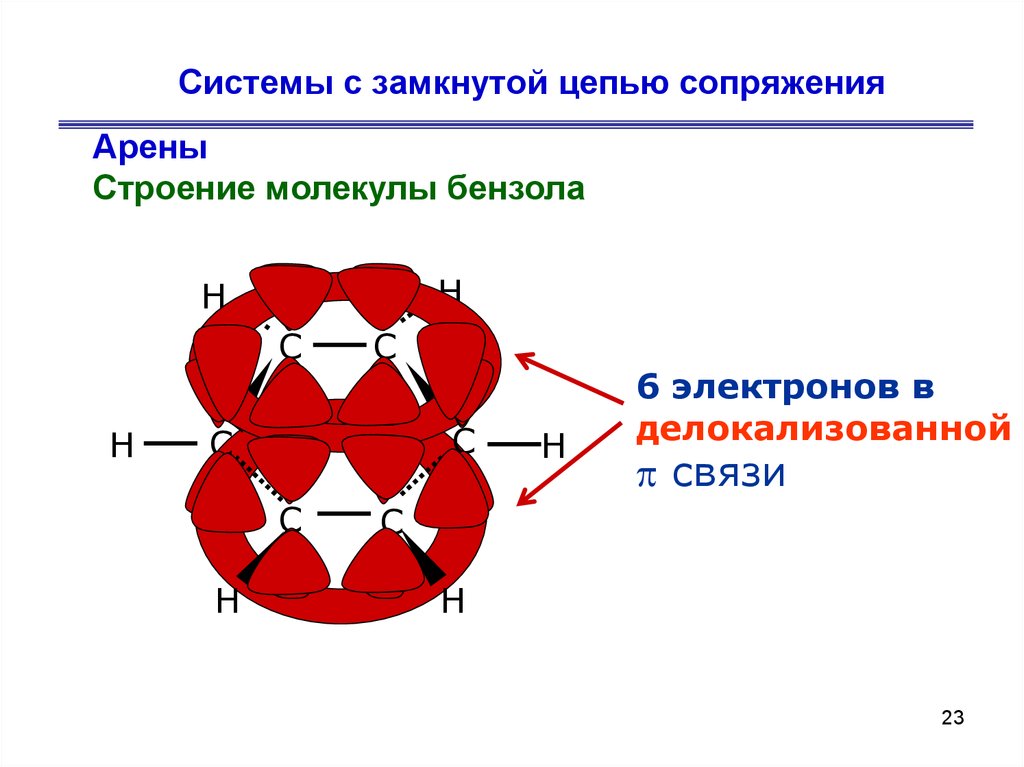
23. Системы с замкнутой цепью сопряжения
АреныСтроение молекулы бензола
H
H
C
H
C
C
C
C
H
H
6 электронов в
делокализованной
связи
C
H
23
24. Арены
«Ароматичность» – совокупность особыхсвойств бензола
Правило Хюккеля (1931): 1. плоский замкнутый цикл
2. сопряженная система
-электронов,
содержащая 4n + 2 электронов
(где n = 1, 2,3 и т.д.).
Эрих Хюккель24
1896-1980
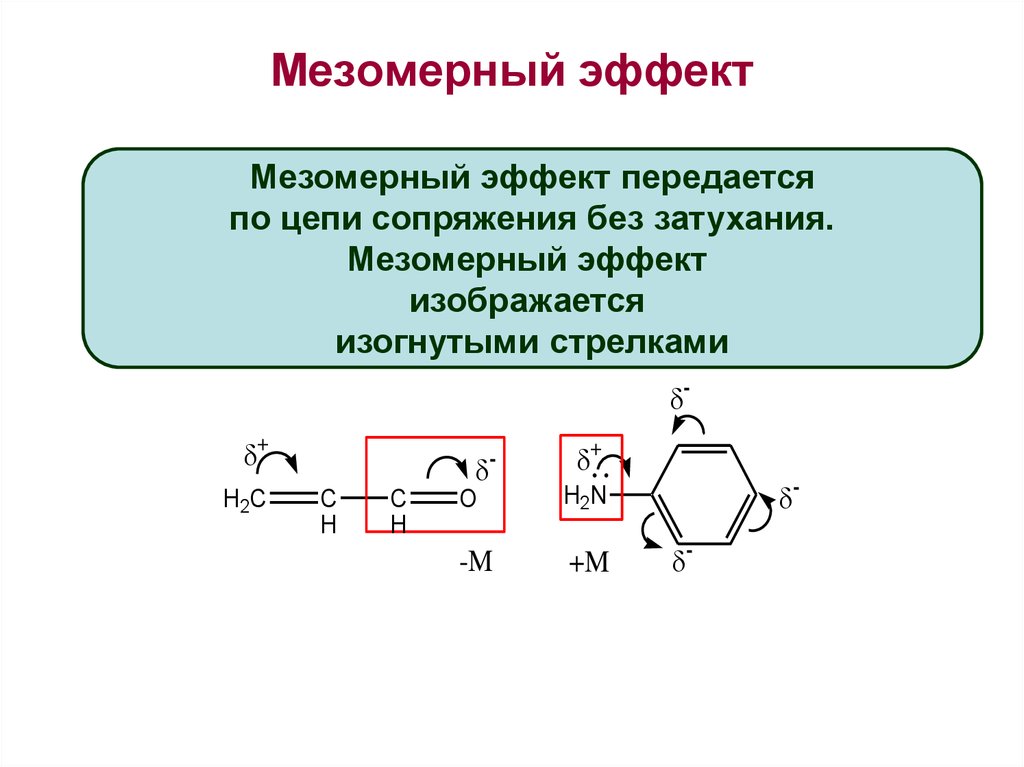
25. Мезомерный эффект
Мезомерный эффект передаетсяпо цепи сопряжения без затухания.
Мезомерный эффект
изображается
изогнутыми стрелками
+
H2C
-
C
H
C
H
+
O
H2N
-M
+M
-
26.
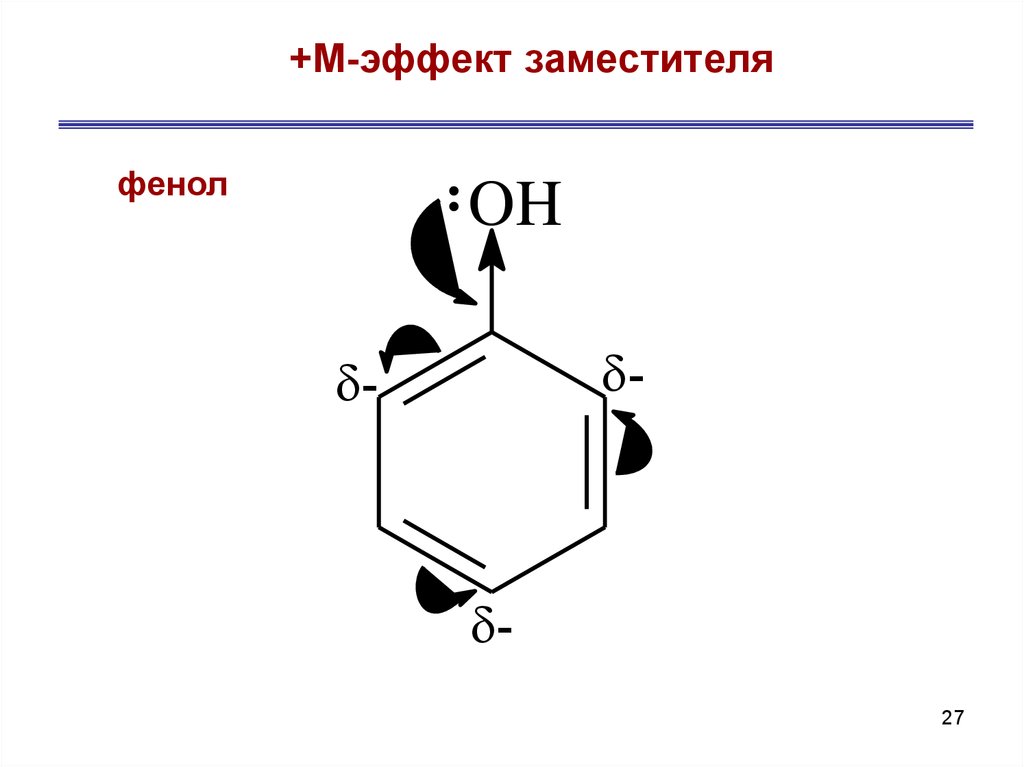
+ М-эффектом обладаютзаместители, повышающие электронную плотность
в сопряженной системе. К ним относятся группы,
которые содержат атомы с неподеленной парой
электронов, способные к передаче этой
пары в общую систему сопряжения.
-OH; -NH2; Cl-; Br-; -CH3, -C2H5
Заместители (ориентанты) первого рода
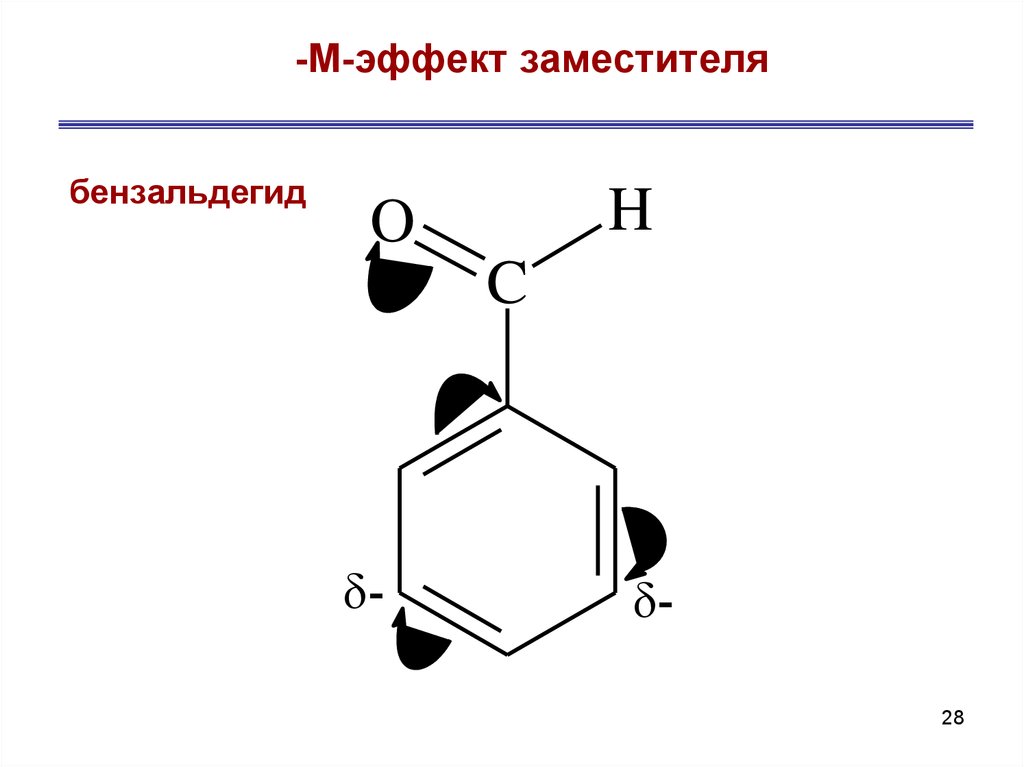
- М-эффект проявляют заместители с
электроотрицательными атомами и смещающие
электронную плотность на себя. Эти группы имеют
неподеленные пары электронов, но пространственное
расположение орбиталей не позволяет электронам
вступать в систему сопряжения.
-СN, -COOH; -CH=O; -COOR; -NO2; -SO3H
Заместители (ориентанты) второго рода
27. +М-эффект заместителя
фенолOH
-
-
27
28. -М-эффект заместителя
бензальдегидH
O
C
-
28
29.
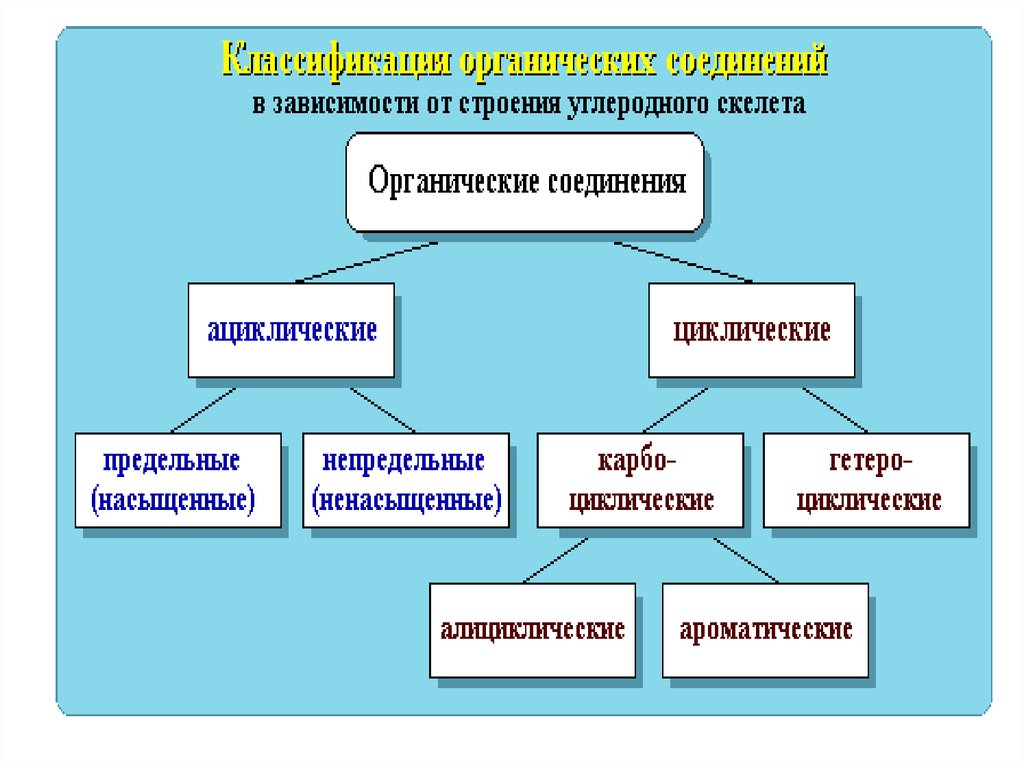
Классификация органических реакций1. По типу разрыва связей.
Гомолитические реакции – симметричный разрыв
ковалентной связи с образованием двух свободных
радикалов, имеющих неспаренный электрон (R·)
A:B
А.
+
B.
30.
Гетеролитические реакции – несимметричный разрывсвязи, приводящий к появлению двух частиц
с противоположными зарядами.
A:B
-
+
А: + B
N
Е
31.
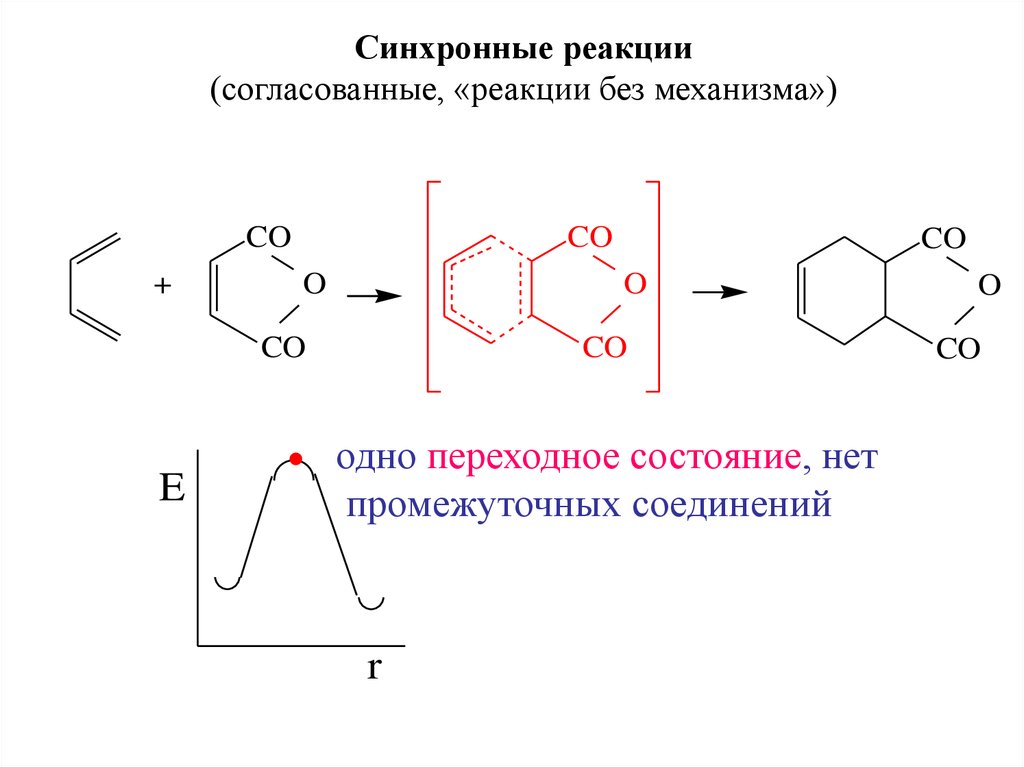
Синхронные реакции(согласованные, «реакции без механизма»)
CO
+
CO
O
O
CO
E
CO
CO
одно переходное состояние, нет
промежуточных соединений
r
O
CO
32.
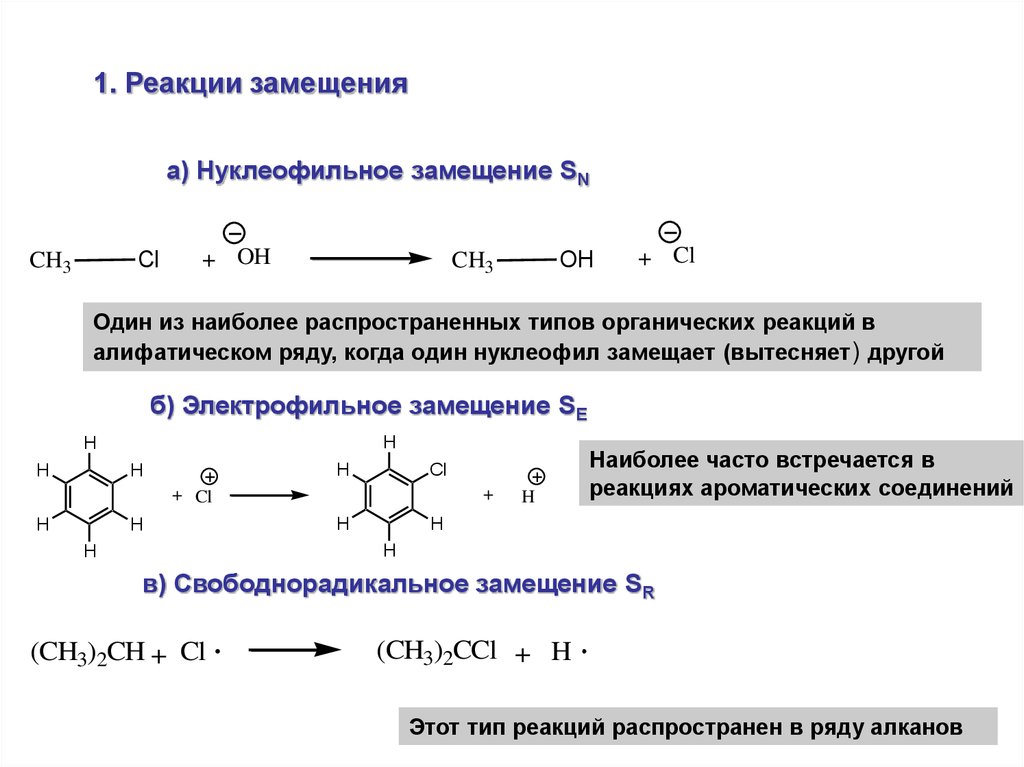
2. Классификация по конечному результату1. Реакции замещения
Данный тип реакций обозначают буквой S (от английского слова
"замещение" - substitution)
R
X
субстрат
+
Y
R
Y + X
реагент
По типу реагента эти реакции разделяют на следующие подклассы:
33.
1. Реакции замещенияа) Нуклеофильное замещение SN
Cl
CH3
+ OH
OH
CH3
+ Cl
Один из наиболее распространенных типов органических реакций в
алифатическом ряду, когда один нуклеофил замещает (вытесняет) другой
б) Электрофильное замещение SE
H
H
H
H
H
Cl
+
+ Cl
H
H
H
H
Наиболее часто встречается в
реакциях ароматических соединений
H
H
H
в) Свободнорадикальное замещение SR
(CH3)2CH + Cl
(CH3)2CCl + H
Этот тип реакций распространен в ряду алканов
34.
2. Реакции присоединенияОбозначаются символом A от англйского «Addition» - присоединение.
К ним относятся реакции присоединения различных реагентов к
кратным связям:
а) Нуклеофильное присоединение AN
R
R
-
+
C
O
+
OH
C
R
R
O
HO
б) Электрофильное присоединение AЕ
H2C
CH2
+
H
H2C
CH3
в) Свободнорадикальное присоединение AR
H2C
CH2
+
Cl
H2C
CH2Cl
35.
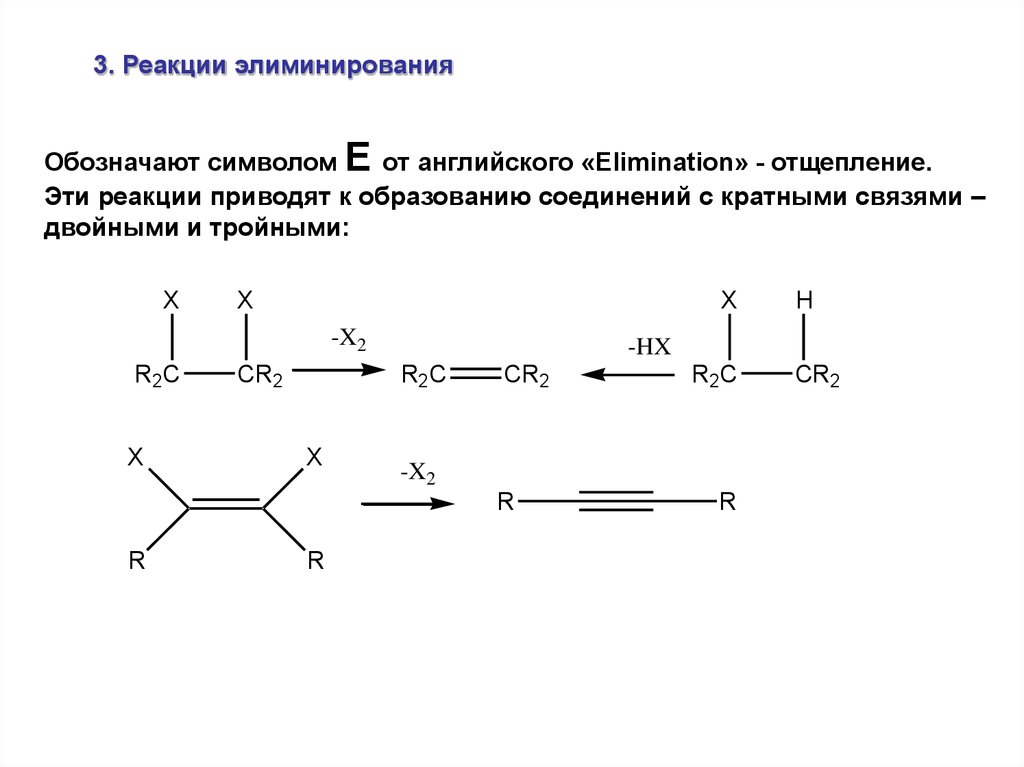
3. Реакции элиминированияОбозначают символом E от английского «Elimination» - отщепление.
Эти реакции приводят к образованию соединений с кратными связями –
двойными и тройными:
X
X
X
-X2
R2C
X
CR2
-HX
R 2C
X
CR2
R
R 2C
-X2
R
R
H
R
CR2
36.
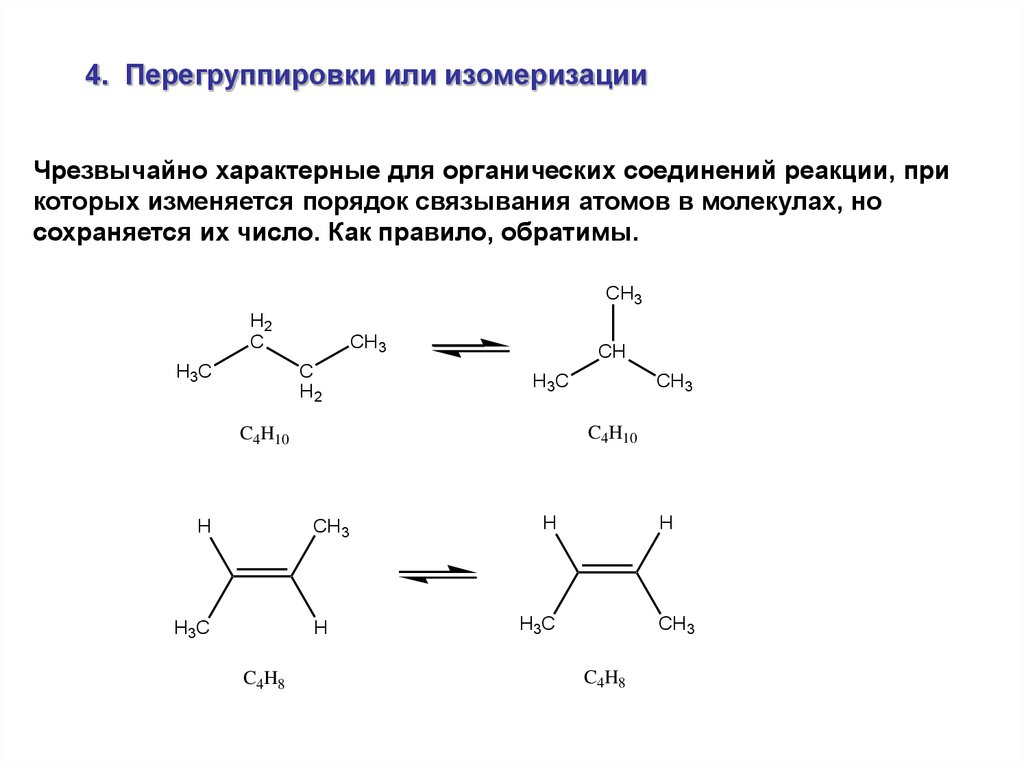
4. Перегруппировки или изомеризацииЧрезвычайно характерные для органических соединений реакции, при
которых изменяется порядок связывания атомов в молекулах, но
сохраняется их число. Как правило, обратимы.
CH3
H2
C
CH3
C
H2
H3C
CH
C4H10
C4H10
CH3
H
H
H3C
C4H8
CH3
H3C
H
H
CH3
H3C
C4H8
37.
5. Реакции окисления и восстановленияСопровождаются изменением степени окисления атома углерода,
Являющегося реакционным центром.
6. Реакции полимеризации и поликонденсации.
38.
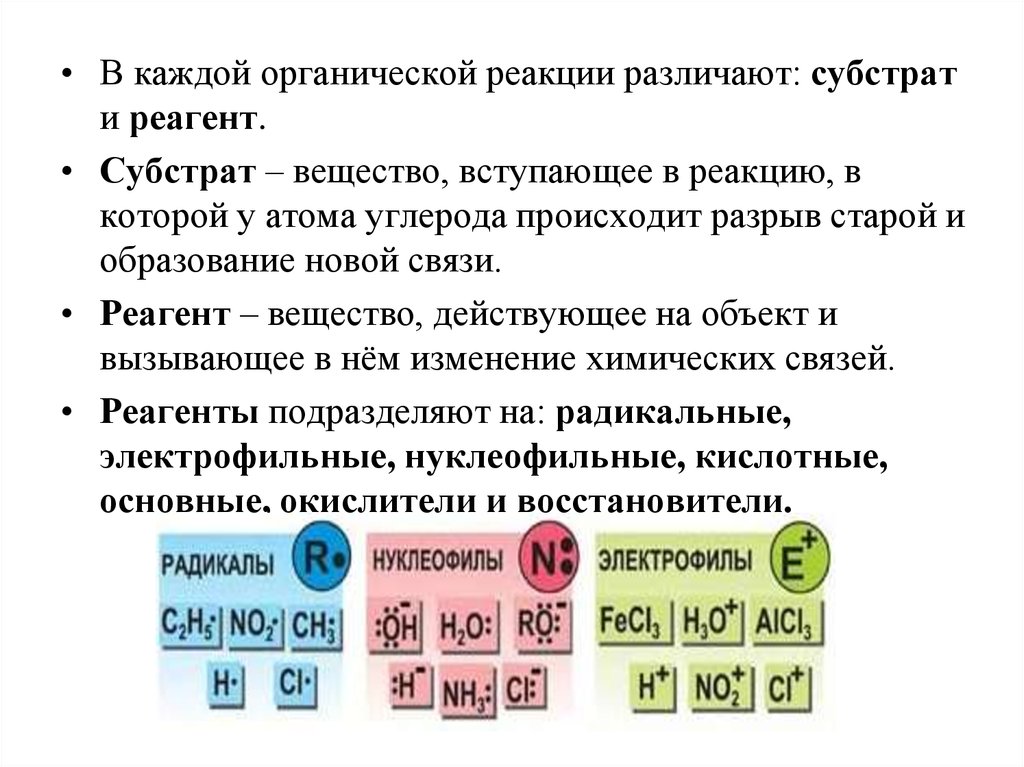
• В каждой органической реакции различают: субстрати реагент.
• Субстрат – вещество, вступающее в реакцию, в
которой у атома углерода происходит разрыв старой и
образование новой связи.
• Реагент – вещество, действующее на объект и
вызывающее в нём изменение химических связей.
• Реагенты подразделяют на: радикальные,
электрофильные, нуклеофильные, кислотные,
основные, окислители и восстановители.
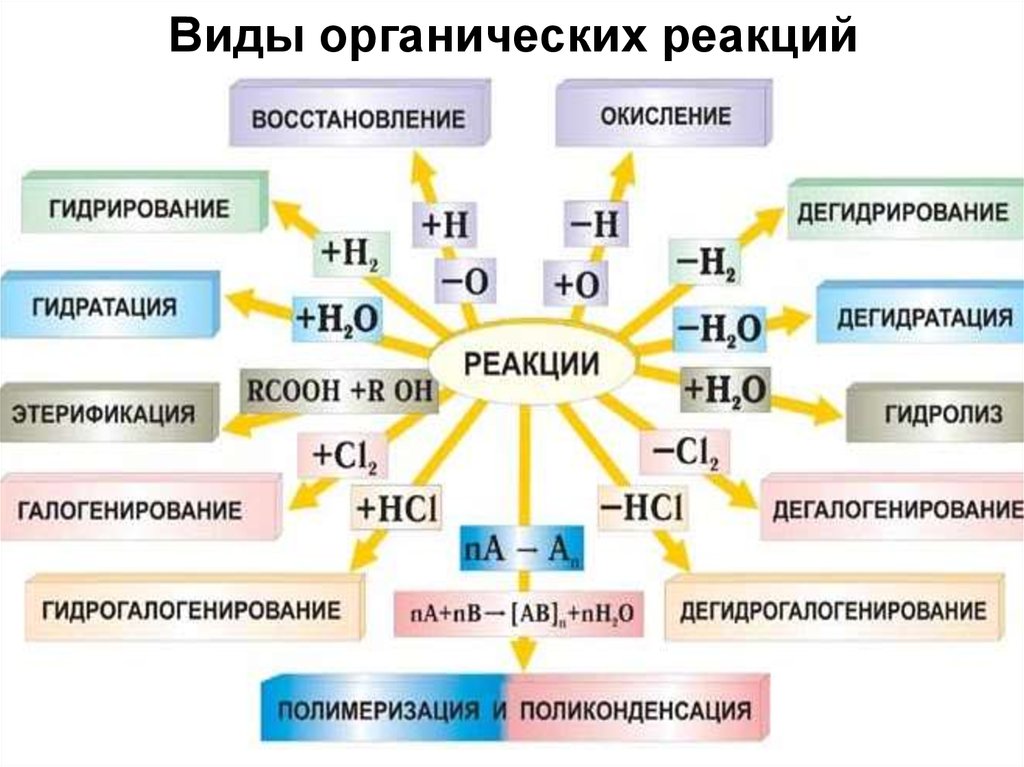
39. Виды органических реакций
40.
Кислотность и основностьорганических соединений.
41.
1. Протонная теория Дж.Бренстеда и Т.ЛоуриКислоты Бренстеда – нейтральные молекулы
или ионы, способные отдавать протон.
Классификация.
ОН – кислоты: карбоновые кислоты, спирты, фенолы
SН – кислоты: тиолы
NН – кислоты: амиды, имиды
СН – кислоты: углеводороды
41
42.
Оценка кислотности1. Сила кислоты характеризуется K дисс.
2. Качественно сила кислоты оценивается по стабильности
сопряженного основания (аниона, получающегося при
диссоциации).
Чем стабильнее анион, тем сильнее кислота
CH3COOH
кислота
H+ + CH3COO –
сопряженное основание
43.
Факторы, определяющие кислотность (стабильностьаниона)
а) Влияние ЭО атома в кислотном центре.
Чем больше ЭО атома в кислотном центре, тем сильнее
кислотные свойства, тем стабильнее анион.
C2H5OH
C2H5O- + H+ ; pK=15,8
этанол
этоксид-ион
C2H5NH2
Этиламин
C2H5NH- + H+
;
pK=30
ЭОO>ЭОN
значит C2H5O- стабильнее, чем C2H5NH- , и
кислотные свойства C2H5OH более выражены,
чем у C2H5NH2.
44. На ЭО атома влияет его гибридизация
ЭО С(sp3) ˂ ЭО С(sp2) ˂ ЭО С(sp)СН3 – СН3
pK=50-60
НС Ξ СН
pK=22
ЭО С(sp3) ˂ ЭО С(sp)
С2Н2 проявляет кислотные свойства, что подтверждается
химическими реакциями.
Ацетиленид меди (I) - качественная
реакция на кислотный Н, связанный с
атомом углерода при тройной связи
45.
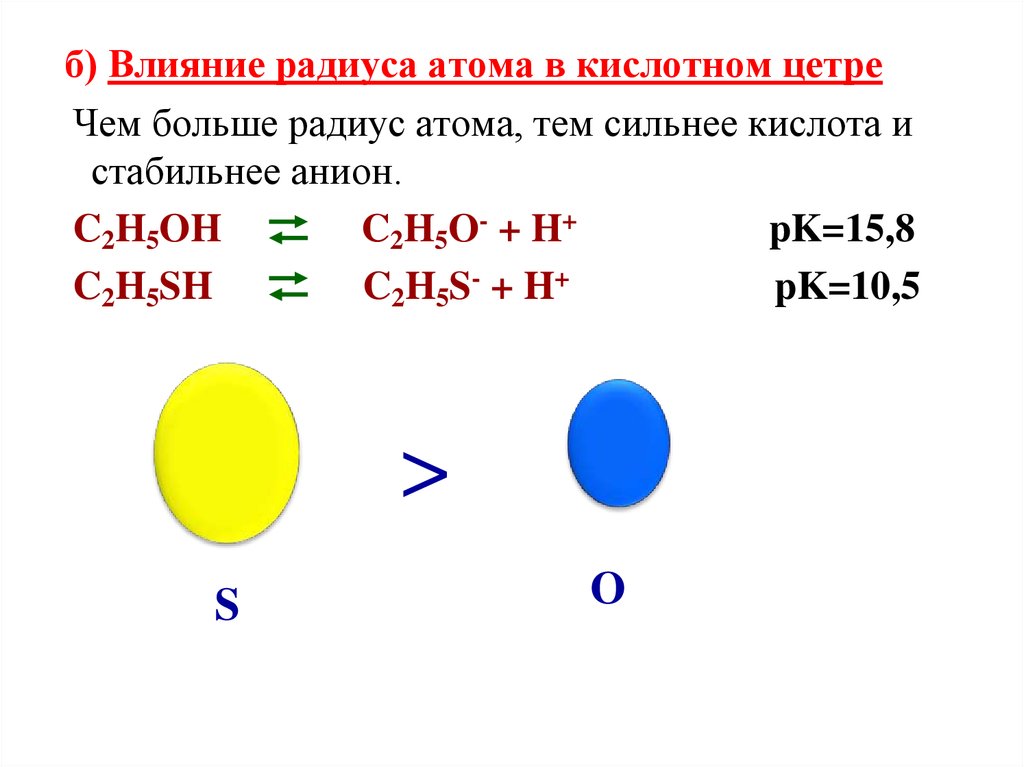
б) Влияние радиуса атома в кислотном цетреЧем больше радиус атома, тем сильнее кислота и
стабильнее анион.
C2H5OH
C2H5O- + H+
pK=15,8
C2H5SH
C2H5S- + H+
pK=10,5
>
S
O
46.
в) Влияние заместителейЗаместители с –I эффектом усиливают кислотность,
а с + I эффектом – ослабляют.
C2H5O- + H+
CBr3CH2O- + H+
C2H5OH
CBr3CH2OH
Br
Br
Br
C
CH2
CF3 - CH2OH
OH
Br
Br
Br
C
CH2
O
+
pK=15,8
pK=12,4
+
H
CF3 - CH2O- + H+
pK=11,4
47.
г) Влияние сопряженияУчастие в сопряжении усиливает кислотность
48.
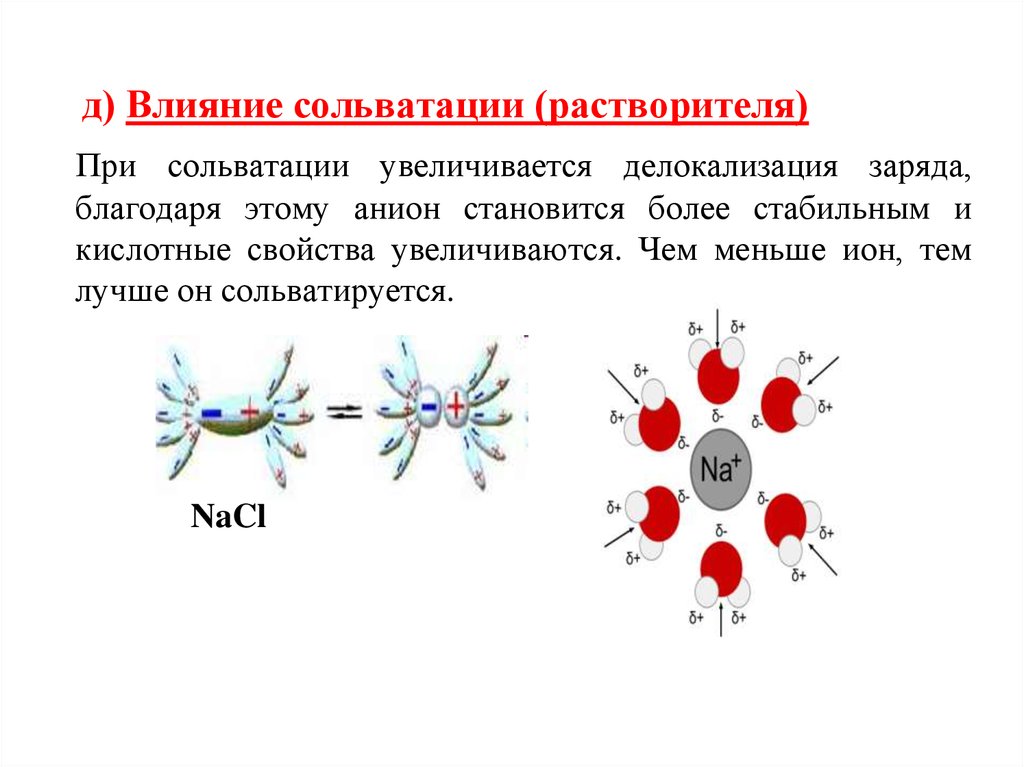
д) Влияние сольватации (растворителя)При сольватации увеличивается делокализация заряда,
благодаря этому анион становится более стабильным и
кислотные свойства увеличиваются. Чем меньше ион, тем
лучше он сольватируется.
NaCl
49.
Основания Бренстеда – нейтральныемолекулы или ионы, способные
присоединять протоны (акцепторы Н+).
π- основания:
молекулы с двойной или тройной связью, арены.
«ониевые» или n-основания,
молекулы или ионы, содержащие гетероатом S, N, O:
«S» – сульфониевые (пр. тиоэфиры);
«О» – оксониевые (пр. простые эфиры);
«N» – аммониевые (пр. амины, амиды).
49
50.
Факторы, влияющие на основностьа) Электроотрицательность элемента
Чем меньше ЭО, тем сильнее основность
б) Размер гетероатома
Чем радиус меньше, тем основность больше
в) Влияние заместителей
ЭД заместители увеличивают основность, ЭА –
уменьшают
г) Влияние сопряжения
Участие в сопряжении ослабляет основность
51. 2.Электронная теория Льюиса (1923).
Кислота- частица-акцептор
электронной пары (H+, BF3, AlCl3).
Основание – частица-донор
электронной пары (простые эфиры, тиоэфиры,
амины).
Основание Льюиса Кислота Льюиса
52.
Принцип жестких и мягких кислот и оснований(ЖКМО) Пирсона
Принцип ЖМКО
жесткие кислоты предпочтительно связываются с
жесткими основаниями,
а мягкие кислоты – с мягкими основаниями.
Названия жесткость и мягкость отражает способность
атомов кислот и оснований удерживать электроны.
52
53.
Жесткие кислоты – кислоты, в которых атом-акцепторпары электронов имеет небольшой размер, положительно
заряжен, обладает низкой поляризуемостью и высокой
электроотрицательностью.
Мягкие кислоты - кислоты, в которых атом акцептора
пары электронов имеет малый положительный заряд,
большой размер, обладает высокой поляризуемостью и
низкой электроотрицательностью.
53
54.
Жесткие основания – основания, в которых атом-донорпары электронов имеет низкую поляризуемость,
высокую электроотрицательность и трудно окисляется.
Мягкие основания - основания, в которых атом-донор
пары электронов обладает большой поляризуемостью,
низкой электроотрицательностью и легко окисляется.
54




























 chemistry
chemistry








