Similar presentations:
Теоретические основы органической химии
1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
Часть II1
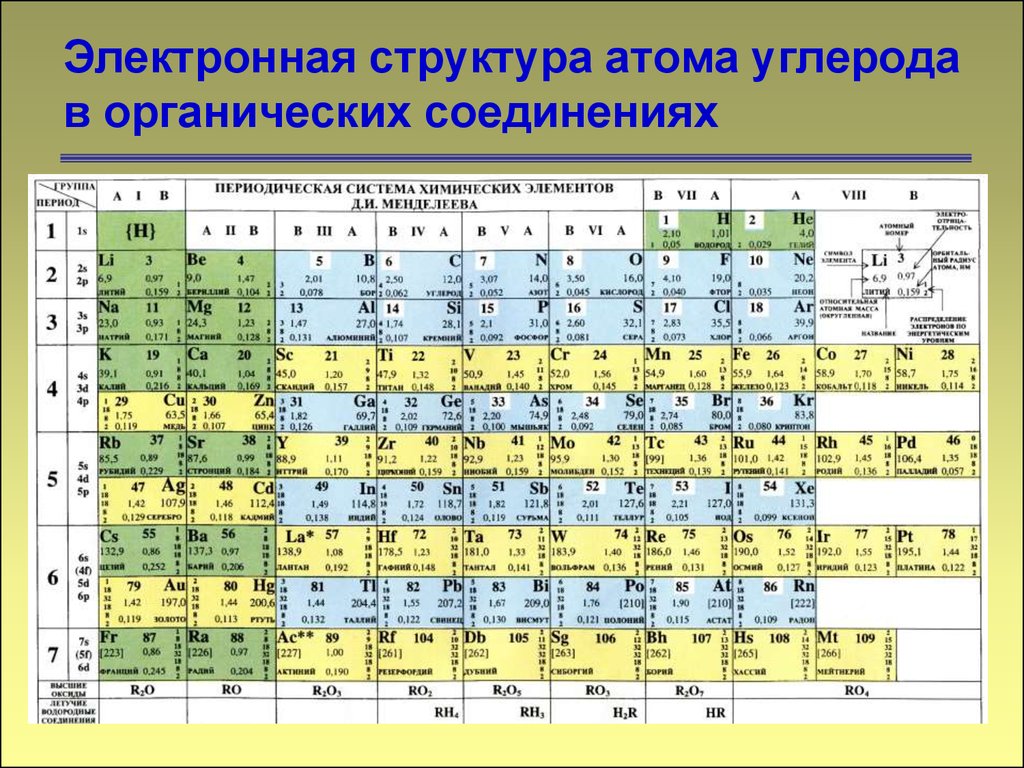
2. Электронная структура атома углерода в органических соединениях
23. Электронная структура атома углерода в органических соединениях
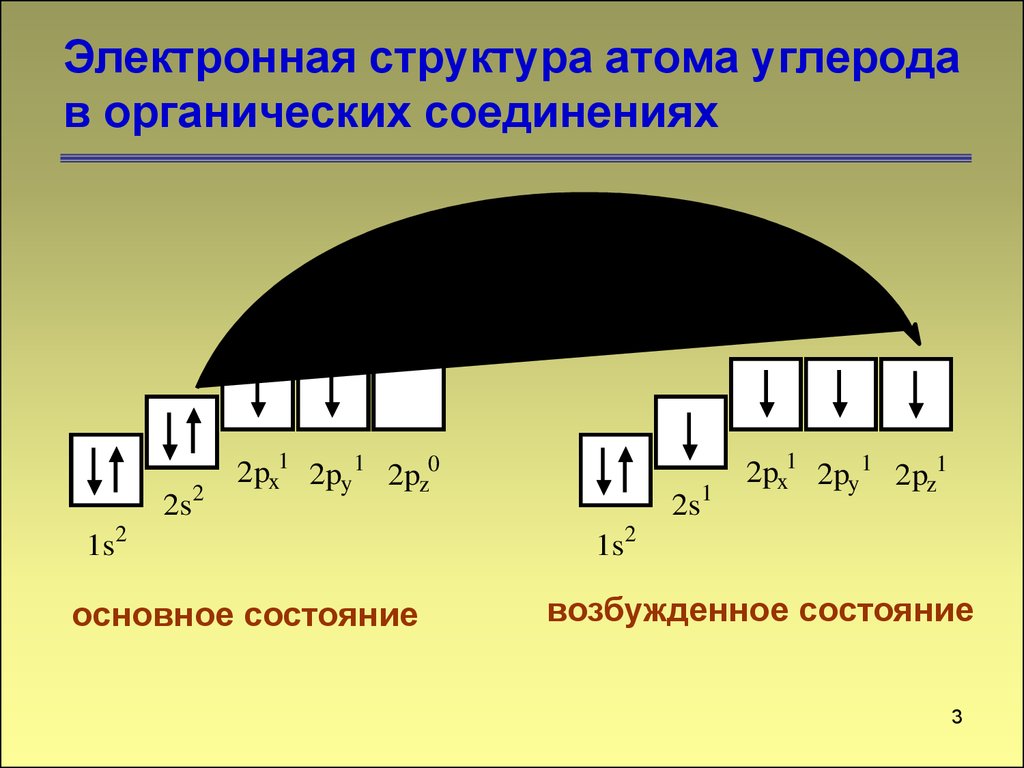
2s22px1 2py 1 2pz0
1s2
основное состояние
2s1
2px1 2py 1 2pz1
1s2
возбужденное состояние
3
4. Электронная структура атома углерода в органических соединениях
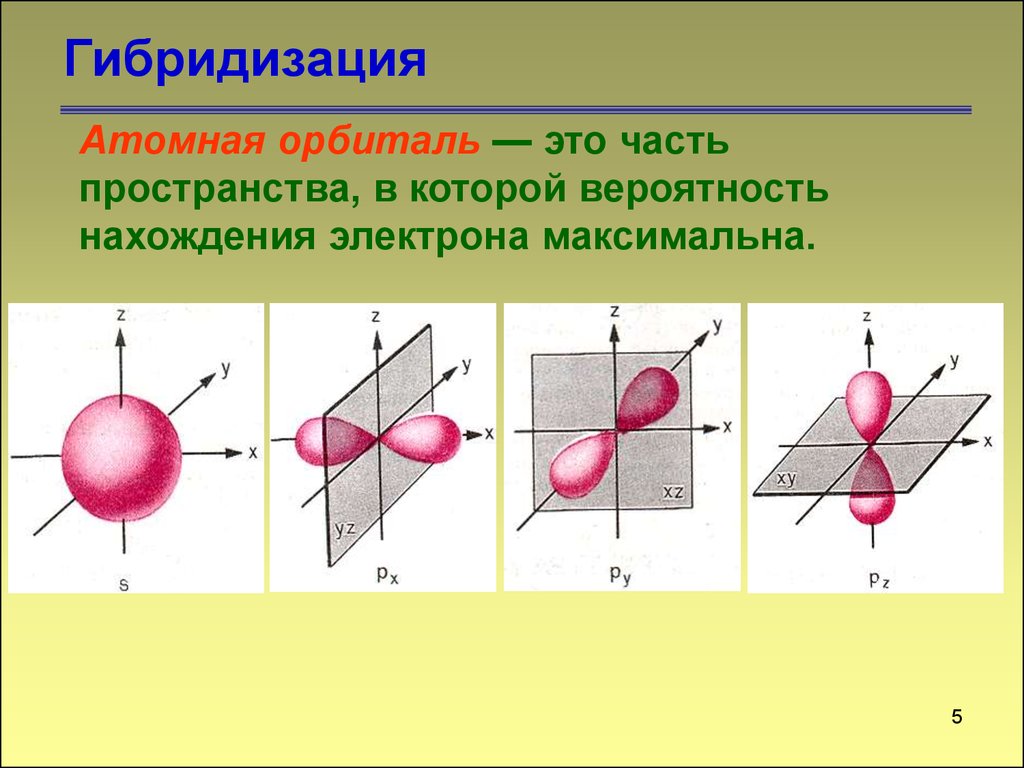
ГибридизацияАтомная орбиталь — это часть
пространства, в которой вероятность
нахождения электрона максимальна.
5
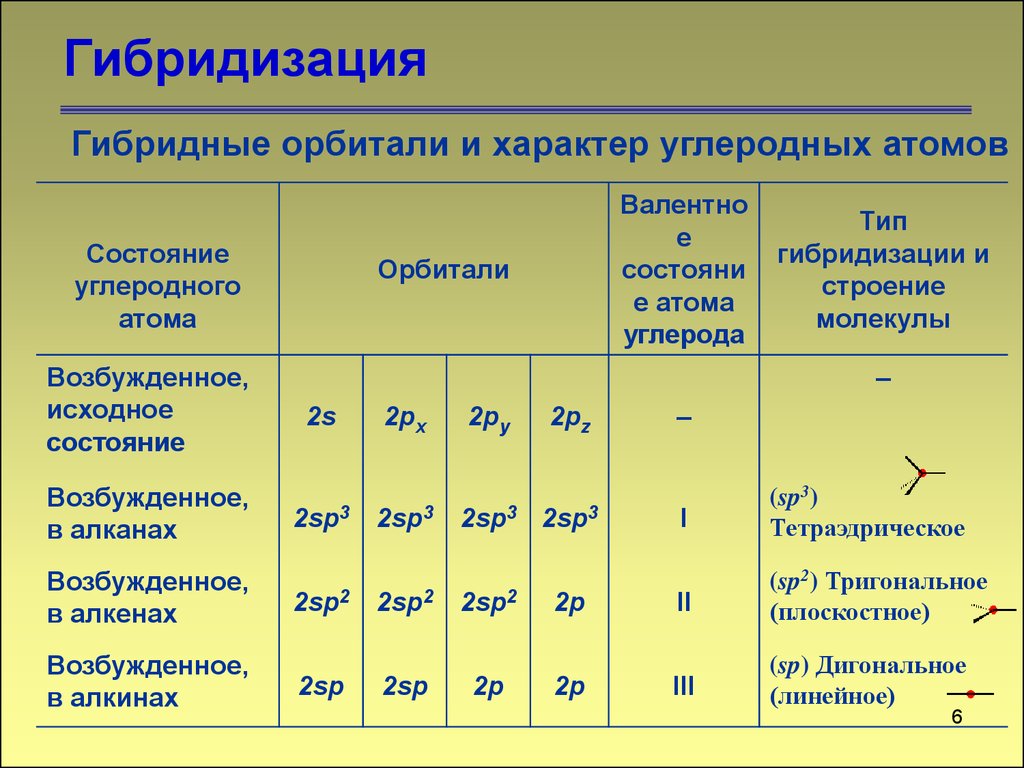
5. Гибридизация
Гибридные орбитали и характер углеродных атомовСостояние
углеродного
атома
Возбужденное,
исходное
состояние
Валентно
е
состояни
е атома
углерода
Орбитали
–
2s
2px
2py
2pz
Возбужденное,
в алканах
2sp3
2sp3
2sp3 2sp3
Возбужденное,
в алкенах
2sp2
2sp2
2sp2
Возбужденное,
в алкинах
Тип
гибридизации и
строение
молекулы
2sp
2sp
2p
2p
2p
–
I
(sp3)
Тетраэдрическое
II
(sp2) Тригональное
(плоскостное)
III
(sp) Дигональное
(линейное)
6
6. Гибридизация
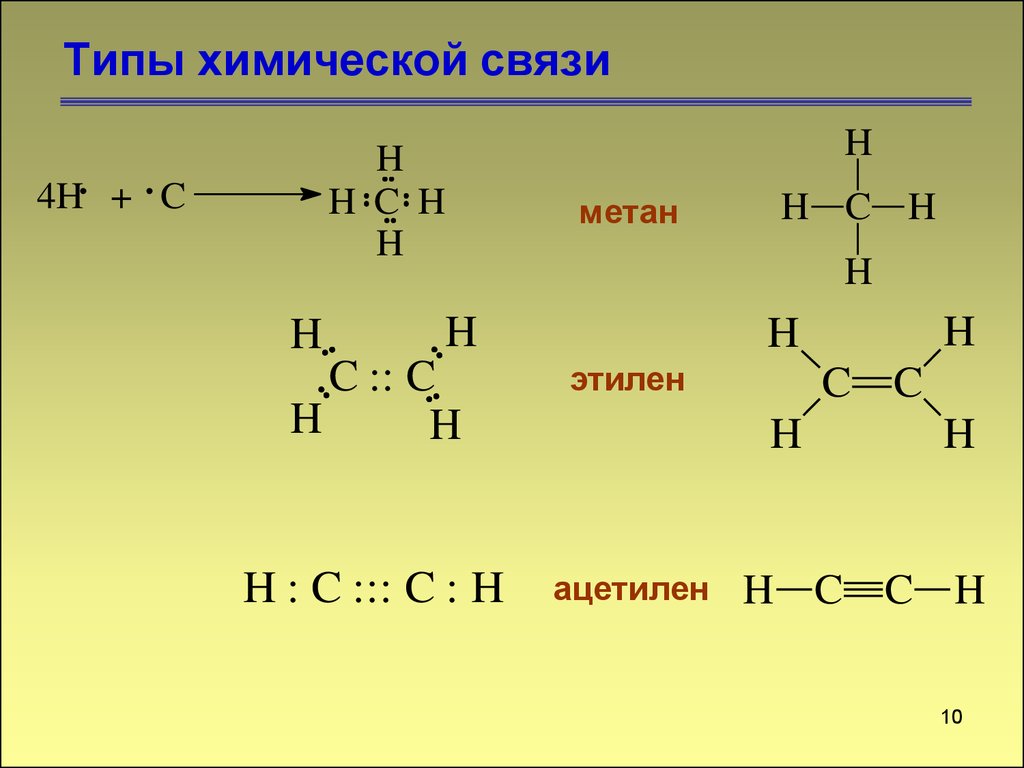
Типы химической связи7
7. Типы химической связи
88. Типы химической связи
99. Типы химической связи
HH C H
H
4H + C
H
H
метан
H C H
H
H
H
H
C :: C
H
H
этилен
H : C ::: C : H
ацетилен
C C
H
H
H C C H
10
10. Типы химической связи
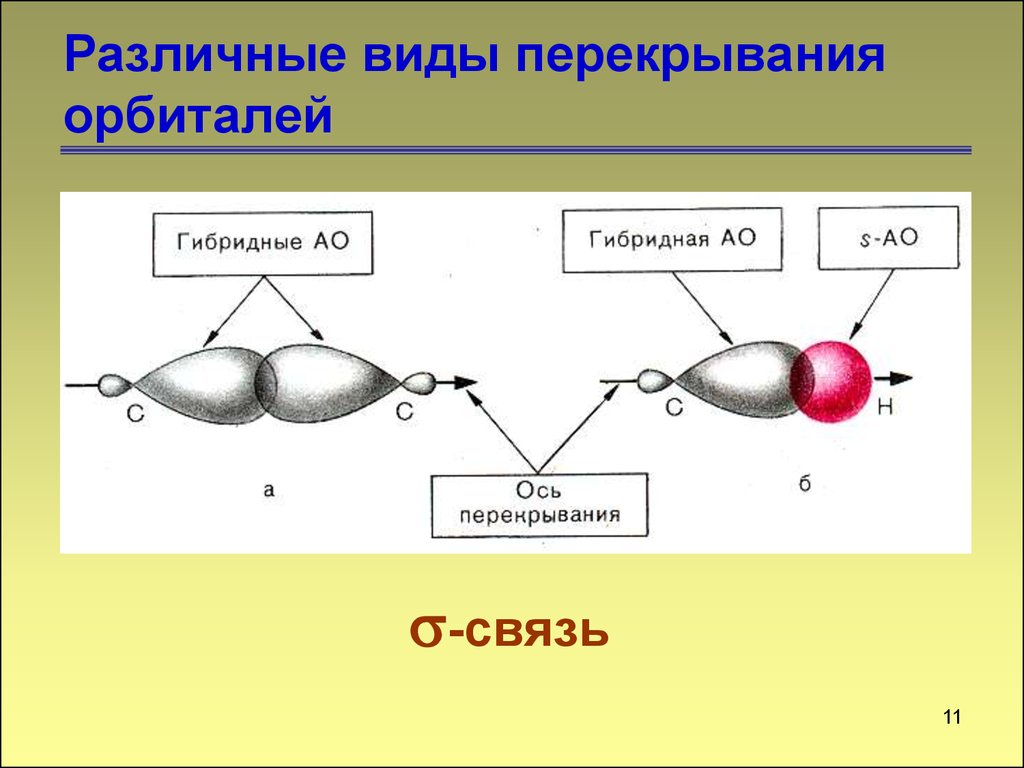
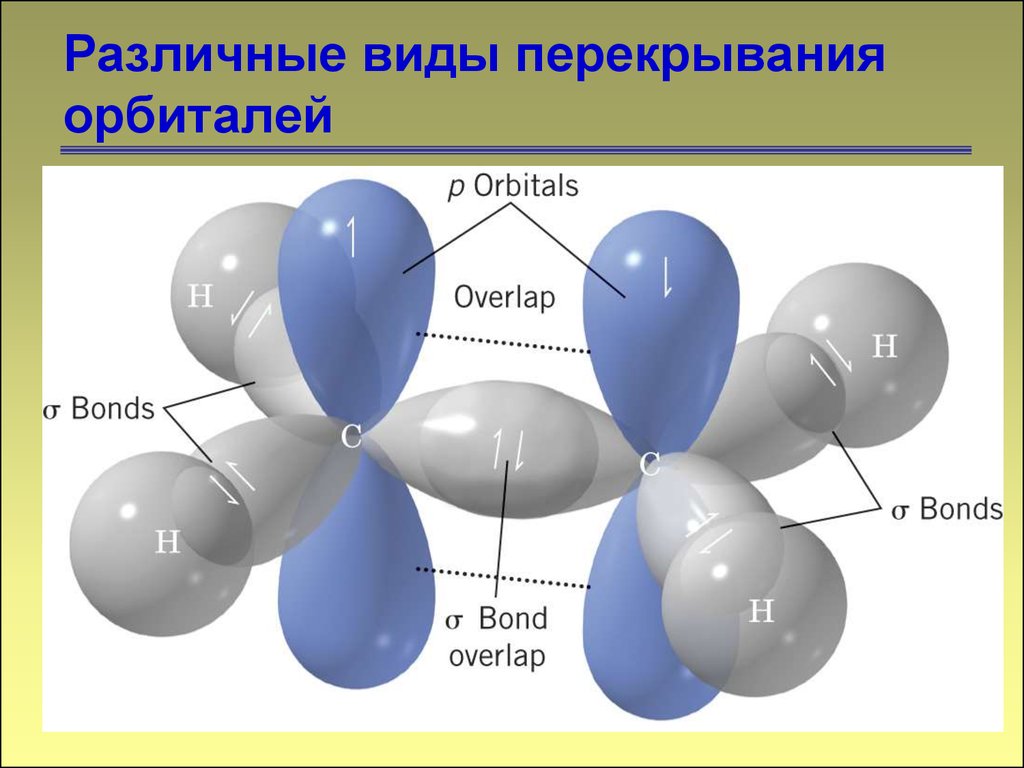
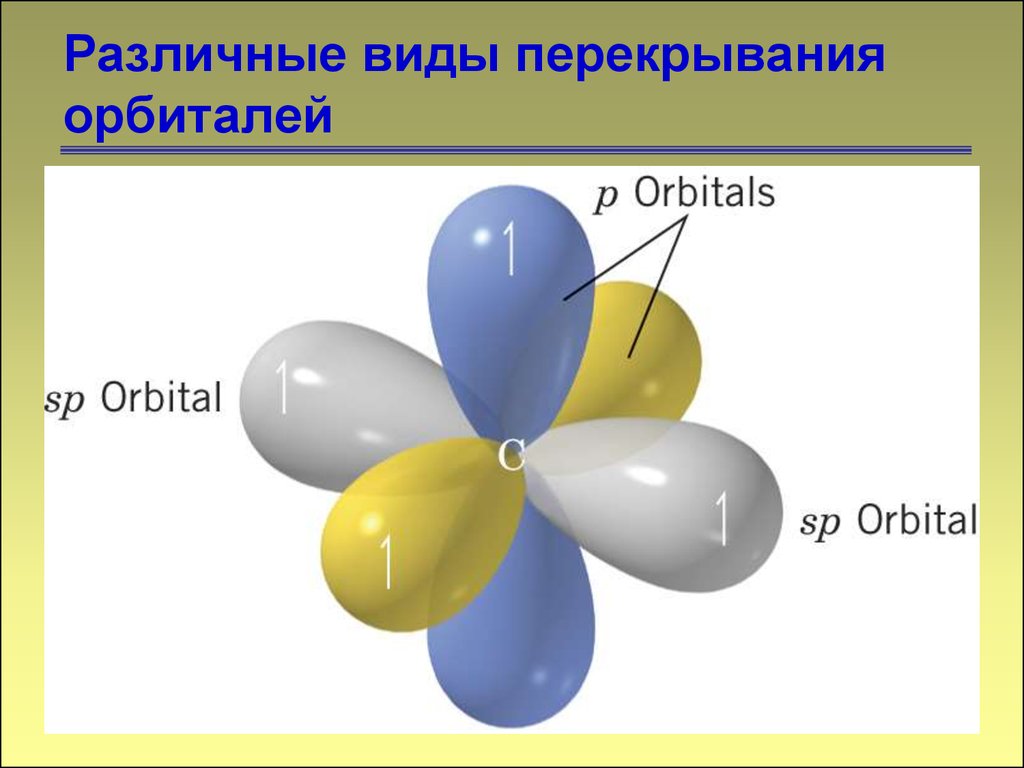
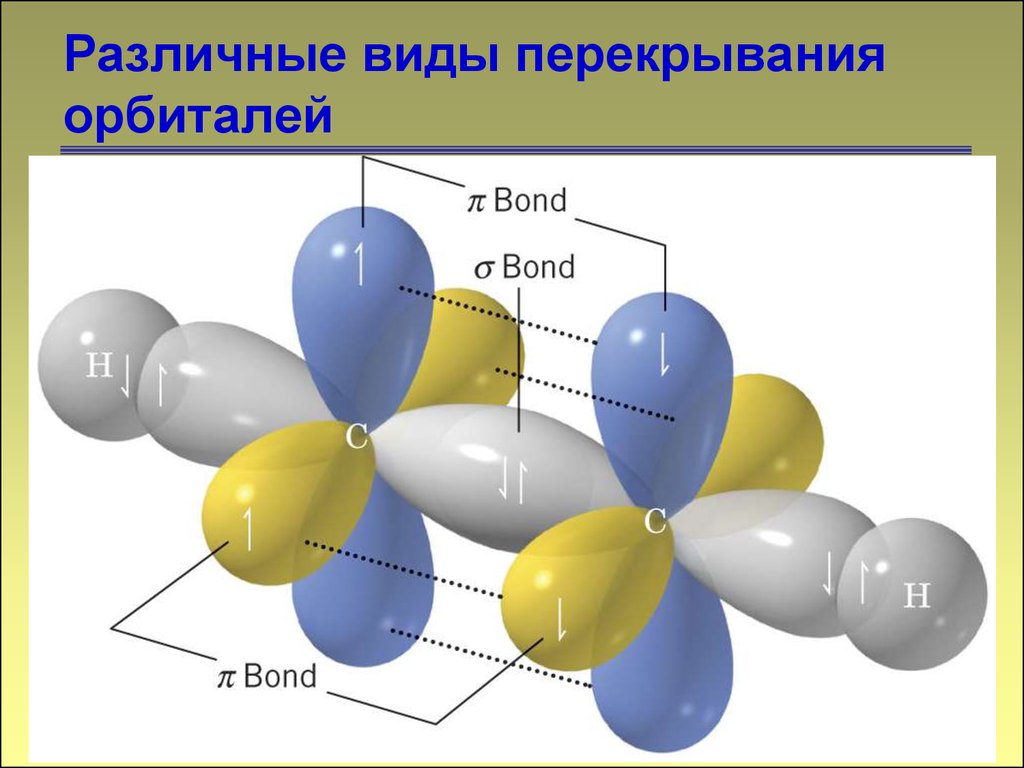
Различные виды перекрыванияорбиталей
-связь
11
11. Различные виды перекрывания орбиталей
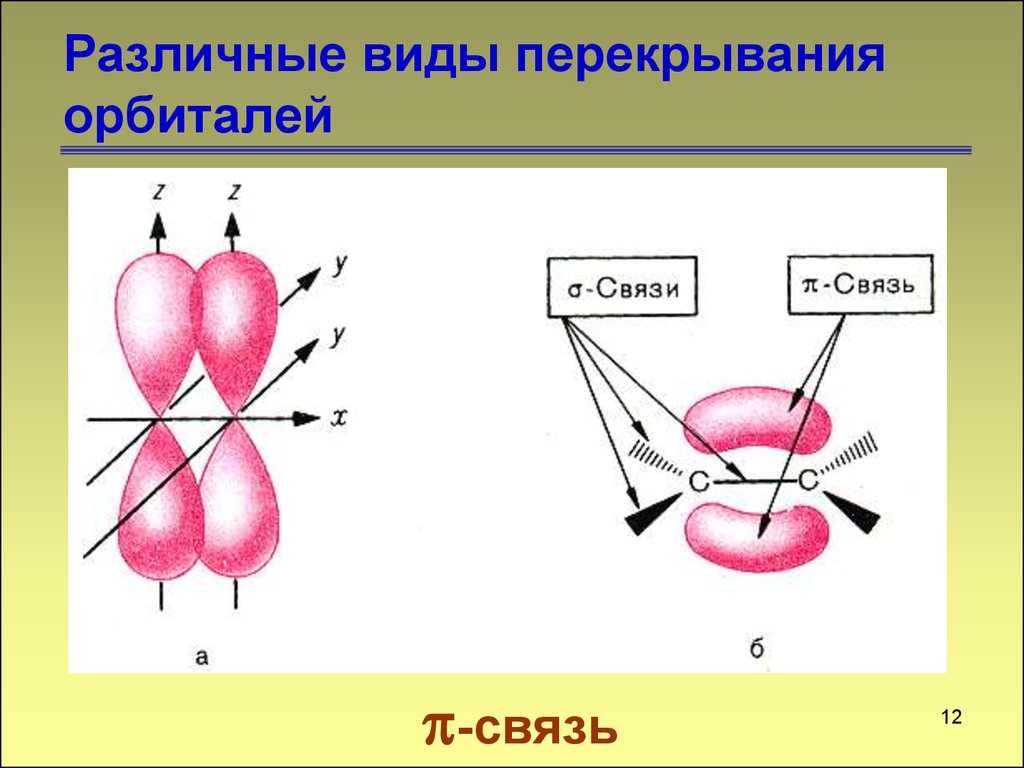
-связь12
12. Различные виды перекрывания орбиталей
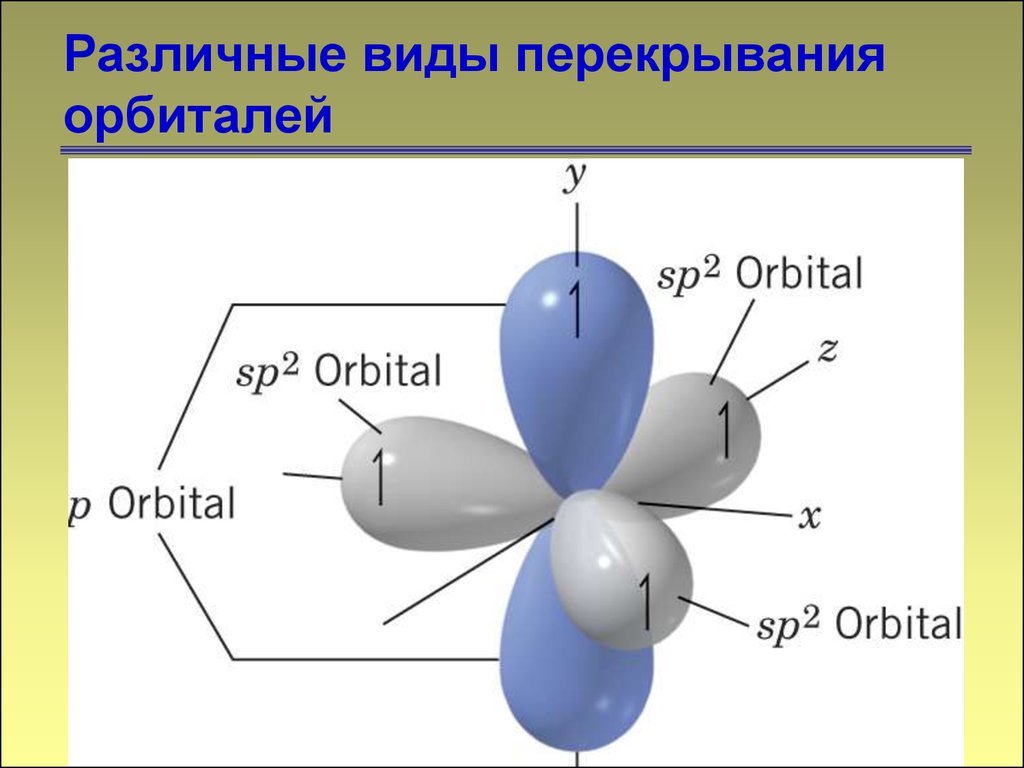
1313. Различные виды перекрывания орбиталей
1414. Различные виды перекрывания орбиталей
1515. Различные виды перекрывания орбиталей
1616. Различные виды перекрывания орбиталей
1717. Различные виды перекрывания орбиталей
Свойства ковалентной связиКовалентная связь характеризуется
несколькими параметрами:
полярностью, длиной, энергией и
направленностью в пространстве
(углами между связями).
18
18. Свойства ковалентной связи
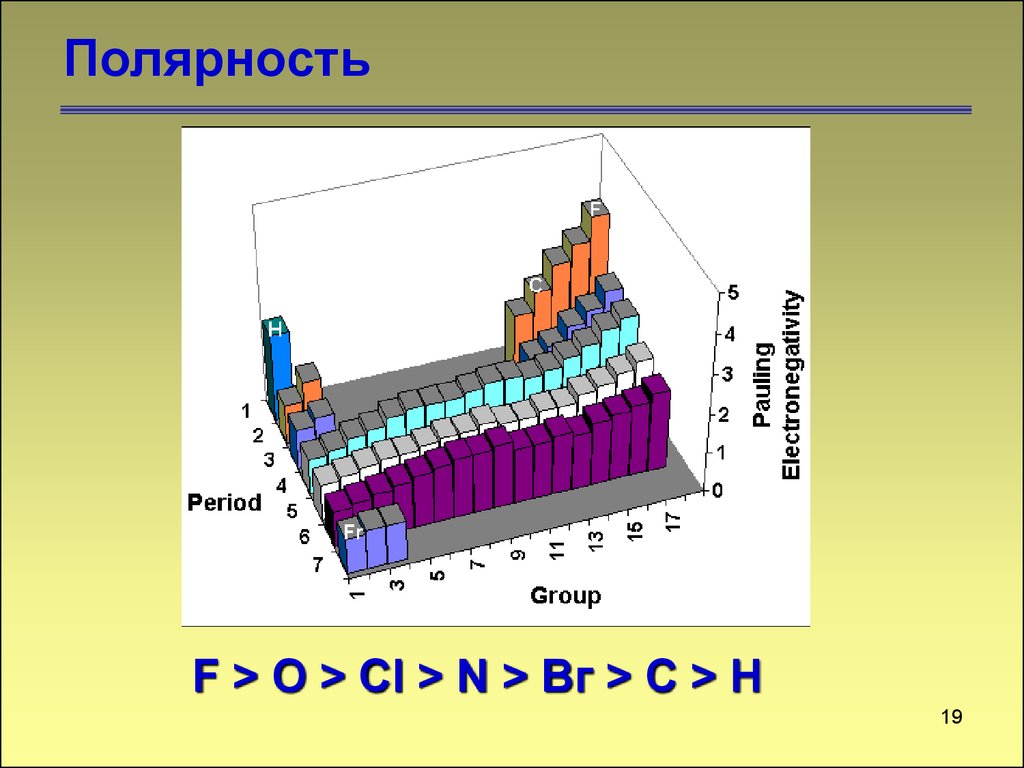
ПолярностьF > O > Сl > N > Вг > С > Н
19
19. Полярность
С ( sp) C ( sp2 ) C ( sp3 )H3C
Cl
20
20. Полярность
ПоляризуемостьКовалентная связь обладает
поляризуемостью — способностью
изменять свою полярность, например,
под влиянием внешнего воздействия.
-связи поляризуются гораздо легче,
чем -связи
21
21. Поляризуемость
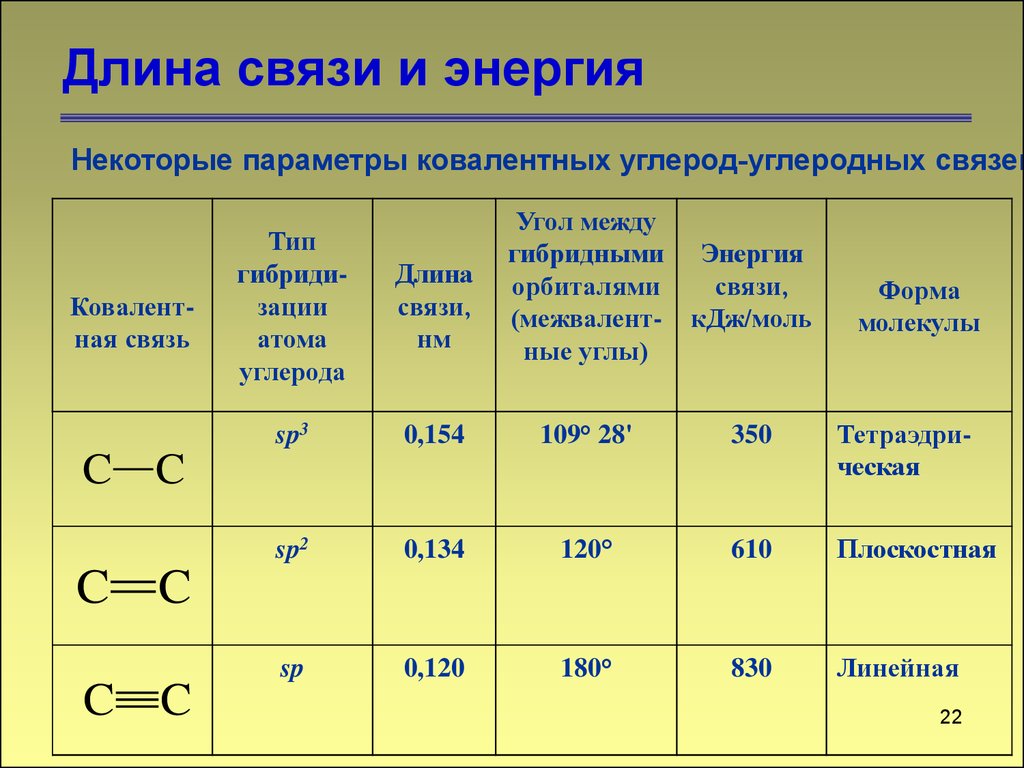
Длина связи и энергияНекоторые параметры ковалентных углерод-углеродных связей
Ковалентная связь
Угол между
гибридными Энергия
орбиталями
связи,
(межвалент- кДж/моль
ные углы)
Тип
гибридизации
атома
углерода
Длина
связи,
нм
sp3
0,154
109° 28'
350
Тетраэдрическая
sp2
0,134
120°
610
Плоскостная
sp
0,120
180°
830
Линейная
C C
Форма
молекулы
C C
C C
22
22. Длина связи и энергия
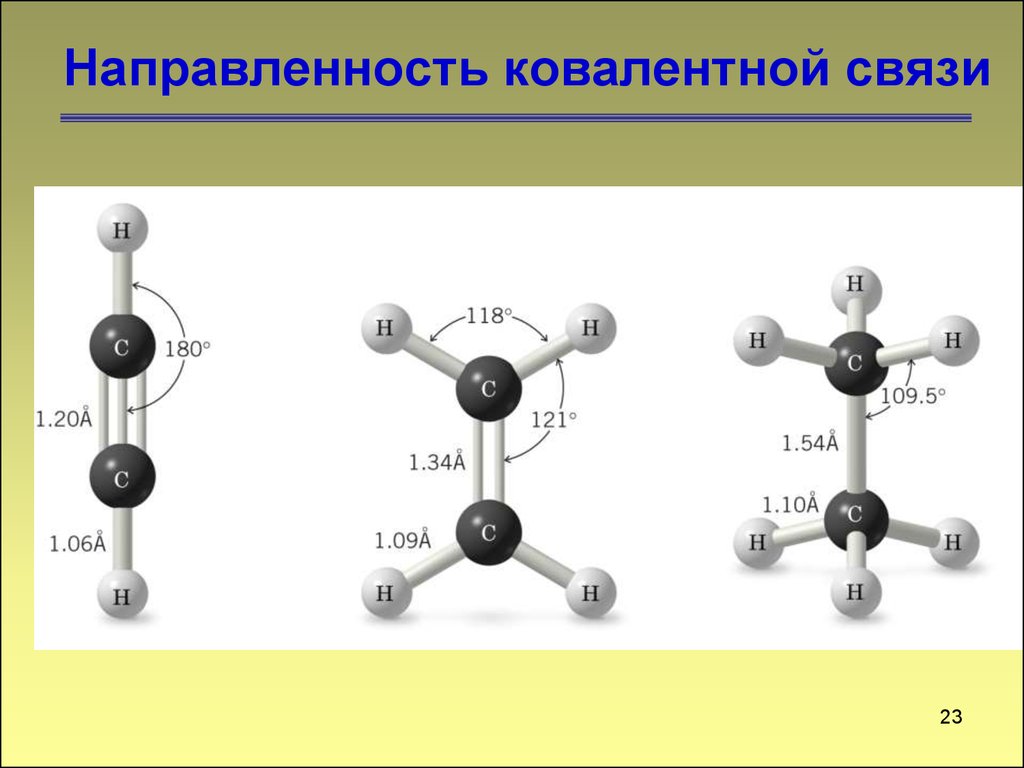
Направленность ковалентной связи23
23. Направленность ковалентной связи
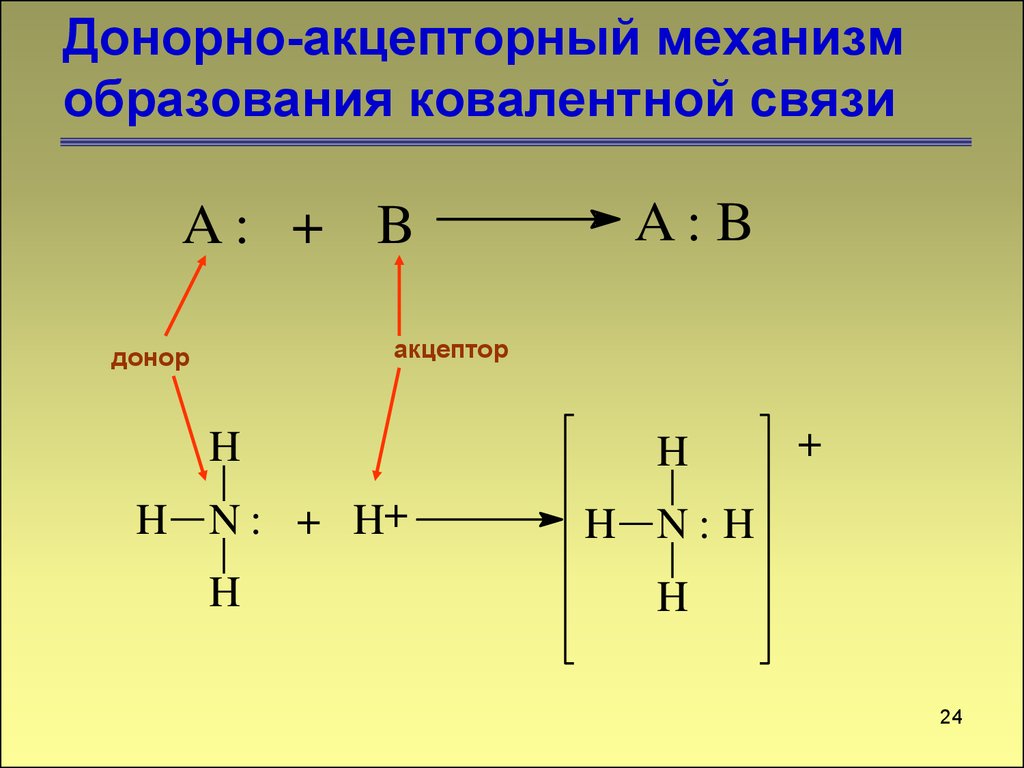
Донорно-акцепторный механизмобразования ковалентной связи
A: + B
A: B
акцептор
донор
H
H N : + H+
H
H
+
H N:H
H
24
24. Донорно-акцепторный механизм образования ковалентной связи
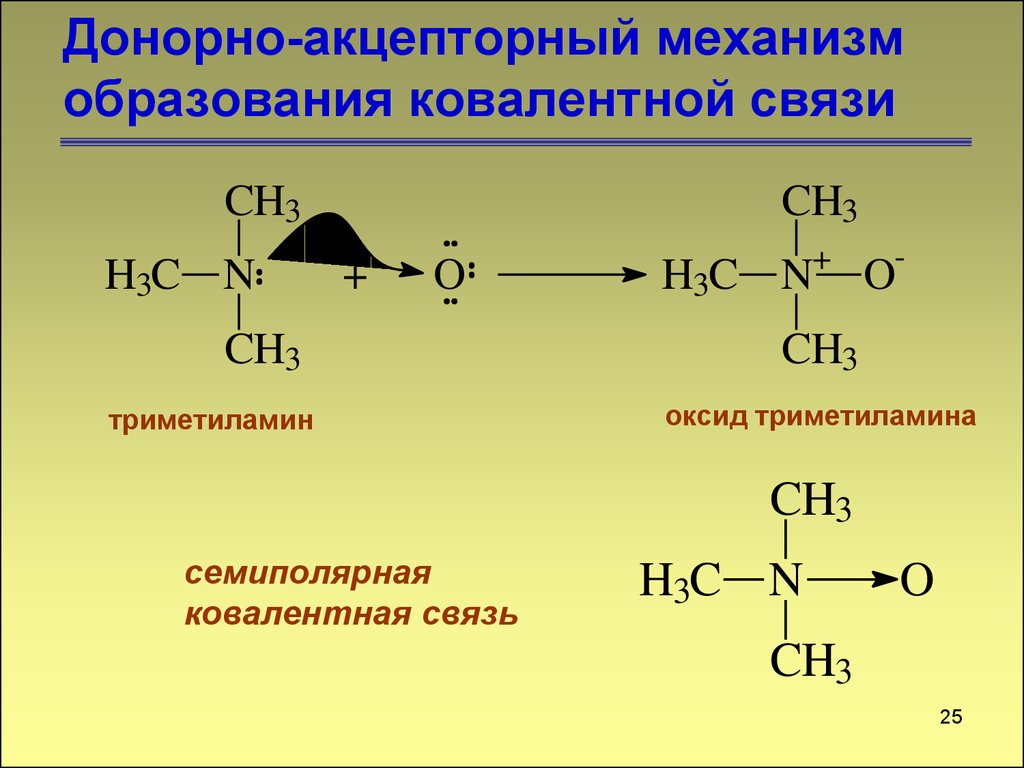
CH3H3C N
CH3
+
O
CH3
триметиламин
+
H3C N
-
O
CH3
оксид триметиламина
CH3
семиполярная
ковалентная связь
H3C N
O
CH3
25
25. Донорно-акцепторный механизм образования ковалентной связи
Водородная связь:O H
:O H
:O H
:O H
H
H
H
H
12,5—20 кДж/моль
26
26. Водородная связь
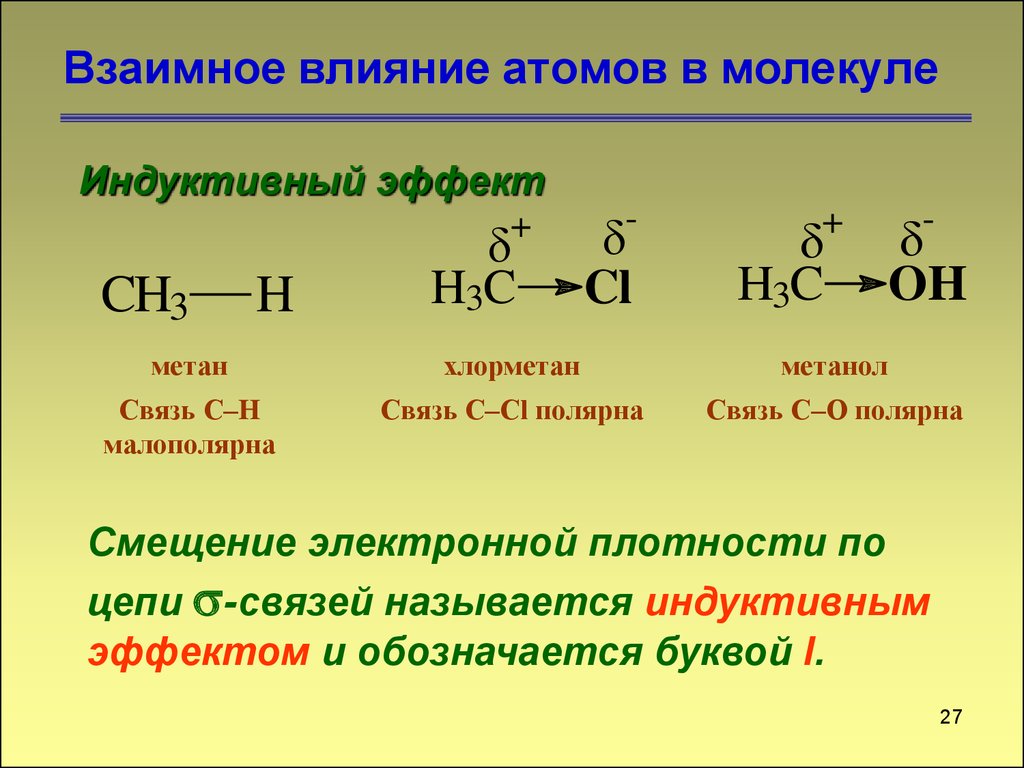
Взаимное влияние атомов в молекулеИндуктивный эффект
+
CH3
H
H3C
-
Cl
+
H3C
-
OH
метан
хлорметан
метанол
Связь C–H
малополярна
Связь C–Cl полярна
Связь C–O полярна
Смещение электронной плотности по
цепи -связей называется индуктивным
эффектом и обозначается буквой I.
27
27. Взаимное влияние атомов в молекуле
Индуктивный эффектH
Cl
Cl
H
Cl
Cl
H
H
COOH
COOH
pKa=5,67
pKa=6,07
I
II
28
28. Взаимное влияние атомов в молекуле
Индуктивный эффектЭлектроноакцепторные заместители,
т.е. атом или группа атомов, смещающие
электронную плотность -связи от атома
углерода, проявляют отрицательный
индуктивный эффект (-I-эффект).
Электронодонорные заместители, т. е. атом
или группа атомов, смещающие электронную
плотность к атому углерода, проявляют
положительный индуктивный эффект
29
(+I-эффект).
29. Взаимное влияние атомов в молекуле
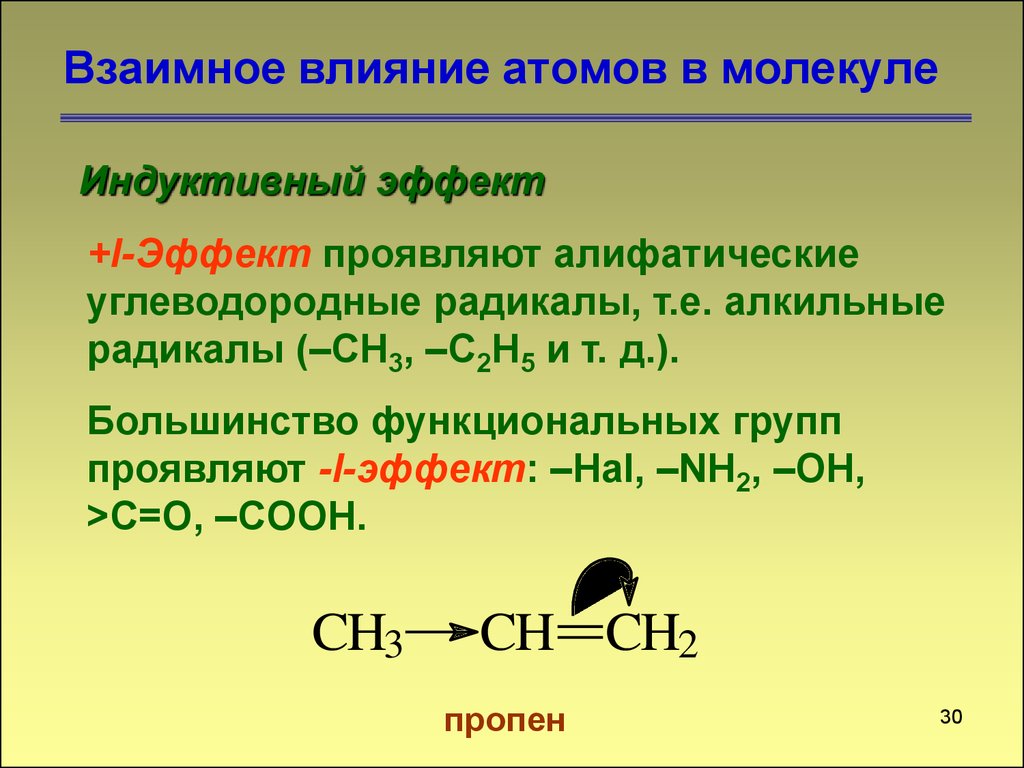
Индуктивный эффект+I-Эффект проявляют алифатические
углеводородные радикалы, т.е. алкильные
радикалы (–CH3, –C2H5 и т. д.).
Большинство функциональных групп
проявляют -I-эффект: –Hal, –NH2, –OH,
>С=O, –COOH.
CH3
CH CH2
пропен
30
30. Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)C
+
C
O
O
2
1
C
O
3
Делокализованная связь
O
CH3 C
CH
O -
-
O
--
O
O
CH3 C
O
CH3 C
O
31
31. Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)32
32. Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)-
O
O
OH
O
O
-
-
+ H2O
+ H3O+
-
OH
+ OH
+ OH
+ OH
-
-
33
33. Взаимное влияние атомов в молекуле
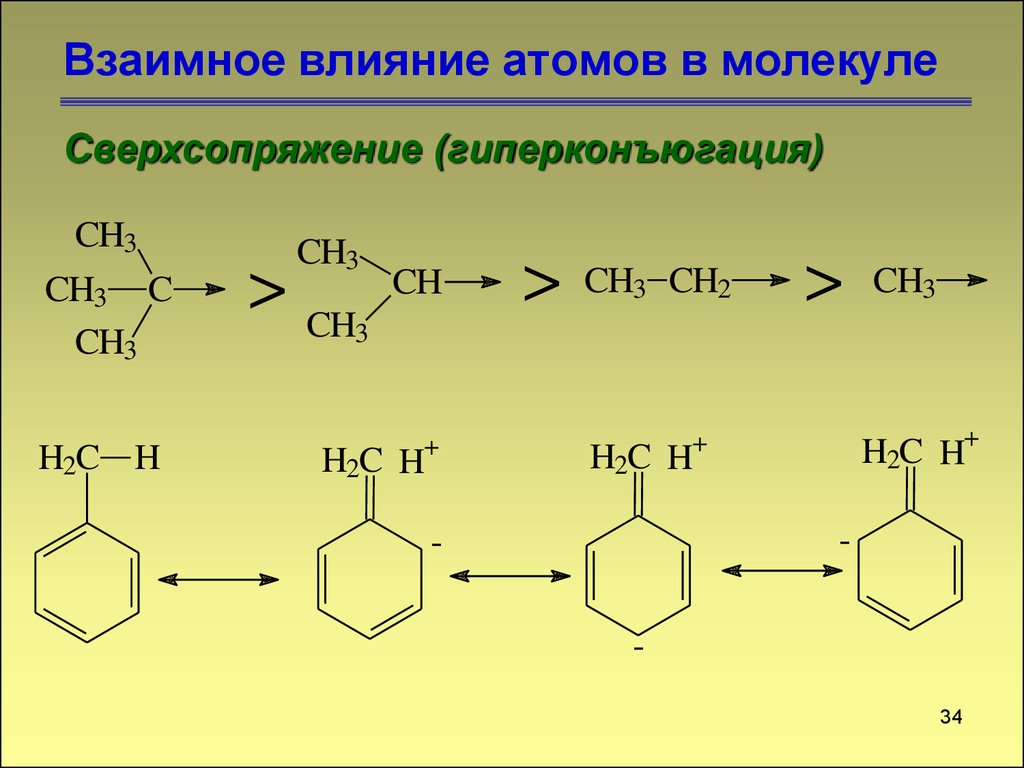
Сверхсопряжение (гиперконъюгация)CH3
CH3 C
CH3
H2C H
CH3
> CH
CH
>
CH3 CH2
>
CH3
3
+
H2C H
H2C H+
+
H2C H
-
-
34
34. Взаимное влияние атомов в молекуле
Сверхсопряжение (гиперконъюгация)CH3
H
H C
CH3
CH CH2
H C CH CH2
H
H
CH3
CH3
C
H
CH CH2
CH3
C
CH CH2
CH3
35
35. Взаимное влияние атомов в молекуле
Сверхсопряжение (гиперконъюгация)CH3
CH3 C CH CH3
2-метилбут-2-ен
CH3
CH3 CH2 C CH2
2-метилбут-1-ен
36
















 chemistry
chemistry








