Similar presentations:
Химия (Органическая химия)
1. Мы все к двадцатилетнему возрасту были бы великими химиками, математиками, ботаниками, зоологами, если бы в детстве жгучее любопытство ко в
Мы все к двадцатилетнемувозрасту были бы великими
химиками, математиками,
ботаниками, зоологами, если
бы в детстве жгучее
любопытство ко всему
окружающему не ослабевало
бы в нас
К.И. Чуковский
2. Химия (Органическая химия)
3. Котов Александр Дмитриевич
• Доктор химическихнаук
• Профессор
• kotad@mail.ru
kot@bio.uniyar.ac.ru
4. Органическая химия
• Лекции – 16 ч (8 лекций)• Лабораторные работы – 32 ч
(16 занятий)
(халат, перчатки, правила ТБ)
• Экзамен – НХ + ОХ + экзамен
(ОХ - рейтинговая система)
5. Рейтинг
Лекции – до 40 баллов (8 5)
Лабораторные занятия (отчеты) –
до 300 баллов (15 20)
Домашние самостоятельные работы
– до 80 баллов (16 5)
Контрольные работы –
до 160 баллов (16 10)
Творческие дополнительные задания
- до 100 баллов
6. Органическая химия
Штрафы – прогулы, несоблюдение ТБ
Допуск к экзамену если > 250
баллов
7. Г.С. Миронов В.Ю. Орлов А.Д. Котов Курс органической химии для биологов и экологов Учебное пособие
8. Органическая химия
В электронном виде:
Справочники
Учебники
Программа курса
Оформление отчета
9. Лекция №1
10. Правила поведения на лекции
Не опаздывать!
Поздороваться с лектором!
Отключить телефоны
Не шуметь
Не отвлекать других слушателей
Не спать (или хотя бы не храпеть)
Стремиться понять лектора
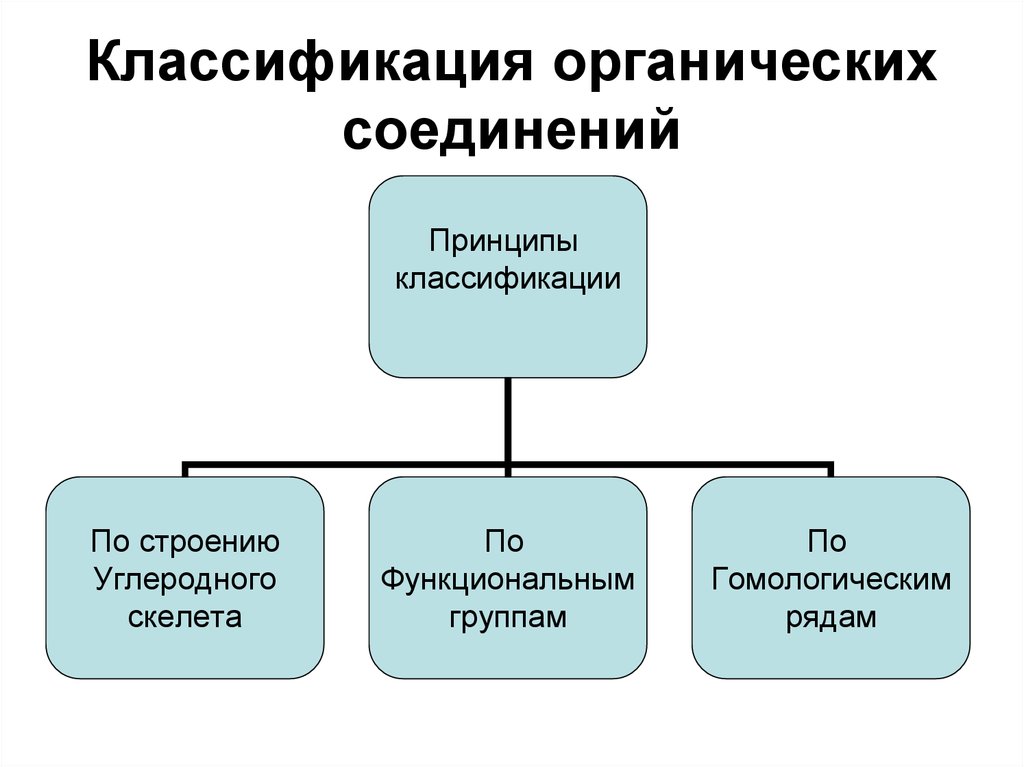
11. Классификация органических соединений
Принципыклассификации
По строению
Углеродного
скелета
По
Функциональным
группам
По
Гомологическим
рядам
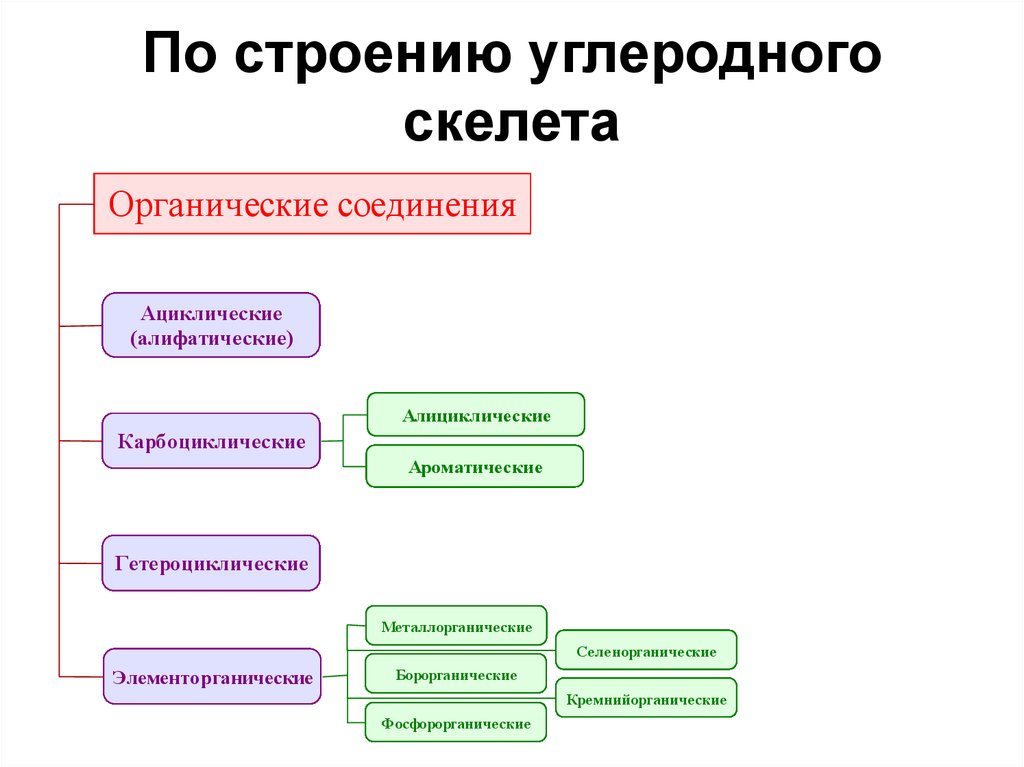
12. По строению углеродного скелета
Органические соединенияАциклические
(алифатические)
Алициклические
Карбоциклические
Ароматические
Гетероциклические
Металлорганические
Селенорганические
Элементорганические
Борорганические
Кремнийорганические
Фосфорорганические
13. По функциональным группам
углеводороды (R-Н)
галогенуглеводороды (R-Hаl)
спирты (R-ОН)
альдегиды (R-CН=О)
кетоны (RR’C=О)
кислоты (R-СОOH)
14. По функциональным группам
простые эфиры (ROR’)
сложные эфиры (RCОOR’)
амины (R-NH2)
нитросоединения (R-NO2)
нитрилы (R-C N)
сульфокислоты (R-SO3Н)
тиоспирты или тиолы (R-SH)
15. По гомологическим рядам
• Ряд соединений, сходных похимическим свойствам,
имеющих общую эмпирическую
формулу, в которой каждый
последующий член отличается от
предыдущего на группу СН2
(гомологическая разность),
называется гомологическим рядом
16. По гомологическим рядам
• АлканыСnH2n+2
• Циклоалканы
СnH2n
• Алкены
СnH2n
• Алкадиены
СnH2n-2
• Алкины
СnH2n-2
• Арены (ароматические):
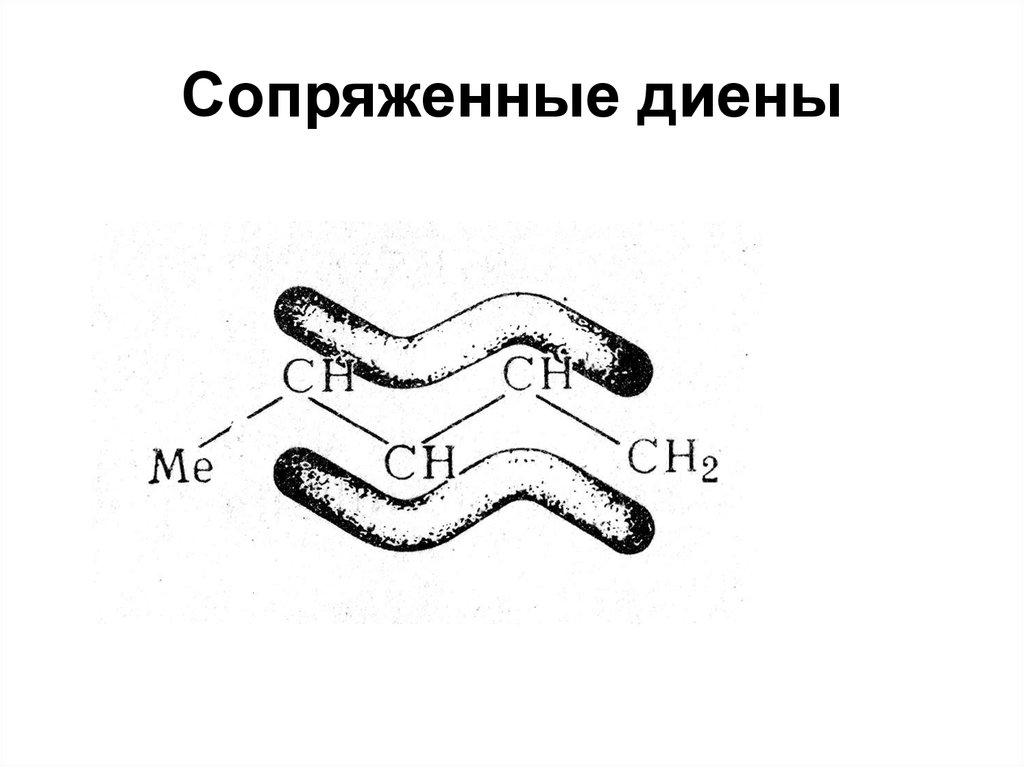
ряд бензола
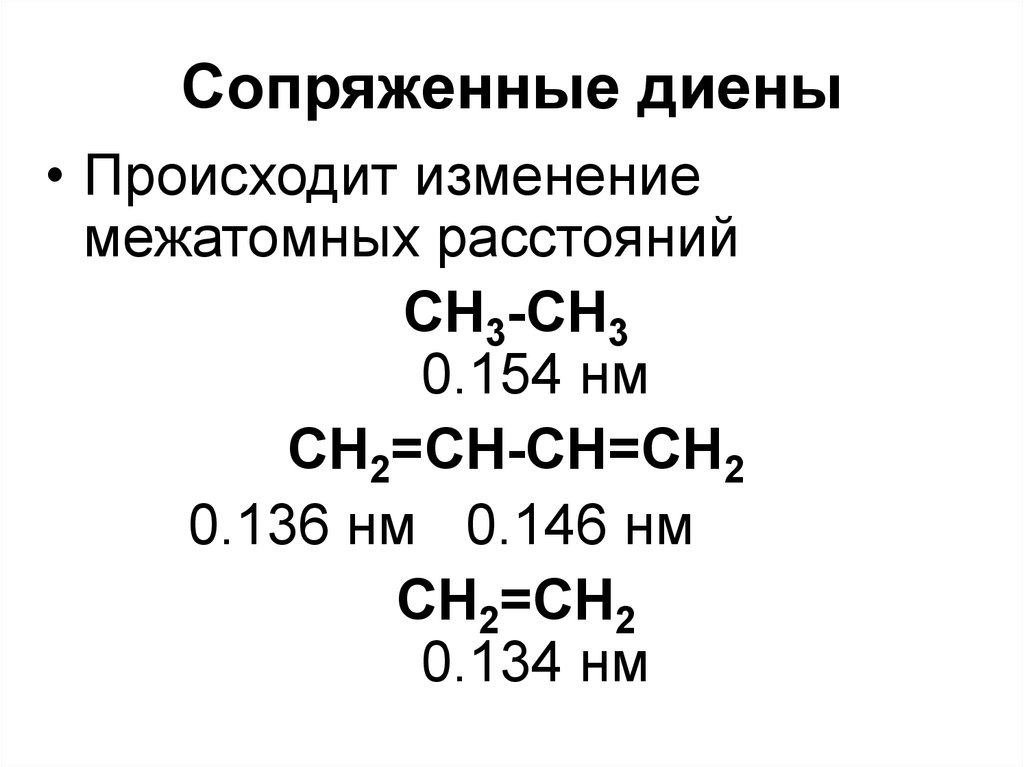
СnH2n-6
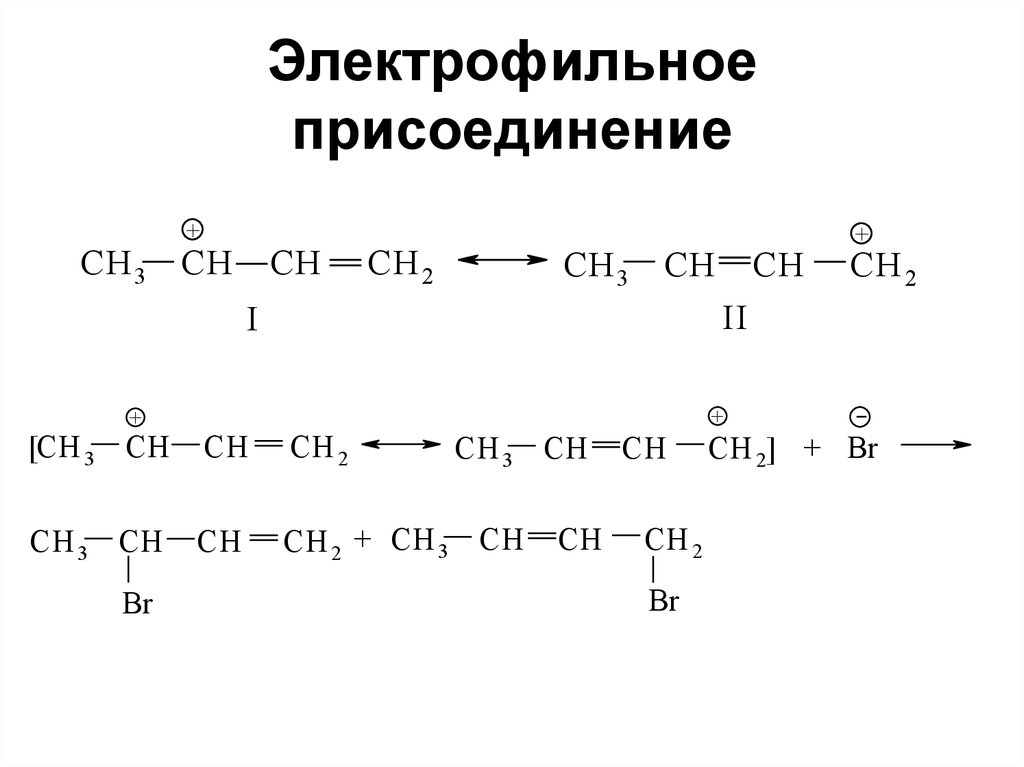
полиядерные и конденсированные
17. Гомологические ряды
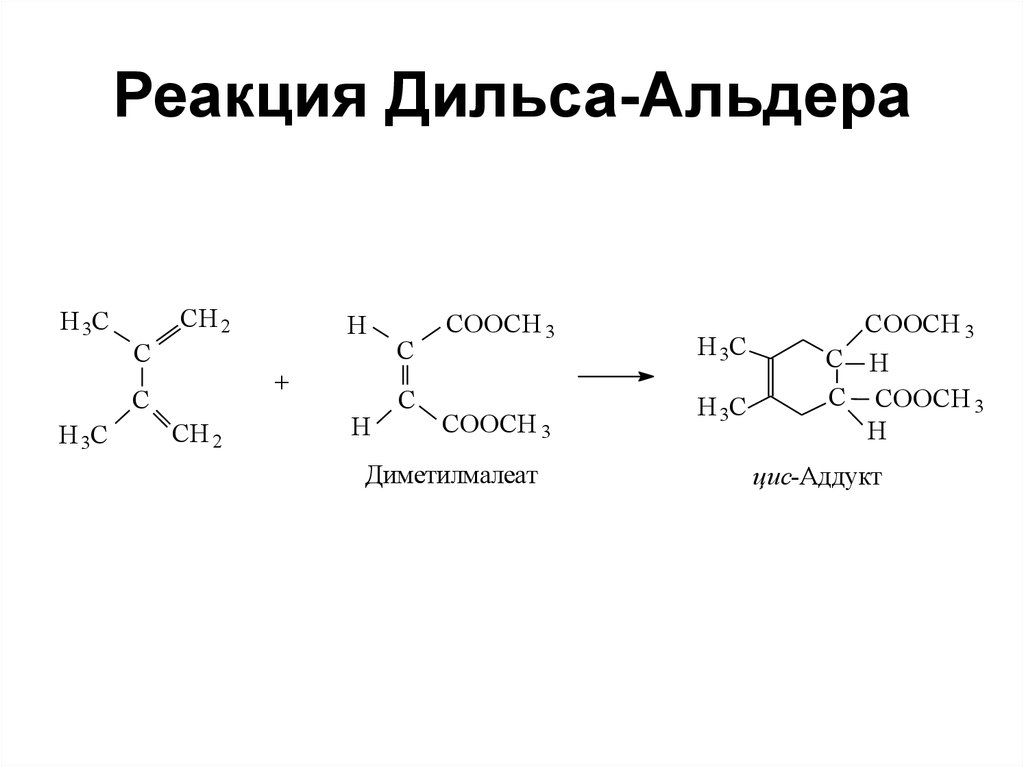
• Предельные спиртыСnH2n+1OH
• Предельные кислоты
СnH2n+1СООН
• Ароматические кислоты
ряда бензола
СnH2n-7СООН
18. Номенклатура органических соединений
• Тривиальная• Рациональная
• Систематическая
(заместительная и радикально –
функциональная)
19. Систематическая номенклатура
СН4 - метан, С2Н6 - этан,С3Н8 - пропан, С4Н10 - бутан,
С5Н12 - пентан, С6Н14 - гексан,
С7Н16 - гептан, С8Н18 - октан,
С9Н20 - нонан, С10Н22 - декан
C14H30 - тетрадекан
20. Систематическая номенклатура
• Выбирается самая длиннаянеразветвленная углеродуглеродная цепь
• Нумеруются атомы углерода
этой цепи с того конца, к
которому ближе разветвление
цепи (заместители, кратная
связь)
21. Систематическая номенклатура
• Одинаковые заместителигруппируются (указываются в
названии один раз)
• В названии цифрой (цифрами)
указывается место радикала
(заместителя), называется
заместитель и его количество, а
затем называется углеводород,
которому отвечает самая длинная
углерод-углеродная цепь
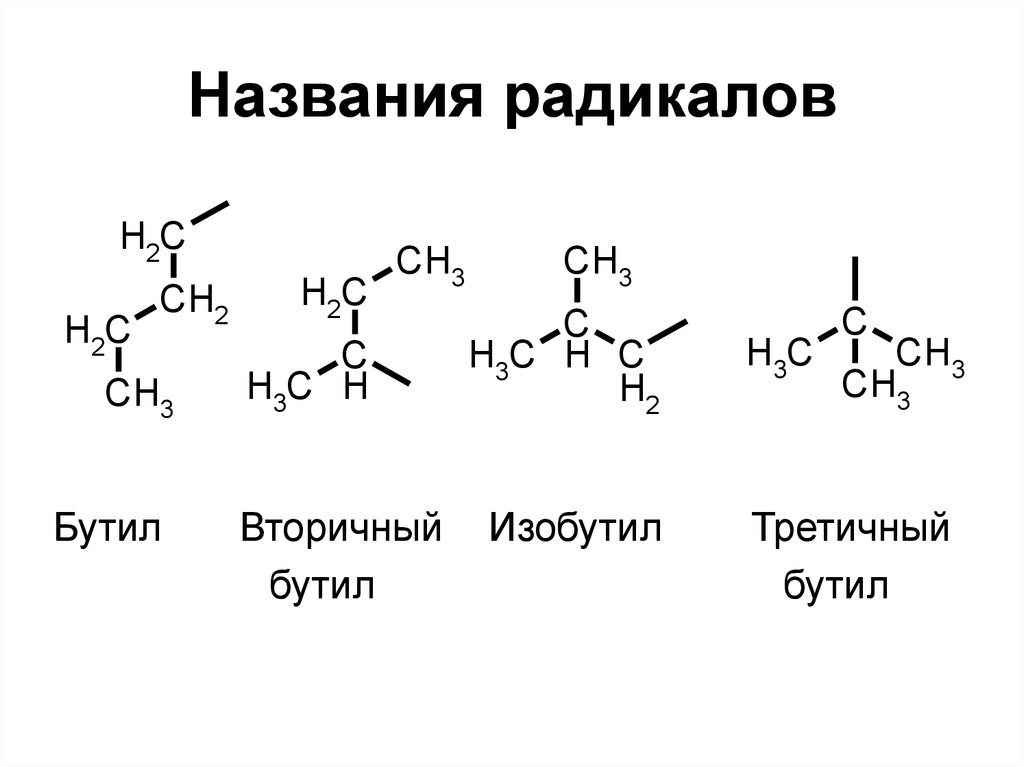
22. Названия радикалов
H3CМетил
H3C
H2
C
Этил
H3C
H2
C
C
H2
Пропил
C
H3C H CH3
Изопропил
23. Названия радикалов
H2CH2C
CH2
CH3
Бутил
H2C
CH3
C
H3C H
Вторичный
бутил
CH3
C
H3C H C
H2
Изобутил
H3C
C
CH3
CH3
Третичный
бутил
24. Систематическая номенклатура
• В названиях соединений скратными углерод-углеродными
связями заменяют суффикс “ан”
на “ен” или “ин”
• Для некоторых классов
соединений к названию основной
цепи добавляют суффиксы «ол»,
«он» и др.
25. Теория строения органических соединений
• Химическое строение –последовательность соединения
атомов в молекуле
• Атомы в молекуле соединяются не
произвольно, а в определенном
порядке
• Связь атомов осуществляется
согласно их валентности
26. Теория строения органических соединений
• Атом углерода в подавляющембольшинстве соединений 4-х
валентен
• Атомы углерода способны
соединяться, образуя линейные,
разветвленные и замкнутые цепи
27. Теория строения органических соединений
• Свойства вещества определяютсяего химическим строением
• Каждому веществу присуща только
одна определенная структура
• Атомы и группы атомов в молекуле
взаимно влияют друг на друга
28. Стереохимическая теория
• Семидесятые годы XIX века• Теория пространственного
расположения атомов в
молекулах
• На ее основе было объяснено
явление пространственной
изомерии
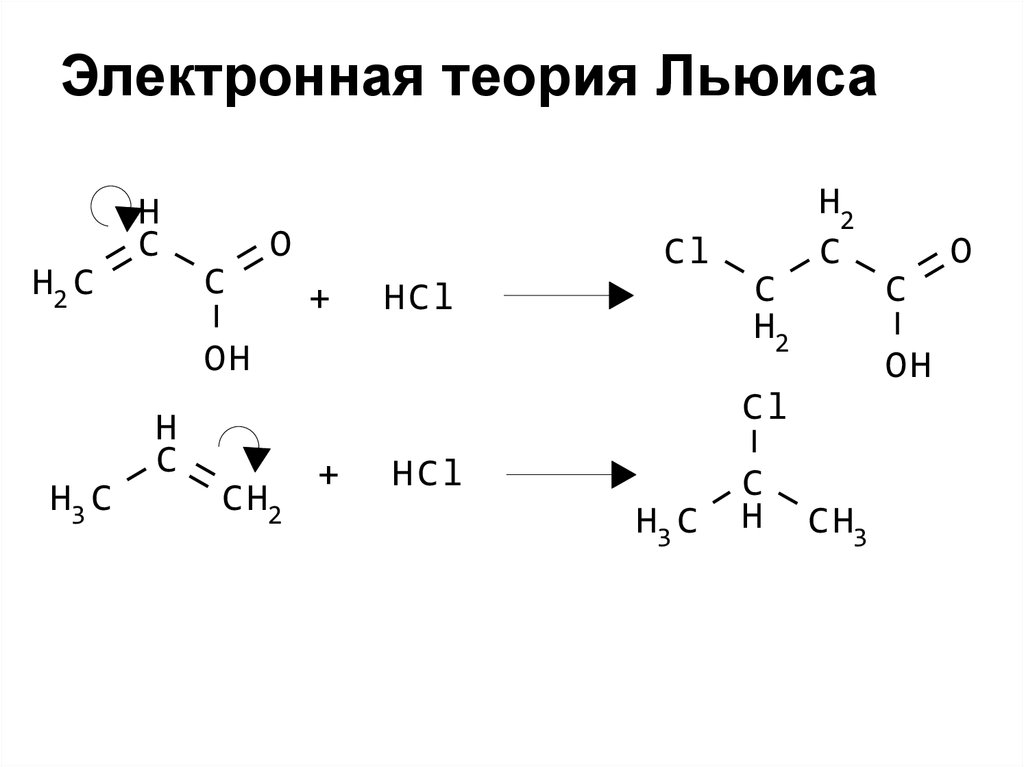
29. Электронная теория Льюиса
• Начало XX века• Дала объяснение влиянию
атомов и групп атомов в
молекулах друг на друга
• Это влияние заключается в
смещении электронной
плотности от одних атомов к
другим
30. Электронная теория Льюиса
H2 CH
C
C
O
Cl
+
HCl
OH
H3 C
H
C
C
H2
H2
C
OH
Cl
CH2
+
HCl
H3 C
C
H
C
CH3
O
31. Квантово-химические методы
• Развитие теории химическогостроения
• Квантово-механические методы
описания химических связей в
органических соединениях
• Химическая связь возникает в
результате взаимодействия
электронов и ядер
32. Квантово-химические методы
33. Изомерия
• Изомеры - это соединения,имеющие одинаковый
состав, но различное
строение и вследствие этого
разные физико-химические
свойства
34. Изомеры
• Структурные (отличаются друг отдруга способом связывания атомов)
• Пространственные
(соединения, имеющие одинаковый
способ связывания атомов, но
различное расположение атомов и
групп в пространстве)
35. Структурная изомерия
• Изомерия углеродногоскелета
• Изомерия положения кратной
связи
• Изомерия положения
функциональной группы
• Межклассовая изомерия
36.
Структурная изомерияИзомерия положения функциональной группы
CH3CH2CH2CH2OH
CH3CHCH2CH3
OH
бутанол-1
бутанол-2
CH2 CHCH3CH3
CH3CH CHCH3
бутен-1
бутен-2
37. Пространственная изомерия
• Геометрическая или цис-трансизомерия
H
H
H
CH
3
C C
CH3 CH3
C C
CH3
H
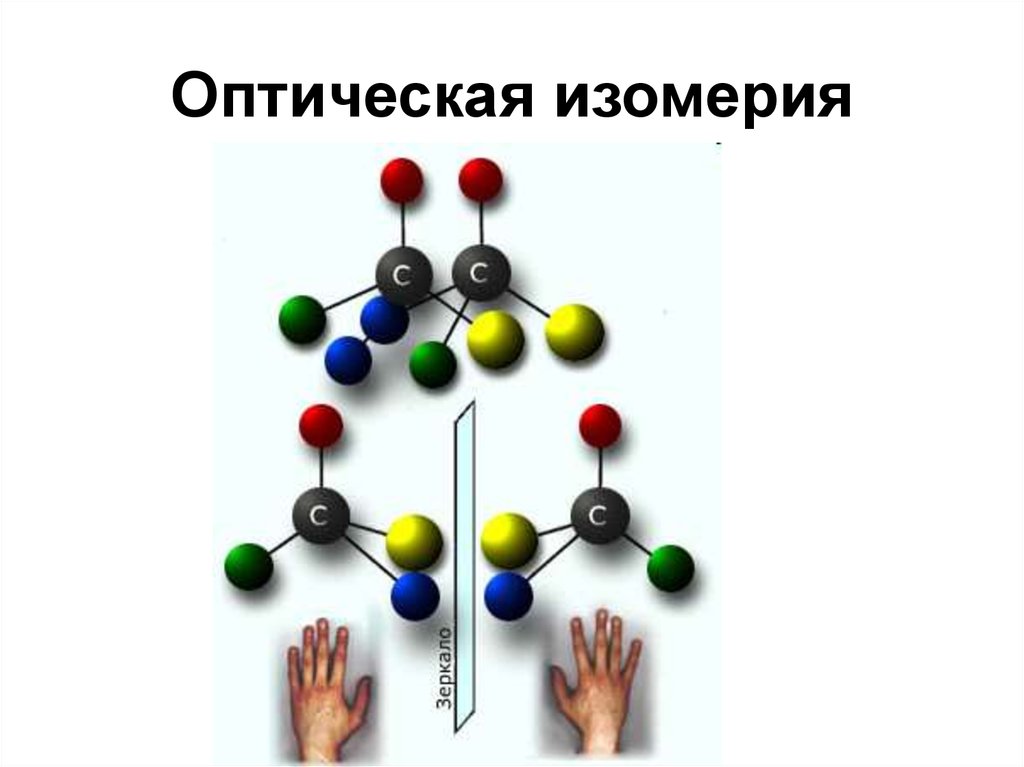
• Оптическая изомерия
COOH
COOH
H C OH
H3C
HO
C
H
CH3
38. Оптическая изомерия
39. Химическая связь в органических соединениях
• Ковалентная связь – образуется обобщениемпары валентных электронов с
противоположными спинами:
А + В А В
Донорно-акцепторный механизм образования
А: + В А:В
Семиполярная связь
А: + В А+:В- (А В)
40. Химическая связь в органических соединениях
Ковалентная связь:• -связь – перекрывание орбиталей
вдоль линии, связывающей центры
атомов
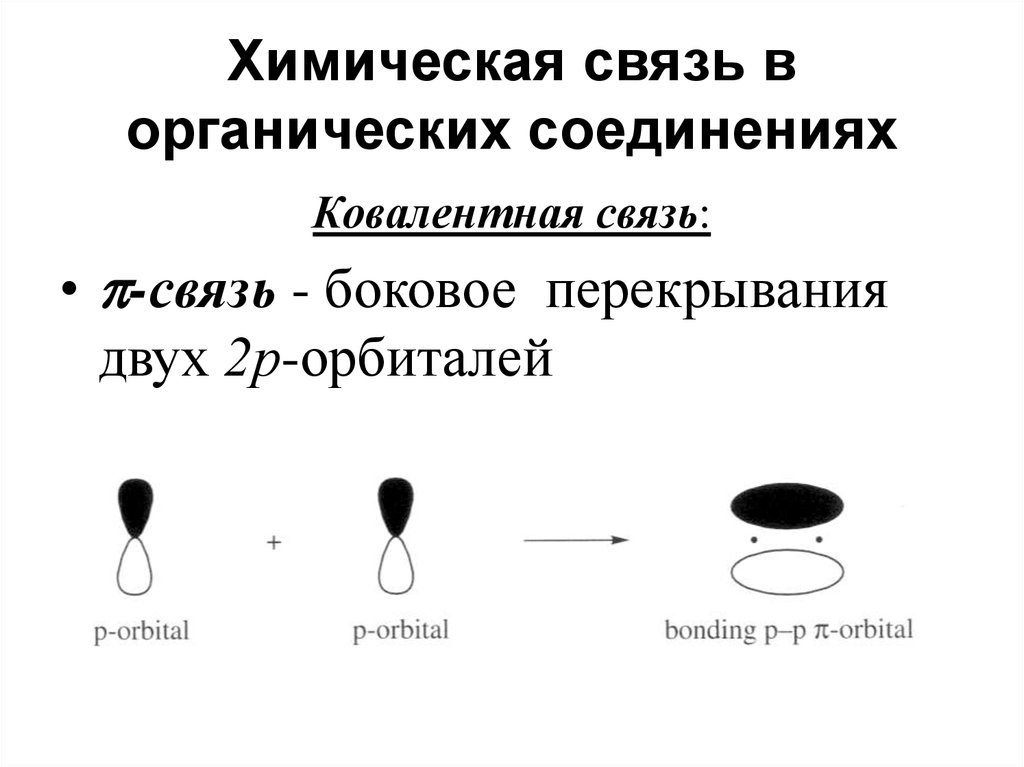
41. Химическая связь в органических соединениях
Ковалентная связь:• -связь - боковое перекрывания
двух 2р-орбиталей
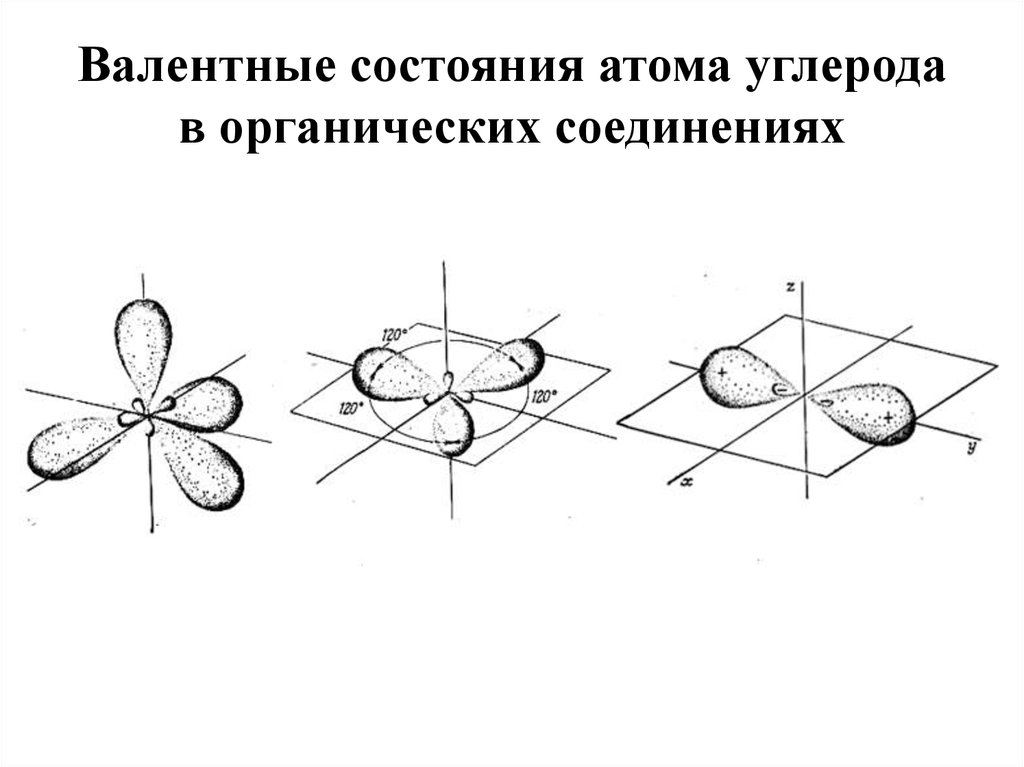
42. Валентные состояния атома углерода в органических соединениях
43. Химическая связь в органических соединениях
• Ионная связь – притяжениеразноименных заряженных ионов,
образующихся за счет передачи
неспаренного электрона одного
атома другому
А + В [А]+[:В]-
44. Химическая связь в органических соединениях
• Водородная связь – химическая связьмежду атомами водорода, связанными
с сильно электроотрицательными
атомами (чаще всего атомами
кислорода), и атомами, имеющими
неподеленную электронную пару:
X-H…:Y-Z
45. Типы разрыва ковалентной связи
• Гомолитический (радикальный)А В А + В
• Гетеролитический (ионный)
А В А+ + :В-
46. Классификация органических реакций
• Реакции замещенияA-B + CD AD + B-C
A-B + C- A- + B-C (SN)
A-B + C+ A+ + B-C (SE)
A-B + C A + B-C (SR)
47. Классификация органических реакций
• Реакции присоединенияА=В + CD D-A-B-C
А=В + C- A--B-C (АN)
A=B + C+ A+-B-C (АE)
A=B + C A-B-C (АR)
48. Классификация органических реакций
• Реакции элиминирования(отщепления) Е
X-А-В-Y A=B + X-Y
49. Классификация органических реакций
• По молекулярности:- Мономолекулярные (SN1, E1)
- Бимолекулярные (SN2, E2)
Определяется числом частиц,
участвующих в самой медленной
стадии процесса
50. Алканы (предельные углеводороды, парафины)
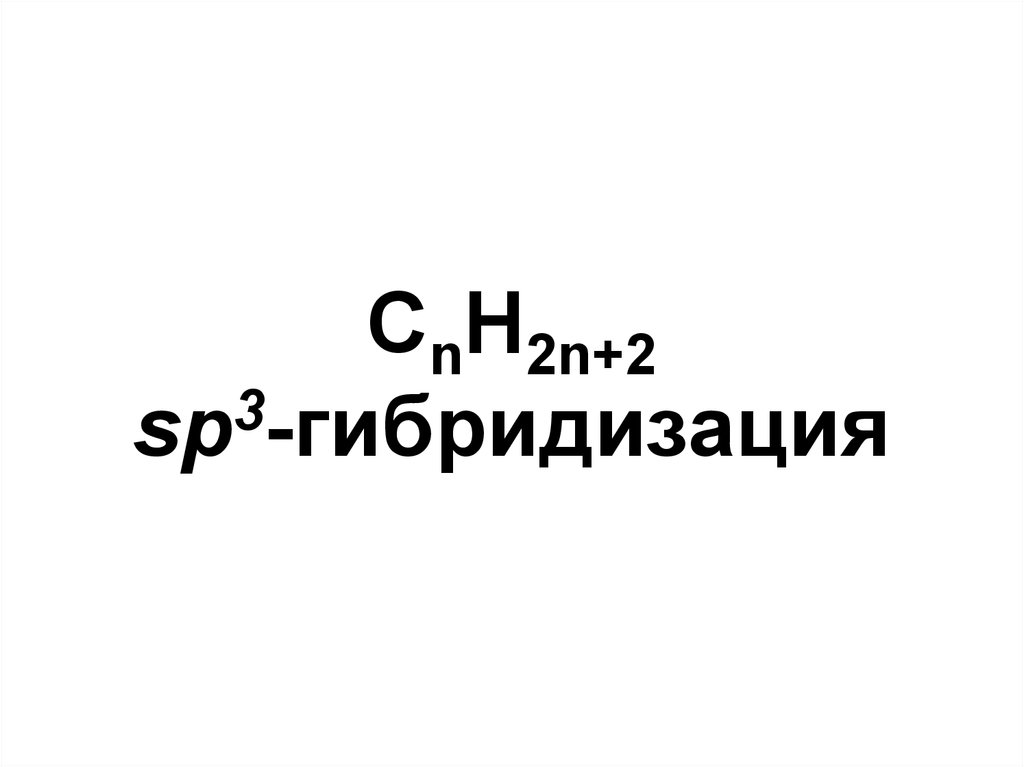
51. CnH2n+2 sp3-гибридизация
CnH2n+23
sp -гибридизация
52. Алканы
• -связи между атомами углеродаобладают цилиндрической
симметрией (0,154 нм)
• группы вращаются вокруг углерод
- углеродной связи почти свободно
• возможны различные
расположения атомов в
пространстве, называемые
конформациями
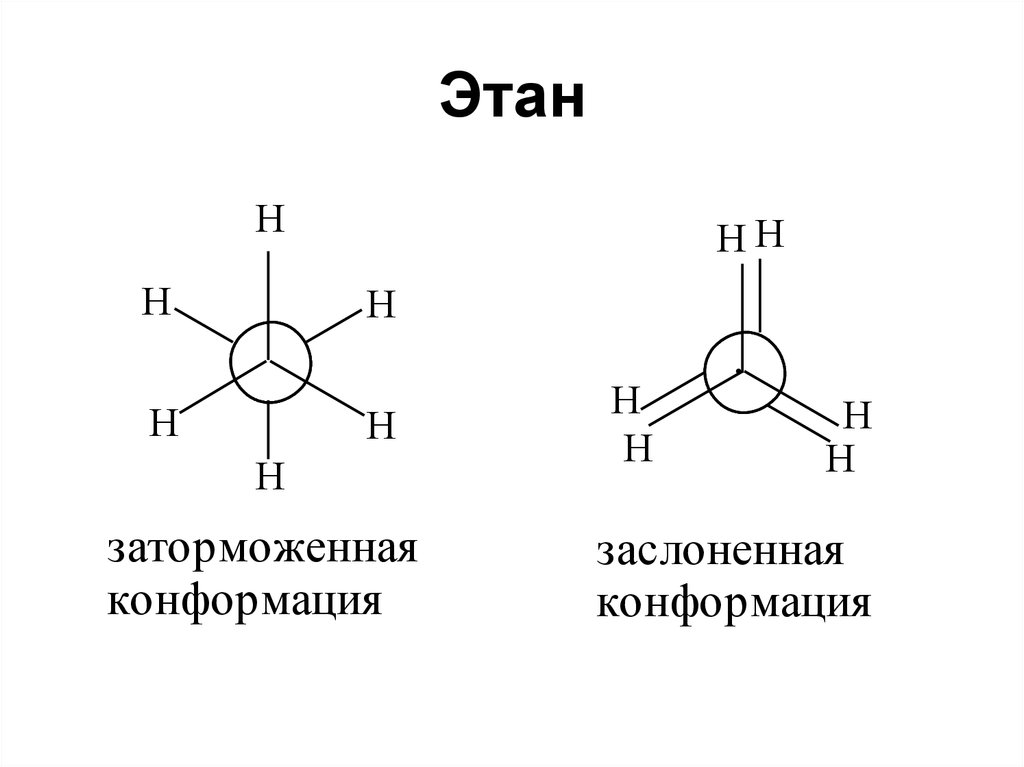
53. Этан
HH
HH
H
H
H
H
заторможенная
конформация
H
H
H
H
заслоненная
конформация
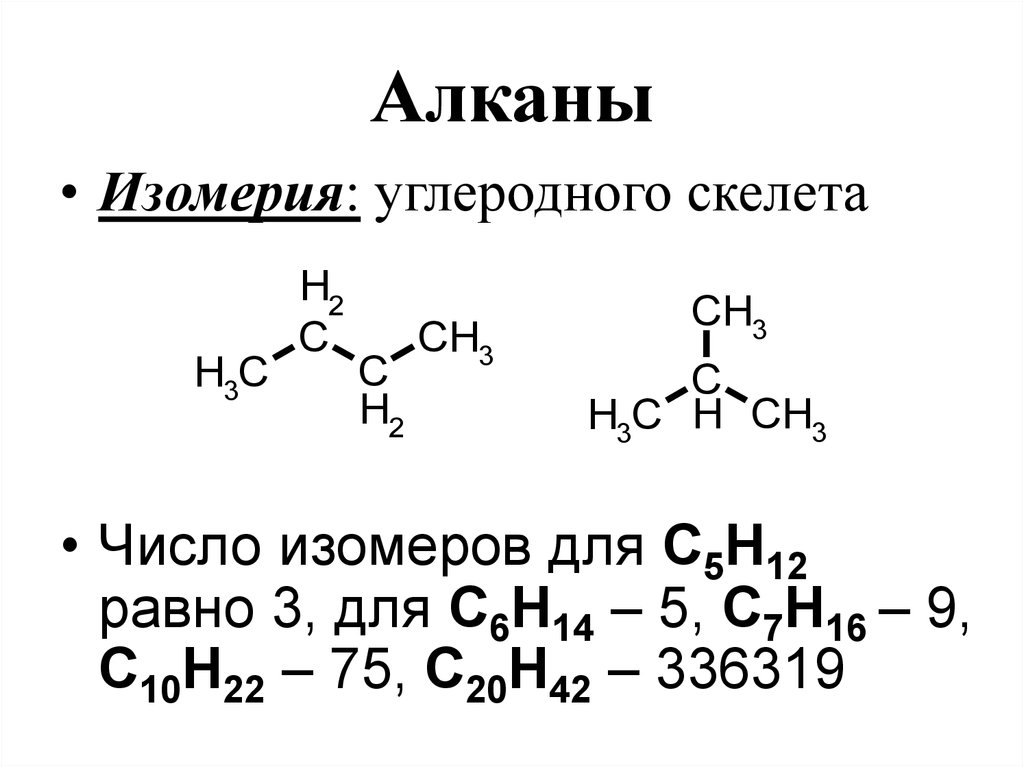
54. Алканы
• Изомерия: углеродного скелетаH3C
H2
C
C
H2
CH3
CH3
C
H3C H CH3
• Число изомеров для С5Н12
равно 3, для С6Н14 – 5, С7Н16 – 9,
С10Н22 – 75, С20Н42 – 336319
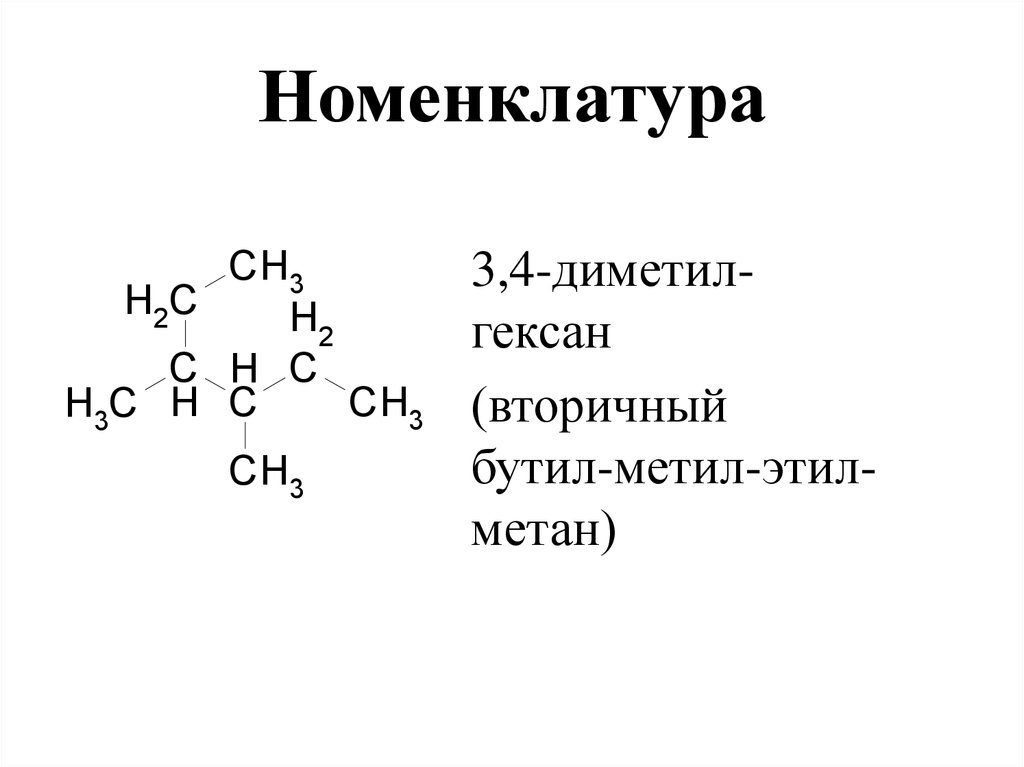
55. Номенклатура
CH3H2C
H2
C H C
CH3
H3C H C
CH3
3,4-диметилгексан
(вторичный
бутил-метил-этилметан)
56. Способы получения алканов
Получение в промышленностиметана и других алканов:
• Фракционирование
природного газа
• Фракционирование перегонкой
углеводородов нефти
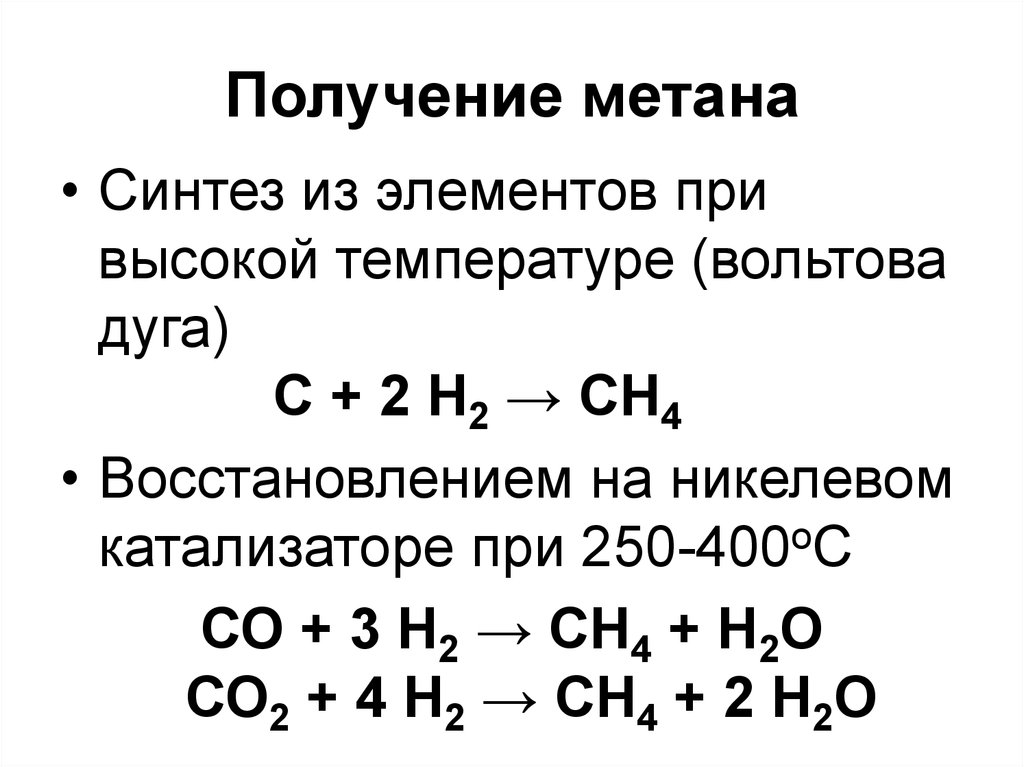
57. Получение метана
• Синтез из элементов привысокой температуре (вольтова
дуга)
C + 2 H2 → CH4
• Восстановлением на никелевом
катализаторе при 250-400оС
СО + 3 Н2 → СН4 + Н2О
СО2 + 4 Н2 → СН4 + 2 Н2О
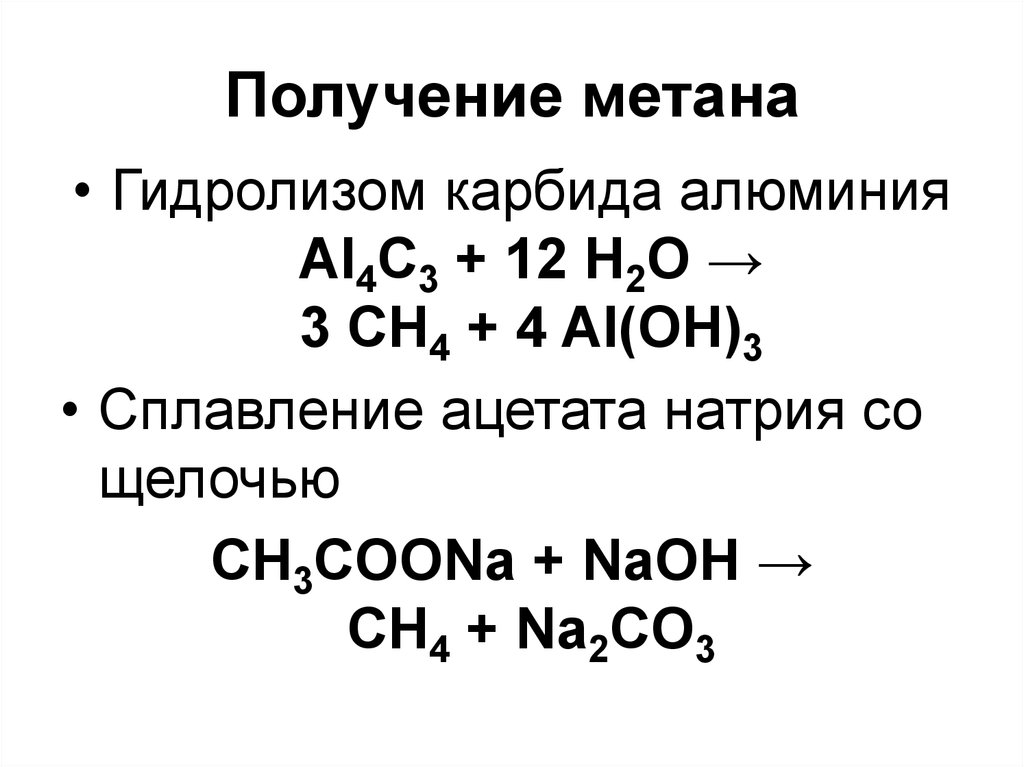
58. Получение метана
• Гидролизом карбида алюминияAl4C3 + 12 H2O →
3 CH4 + 4 Al(OH)3
• Cплавление ацетата натрия со
щелочью
СН3СOONa + NaOH →
CH4 + Na2CO3
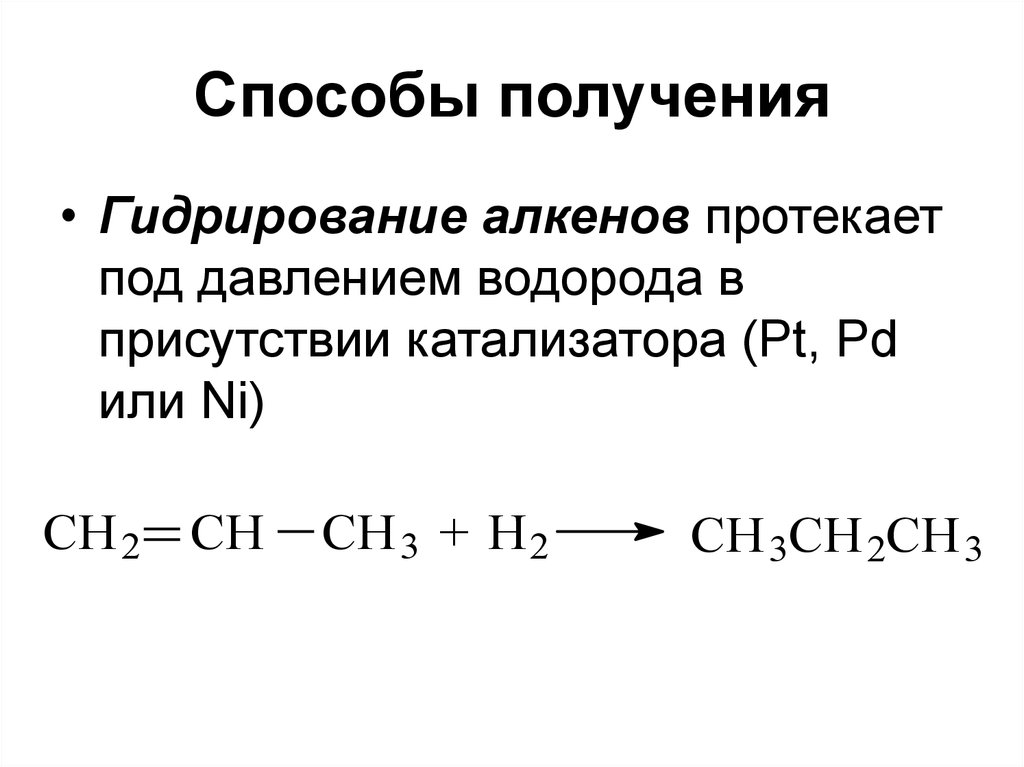
59. Способы получения
• Гидрирование алкенов протекаетпод давлением водорода в
присутствии катализатора (Pt, Pd
или Ni)
CH 2 CH
CH 3 + H 2
CH 3CH 2CH 3
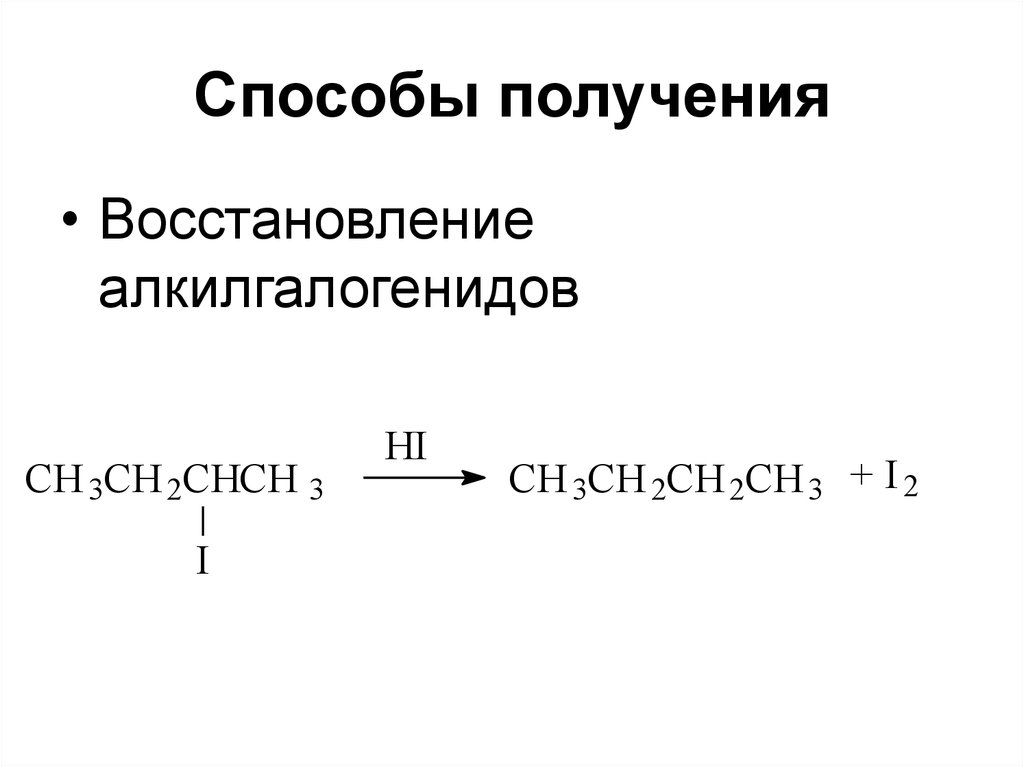
60. Способы получения
• Восстановлениеалкилгалогенидов
CH 3CH 2CHCH 3
I
HI
CH 3CH 2CH 2CH 3 + I 2
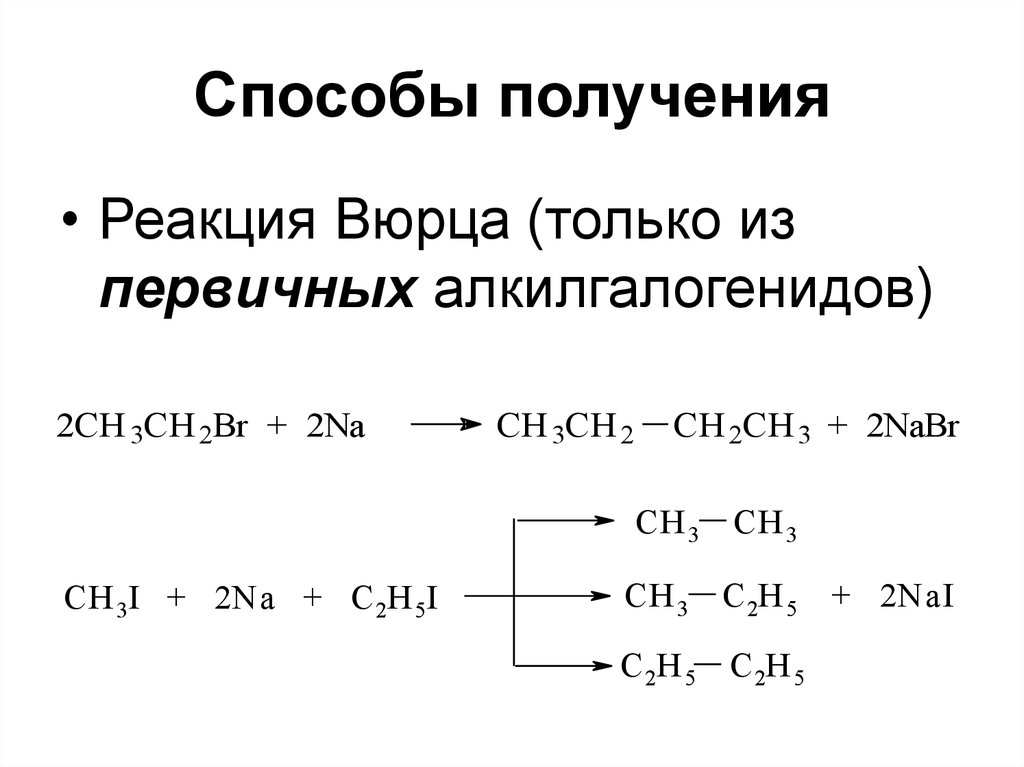
61. Способы получения
• Реакция Вюрца (только изпервичных алкилгалогенидов)
2CH 3CH 2Br + 2Na
CH 3CH 2
CH 2CH 3 + 2NaBr
CH 3 CH 3
СH 3I + 2Na + C 2H 5I
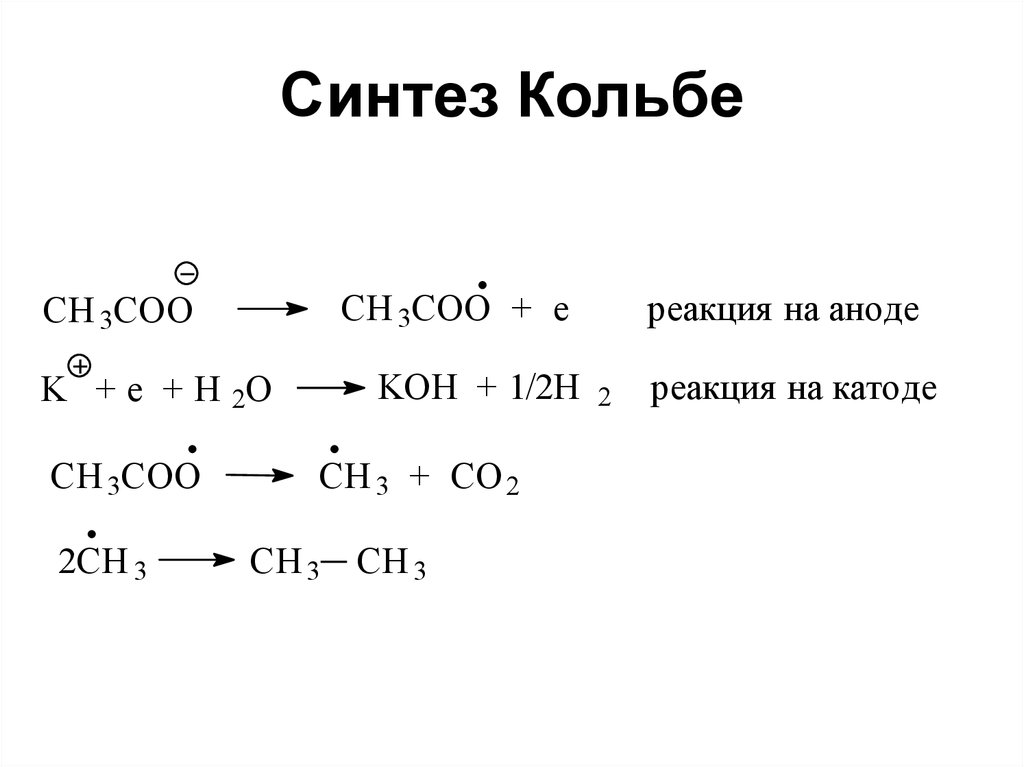
CH 3 C 2H 5 + 2NaI
C 2H 5 C 2H 5
62. Синтез Кольбе
CH 3COO + eCH 3COO
K + e + H 2O
CH 3COO
2CH 3
KOH + 1/2H
CH 3 + CO 2
CH 3 CH 3
реакция на аноде
2
реакция на катоде
63. Физические свойства
• С1-С4 при обычнойтемпературе – газы
• С5-С15 – жидкости
• с С16 – твердые вещества
• Плотность лежит в пределах
0.4-0.7 г/мл
• Растворимость в воде ничтожна
64. Химические свойства
• Нечувствительны к ионнымреагентам
• Инертны по отношению к кислотам,
основаниям, окислителям
• Наиболее характерным свойством
является радикальное замещение
незаряженного атома водорода при
действии незаряженных
радикальных реагентов
65. Галогенирование
Замещение атомов водорода нагалоген - наиболее
характерная реакция алканов
CH4 + Cl2
h , 25 oC
CH3Cl + HCl
66. Механизм хлорирования
• SRCl2 2 Cl (зарождение цепи)
СН4 + Cl CН3 + НСl (рост цепи)
CН3 + Cl2 Cl + CН3Сl (рост цепи)
2 Cl Cl2 (обрыв цепи)
2 CН3 C2Н6 (обрыв цепи)
CН3 + Cl CН3Сl (обрыв цепи)
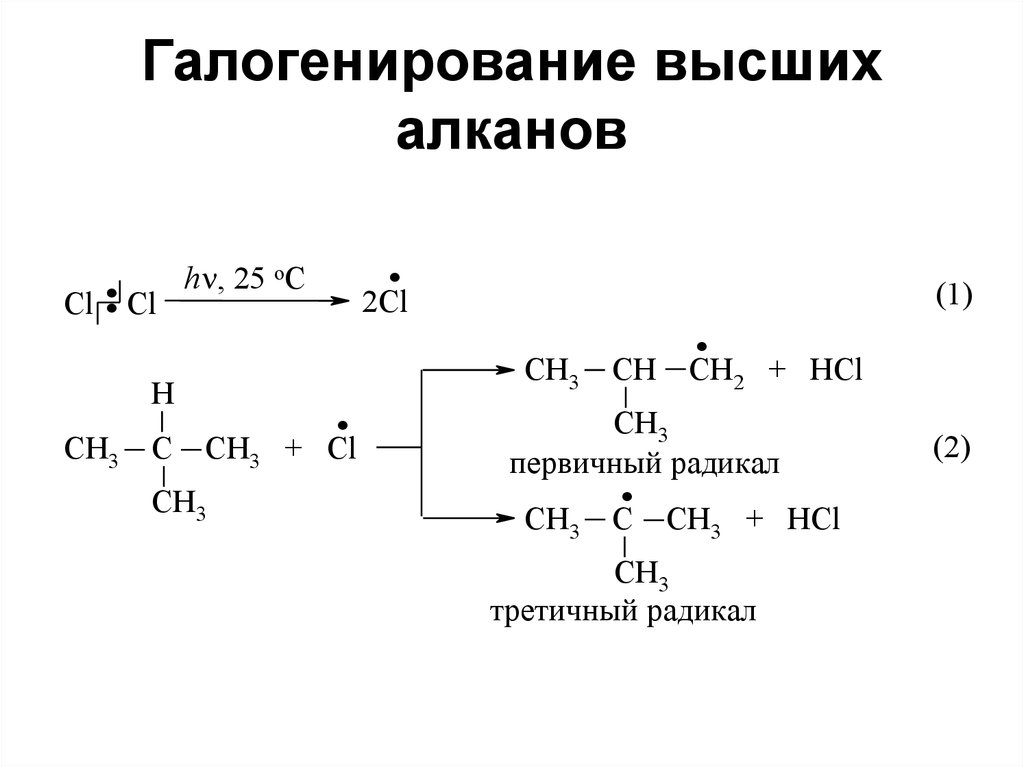
67. Галогенирование высших алканов
Сl.
Cl
H
CH3
C
.
h , 25 oC
2Cl
.
CH3 + Cl
CH3
CH3
CH
.
CH2 + HCl
CH3
пeрвичный радикал
CH3
.
C
(1)
CH3 + HCl
CH3
трeтичный радикал
(2)
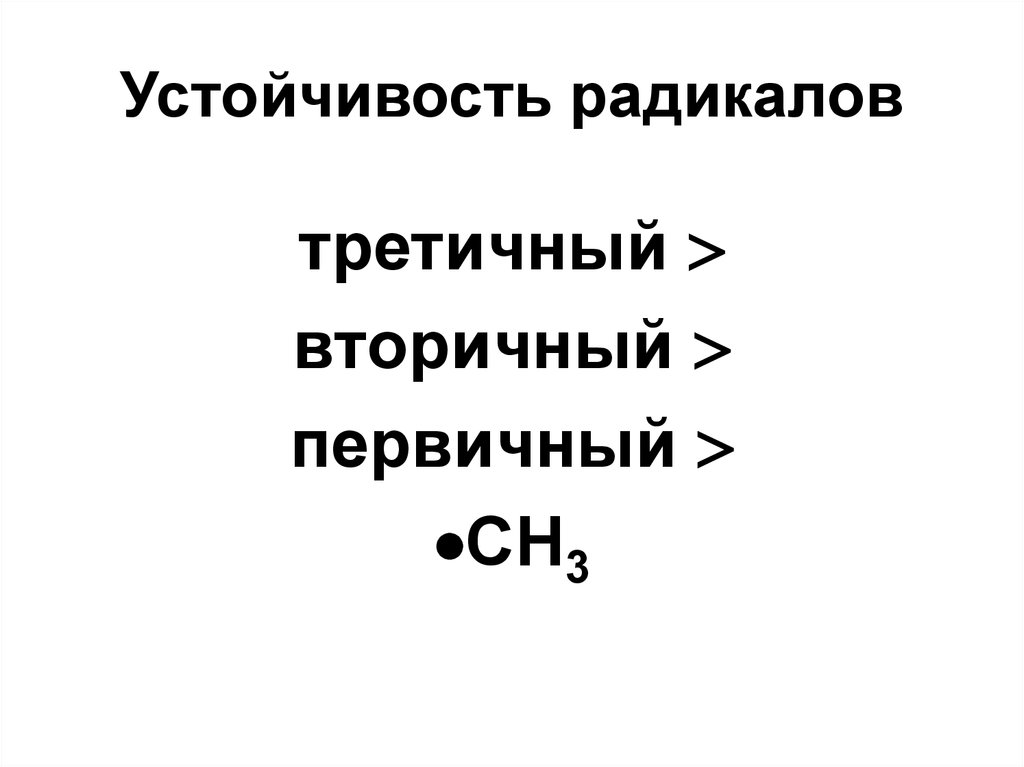
68. Устойчивость радикалов
третичныйвторичный
первичный
CH3
69. Нитрование алканов
CH 3CH 2CH 3+HNO3
CH 3CH 2CH 2NO 2 + CH 3CHCH 3 + CH 3CH 2NO 2 + CH 3NO 2
25 %
NO 2
40 %
10 %
25 %
70. Сульфирование
• Серная кислота при комнатнойтемпературе не действует на
алканы, а при нагревании она
действует как окислитель.
Дымящая серная кислота с
высшими парафинами образует
сульфокислоты:
R-Н + Н2SО4 R-SО3Н + Н2О
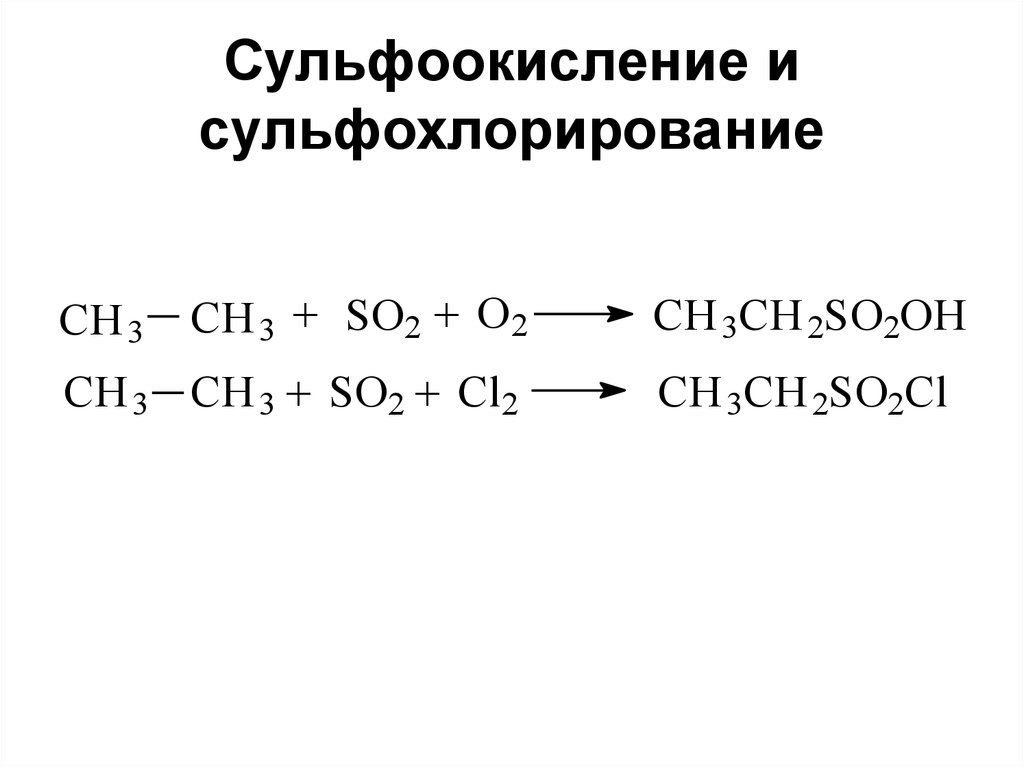
71. Сульфоокисление и сульфохлорирование
CH 3CH 3 + SO2 + O 2
CH 3 CH 3 + SO2 + Cl2
CH 3CH 2SO2OH
CH 3CH 2SO2Cl
72. Окисление
• Кислород воздуха, КМnО4, К2Сr2О7и др., окисляют парафины только
при высоких температурах с
разрывом углеродной цепи и
образованием в основном кислот
• Идет также процесс
декарбоксилирования с
выделением СО2
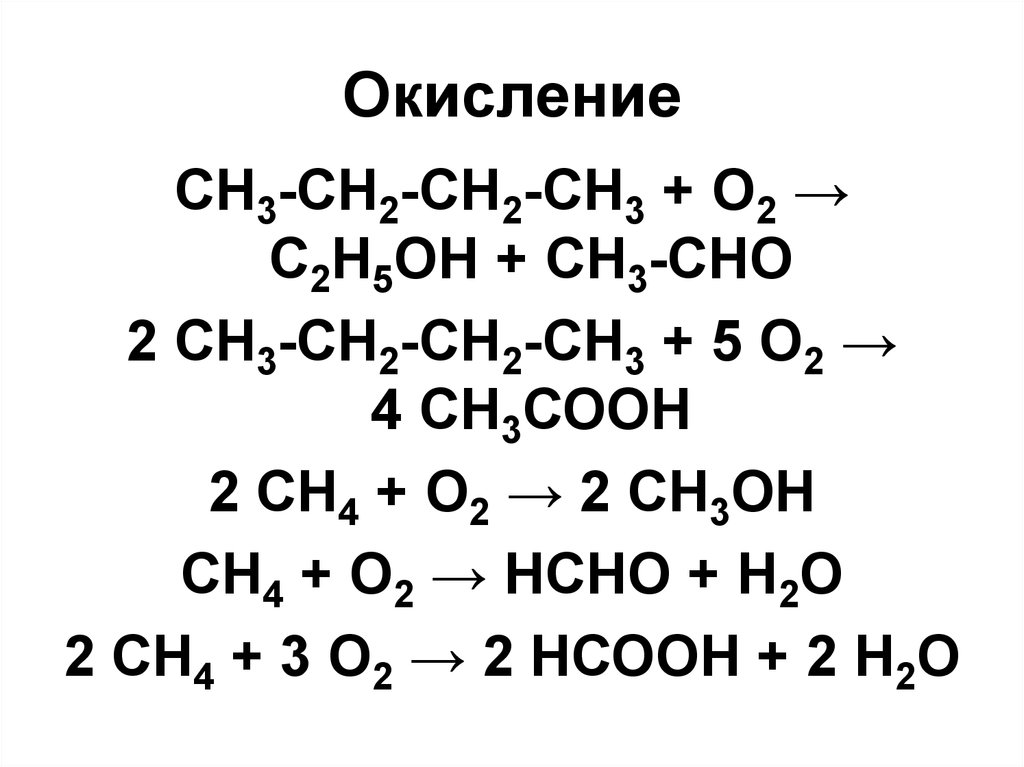
73. Окисление
CH3-CH2-CH2-CH3 + O2 →C2H5OH + СН3-СНО
2 СН3-СН2-СН2-СН3 + 5 О2 →
4 СН3СООН
2 СН4 + О2 → 2 CH3OH
СН4 + О2 → НСНО + Н2О
2 СН4 + 3 О2 → 2 НСООН + 2 Н2О
74. Горение
• Требует поджигания, или искры• Смеси алканов (особенно
метана) с воздухом (1:10)
чрезвычайно взрывоопасны
(причина взрывов на шахтах)
75. Термический и каталитический крекинг
• При температурах выше 1000оСвсе предельные углеводороды
распадаются на углерод и
водород (производство
дешевой газовой сажи и
водорода)
СН4 → C +2 H2
76. Термический и каталитический крекинг
• В определенных условияхудается отделять
промежуточные продукты
(ацетилен получают из метана)
2 CH4 → C2H2 + 3 H2
77. Термический и каталитический крекинг
С5Н12 C3Н8 + С2Н4С16Н34 → С8Н18 + С8Н16
• Введение катализатора в
процесс может сильно изменить
направление реакции
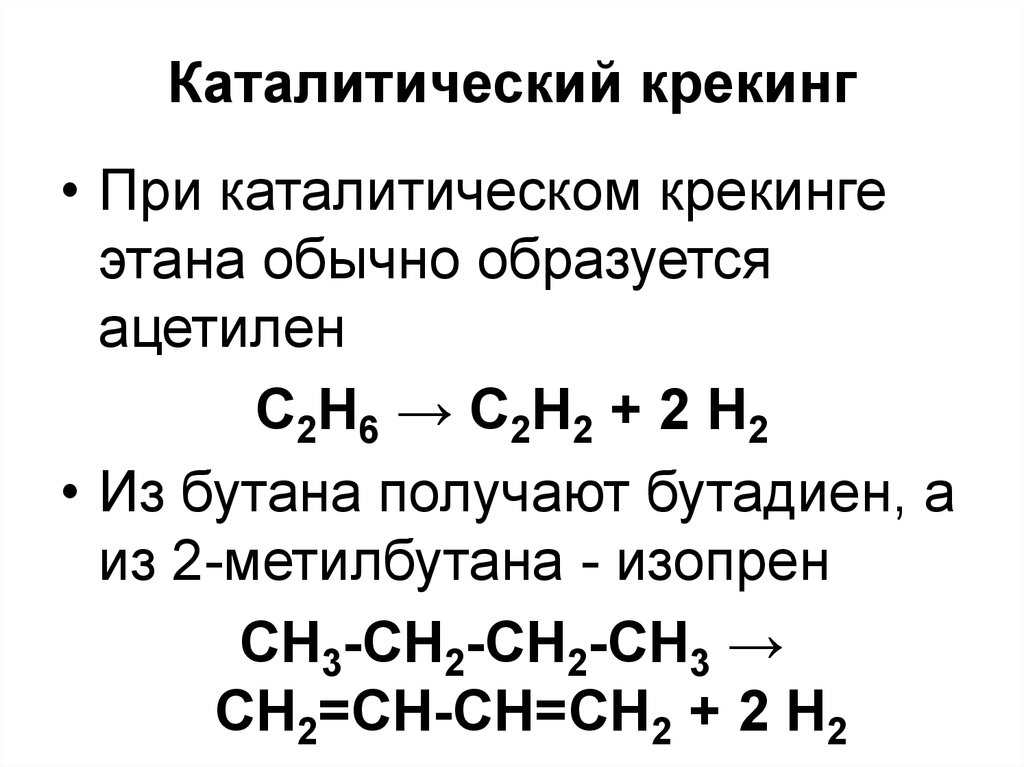
78. Каталитический крекинг
• При каталитическом крекингеэтана обычно образуется
ацетилен
С2Н6 → С2Н2 + 2 Н2
• Из бутана получают бутадиен, а
из 2-метилбутана - изопрен
CH3-CH2-CH2-CH3 →
CH2=CH-CH=CH2 + 2 H2
79. Каталитический крекинг
H3CH2
C
C
H2
H2
C
C
H2
CH3
80. Реакции изомеризации
• В присутствии катализаторов(AlCl3) нормальные алканы
могут превращаться в алканы с
разветвленной цепью:
81. Применение алканов
• Газообразное и жидкоетопливо
• Смазочные материалы
• Сырье для получения сажи,
ацетилена, высших
синтетических кислот и др.
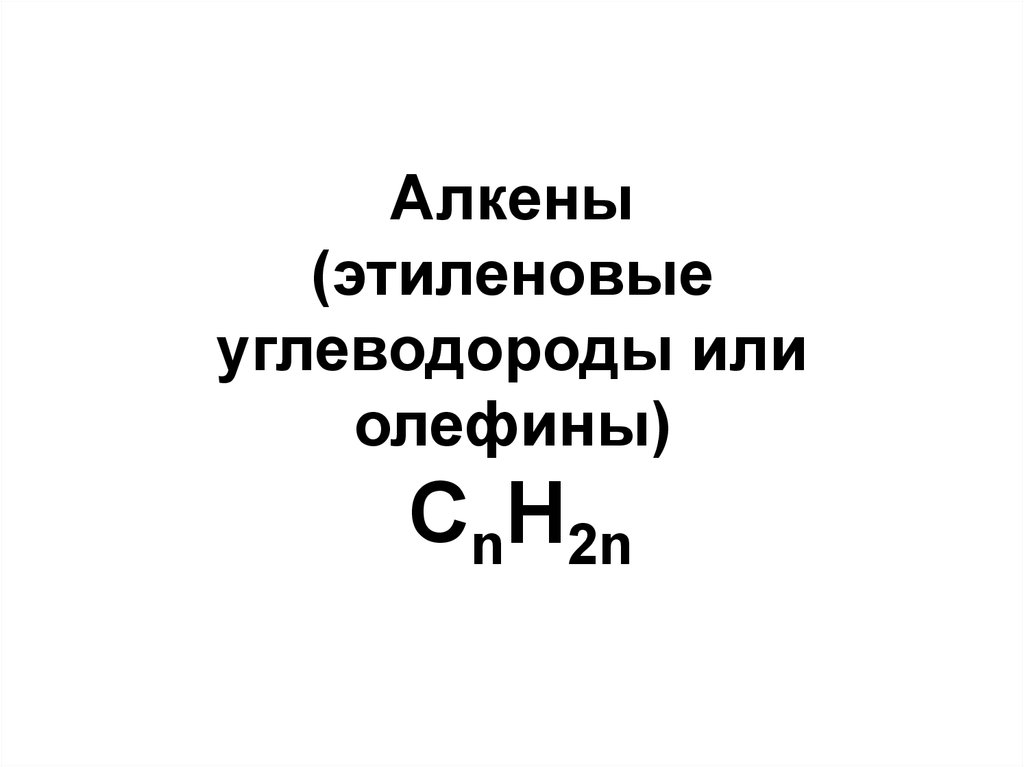
82. Алкены (этиленовые углеводороды или олефины) CnH2n
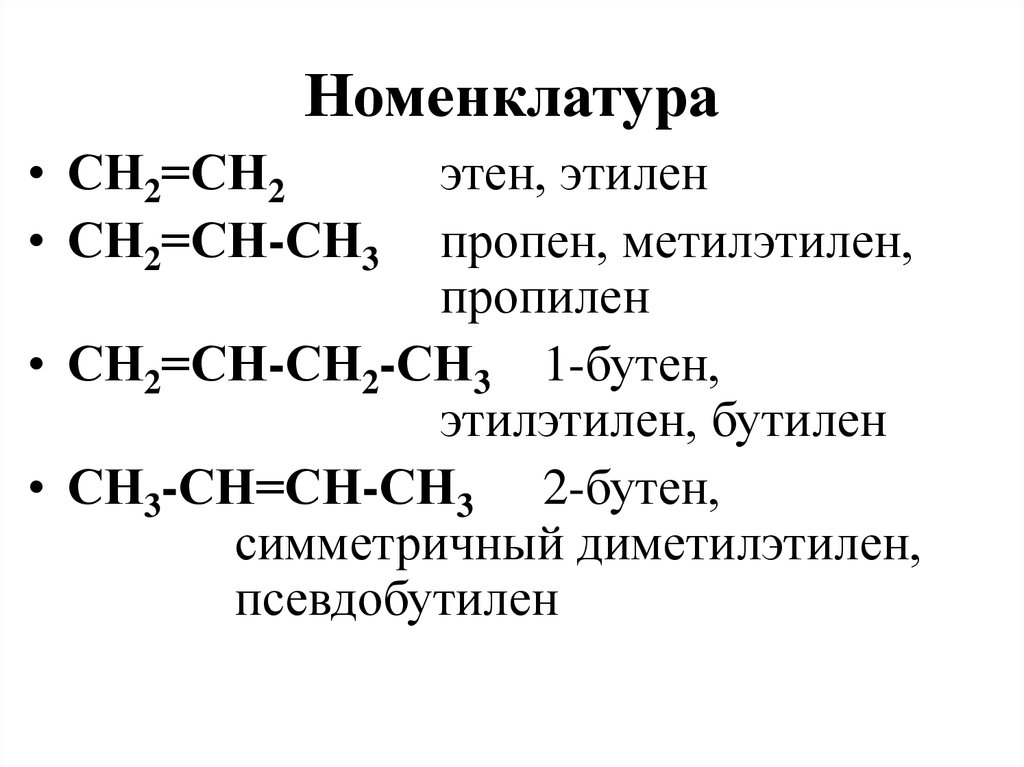
83. Номенклатура
• СН2=СН2• СН2=СН-СН3
этен, этилен
пропен, метилэтилен,
пропилен
• СН2=СН-СН2-СН3 1-бутен,
этилэтилен, бутилен
• СН3-СН=СН-СН3 2-бутен,
симметричный диметилэтилен,
псевдобутилен
84. Изомерия
Структурная изомерия• Углеродного скелета
• Положения двойной связи
СН2=СН-СН2-СН3 (бутен-1)
СН3-СН=СН-СН3 (бутен-2)
• Межклассовая (с циклоалканами)
Пространственная изомерия
• Геометрическая
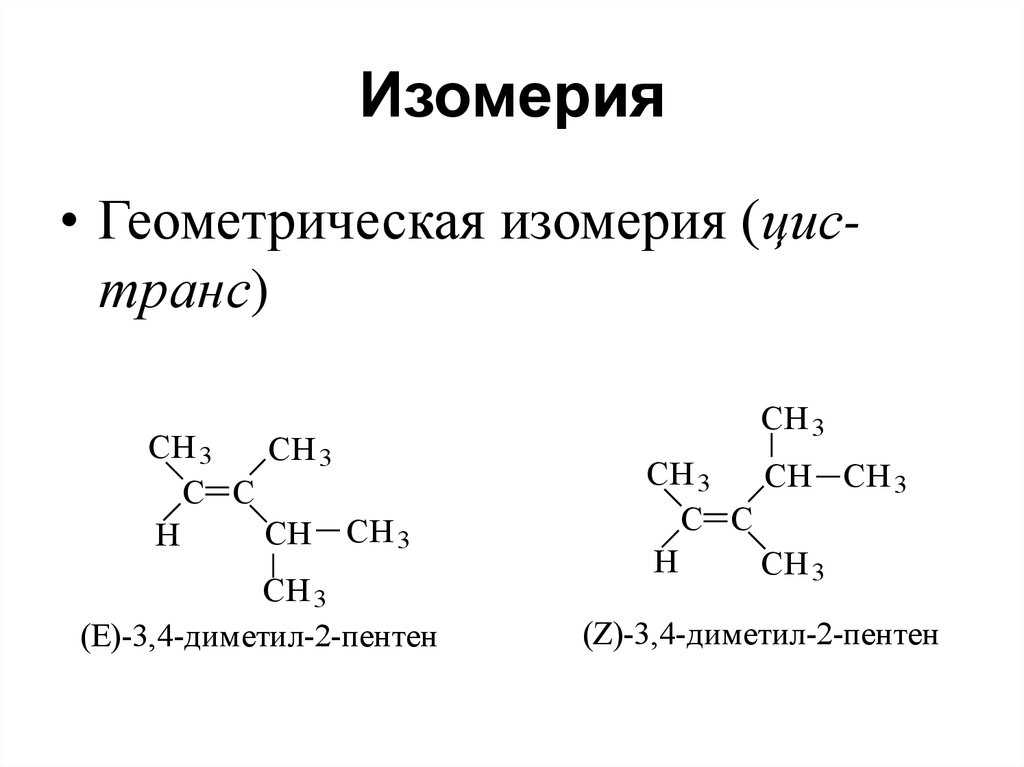
85. Изомерия
• Геометрическая изомерия (цистранс)CH 3
CH 3
C C
CH CH 3
H
CH 3
(E)-3,4-диметил-2-пентен
CH 3
CH 3
CH CH 3
C C
H
CH 3
(Z)-3,4-диметил-2-пентен
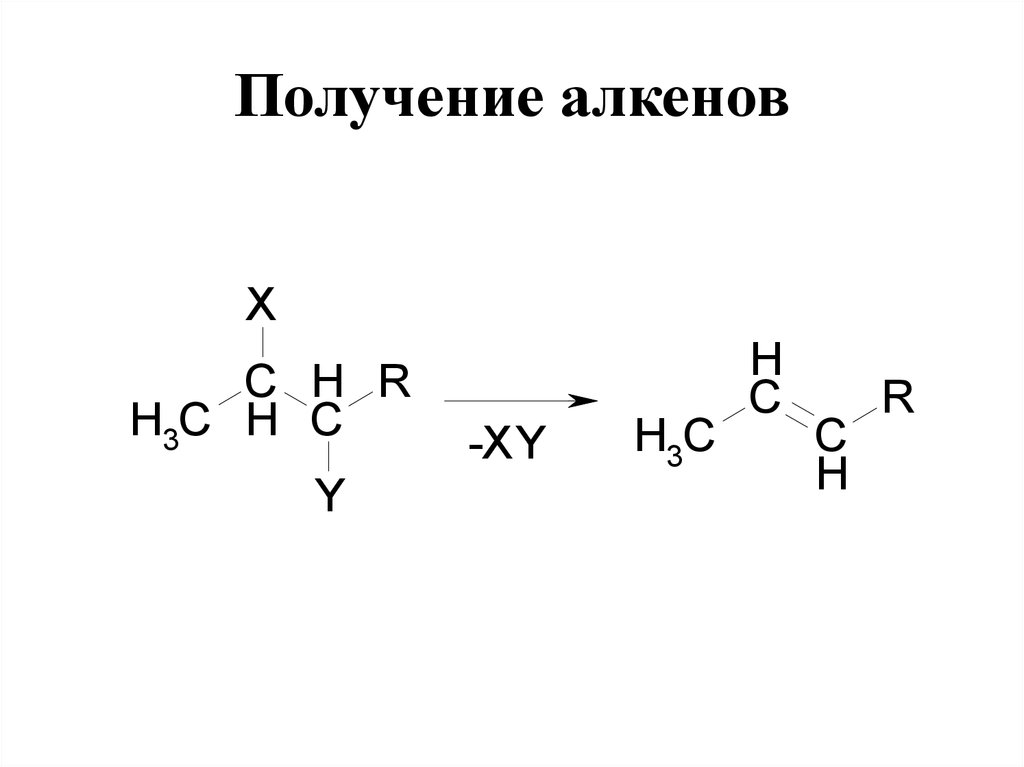
86. Получение алкенов
XC H R
H3C H C
Y
-XY
H3C
H
C
C
H
R
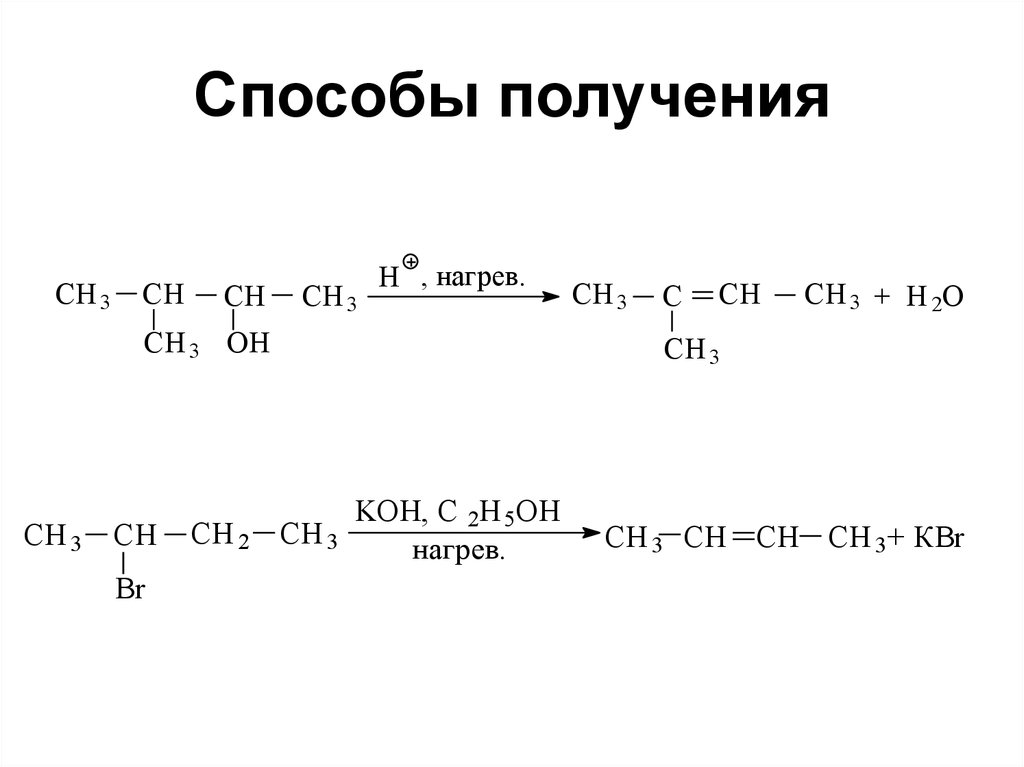
87. Способы получения
• Дегидрогенизациейпредельных углеводородов на
окиси хрома (катализатор):
С4Н10 СН2=СН-СН2-СН3
88. Способы получения
CH 3CH
CH
CH 3
H , нагрев.
CH 3 OH
CH 3
CH
Br
CH 2 CH 3
CH 3
C
CH
CH 3 + H 2O
CH 3
KOH, C 2H 5OH
нагрев.
CH 3 CH CH CH 3+ КBr
89.
• Отщепление воды игалогенводородов
определяется правилом
Зайцева: водород отщепляется
от ближайшего углерода
наименее
гидрогенизированного
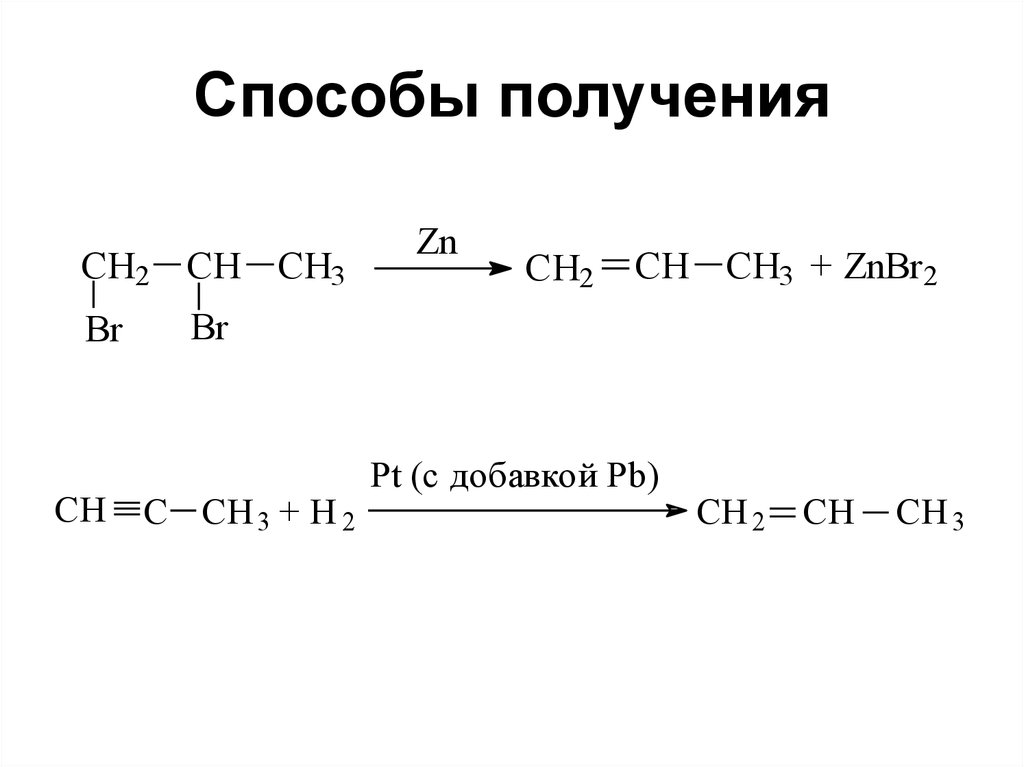
90. Способы получения
CH2 CH CH3Br
CH
Zn
CH2
CH CH3 + ZnBr2
Br
C CH 3 + H 2
Pt (с добавкой Pb)
CH 2
CH
CH 3
91. Физические свойства
• С2-С4 – газы,С5-С17 – жидкости,
далее - твердые вещества
• Перемещение двойной связи в
центр молекулы вызывает
повышение температуры
кипения олефина
92. Физические свойства
• Цис-изомеры кипят при болеевысокой температуре, чем трансизомеры
• Плотность олефинов меньше
единицы, но больше, чем
соответствующих парафинов
• Растворимость в воде мала, но
выше, чем у парафинов
93. Химические свойства
• Реакции присоединения• Реакции окисления
• Реакции полимеризации
94. Реакции присоединения
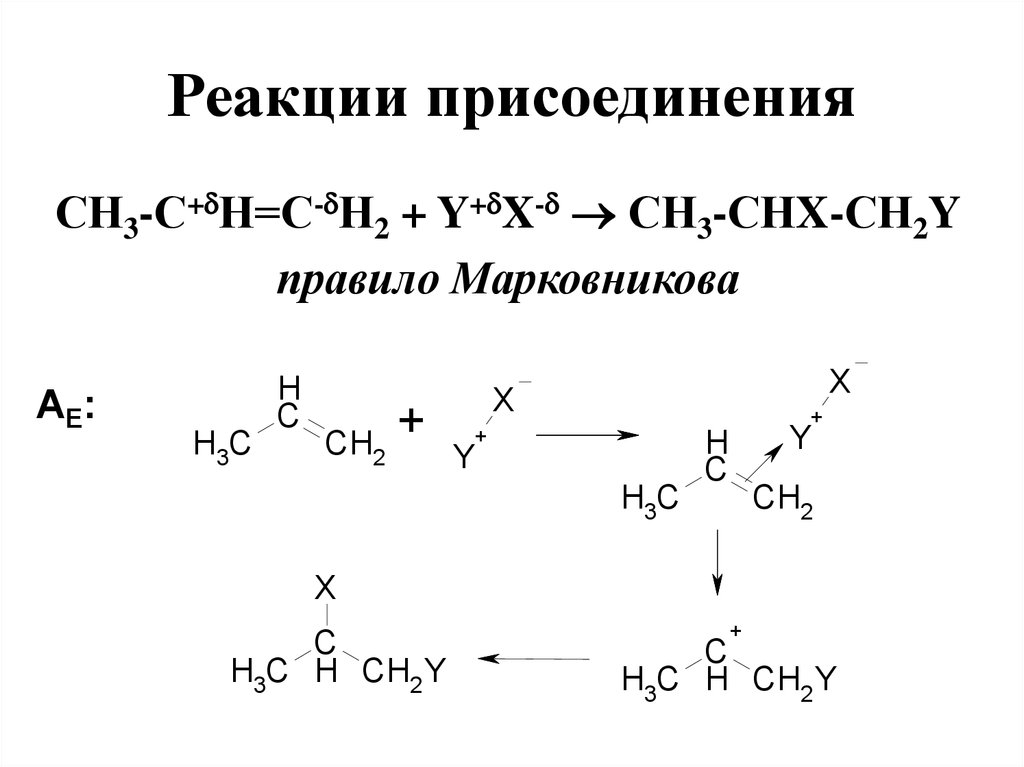
СН3-С+ Н=С- Н2 + Y+ X- СН3-СНX-СН2Yправило Марковникова
АE:
H3C
H
C
CH2
+
X
X
+
Y
H3C
H
C
+
Y
CH2
X
C
H3C H CH2 Y
+
C
H3C H CH2 Y
95. Электрофильное присоединение
• Правило Марковникова:водород присоединяется по
месту разрыва двойной связи
преимущественно к наиболее
гидрогенизированному
атому углерода
96. Устойчивость карбкатионов
• Чем больше распределен(делокализован) заряд в
карбкатионе, тем устойчивее
карбкатион
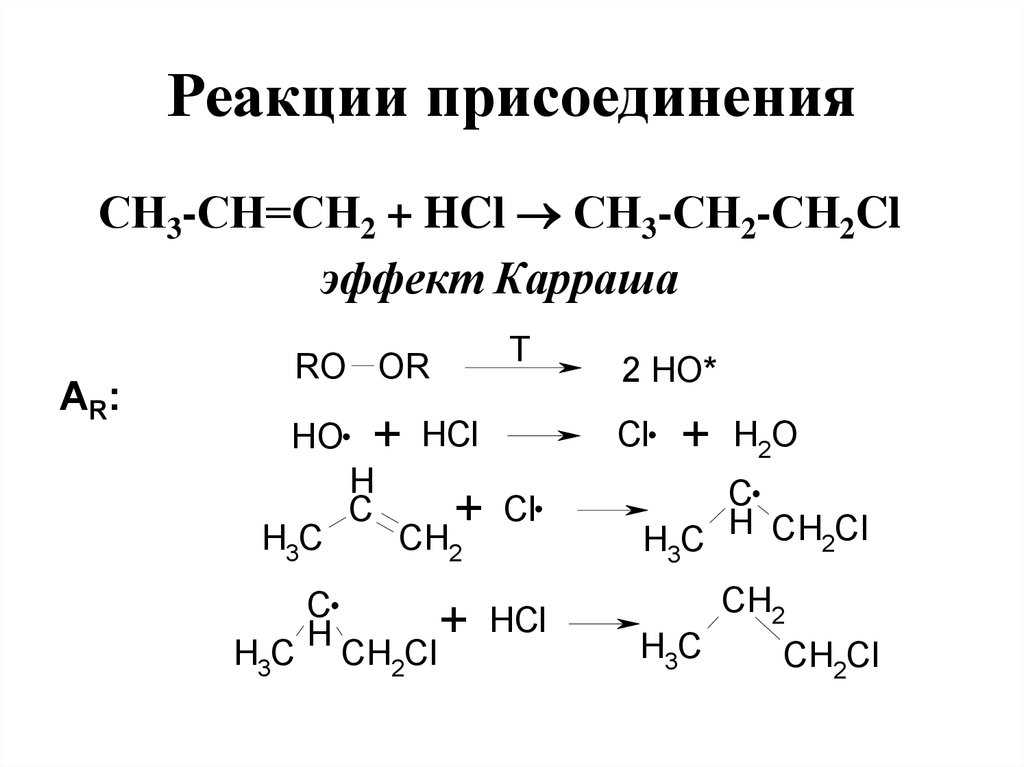
97. Реакции присоединения
СН3-СН=СН2 + HCl СН3-СН2-СН2Clэффект Карраша
АR:
T
RO OR
HO
H3C
H3C
C
H
+
H
C
HCl
+
CH
Cl
CH2Cl
+
H2O
Cl
C
H3C H CH2Cl
HCl
CH2
2
+
2 HO*
H3C
CH2Cl
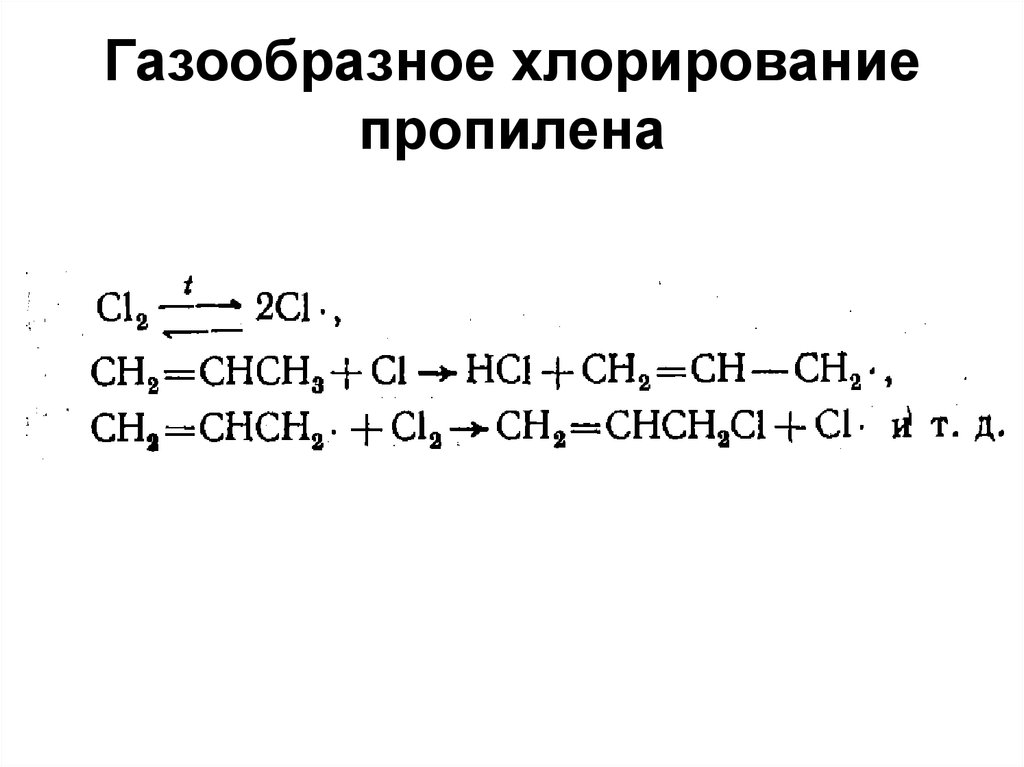
98. Газообразное хлорирование пропилена
99. Окисление алкенов
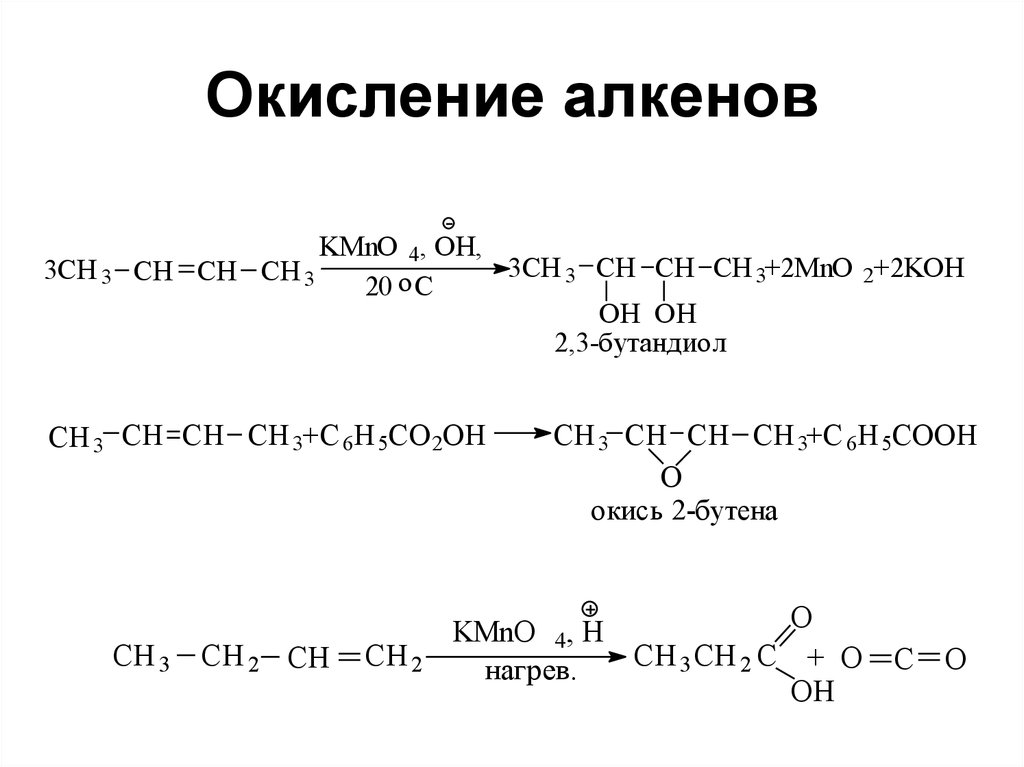
3CH 3KMnO 4, OH,
3CH 3 CH CH CH 3+2MnO 2+2KOH
CH CH CH 3
o
20 C
OH OH
2,3-бутандиол
CH 3 CH CH CH 3+C 6H 5CO 2OH
CH 3
CH 2 CH
CH 2
CH 3 CH CH CH 3+C 6H 5COOH
O
окись 2-бутена
O
KMnO 4, H
CH 3 CH 2 C + O
нагрев.
OH
C O
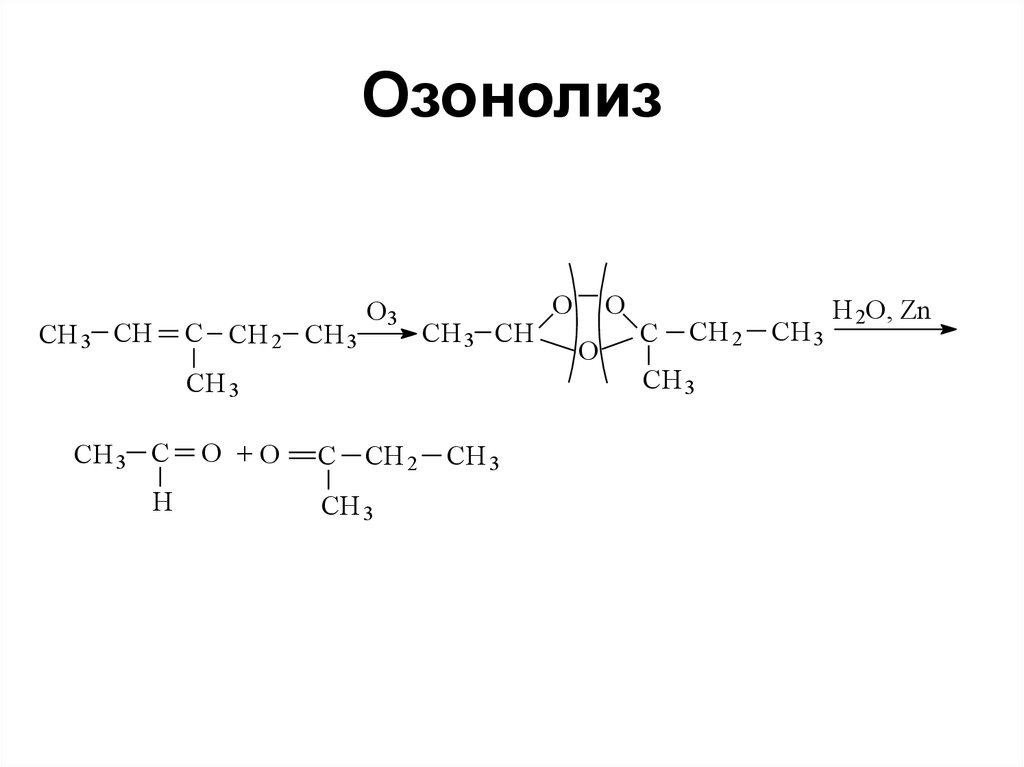
100. Озонолиз
CH 3 CHC CH 2 CH 3
O3
CH 3 CH
CH 3
CH 3 C
H
O +O
C
CH 2
CH 3
CH 3
O
O
O
C
CH 2
CH 3
CH 3
H 2O, Zn
101. Реакции полимеризации
Получение полиэтилена:n СН2=СН2 (-СН2-СН2-)n
Получение полипропилена:
n СН3-СН=СН2 (-СН-СН2-)n
\
СН3
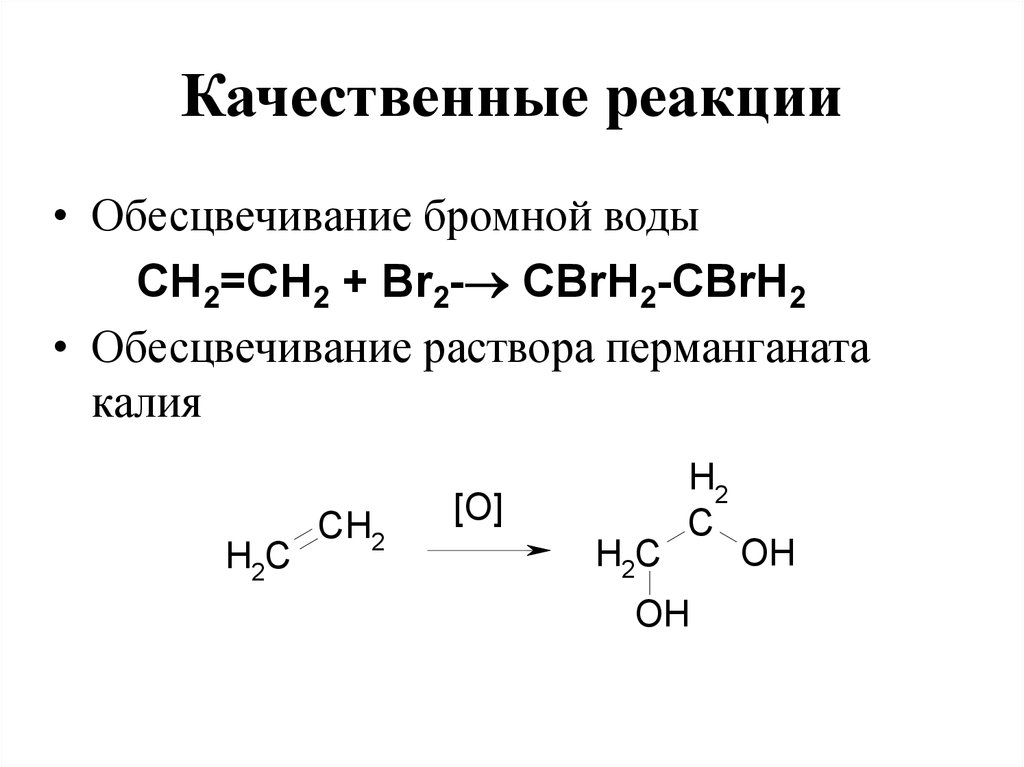
102. Качественные реакции
• Обесцвечивание бромной водыСН2=СН2 + Вr2- CBrН2-СBrН2
• Обесцвечивание раствора перманганата
калия
H2C
CH2
[O]
H2C
H2
C
OH
OH
103. Применение алкенов
• В производстве полимерныхматериалов (пластмасс,
каучуков, пленок)
• Для получения спиртов,
альдегидов,
галогенопроизводных и многих
других органических
соединений
104. Алкадиены (диеновые углеводороды) СnН2n-2
105. Диеновые углеводороды
• С кумуллированными связямиСН2=С=СН2
пропадиен, аллен
• С сопряженными связями
СН2=СН-СН=СН2
1,3-бутадиен,
дивинил
• С изолированными связями
СН2=СН-СН2-СН2-СН=СН2
1,5-гексадиен, диаллил
106. Изомерия
Структурная изомерия
Углеродного скелета
Положения двойных связей
Межклассовая (с алкинами)
Пространственная изомерия
Геометрическая
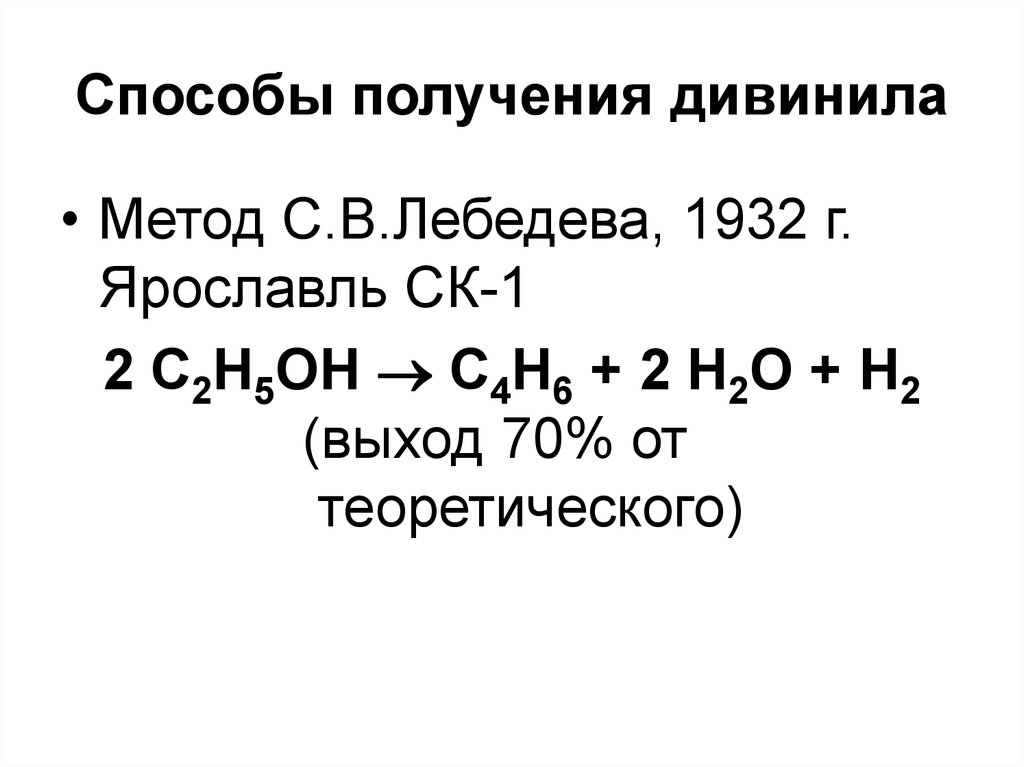
107. Способы получения дивинила
• Метод С.В.Лебедева, 1932 г.Ярославль СК-1
2 С2Н5ОН С4Н6 + 2 Н2О + Н2
(выход 70% от
теоретического)
108. Способы получения дивинила
• Дегидрирование бутанобутиленовых смесей (методБызова)
H3C
H2
C
C
H2
CH3
kat
500-600
H2C
H
C
C
H2
CH3
H2C
H
C
C
H
CH2
109. Способы получения изопрена
• Дегидрирование изопентан изоамиленовых смесейС5Н12 С5Н10 С5Н8
110. Сопряженные диены
• Дивинил - газ с Ткип 4,5оС, вводе нерастворим, легко
взрывается с воздухом
• Изопрен и другие простейшие
диены - жидкости
111. Сопряженные диены
112. Сопряженные диены
• Происходит изменениемежатомных расстояний
СН3-СН3
0.154 нм
СН2=СН-СН=СН2
0.136 нм 0.146 нм
СН2=СН2
0.134 нм
113. Электрофильное присоединение
CH 2=CHCH=CH
2
+ HBr
CH 2 CH
H
CH=CH
2
+ CH 2 CH=CH
H
Br
3-Бром-1-бутен
1,2-присоединение
CH 2
CH
CH
CH 2 + H +
CH 2
Br
1-Бром-2-бутен
1,4-присоединение
CH 2
CH 2
CH
CH 3
CH
CH
CH 2
Менее устойчивый карбокатион
CH 2
Более устойчивый аллильный
карбокатион
114. Электрофильное присоединение
+CH 3 CH
CH
CH 2
CH 3 CH
+
[CH 3
CH
CH
CH 2
CH 3
CH
CH
CH 2 + CH 3
Br
CH 2
II
I
+
CH
+
CH 3
CH
CH
CH
CH
CH 2
Br
CH 2] + Br
115. Реакция Дильса-Альдера
Н 3ССН 2
С
+
С
Н 3С
Н
СН 2
Н
С
С
СООСН 3
СООСН 3
Диметилмалеат
Н 3С
Н 3С
СООСН 3
С Н
С СООСН 3
Н
цис-Аддукт
116. Полимеризация
.R + CH 2 = CH
R
CH 2
CH = CH 2
CH = CH
CH 2 CH 2
R
CH 2
CH = CH
CH = CH
.
CH 2 и т.д.
.
CH 2
CH 2 = CH
CH = CH 2
117. Натуральный каучук
• Добывается из млечного соканекоторых растений (гевея,
гваюлла, коксалыз, таусалыз и
др.)
• Промышленное значение
имеют только плантации гевеи
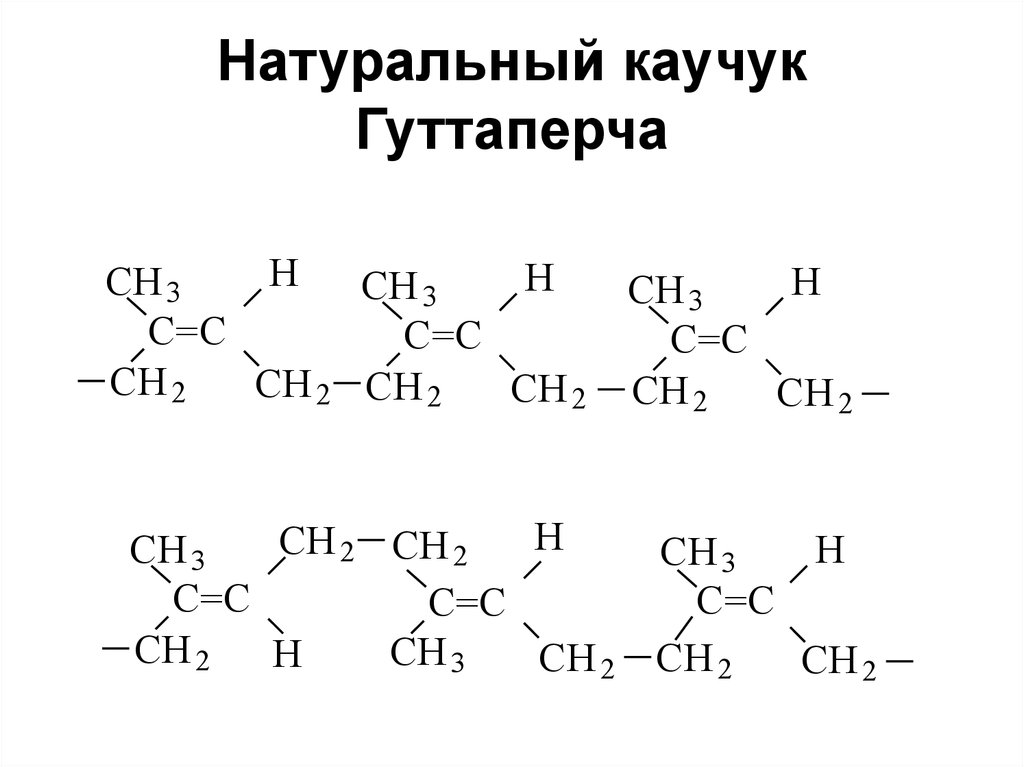
118. Натуральный каучук Гуттаперча
HH
CH 3
CH 3
C=C
C=C
CH 2
CH 2 CH 2
CH 2
H
CH 2 CH 2
CH 3
C=C
C=C
CH 2
CH 3
H
CH 2
H
CH 3
C=C
CH 2
CH 2
H
CH 3
C=C
CH 2
CH 2
119.
120. Контрольное задание № 1
Напишите реакцииокисления метана,
бутана,
этилена,
бутена-2 и
бутадиена-1,3















































































 chemistry
chemistry








