Similar presentations:
Гомологические ряды углеводородов
1. Если хочешь, чтобы у тебя было мало времени, - ничего не делай
2. Гомологические ряды углеводородов
• АлканыСnH2n+2
• Циклоалканы СnH2n
• Алкены
СnH2n
• Алкадиены
СnH2n-2
• Алкины
СnH2n-2
• Арены (ароматические):
ряд бензола
СnH2n-6
полиядерные и конденсированные
3. Степень ненасыщенности
СН = x – (y/2) + (z/2) + 1•x – количество четырехвалентных
атомов
•y – количество одновалентных атомов
•z - количество трехвалентных атомов
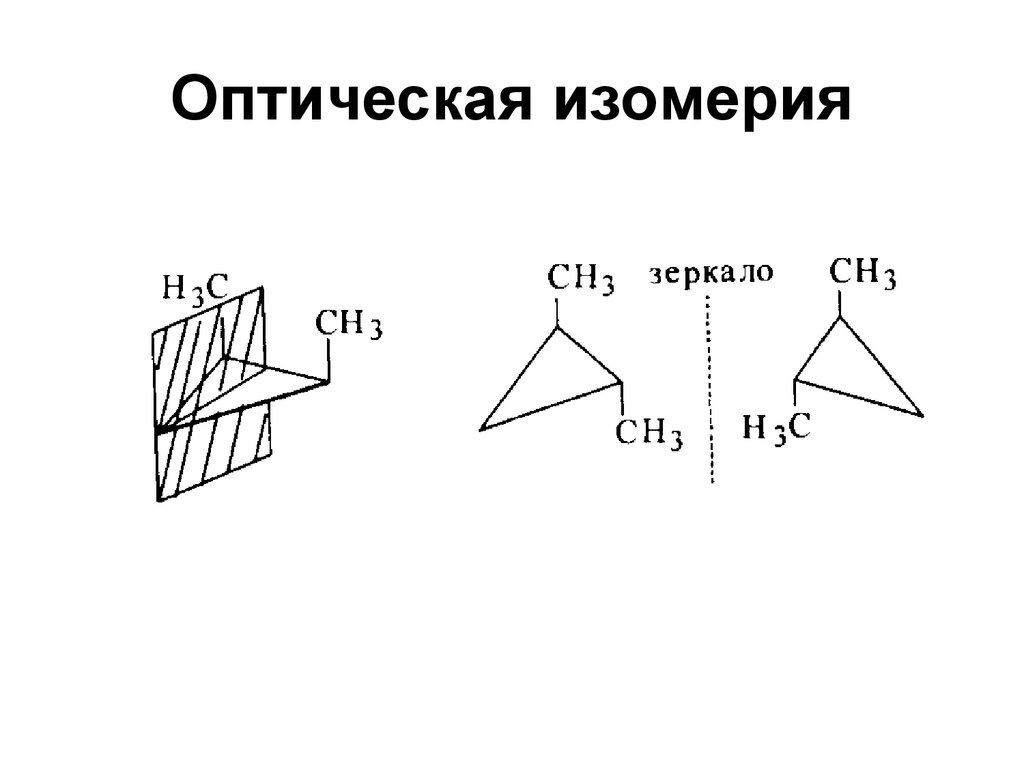
4. Оптическая изомерия
5. Наиболее важные органические реакции
6. Расчет состава продуктов галогенирования алканов
CH 3CH 2CH 2CH 3 + Cl 2h , 25 o C
CH 3CH 2CH 2CH 2Cl + CH 3CHClCH 2CH 3
• Общая активность
первичных атомов водорода равна
1 6=6, вторичных составляет 3,8 4=15,2
Активность всех атомов водорода
равна 6+15,2=21,2
и принимается за 100 %
7. Расчет состава продуктов галогенирования алканов
CH 3CH 2CH 2CH 3 + Cl 2h , 25 o C
CH 3CH 2CH 2CH 2Cl + CH 3CHClCH 2CH 3
• Массовая доля 1-хлорбутана в
продуктах реакции составляет
6:21,2 100 = 28,3 %,
массовая доля 2-хлорбутана равна
15,2:21,2 100 = 71,7 %
8. Реакция Коновалова
CH 3CH 2CH 3+HNO 3CH 3CH 2CH 2NO 2 + CH 3CHCH 3 + CH 3CH 2NO 2 + CH 3NO 2
25 %
NO 2
40 %
10 %
25 %
9. Реакция Вюрца
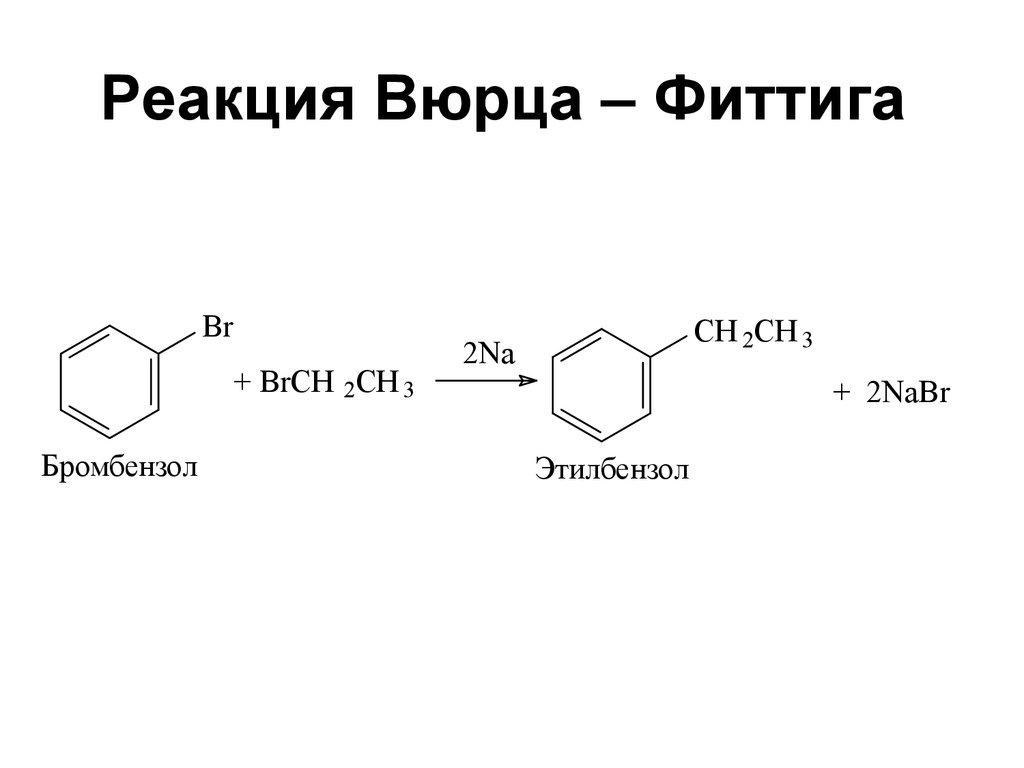
910. Реакция Вюрца – Фиттига
Br+ BrCH 2CH 3
Бромбензол
CH 2CH 3
2Na
+ 2NaBr
Этилбензол
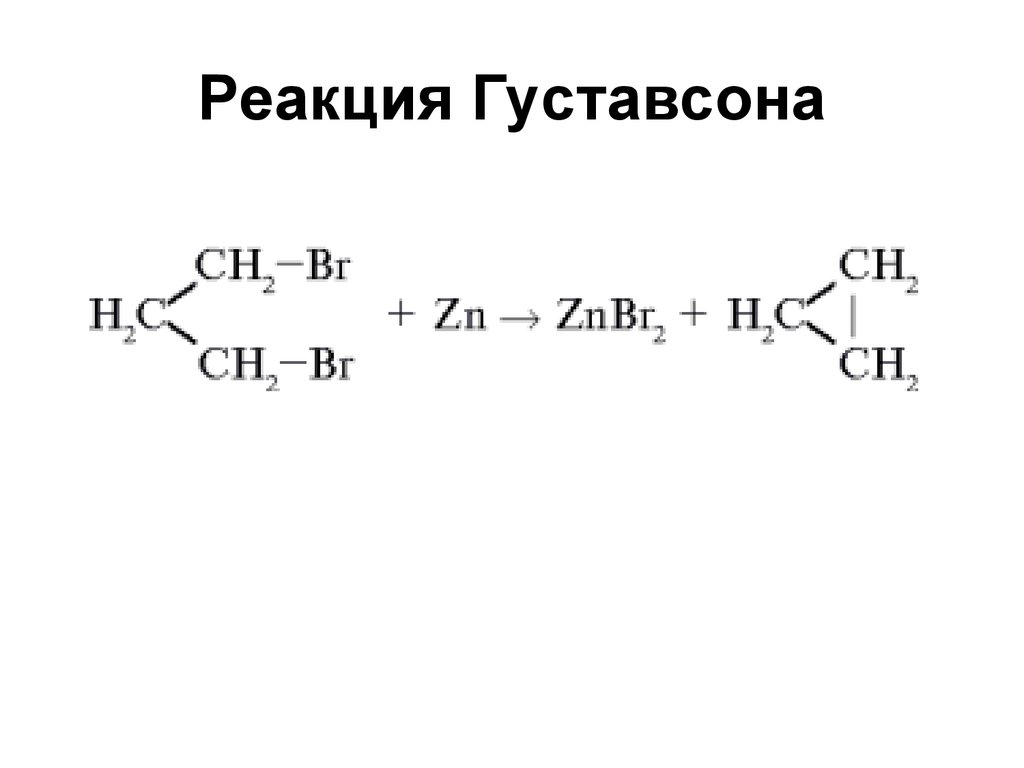
11. Реакция Густавсона
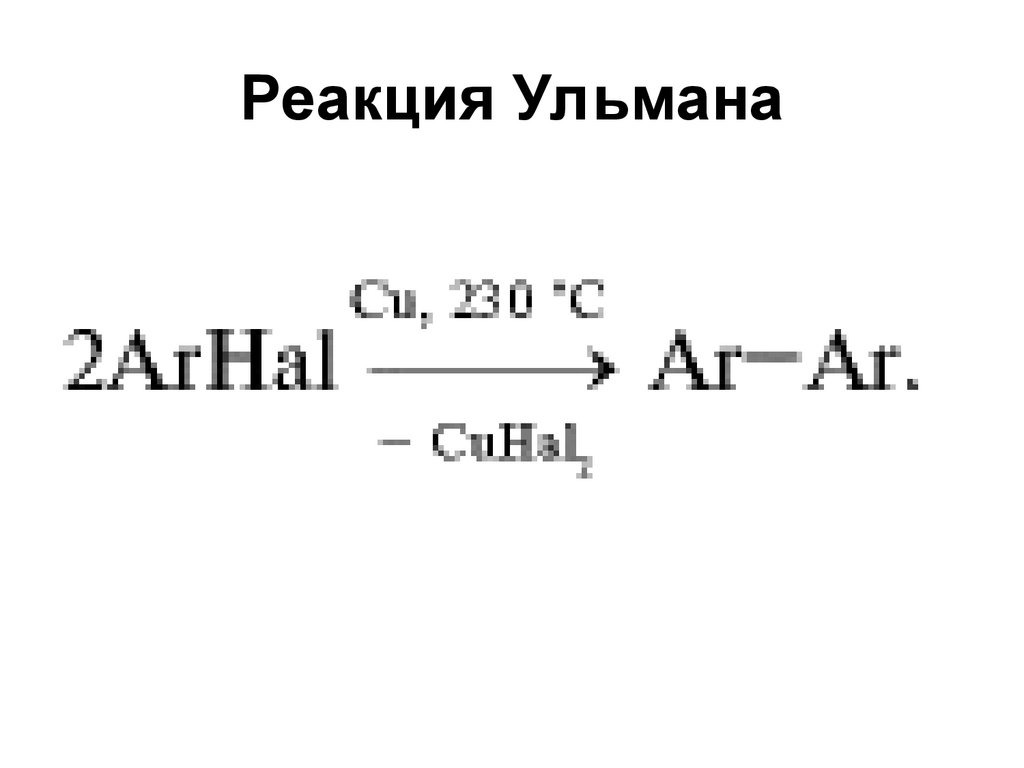
12. Реакция Ульмана
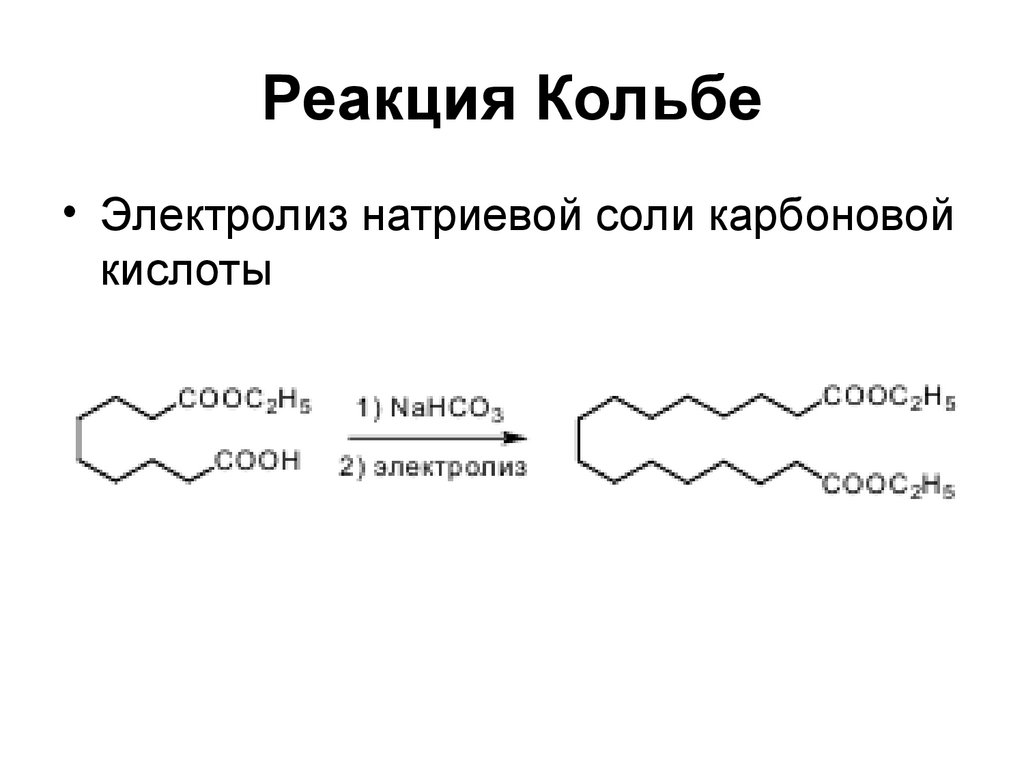
13. Реакция Кольбе
• Электролиз натриевой соли карбоновойкислоты
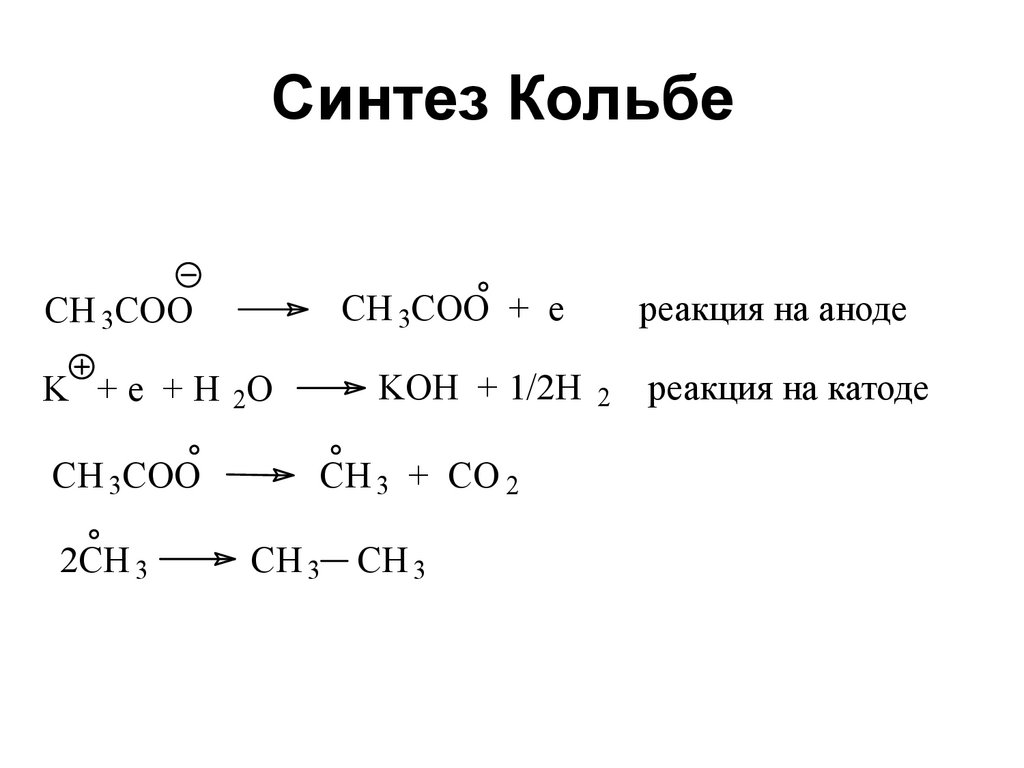
14. Синтез Кольбе
CH 3COO + eCH 3COO
K + e + H 2O
CH 3COO
2CH 3
реакция на аноде
KOH + 1/2H 2 реакция на катоде
CH 3 + CO 2
CH 3 CH 3
15. Реакция Дюма
Сплавление солей карбоновыхкислот со щелочами.
Н3С-СООNa + NaOH →
CH4 + Na2CO3
Декарбоксилирование (-СО2 ↑)
ДЮМА Жан Батист Андре
(14.7.1800-11.4.1884)
16. Синтез Фишера–Тропша
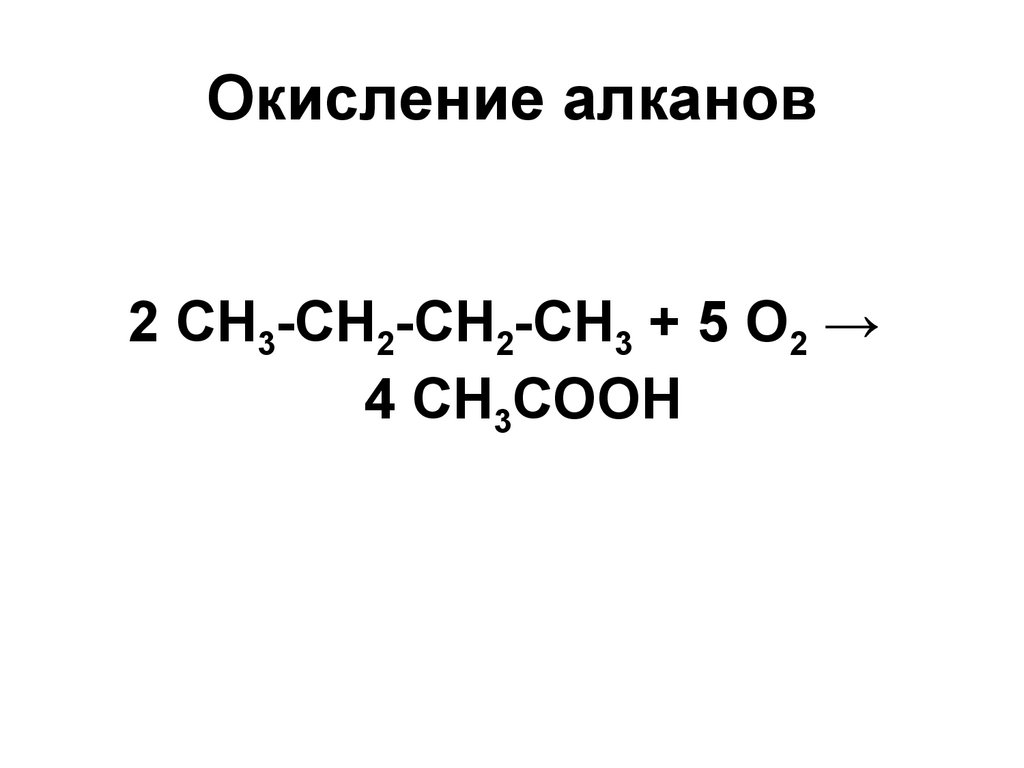
17. Окисление алканов
2 СН3-СН2-СН2-СН3 + 5 О2 →4 СН3СООН
18. Термический и каталитический крекинг
• В определенных условияхудается отделять
промежуточные продукты
(ацетилен получают из метана)
2 CH4 → C2H2 + 3 H2
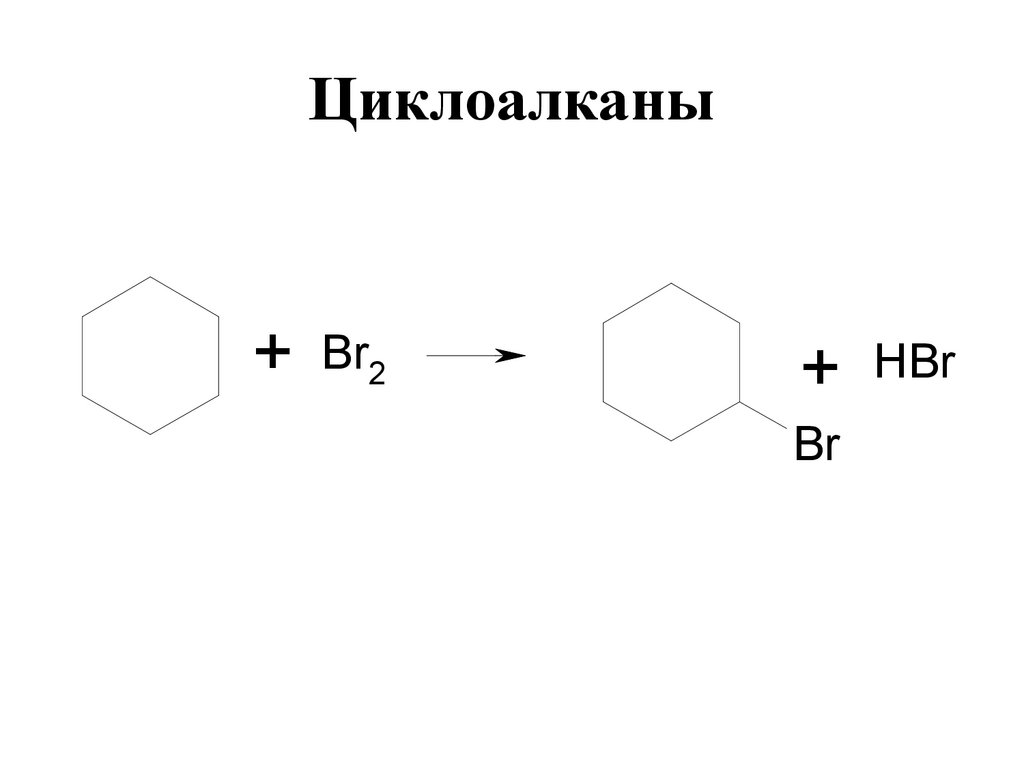
19. Циклоалканы
+ Br2+ HBr
Br
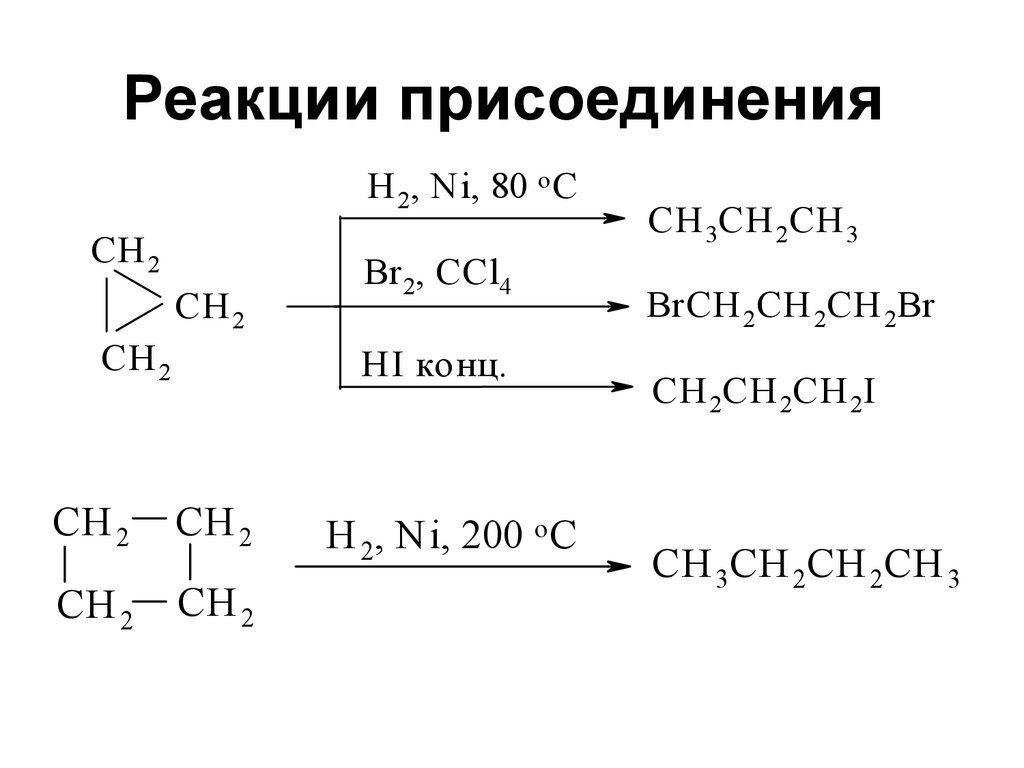
20. Реакции присоединения
H 2, N i, 80 o CСH 2
СH 2
СH 2
Br 2, CCl4
HI конц.
СH 2
СH 2
СH 2
СH 2
H 2, N i, 200 o C
СH 3CH 2CH 3
BrСH 2CH 2CH 2Br
СH 2CH 2CH 2I
СH 3CH 2CH 2CH 3
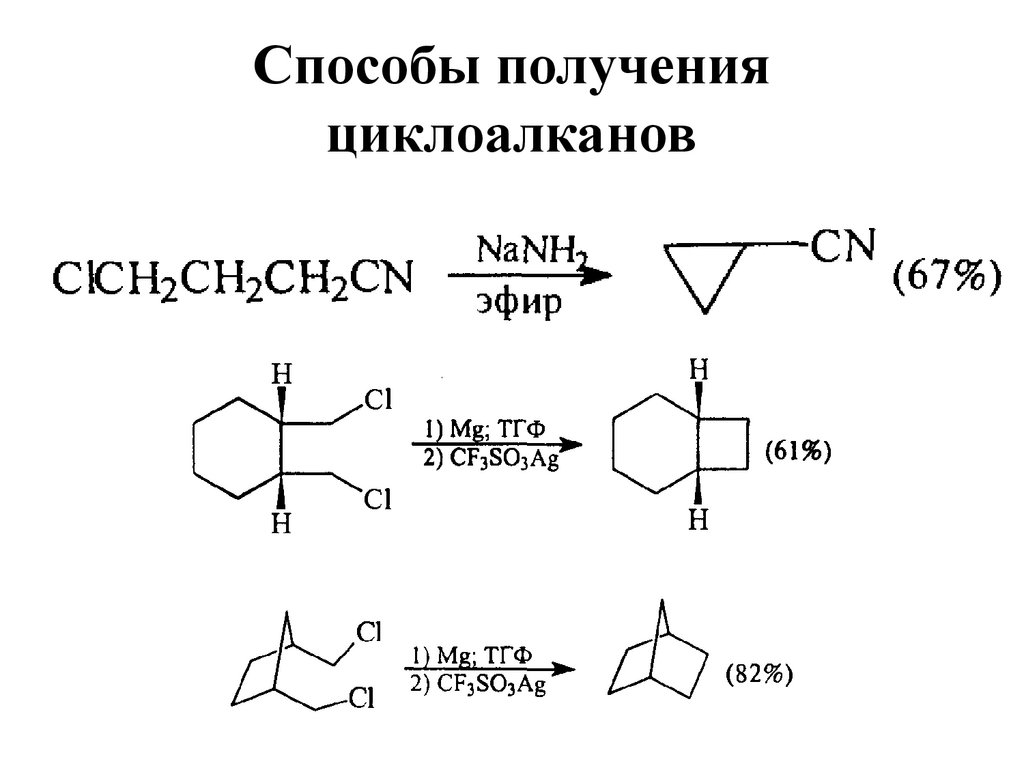
21. Способы получения циклоалканов
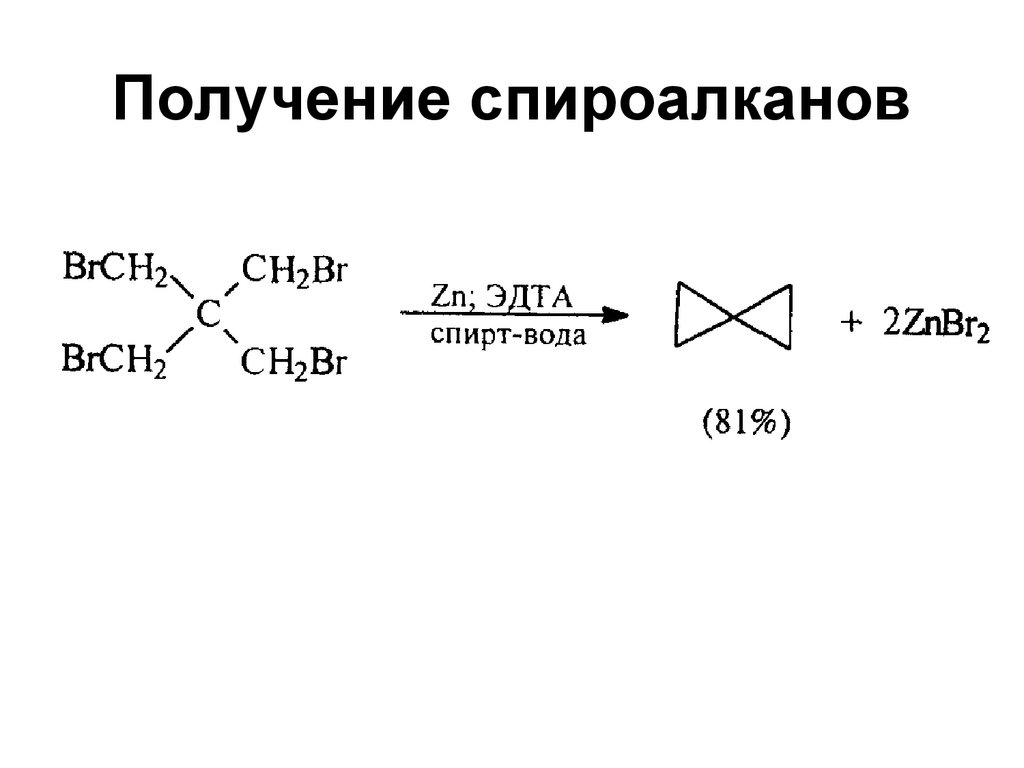
22. Получение спироалканов
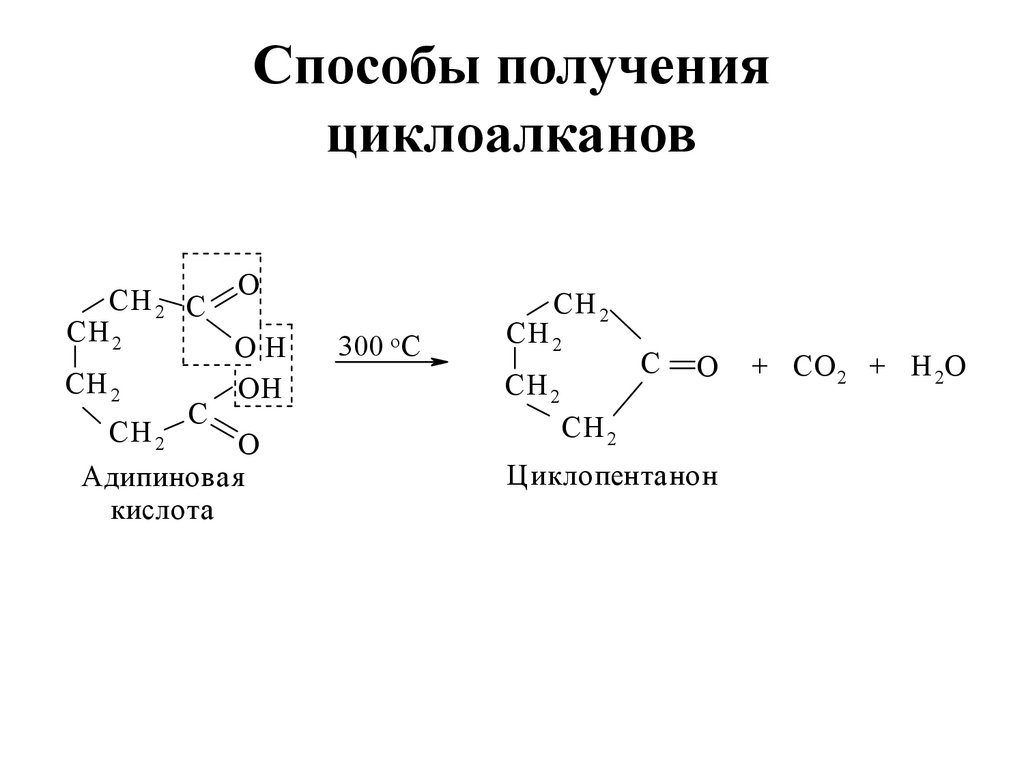
23. Способы получения циклоалканов
СН 2 ССН 2
СН 2
O
ОН
ОН
С
СН 2
O
Адипиновая
кислота
300 о С
СН 2
СН 2
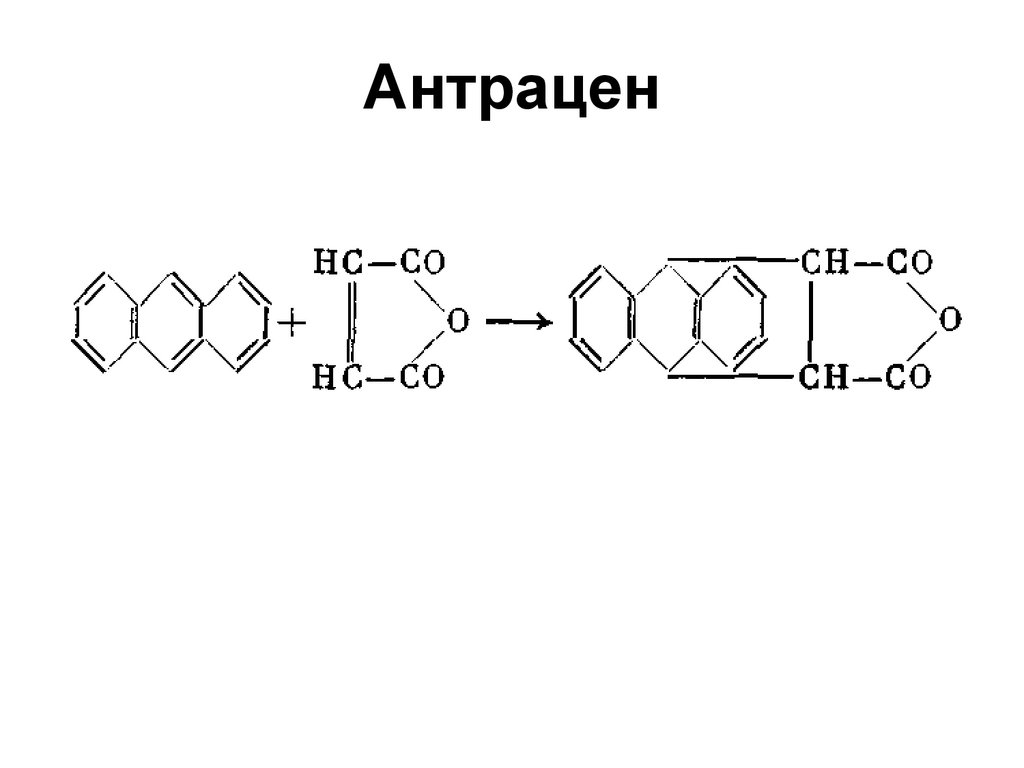
СН 2
С
O
СН 2
Циклопентанон
+ СО 2 + Н 2О
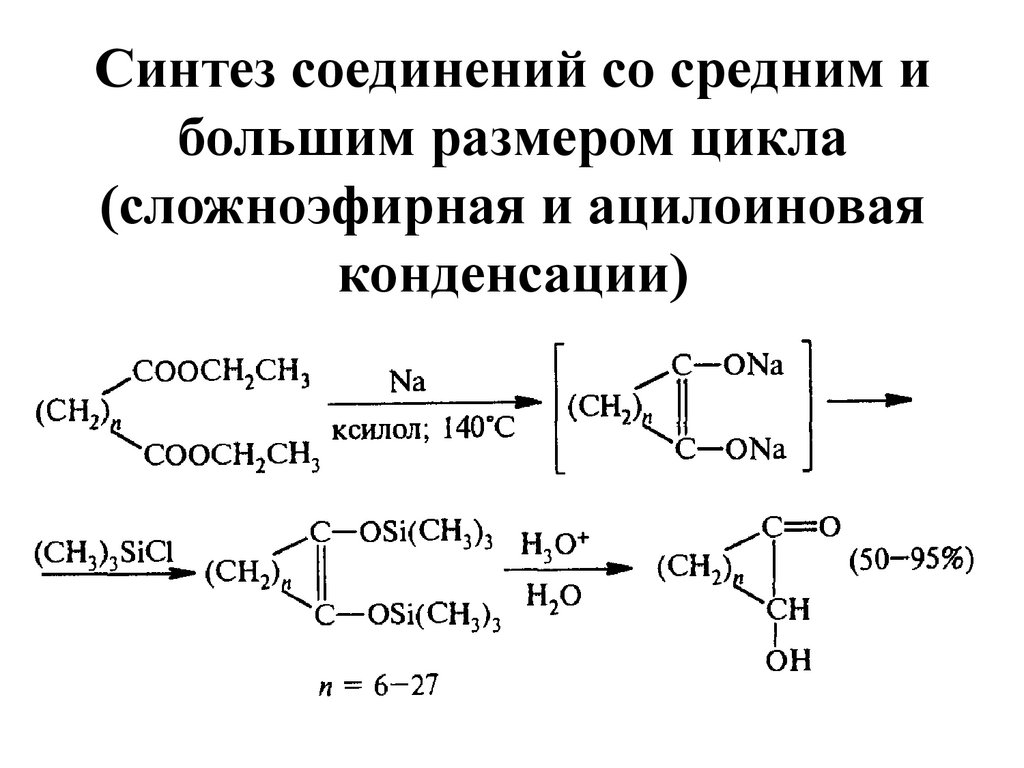
24. Синтез соединений со средним и большим размером цикла (сложноэфирная и ацилоиновая конденсации)
25.
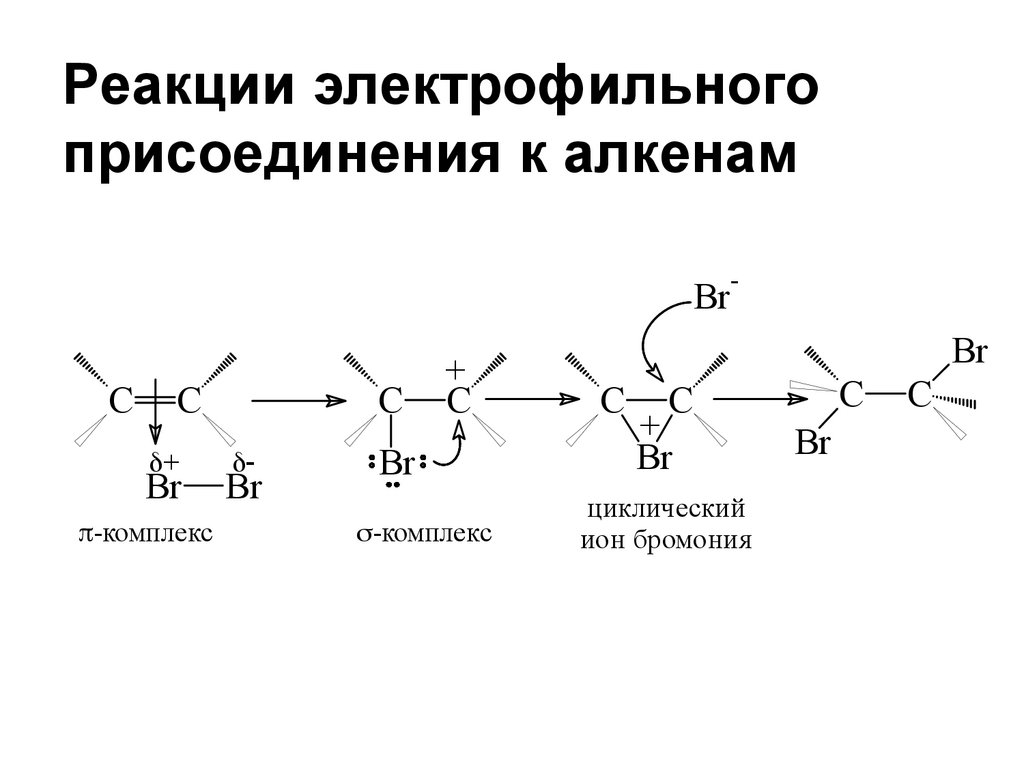
Реакции электрофильногоприсоединения к алкенам
-
Br
C
C
+
Br
-комплекс
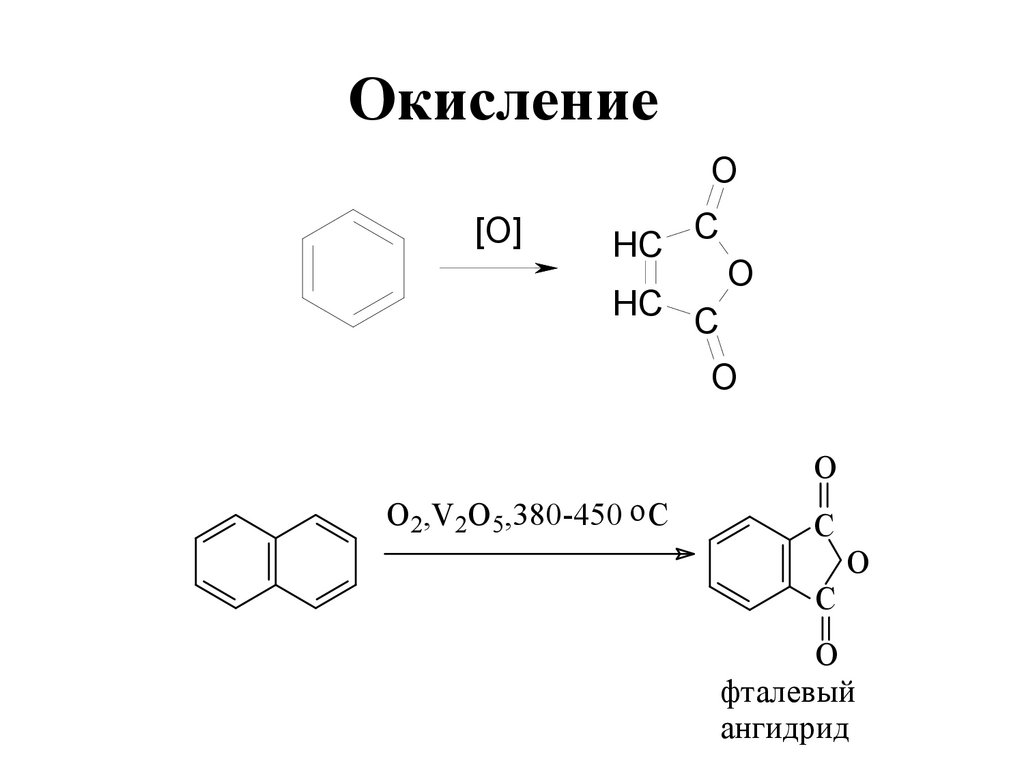
C
Br
+
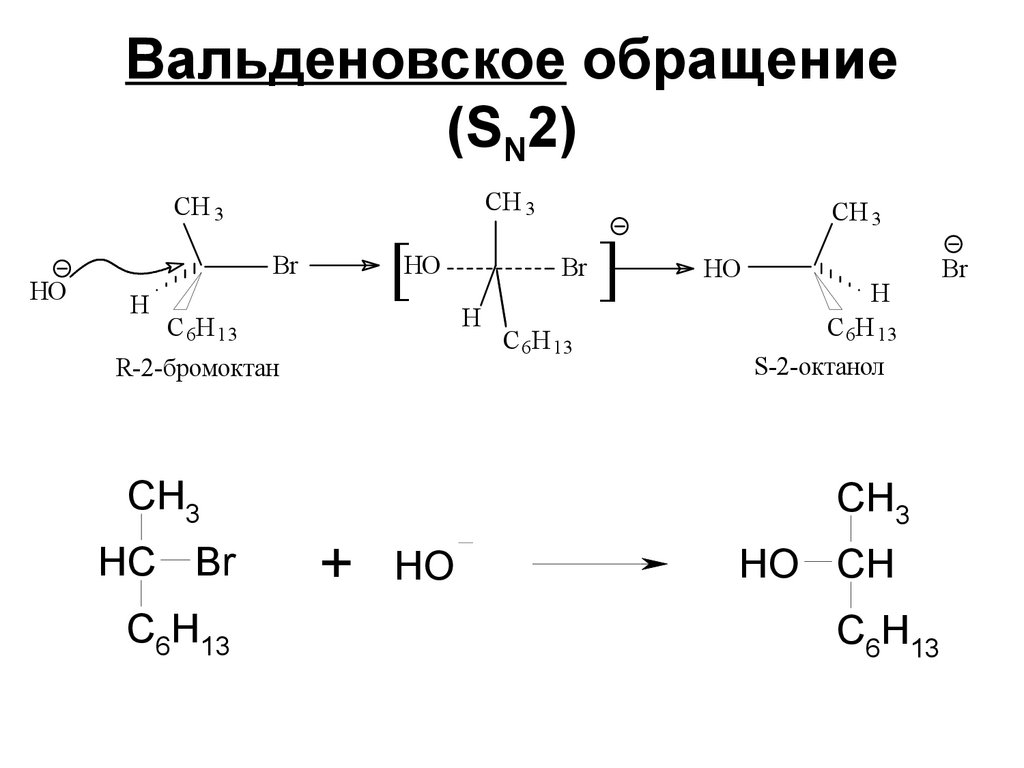
C
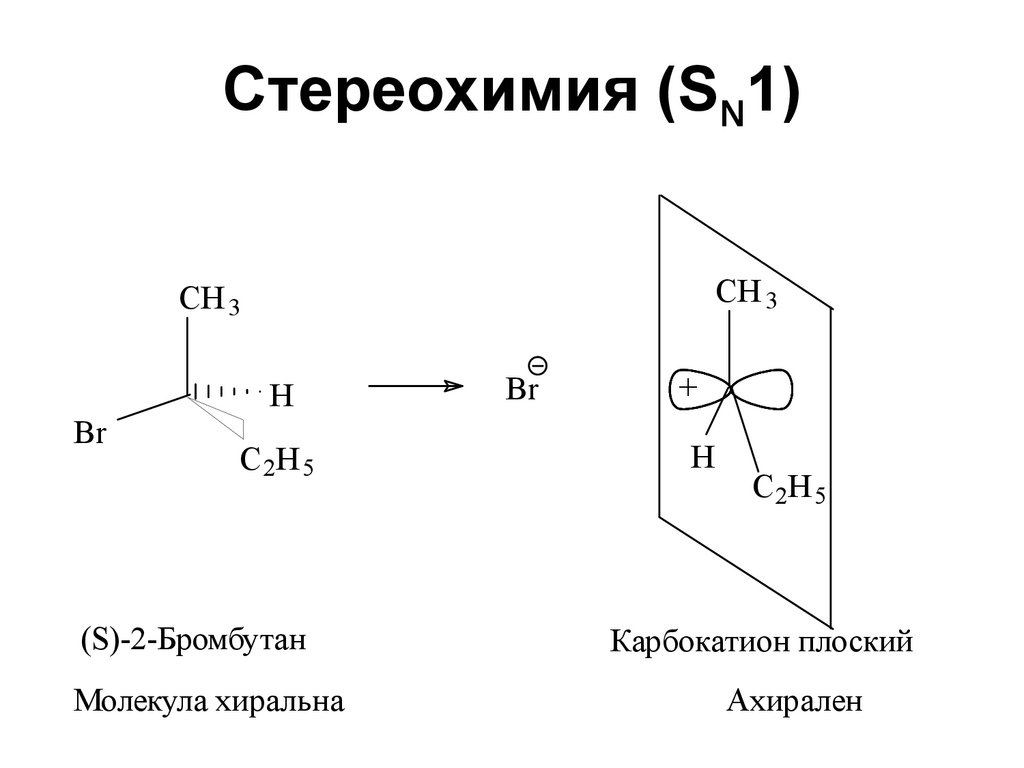
Br
-комплекс
C
C
+
Br
циклический
ион бромония
Br
C
C
Br
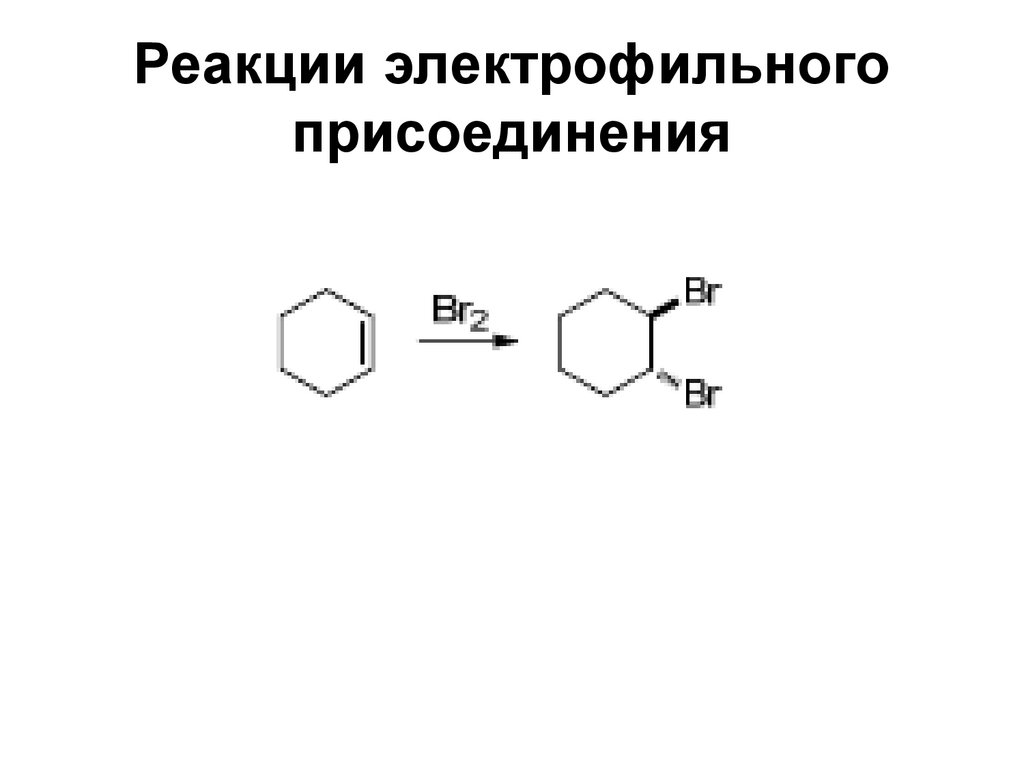
26. Реакции электрофильного присоединения
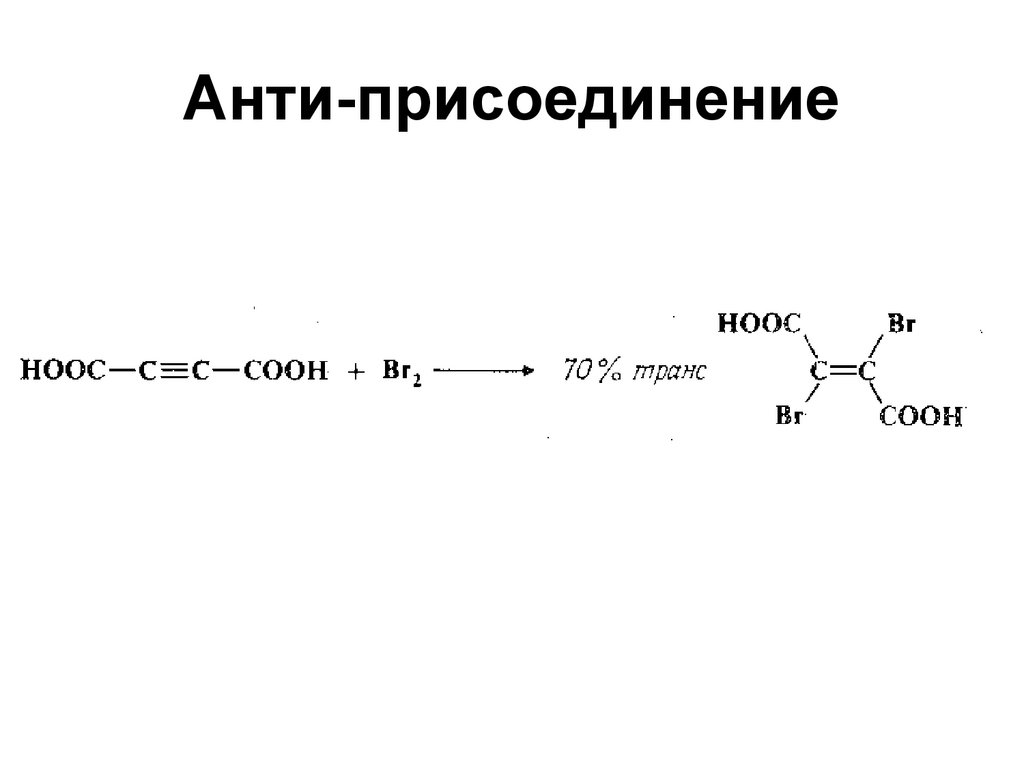
27. Анти-присоединение
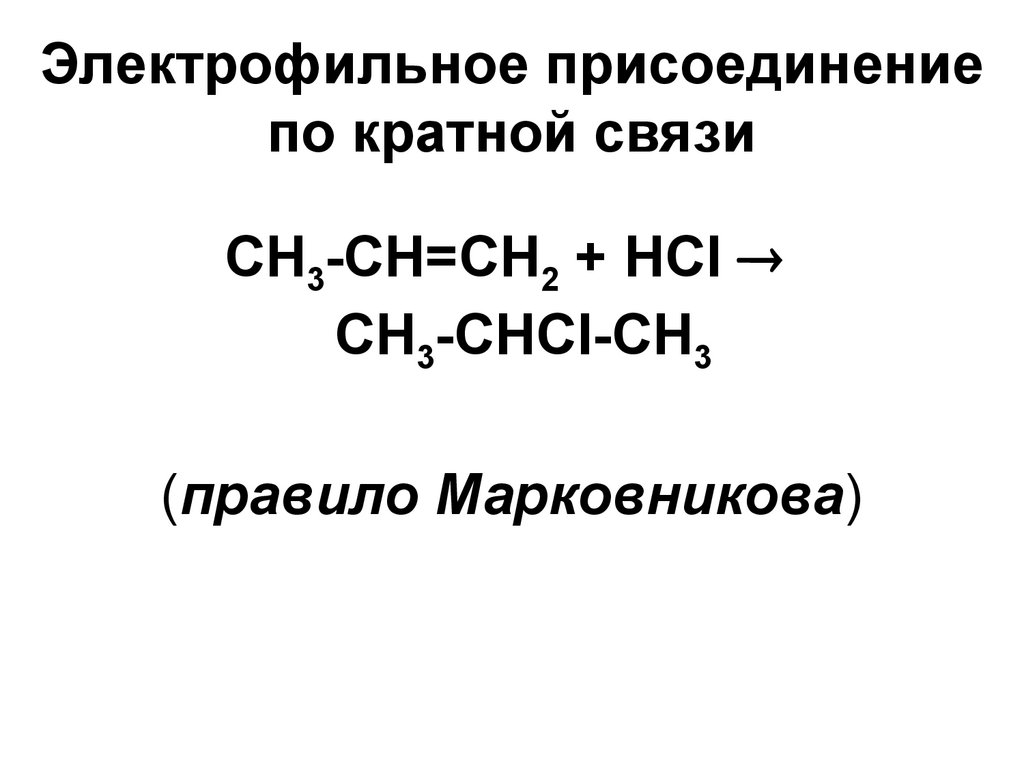
28. Электрофильное присоединение по кратной связи
СН3-СН=СН2 + НСlСН3-СНCl-СН3
(правило Марковникова)
29. Правило Марковникова
В случае присоединенияводородсодержащих соединений к
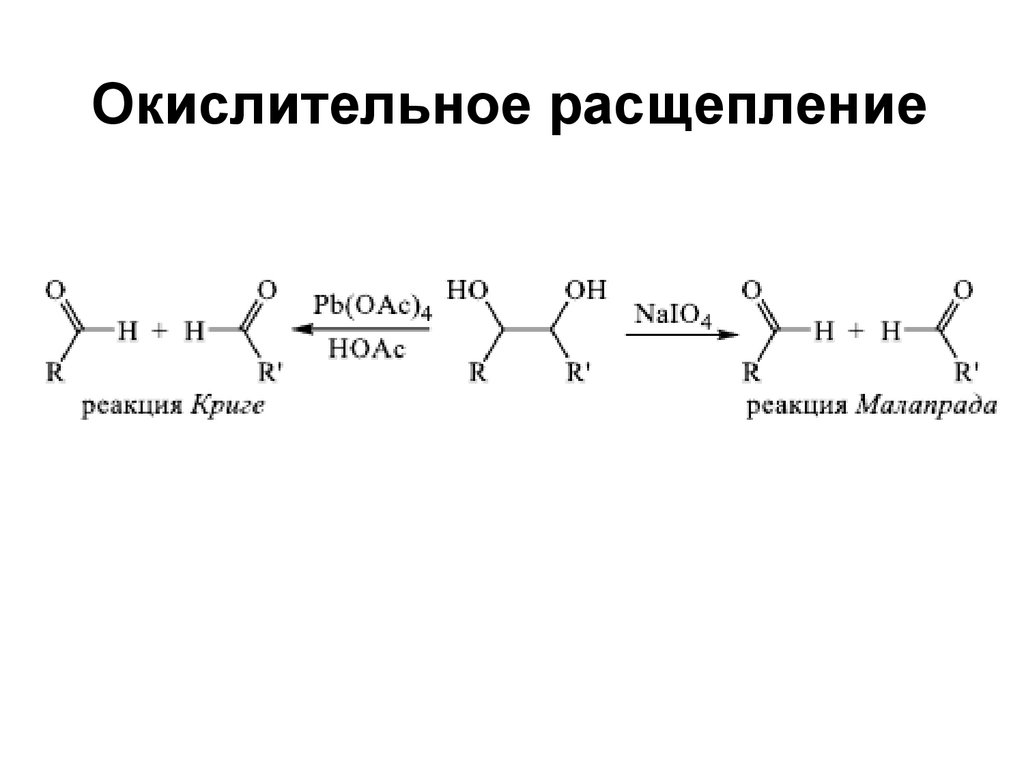
несимметричному алкену атом
водорода присоединяется к наиболее
гидрированному атому углерода,
стоящему при двойной связи.
(1869 г.)
H2C=CH2 + H+OH -
CH3 CH2OH
МАРКОВНИКОВ Владимир Васильевич.
(25.11.1837-11.02.1904)
CH3 CH=CH2+H+OH-
H3C CH CH3
OH
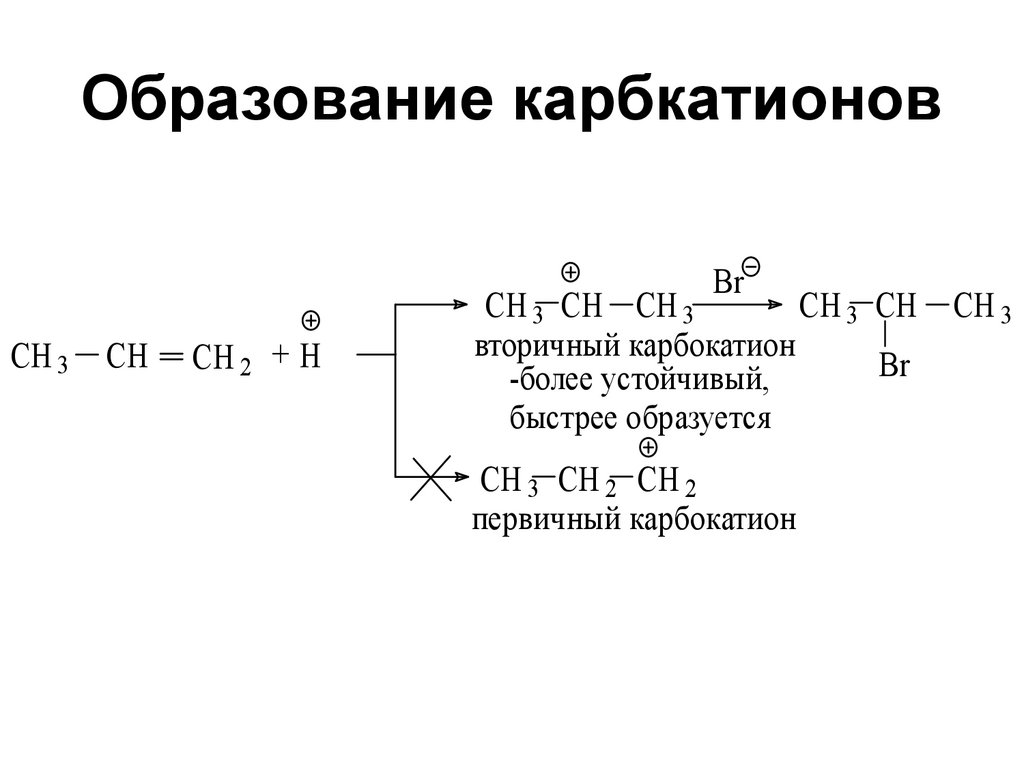
30. Образование карбкатионов
BrCH 3
CH
CH 2 + H
CH 3 CH CH 3
CH 3 CH CH 3
вторичный карбокатион
Br
-более устойчивый,
быстрее образуется
CH 3 CH 2 CH 2
первичный карбокатион
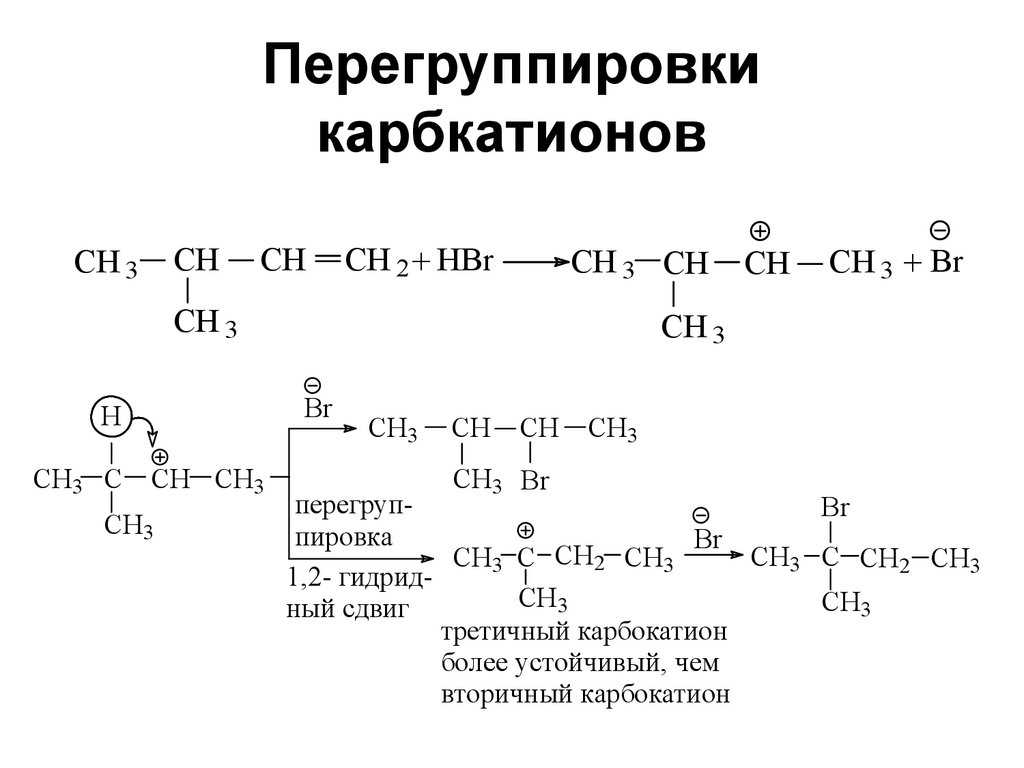
31. Перегруппировки карбкатионов
CH 3CH
CH
CH 2 + HBr
CH 3 CH
CH 3
H
CH3 C CH CH3
CH3
CH
CH 3 + Br
CH 3
Br
CH3
CH
CH
CH3 Br
CH3
перегрупBr
пировка
Br
CH3 C CH2 CH3
CH3 C CH2 CH3
1,2- гидридCH3
CH3
ный сдвиг
третичный карбокатион
более устойчивый, чем
вторичный карбокатион
32.
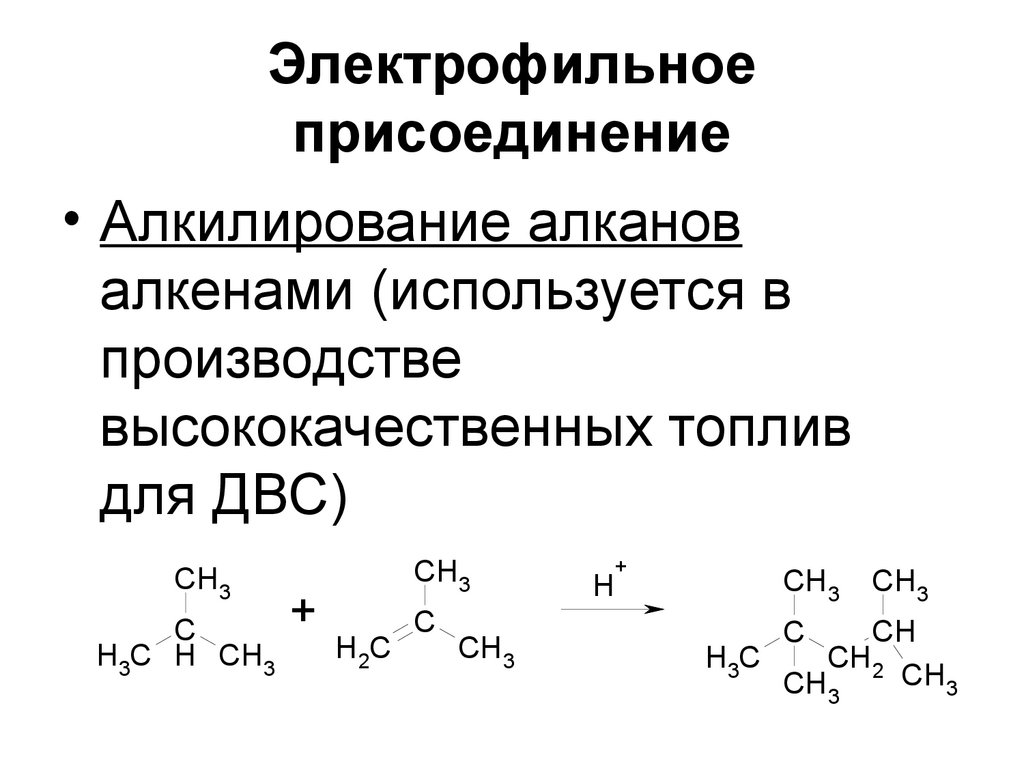
33. Электрофильное присоединение
• Алкилирование алкановалкенами (используется в
производстве
высококачественных топлив
для ДВС)
CH3
CH3
+
C
C
H2C
CH3
H3C H CH3
H
+
CH3
CH3
CH
H3C
CH2
CH3
CH
C
3
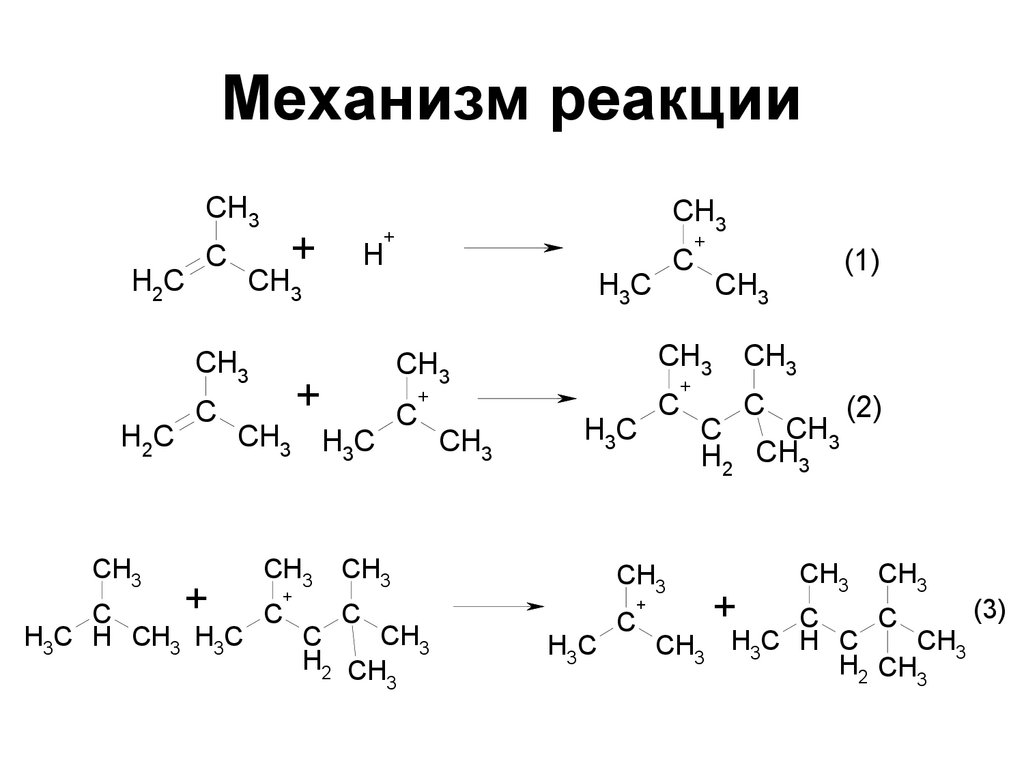
34. Механизм реакции
CH3H2C
C
+
H2C
CH3
C
+
CH3
CH3
C
H3C
CH3
H3C
CH3
3
CH3
CH3
C
C
CH3
C
H2 CH3
CH3
+
H3C
C
(1)
CH3
+
+
+ C C
C
CH3
H3C H CH3 H3C
C
H2 CH
+
C
H3C
+
CH3
+
H
CH3
CH3
CH3
CH3
+
(2)
CH3
CH3
(3)
C
C
CH3
H3C H C
H2 CH3
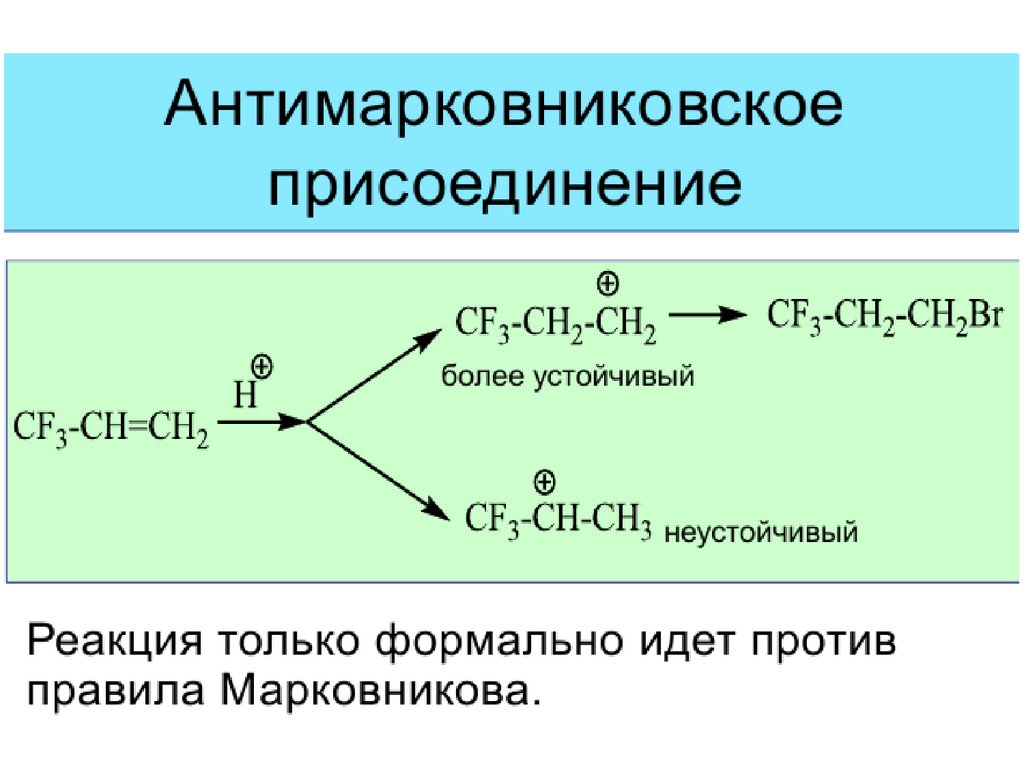
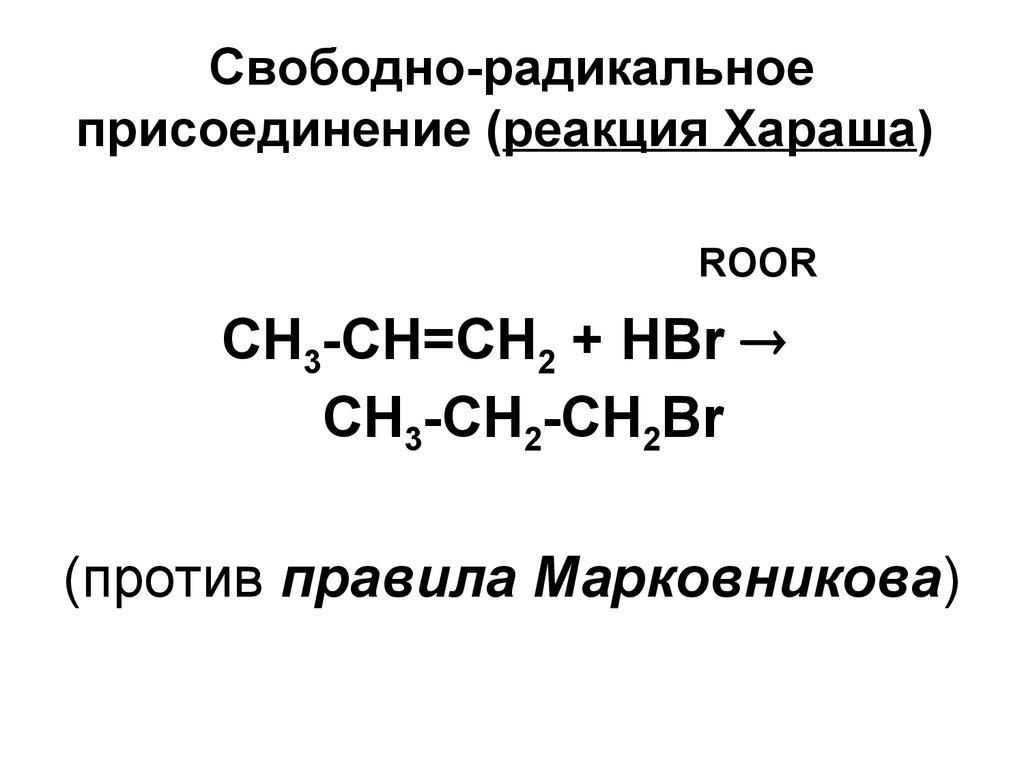
35. Свободно-радикальное присоединение (реакция Хараша)
ROORСН3-СН=СН2 + НBr
СН3-СН2-СН2Br
(против правила Марковникова)
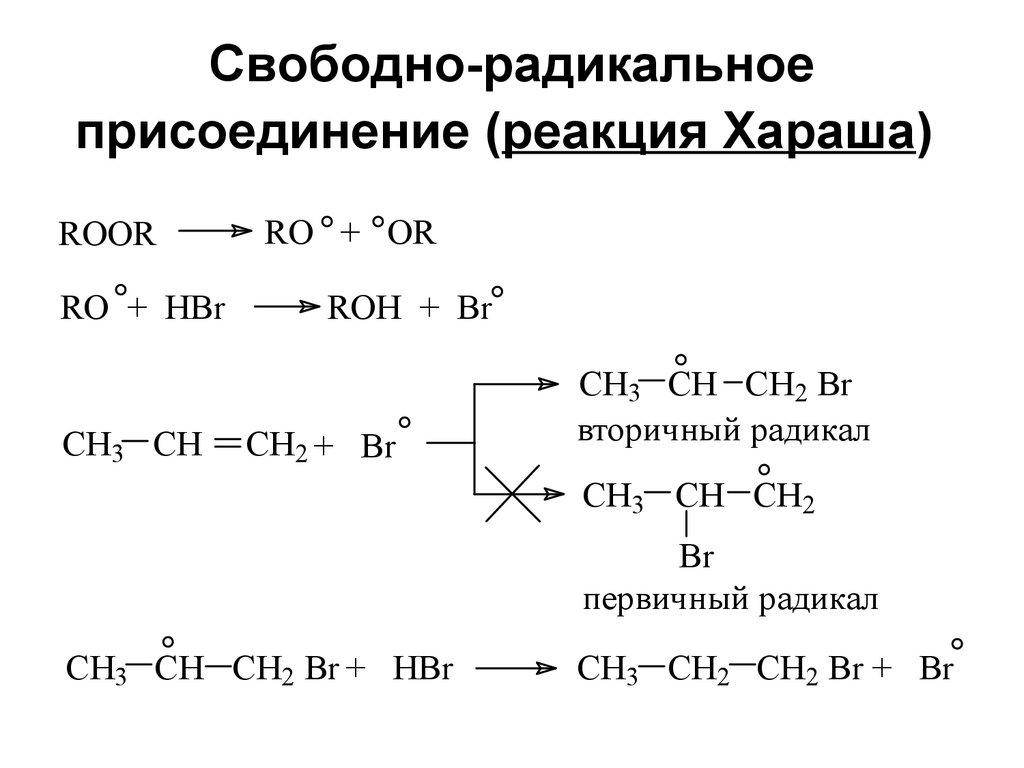
36. Свободно-радикальное присоединение (реакция Хараша)
ROORRO + HBr
CH3 CH
RO + OR
ROH + Br
CH2 + Br
CH3 CH CH2 Br
вторичный радикал
CH3 CH CH2
Br
первичный радикал
CH3 CH CH2 Br + HBr
CH3 CH2 CH2 Br + Br
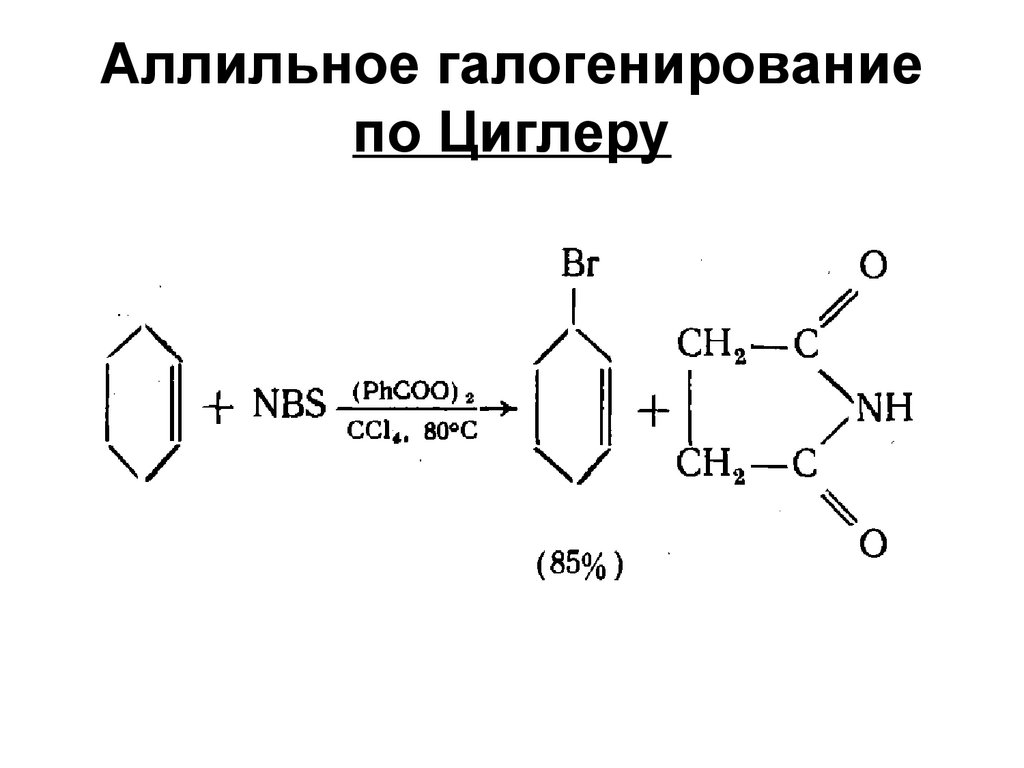
37. Аллильное галогенирование по Циглеру
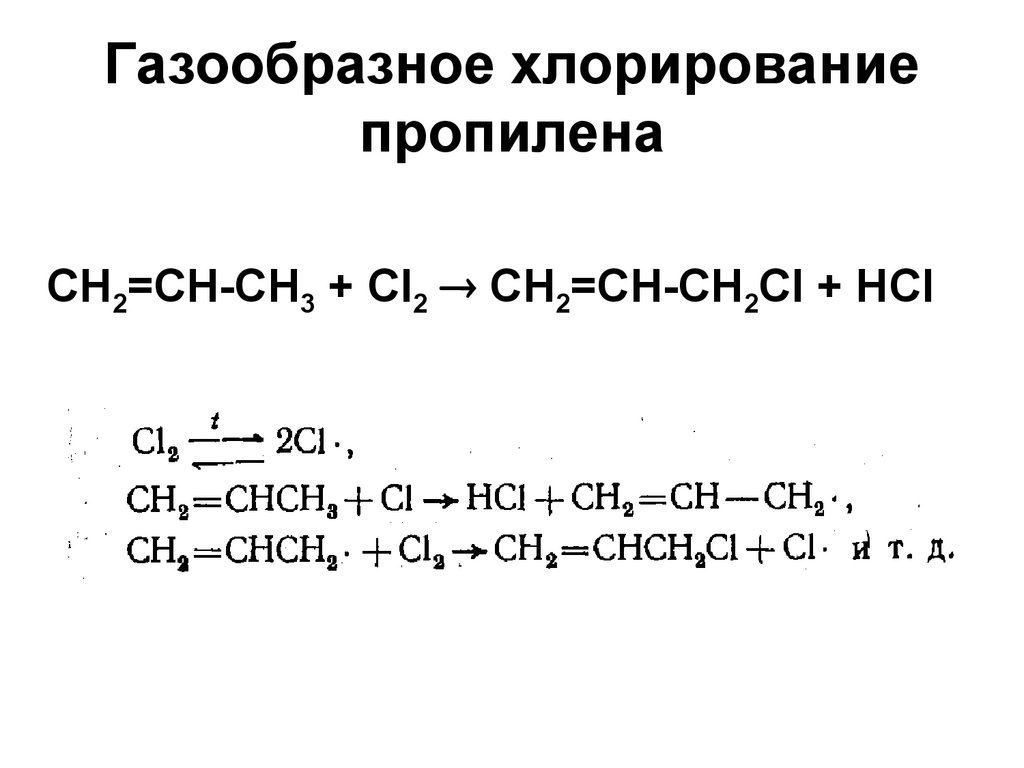
38. Газообразное хлорирование пропилена
CH2=CH-CH3 + Cl2 CH2=CH-CH2Cl + HCl39. Реакция Львова–Шешукова
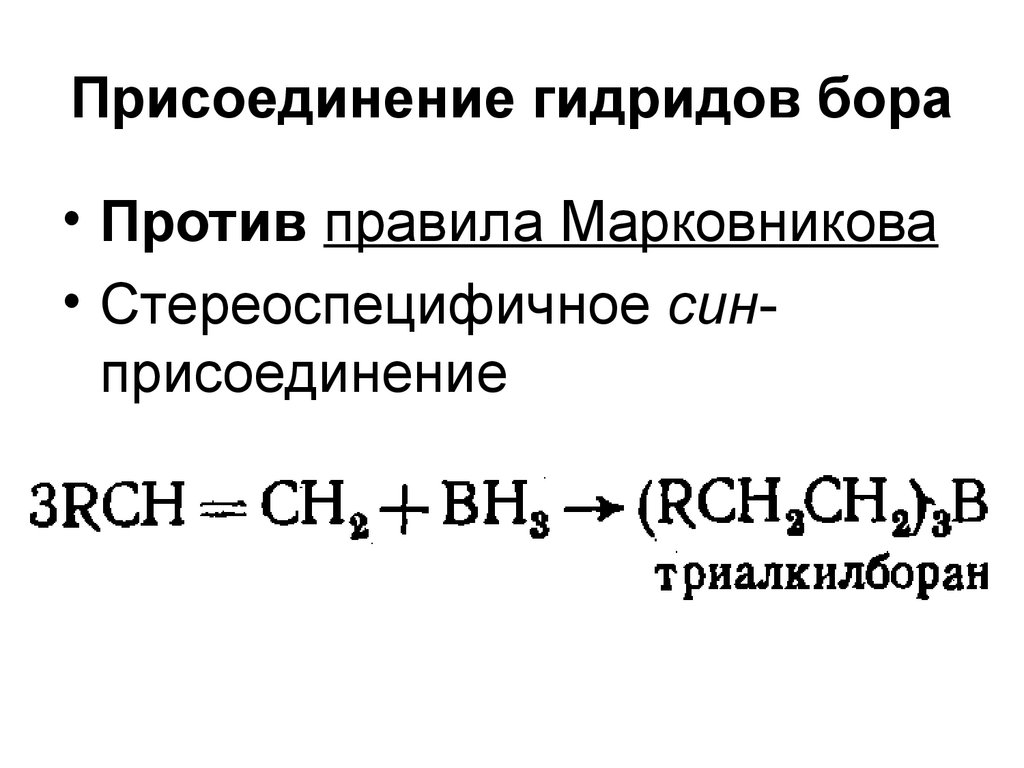
40. Присоединение гидридов бора
• Против правила Марковникова• Стереоспецифичное синприсоединение
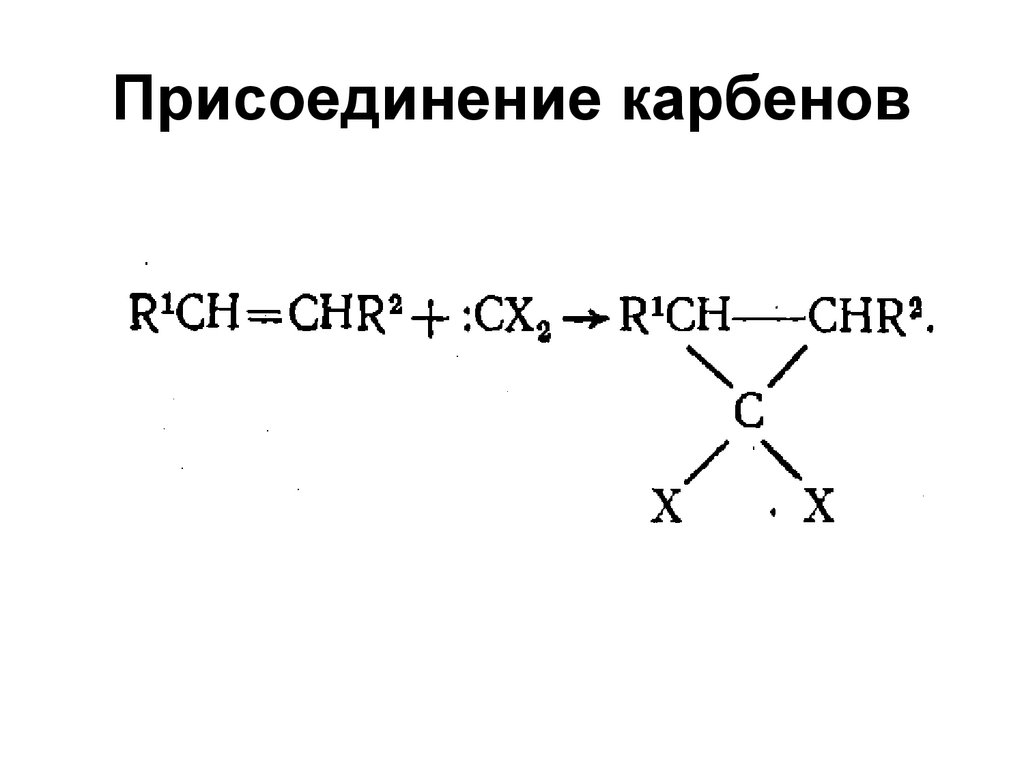
41. Присоединение карбенов
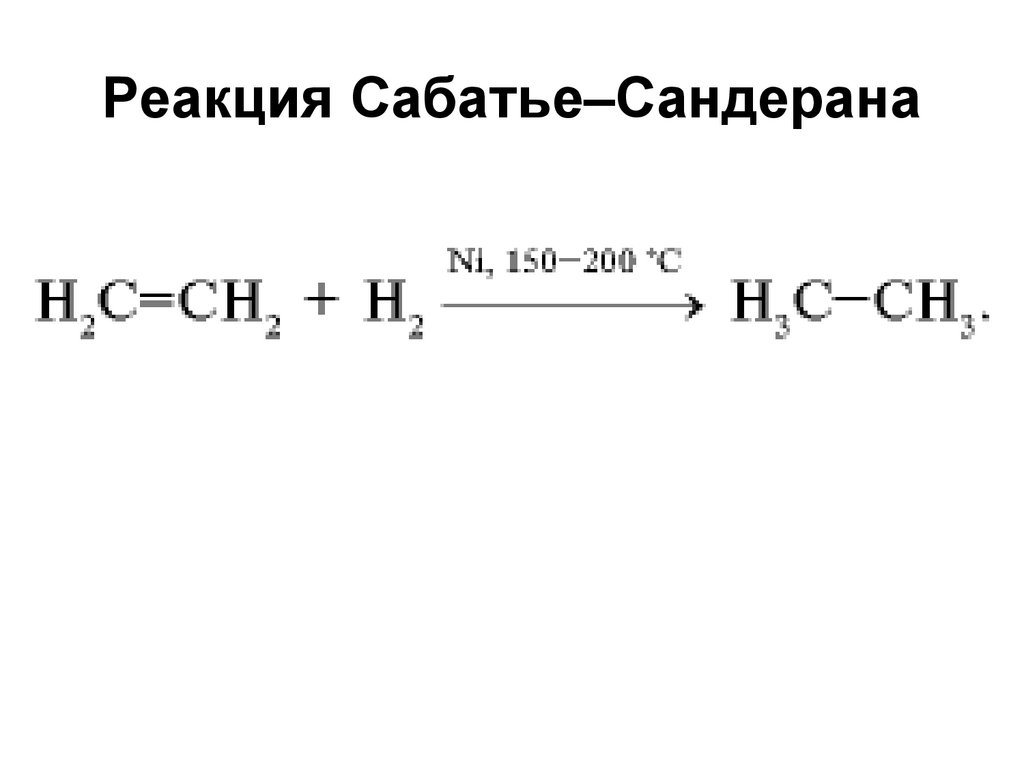
42. Реакция Сабатье–Сандерана
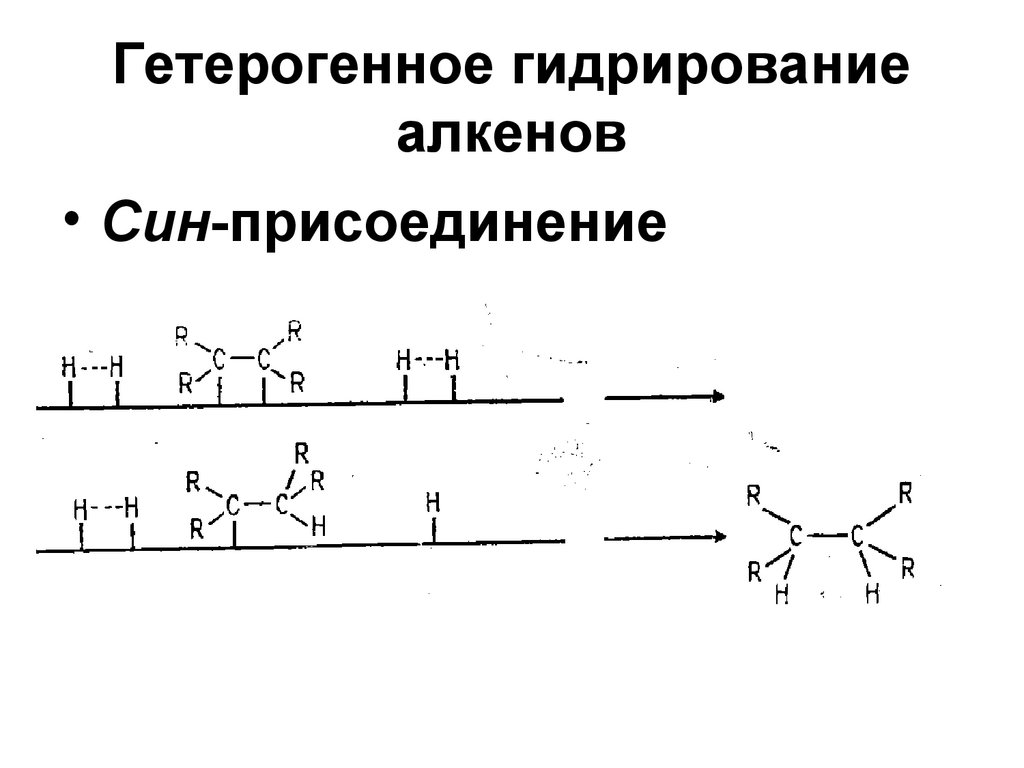
43. Гетерогенное гидрирование алкенов
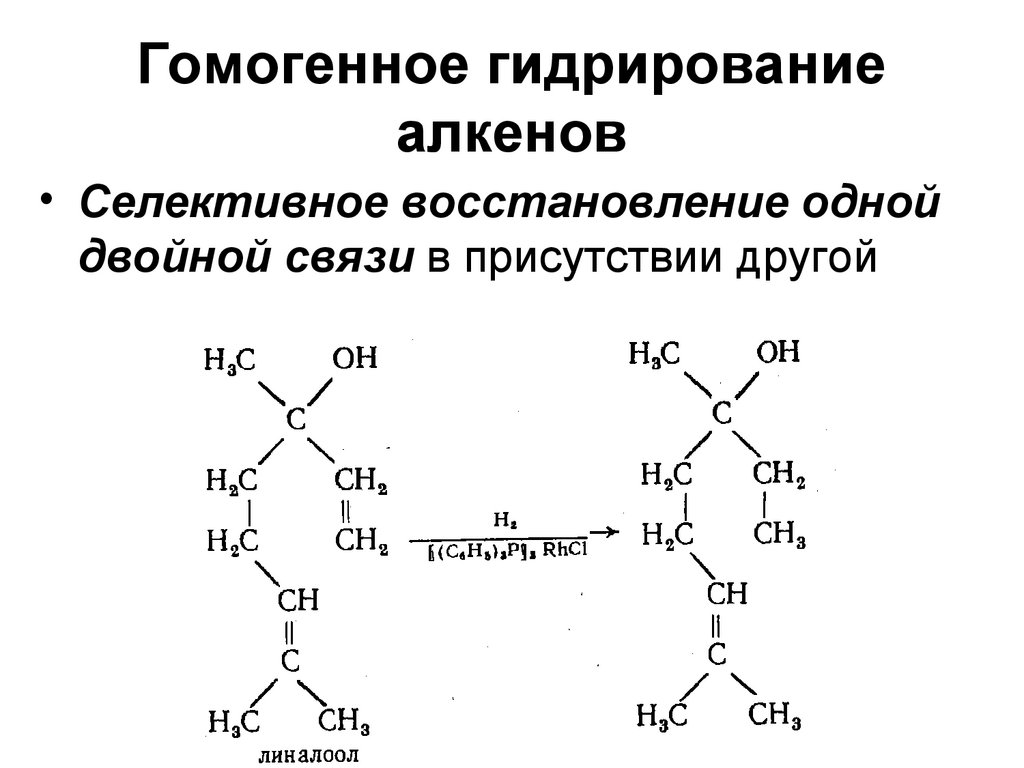
• Син-присоединение44. Гомогенное гидрирование алкенов
• Селективное восстановление однойдвойной связи в присутствии другой
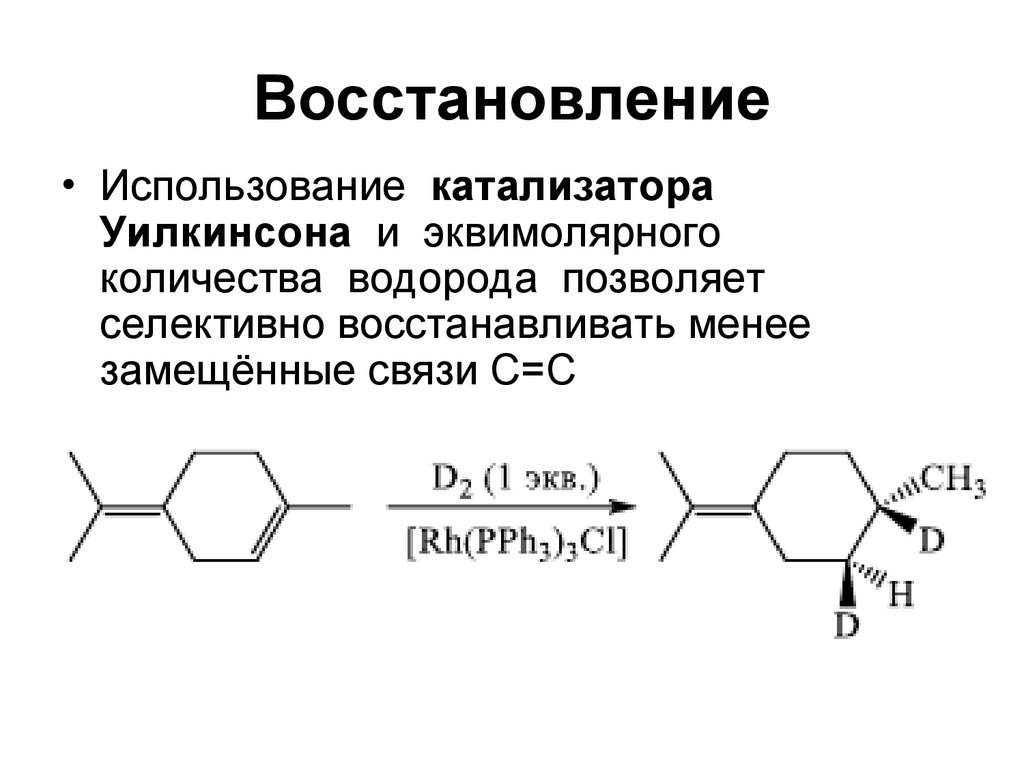
45. Восстановление
• Использование катализатораУилкинсона и эквимолярного
количества водорода позволяет
селективно восстанавливать менее
замещённые связи C=C
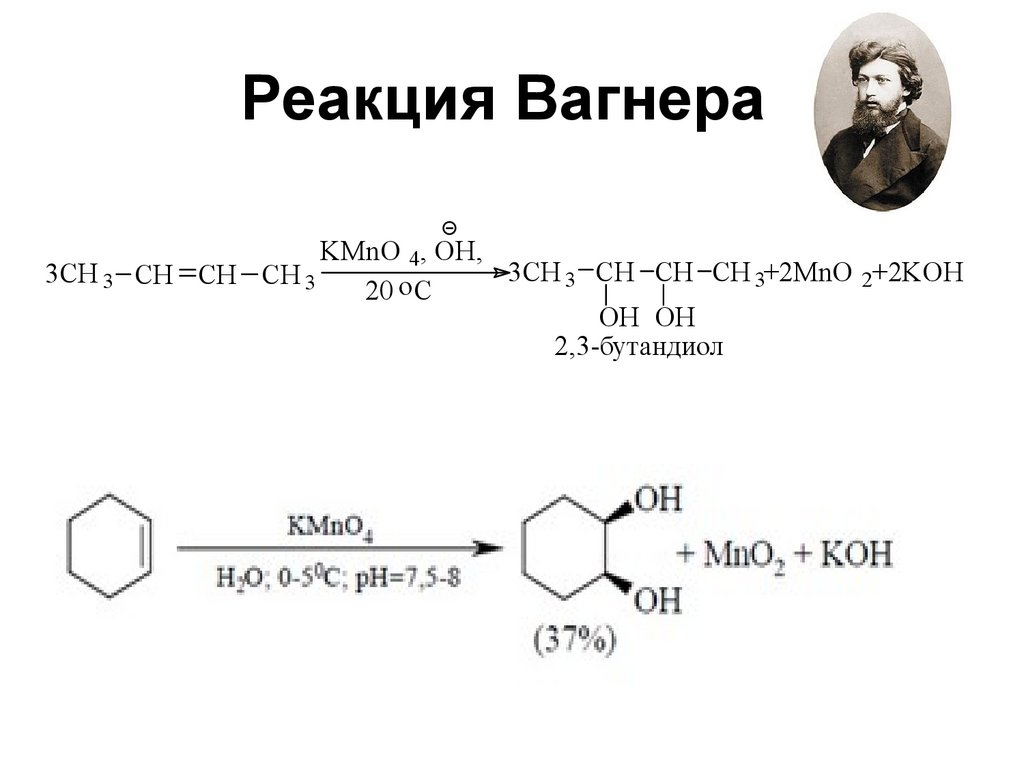
46. Реакция Вагнера
3CH 3KMnO 4, OH,
3CH 3 CH CH CH 3+2MnO 2+2KOH
CH CH CH 3
20 o C
OH OH
2,3-бутандиол
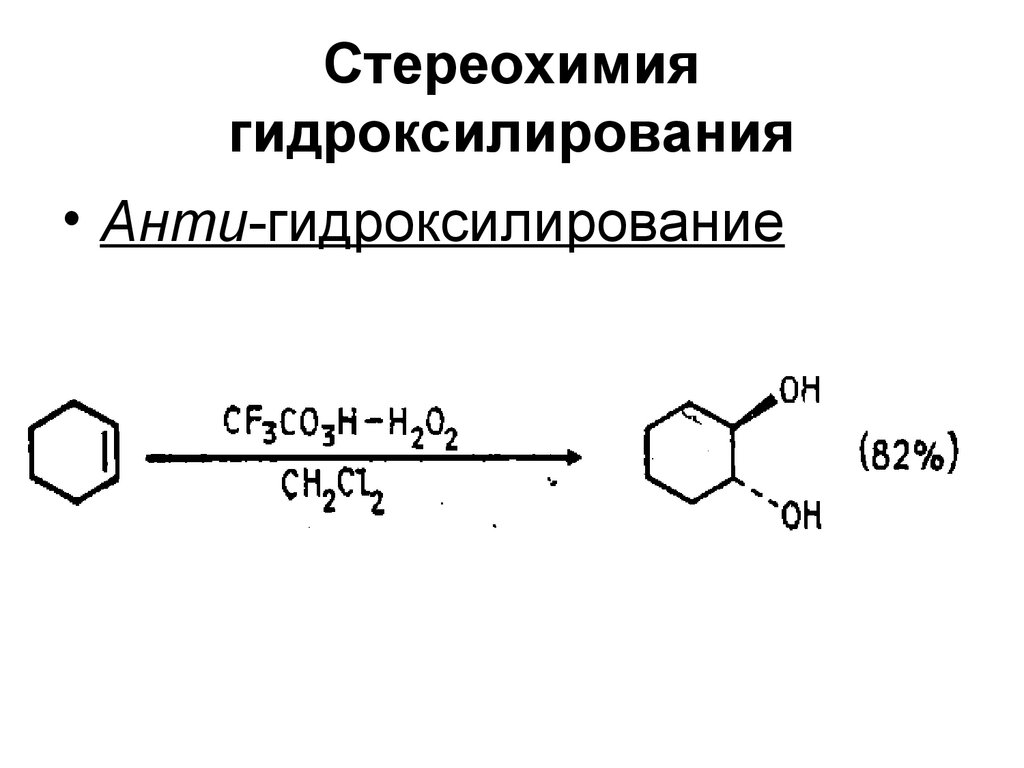
47. Стереохимия гидроксилирования
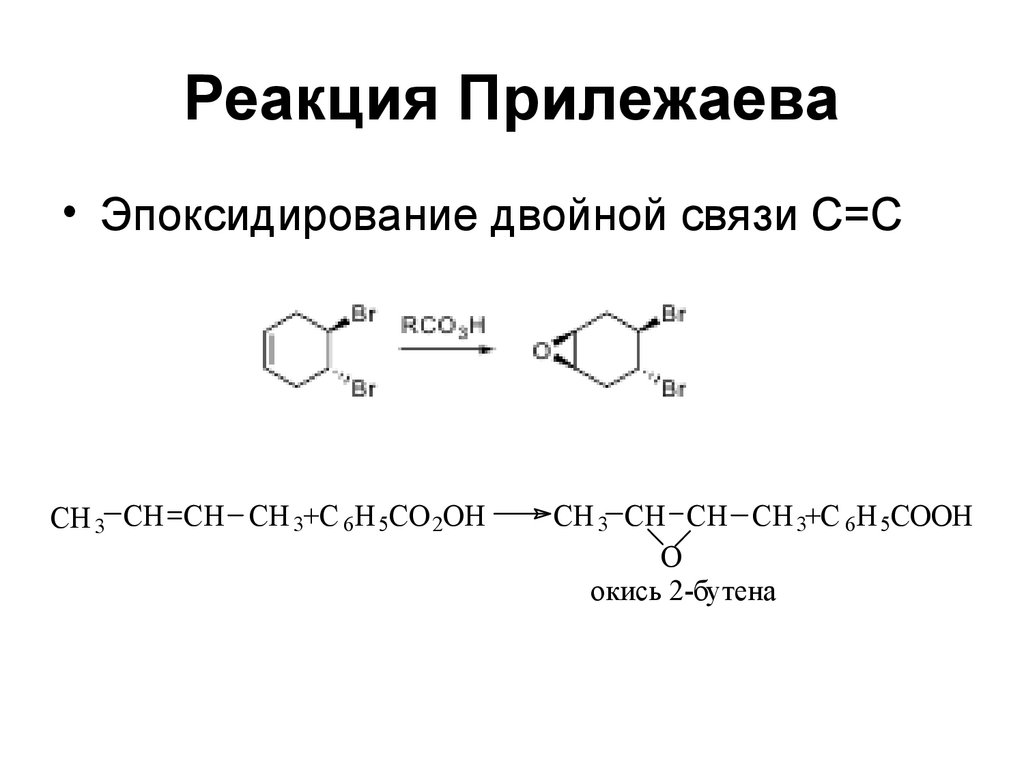
• Анти-гидроксилирование48. Реакция Прилежаева
• Эпоксидирование двойной связи С=СCH 3 CH CH CH 3+C 6H 5CO 2OH
CH 3 CH CH CH 3+C 6H 5COOH
O
окись 2-бутена
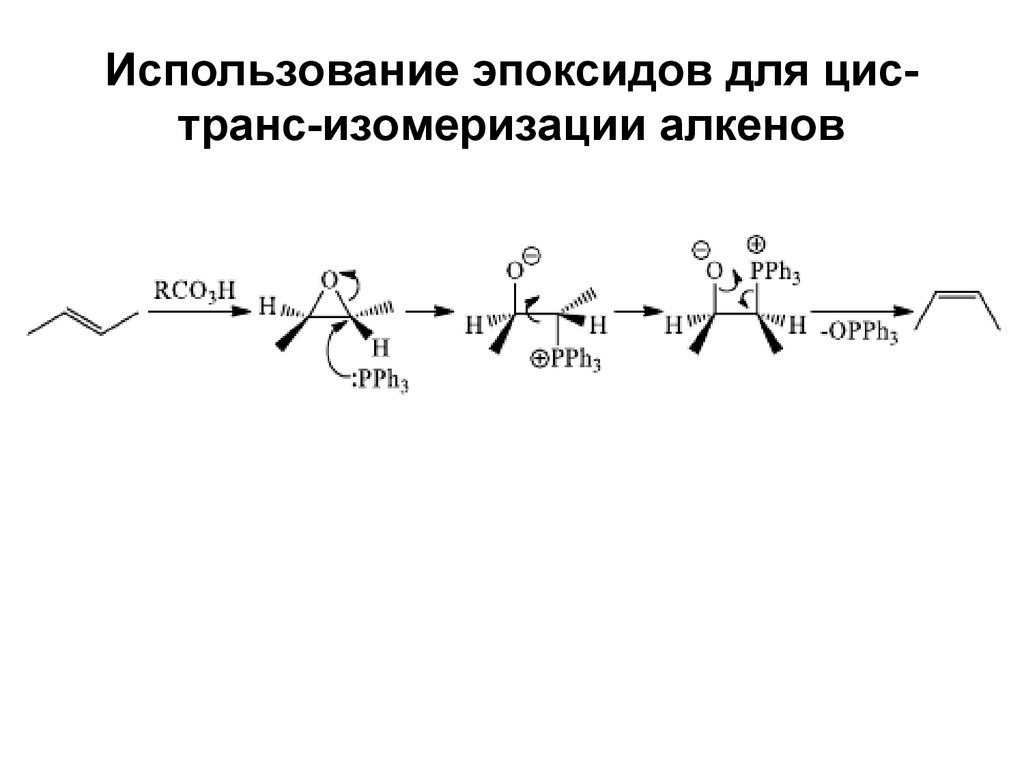
49. Использование эпоксидов для цис-транс-изомеризации алкенов
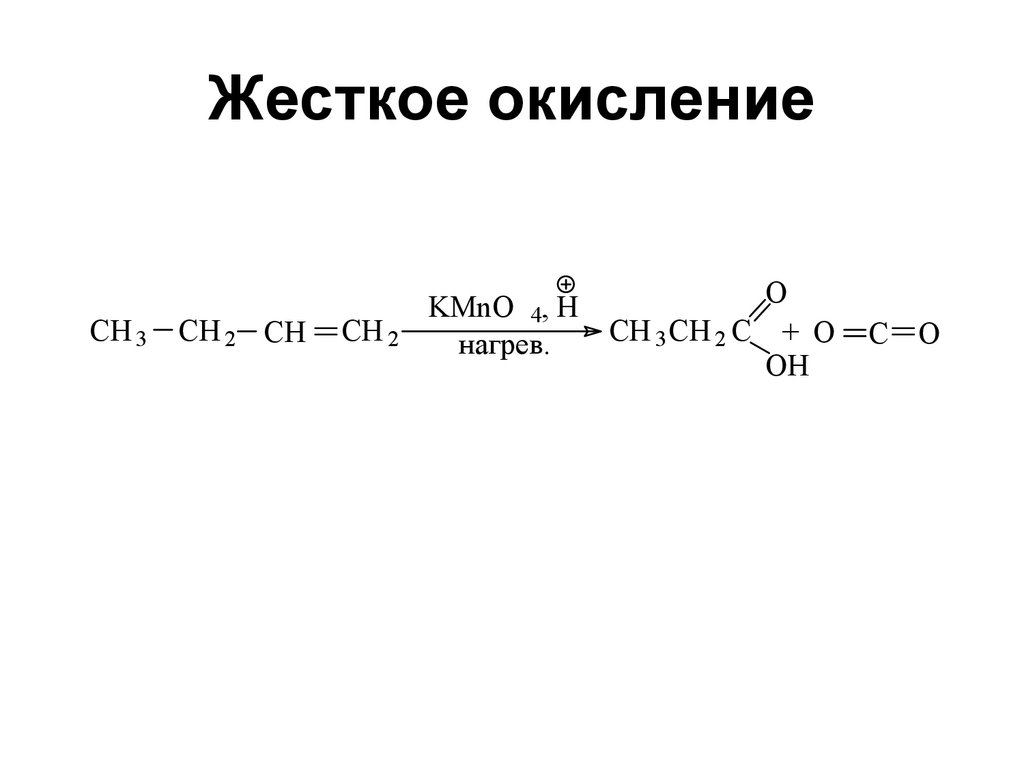
Использование эпоксидов для цистранс-изомеризации алкенов50. Жесткое окисление
CH 3CH 2 CH
CH 2
KMnO 4, H
нагрев.
O
CH 3 CH 2 C + O
OH
C
O
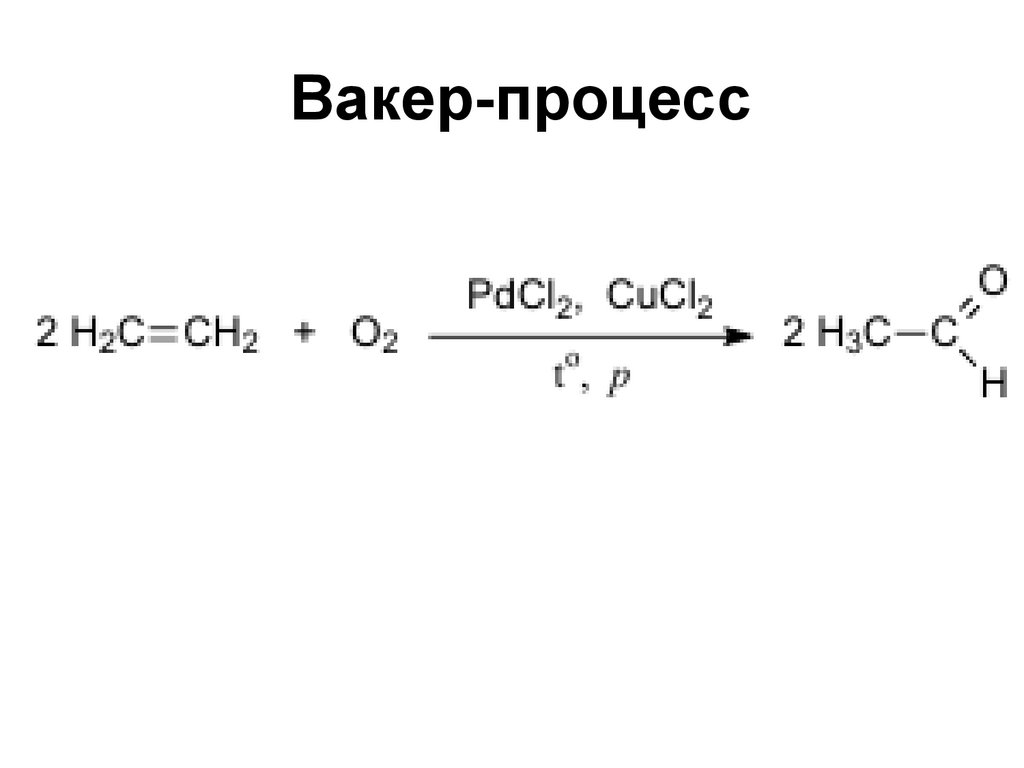
51. Вакер-процесс
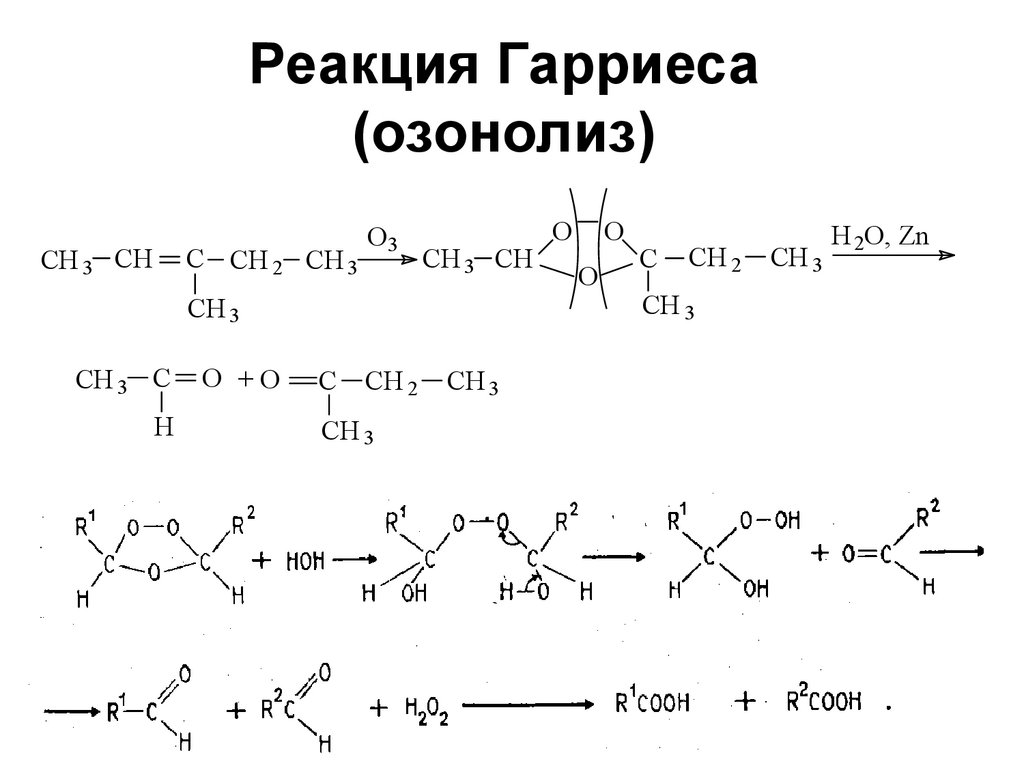
52. Реакция Гарриеса (озонолиз)
CH 3 CHC CH 2 CH 3
O3
CH 3 CH
CH 3
CH 3 C
H
O +O
C
CH 2
CH 3
CH 3
O
O
O
C
CH 2
CH 3
CH 3
H 2O, Zn
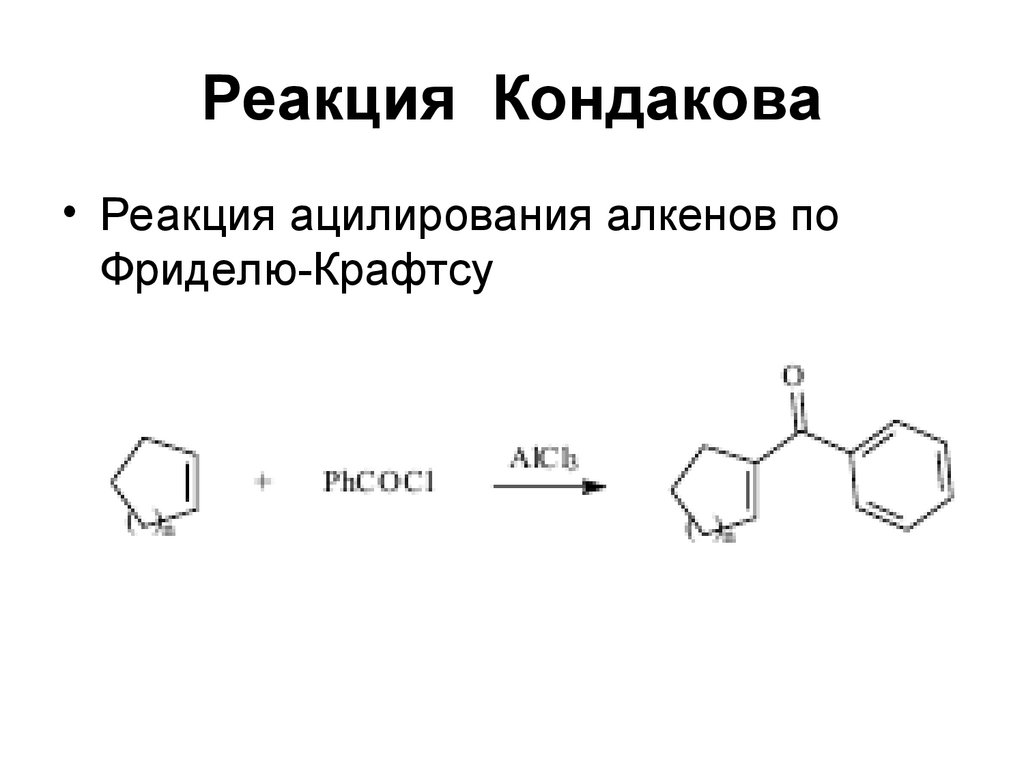
53. Реакция Кондакова
• Реакция ацилирования алкенов поФриделю-Крафтсу
54. Реакции полимеризации
Получение полиэтилена:n СН2=СН2 (-СН2-СН2-)n
Получение полипропилена:
n СН3-СН=СН2 (-СН-СН2-)n
\
СН3
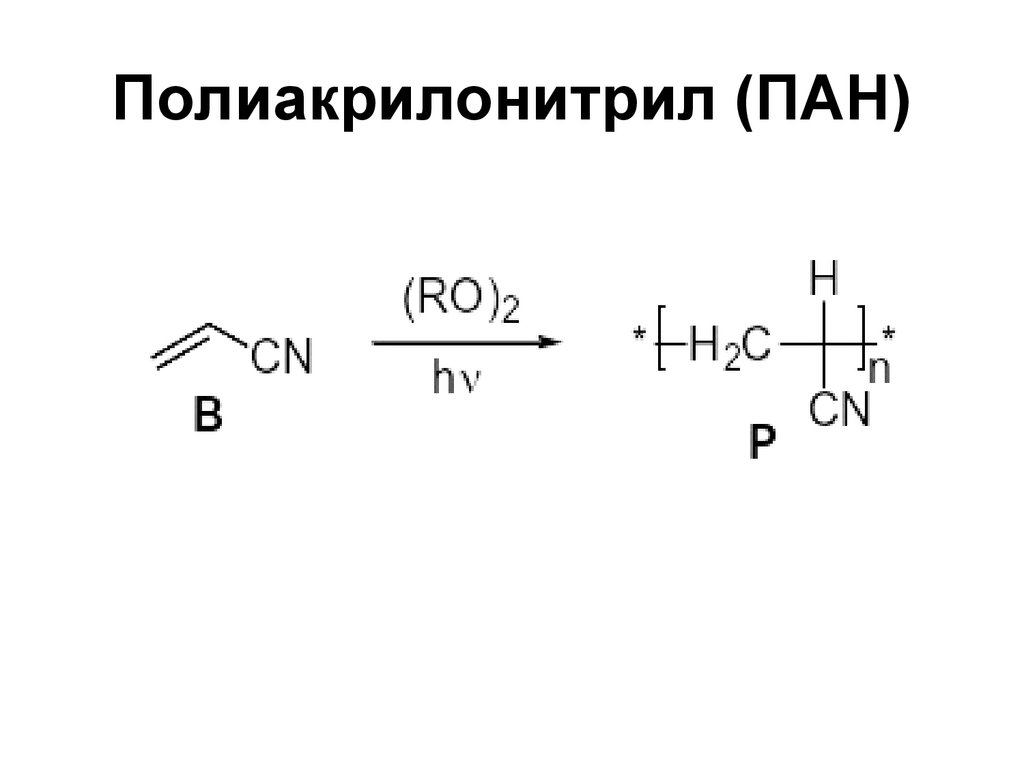
55. Полиакрилонитрил (ПАН)
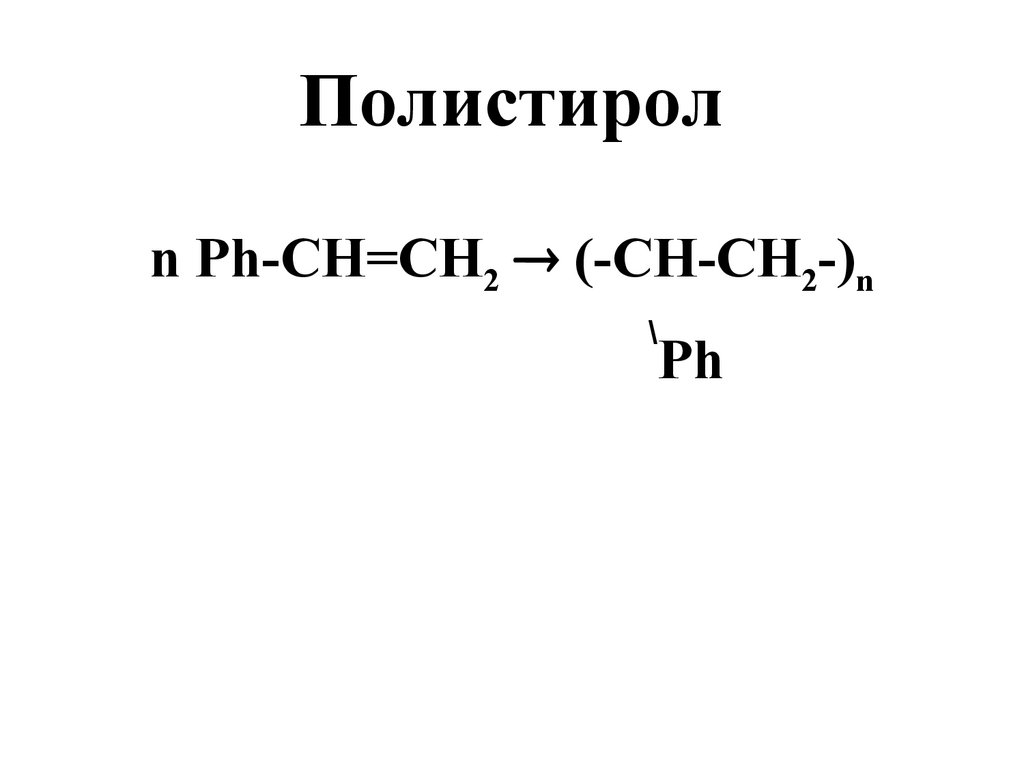
56. Полистирол
n Ph-СН=СН2 (-СН-СН2-)n\
Ph
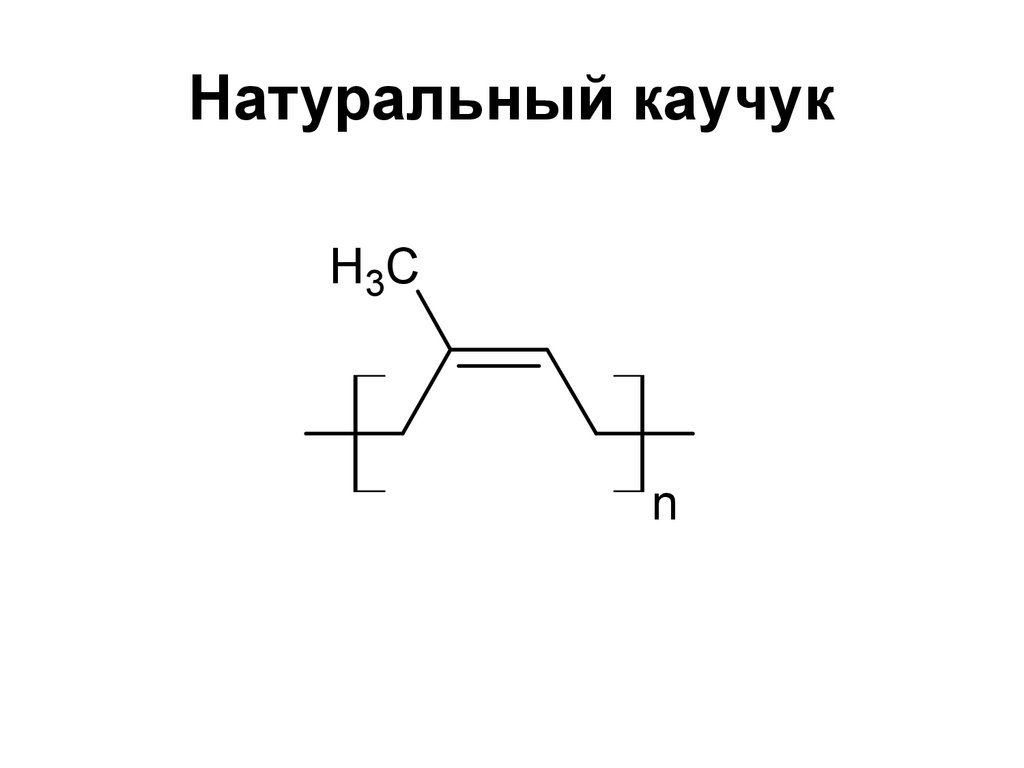
57. Натуральный каучук
H3Cn
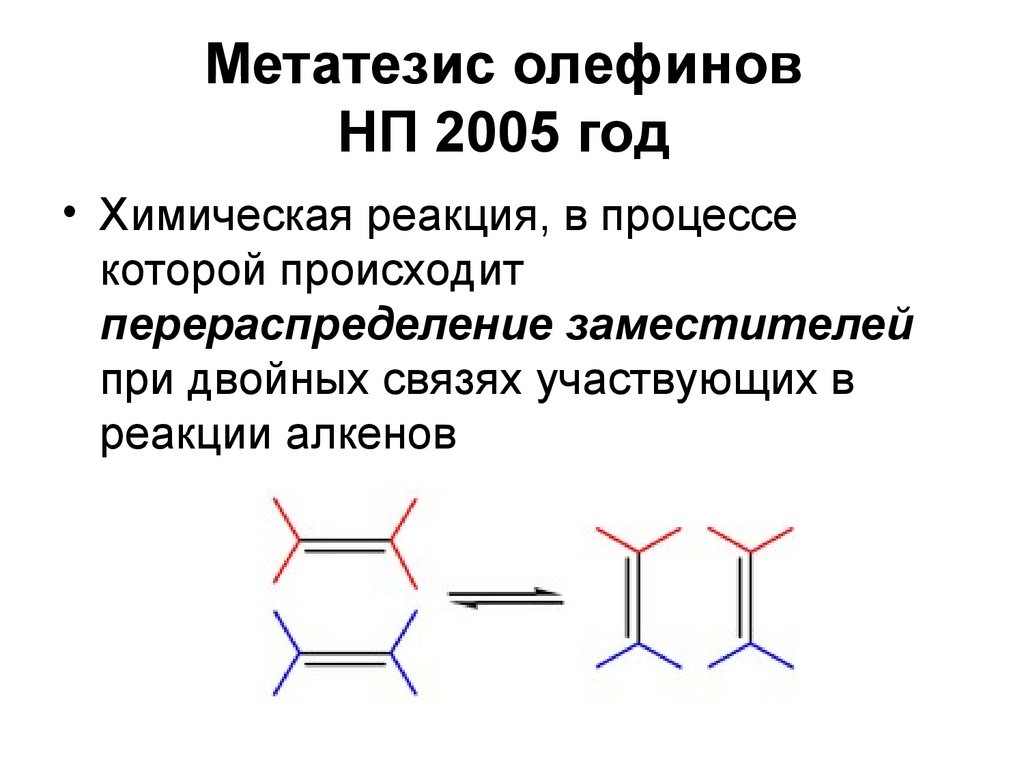
58. Метатезис олефинов НП 2005 год
Метатезис олефиновНП 2005 год
• Химическая реакция, в процессе
которой происходит
перераспределение заместителей
при двойных связях участвующих в
реакции алкенов
59. Метатезис алкенов
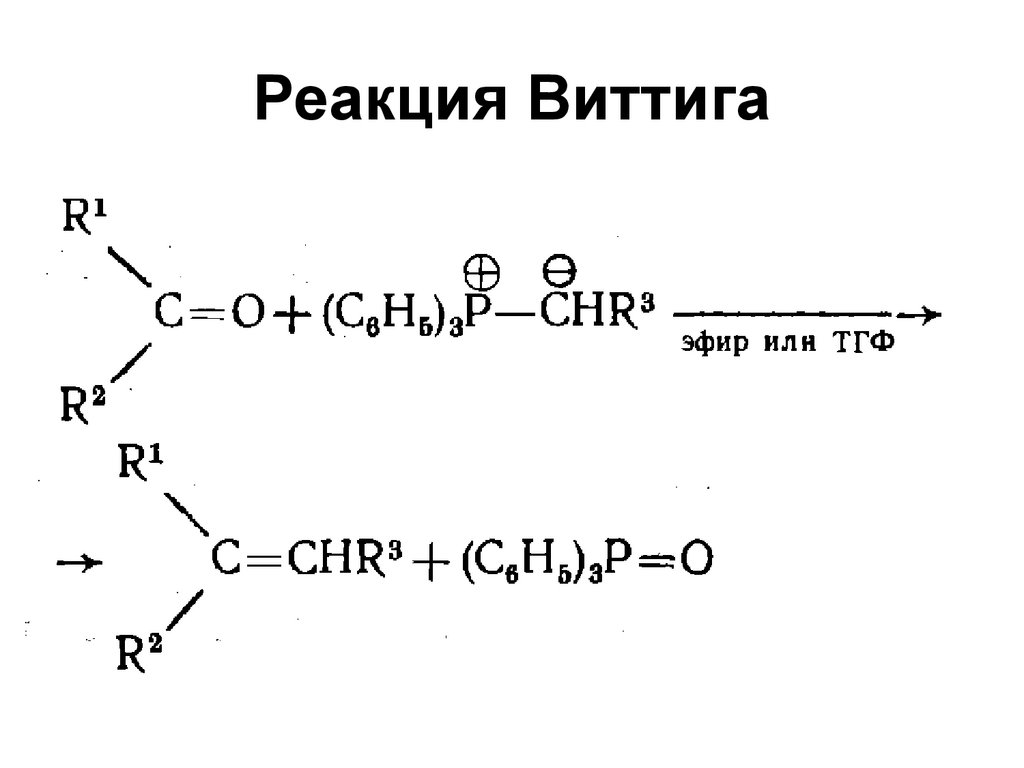
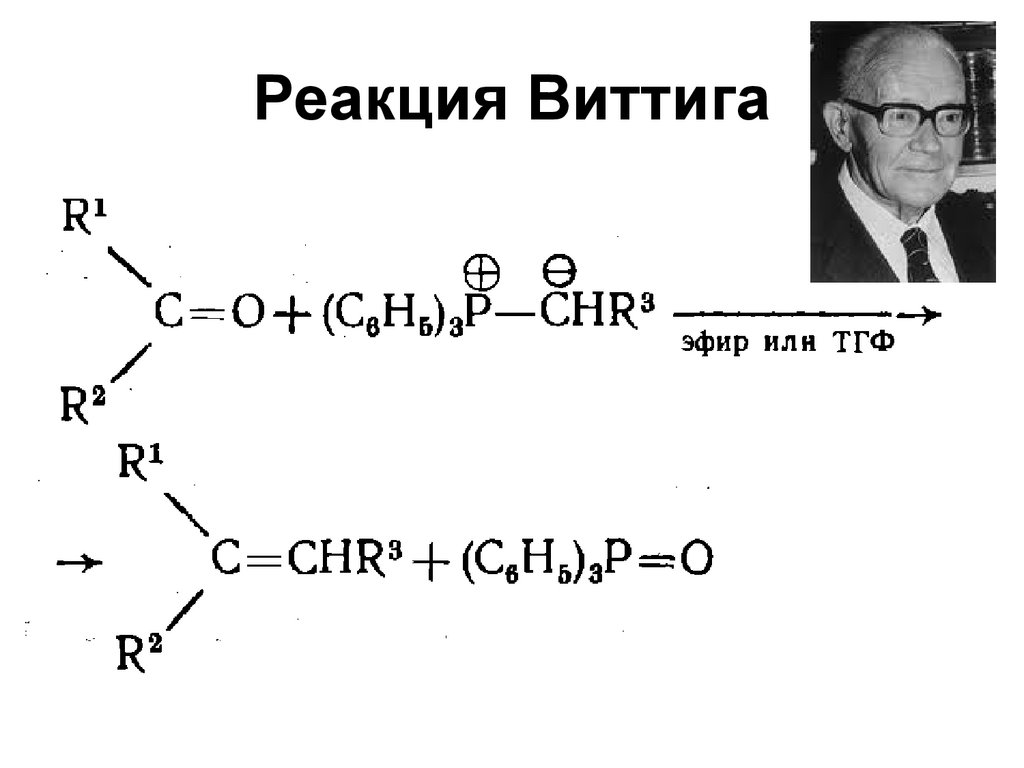
• Реакция дисмутации алкенов60. Реакция Виттига
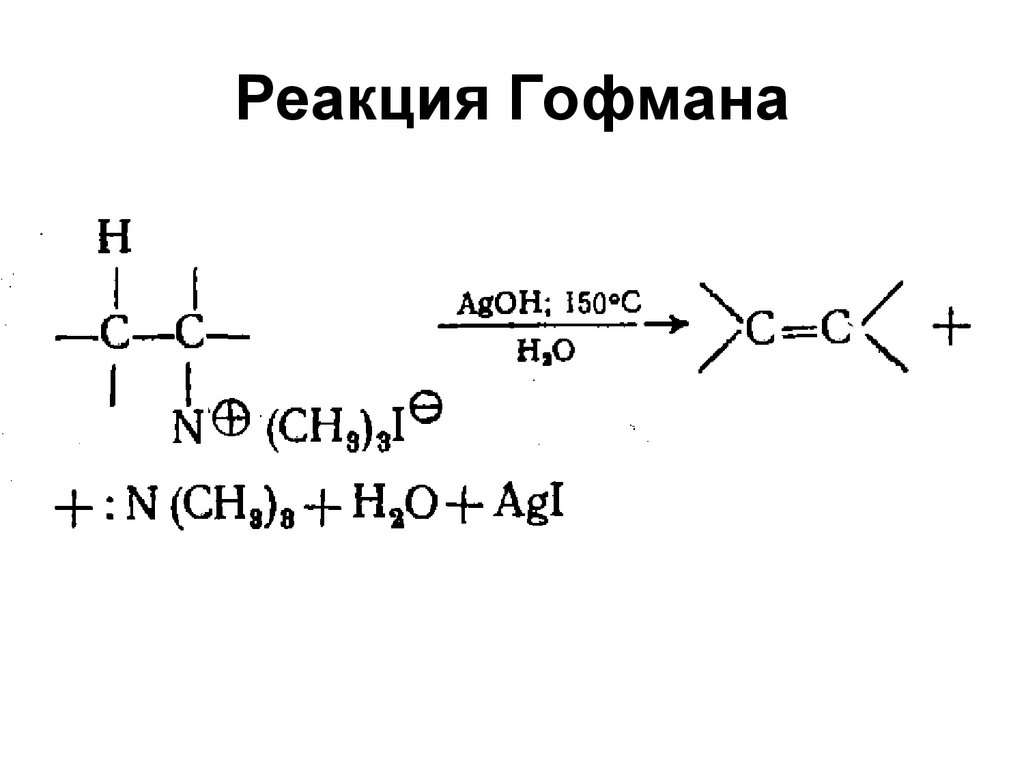
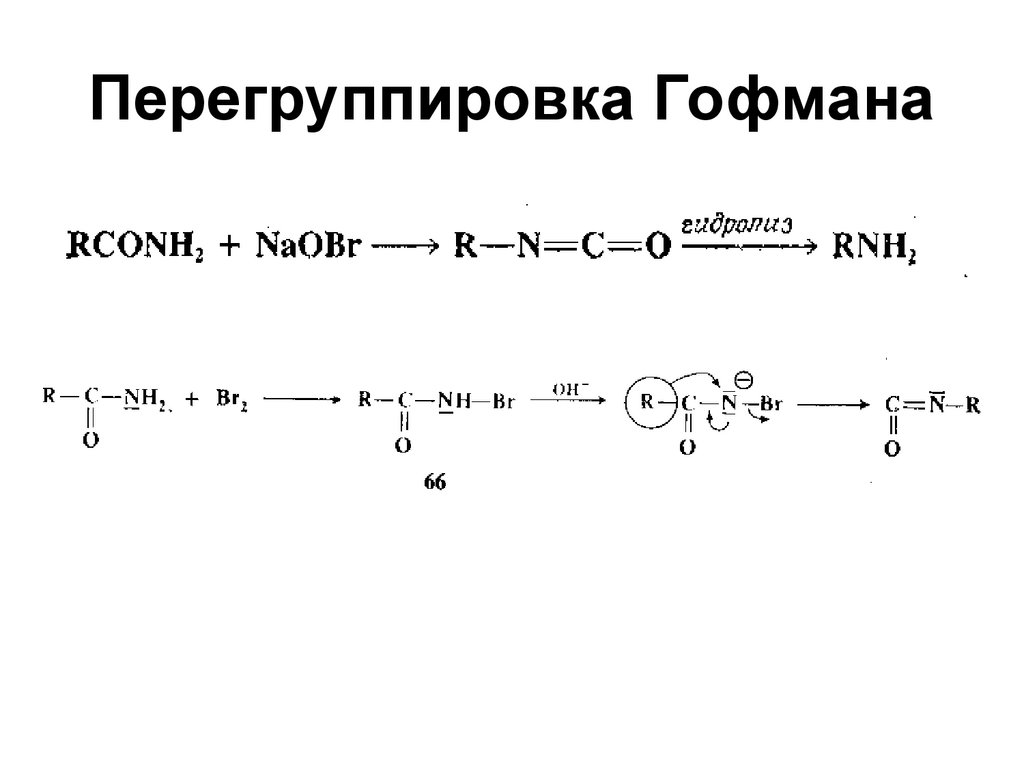
61. Реакция Гофмана
62. Элиминирование по Гофману
6263. Правило Зайцева
Отщепление галогенводородов отгалогензамещенных алкпнов или воды
от спиртов преимущественно происходит
так, что с галогеном или гидроксилом
(группа -ОН) уходит водород от
наименее гидрованного атома углерода
(1875 г.):
ЗАЙЦЕВ Александр
Михайлович.
(2.07.1841-1.09.1910 г )
СН3
КОН (спирт. р)
СН3 С СН СН3
Н Сl
СН3
CН3 С=СН СН3 + КСl + НОН
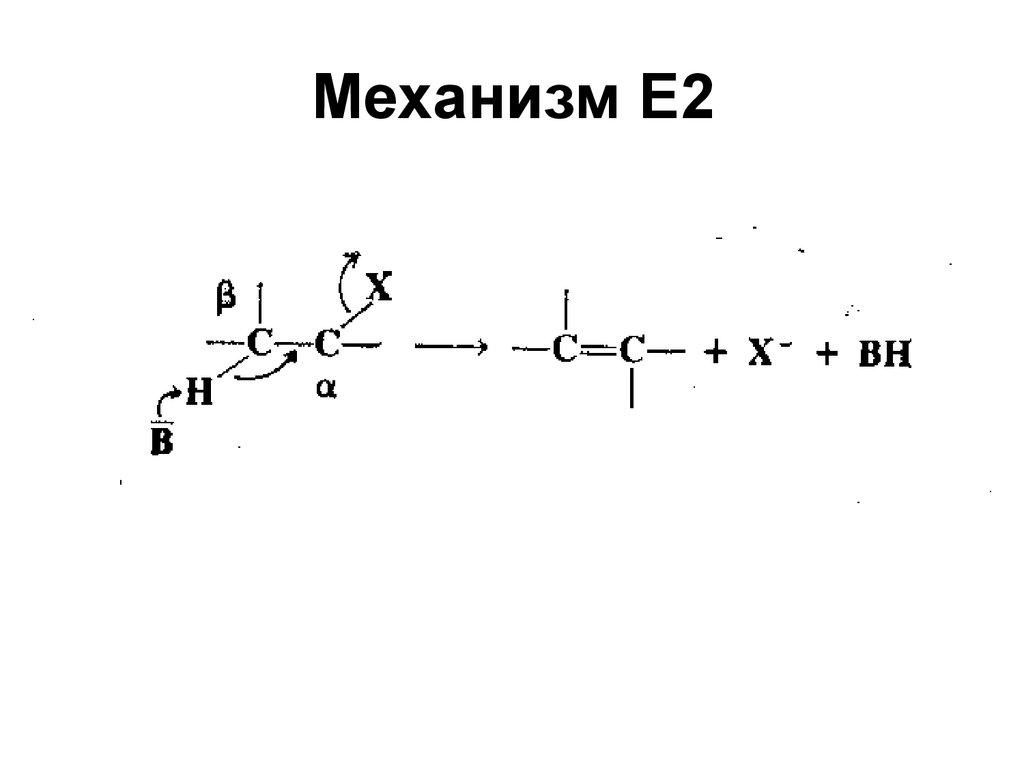
64. Механизм Е2
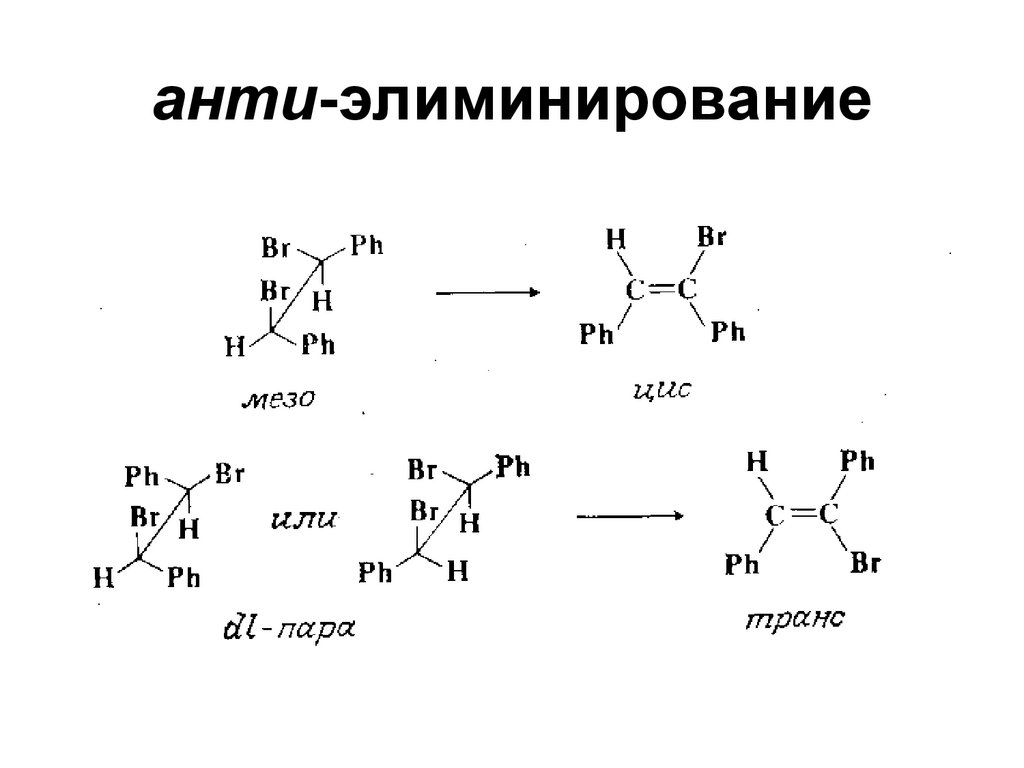
65. анти-элиминирование
66. Реакция Савича
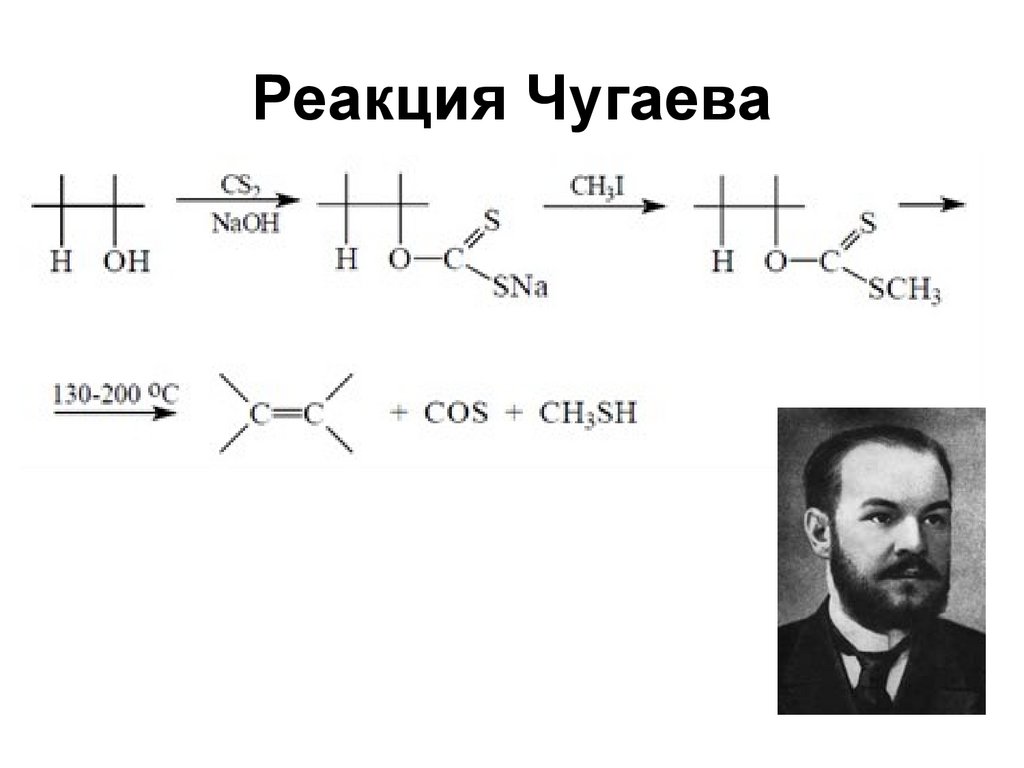
67. Реакция Чугаева
6768. Способы получения дивинила
• Метод С.В.Лебедева, 1932 г.Ярославль СК-1
2 С2Н5ОН С4Н6 + 2 Н2О + Н2
(выход 70% от теоретического)
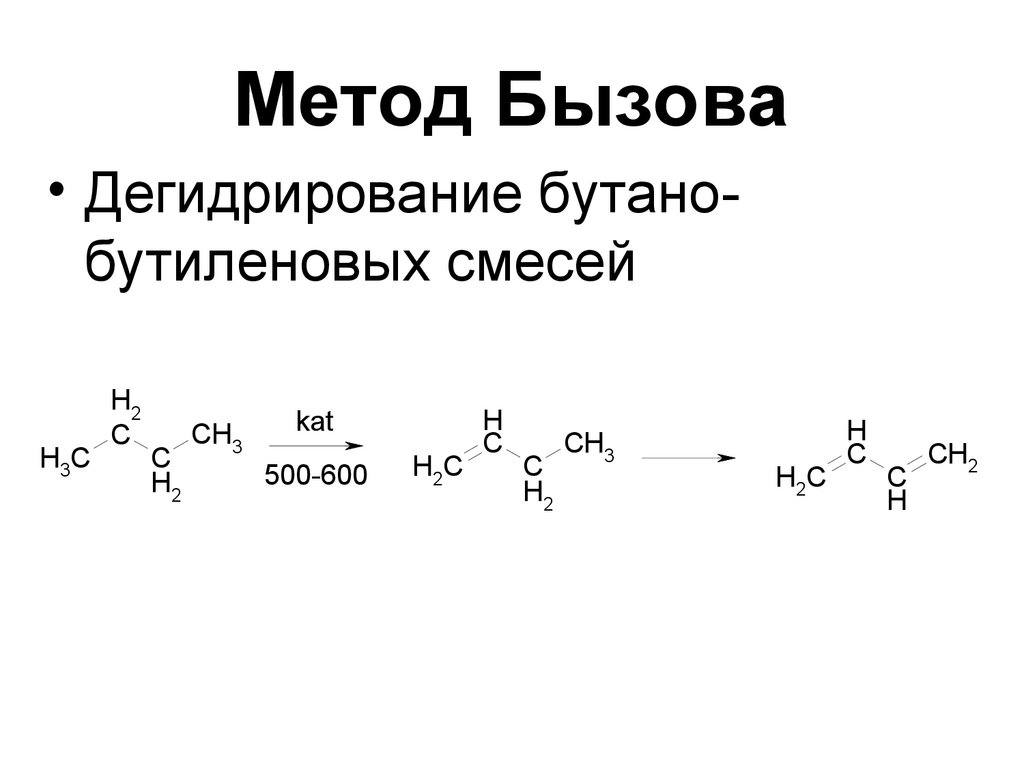
69. Метод Бызова
• Дегидрирование бутанобутиленовых смесейH3C
H2
C
C
H2
CH3
kat
500-600
H2C
H
C
C
H2
CH3
H2C
H
C
C
H
CH2
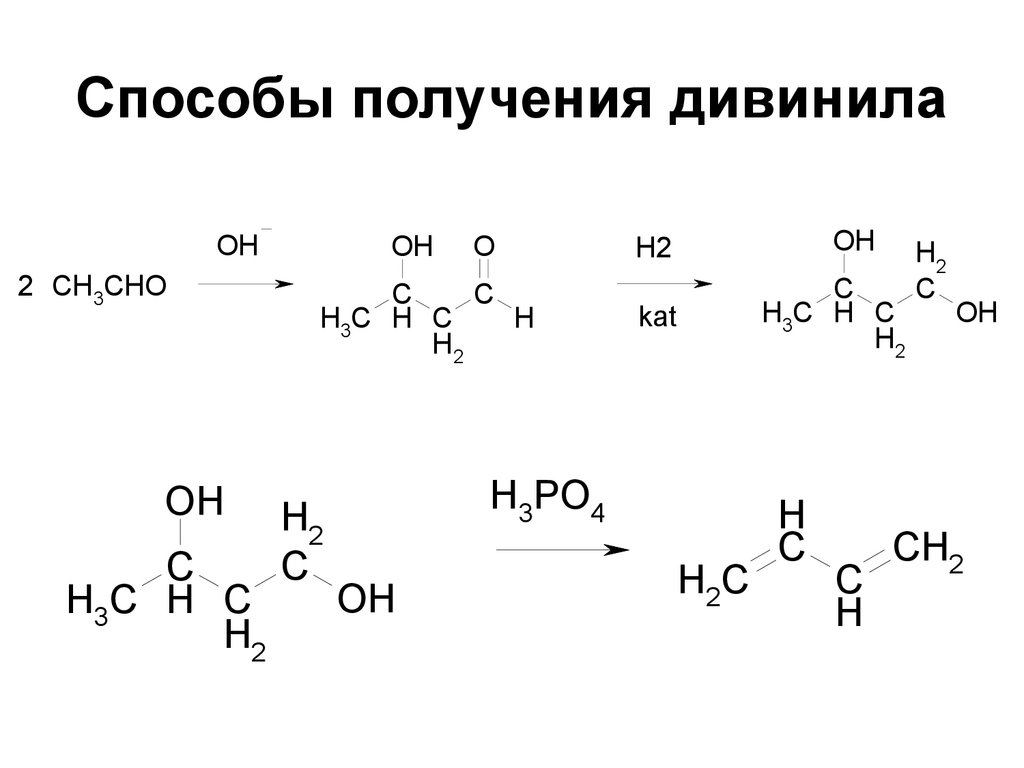
70. Способы получения дивинила
OH2 CH3CHO
OH
C
H3C H C
H2
OH
O
C
C
H
H3C H C
H2
H2
C
OH
H2
C
H3C H C
H2
kat
H3PO4
OH
H2C
H
C
C
H
H2
C
OH
CH2
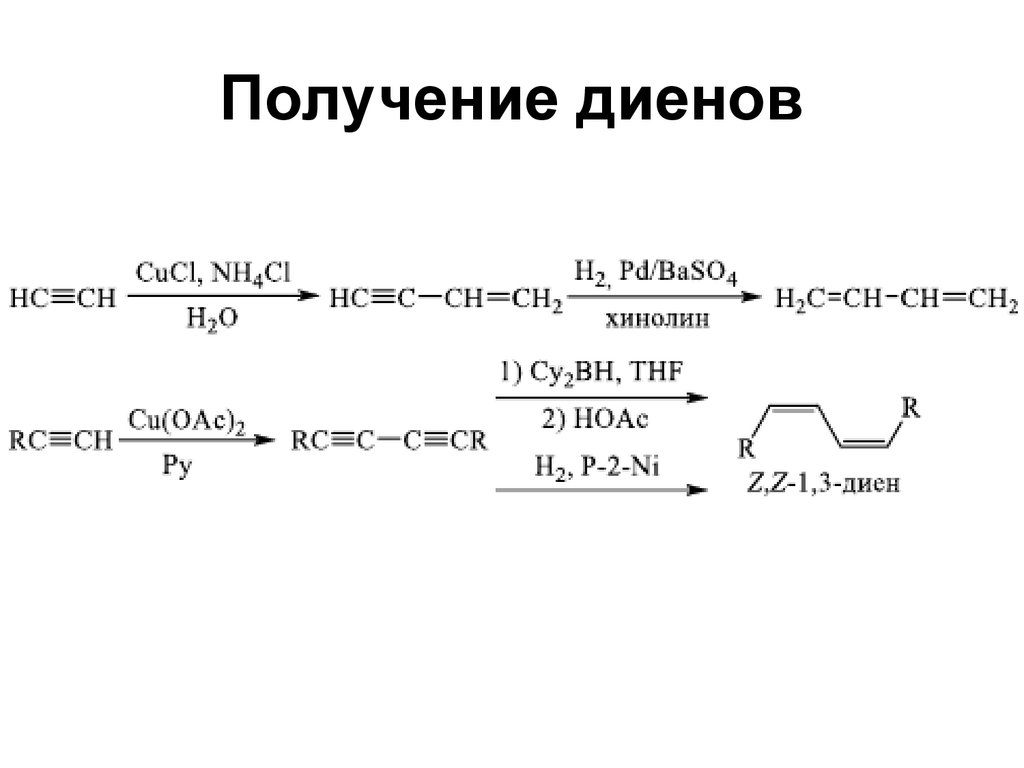
71. Получение диенов
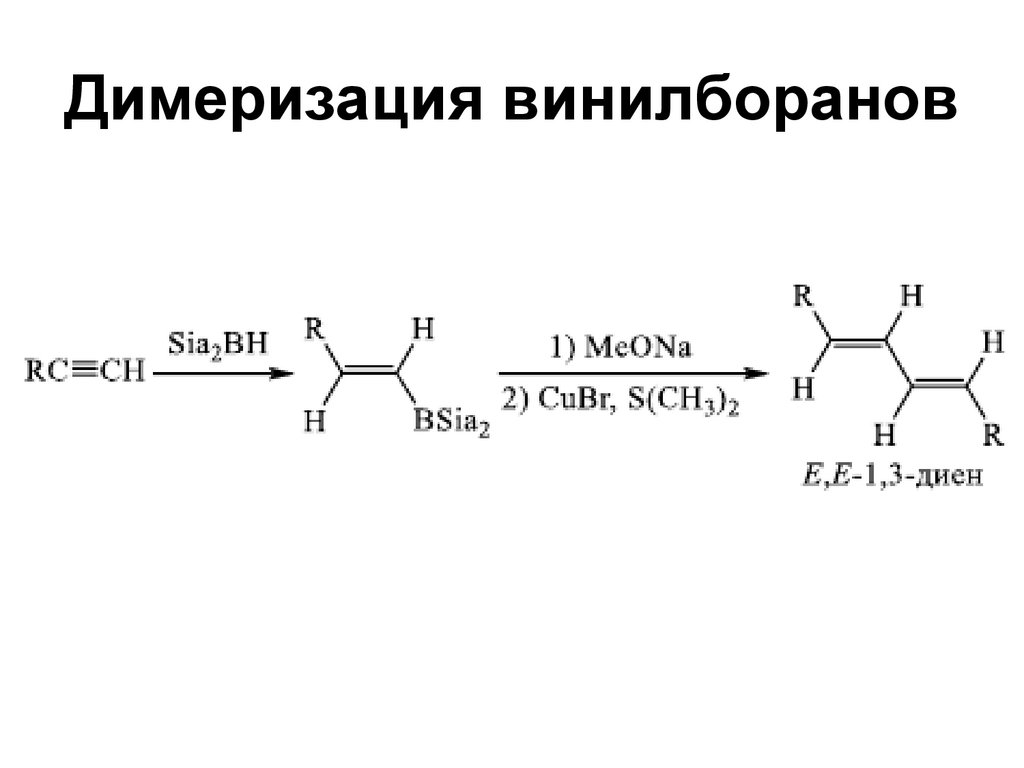
72. Димеризация винилборанов
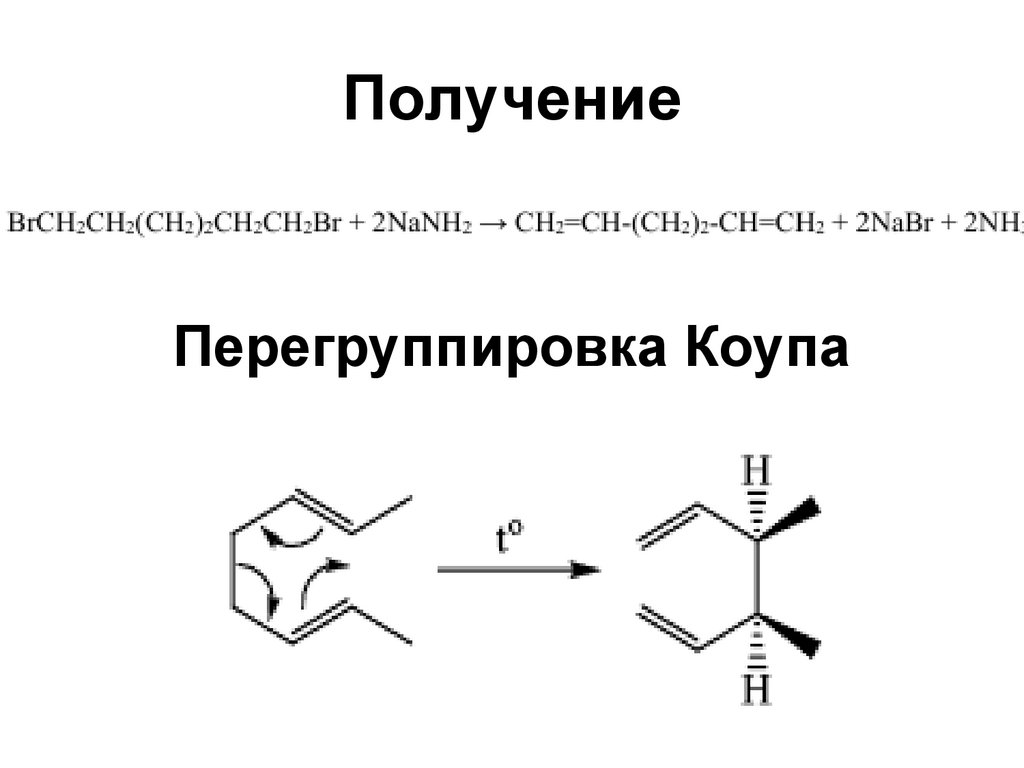
73. Получение
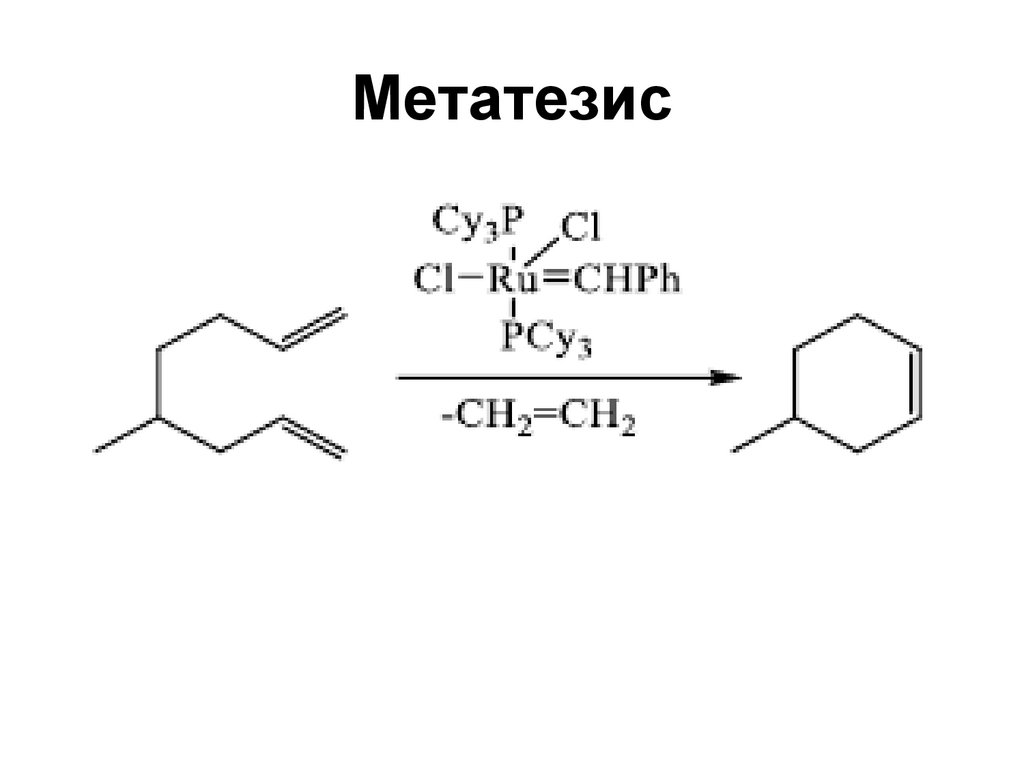
Перегруппировка Коупа74. Метатезис
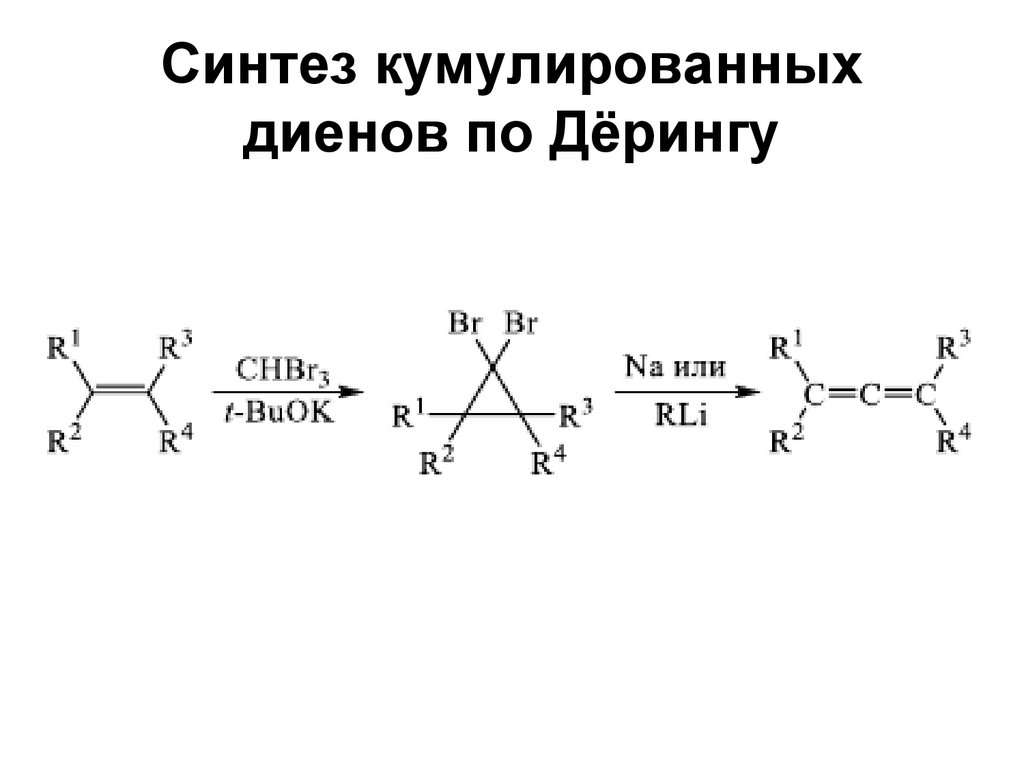
75. Синтез кумулированных диенов по Дёрингу
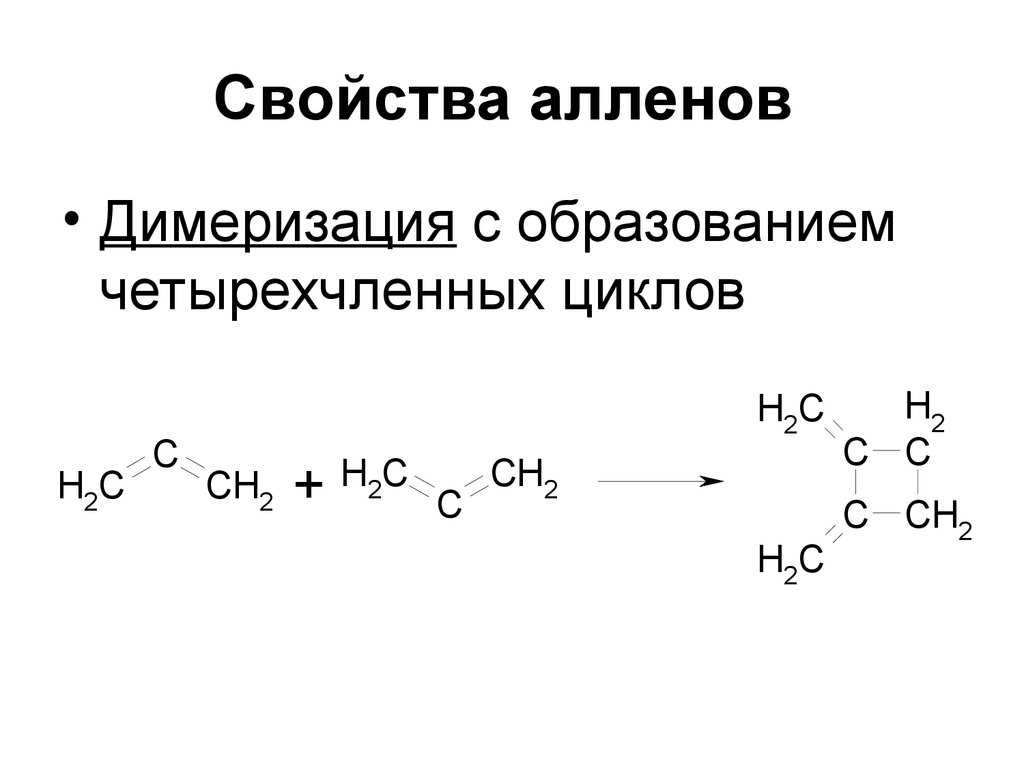
76. Свойства алленов
• Димеризация с образованиемчетырехчленных циклов
H2C
C
H2C
CH2 + H2C
C
CH2
H2C
H2
C C
C CH2
77. Электрофильное присоединение к диенам
CH 2=CHCH=CH 2 + HBr
CH 2 CH
H
Br
CH=CH 2 + CH 2 CH=CH
H
3-Бром-1-бутен
1,2-присоединение
СH 3
CH
CH=CH 2 H 1,2)
1-Бром-2-бутен
1,4-присоединение
-80 o C
40 o C
80 %
20 %
20 %
80 %
Br
Образуется быстрее
кинетически контролируемый
СH 3
CH = CH
CH 2 H 1,4)
Br
Более устойчивый,
термодинамически контролируемый
CH 2
Br
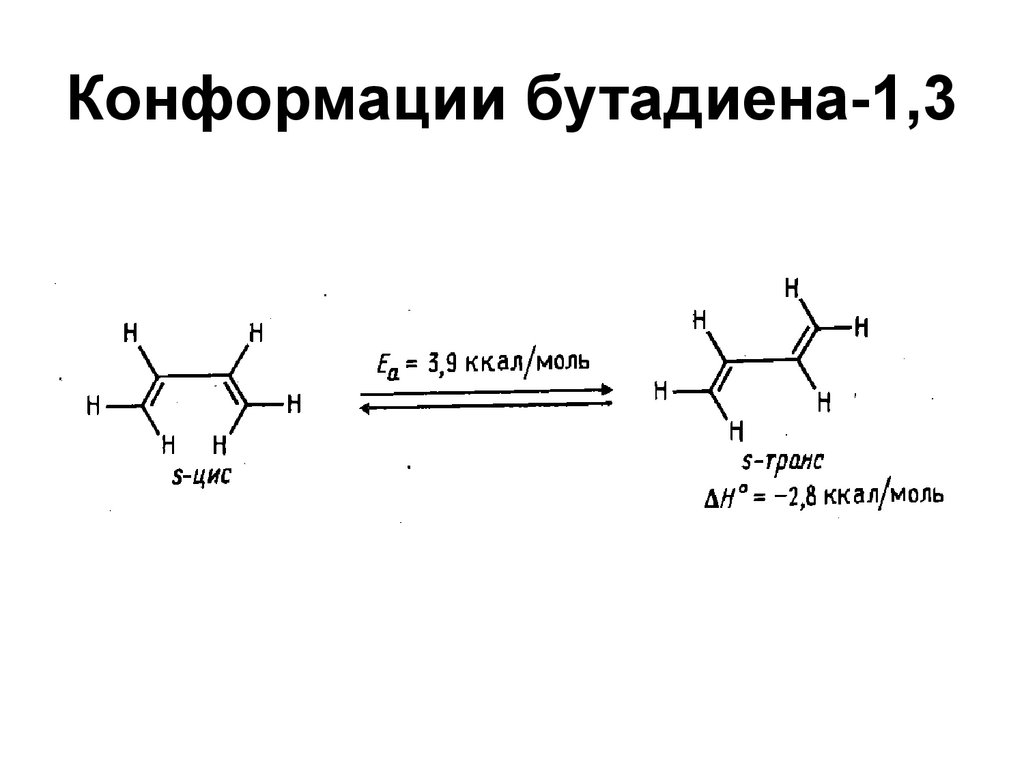
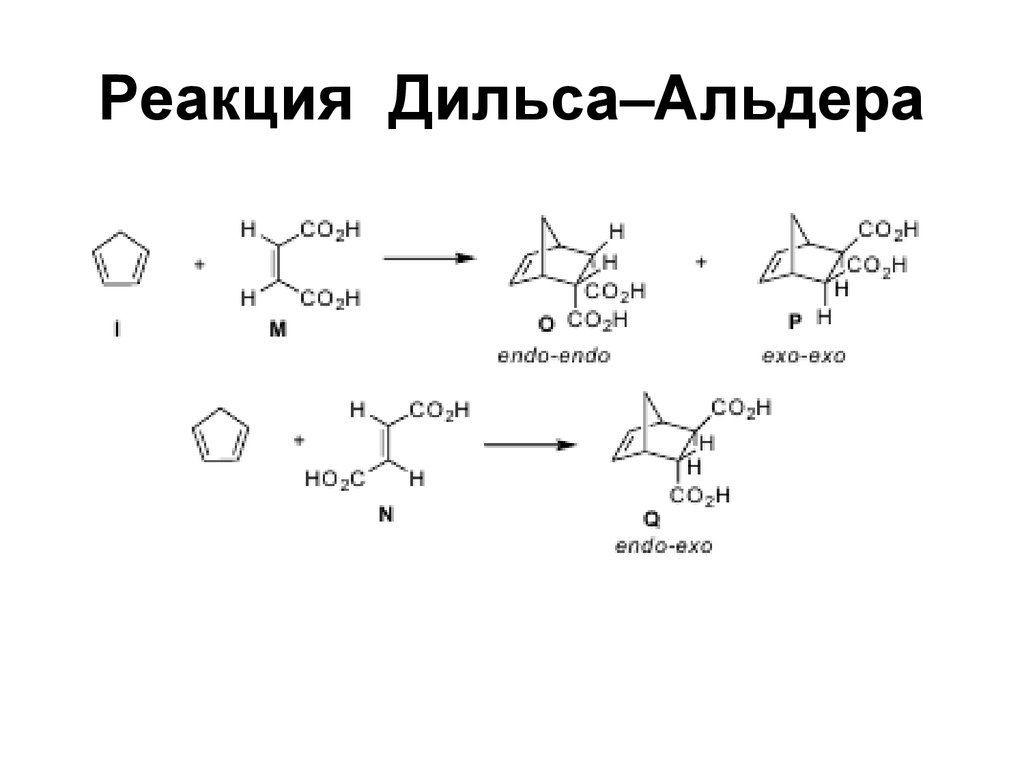
78. Конформации бутадиена-1,3
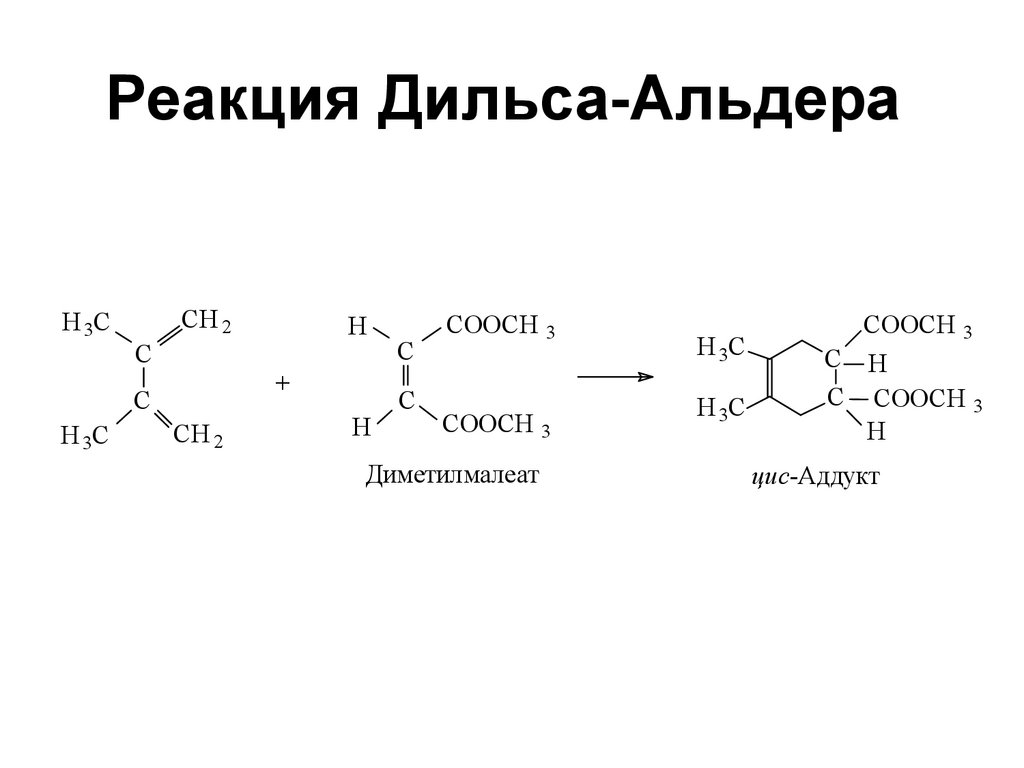
79. Реакция Дильса — Альдера
Реакция Дильса — Альдера79
80. Реакция Дильса-Альдера
Н 3СС
С
Н 3С
СН 2
Н
+
СН 2
Н
С
С
СООСН 3
СООСН 3
Диметилмалеат
Н 3С
Н 3С
СООСН 3
С Н
С СООСН 3
Н
цис-Аддукт
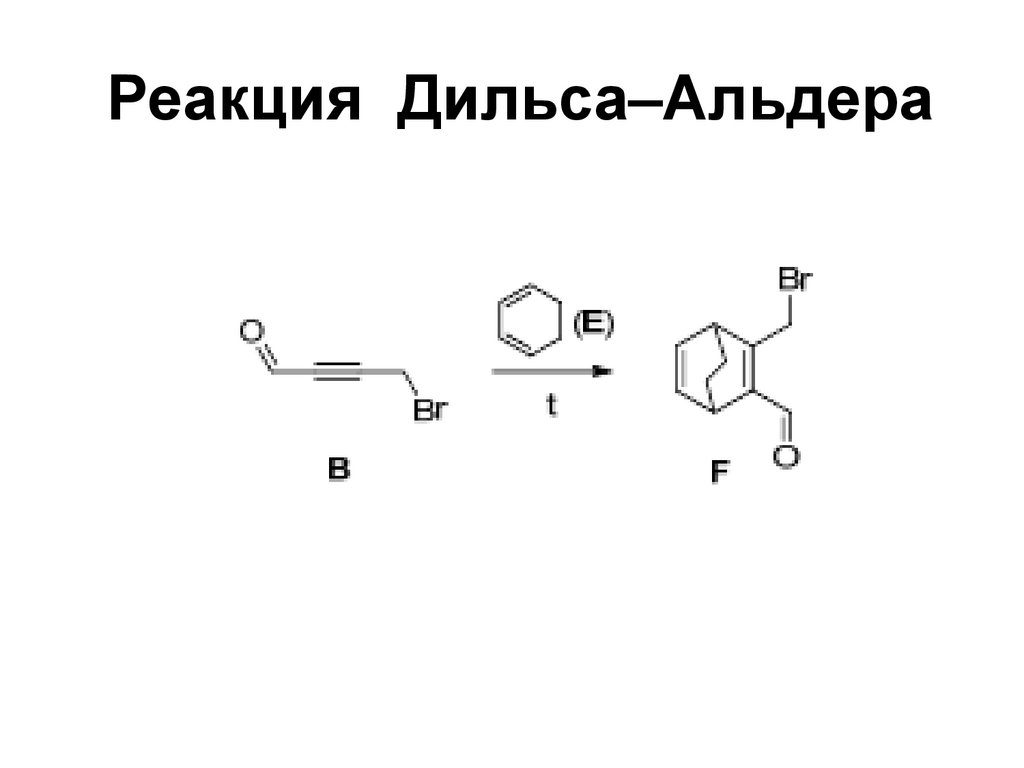
81. Реакция Дильса–Альдера
82. Реакция Дильса–Альдера
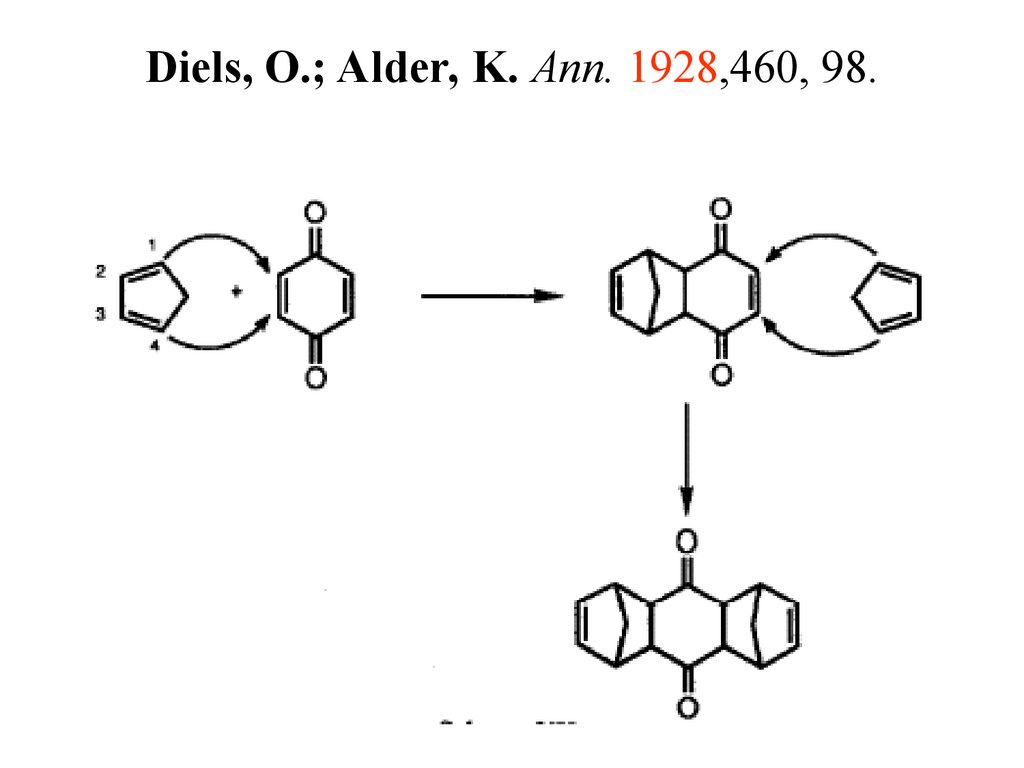
83. Diels, O.; Alder, K. Ann. 1928,460, 98.
84. Синтез Велера
Синтез ацетиленавзаимодействием карбида
кальция с водой (1862)
CaC2 + 2HOH
HC CH + Ca(OH)2
ВЕЛЕР Фридрих
(31. 07. 1800-23. 09. 1882)
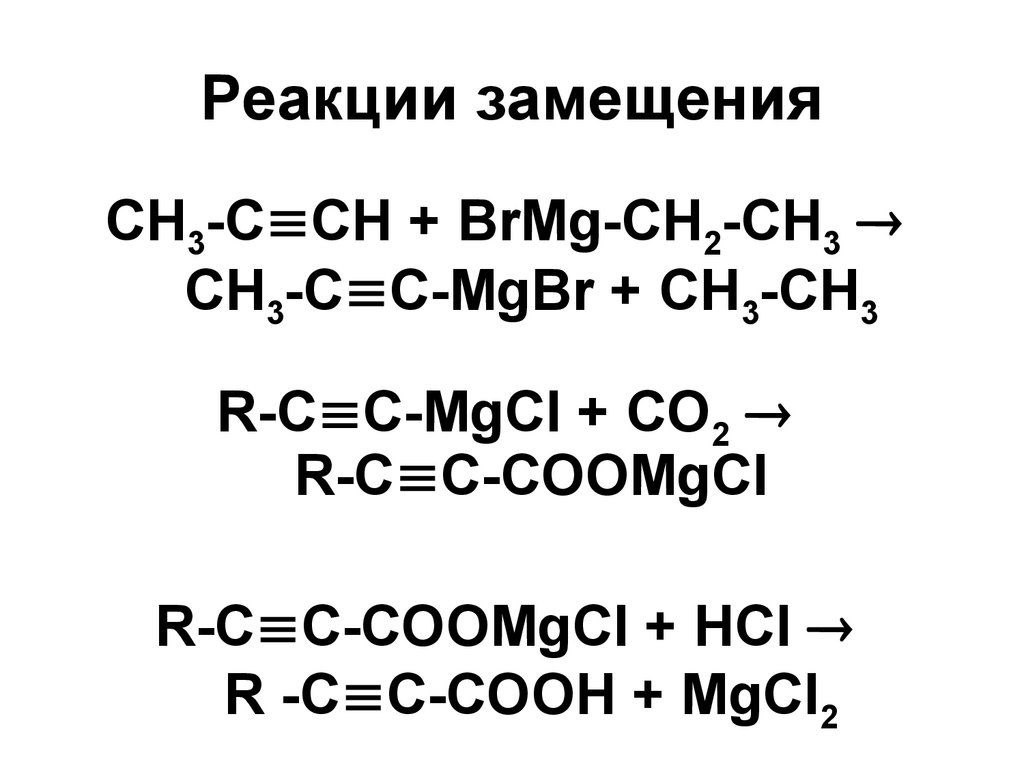
85. Реакции замещения
НС СН + 2 [Аg(NН3)2]ОНAgС СAg + 2 Н2О + 4 NН3
диацетиленид серебра (белого цвета)
НС СН + 2 [Сu(NН3)2]ОН
СuС ССu + 2 Н2О + 4 NН3
(бурого цвета)
• Устойчивы во влажном состоянии, а
в сухом виде взрываются от трения,
удара, искры и т.д.
86. Реакции замещения
СН3-С СН + ВrМg-СН2-СН3СН3-С С-МgВr + СН3-СН3
R-С С-MgCl + СО2
R-С С-СООМgCl
R-С С-СООМgCl + НСl
R -С С-СООН + MgCl2
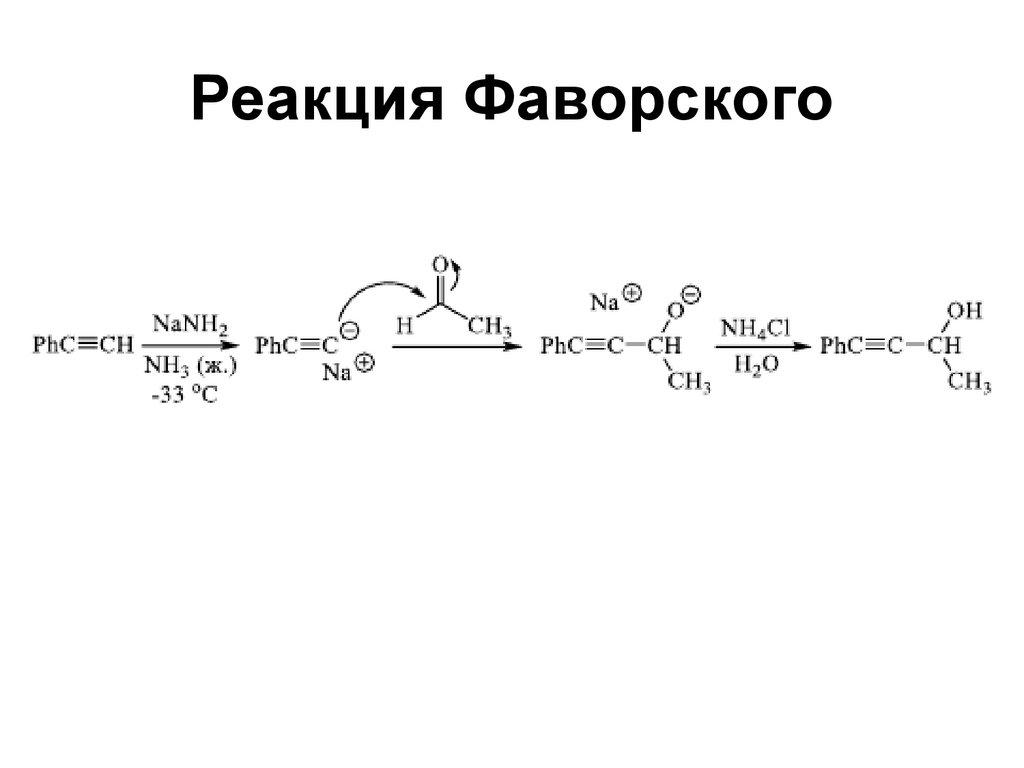
87. Реакция Фаворского
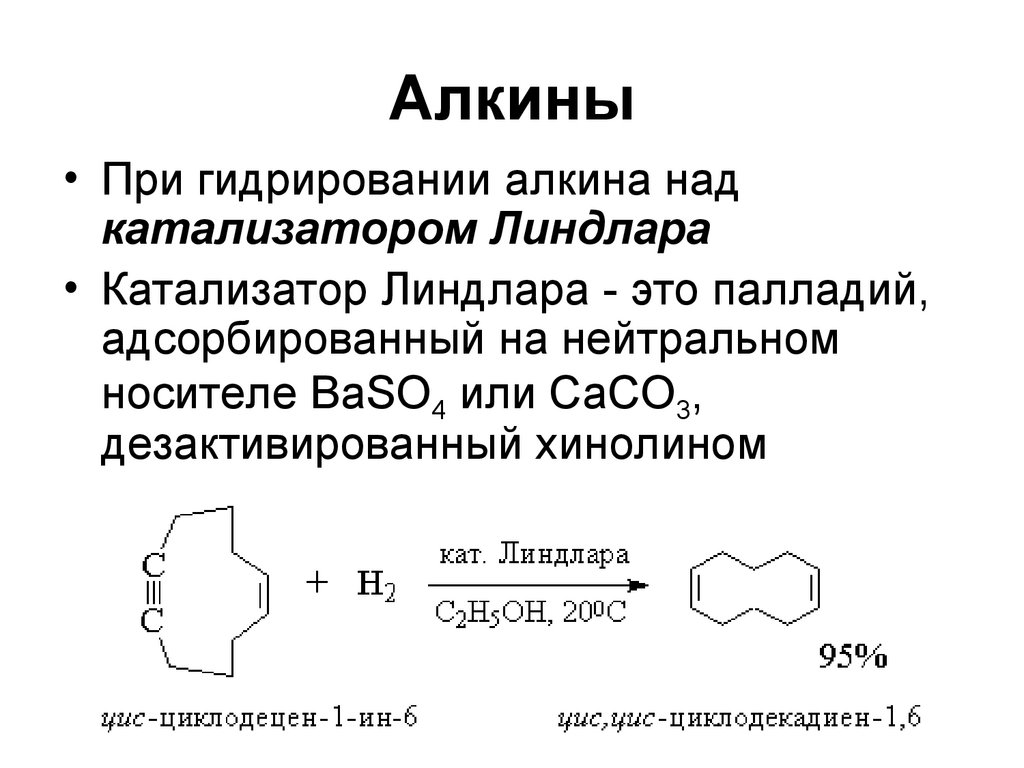
88. Алкины
• При гидрировании алкина надкатализатором Линдлара
• Катализатор Линдлара - это палладий,
адсорбированный на нейтральном
носителе BaSO4 или CaCO3,
дезактивированный хинолином
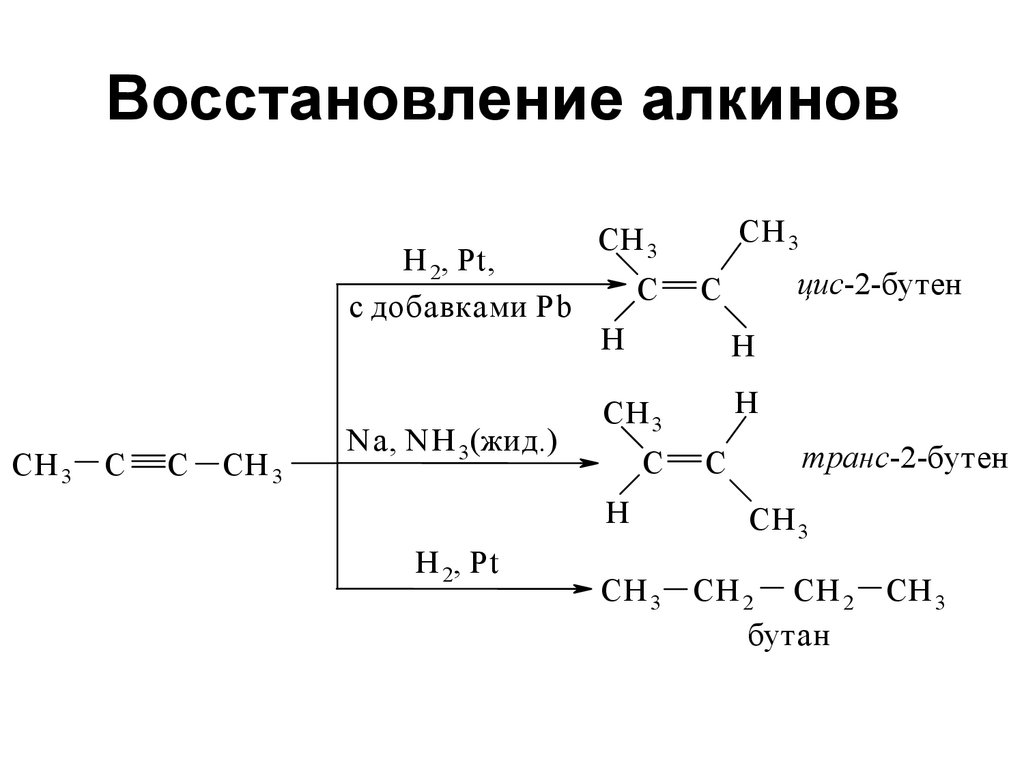
89. Восстановление алкинов
Н 2, Рt,с добавками Pb
CH 3
C
C
CH 3
Na, N H 3(жид.)
Н 2, Pt
СН 3
СН 3
С
цис-2-бутен
С
Н
Н
СН 3
Н
С
С
транс-2-бутен
Н
СН 3
CH 3
CН 2 CН 2
бутан
CH 3
90. Реакция Кучерова
H 3CC
CH + H 2O
H 2SO 4, H gSO 4
H 3C
C
CH 2
Более сильная
кислота
— C=C — O
+H
— C — C=O
H
— C — C=O
C
CH 3
O
OH
— C=C — OH
H 3C
Кетон более
слабая кислота
Кетоенольная
таутомерия
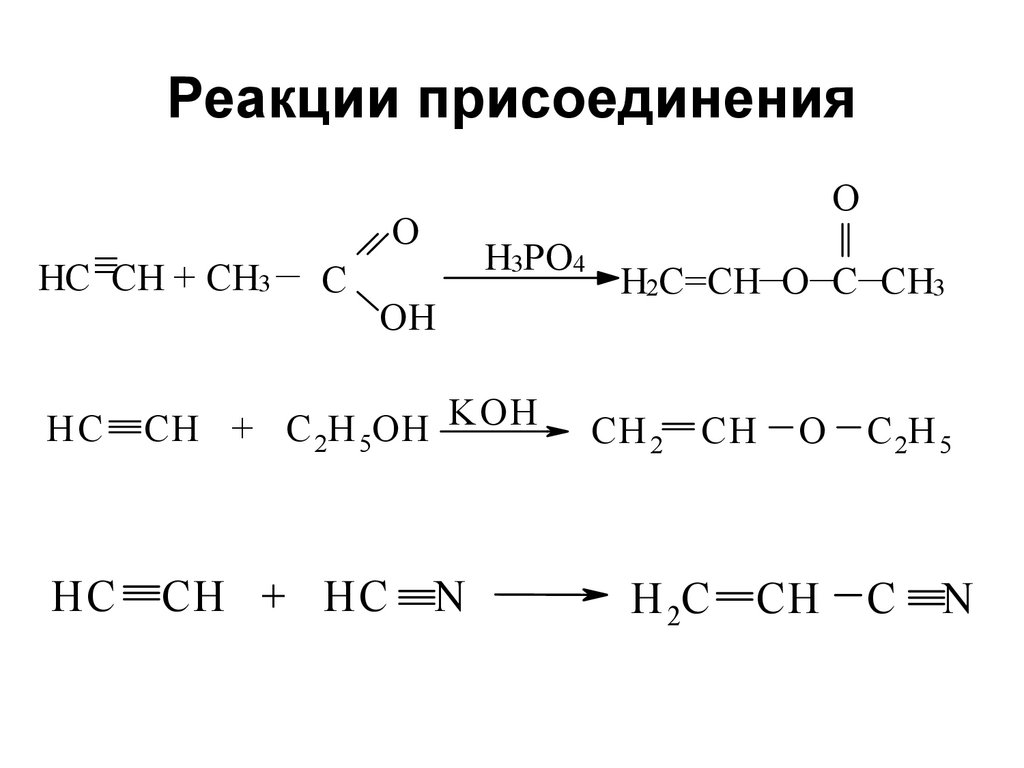
91. Реакции присоединения
HC CH + CH3 — CO
O
H3PO4
OH
HC
CH + C 2H 5OH KOH
HC
CH + HC
N
H2C=CH—O—C—CH3
CH 2
CH
H 2C
O
CH
C 2H 5
C
N
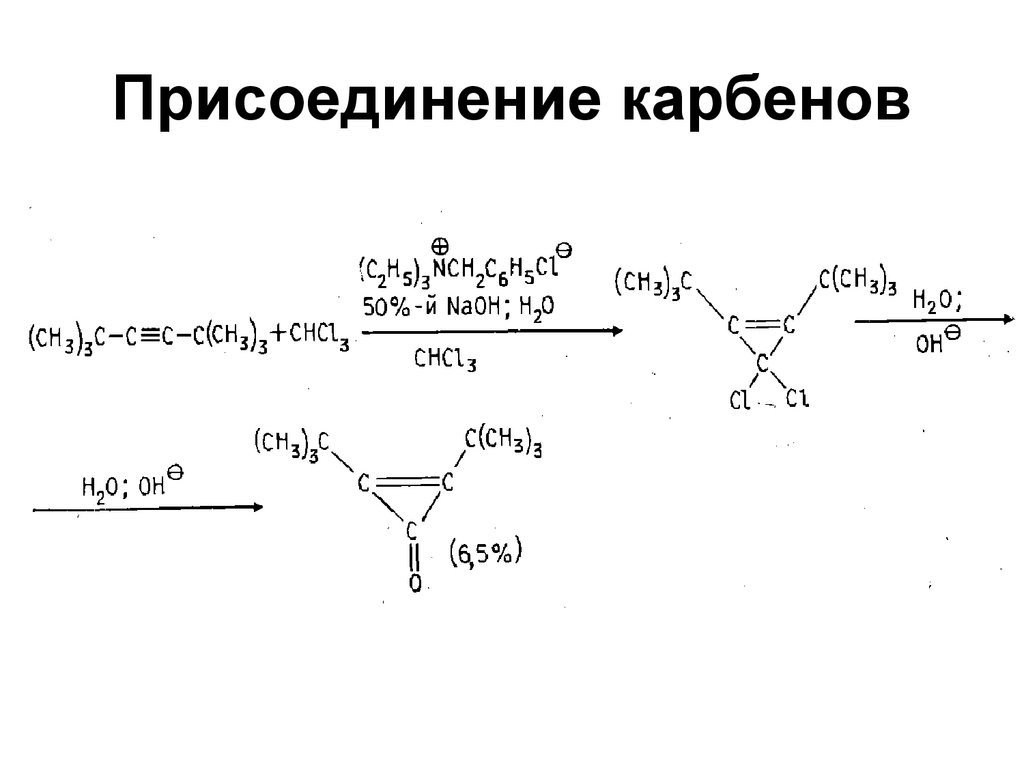
92. Присоединение карбенов
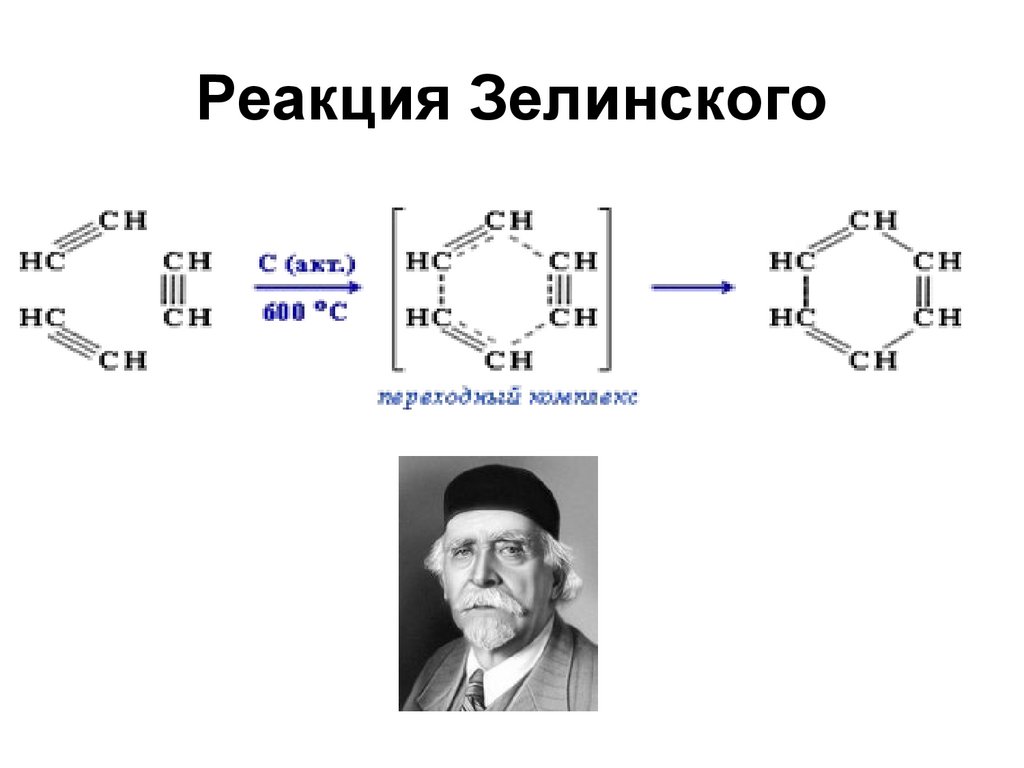
93. Реакция Зелинского
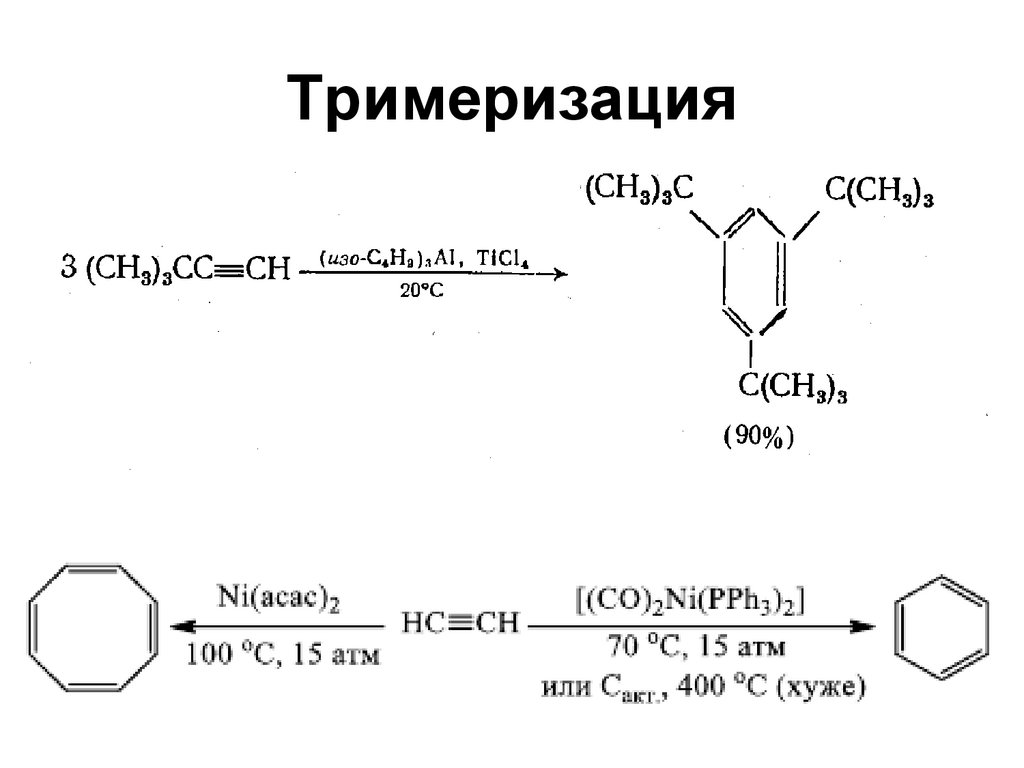
9394. Тримеризация
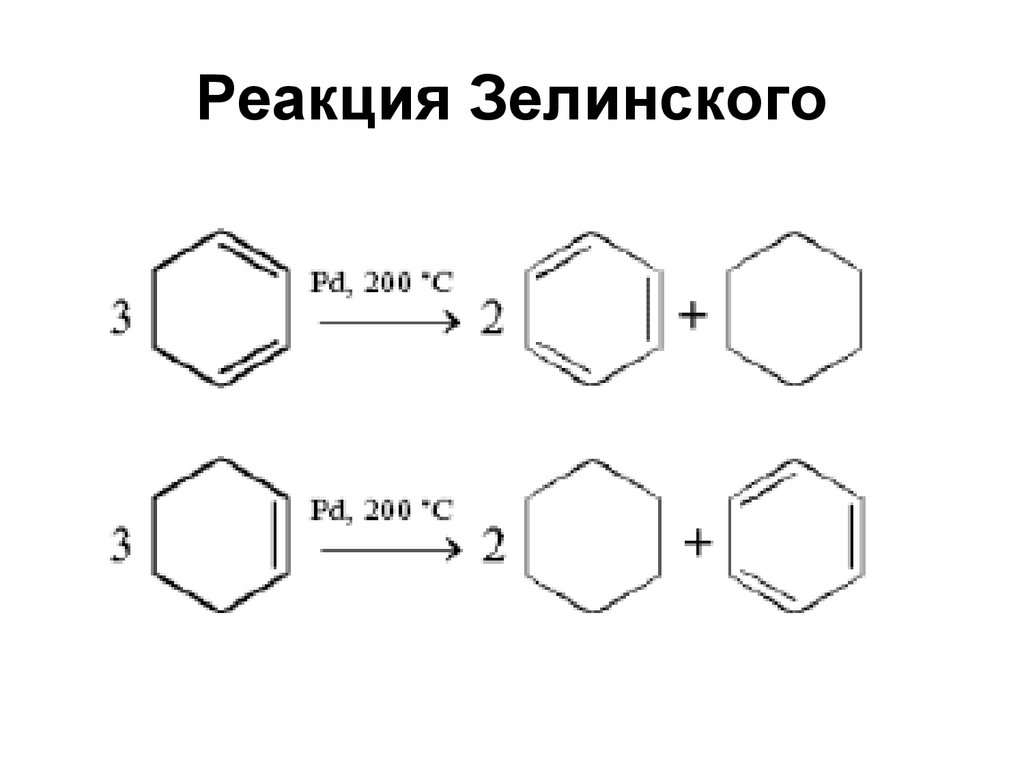
95. Реакция Зелинского
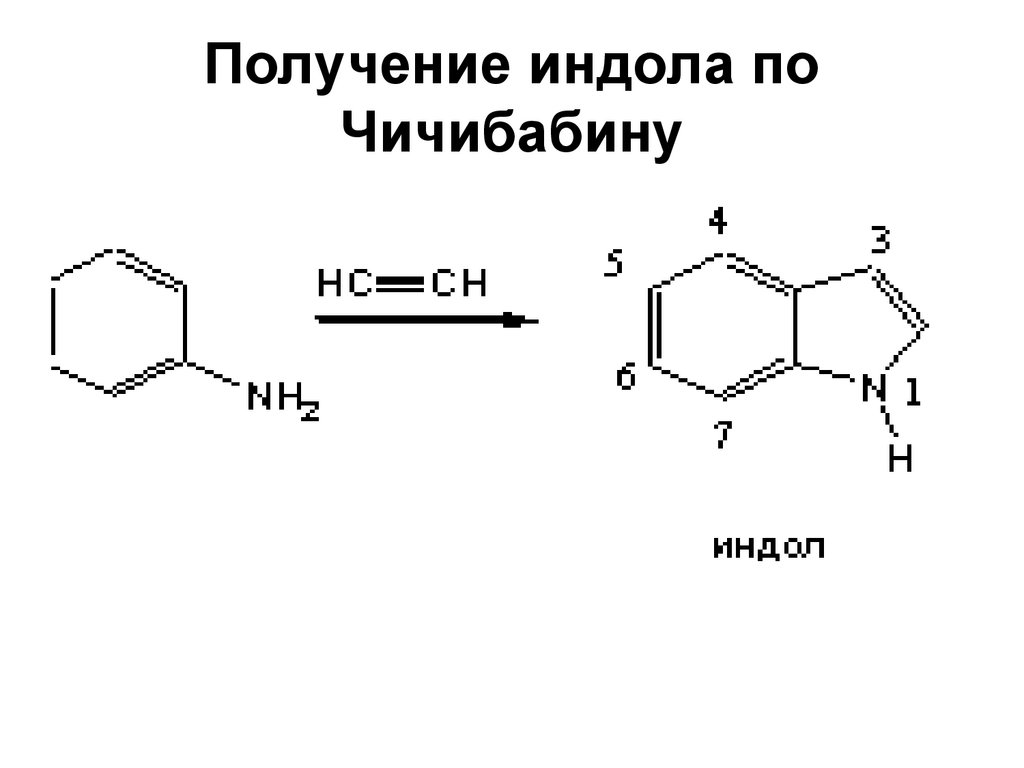
96. Получение индола по Чичибабину
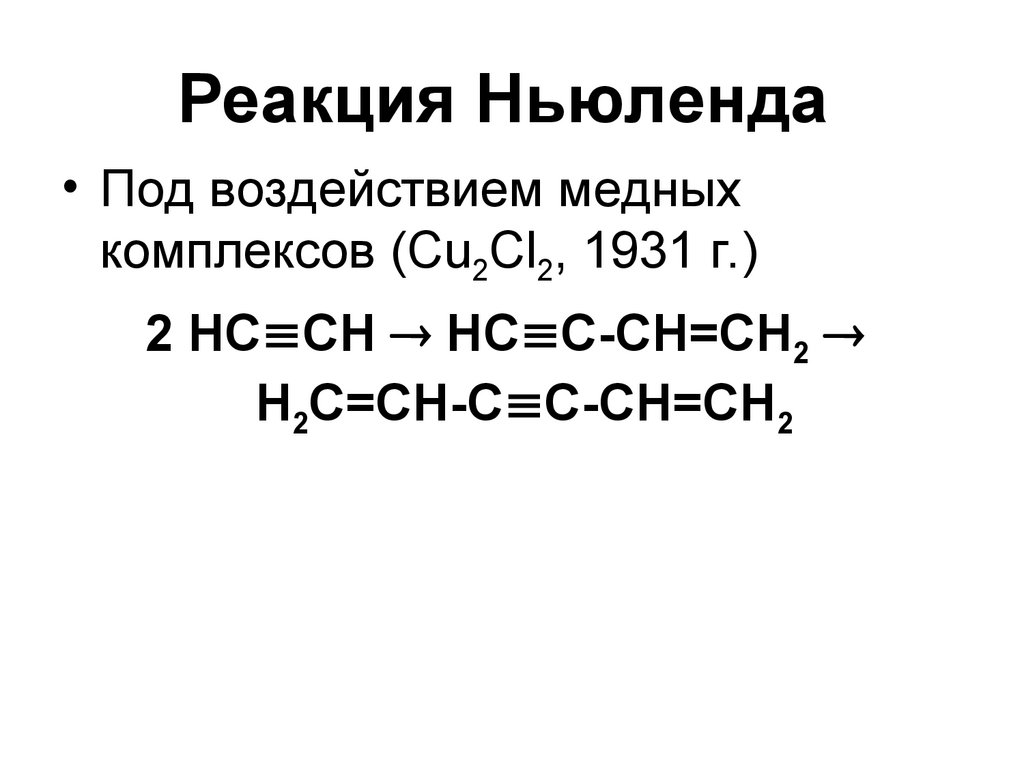
97. Реакция Ньюленда
• Под воздействием медныхкомплексов (Сu2Сl2, 1931 г.)
2 НС СН НС С-СН=СН2
Н2С=СН-С С-СН=СН2
98. Реакция Глазера
• В присутствии солей одновалентноймеди в спиртовом растворе аммиака
алкины окисляются кислородом воздуха
до диацетиленов
4 R-C≡C-H + O2 →
2 R-C≡C-C≡C-R + 2 H2O
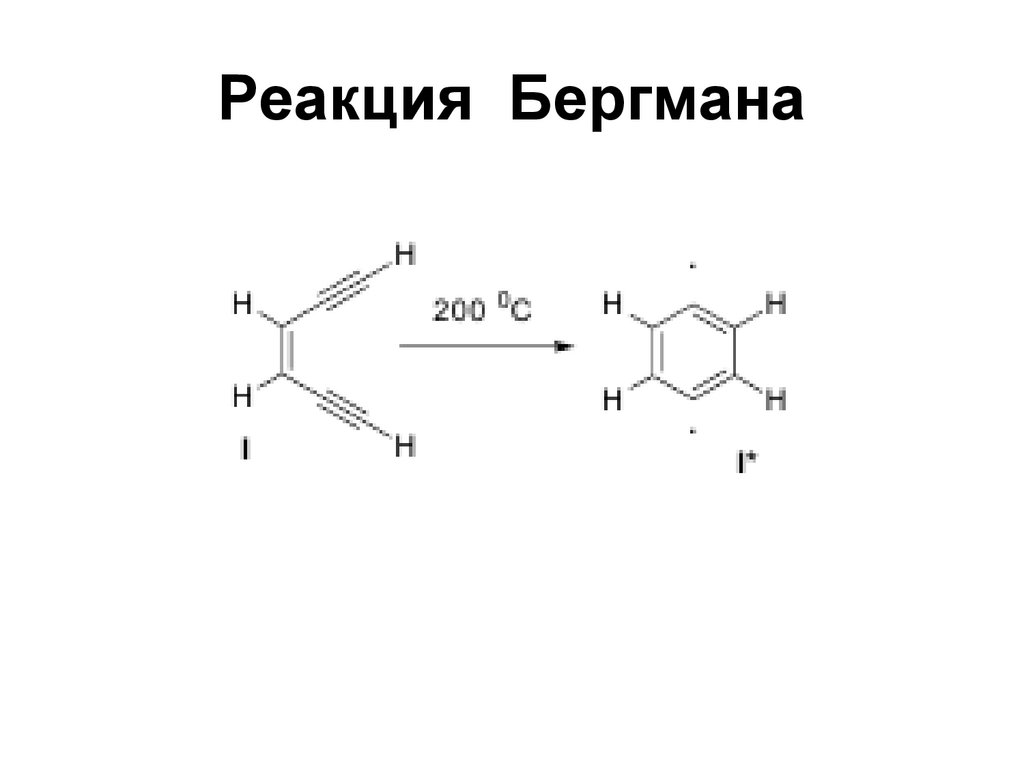
99. Реакция Бергмана
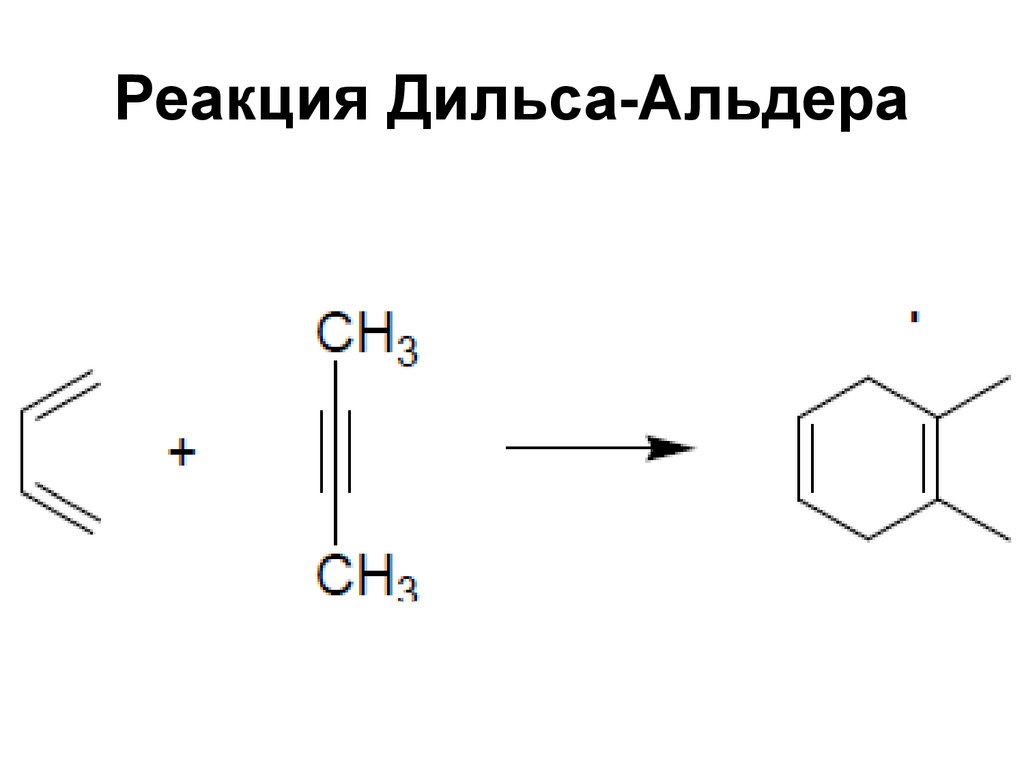
100. Реакция Дильса-Альдера
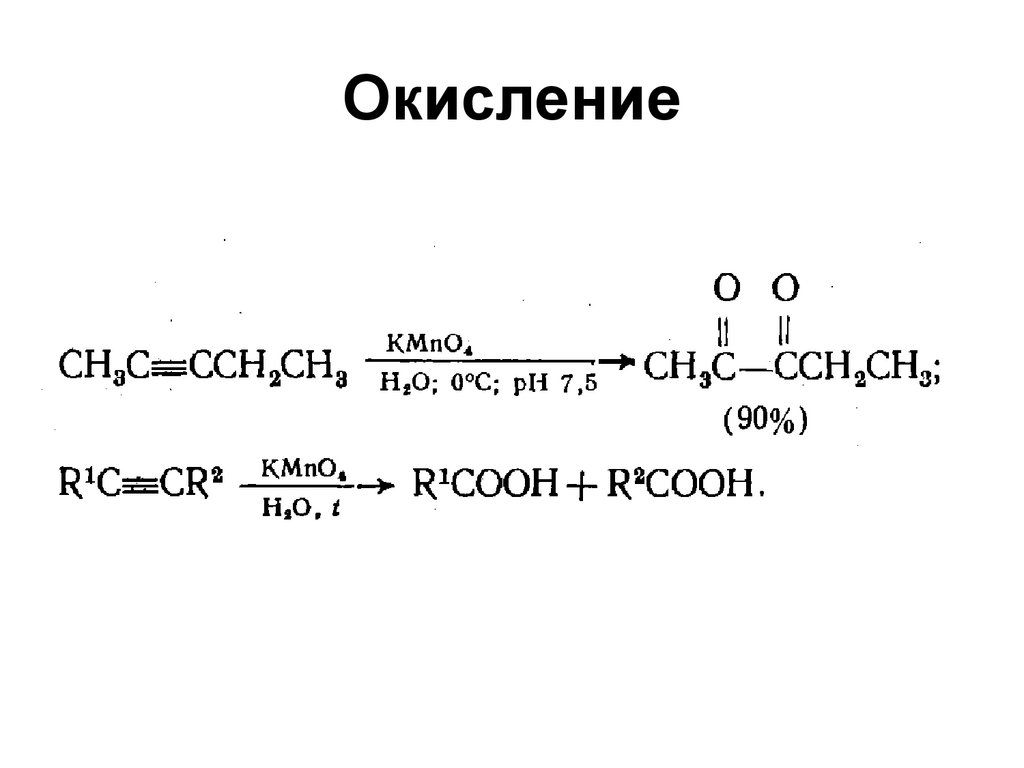
101. Окисление
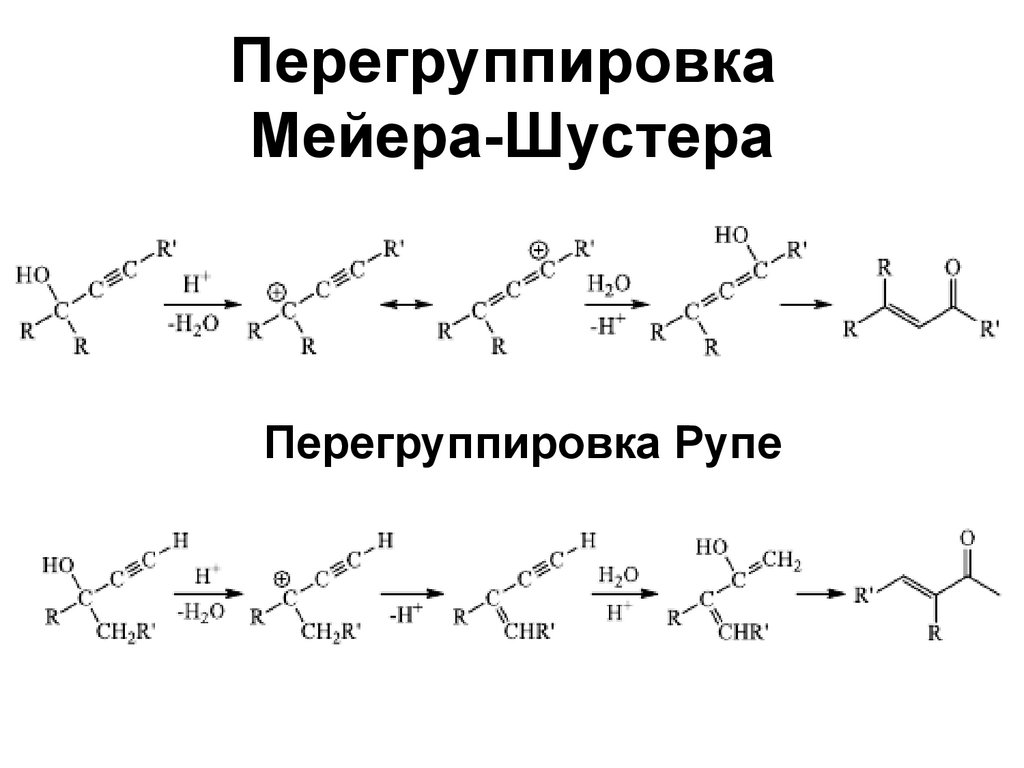
102. Перегруппировка Мейера-Шустера
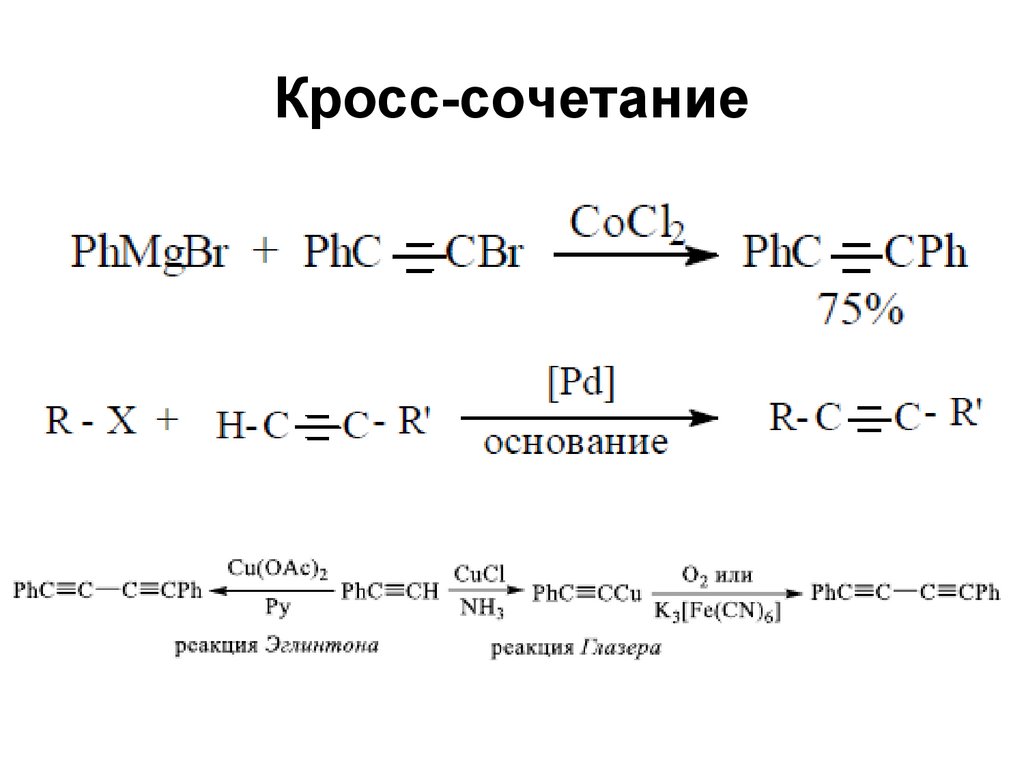
Перегруппировка Рупе103. Кросс-сочетание
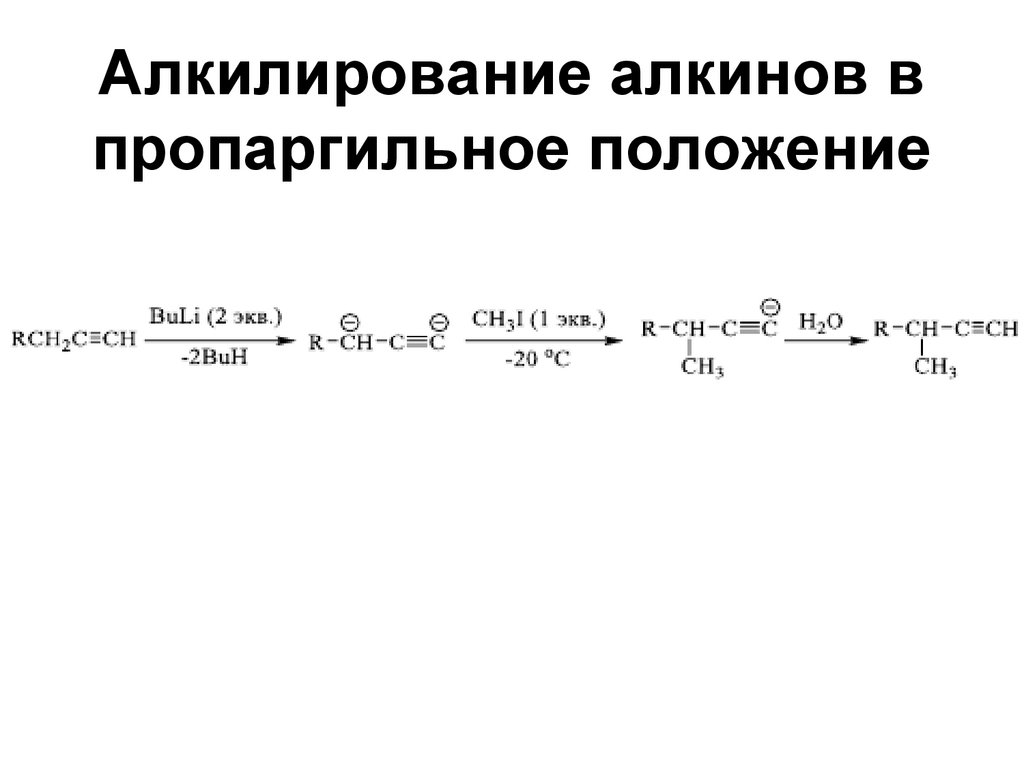
104. Алкилирование алкинов в пропаргильное положение
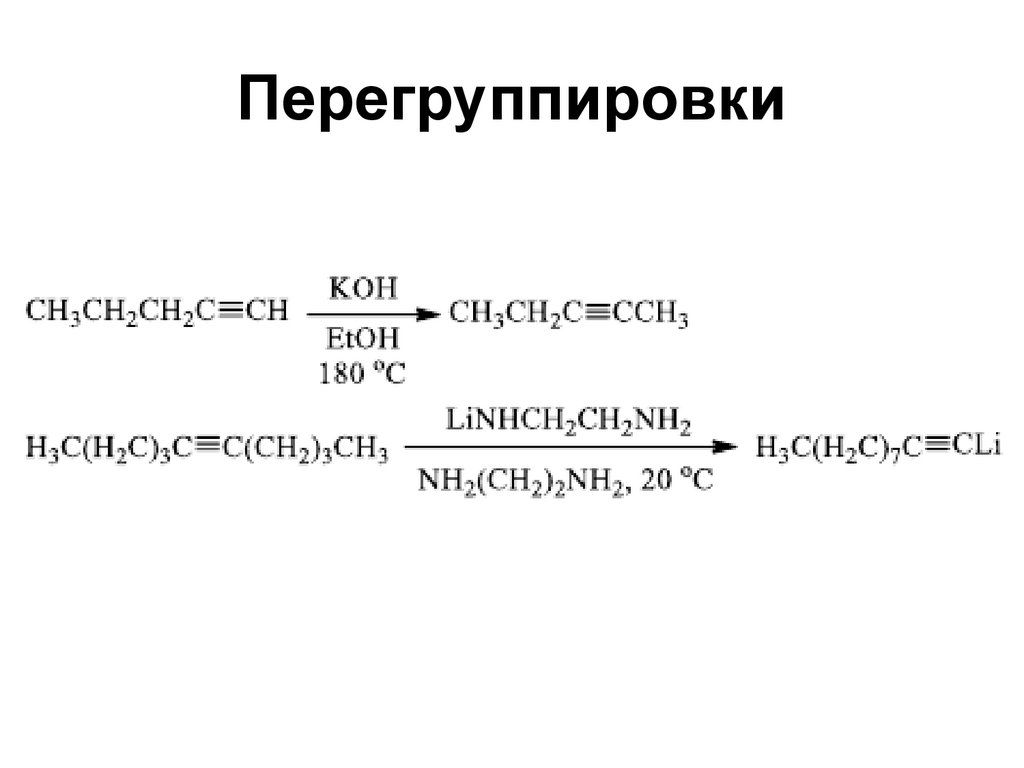
105. Перегруппировки
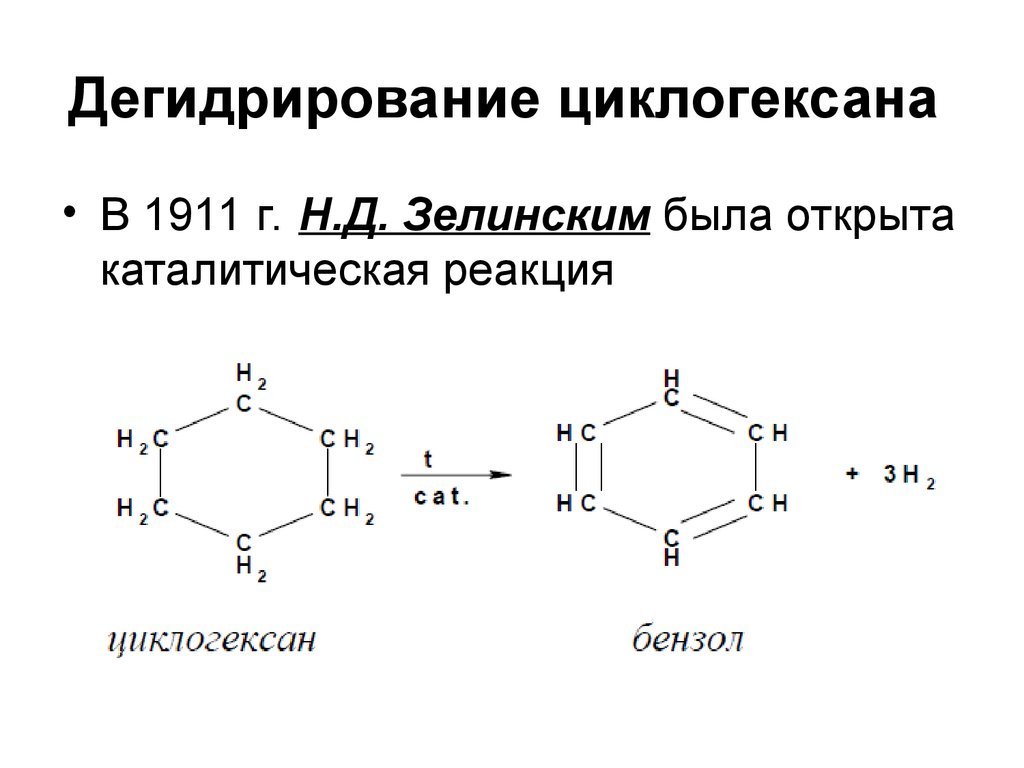
106. Дегидрирование циклогексана
• В 1911 г. Н.Д. Зелинским была открытакаталитическая реакция
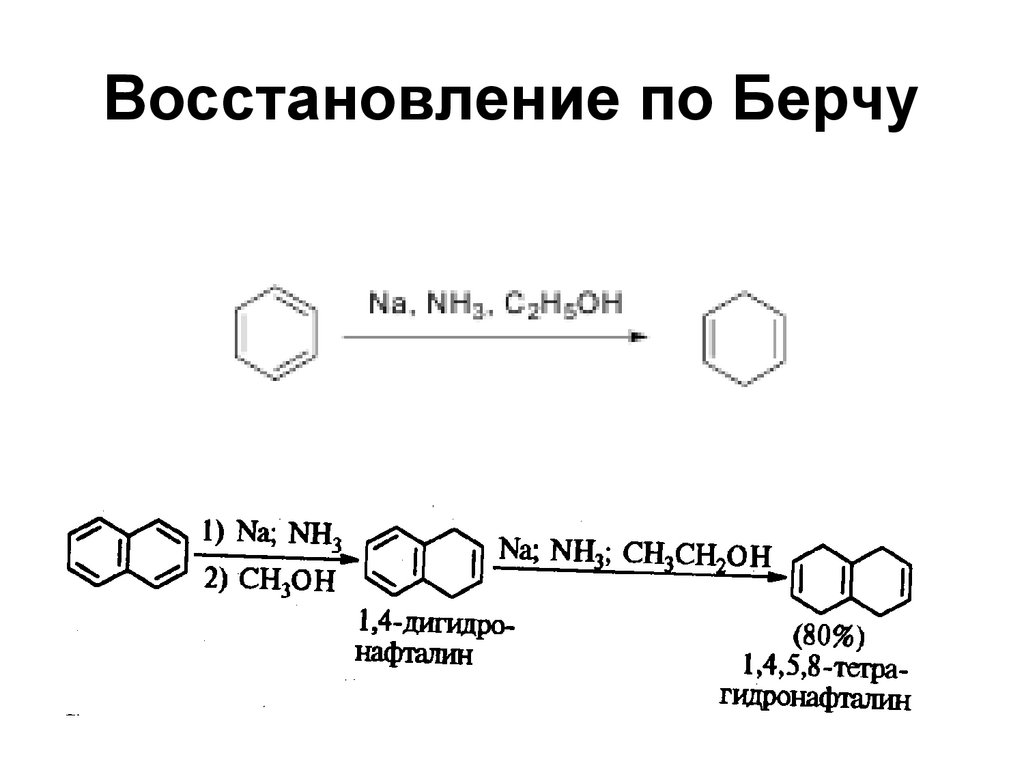
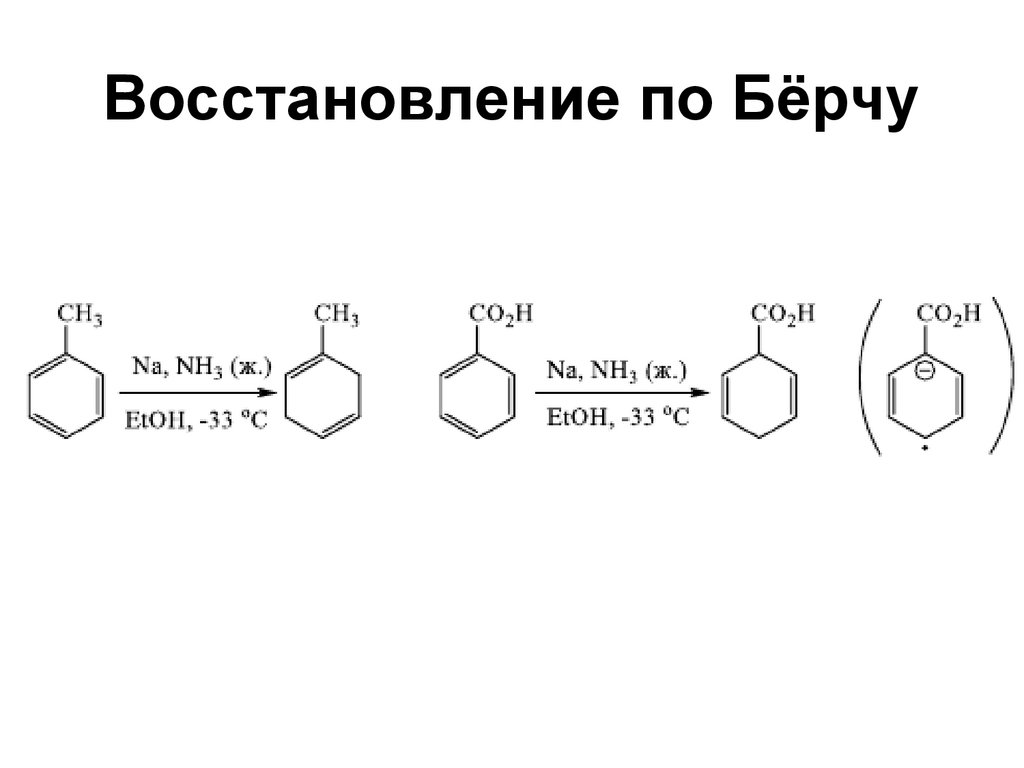
107. Восстановление по Берчу
108. Восстановление по Бёрчу
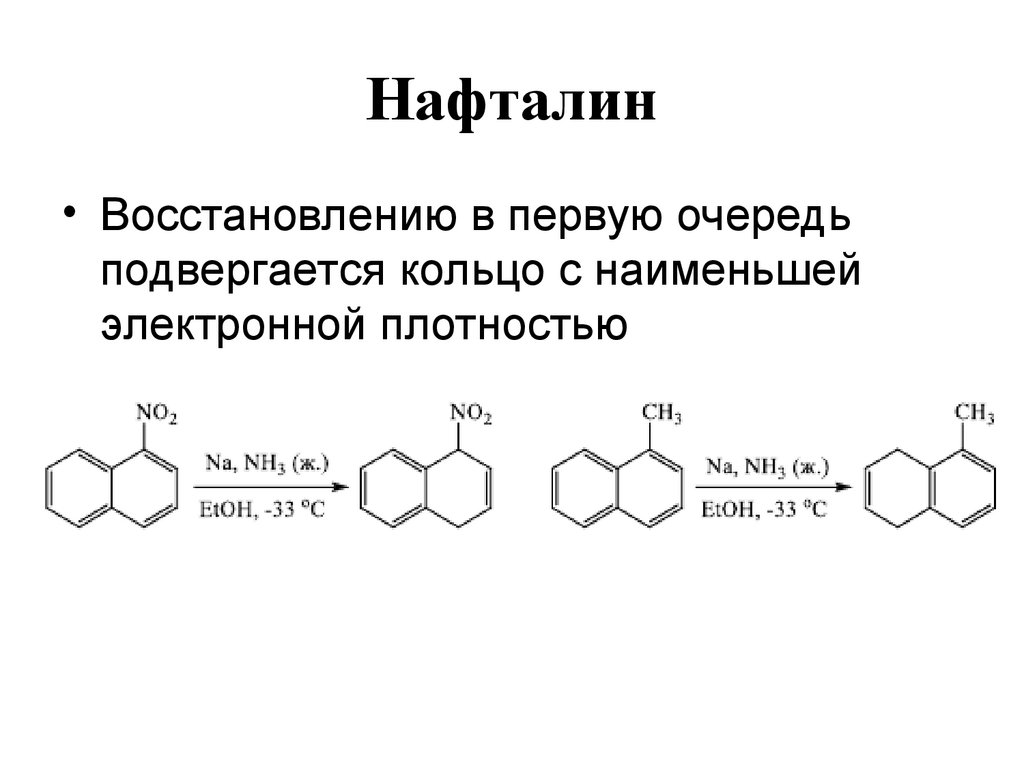
109. Нафталин
• Восстановлению в первую очередьподвергается кольцо с наименьшей
электронной плотностью
110. Реакция Фриделя - Крафтса
Реакция Фриделя - КрафтсаC2H5CI + AlCl3 → C2H5+ + [AICl4]−
C2H5+ + C6H6 → C6H5C2H5 + H+
110
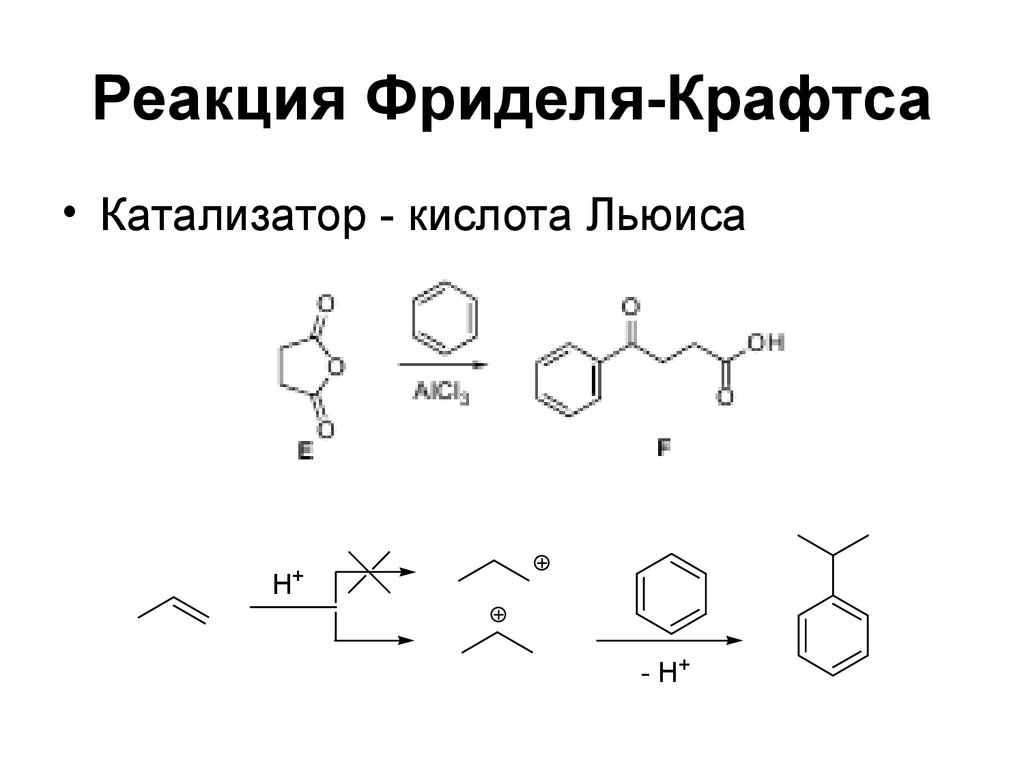
111. Реакция Фриделя-Крафтса
• Катализатор - кислота ЛьюисаH+
- H+
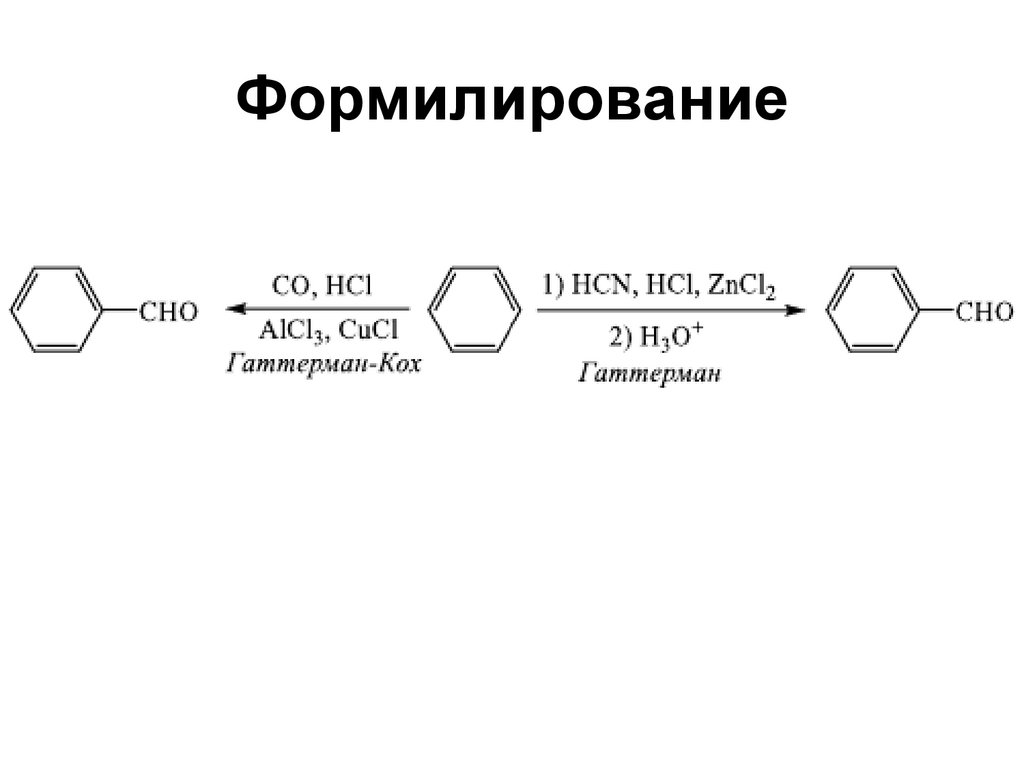
112. Формилирование
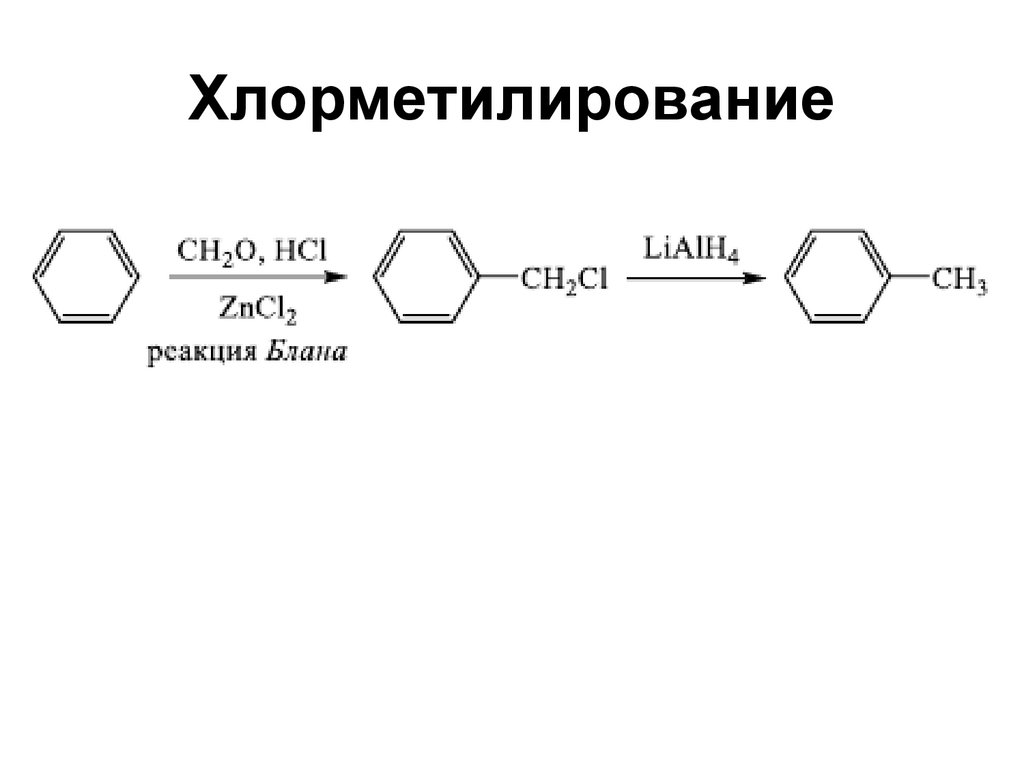
113. Хлорметилирование
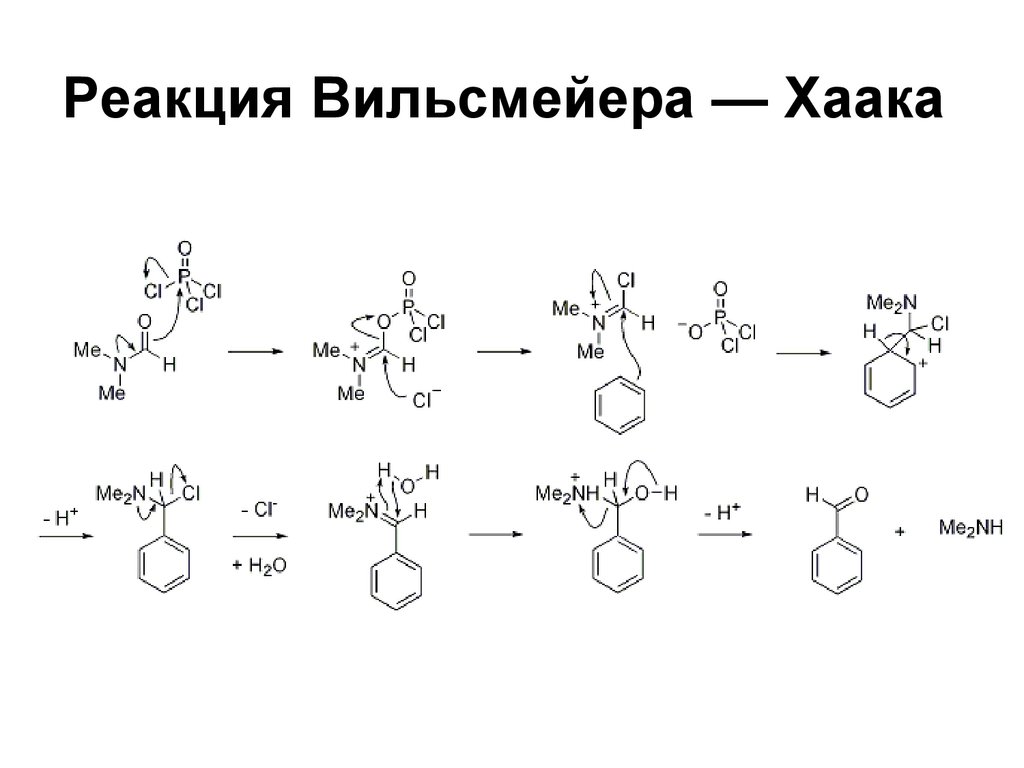
114. Реакция Вильсмейера — Хаака
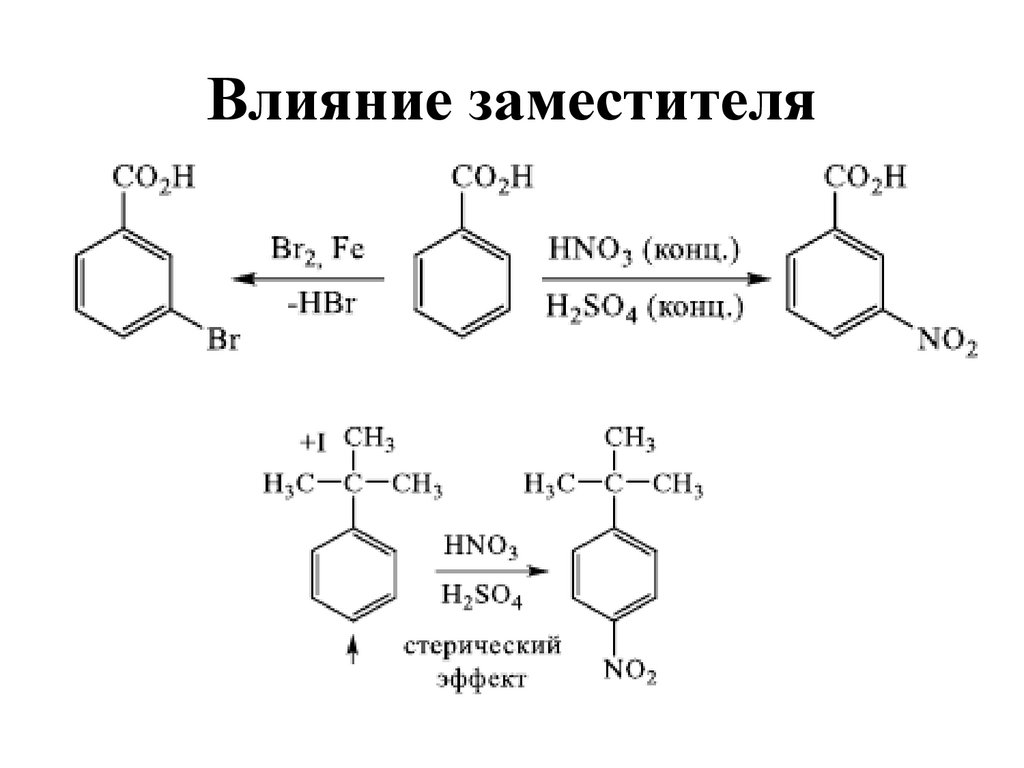
115. Влияние заместителя
116. Правила ориентации в нафталине
SO3HH2SO4
H2SO4
80 o
160o
SO3H
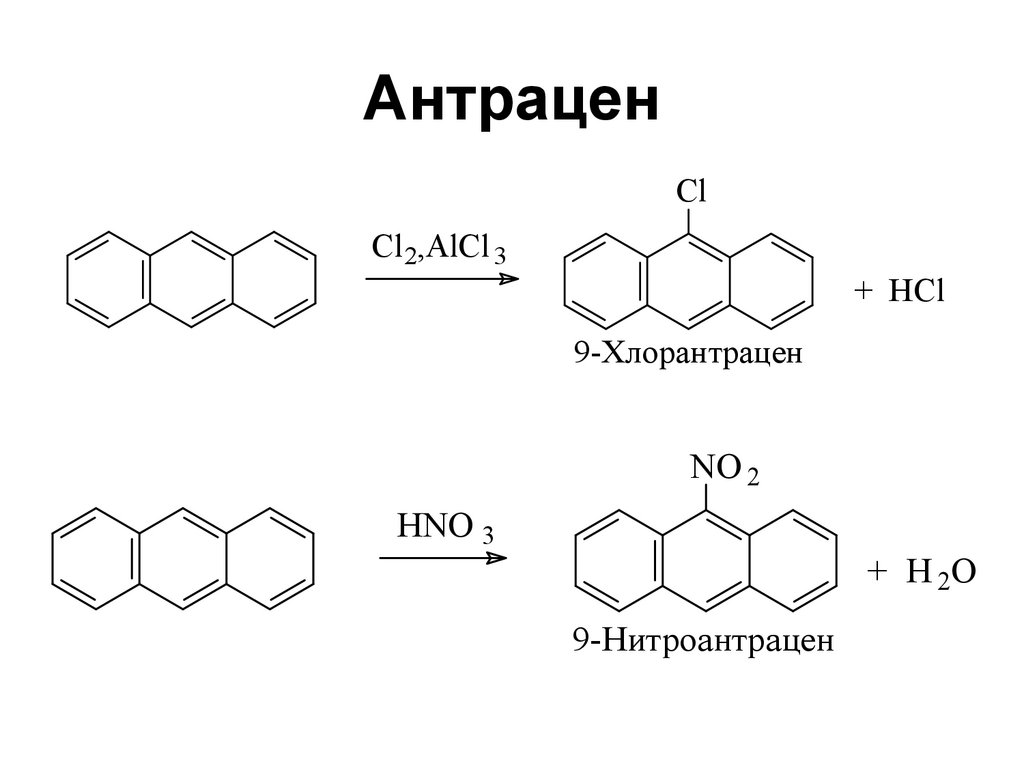
117. Антрацен
ClCl 2,AlCl 3
+ HCl
9-Хлорантрацен
NO 2
HNO 3
+ H 2O
9-Нитроантрацен
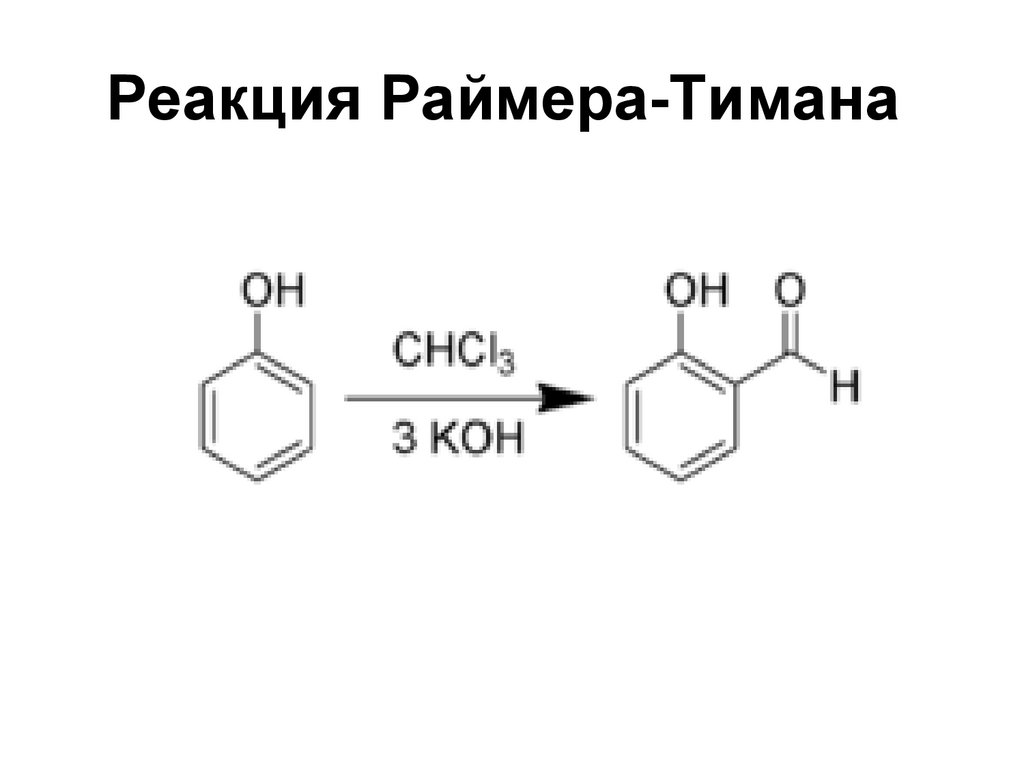
118. Реакция Раймера-Тимана
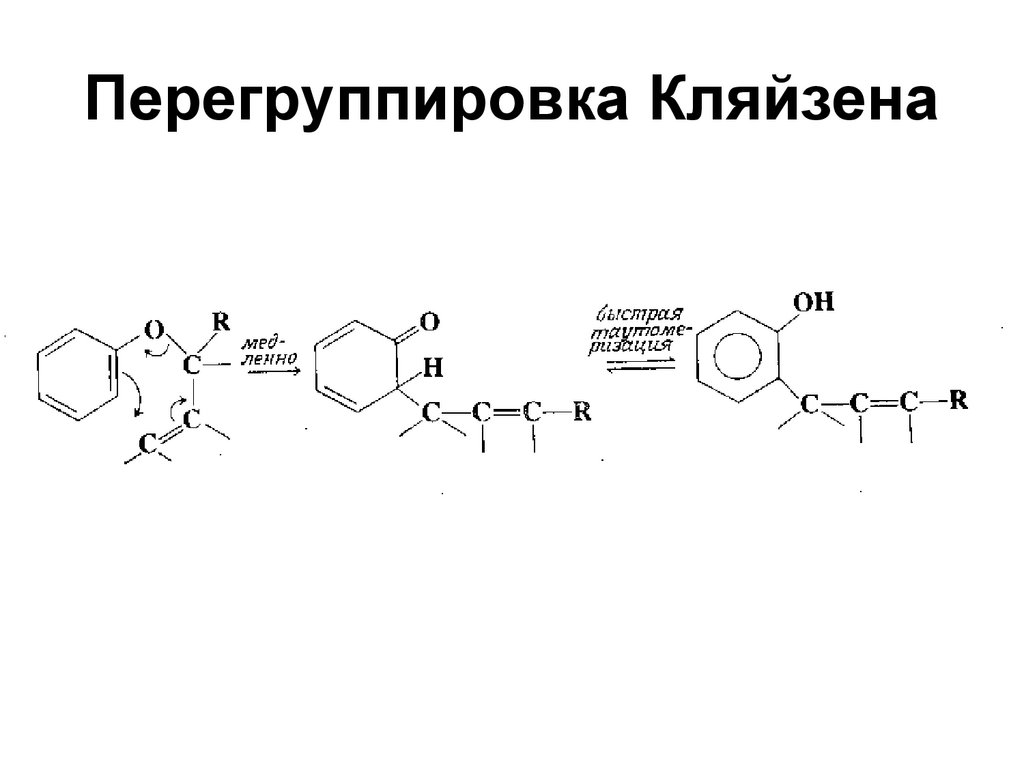
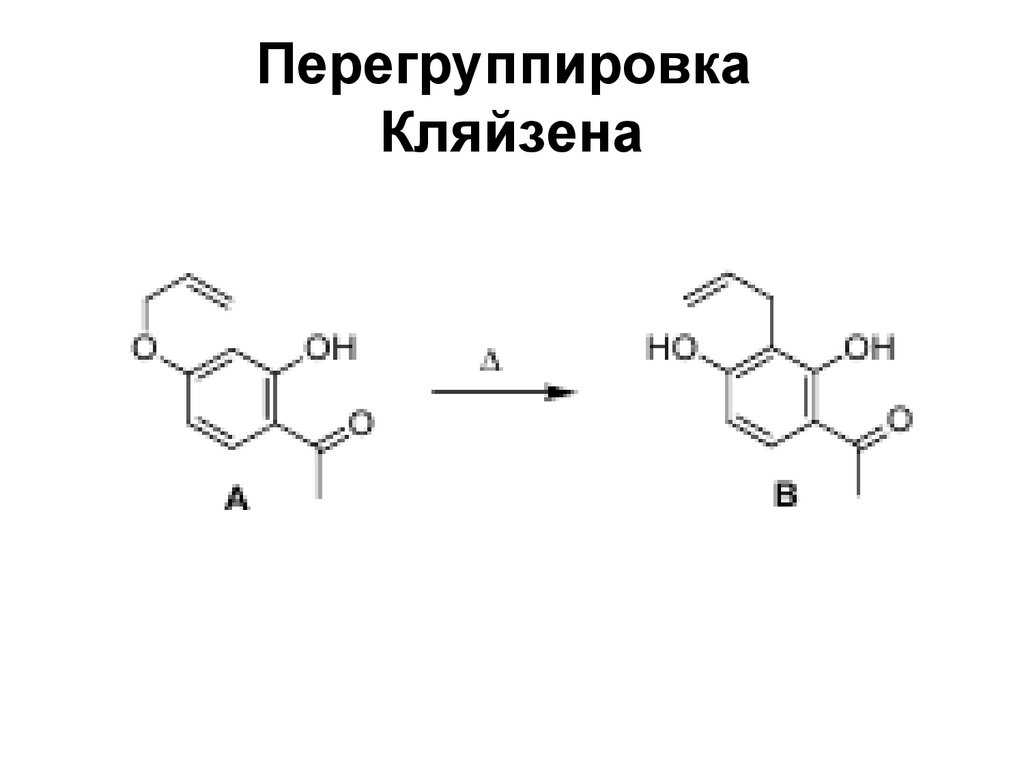
119. Перегруппировка Кляйзена
120. Перегруппировка Кляйзена
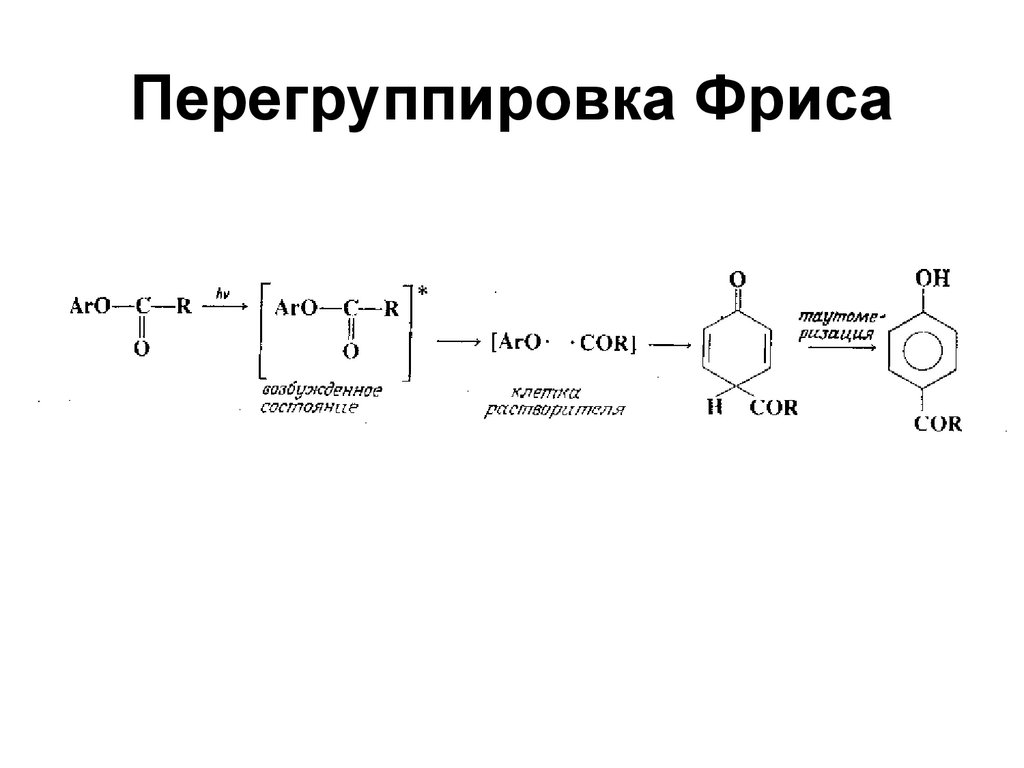
121. Перегруппировка Фриса
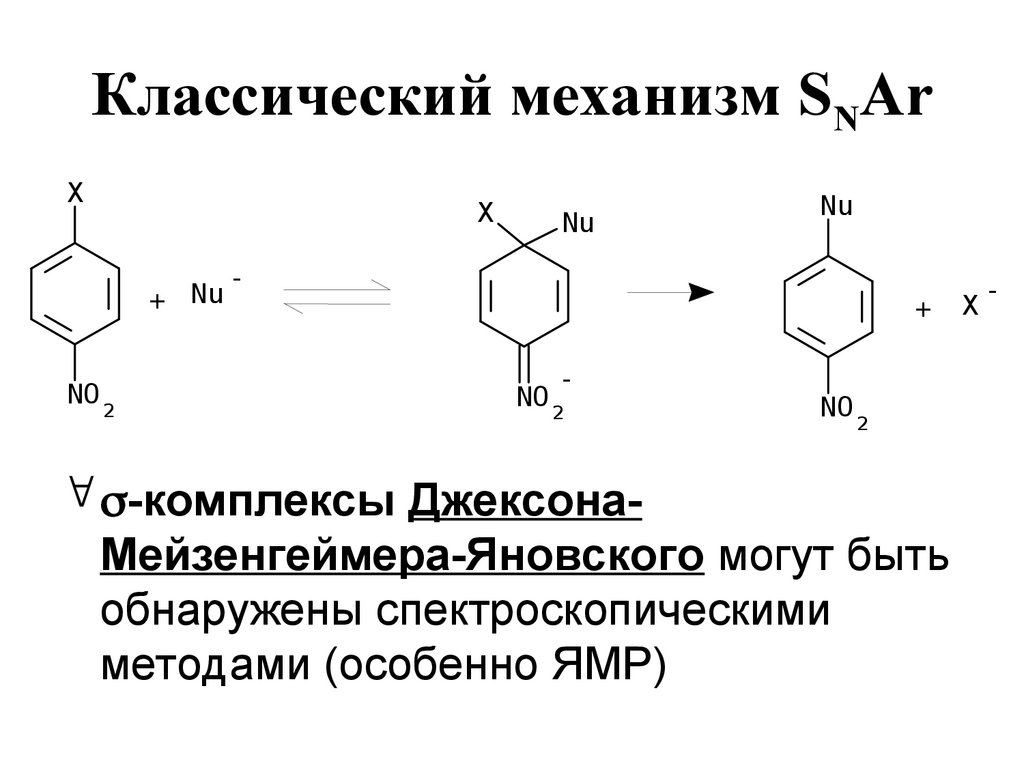
122. Классический механизм SNAr
XX
+ Nu
NO 2
Nu
Nu
-
+
NO 2
NO 2
-комплексы ДжексонаМейзенгеймера-Яновского могут быть
обнаружены спектроскопическими
методами (особенно ЯМР)
X
-
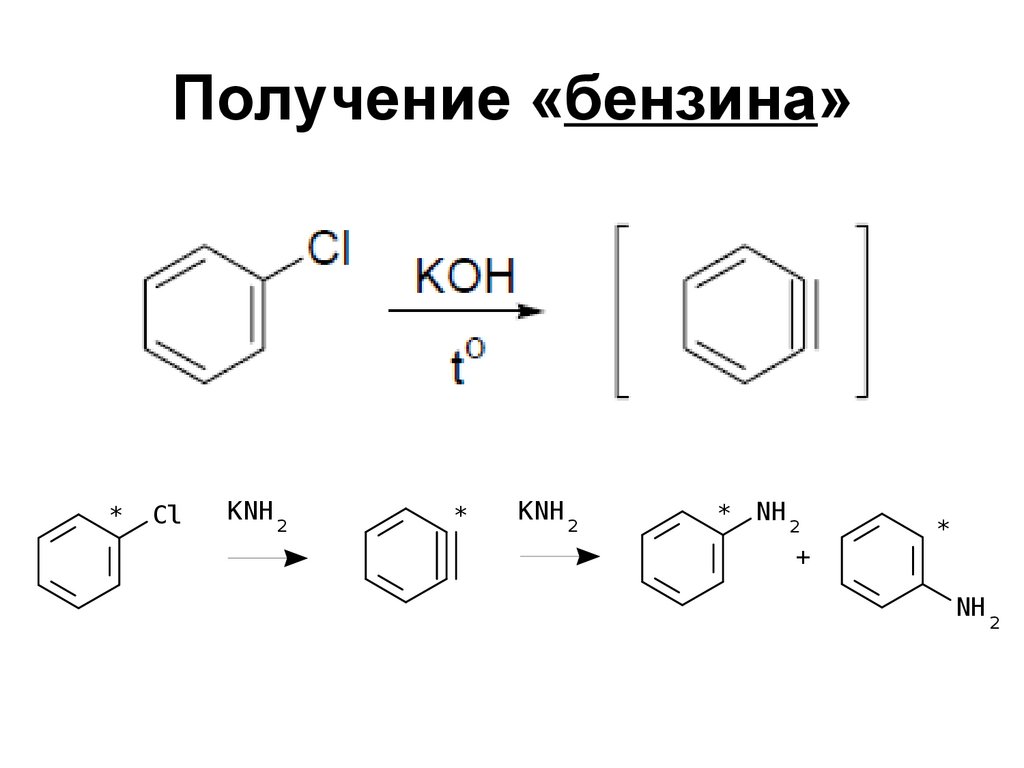
123. Получение «бензина»
*Cl
KNH 2
*
KNH 2
* NH 2
+
*
NH 2
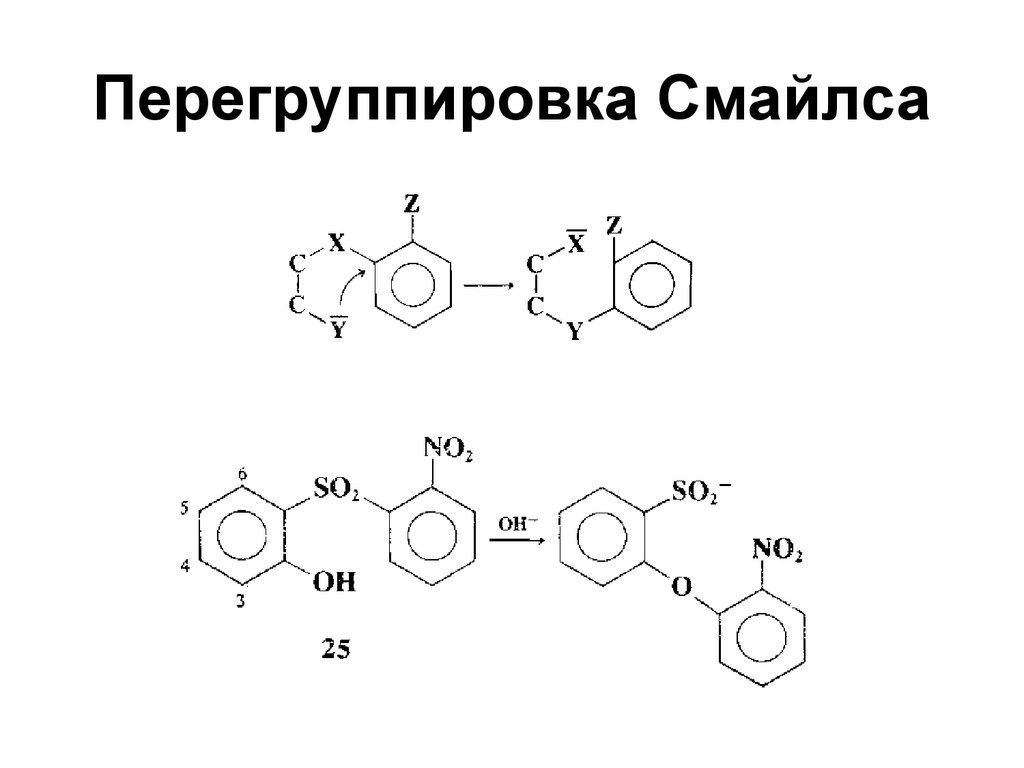
124. Перегруппировка Смайлса
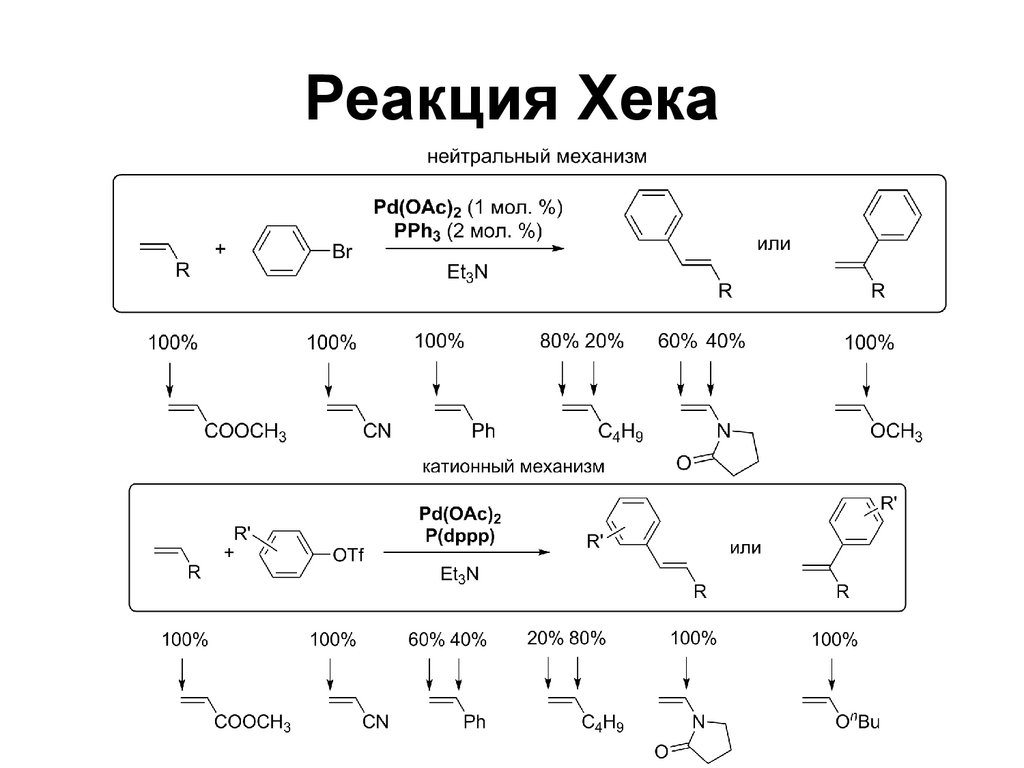
125. Реакция Хека
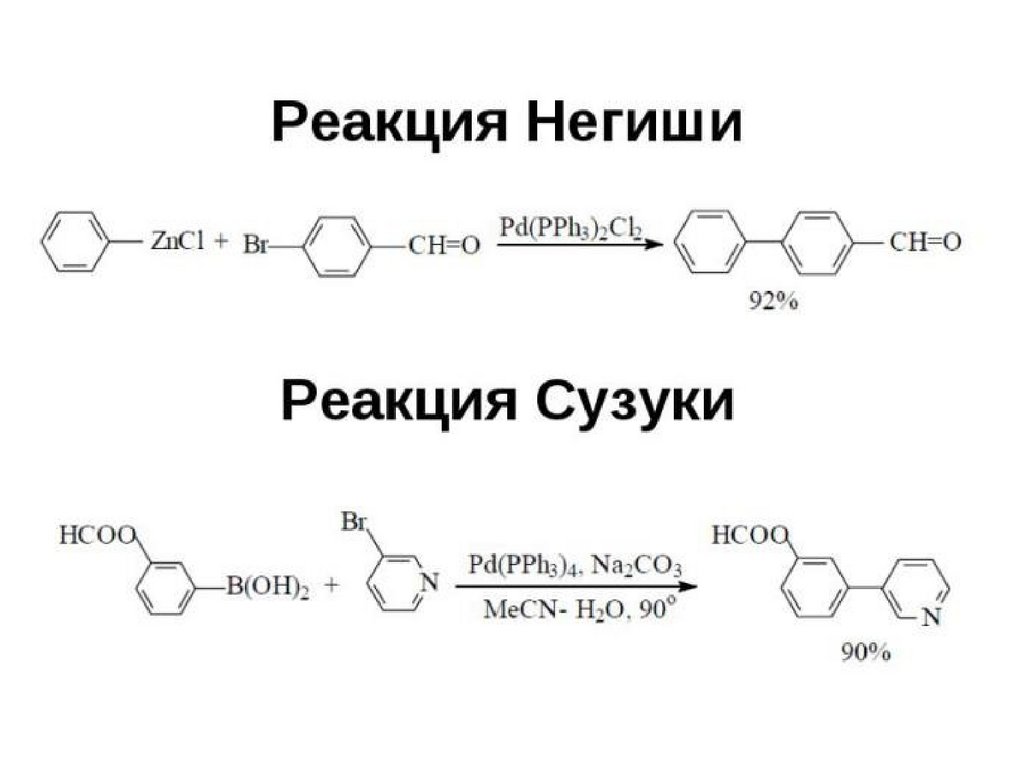
126.
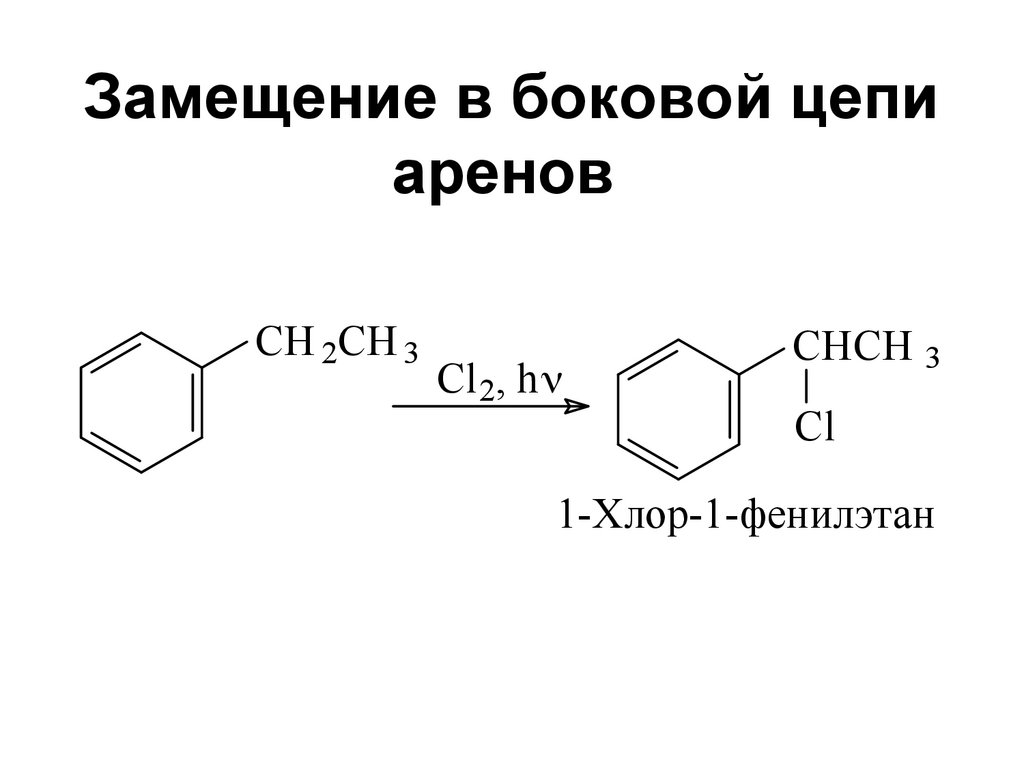
127. Замещение в боковой цепи аренов
CH 2CH 3Cl 2, h
CHCH 3
Cl
1-Хлор-1-фенилэтан
128. Замещение в боковой цепи аренов
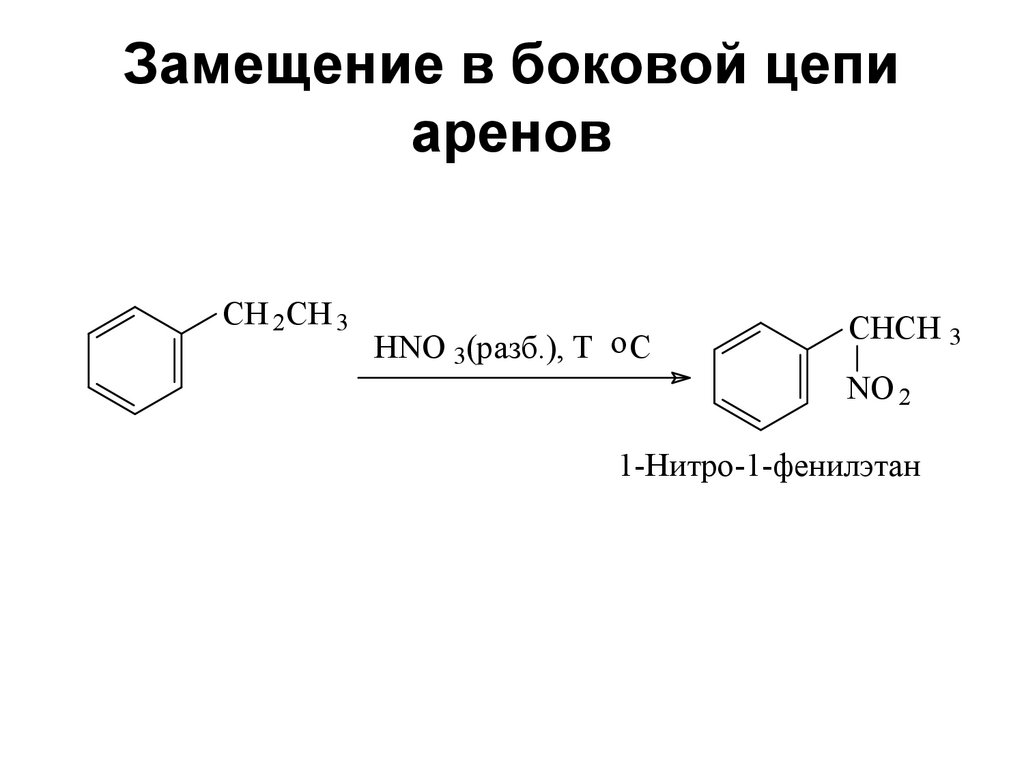
CH 2CH 3HNO 3(разб.), T o C
CHCH 3
NO 2
1-Нитро-1-фенилэтан
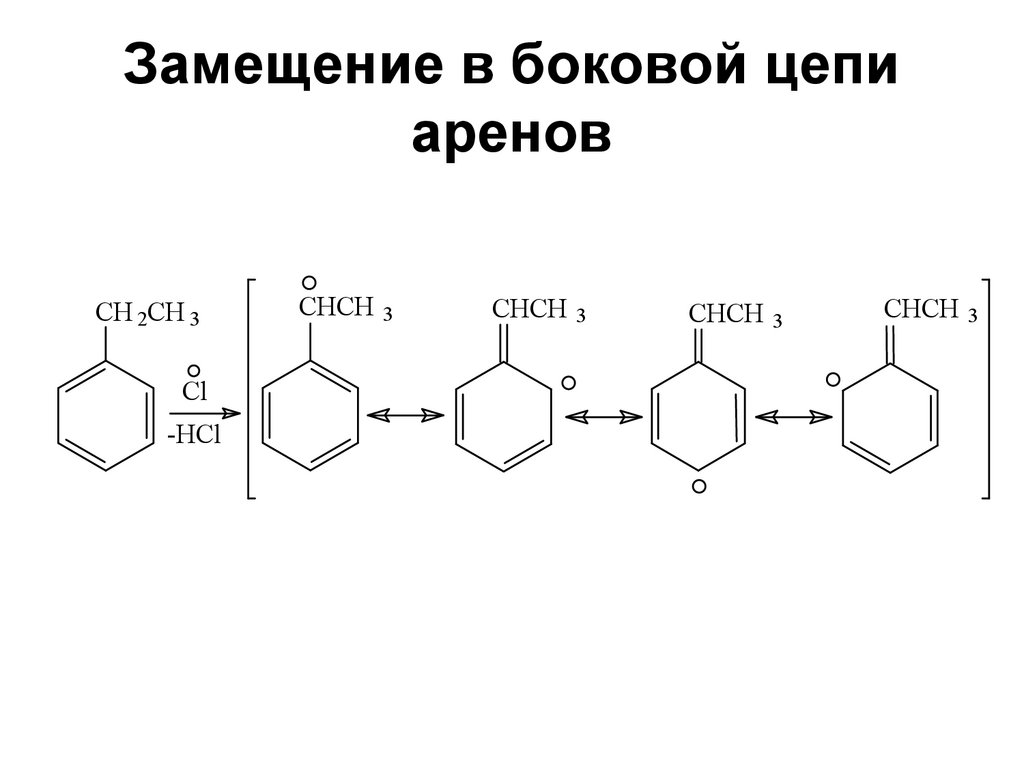
129. Замещение в боковой цепи аренов
CH 2CH 3Cl
-HCl
CHCH 3
CHCH 3
CHCH 3
CHCH 3
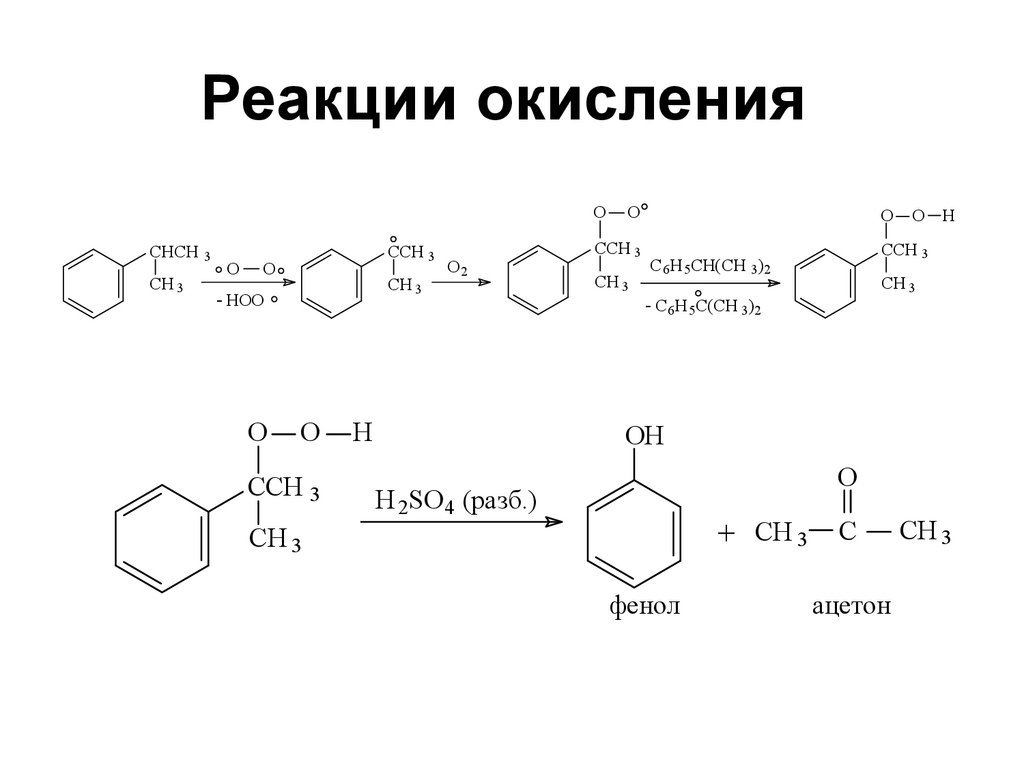
130. Реакции окисления
OCHCH 3
CH 3
O
CCH 3
O
CH 3
HOO
O
O
CCH 3
CH 3
O2
H
O
CCH 3
CH 3
O
O H
CCH 3
C 6H 5CH(CH 3)2
CH 3
C 6H 5C(CH 3)2
OH
O
H 2SO 4 (разб.)
+ CH 3
фенол
C
ацетон
CH 3
131. Регион-2011
• Прямое окисление бензола закисьюазота
132.
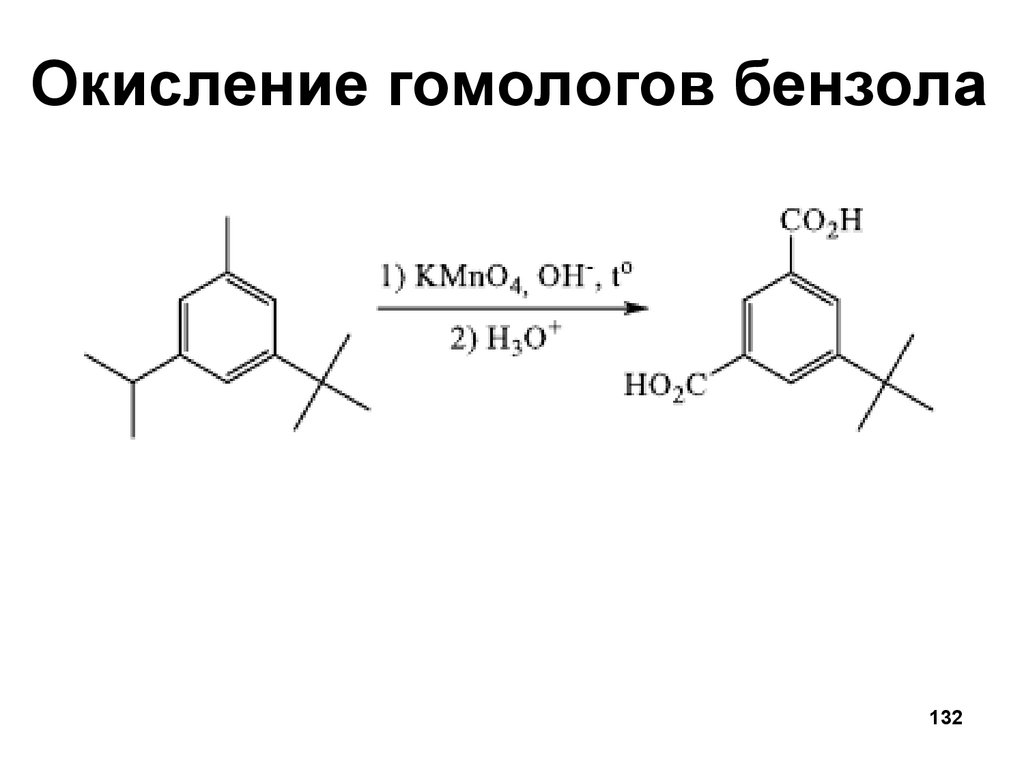
Окисление гомологов бензола132
133. Окисление
O[O]
HC
HC
C
O
C
O
O 2,V2O 5,380-450 o C
O
C
C
O
O
фталевый
ангидрид
134. Антрацен
135. Галогенуглеводороды
• При действии многих металловв эфире галоген замещается на
металл:
R-Cl + 2 Li R-Li + LiCl
R-Cl + Mg RMgCl
(соединения Гриньяра)
136. Вальденовское обращение (SN2)
CH 3CH 3
HO
Br
H
С 6H 13
[
HO
R-2-бромоктан
CH3
HC Br
C6H13
+ HO
Br
H
С 6H 13
]
CH 3
HO
H
С 6H 13
S-2-октанол
CH3
HO CH
C6H13
Br
137. Стереохимия (SN1)
CH 3CH 3
Br
H
C 2H 5
(S)-2-Бромбутан
Молекула хиральна
Br
+
H
C 2H 5
Карбокатион плоский
Ахирален
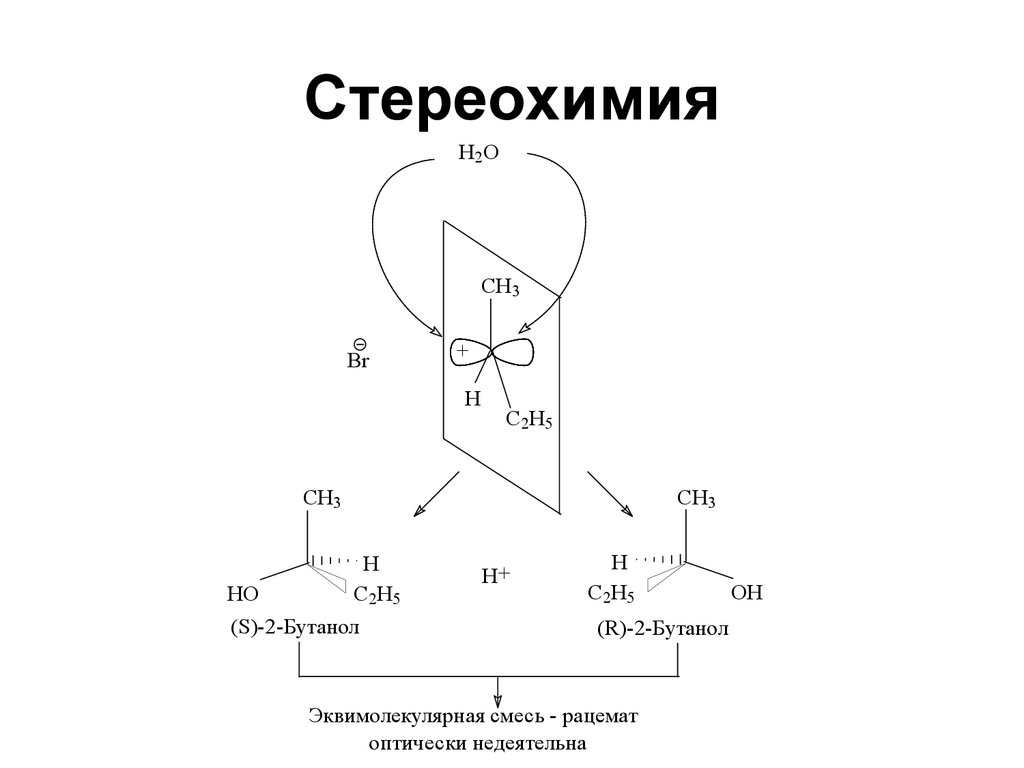
138. Стереохимия
H2OCH3
Br
+
H
C2H5
CH3
H
HO
C2H5
(S)-2-Бутанол
CH3
H+
H
C2H5
(R)-2-Бутанол
Эквимолекулярная смесь - рацемат
оптически недеятельна
OH
139. Механизм SN1
CHCH 3
CH
CH 3
CH 3 Br
H 2O, C 2H 5OH
медленно
H
CH 3
C
CH CH 3
CH 3
перегруппировка
1,2-сдвиг гидрид-иона Н
CH 3
втор. карбокатион
CH 3 C
H
CH CH 3 + H 2O
CH 3
CH
CH
CH 3 + Br
CH 3
H
CH 3
C
CH CH 3
CH 3
трет. карбокатион
H 2O H
CH 3 C CH CH 3
CH 3
H
HO H
CH 3 C CH CH 3
CH 3
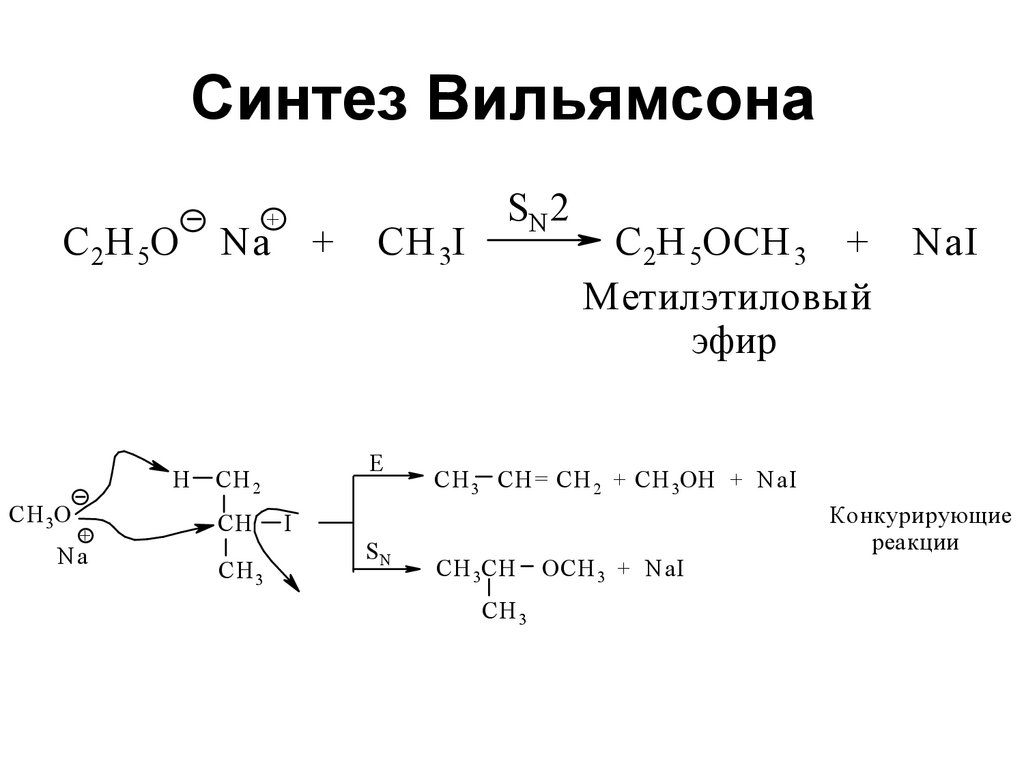
140. Синтез Вильямсона
+С 2Н 5О
Na
H
CH 2
CH 3О
+
Na
CH
CH 3
+
CH 3I
E
I
SN
SN 2
C 2H 5OCH 3 +
Метилэтиловый
эфир
N aI
CH 3 CH= CH 2 + CH 3OH + NaI
CH 3CH
CH 3
OCH 3 + NaI
Конкурирующие
реакции
141. Расщепление простых эфиров
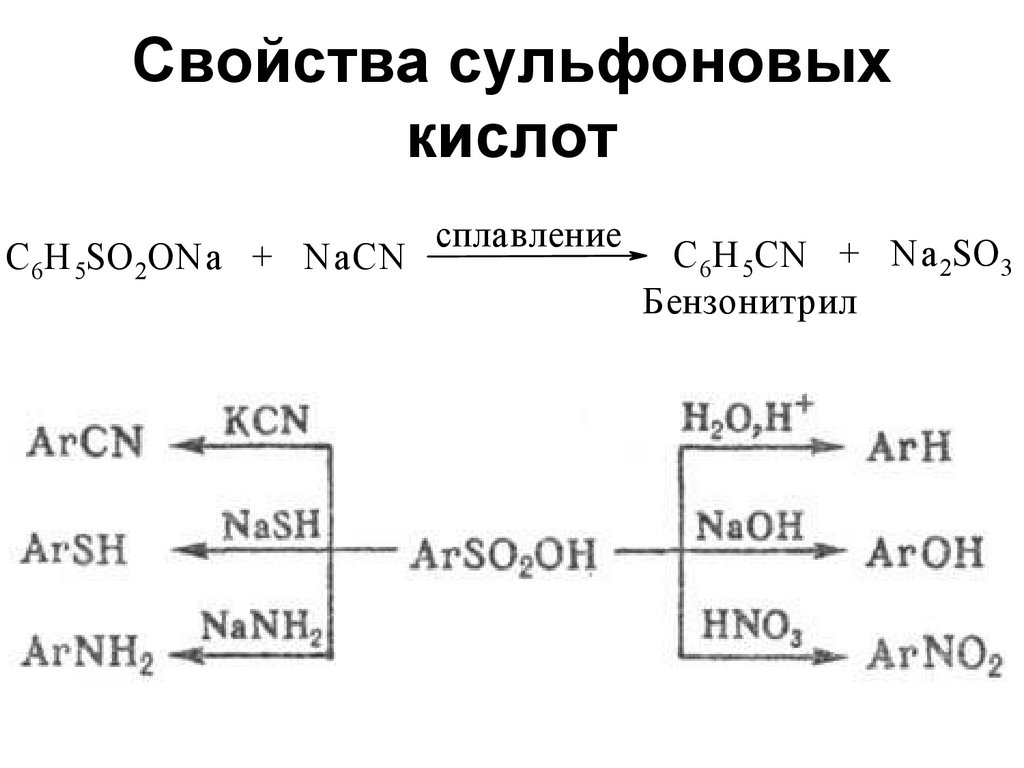
142. Свойства сульфоновых кислот
C 6H 5SO 2ONa + NaCNсплавление
C 6H 5CN + Na 2SO 3
Бензонитрил
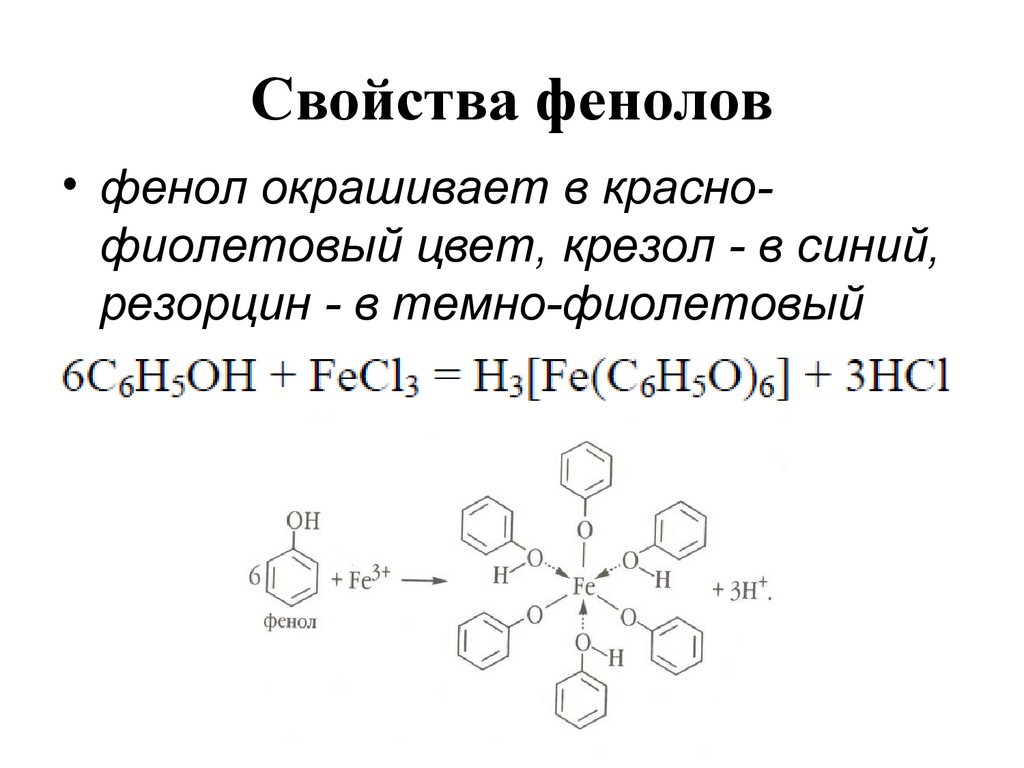
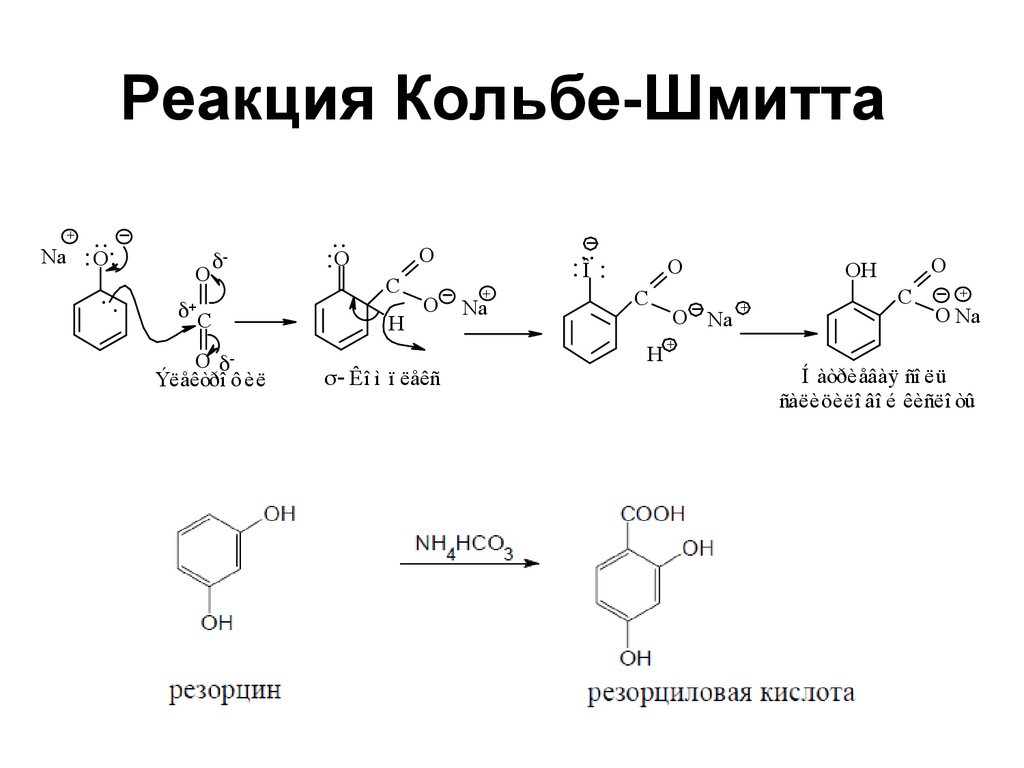
143. Свойства фенолов
• фенол окрашивает в краснофиолетовый цвет, крезол - в синий,резорцин - в темно-фиолетовый
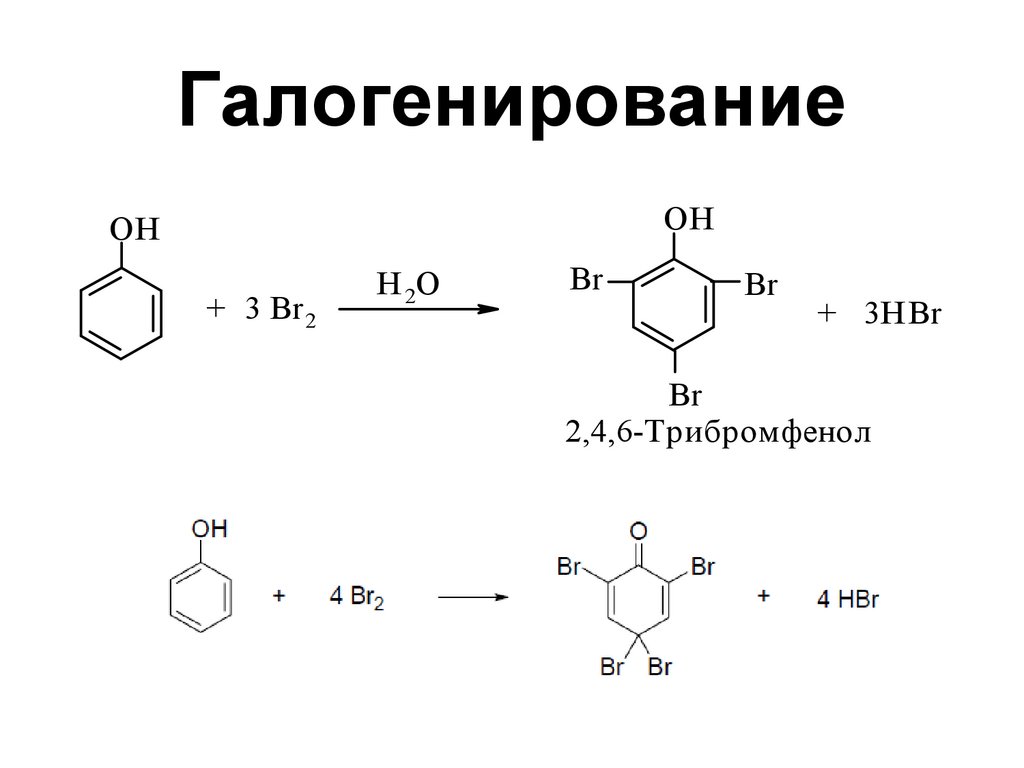
144. Галогенирование
OHOH
+ 3 Br 2
H 2O
Br
Br
+ 3HBr
Br
2,4,6-Трибромфенол
145. Реакция Кольбе-Шмитта
Na+
.. O....
..
O
C
O
Ýëåêòðî ô èë
....O
O
C
H
O
Êî ì ï ëåêñ
+
Na
....Î ..
O
C
H
O Na
OH
+
O
C
+
O Na
+
Í àòðèåâàÿ ñî ëü
ñàëèöèëî âî é êèñëî òû
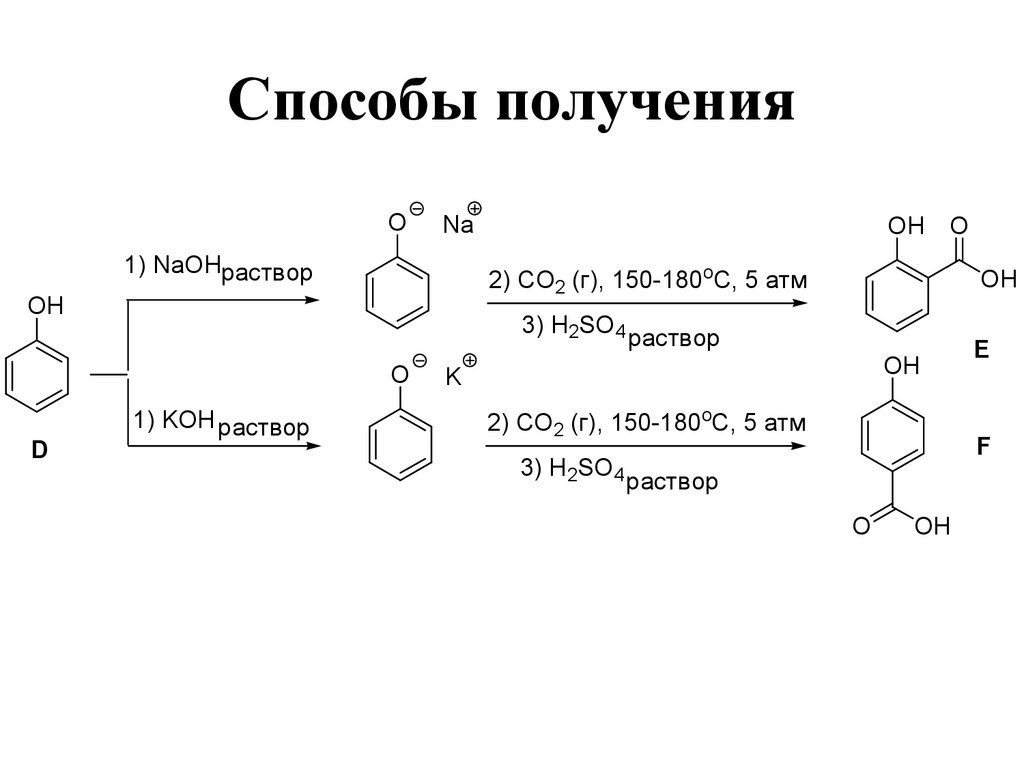
146. Способы получения
ONa
1) NaOHраствор
2) CO2 (г), 150-180oC, 5 атм
OH
3) H2SO4
O
D
OH O
1) KOH раствор
OH
раствор
OH
K
2) CO2 (г), 150-180oC, 5 атм
3) H2SO4
E
F
раствор
O
OH
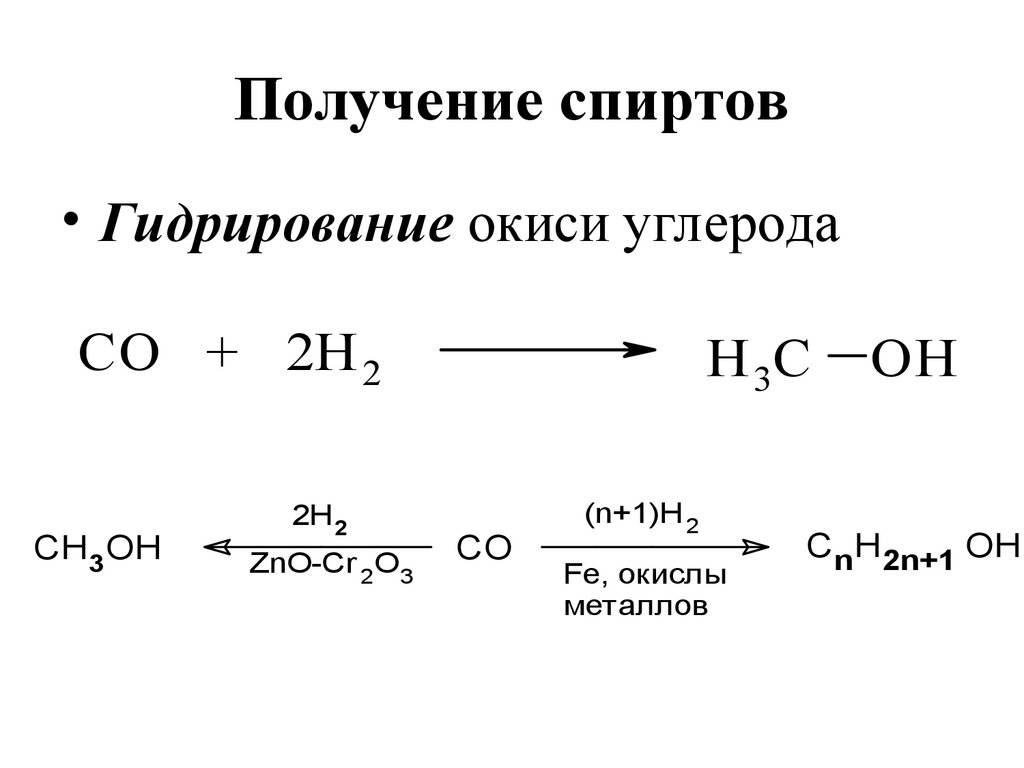
147. Получение спиртов
-H+вление карбонильных соединений,
ых кислот и их производных
Получение спиртов
2[H]
OH
Alk CH R
C C C
O
2H2
C
• Гидрирование окиси углерода
H
R = H или Alk'
lk C
СО
+ 2Н 2
3[H]
O
Y
CH3OH
товое
-HY
Н 3С
Y = OH, OR, OCOR, C
Alk CH2 OH
2H 2
ZnO-Cr 2O3
CO
ОН
(n+1)H 2
Fe, окислы
металлов
nH O
CnH2n+1 OH
148. Получение спиртов
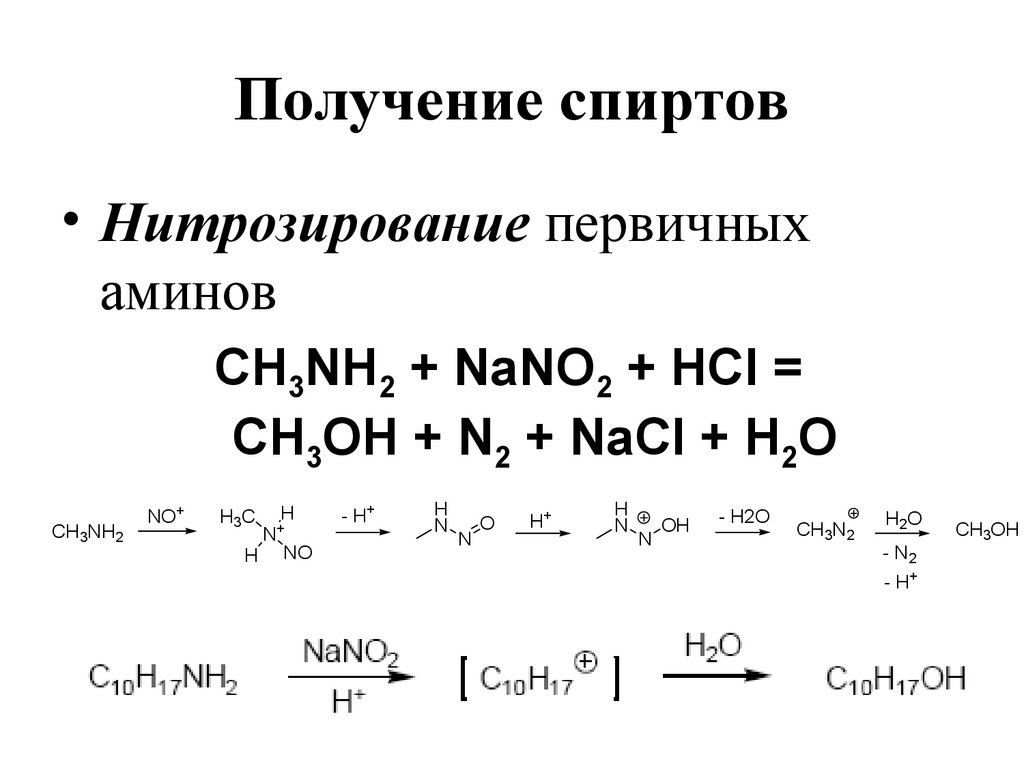
• Нитрозирование первичныхаминов
CH3NH2 + NaNO2 + HCl =
CH3OH + N2 + NaCl + H2O
CH3NH2
NO+
H3C
H
N
H
+
NO
- H+
H
N
N
O
H+
H
N
N
OH
- H2O
CH3N2
H2O
- N2
- H+
CH3OH
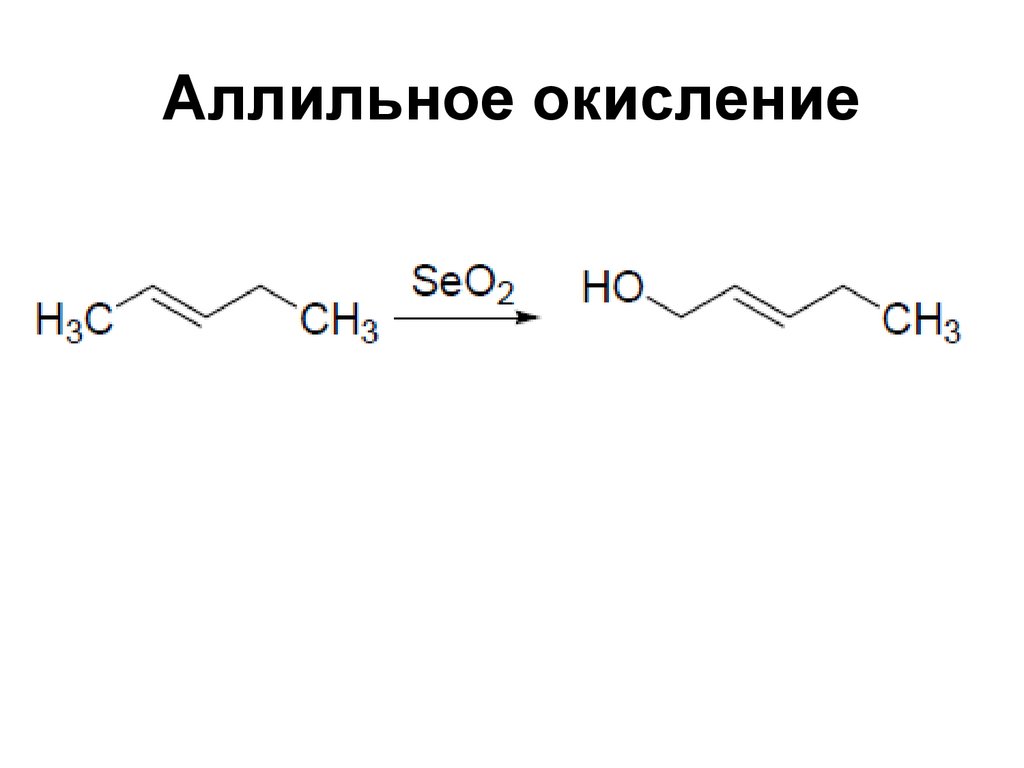
149. Аллильное окисление
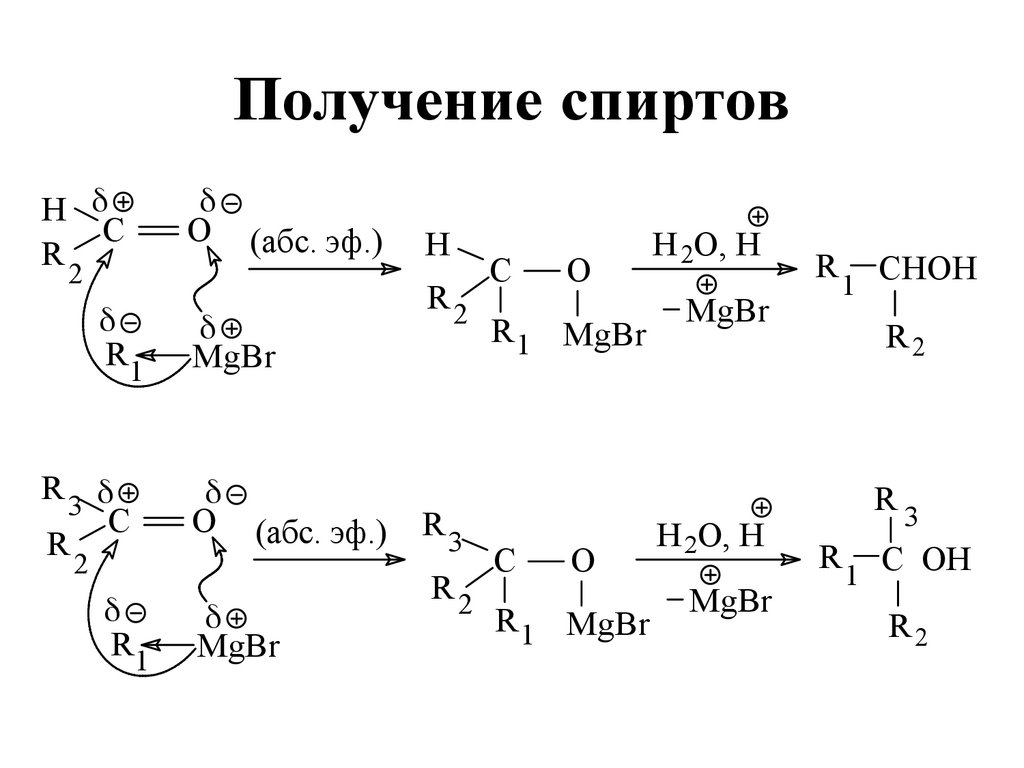
150. Получение спиртов
HC
R
2
R1
R3
C
R
2
R1
O (абс. эф.)
MgBr
O (абс. эф.)
MgBr
H
R2
R3
R2
C
O
R 1 MgBr
C
O
R 1 MgBr
H 2O, H
MgBr
H 2O, H
MgBr
R
1
CHOH
R2
R
R3
1
C OH
R2
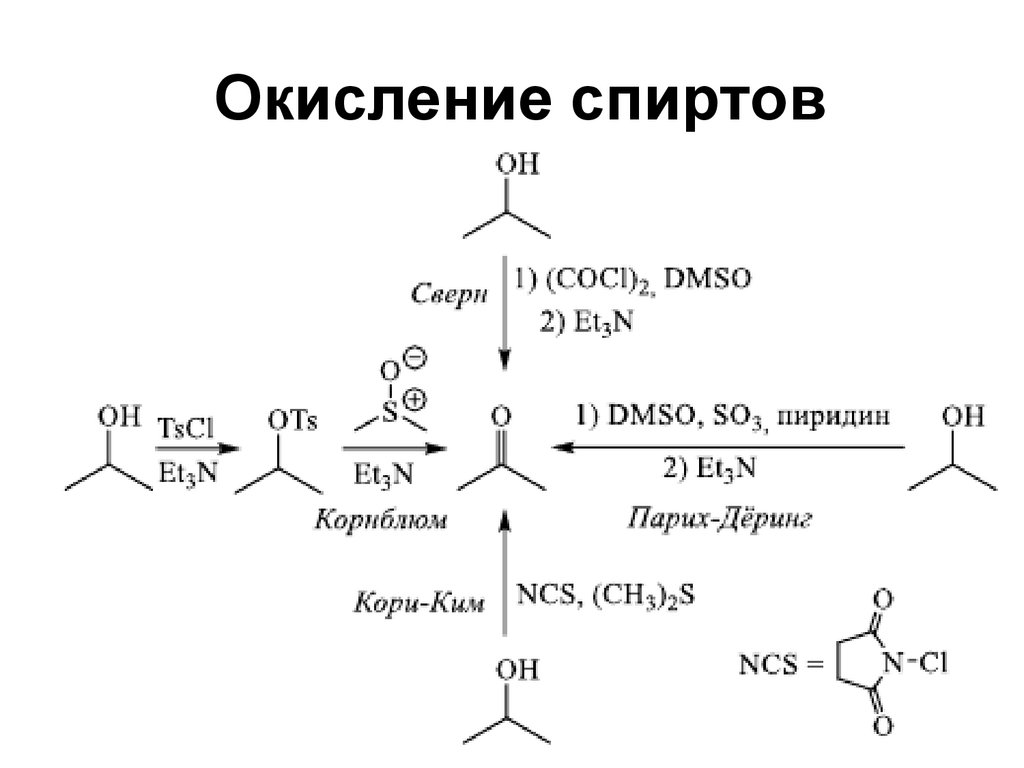
151. Окисление спиртов
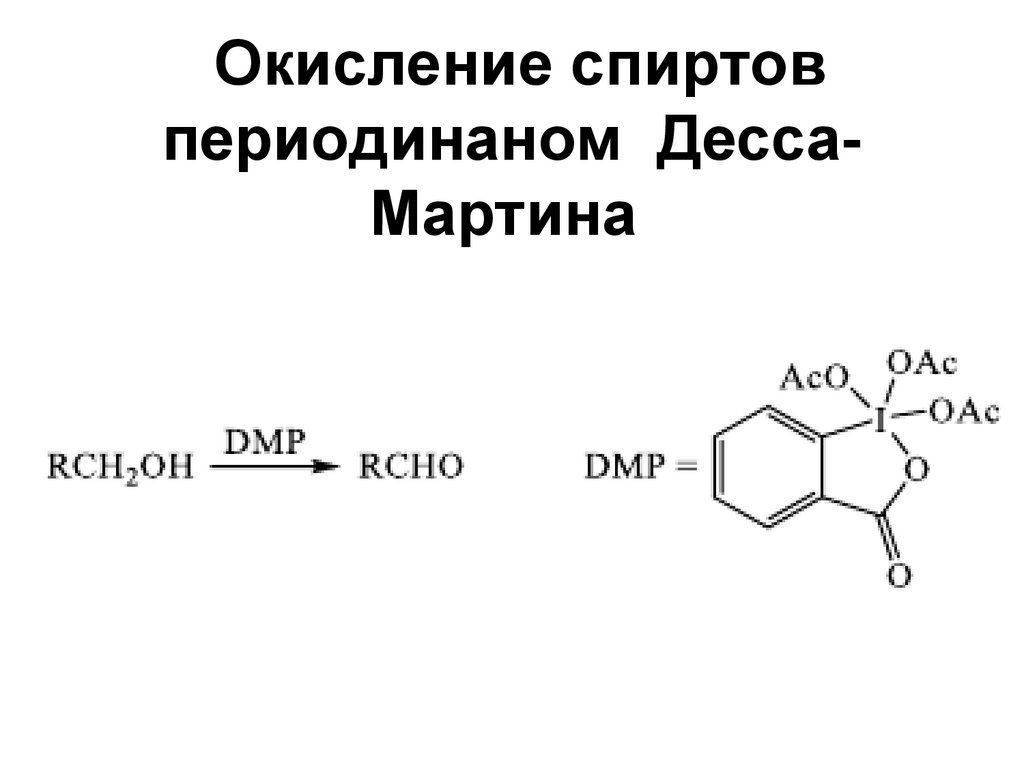
152. Окисление спиртов периодинаном Десса-Мартина
Окисление спиртовпериодинаном ДессаМартина
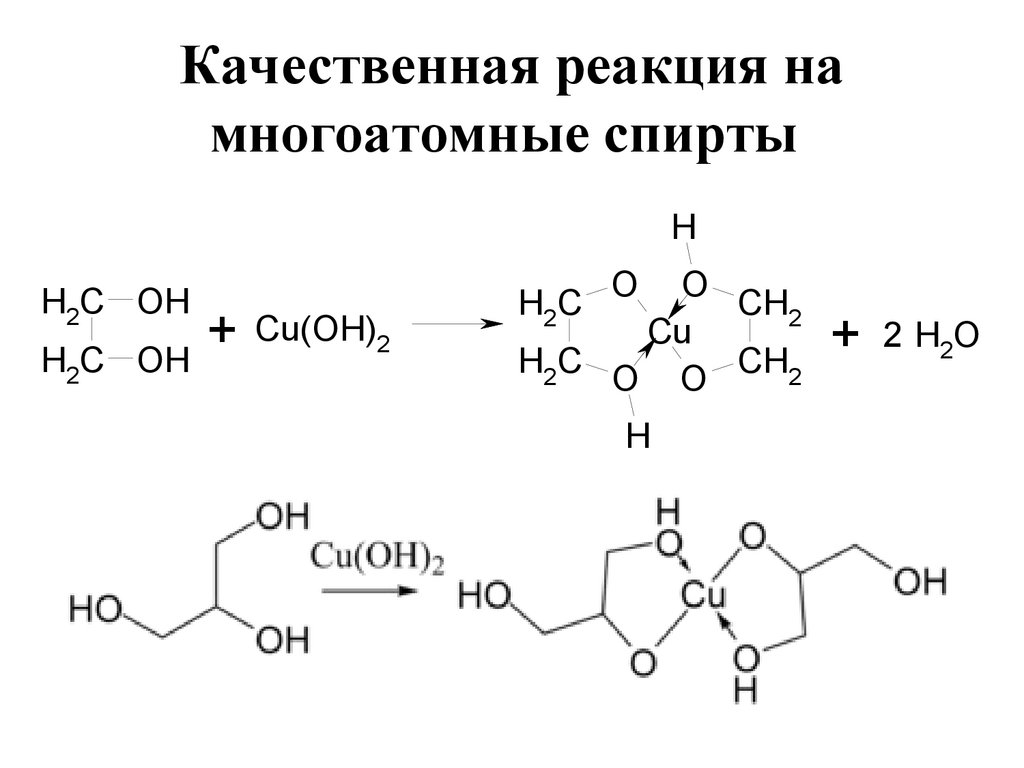
153. Качественная реакция на многоатомные спирты
HH2C OH
Cu(OH)2
+
H C OH
2
O
CH2
Cu
H2C
CH2
O O
H2C
O
H
+ 2 H2O
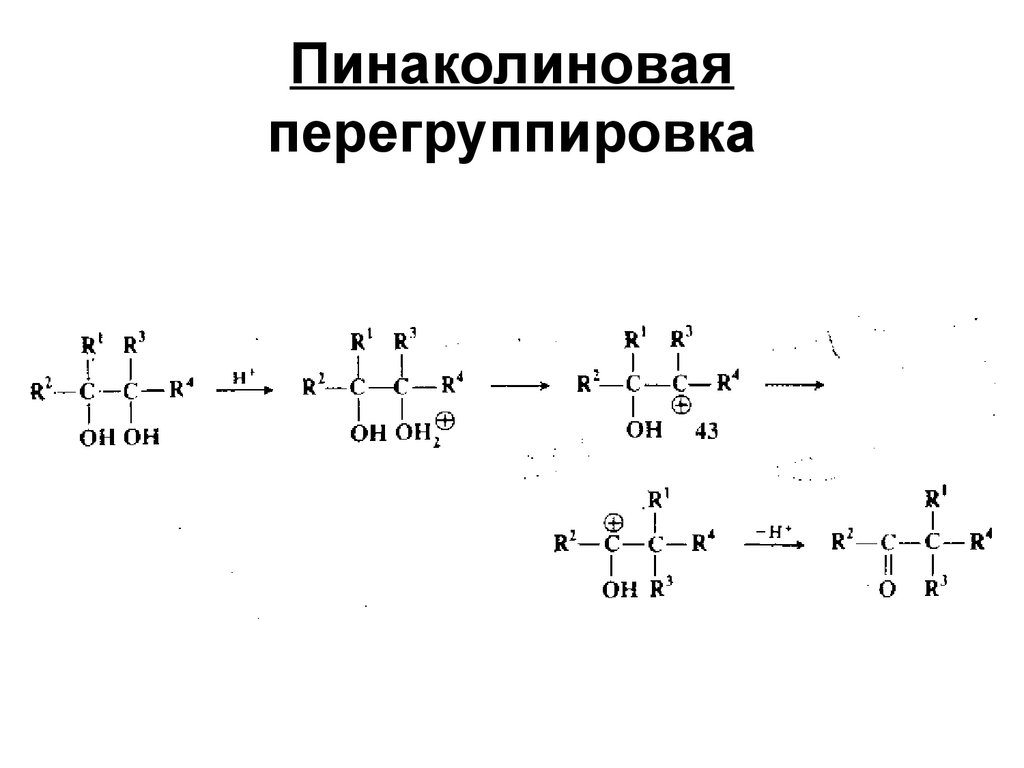
154. Пинаколиновая перегруппировка
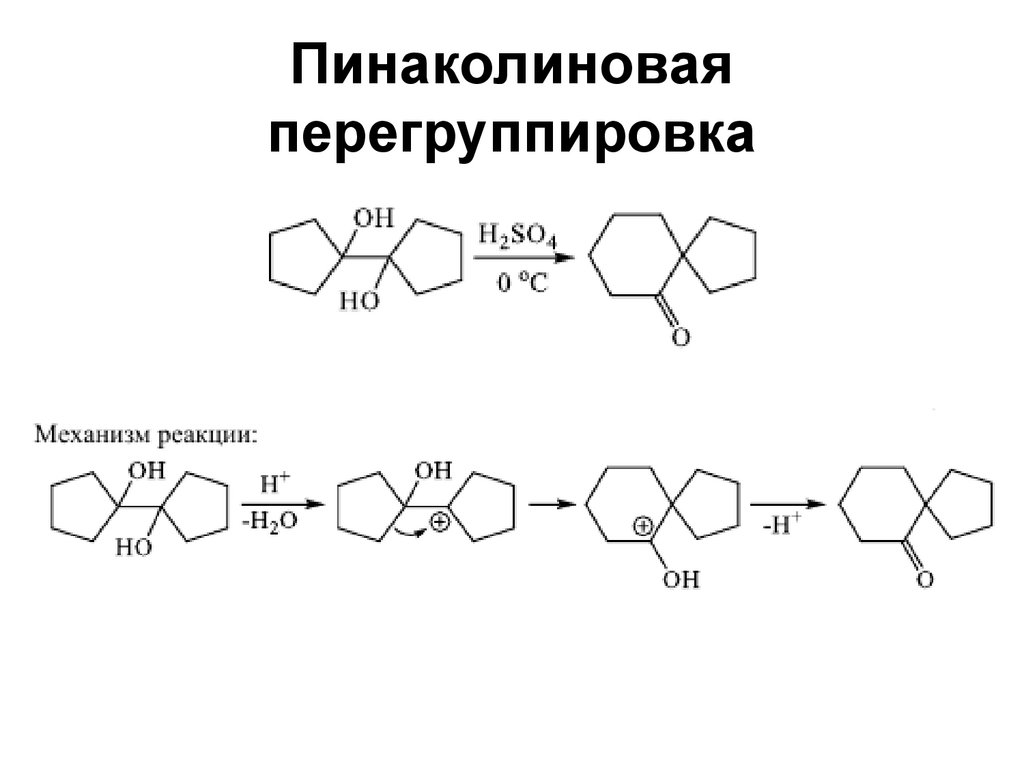
155. Пинаколиновая перегруппировка
156.
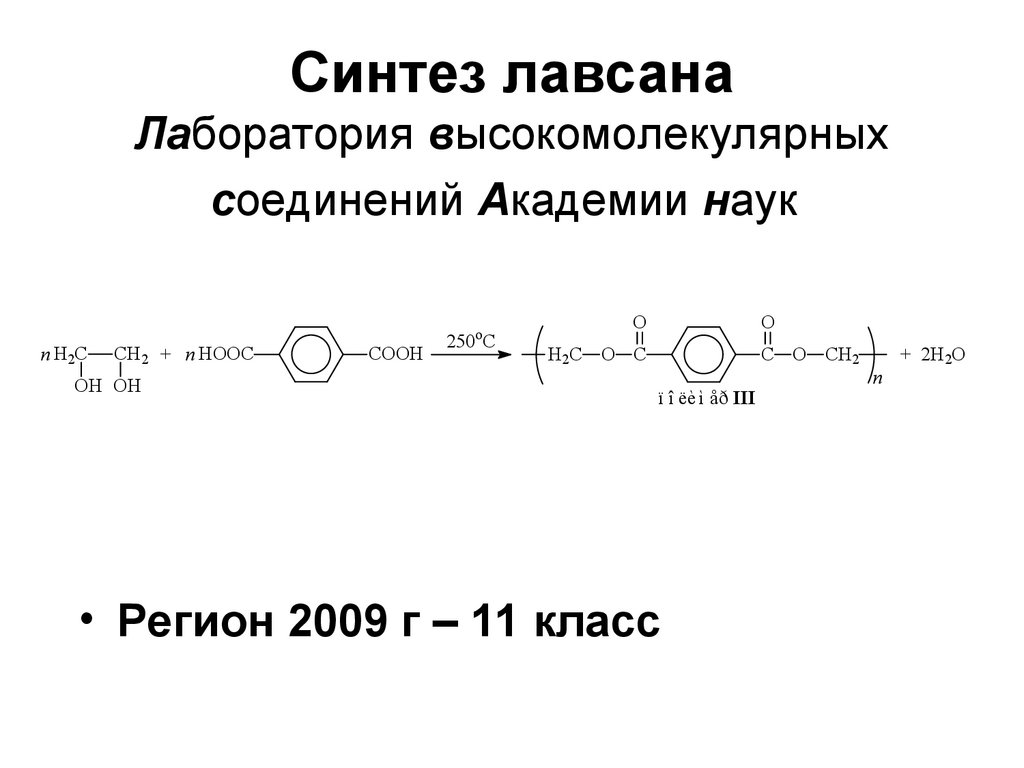
Окислительное расщепление157. Синтез лавсана Лаборатория высокомолекулярных соединений Академии наук
n H2CCH2 + n HOOC
OH OH
COOH
o
250 C
O
H2C
O
O C
C O CH2
ï î ëèì åð III
• Регион 2009 г – 11 класс
n
+ 2H2O
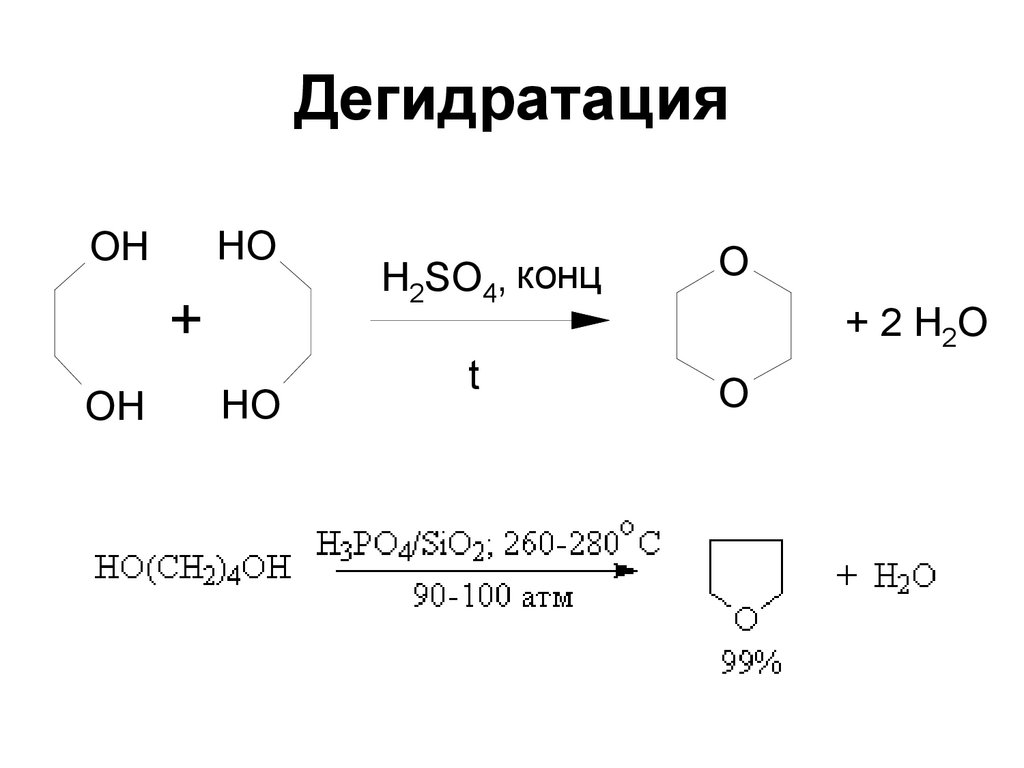
158. Дегидратация
HOOH
+
OH
HO
H2SO4, конц
O
t
O
+ 2 H2O
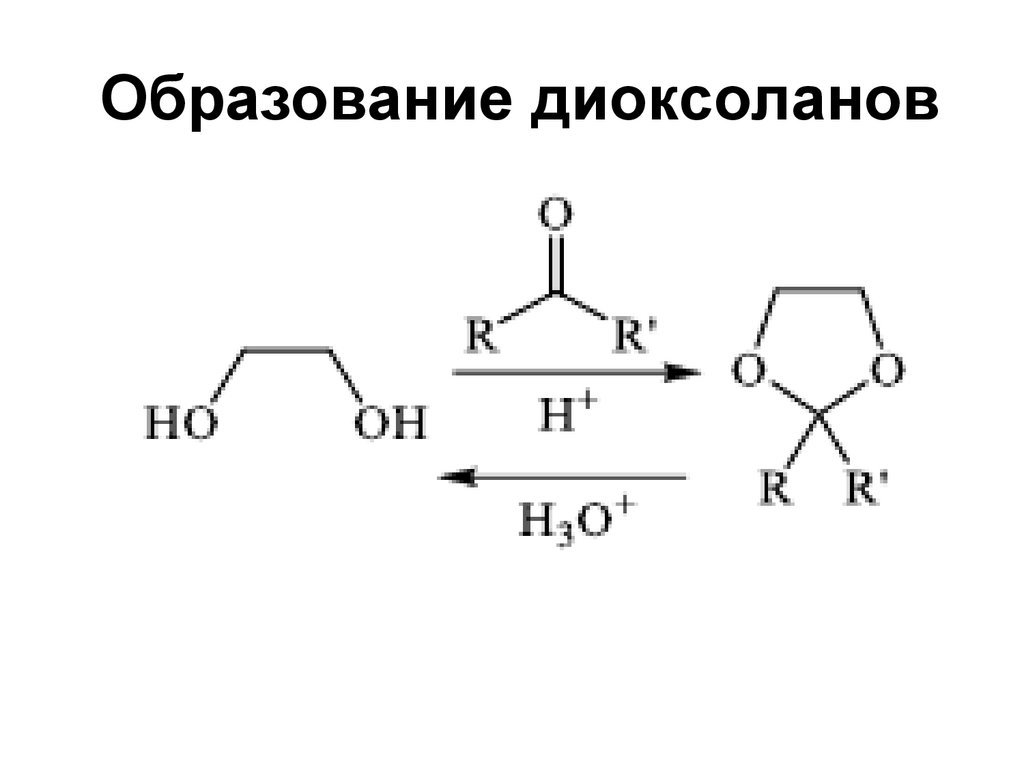
159. Образование диоксоланов
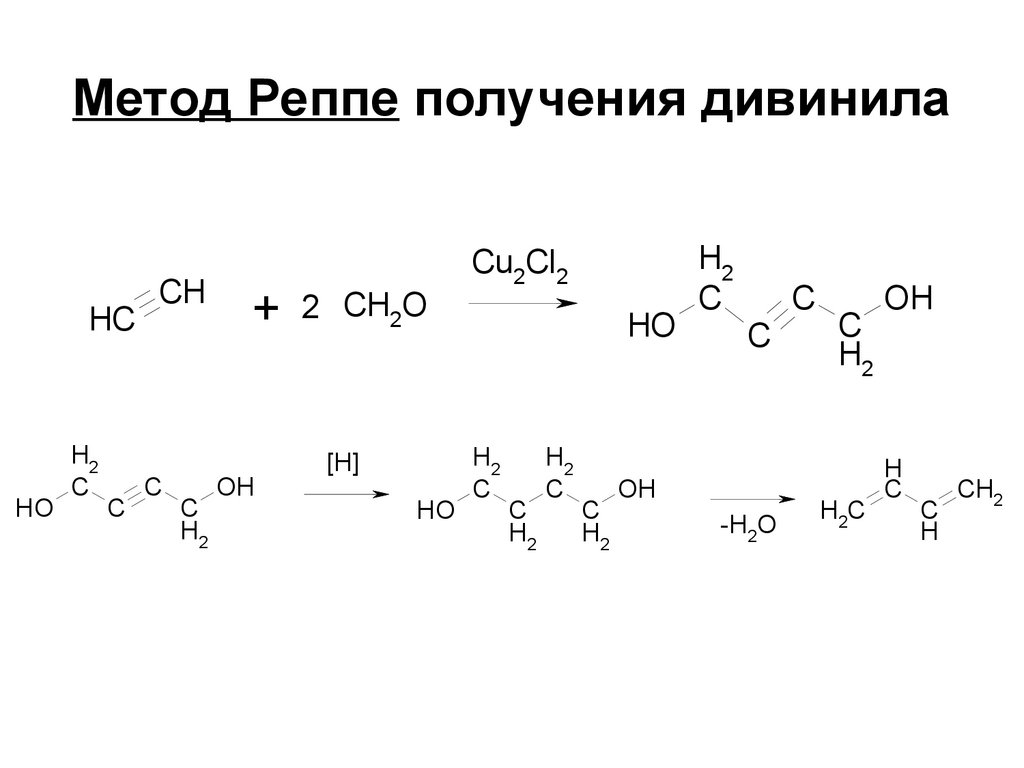
160. Метод Реппе получения дивинила
HCHO
H2
C
C
CH
C
C
H2
+ 2 CH2O
OH
[H]
HO
Cu2Cl2
HO
H2
C
C
H2
H2
C
C
H2
H2
C
C
OH
-H2O
C
C
H2
H2C
OH
H
C
C
H
CH2
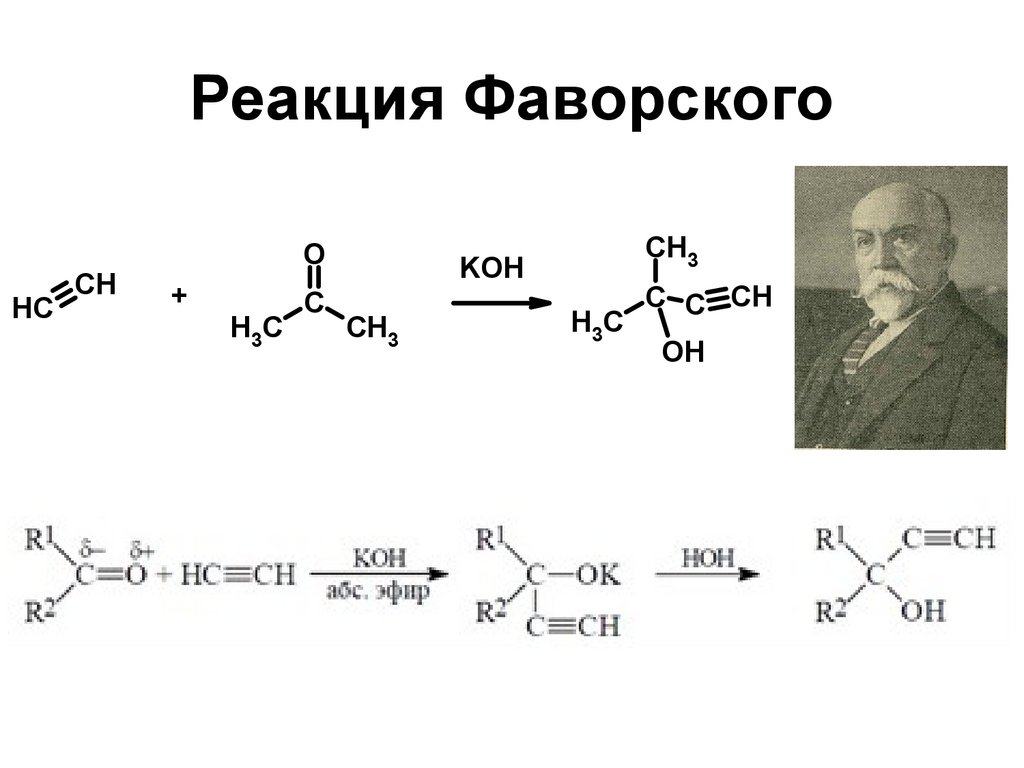
161. Реакция Фаворского
HCCH
O
+
H3C
C
CH3
KOH
CH3
H3C
C C CH
OH
161
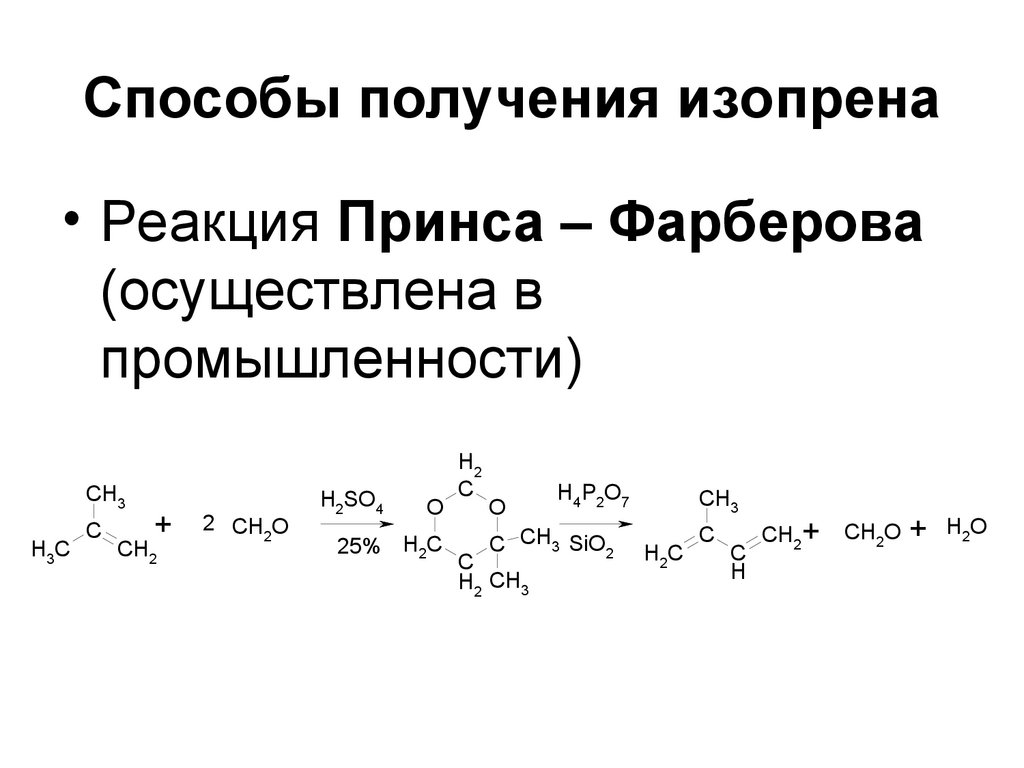
162. Способы получения изопрена
• Реакция Принса – Фарберова(осуществлена в
промышленности)
CH3
H3C
C
+
CH2
2 CH O
2
H2SO4
O
25% H2C
H2
C
O
H4P2O7
C CH3 SiO2
C
H2 CH3
CH3
H2C
C
C
H
CH2 +
CH2O + H2O
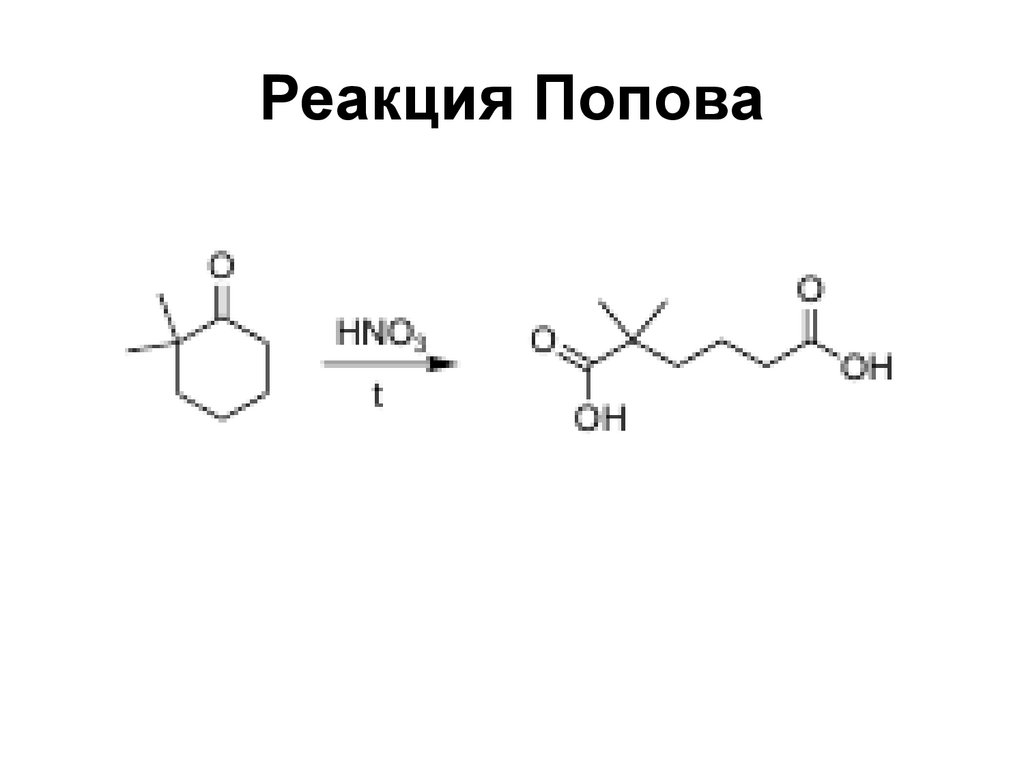
163. Реакция Попова
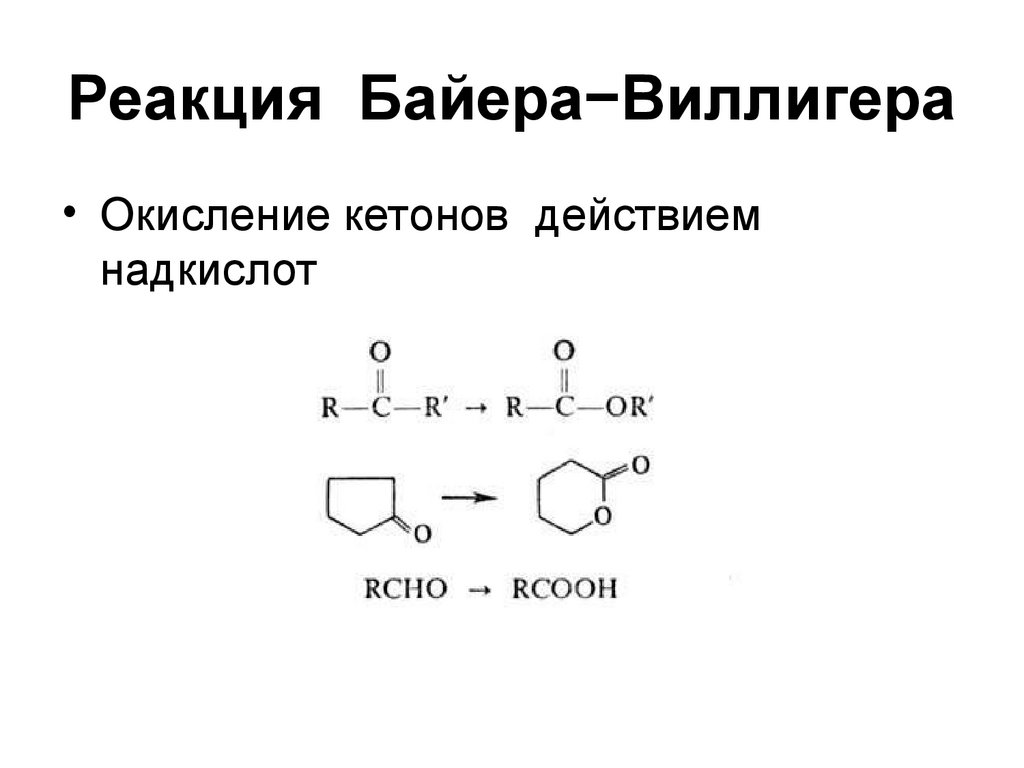
164. Реакция Байера−Виллигера
• Окисление кетонов действиемнадкислот
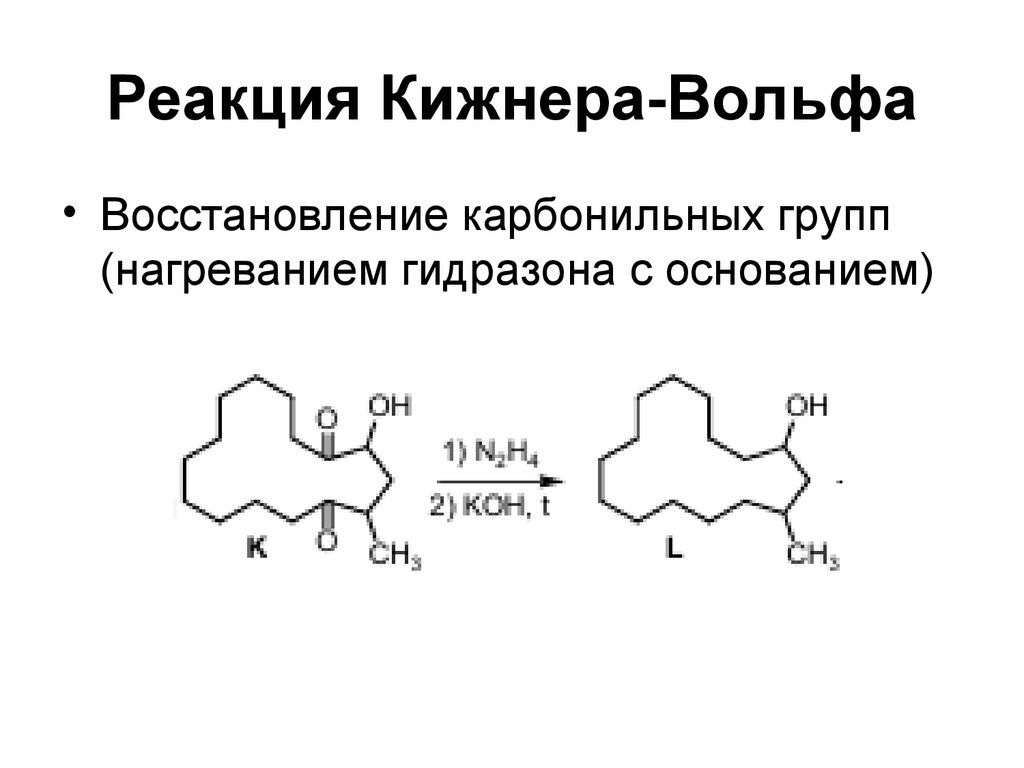
165. Реакция Кижнера-Вольфа
• Восстановление карбонильных групп(нагреванием гидразона с основанием)
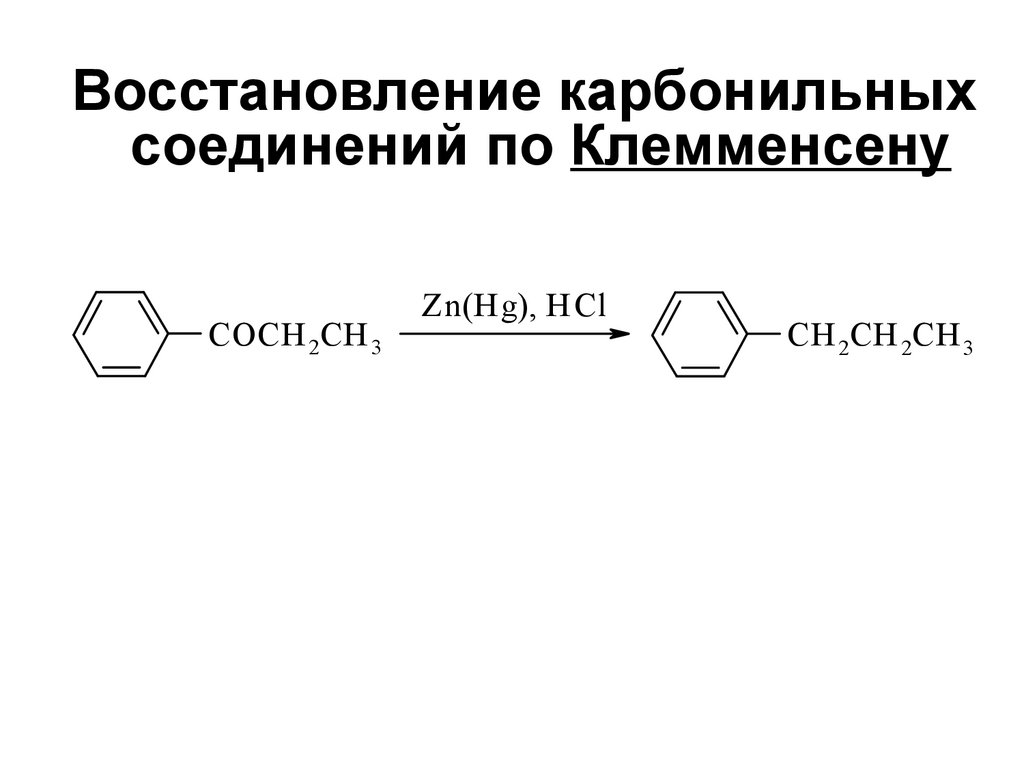
166.
Восстановление карбонильныхсоединений по Клемменсену
СOCH 2CH 3
Zn(H g), H Cl
СH 2CH 2CH 3
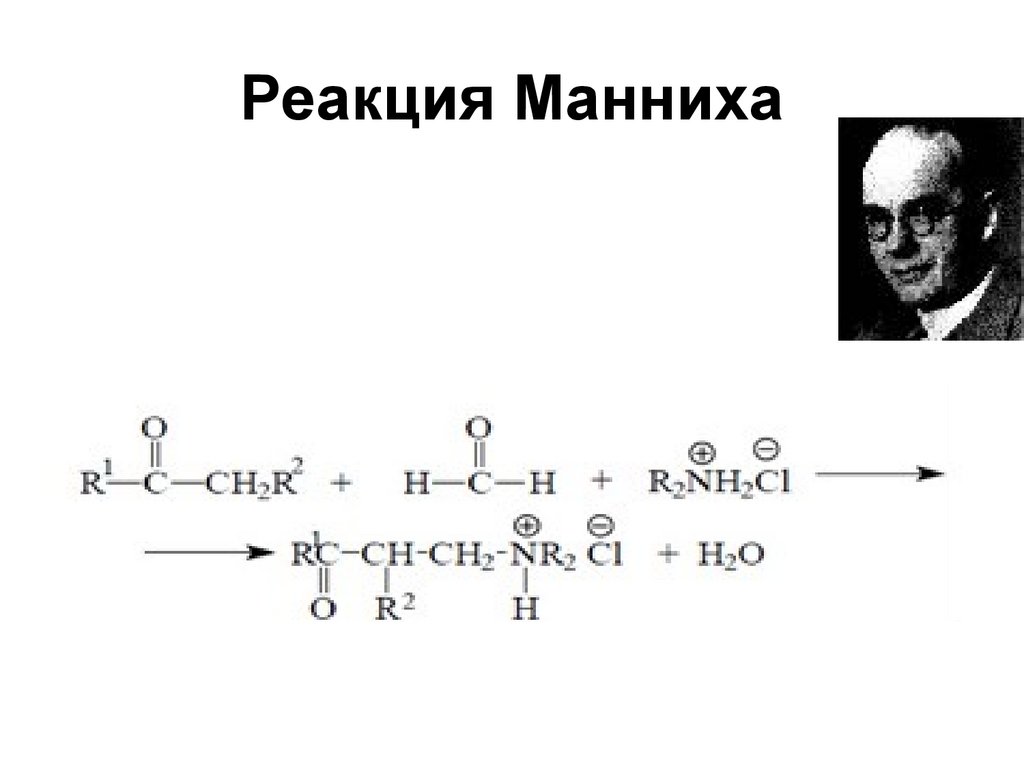
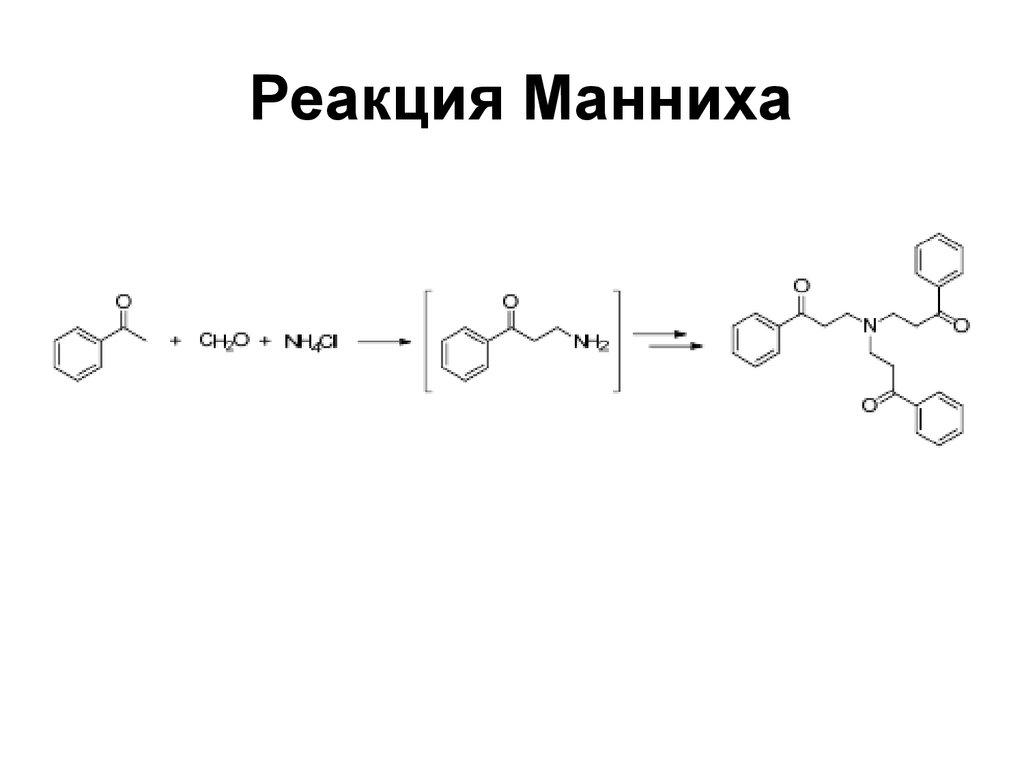
167. Реакция Манниха
167168. Реакция Манниха
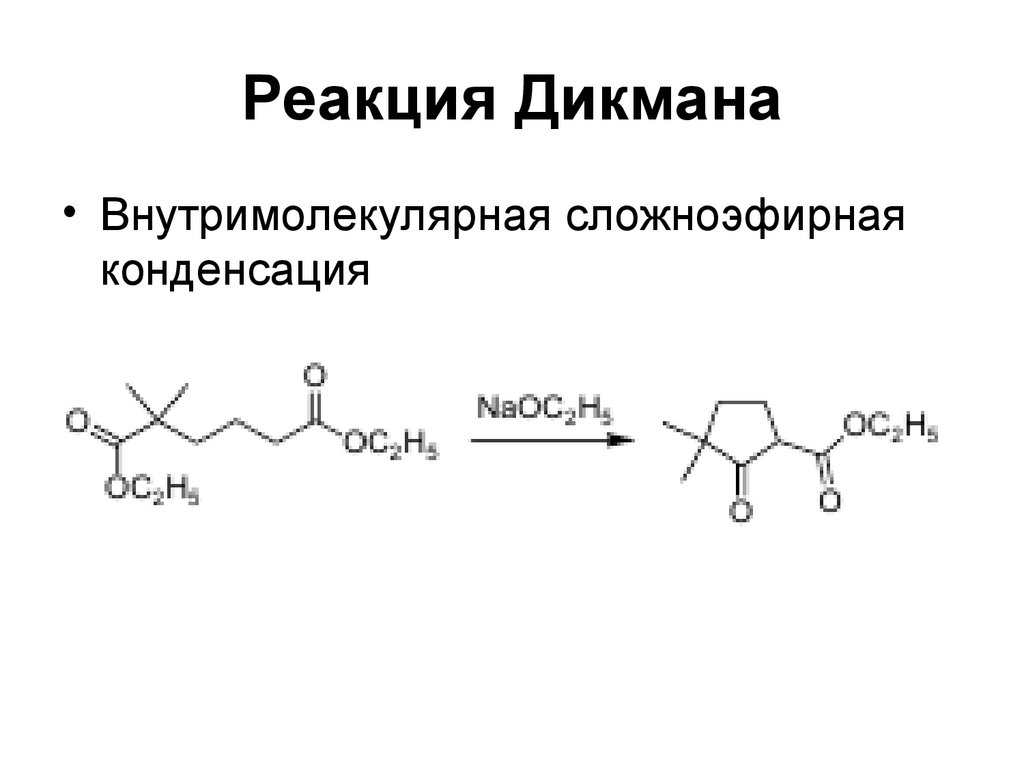
169. Реакция Дикмана
• Внутримолекулярная сложноэфирнаяконденсация
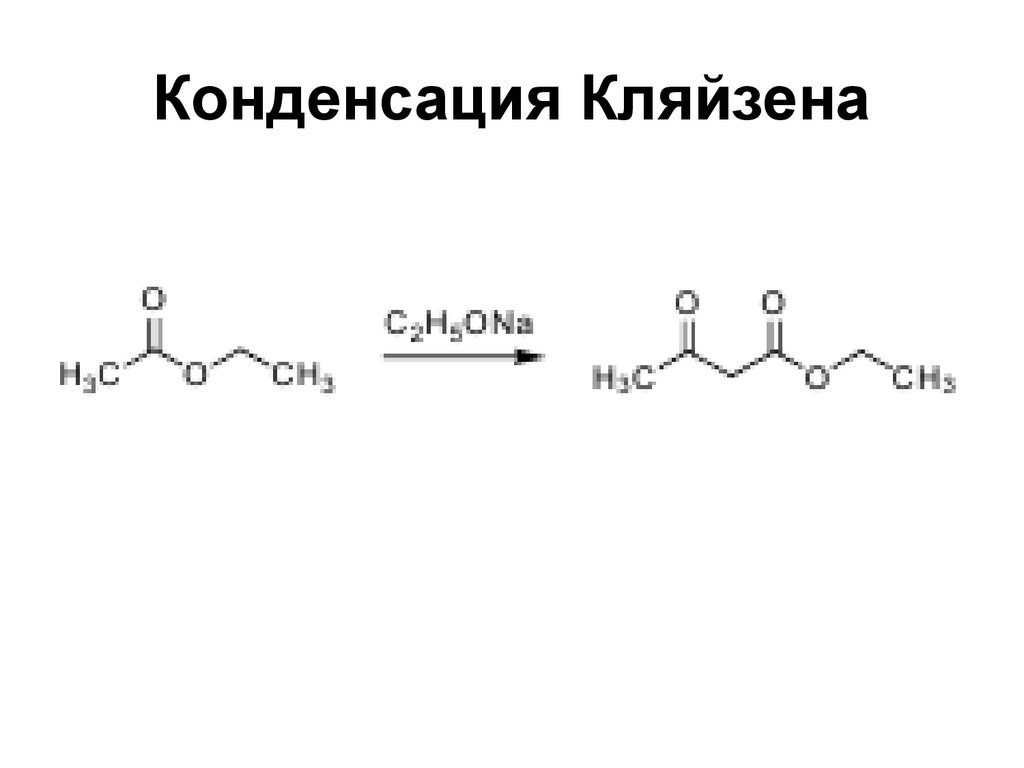
170. Конденсация Кляйзена
171. Реакция Реформатского
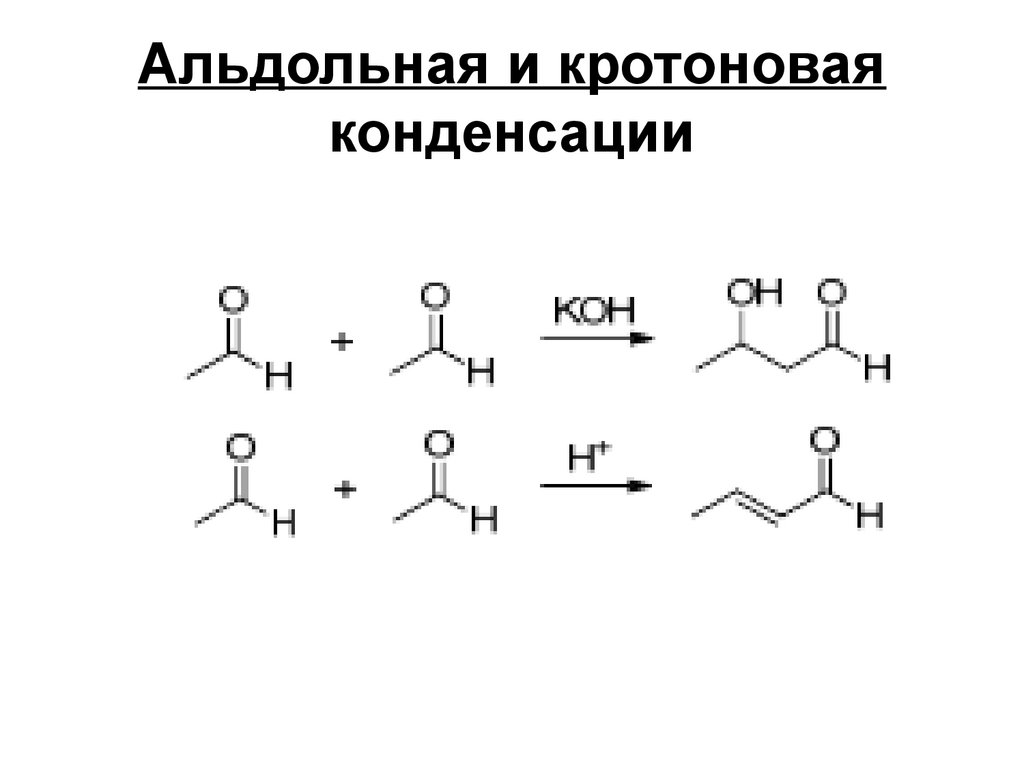
171172. Альдольная и кротоновая конденсации
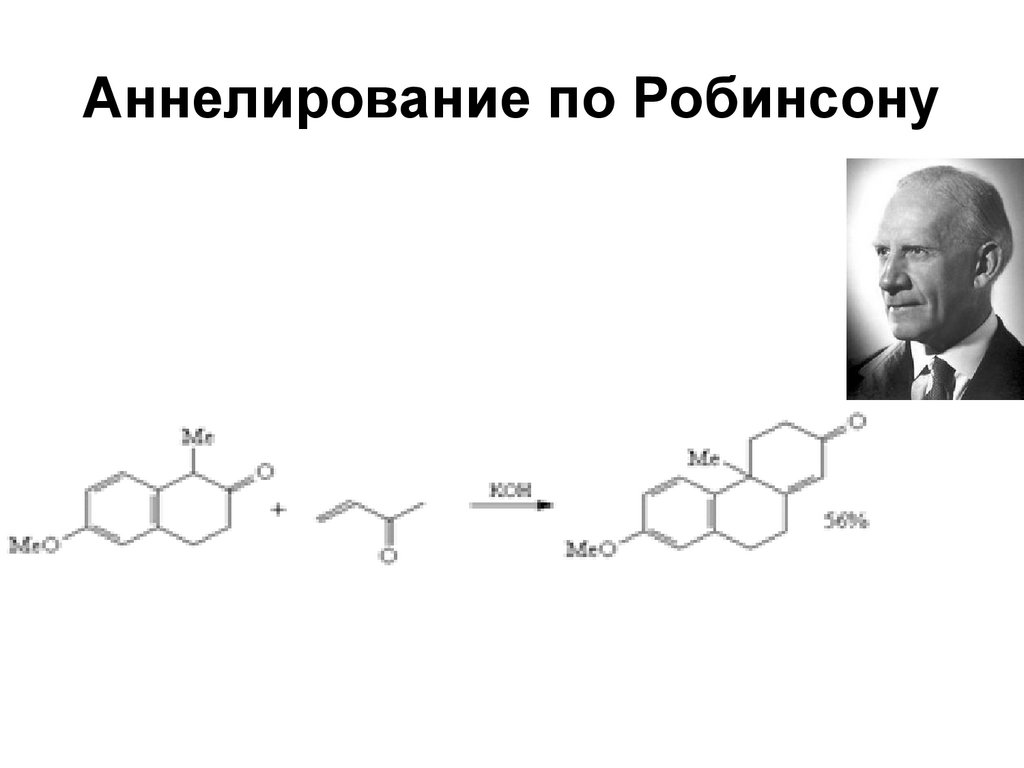
173. Аннелирование по Робинсону
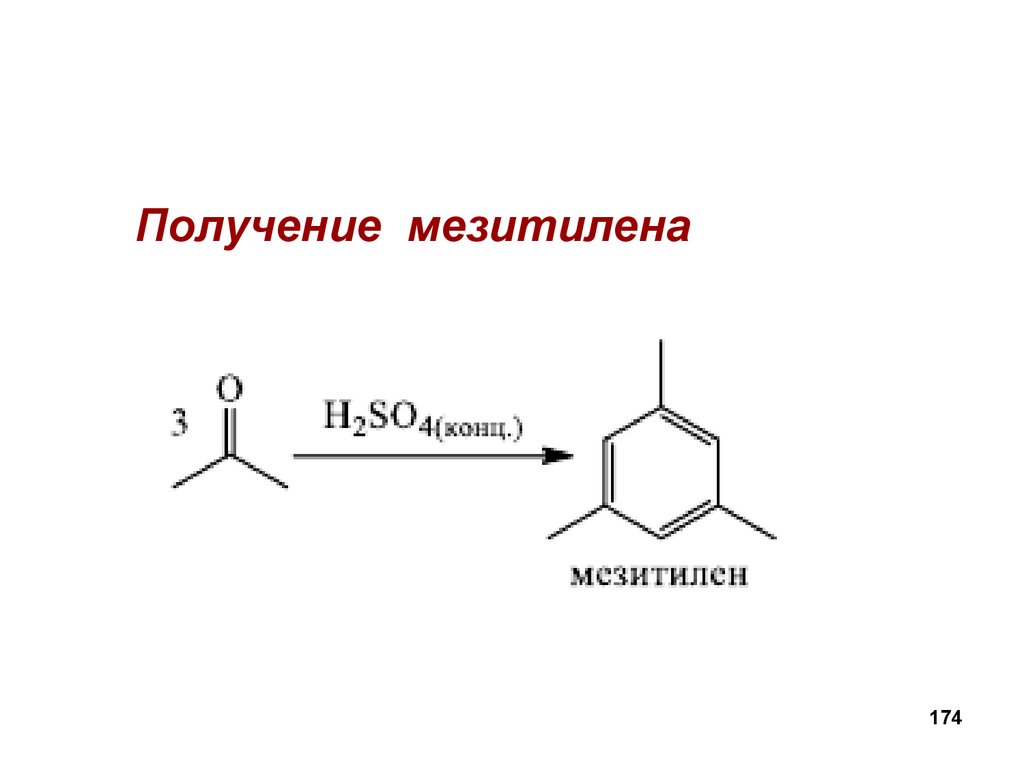
173174.
Получение мезитилена174
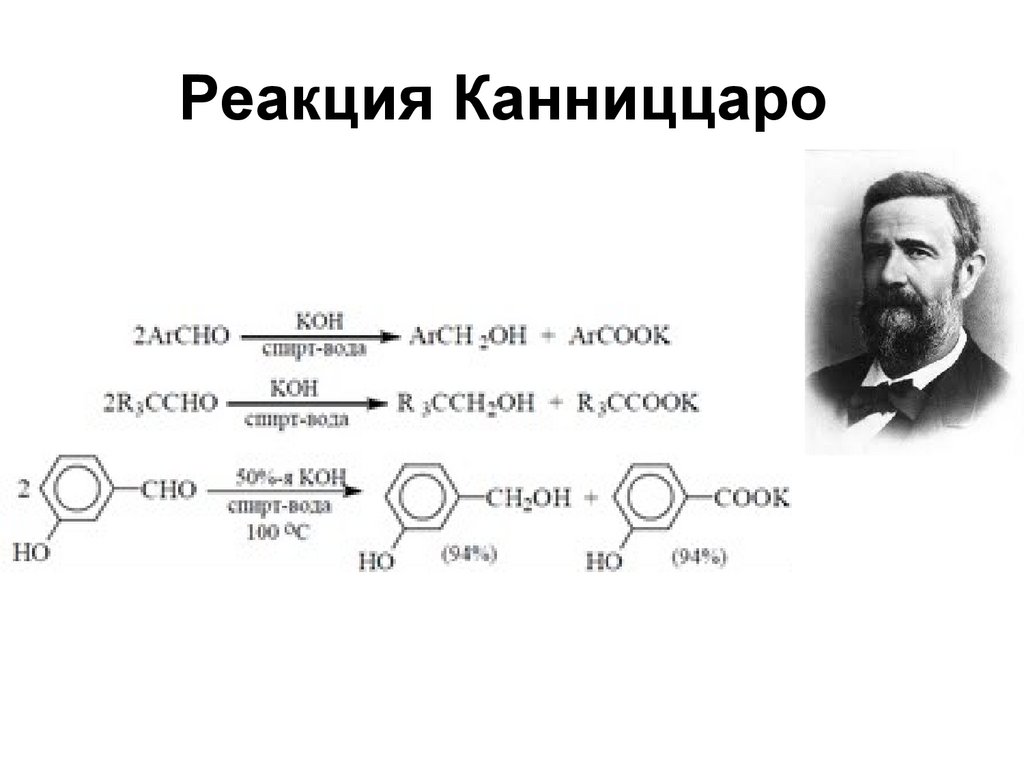
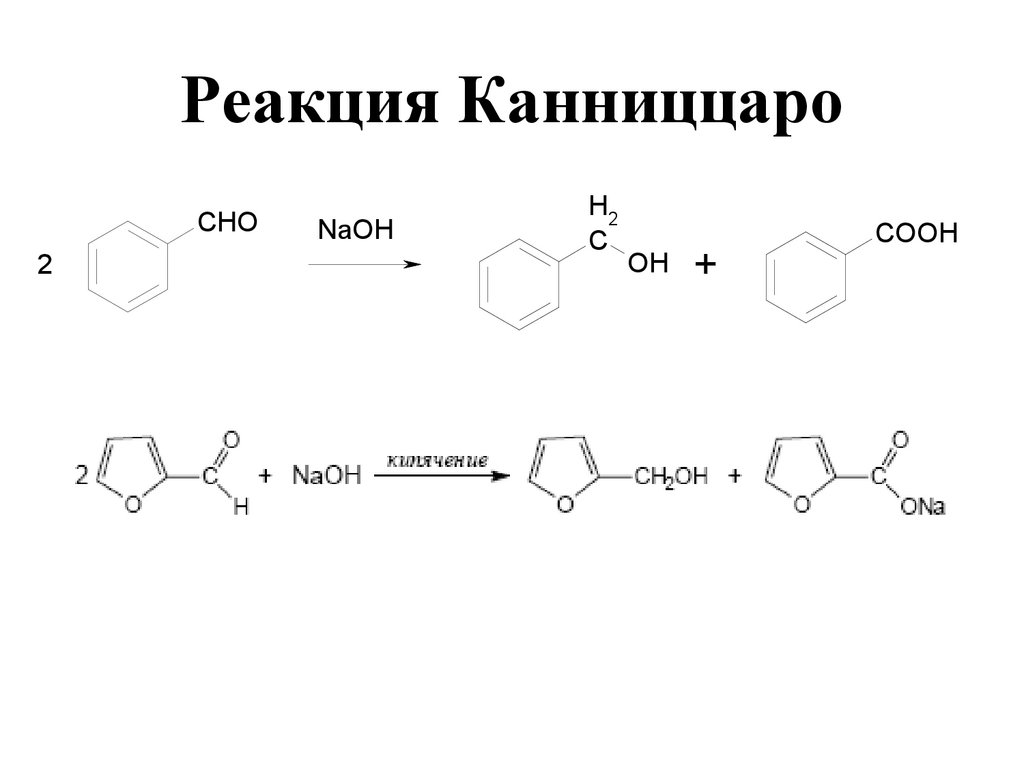
175. Реакция Канниццаро
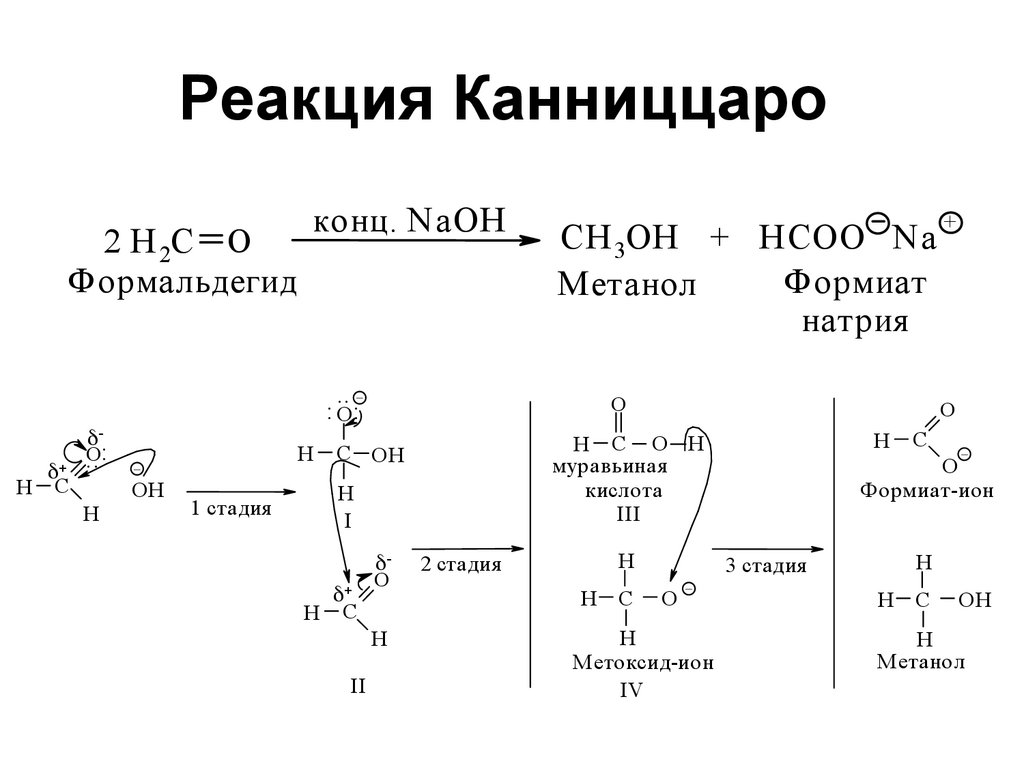
175176. Реакция Канниццаро
2 H 2C OФормальдегид
H
C
H
CH 3OH + H COO N a
Формиат
Метанол
натрия
.. _
: O:
O:
..
конц. N aOH
H
_
OH
1 cтадия
O
H
I
H C
II
O
H
O
H
H C O H
муравьиная
кислота
III
C OH
Н
2 cтадия
Н
С
+
О
_
Н
Метоксид-ион
IV
C
_
О
Формиат-ион
Н
3 cтадия
Н
С
ОН
Н
Метанол
177. Реакция Канниццаро
CHO2
NaOH
H2
C
OH
+
COOH
178.
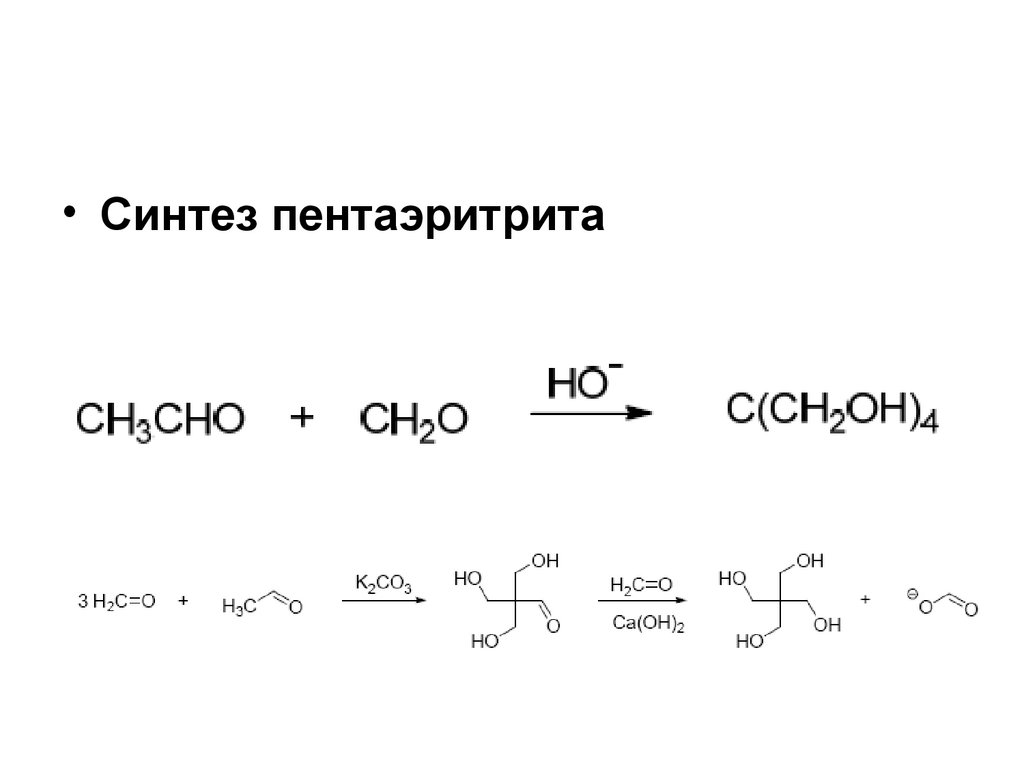
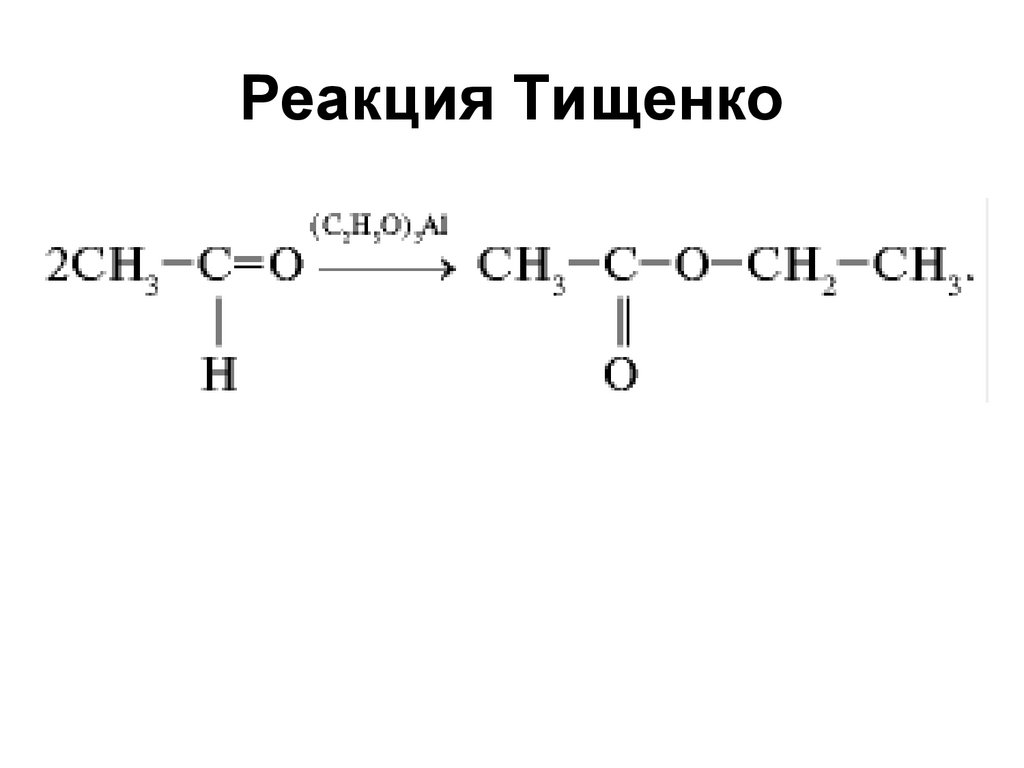
• Синтез пентаэритрита179. Реакция Тищенко
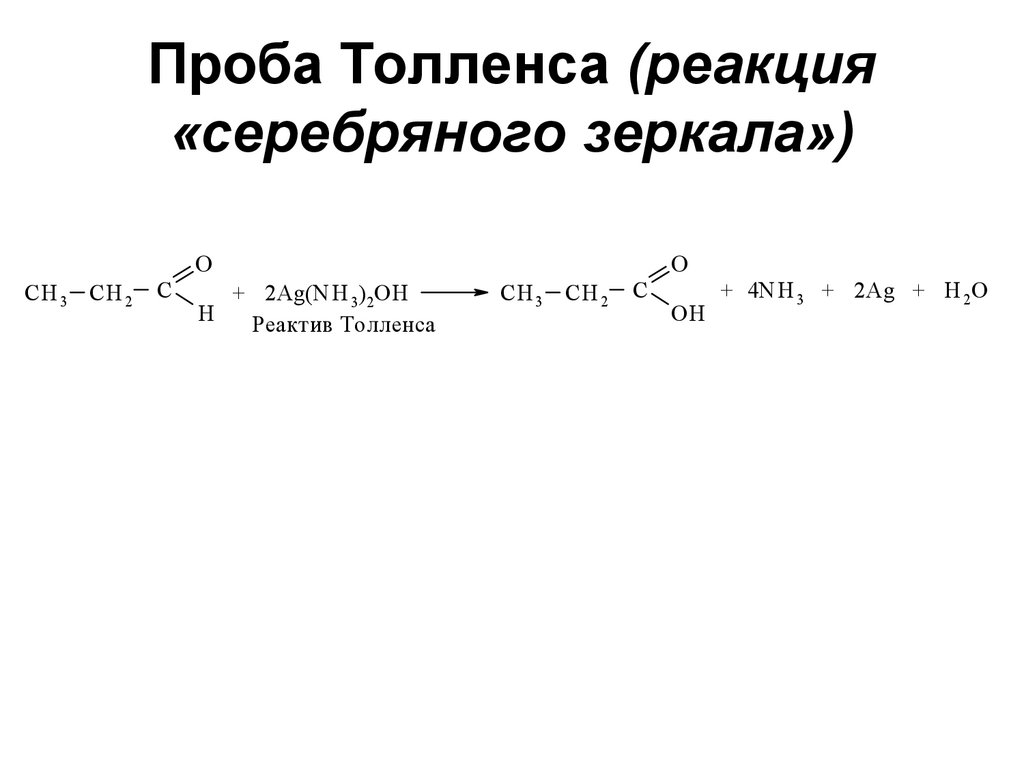
180. Проба Толленса (реакция «серебряного зеркала»)
CH 3 CH 2C
O
+ 2Ag(N H 3)2OH
H
Реактив Толленса
CH 3 CH 2
C
O
ОH
+ 4N H 3 + 2Ag + Н 2О
181. Реакция Виттига
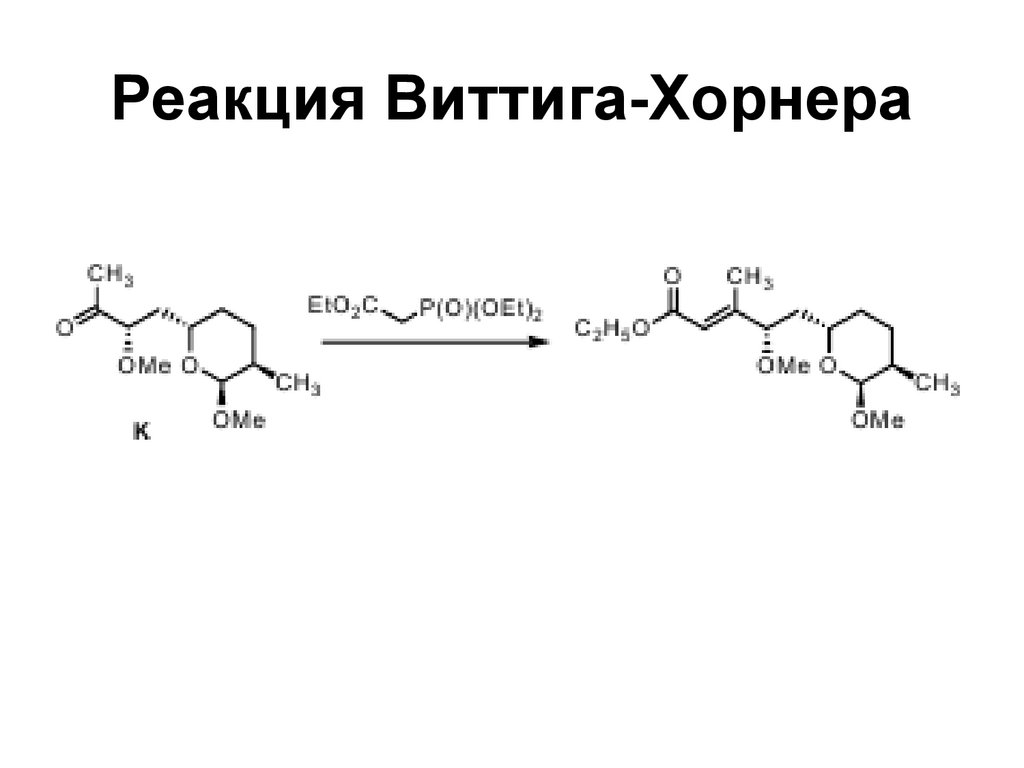
182. Реакция Виттига-Хорнера
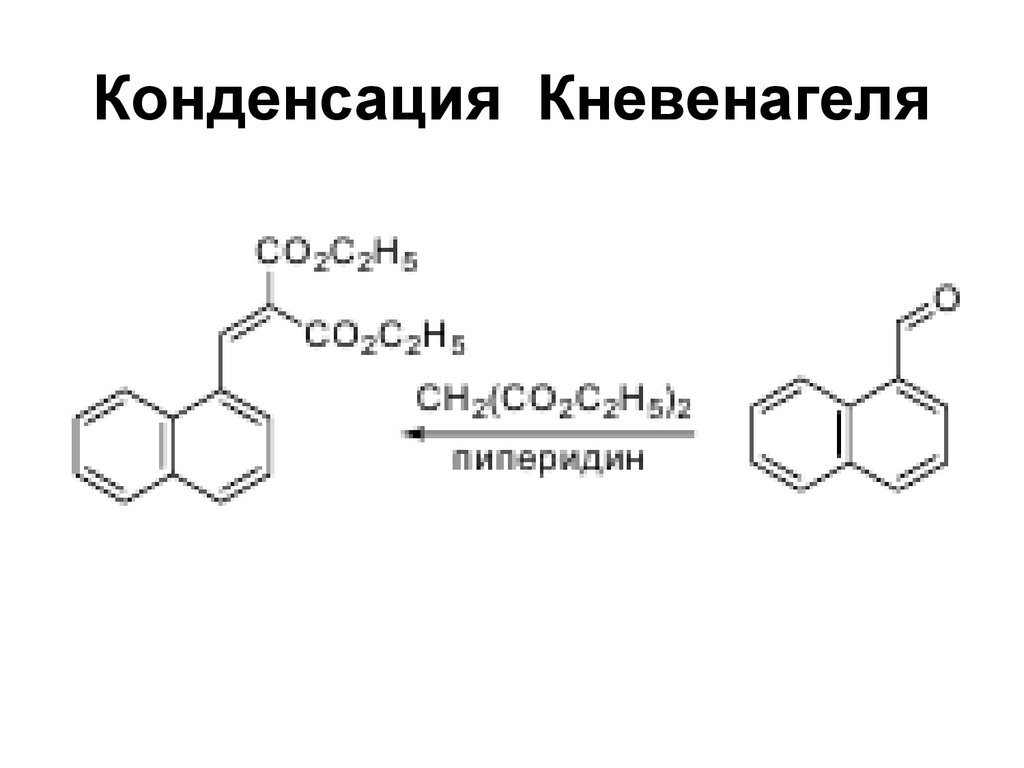
183. Конденсация Кневенагеля
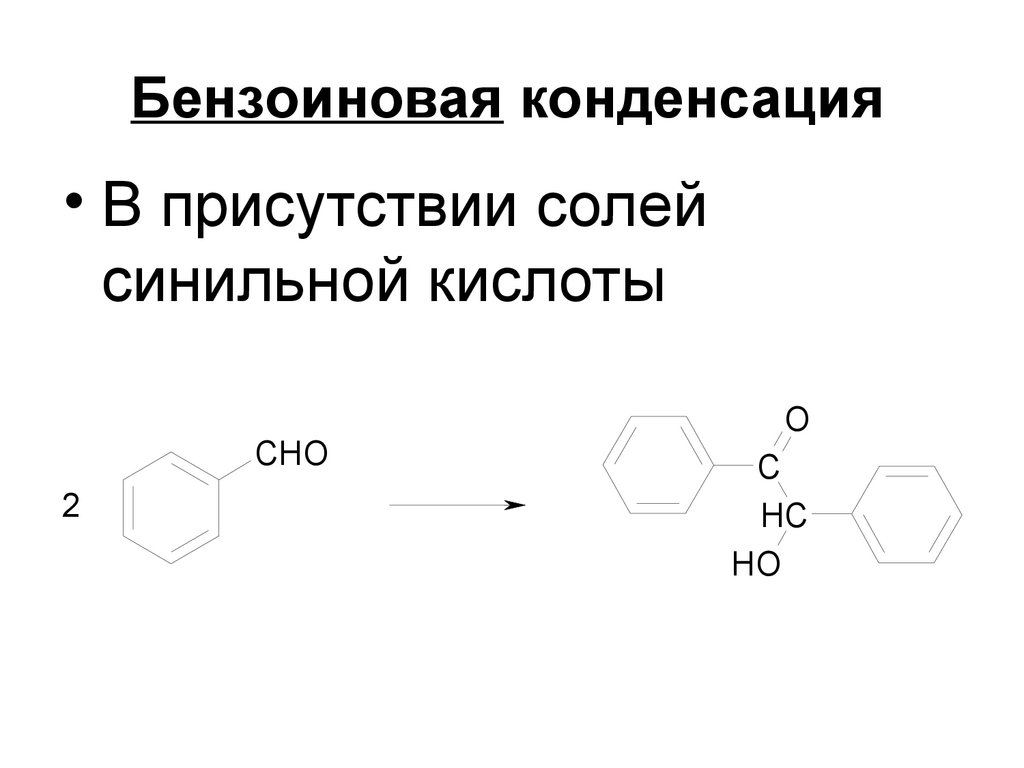
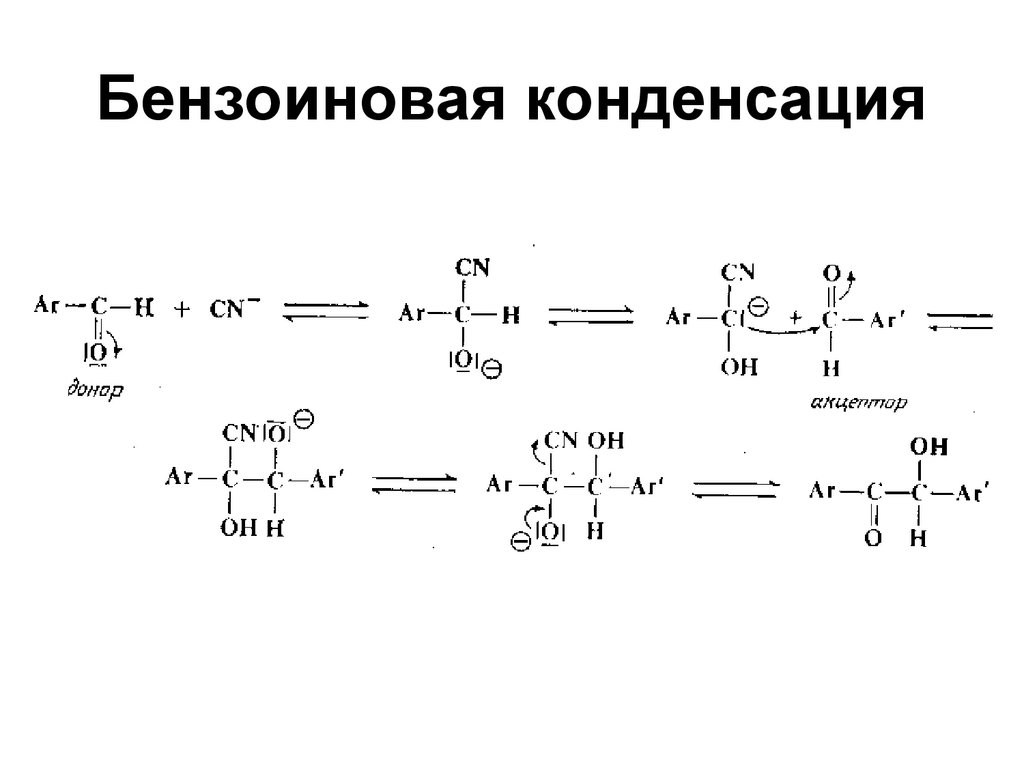
184. Бензоиновая конденсация
• В присутствии солейсинильной кислоты
CHO
2
O
C
HC
HO
185. Бензоиновая конденсация
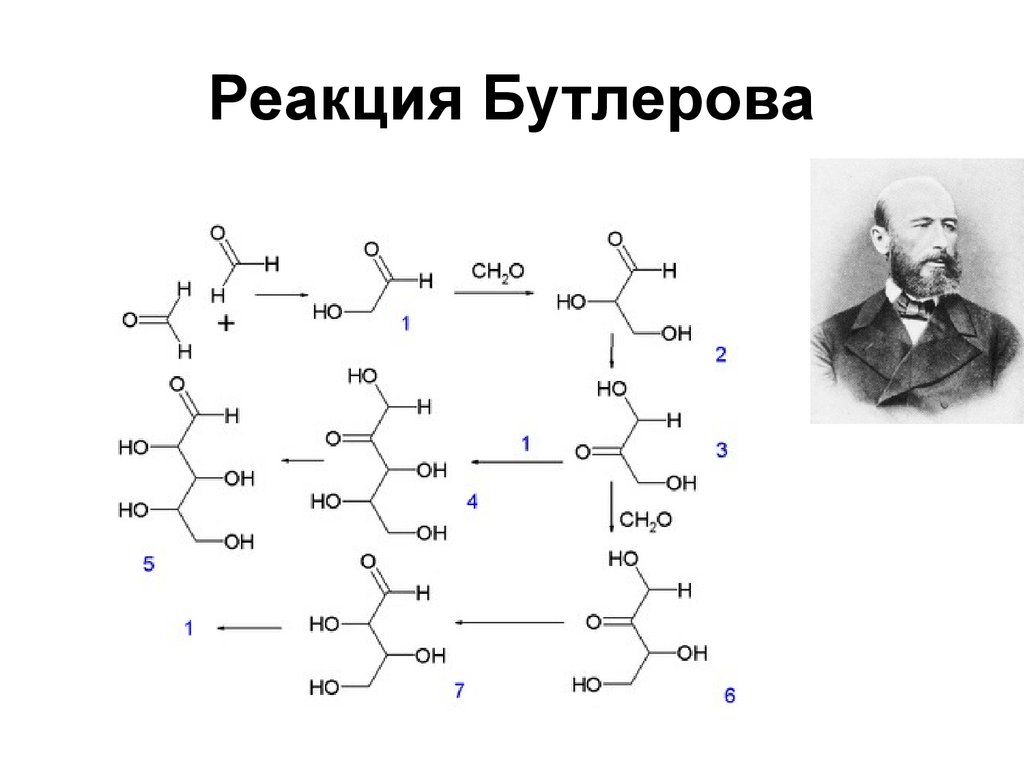
186. Синтез Бутлерова
Синтез сахаристого вещества изформальдегида.
6CH 2 O Ca(OH)
2 C6 H12 O6
Разработал теорию химического
строения органических веществ
БУТЛЕРОВ Александр
Михайлович
(15.09.1828-17.08.1886)
187. Реакция Бутлерова
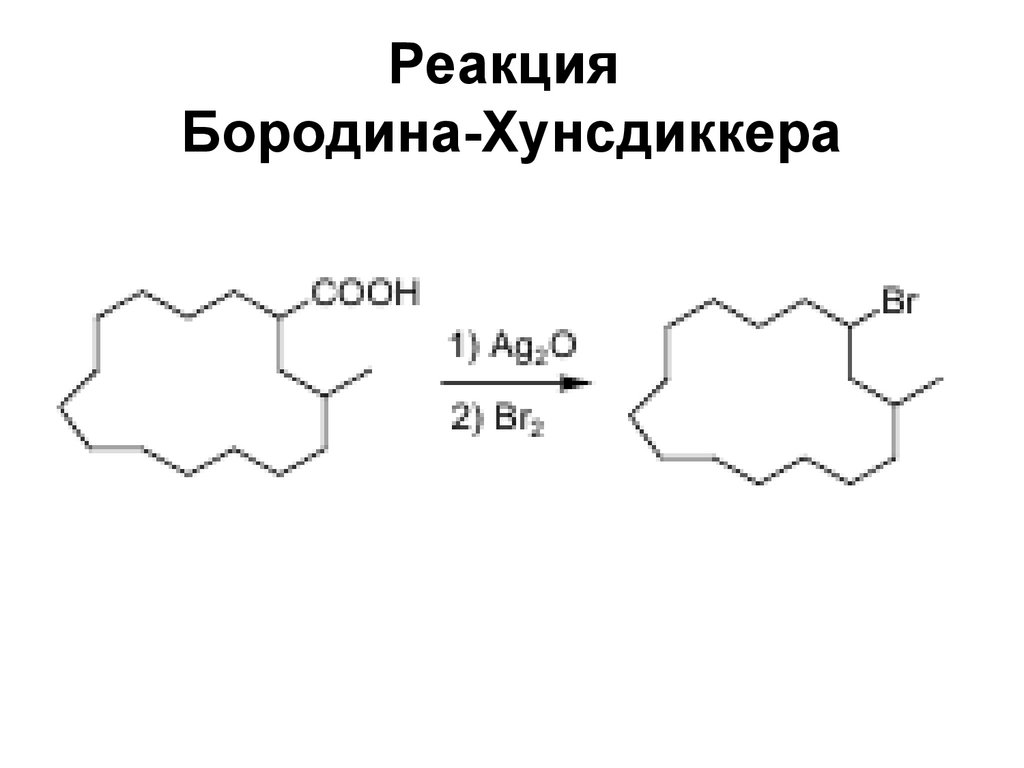
187188. Реакция Бородина-Хунсдиккера
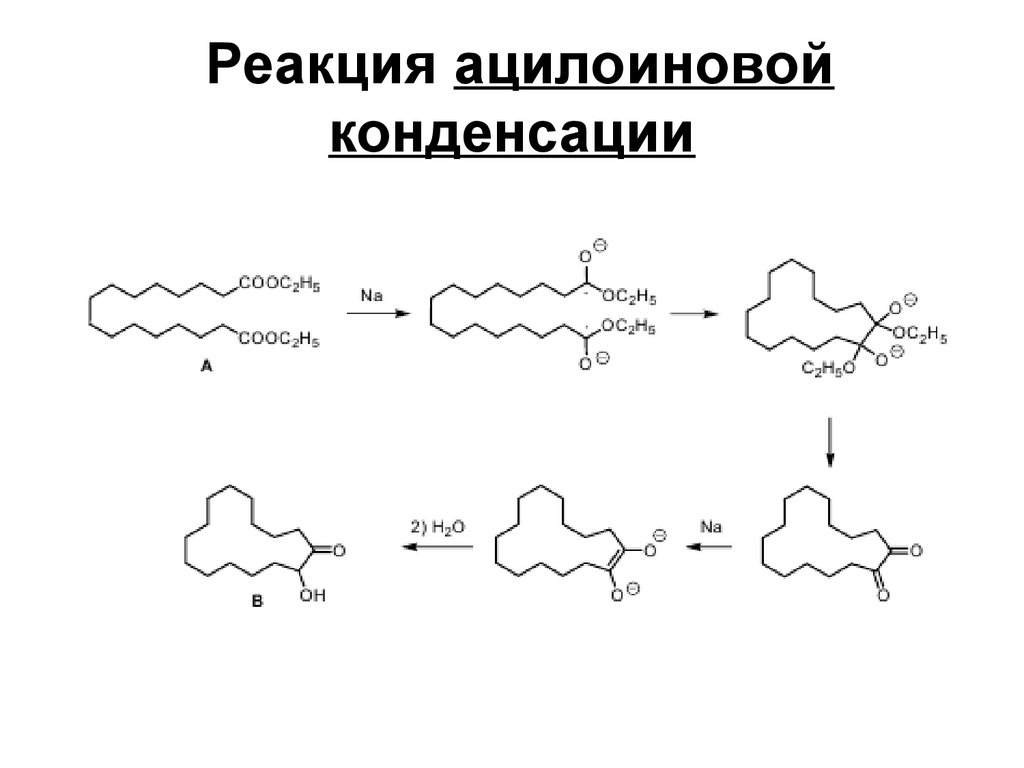
189. Реакция ацилоиновой конденсации
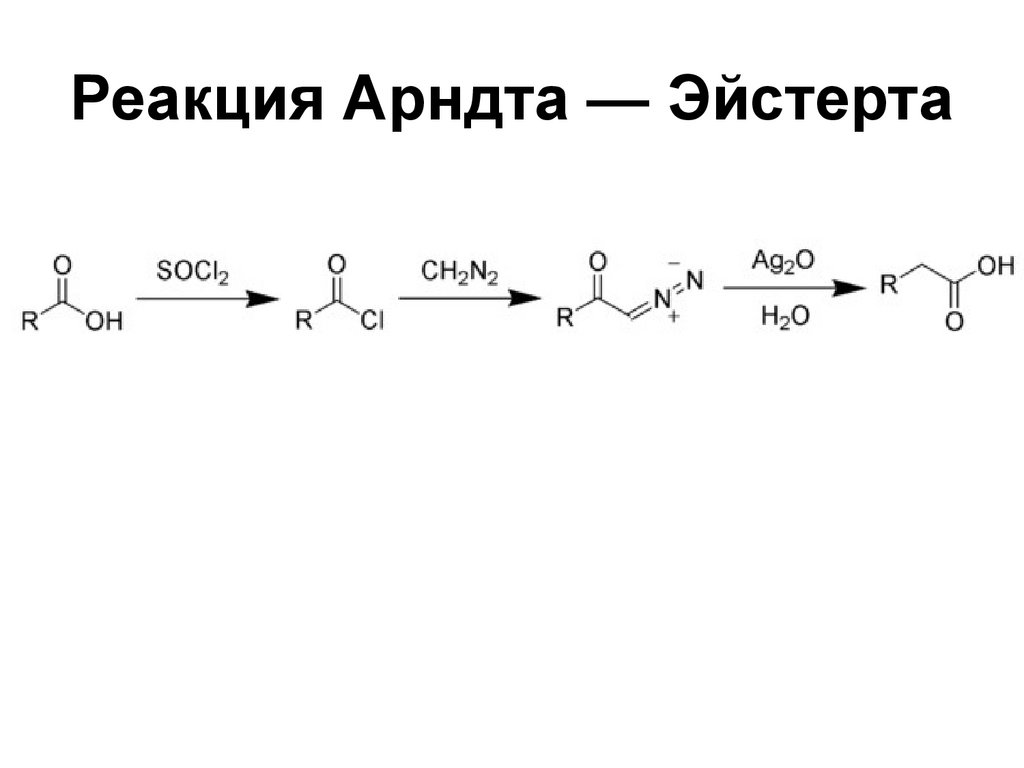
190. Реакция Арндта — Эйстерта
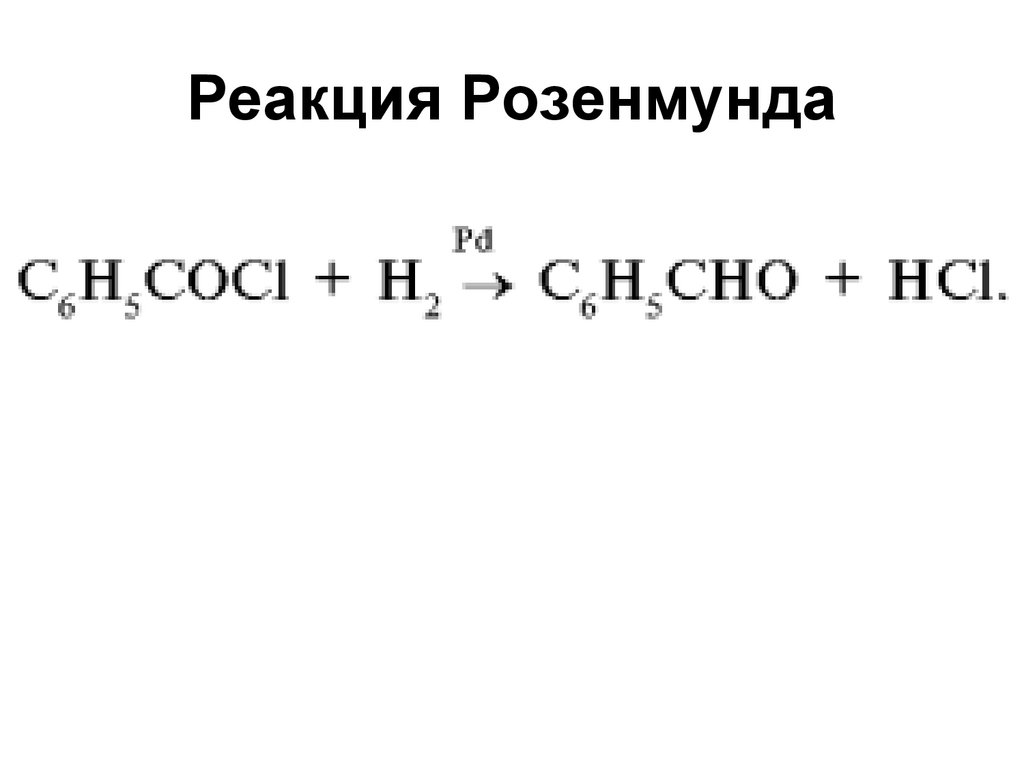
191. Реакция Розенмунда
192. Реакция Фокина
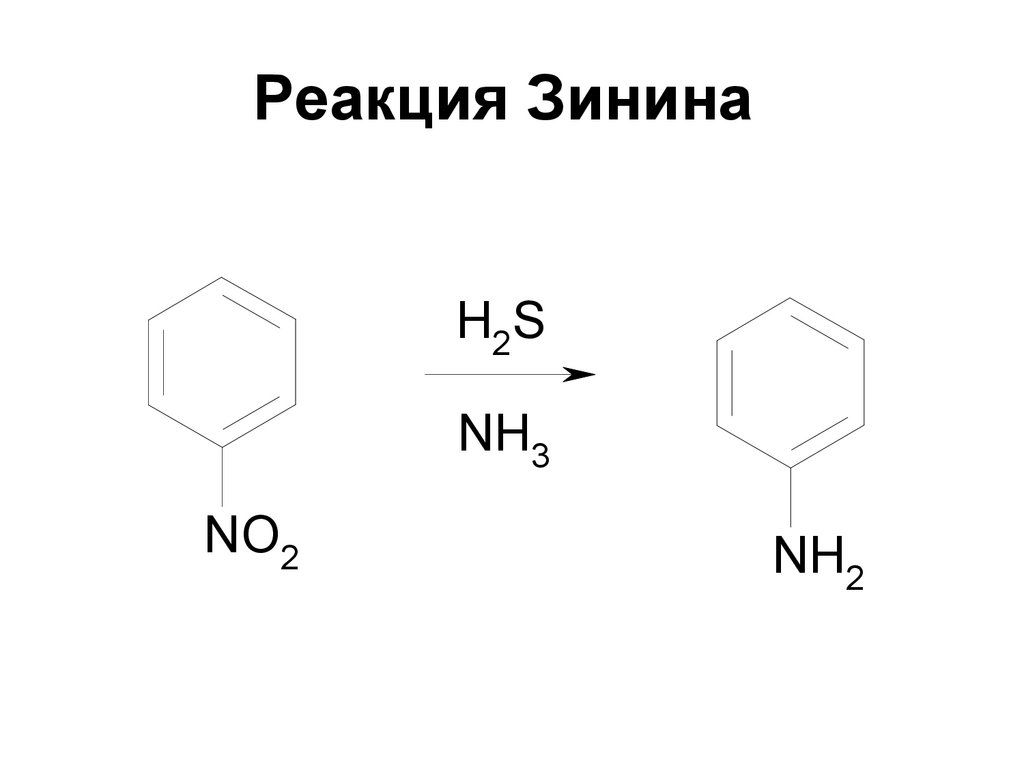
193. Реакция Зинина
R-NO2+ 6 H = R-NH2 + 2 H2OC6H5NO2 + 3 (NH4)2S →
C6H5NH2 + 6 NH3 + 3 S + 2 H2O
193
194. Реакция Зинина
H2SNH3
NO2
NH2




































 chemistry
chemistry








