Similar presentations:
Галогенопроизводные углеводородов
1. ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Галогенопроизводныеуглеводородов
Классификация
1. От природы галогена:
Различают фтористые, хлористые,
бромистые, иодистые
галогенорпроизводные.
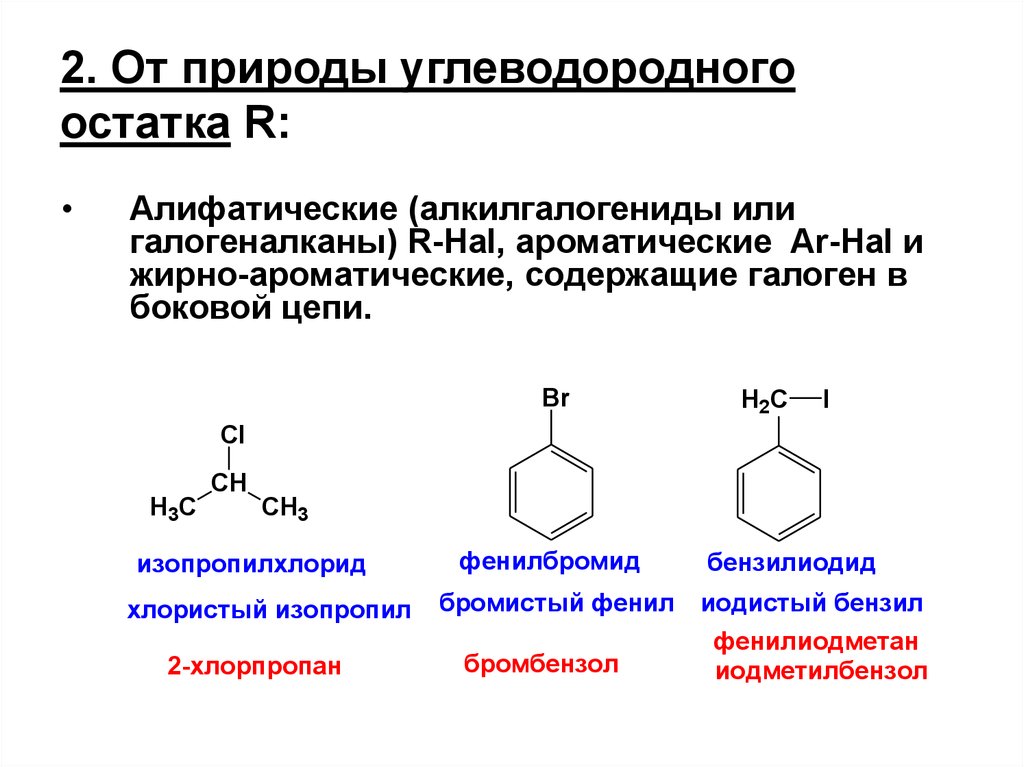
2. 2. От природы углеводородного остатка R:
Алифатические (алкилгалогениды или
галогеналканы) R-Hal, ароматические Ar-Hal и
жирно-ароматические, содержащие галоген в
боковой цепи.
Br
H2C
I
Cl
H3C
CH
CH3
изопропилхлорид
хлористый изопропил
2-хлорпропан
фенилбромид
бензилиодид
бромистый фенил иодистый бензил
бромбензол
фенилиодметан
иодметилбензол
3. 3. По характеру С в sp3-гибридном состоянии, с которым связан галоген:
Первичные – R-СН2- Hal,
вторичные (R)2СН- Hal,
третичные (R)3С- Hal.
4. Номенклатура
Радикально-функциональныеназвания: строятся путем
прибавления названия галогена в
форме прилагательного перед
названием R, или после него с
окончанием –ид.
По ИЮПАК галогены перечисляются
в префиксной части названия .
5.
HC
C Cl
H2
аллилхлорид
H2C
хлористый аллил
3-хлорпропен-1
первичный
H2C
Cl
I
H3C
C
CH3
CH3
трет-бутилхлорид
бензилиодид
хлористый трет-бутил
иодистый бензил 2-метил-2-хлорпропан
фенилиодметан
иодметилбензол
первичный
третичный
6. Изомерия
• Изомерия обусловлена изомериейуглеродного скелета и положением
галогена в цепи.
• Пространственная изомерия связана с
присутствием хирального углерода
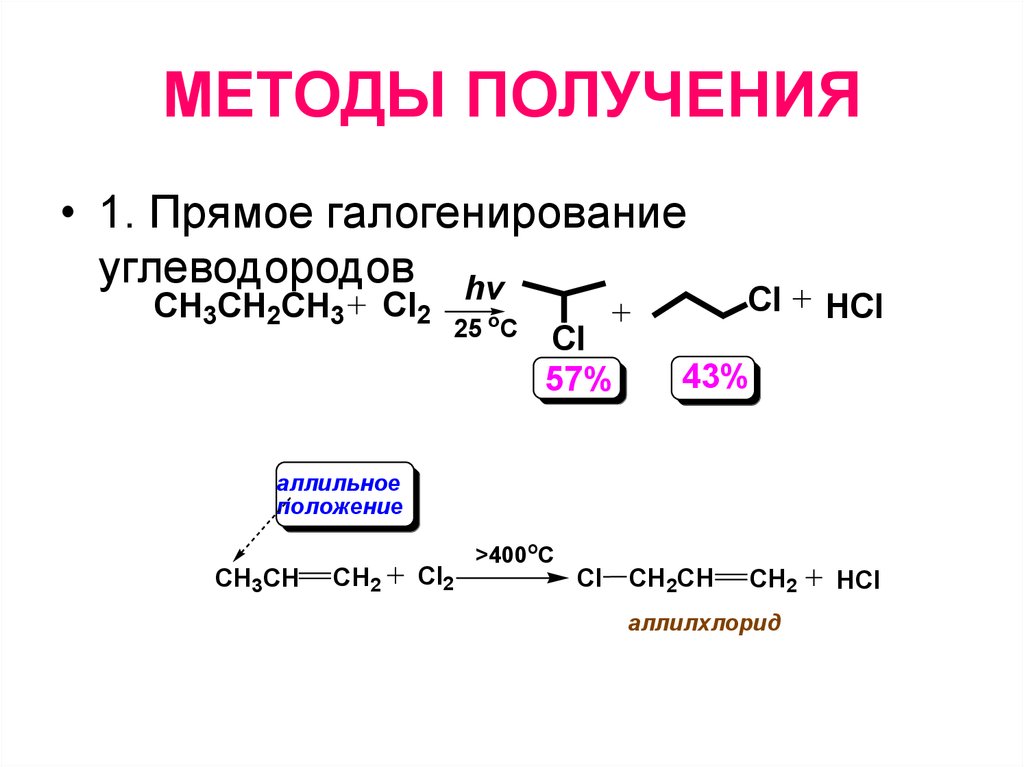
7. МЕТОДЫ ПОЛУЧЕНИЯ
• 1. Прямое галогенированиеуглеводородов hv
CH3CH2CH3
Cl2
о
25 С
Cl
57%
Cl
HCl
43%
аллильное
положение
CH3CH
CH2
Cl2
>400oC
Cl
CH2CH
CH2
аллилхлорид
HCl
8.
Brv
h
Br 2,
SR
Br
2, Fe
B
SE
HBr
r
Br
HBr
3
Br
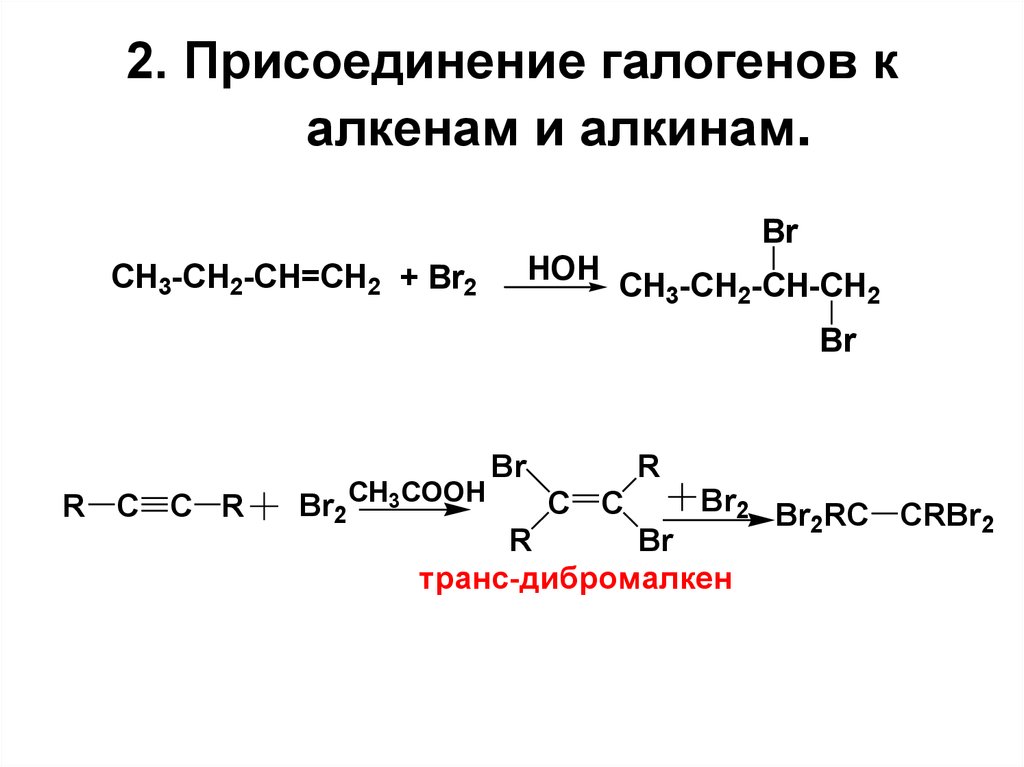
9. 2. Присоединение галогенов к алкенам и алкинам.
BrHOH
CH3-CH2-CH=CH2 + Br2
CH3-CH2-CH-CH2
Br
R C C R
Br2CH3COOH
Br
R
C C
Br2 Br RC CRBr
2
2
R
Br
транс-дибромалкен
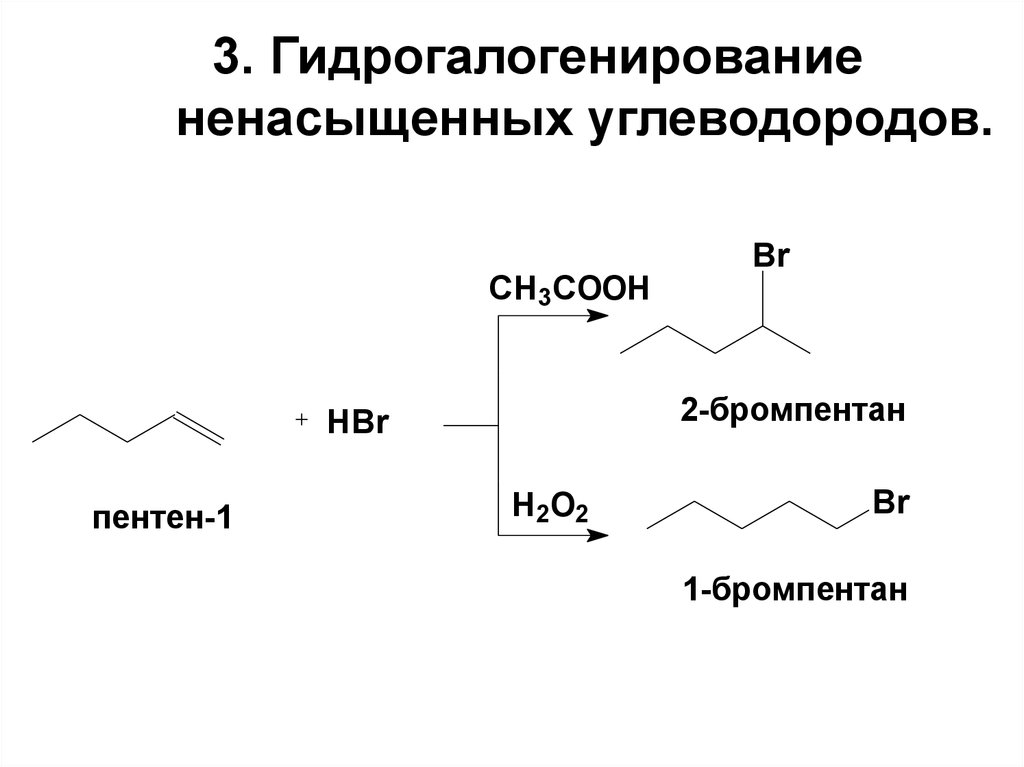
10. 3. Гидрогалогенирование ненасыщенных углеводородов.
CH3COOH2-бромпентан
HBr
пентен-1
Br
H2O2
Br
1-бромпентан
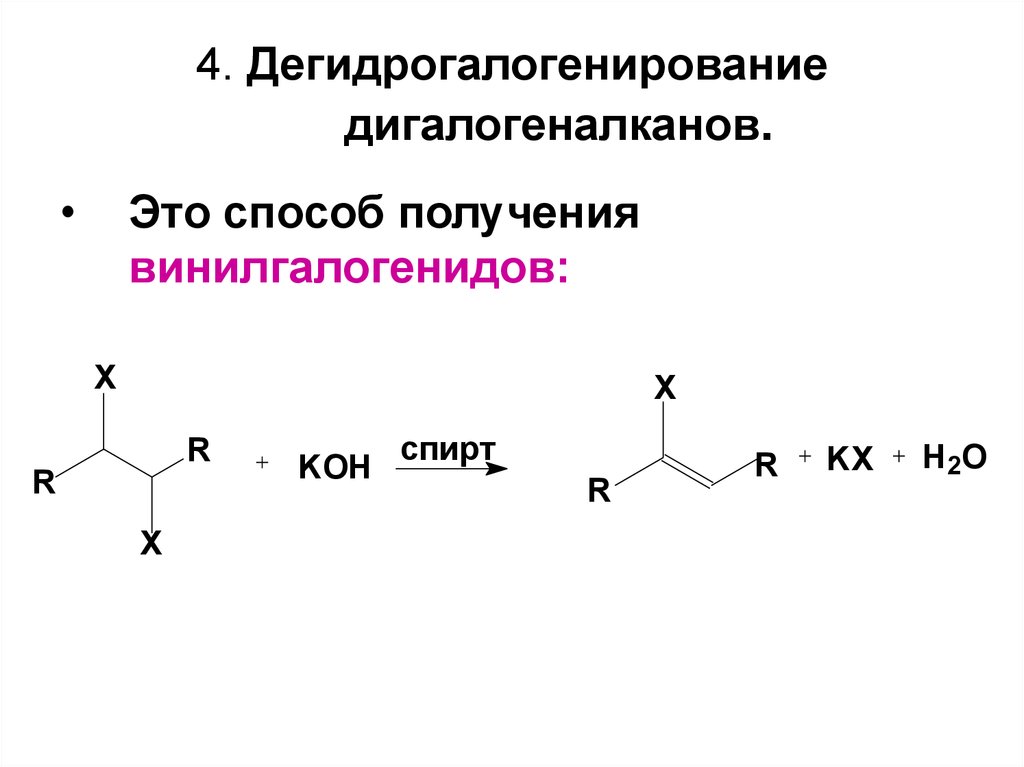
11. 4. Дегидрогалогенирование дигалогеналканов.
Это способ получения
винилгалогенидов:
X
X
R
R
X
KOH
спирт
R
R
KX
H2O
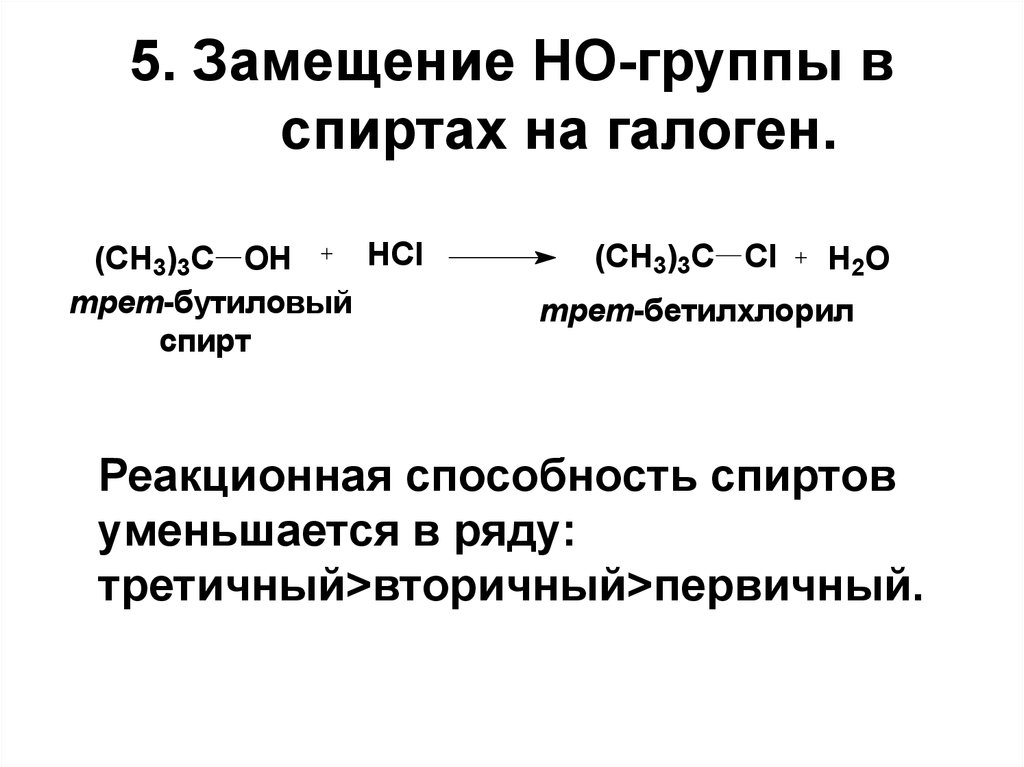
12. 5. Замещение HO-группы в спиртах на галоген.
HCl(CH3)3C OH
трет-бутиловый
спирт
(CH3)3C Cl
H 2O
трет-бетилхлорил
Реакционная способность спиртов
уменьшается в ряду:
третичный>вторичный>первичный.
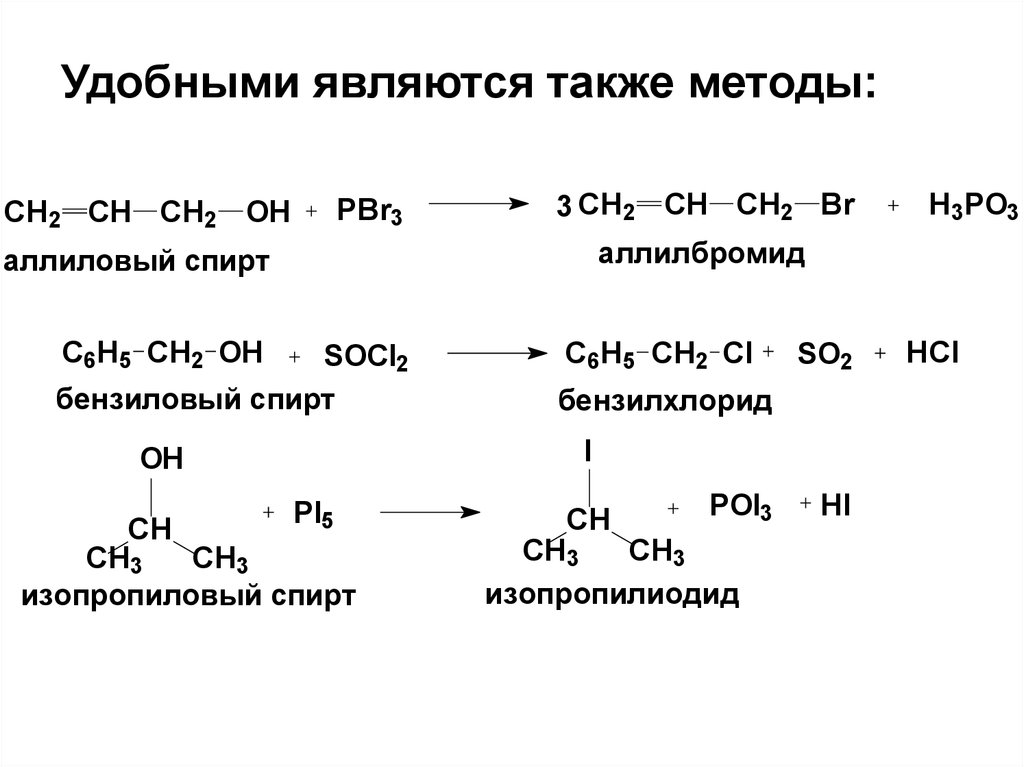
13.
Удобными являются также методы:PBr3
CH2 CH CH2 OH
3 CH2 CH CH2 Br
H3PO3
аллилбромид
аллиловый спирт
C6H5 CH2 OH
SOCl2
бензиловый спирт
C6H5 CH2 Cl
SO2
бензилхлорид
I
OH
PI5
CH
CH3
CH3
изопропиловый спирт
POI3
CH
CH3
CH3
изопропилиодид
HI
HCl
14. 6. Получение из альдегидов и кетонов.
ClR
C
O
H
PCI5
R
C
Cl
H
POCI3
15. 7. Получение иодпроизводных реакцией Финкельштейна
R ClNaI
ацетон
R
I
NaCl
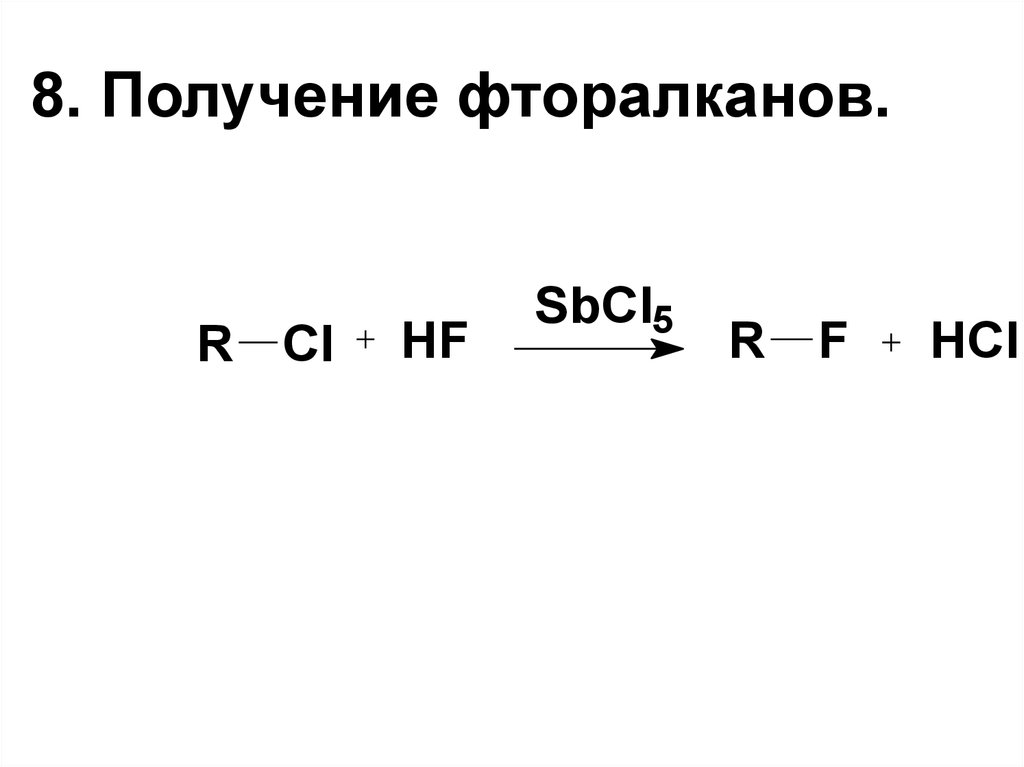
16. 8. Получение фторалканов.
R ClHF
SbCl5
R
F
HCl
17. ФИЗИЧЕСКИЕ СВОЙСТВА
• Физические свойства галогеналкановзависят от природы и числа атомов
галогена в молекуле. Низшие и средние
галагеналканы – бесцветные газы или
жидкости со своеобразным сладковатым
запахом.
• Т. кип. галогеналканов с одинаковым R
повышаются с увеличением атомной
массы галогена в ряду F<Cl<Br<I.
• Высшие гомологи , а также
полигалогенпроизводные – бесцветные
крист. в-ва.
18.
• Полифторалканы заметно отличаются посвойствам от других галогеналканов.
• Переход от одного галогена к другому заметно
отражается на изменении относительной
плотности веществ. Однозамещенные
хлороалканы легче воды, Br- и I-производные
– тяжелее.
• С увеличением атомного радиуса галогена
увеличивается показатель преломления. Iпроизводные имеют наиболее высокие
показатели преломления.
19.
• Галогеноуглеводороды – полярныесоединения, но они почти
нерастворимы в воде , так как не
образуют с ней водородных связей, и
растворимы в спиртах и других орг.
растворителях.
• Таблица физических характеристик
связей С-Hal представлена на стр.254,
учебник.
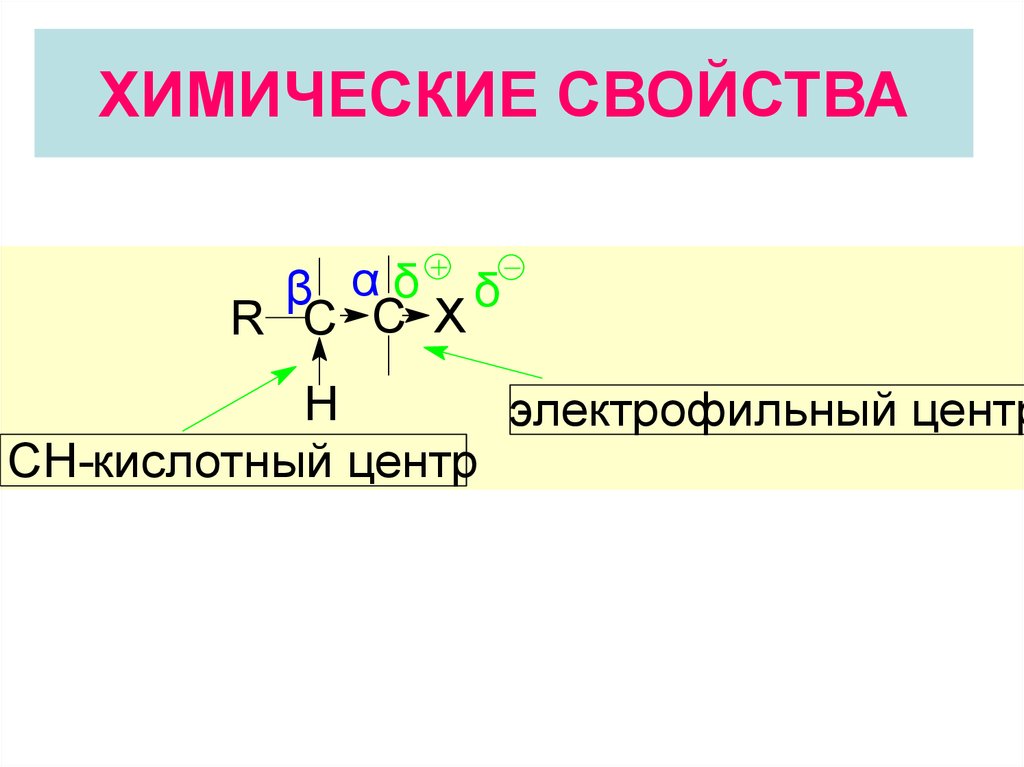
20. ХИМИЧЕСКИЕ СВОЙСТВА
β αδ δR C C X
H
электрофильный центр
СН-кислотный центр
21.
1.Электрофильный центр (α-атом углерода)
возникает вследствие поляризации связи С-Нal и
может подвергаться атаке нуклеофилом. В
результате происходит замещение галогена на
нуклеофил , т. е. осуществляется реакция
нуклеофильного замещения.
2.
3.
Если в реакционной среде имеется сильное
основание, то реакция идет по СН-кислотному
центру. Результатом такой реакции является
элиминирование (отщепление ) атомов
водорода и галогена от соседних атомов углерода.
Галогенопроизводные могут реагировать с
металлами, в результате чего получаются
металлоорганические соединения RMX
22. 1. Реакции нуклеофилов–наиболее распространенные превращения галогеналканов.
1. Реакции нуклеофилов–наиболее распространенные
превращения галогеналканов.
• Именно эти реакции позволяют
вводить в органические соединения
самые разнообразные
функциональные группы.
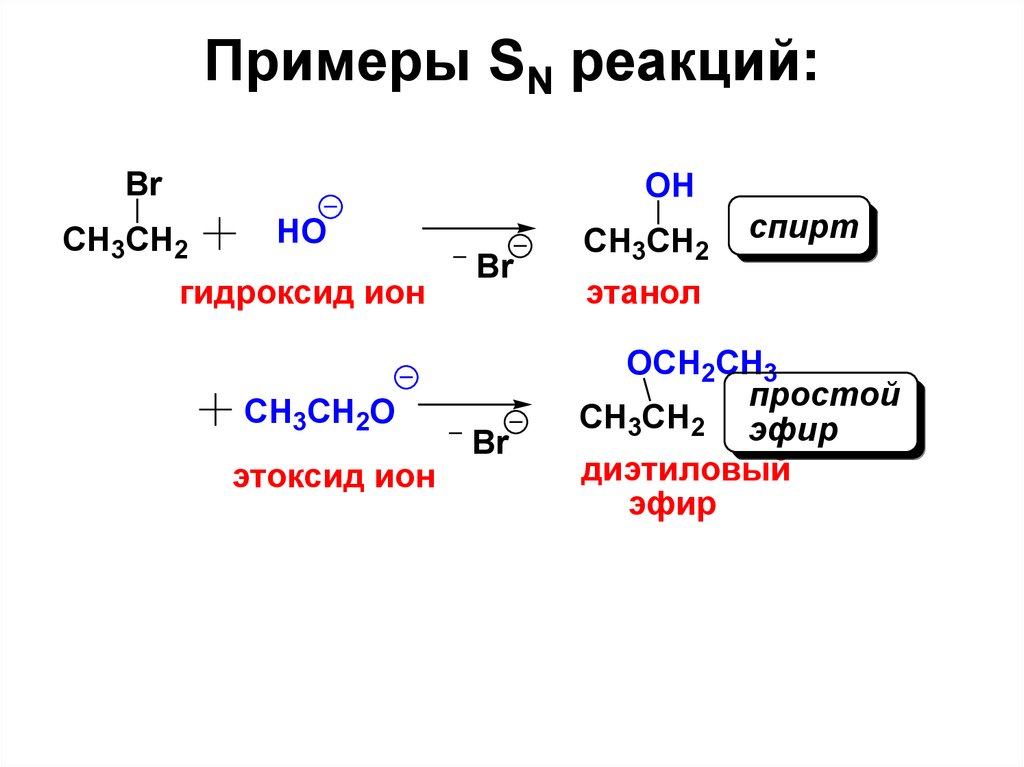
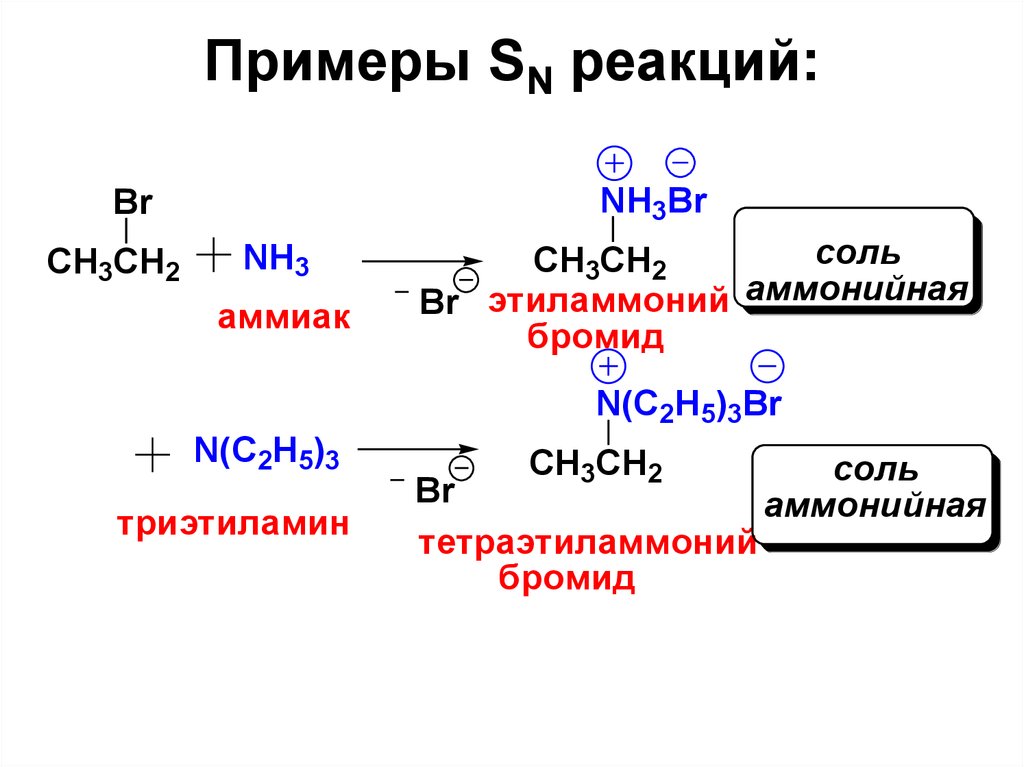
23. Примеры SN реакций:
BrOH
CH3CH2
HO
гидроксид ион
СH3CH2O
этоксид ион
Br
Br
CH3CH2
спирт
этанол
OCH2CH3
простой
CH3CH2 эфир
диэтиловый
эфир
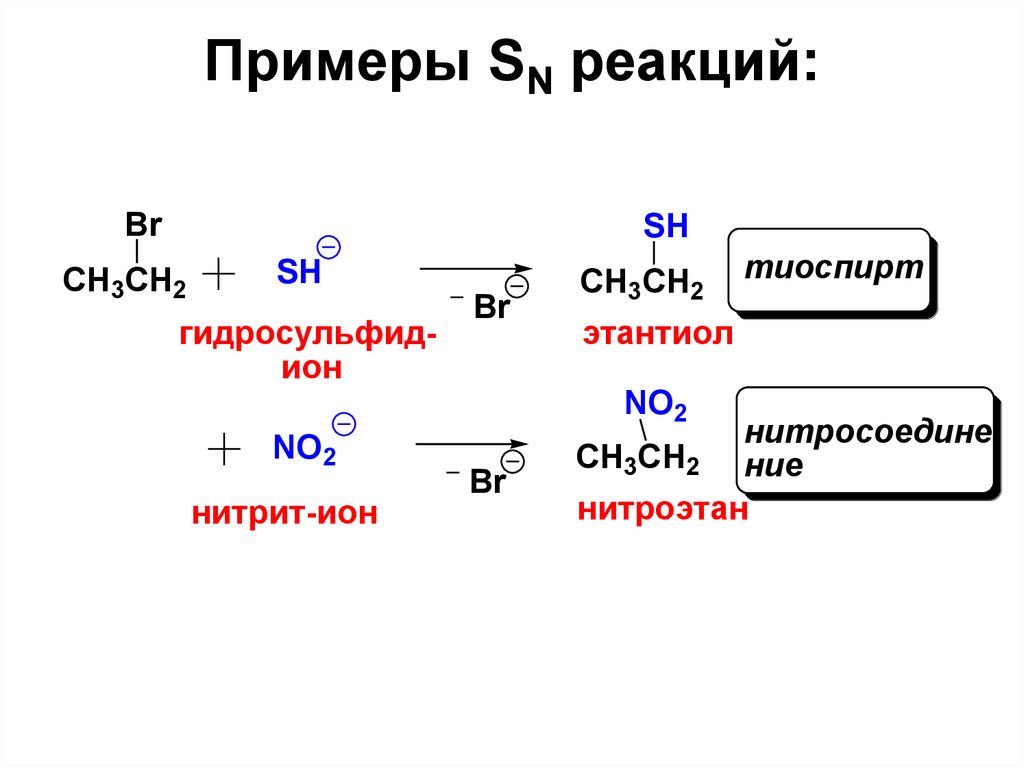
24. Примеры SN реакций:
BrSH
CH3CH2
SH
гидросульфидион
Br
CH3CH2
этантиол
NO2
NO2
нитрит-ион
Br
тиоспирт
нитросоедине
CH3CH2 ние
нитроэтан
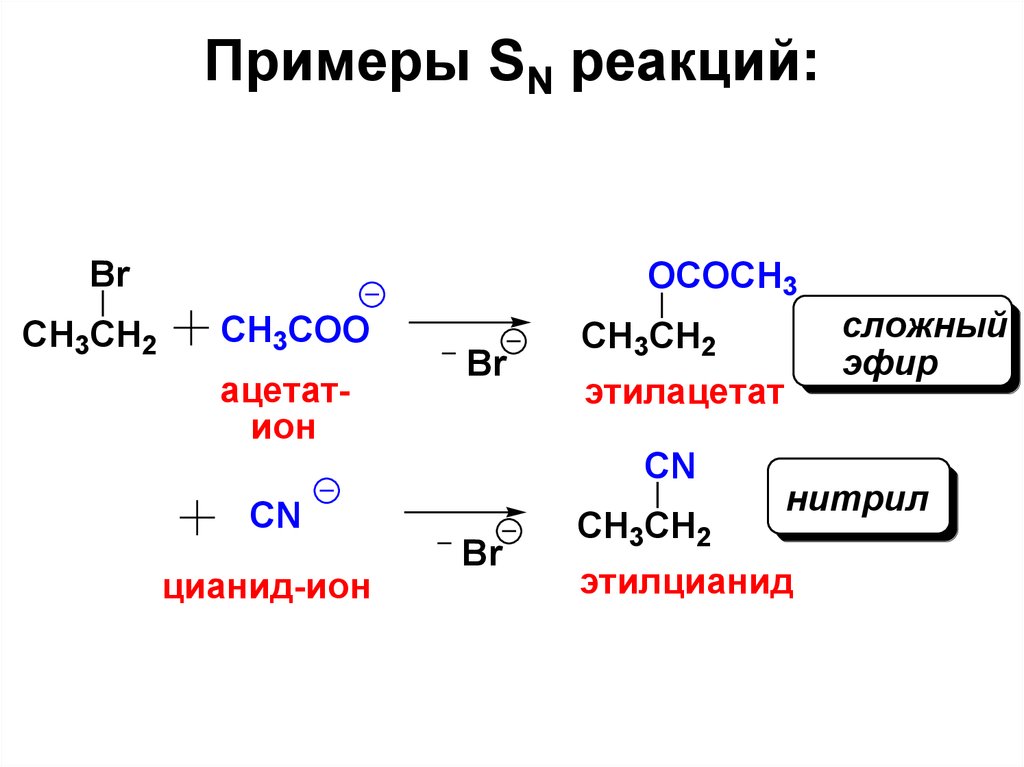
25. Примеры SN реакций:
BrCH3CH2
OCOCH3
CH3COO
ацетатион
Br
этилацетат
CN
CN
цианид-ион
Br
сложный
эфир
CH3CH2
CH3CH2
нитрил
этилцианид
26. Примеры SN реакций:
NH3BrBr
CH3CH2
NH3
аммиак
соль
CH3CH2
Br этиламмоний аммонийная
бромид
N(C2H5)3Br
N(C2H5)3
триэтиламин
CH3CH2
Br
тетраэтиламмоний
бромид
соль
аммонийная
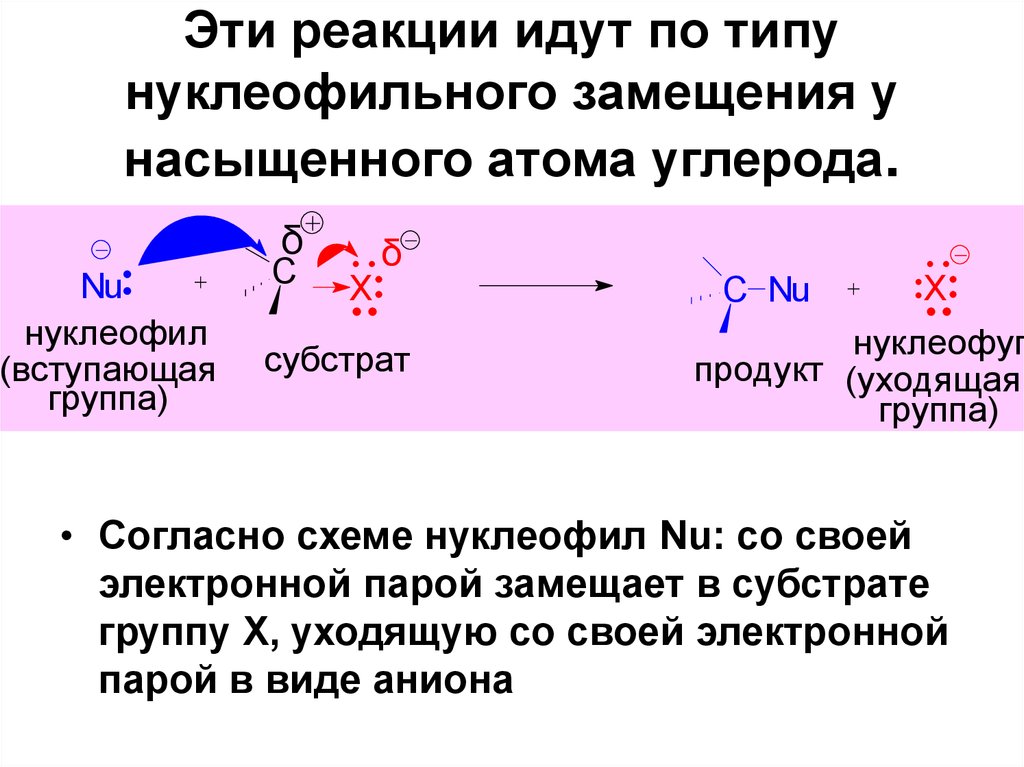
27. Эти реакции идут по типу нуклеофильного замещения у насыщенного атома углерода.
δNu
нуклеофил
(вступающая
группа)
C
X
δ
субстрат
C Nu
X
нуклеофуг
продукт (уходящая
группа)
• Согласно схеме нуклеофил Nu: со своей
электронной парой замещает в субстрате
группу Х, уходящую со своей электронной
парой в виде аниона
28.
• Нуклеофильные реагенты - это частицы(атомы или молекулы) доноры
электронной пары при образовании
связи с любым элементом, кроме
водорода.
• Нуклеофилы подразделяют по признаку
наличия или отсутствия отрицательного
заряда
29. Нуклеофилы – отрицательно заряженные ионы:
OH,I ,
C N,
SH, NO3 , SCN,
CH3O , CH3C
N3 ,
NO2;
O
O
, Br ,
Cl ,
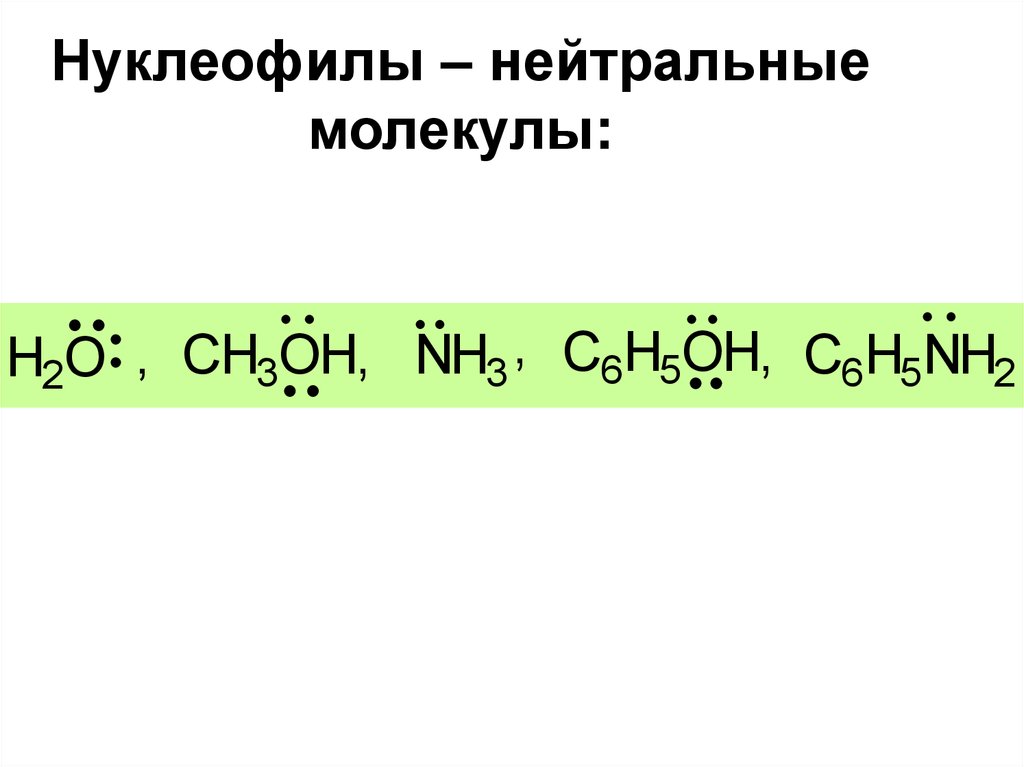
30. Нуклеофилы – нейтральные молекулы:
H2O , CH3OH, NH3 , C6H5OH, C6H5NH231. Реакции нуклеофильного замещения идут по одной из следующих схем:
бимолекулярное нуклеофильное
замещение (SN2);
мономолекулярное нуклеофильное
замещение (SN1).
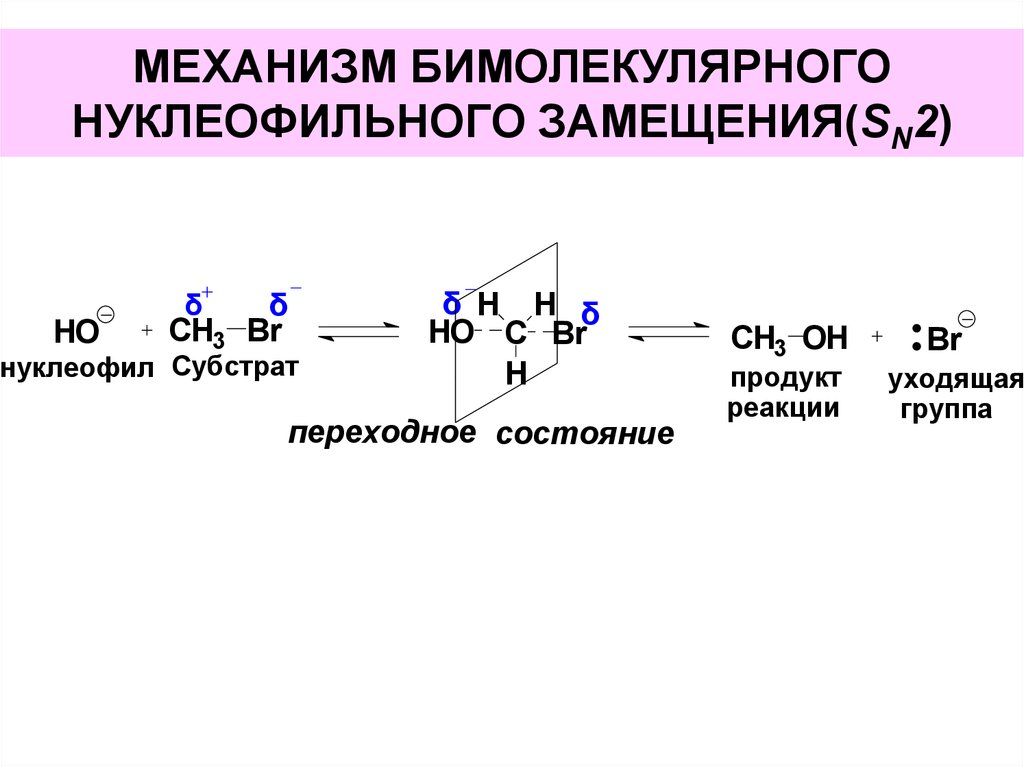
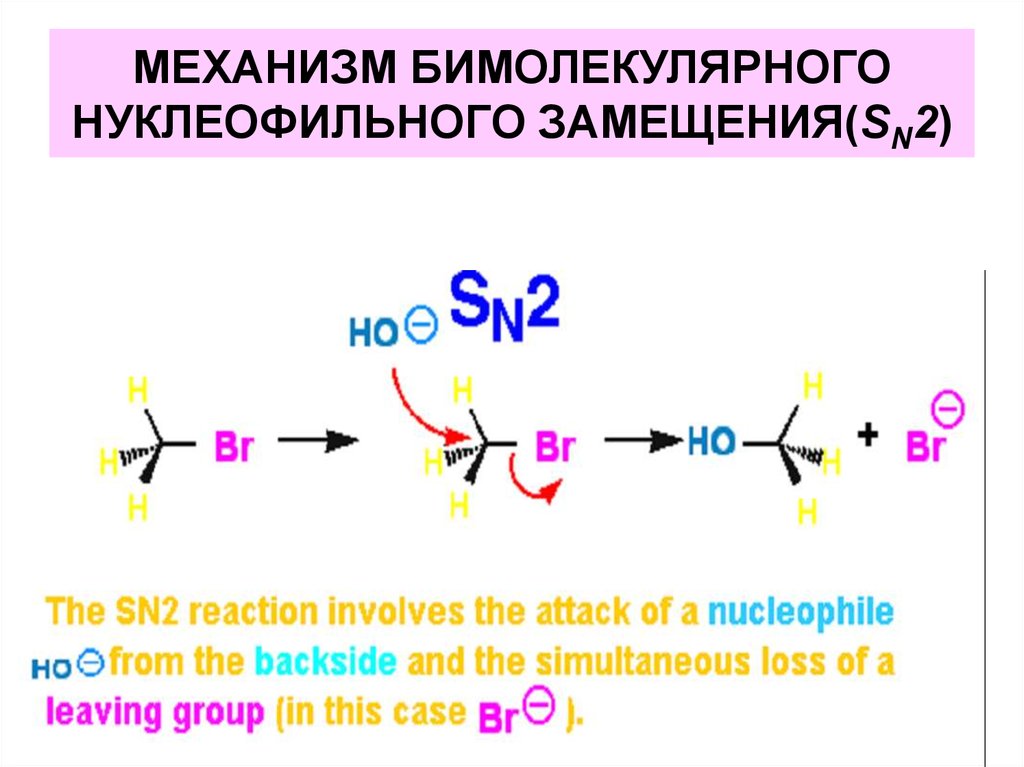
32. МЕХАНИЗМ БИМОЛЕКУЛЯРНОГО НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ(SN2)
HOδ
CH3 Br
δ
нуклеофил Субстрат
δ H H δ
HO C Br
H
переходное состояние
CH3 OH
продукт
реакции
Br
уходящая
группа
33. МЕХАНИЗМ БИМОЛЕКУЛЯРНОГО НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ(SN2)
34. Кинетика реакции:
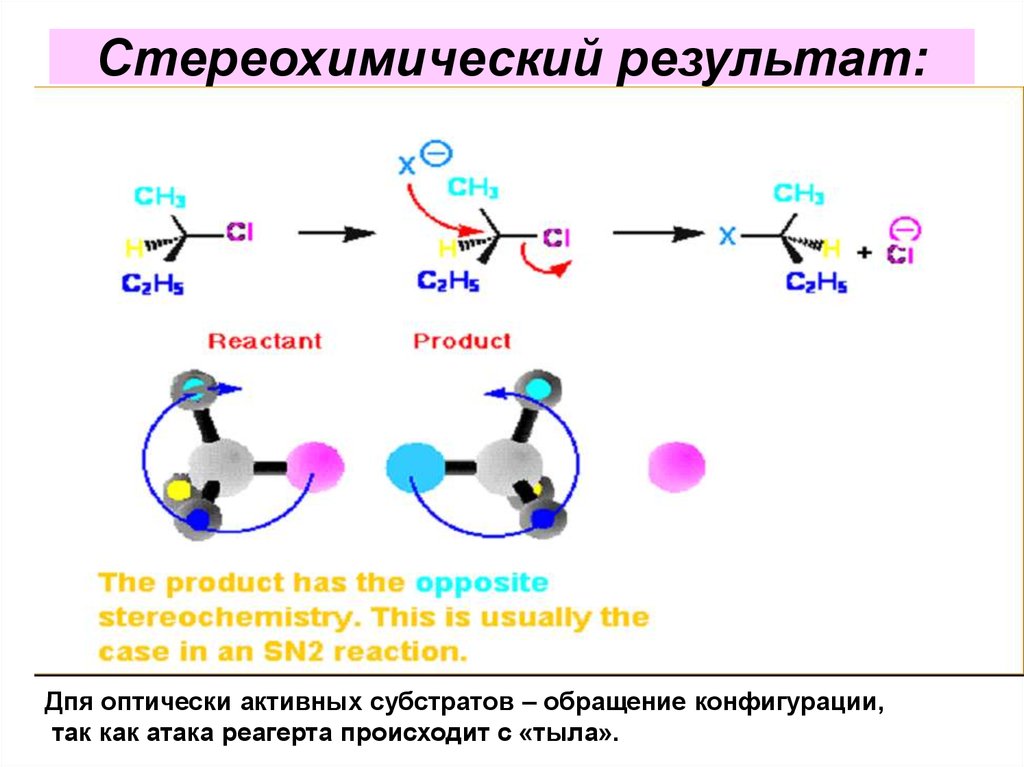
V=k[субстрат] [реагент]35. Стереохимический результат:
Дпя оптически активных субстратов – обращение конфигурации,так как атака реагерта происходит с «тыла».
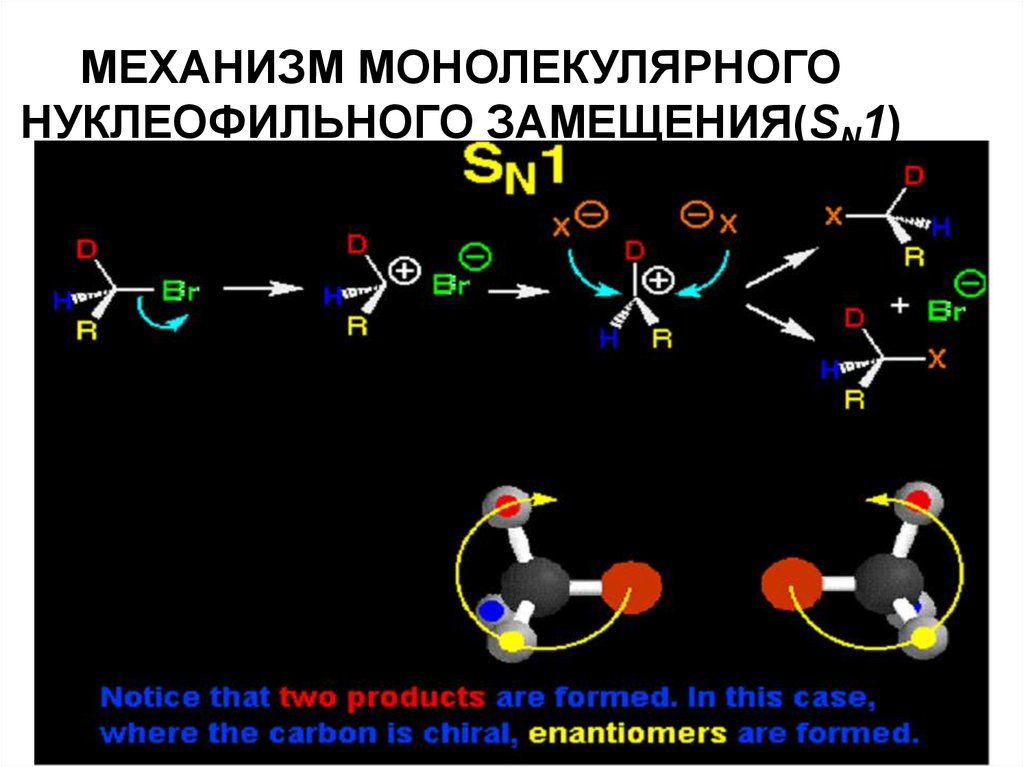
36. МЕХАНИЗМ МОНОЛЕКУЛЯРНОГО НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ(SN1)
37. МЕХАНИЗМ МОНОЛЕКУЛЯРНОГО НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ(SN1)
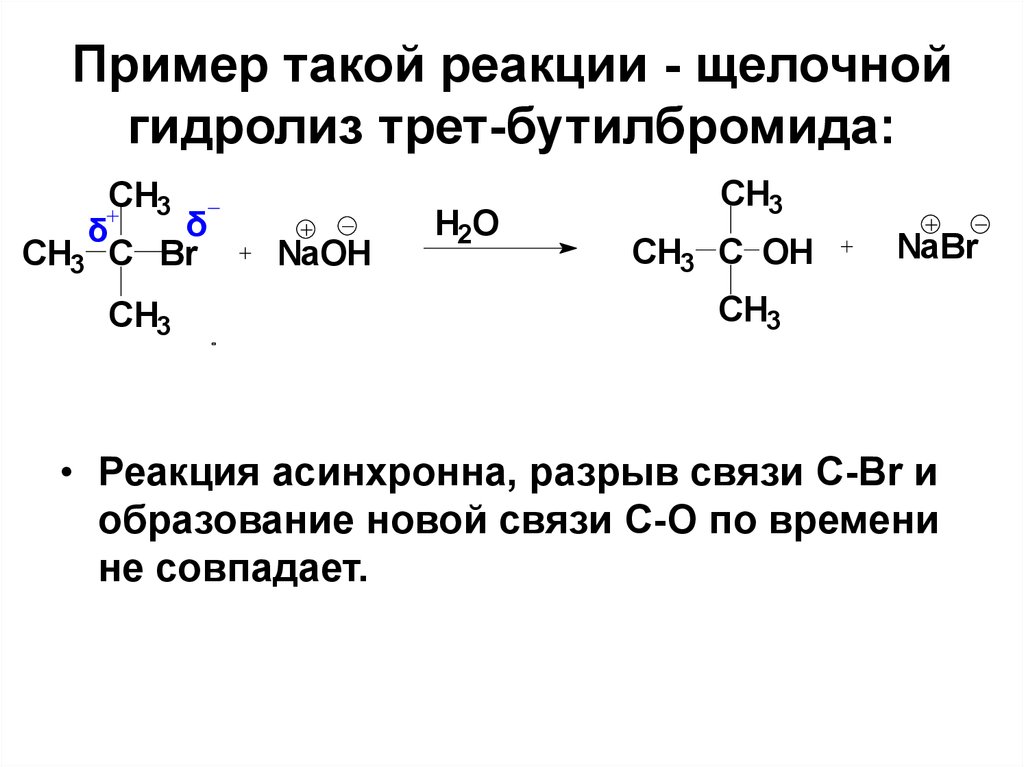
38. Пример такой реакции - щелочной гидролиз трет-бутилбромида:
CH3δ
CH3
δ
C Br
CH3
NaOH
H2O
CH3
CH3 C OH
NaBr
CH3
• Реакция асинхронна, разрыв связи С-Br и
образование новой связи С-О по времени
не совпадает.
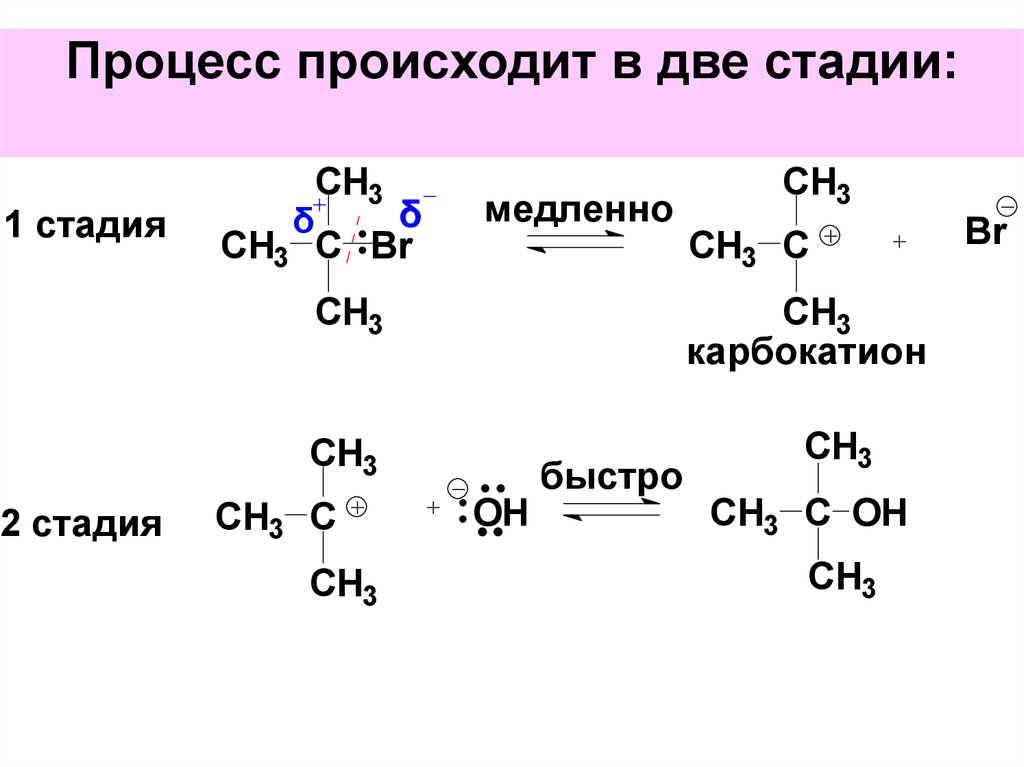
39. Процесс происходит в две стадии:
1 стадияCH3
δ
CH3
δ
C Br
медленно
CH3
CH3 C
CH3
CH3 C
CH3
карбокатион
CH3
2 стадия
CH3
OH
быстро
CH3
CH3 C OH
CH3
Br
40. Кинетика реакции:
V=k[субстрат]Концентрация нуклеофила на
скорость реакции не влияет.
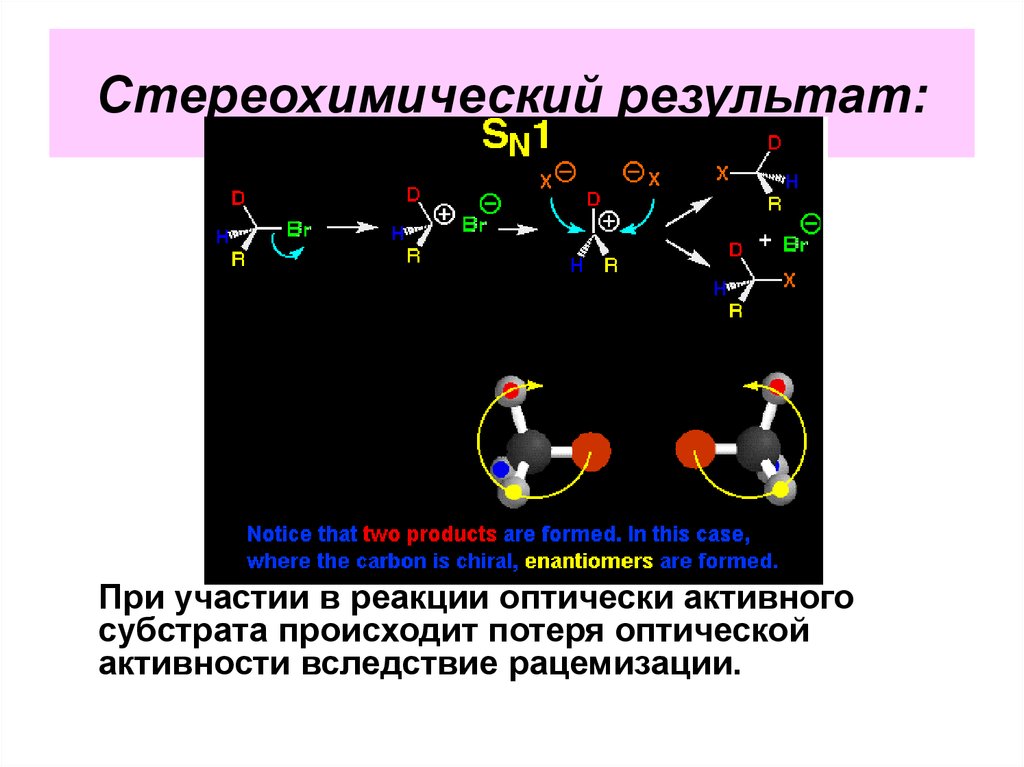
41. Стереохимический результат:
При участии в реакции оптически активногосубстрата происходит потеря оптической
активности вследствие рацемизации.
42. Факторы,влияющие на ход нуклеофильного замещения
1. Строение субстрата.2. Природа уходящей группы.
3. Природа растворителя.
4. Нуклеофильность реагента
43. Строение субстрата.
• Природа углеводородного радикала,связанного с галогеном, играет
важную роль.
• С точки зрения реакционной
способности все
галогенопроизводные можно
разделить на 3 типа:
44.
• а) Соединения с нормальнойреакционной способностью (нормальной
подвижностью галогена в SN реакциях);
• б) Соединения с пониженной
реакционной способностью (пониженной
подвижностью галогена в SN реакциях);
• а) Соединения с повышенной
реакционной способностью (повышенной
подвижностью галогена в SN реакциях).
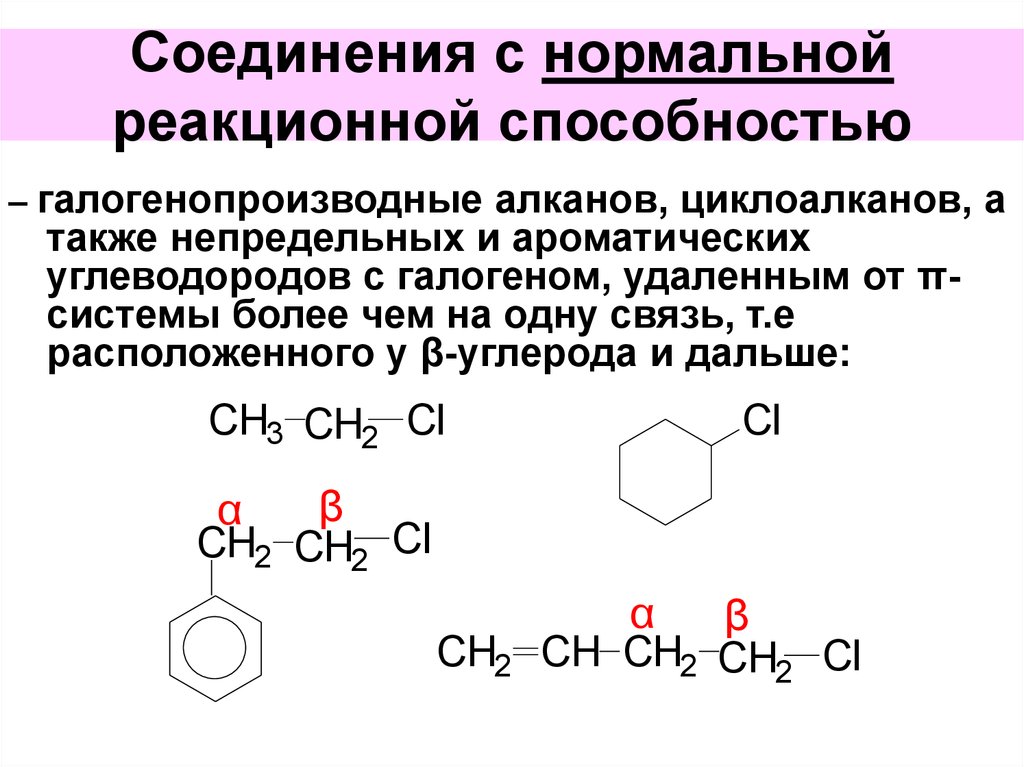
45. Соединения с нормальной реакционной способностью
– галогенопроизводные алканов, циклоалканов, атакже непредельных и ароматических
углеводородов с галогеном, удаленным от πсистемы более чем на одну связь, т.е
расположенного у β-углерода и дальше:
CH3 CH2 Cl
Cl
β
α
CH2 CH2 Cl
CH2
α
β
CH CH2 CH2 Cl
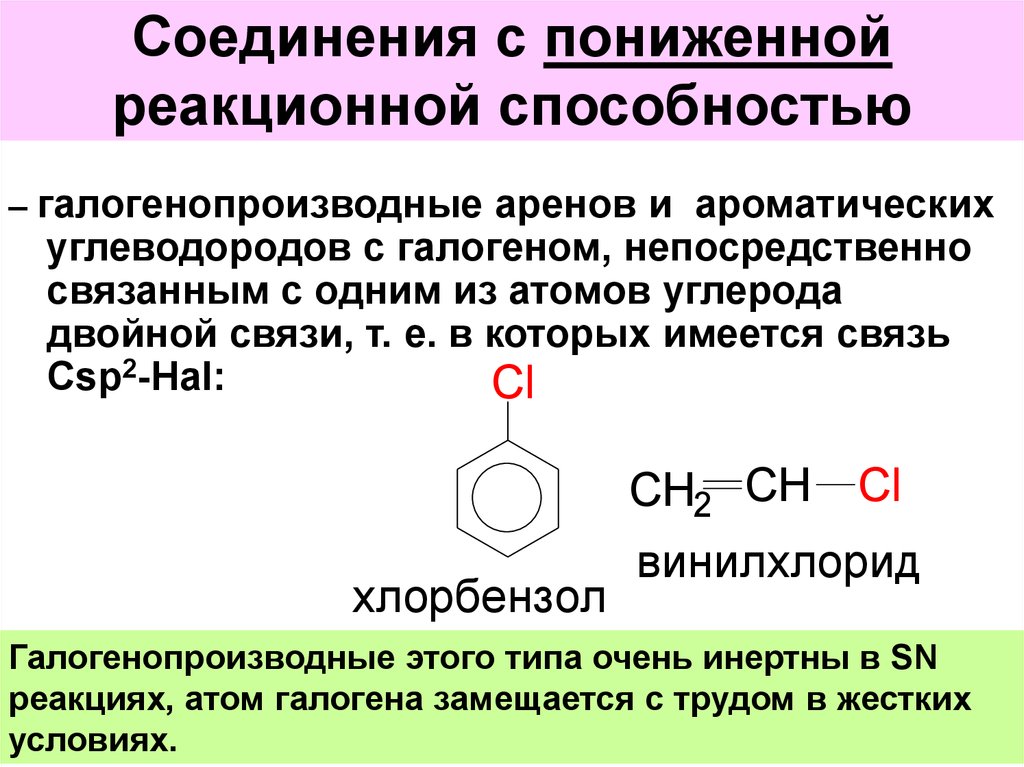
46. Соединения с пониженной реакционной способностью
– галогенопроизводные аренов и ароматическихуглеводородов с галогеном, непосредственно
связанным с одним из атомов углерода
двойной связи, т. е. в которых имеется связь
Сsp2-Hal:
Cl
CH2 CH Cl
хлорбензол
винилхлорид
Галогенопроизводные этого типа очень инертны в SN
реакциях, атом галогена замещается с трудом в жестких
условиях.
47.
Вследствие +М эффекта связь С-Hal в этихсоединениях становится короче , прочнее и
менее полярной. (Таблица сравнительных
характеристик связи С-Cl представлена
на стр.261, учебник).
M
M
CH2 CH Cl
I
Cl
I
48. Соединения с повышенной реакционной способностью
– галогенопроизводные углеводородов сгалогеном, связанным с α-углеродным
атомом при двойной связи, т. е. в которых
имеется связь Сsp2-СН2-Hal:
CH2
α
CH CH2 Cl
аллилхлорид
α
CH C CH2 Cl
α
CH2 Cl
пропаргилхлорид бензилхлорид
49.
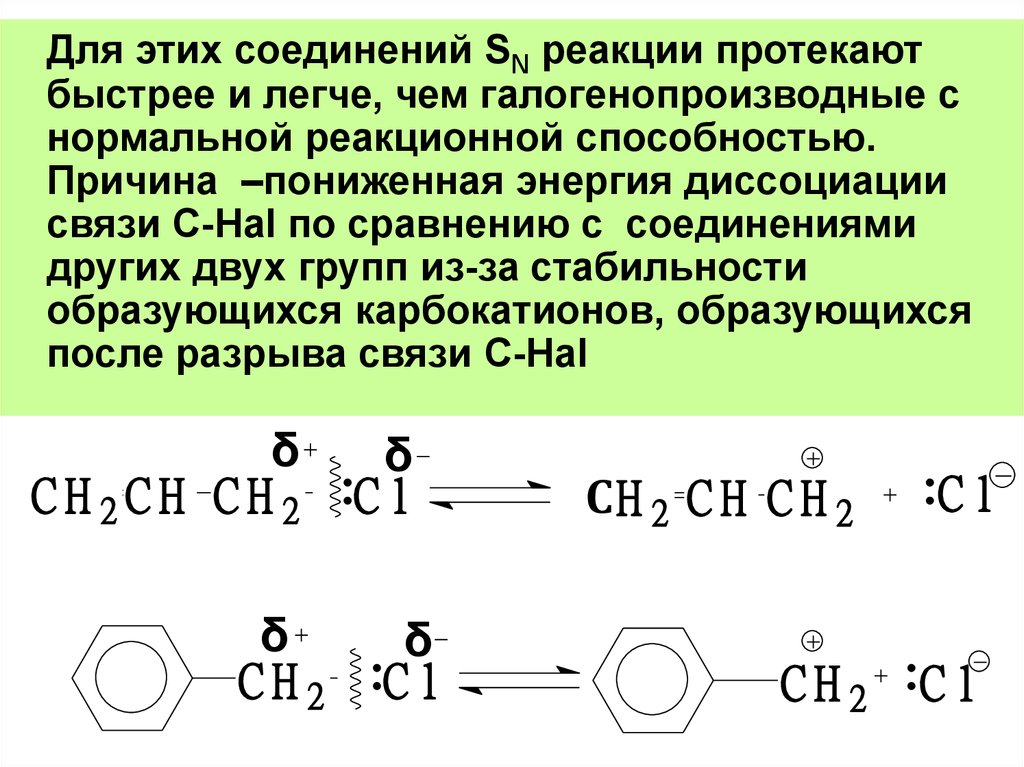
Для этих соединений SN реакции протекаютбыстрее и легче, чем галогенопроизводные с
нормальной реакционной способностью.
Причина –пониженная энергия диссоциации
связи С-Hal по сравнению с соединениями
других двух групп из-за стабильности
образующихся карбокатионов, образующихся
после разрыва связи С-Hal
δ
CH2CH CH2
δ
CH2
δ
Cl
δ
Cl
СH 2 C H C H 2
CH2
Cl
Cl
50.
• Природа R влияет и напредпочтительность реализации
замещения по (SN1) или (SN2) механизмам.
• Склонность субстрата вступать в (SN1)
или (SN2) реакции зависит от
пространственного строения заместителя
и от энергии диссоциации связи С-Hal.
51.
• В случае SN2 реакции определяющимявляется стерический фактор: большие
по объему R при атоме С уменьшают
реакционную способность субстрата, так
как затрудняют подход заместителя с
тыла и создают препятствия для
пентакоординационного переходного
состояния. Поэтому тенденция к SN2
реакциям и их скорость увеличиваются в
ряду:
CH3 CH3
CH3 C Br<
C H B r < C H 3 C H 2B r < C H 3 B r
CH3
CH3
150
0,007
1
0,0005
скорость SN2 растет
52.
• SN1 Реакции могут протекать для техсубстратов, у которых связь С-Hal легко
диссоциирует с образованием
стабильного карбокатиона. Поэтому
тенденция к SN1 реакциям и их скорость
увеличиваются в ряду:
C H3
C H3
C
Br
C H3
100 000
C H3
>>
CH Br
C H3
45
>
C H3 C H2 B r
1,7
скорость SN1 растет
>
C H3
Br
1
53.
Таким образом, третичные субстраты обычновступают в SN1, а первичные – SN2-реакции.
Субстраты вторичные, а также бензильного
и аллильного типа могут реагировать по SN1
или SN2 –механизмам в зависимости от
природы растворителя.
54. Влияние природы уходящей группы (нуклеофуга)
Хорошие уходящие группы бедны энергией, т.е.являются устойчивыми ионами или нейтральными
молекулами.
Плохие уходящие группы богаты энергией; в них
невелика или отсутствует степень делокализации
отрицательного заряда.
В ряду алкилгалогенидов реакционная способность
в реакциях нуклеофильного замещения изменяется
следующим образом:
SN2-механизм
R
F
<< R
Cl < R
Br < R
I
очень инертны активность в SN-реакциях растёт
в SN-реакциях
55. Влияние природы растворителя.
Роль полярного растворителя:• 1) принимает участие в ионизации
молекул исходных веществ;
• 2) стабилизирует образующиеся
ионы за счёт их сольватации;
• 3) стабилизирует переходное
состояние.
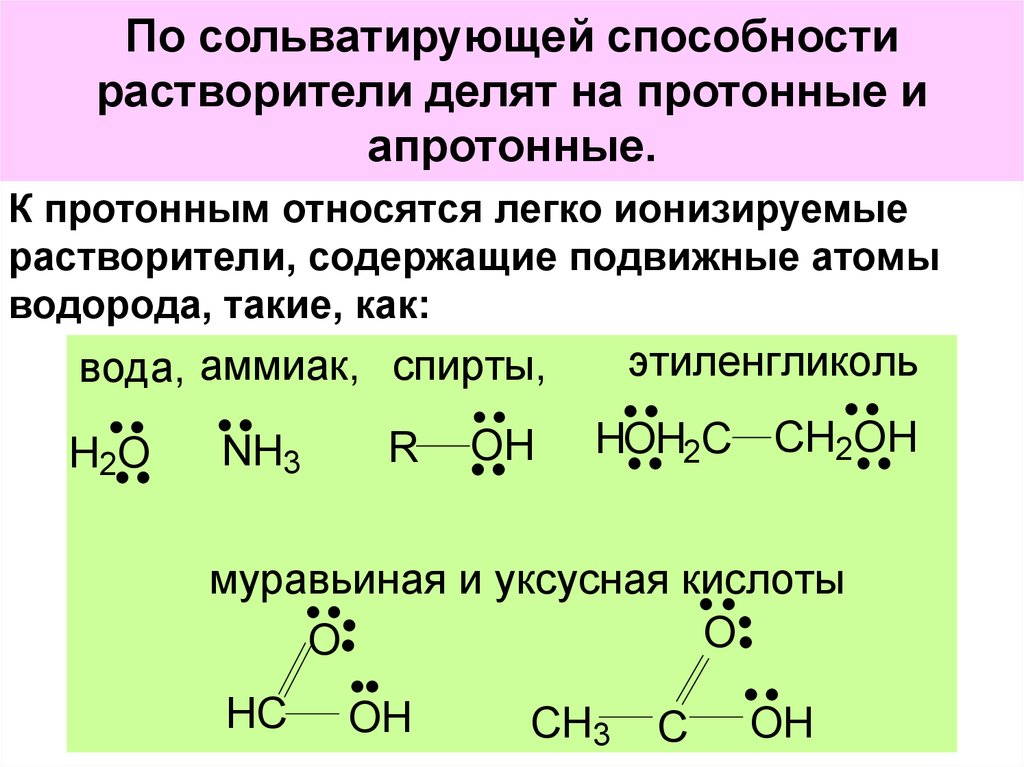
56. По сольватирующей способности растворители делят на протонные и апротонные.
К протонным относятся легко ионизируемыерастворители, содержащие подвижные атомы
водорода, такие, как:
вода, аммиак, спирты,
этиленгликоль
OH
HOH2C CH2OH
H2O
NH3
R
муравьиная и уксусная кислоты
O
O
HC
OH
CH3
C
OH
57.
Эти растворители за счёт неподелённыхэлектронных пар хорошо сольватируют
катионы, а за счет образования
водородных связей также сольватируют и
анионы :
O
R
H
O
H X
Поэтому они способствуют протеканию реакций
по механизму SN1, где образуются катионы и
анионы.
58. Апротонные полярные растворители
OCH3
C
CH2
CH3
O
O
O
CH2
H
C
N(CH3)2
CH2 диметрилформамид
(ДМФА)
диоксан
ацетон
CH2
O
CH3
S
CH3
диметилсульфоксид
(ДМСО)
C2H5 O
C2H5
диэтиловый эфир
59.
Апротонные полярные растворители засчёт неподелённых электронных пар
гетероатомов хорошо сольватируют
катионы. Анионы не сольватируют,т.к.
они не способны к образованию
водородных связей. Таким образом, в
этих растворителях нуклеофилы
оказываются как бы «обнажёнными» и
сохраняют свою активность по
отношению с субстрату. В результате
облегчается протекание SN2-реакций.
O
R
60.
• Таким образом, характер растворителяоказывает существенное влияние на
скорость реакций и её механизм. Это
позволяет, подбирая растворитель,
направлять реакцию по нужному
механизму и получать целевые продукты,
например в случае аллильной
перегруппировки или участия в реакции
амбидентных нуклеофилов.
61. Влияние нуклеофильности реагента.
Активность нуклеофиласказывается на скорости реакций типа
SN2, поскольку он принимает участие
в лимитирующей стадии процесса.
Нуклеофильность зависит от:
а) основности реагента,
б) поляризуемости реагента,
в) природы растворителя.
62.
а) Между основностью реагента и егонуклеофильностью имеется
определённая связь. В первом
приближении нуклеофильность
пропорциональна основности.
HO > HOH,
RO > ROH,
R
COO > R
COOH,
т.е. анионы- более сильные основания и более сильные нуклеофилы.
63.
б) Нуклеофильность определяется ещё иполяризуемостью. Чем больше размер
атома, тем выше его нуклеофильность.
Легкополяризуемые реагенты
SH, SCN, I, S2O3
обладают высокой нуклеофильностью в
растворителях различного типа.
64.
в) На нуклеофильностьслабополяризуемых ионов значительное
влияние оказывает природа
растворителя.
H O H X
• В полярных растворителях ионы
находятся в сольватированном
состоянии, и чем сильнее сольватирован
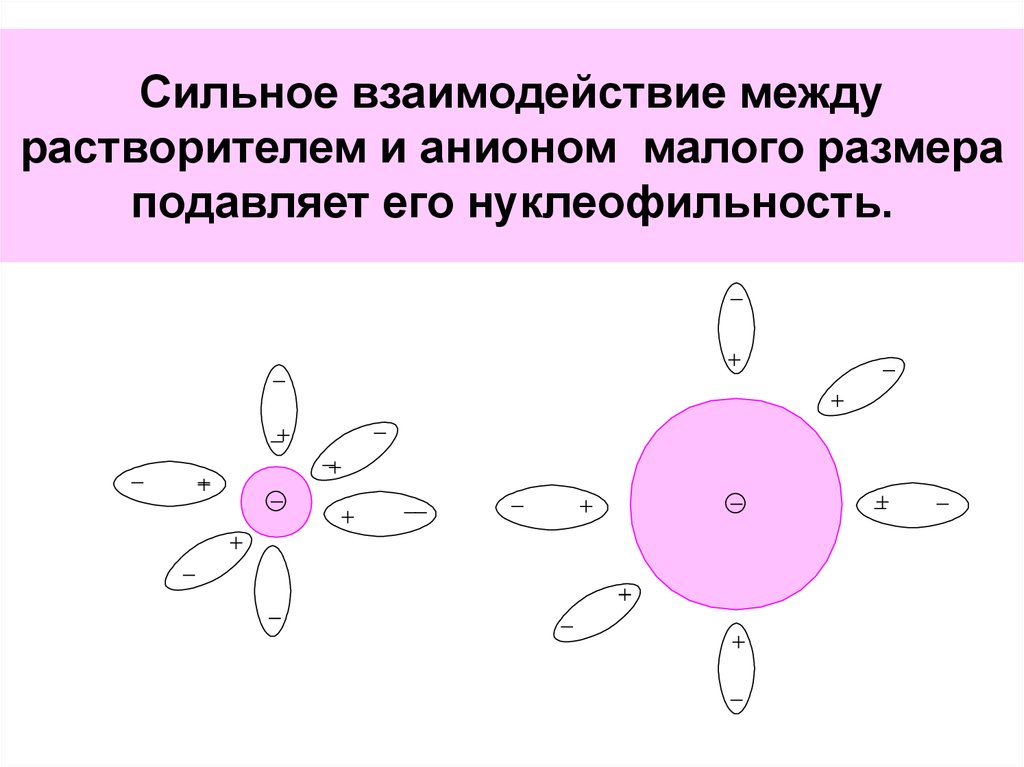
анион, тем меньше его нуклеофильность.
В больших анионах степень сольватации
меньше. Поэтому больший анион
освобождается от растворителя с
меньшей затратой энергии.
65. Сильное взаимодействие между растворителем и анионом малого размера подавляет его нуклеофильность.
66. Реагенты по возрастанию их нуклеофильности в SN2-реакциях в протонных растворителях можно расположить таким образом:
F < H2O < Cl < C6H5O < Br < OH < OR < NH3 < CN< I
Нуклеофильность возрастает с увеличением поляризуемости
67. Апротонный растворитель не способен сольватировать анионы за счёт образования водородных связей с ними, поэтому анионы в этом случае «обн
Апротонный растворитель не способенсольватировать анионы за счёт
образования водородных связей с ними,
поэтому анионы в этом случае
«обнажённые», т.е. без сольватных
оболочек. Поэтому анион малого размера,
имеющий большой «-» заряд, является
более сильным нуклеофилом.
68. Порядок нуклеофильности в апротонном растворителе диметилформамиде (ДМФА) становится следующим:
I < Br < Cl < C6H5O < CN• Таблица сравнения SN1- и SN2-реакций
представлена
на стр. 268, Учебник.
69. Особенность реакций нуклеофильного замещения с амбидентными нуклеофилами (стр. 269, Учебник).
Нуклеофил, содержащий два реакционныхцентра, называется амбидентным.
δO N
δO
нитрит ион
SN2
δR Hal
δδO N O
R NO2
(ДМФА)
нитроалкан
SN1
R ONO
(Н2О, спирт)
эфир азотистой кислоты
70.
C Nцианид ион
SN2
R C N
нитрил
R Hal
C
N
SN1
R N
C
изонитрил
71. Правило Корнблюма:
• В SN2-реакциях атакующим атомомамбидентного нуклеофила будет
более нуклеофильный атом, а в SN1реакциях – более основный (более
электроотрицательный).
72. Аллильная перегруппировка.
• Реализуется при нуклеофильном замещении в аллильныхсоединениях.
продукт аллильной
перегруппировки
CH3
SN2
СH3
CH CH CH2 Br NaOH
CH3
HO CH CH CH2 Br
Br
δ
δ
SN1 СH3 CH CH CH
2
Br
аллильный катион
HO
CH CH CH2
HO
СH3 CH CH CH2 OH
продукт замещения
В SN2-реакциях – продукт аллильной перегруппировки,
а в В SN1-реакциях – смесь обычного продукта замещения
и продукта аллильной перегруппировки.
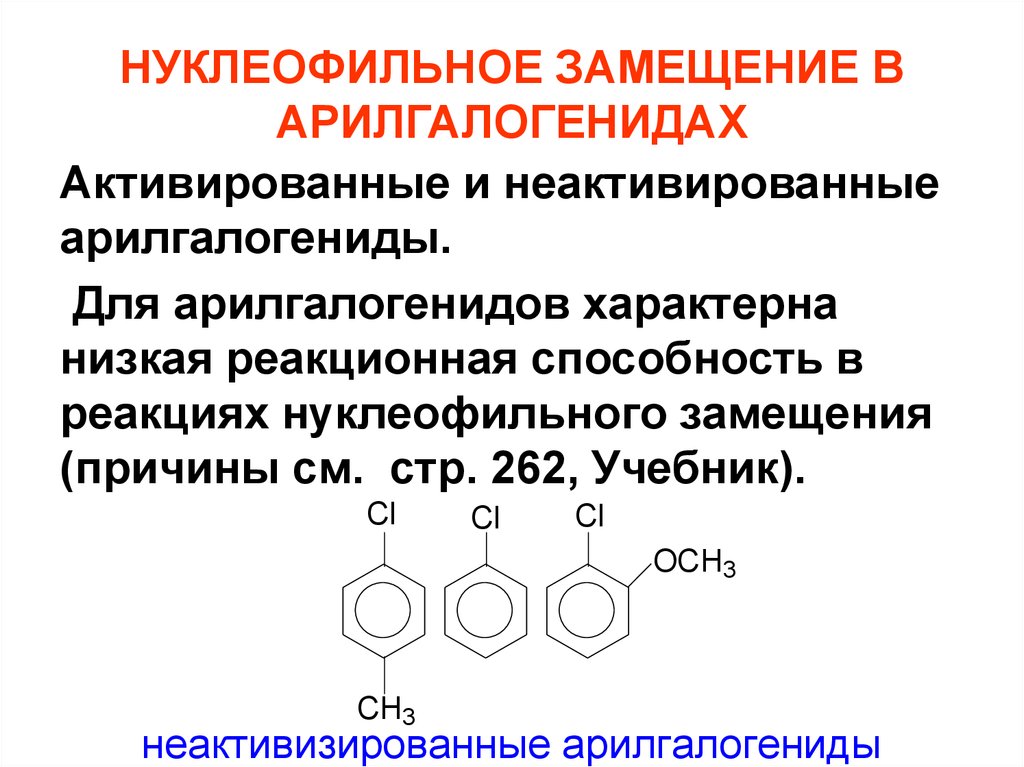
73. НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АРИЛГАЛОГЕНИДАХ
Активированные и неактивированныеарилгалогениды.
Для арилгалогенидов характерна
низкая реакционная способность в
реакциях нуклеофильного замещения
(причины см. стр. 262, Учебник).
Cl
Cl
Cl
OCH3
CH3
неактивизированные арилгалогениды
74.
• Подвижность галогена можно увеличитьвведением в о- или п-положение сильных
электроноакцепторных групп, обладающих –I- и
–М-эффектами (-NO2, -N=O, -CN и др.). За счёт
электроноакцепторных свойств) эти
заместители:
1) уменьшают электронную плотность
бензольного кольца, особенно в –о и пположениях, вследствие чего у реакционного
центра , связанного с галогеном увеличивается
дефицит электронов и облегчается
нуклеофильная атака.
2) принимая участие в делокализации
отрицательного заряда, электроноакцепторные
группы стабилизируют образующийся в
лимитирующей стадии σ-аддукт, имеющий
характер аниона.
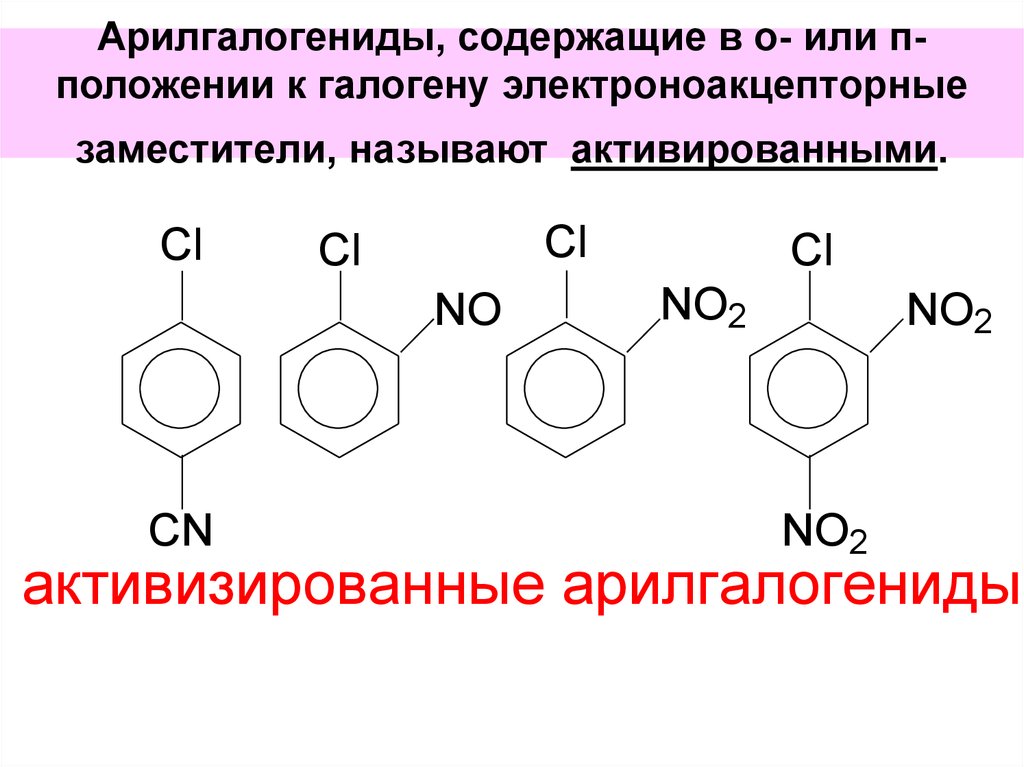
75. Арилгалогениды, содержащие в о- или п-положении к галогену электроноакцепторные заместители, называют активированными.
Арилгалогениды, содержащие в о- или пположении к галогену электроноакцепторныезаместители, называют активированными.
Cl
Cl
Cl
NO
CN
Cl
NO2
NO2
NO2
активизированные арилгалогениды
76. Сравним условия реакций нуклеофильного замещения:
OHN aO H
Cl
380 o C , 350 атм., C u
фенол
NH2
или N aN H 2
в жидком аммиаке- 33 оС
N H 3 , 200 o C , катализатор
анилин
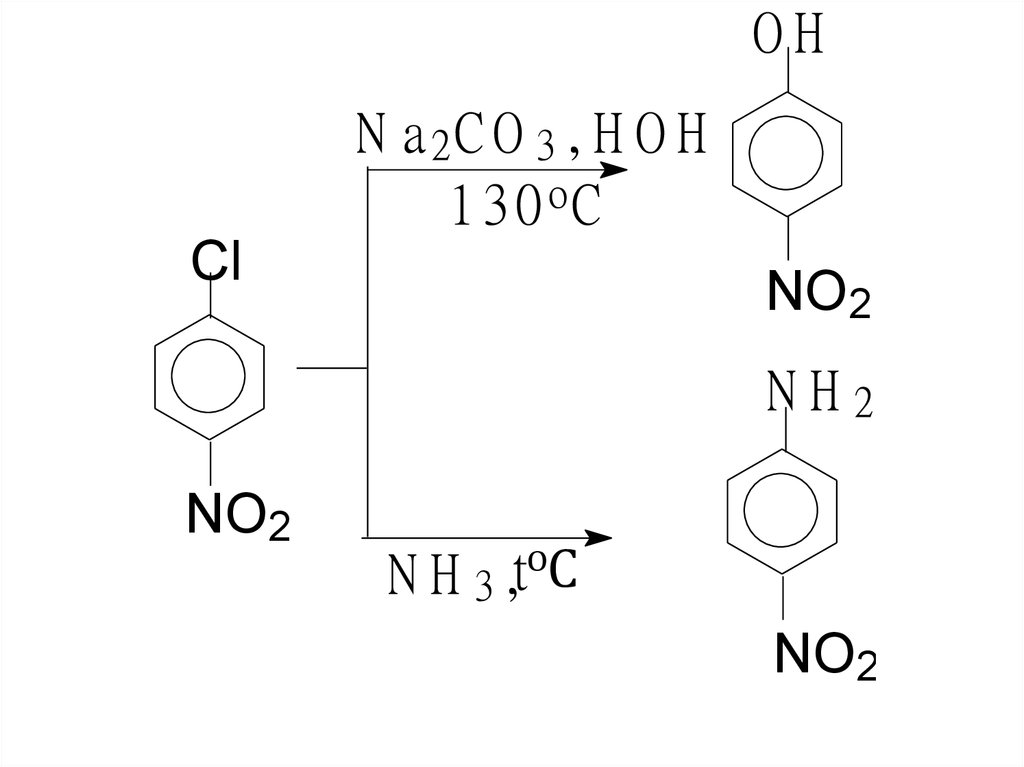
77.
OHN a2 C O 3 , H O H
130 o C
Cl
NO2
NH2
NO2
N H 3 ,tоС
NO2
78. Механизм реакций нуклеофильного замещения у неактивированных арилгалогенидов
ClNH2
N aN H 2 / N H 3
- 33 o C
Cl
NH2
H
+NH2
- N H 3, - C l
1-ая стадияотщепление
+NH3
дегидробензол 2-ая стадия(арин)
присоединение
79.
В реакциях неактивированных арилгалогенидовнуклеофил не всегда занимает то положение,
которое освобождает галоген. Например, при
гидролизе п-хлортолуола получается смесь п- и мкрезолов:
CH3
CH3
CH3
NaOH / HOH, 340oC
Cl
H
OH
CH3
+OH
-H2O
-Cl
O
H
H
OH
80.
Арилгалогениды, содержащие двазаместителя в о-положениях к галогену, не
способны к SN-реакциям, так как в этом
случае образование арина невозможно
вследствие отсутствия атомов водорода,
необходимых для осуществления
элиминирования.
Br
H3C
OCH3
NaNH2 / NH3
не идёт
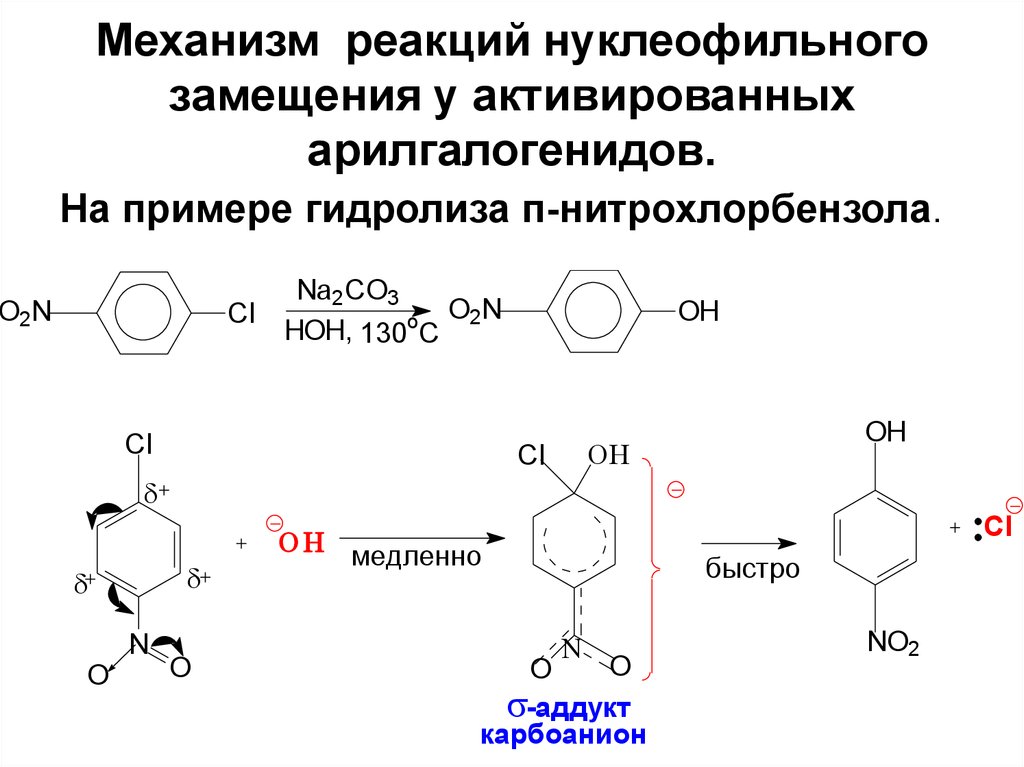
81. Механизм реакций нуклеофильного замещения у активированных арилгалогенидов.
На примере гидролиза п-нитрохлорбензола.O2N
Cl
Na2CO3
O2N
HOH, 130oC
Cl
OH
OH
Cl
N
O
O
Cl
медленно
быстро
O
O
-аддукт
карбоанион
NO2
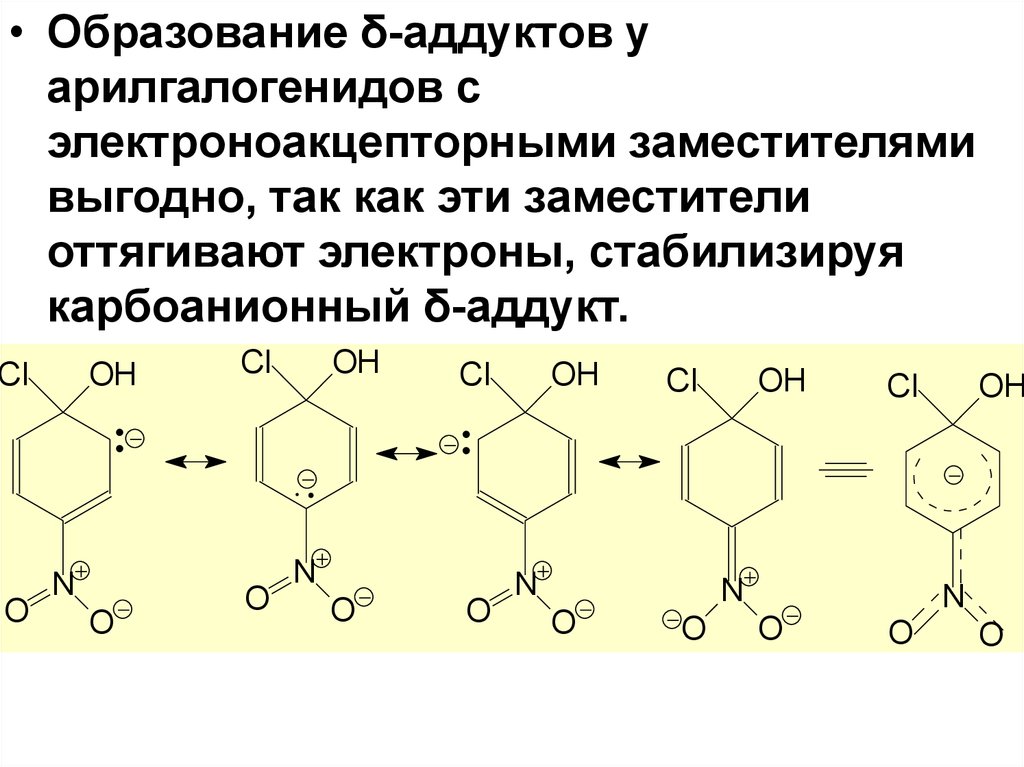
82.
• Образование δ-аддуктов уарилгалогенидов с
электроноакцепторными заместителями
выгодно, так как эти заместители
оттягивают электроны, стабилизируя
карбоанионный δ-аддукт.
Cl
O
OH
N
O
Cl
O
OH
Cl
N
O
O
OH
Cl
N
O
OH
Cl
N
O
O
OH
N
O
O
83.
• Т.к. в lim-стадии участвуют два веществареакция по своему типу относится к
SN2аром.
• Сравнение реакций SN2аром и SN2 у
насыщенного атома углерода приведено
на стр. 276 Учебника.
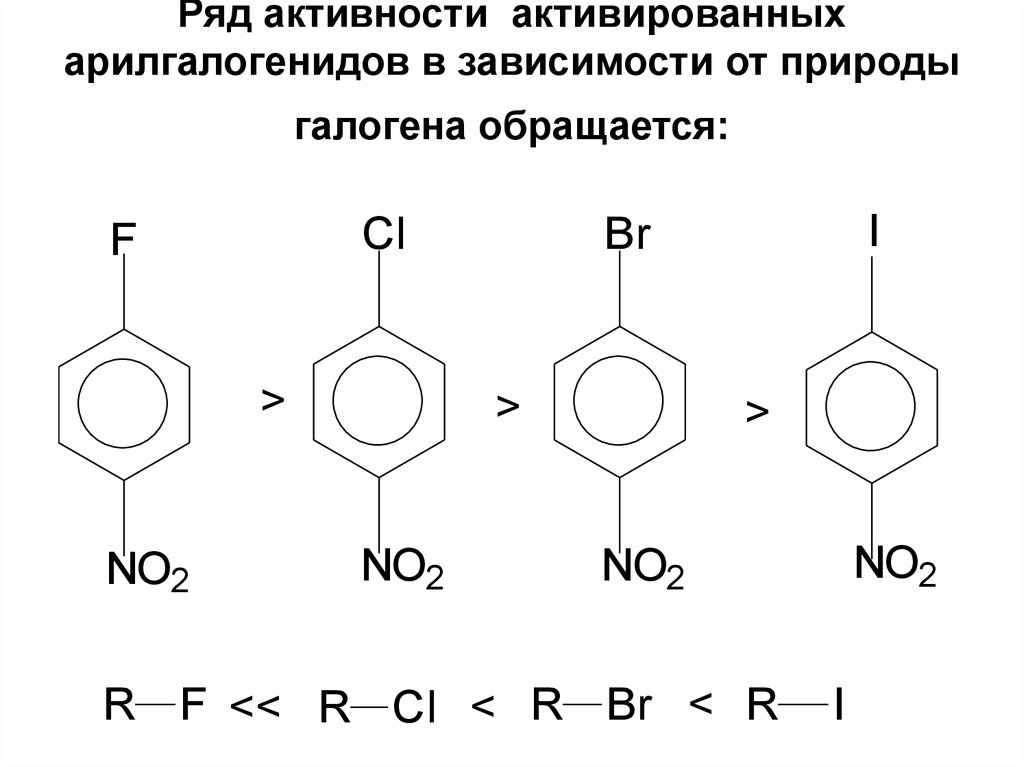
84. Ряд активности активированных арилгалогенидов в зависимости от природы галогена обращается:
ClF
>
NO2
>
NO2
I
Br
>
NO2
NO2
R F << R Cl < R Br < R
I
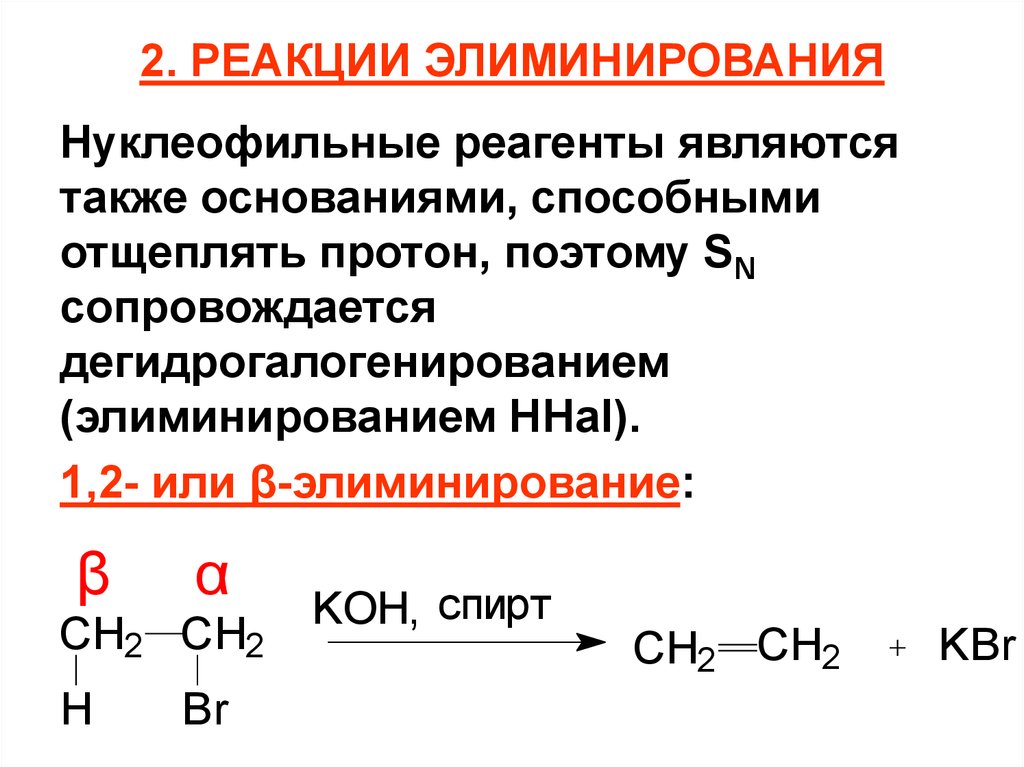
85. 2. РЕАКЦИИ ЭЛИМИНИРОВАНИЯ
Нуклеофильные реагенты являютсятакже основаниями, способными
отщеплять протон, поэтому SN
сопровождается
дегидрогалогенированием
(элиминированием НHal).
1,2- или β-элиминирование:
β
α
CH2 CH2
H
Br
KOH, спирт
СH2 CH2
KBr
86. α-элиминирование:
HCCl3
HO
HOH
CCl3
медл.
CCl2
Cl
дихлоркарбен
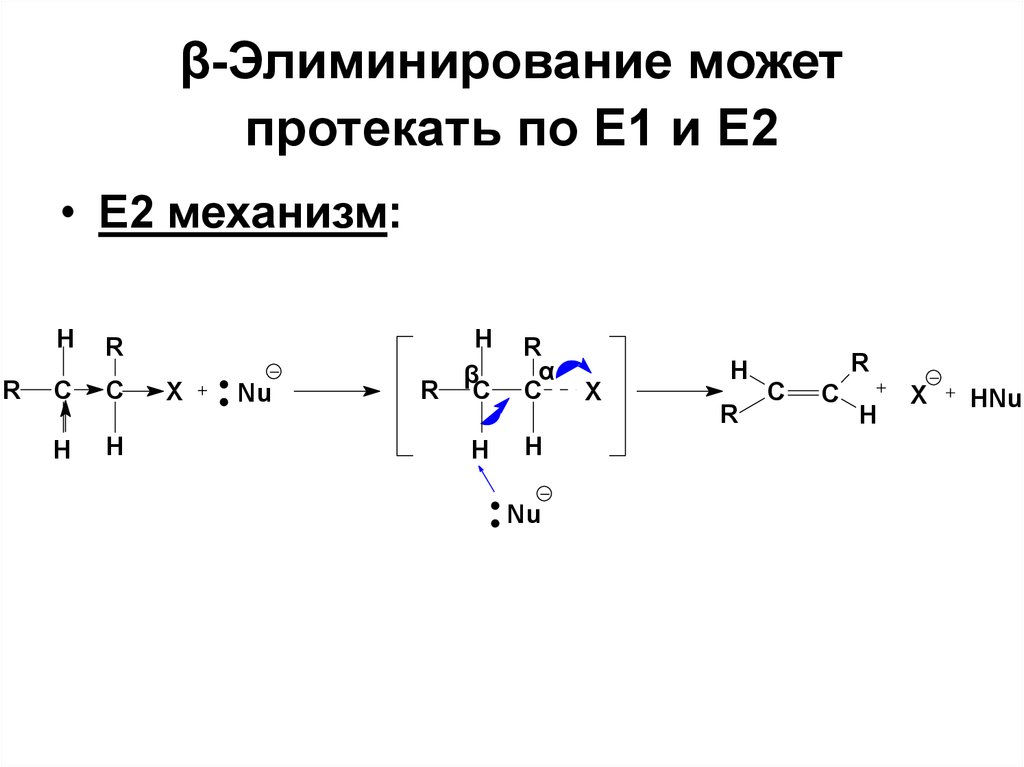
87. β-Элиминирование может протекать по Е1 и Е2
• Е2 механизм:H
R
R
C
C
H
H
X
Nu
H
β
R C
H
R
α
C
H
Nu
X
H
R
R
C
C
H
X
HNu
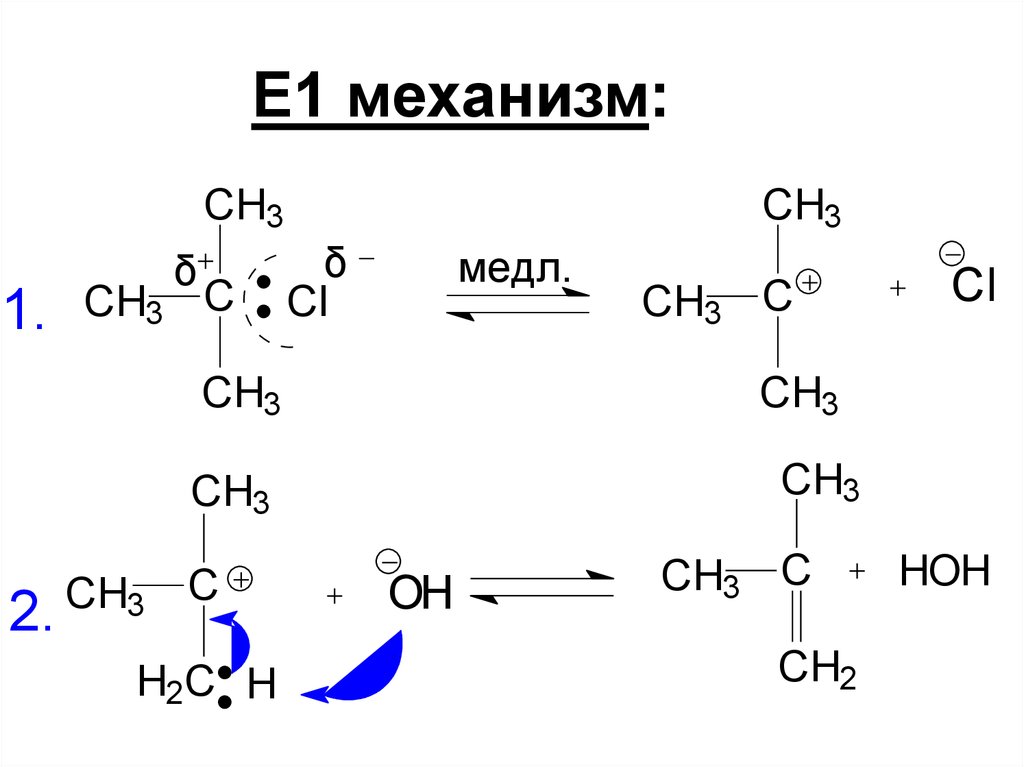
88. Е1 механизм:
CH31.
δ
CH3 C
CH3
δ
Cl
медл.
CH3
2.
CH3
H2C H
Cl
CH3
CH3
CH3
C
CH3 C
OH
CH3 C
CH2
HOH
89. Направление и стереохимия реакций элиминирования.
HBr
CH3-CH2-C-CH-CH3
CH3
KOH, t0C
CH3-CH2-C=CH-CH3 + HBr
спирт
CH3
• в соответствии с правилом Зайцева:
• Правило Зайцева не соблюдается при
наличии пространственных препятствий в
субстрате и использовании объемных
реагентов ( см. стр. 279-280 Учебник).
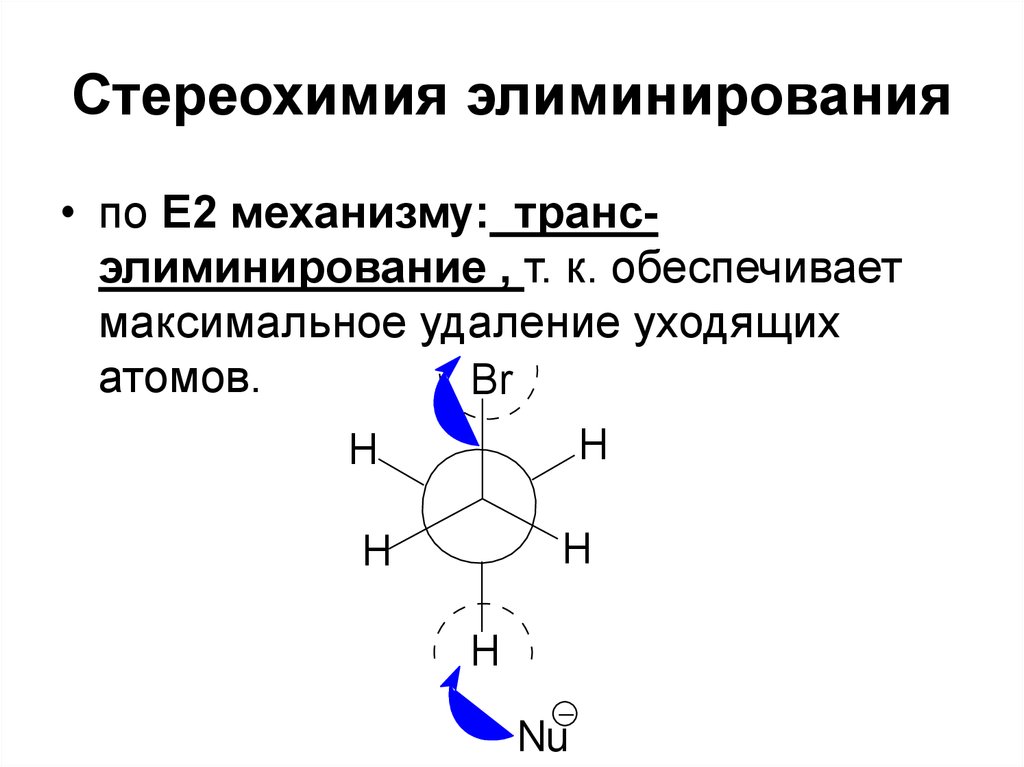
90. Стереохимия элиминирования
• по Е2 механизму: трансэлиминирование , т. к. обеспечиваетмаксимальное удаление уходящих
атомов.
Br
H
H
H
H
H
Nu
91. Факторы, влияющие на соотношение реакций замещения и элиминирования.
SNβ
C
H
E
C
α
SN
Nu
C C Nu
Hal
H
X
E
C C
• а) основность реагента;
• б) строение субстрата;
• в) температура реакции.
HNu
Hal
92. а) Основность реагента как сродство к протону увеличивает вклад Е-реакций:
NH2 > OC2H5 > OH > OC6H5 > Cl > Br > I93. б) строение субстрата
• В зависимости от природ Hal приодинаковом R скорость отщепления
изменяется в соответствии с
прочностью связи С- Hal:
R
I > R
Br > R Cl > R F
Элиминирование более характерно для
третичных и менее для первичных
алкилгалогенидов.
94. в) температура реакции.
• Повышение температурыувеличивает вклад Е-реакций.
95. 3.РЕАКЦИИ ГАЛОГЕНПРОИЗВОДНЫХ С МЕТАЛЛАМИ
• Алкил- и арилгалогениды реагируютс металлами с образованием
металлоорганических соединений.
Происходит образование связи
углерод-металл.
• Образование литийалкилов:
R
N2
Ha1 + 2Li растворитель R
Li + LiHa1
Литийарилы менее реакционноспособны, чем литийалкилы
96.
Li образует ковалентную связь сугдеродом, в то время как Na-производные
в основном ионные соединения. Они очень
реакционноспособны, и реакцию трудно
остановить на стадии образования Naалкилов: образовавшееся Na-органическое
соединение реагирует со второй молекулой
галогенопроизводного по реакции Вюрца.
97.
При переходе от R-Ha1 к Li - и Naорганическим соединениям происходитобращение поляризации атома углерода
от карбокатионного типа к
карбанионному.
Поэтому Li -алкилы и Na-алкилы –
сильнейшие С-основания и Снуклеофилы.
98. Mg-органические галогениды –реактивы Гриньяра ( 1912 г. Нобелевская премия).
Mg-органические галогениды –реактивы Гриньяра ( 1912 г. Нобелевская премия).
C2H5
Br
Mg
C2H5OC2H5
C2H5
MgBr
этилмагнийбромид
Роль диэтилового эфира :
1) эфир растворяет RMgX, удаляя его с поверхности
металла, что способствует протеканию реакции до
конца. Растворение происходит за счёт сольватации
эфиром .
2) Диэтиловый эфир имеет низкую Т.кип. (34,8оС) и
«подушка» паров над раствором защищает RMgX от
окисления О2 воздуха.
Чаще для получения реактивов Гриньяра
используются R-Br, так как R-Cl реагируют вяло, R-I
дают малые выходы. Н- Алкилгалогениды дают
лучшие выходы, чем втор-, а втор- лучшие, чем треталкилгалогениды.
99. Реакции магнийорганических соединений.
• В реактивах Гриньяра связь достаточнополярна, что определяет карбанионный
характер атома углерода , и позволяет
рассматривать их как нуклеофильные
реагенты.
• 1). Взаимодействие с соединениями,
имеющими подвижный атом водорода.
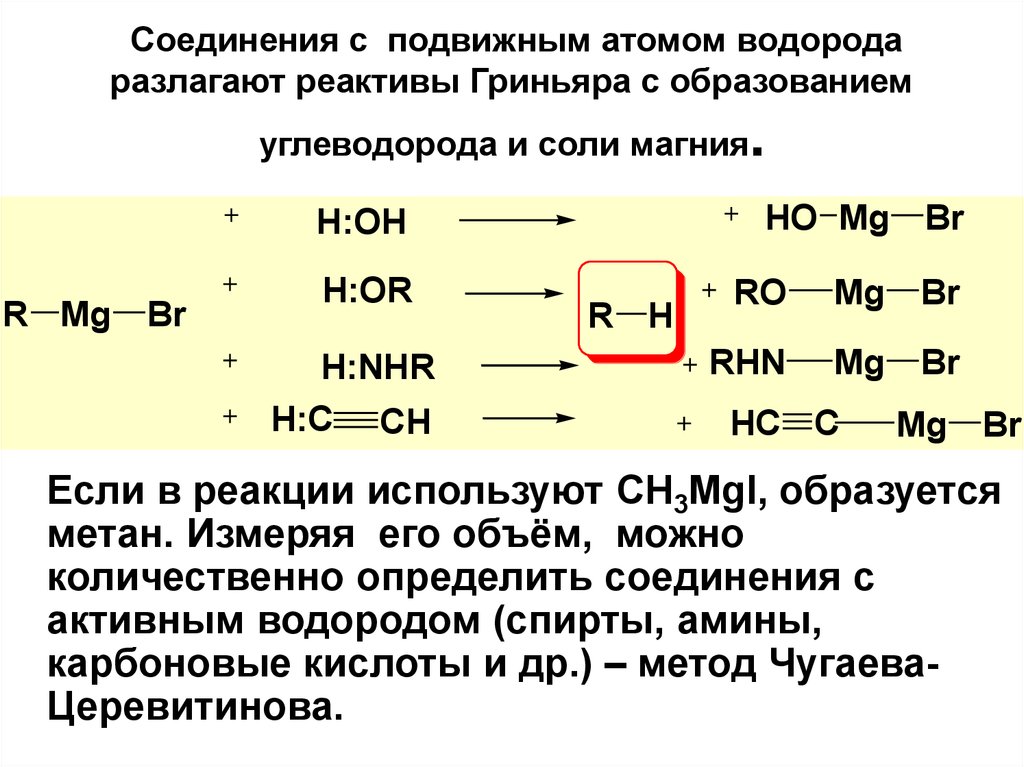
100. Соединения с подвижным атомом водорода разлагают реактивы Гриньяра с образованием углеводорода и соли магния.
Соединения с подвижным атомом водородаразлагают реактивы Гриньяра с образованием
.
углеводорода и соли магния
H:OH
R Mg Br
H:OR
H:NHR
H:C CH
HO Mg Br
R H
RO
Mg Br
RHN
Mg Br
HC C
Mg Br
Если в реакции используют CH3MgI, образуется
метан. Измеряя его объём, можно
количественно определить соединения с
активным водородом (спирты, амины,
карбоновые кислоты и др.) – метод ЧугаеваЦеревитинова.
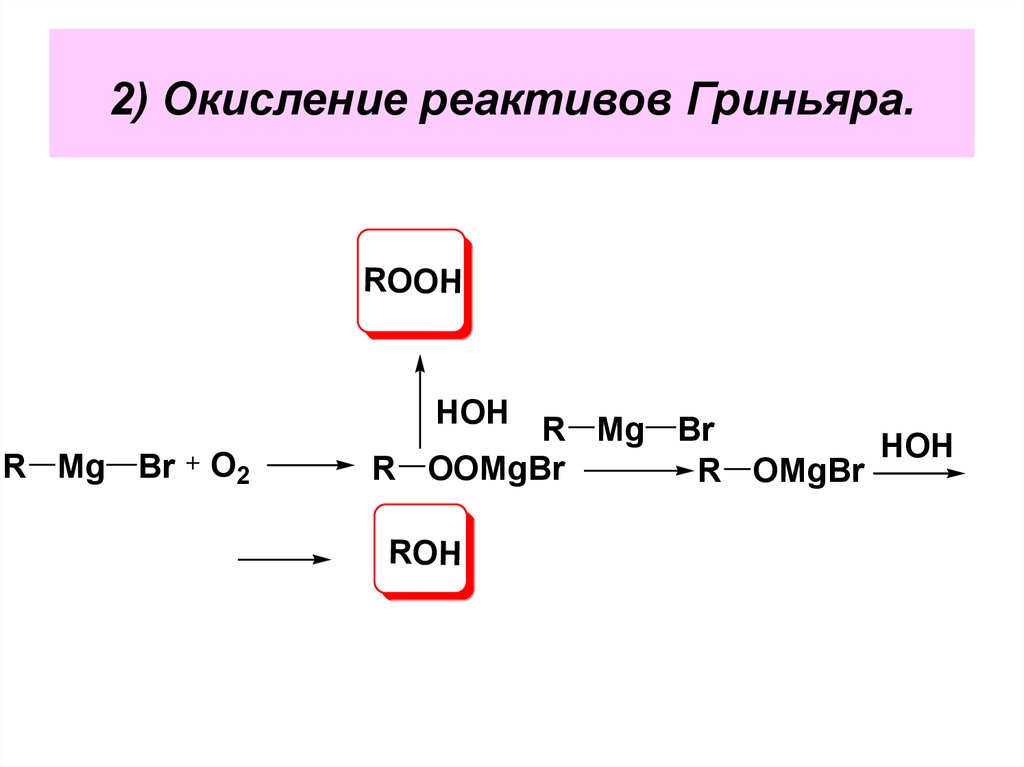
101. 2) Окисление реактивов Гриньяра.
ROOHHOH
R Mg Br
O2
R Mg Br
HOH
R OOMgBr
R OMgBr
ROH
102. 3.Присоединение к полярным кратным связям.
H СR1 С
O
H
O
H
R MgBr
OMgBr
HO
H C R 2
H
R MgBr
R1
O
R MgBr
CH2 R
Mg(OH)Br
первичный спирт
OMgBr
OH
H2O
C R
R1 CH R Mg(OH)Br
H
вторичный спирт
R
R1 C R2
OH
R1 C R2
H2O
OMgBr
R
R1 C R2
Mg(OH)Br
OH
третичный спирт






























































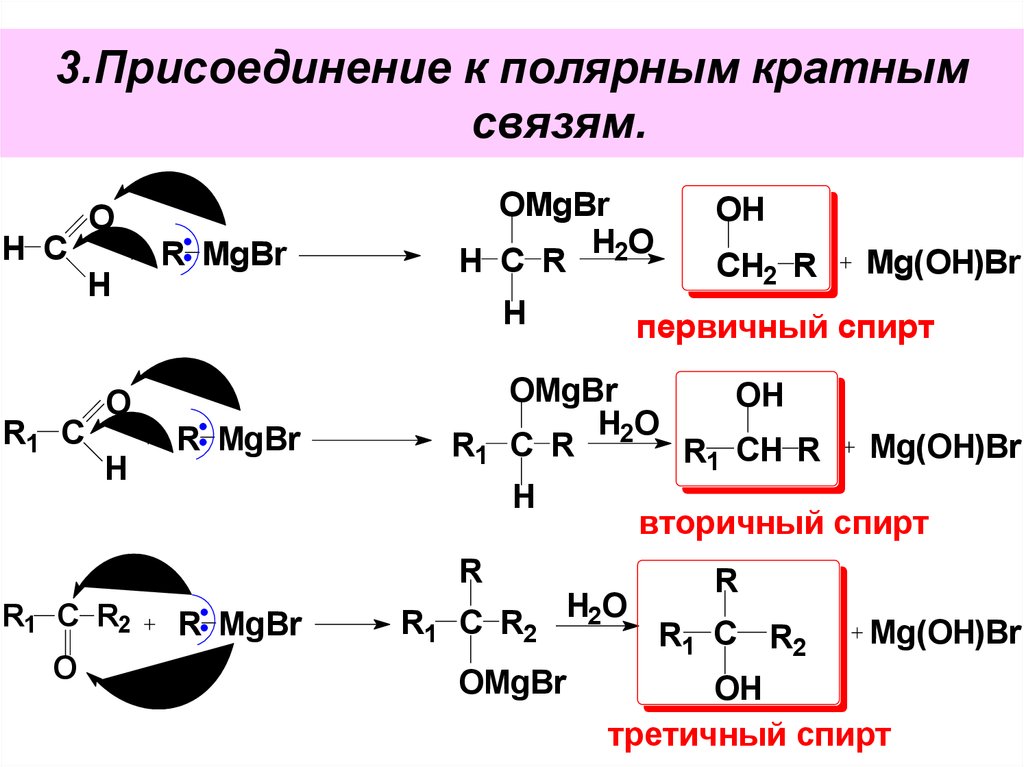
 chemistry
chemistry








