Similar presentations:
Основные интермедиаты в органических реакциях. Часть 1
1. Часть 1
Основные интермедиаты ворганических реакциях
2.
• Многиеорганические
реакции
проходят
через
образование
промежуточных
малостабильных
частиц
–
карбокатионов,
карбоанионов, радикалов…
• Стабилизация частиц достигается в
первую
очередь
за
счет
резонансных
структур,
а
не
индуктивных эффектов
3. Карбокатионы
• Карбокатионы – неустойчивые частицы, вкоторых атом углерода имеет три заместителя
и несет положительный заряд
H
C
+
H
H
• Как правило плоские -> ахиральны
4. Устойчивость
• Наличие донорных групп стабилизируеткарбокатион. Например, устойчивость
возрастает
в
ряду
CH3+>CH3CH2+>CH(CH3)2+>C(CH3)3+
• Наличие в α-положении двойной связи
стабилизирует карбокатион (PhCH2+ и
CH2=CHCH2+ стабильнее CH3+)
5. Устойчивость
• Абсолютно нестабильны и образуютсякрайне
редко
карбокатионы
с
положительным зарядом при двойной
связи
6. Устойчивость
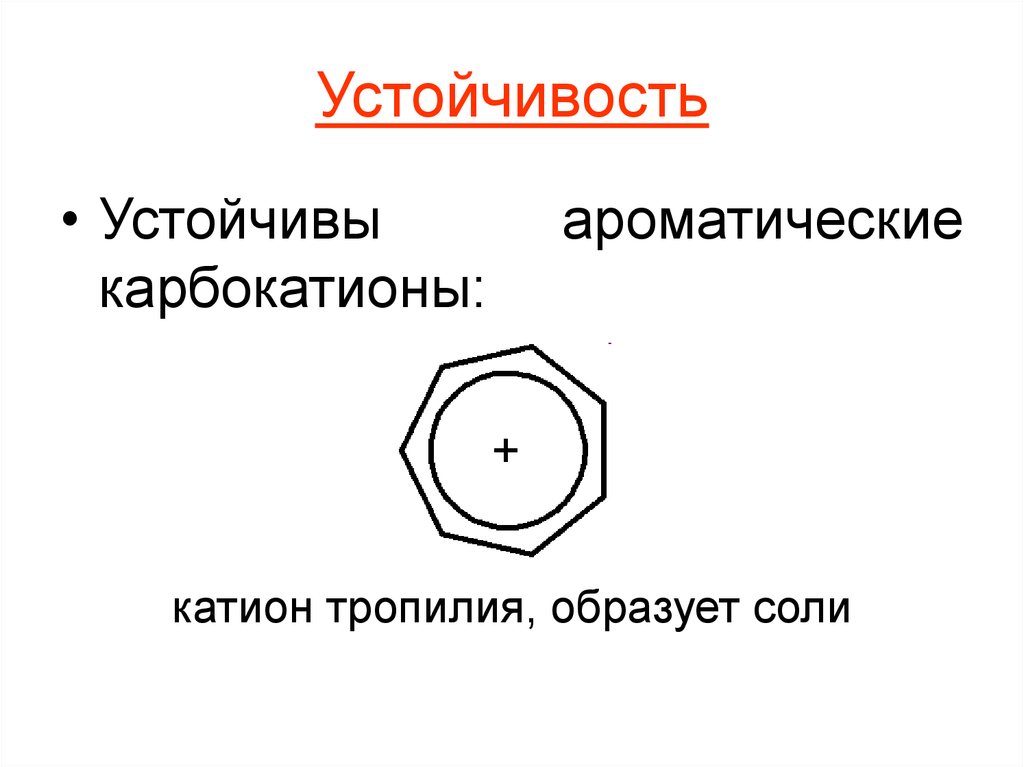
• Устойчивыкарбокатионы:
ароматические
катион тропилия, образует соли
7. Генерация
1. Гетеролитический разрыв связи C-X:O
+
AlCl3
+
RCO AlCl4
Cl
+
N
N
+
-
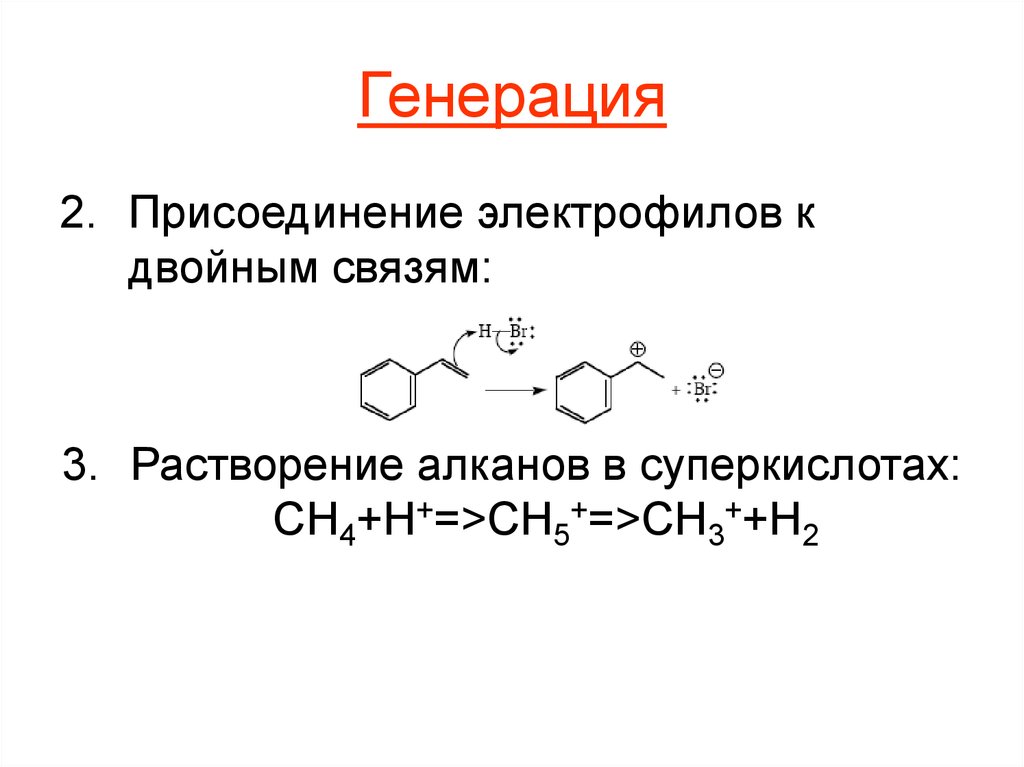
8. Генерация
2. Присоединение электрофилов кдвойным связям:
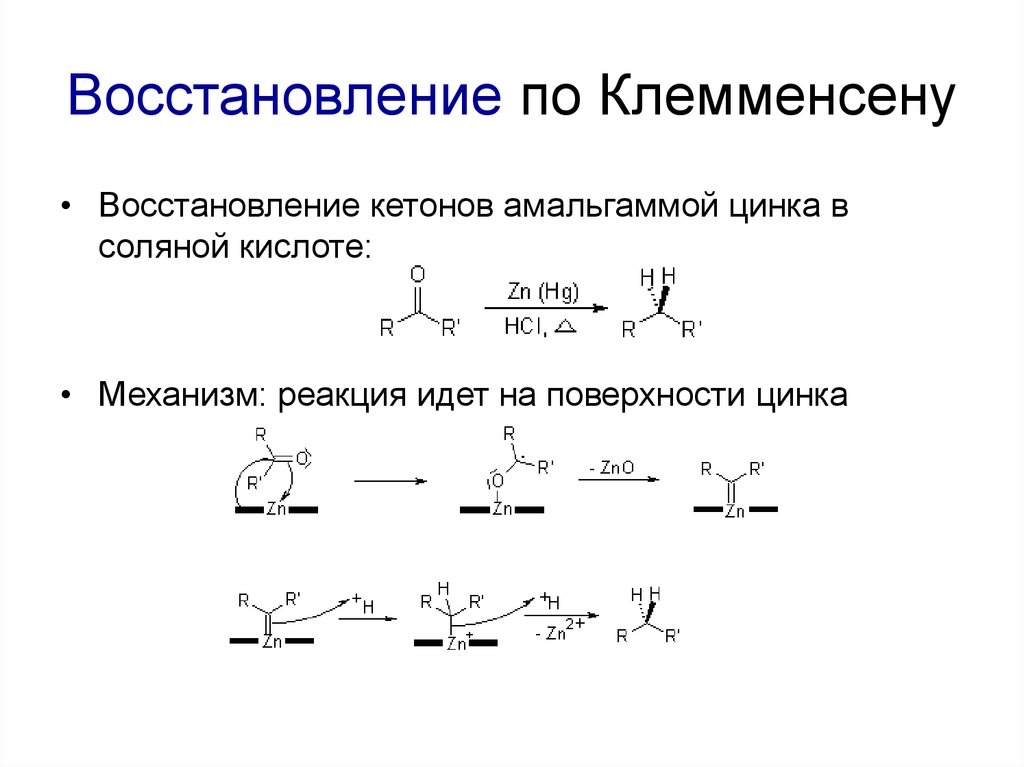
3. Растворение алканов в суперкислотах:
CH4+H+=>CH5+=>CH3++H2
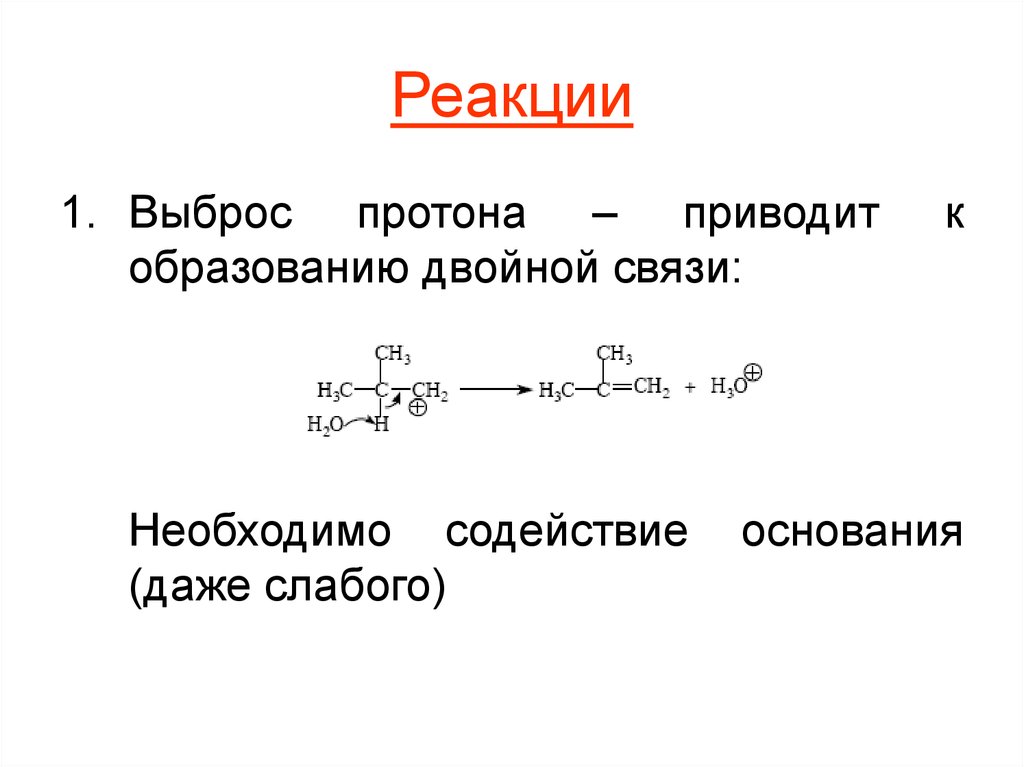
9. Реакции
1. Выброс протона – приводитобразованию двойной связи:
Необходимо содействие
(даже слабого)
к
основания
10. Реакции
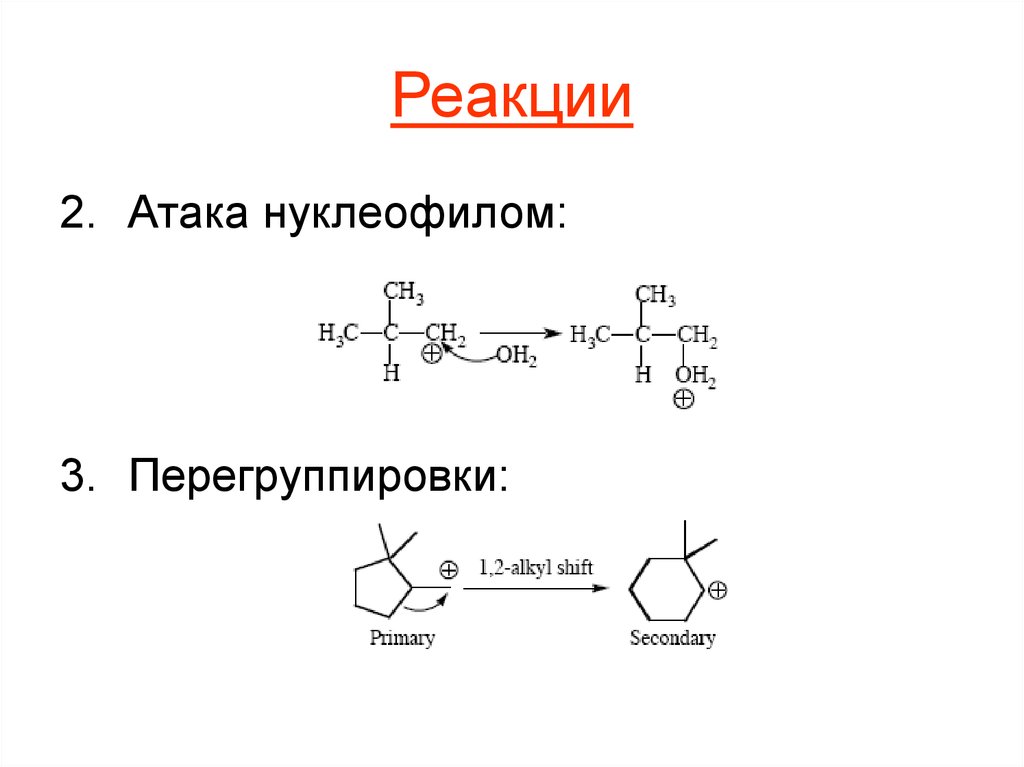
2. Атака нуклеофилом:3. Перегруппировки:
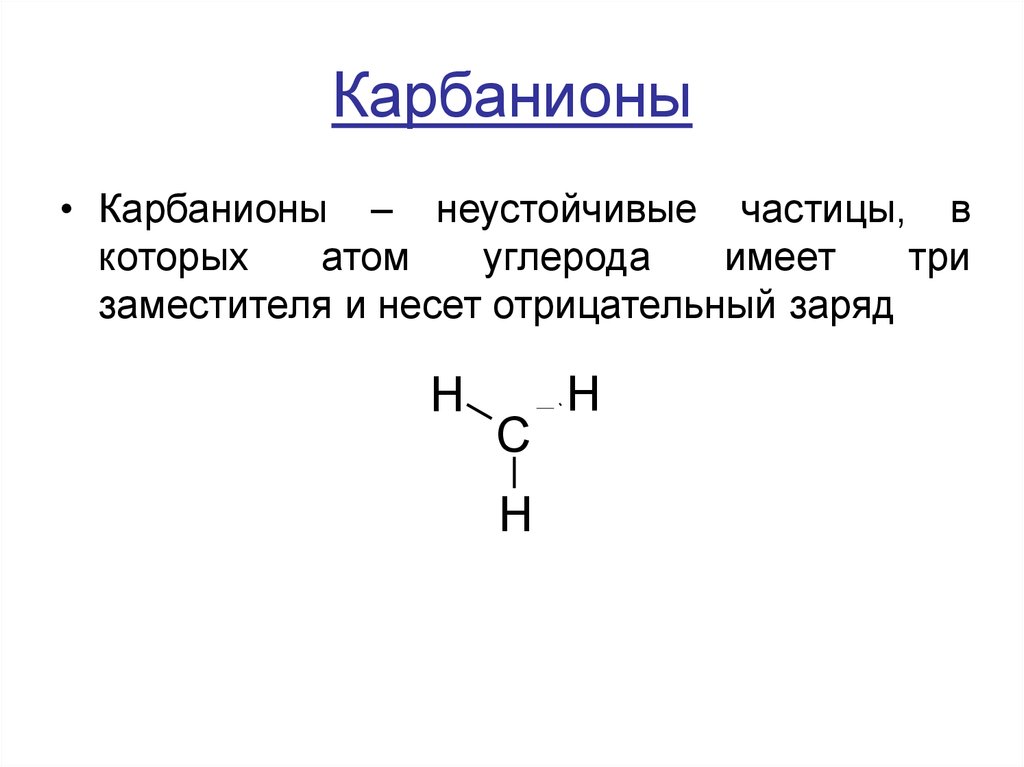
11. Карбанионы
• Карбанионы – неустойчивые частицы, вкоторых
атом
углерода
имеет
три
заместителя и несет отрицательный заряд
H
C
H
H
12. Устойчивость
• Наличиеакцепторных
групп
стабилизирует карбанион: pKa для
кетонов ~25, а для алканов ~50
• Относительно более стабильны анионы
аллильного и бензильного типа
• Стабильны ароматические карбанионы:
13. Генерация
• Депротонирование C-H кислот:• Металлирование галогенидов:
14. Реакции
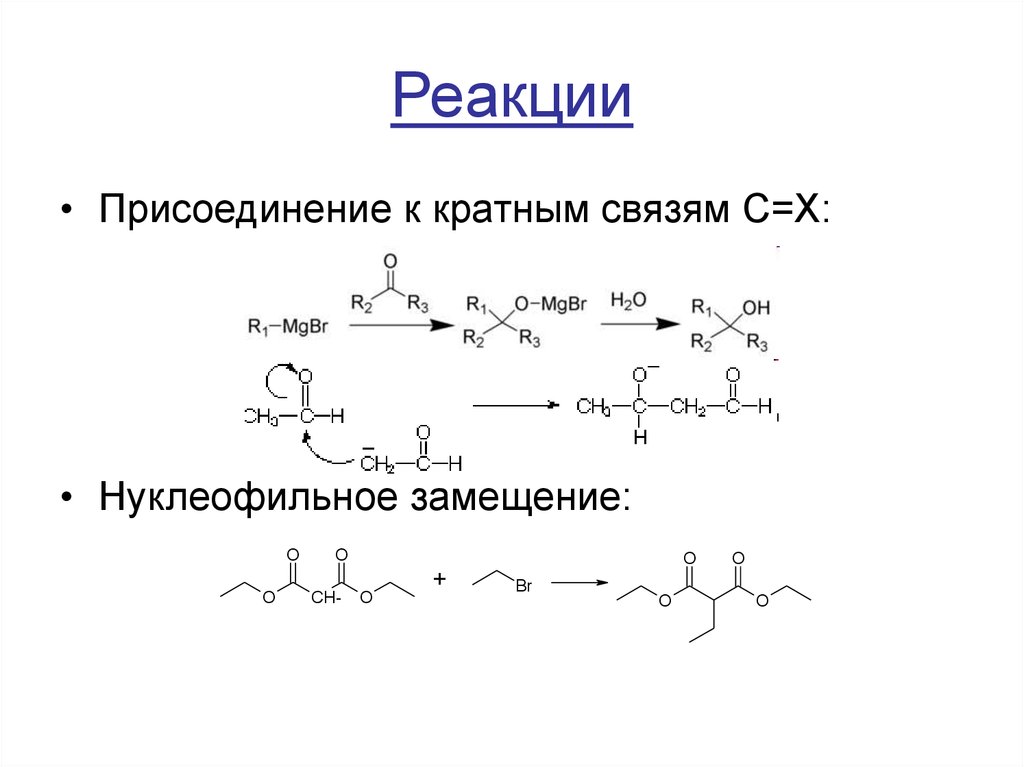
• Присоединение к кратным связям C=X:• Нуклеофильное замещение:
O
O
O
CH-
O
O
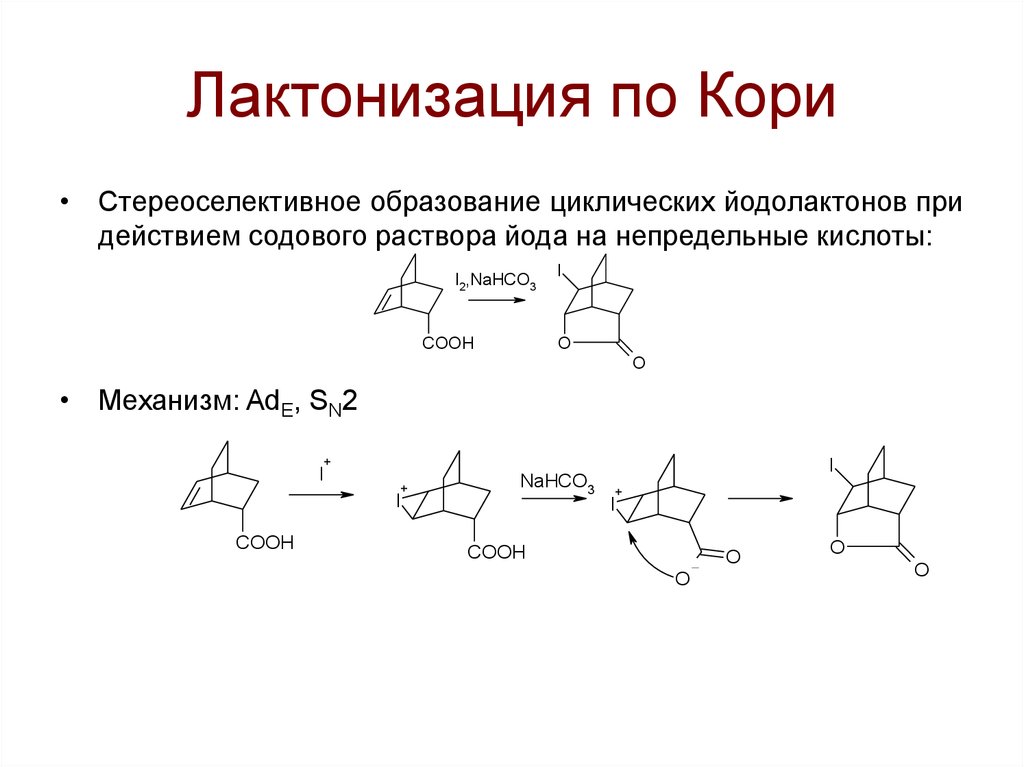
+
Br
O
O
O
15. Реакции
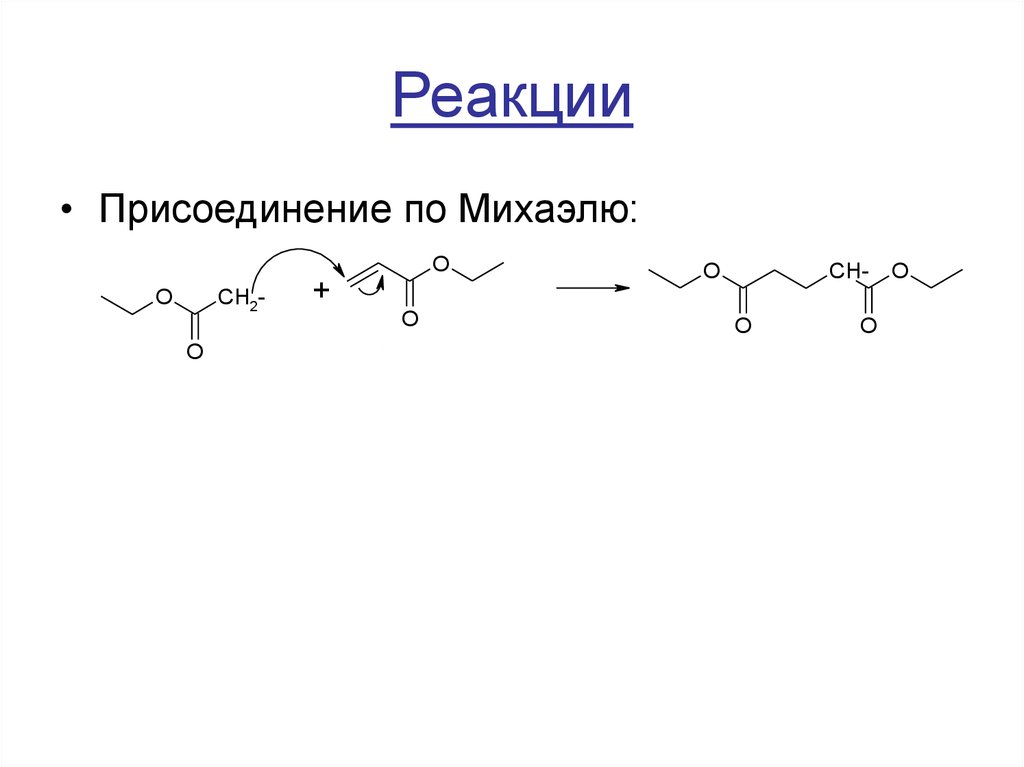
• Присоединение по Михаэлю:O
CH2-
O
O
+
O
CH-
O
O
O
O
16. Радикалы
• В общем случае – частицы с неспареннымиэлектронами
H
C
H
H
• В общем случае не обязательно плоские
17. Стабильность
• Электронодонорные заместители стабилизируют радикалы,электроноакцепторные – дестабилизируют
• Кинетически стабильны стерически затрудненные радикалы
(Ph3C, ДФПГ)
• Стабильны
радикалы,
содержащие
в
α-положении
к
радикальному центру двойную связь (бензильный, аллильный)
• Стабильные радикалы:
O
+
O N
O
+
N N
N
+
O N
O
ДФПГ
O
18. Генерация
• Термический распад некоторых соединений(пероксидов, азосоединений):
T
N N
CN
2
C
CN
CN
+
N2
AIBN
• Реакции «обычных» молекул с радикалами:
+
Br
.
CH2
+
BrH
19. Генерация
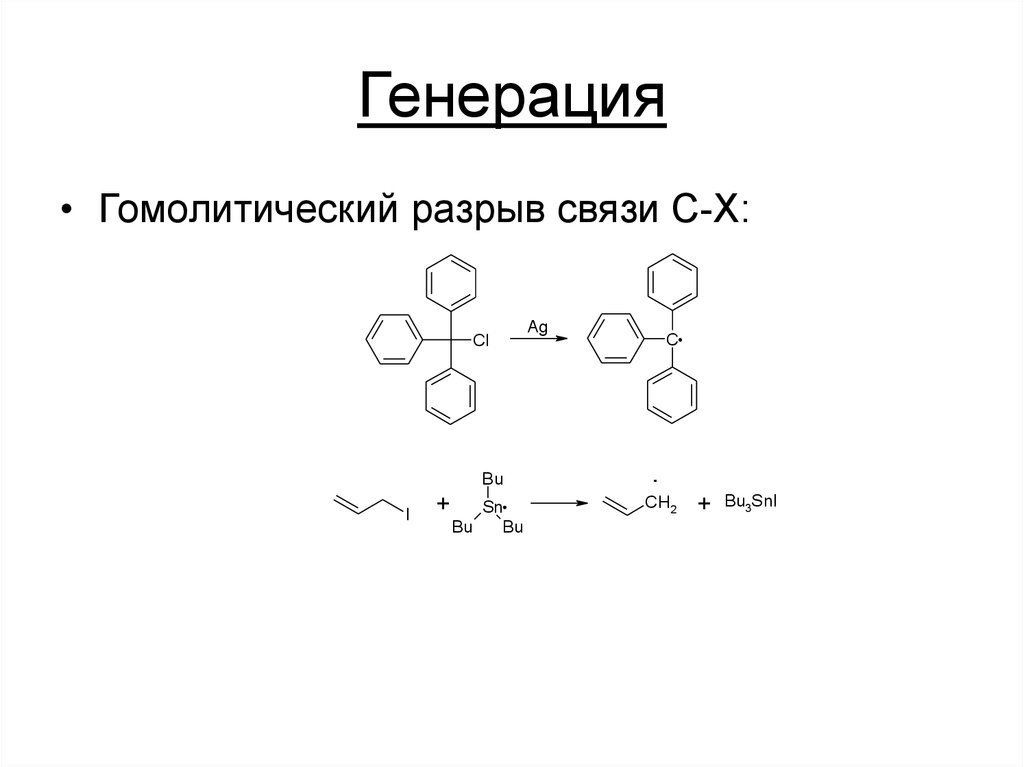
• Гомолитический разрыв связи C-X:Cl
Bu
I
+
Sn
Bu
Bu
Ag
C
.
CH2
+
Bu3SnI
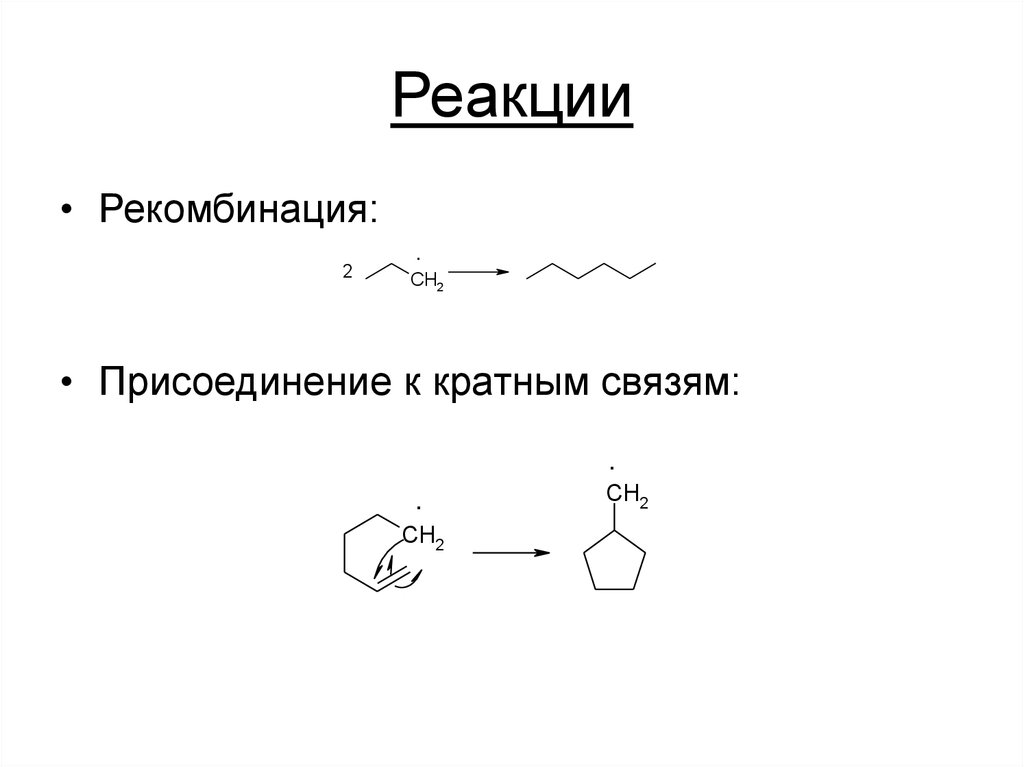
20. Реакции
• Рекомбинация:2
.
CH2
• Присоединение к кратным связям:
.
.
CH2
CH2
21. Реакции
• Разрыв связей C-X:+
Br
.
CH2
+
BrH
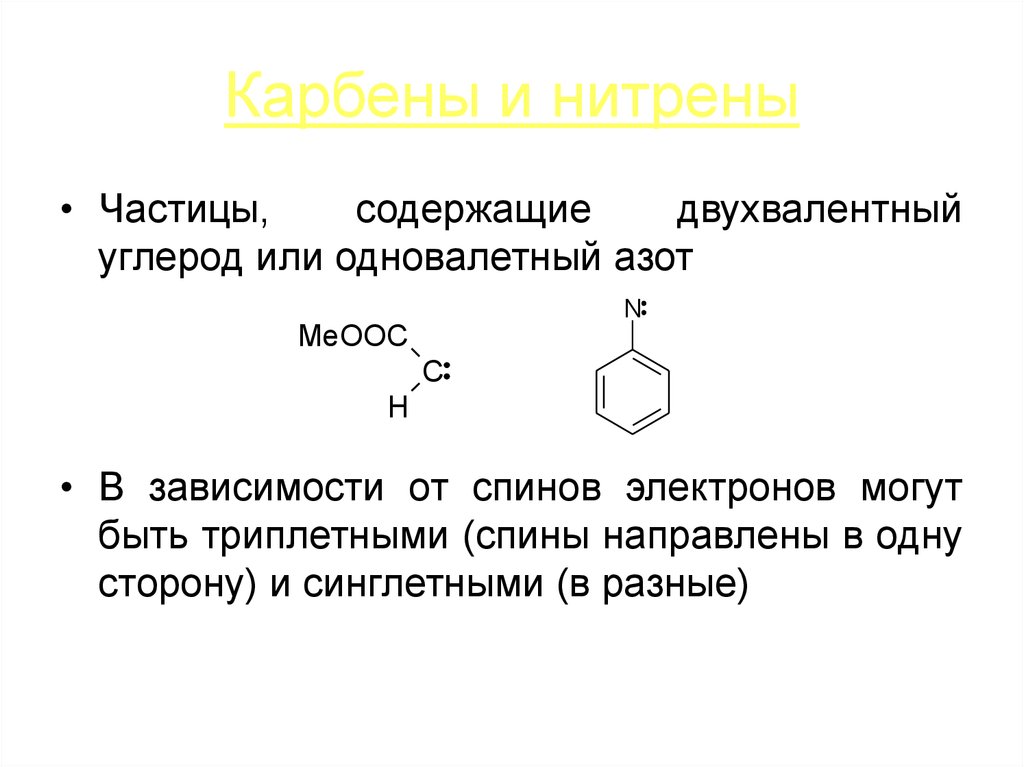
22. Карбены и нитрены
• Частицы,содержащие
двухвалентный
углерод или одновалетный азот
N
MeOOC
C
H
• В зависимости от спинов электронов могут
быть триплетными (спины направлены в одну
сторону) и синглетными (в разные)
23. Устойчивость
• Все карбены крайне неустойчивы• Возможна
стабилизация
за
счет
резонанса (опять же арильные и
винильные заместители)
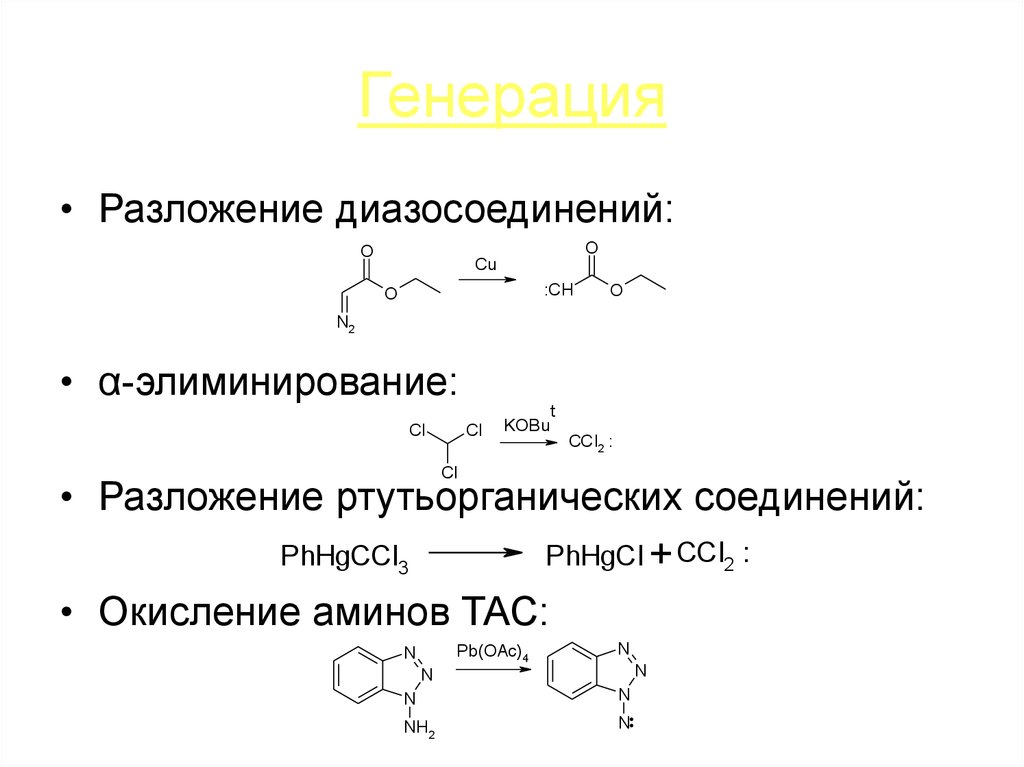
24. Генерация
• Разложение диазосоединений:O
O
Cu
:CH
O
O
N2
• α-элиминирование:
Cl
Cl
KOBu
t
CCl2 :
Cl
• Разложение ртутьорганических соединений:
PhHgCCl3
PhHgCl + CCl2 :
• Окисление аминов ТАС:
Pb(OAc)4
N
N
N
N
N
N
NH2
N
25. Реакции
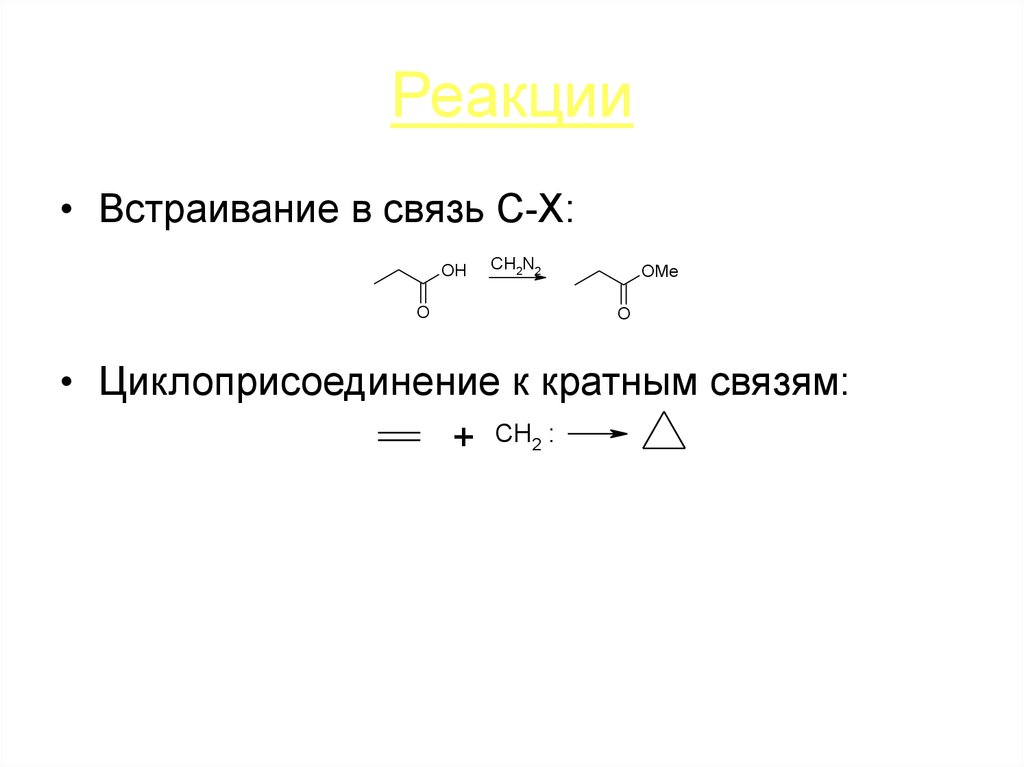
• Встраивание в связь C-X:OH
O
CH2N2
OMe
O
• Циклоприсоединение к кратным связям:
+ CH2 :
26.
Помимо описанных выше частицсуществует
много
других
(ионрадикалы, арины, металлоорганические
соединения). Они встречаются реже и
будут рассмотрены в соответствующих
реакциях
27. Часть 2
Основные механизмыорганических реакций
28. Нуклеофильное замещение
R-X+Nu:->R-Nu+X:• Нуклеофил – частица (ион, молекула),
имеющая электронную пару
• Нуклеофильное
замещение
может
проходить по механизмам SN1, SN2,
SNAr, SNi
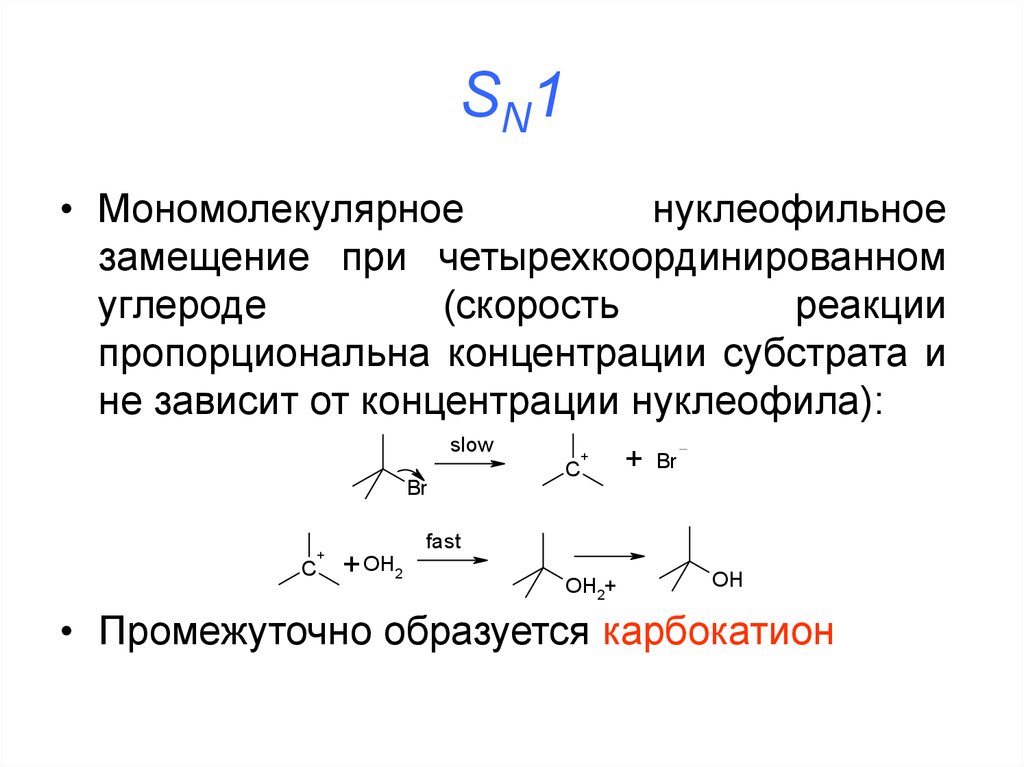
29. SN1
• Мономолекулярноенуклеофильное
замещение при четырехкоординированном
углероде
(скорость
реакции
пропорциональна концентрации субстрата и
не зависит от концентрации нуклеофила):
slow
Br
C
+
+ OH2
C
+
+
Br
fast
OH2+
OH
• Промежуточно образуется карбокатион
30. SN2
• Бимолекулярноезамещение
(скорость
реакции
прямо
пропорциональна
концентрациям нуклеофила и субстрата)
Br
Br
I
H
I
H
+
Br
H
I
• Реакция
проходит
пятикоординированный углерод
через
31. Сравнение SN1 и SN2
• SN2 приводит к полному обращению конфигурации,SN1 – к полной (частичной) рацемизации
• SN2 не проходит для субстратов, содержащих
объемные группы при атакуемом атоме углерода
(например (CH3)3CCI)
• Оптимальный растворитель для SN1 – достаточно
кислый протонный (CH3COOH), а для SN2 –
биполярный апротонный (ДМФА, ацетон)
32. SNAr
• Нуклеофильноезамещение
в
ароматических соединениях
• Может проходить через комплекс
Мейзенхеймера,
арины,
по
радикальному механизму и механизму
ANRORC
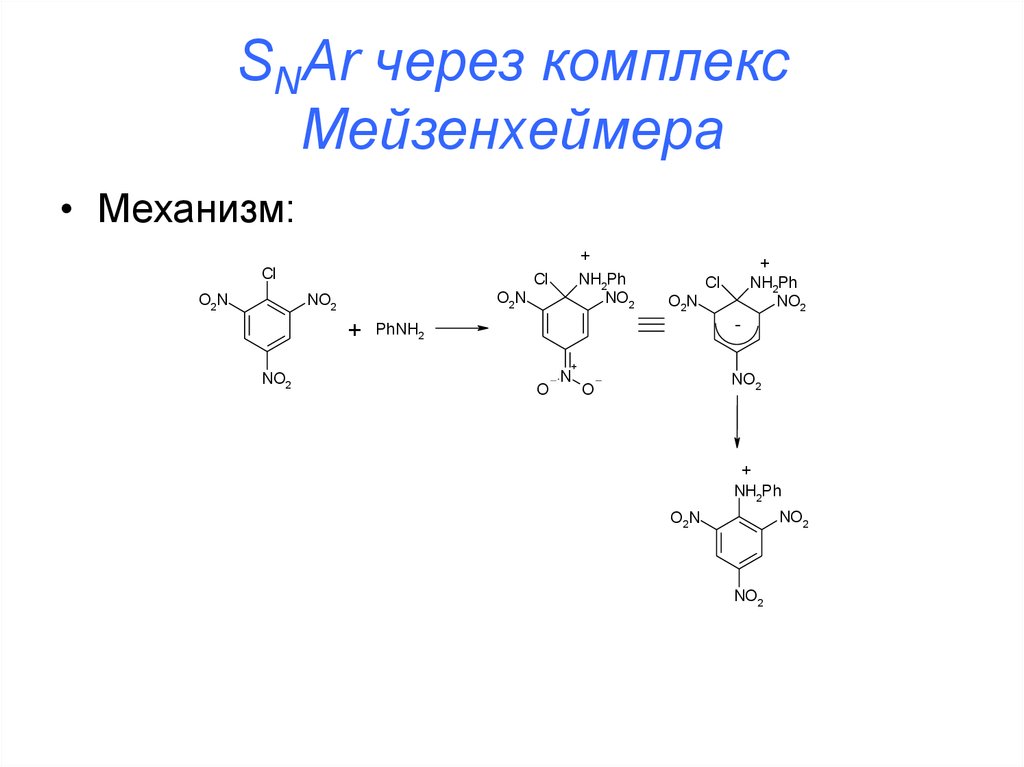
33. SNAr через комплекс Мейзенхеймера
• Характерно для активированных субстратов(содержащих электроноакцепторные группы)
• Для неактивированных субстратов проходит с
очень большим трудом (реакция хлорбензола
с NaOH проходит при 350oС и под давлением)
34. SNAr через комплекс Мейзенхеймера
• Механизм:Cl
Cl
O2N
NO2
O2N
+
NH2Ph
NO2
+
+
NH2Ph
NO2
Cl
O2N
-
PhNH2
+
NO2
O
N
NO2
O
+
NH2Ph
NO2
O2N
NO2
35. SNAr через образование аринов
• Протекаетоснований
• Приводит
продуктов
под
к
действием
образованию
сильных
смеси
36. SNAr через образование аринов
• Механизм:37. ANRORC
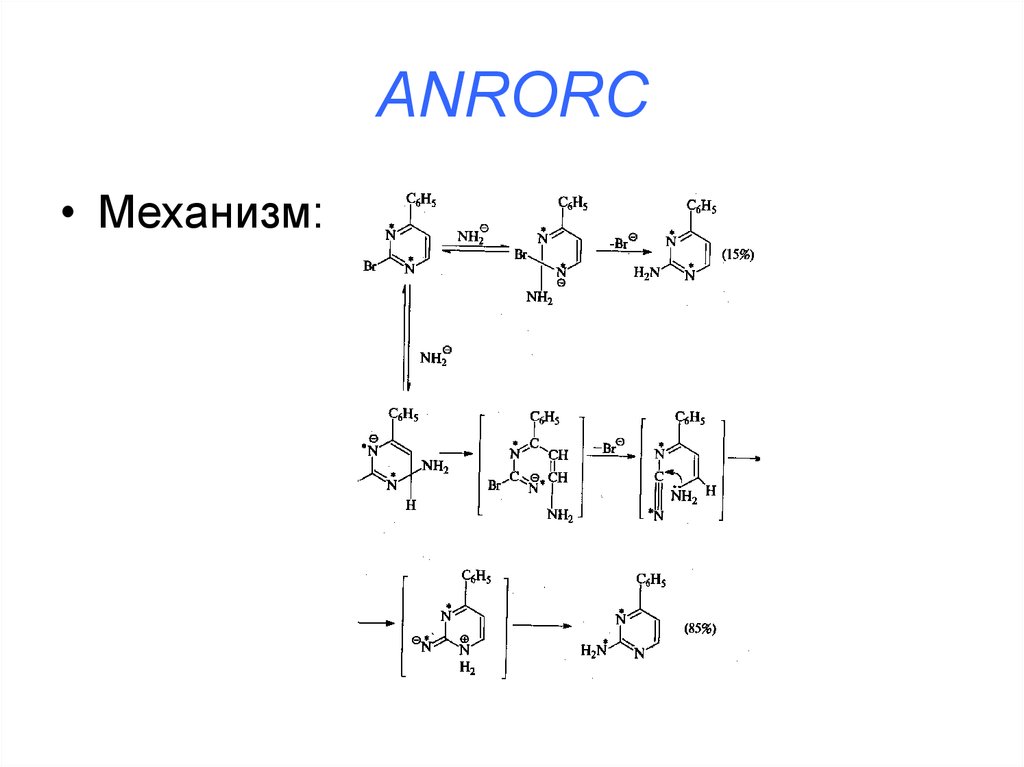
• Addition of Nucleofile, Ring Opening, RingCloisure (присоединение нуклеофила,
раскрытие цикла, закрытие цикла)
38. ANRORC
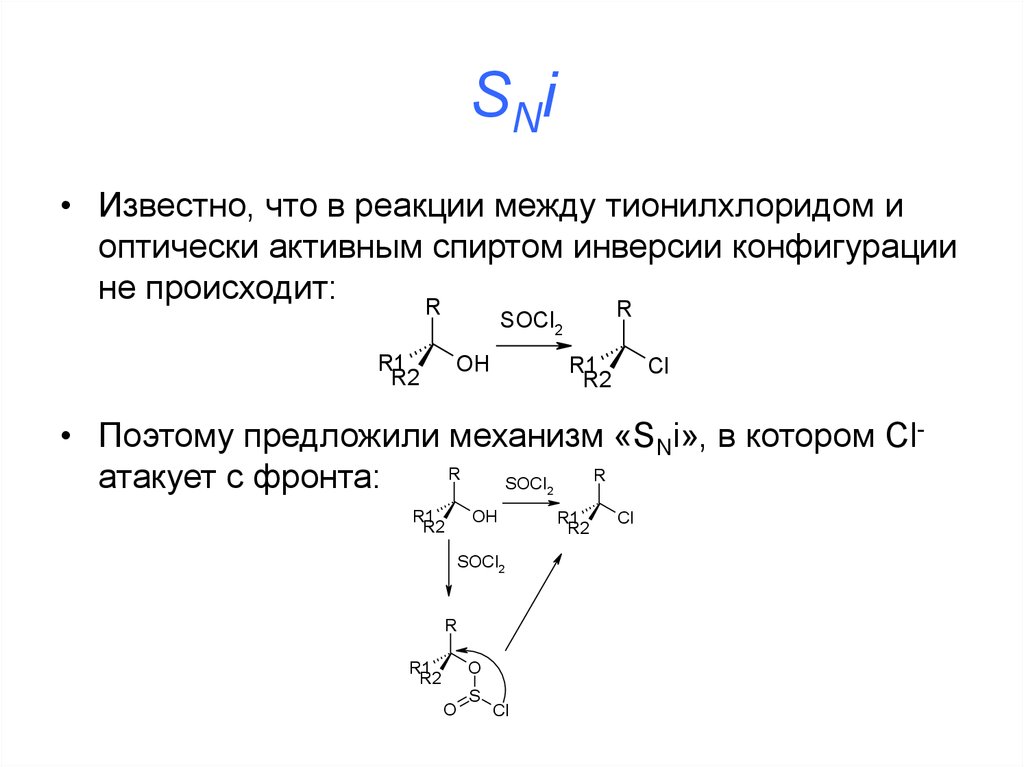
• Механизм:39. SNi
• Известно, что в реакции между тионилхлоридом иоптически активным спиртом инверсии конфигурации
не происходит:
R
R
SOCl2
R1
R2
OH
R1
R2
Cl
• Поэтому предложили механизм «SNi», в котором ClR
R
атакует с фронта:
SOCl
2
R1
R2
OH
SOCl2
R
R1
R2
O
O
S
Cl
R1
R2
Cl
40. SNi
• Однако такой механизм никого не устроил. Сейчассуществуют 2 альтернативных объяснения:
– Образование тесной ионной пары
R
R1
R2
R
+
O
O
S
R1
R2
R
+ SO2 + Cl
R1
R2
Cl
Cl
– Двойное обращение за счет нуклеофильности растворителя
R
R1
R2
O
O
R
O
S
+
+
O
O
R
R1
R2
O
Cl
Cl
R1
R2
Cl
41. Нуклеофильное присоединение
• Присоединение нуклеофильных реагентов к кратнойсвязи (в основном к связям C=X, где X=O,N)
O
O
CN
CN-
• Реакция обратима!
O
O
42. Электрофильное замещение
• Характерно для ароматических субстратов (SEAr)• Механизм:
• Правила ориентации (школьная программа)
43. Электрофильное присоединение
• Присоединениеэлектрофильных
реагентов к двойным связям (как
правило, C=C)
+
HgOAc
+
HgOAc
• Обратимая реакция (см. E1)
+
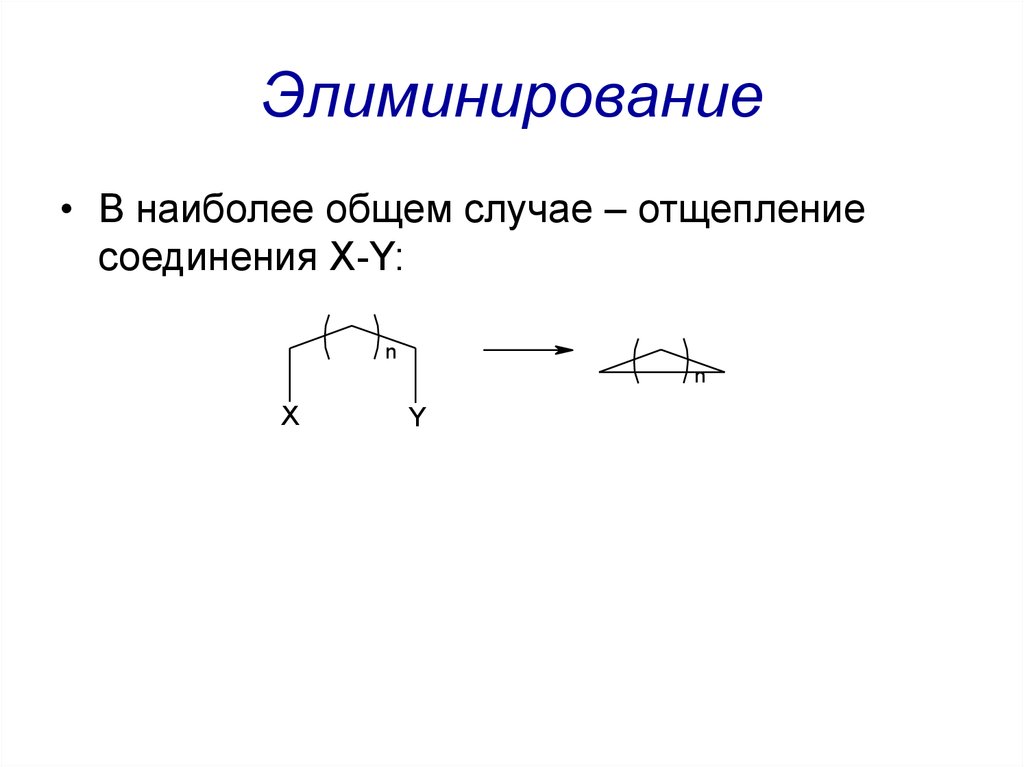
44. Элиминирование
• В наиболее общем случае – отщеплениесоединения X-Y:
n
n
X
Y
45. Элиминирование
• α-элиминирование:Cl
Cl
KOBu
t
CCl2 :
Cl
• β-элиминирование:
Y
+X
X
• γ-элиминирование:
Zn
Br
Br
Y
46. Элиминирование
• Наиболее распространены реакции βэлиминирования:t
KOBu
Cl
• Оно может протекать по двум механизмам:
E1 и E2
47. Элиминирование
• E1: мономолекулярное элиминирование; проходитобразование карбокатиона в достаточно кислых средах
через
+
H
OH2+
OH
+
• E2:
бимолекулярное
элиминирование;
антиперипланарного расположения H и X
B
H
Cl
требует
48. Элиминирование
• При β-элиминировании как правило образуется наиболеезамещенный и транс-алкен (правило Зайцева)
• Исключение из правила Зайцева – разложение гидроксидов
четвертичных аминов (реакция Гофмана):
Ag2O
NMe3+
I
H2O,t
+ NMe3
• Как правило, элиминирование конкурирует с нуклеофильным
замещением; при этом элиминированию способствует
нагревание и использование сильных оснований
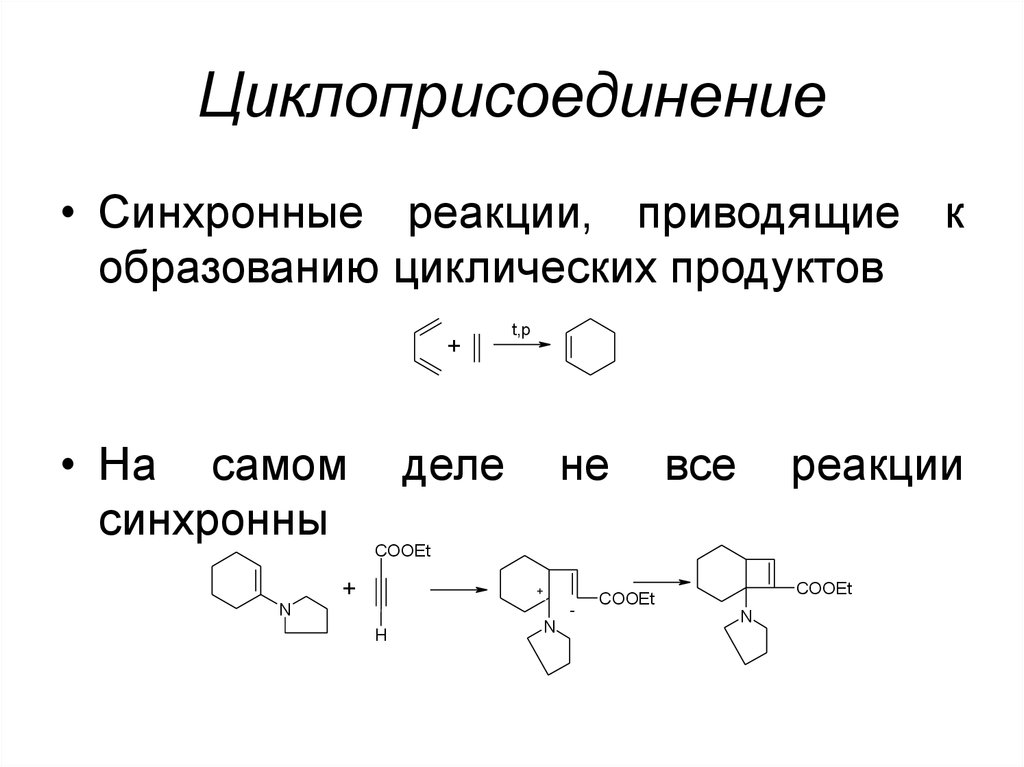
49. Циклоприсоединение
• Синхронные реакции, приводящие кобразованию циклических продуктов
+
• На самом
синхронны
t,p
деле
не
все
реакции
COOEt
+
+
N
H
N
COOEt
COOEt
N
50. [1,n]-сдвиги
• Сдвиги заместителей (характерны для карбокатионови карбанинов)
• [1,2]-гидридный сдвиг:
+
H
H
+
H
• [1,2]-алкильный сдвиг:
BuLi
O
O
O
51. Часть 3
Именные и безымянныеорганические реакции
52. Конденсации
• Реакции образования C-C связей,протекающие
с
отщеплением
небольших молекул
• В большинстве реакций участвуют
карбонильные соединения
• Мощный метод построения углеродного
скелета
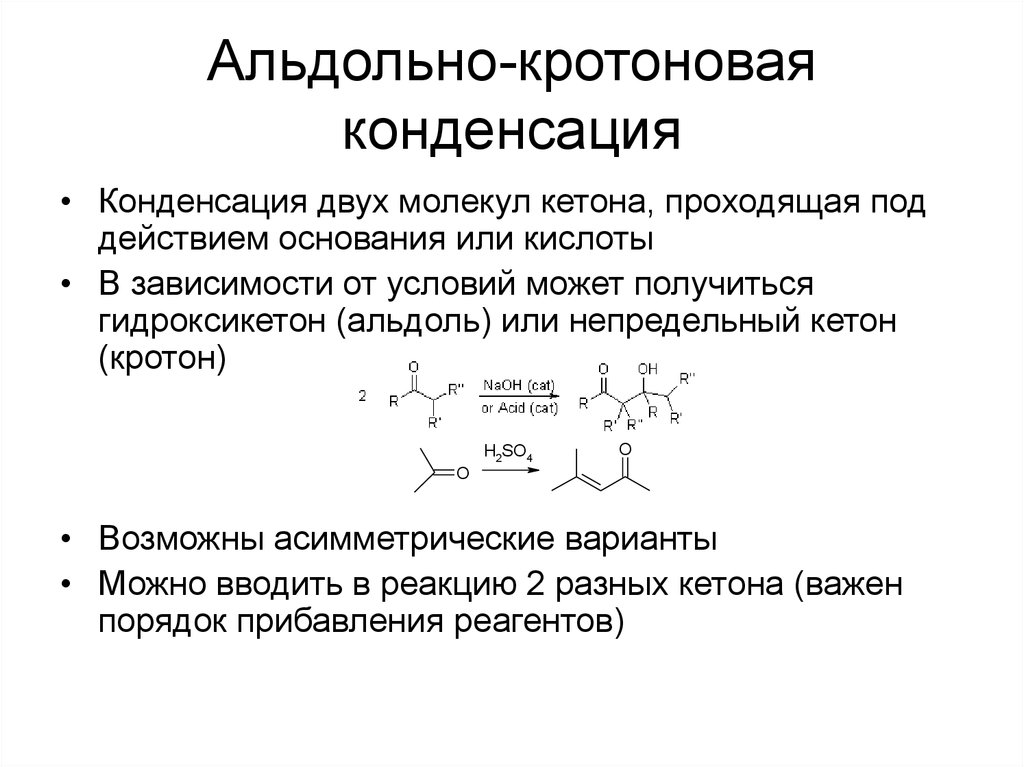
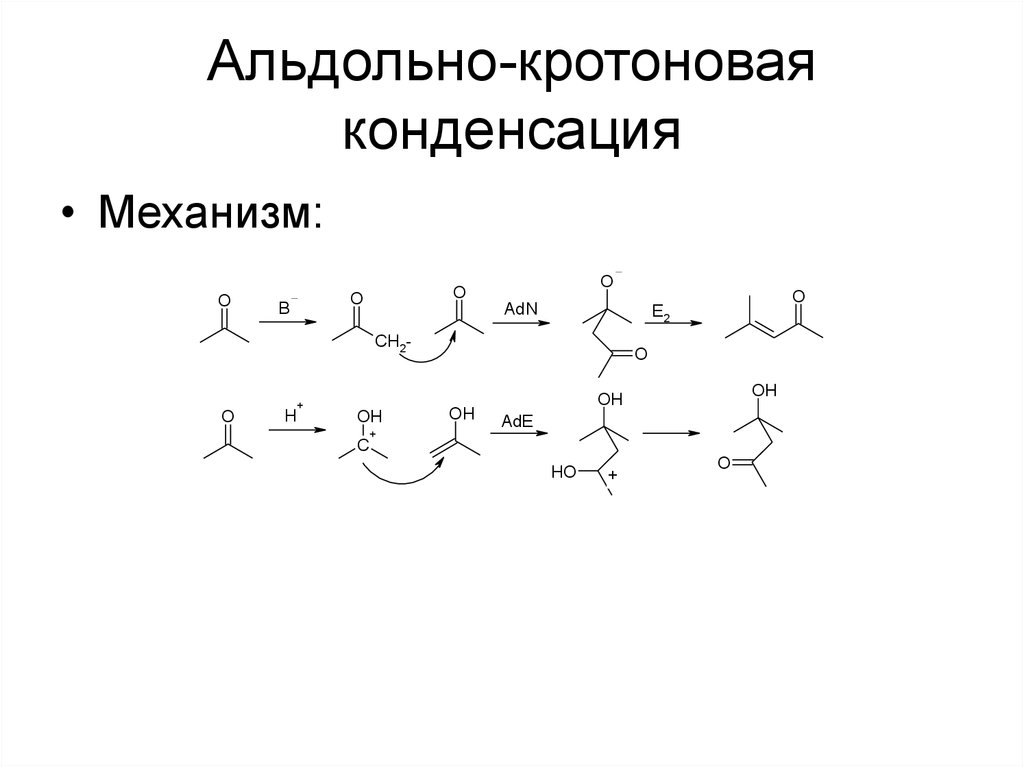
53. Альдольно-кротоновая конденсация
• Конденсация двух молекул кетона, проходящая поддействием основания или кислоты
• В зависимости от условий может получиться
гидроксикетон (альдоль) или непредельный кетон
(кротон)
H2SO4
O
O
• Возможны асимметрические варианты
• Можно вводить в реакцию 2 разных кетона (важен
порядок прибавления реагентов)
54. Альдольно-кротоновая конденсация
• Механизм:O
B
O
O
O
AdN
CH2-
O
+
H
OH
C
+
O
E2
O
OH
OH
OH
AdE
HO
+
O
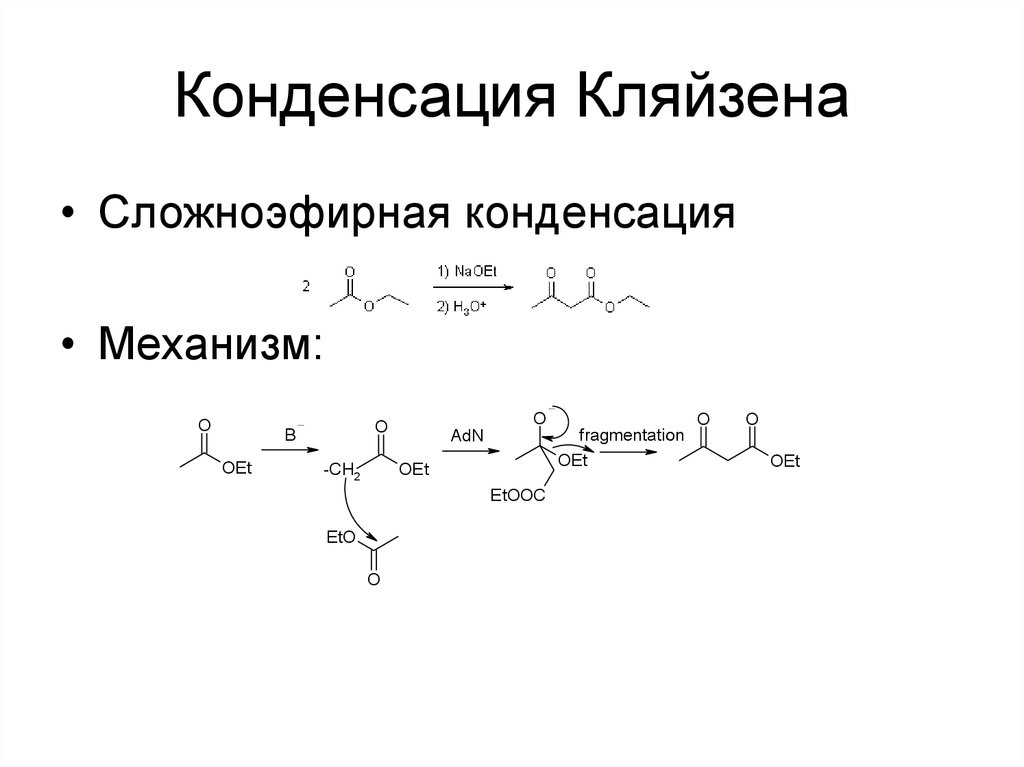
55. Конденсация Кляйзена
• Сложноэфирная конденсация• Механизм:
O
OEt
O
O
B
fragmentation
AdN
OEt
OEt
-CH2
EtOOC
EtO
O
O
O
OEt
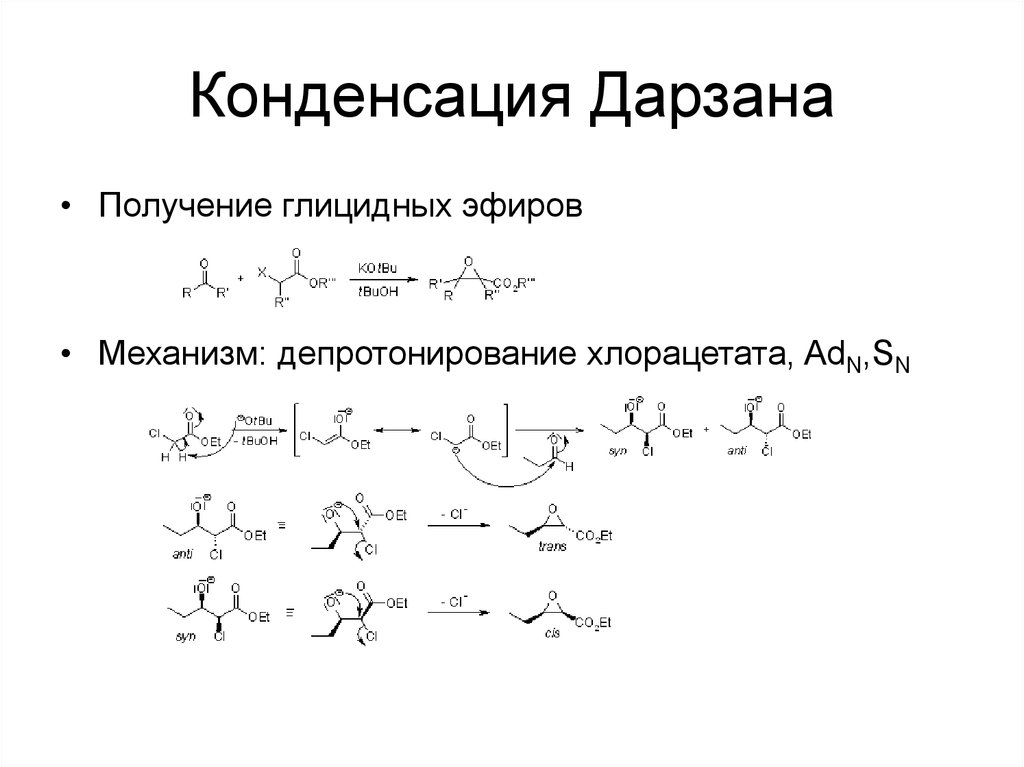
56. Конденсация Дарзана
• Получение глицидных эфиров• Механизм: депротонирование хлорацетата, AdN,SN
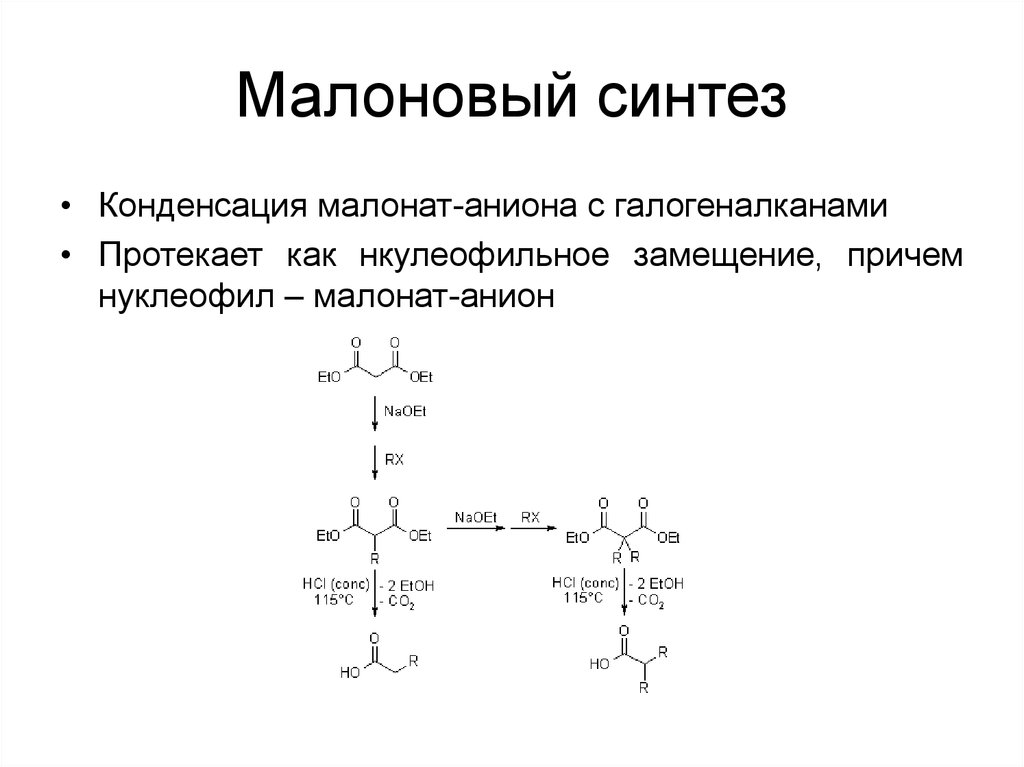
57. Малоновый синтез
• Конденсация малонат-аниона с галогеналканами• Протекает как нкулеофильное замещение, причем
нуклеофил – малонат-анион
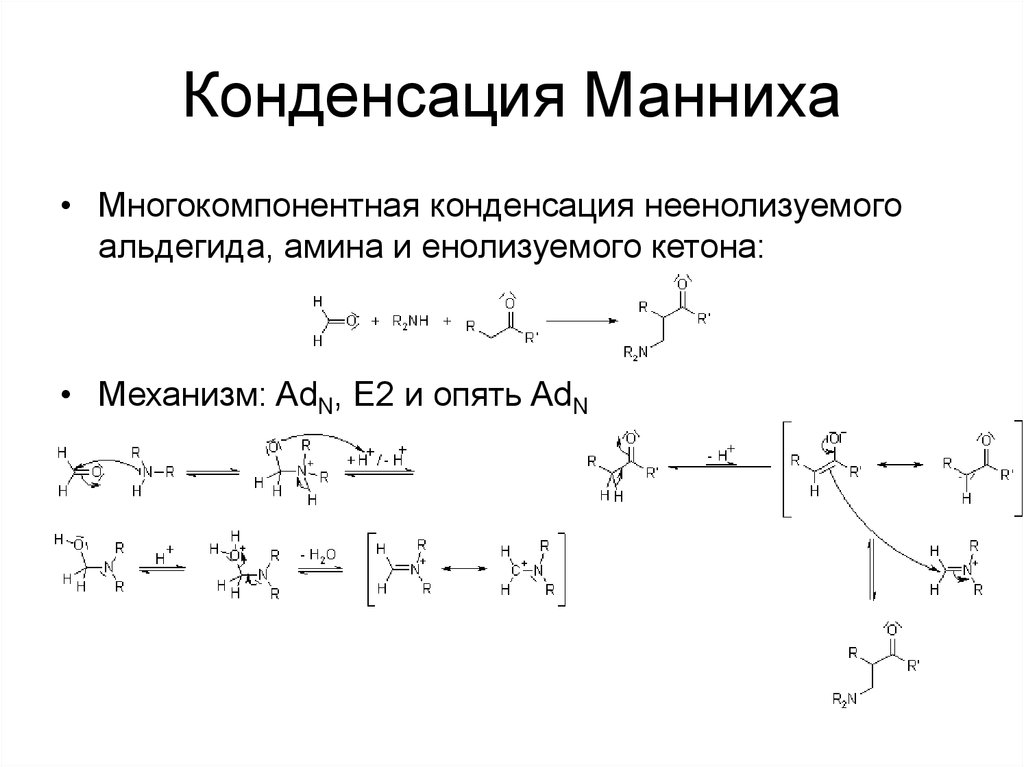
58. Конденсация Манниха
• Многокомпонентная конденсация неенолизуемогоальдегида, амина и енолизуемого кетона:
• Механизм: AdN, E2 и опять AdN
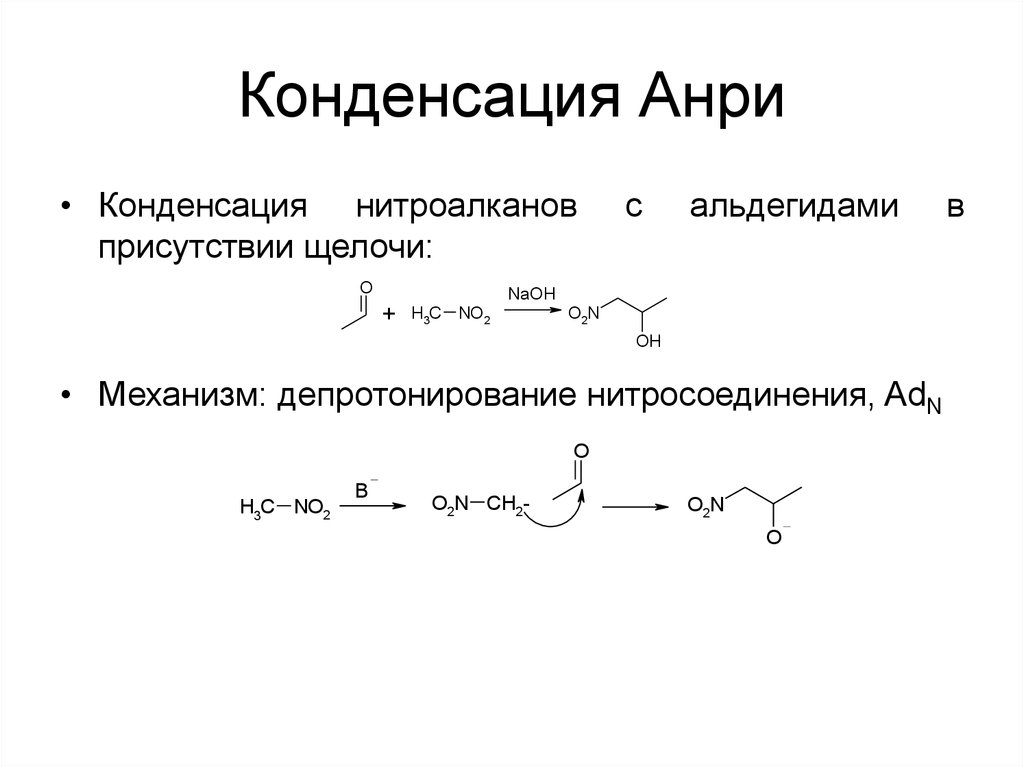
59. Конденсация Анри
• Конденсация нитроалкановприсутствии щелочи:
O
с
альдегидами
NaOH
+
H3C NO2
O2N
OH
• Механизм: депротонирование нитросоединения, AdN
O
H3C NO2
B
O2N CH2-
O2N
O
в
60. «Конденсация» Тищенко
• «Конденсация»альдегидов
под
алкоголятов алюминия, приводящая
эфирам
• Механизм:
AdN(нуклеофил
кислород!), [1,2]-H сдвиг
–
действием
к сложным
карбонильный
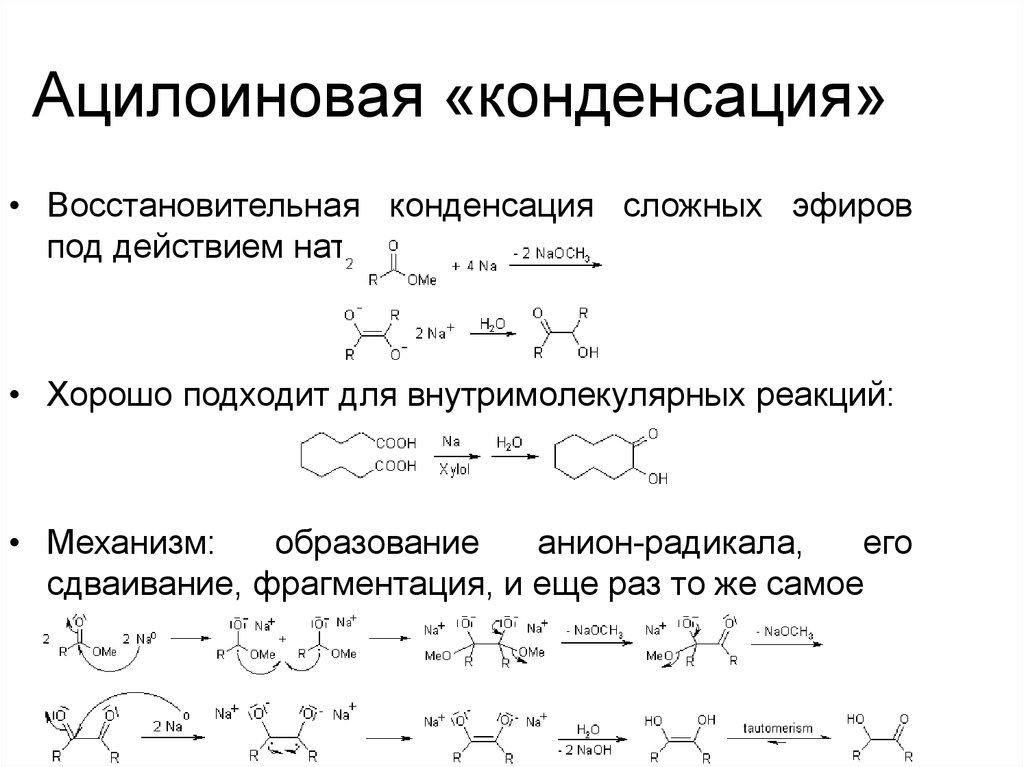
61. Ацилоиновая «конденсация»
• Восстановительная конденсация сложных эфировпод действием натрия:
• Хорошо подходит для внутримолекулярных реакций:
• Механизм:
образование
анион-радикала,
его
сдваивание, фрагментация, и еще раз то же самое
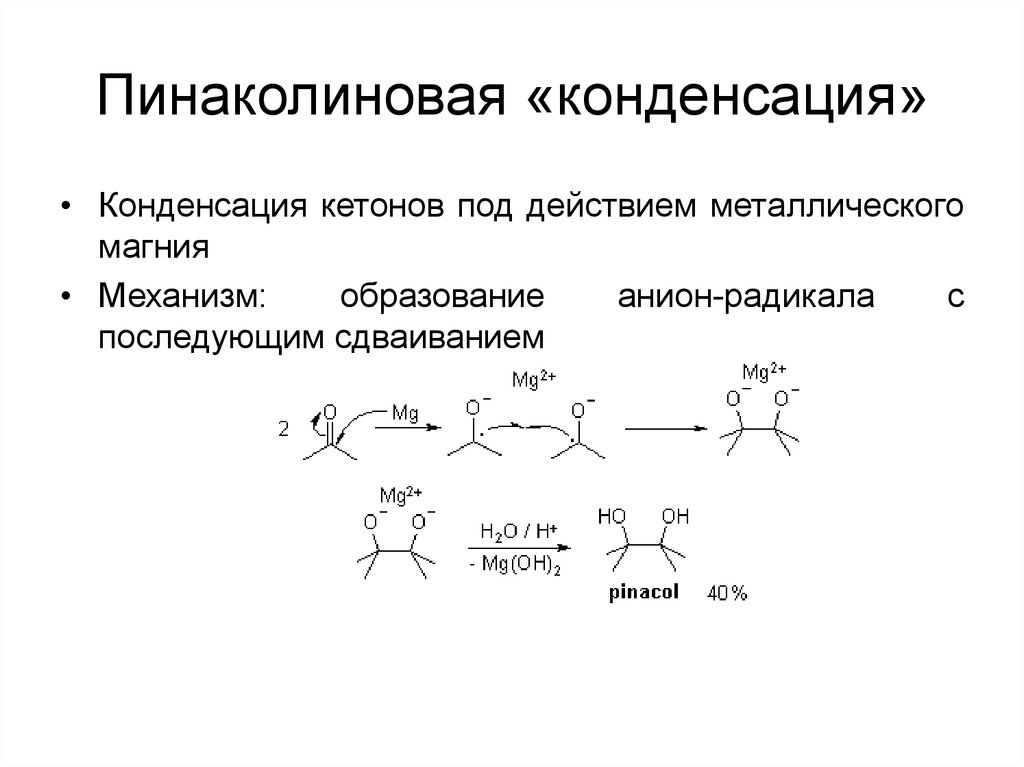
62. Пинаколиновая «конденсация»
• Конденсация кетонов под действием металлическогомагния
• Механизм:
образование
анион-радикала
с
последующим сдваиванием
63. Бензоиновая «конденсация»
• Конденсацияароматических
действием цианидов:
альдегидов
• Механизм:
AdN,
депротонирование
стабилизирует анион), AdN, фрагментация
O
H
O
CN
HO - CN O
CN-
O
OH
HO
NC
O
H
под
(CN
64. Реакции окисления и восстановления
• Формально очень многие органическиереакции относятся к ОВ-реакциям
(например, SEAr), но мы не будем их
рассматривать с такой точки зрения
65. Восстановление карбонильных соединений
• Реакционнаяспособность
падает
RCHO>RCOR’>RCOOR’>RCOO• Наиболее мощный восстановитель
Восстанавливает все до спиртов:
O
R
O
R'
LiAlH4
Et2O
в
–
ряду
LiAlH4.
RCH2OH + R'OH
• Боргидрид натрия NaBH4 восстанавливает альдегиды
и кетоны (с трудом)
• Вариации
на
тему
боргидрида
натрия
–
ацетоксиборгидрид
натрия
NaBH(OAc)3,
цианоборгидрид натрия NaBH3CN, L-селектрид
K[BH(CH(CH3)C(CH)3)3] – более селективны
66. Восстановление карбонильных соединений
• Для селективного восстановления сложных эфировдо
альдегидов
используют
диизобутилалюминийгидрид ДИБАЛ ((iBu)2AlH):
O
R
DIBAL-H
O
R'
Et2O
RCHO
• Реакция Буво-Блана – восстановление сложных
эфиров натрием в этаноле
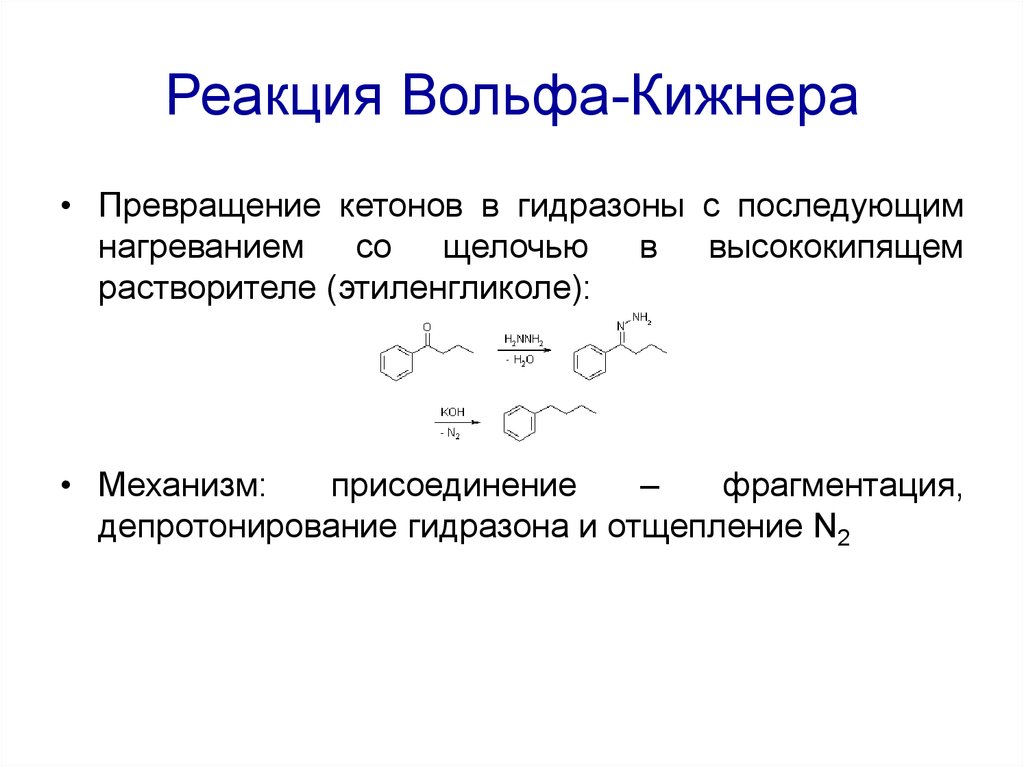
67. Реакция Вольфа-Кижнера
• Превращение кетонов в гидразоны с последующимнагреванием со щелочью в высококипящем
растворителе (этиленгликоле):
• Механизм:
присоединение
–
фрагментация,
депротонирование гидразона и отщепление N2
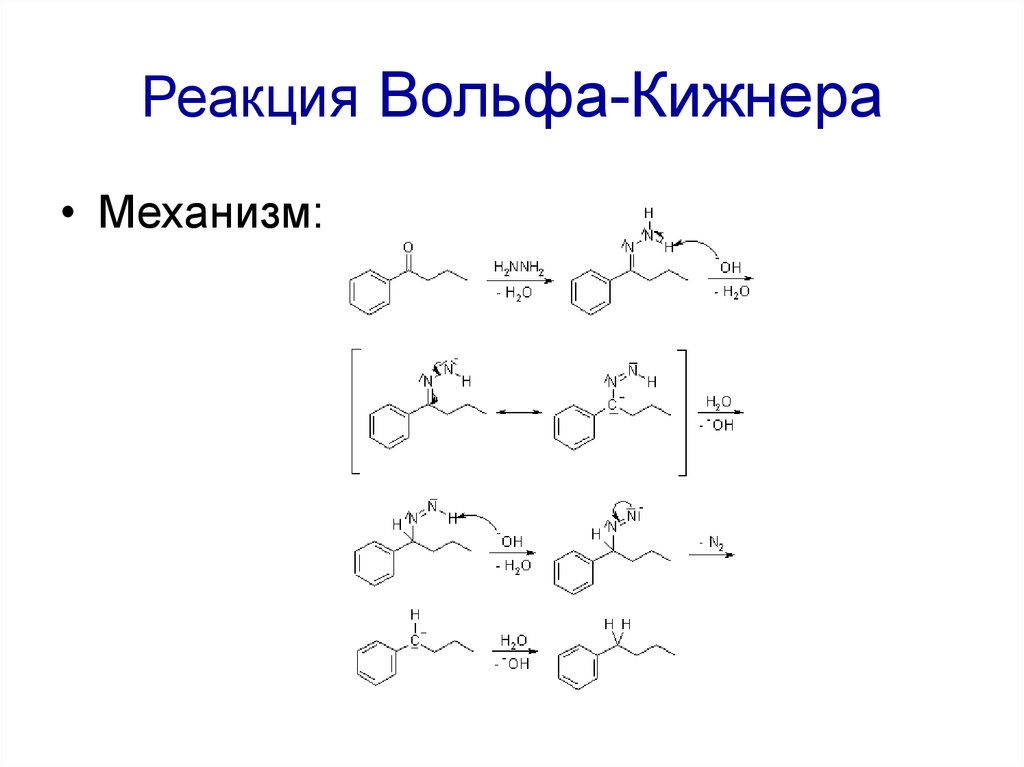
68. Реакция Вольфа-Кижнера
• Механизм:69. Восстановление по Клемменсену
• Восстановление кетонов амальгаммой цинка всоляной кислоте:
• Механизм: реакция идет на поверхности цинка
70. Окисление по Кори-Киму
• Мягкоеокисление
диметилсульфидом:
спиртов
активированным
• Механизм:
активация
ДМС,
нуклеофильное
замещение при атоме серы, гидридный сдвиг
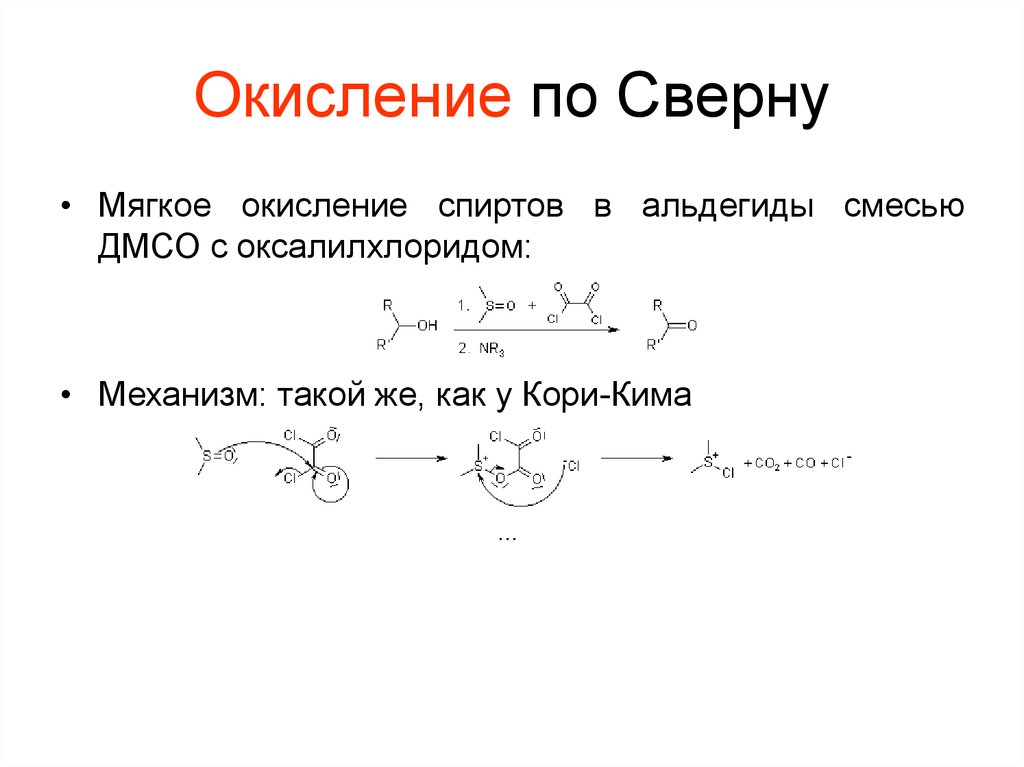
71. Окисление по Сверну
• Мягкое окисление спиртов в альдегиды смесьюДМСО с оксалилхлоридом:
• Механизм: такой же, как у Кори-Кима
…
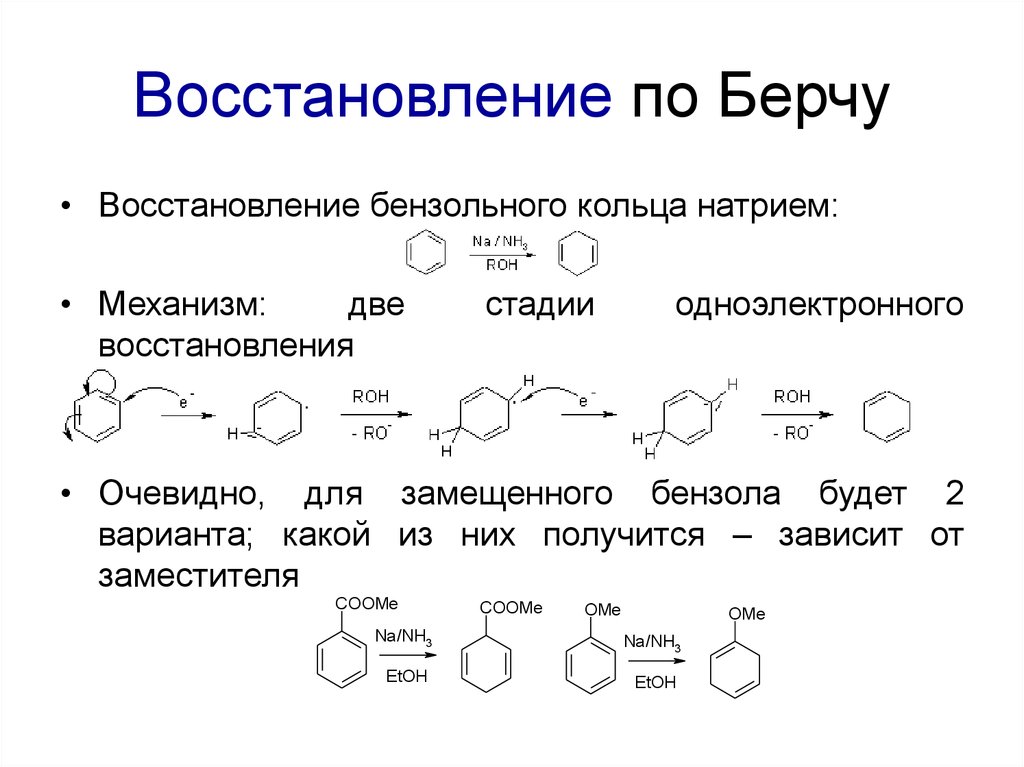
72. Восстановление по Берчу
• Восстановление бензольного кольца натрием:• Механизм:
две
восстановления
стадии
одноэлектронного
• Очевидно, для замещенного бензола будет 2
варианта; какой из них получится – зависит от
заместителя
COOMe
COOMe
OMe
OMe
Na/NH3
Na/NH3
EtOH
EtOH
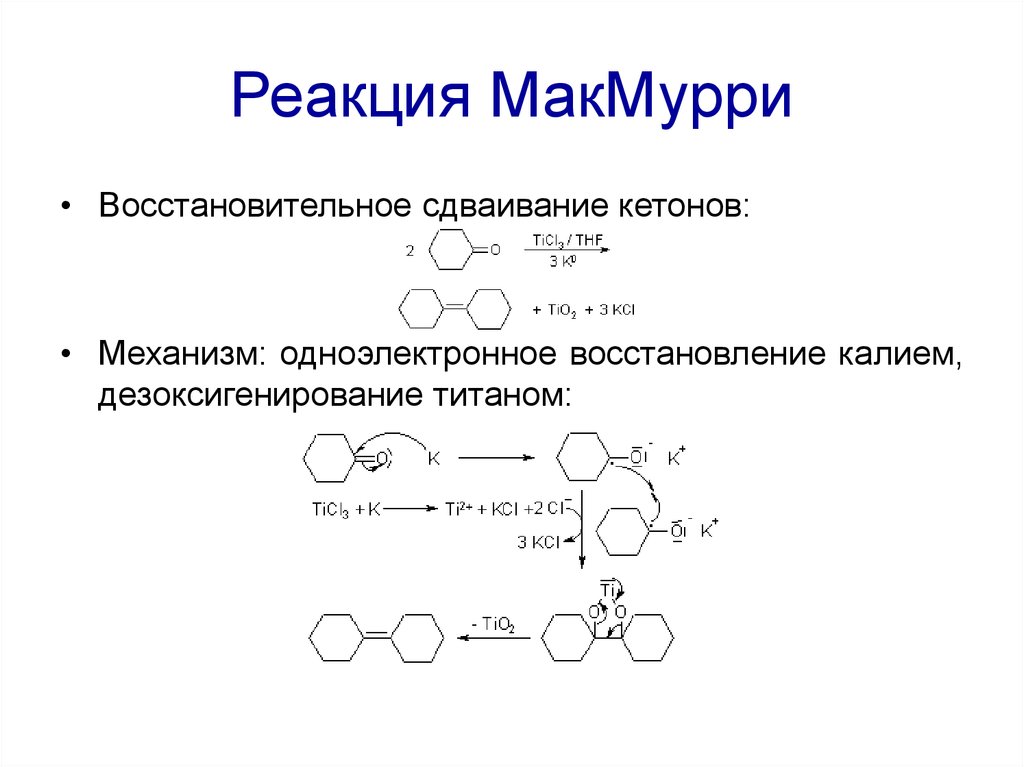
73. Реакция МакМурри
• Восстановительное сдваивание кетонов:• Механизм: одноэлектронное восстановление калием,
дезоксигенирование титаном:
74. Реакция Глязера
• Окислительноесдваивание
терминальных
ацетиленов под действием одновалентной меди:
• Реакция видимо идет через радикалы
75. Реакция Нефа
• Гидролиз нитросоединений до карбонильныхсоединений:
• Механизм: депротонирование, AdN, фрагментация:
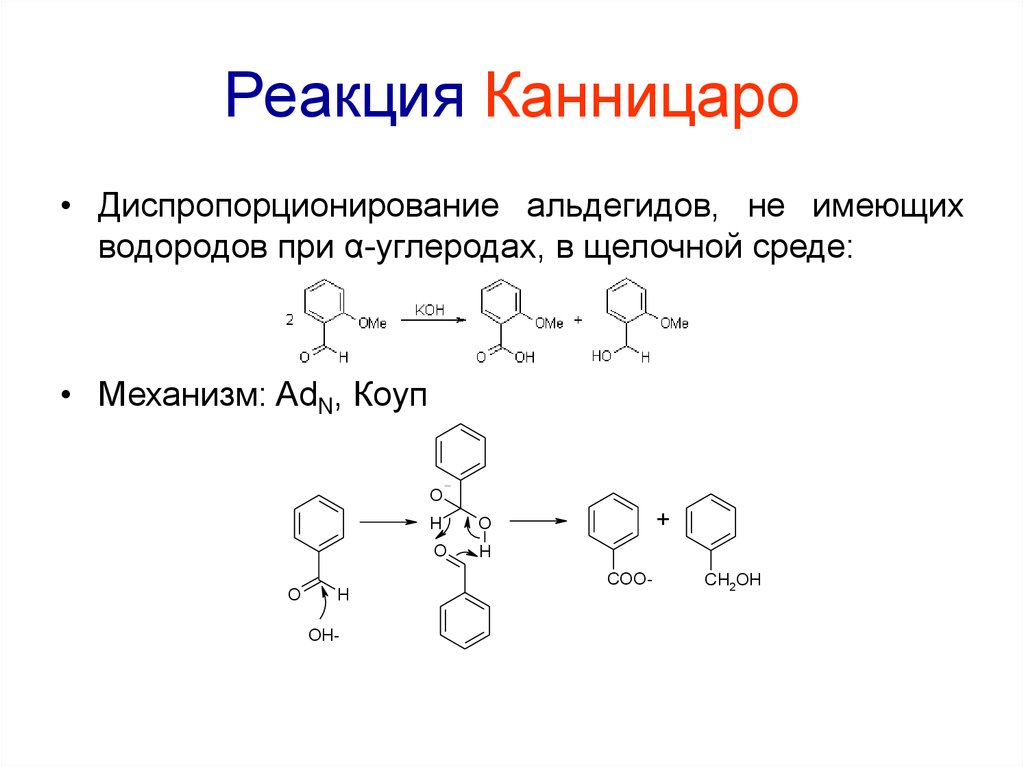
76. Реакция Канницаро
• Диспропорционирование альдегидов, не имеющихводородов при α-углеродах, в щелочной среде:
• Механизм: AdN, Коуп
O
H
O
O
H
+
COO-
O
H
OH-
CH2OH
77. Реакция Канницаро
• Если целевым продуктом является спирт, используюткросс-Каницарро с формальдегидом:
78. Реакции с участием фосфорорганических соединений
79. Реакция Аппеля
• Стереоселективноезамещение
спиртового
гидроксила на галоген с обращением конфигурации:
• Механизм:
дегалогенирование
CX4,
депротонирование спирта, SN при атоме фосфора и
SN при атоме углерода:
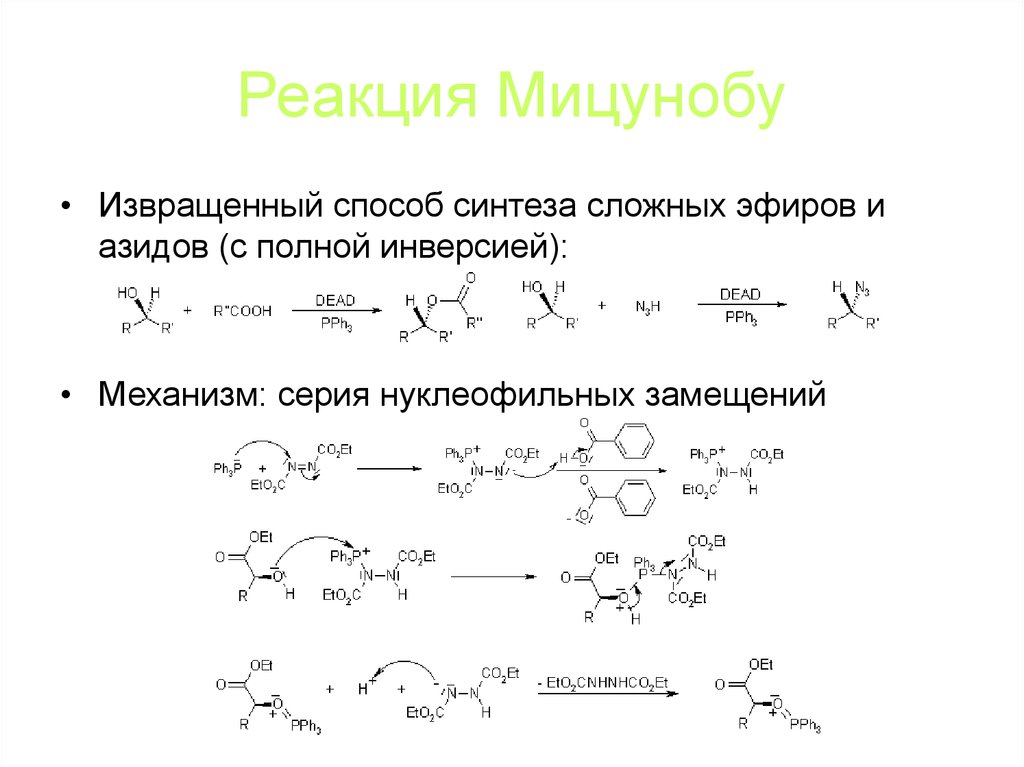
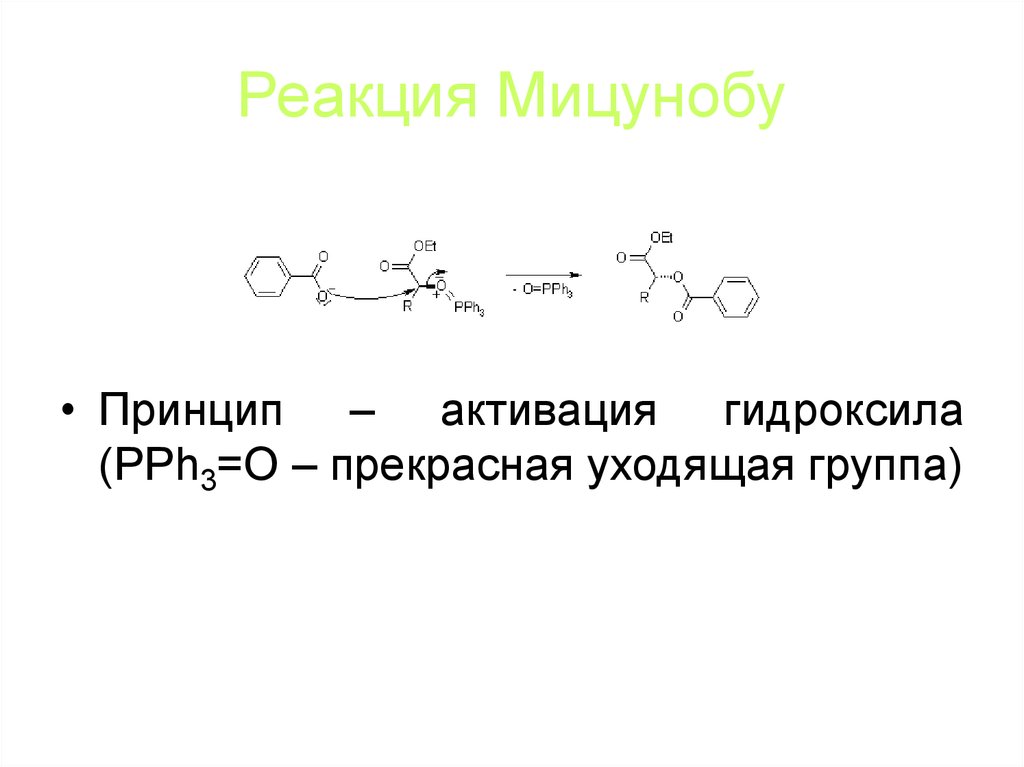
80. Реакция Мицунобу
• Извращенный способ синтеза сложных эфиров иазидов (с полной инверсией):
• Механизм: серия нуклеофильных замещений
81. Реакция Мицунобу
• Принцип – активация гидроксила(PPh3=O – прекрасная уходящая группа)
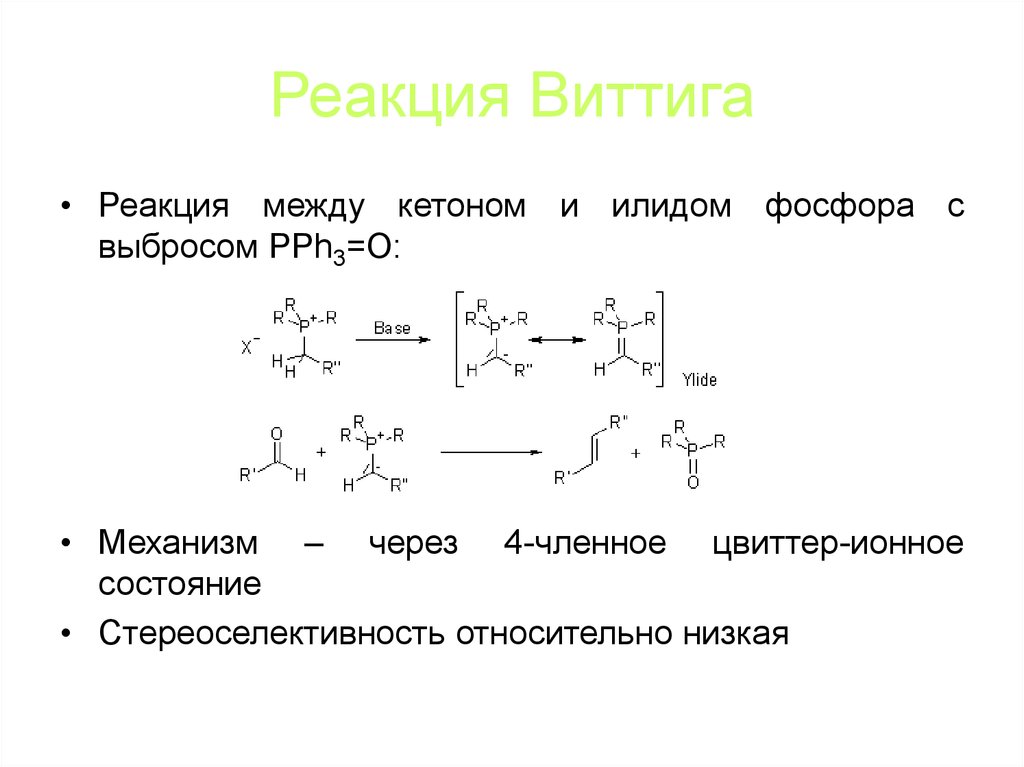
82. Реакция Виттига
• Реакция между кетоном и илидом фосфора свыбросом PPh3=O:
• Механизм – через 4-членное цвиттер-ионное
состояние
• Стереоселективность относительно низкая
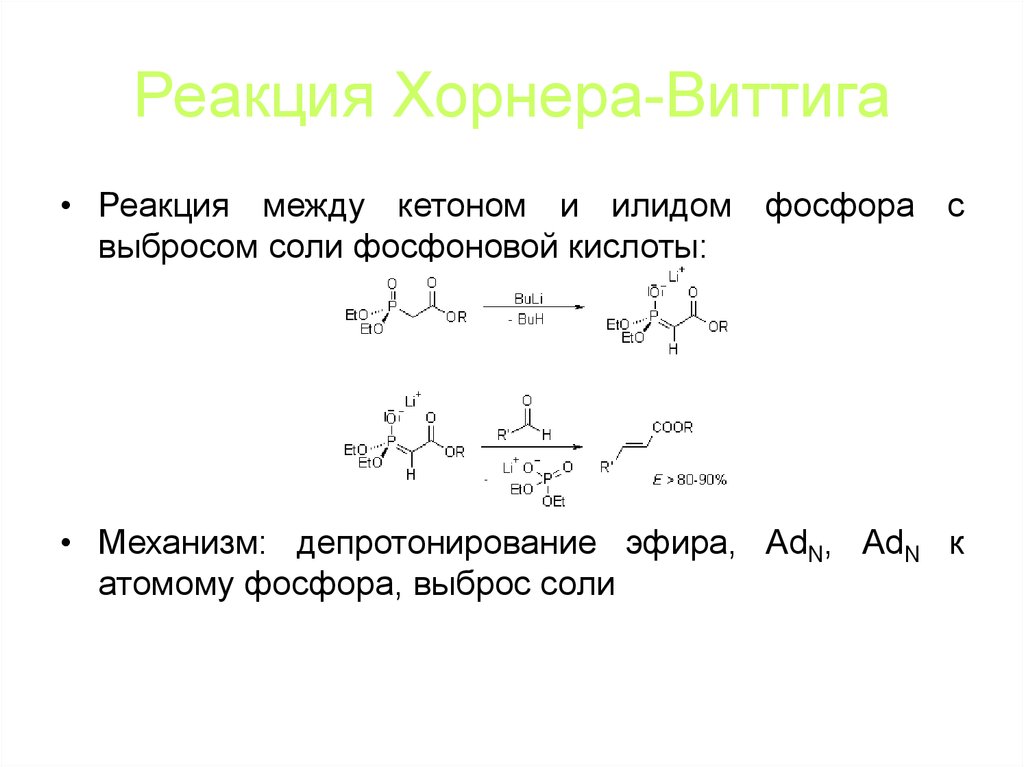
83. Реакция Хорнера-Виттига
• Реакция между кетоном и илидом фосфора свыбросом соли фосфоновой кислоты:
• Механизм: депротонирование эфира, AdN, AdN к
атомому фосфора, выброс соли
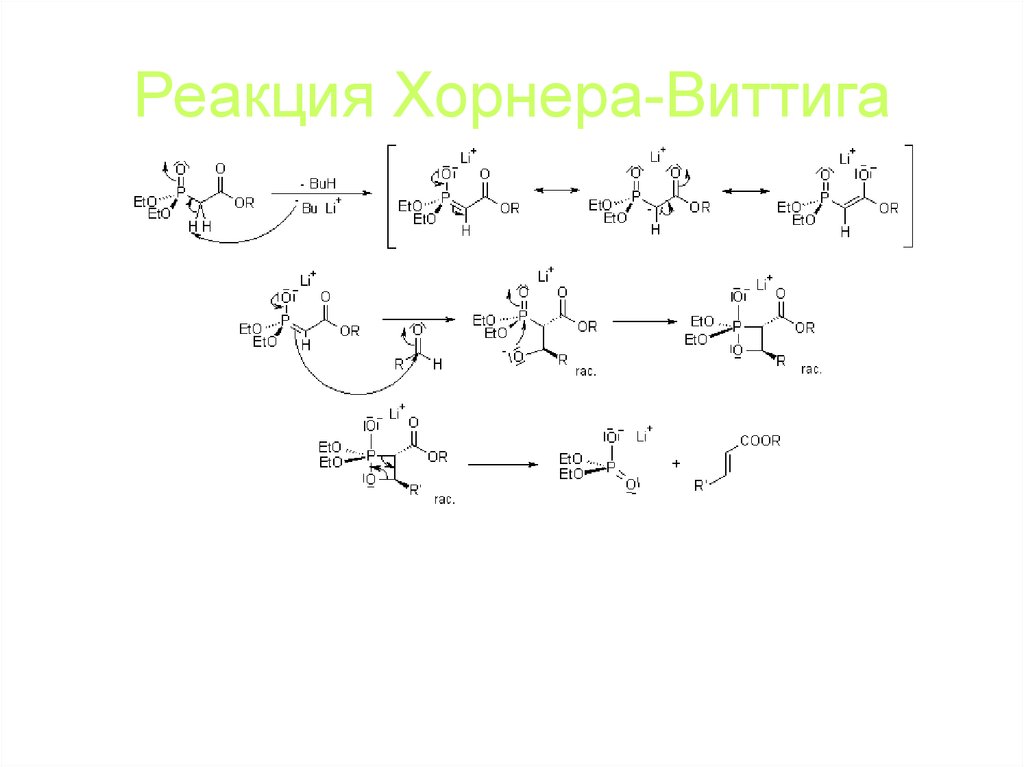
84. Реакция Хорнера-Виттига
85. Перегруппировки
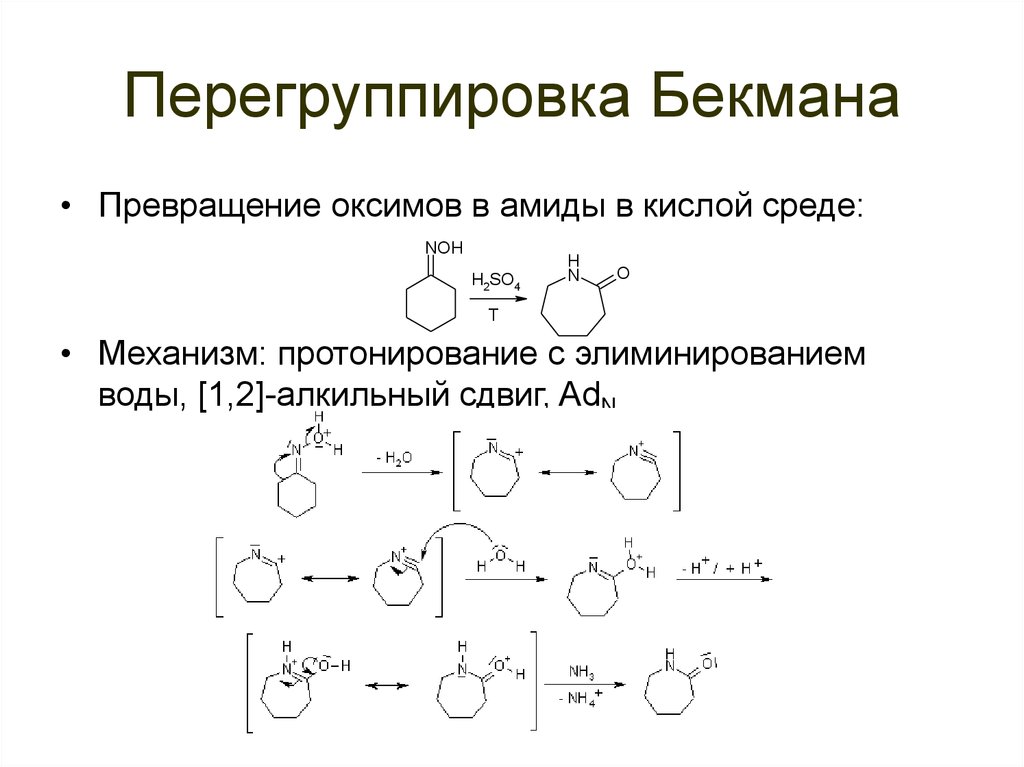
86. Перегруппировка Бекмана
• Превращение оксимов в амиды в кислой среде:NOH
H2SO4
H
N
O
T
• Механизм: протонирование с элиминированием
воды, [1,2]-алкильный сдвиг, AdN
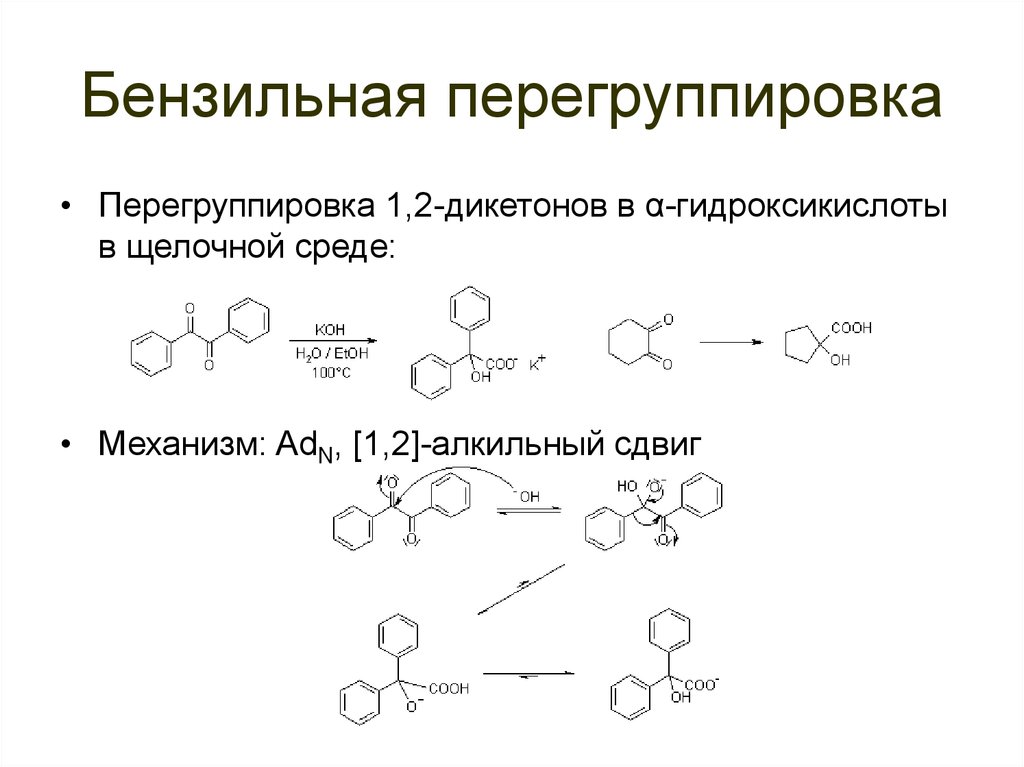
87. Бензильная перегруппировка
• Перегруппировка 1,2-дикетонов в α-гидроксикислотыв щелочной среде:
• Механизм: AdN, [1,2]-алкильный сдвиг
88. Пинаколиновая перегруппировка
• Перегруппировка пинаконов в пинаколины в кислойсреде:
• Механизм: протонирование, отщепление воды, [1,2]алкильный сдвиг
89. Перегруппировка Курциуса
• Превращение ацилазидов в изоцианаты, которыезатем могут дать карбаматы или уретаны:
• Механизм: отщепление
нитрена, AdN
азота,
перегруппировка
90. Перегруппировка Коупа
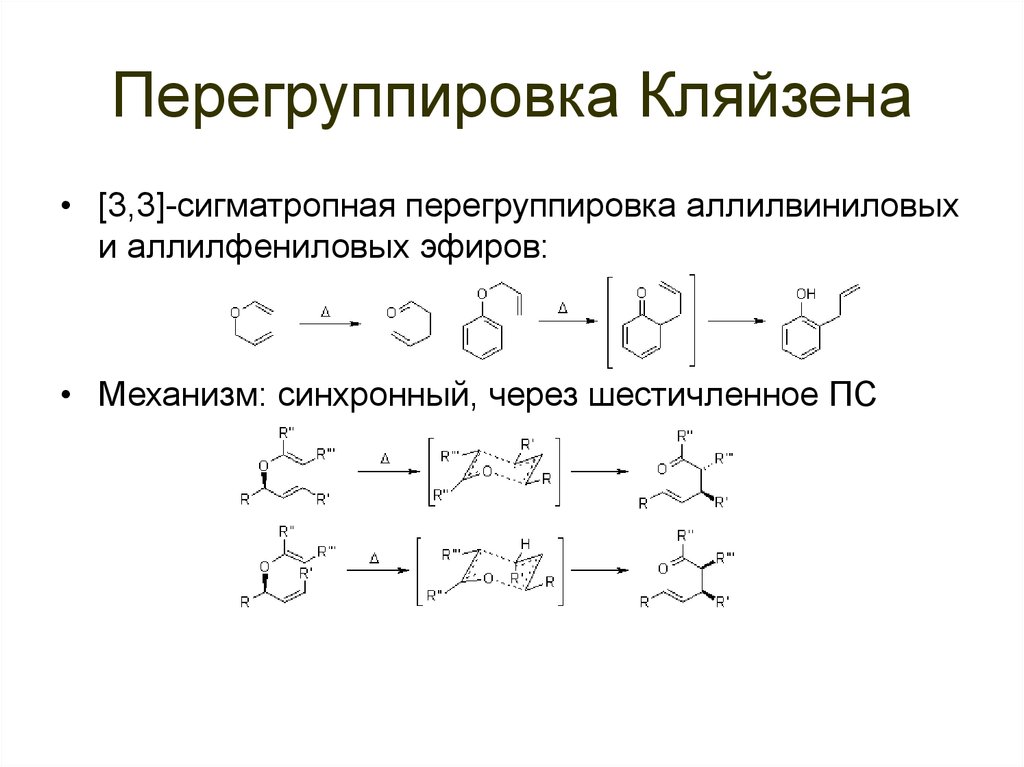
• [3,3]-сигматропная перегруппировка• Проходит по синхронному механизму:
91. Перегруппировка Кляйзена
• [3,3]-сигматропная перегруппировка аллилвиниловыхи аллилфениловых эфиров:
• Механизм: синхронный, через шестичленное ПС
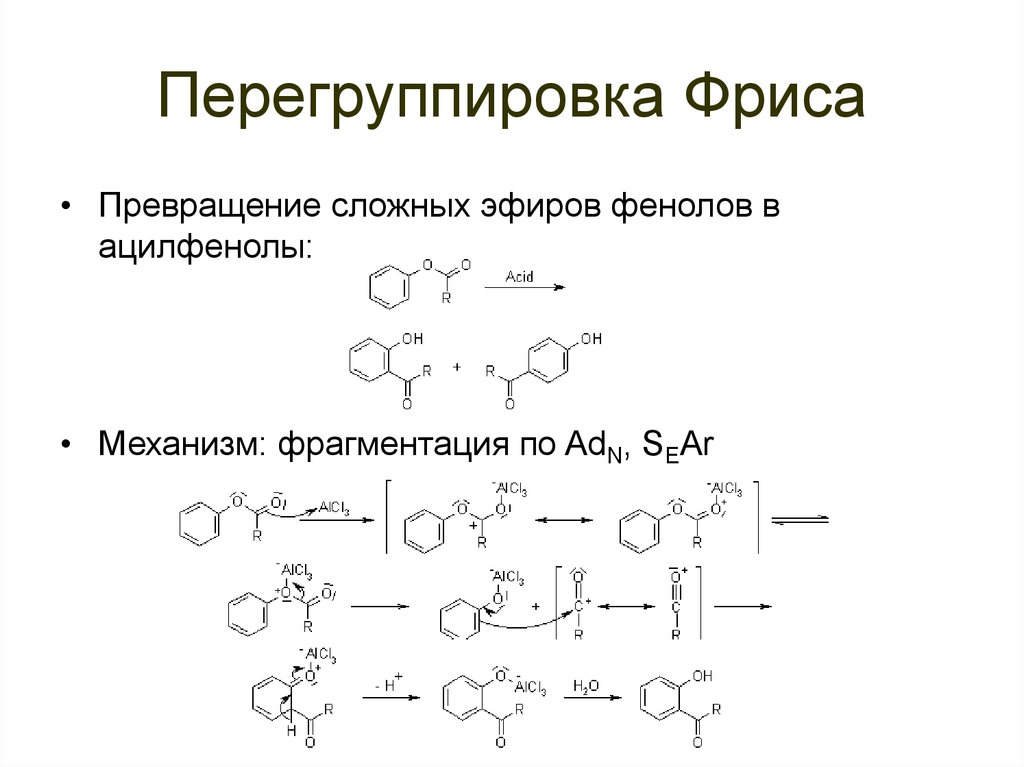
92. Перегруппировка Фриса
• Превращение сложных эфиров фенолов вацилфенолы:
• Механизм: фрагментация по AdN, SEAr
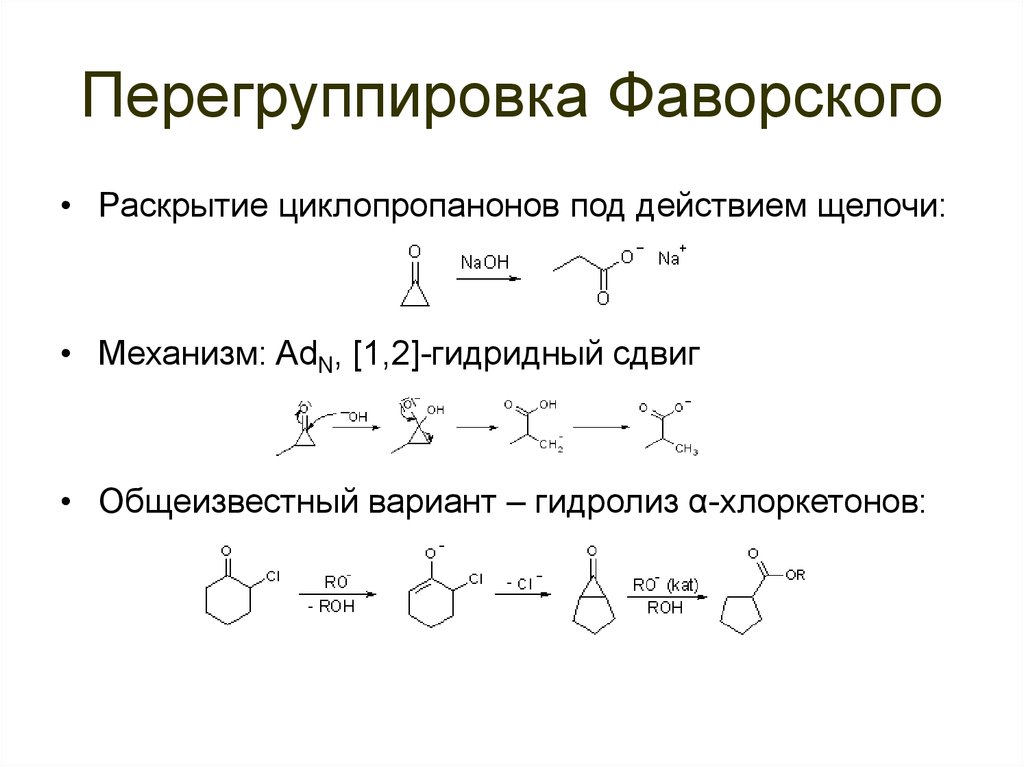
93. Перегруппировка Фаворского
• Раскрытие циклопропанонов под действием щелочи:• Механизм: AdN, [1,2]-гидридный сдвиг
• Общеизвестный вариант – гидролиз α-хлоркетонов:
94. Часто используемые препаративные реакции
95. 1,3-диполярное циклоприсоединение
• Взаимодействие кратной связи с 1,3-диполем собразованием 5-членного гетероцикла:
• Наиболее распространенные 1,3-диполи:
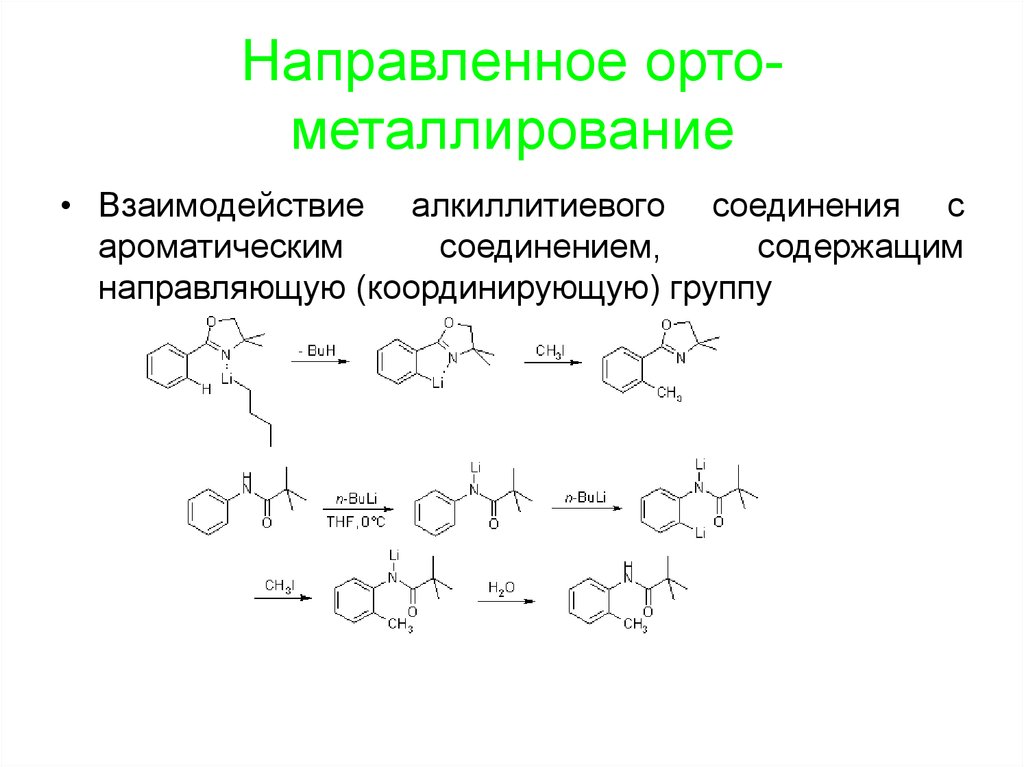
96. Направленное орто-металлирование
Направленное ортометаллирование• Взаимодействие алкиллитиевого соединения с
ароматическим
соединением,
содержащим
направляющую (координирующую) группу
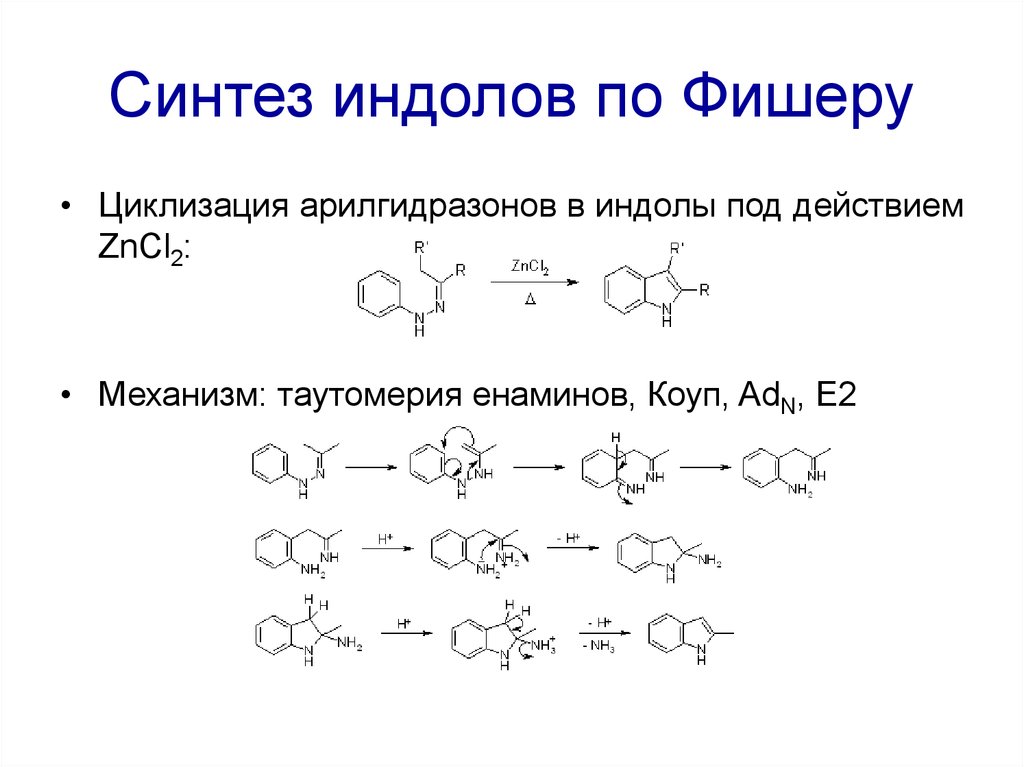
97. Синтез индолов по Фишеру
• Циклизация арилгидразонов в индолы под действиемZnCl2:
• Механизм: таутомерия енаминов, Коуп, AdN, E2
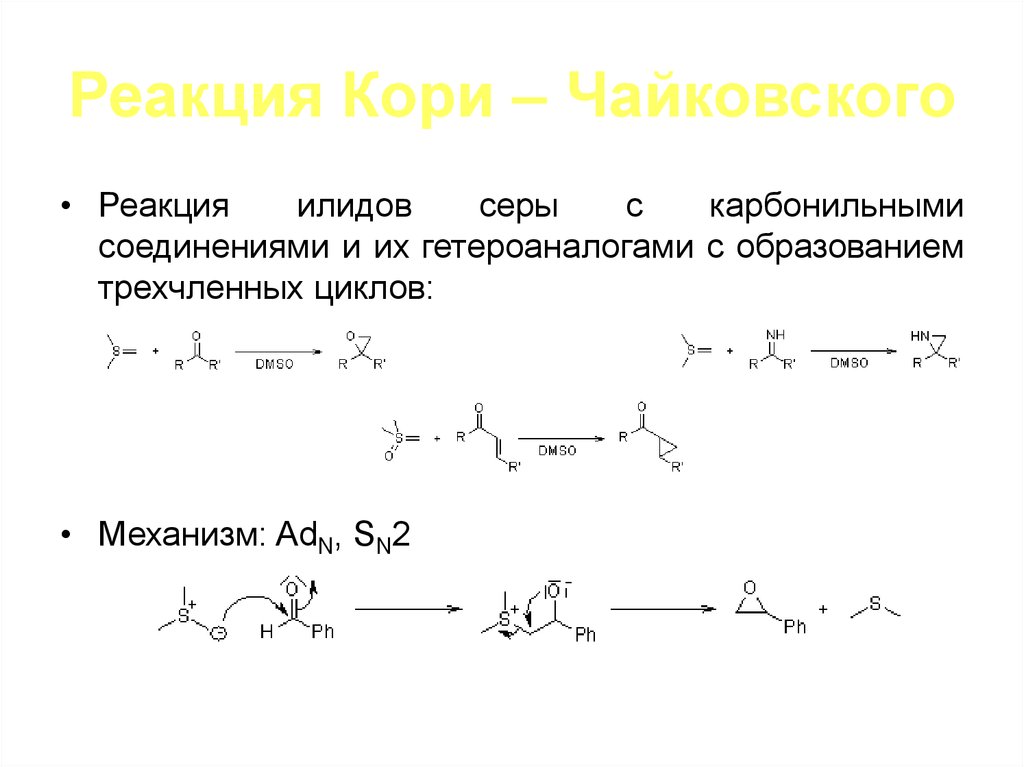
98. Реакция Кори – Чайковского
• Реакцияилидов
серы
с
карбонильными
соединениями и их гетероаналогами с образованием
трехчленных циклов:
• Механизм: AdN, SN2
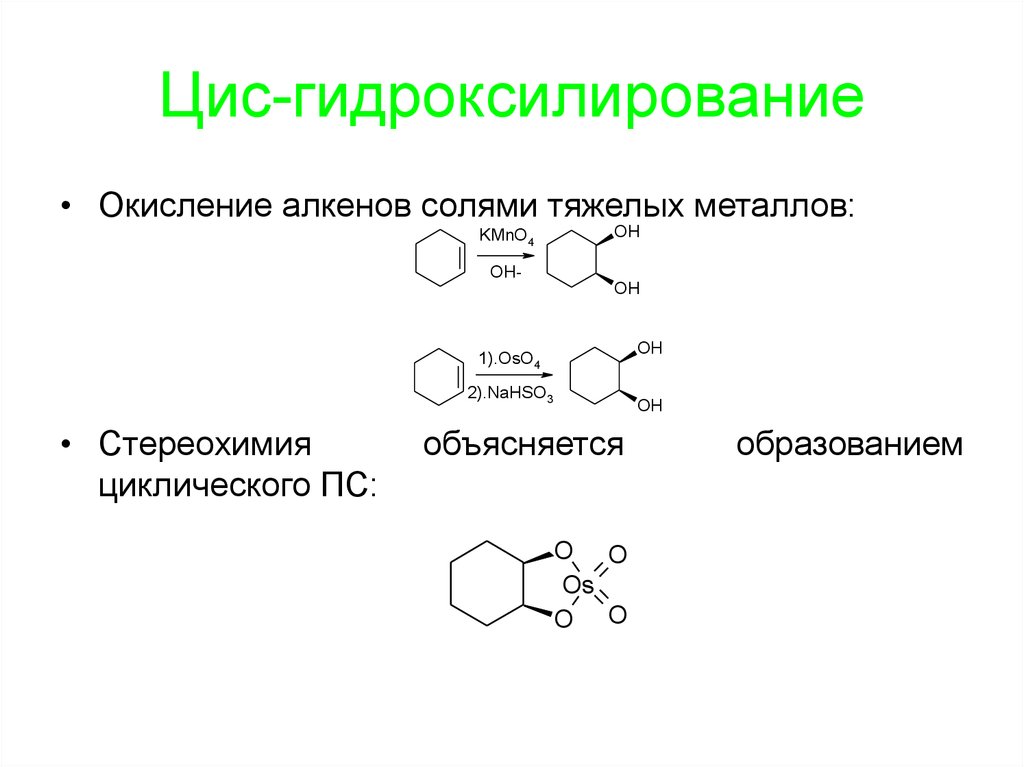
99. Цис-гидроксилирование
• Окисление алкенов солями тяжелых металлов:KMnO4
OH
OHOH
OH
1).OsO4
2).NaHSO3
• Стереохимия
циклического ПС:
OH
объясняется
O O
Os
O O
образованием
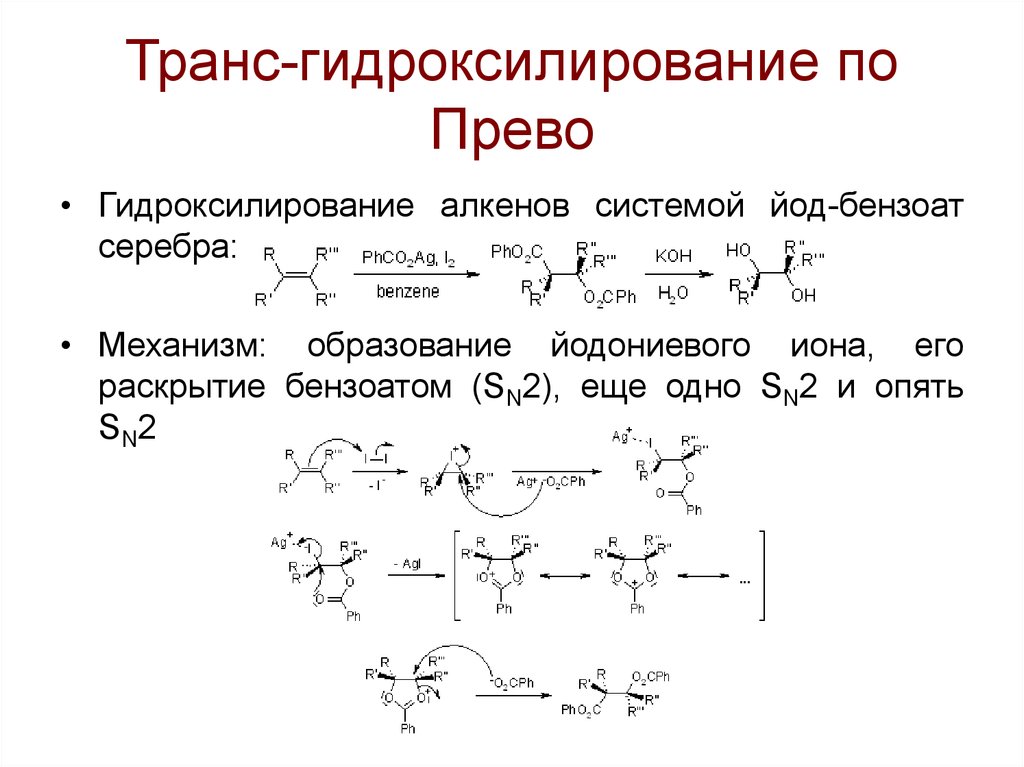
100. Транс-гидроксилирование по Прево
• Гидроксилирование алкенов системой йод-бензоатсеребра:
• Механизм: образование йодониевого иона, его
раскрытие бензоатом (SN2), еще одно SN2 и опять
SN2
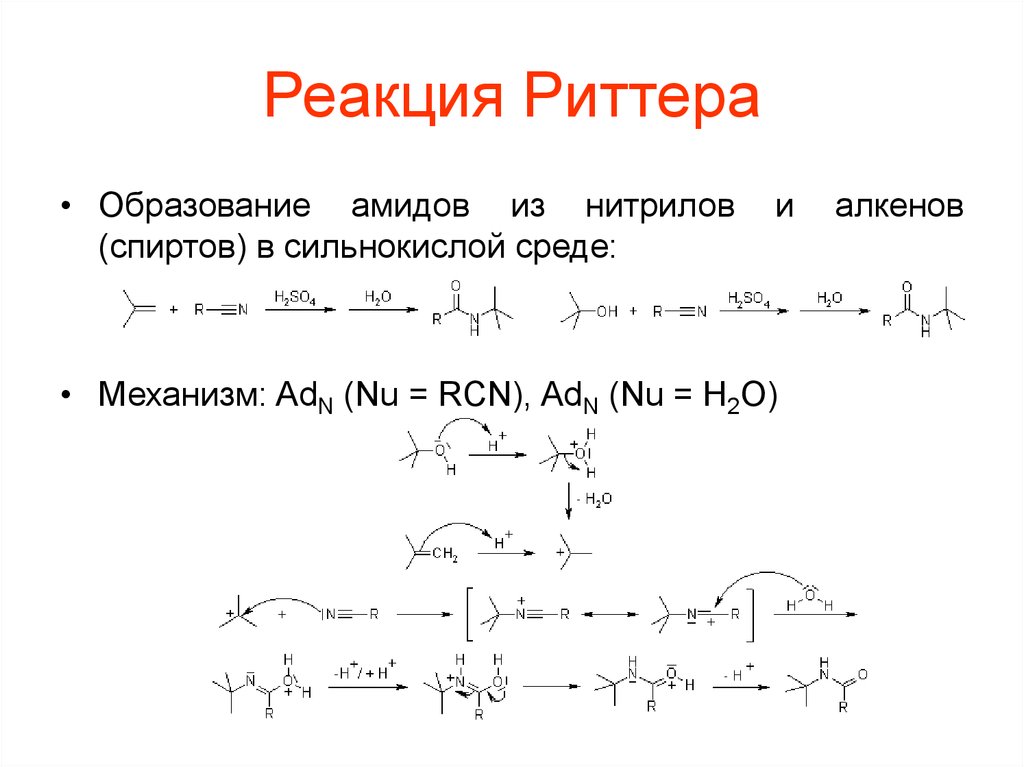
101. Реакция Риттера
• Образование амидов из нитрилов(спиртов) в сильнокислой среде:
и
• Механизм: AdN (Nu = RCN), AdN (Nu = H2O)
алкенов
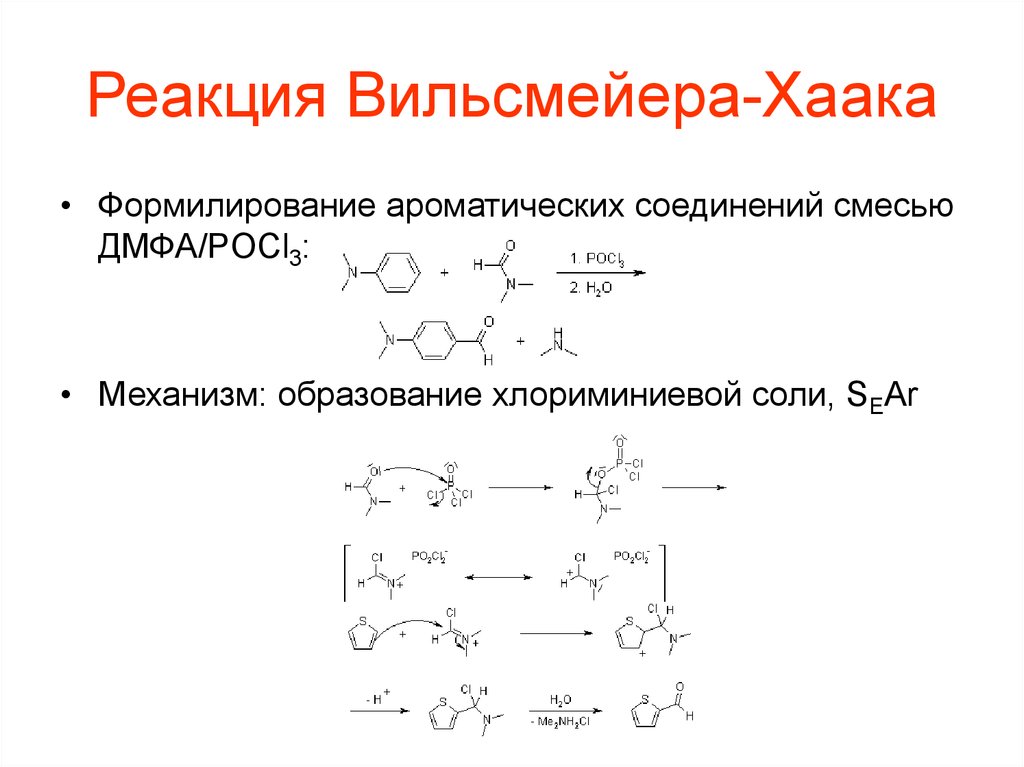
102. Реакция Вильсмейера-Хаака
• Формилирование ароматических соединений смесьюДМФА/POCl3:
• Механизм: образование хлориминиевой соли, SEAr
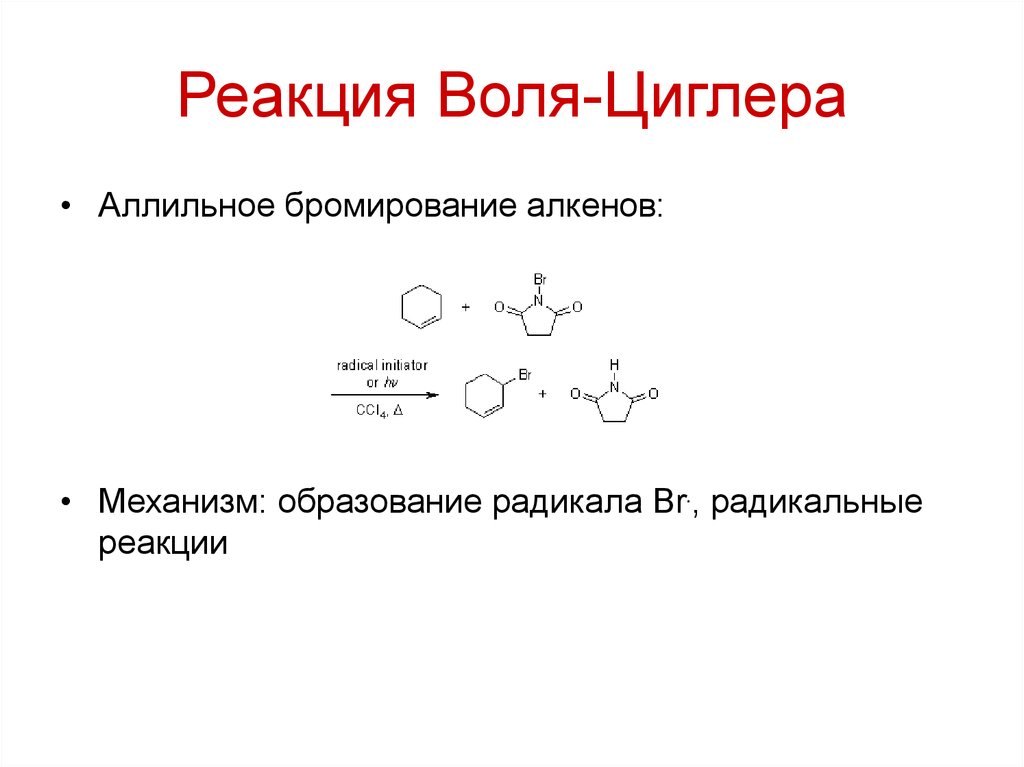
103. Реакция Воля-Циглера
• Аллильное бромирование алкенов:• Механизм: образование радикала Br., радикальные
реакции
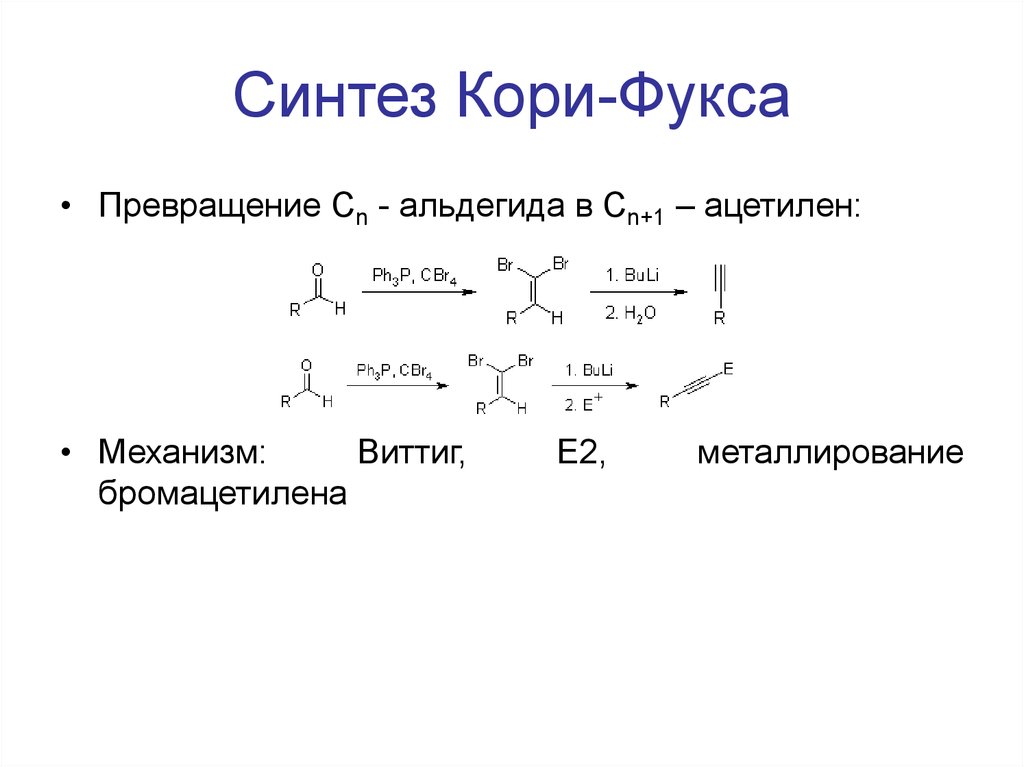
104. Синтез Кори-Фукса
• Превращение Cn - альдегида в Сn+1 – ацетилен:• Механизм:
Виттиг,
бромацетилена
E2,
металлирование
105. Синтез Арндта-Айстерта
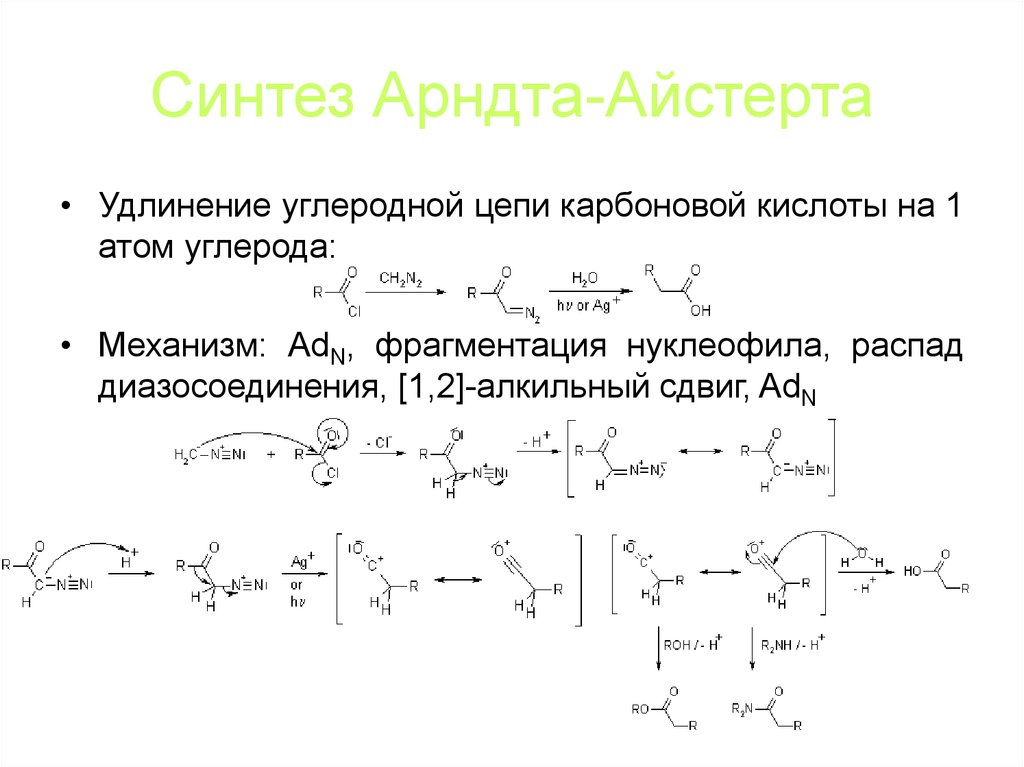
• Удлинение углеродной цепи карбоновой кислоты на 1атом углерода:
• Механизм: AdN, фрагментация нуклеофила, распад
диазосоединения, [1,2]-алкильный сдвиг, AdN
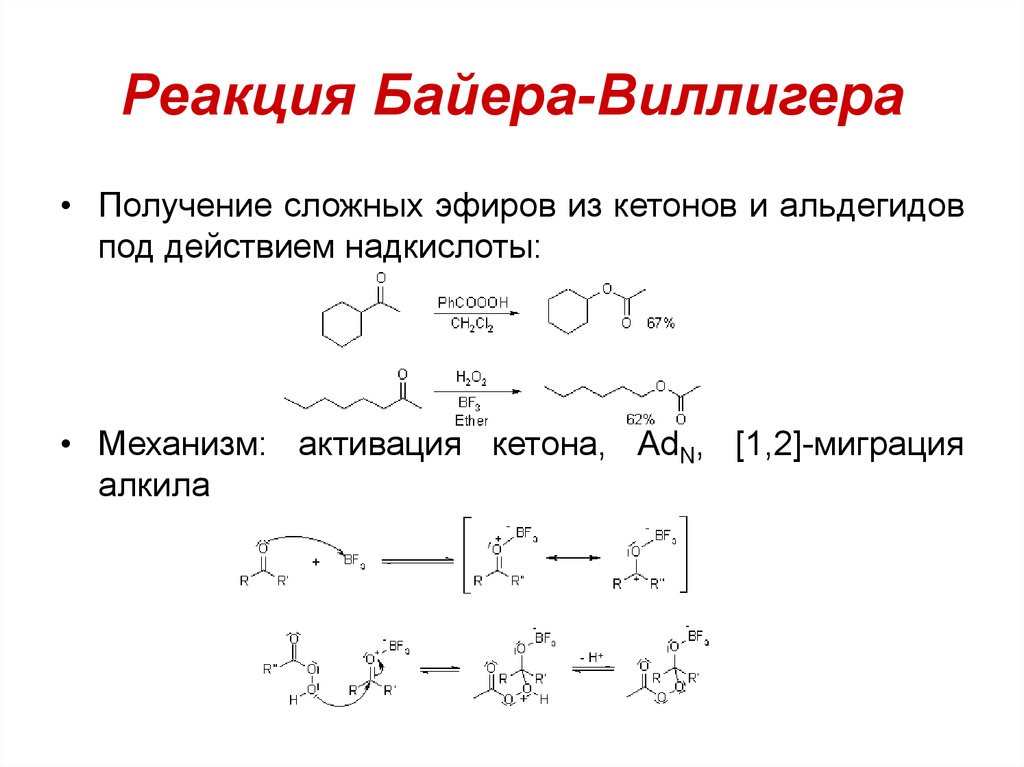
106. Реакция Байера-Виллигера
• Получение сложных эфиров из кетонов и альдегидовпод действием надкислоты:
• Механизм: активация кетона, AdN, [1,2]-миграция
алкила
107. Реакция Байера-Виллигера
• Лучше мигрируют заместители, образующие болеестабильные карбокатионы
108. Лактонизация по Кори
• Стереоселективное образование циклических йодолактонов придействием содового раствора йода на непредельные кислоты:
I2,NaHCO3
COOH
I
O
O
• Механизм: AdE, SN2
+
I
+
I
COOH
NaHCO3
I
+
I
COOH
O
O
O
O
109. Часть 4
Задачи110. Расчетная задача на сообразительность
Пары циклогексена пропустили через нагретую до температурыкрасного каления железную трубку. После пропускания объем
смеси увеличился на 10%, а количество бромной воды на
обесцвечивание продуктов реакции не изменилось по
сравнению с количеством воды на обесцвечивание исходного
циклогексена. Расчитать степень превращения циклогексена и
состав продуктов на выходе.
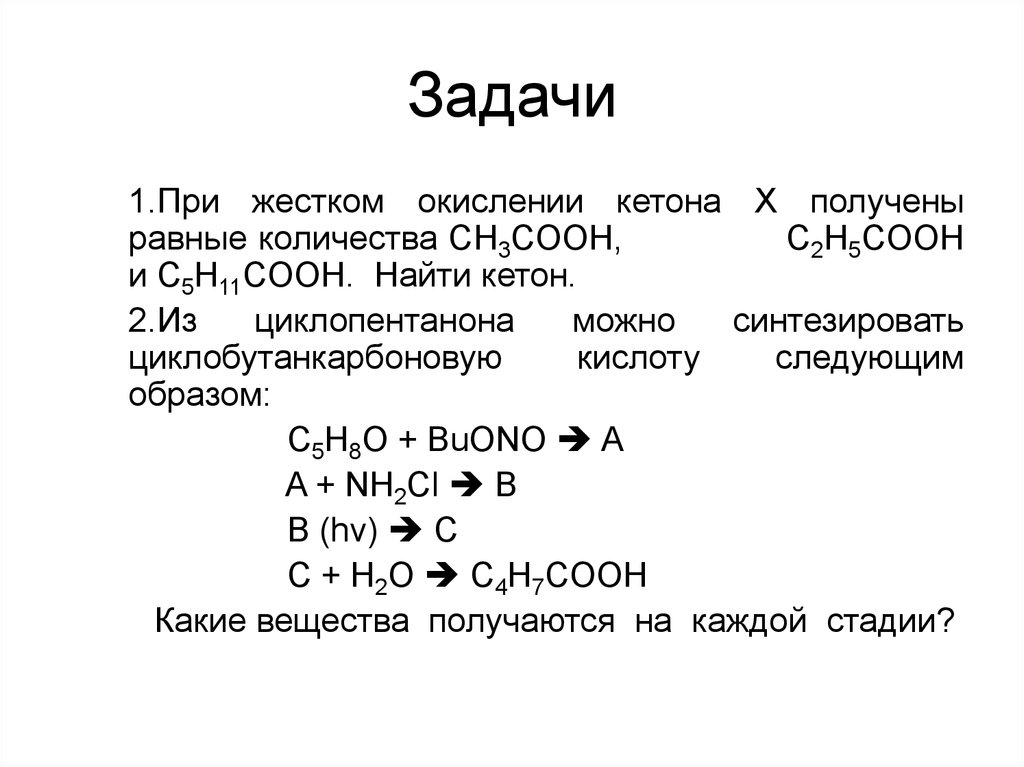
111. Задачи
1.При жестком окислении кетона Х полученыравные количества CH3COOH,
C2H5COOH
и C5H11COOH. Найти кетон.
2.Из
циклопентанона
можно
синтезировать
циклобутанкарбоновую
кислоту
следующим
образом:
C5H8O + BuONO A
A + NH2Cl B
B (hv) C
C + H2O C4H7COOH
Какие вещества получаются на каждой стадии?
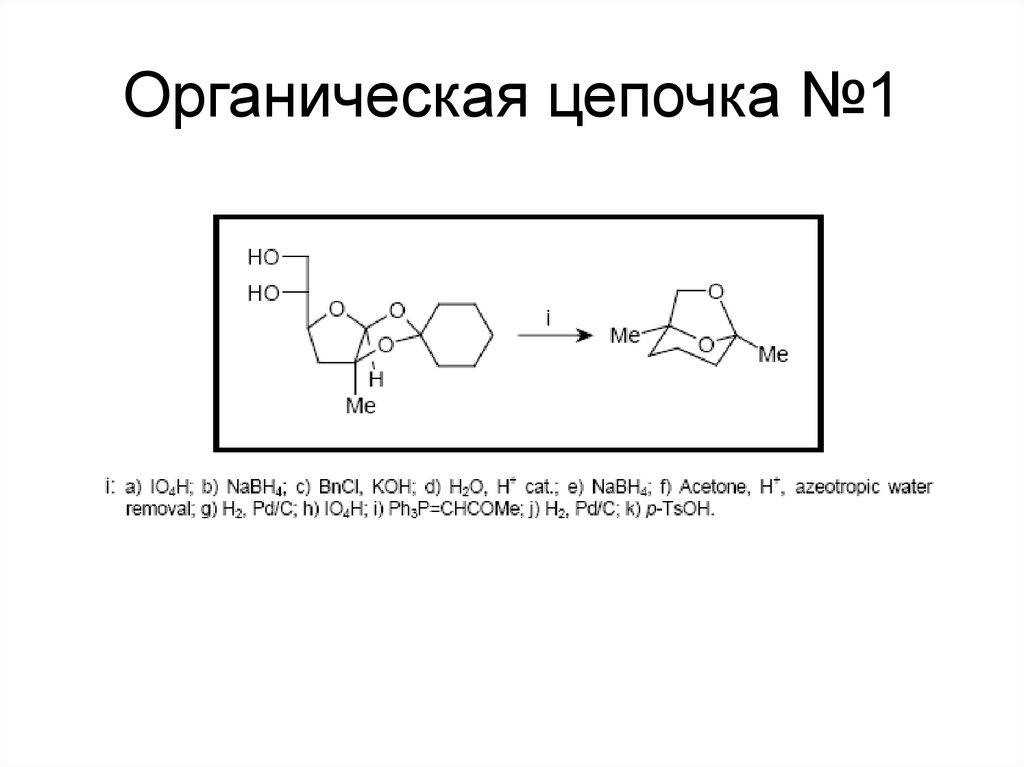
112. Органическая цепочка №1
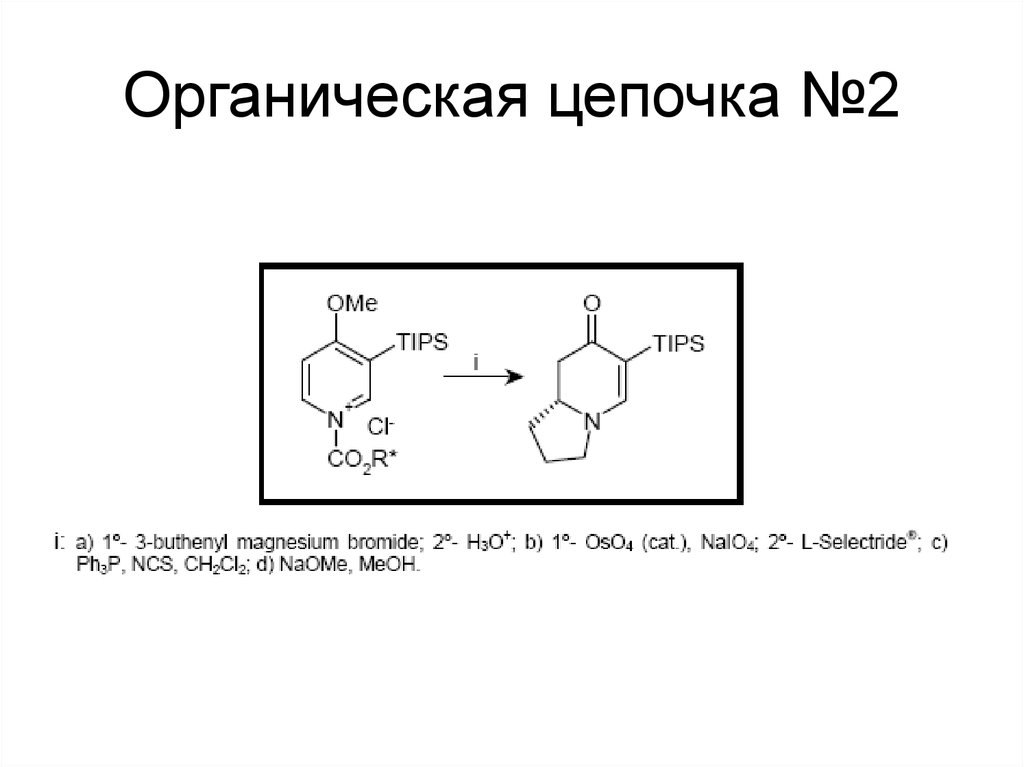
113. Органическая цепочка №2
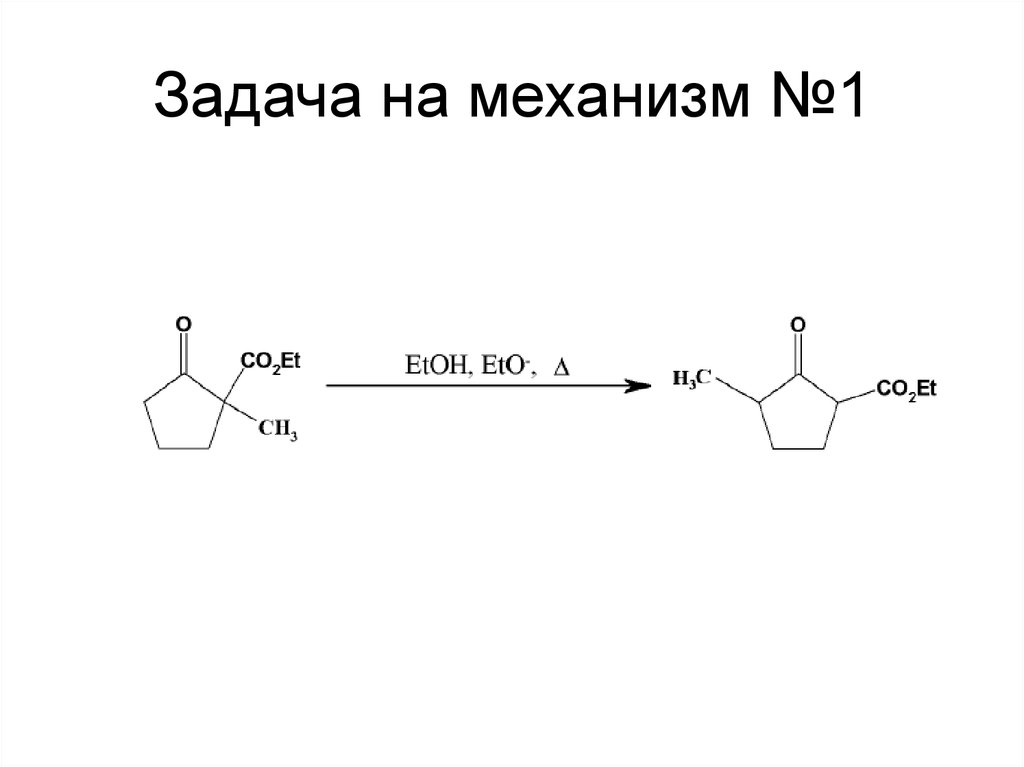
114. Задача на механизм №1
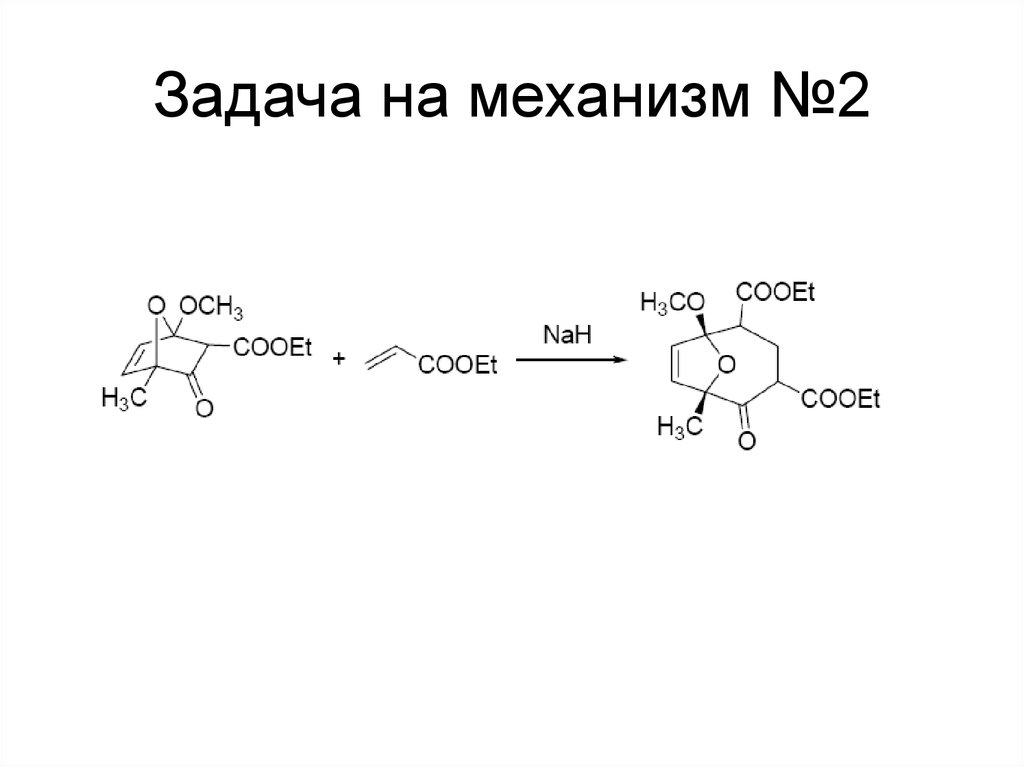
115. Задача на механизм №2
116. Задача на механизм №3
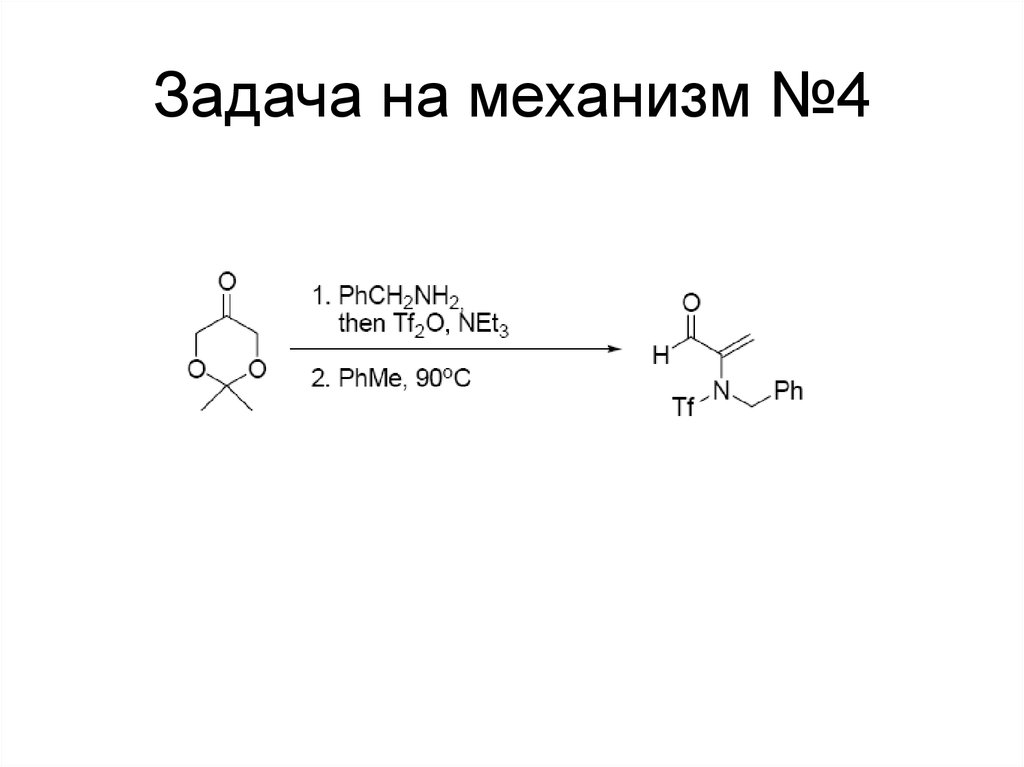
117. Задача на механизм №4
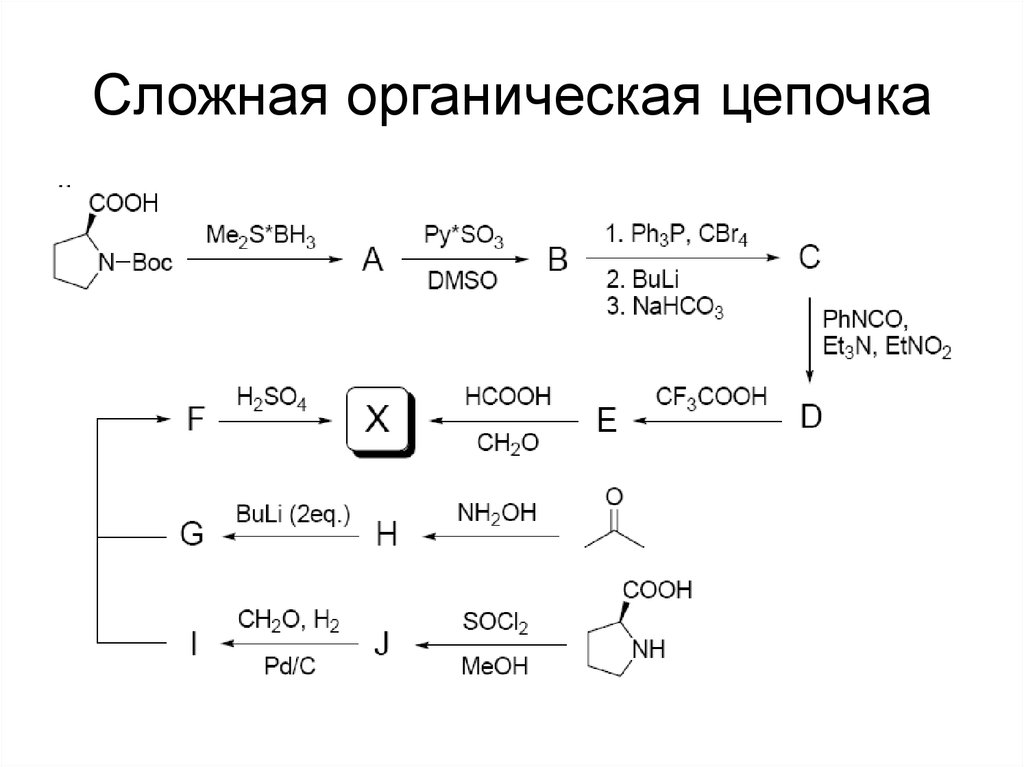
118. Сложная органическая цепочка
119. ТАС
Интересное с теоретической точки зрения соединениеХ можно получить исходя из фталимида (А) следующим
образом (ТАС - тетраацетат свинца):
A + NH2Cl (NaHCO3) Б
Б + С2Н4 + ТАС B
B + N2H4 Г + Д (изомер Б)
Г + ТАС + C2H4 X (C4H8N2)
Нагревание Х приводит к его изомеризации в гидразид
ацетальдегида.
Напишите уравнения реакций. Рассмотрите эту схему
синтеза, используя вместо этилена пропилен. Какие
изомеры будут существовать для аналога Х в этом
случае?
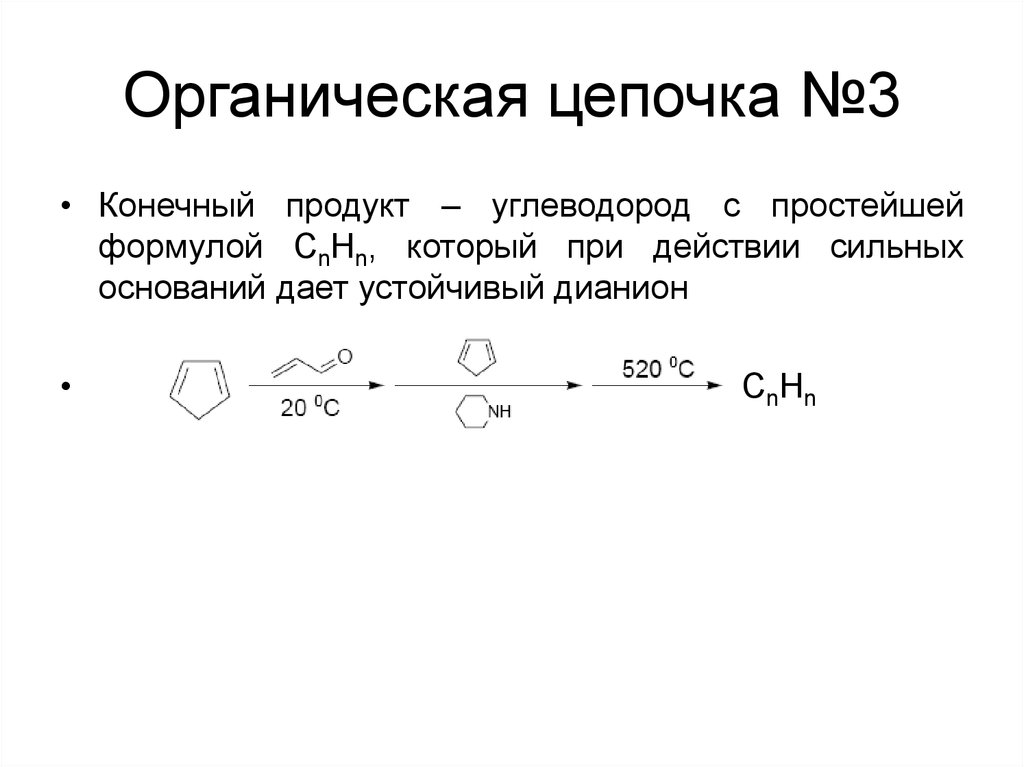
120. Органическая цепочка №3
• Конечный продукт – углеводород с простейшейформулой CnHn, который при действии сильных
оснований дает устойчивый дианион
CnHn
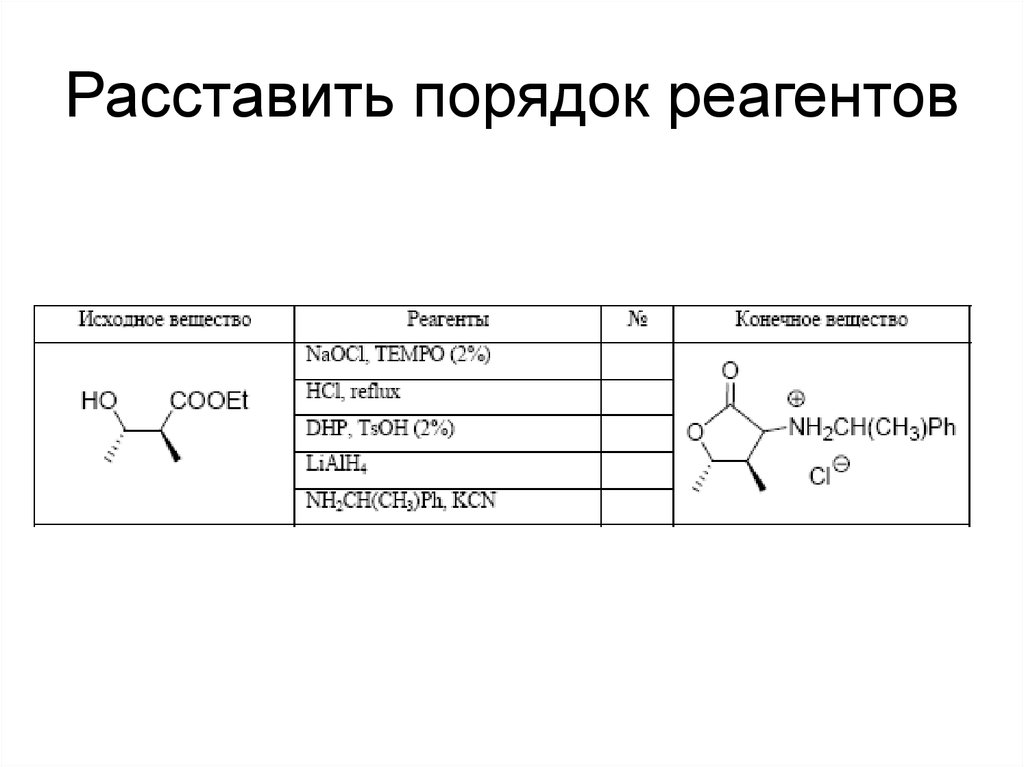
121. Расставить порядок реагентов
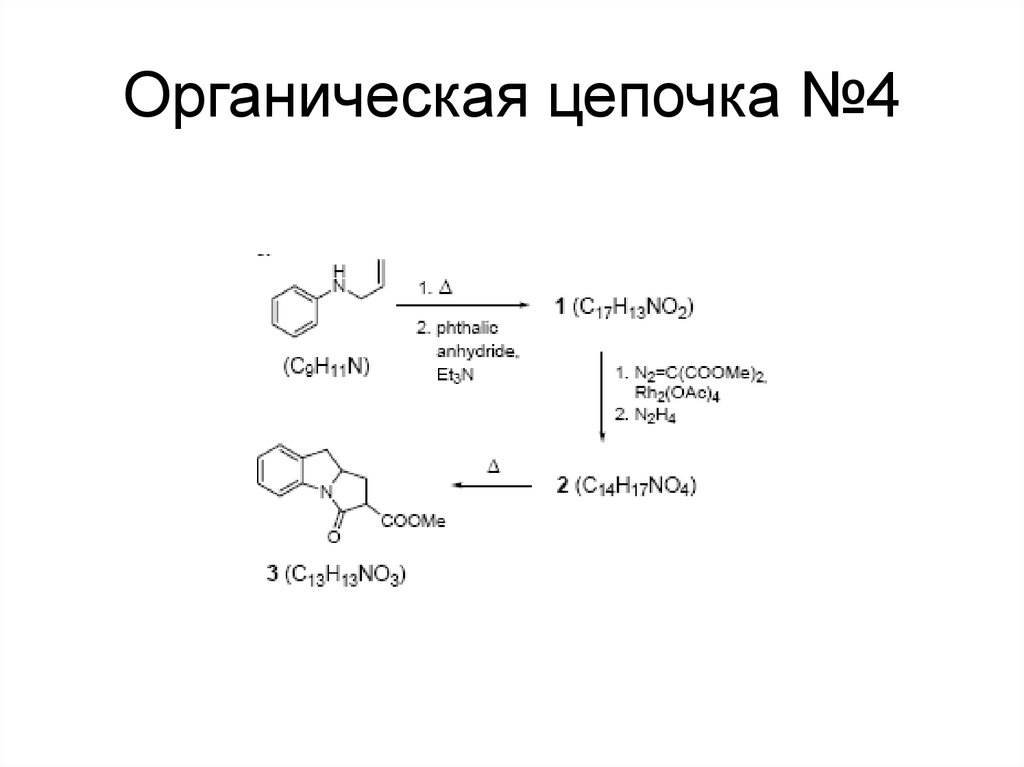
122. Органическая цепочка №4
123. Органическая цепочка №5
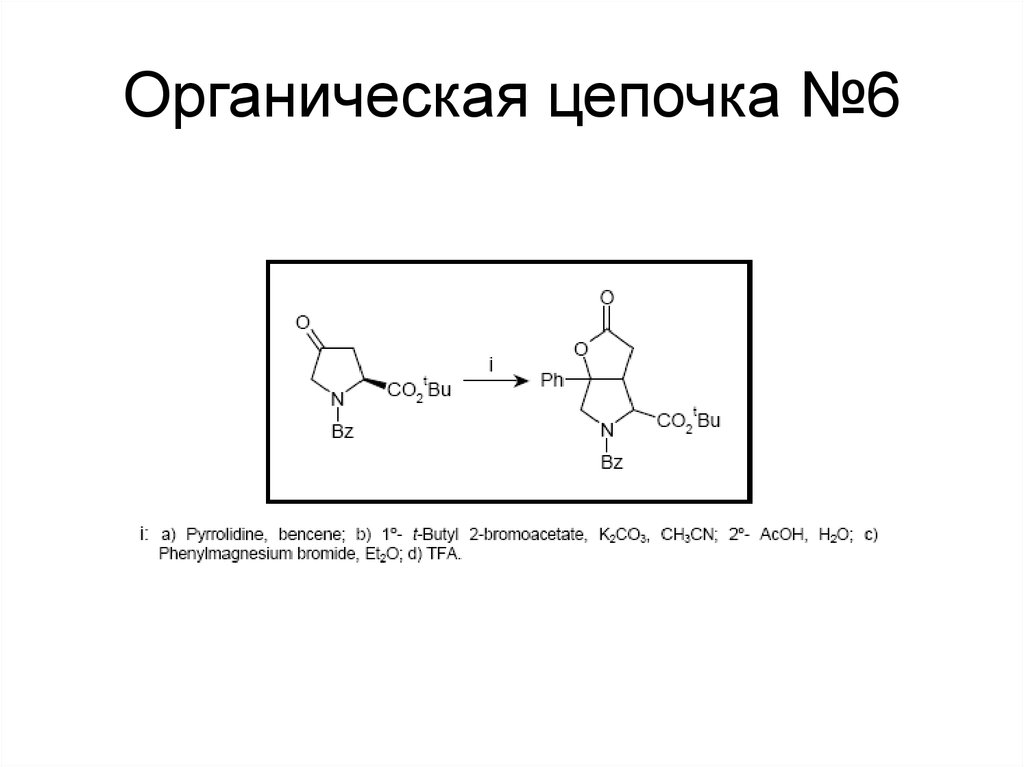
124. Органическая цепочка №6
125. Изомерные углеводороды
Два
изомерных
углеводорода,
не
обесцвечивающие бромную воду и имеющие
соотношение атомов углерода и водорода в них
1:2, образуют только по 1 монохлорпроизводному.
Один из них образует 6, а другой - 7
дихлорпроизводных
(без
учета
оптических
изомеров). Найти углеводороды.
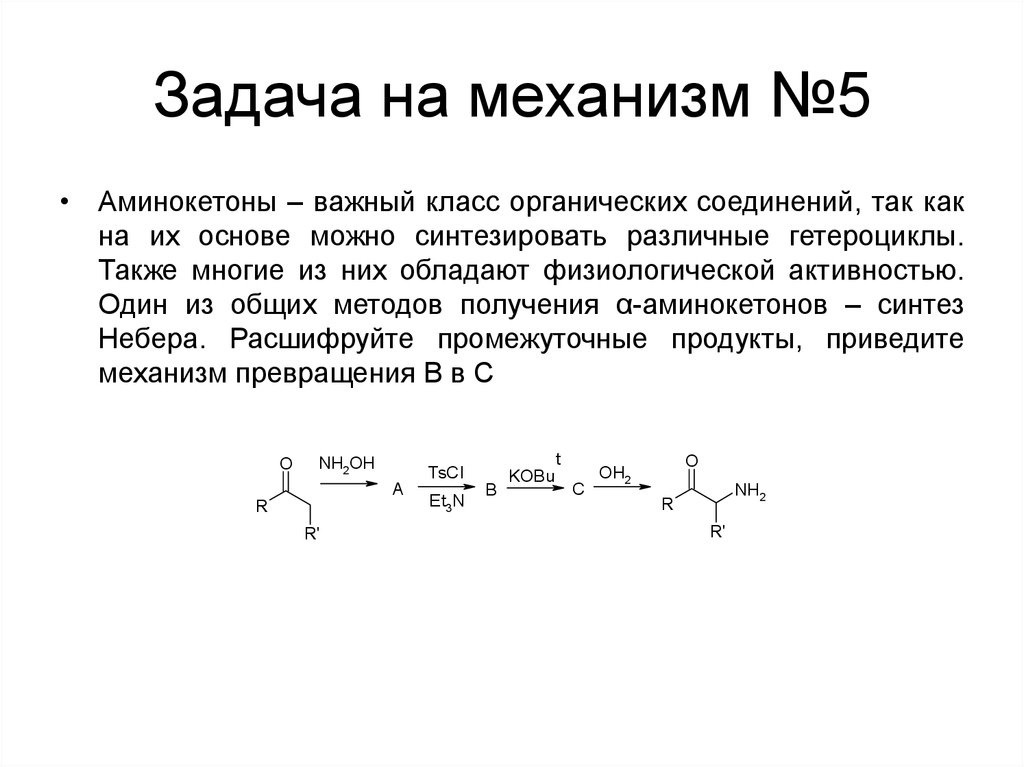
126. Задача на механизм №5
• Аминокетоны – важный класс органических соединений, так какна их основе можно синтезировать различные гетероциклы.
Также многие из них обладают физиологической активностью.
Один из общих методов получения α-аминокетонов – синтез
Небера. Расшифруйте промежуточные продукты, приведите
механизм превращения B в C
O
NH2OH
A
R
R'
t
TsCl
Et3N
B
KOBu
C
O
OH2
NH2
R
R'































![[1,n]-сдвиги [1,n]-сдвиги](https://cf2.ppt-online.org/files2/slide/c/cwfKaHGPm8viurzbhte4J10DBysR2kFUZdp7EQCgXV/slide-49.jpg)



























 chemistry
chemistry