Similar presentations:
Типичные реакции органических соединений
1.
Лекция 42013
Органическая химия
4. Типичные реакции органических
соединений
Лекцию читает проф. Иван Юрьевич Белавин
1
2.
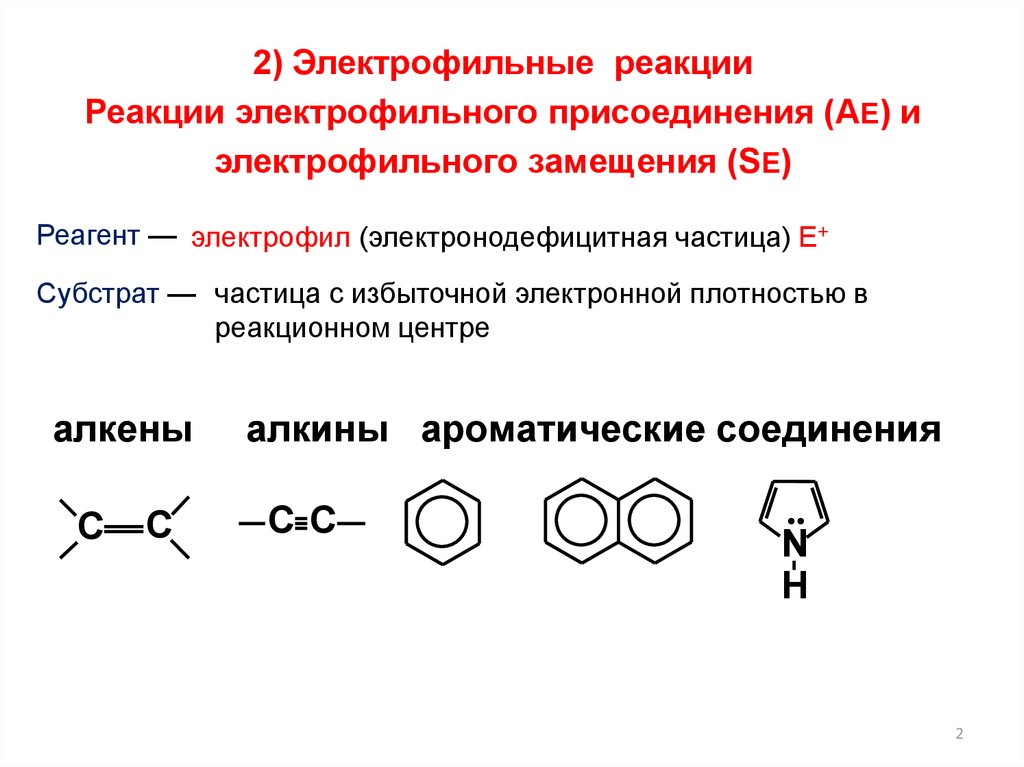
2) Электрофильные реакцииРеакции электрофильного присоединения (АЕ) и
электрофильного замещения (SE)
Реагент — электрофил (электронодефицитная частица) Е+
Субстрат — частица с избыточной электронной плотностью в
реакционном центре
алкены
С
С
алкины ароматические соединения
СС
N
H
2
3.
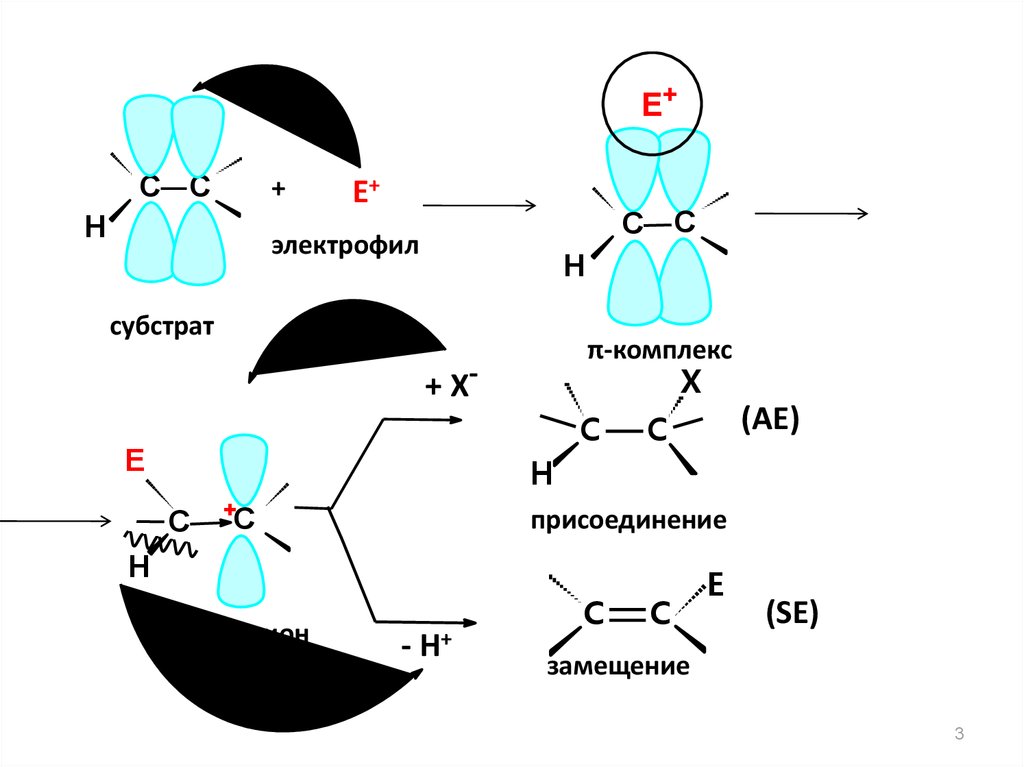
Е+С С
+
Н
Е+
С С
электрофил
Н
субстрат
π-комплекс
X
+ Х-
C
Е
(АЕ)
C
H
С
+
С
присоединение
Н
карбокатион
- Н+
C
C
E
(SЕ)
замещение
3
4.
Факторы, определяющие направление реакцииДинамический фактор
Cl–
Статические
факторы
+
–
CH CH2
CH3
CH3
H
CH
CH3
CH3
CH3
Cl
карбокатион 1
+
CH
образуется
электронный и
пространственый
CH3
CH2
CH2
Cl–
CH3 CH2 CH2Cl
не образуется
карбокатион 2
Стабильность карбокатионов:
третичный >> вторичный >> первичный
R
sp2
C
карбокатион
R
C
R
третичный
R
R
C
R
вторичный
H
C
H
H
первичный
уменьшение стабильности карбокатионов
4
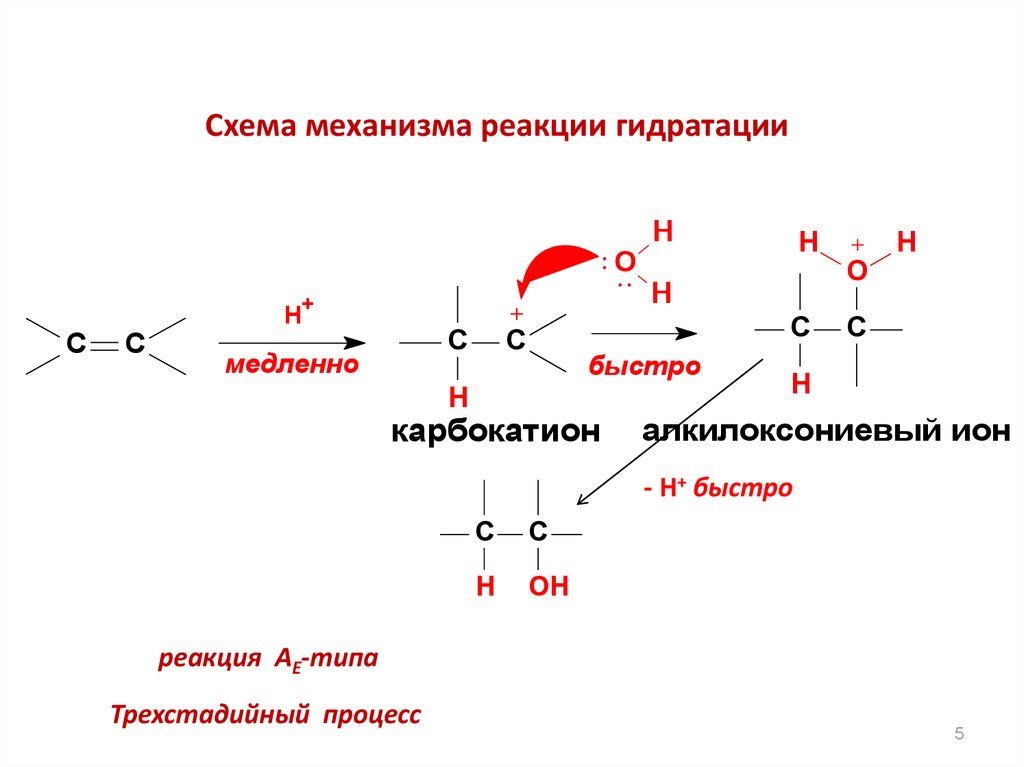
5.
Схема механизма реакции гидратацииH
O
+
H
C
C
C
медленно
H
O
H
C
C
быстро
H
карбокатион
H
C
H
алкилоксониевый ион
- H+ быстро
C
C
H
OH
реакция AE-типа
Трехстадийный процесс
5
6.
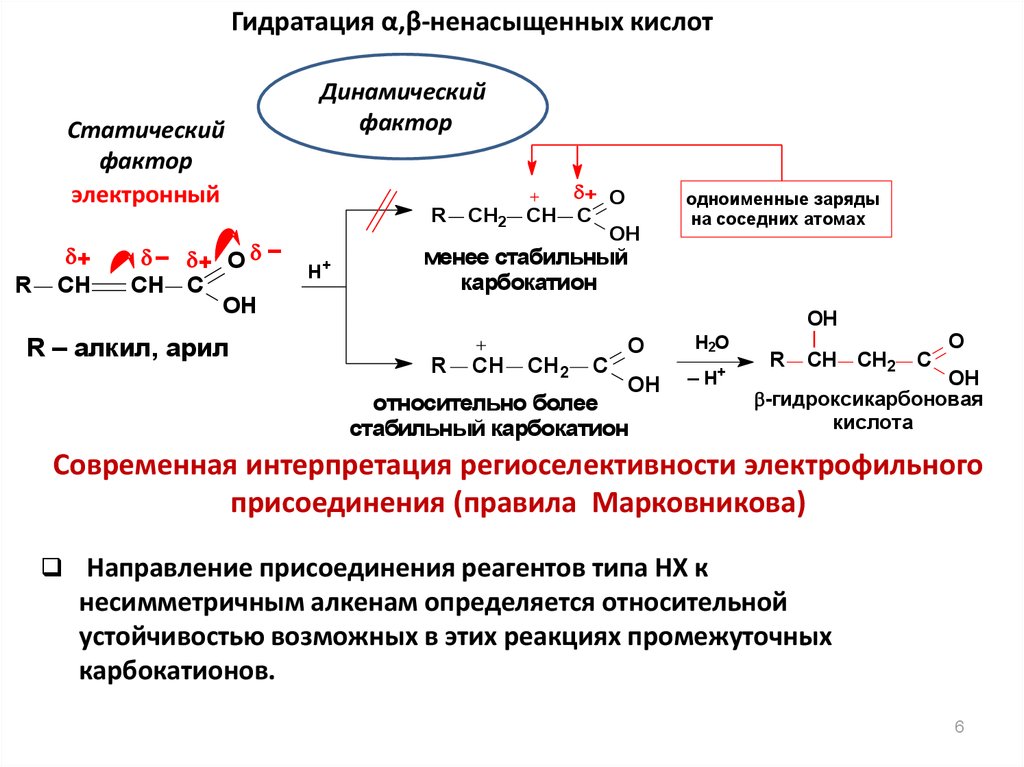
Гидратация α,β-ненасыщенных кислотСтатический
фактор
электронный
R
+
CH
– + O –
CH C
OH
R – алкил, арил
Динамический
фактор
R
H+
CH2
+ O
CH C
OH
одноименные заряды
на соседних атомах
менее стабильный
карбокатион
OH
R
CH
CH2
C
O
OH
H2O
– H+
относительно более
стабильный карбокатион
R
CH
CH2
C
O
OH
-гидроксикарбоновая
кислота
Современная интерпретация региоселективности электрофильного
присоединения (правила Марковникова)
Направление присоединения реагентов типа НХ к
несимметричным алкенам определяется относительной
устойчивостью возможных в этих реакциях промежуточных
карбокатионов.
6
7.
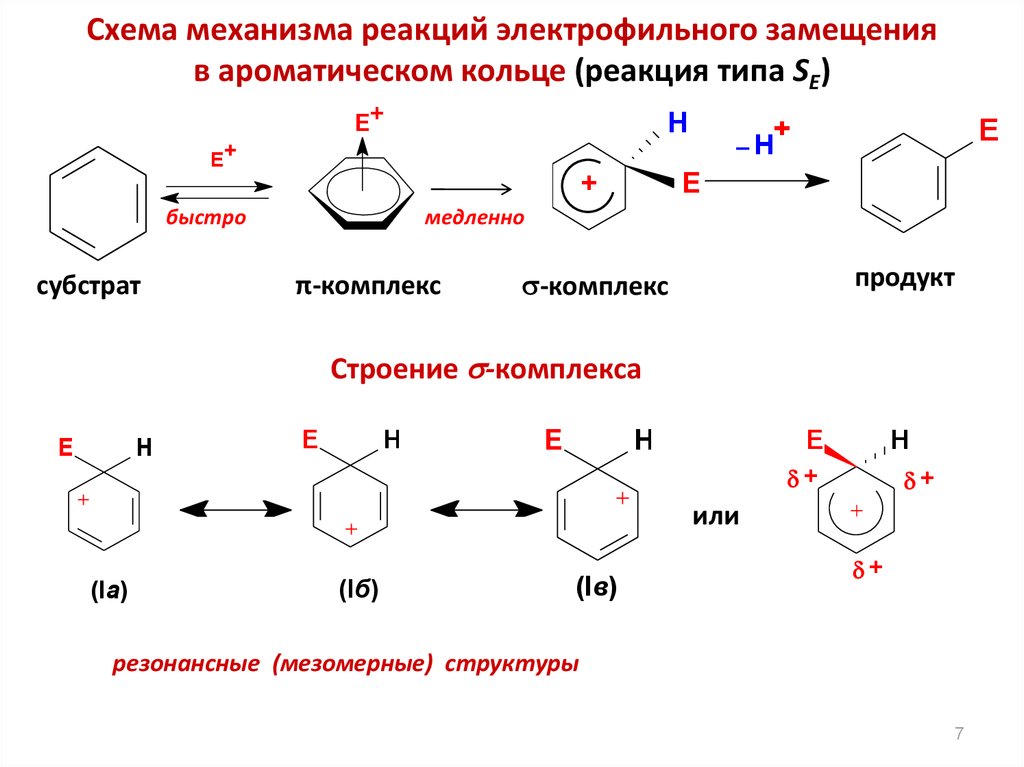
Схема механизма реакций электрофильного замещенияв ароматическом кольце (реакция типа SE)
E+
H
+
H
E+
+
быстро
субстрат
E
E
медленно
π-комплекс
продукт
-комплекс
Строение -комплекса
E
H
E
H
E
E
H
H
+
+
или
(Ia)
(Iб)
(Iв)
+
резонансные (мезомерные) структуры
7
8.
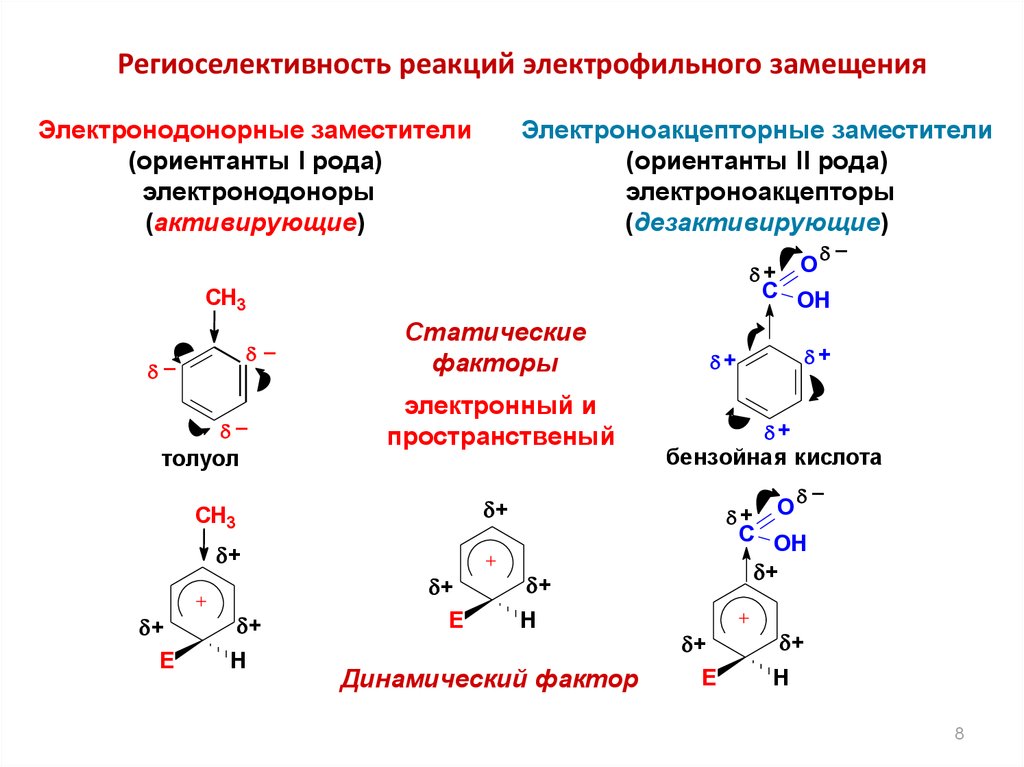
Региоселективность реакций электрофильного замещенияЭлектронодонорные заместители
(ориентанты I рода)
электронодоноры
(активирующие)
Электроноакцепторные заместители
(ориентанты II рода)
электроноакцепторы
(дезактивирующие)
O
+
C OH
CH3
–
–
–
толуол
Статические
факторы
электронный и
пространственый
+
бензойная кислота
+
+
H
+
H
Динамический фактор
O
–
C OH
+
+
+
E
+
+
+
CH3
+
E
–
+
E
+
H
8
9.
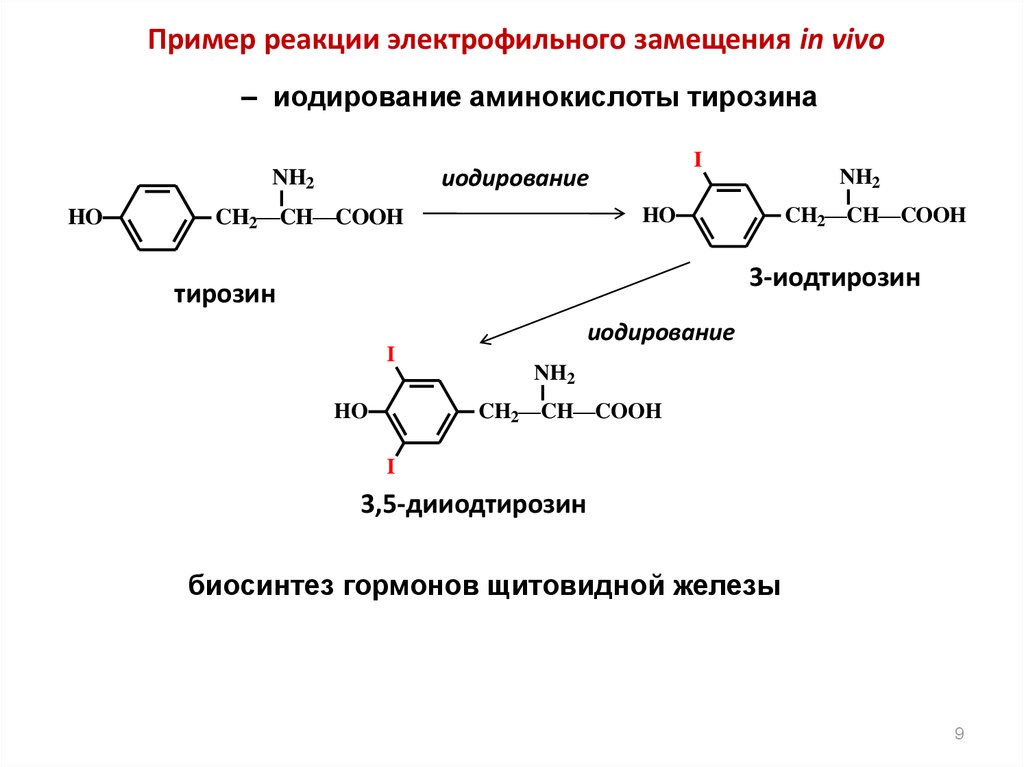
Пример реакции электрофильного замещения in vivo– иодирование аминокислоты тирозина
HO
I
иодирование
NH2
CH2—CH—COOH
NH2
CH2—CH—COOH
HO
3-иодтирозин
тирозин
иодирование
I
NH2
CH2—CH—COOH
HO
I
3,5-дииодтирозин
биосинтез гормонов щитовидной железы
9
10.
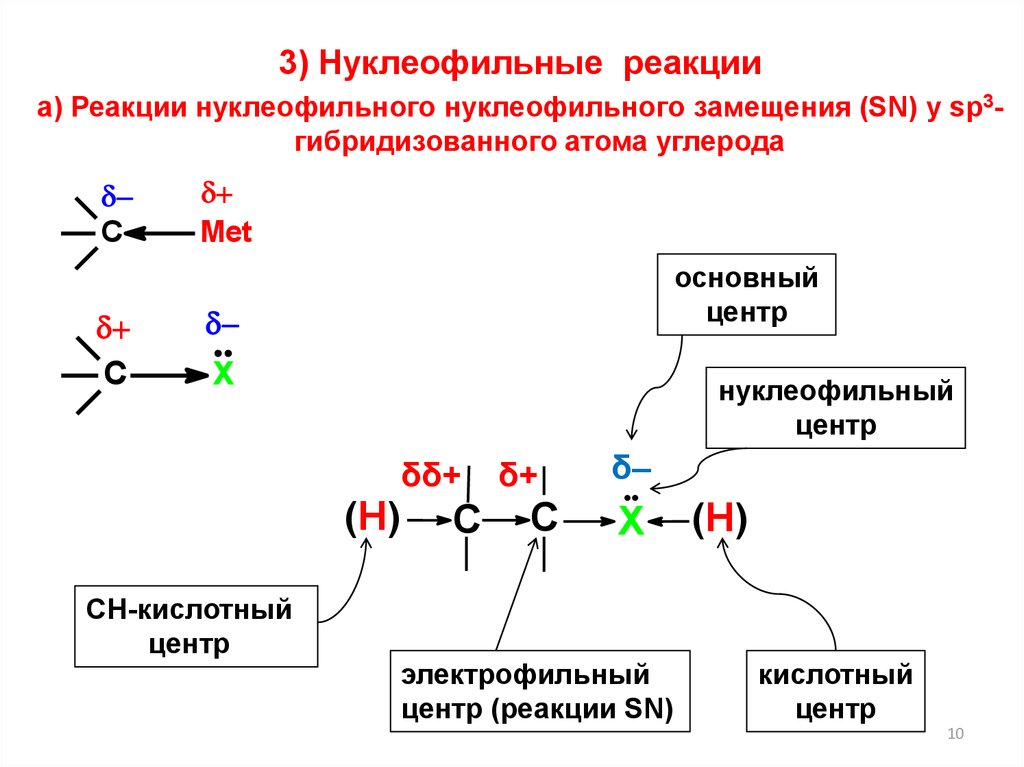
3) Нуклеофильные реакцииа) Реакции нуклеофильного нуклеофильного замещения (SN) у sp3гибридизованного атома углерода
С
С
Met
основный
центр
Х
нуклеофильный
центр
δδ+
(Н)
СН-кислотный
центр
С
δ+
С
δ–
Х
электрофильный
центр (реакции SN)
(Н)
кислотный
центр
10
11.
Общая схема реакций нуклеофильного замещенияX
+
C
(-)
Y
нуклеофил
(-)
X
C Y +
уходящая
группа
(нуклеофуг)
продукт
реакции
субстрат
Ассоциативный механизм (SN 2)
HO-
+ CH3
I
HO
C
I
CH3OH + I-
переходное состояние
11
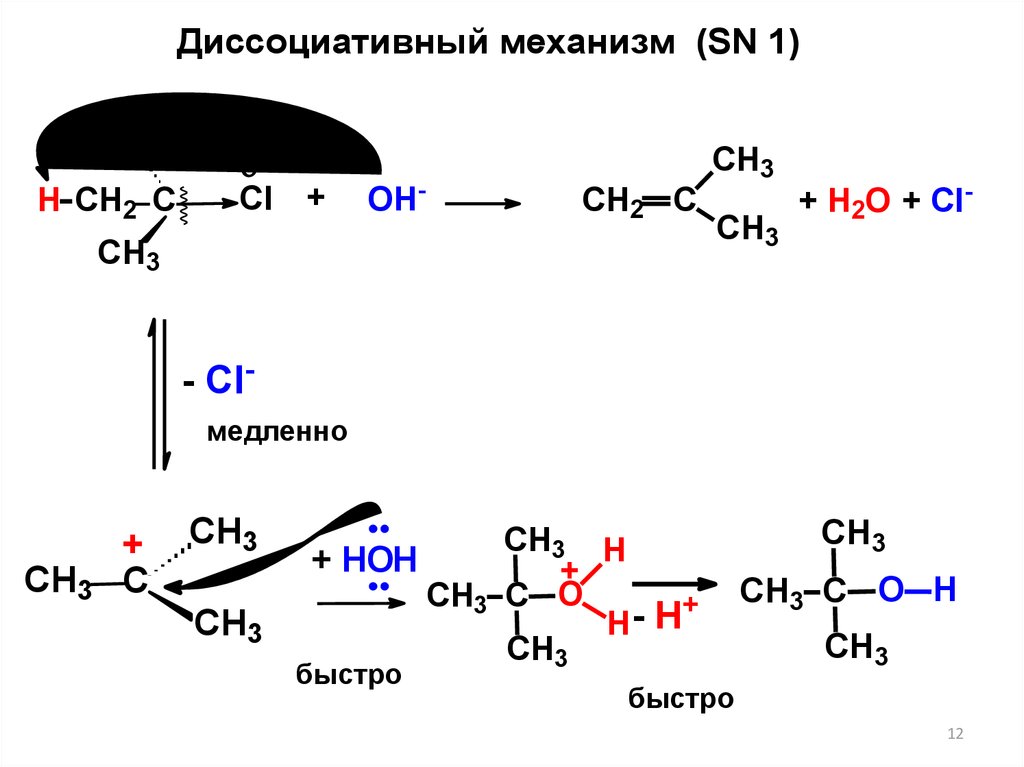
12.
Диссоциативный механизм (SN 1)СН3
Н CH2 C
Cl +
OH-
СН2 С
CH3
СН3
СН3
+ Н2О + Сl-
- Clмедленно
CH3
+
C
СН3
СН3
CH3 H
+ HOH
+
CH3 C O
+
H
H
CH3
быстро
CH3
CH3 C O H
CH3
быстро
12
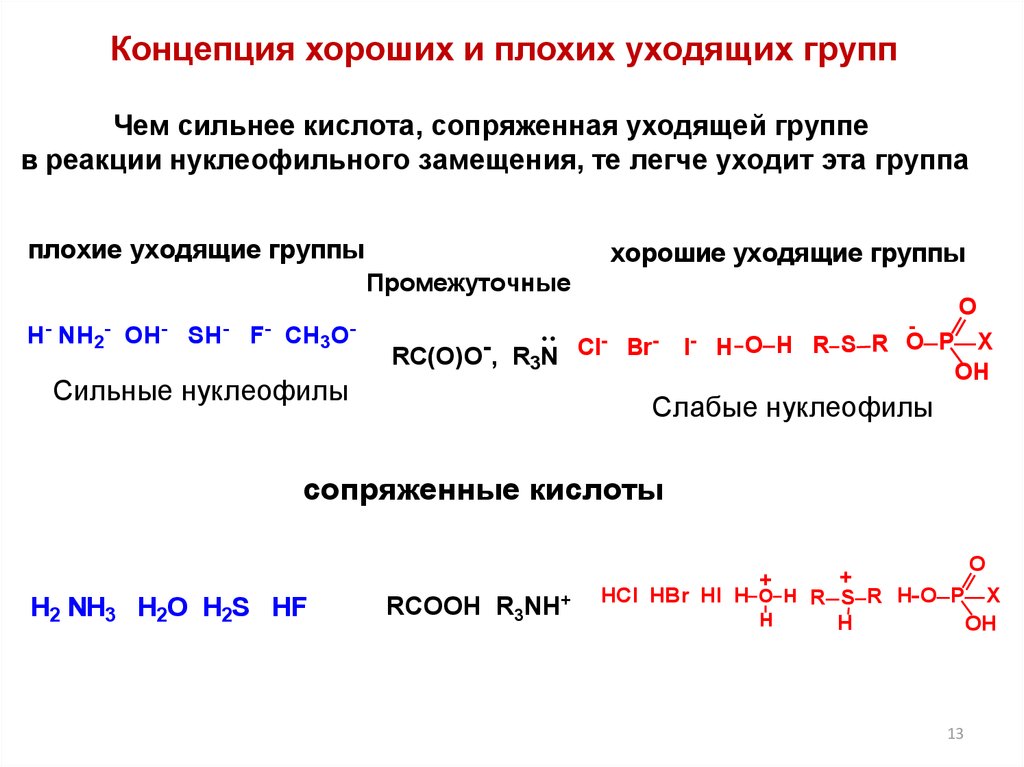
13.
Концепция хороших и плохих уходящих группЧем сильнее кислота, сопряженная уходящей группе
в реакции нуклеофильного замещения, те легче уходит эта группа
плохие уходящие группы
хорошие уходящие группы
Промежуточные
Н
-
NH2-
-
OH
-
SH
-
F CH3O
-
RC(O)O-, R3N Cl Br
Сильные нуклеофилы
-
О
I- H О H R S R O P
X
OH
Слабые нуклеофилы
сопряженные кислоты
О
+
HCl HBr HI H O H R S R H O P X
H
Н
OH
+
Н2 NH3 H2O H2S HF
RCOOH R3NH+
13
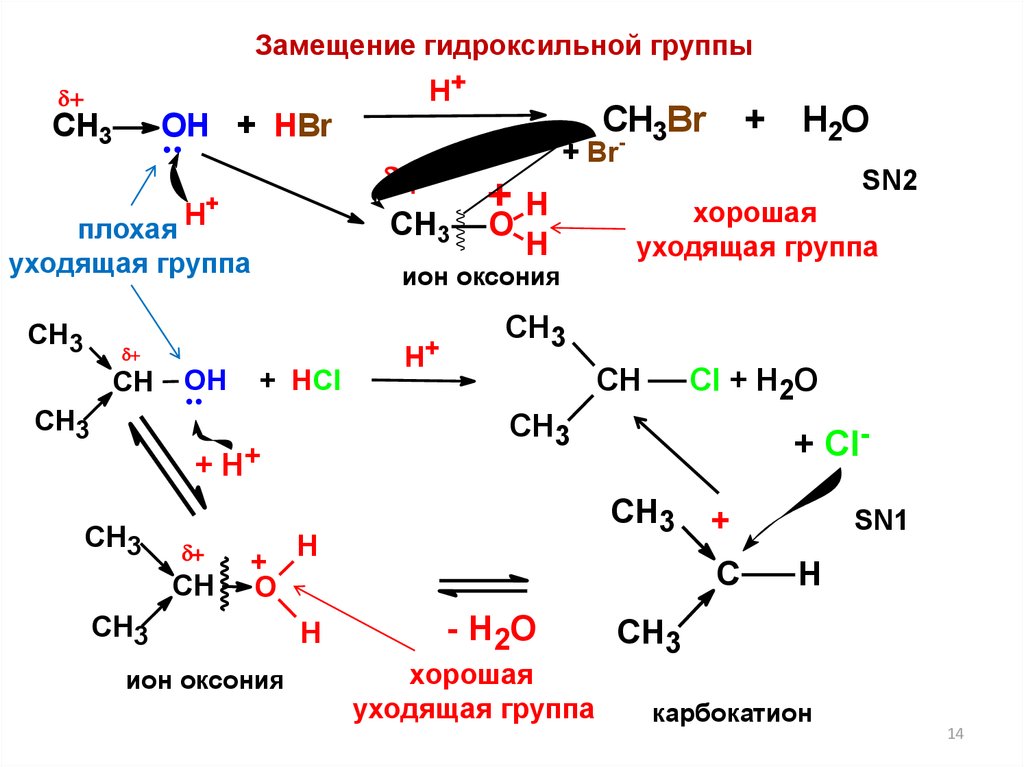
14.
Замещение гидроксильной группыH+
СН3
CH3
уходящая группа
CH
CH3
OH
+ HCl
CH
O
H
H
+
O
CH3
ион оксония
хорошая
уходящая группа
СH3
CH
Cl + H2O
+ ClСH3
H
H
H2O
SN2
CH3
+ H+
СH3
+
ион оксония
H+
+
+ Br
+
H
плохая
СH3
CH
Br
- 3
ОН + HBr
+
C
- H2O
хорошая
уходящая группа
SN1
H
CH3
карбокатион
14
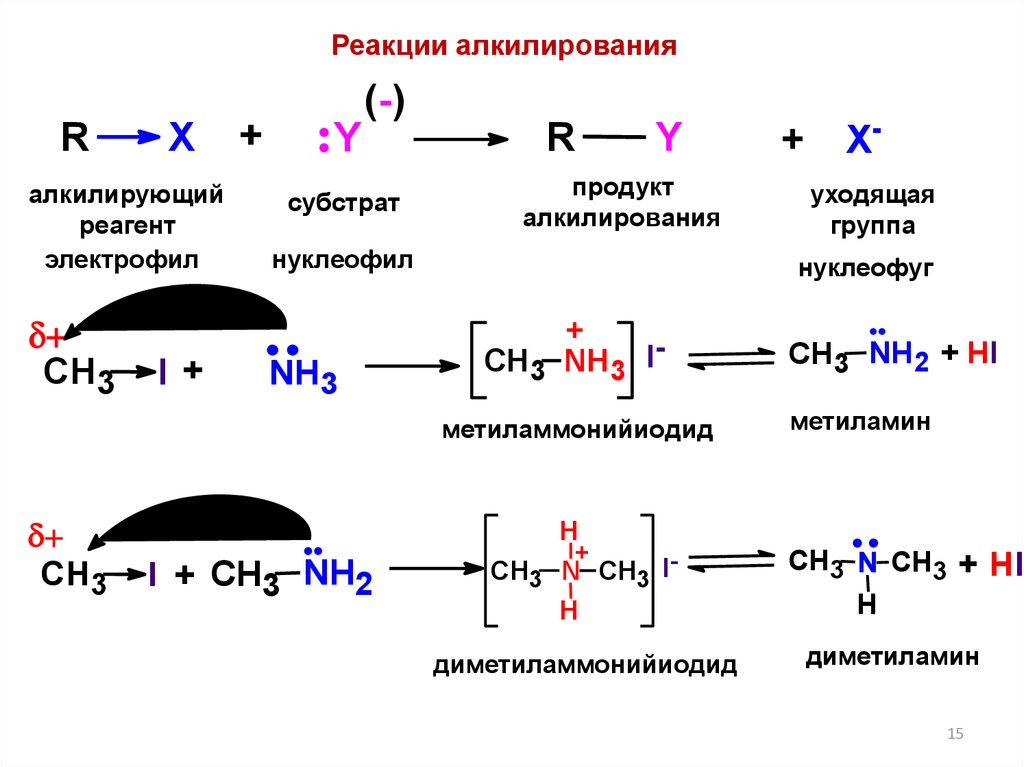
15.
Реакции алкилированияR
X
алкилирующий
реагент
электрофил
CH3
I+
+
Y
(-)
субстрат
R
Y
продукт
алкилирования
нуклеофил
NH3
I + CH3 NH2
Xуходящая
группа
нуклеофуг
+
CH3 NH3 Iметиламмонийиодид
CH3
+
H
+
CH3 N CH3 IH
диметиламмонийиодид
CH3 NH2 + HI
метиламин
CH3 N CH3 + HI
H
диметиламин
15
16.
CH3I + CH3 N CH3
H
H
+
CH3 N CH3 ICH3
триметиламмонийиодид
CH3
CH3 N CH3 + HI
CH3
триметиламин
CH3
+
CH3 N CH3 ICH3
I + CH3 N CH3
CH3
тетраметиламмонийиодид
Биологически важные алкилирующие реагенты
R галоген
галогенопроизводные
ROH
спирты
О
R
O P
X
OH
алкилфосфаты
СH3
+
S
R
R
метилсульфониевые ионы
16
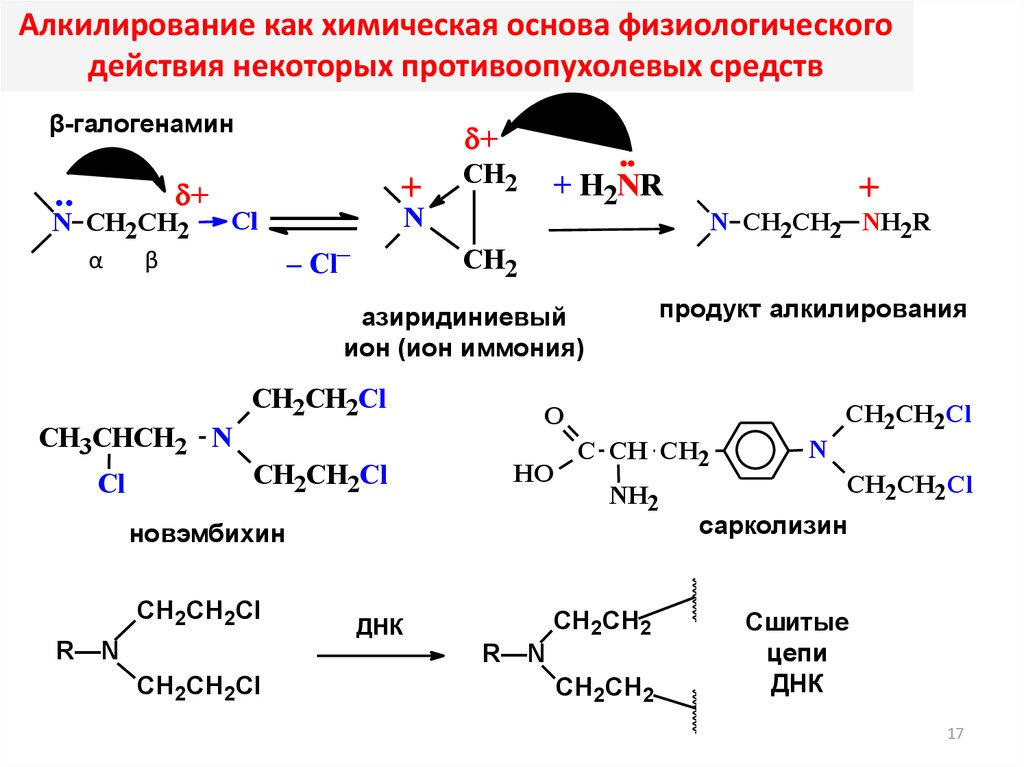
17.
Алкилирование как химическая основа физиологическогодействия некоторых противоопухолевых средств
β-галогенамин
+
N CH2CH2
α
β
+
+
CH2
N
Cl
– Cl–
CH2CH2Cl
Cl
CH2CH2Cl
продукт алкилирования
CH2CH2Cl
O
HO
C CH CH2
NH2
новэмбихин
CH2CH2Cl
R—N
CH2CH2
ДНК
R—N
CH2CH2Cl
N CH2CH2 NH2R
CH2
азиридиниевый
ион (ион иммония)
СH3CHCH2 N
+
+ H2NR
CH2CH2
N
CH2CH2Cl
сарколизин
Сшитые
цепи
ДНК
17
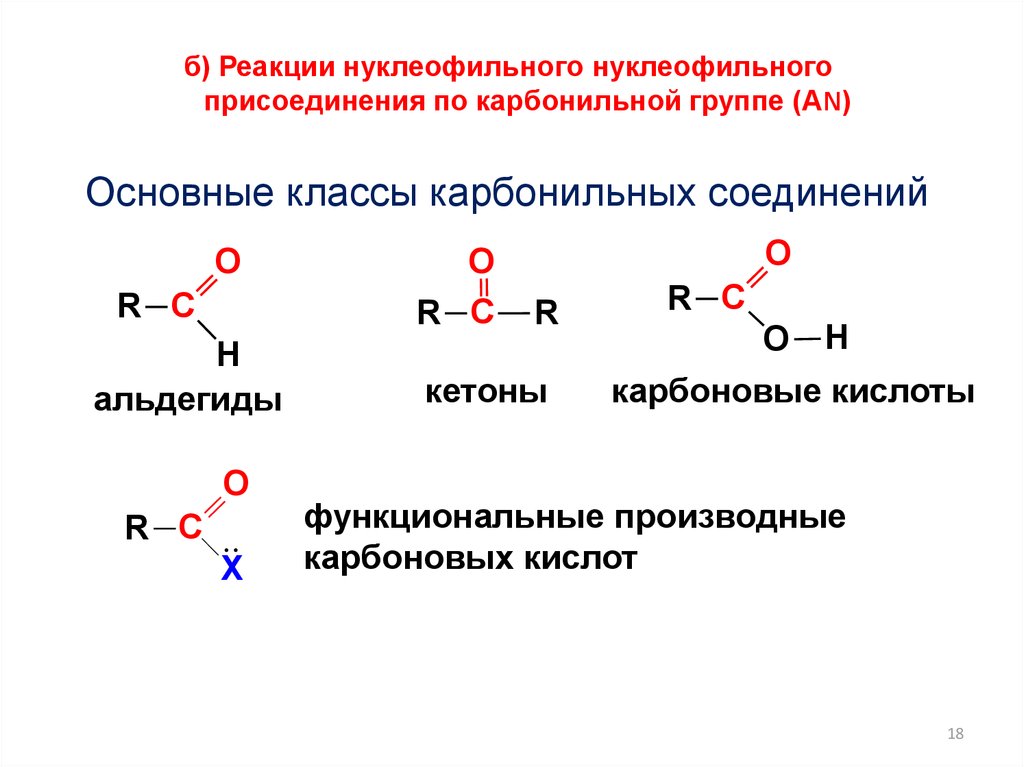
18.
б) Реакции нуклеофильного нуклеофильногоприсоединения по карбонильной группе (АN)
Основные классы карбонильных соединений
O
R C
H
альдегиды
O
R C
Х
O
R C
O
R
кетоны
R C
O
H
карбоновые кислоты
функциональные производные
карбоновых кислот
18
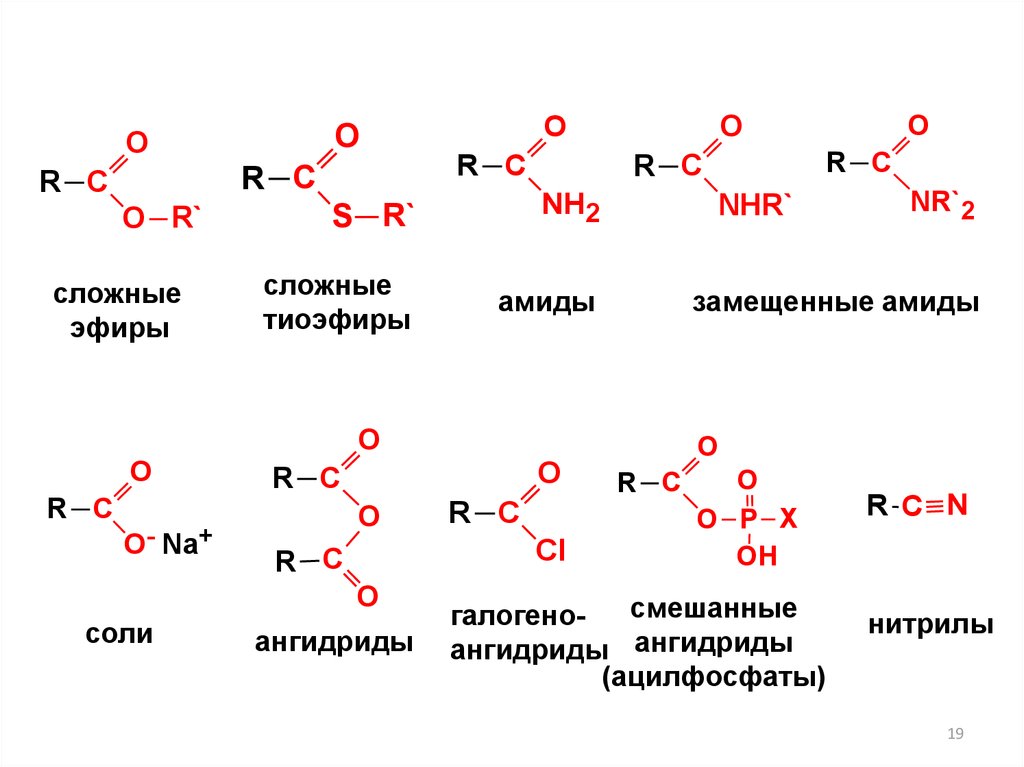
19.
OO
R C
R C
O R`
сложные
эфиры
O
R C
O- Na+
сложные
тиоэфиры
амиды
O
O
R C
R C
Cl
R C
ангидриды
O
R C
R C
NH2
O
соли
R C
S R`
O
O
O
NHR`
NR`2
замещенные амиды
O
R C
O
O P X
OH
смешанные
галогеноангидриды ангидриды
(ацилфосфаты)
R C N
нитрилы
19
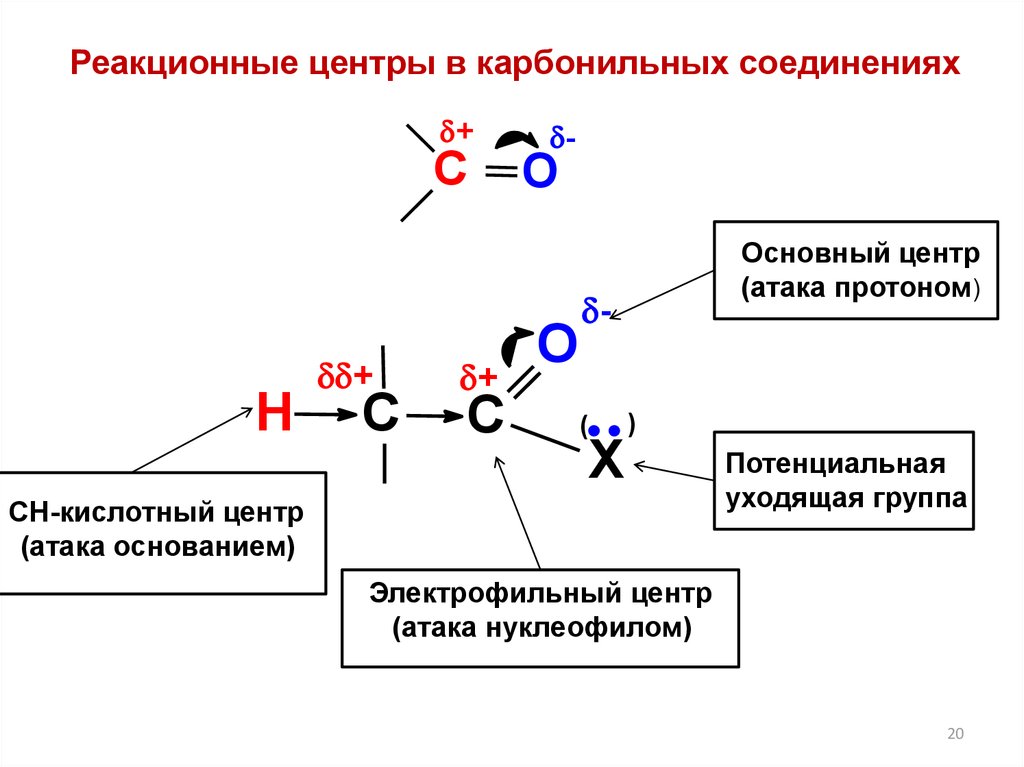
20.
Реакционные центры в карбонильных соединениях+
С
H
+
C
+
C
-
О
O
Основный центр
(атака протоном)
(
X
)
СН-кислотный центр
(атака основанием)
Потенциальная
уходящая группа
Электрофильный центр
(атака нуклеофилом)
20
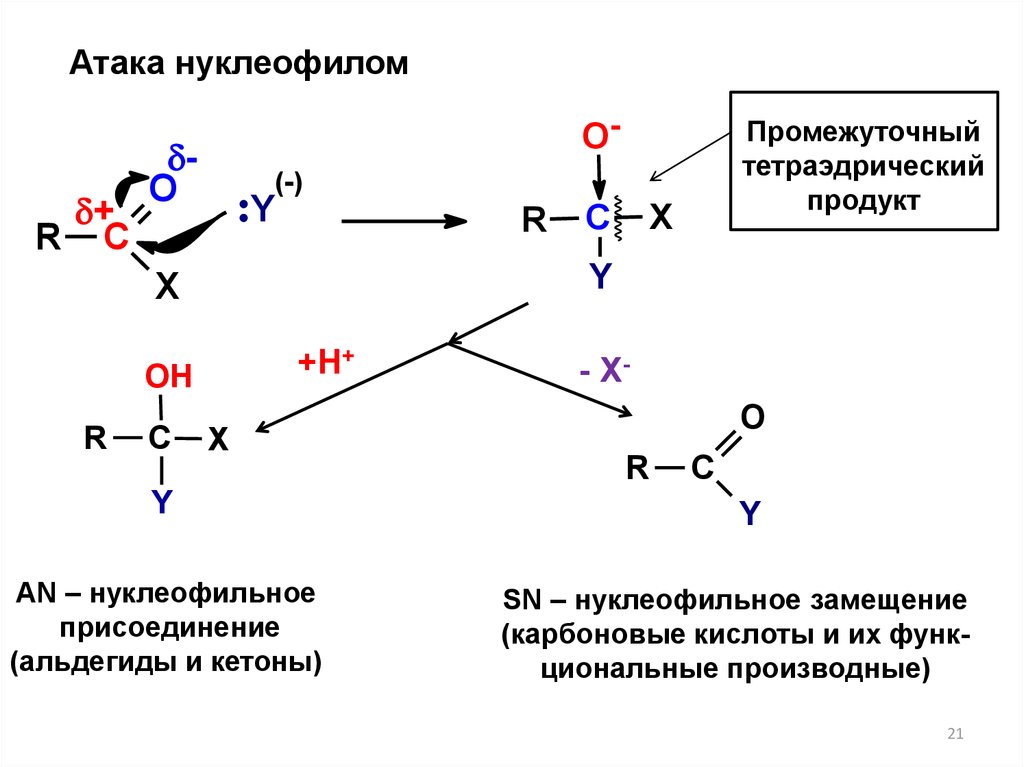
21.
Атака нуклеофилом+
R С
О-
О
(-)
Y
R
+Н+
ОH
С
Х
С
Y
Х
R
Промежуточный
тетраэдрический
продукт
Х
Y
AN – нуклеофильное
присоединение
(альдегиды и кетоны)
- XO
R
С
Y
SN – нуклеофильное замещение
(карбоновые кислоты и их функциональные производные)
21
22.
Реакции нуклеофильного присоединенияк альдегидам и кетонам AN
Гидратация
+ О
+
R С
Н
О Н
R С О
Н2О
Н
ОR С
О
Н
О
%
гидрата
соединение
O
формальдегид
+ Н
Н
Н
хлораль Cl3C
Н Гидрат
C
100
H O
H C
99
H
Н
%
соединение
гидрата
O
50
ацетальдегид CH3 C
H
O
0
ацетон CH3 C CH3
22
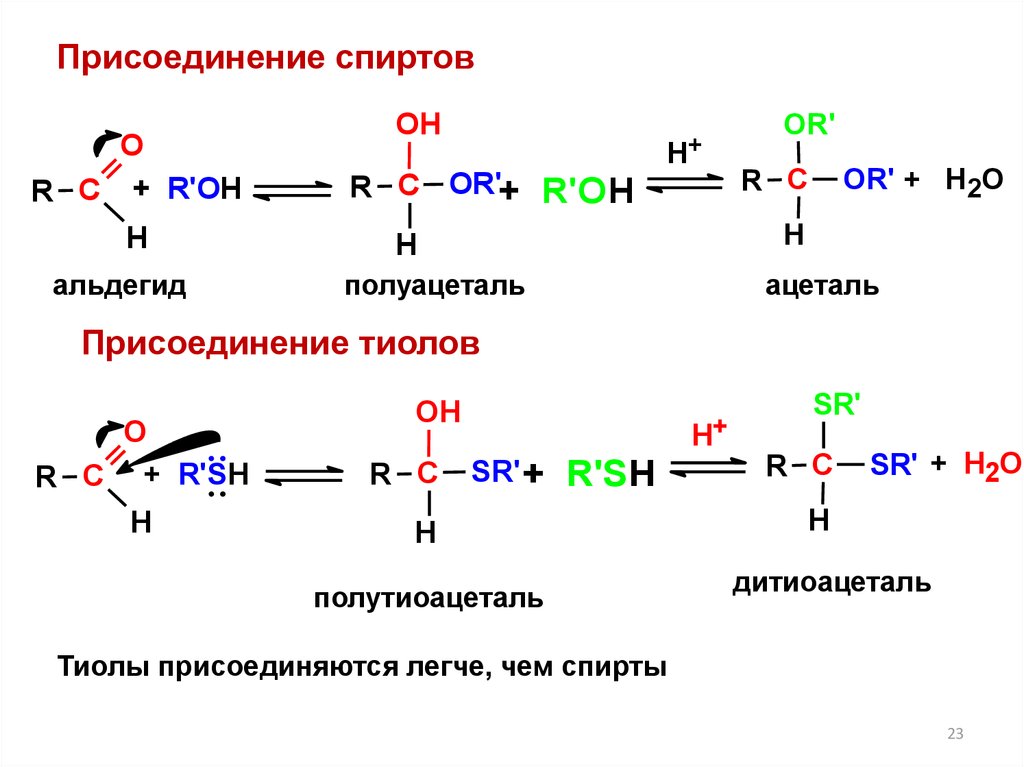
23.
Присоединение спиртовО
R С + R'OH
Н
альдегид
ОH
R С OR'+ R'OH
Н+
OR'
R С
OR' + H2O
Н
Н
полуацеталь
ацеталь
Присоединение тиолов
О
R С + R'SH
Н
ОH
R С
Н+
SR' +
R'SH
Н
полутиоацеталь
SR'
R С
SR' + H2O
Н
дитиоацеталь
Тиолы присоединяются легче, чем спирты
23
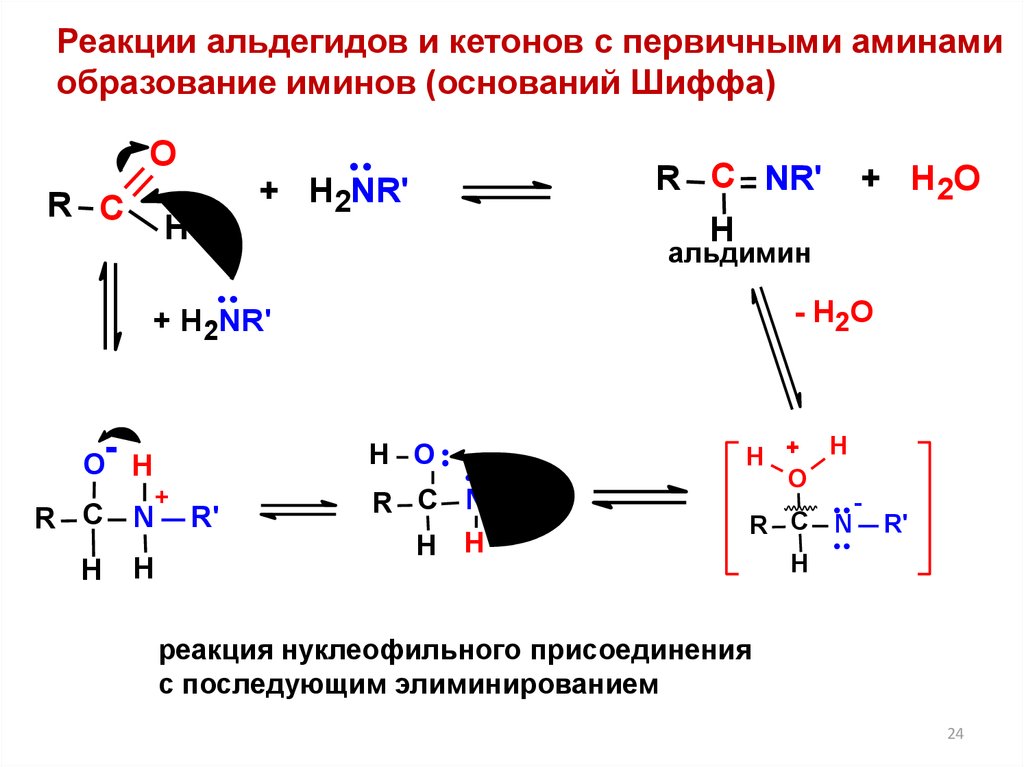
24.
Реакции альдегидов и кетонов с первичными аминамиобразование иминов (оснований Шиффа)
О
R С
+ H2NR'
Н
R С NR'
Н
альдимин
- H2O
+ H2NR'
О-
Н
R С
N
Н
Н
H O
+
+ H2O
R'
R С N R'
Н Н
Н + H
О
R С N
-
R'
Н
реакция нуклеофильного присоединения
с последующим элиминированием
24
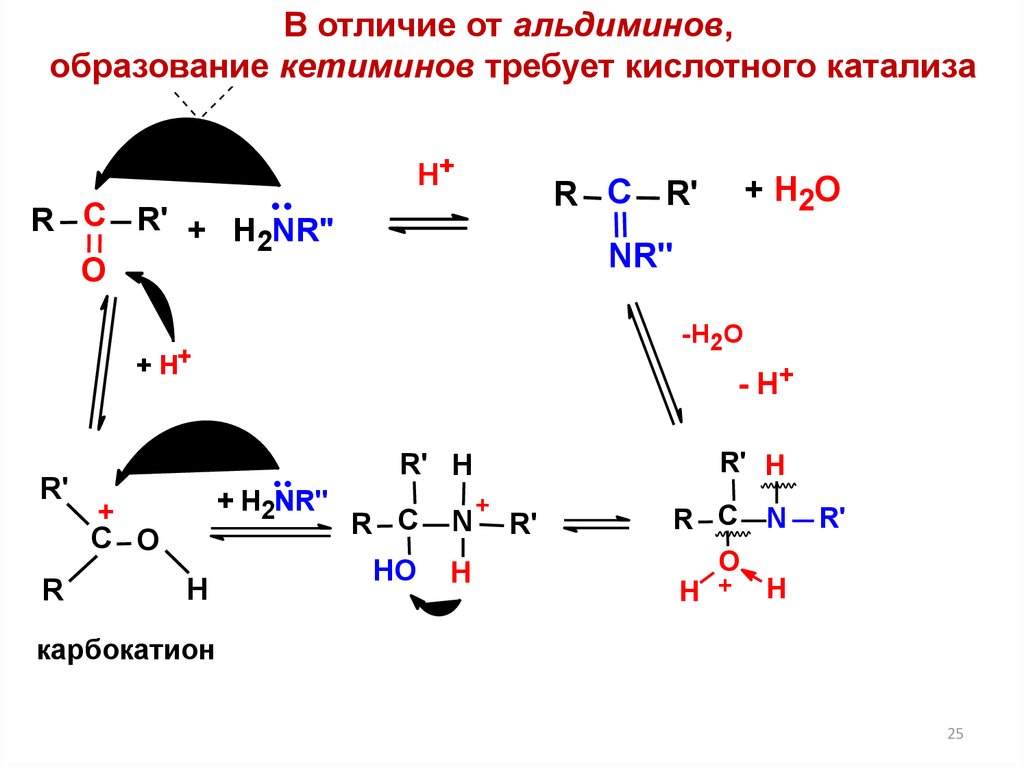
25.
В отличие от альдиминов,образование кетиминов требует кислотного катализа
Н+
R С R' + H NR"
2
О
NR''
-H2O
+ H+
R'
R
- H+
R' Н
R' Н
+ H2NR"
+
С O
H
+ H2O
R С R'
R С
N
НО
Н
+
R'
R С N
О
H + H
R'
карбокатион
25
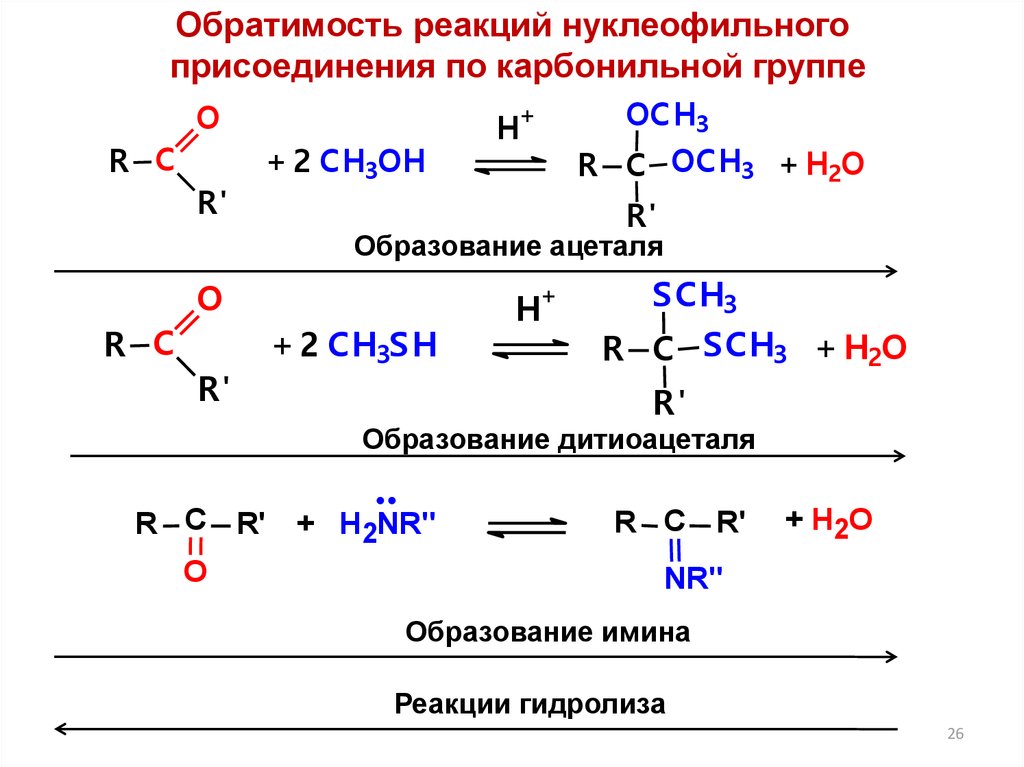
26.
Обратимость реакций нуклеофильногоприсоединения по карбонильной группе
O
R C
R'
+ 2 CH3OH
H+
OCH3
R C OCH3 + H2O
R'
Образование ацеталя
O
R C
R'
+ 2 CH3SH
H+
SCH3
R C SCH3 + H2O
R'
Образование дитиоацеталя
R С R' + H2NR"
О
R С R'
+ H2O
NR''
Образование имина
Реакции гидролиза
26
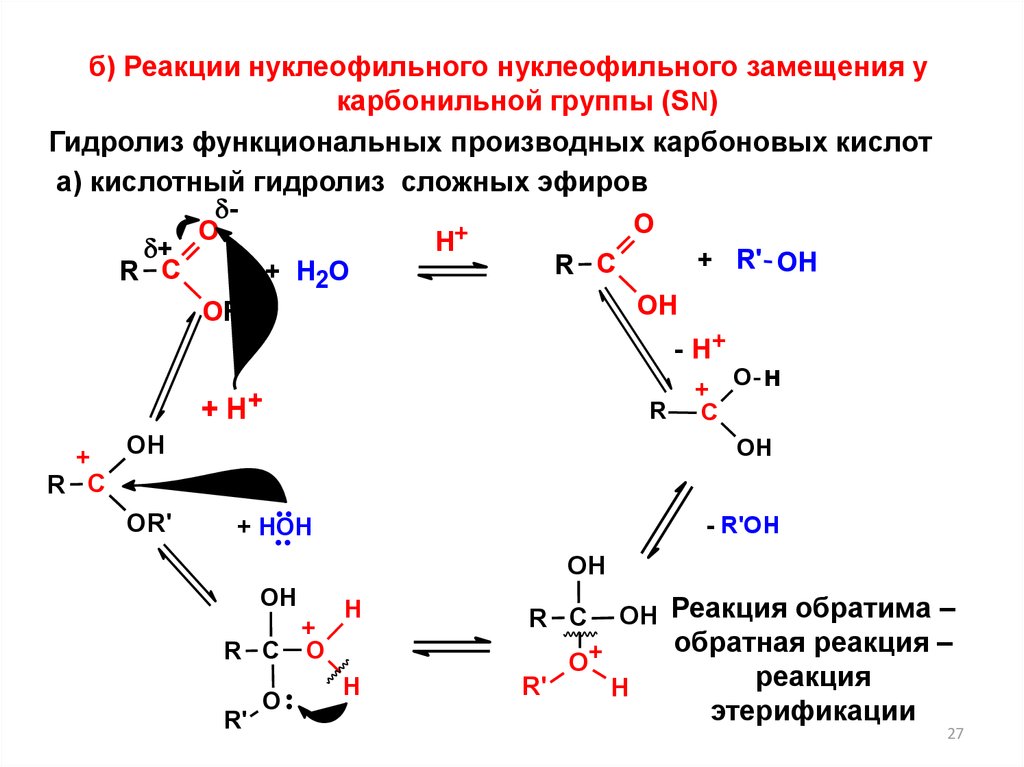
27.
б) Реакции нуклеофильного нуклеофильного замещения укарбонильной группы (SN)
Гидролиз функциональных производных карбоновых кислот
а) кислотный гидролиз сложных эфиров
+
R С
О
+ H2O
О
H+
+ R' OH
R С
OН
OR'
- H+
+ H+
+ ОH
R С
OR'
R
+
С
О
н
OН
- R'OH
+ HOH
ОH
ОH
+
R С O
R'
O
H
H
R С
R'
O+
OН Реакция обратима –
H
обратная реакция –
реакция
этерификации
27
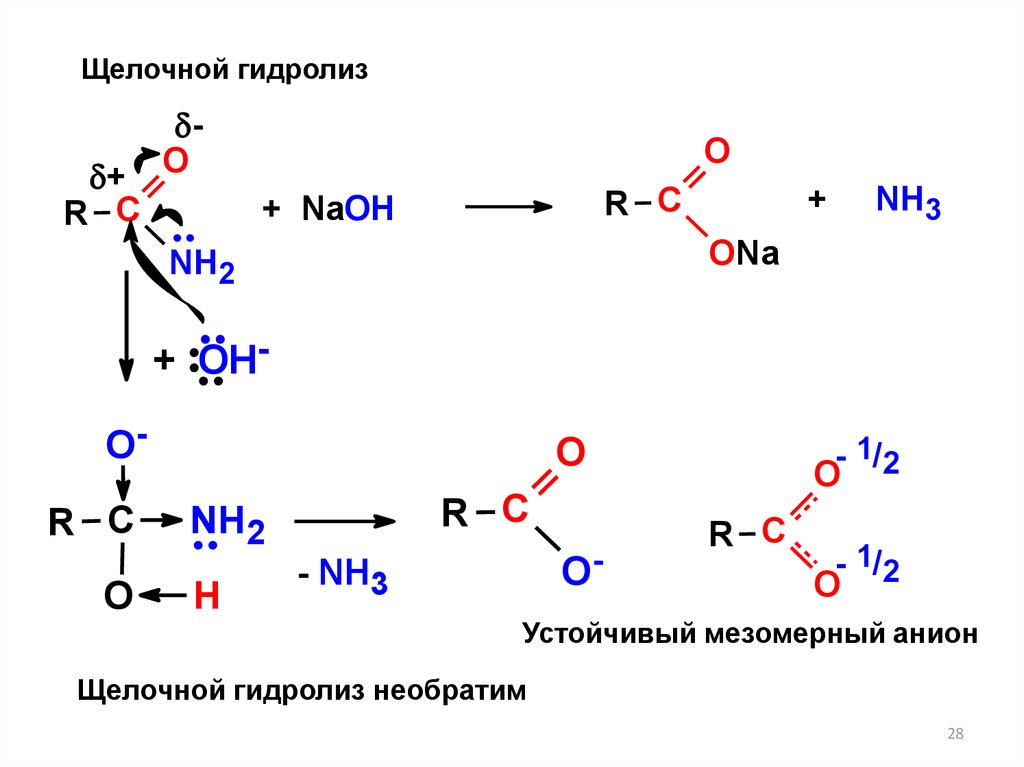
28.
Щелочной гидролиз+
R С
О
О
+
R С
+ NaOH
NH3
ONa
NН2
+ OHОR С
O
О
R С
NH2
H
O-
- NH3
- 1/2
О
R С
- 1/2
O
Устойчивый мезомерный анион
Щелочной гидролиз необратим
28
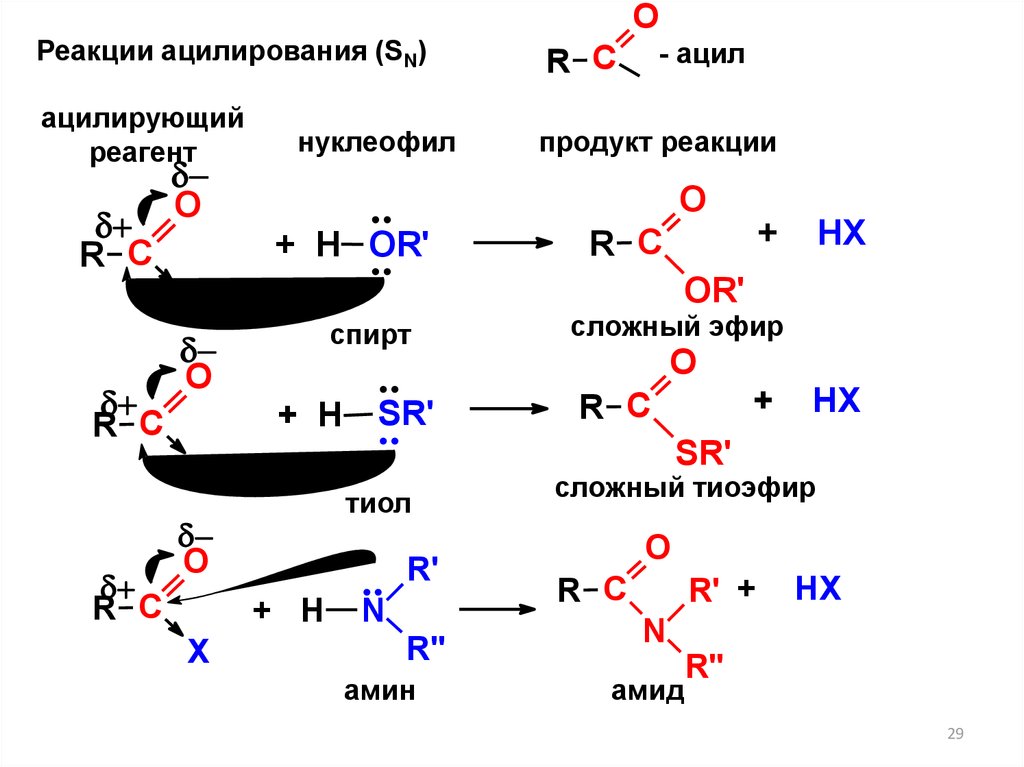
29.
ОРеакции ацилирования (SN)
R С
ацилирующий
реагент
продукт реакции
R С
R С
О
нуклеофил
О
+ H OR'
спирт
+ H
SR'
HX
R'
+ H
сложный эфир
О
+
R С
HX
SR'
тиол
О
X
+
R С
OR'
X
О
X
R С
- ацил
N
R"
амин
сложный тиоэфир
О
R' +
R С
N
амид
HX
R"
29
30.
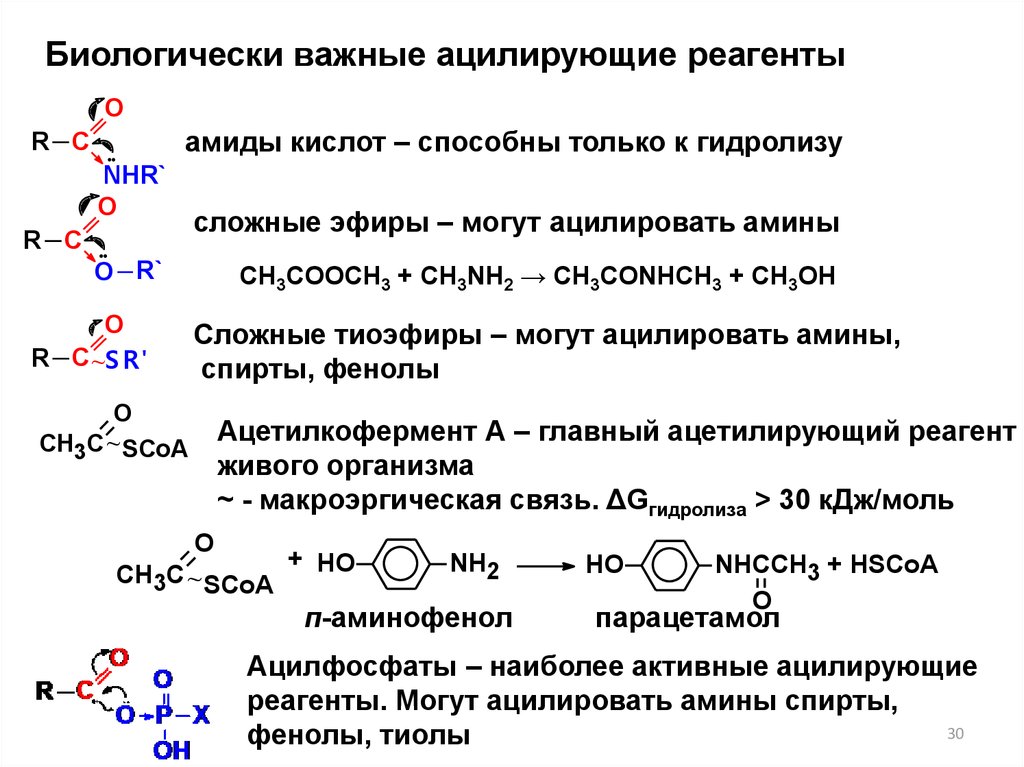
Биологически важные ацилирующие реагентыO
амиды кислот – способны только к гидролизу
R C
NHR`
O
R C
O R`
O
R C ~S R'
О
СН3С ~ SСoA
сложные эфиры – могут ацилировать амины
CH3COOCH3 + CH3NH2 → CH3CONHCH3 + CH3OH
Сложные тиоэфиры – могут ацилировать амины,
спирты, фенолы
Ацетилкофермент А – главный ацетилирующий реагент
живого организма
~ - макроэргическая связь. ΔGгидролиза > 30 кДж/моль
О
+ HO
СН3С ~ SСoA
NH2
п-аминофенол
HO
NHCCH3 + HSCoA
O
парацетамол
Ацилфосфаты – наиболее активные ацилирующие
реагенты. Могут ацилировать амины спирты,
30
фенолы, тиолы
31.
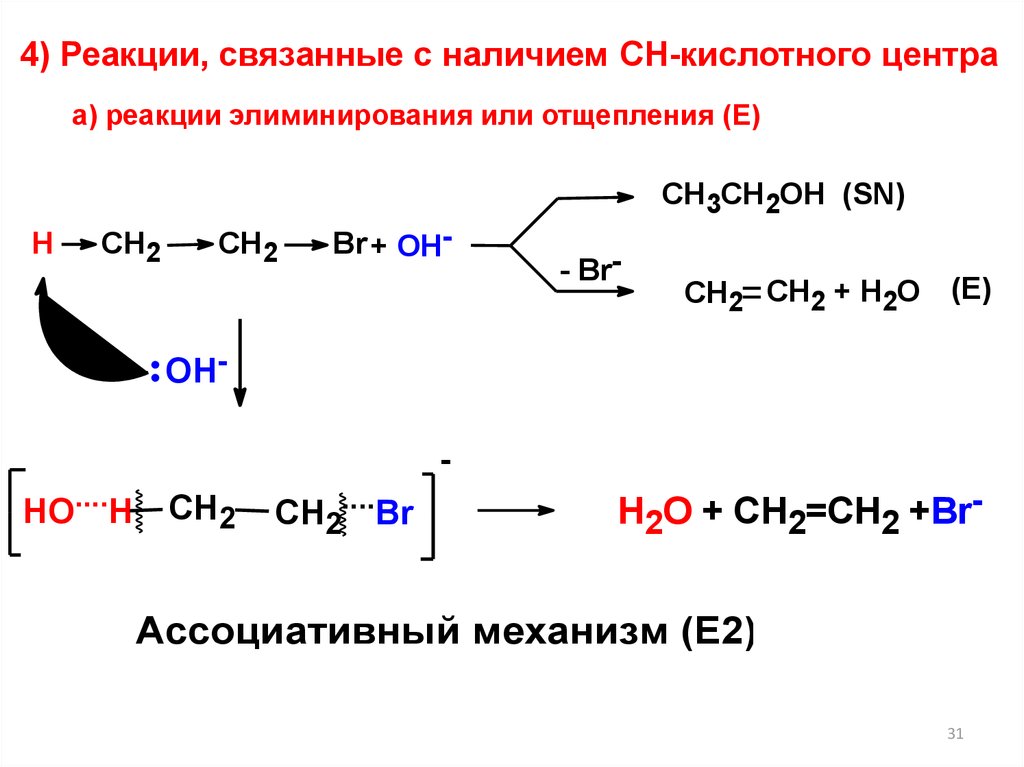
4) Реакции, связанные с наличием СН-кислотного центраа) реакции элиминирования или отщепления (Е)
CH3CH2OH (SN)
H
CH2
CH2
Br + OH-
- Br-
CH2 CH2 + H2O (E)
OHHO....H
СН2
CH2....Br
H2O + CH2=CH2 +Br-
Ассоциативный механизм (Е2)
31
32.
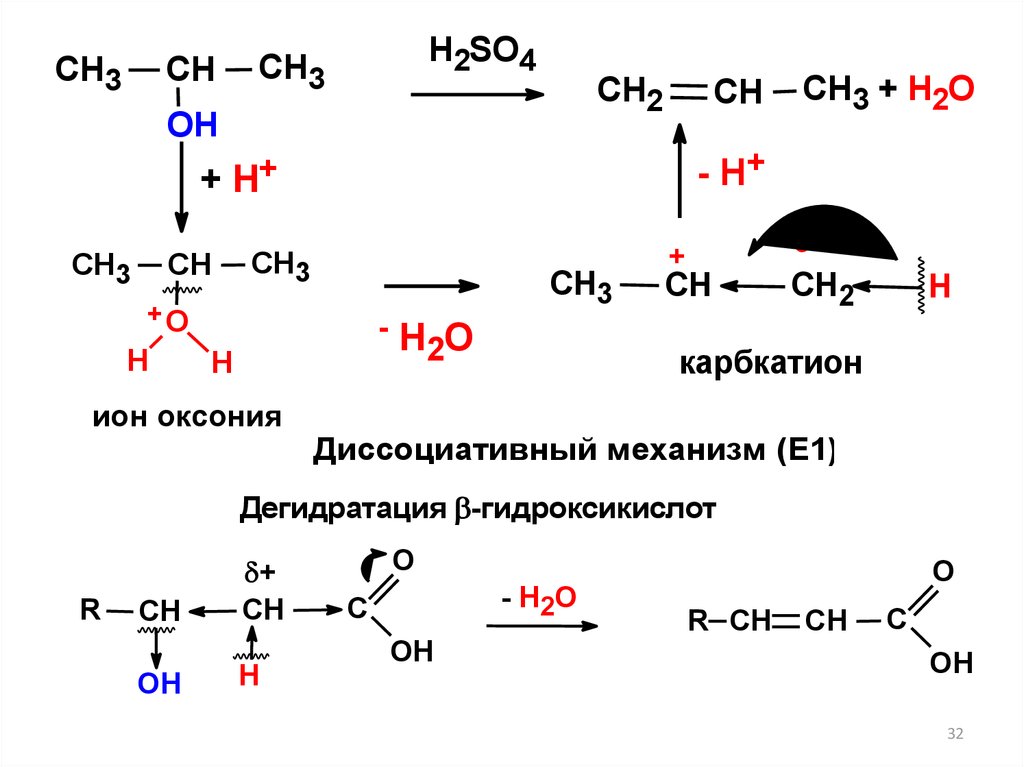
CH3CH
H2SO4
CH3
CH2
ОН
CH
- H+
+ H+
CH3
CH
CH3
+О
H
-H O
2
H
ион оксония
CH3 + H2O
CH3
+
CH
+
CH2
H
карбкатион
Диссоциативный механизм (Е1)
Дегидратация -гидроксикислот
R
CH
OH
+
CH
Н
O
- H2O
C
OH
O
R CH
CH
C
OH
32
33.
б) реакции альдольного присоединенияН
С
С
О + ОНХ
- H2O
С
О
С
Х
карбоанион
О
С
С
Х
енолят-ион
сильный нуклеофил
33
34.
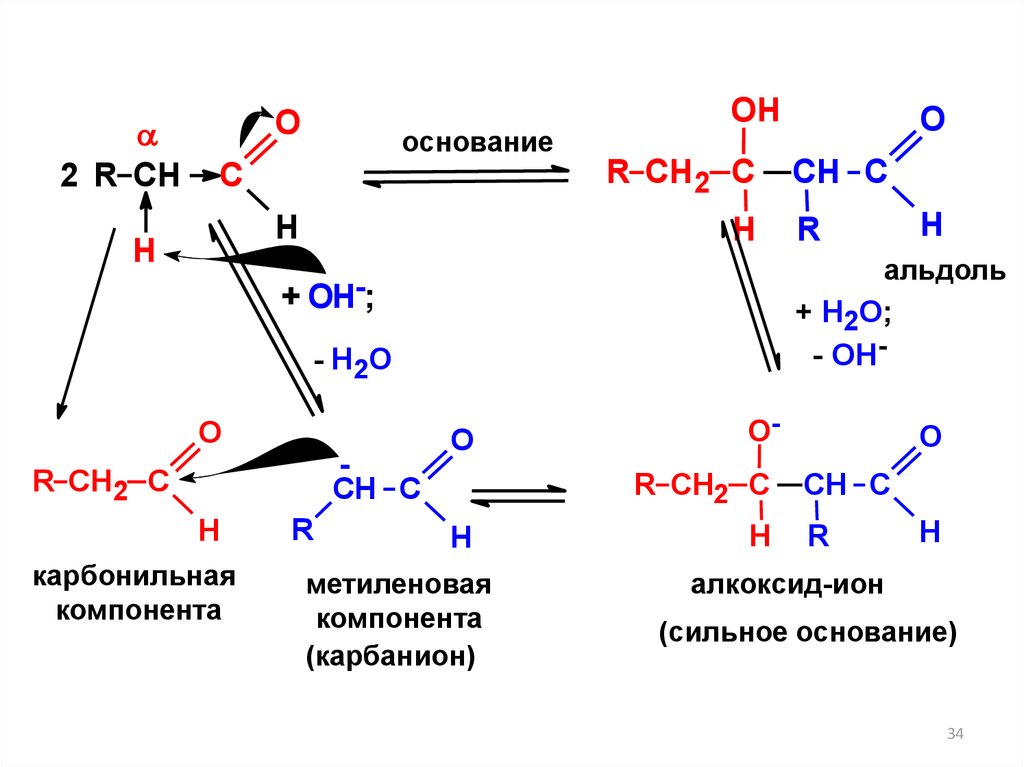
2 R CHO
основание
C
H
Н
OH
R CH2 C
H
CH C
H
карбонильная
компонента
R
H
R
+ Н2О;
- ОН-
- Н2О
R CH2 C
CH C
альдоль
+ ОН-;
O
O
O
H
метиленовая
компонента
(карбанион)
OR CH2 C
H
O
CH C
R
H
алкоксид-ион
(сильное основание)
34
35.
Карбонильнаякомпонента
Метиленовая
компонента
H
O
CH3CH2C
+ CH3CHC
H
H
C O+
H
O KOH
H
H
CH3
O
CC
CH3
H
О
+
С
Н
О
СН2 С СН3
H
KOH
KOH
HO CH3
CH3CH2CHCHC
O
H
CH3 O
HOCH2 C C
H
CH3
О
ОН
С СН2 С СН3
Н
Альдольное присоединение
Альдольное расщепление (ретроальдольный распад)
35
36.
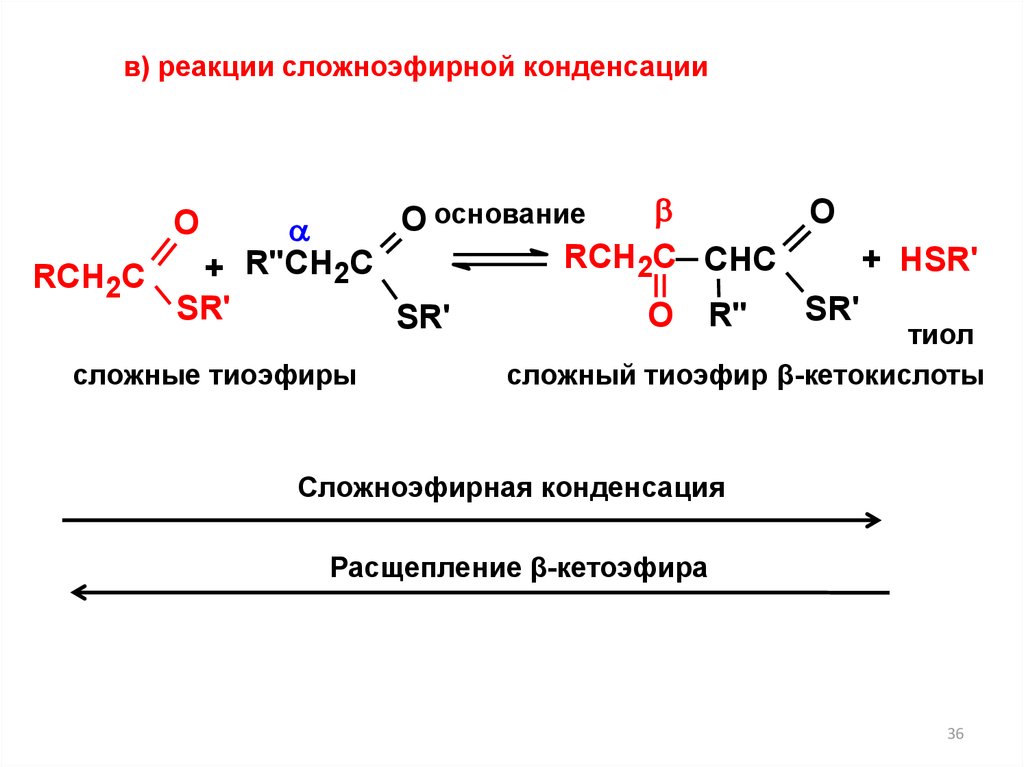
в) реакции сложноэфирной конденсацииO
O основание
RCH2C CHC
+ HSR'
+ R"CH2C
RCH2C
SR'
SR'
О R"
SR'
тиол
O
сложные тиоэфиры
сложный тиоэфир β-кетокислоты
Сложноэфирная конденсация
Расщепление β-кетоэфира
36
37.
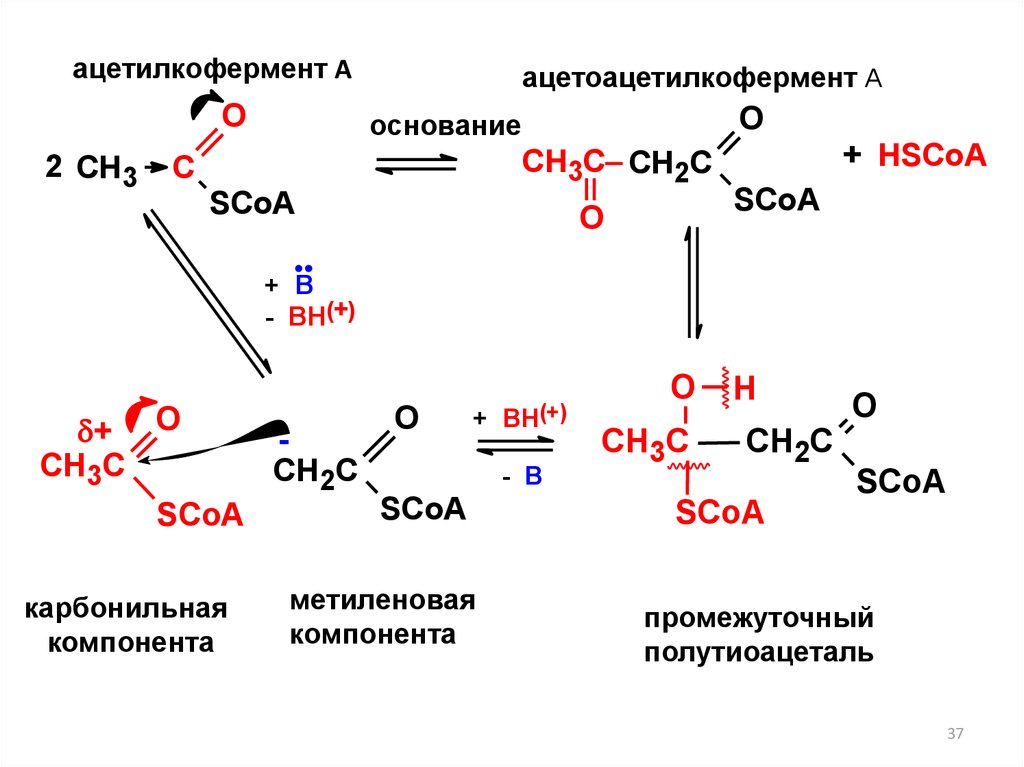
ацетилкофермент АO
2 СН3
ацетоацетилкофермент А
O
основание
CH3C CH2C
C
SСoA
О
+ HSСoA
SСoA
+ В
- ВН(+)
+
CH3C
O
SСoA
карбонильная
компонента
CH2C
O
+ ВН(+)
- В
SСoA
метиленовая
компонента
O
CH3C
Н
CH2C
SСoA
O
SСoA
промежуточный
полутиоацеталь
37
38.
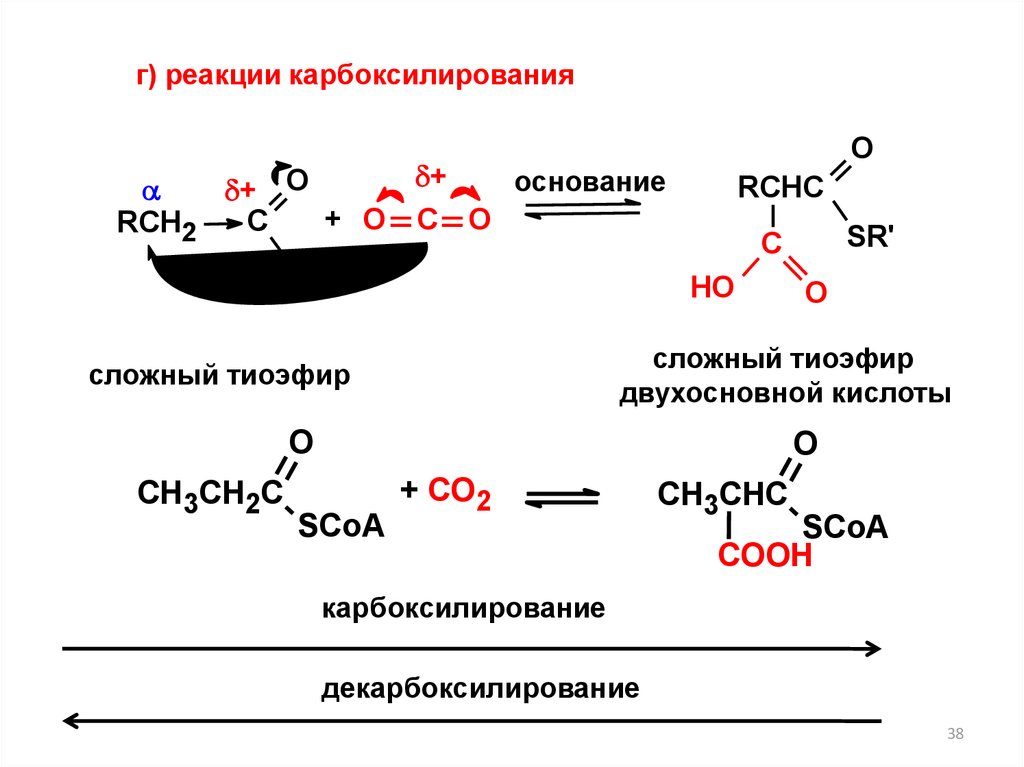
г) реакции карбоксилированияO
+
основание
+ O
+ О С О
C
RCH2
SR'
RCHC
НО
О
сложный тиоэфир
двухосновной кислоты
сложный тиоэфир
O
СН3СН2С
SR'
С
O
SCoA
+ CO2
СН3СНС
SCoA
COOH
карбоксилирование
декарбоксилирование
38







 chemistry
chemistry








