Similar presentations:
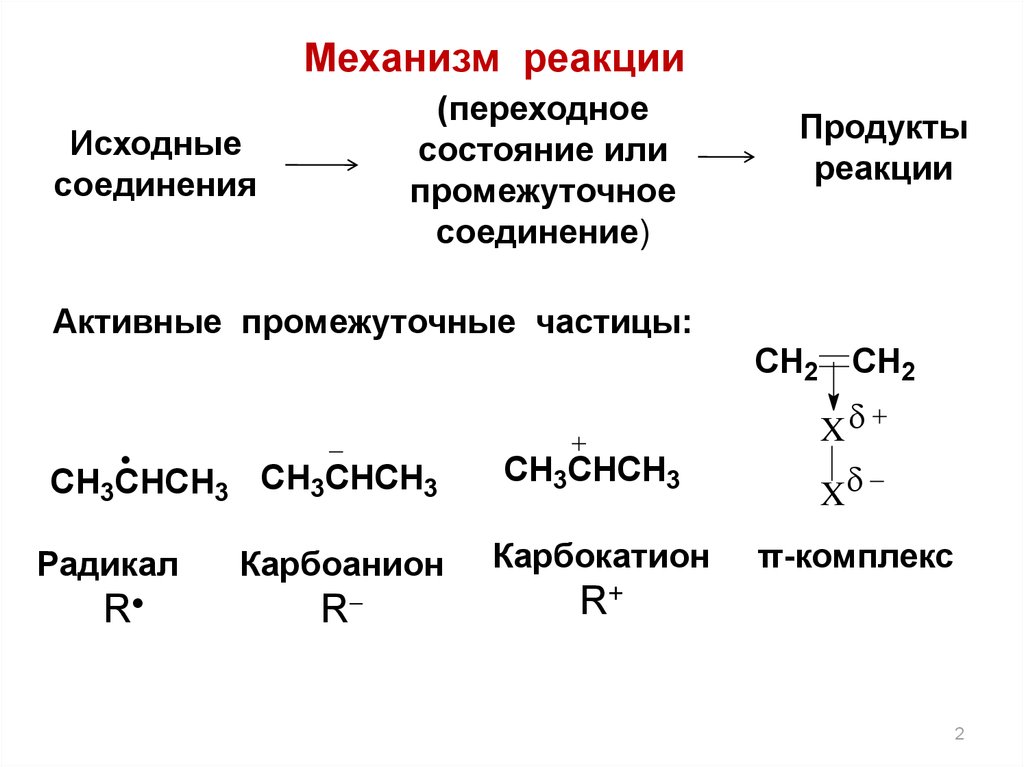
Механизм реакции
1.
РОССИЙСКИЙ НАЦИОНАЛЬНЫЙИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ им. Н.И.ПИРОГОВА
химия
Лекция 6
2013/14 уч. год
Лекцию читает профессор Белавин Иван Юрьевич
2.
Механизм реакции(переходное
состояние или
промежуточное
соединение)
Исходные
соединения
Продукты
реакции
Активные промежуточные частицы:
CH2 CH2
CH3CHCH3 CH3CHCH3
Радикал
R
CH3CHCH3
Карбоанион
Карбокатион
R
R+
X
X
π-комплекс
2
3.
Факторы, определяющие реакционную способностьорганического соединения
(статические и динамические)
Статические факторы
(молекула в нереагирующем состоянии)
электронный
распределение электронной
плотности в молекуле
(электроотрицательность
атомов, входящих в
молекулу, электронные
эффекты заместителей,
наличие сопряженных и
ароматических фрагментов).
пространственный
пространственная
доступность реакционного
центра молекулы.
3
4.
Динамические факторыВключают оценку энергии промежуточных
частиц или переходного состояния.
Чем больше возможностей для делокализации
(рассредоточения) электронной плотности в
промежуточной частице (свободном радикале,
катионе, анионе, -комплексе), или в переходном
состоянии, тем более они устойчивы (стабильны),
тем ниже их энергия и тем легче идет реакция.
4
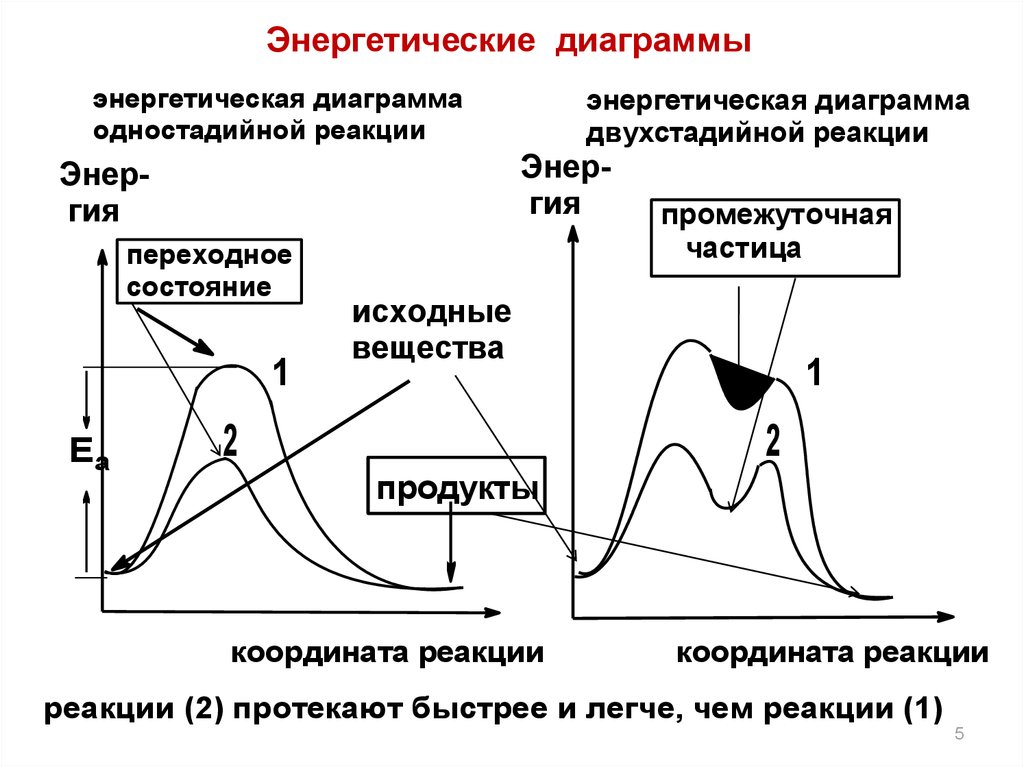
5.
Энергетические диаграммыэнергетическая диаграмма
одностадийной реакции
Энергия
Энергия
переходное
состояние
1
Еа
энергетическая диаграмма
двухстадийной реакции
промежуточная
частица
исходные
вещества
2
1
2
продукты
координата реакции
координата реакции
реакции (2) протекают быстрее и легче, чем реакции (1)
5
6.
Влияние совокупности различных факторов нанаправление реакции
нуклеофильная
атака
Электрофильный центр
H +
H C
H
замещение
+
–
CH3OH + NaBr
Na OH
–
Br
+
(SN2)
Кислотный центр
атака основанием
H
CH2
CH3
+
C
–
Br
+
CH3
трет-бутилбромид
(субстрат)
Na+OH–
CH2
C
CH3
CH3
(реагент – основание) 2-метилпропен
6
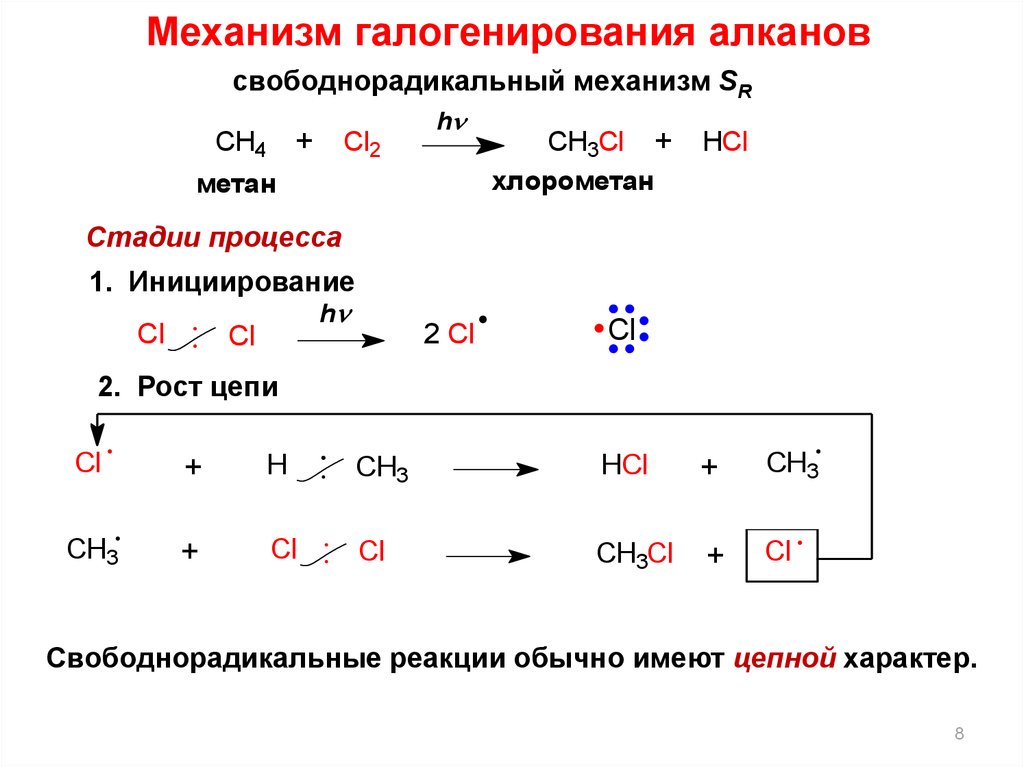
7.
Свободно-радикальные процессы(реакции радикального замещения в углеводородах
и их производных SR)
Пути образования свободных радикалов
1. Фотохимический расщепление ковалентной связи при
помощи лучистой энергии (фотолиз).
Cl2
h
2 Cl
Cl2
2. Термический расщепление ковалентной связи за счет
тепловой энергии (термолиз).
R O O R'
to
R–O
+
R'–O
3. Химический образование радикалов в окислительновосстановительных процессах.
Н–О– + Fe3+
H–O +
Fe2+
7
8.
Механизм галогенирования алкановсвободнорадикальный механизм SR
+ Cl2
CH4
h
метан
CH3Cl +
хлорометан
HCl
Стадии процесса
1. Инициирование
h
Cl
Cl
2 Cl
Cl
2. Рост цепи
Cl
+
H
CH3
HCl
+
CH3
CH3
+
Cl
Cl
CH3Cl
+
Cl
Свободнорадикальные реакции обычно имеют цепной характер.
8
9.
3. Обрыв цепиCl + Cl
Cl2;
CH3 +
CH3
CH3 +
Cl
CH3CH3;
CH3Cl
СН3• – простейший органический свободный радикал
(плоский).
H
H 2
sp
C H
H C
H
H
Простые алкильные радикалы – короткоживущие частицы.
Высокая реакционная способность свободных радикалов
объясняется их стремлением достроить внешний электронный уровень до устойчивого октета.
9
10.
Региоселективность реакций радикального замещенияРегиоселективность – предпочтительное протекание
реакции по одному из нескольких реакционных центров
одинаковой химической природы.
Br2 + CH3 CH2 CH3
h , to
–HBr
Br
CH3 CH CH3 + CH3 CH2 CH2Br
125 oC
97%
3%
статистически:
25%
75%
Статический фактор: энергия разрыва связи (кДж/моль)
СН3
СН3
СН3СН2
СН
Н
Н
СН3
406
393.5
СН3 С
СН3
Н
381
СН2
Н
331
СН2=СН СН2
Н
327
Преимущественное направление радикальной атаки
10
11.
Динамический фактор: устойчивость (стабильность) радикалаН
Н
С
Н <
Н
С
Н
СН3
Н
метил
<
С
СН3
первичный
< CH2=CH CH2
СН3
вторичный
СН2
аллил
<
<
СН3
С
СН3
СН3
третичный
C
бензил
трифенилметил
СН2 СН
СН2
СН2
СН
СН2
CH2
мезомерный радикал
СН2 СН СН2
СН2 СН СН2
мезомерные (резонансные)
структуры
11
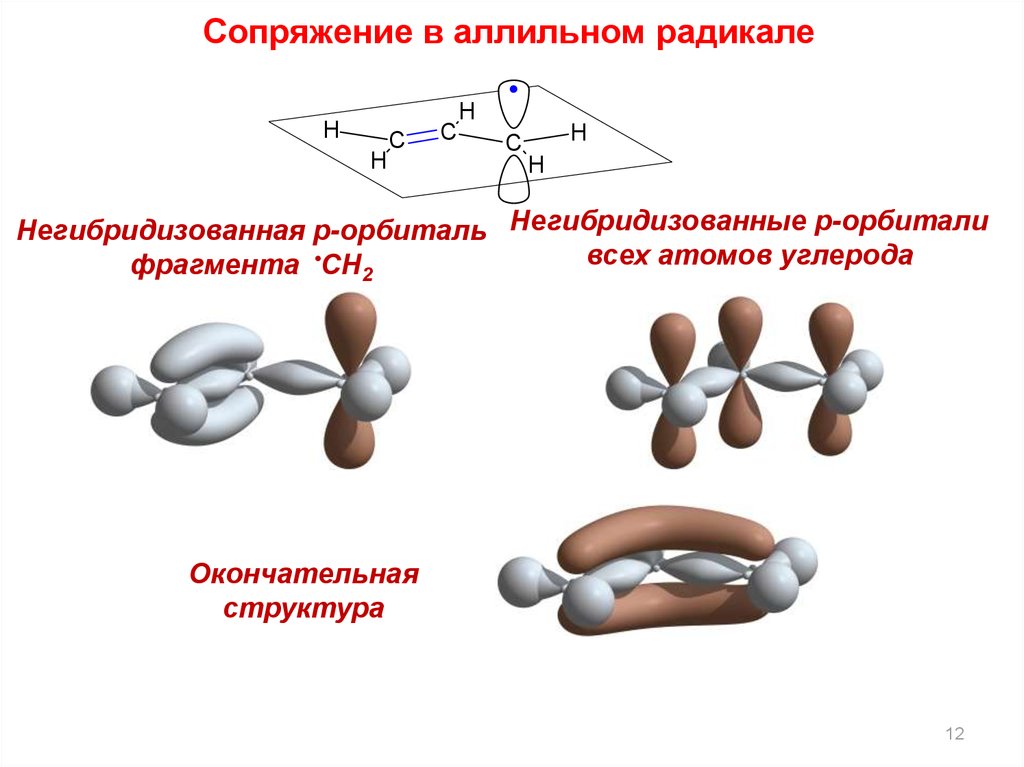
12.
Сопряжение в аллильном радикалеH
H
C
C
H
H
C
H
Негибридизованная p-орбиталь Негибридизованные p-орбитали
всех атомов углерода
фрагмента •CH2
Окончательная
структура
12
13.
Преимущественное направление радикальной атакиСН2
СН3 + Х
СН
–HX
СН3
этилбензол
СН2=СН СН2 СН3 + Х
бутен-1
Влияние
различных
факторов
на
селективность
радикальных
реакций
–HX
СН2=СН СН СН3
Br2 + CH3 CH2 CH3
h , to
–HBr
Br
CH3 CH CH3 + CH3 CH2 CH2Br
125 oC
Cl2 + CH3 CH2 CH3
h , to
–HCl
97%
3%
Cl
CH3 CH CH3 + CH3 CH2 CH2Cl
550 oC
70 oC
42%
60%
58%
40%
Более высокая селективность менее активного реагента
(радикала брома) по сравнению с более активным реагентом
(радикалом хлора) – общая закономерность в протекании
органических реакций.
13
14.
Реакции пероксидного окисленияR
H
+
O2
O O
R O O H
гидропероксид
Гидропероксиды – производные пероксида водорода, в которых
один атом водорода замещен на органический радикал.
Пероксиды – производные пероксида водорода, в которых
два атома водорода замещены на органические радикалы.
Гидропероксиды
R
O
O
H
Пероксиды
R
O
O
R'
14
15.
Механизм реакции пероксидного окисления(реакция типа SR)
• инициирование
R
H
+
HX
X
+
R
• рост цепи
R
+
RO O
+
O2
R
RO O
H
RO OH
+
R
• обрыв цепи (один из возможных путей)
R
+
RO O
RO OR
15
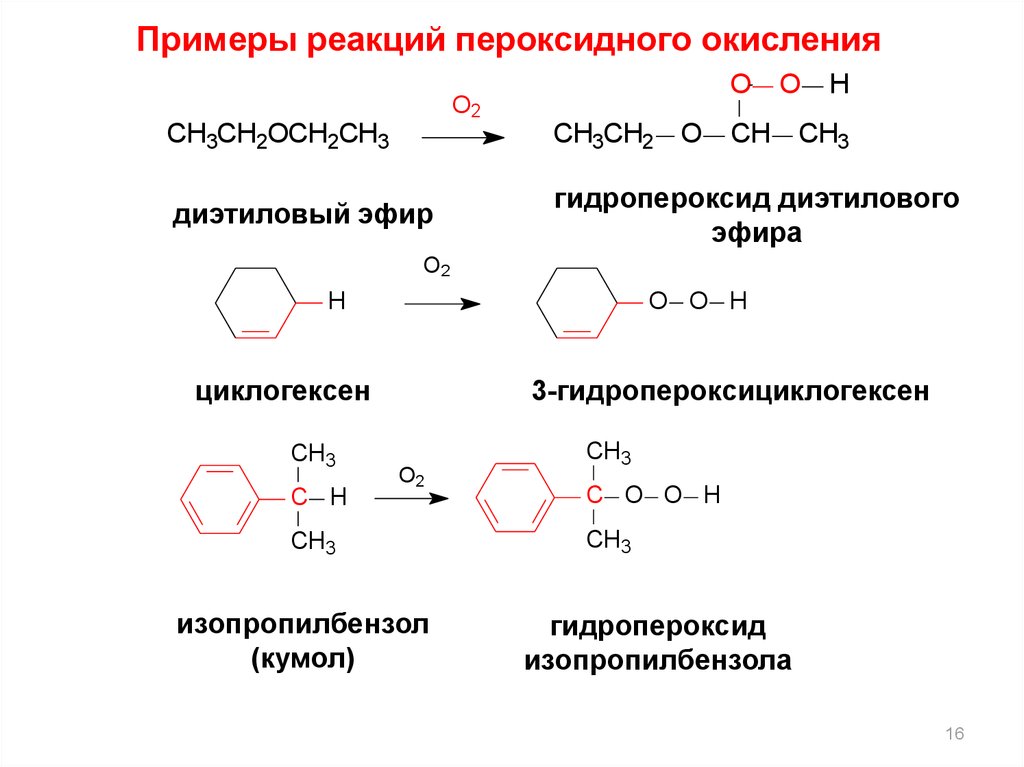
16.
Примеры реакций пероксидного окисленияO
O2
O
CH
H
CH3CH2OCH2CH3
CH3CH2 O
CH3
диэтиловый эфир
гидропероксид диэтилового
эфира
O2
H
O O H
циклогексен
CH3
C H
3-гидропероксициклогексен
O2
CH3
изопропилбензол
(кумол)
CH3
C O O H
CH3
гидропероксид
изопропилбензола
16
17.
Пероксидное окисление липидовО
остаток олеиновой кислоты
СН2 О С C17H33
О
СН
О С C17H35
СН2 О
фрагмент липида клеточной
мембраны
18 17
16 15
14 13 12
11
10
9
8
7
6
5
4
3
2
1
СН3СН2СН2СН2СН2СН2СН2СН2 СН СН СН2СН2СН2СН2СН2СН2СН2С
О
О
Х
11
10
10
9
СН СН СН
или
9
8
СН СН СН
17
18.
1110
9
СН СН СН
11
10
11
9
СН СН СН
10
9
СН СН СН
мезомерный радикал
О2
11
10
9
СН СН СН
О-О
+RH
-R
11
10
9
11
10
9
СН СН СН
О-О
+RH
фрагмент соседней
-R
молекулы
11
СН СН СН
О-ОН
10
9
СН СН СН
О-ОН
продукты распада
18
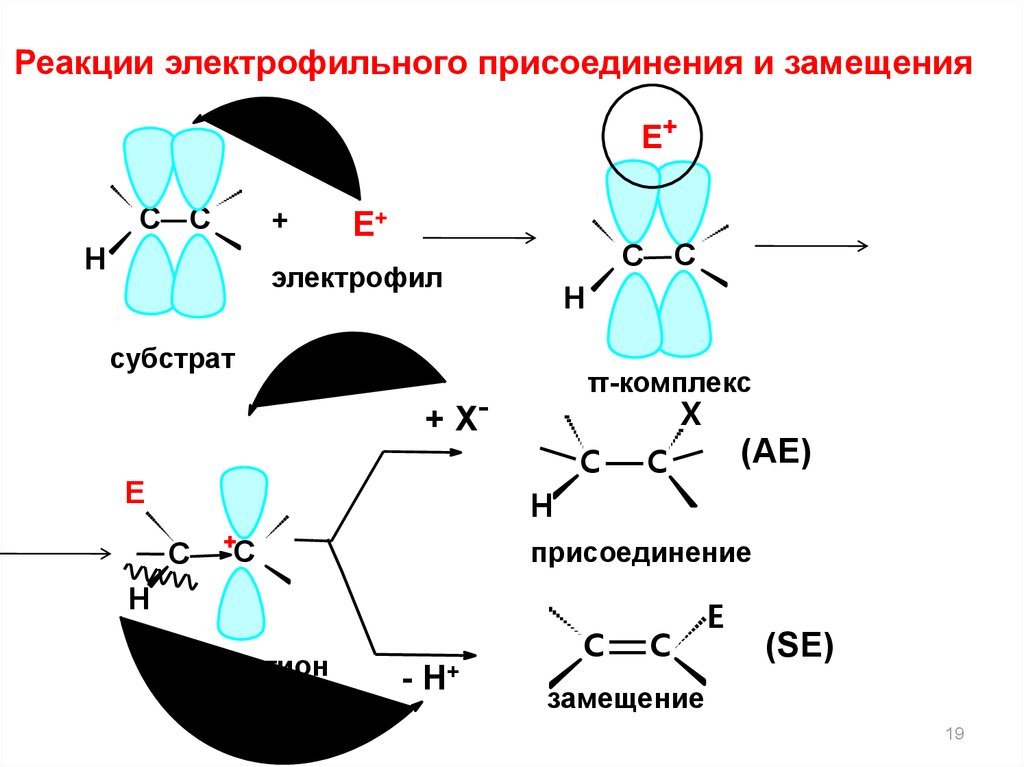
19.
Реакции электрофильного присоединения и замещенияЕ+
С С
+
Н
Е+
С С
электрофил
Н
субстрат
π-комплекс
X
+ Х-
C
Е
(АЕ)
C
H
С
+
С
присоединение
Н
карбокатион
- Н+
C
C
E
(SЕ)
замещение
19
20.
Присоединение воды (гидратация)Катализаторы – сильные кислоты (серная, азотная, хлорная)
CH2 CH2
этилен
H2O, H+
Общий способ
получения спиртов
CH3CH2OH
этанол
Схема механизма реакции гидратации
H
O
+
H
C
C
C
медленно
H
O
H
C
C
быстро
H
карбокатион
H
C
H
алкилоксониевый
ион
- H+ быстро
реакция AE-типа
C
C
H
OH
Трехстадийный процесс
20
21.
Региоселективность реакций электрофильного присоединенияЭмпирическое правило В.В. Марковникова (1869)
При взаимодействии галогеноводородов и других реагентов
типа НХ с несимметричными алкенами водород присоединяется к атому углерода, связанному с максимальным числом
атомов водорода, т. е. к наиболее «гидрогенизированному»
атому углерода двойной связи.
(CH3)2C CH2 + HCl
2-метилпропен
(изобутилен)
CH3 + HBr
1-метилциклогексен
(C2H5)2O
(CH3)3CCl
2-хлоро-2-метилпропан
(трет-бутилхлорид), 96%
CH3
Br
1-бромо-1-метилциклогексан,
91%
21
22.
Факторы, определяющие направление реакцииДинамический фактор
Cl–
Статические
факторы
CH3
+
CH
CH3
H
CH
CH3
CH3
CH3
Cl
карбокатион 1
+
CH
образуется
CH2
электронный и
пространственый
CH3
CH2
CH2
Cl–
CH3 CH2 CH2Cl
не образуется
карбокатион 2
Стабильность карбокатионов:
третичный >> вторичный >> первичный
R
sp2
C
карбокатион
R
C
R
R
C
H
C
H
R
R
H
вторичный
первичный
третичный
уменьшение стабильности карбокатионов
22
23.
Особенности реакций присоединения к алкенамс электроноакцепторными заместителями
статический фактор
+ +
CH CH2 H Cl
CF3
CF3
CH2
CH2
Cl
-ICF
3
CF3
+H+
+
CH
CH3
+Cl-
или
CF3
CH2
+
CH2
динамический фактор
-ICF
3
>> +ICH
3
Антимарковниковское присоединение
23
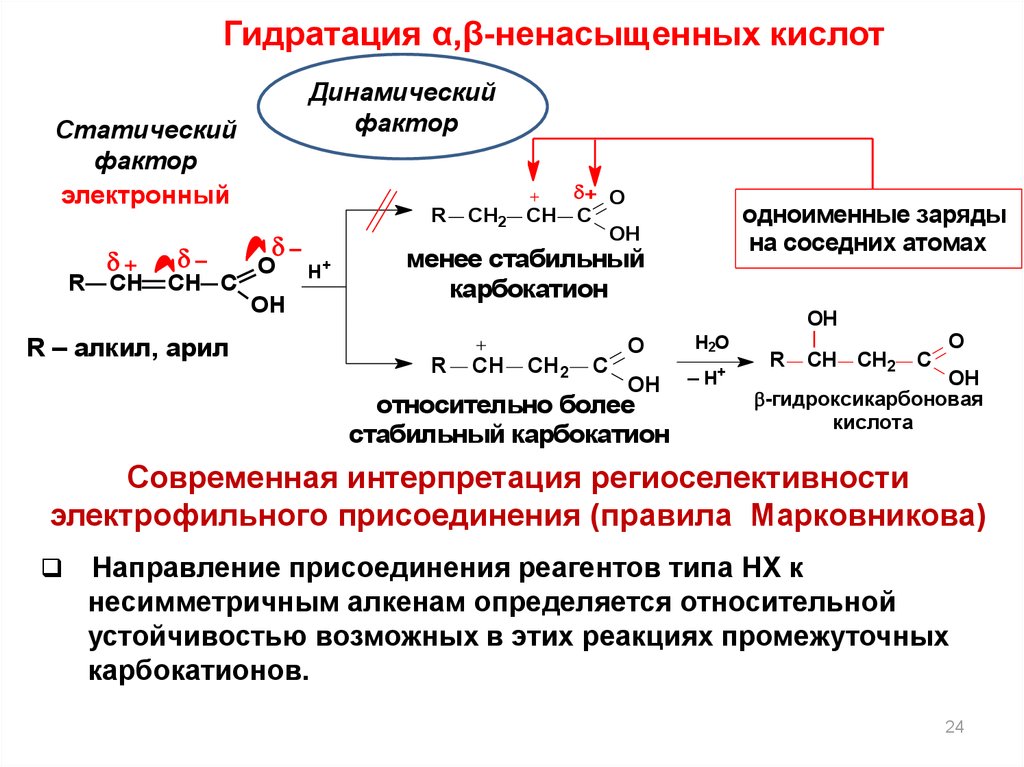
24.
Гидратация α,β-ненасыщенных кислотДинамический
фактор
Статический
фактор
электронный
R
+
CH
CH C
R
O
OH
R – алкил, арил
H+
CH2
+ O
CH C
OH
одноименные заряды
на соседних атомах
менее стабильный
карбокатион
OH
R
CH
CH2
C
O
OH
относительно более
стабильный карбокатион
H2O
– H+
R
CH
CH2
C
O
OH
-гидроксикарбоновая
кислота
Современная интерпретация региоселективности
электрофильного присоединения (правила Марковникова)
Направление присоединения реагентов типа НХ к
несимметричным алкенам определяется относительной
устойчивостью возможных в этих реакциях промежуточных
карбокатионов.
24
25.
Присоединение галогенов к алкенамБромирование
Быстрое обесцвечивание раствора брома без выделения HBr
– качественная проба на наличие двойной связи.
C C
+
Br2
H2O или CCl4, 20 C
C
C
Br Br
дибромоалкан
алкен
Br
анти-атака
Br2
С
С
(1)
алкен
С
С
Br +
Br -
-комплекс
Br+
(2)
C
C
+
Br
циклический
ион
бромония
Br–
(3)
Br
продукт
антиприсоединения
25
26.
Стереоселективность реакции галогенированияСтереоселективность – предпочтительность образования
одного из нескольких возможных стереоизомеров.
анти-присоединение с образованием транс-аддуктов
+
H
Br2
H
циклопентен
H
Br
Br
H
+
транс-1,2-дибромоциклопентан
H
H
Br
Br
цис-1,2-дибромоциклопентан
Равновесие между ионом галогенония и карбокатионом
C
C
Br
циклический ион
бромония
C
C
Br
карбокатион
26
27.
Присоединение карбокатионов к алкенамR+ +
C
C
R C
C
H
C
C
+ H+
R
H
Алкилирование алкенов карбокатионами
в биохимических реакциях
CH3
CH3
O
O
CH3
C CHCH2 O P O P O
O
O
P2O74
3-метилбутен-2-илдифосфат
CH3
CH3
CH3
C CHCH2
катион
аллильного типа
CH3
C CHCH2
катион аллильного типа
O
O
+ CH2 C CH2 CH2 O P O P O
O
O
3-метилбутен-3-илдифосфат
(изопентенилдифосфат)
27
28.
Наращивание углеродной цепиCH3
CH3
CH3
O
O
C CHCH2 CH2 C CH CH2 O P O P O
O
O
H
промежуточный карбокатион
H
CH3
CH3
CH3
O
O
C CHCH2 CH2 C CH CH2 O P O P O
O
O
геранилдифосфат
– предшественник терпенов и стероидов
28
29.
Особенности реакций электрофильногоприсоединенияк сопряженным диенам
1,2
1,2
BrCH2CHCH CH2
CH3CHCH CH2
Br
Br2
1,4
BrCH2CH CHCH2Br
1
2
3
4
Cl
HCl
CH2 CH CH CH2
1,3-бутадиен
1,4
CH3CH CHCH2Cl
Образование продуктов 1,2- и 1,4-присоединения
29
30.
Схема механизма реакций 1,2- и 1,4-присоединения1
2
3
4
СН2=СН СН=СН2 + HCl
Cl
CH3 CH CH CH2 + СН3 СН СН СН2Cl
продукт 1,2
продукт 1,4
+ Н+
+ Cl
–
1
+
/2
+ /2
СН3 СН СН СН2
1
+
СН2 СН2 СН=СН2 СН3 СН СН=СН2
+
+
+
СН3 СН СН=СН2
СН3 СН СН СН2
мезомерный катион
Мезомерия* (сопряжение) – явление выравнивания связей и
зарядов в реальной молекуле (частице) по сравнению с
идеальной, но несуществующей (резонансной) структурой.
* от греч. mesos – средний
30
31.
Примеры реакций электрофильного замещенияГалогенирование
Алкилирование
Ацилирование
+ Сl2
+ СН3Cl
+ СН3С
FeCl3
AlCl3
О AlCl3
Cl
Cl
+
HCl
CH3
+
HCl
О
C CH3
+ HCl
Роль катализатора: формирование электрофильной частицы:
СН3Cl + AlCl3
CH3+ ..... AlCl4-
31
32.
Пример реакции электрофильного замещения in vivo– иодирование аминокислоты тирозина
NH2
HO
CH2 CH COOH
тирозин
иодирование
I
NH2
HO
иодирование
CH2 CH COOH
3-иодтирозин
I
NH2
HO
CH2 CH COOH
I
3,5-дииодтирозин
биосинтез гормонов щитовидной железы
32
33.
Алкилирование алкенами, спиртами, алкилфосфатами+ СН3
СН=СН2
СН3
СН
СН3
Н+
Роль катализатора:
+
СН3
СН3
СН=СН2 + Н
+ СН3СН2ОН
Н+
+
СН СН3
СН2СН3
+ Н2О
Роль катализатора:
+
СН3СН2ОН + Н
+ Н
СН3СН2О
Н
СН3СН2+ + Н2О
33
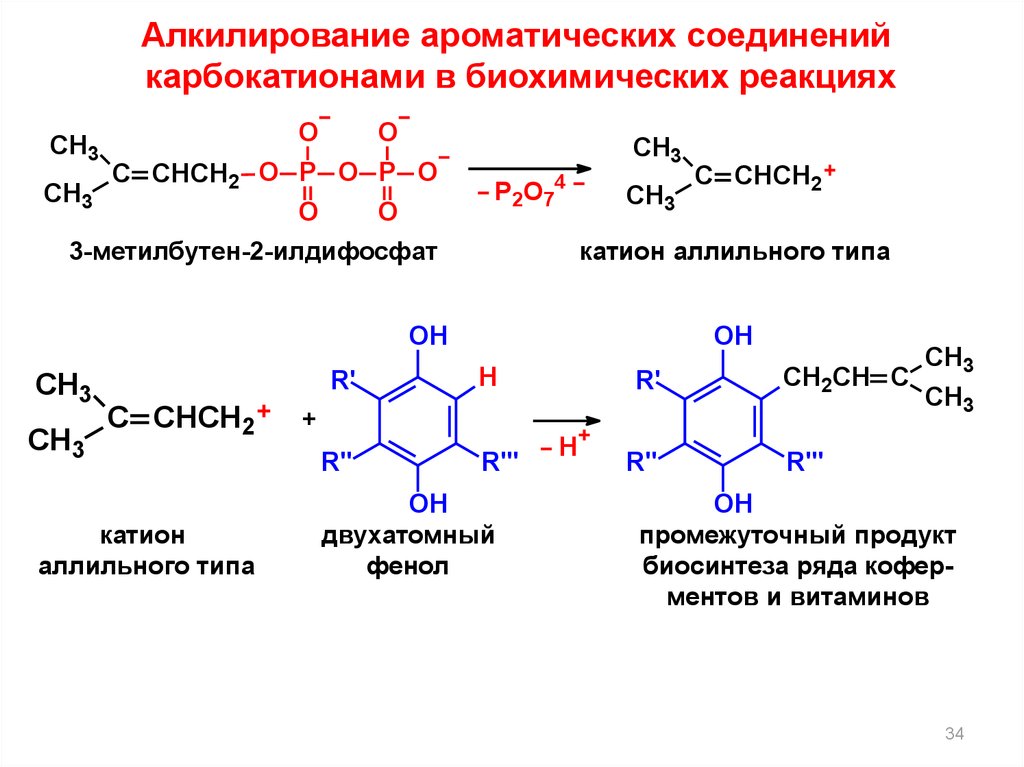
34.
Алкилирование ароматических соединенийкарбокатионами в биохимических реакциях
O
CH3
O
C CHCH2 O P O P O
O
O
3-метилбутен-2-илдифосфат
CH3
CH3
P2O74
CH3
катион аллильного типа
OH
CH3
CH3
R'
C CHCH2
катион
аллильного типа
C CHCH2
OH
H
R'
CH2CH C
+
R"
R"'
OH
двухатомный
фенол
H
R"
CH3
CH3
R"'
OH
промежуточный продукт
биосинтеза ряда коферментов и витаминов
34
35.
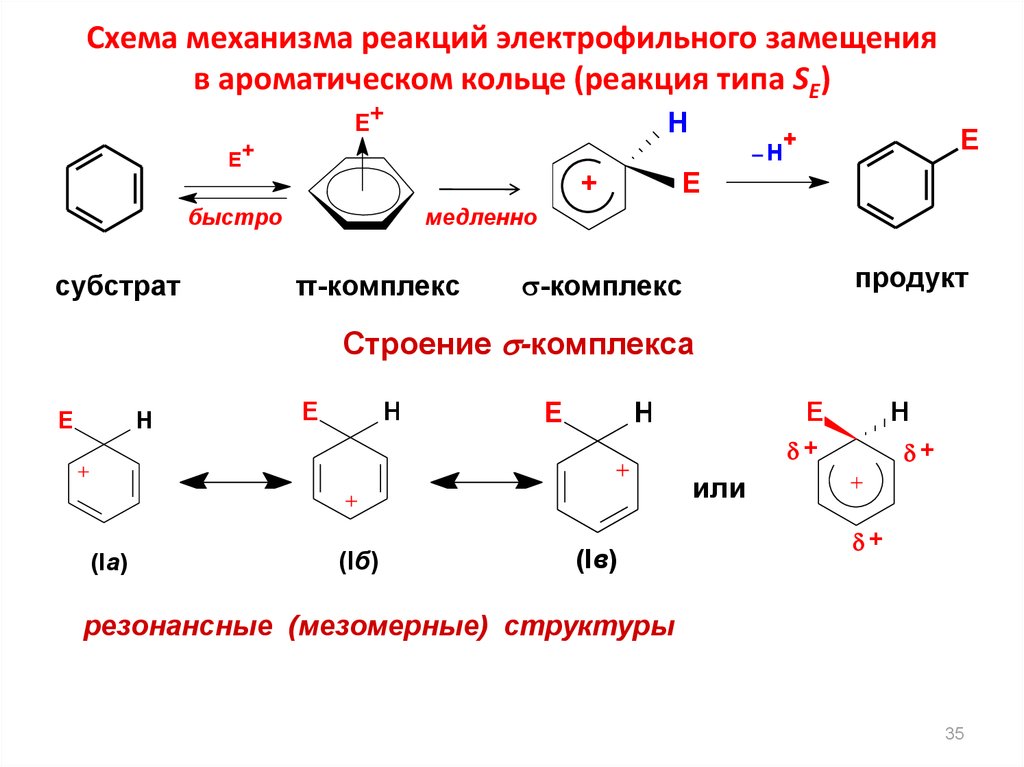
Схема механизма реакций электрофильного замещенияв ароматическом кольце (реакция типа SE)
E+
H
+
быстро
субстрат
E
+
H
E+
E
медленно
π-комплекс
продукт
-комплекс
Строение -комплекса
E
H
E
H
E
E
H
H
+
+
или
(Ia)
(Iб)
(Iв)
+
резонансные (мезомерные) структуры
35
36.
Региоселективность реакций электрофильногозамещения
Электронодонорные заместители
(ориентанты I рода)
электронодоноры
(активирующие)
+
CH3
–
–
Электроноакцепторные заместители
(ориентанты II рода)
электроноакцепторы
(дезактивирующие)
–
Статические
факторы
электронный и
пространственый
толуол
–
C OH
+
+
+
бензойная кислота
CH3
+
+
+
+
E
O
–
C OH
+
+
+
E
O
+
H
H
+
E
+
H
Динамический фактор
36
37.
облегчают реакции электрофильногозамещения и направляют входящую группу
в орто- и пара-положения
Электронодонорные
заместители
OH, OR, NH2, NHR, NR2, NHC(O)R, Cl, Br, I (+M-эффект > I-эффекта)
CH3 и другие алкилы (+I-эффект)
E
CH3
H
+
+
+
+
+
-комплекс
CH3
+
Br
H
+
+
+
атака в
орто-положение
FeBr3
+
Br2
+
+
H
H
Br
+
атака в
пара-положение
Br
атака в
мета-положение
CH3
CH3
CH3
толуол
CH3
Br
+
– HBr
орто-бромтолуол
Br
пара-бромтолуол
37
38.
Электроноакцепторныезаместители
затрудняют реакции электрофильного
замещения и направляют входящую группу
в мета-положения
C N, C(O)H, C(O)R, COOH, COOR, NO2, SO3H ( I-, M-эффекты);
NH3+, NR3+, CF3, CCl3 ( I-эффект)
+
+
E
+
Br
H
+
+
+
-комплекс
+
+
+
H
атака в
орто-положение
COOH
+
H
+
+
Br
атака в
пара-положение
FeBr3
+
COOH
+
+
H
+
COOH
COOH
Br
атака в
мета-положение
COOH
+ HBr
Br2
Br
бензойная
кислота
мета-бромбензойная
кислота
38
39.
Влияние изменения механизма реакциина направление процесса
CH2Cl
h
CH3
SR
Cl2
– HCl
CH3
CH3
FeCl3
Cl
SE
+
Cl
39
40.
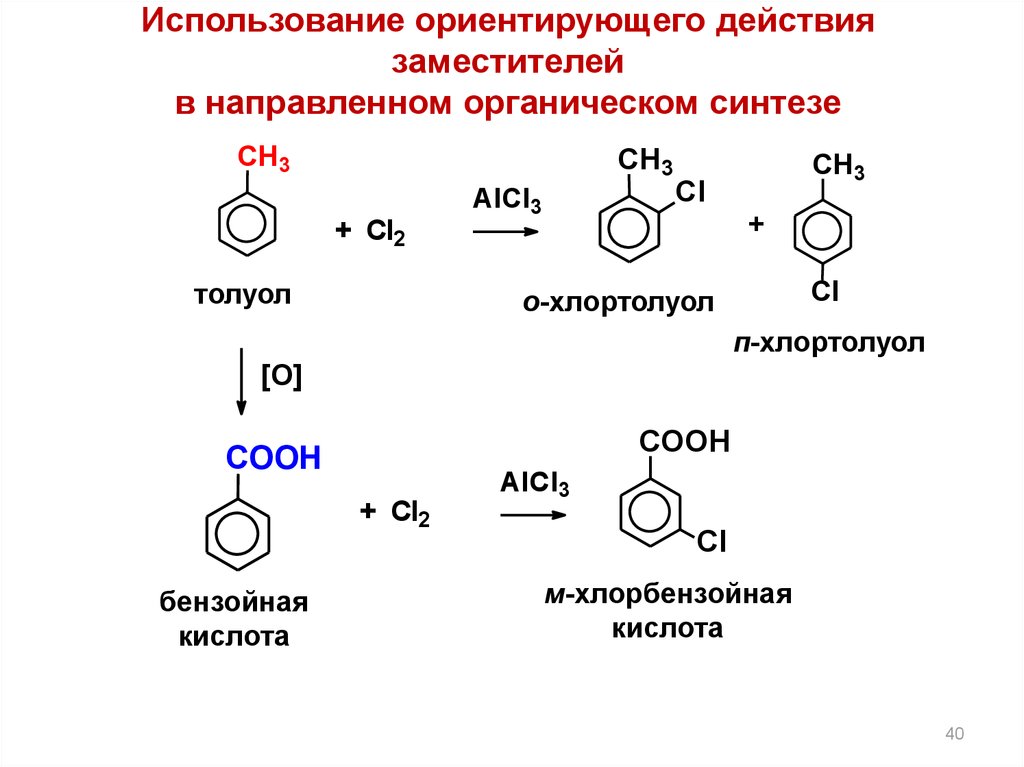
Использование ориентирующего действиязаместителей
в направленном органическом синтезе
СН3
СН3
+ Cl2
толуол
AlCl3
СН3
Cl
+
Cl
о-хлортолуол
п-хлортолуол
[O]
СOOН
СOOН
+ Cl2
бензойная
кислота
AlCl3
Cl
м-хлорбензойная
кислота
40






























 chemistry
chemistry








