Similar presentations:
Классификации, номенклатура, строение и свойства органических соединений
1.
Классификации,номенклатура, строение и
свойства органических
соединений
2.
ПЛАН ЛЕКЦИИ1.Классификация (электронная версия)
2. Номенклатура (электронная версия)
3.Теория химического строения
1.Типы гибридизации, конформации
2.Виды связей
3.Сопряжение
4.Ароматичность
5.Взаимное влияние атомов в молекуле
3.
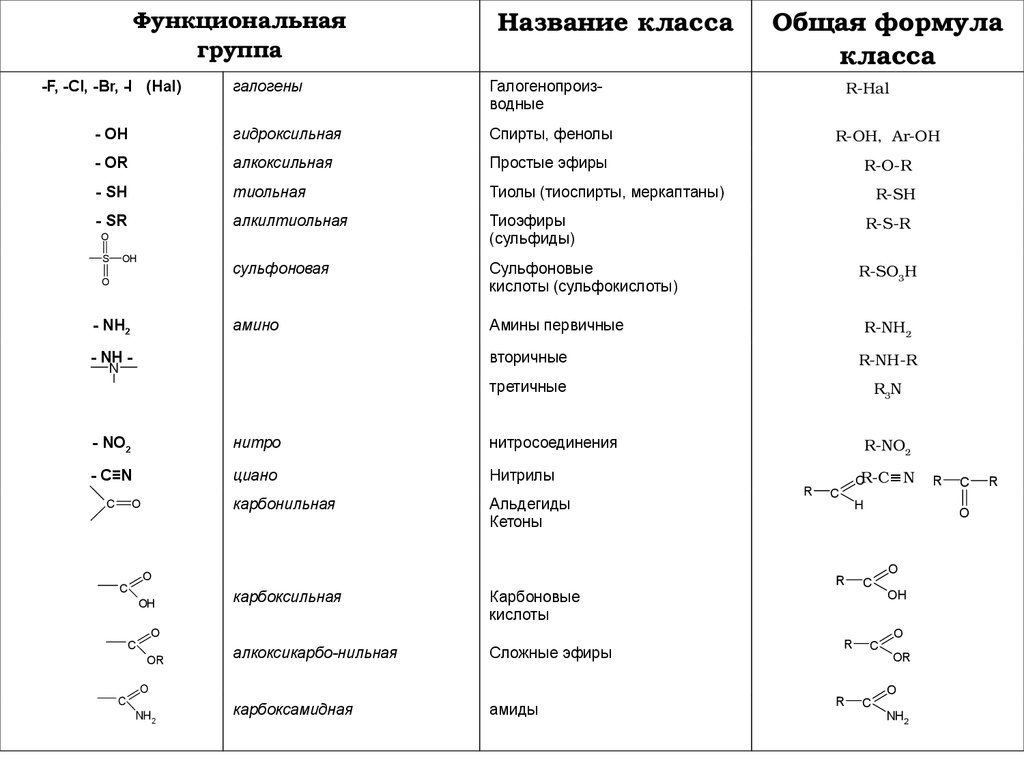
Функциональнаягруппа
-F, -Cl, -Br, -I (Hal)
Название класса
Общая формула
класса
R-Hal
галогены
Галогенопроизводные
- OH
гидроксильная
Спирты, фенолы
R-OH, Ar-OH
- OR
алкоксильная
Простые эфиры
R-O-R
- SH
тиольная
Тиолы (тиоспирты, меркаптаны)
- SR
алкилтиольная
Тиоэфиры
(сульфиды)
сульфоновая
Сульфоновые
кислоты (сульфокислоты)
амино
Амины первичные
O
S
OH
O
- NH2
- NH N
R3N
- C≡N
циано
Нитрилы
OH
OR
карбоксильная
Карбоновые
кислоты
алкоксикарбо-нильная
Сложные эфиры
карбоксамидная
амиды
O
NH2
R-NO2
R
OR-C≡N
C
H
R
O
C
C
Альдегиды
Кетоны
O
C
R-NH2
третичные
нитросоединения
карбонильная
R-SO3H
R-NH-R
нитро
O
R-S-R
вторичные
- NO2
C
R-SH
R
R
R
C
O
C
C
C
O
OH
O
OR
O
NH2
R
4.
-OHsp
C
3
OH
спирты
СН3ОН
Метанол или древесный
спирт
С2Н5ОН
Этанол или винный спирт
sp
2
OH
фенолы
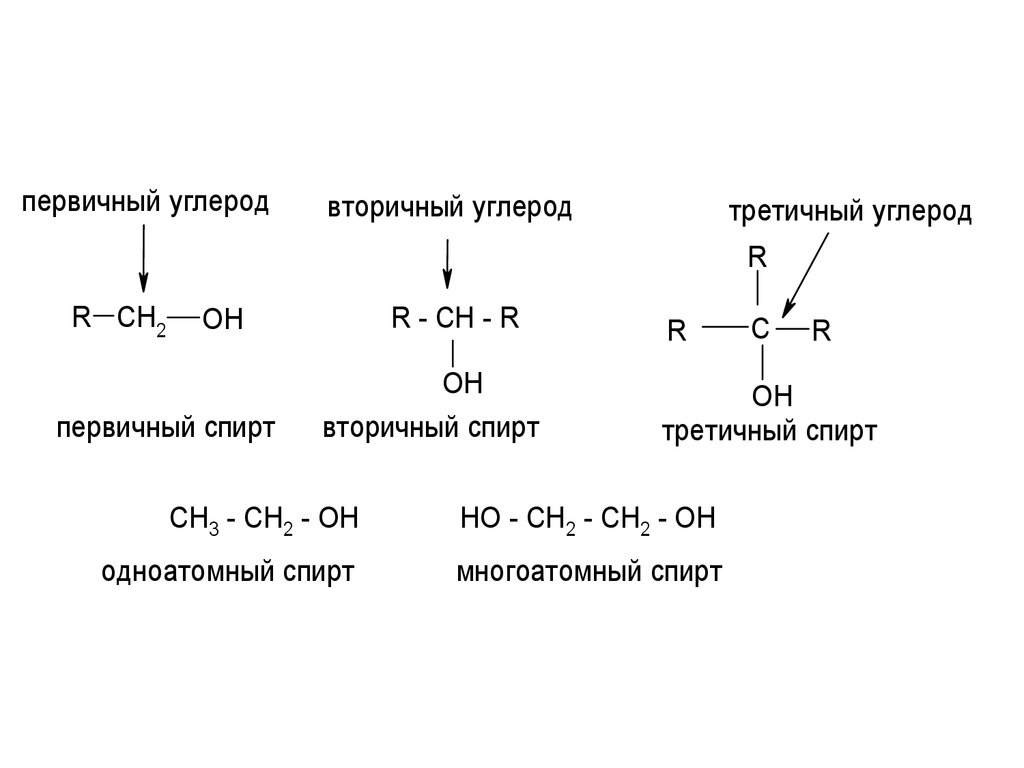
5.
первичный углеродвторичный углерод
третичный углерод
R
R CH2
R - CH - R
OH
первичный спирт
OH
вторичный спирт
R
C
R
OH
третичный спирт
CH3 - CH2 - OH
HO - CH2 - CH2 - OH
одноатомный спирт
многоатомный спирт
6. Тривиальные и номенклатурные названия альдегидов
Тривиальные номенклатурныеформальдегид
уксусный альдегид
пропионовый альдегид
масляный альдегид
H
метаналь
H3C
этаналь
H3C
пропаналь
бутаналь
H3C
CH2
C
C
CH2
CH2
O
H
O
H
O
C
H
C
O
H
7.
Тривиальные и номенклатурныеназвания монокарбоновых
кислот и их солей
муравьиная /метановая
формиаты
СН3СООН уксусная/этановая
ацетаты
СН3СН2СООН пропионовая/пропановая пропионаты
СН3СН2СН2СООН масляная/бутановая бутираты
СН2 = СН - СООН акриловая/пропеновая акрилаты
НСООН
8. Тривиальные и номенклатурные названия дикарбоновых кислот и их солей
НООС-СООННООС-СН2-СООН
щавелевая/этандиовая
малоновая/пропандиовая
оксалаты
малоаты
НООС-СН2-СН2- СООН янтарная/бутандиовая сукцинаты
НООС(СН2)3 СООН глутаровая/пентандиовая
HOOC
HOOC
глутараты
COOH
CH
CH
CH
CHфумаровая /транс-бутендиовая фумараты
COOH
малеиновая /цис-бутендиовая
9. Заместительная систематическая номенклатура органических соединений (IUPAC)
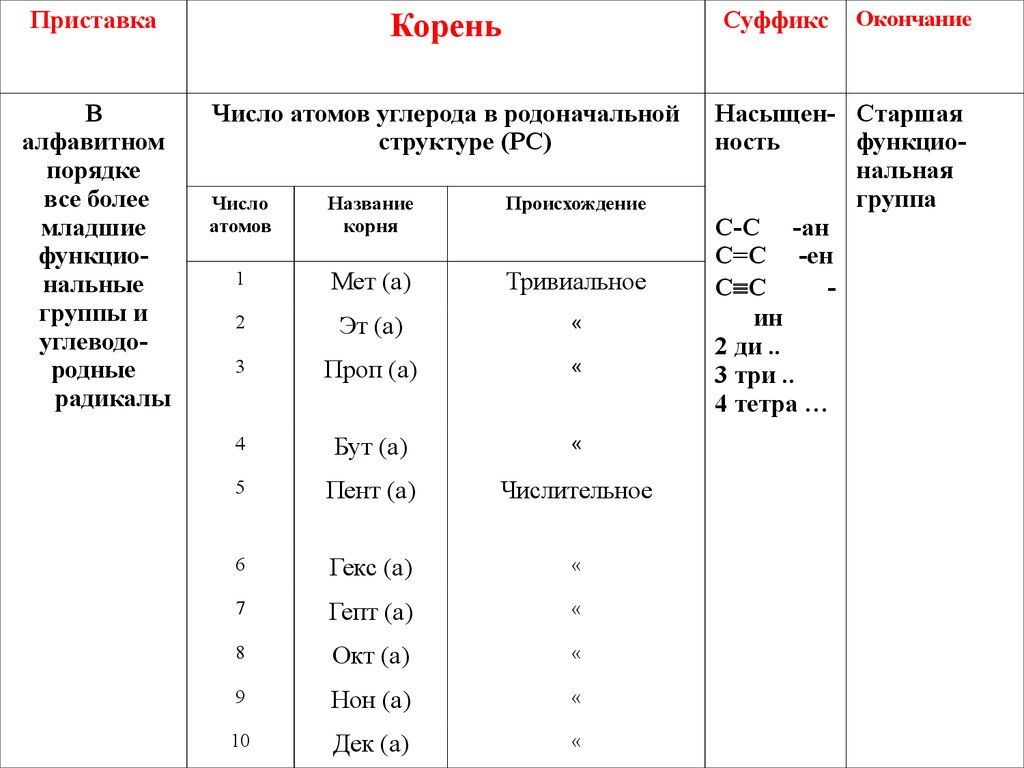
10.
ПриставкаСуффикс
Корень
«
Окончание
11.
ПриставкаКорень
Суффикс
В
алфавитном
порядке
все более
младшие
функциональные
группы и
углеводородные
радикалы
Число атомов углерода в родоначальной
структуре (РС)
Число
атомов
Название
корня
Происхождение
1
Мет (а)
Тривиальное
2
Эт (а)
«
3
Проп (а)
«
4
Бут (а)
«
5
Пент (а)
Числительное
6
Гекс (а)
«
7
Гепт (а)
«
8
Окт (а)
«
9
Нон (а)
«
10
Дек (а)
«
Окончание
Насыщен- Старшая
ность
функциональная
группа
С-С -ан
С=С -ен
С С
ин
2 ди ..
3 три ..
4 тетра …
12. 3.Химическое строение органических соединений
1.Типы гибридизации атомов.Конформации молекул
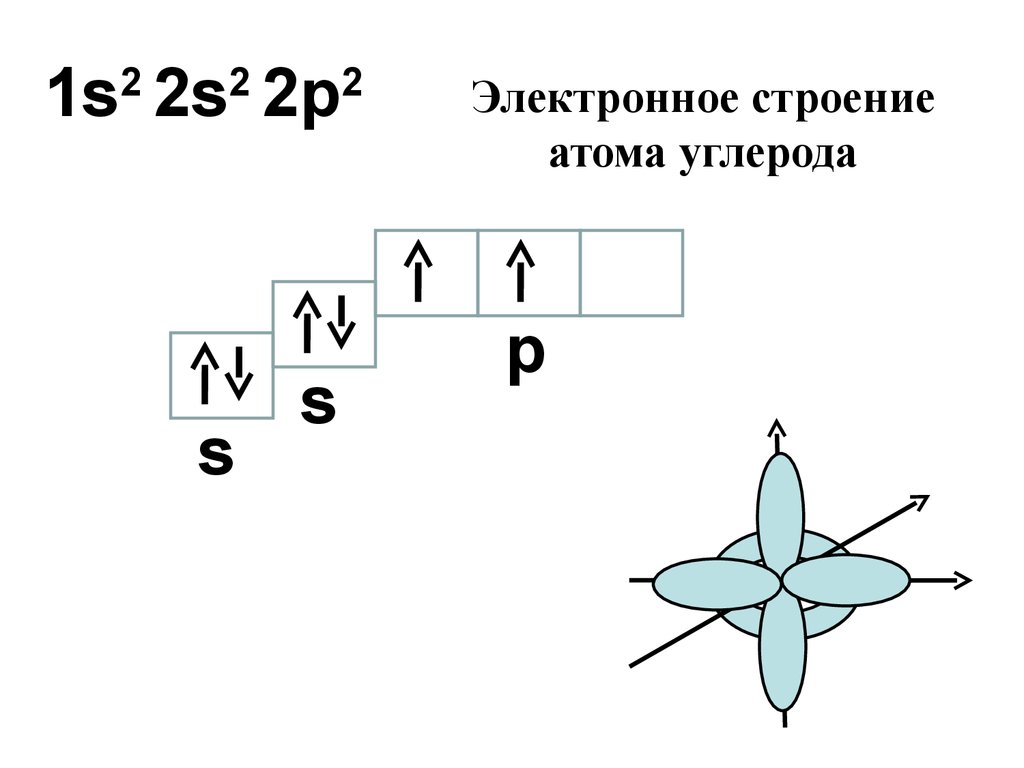
13.
1s 2s 2p2
2
s
s
2
Электронное строение
атома углерода
p
14.
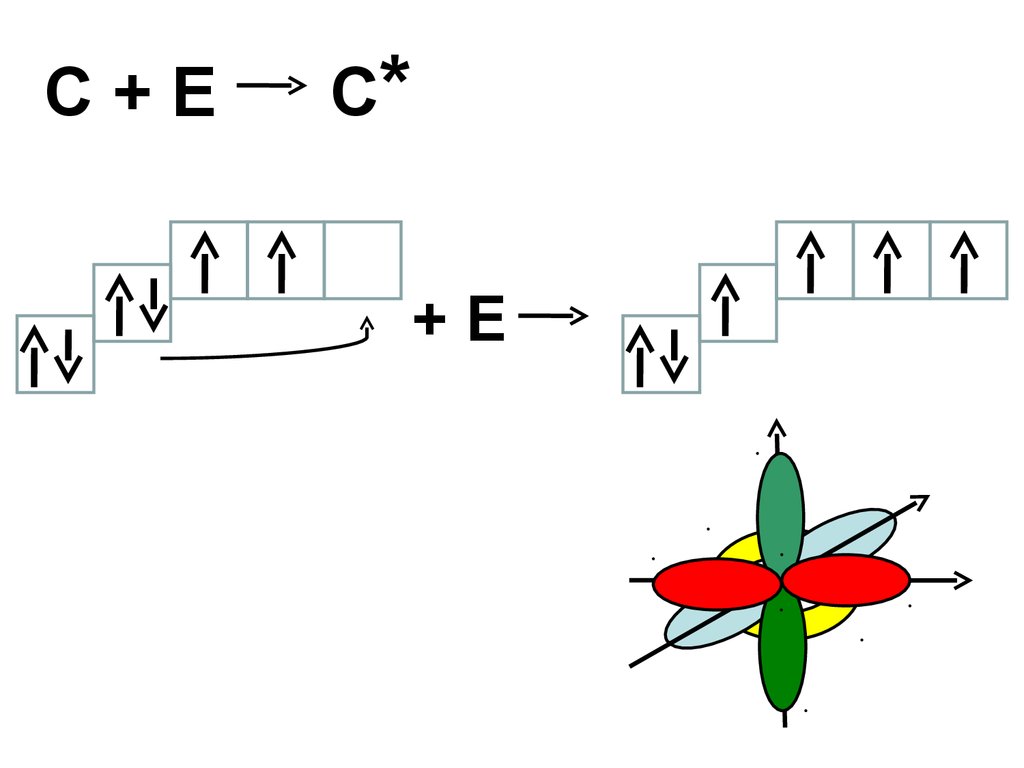
C+EC*
+E
15.
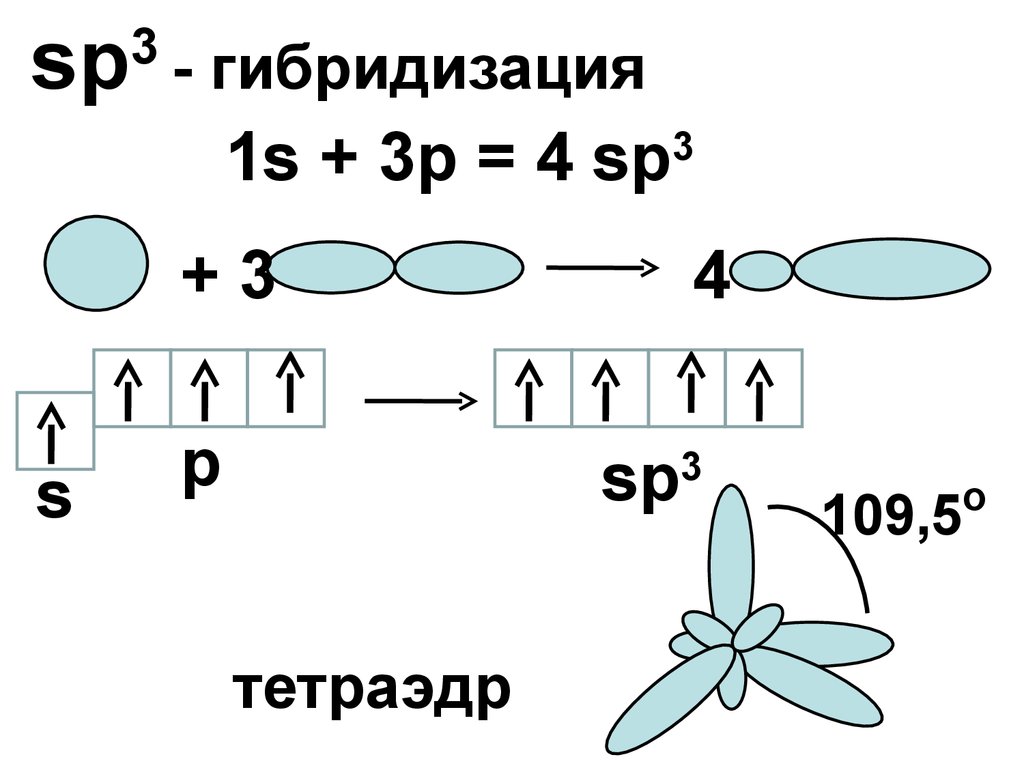
sp3
- гибридизация
1s + 3p = 4 sp3
+3
s
p
4
sp3
тетраэдр
o
109,5
16.
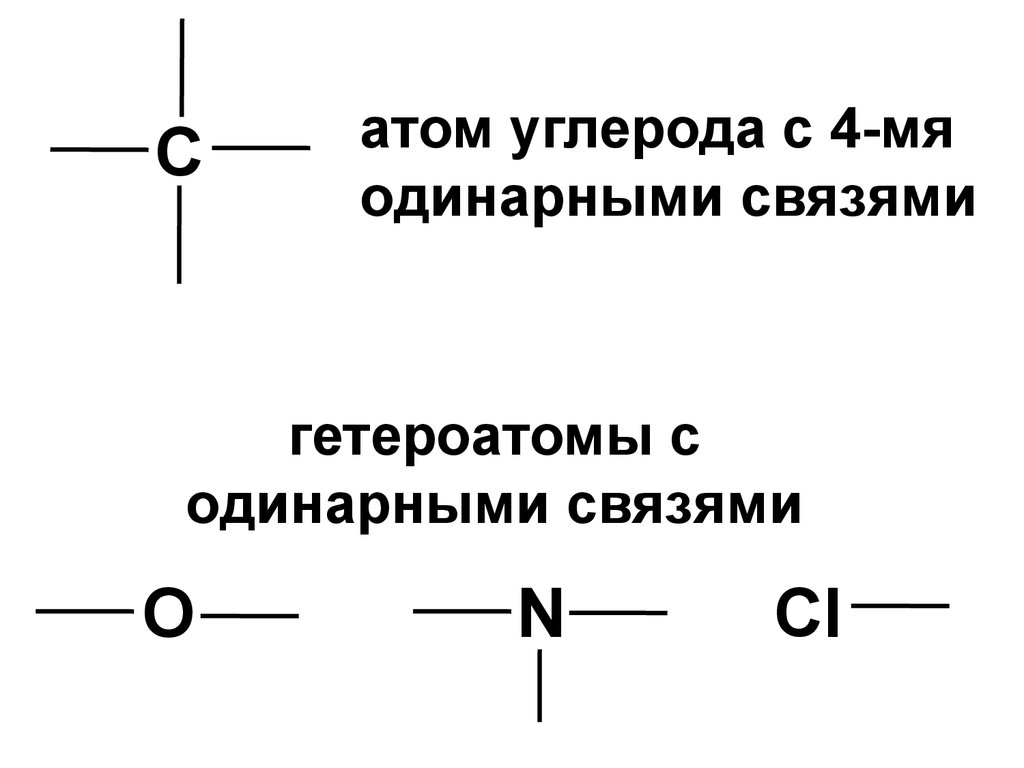
Сатом углерода с 4-мя
одинарными связями
гетероатомы с
одинарными связями
О
N
Cl
17.
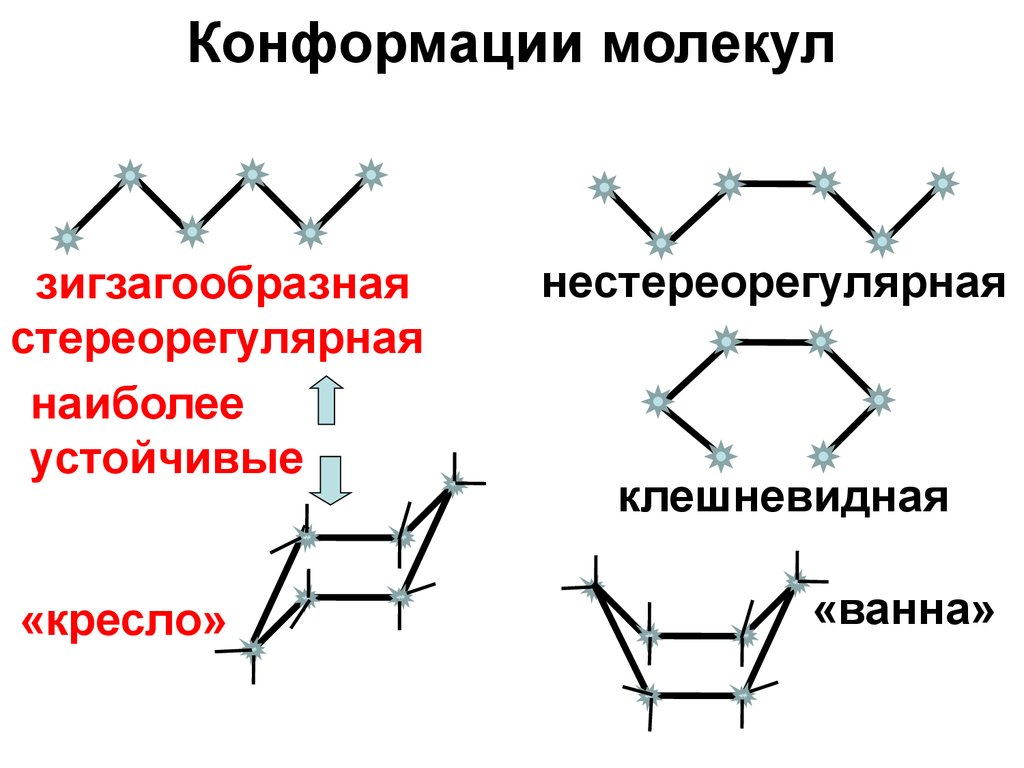
Конформации молекулзигзагообразная
стереорегулярная
наиболее
устойчивые
«кресло»
нестереорегулярная
клешневидная
«ванна»
18.
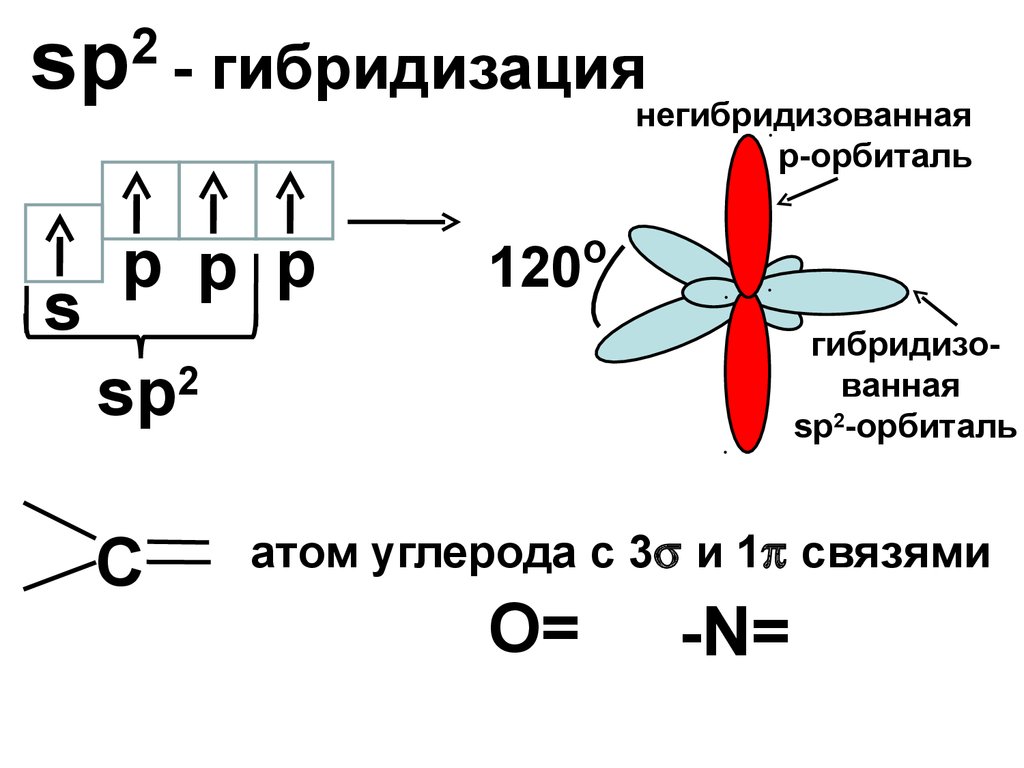
sp2
s
- гибридизация
негибридизованная
р-орбиталь
p p p
o
120
гибридизованная
sp2-орбиталь
sp2
С
атом углерода с 3 и 1 связями
О=
-N=
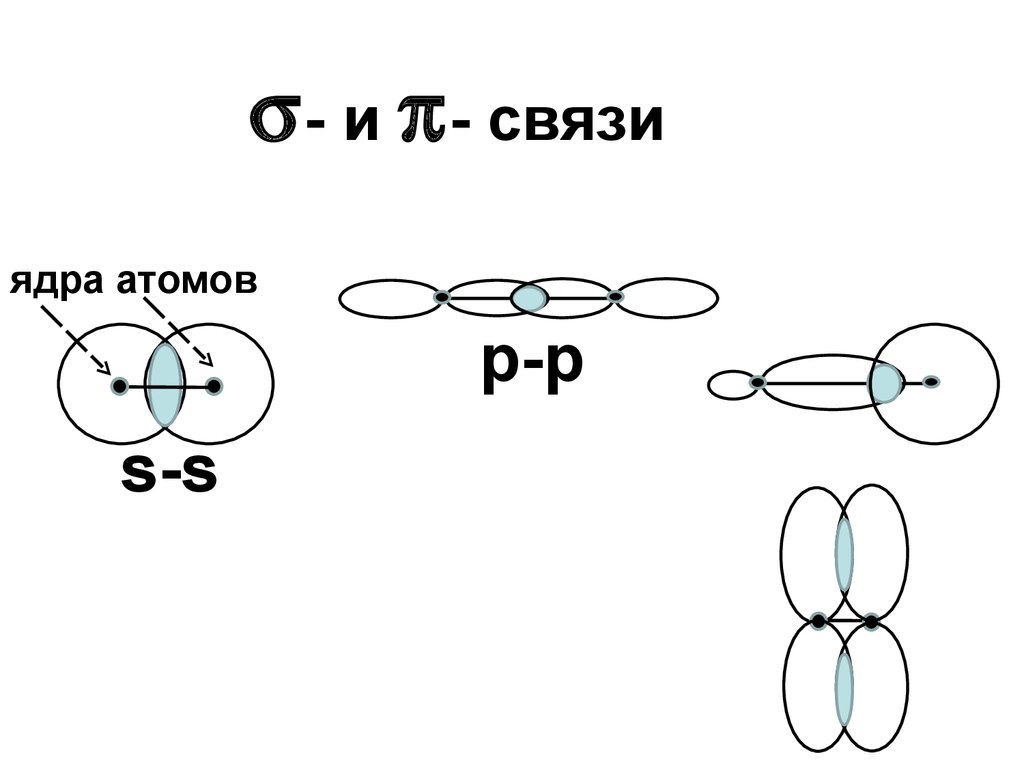
19.
- и - связиядра атомов
р-р
s-s
20. Локализованные химические связи
этан-связи
этен
-связь
21.
Явление сопряжения22. Бутадиен-1,3
23.
Типы сопряжения:1. ,
- сопряжение
примеры:
СН2=СН-СН=СН2
CH2 = CH - CH =O
N
24.
2. р, - сопряжениеCH2 = CH -O-CH3
..
X
примеры:
CH2 = CH - NH2
CH3
C
O
OH
OH
25.
Число электронов в сопряжении:-связь предоставляет 2 электрона,
гетероатом в р, -сопряжении
также предоставляет 2 электрона
26. 3.Ароматичность
бензолO
N
27. Структурные признаки ароматичности
плоскостное строение цикла (все атомы
в sp2 – гибридном состоянии);
замкнутая -сопряженная система всех
атомов цикла;
сумма сопряженных электронов в цикле
соответствует формуле Хюккеля
4n+ 2 = ē в сопряжении,
где n – целое число
28. ПРИМЕР Протопорфирин
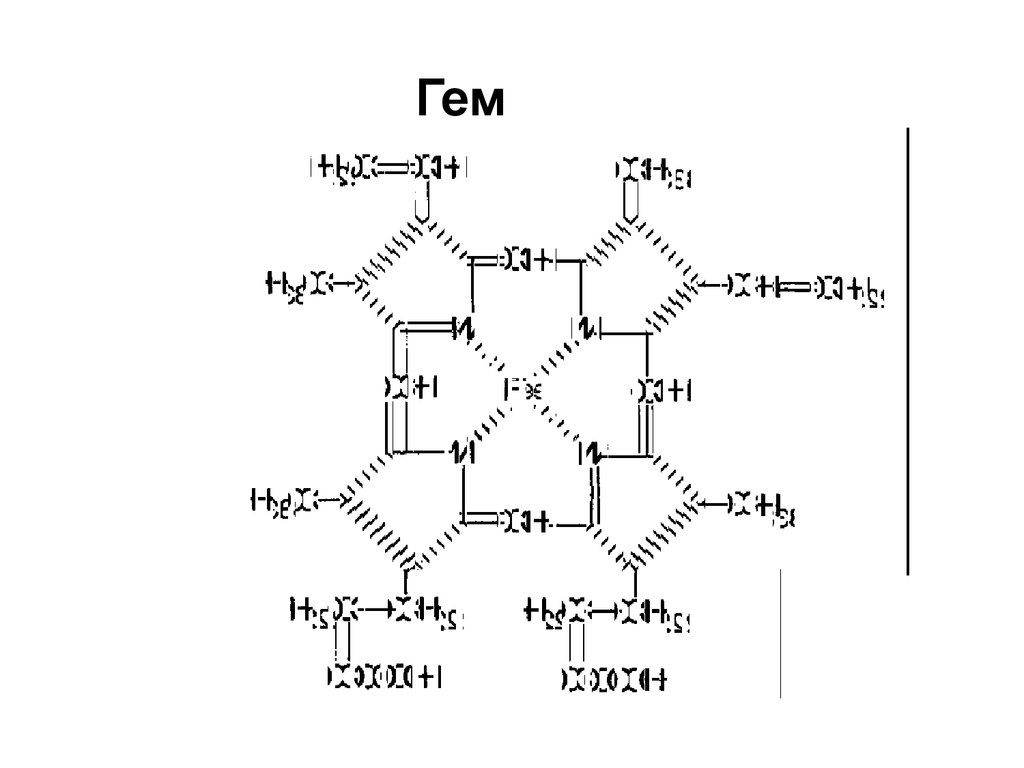
29. Гем
30. Плоская структура гема позволяет железу присоединить кислород
o=oFe
o=o
Fe
31. Взаимное влияние атомов в органических молекулах
32. Индуктивный электронный эффект (I)
Индуктивный электронныйэффект ( I)
Сравнительная электроотрицательность
F O N Csp Csp2 Csp3
-I
+I
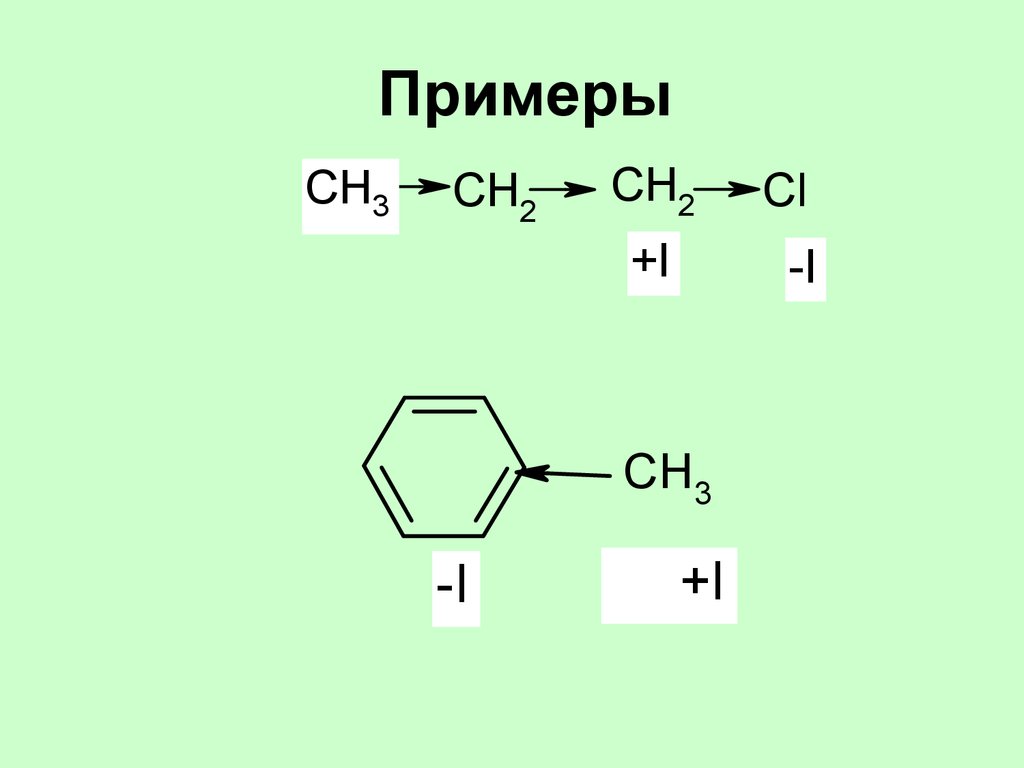
33. Примеры
CH3CH2
CH2
+I
-I
CH3
-I
Cl
+I
34. Мезомерый эффект или эффект сопряжения (M)
Мезомерый эффект илиэффект сопряжения ( M)
CH2
CH2
CH
CH
CH
X
X
+M
-M
35. Примеры
36. Электронный эффекты заместителей
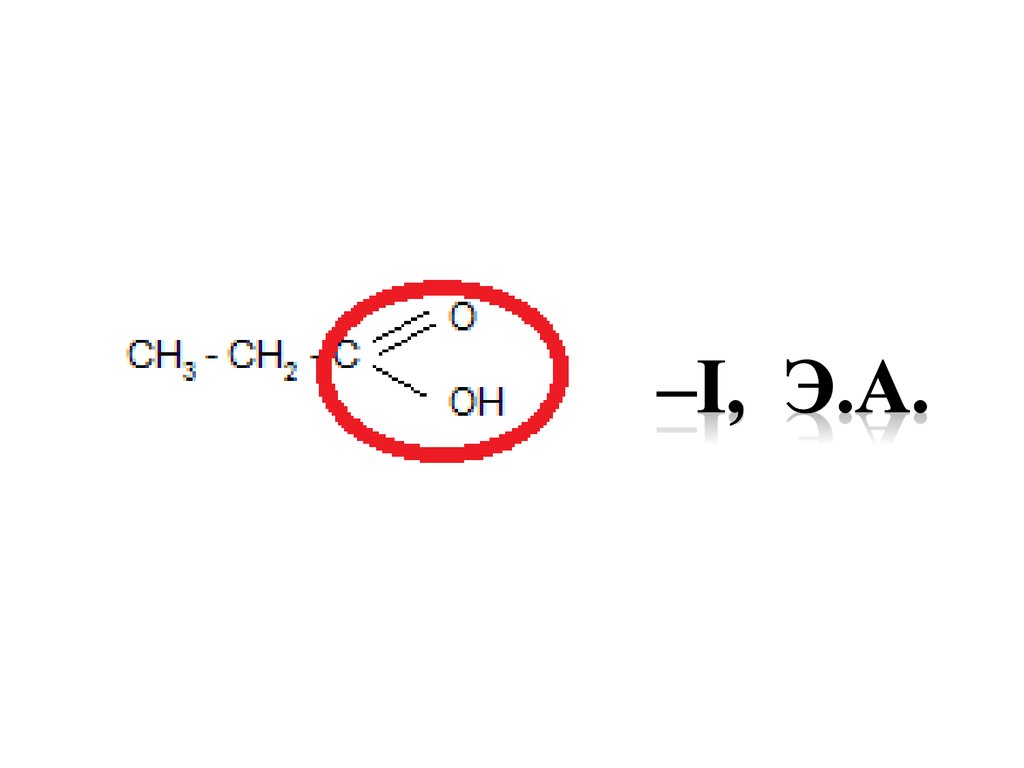
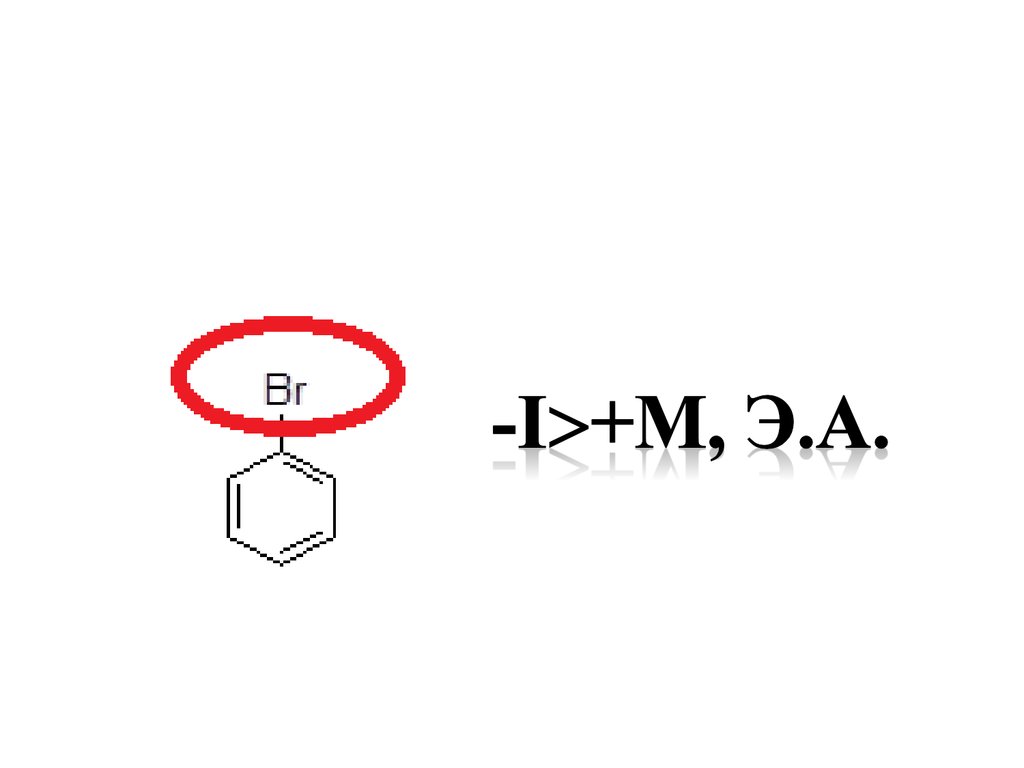
37. Функциональные группы как электронодоноры или электроноакцепторы -I , Э.А.
38.
39.
40.
41.
42.
OHNH2
43.
OHNH2
44.
OC
H
HO
H3C
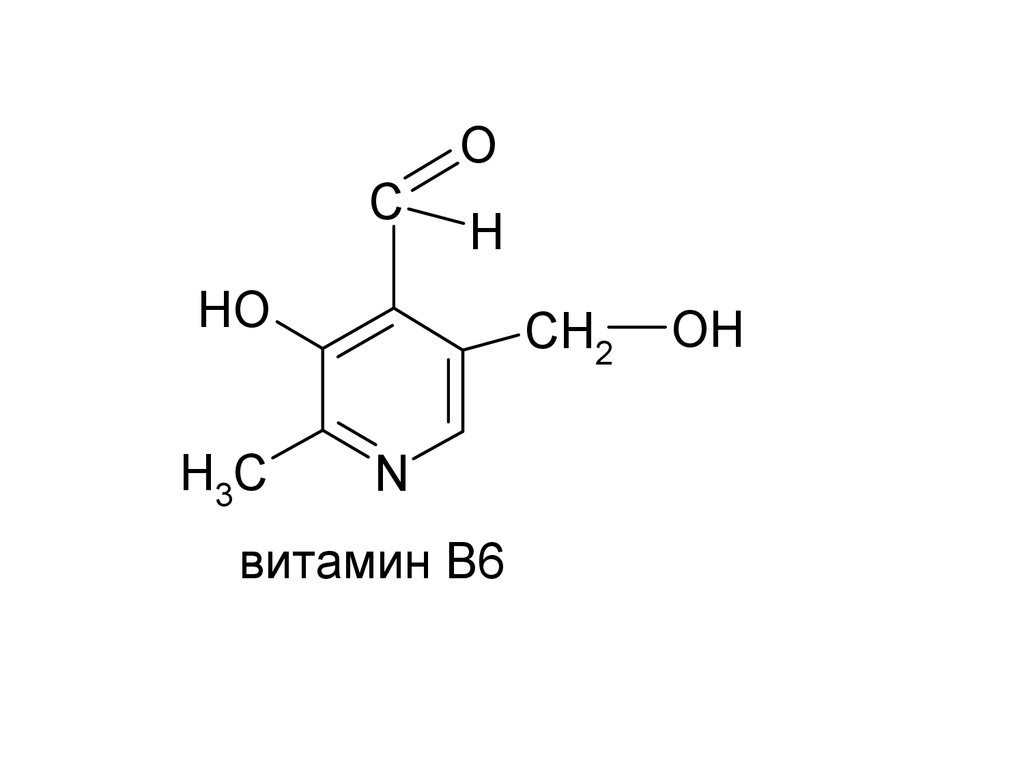
CH2
N
витамин В6
OH
45.
OC
H
HO
H3C
CH2
N
витамин В6
OH
46.
OC
O
NH2
новокаин
CH2 CH2
N
C2H5
C2H5
47. Реакционная способность органических соединений
48.
Виды химических реакцийI.Кислотно-основные
II. Характерные реакции органических
соединений
III. Окислительно-восстановительные
реакции
IV. Качественные реакции
49. I. Кислотно-основные свойства органических соединений
Кислота R-XHКислотный центр -ХН
-SH, -OH, -NH, -CH
Основание H-X
Основный центр –Х
n-основания:
Гетероатом с
неподеленной
электронной парой
-Основания :
-Связь между
атомами углерода
50. Сравнительная сила кислот
R – XH=
кислота
R-X-
+
H+
сопряженное
основание
(анион)
Усиливают кислотность:
сопряжение с кислотным центром
большой радиус атома в кислотном центре
высокая электроотрицательность атома в
кислотном центре
электроноакцепторные заместители в
молекуле кислоты
51.
карбоновые кислотыфенолы
тиолы
многоатомные спирты
одноатомные спирты
амины
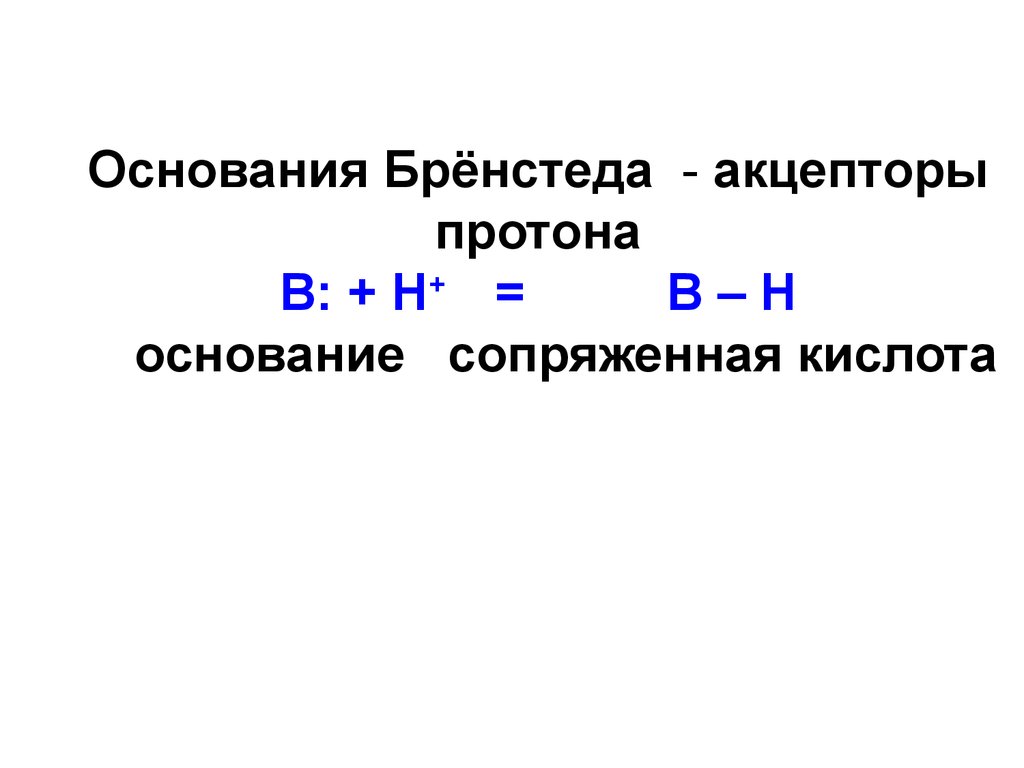
52. Основания Брёнстеда - акцепторы протона В: + Н+ = В – Н основание сопряженная кислота
Основания Брёнстеда - акцепторыпротона
В: + Н+ =
В–Н
основание сопряженная кислота
53.
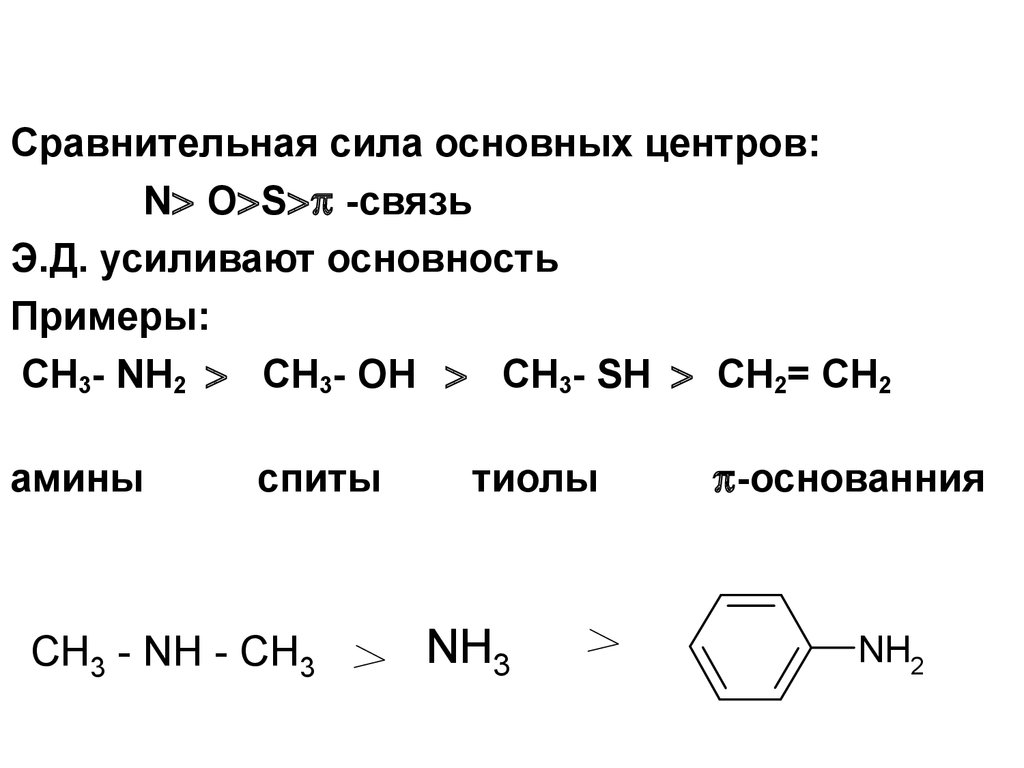
Сравнительная сила основных центров:N O S -связь
Э.Д. усиливают основность
Примеры:
CH3- NH2 CH3- OH CH3- SH CH2= CH2
амины
спиты
CH3 - NH - CH3
тиолы
NH3
-основанния
NH2
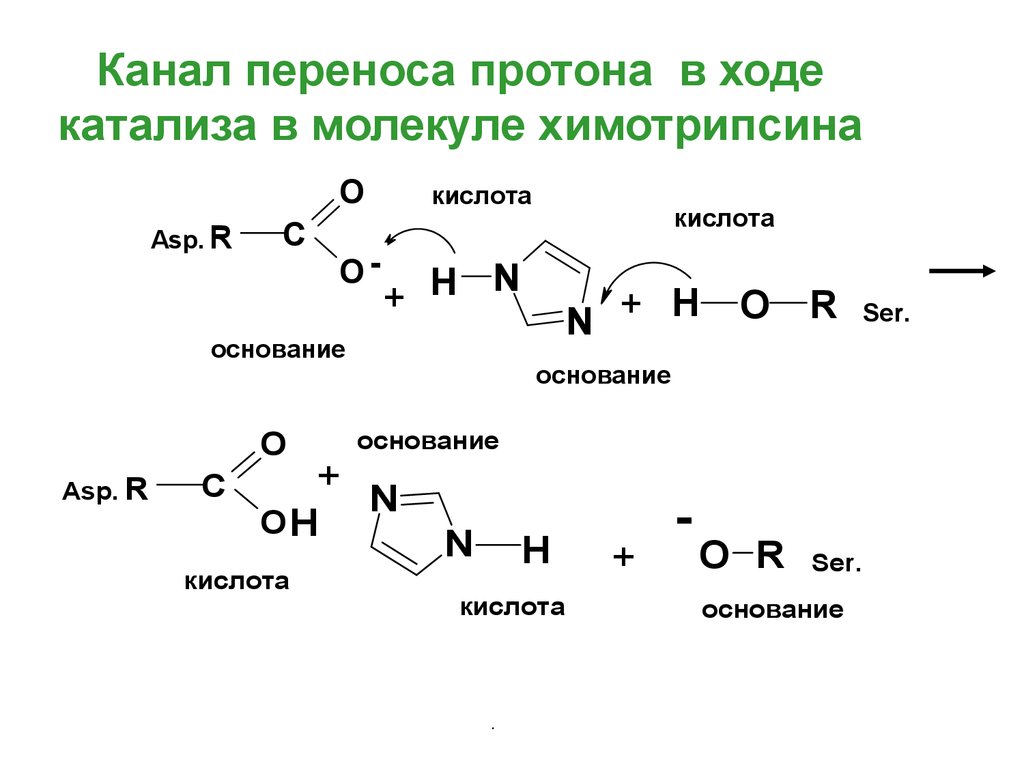
54. Канал переноса протона в ходе катализа в молекуле химотрипсина
OAsp. R
C
O-
кислота
N
+ H
основание
O
Asp. R
C
N + H
O R
основание
основание
+
N
OH
кислота
кислота
N
H
кислота
+
-
O R
Ser.
основание
Ser.
55.
Характерныереакции
органических
соединений
56. Основные понятия
• Субстрат – вещество, у которогопроисходит разрыв связи у атома
углерода. Определяет тип реакции
• Реагент
–
вещество
(частица),
атакующая
субстрат
(радикал,
электрофил, нуклеофил). Определяет
механизм реакции.
57.
реагентыА. радикалы
Свободный радикал
R – частица с неспаренным электроном:
Н СН3 Сl
Определяет радикальный (цепной) механизм
реакции.
В организме по нему идут процессы пероксидного
окисления
58. Б. нуклеофилы и электрофилы
• Нуклеофил –реагент с целым или частичнымотрицательным зарядом (анион или молекула),
содержит неподеленную электронную пару:
ОН- , NH3 , H2O , CH3OH ,
Электрофил - реагент с целым или частичным
положительным зарядом (катион или молекула):
Н+ , SO3
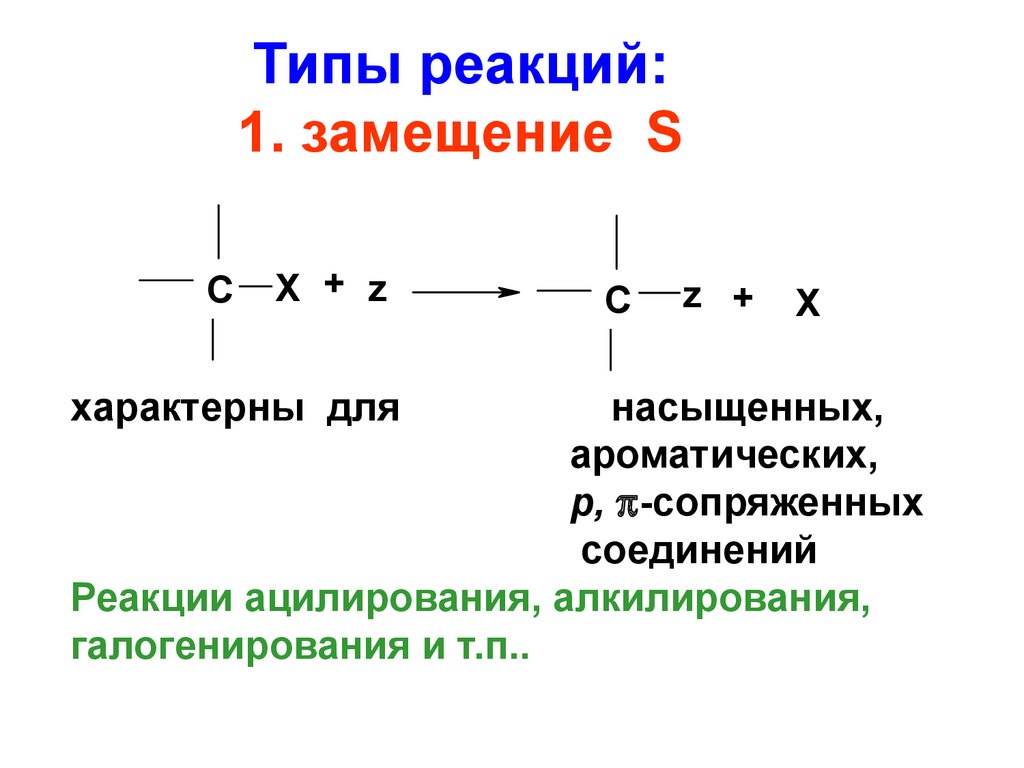
59. Типы реакций: 1. замещение S
CX + z
характерны для
C
z +
X
насыщенных,
ароматических,
р, -сопряженных
соединений
Реакции ацилирования, алкилирования,
галогенирования и т.п..
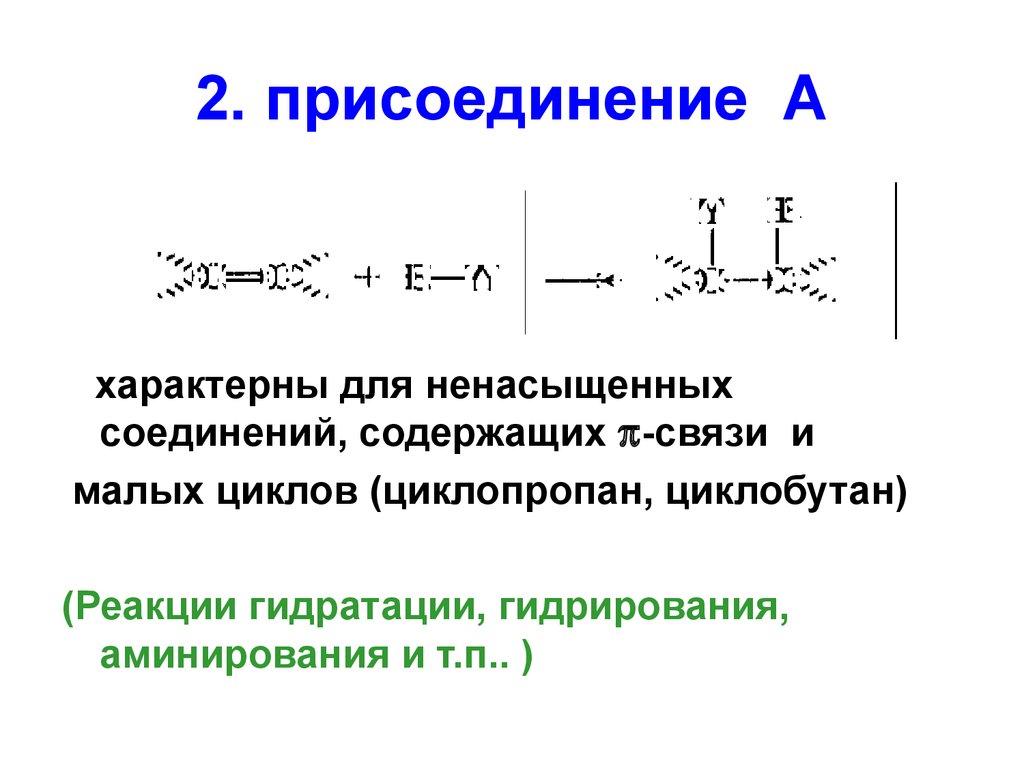
60. 2. присоединение А
характерны для ненасыщенныхсоединений, содержащих -связи и
малых циклов (циклопропан, циклобутан)
(Реакции гидратации, гидрирования,
аминирования и т.п.. )
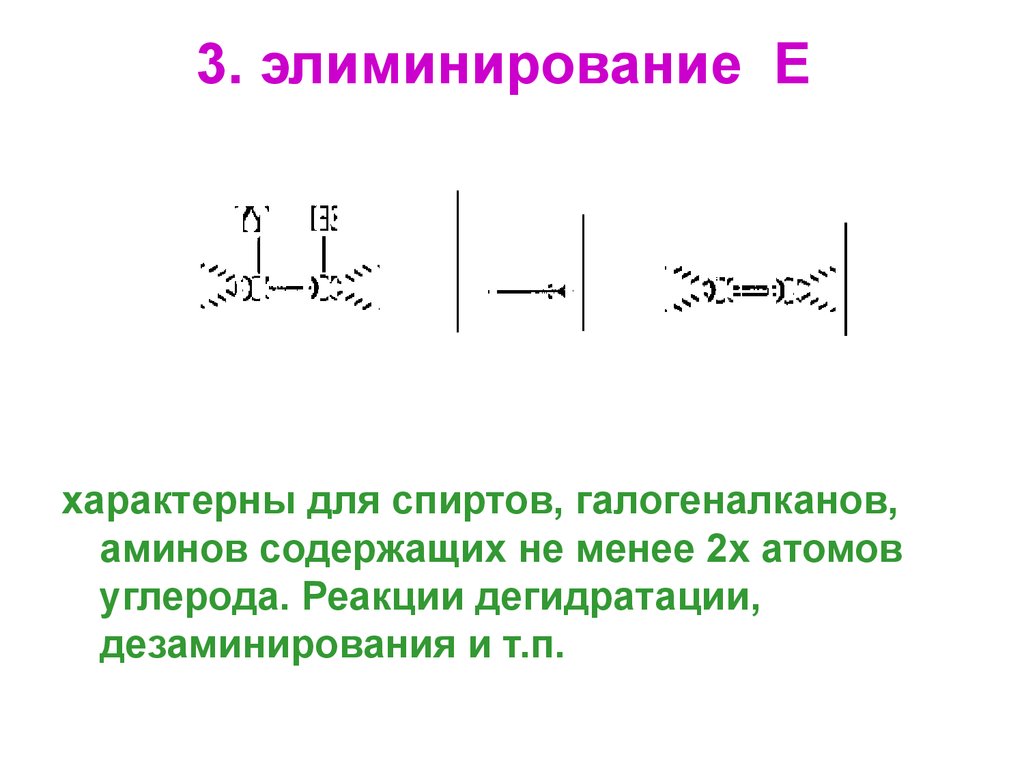
61. 3. элиминирование Е
характерны для спиртов, галогеналканов,аминов содержащих не менее 2х атомов
углерода. Реакции дегидратации,
дезаминирования и т.п.
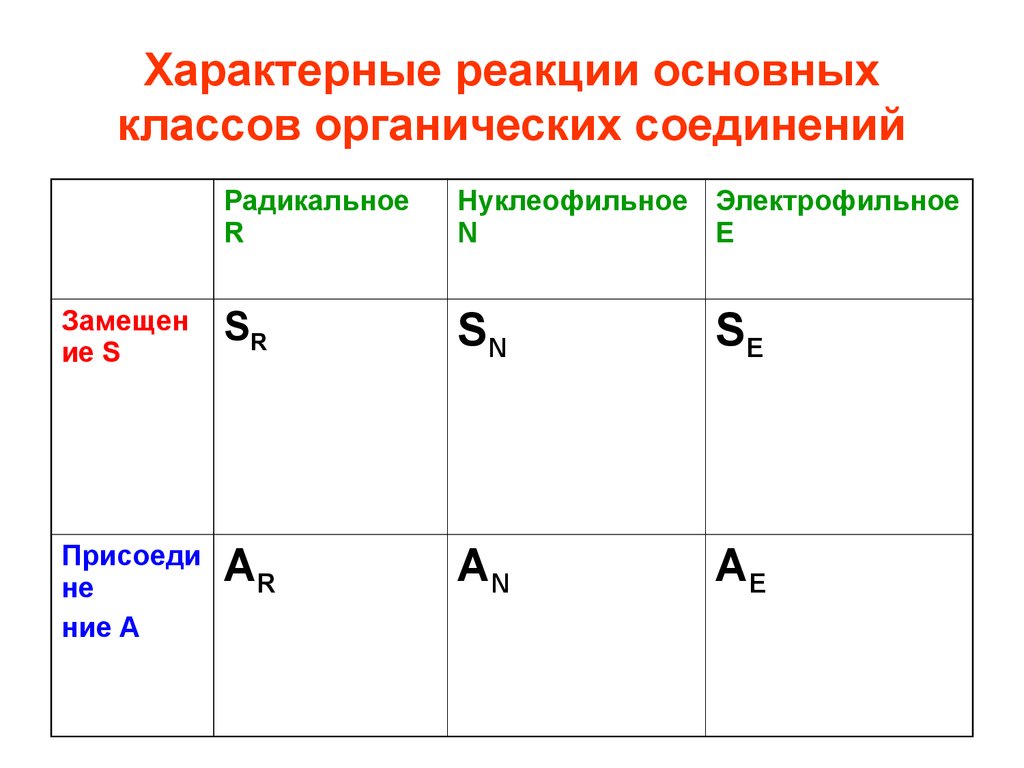
62. Характерные реакции основных классов органических соединений
РадикальноеR
Нуклеофильное Электрофильное
N
Е
Замещен
ие S
SR
SN
SE
Присоеди
не
ние А
AR
AN
AE
63. Характерные реакции основных классов органических соединений
Замещение S
Радикальное
R
Нуклеофильное Электрофильное
N
Е
SR
SN
SE
Галогеналканы,
спирты,
карбоновые
кислоты и их ф.
производные
Ароматические
соединения
AN
AE
Альдегиды,
кетоны
Алкены, алкины,
диены, малые
циклоалканы
Алканы,
циклоалканы
A
Присоеди
R
не
Алкены,
ние А
алкины,
диены
64.
Электронодоноры активизируютсубстрат в реакциях
электрофильного замещения SE или
присоединения AE
Электроноакцепторы активизируют
субстрат в реакциях нуклеофильного
SN замещения или присоединения AN.
























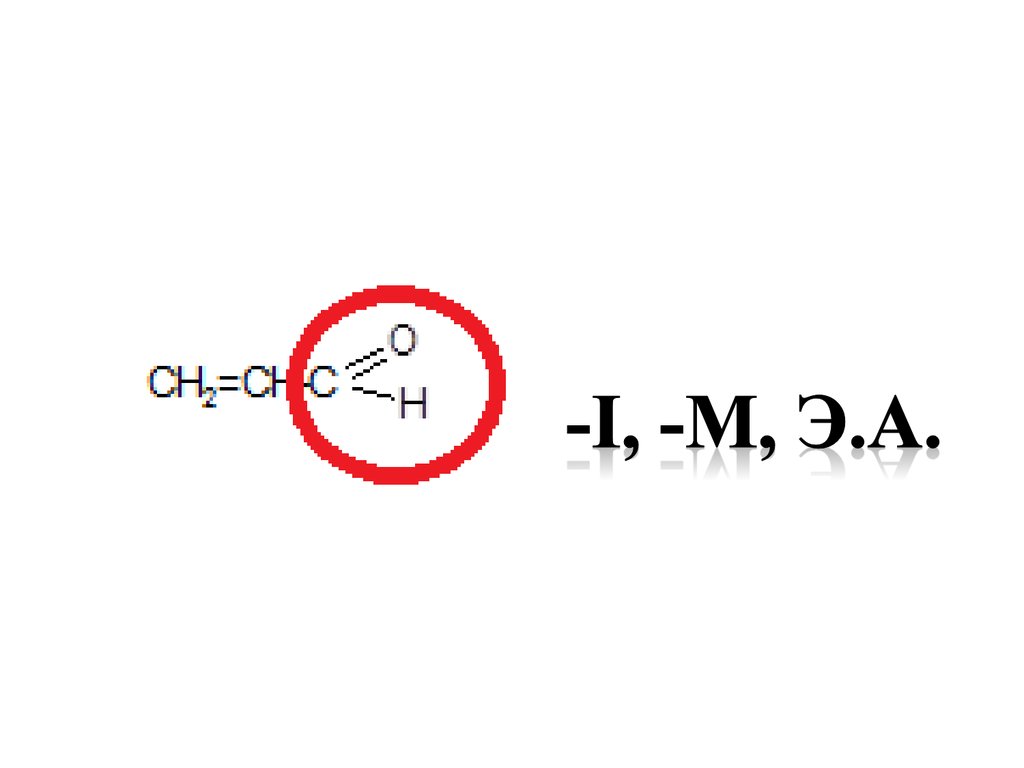
















 chemistry
chemistry








