Similar presentations:
Классификация и номенклатура органических соединений. (Лекция 1)
1. Классификация и номенклатура органических соединений
2. Предмет органической химии
Органическая химия – это химия соединенийуглерода с другими элементами (Ф.А. Кекуле,
середина XIX в.).
Органическая
химия
–
это
химия
углеводородов и их производных (К. Шорлеммер,
1889 г.).
Органогены – это химические элементы,
входящие в состав молекул органических
соединений (С, Н, N, P, O, S).
3. Причины выделения органической химии в отдельную науку
четырехвалентность атома углерода;способность атомов углерода образовывать
длинные цепи и кольца;
способность атомов углерода образовывать
устойчивые химические связи с другими
атомами элементов-органогенов;
из всех элементов периодической системы
именно атом углерода играет главную и
определяющую роль в биологическом мире.
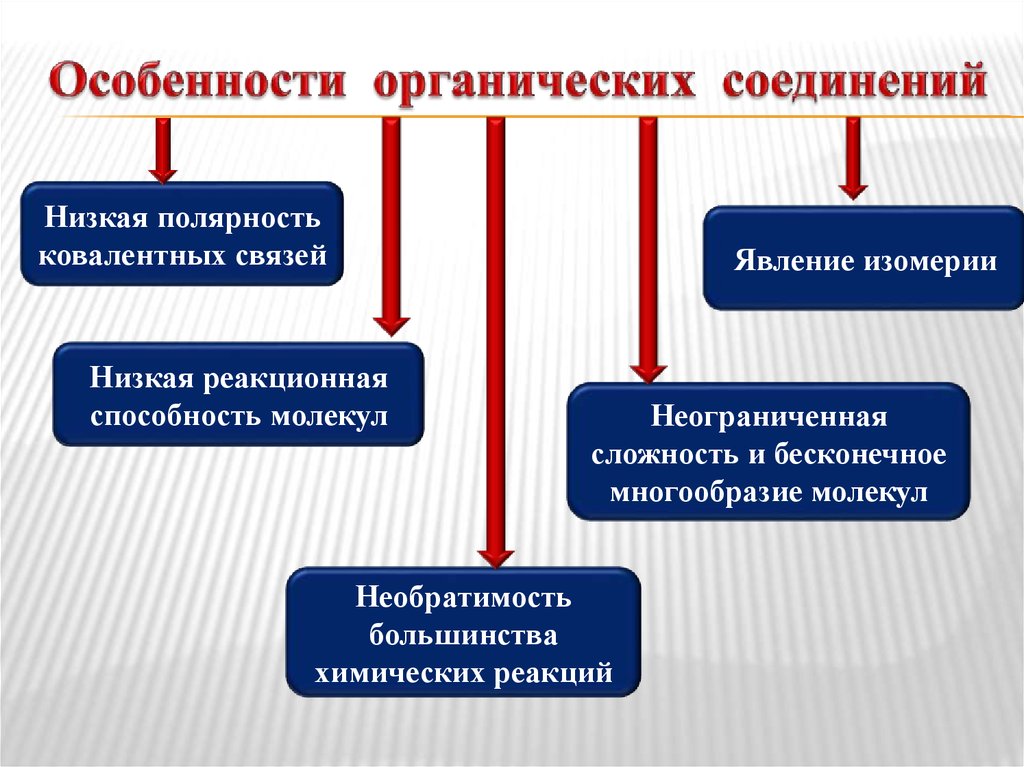
4. Особенности органических соединений
Низкая полярностьковалентных связей
Низкая реакционная
способность молекул
Явление изомерии
Неограниченная
сложность и бесконечное
многообразие молекул
Необратимость
большинства
химических реакций
5. Основные положения теории химического строения органических соединений А.М. Бутлерова
Атомыв молекулах органических
соединений связаны друг с другом
химическими связями в соответствии с
их валентностью.
Свойства органических соединений
зависят не только от числа и природы
входящих в их состав атомов, но и от
химического строения молекул;
В молекулах органических соединений
существует взаимное влияние атомов как
связанных, так и непосредственно друг с
другом не связанных.
6. Изомерия органических соединений
Изомеры - это соединения, имеющиеодинаковый состав, но отличающиеся
последовательностью соединения атомов в
молекуле
или
расположением
их
в
пространстве,
и
поэтому
обладающие
различными свойствами.
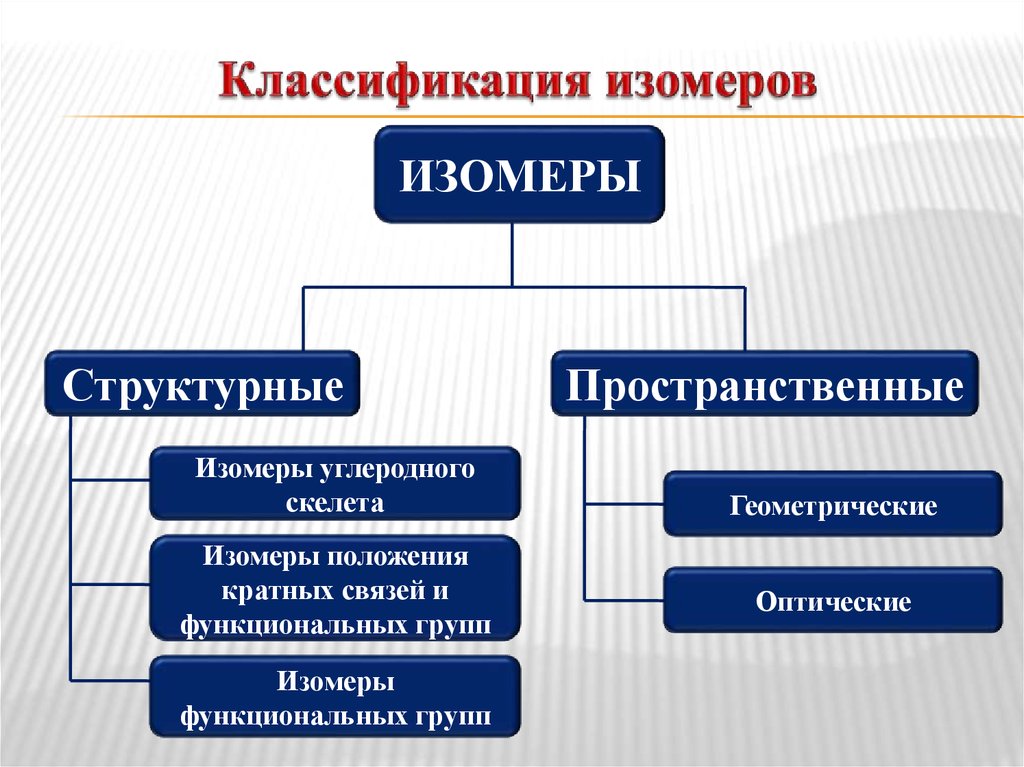
7. Классификация изомеров
ИЗОМЕРЫСтруктурные
Изомеры углеродного
скелета
Изомеры положения
кратных связей и
функциональных групп
Изомеры
функциональных групп
Пространственные
Геометрические
Оптические
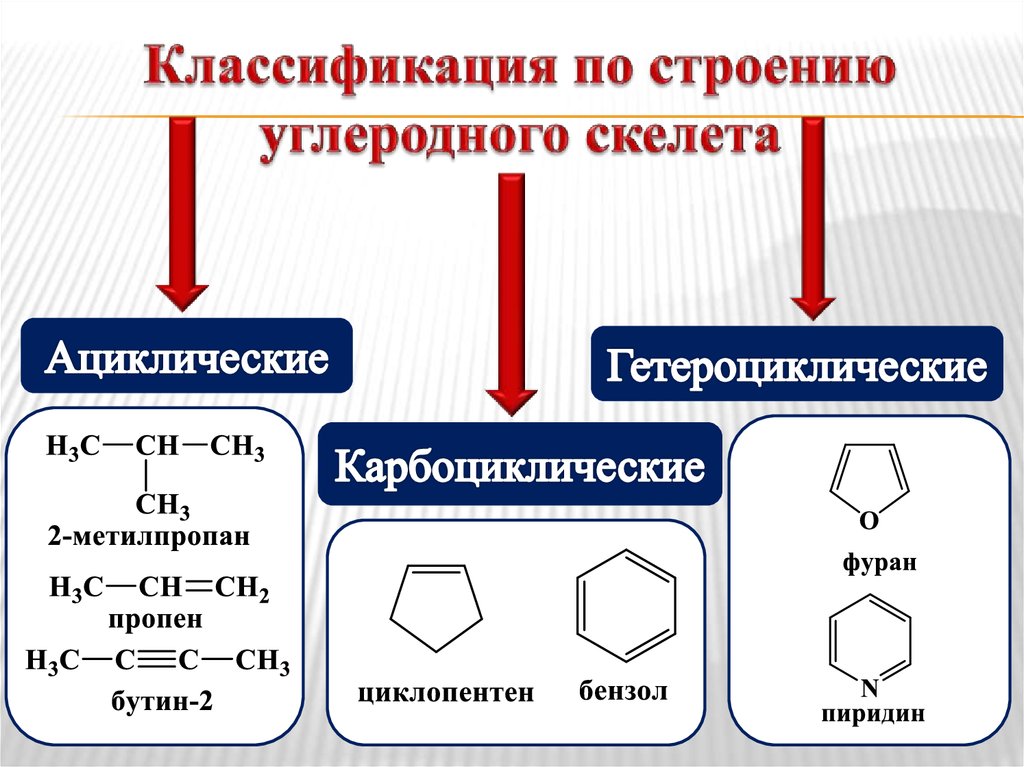
8. Признаки классификации органических соединений
Строение углеродного скелета молекулы;Наличие в молекуле функциональных
групп.
9. Классификация по строению углеродного скелета
10.
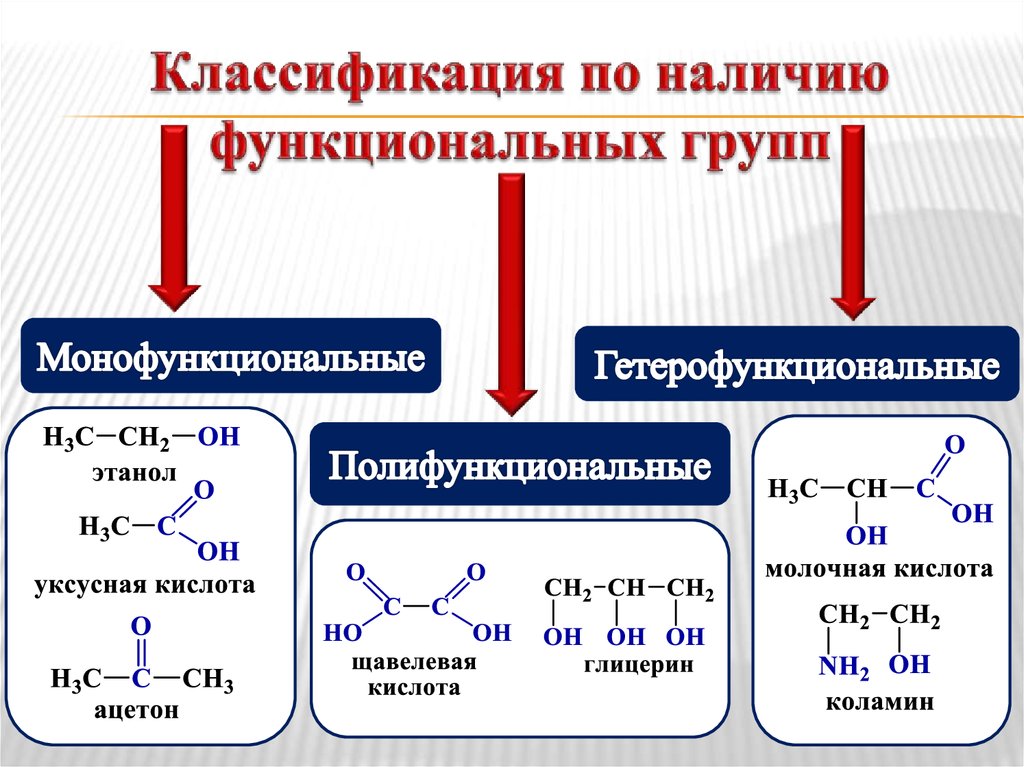
Функциональная группа – это атомили группа атомов, определяющие
химические свойства соединения и
принадлежность его к определенному
классу.
11. Классификация по наличию функциональных групп
12. Номенклатура органических соединений
Номенклатура – это система терминов,обозначающих строение веществ и
пространственное расположение атомов в
их молекулах.
- тривиальная номенклатура
- радикально-функциональная номенклатура
- заместительная номенклатура ИЮПАК
13.
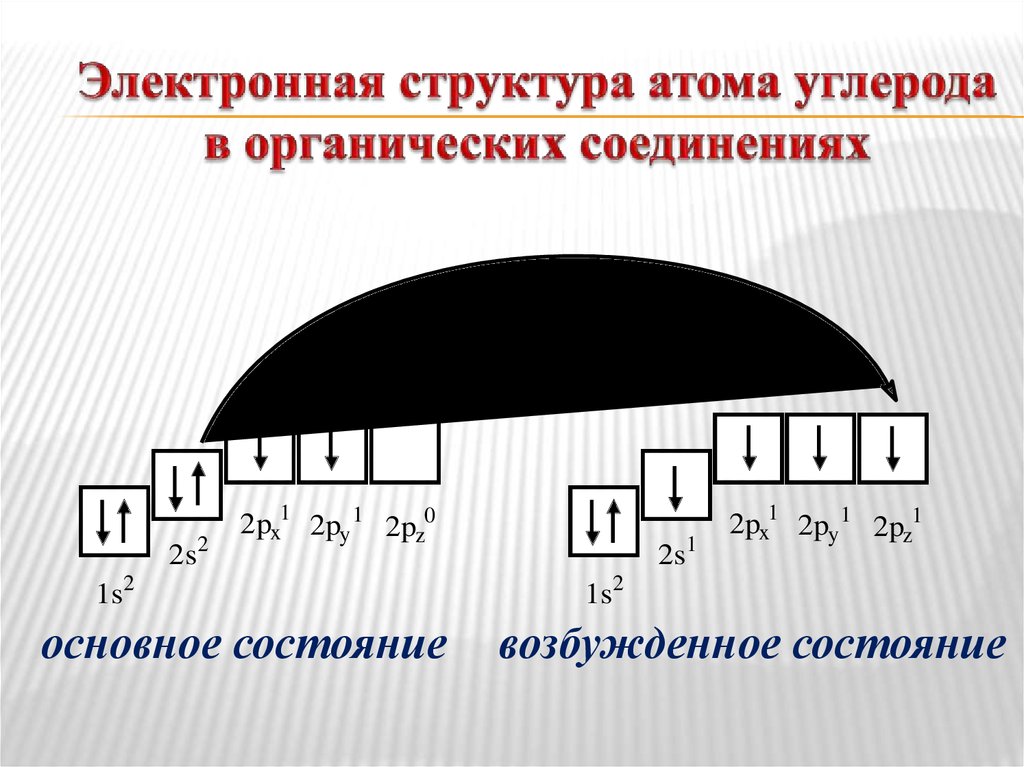
14. Электронная структура атома углерода в органических соединениях
2s22px1 2py 1 2pz0
1s2
основное состояние
2s1
2px1 2py 1 2pz1
1s2
возбужденное состояние
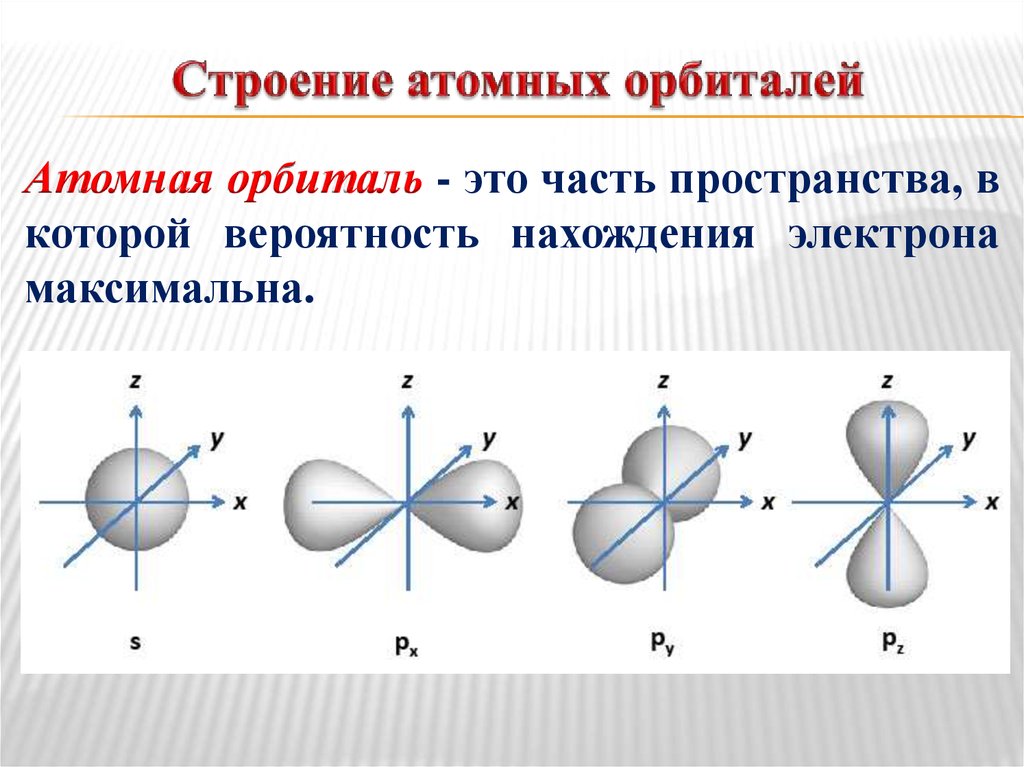
15. Строение атомных орбиталей
Атомная орбиталь - это часть пространства, вкоторой вероятность нахождения электрона
максимальна.
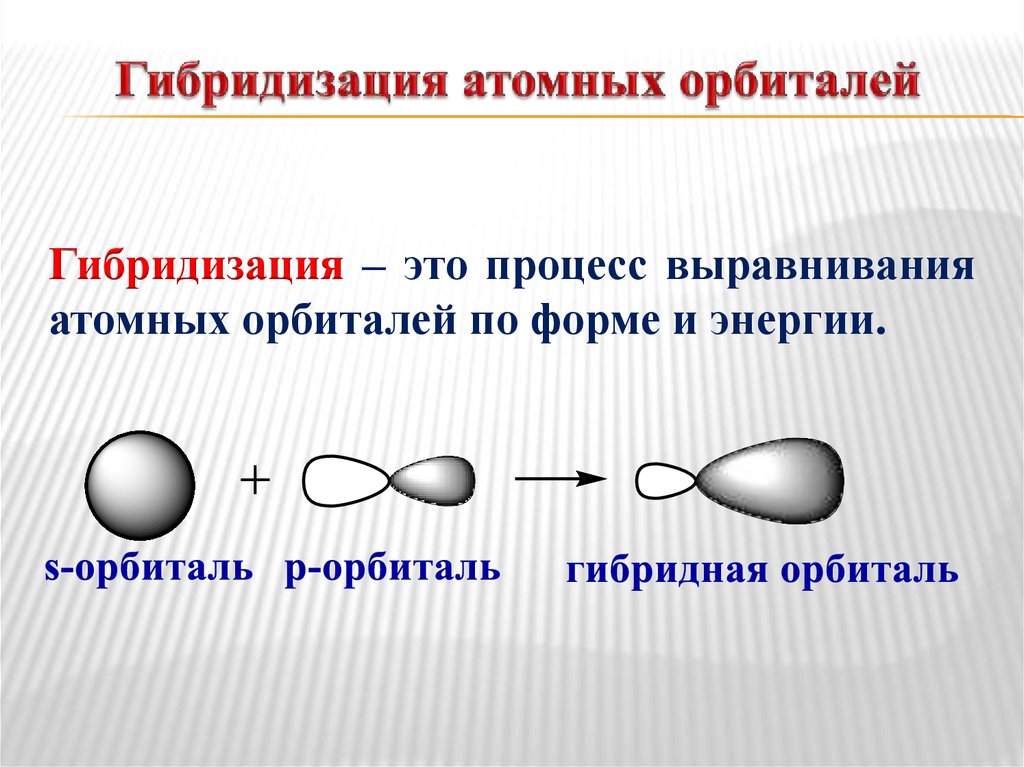
16. Гибридизация атомных орбиталей
Гибридизация – это процесс выравниванияатомных орбиталей по форме и энергии.
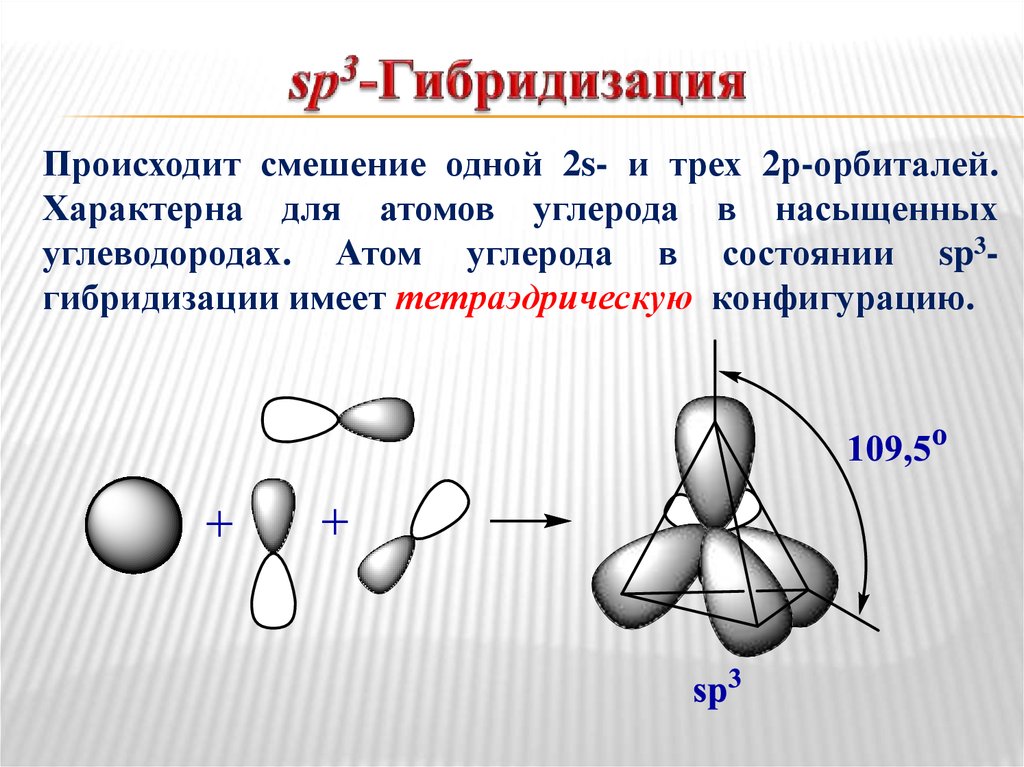
17. sp3-Гибридизация
Происходит смешение одной 2s- и трех 2р-орбиталей.Характерна для атомов углерода в насыщенных
углеводородах. Атом углерода в состоянии sp3гибридизации имеет тетраэдрическую конфигурацию.
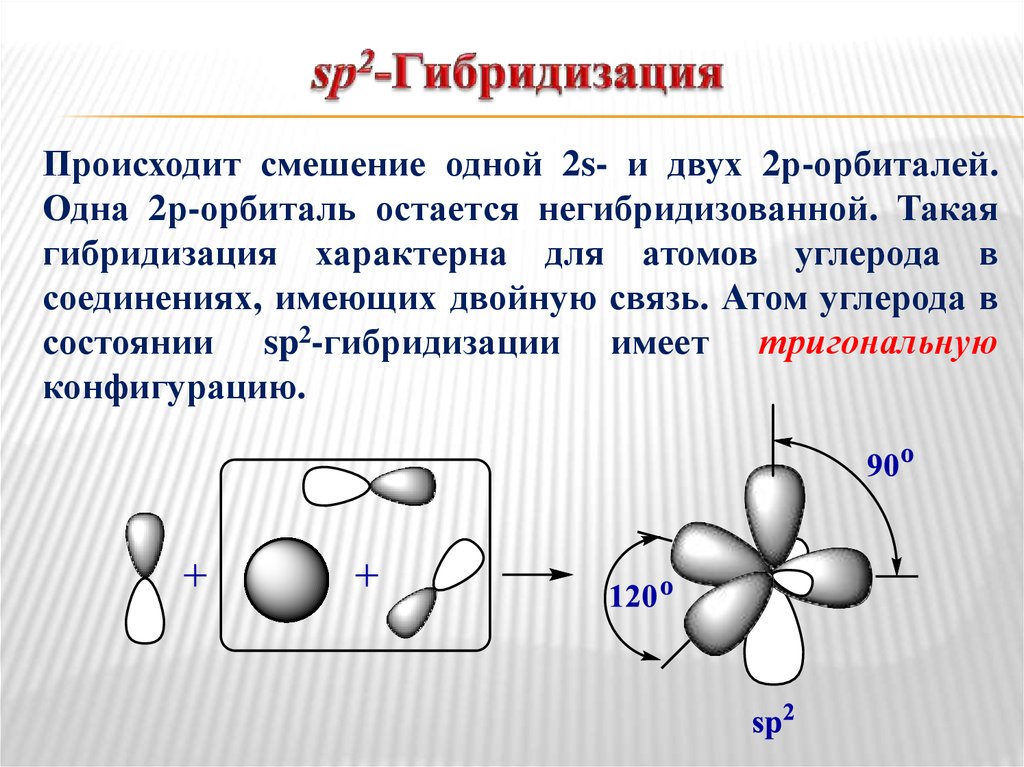
18. sp2-Гибридизация
Происходит смешение одной 2s- и двух 2р-орбиталей.Одна 2р-орбиталь остается негибридизованной. Такая
гибридизация характерна для атомов углерода в
соединениях, имеющих двойную связь. Атом углерода в
состоянии sp2-гибридизации имеет тригональную
конфигурацию.
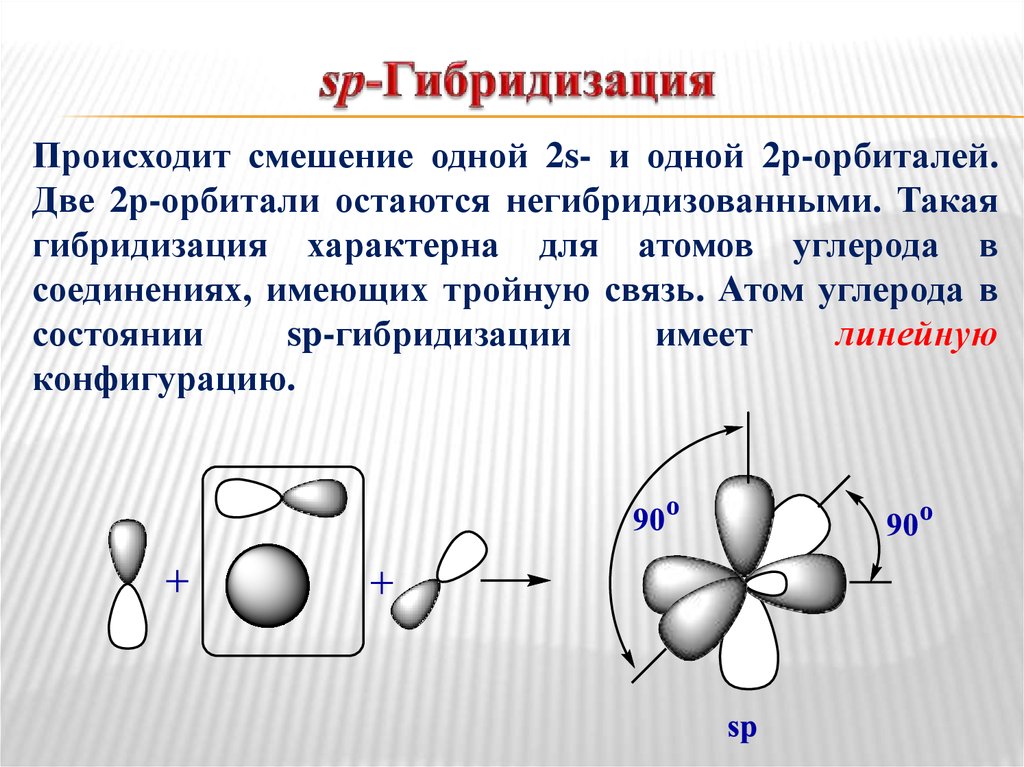
19. sp-Гибридизация
Происходит смешение одной 2s- и одной 2р-орбиталей.Две 2р-орбитали остаются негибридизованными. Такая
гибридизация характерна для атомов углерода в
соединениях, имеющих тройную связь. Атом углерода в
состоянии
sp-гибридизации
имеет
линейную
конфигурацию.
20. Химическая связь в органических молекулах
В органических соединениях преимущественновстречаются ковалентные связи – химические связи,
образованные
в
результате
обобществления
электронов связываемых атомов.
Ковалентные связи бывают двух видов:
- σ - связи;
- π - связи.
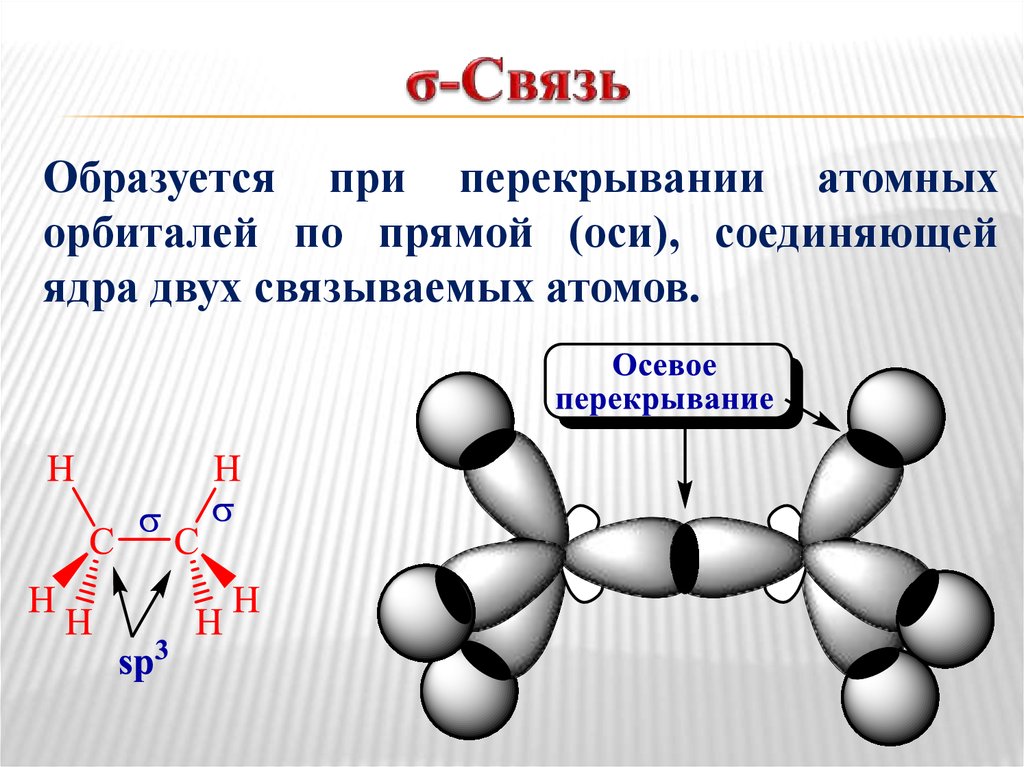
21. σ-Связь
Образуется при перекрывании атомныхорбиталей по прямой (оси), соединяющей
ядра двух связываемых атомов.
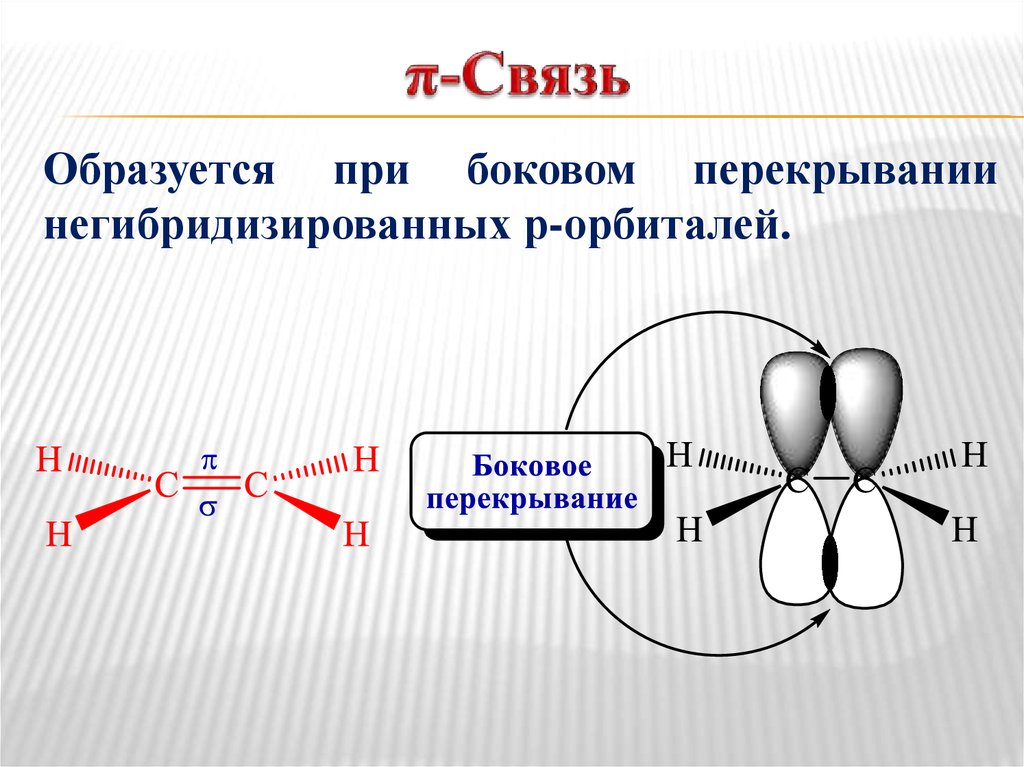
22. π-Связь
Образуется при боковом перекрываниинегибридизированных р-орбиталей.
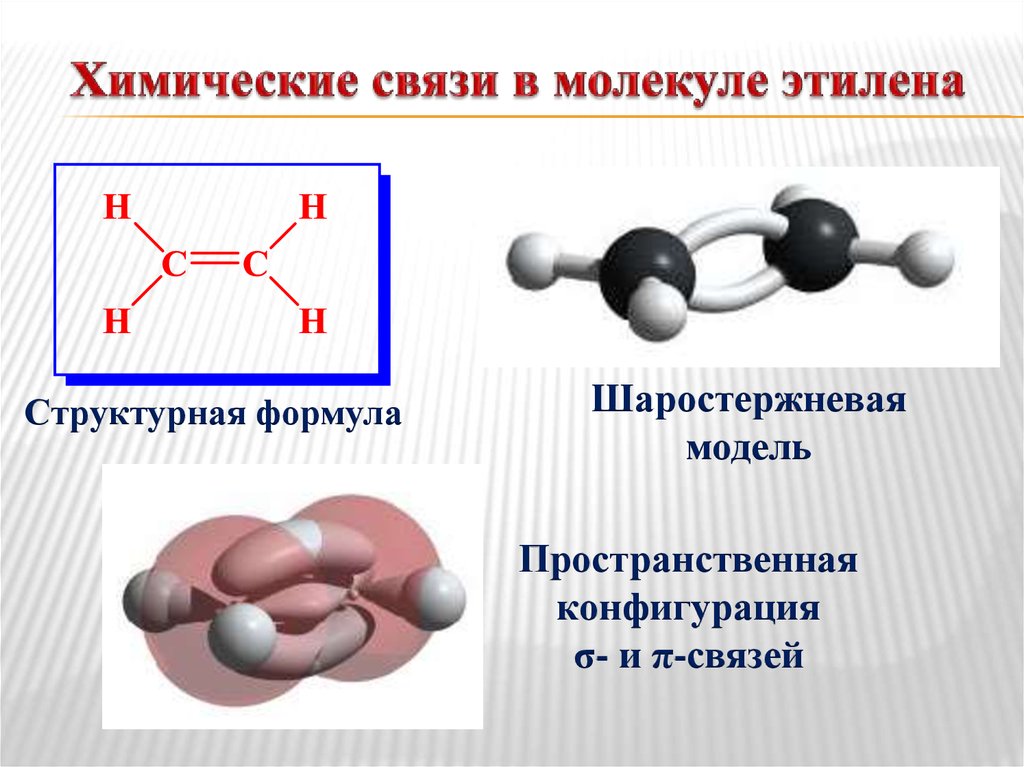
23. Химические связи в молекуле этилена
Структурная формулаШаростержневая
модель
Пространственная
конфигурация
σ- и π-связей
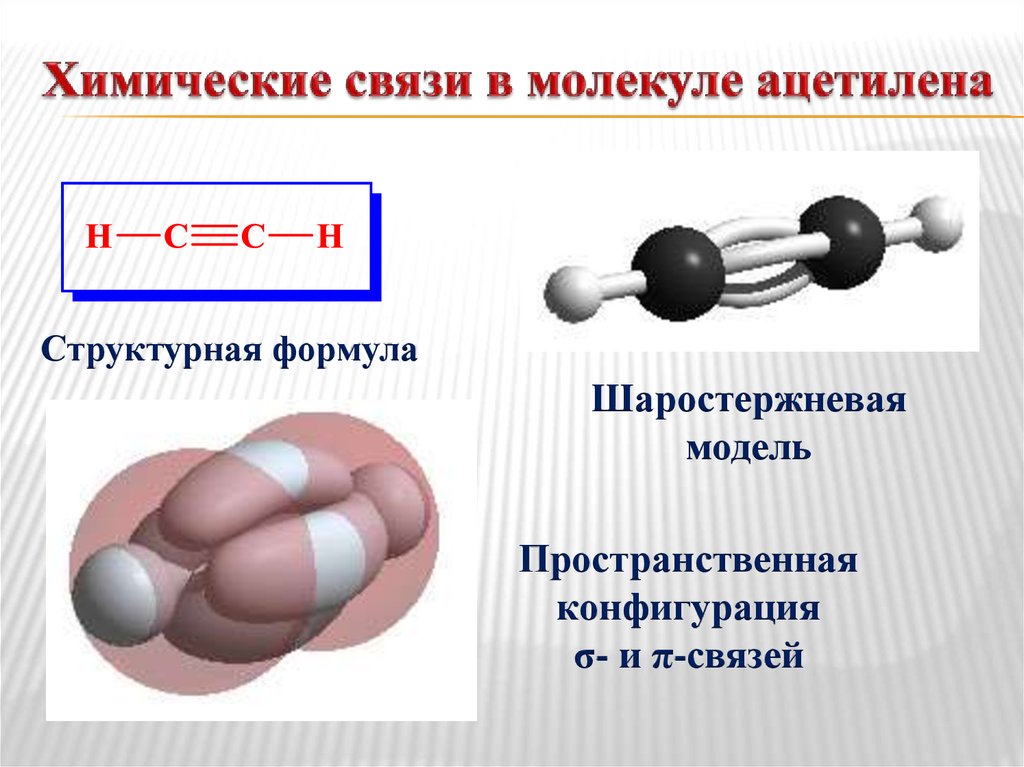
24. Химические связи в молекуле ацетилена
Структурная формулаШаростержневая
модель
Пространственная
конфигурация
σ- и π-связей
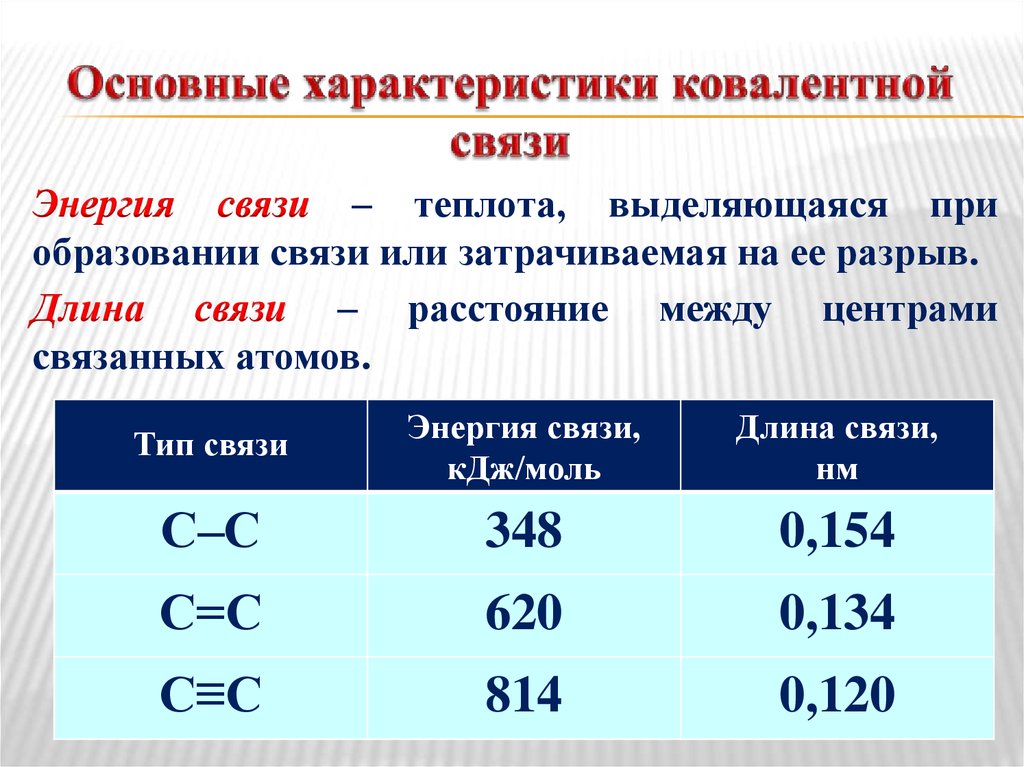
25. Основные характеристики ковалентной связи
Энергия связи – теплота, выделяющаяся приобразовании связи или затрачиваемая на ее разрыв.
Длина связи – расстояние между центрами
связанных атомов.
Тип связи
Энергия связи,
кДж/моль
Длина связи,
нм
С–С
348
0,154
С=С
620
0,134
С≡С
814
0,120
26. Полярность ковалентной связи
Электроотрицательность – это способность атома в молекулепритягивать электроны, участвующие в образовании
химической связи.
Лайнус
Полинг
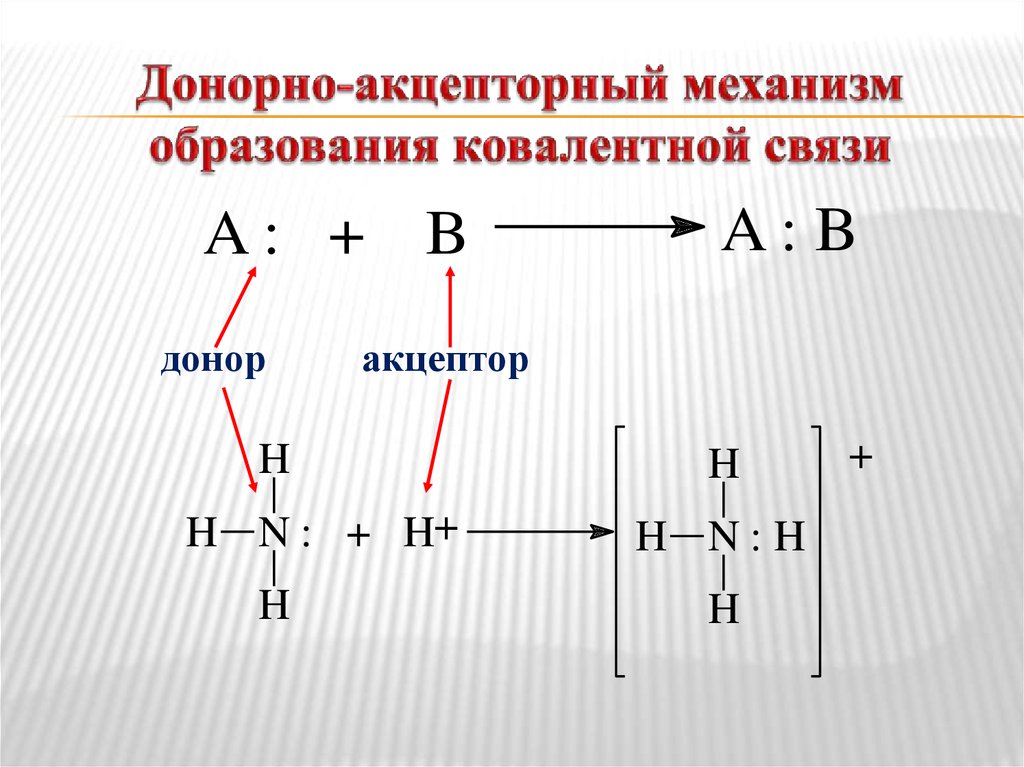
27. Донорно-акцепторный механизм образования ковалентной связи
A: + Bдонор
акцептор
H
H N : + H+
H
A: B
H
H N:H
H
+
28. Водородная связь
Характернадля
органических
соединений,
имеющих атомы водорода, связанные с сильно
электроотрицательными атомами (фтора, азота,
кислорода).
Энергия водородной связи — 12,5 - 20 кДж/моль
29. Сопряжение
Локализованная связь – это ковалентная связь,электронная пара которой находится в поле двух
ядер и охватывает только два атома.
Делокализованная связь – это ковалентная связь,
молекулярные орбитали которой охватывают
более двух атомов.
Сопряжение – это образование в молекуле
единого делокализованного электронного облака
в результате перекрывания р-орбиталей.
30. Условия, необходимые для образования сопряженных систем
Все атомы, участвующие в образованиисопряженной системы, находятся в sр2гибридизации;
рZ-орбитали всех атомов, образующих
сопряженную систему, перпендикулярны
плоскости -скелета, т. е. параллельны друг
другу.
31. π,π-Сопряжение
Наблюдается при чередовании в системепростых и кратных связей.
бутадиен-1,3
Гипотетическая структура
Выравнивание связей и
зарядов за счет сопряжения
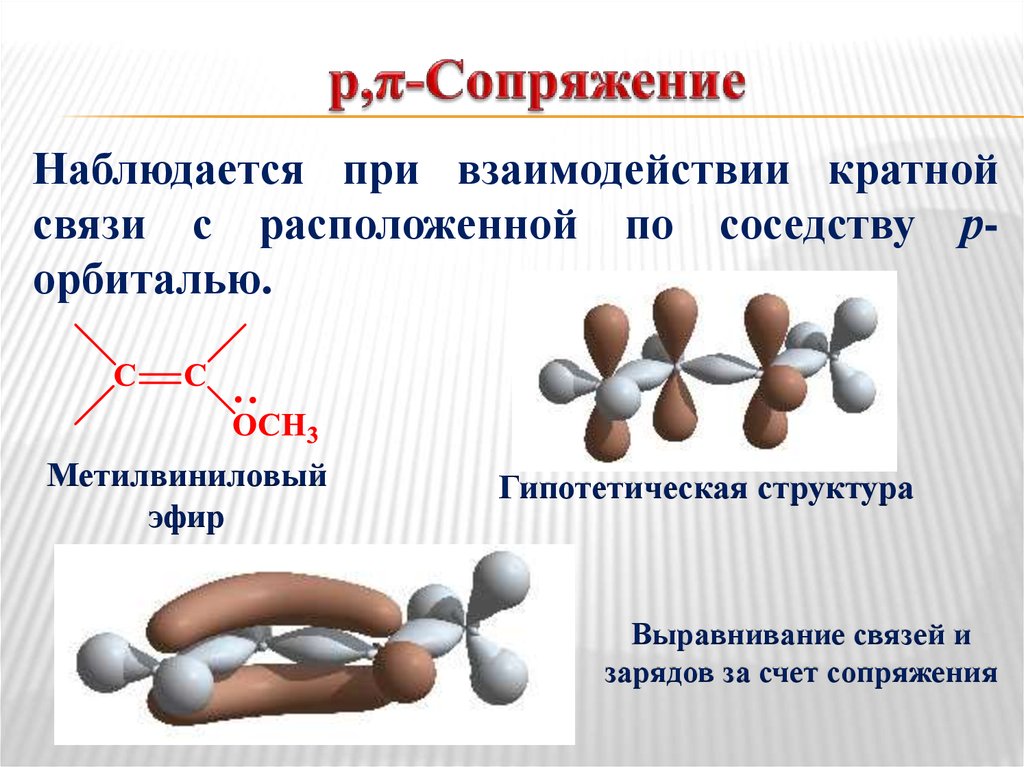
32. р,π-Сопряжение
Наблюдается при взаимодействии кратнойсвязи с расположенной по соседству рорбиталью.
Метилвиниловый
эфир
Гипотетическая структура
Выравнивание связей и
зарядов за счет сопряжения
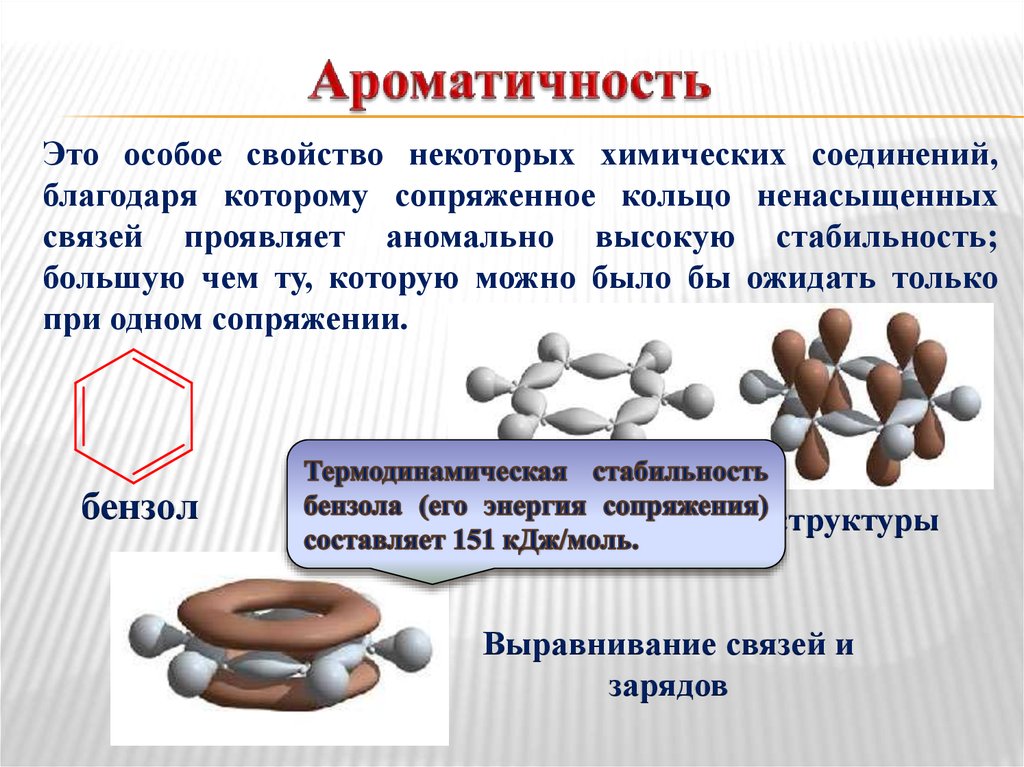
33. Ароматичность
Это особое свойство некоторых химических соединений,благодаря которому сопряженное кольцо ненасыщенных
связей проявляет аномально высокую стабильность;
большую чем ту, которую можно было бы ожидать только
при одном сопряжении.
бензол
Гипотетические структуры
Выравнивание связей и
зарядов
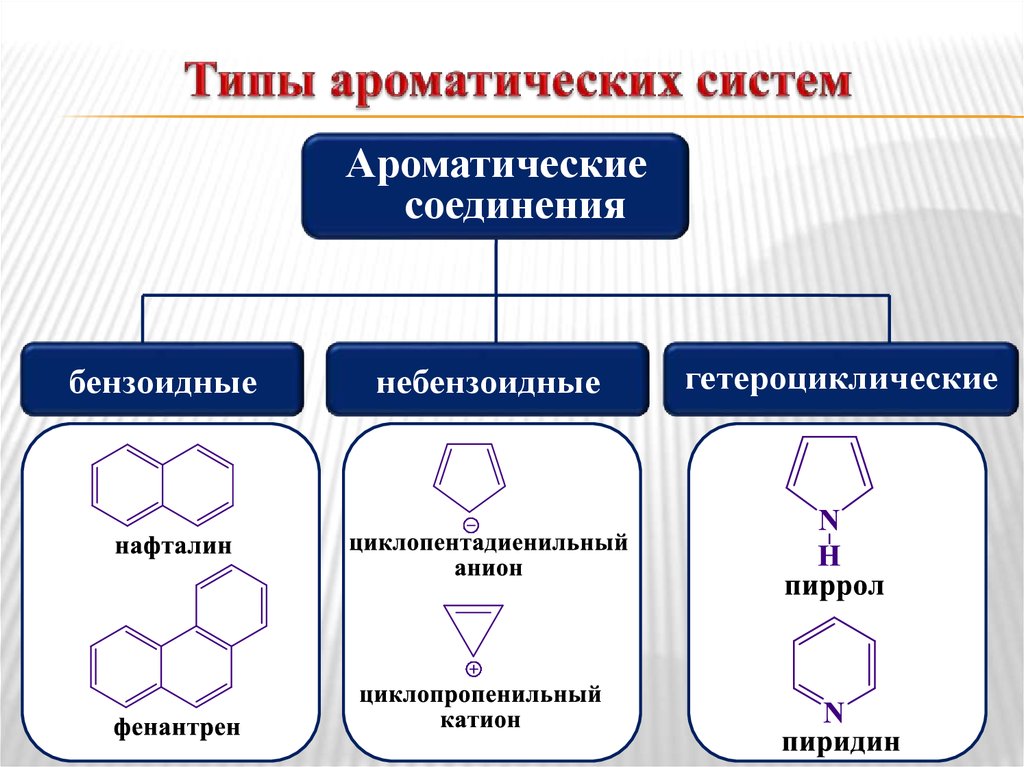
34. Типы ароматических систем
Ароматическиесоединения
бензоидные
небензоидные
гетероциклические
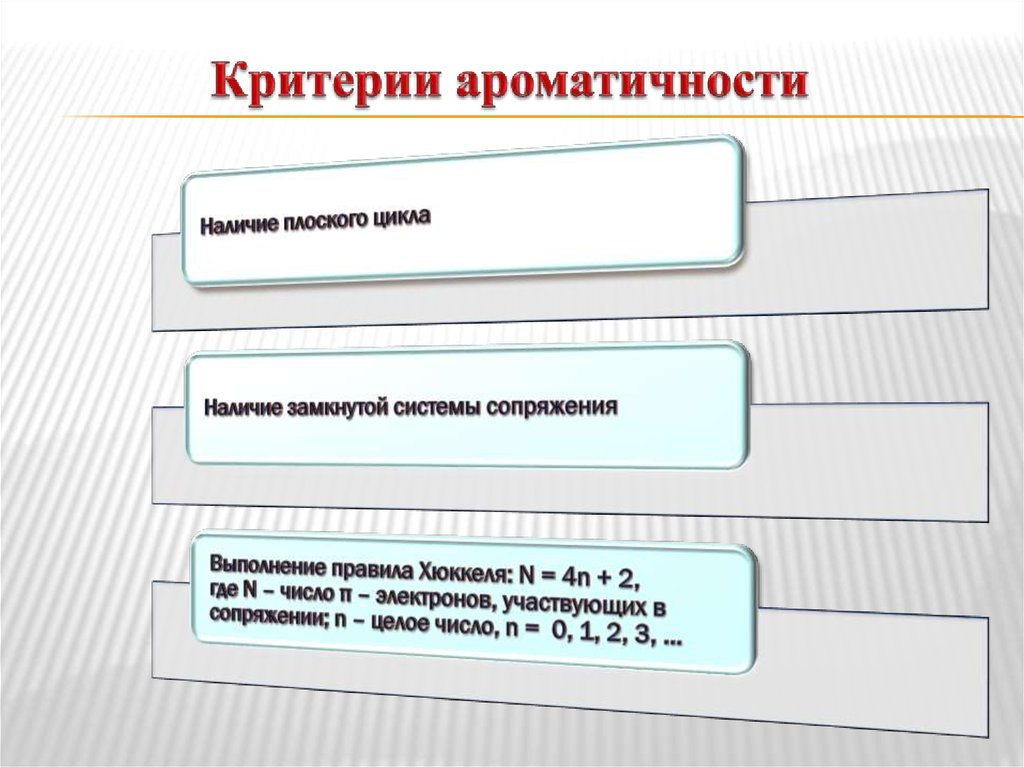
35. Критерии ароматичности
36. Взаимное влияние атомов в молекуле
Взаимное влияние атомов в молекулахпередается с помощью электронных и
пространственных эффектов:
Индуктивный эффект
Эффект поля
Мезомерный эффект
37. Индуктивный эффект
(I) передача электронного влияниязаместителя в результате смещения электронов -связей.
присутствует в любой полярной молекуле;
является затухающим (распространяется не более чем на
три связи).
СН3 СН2 Сl
-I-эффект
CH3 CH2 MgCl
+I-эффект
Заместитель, притягивающий электронную плотность -связи сильнее,
чем атом водорода, проявляет отрицательный индуктивный эффект (–I).
Заместитель, смещающий электронную плотность -связи от себя,
проявляет положительный индуктивный эффект (+I).
38. Эффект поля
передача электронного влияниязаместителя непосредственно через пространство
или через молекулы растворителя по механизму
диполь-дипольного взаимодействия.
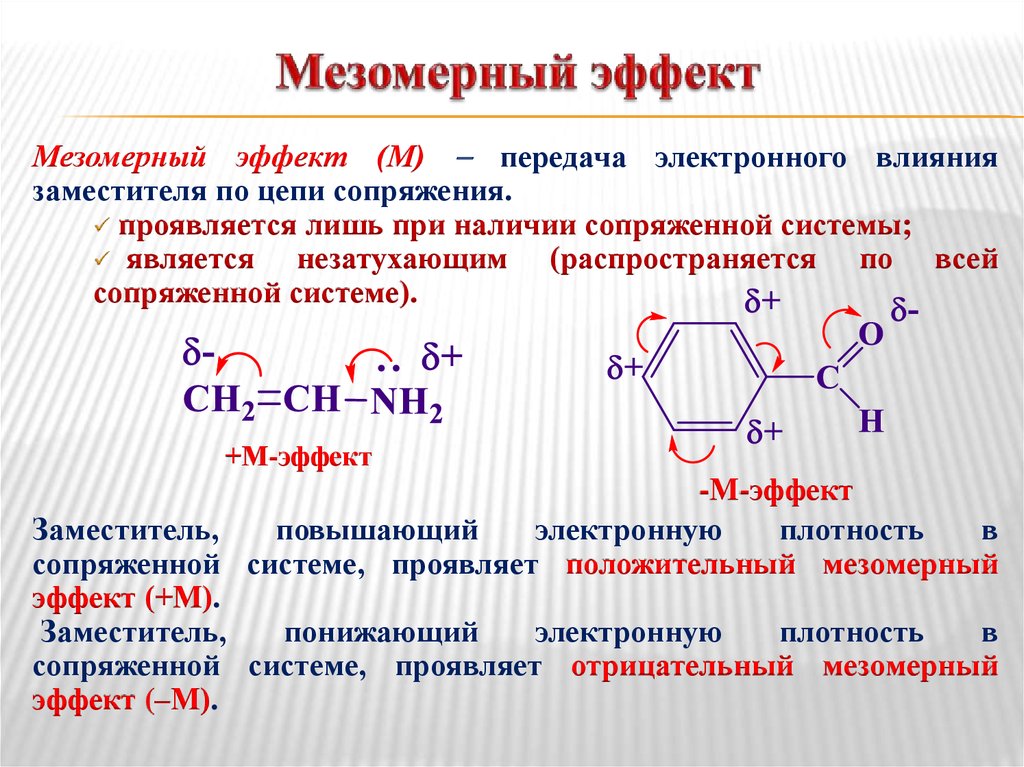
39. Мезомерный эффект
(М) передача электронного влияниязаместителя по цепи сопряжения.
проявляется лишь при наличии сопряженной системы;
является
незатухающим (распространяется по всей
сопряженной системе).
+М-эффект
-М-эффект
Заместитель,
повышающий
электронную
плотность
в
сопряженной системе, проявляет положительный мезомерный
эффект (+М).
Заместитель,
понижающий
электронную
плотность
в
сопряженной системе, проявляет отрицательный мезомерный
эффект (–М).
40. Электронодонорные и электроноакцепторные группы
Электронные эффектыЗаместитель
Суммарное
электронное
влияние
заместителя
индуктивный
мезомерный
Алкил- (R)
+I
-
электронодонор
−NH2, −NHR, −NR2,
−OH, −OR
-I
+M
+M > −I
электронодонор
Галогены
-I
+M
−I > +M
электроноакцептор
−NO2, −COOH,
−CN, −SO3H, >C=O
-I
-M
электроноакцептор



















 chemistry
chemistry








