Similar presentations:
Теория строения органических соединений А.М. Бутлерова
1. ТЕОРИЯ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ А.М. БУТЛЕРОВА
Основные положения:Атомы в молекулах соединены друг с другом в определенной
последовательности согласно их валентностям.
Последовательность соединения атомов в молекуле называется ее
химическим строением и отражается формулой строения
(структурной формулой).
Химическое строение можно устанавливать химическими
методами (в настоящее время используются также современные
физические методы).
Свойства веществ зависят от их химического строения.
По свойствам данного вещества можно определить строение его
молекулы, а по строению молекулы – предвидеть свойства.
Атомы и группы атомов в молекуле оказывают взаимное влияние
друг на друга.
2. ХИМИЧЕСКАЯ СВЯЗЬ
• Связь между атомами химических элементов (химическаясвязь) осуществляется взаимодействием внешних
(валентных) электронов, в большей или меньшей степени
удерживаемых положительно заряженными ядрами
связываемых атомов.
• Тип и свойства химической связи определяются
электpоотрицательностью элементов, участвующих в
ее образовании, и характером взаимодействия атомных
орбиталей.
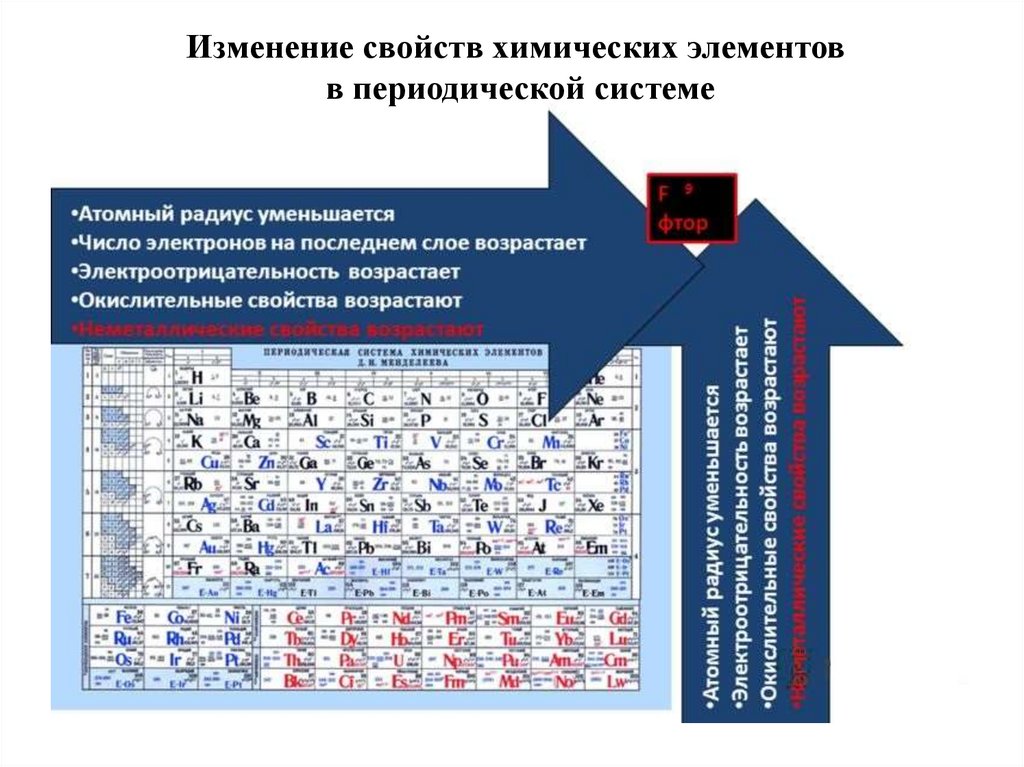
3. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
• Электpоoтрицательность - способность атомаудерживать внешние (валентные) электроны.
• Проявляется в химических связях как смещение
электронов связи в сторону более
электроотрицательного атома.
• Подчиняется периодическому закону: в периодах она
растет с увеличением номера элемента, а в главных
подгруппах – с его уменьшением.
4.
Изменение свойств химических элементовв периодической системе
5.
Электроотрицательность элемента не являетсяабсолютной константой!
Зависит от следующих факторов:
• эффективного заряда ядра атома, который может
изменяться под влиянием соседних атомов или групп
атомов (заместителей)
• типа атомных орбиталей
• характера гибридизации атомных орбиталей
6.
7.
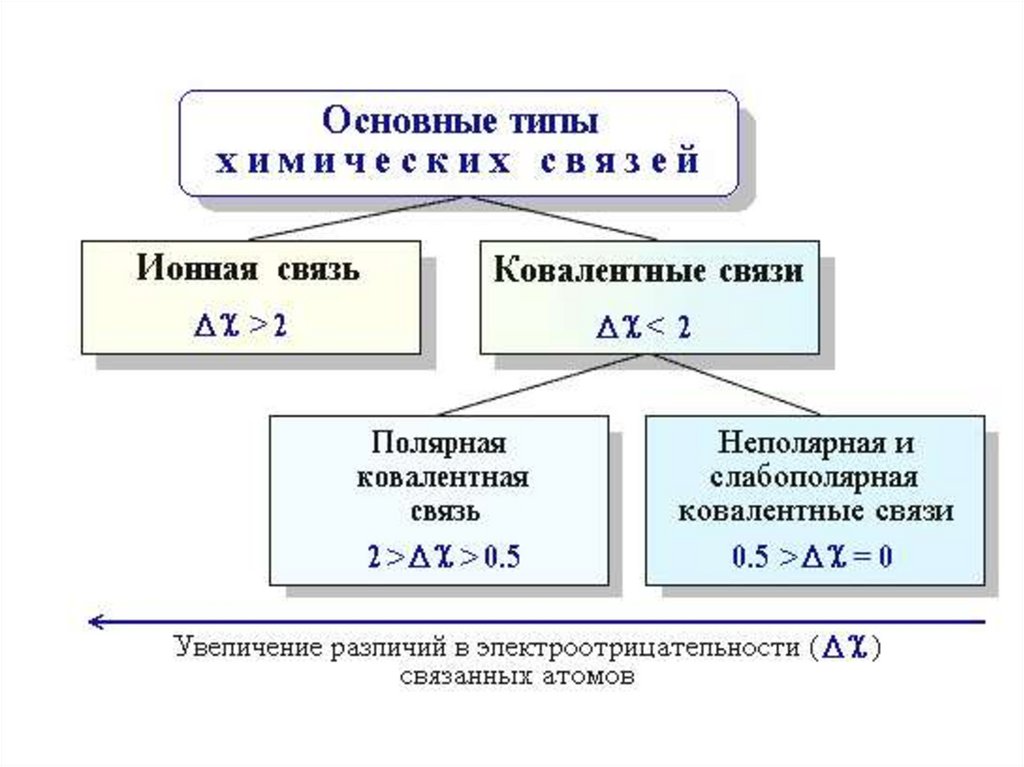
Ионная связь• Химическая связь, основанная на электростатическом
притяжении ионов, называется ионной связью.
Ионная связь не имеет пространственной направленности, так как
каждый ион связан с окружающими его противоионами.
Соединения с ионными связями:
• не имеют молекулярного строения
• образуют ионные кристаллические решетки
• представляют собой твердые вещества с высокими
температурами плавления и кипения,
• высокополярны,
• в водных растворах электропроводны
Соединений с чисто ионными связями практически не существует.
8.
Ковалентная связь• Связь, образованная путем обобществления пары
электронов связываемых атомов, называется
ковалентной
Возникает между атомами с относительно малыми различиями в
электроотрицательностях ( < 2), которые образуют химическую
связь за счет общей электронной пары:
H:H
H:C
C:C
C:O
Обозначают валентной чертой:
Cl Cl,
H CH3
Для ковалентных соединений характерно:
• молекулярное строение (молекулярные кристаллические решетки),
• относительно низкие температуры плавления и кипения.
• малая полярность,
• плохая растворимость в воде,
• их растворы не проводят электрический ток.
9. Свойства ковалентной связи
• Направленность• Насыщаемость
• Полярность
• Поляризуемость
Количественные характеристики ковалентной связи :
Энергия связи
увеличивается в ряду:
С C < С=С < C C
Длина связи
растет в ряду:
С С < C=C < C C
Дипольный момент связи ( )
= l q
l - длина связи,
q - эффективный заряд, который приобретают атомы при смещении
электронной плотности
10.
Неполярная ковалентная связь• Это
связь
между
атомами
с
практически
равной
электроотрицательностью (0,4 > = 0) и равномерным
(симметричным) распределением электронной плотности между
ядрами атомов.
Например:
H H
F F
Cl Cl
C C
Дипольный момент таких связей равен 0.
Связь С Н в предельных углеводородах (например, в СН4) считается
практически неполярной, т.к. = 2,5(С) 2,1(Н) = 0,4.
11.
Полярная ковалентная связь• Это связь между атомами с различной электроотрицательностью
(2 > > 0,5) и несимметричным распределением общей
электронной пары.
Электронная плотность такой связи смещена в сторону более
электроотрицательного атома, что приводит к появлению на нем
частичного отрицательного заряда , а на менее
электроотрицательном атоме - частичного положительного заряда :
C Cl
C O
C N
O H
C Mg
Направление смещения электронов обозначается также стрелкой:
C Cl
C О
C N
О Н
C Mg
Чем больше различие в электроотрицательности связываемых
атомов, тем выше полярность связи и больше ее дипольный момент.
12.
ПРИРОДА КОВАЛЕНТНОЙ СВЯЗИМолекулярные орбитали
n AO → n MO
Взаимодействие (перекрывание) АО двух (или более) атомов приводит к
образованию молекулярных орбиталей (МО), которые заселяются
обобществленными электронами, связывающими ядра атомов в
молекуле.
Молекулярная орбиталь – область наиболее вероятного пребывания
электрона в электрическом поле двух (или более) ядер атомов,
составляющих молекулу.
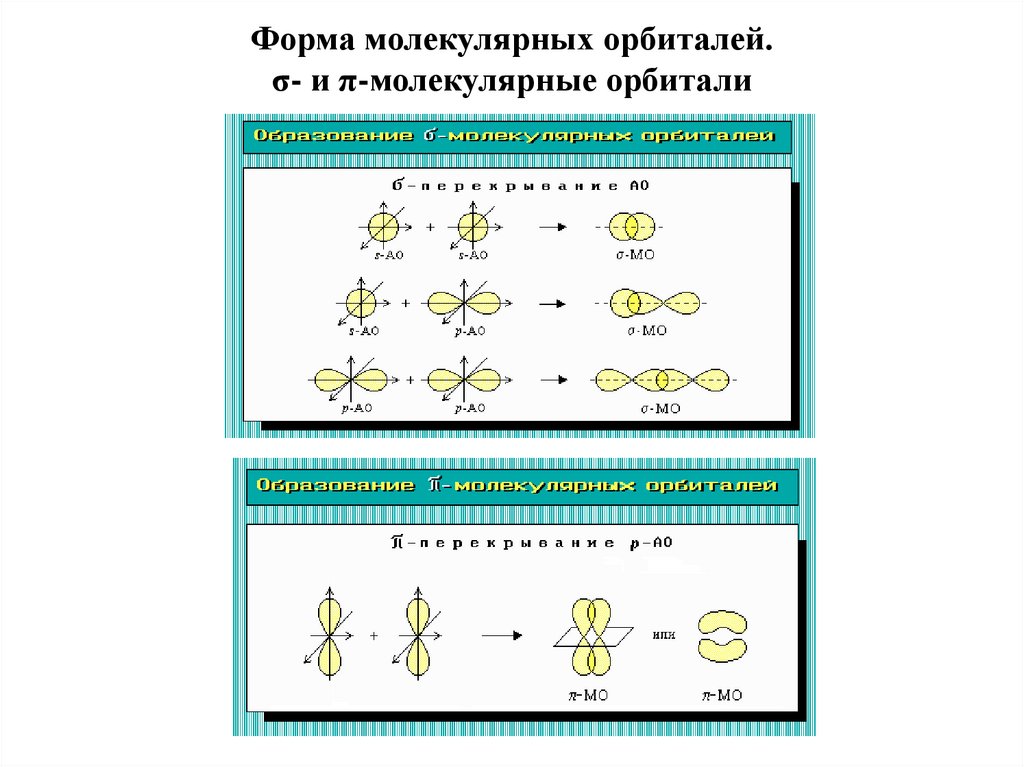
МО подразделяют по двум признакам:
-относительно уровня энергии и степени связывания атомов
-по типу (геометрии) перекрывания исходных АО (σ-МО и π-МО)
Заселение МО электронами происходит по тем же правилам, что и АО.
13.
Энергия молекулярных орбиталейПо уровню энергии МО подразделяются на 3 типа:
• связывающие (СМО), энергия которых ниже энергии исходных
АО, нахождение электронов на СМО уменьшает общую энергию
молекулы и определяет связывание атомов – химическую связь.
• разрыхляющие (РМО), энергия которых выше, чем у исходных
АО, в невозбужденном состоянии молекулы ее РМО вакантны, но
в ходе реакции эти орбитали могут принимать 1 или 2 электрона.
• несвязывающие (НСМО), энергия которых равна энергии АО
14.
Форма молекулярных орбиталей.σ- и π-молекулярные орбитали
15.
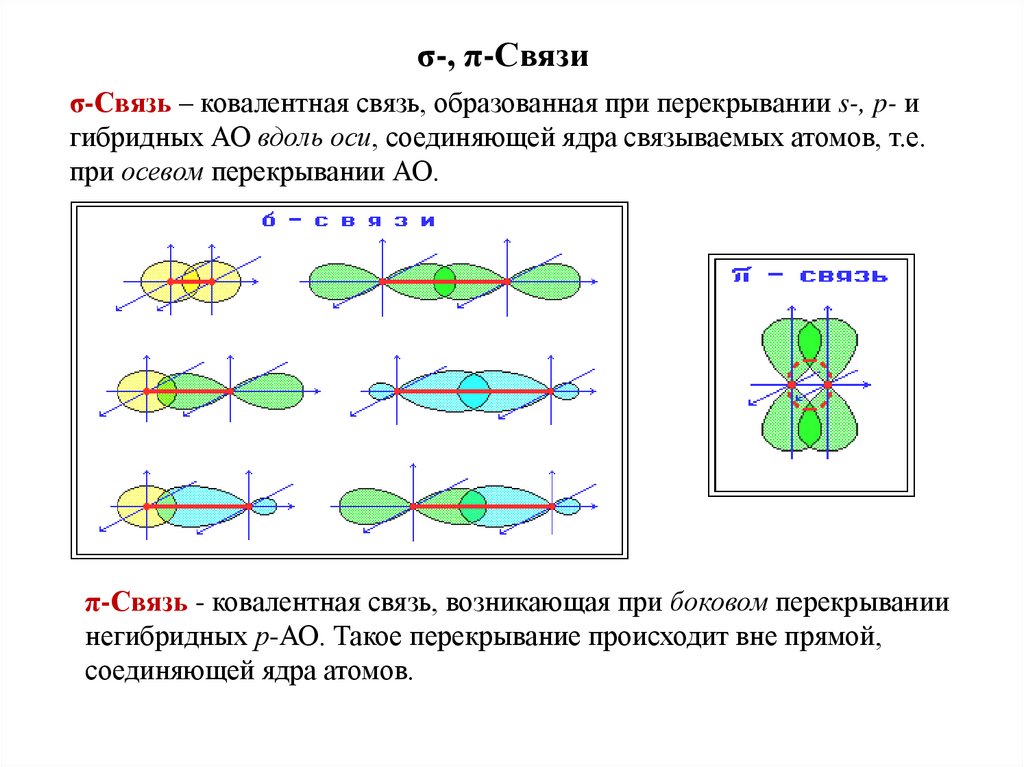
σ-, π-Связиσ-Связь – ковалентная связь, образованная при перекрывании s-, p- и
гибридных АО вдоль оси, соединяющей ядра связываемых атомов, т.е.
при осевом перекрывании АО.
π-Связь - ковалентная связь, возникающая при боковом перекрывании
негибридных р-АО. Такое перекрывание происходит вне прямой,
соединяющей ядра атомов.
16.
Характерные особенности σ- и π-связей1. σ-Связь прочнее π-связи. Это обусловлено более эффективным
осевым перекрыванием АО при образовании σ-МО и нахождением σэлектронов между ядрами.
2. По σ-связям возможно внутримолекулярное вращение атомов,
т.к. форма МО допускает такое вращение без разрыва связи.
Вращение по двойной (σ+ π) связи невозможно без разрыва π-связи.
3. Электроны на π-МО, находясь вне межъядерного пространства,
обладают большей подвижностью по сравнению с σ-электронами.
Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
17. Гибридизация атомных орбиталей
• Гибридизация АО – это взаимодействие (смешение) разных по типу, ноблизких по энергии атомных орбиталей данного атома с образованием
гибридных орбиталей одинаковой формы и энергии.
Основное и возбужденное состояния атома углерода:
2s
1s
2px
2py
1s22s22p2
Основное состоя ние
2pz
2s
1s
2px
2py
2pz
1s22s12p3
Возбужденное состоя ние
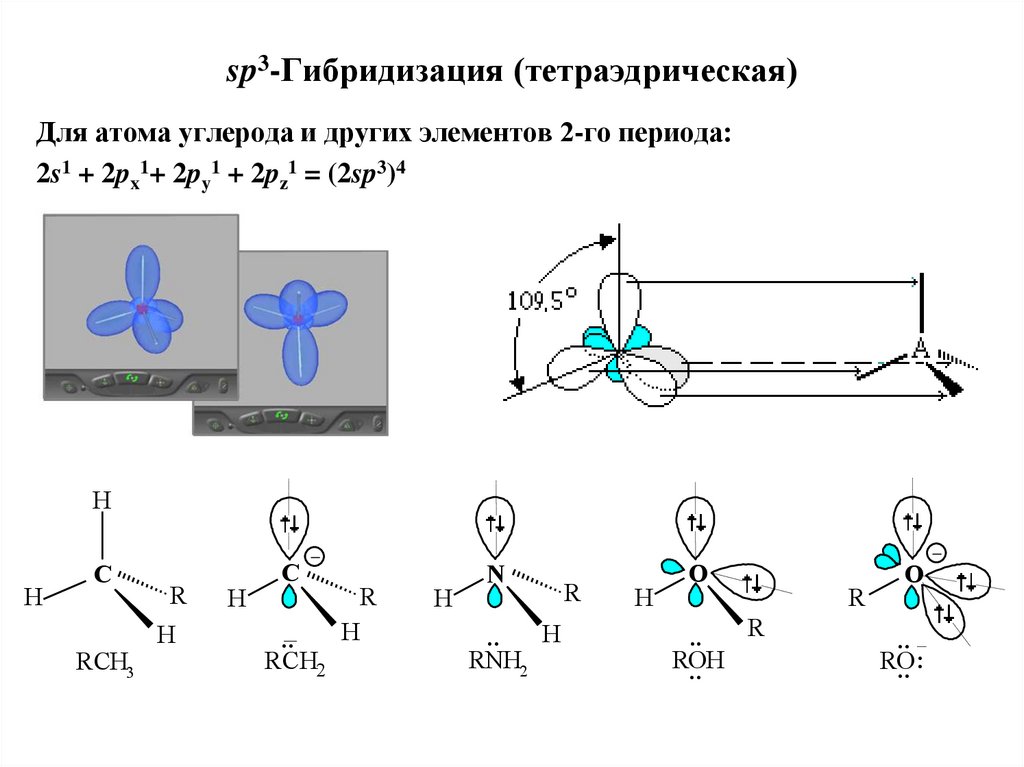
18. sp3-Гибридизация (тетраэдрическая)
Для атома углерода и других элементов 2-го периода:2s1 + 2px1+ 2py1 + 2pz1 = (2sp3)4
H
_
_
H
C
RCH3
R
H
H
C
H
.._
R CH2
R
H
N
H
..
RNH2
R
H
O
R
..
ROH
..
R
O
..
RO:
..
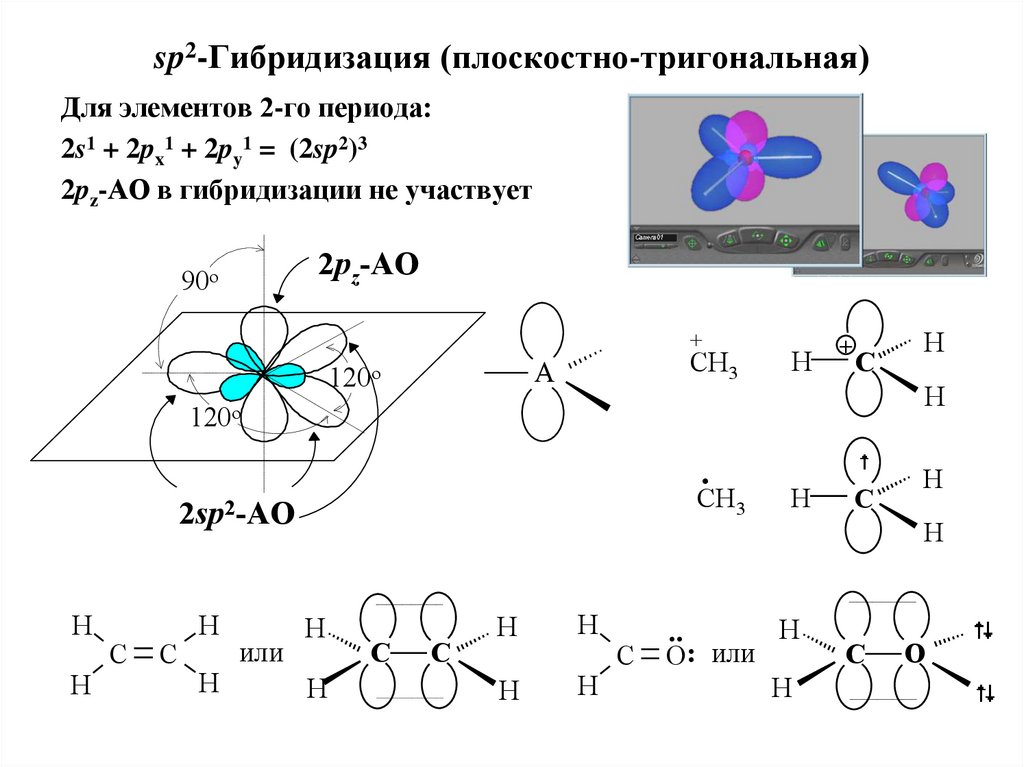
19. sp2-Гибридизация (плоскостно-тригональная)
Для элементов 2-го периода:2s1 + 2px1 + 2py1 = (2sp2)3
2pz-АО в гибридизации не участвует
2pz-AO
90o
+
CH3
A
120o
H
+
C
H
120o
.
CH3
2sp2-AO
H
H
C
C
H
H
или
H
H
C
C
H
H
H
H
C
H
H
H
..
O: или
H
C
H
H
C
O
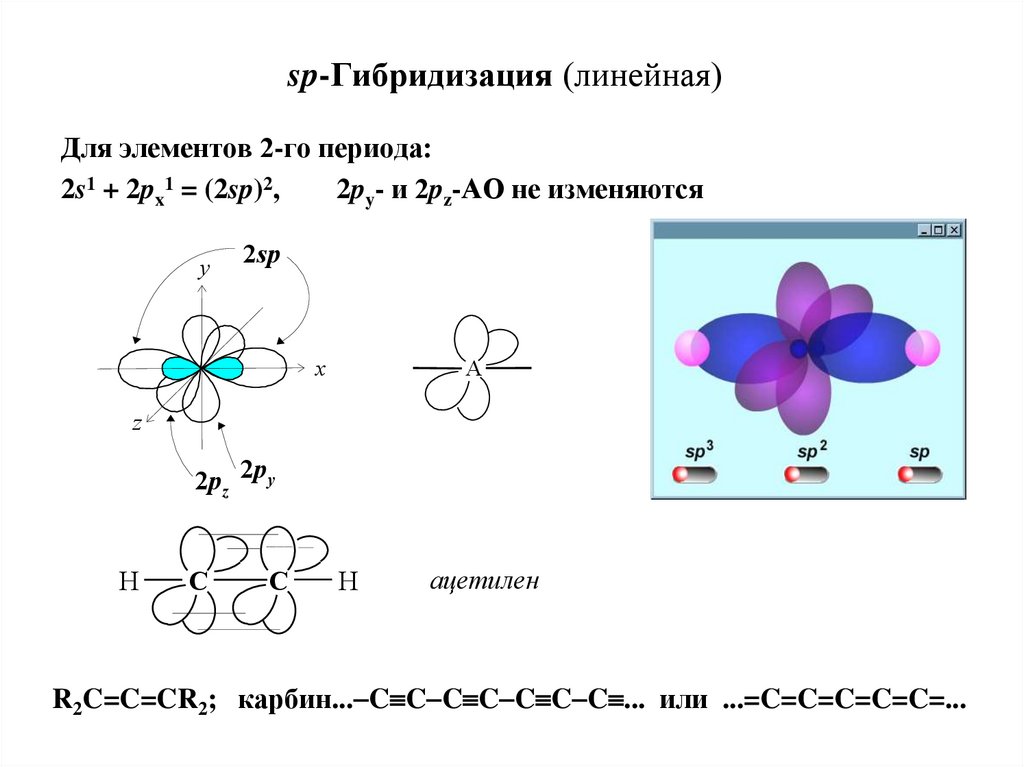
20. sp-Гибридизация (линейная)
Для элементов 2-го периода:2s1 + 2px1 = (2sp)2,
2py- и 2pz-АО не изменяются
y
2sp
x
A
z
2pz 2py
H
C
C
H
ацетилен
R2C=C=CR2; карбин... C C C C C C C ... или ...=C=C=C=C=C=...
21.
• Тип гибридизации атома в молекуле можно определить по сумме:Число атомов, связанных данным атомом +
число его неподеленных электронных пар.
Значение суммы
4
Тип гибридизации
sp3
3
sp2
2
sp
• Исключение составляют атомы с неподеленной парой, если они
связаны с sp2- или sp-атомом: при сумме 4 их гибридизация sp2
22. СРАВНЕНИЕ ХАРАКТЕРИСТИК ГИБРИДНЫХ ОРБИТАЛЕЙ
• Валентный угол:sp3 (109°28');
sp2 (120°);
sp (180°)
• Энергия орбитали уменьшается с увеличением вклада s-АО в
гибридизованное состояние:
sp3
(25% s-АО)
>
sp2
(33,3% s-АО)
>
sp
(50% s-АО)
23.
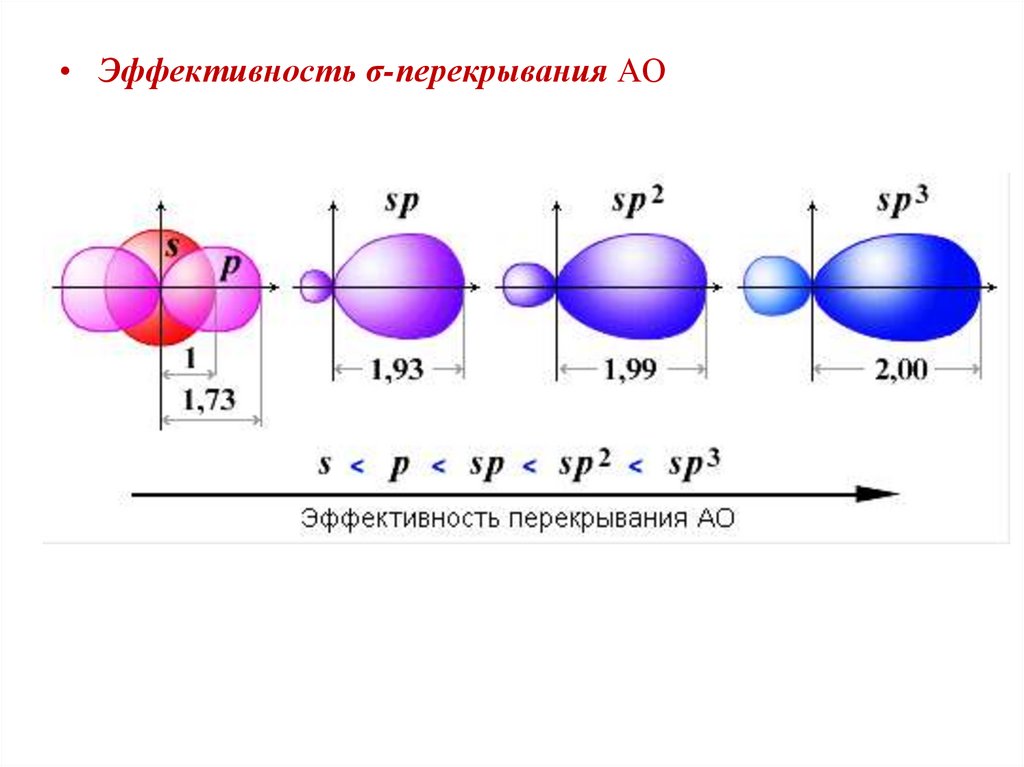
• Эффективность σ-перекрывания АО24.
• Электроотрицательность атома возрастает сувеличением доли s-АО в гибридной орбитали
C (sp3) 2,5 < C (sp2) 2,8 < C(sp) 3,2
Это связано c тем, что s-АО более электроотрицательна, чем
р-орбиталь (s-электроны прочнее связаны с ядром).
• Полярность связей С—Н увеличивается в той же
последовательности:
25. Механизмы образования ковалентной связи
• Обменный механизмA + В
А:В
• Донорно-акцепторный механизм
А +
:В А : В
Характеристики ковалентной связи не зависят от
способа ее образования
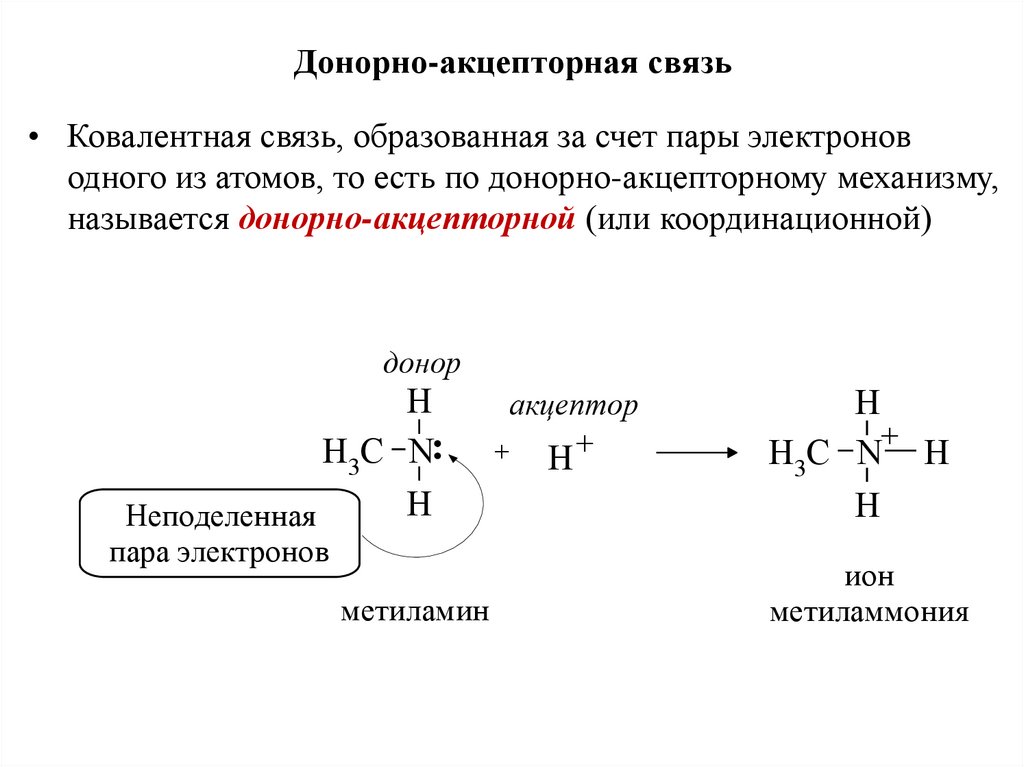
26. Донорно-акцепторная связь
• Ковалентная связь, образованная за счет пары электроноводного из атомов, то есть по донорно-акцепторному механизму,
называется донорно-акцепторной (или координационной)
донор
H
H3C N
H
Неподеленнаяя
пара электронов
метиламин
акцептор
+
+
H
H
+
H3C N H
H
ион
метиламмония
27. Кислоты и основания Льюиса
• Кислота Льюиса – это любое соединение, способное принятьпару электронов на незаполненную орбиталь, в результате
чего образуется ковалентная связь.
Кислота Льюиса – акцептор пары электронов.
• Основание Льюиса – любое соединение, которое обладает
несвязывающей (неподеленной) или слабосвязывающей парой
электронов (например, π-связи) и которое способно отдавать
эти электроны кислоте Льюиса.
Основание Льюиса – донор пары электронов
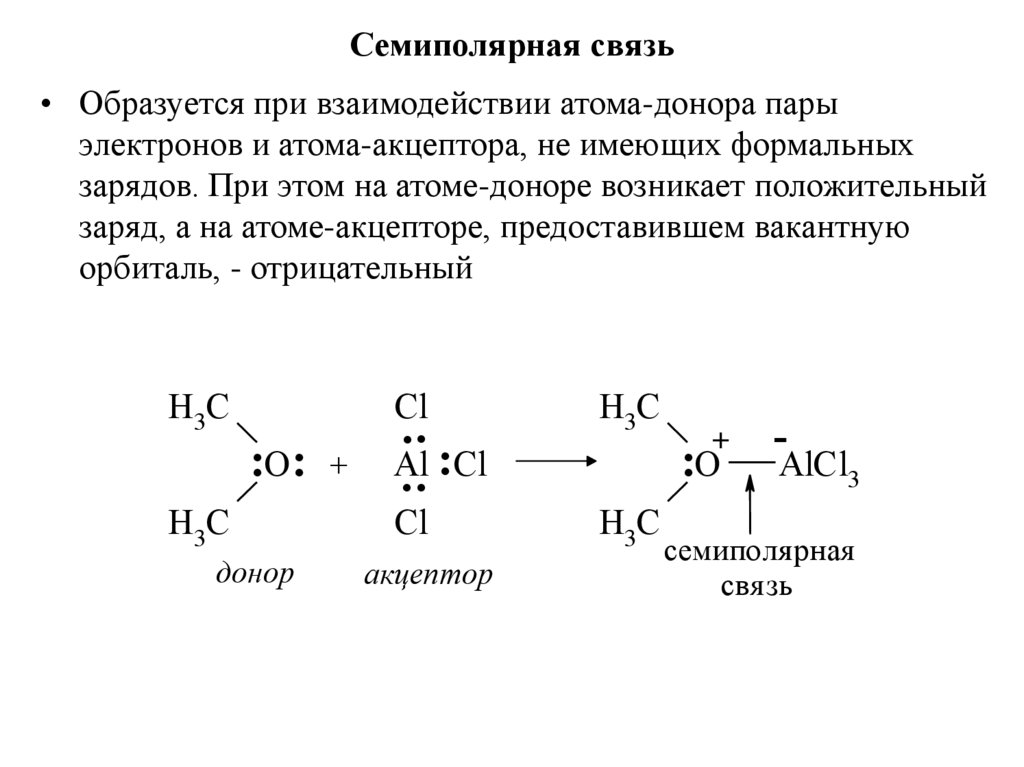
28. Сeмипoлярная связь
• Образуется при взаимодействии атома-донора парыэлектронов и атома-акцептора, не имеющих формальных
зарядов. При этом на атоме-доноре возникает положительный
заряд, а на атоме-акцепторе, предоставившем вакантную
орбиталь, - отрицательный
H3C
Cl
:O: +
H3C
донор
..
Al
.. :Cl
H3C
Cl
H3C
акцептор
+
:O
-
AlCl3
семиполяя рная
свя зь
29.
• Сочетание ковалентной и ионной связей называютсeмиполярной связью
К семиполярным связям относится также связь азоткислород в нитрогруппе NO2, входящей в состав азотной
кислоты, ее солей и органических нитросоединений RNO2:
30. Кратные связи
• Схема образования двойной связи2p-AO
H
R
H
C
C
H
H
H
C C
R
H
R
C
C
H
H
H
2sp2-AO
• Схема образования тройной связи
(pz-pz)
H
C
C
(py-py)
(sp-sp)
H
H
C
C
H
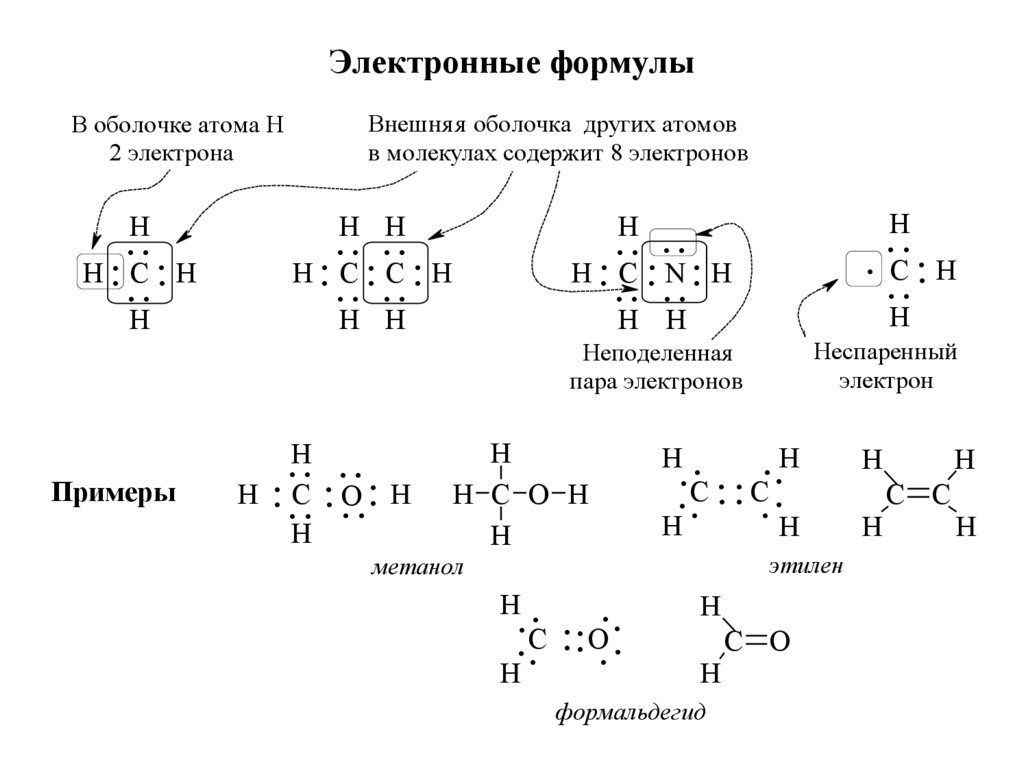
31. Электронные формулы
В оболочке атома Н2 электрона
H
..
H .. C .. H
..
H
Примеры
Внешня я оболочка других атомов
в молекулах содержит 8 электронов
H H
.. ..
H .. C .. C .. H
.. ..
H H
.H. . . .
H .. .C. .. O
. .. H
H
H
.. ..
H .. C .. N .. H
.. ..
H H
H
..
. C .. H
..
H
Неподеленная
пара электронов
Неспаренный
электрон
H
H C O H
H
H.
H
. . . ..
C
.C
. . . ..
H
H
этилен
метанол
H.
. .. ..
. O
.C
. . ..
H
H
C O
H
формальдегид
H
H
C C
H
H
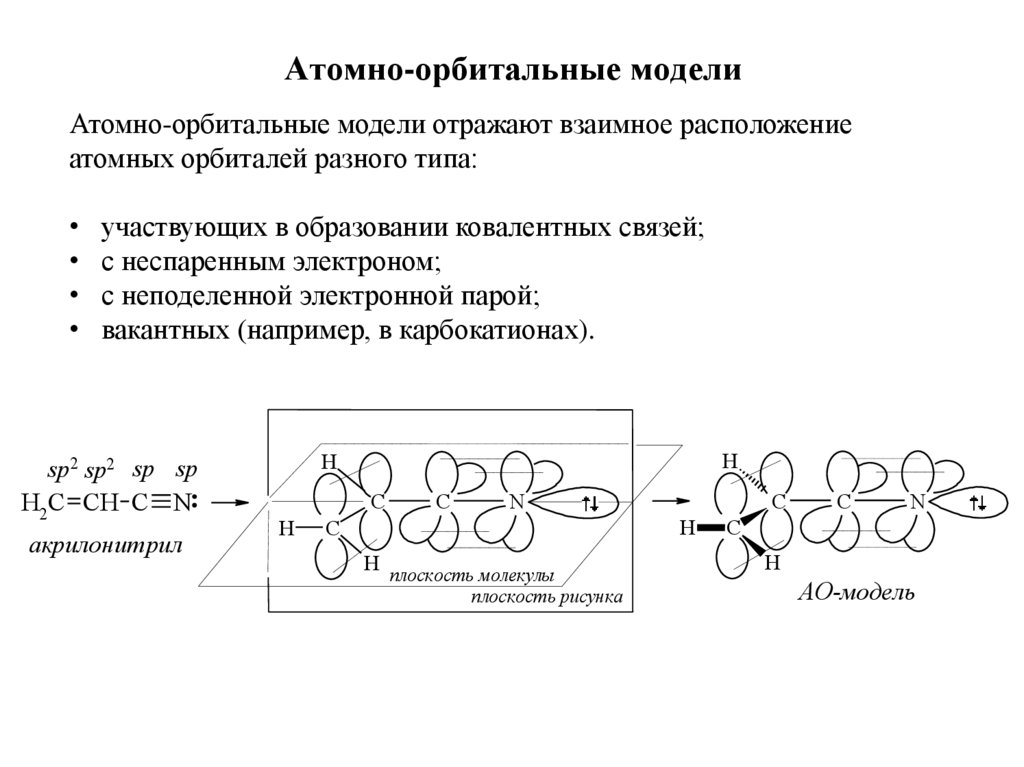
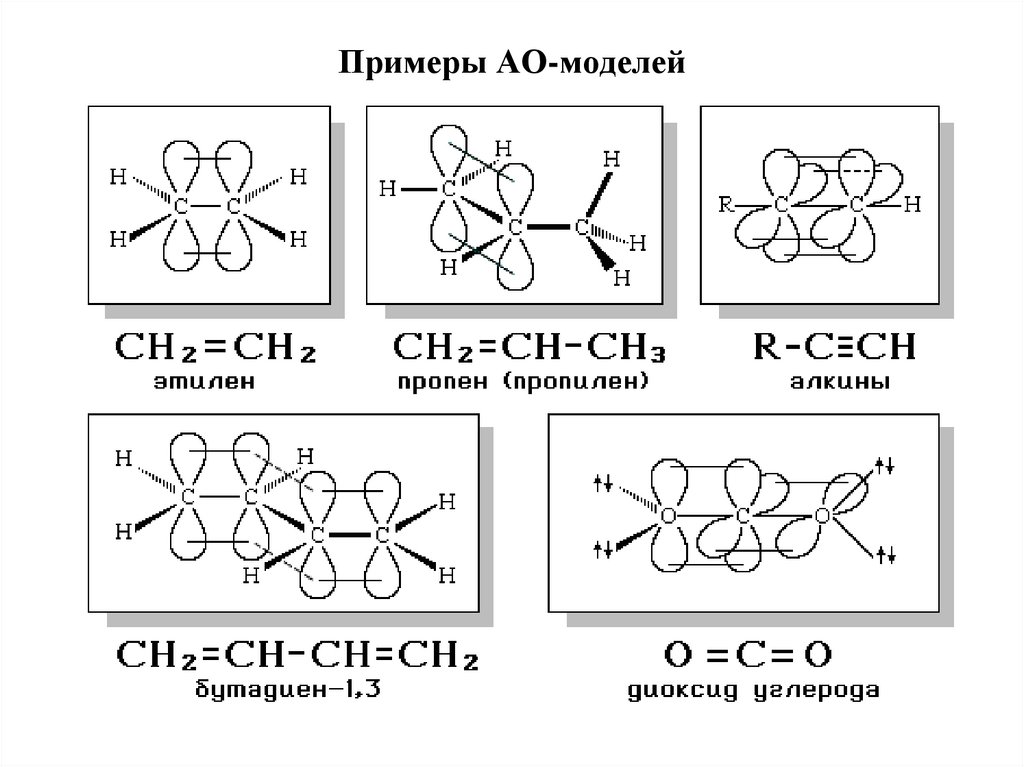
32. Атомно-орбитальные модели
Атомно-орбитальные модели отражают взаимное расположениеатомных орбиталей разного типа:
участвующих в образовании ковалентных связей;
с неспаренным электроном;
с неподеленной электронной парой;
вакантных (например, в карбокатионах).
sp2 sp2 sp sp
H2C CH C N
акрилонитрил
H
H
C
H
C
C
N
H
C
H
плоскость молекулы
плоскость рисунка
C
N
C
H
АО-модель
33. Примеры АО-моделей
34. Делокализованные связи
• Ковалентная связь считается локализованной, если ее электронная паранаходится в поле двух ядер и связывает только два атома.
Локализованные π-связи имеют молекулы, содержащие:
• изолированные кратные связи (разделённые двумя и более одинарными
связями). Например,
RCH=CH–CH2–CH=CH2, RC≡C–CH2–CH2–CH=CR2;
• единичные кратные связи R2C=CR2, RC≡CR;
• кумулированные (алленовые) двойные связи R2С=C=CR2.
35.
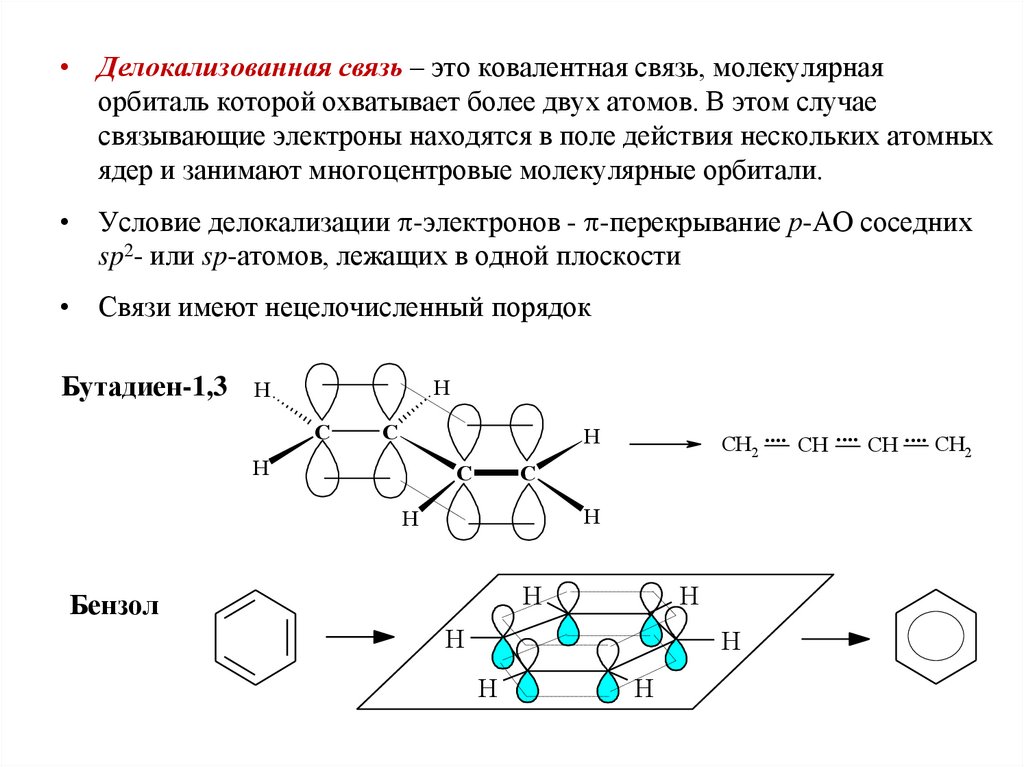
• Делокализованная связь – это ковалентная связь, молекулярнаяорбиталь которой охватывает более двух атомов. В этом случае
связывающие электроны находятся в поле действия нескольких атомных
ядер и занимают многоцентровые молекулярные орбитали.
• Условие делокализации -электронов - -перекрывание р-АО соседних
sp2- или sp-атомов, лежащих в одной плоскости
• Связи имеют нецелочисленный порядок
Бутадиен-1,3
H
H
С
C
CH2 .... CH .... CH .... CH2
H
H
C
C
H
H
H
Бензол
H
H
H
H
H
36.
Делокализованные связи характерны для молекул:• с кратными связями, чередующимися с одинарными
(сопряженными π-связями):
RCH=CH–CH=CHR, RC≡C–CH=CHR,
CH2=CH–CH=О (акролеин), C6H6 (бензол)
• С кратными связями, соединёнными с атомом, имеющим неподелённую
пару электронов (I), отрицательный заряд (II), неспаренный электрон (III)
или вакантную орбиталь (IV):
CH2=CH–O–CH=CH2 (I)
CH2=CH–CH2• (III)
CH2=CH–CH2¯ (II)
CH2=CH–CH2+ (IV)
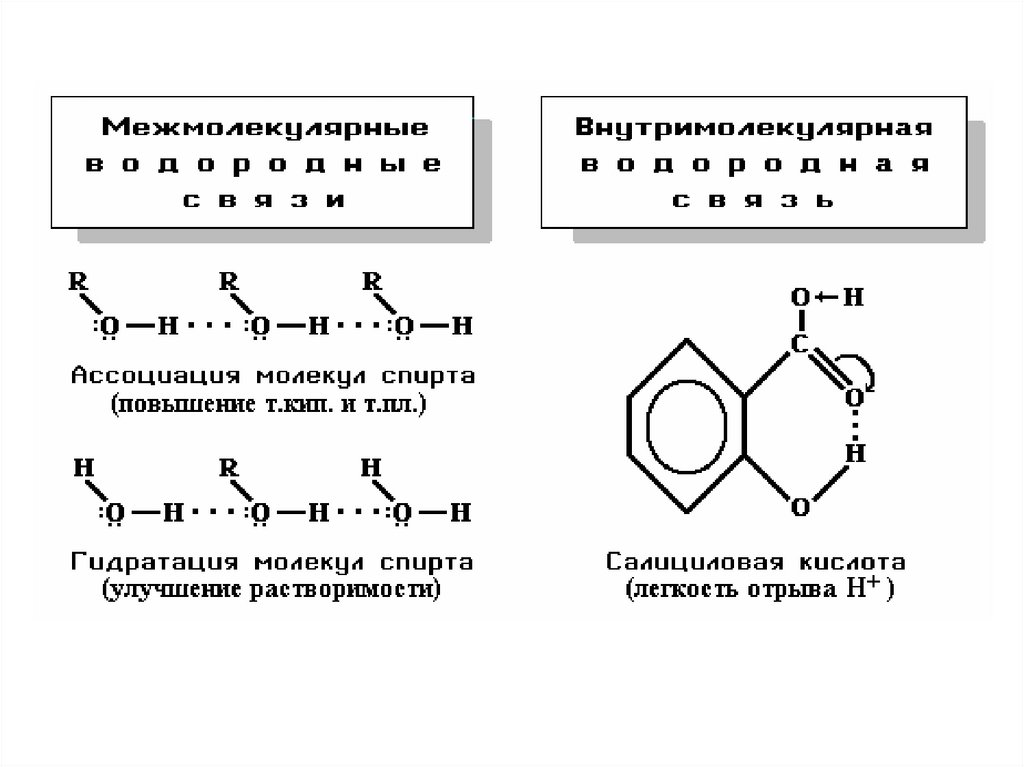
37. Водородные связи
Атом водорода, связанный с сильно электроотрицательным элементом(азотом, кислородом, фтором и др.), испытывает недостаток электронов и
поэтому способен притягивать неподеленную пару электронов другого
электроотрицательного атома этой же или другой молекулы. В результате
возникает водородная связь (Н-связь).
O
O
H . . . :O
Длина свя зи, нм:
0,107
O
Энергия свя зи:
H . . . :O C
O H . . . :N H
0,166
H . . . O
25 кДж/моль
N
H . . . O
10 кДж/моль
38.
39. Электронные эффекты заместителей
• Электронные эффекты – смещение электронной плотности вмолекуле, ионе или радикале под влиянием заместителей
• Заместители подразделяются на
-электронодонорные
-электроноакцепторные
• Электронодонорные заместители – атомы или атомные
группировки, повышающие электронную плотность на
остальной части молекулы
• Электроноакцепторные заместители - атомы и группы
атомов, понижающие электронную плотность на связанном
с ним углеводородном фрагменте
40. Индуктивный эффект (I-эффект)
• Индуктивный эффект - смещение электронной плотности поцепи -связей, которое обусловлено различиями в
электроотрицательности атомов
Направление смещения электронной плотности σ-связей обозначается
прямыми стрелками (по линии связи) и символами частичных зарядов
(δ+ или δ–), индуцируемых заместителем:
+
+
+
СН3 CH2 CH2 X
СН3 CH2 CH2 Y
( >> >> )
I-эффект быстро ослабевает с удалением от заместителя и через тричетыре связи в цепи становится практически равным 0
41. –I-эффект
• Индуктивный эффект называют отрицательным(–I), если заместитель уменьшает электронную плотность на
атоме углерода, с которым связан этот заместитель, т.е.
проявляет электроноакцепторные свойства.
• Заместитель приобретает частичный отрицательный заряд
(δ-), а атом углерода - частичный положительный заряд (δ+)
H
H
H
4
3
H
H
C
C
H
2
C
H
H
1
C
H
Br
(-I-эффект атома брома)
42.
-I-эффект проявляют:• -F, -Cl, -Br, -OH, -NH2, -NO2, >C=O, -COOH и др.,
• ненасыщенные группировки (например, -СH=CHR)
• катионы (-СН2+, -ОН2+, -NH3+).
В порядке ослабления –I-эффекта следующие заместители
можно расположить в ряд:
-N+(CH3)3 > -NO2 > -CN > -CO > -COOR > -F > -Cl > -Br > -I >
> -OH > -NH2 > H
43. Правила определения величины -I-эффекта
• Величина -I-эффекта растет с увеличением положительногозаряда заместителя:
+
-OR < -OR2
+
-NR2 < –NR3
• -I-эффект тем сильнее, чем больше электроотрицательность
соответствующего гетероатома:
NR2 < -OR < -F;
-F > -Cl > -Br > -I;
-CR=NR < -CR=O
• Непредельные заместители вызывают -I-эффект, который
увеличивается с ростом степени ненасыщенности
заместителя:
-CR=CR2 < -CR=CR-CH=CH2 < -C6H5 < -C≡CR;
-CR=NR < -C≡N
44. +I-эффект
• Индуктивный эффект называется положительным (+I), еслизаместитель увеличивает электронную плотность на атоме
углерода, индуцируя на нем частичный отрицательный заряд δ-,
сам при этом приобретая заряд δ+
+I-эффект проявляют:
• металлы (-Mg-, -Li и др.),
• алкильные группы (-CH3, -C2H5)
• анионы (-СН2 , -О ).
+I-эффект алкильных групп обусловлен суммарным действием
нескольких слабополярных С Н-связей (С Н ).
45. Правила определения величины +I-эффекта
• Величина +I-эффекта растет с увеличением отрицательного зарядазаместителя
-OH < -O-SH < -S• +I-эффект заместителя тем сильнее, чем меньше
электроотрицательность соответствующего гетероэлемента:
- Li > - BeR > - BR2
- Na > - MgR > - AlR2 > - SiR3
• Алкильные группы проявляют относительно слабый
+I-эффект, обусловленный суммарным действием слабополярных
связей С–Н (Сδ––Нδ+). C увеличением числа С–Н-связей +I-эффект
возрастает в ряду:
-СН3 < -CH2-CH3 < -CH(CH3)2 < -C(CH3)3
46. Мезомерный эффект (М-эффект)
Эффект, проявляющийся в смещении электронной плотностиделокализованной (сопряженной) -системы, называют
мезомерным или эффектом сопряжения
• Мезомерный эффект - передача электронного влияния
заместителей по сопряженной -системе
М-эффект отмечается лишь в том случае, если заместитель связан c
sp2- или с sp-гибридизованным атомом и сам является участником
сопряженной системы.
Заместитель может вносить в систему сопряжения -связь (>C=C<,
-С=О, >С=NН, -C С -C N и др.), неподеленную пару электронов
гетероатома (галогены, группы -NH2, -NHR, -NR2, -OH, -OR и др.),
вакантную или заполненную одним, либо двумя электронами рорбиталь
47. +М-эффект
• Заместители, повышающие электронную плотность в сопряженнойсистеме, проявляют положительный мезомерный эффект и
являются электронодонорными.
+М-эффектом обладают заместители, содержащие атомы с
неподеленной парой электронов или целым отрицательным зарядом,
и способные к передаче пары электронов в общую сопряженную
систему:
-O-, -OH, -OR,
-NH2, -NHR, -NR2,
-S-, -SH, -SR,
-F, -Cl, -Br, -I
48. Правила определения величины +М-эффекта
• Заместители, содержащие атомы с большейэлектроотрицательностью, обладают меньшим
+М-эффектом:
-NR2 > -OR
• +М-эффект галогенов изменяется в следующем ряду:
-F > -Cl > -Br > -I
• Отрицательно заряженные группы проявляют наибольший
+М-эффект:
-О-> -OR > -О+R2
49. М-эффект
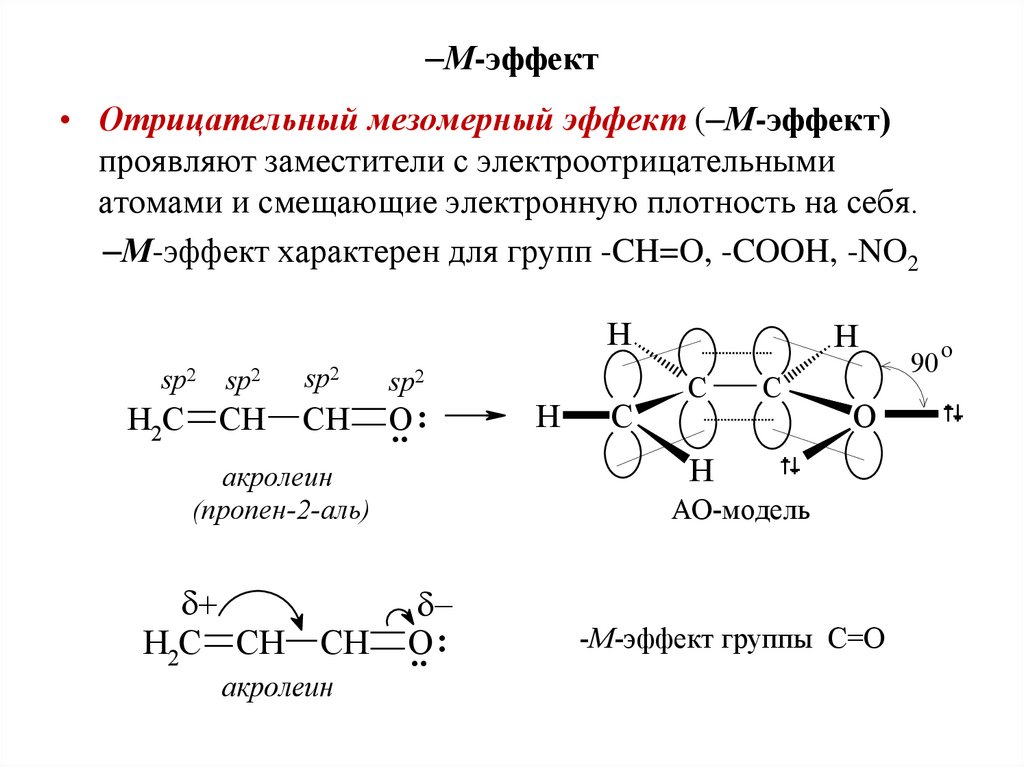
М-эффект• Отрицательный мезомерный эффект ( М-эффект)
проявляют заместители с электроотрицательными
атомами и смещающие электронную плотность на себя.
М-эффект характерен для групп -CH=O, -COOH, -NO2
H
sp2 sp2
H2C
CH
sp2
sp2
CH
O
.. :
CH
акролеин
C
C
C
O
H
акролеин
(пропен-2-аль)
H2C CH
H
H
АО-модель
O
.. :
-М-эффект группы С=О
90
o
50. Правила определения величины -М-эффекта
• Заместители, содержащие атомы с большейэлектроотрицательностью, обладают большим
–М-эффектом:
-С=О > -CR=NR > -CR=CR2
• При наличии положительного заряда –М-эффект
усиливается:
-CR=N+R2 > -CR=NR
• – М-эффект усиливается с увеличением степени
ненасыщенности:
-C≡N > -CR=NH
51. Определение знака М-эффекта
• – М-эффект проявляется, если электроотрицательныйатом связан с другим атомом кратной связью, и последний
не имеет неподеленной пары электронов
• +М-эффект проявляется, если электроотрицательный
гетероатом, имеющий неподеленную пару электронов,
связан с сопряженной -системой одинарной σ-связью
O :
C ..
H
бензальдегид
-М-эффект группы С=О
..
O
.. H
фенол
+М-эффект группы -ОН
52. Эффект сверхсопряжения
• , - сопряжениеH
H
C
H
H2 C CH CH3
C
пропилен
C
H
• , р-сопряжение
H
H
.
H3 C CH CH3
H
C
изопропил-радикал
C
H
H
увеличение устойчивости свободных радикалов в ряду:
. CH < . CH CH < . CH(CH ) < . C(CH )
2
3
3 2
3 3
3
увеличение устойчивости карбокатионов в ряду:
+
+
+
+
CH3 < CH2 CH3 < CH(CH3)2 < C(CH3)3
C
H
H
H
H
53. Электронные эффекты некоторых заместителей
ЗаместительЭлектронные эффекты
Индуктивный
Мезомерный
Суммарный
эффект
Алкильные
группы (R)
+I
слабый +М
(если есть Н-связи, способные
к сверхсопряжению)
донор
NH2, NHR,
NR2
I
+M (больше, чем I)*
(*если связан с sp2 атомом)
донор*
OH
I
+M (больше, чем I)*
донор *
OR
I
+M (больше, чем I)*
донор *
Галогены
I
+M (меньше, чем I)*
акцептор
NO2
I
M
акцептор
>C=O
I
M
акцептор
СOOH
I
M
акцептор
SO3H
I
M
акцептор
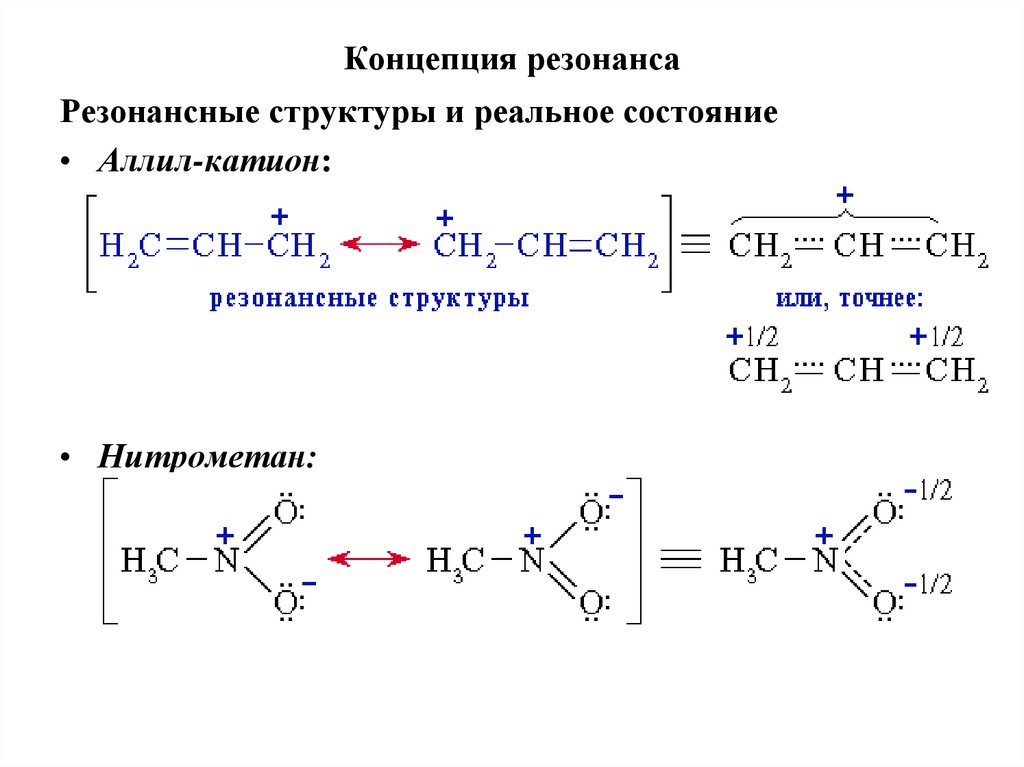
54. Концепция резонанса
Резонансные структуры и реальное состояние• Аллил-катион:
• Нитрометан:
55.
Наименьшей энергией обладают такие резонансныеструктуры сопряженной системы, которые:
• включают наибольшее число π-связей,
• имеют отрицательный заряд на наиболее
электроотрицательном атоме, а положительный – на
наименее электроотрицательном,
• отличаются наибольшим расстоянием между
одноименными зарядами и наименьшим между
разноименными.
56.
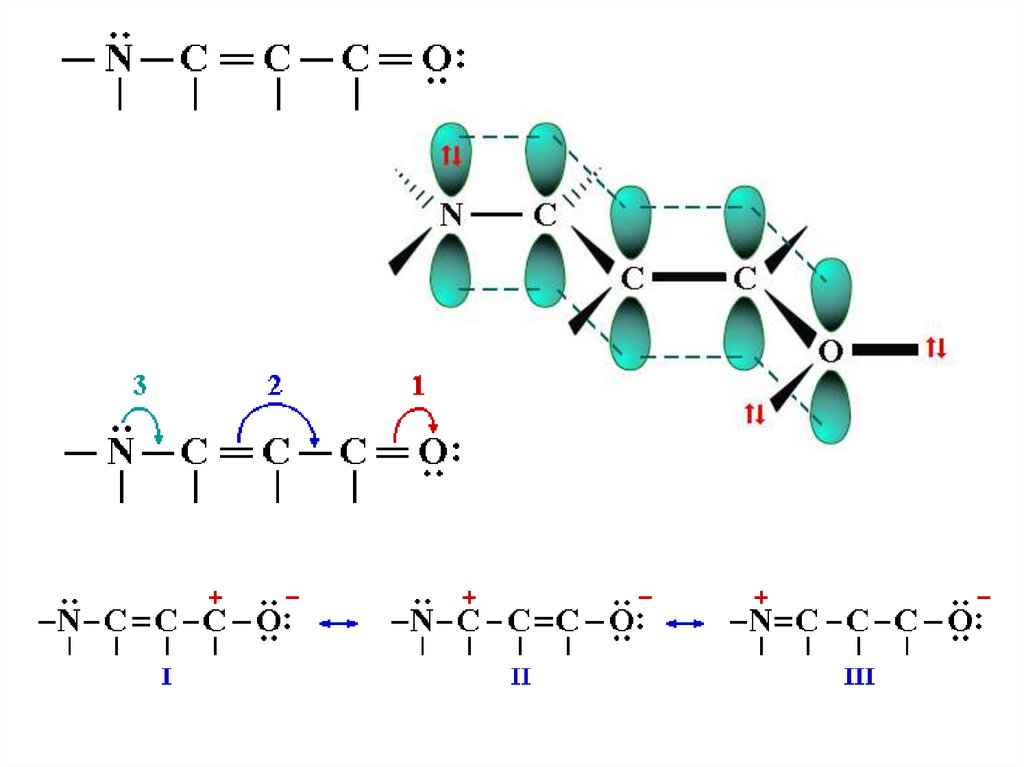
Вклад резонансных структур в основное состояние акролеинауменьшается в ряду:
1 > 2 > 3 >> 5 > 4 >> 6
57. Резонансные структуры
• Установите, какой тип сопряжения (π,π- или р,π-) реализуетсяв рассматриваемой частице, используя ее атомноорбитальную модель. Это позволит определить, какие атомы
входят в π-систему, и могут ли n-электроны гетероатома
участвовать в сопряжении.
• Исходя из электроотрицательности атомов, определите
направление смещения электронов в π-системе и покажите
это смещение изогнутыми стрелками, отражающими
положительный или отрицательный М-эффект заместителя.
• Изобразите резонансные структуры, придерживаясь
"указаний", даваемых стрелками смещения электронов, и
соблюдая правило октета.
58.
59. Пространственные (стерические) эффекты
Стерические эффекты определяют доступность реакционных центров вмолекуле.
• Объемные группы могут менять направление и механизм реакции.
Реакция с водным раствором NaOH двух однотипных соединений СН3Br и
(СН3)3СBr:
60.
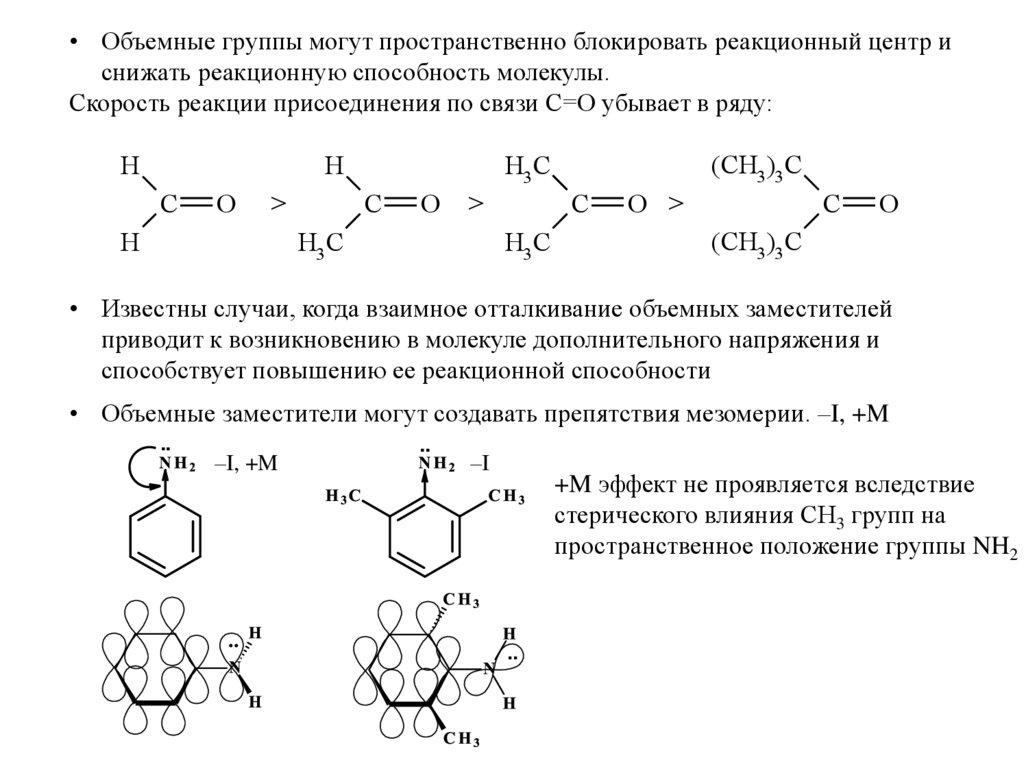
• Объемные группы могут пространственно блокировать реакционный центр иснижать реакционную способность молекулы.
Скорость реакции присоединения по связи С=О убывает в ряду:
H
H
C
O
C
>
H
(CH3 )3 C
H3 C
O
C
>
H3 C
H3 C
O >
C
O
(CH3 )3 C
• Известны случаи, когда взаимное отталкивание объемных заместителей
приводит к возникновению в молекуле дополнительного напряжения и
способствует повышению ее реакционной способности
• Объемные заместители могут создавать препятствия мезомерии. –I, +M
..
–I, +M
..
..
–I
+M эффект не проявляется вследствие
стерического влияния СН3 групп на
пространственное положение группы NH2
..









































 chemistry
chemistry








