Similar presentations:
Реакционная способность соединений со связью углерод-гетероатом
1.
РОССИЙСКИЙ НАЦИОНАЛЬНЫЙИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ им. Н.И.ПИРОГОВА
химия
Лекция 7
2013/14 уч. год
Реакционная способность соединений с σсвязью углерод-гетероатом
Лекцию читает профессор Белавин Иван Юрьевич
2.
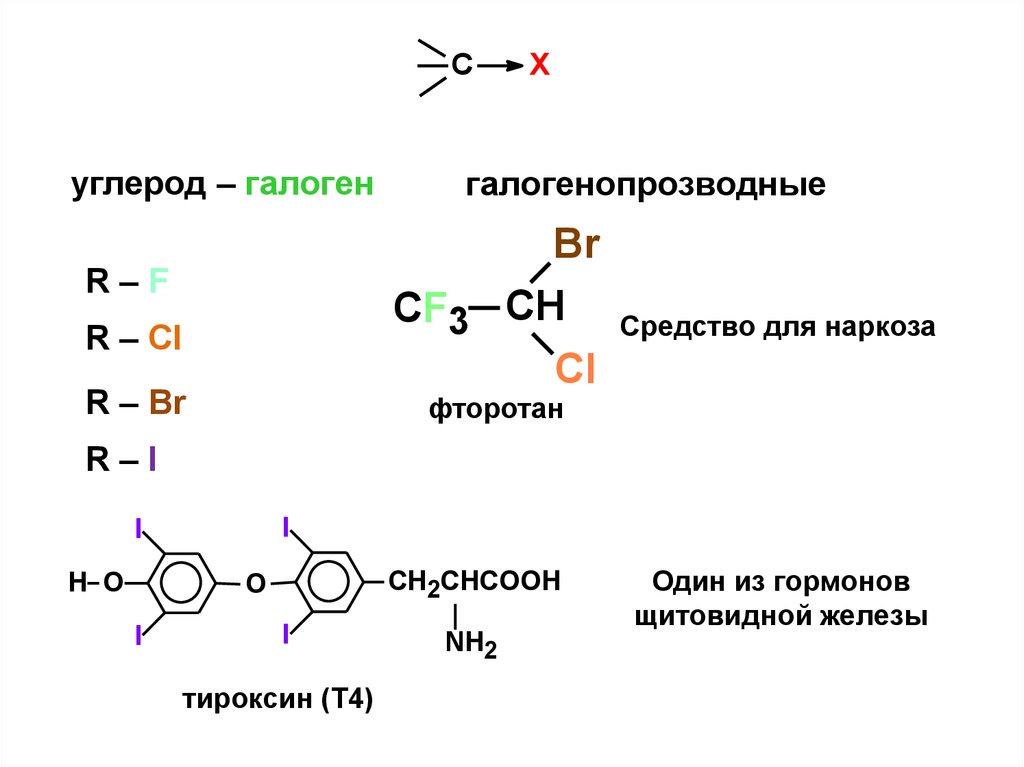
Суглерод – галоген
Х
галогенопрозводные
Br
CF3 CH
Cl
R–F
R – Cl
R – Br
Средство для наркоза
фторотан
R–I
I
I
H O
CH2CHCOOH
O
I
I
тироксин (Т4)
NH2
Один из гормонов
щитовидной железы
3.
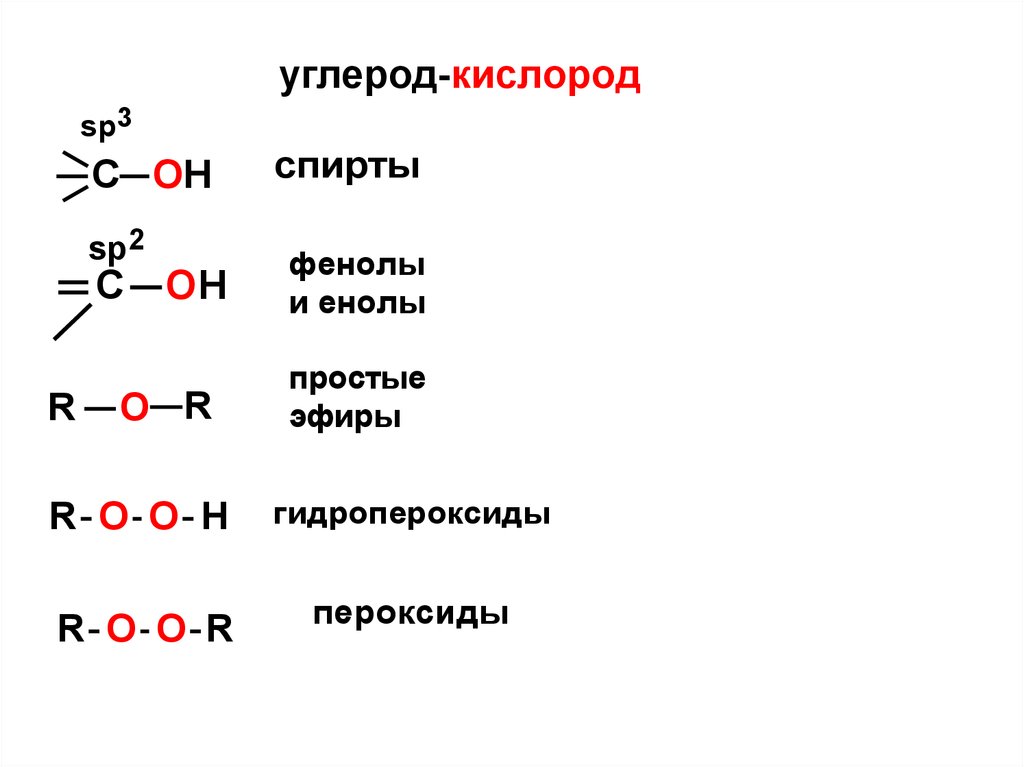
углерод-кислородsp3
С ОН
sp2
С
R
OH
O R
спирты
фенолы
и енолы
простые
эфиры
R O O H
гидропероксиды
R O O R
пероксиды
4.
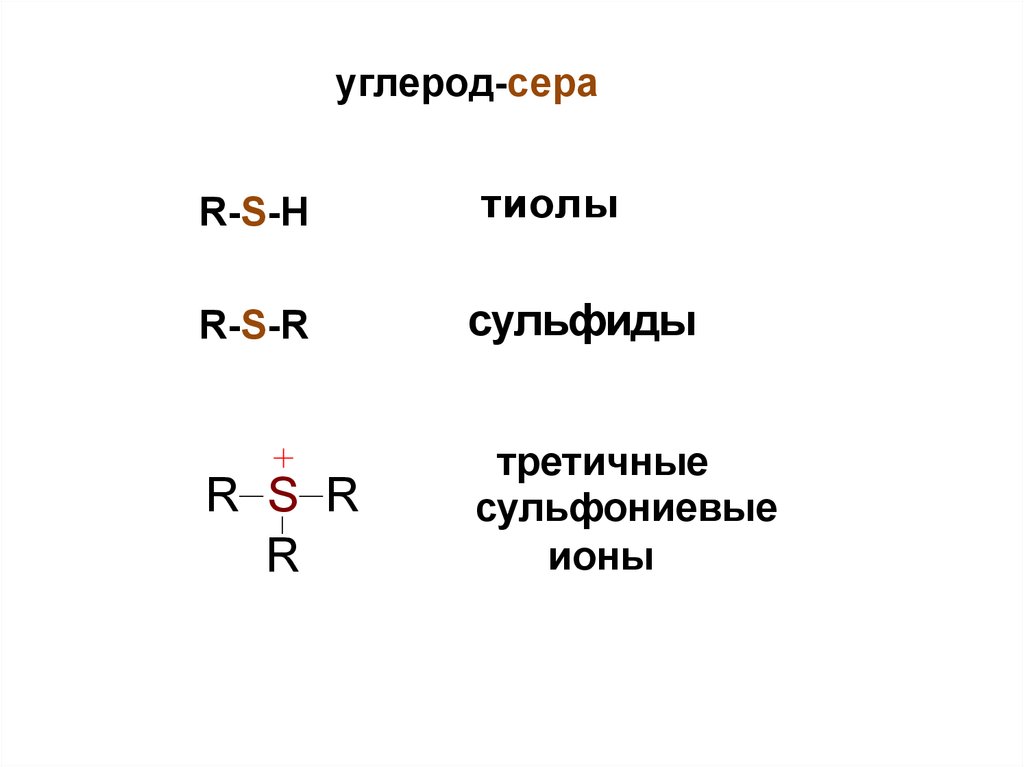
углерод-сераR-S-H
тиолы
R-S-R
сульфиды
R S R
R
третичные
сульфониевые
ионы
5.
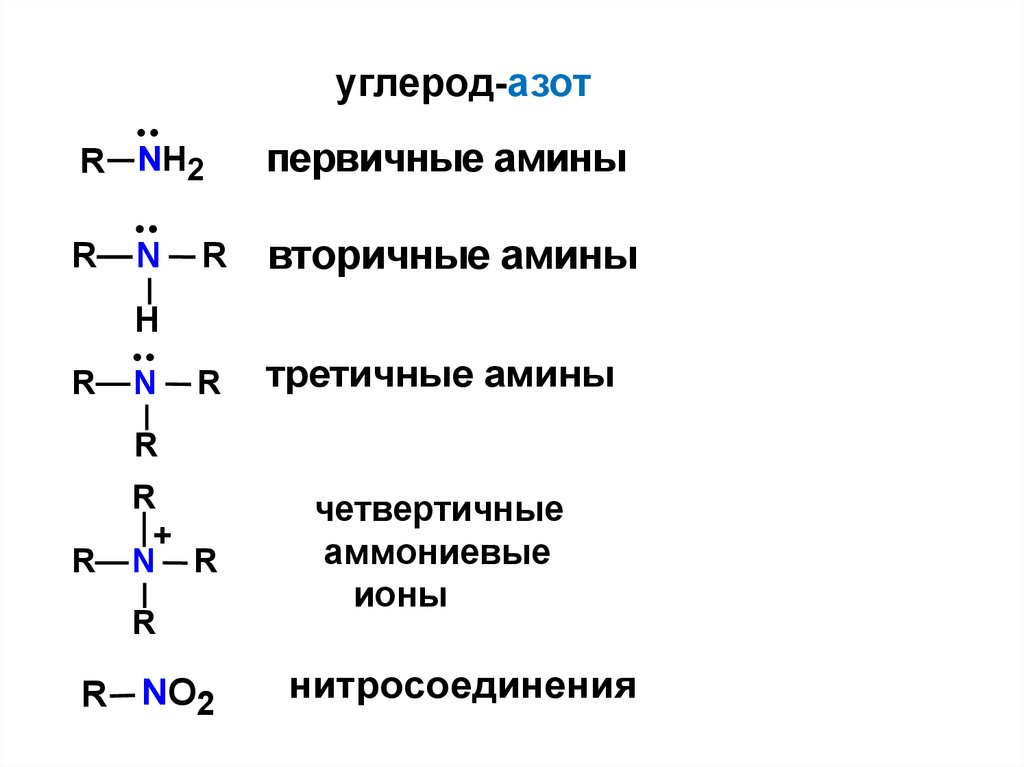
углерод-азотR NH2
первичные амины
R
R
вторичные амины
R
третичные амины
N
H
R
N
R
R
R
+
N R
R
R NO2
четвертичные
аммониевые
ионы
нитросоединения
6.
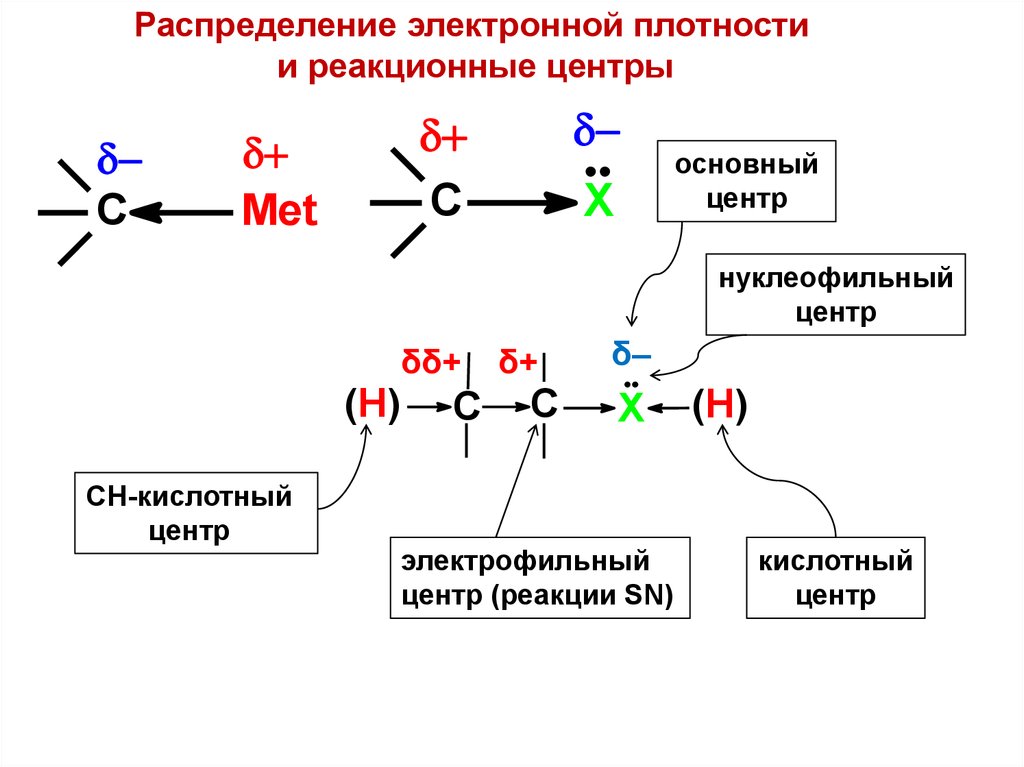
Распределение электронной плотностии реакционные центры
С
С
Met
Х
основный
центр
нуклеофильный
центр
δδ+
(Н)
СН-кислотный
центр
С
δ+
С
δ–
Х
электрофильный
центр (реакции SN)
(Н)
кислотный
центр
7.
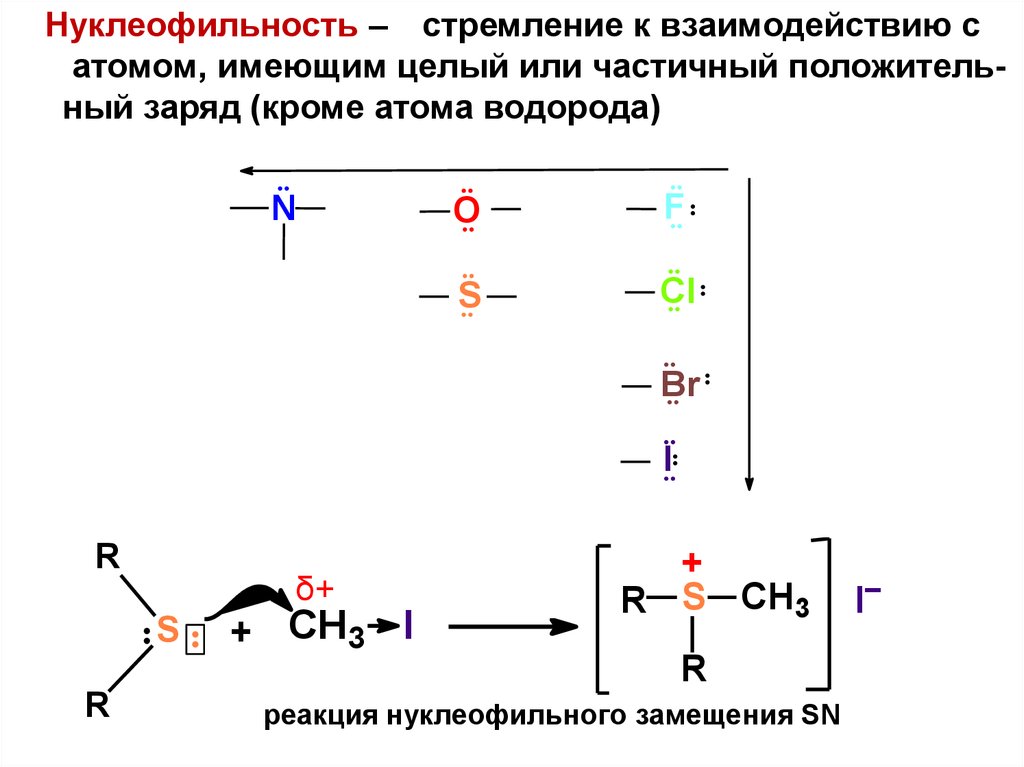
Нуклеофильность – стремление к взаимодействию сатомом, имеющим целый или частичный положительный заряд (кроме атома водорода)
N
O
F
S
Cl
Br
I
R
δ+
S
R
+ CH3 I
+
R S CH3
R
реакция нуклеофильного замещения SN
I–
8.
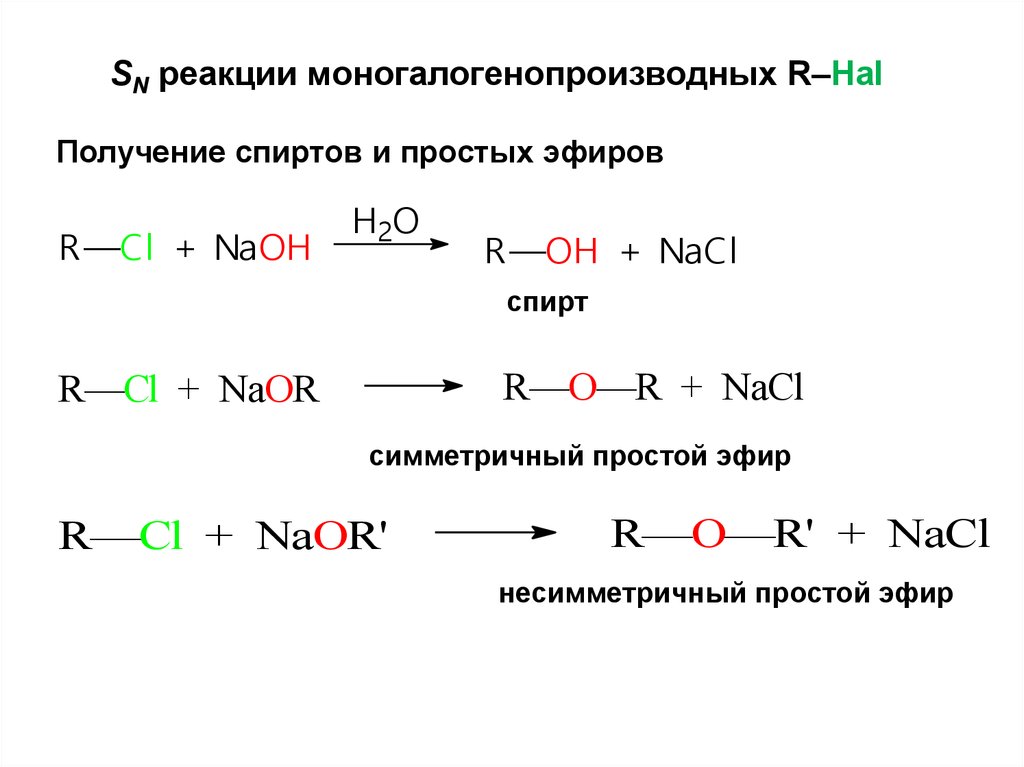
SN реакции моногалогенопроизводных R–HalПолучение спиртов и простых эфиров
R—Cl + NaOH
H2O
R—OH + NaCl
спирт
R—O—R + NaCl
R—Cl + NaOR
симметричный простой эфир
R—Cl + NaOR'
R—O—R' + NaCl
несимметричный простой эфир
9.
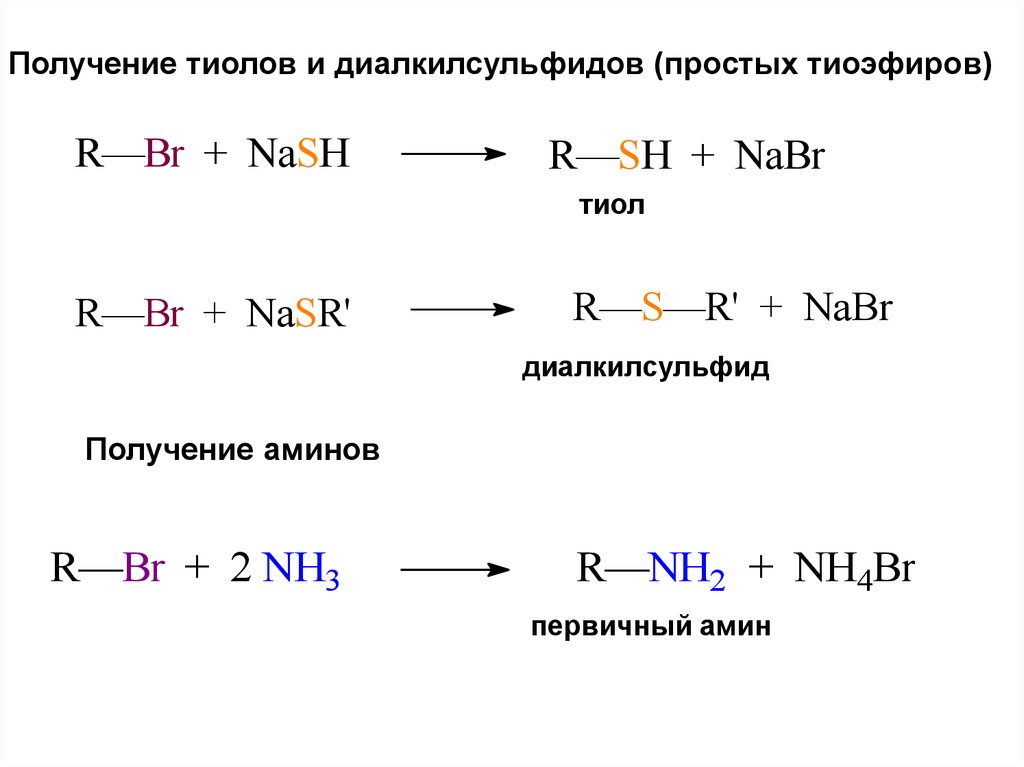
Получение тиолов и диалкилсульфидов (простых тиоэфиров)R—Br + NaSH
R—SH + NaBr
тиол
R—Br + NaSR'
R—S—R' + NaBr
диалкилсульфид
Получение аминов
R—Br + 2 NH3
R—NH2 + NH4Br
первичный амин
10.
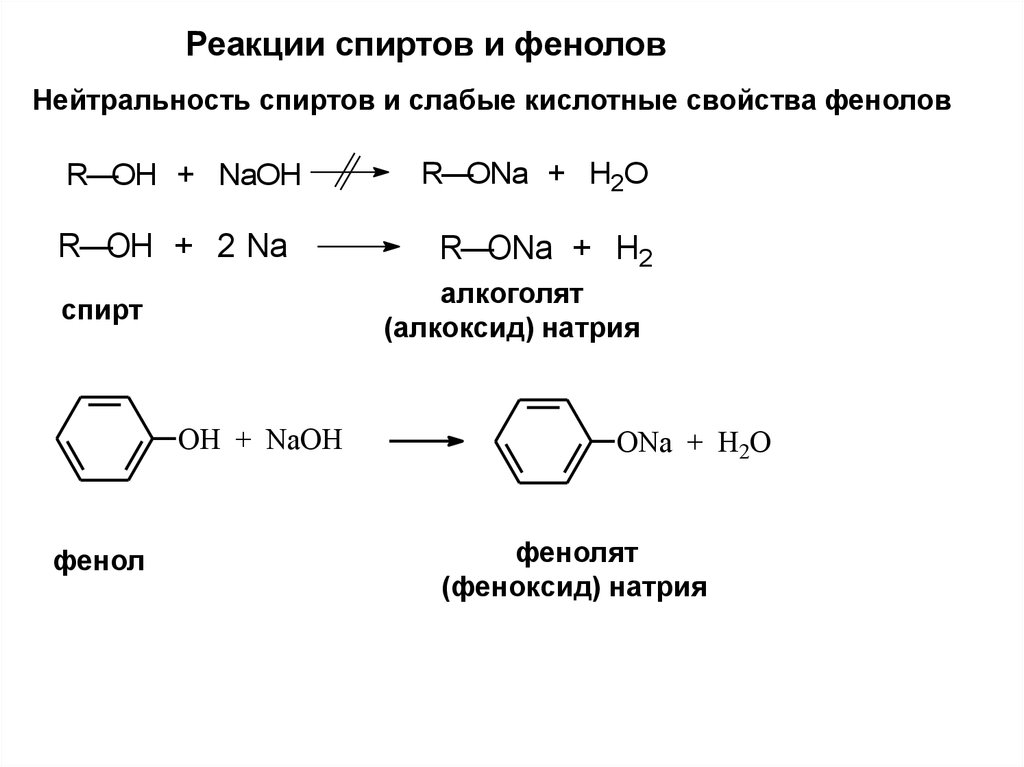
Реакции спиртов и феноловНейтральность спиртов и слабые кислотные свойства фенолов
R—OH + NaOH
R—OH + 2 Na
R—ONa + H2
алкоголят
(алкоксид) натрия
спирт
OH + NaOH
фенол
R—ONa + H2O
ONa + H2O
фенолят
(феноксид) натрия
11.
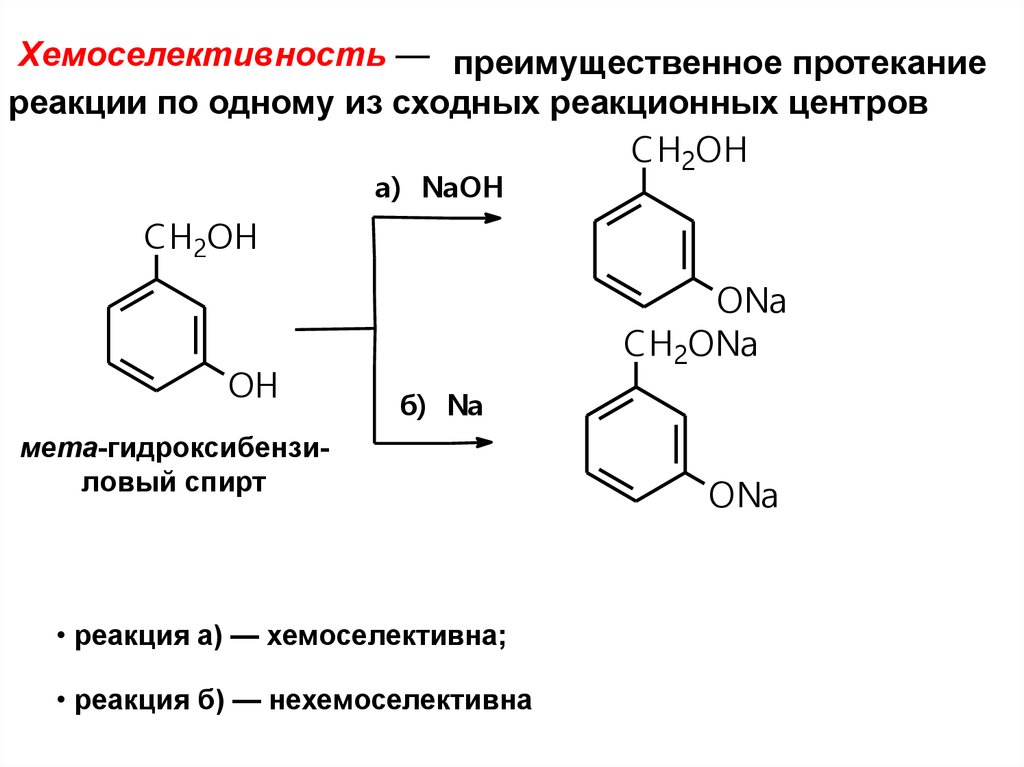
Хемоселективность — преимущественное протеканиереакции по одному из сходных реакционных центров
CH2OH
а) NaOH
CH2OH
OH
ONa
CH2ONa
б) Na
мета-гидроксибензиловый спирт
• реакция а) — хемоселективна;
• реакция б) — нехемоселективна
ONa
12.
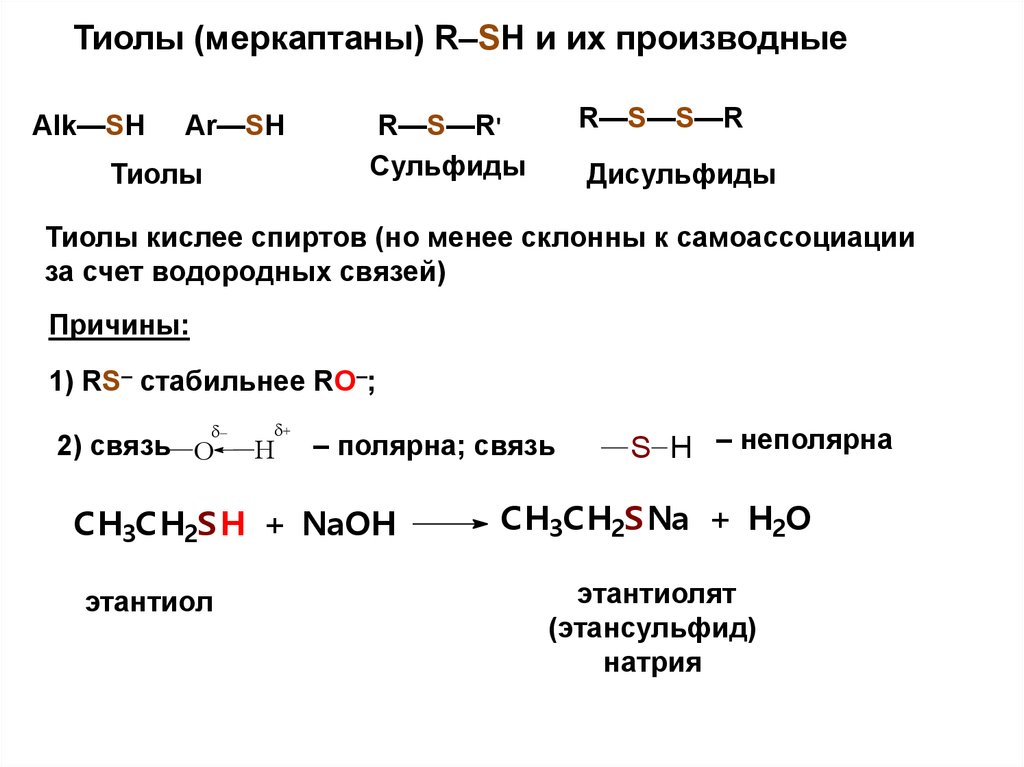
Тиолы (меркаптаны) R–SH и их производныеAlk—SH
Ar—SH
Тиолы
R—S—S—R
R—S—R'
Сульфиды
Дисульфиды
Тиолы кислее спиртов (но менее склонны к самоассоциации
за счет водородных связей)
Причины:
1) RS– стабильнее RO–;
–
2) связь O
+
H
– полярна; связь
CH3CH2SH + NaOН
этантиол
S H – неполярна
CH3CH2SNa + H2O
этантиолят
(этансульфид)
натрия
13.
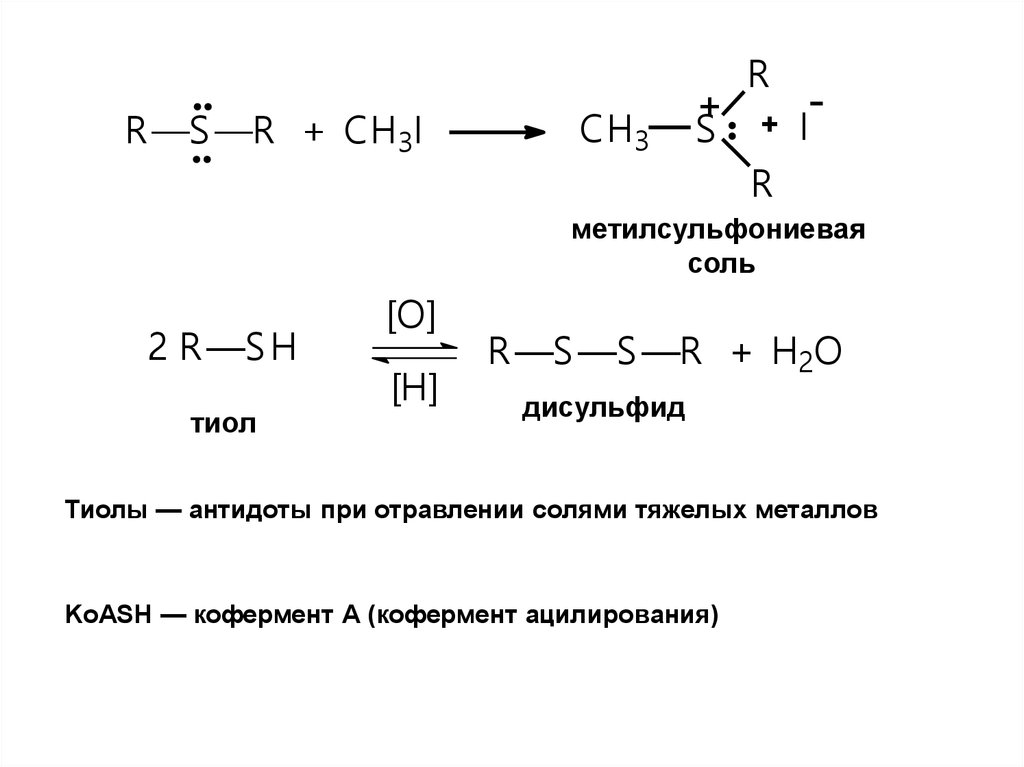
R —S —R + CH3ICH3
+
S
R
+
I
R
метилсульфониевая
соль
2 R —S H
тиол
[O]
[H]
R —S —S —R + H2O
дисульфид
Тиолы — антидоты при отравлении солями тяжелых металлов
KoASH — кофермент А (кофермент ацилирования)
14.
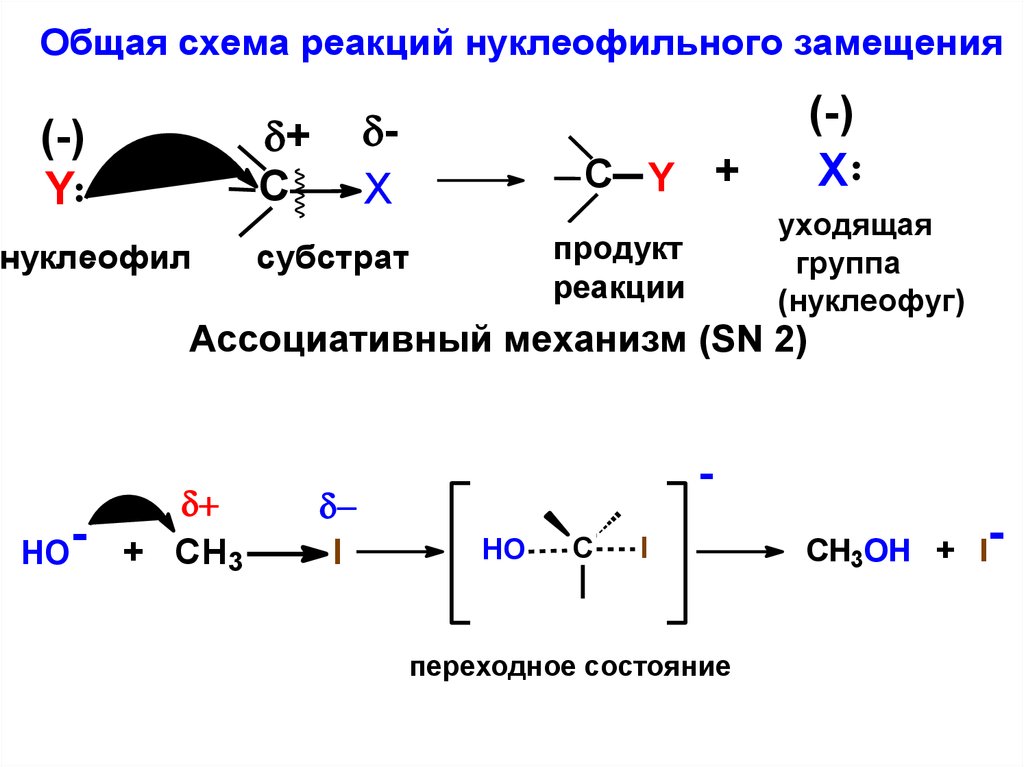
Общая схема реакций нуклеофильного замещенияX
+
C
(-)
Y
нуклеофил
(-)
X
C Y +
уходящая
группа
(нуклеофуг)
продукт
реакции
субстрат
Ассоциативный механизм (SN 2)
HO-
+ CH3
I
HO
C
I
переходное состояние
CH3OH + I-
15.
Диссоциативный механизм (SN 1)СН3
Н CH2 C
Cl +
OH-
СН2 С
CH3
СН3
СН3
+ Н2О + Сl-
- Clмедленно
CH3
+
C
СН3
СН3
CH3 H
+ HOH
+
CH3 C O
+
H
H
CH3
быстро
быстро
CH3
CH3 C O H
CH3
16.
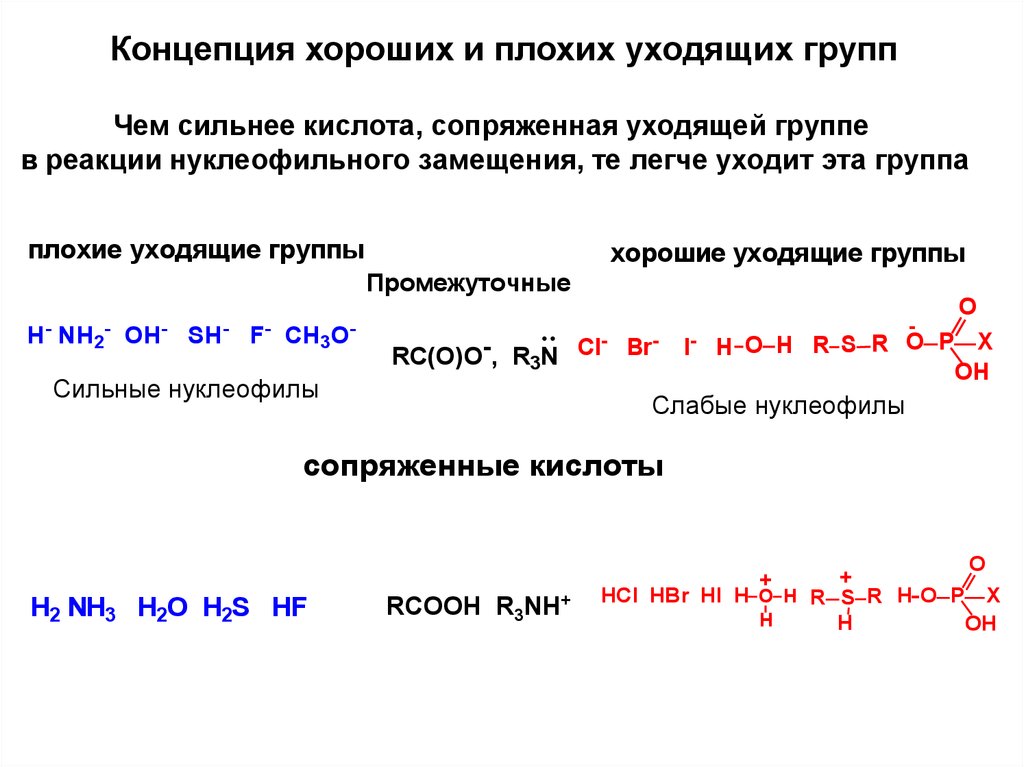
Концепция хороших и плохих уходящих группЧем сильнее кислота, сопряженная уходящей группе
в реакции нуклеофильного замещения, те легче уходит эта группа
плохие уходящие группы
хорошие уходящие группы
Промежуточные
Н
-
NH2-
-
OH
-
SH
-
F CH3O
-
RC(O)O-, R3N Cl Br
Сильные нуклеофилы
-
I- H О H R S R O P
О
X
OH
Слабые нуклеофилы
сопряженные кислоты
О
+
HCl HBr HI H O H R S R H O P X
H
Н
OH
+
Н2 NH3 H2O H2S HF
RCOOH R3NH+
17.
Гидролиз галогенопроизводныхподвижный атом галогена
SN2
- ClCH2
CH
НО СH2 CH=CH2 + HCl
Cl + H2O
CH2 CH CH2
H
O
+
CH2
H
CH2
CH
SN1
мезомерный катион
- H+
H
H
+
C O
H
H
ион оксония
CH3 CH
O
C
+
O
OH
H - ClH
- H+
Cl
CH3
CH
O H
C
OH
O
CH3
H
CH
O
+
C
H
OH
ион оксония
SN2
18.
Соединения с обычной подвижностью атома галогенаЭтилхлорид CH3CH2Cl – местноанестезирующее средство.
Хлороформ CHCl3 – средство для ингаляционного наркоза
(невоспламеняемость, быстрое действие).
Иодоформ CHI3 – антисептическое (обеззараживающее)
средство.
Дихлорэтан CH2ClCH2Cl – растворитель, обладает
токсическим действием, воздействует на ЦНС, печень в условиях
организма частично подвергается гидролизу.
19.
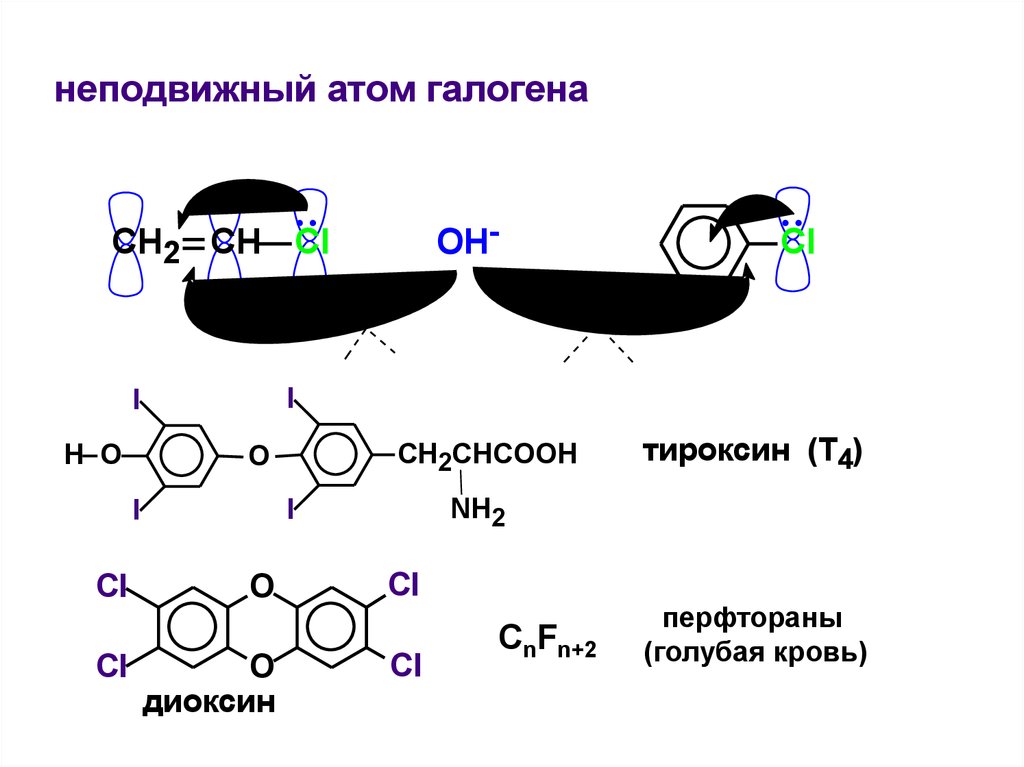
неподвижный атом галогенаOH-
СН2 СН Сl
I
I
H O
Cl
CH2CHCOOH
O
O
O
диоксин
тироксин (Т4)
NH2
I
I
Cl
Cl
Cl
Cl
CnFn+2
перфтораны
(голубая кровь)
20.
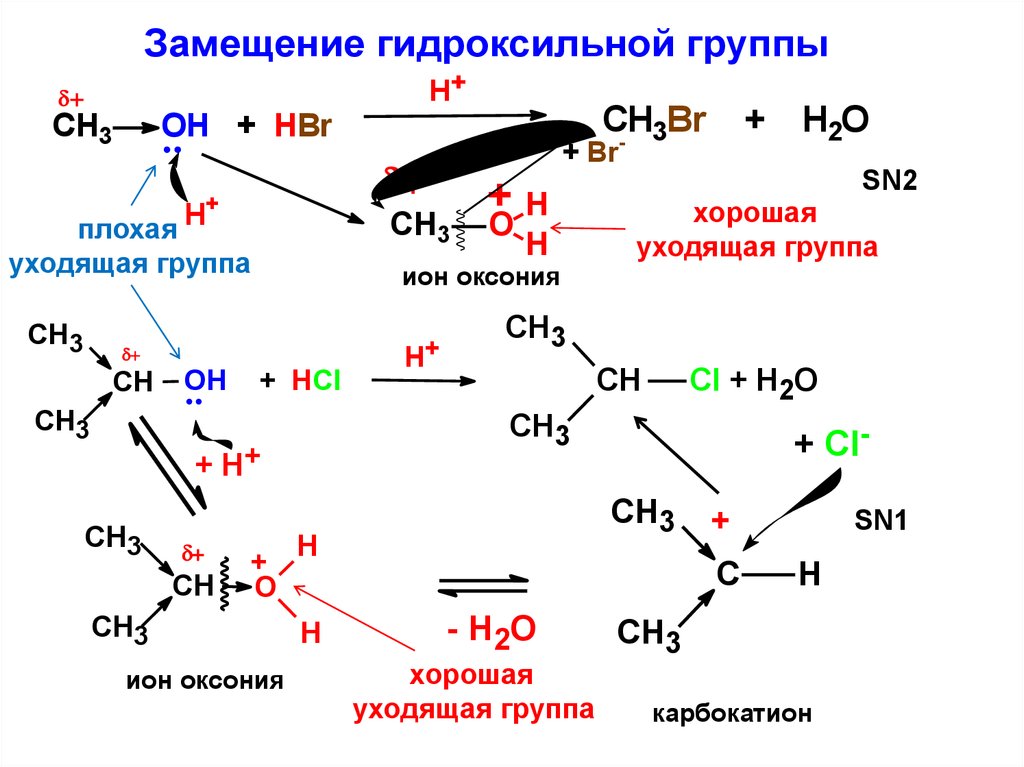
Замещение гидроксильной группыH+
СН3
CH3
уходящая группа
CH
CH3
OH
+ HCl
CH
O
H
H
+
O
CH3
ион оксония
хорошая
уходящая группа
СH3
CH
Cl + H2O
+ ClСH3
H
H
H2O
SN2
CH3
+ H+
СH3
+
ион оксония
H+
+
+ Br
+
H
плохая
СH3
CH
Br
- 3
ОН + HBr
+
C
- H2O
хорошая
уходящая группа
SN1
H
CH3
карбокатион
21.
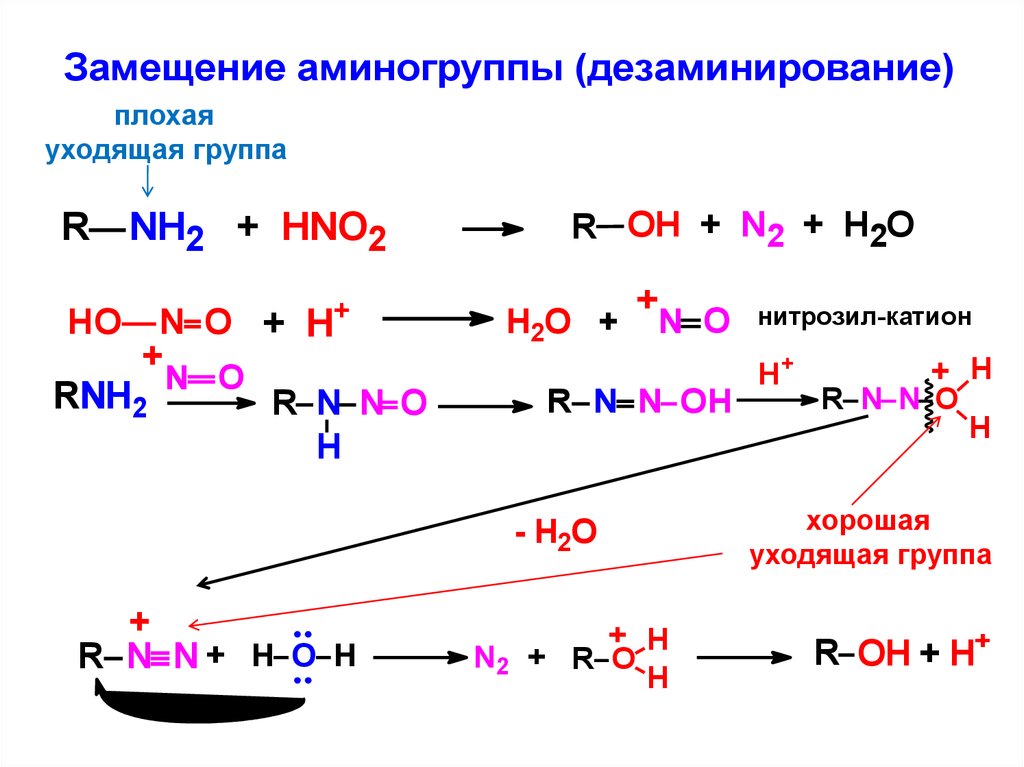
Замещение аминогруппы (дезаминирование)плохая
уходящая группа
R
NH2 + HNO2
N O + H+
+
N O
RNH2
R N N O
H
HO
R OH + N2 + H2O
H2O +
+
N O
R N N OH
- H2O
+
R N N+ H O H
+ H
N2 + R O
H
нитрозил-катион
H+
+ H
R N N O
H
хорошая
уходящая группа
R OH + H+
22.
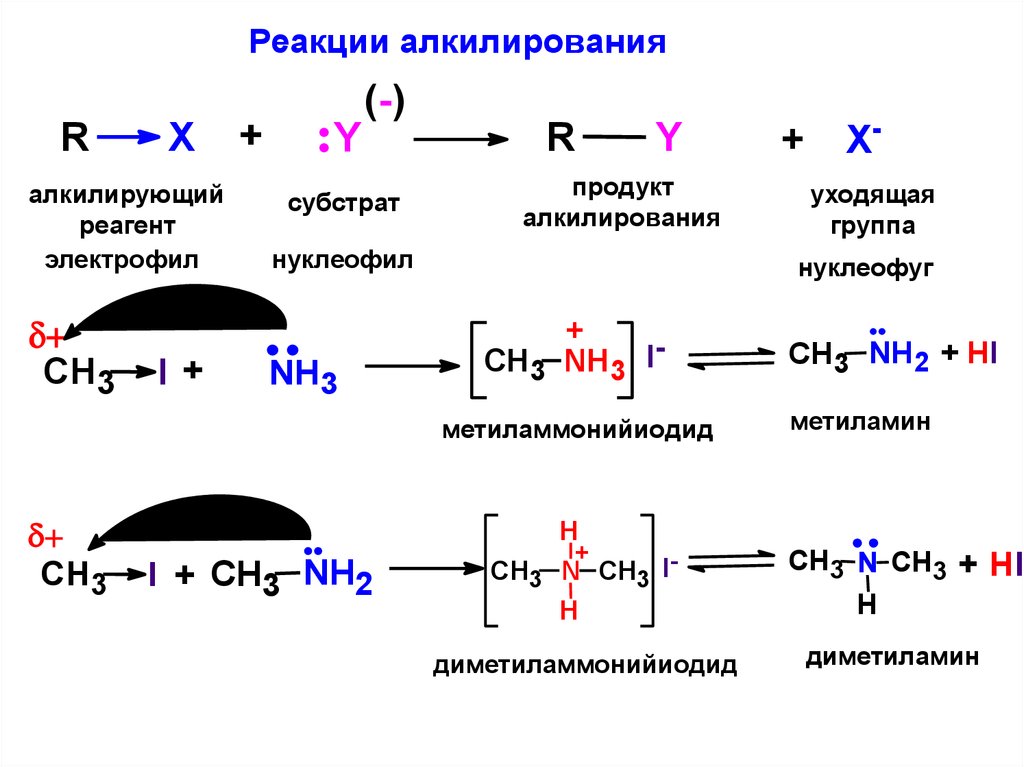
Реакции алкилированияR
X
алкилирующий
реагент
электрофил
CH3
I+
+
Y
(-)
субстрат
R
Y
продукт
алкилирования
нуклеофил
NH3
I + CH3 NH2
Xуходящая
группа
нуклеофуг
+
CH3 NH3 Iметиламмонийиодид
CH3
+
H
+
CH3 N CH3 IH
диметиламмонийиодид
CH3 NH2 + HI
метиламин
CH3 N CH3 + HI
H
диметиламин
23.
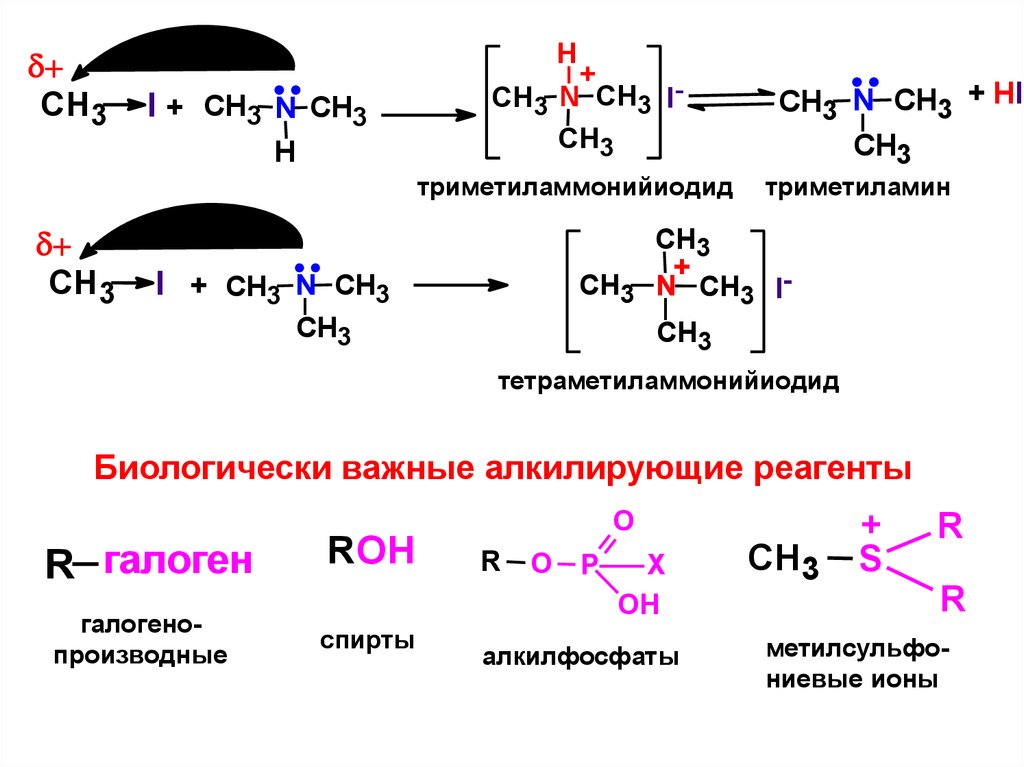
CH3I + CH3 N CH3
H
H
+
CH3 N CH3 ICH3
триметиламмонийиодид
CH3
CH3 N CH3 + HI
CH3
триметиламин
CH3
+
CH3 N CH3 ICH3
I + CH3 N CH3
CH3
тетраметиламмонийиодид
Биологически важные алкилирующие реагенты
R галоген
галогенопроизводные
ROH
спирты
О
R
O P
X
OH
алкилфосфаты
СH3
+
S
R
R
метилсульфониевые ионы
24.
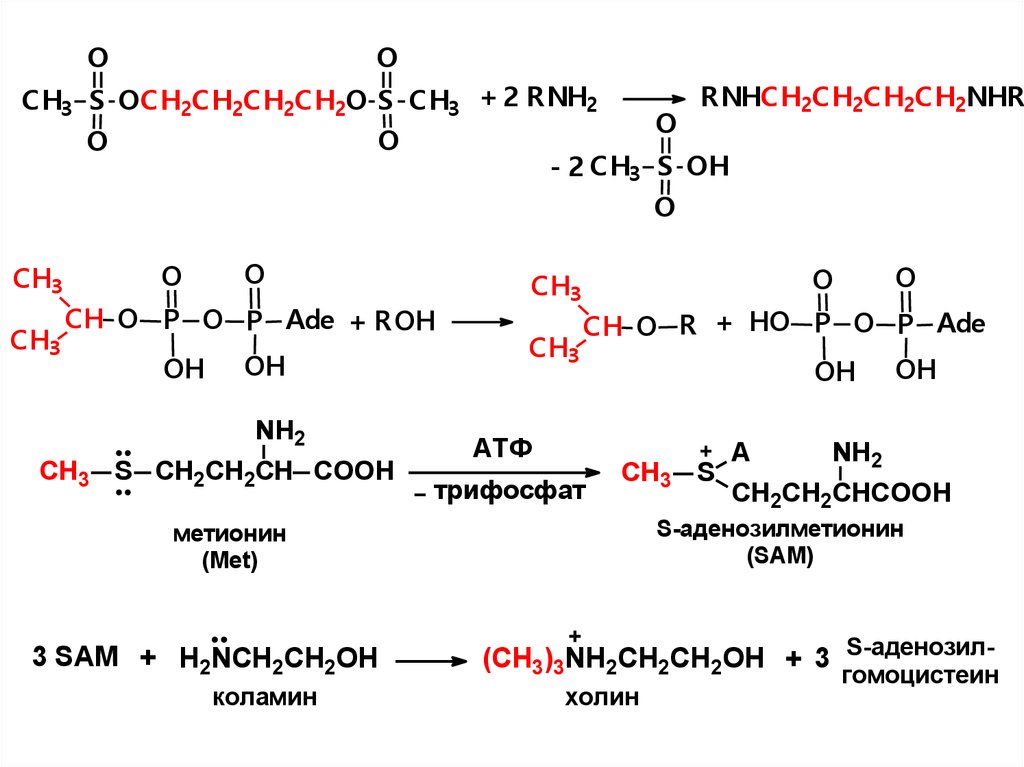
OO
RNHCH2CH2CH2CH2NHR
CH3 S OCH2CH2CH2CH2O S CH3 + 2 RNH2
O
O
O
- 2 CH3 S OH
O
CH3
CH3
O
O
CH O P O P Ade + ROH
OH
OH
NH2
CH3 S CH2CH2CH COOH
CH3
CH3
O
CH O R + HO P O P Ade
АТФ
трифосфат
OH
CH3 S
коламин
A
OH
NH2
CH2CH2CHCOOH
S-аденозилметионин
(SAM)
метионин
(Met)
3 SAM + H2NCH2CH2OH
O
(CH3)3NH2CH2CH2OH + 3 S-аденозилгомоцистеин
холин
25.
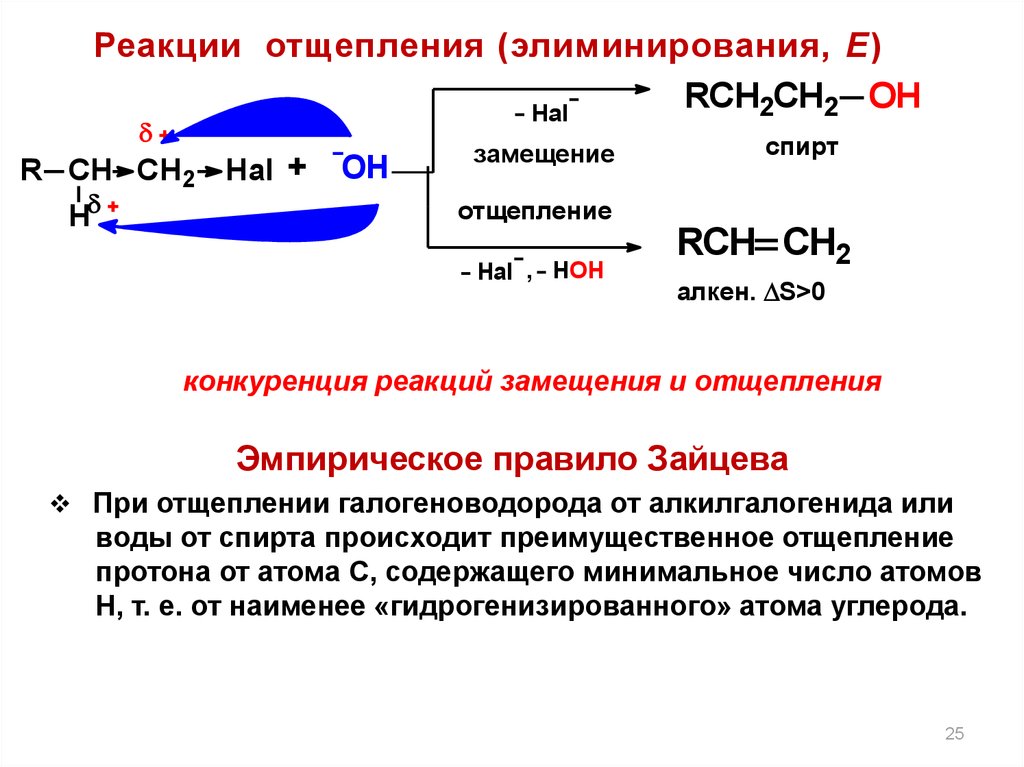
Реакции отщепления (элиминирования, Е)RCH2CH2 OH
Hal
R CH CH2 Hal +
H
OH
замещение
спирт
отщепление
Hal , HOH
RCH CH2
алкен. S>0
конкуренция реакций замещения и отщепления
Эмпирическое правило Зайцева
При отщеплении галогеноводорода от алкилгалогенида или
воды от спирта происходит преимущественное отщепление
протона от атома С, содержащего минимальное число атомов
Н, т. е. от наименее «гидрогенизированного» атома углерода.
25
26.
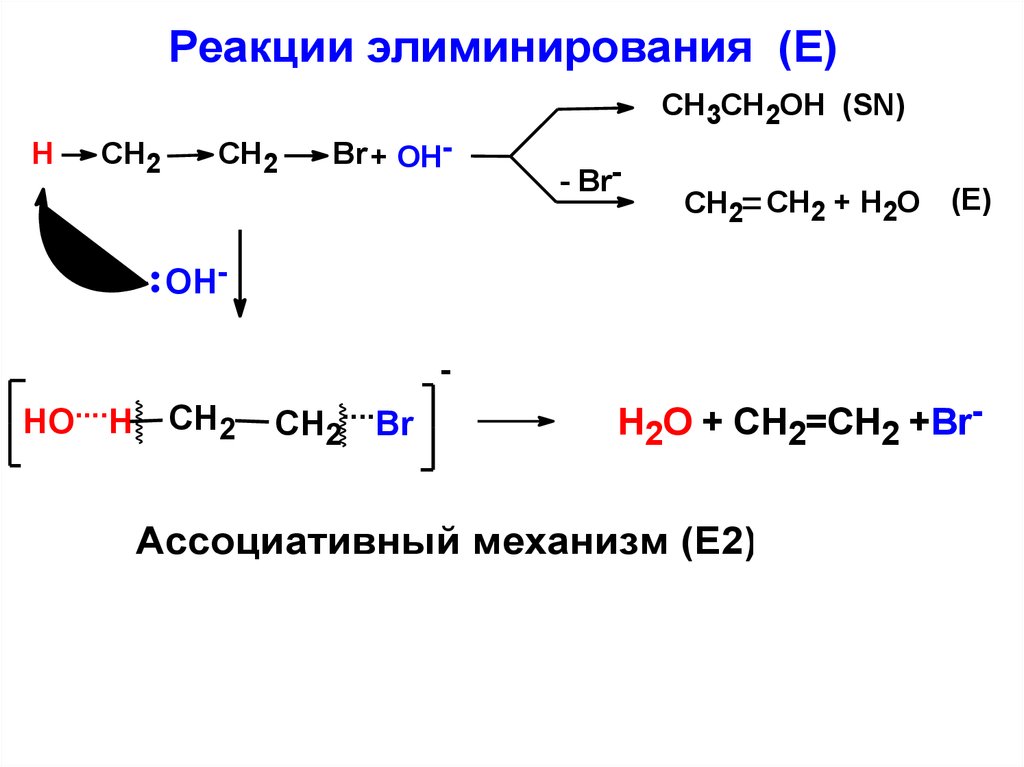
Реакции элиминирования (Е)CH3CH2OH (SN)
H
CH2
CH2
Br + OH-
- Br-
CH2 CH2 + H2O (E)
OHHO....H
СН2
CH2....Br
H2O + CH2=CH2 +Br-
Ассоциативный механизм (Е2)
27.
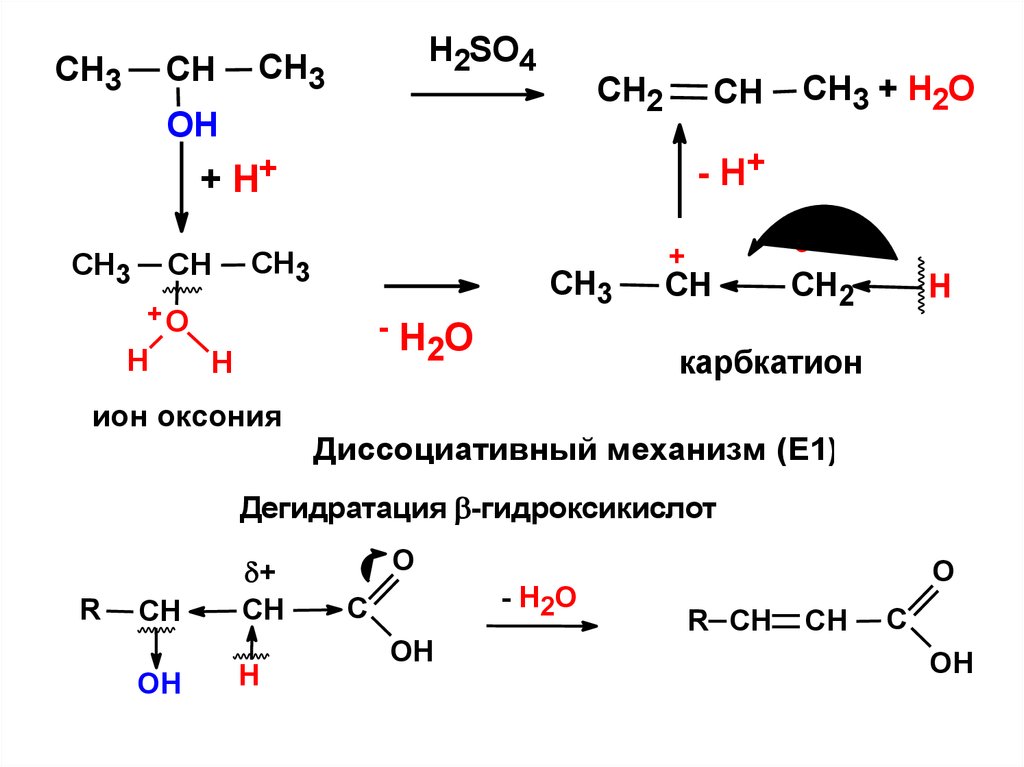
CH3CH
H2SO4
CH3
CH2
ОН
CH
- H+
+ H+
CH3
CH
CH3
+О
H
-H O
2
H
ион оксония
CH3 + H2O
CH3
+
CH
+
CH2
H
карбкатион
Диссоциативный механизм (Е1)
Дегидратация -гидроксикислот
R
CH
OH
+
CH
Н
O
- H2O
C
OH
O
R CH
CH
C
OH
28.
Реакционная способность соединений скарбонильной группой
Основные классы карбонильных соединений
O
O
O
R C
R C
R C R
O H
H
кетоны
карбоновые кислоты
альдегиды
Альдегиды – органические соединения, содержащие
атом водорода, связанный с карбонильной группой
Кетоны – соединения, содержащие два органических
радикала, связанных с карбонильной группой.
Карбоновые кислоты – соединения, содержащие
гидроксильную группу, связанную с карбонильной группой
Функциональные производные карбоновых кислот –
органические соединения, в результате гидролиза которых
образуются карбоновые кислоты
29.
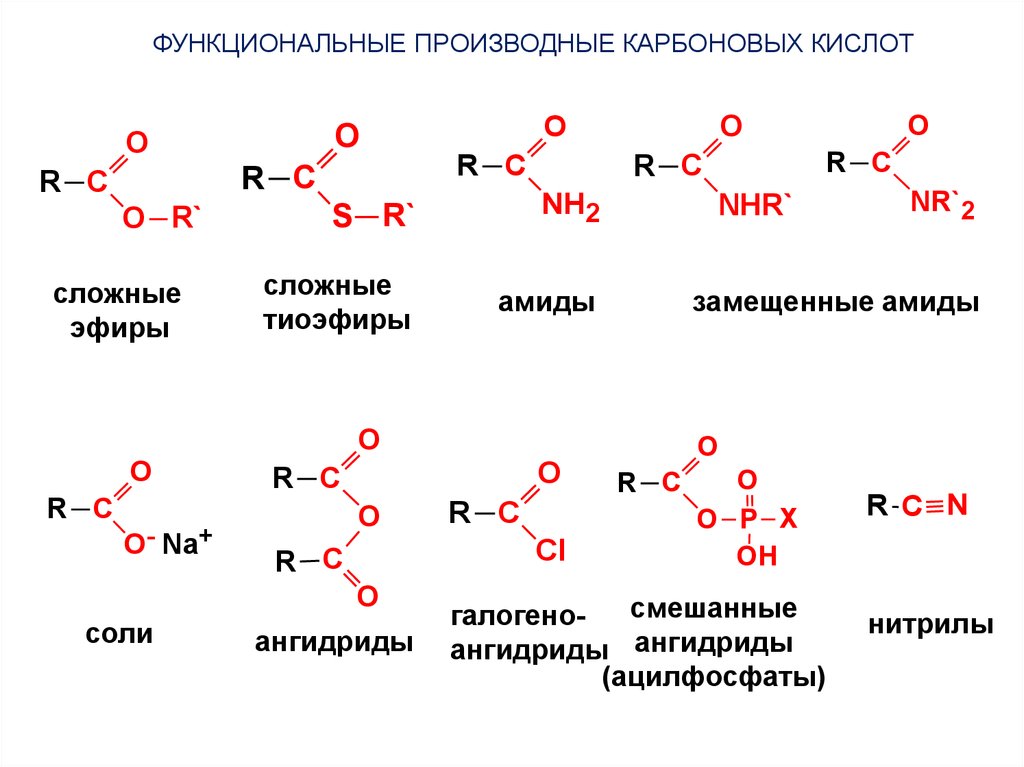
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТO
O
R C
R C
O R`
сложные
эфиры
O
R C
O- Na+
сложные
тиоэфиры
амиды
O
O
R C
R C
Cl
R C
ангидриды
O
R C
R C
NH2
O
соли
R C
S R`
O
O
O
NHR`
NR`2
замещенные амиды
O
R C
O
O P X
OH
смешанные
галогеноангидриды ангидриды
(ацилфосфаты)
R C N
нитрилы
30.
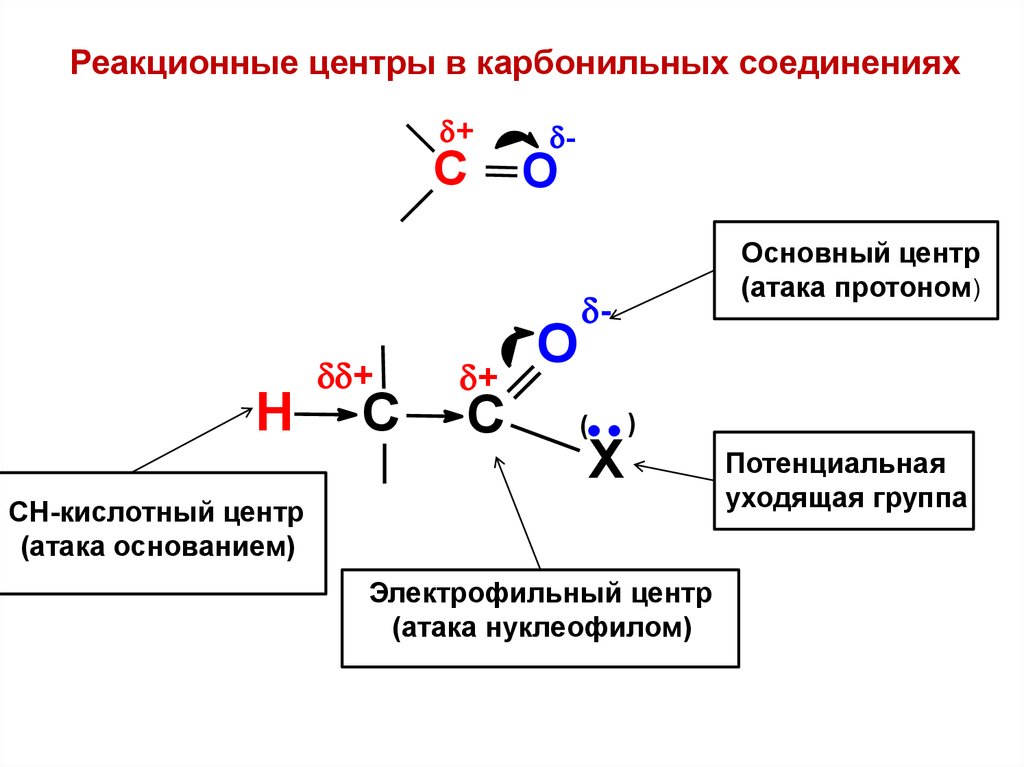
Реакционные центры в карбонильных соединениях+
С
H
+
C
+
C
-
О
O
Основный центр
(атака протоном)
(
X
)
СН-кислотный центр
(атака основанием)
Электрофильный центр
(атака нуклеофилом)
Потенциальная
уходящая группа
31.
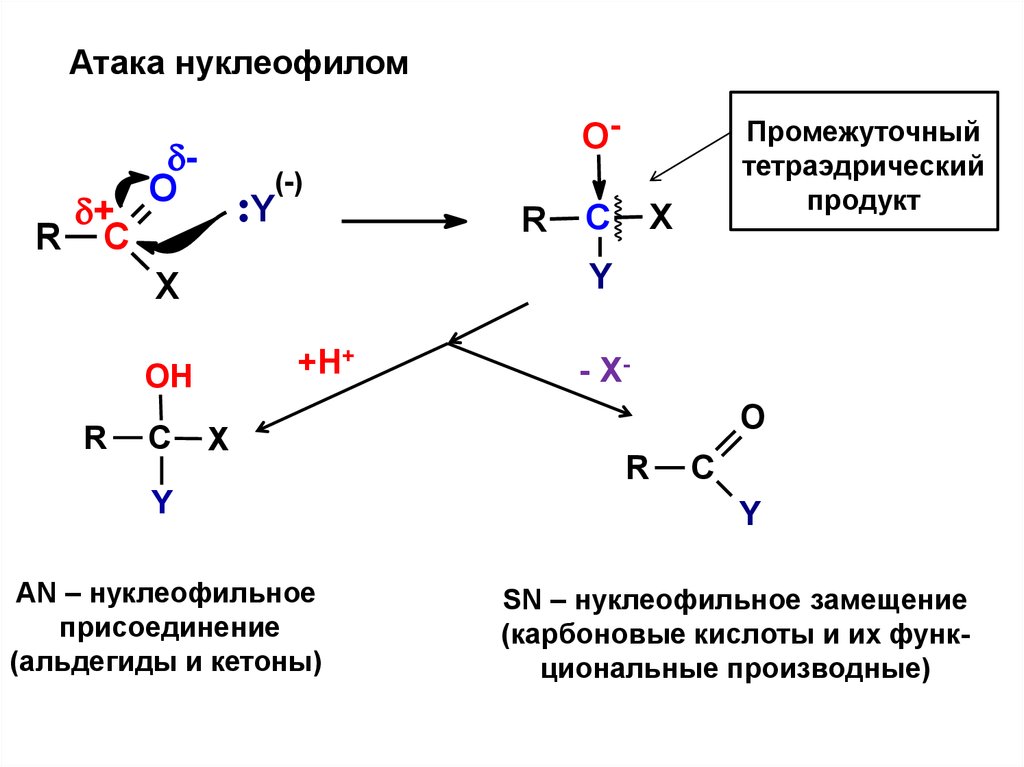
Атака нуклеофилом+
R С
О-
О
(-)
Y
R
+Н+
ОH
С
Х
С
Y
Х
R
Промежуточный
тетраэдрический
продукт
Х
Y
AN – нуклеофильное
присоединение
(альдегиды и кетоны)
- XO
R
С
Y
SN – нуклеофильное замещение
(карбоновые кислоты и их функциональные производные)
32.
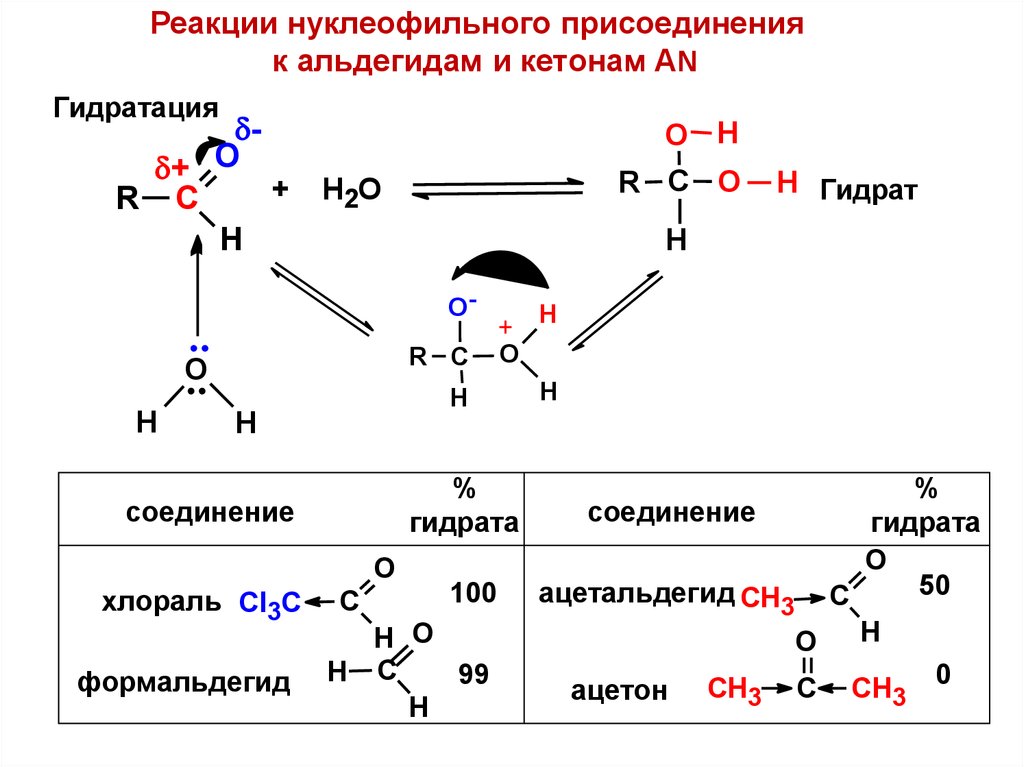
Реакции нуклеофильного присоединенияк альдегидам и кетонам AN
Гидратация
+ О
+
R С
Н
О Н
R С О
Н2О
Н
ОR С
О
Н
О
%
гидрата
соединение
O
формальдегид
+ Н
Н
Н
хлораль Cl3C
Н Гидрат
C
100
H O
H C
99
H
Н
%
соединение
гидрата
O
50
ацетальдегид CH3 C
H
O
0
ацетон CH3 C CH3
33.
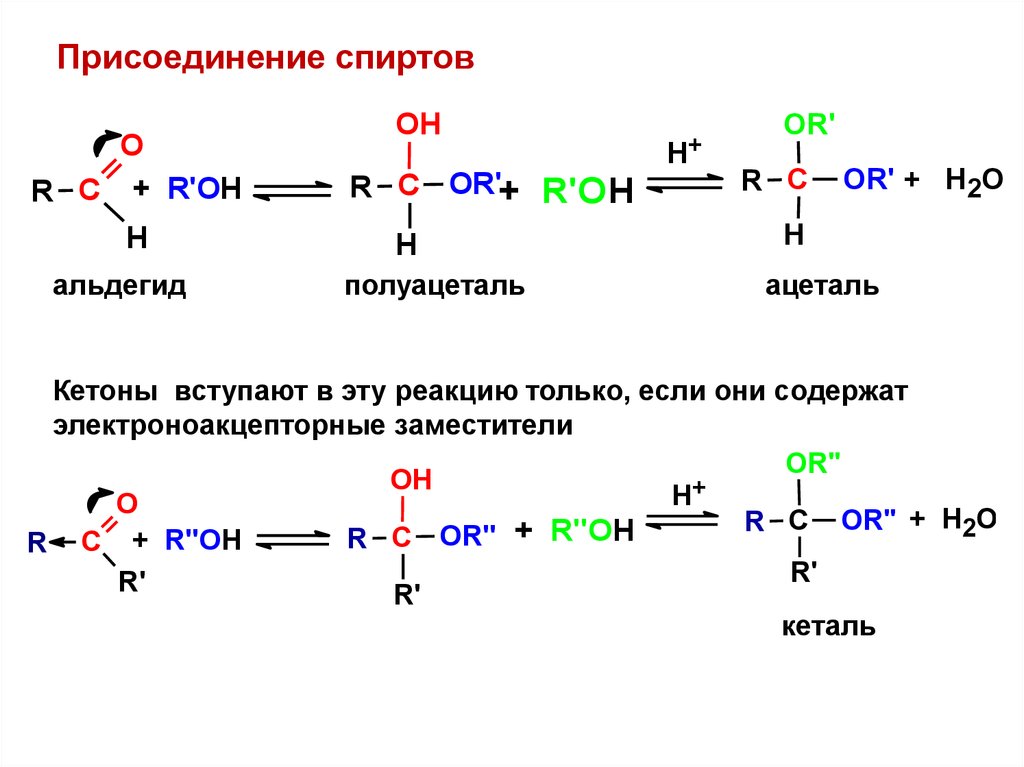
Присоединение спиртовО
R С + R'OH
Н
альдегид
ОH
R С OR'+ R'OH
Н
полуацеталь
Н+
OR'
R С
OR' + H2O
Н
ацеталь
Кетоны вступают в эту реакцию только, если они содержат
электроноакцепторные заместители
OR"
ОH
Н+
О
R С OR" + H2O
+
R"OH
OR"
R С
R С + R"OH
R'
R'
R'
кеталь





 chemistry
chemistry








