Similar presentations:
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих
1. ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА ГИДРОКСИЛСОДЕРЖАЩИХ
12. Спирты
Спиртами называются производныеуглеводородов, в которых один или
несколько атомов водорода заменены на
гидроксильньк группы.
2
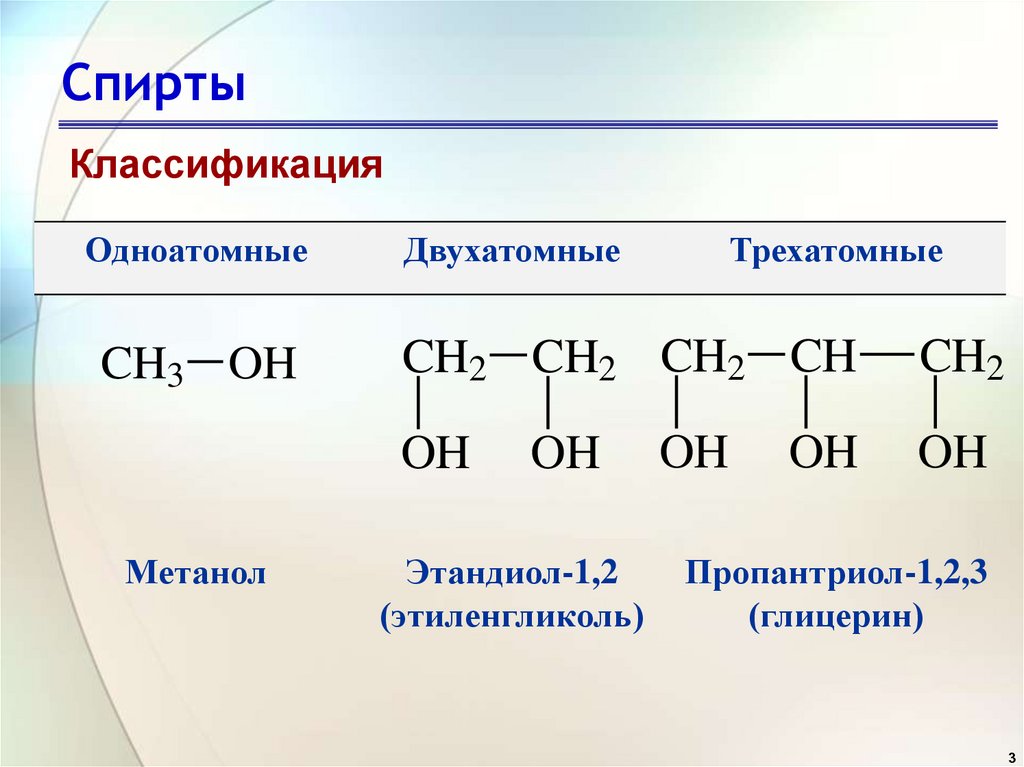
3. Спирты
КлассификацияОдноатомные
Двухатомные
CH3 OH
CH2 CH2 CH2 CH
OH
Метанол
OH
Этандиол-1,2
(этиленгликоль)
Трехатомные
OH
OH
CH2
OH
Пропантриол-1,2,3
(глицерин)
3
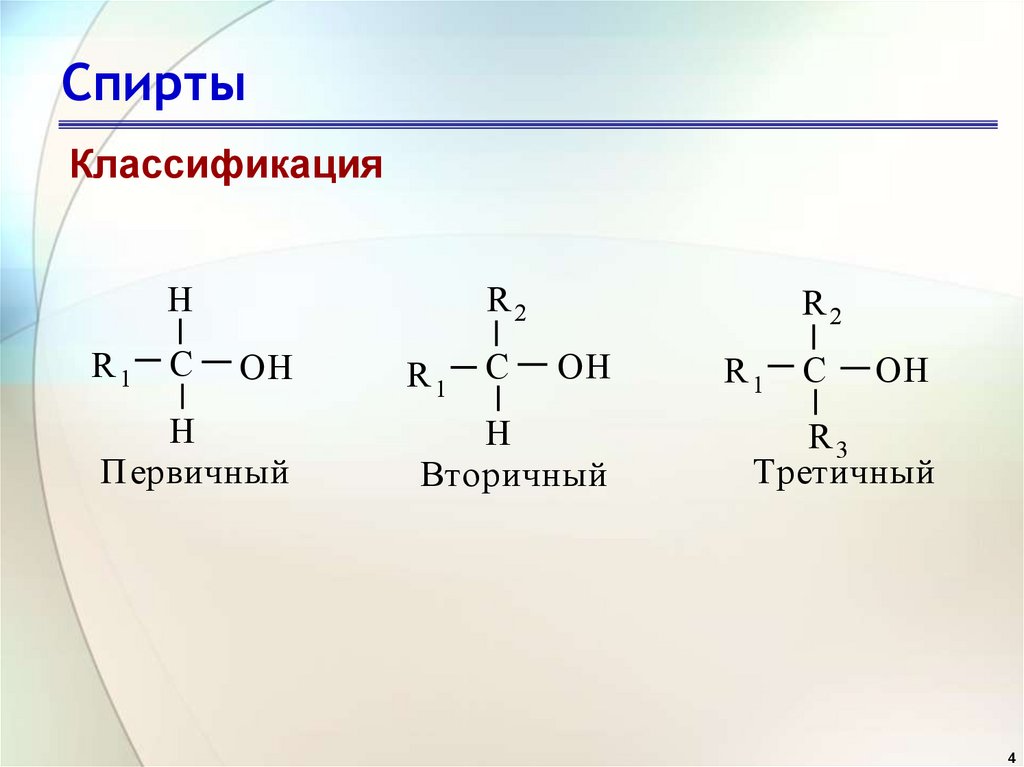
4. Спирты
КлассификацияR2
H
R1
C
OH
H
Первичный
R1
C
R2
OH
H
Вторичный
R1
C
OH
R3
Третичный
4
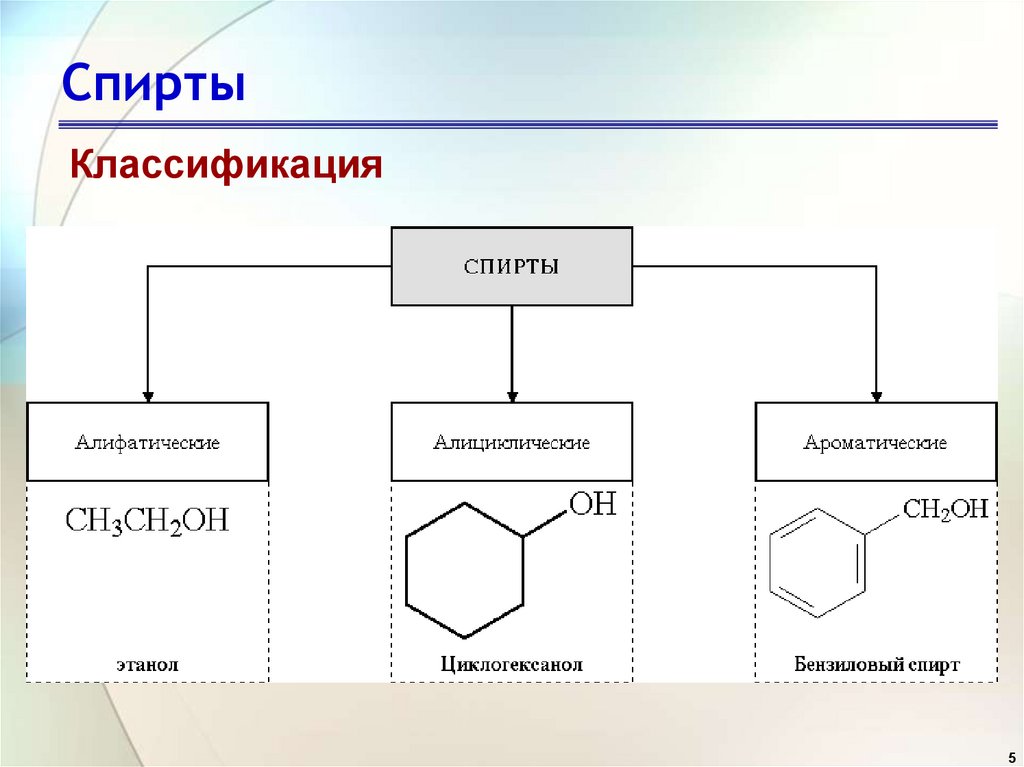
5. Спирты
Классификация5
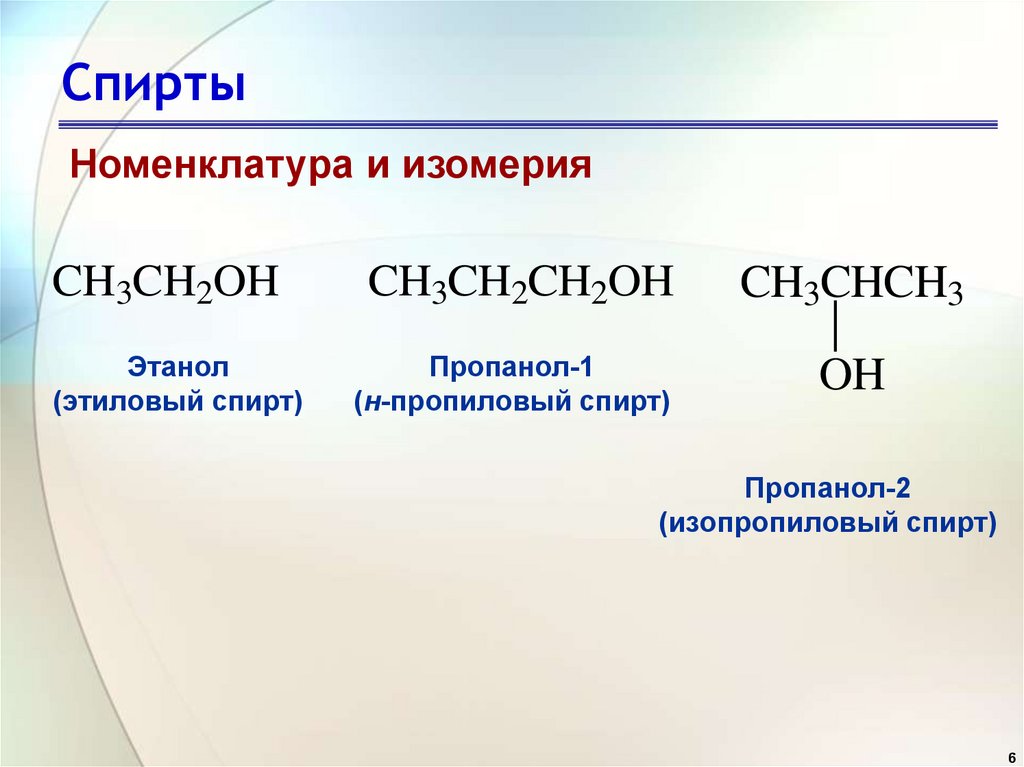
6. Спирты
Номенклатура и изомерияCH3CH2OH
CH3CH2CH2OH
CH3CHCH3
Этанол
(этиловый спирт)
Пропанол-1
(н-пропиловый спирт)
OH
Пропанол-2
(изопропиловый спирт)
6
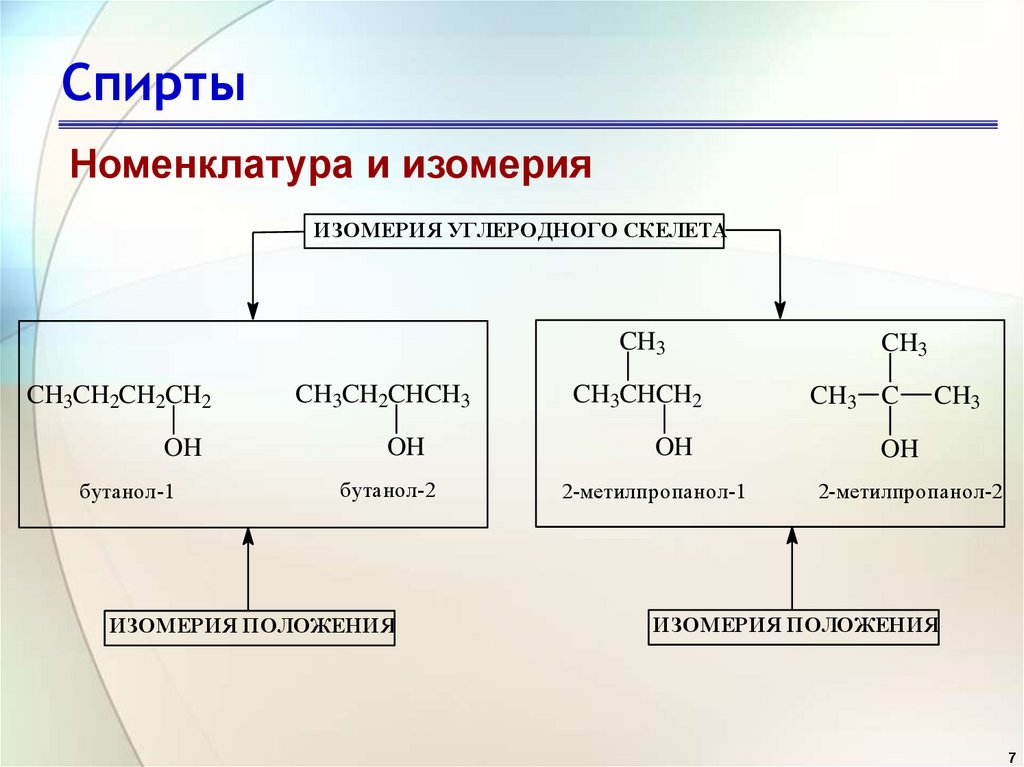
7. Спирты
Номенклатура и изомерияИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА
CH3
CH3CH2CH2CH2
OH
бутанол-1
CH3CH2CHCH3
OH
бутанол-2
ИЗОМЕРИЯ ПОЛОЖЕНИЯ
CH3CHCH2
OH
2-метилпропанол-1
CH3
CH3 C
CH3
OH
2-метилпропанол-2
ИЗОМЕРИЯ ПОЛОЖЕНИЯ
7
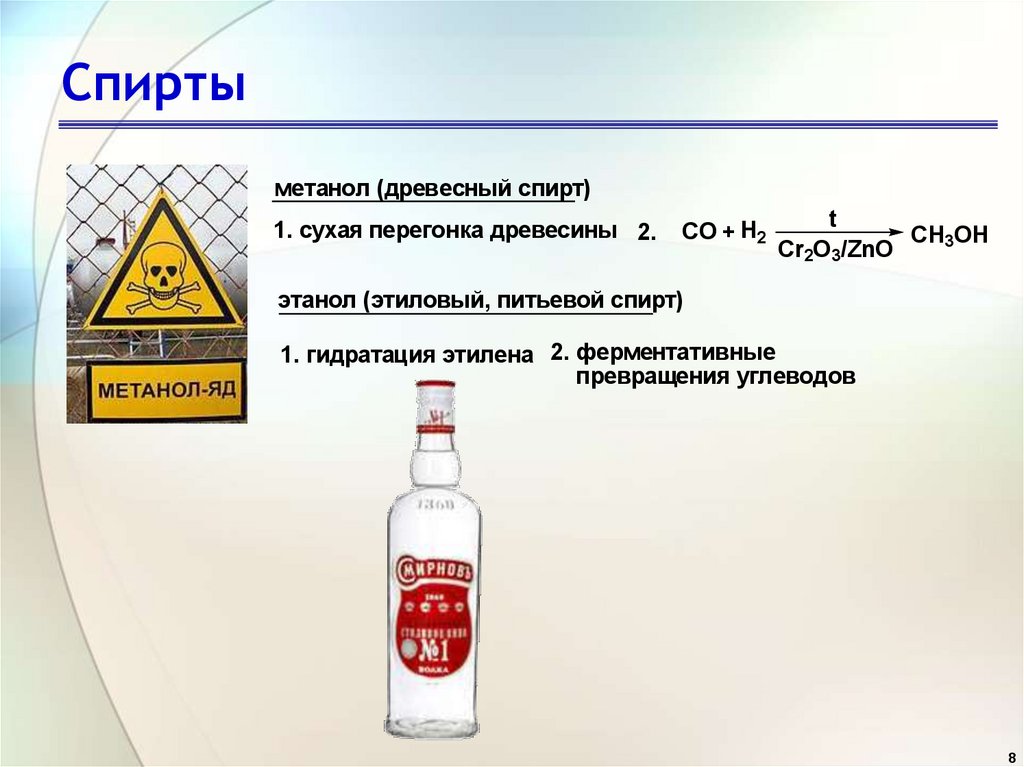
8. Спирты
метанол (древесный спирт)1. сухая перегонка древесины 2.
CO + H2
t
CH3OH
Cr2O3/ZnO
этанол (этиловый, питьевой спирт)
1. гидратация этилена 2. ферментативные
превращения углеводов
8
9. Спирты
ЭтанолФизические свойства
CH3CH2OH
J Bump
9
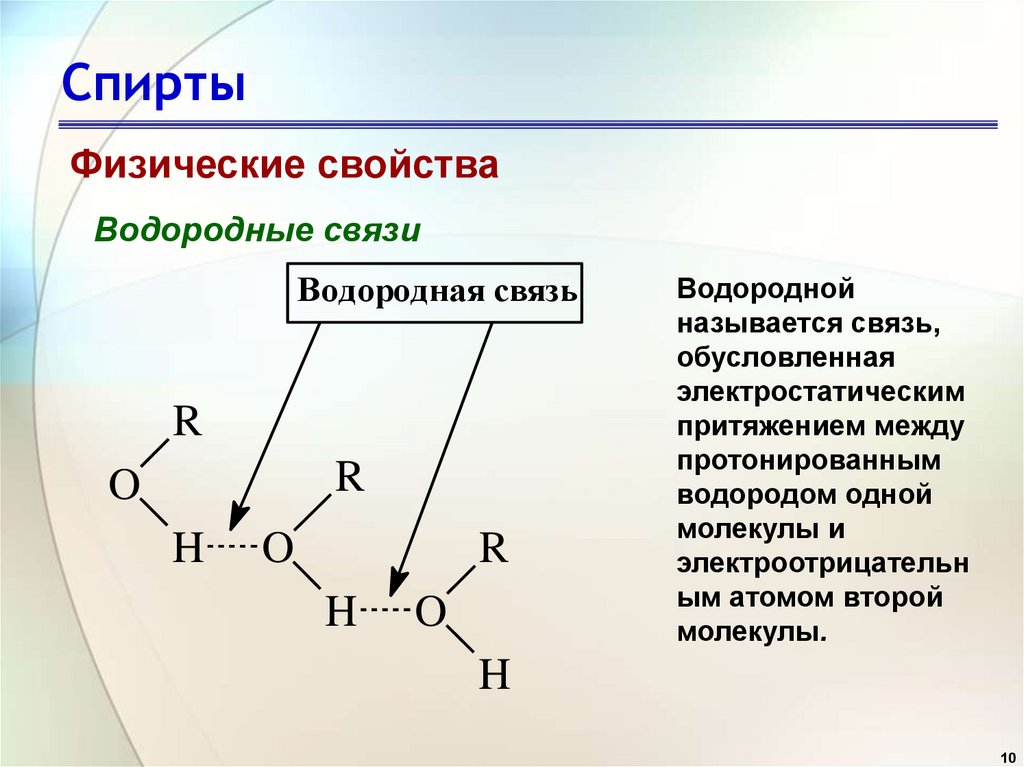
10. Спирты
Физические свойстваВодородные связи
Водородная связь
R
R
O
H
O
R
H
O
Водородной
называется связь,
обусловленная
электростатическим
притяжением между
протонированным
водородом одной
молекулы и
электроотрицательн
ым атомом второй
молекулы.
H
10
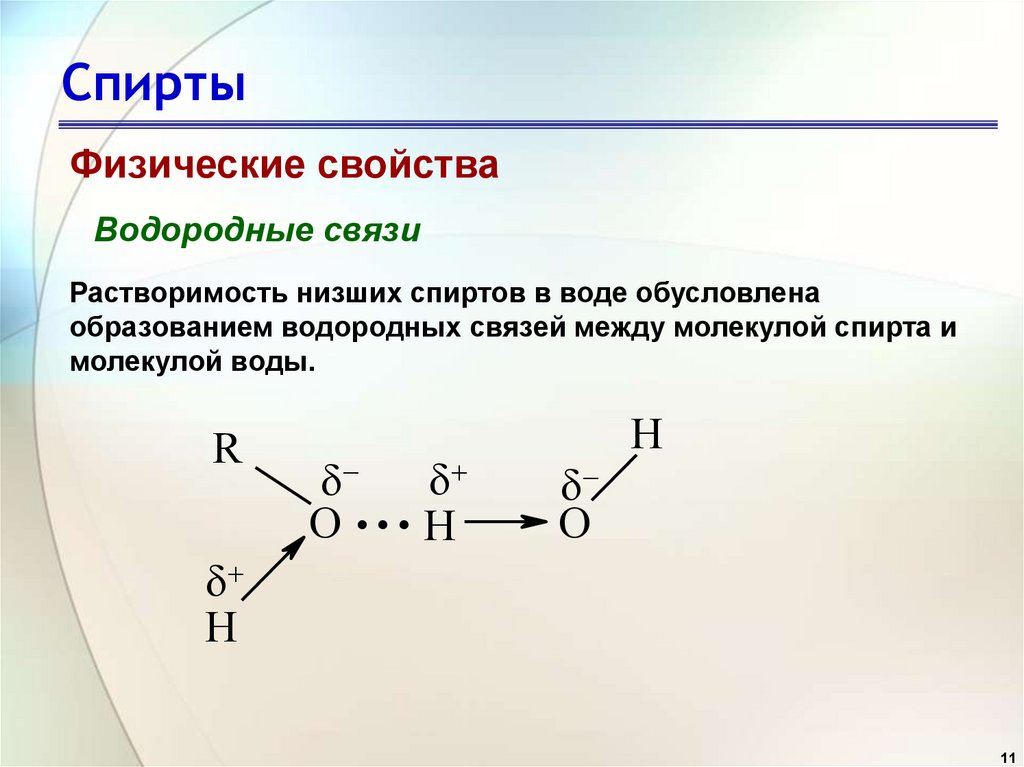
11. Спирты
Физические свойстваВодородные связи
Растворимость низших спиртов в воде обусловлена
образованием водородных связей между молекулой спирта и
молекулой воды.
R
O
...
H
O
H
H
11
12. Спирты
Химические свойства1. Кислотность спиртов
В молекуле спирта содержится атом водорода, связанный с
сильно электроотрицательным кислородом, поэтому спирт
проявляет заметную кислотность.
Спирты (кроме метанола) более слабые кислоты, чем вода:
алкильная группа, проявляя электронодонорный
индукционный эффект, подает электроны на кислород R→О ,
увеличивает на нем отрицательный заряд (по сравнению с
зарядом на гидроксид-ионе) и делает алкоксид-ион R→О
(сопряженное основание) более сильным, а кислоту - более
слабой.
12
13. Спирты
Химические свойства1. Кислотность спиртов
Н О Н
Б. сильнаяя
кислота
+
Н О + Н
Б. слабое
основание
O H
R
Б. слабая
кислота,
чем Н2О
R
O
+ H
Б. сильное
основание,
чем ОН
+
13
14. Спирты
Химические свойства1. Кислотность спиртов
Алкоксиды (алкоголяты) нельзя получить реакцией спирта с
гидроксидами металлов, их синтезируют реакцией спирта с
активным металлом (Na, K, Mg, Al и др.).
+
Na
OH
+ RO H
Б. слабое
Б. слабая
основание
кислота
R O-H
+
Na
RO
Na
Б. сильное
основание
RO
Na
+
+
Н OH
Б. сильнаяя
кислота
+
+ 1/2H 2
14
15. Спирты
Кислотность спиртовКислотность спиртов в водных растворах
R OH
R
O
+
pKa
трет-Бутанол
18,0
Этанол
15,9
Метанол
15,5
Вода
15,7
FCH2CH2OH
13,9
CF3CH2OH
12,4
(CF3)3COH
5,0
+
H
Ka
[RO ][H ]
[ROH]
pKa=-lgKa
+I-эффект
алкильных групп
-M-эффект F
15
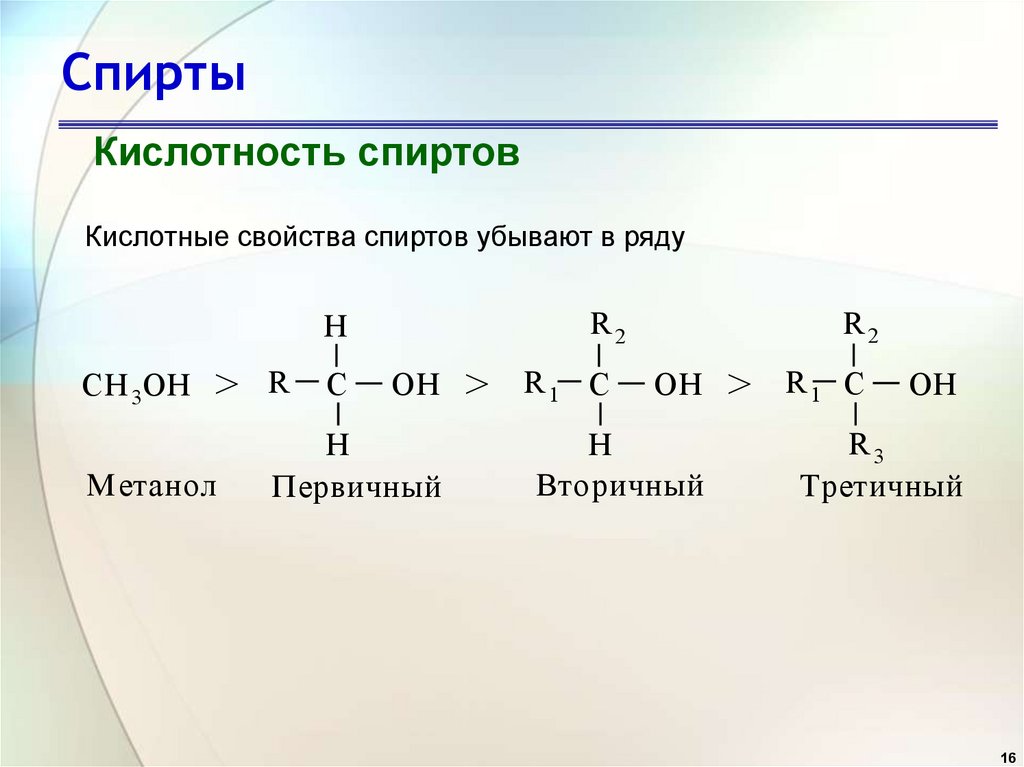
16. Спирты
Кислотность спиртовКислотные свойства спиртов убывают в ряду
CH 3OH
>
М етанол
R
C
R2
R2
H
OH
H
Первичный
>
R1 C
OH
H
Вторичный
>
R1 C
OH
R3
Третичный
16
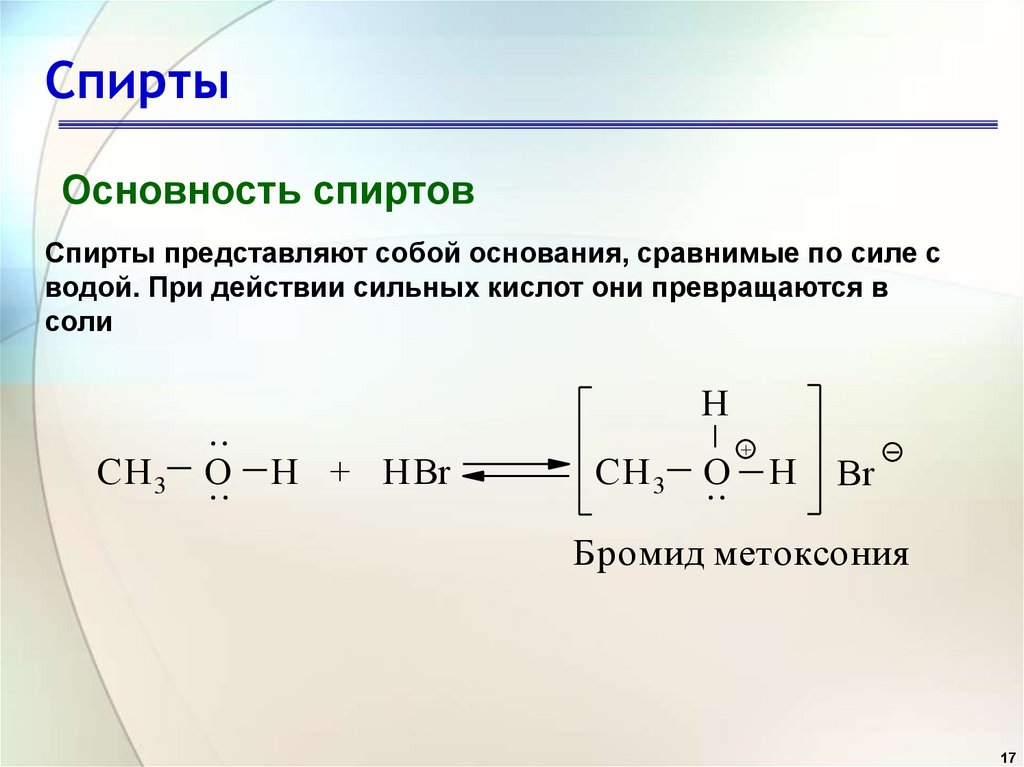
17. Спирты
Основность спиртовСпирты представляют собой основания, сравнимые по силе с
водой. При действии сильных кислот они превращаются в
соли
СН 3
..
О
.. Н + HBr
H
CH 3
O
..
+
H
Br
Бромид метоксония
17
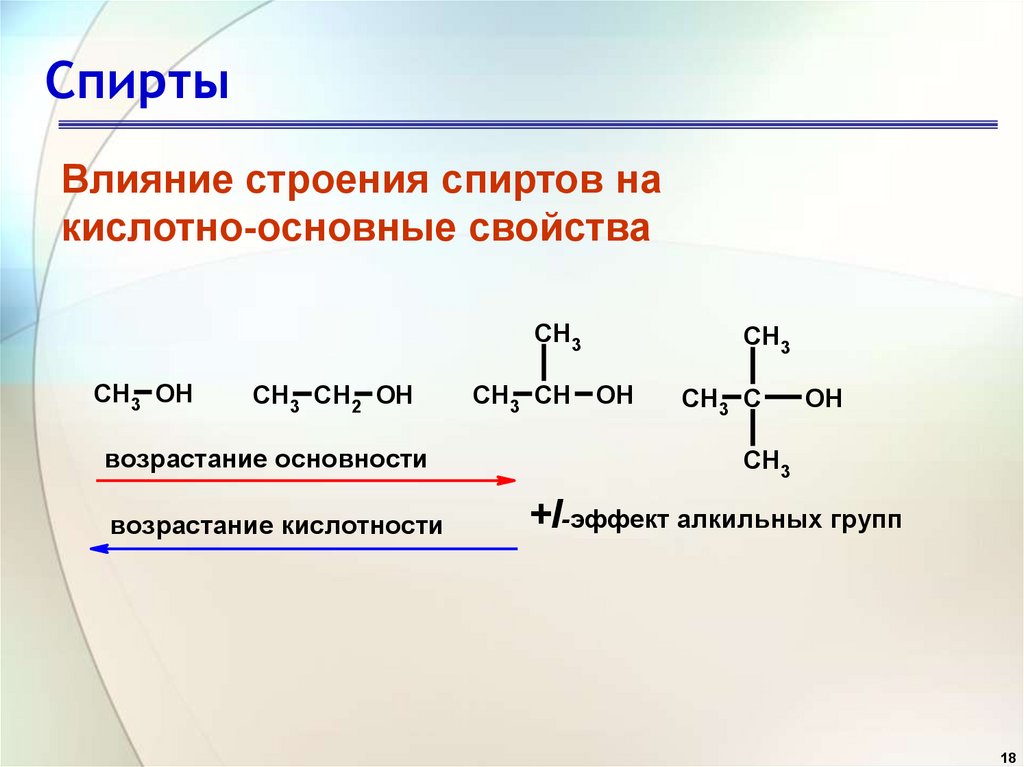
18. Спирты
Влияние строения спиртов накислотно-основные свойства
CH3
CH3 OH
CH3 CH2 OH
возрастание основности
возрастание кислотности
CH3 CH OH
CH3
CH3 C
OH
CH3
+I-эффект алкильных групп
18
19. Спирты
Взаимодействие с магнийгалогеналкиламиВ этой реакции происходит замещение гидроксильного водорода
на магнийгалоген и выделяется углеводород.
СН 3СН 2
MgBr
+ RO H
Более
сильная
кислота
RO
MgBr + CH 3CH 2 H
Более
слабая
кислота
В случае использования СН3MgJ выделяется метан. По объему
выделившегося метана определяют количественное
содержание гидроксильных групп
19
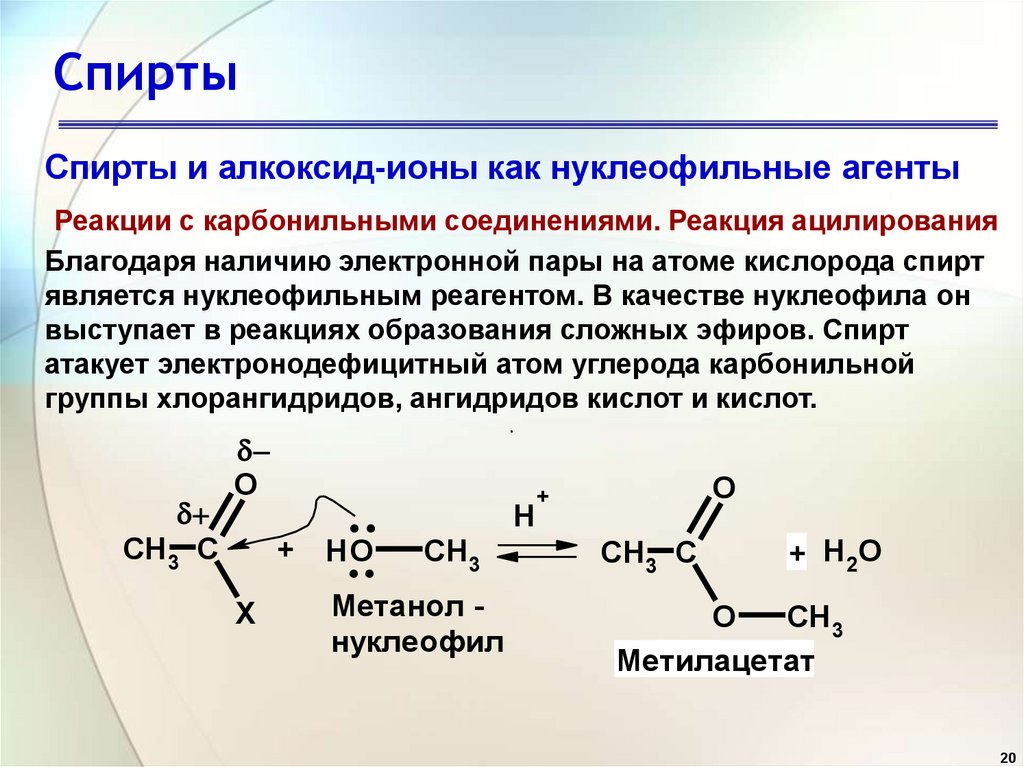
20. Спирты
Спирты и алкоксид-ионы как нуклеофильные агентыРеакции с карбонильными соединениями. Реакция ацилирования
Благодаря наличию электронной пары на атоме кислорода спирт
является нуклеофильным реагентом. В качестве нуклеофила он
выступает в реакциях образования сложных эфиров. Спирт
атакует электронодефицитный атом углерода карбонильной
группы хлорангидридов, ангидридов кислот и кислот.
CH3 C
O
X
.
..
+ HO
..
H
CH3
Метанол нуклеофил
O
+
CH3 C
+ H2 O
O
CH3
Метилацетат
20
21. Спирты
Реакции с карбонильными соединениями. Реакция ацилированияX=
-Cl
O
O C
Хлорангидриды карбоновых кислот
Ангидриды карбоновых кислот
CH3
-OH
Карбоновые кислоты
.
С карбоновыми кислотами спирты реагируют в присутствии
кислотных катализаторов, которые увеличивают поляризацию,
а, следовательно, и реакционную способность карбонильной
групп, Эта реакция называется реакцией этерификации
Это реакция нуклеофильного замещения (SN), протекающая
через стадии нуклеофильного присоединения и отщепления
(AdN, E).
21
22. Спирты
Реакция с участием связи R–OHЭлектроотрицательный
электронов
C
связи
кислород,
оттягивая
общую
пару
O
создает частичный положительный заряд на углероде и этот атом
углерода может подвергаться атаке нуклеофила:
.
Nu
C
OH
22
23. Спирты
Реакции нуклеофильного замещенияРеакции с галогеноводородами, образование алкилгалогенидов
Спирты легко реагируют с галогеноводородами (HCl, HBr, HI).
Реакционная способность падает в ряду
НI > HBr > HCl.
ROH
+
RХ
HX
+ H 2O
Сухой газообразный галогеноводород пропускают в спирт или спирт
нагревают с концентрированным раствором галогеноводорода.
Реакция катализируется кислотами. Спирт, присоединяя протон,
превращается в ион алкилоксония, который гораздо легче отщепляет
нейтральную молекулу воды (“хорошая” уходящая группа), чем спирт
– ион ОН (“плохая” уходящая группа).
R
..
OH
H
+
+
HX
H
X
R
..O
+
R O
.. H + X
Ион алкилоксония
H
X
R
+ H 2O
23
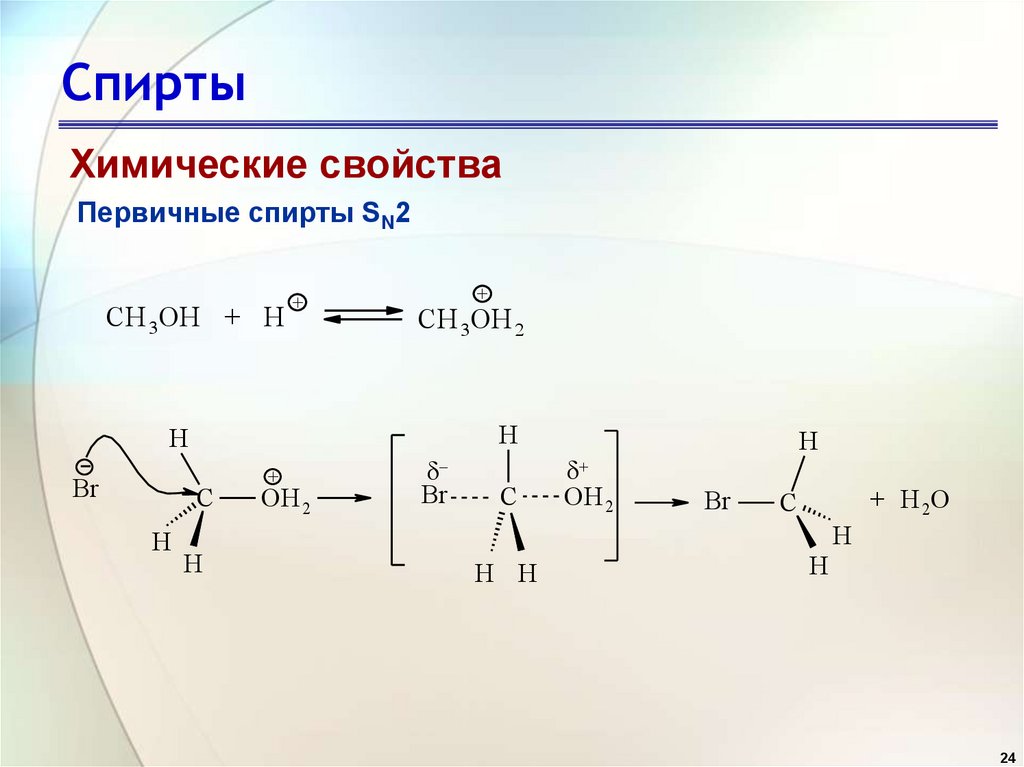
24. Спирты
Химические свойстваПервичные спирты SN2
CH 3OH + H
+
+
CH 3OH 2
H
H
Br
C
H
H
+
OH 2
Br
C
H
OH 2
Br
+ H 2O
C
H
H H
H
24
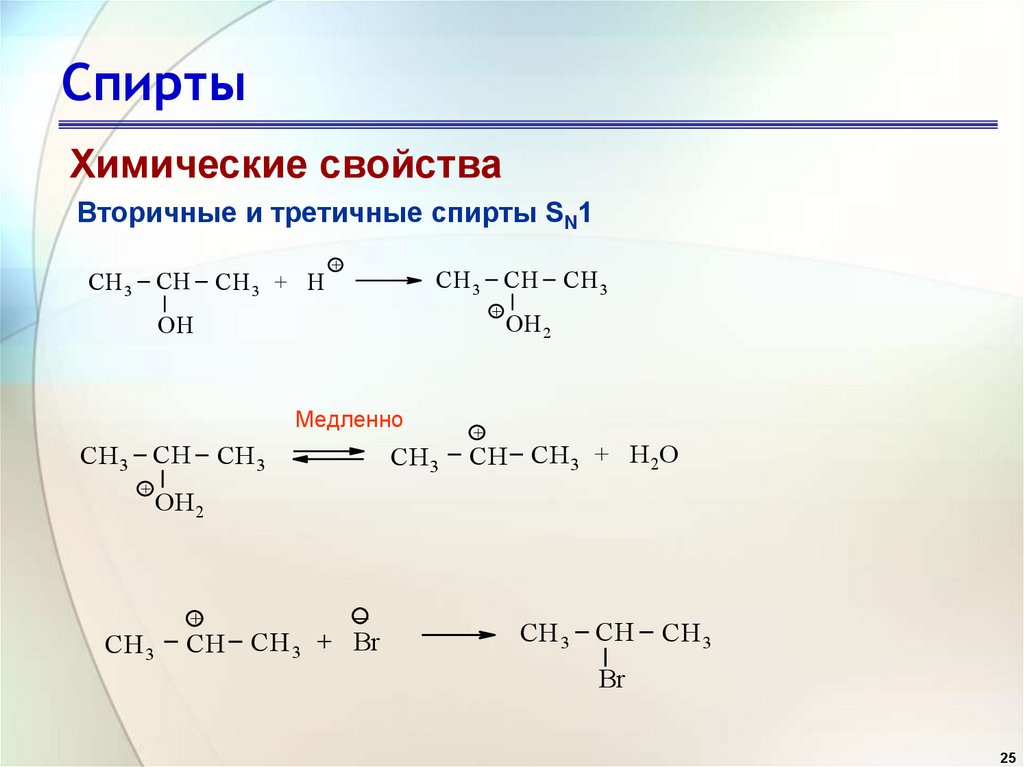
25. Спирты
Химические свойстваВторичные и третичные спирты SN1
СH 3 CH
СH 3 + H
+
СH 3 CH
+
OH
Медленно
СH 3 CH
+
СH 3
СH 3
СH 3
СH 3
OH 2
+
CH СH 3 + H 2O
OH 2
+
_
CH СH 3 + Br
СH 3 CH
СH 3
Br
25
26. Спирты
Химические свойстваВторичные и третичные спирты SN1
Поскольку реакции замещения у вторичных и третичных спиртов
протекают через стадию образования карбониевого иона, возможна
перегруппировка.
СH 3
СH 3
СH 3
CH 3
CH
CH
СH 3
HI
СH 3
C
CH 2
СH 3 + H 2O
OH
3-Метил-2-бутанол
I
2-Метил-2-иодбутан
CH 3
CH 3
C
CH
H
OH 2
+
CH 3
CH 3
C
+
CH
CH 3 + H 2O
CH 3
H
I
Перегруппировка CH
C
CH
CH
3
2
3
+
Перенос
Третичный карбокатион
гидрид-иона Н
более устойчив
CH 3
CH 3
C
CH 2
CH 3
I
26
27. Спирты
Химические свойстваРеакционная способность спиртов по отношению
галогенводородам изменяется следующим образом:
к
Бензиловый, аллиловый > трет- > втор- > первичный < метанол
SN1
Устойчивость карбокатионов увеличивается,
реакционная способность
возрастает
SN2
Пространственные
препятствия для атаки
реакционного центра
уменьшаются,
реакционная
способность
увеличивается
27
28. Спирты
Реакции нуклеофильного замещенияРеакция с галогенидами фосфора PCl5, PCl3, PBr3, PI3,
тионилхлоридом SOCl2.
Для получения алкилгалогенидов используют реакции спиртов с
галогенидами фосфора и тионилхлоридом, они не сопровождаются
перегруппировками
СН3 Br
СН3 ОН
3СН3 СН СН СН3
3-Метил-2-бутанол
+ PBr3
3СН3
СН3
+ P(OH)3
СН3 Cl
+ PCl5
СН3
СН
СН
СН3
+ POCl3 + HCl
2-Хлор-3-метилбутан
СН3 Cl
СН3 ОН
СН3 СН СН СН3
3-Метил-2-бутанол
СН
2-Бром-3-метилбутан
СН3 ОН
СН3 СН СН СН3
3-Метил-2-бутанол
СН
+ SOCl2
СН3
СН
СН
СН3
+ SO2 + HCl
2-Хлор-3-метилбутан
28
29. Спирты
Реакции нуклеофильного замещенияМежмолекулярная дегидратация спиртов. Получение
простых эфиров
СH3СH2OH + HOCH2CH3
H
+
СH3СH2
O
CH2CH3 + H2O
Диэтиловый эфир
Межмолекулярная дегидратация спиртов в присутствии
каталитических количеств кислоты служит примером
нуклеофильного замещения, в котором субстратом является
протонированная молекула спирта, а другая молекула ROH
служит нуклеофилом
29
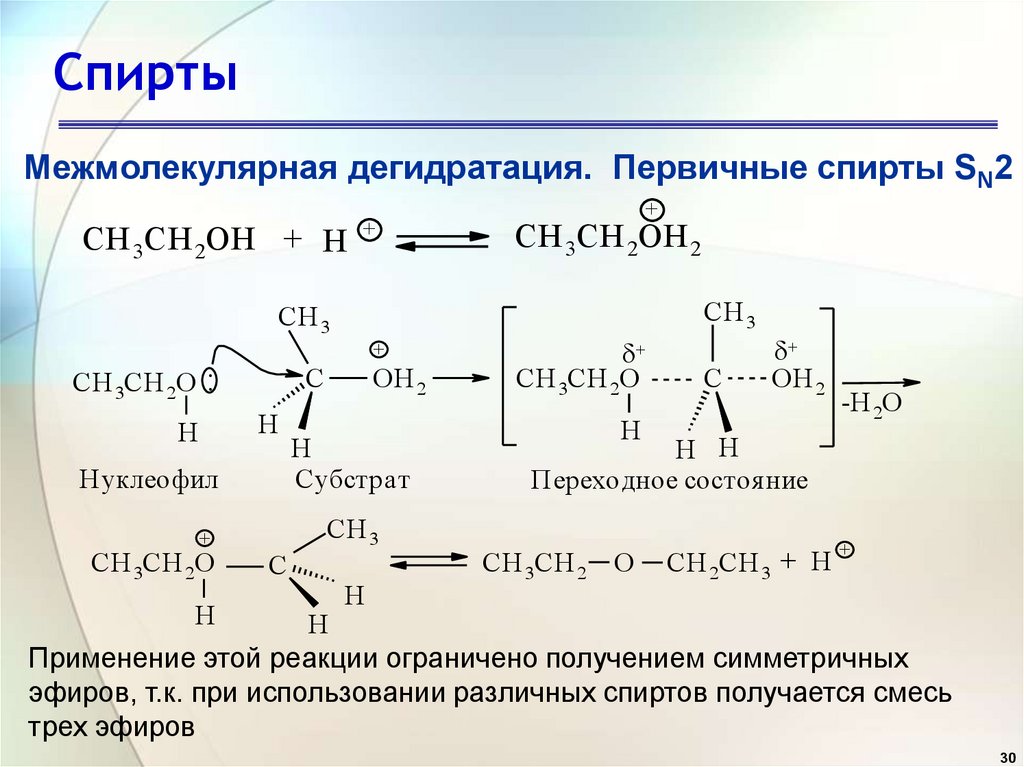
30. Спирты
Межмолекулярная дегидратация. Первичные спирты SN2СH 3СH 2OH + H
+
+
Нуклеофил
H
H
Субстрат
CH 3
+
CH 3CH 2O
OH 2
C
H
H
C
СH 3СH 2OH 2
CH 3
CH 3
CH 3CH 2O :
+
H
CH 3CH 2O
C
OH 2
H
-H 2O
H H
Переходное состоя ние
CH 3CH 2
O
CH 2CH 3 + H
+
H
Применение этой реакции ограничено получением симметричных
эфиров, т.к. при использовании различных спиртов получается смесь
трех эфиров
30
31. Спирты
Синтез простых эфировВажным методом получения простых эфиров является реакция
алкоголятов с алкилгалогенидами (синтез Вильямсона) или
алкилсульфатами ROSO2OR
С 2Н 5О
+
Na
+
CH 3I
SN 2
C 2H 5OCH 3 +
Метилэтиловый
эфир
NaI
31
32. Спирты
Получение простых эфиров. Синтез А.Вильямсона.Важным методом получения простых эфиров
реакция
алкоголятов
с
алкилгалогенидами
Вильямсона) или алкилсульфатами ROSO2OR.
+
С2Н5О Na
+
+
CH3I
SN2
является
(синтез
C2H5OCH3 + NaI
Метилэтиловый
эфир
C6H5-O Na + H3C-OSO2O-C6H4CH3-п
C6H5-O-CH3 + п-CH3C6H4SO2O Na
32
33. Спирты
Александр УильямВильямсон
33
34. Спирты
Получение простых эфиров. Синтез А.Вильямсона.Бόльшая нуклеофильность алкоксидиона RО по сравнению со
спиртом ROH означает бόльшую склонность к тому, чтобы
выступать в качестве основания в реакции элиминирования.
Поэтому при получении смешанных эфиров ROR1 следует
учитывать возможность протекания конкурирующих реакций:
нуклеофильного замещения и элиминирования. Например, для
получения метилизопропилового эфира следует использовать
йодистый метил и изопропилоксид натрия, а не изопропилиодид
и метоксид натрия
34
35. Спирты
Синтез простых эфировПример 1
CH 3I + CH 3CHO
CH 3
+
Na
SN 2
CH 3CHO
CH 3 + NaCl
CH 3
Метилизопропиловый эфир,
единственный продукт
35
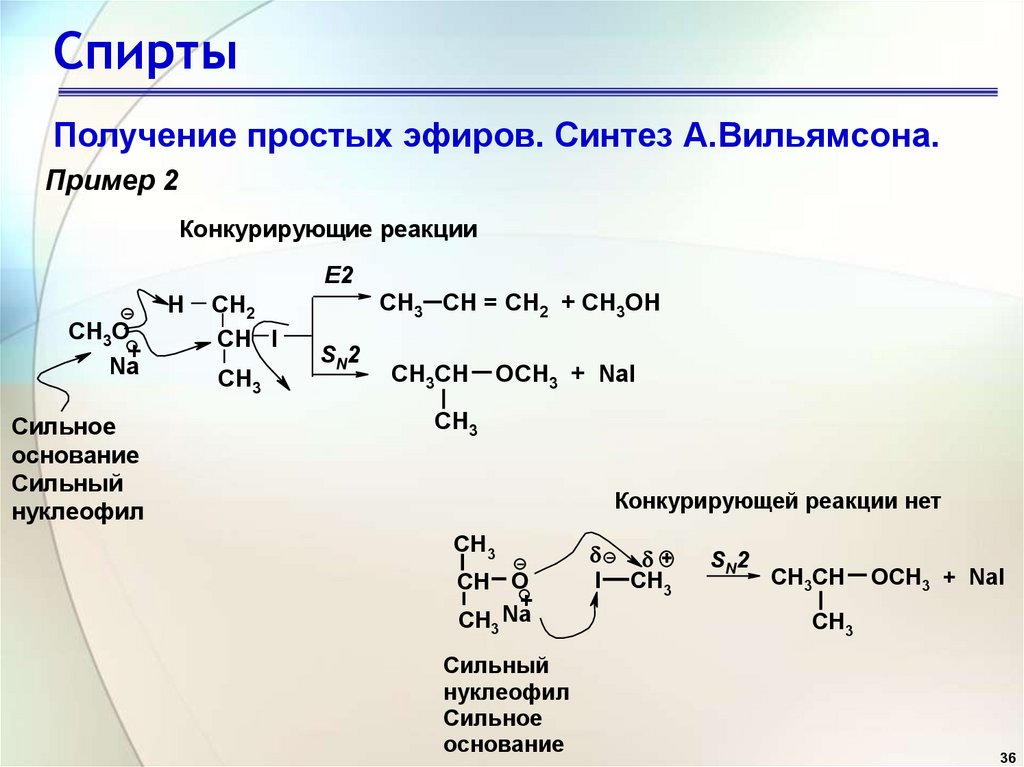
36. Спирты
Получение простых эфиров. Синтез А.Вильямсона.Пример 2
Конкурирующие реакции
E2
H
CH3О
+
Na
Сильное
основание
Сильный
нуклеофил
CH2
CH I
CH3
CH3 CH = CH2 + CH3OH
SN2
CH3CH
OCH3 + NaI
CH3
Конкурирующей реакции нет
CH3
CH О
+
Na
CH
3
Сильный
нуклеофил
Сильное
основание
I
+
CH3
SN2
CH3CH
OCH3 + NaI
CH3
36
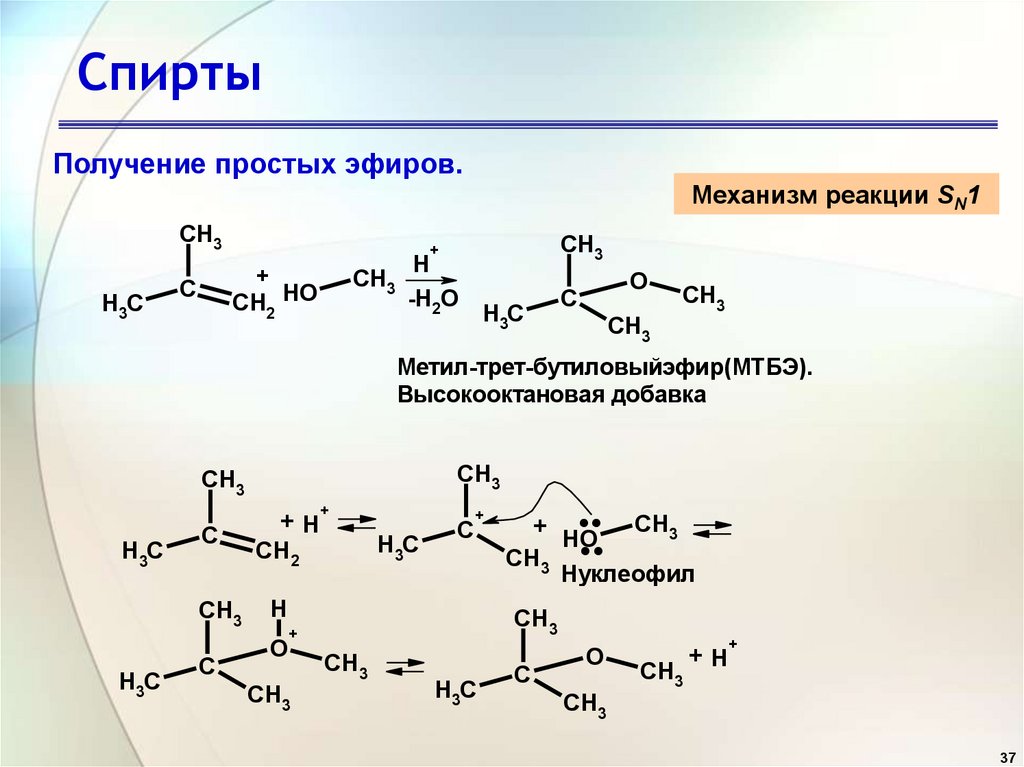
37. Спирты
Получение простых эфиров.Механизм реакции SN1
CH3
H3C
+
CH2 HO
C
CH3
+
CH3
H
-H2O
H3C
O
C
CH3
CH3
Метил-трет-бутиловыйэфир(МТБЭ).
Высокооктановая добавка
H3C
H3C
C
+H
CH2
CH3
H
C
....
CH3
CH3
+
H3C
C
+
CH3
+
O
CH3
CH3
+
HO
CH3
Нуклеофил
CH3
H3C
C
O
CH3
+H
+
CH3
37
38. Спирты
Межмолекулярная дегидратацияВторичные и третичные спирты не подвергаются межмолекулярной
дегидратации, а реагируют с образованием продуктов
внутримолекулярной дегидратации - алкенов
CH3
CH
CH2
CH3
OH
2-Бутанол
C
CH2
E1
CH3
CH = CH2
CH3 + H2O
транс-2-бутен
(основной продукт)
ОН
CH3
H2SO4, T
CH3
СН3
2-Метил-2-бутанол
(трет-Пентиловый спирт)
H2SO4, T
E1
CH3
C = CH
CH3 + Н2О
СН3
2-Метил-2-бутен
38
39. Спирты
Образование алкенов – внутримолекулярнаядегидратация
Под влиянием электроотрицательного кислорода на связанном с
кислородом атоме углерода появляется положительный заряд,
это вызывает поляризацию связи углерод-углерод и далее связи
'
C
OH, ' <
C
H
В определенных условиях водород при Сβ способен отщепляться в в
протона, происходит реакция элиминирования
Н
ОН
СН 2
СН 2
H 2SO 4, T
СН 2
СН 2 + Н 2O
39
40. Спирты
Образование алкенов – внутримолекулярнаядегидратация
Спирт превращается в алкен при температуре ~ 200 оС в
присутствии серной или фосфорной кислоты, либо при
пропускании паров спирта над окисью алюминия (Al2O3 - кислота
Льюиса) при температуре 300-350 оС.
40
41. Спирты
Образование алкенов – внутримолекулярнаядегидратация
Механизм дегидратации Е1
Первая стадия
..
+
CH 3
CH 2OH + H
CH 3
H
.. + Медленно
CH 2OH
CH 3
H
.. +
CH 2OH
Протонированный спирт
оксоний-ион
+
CH 3 CH 2 + H 2O
41
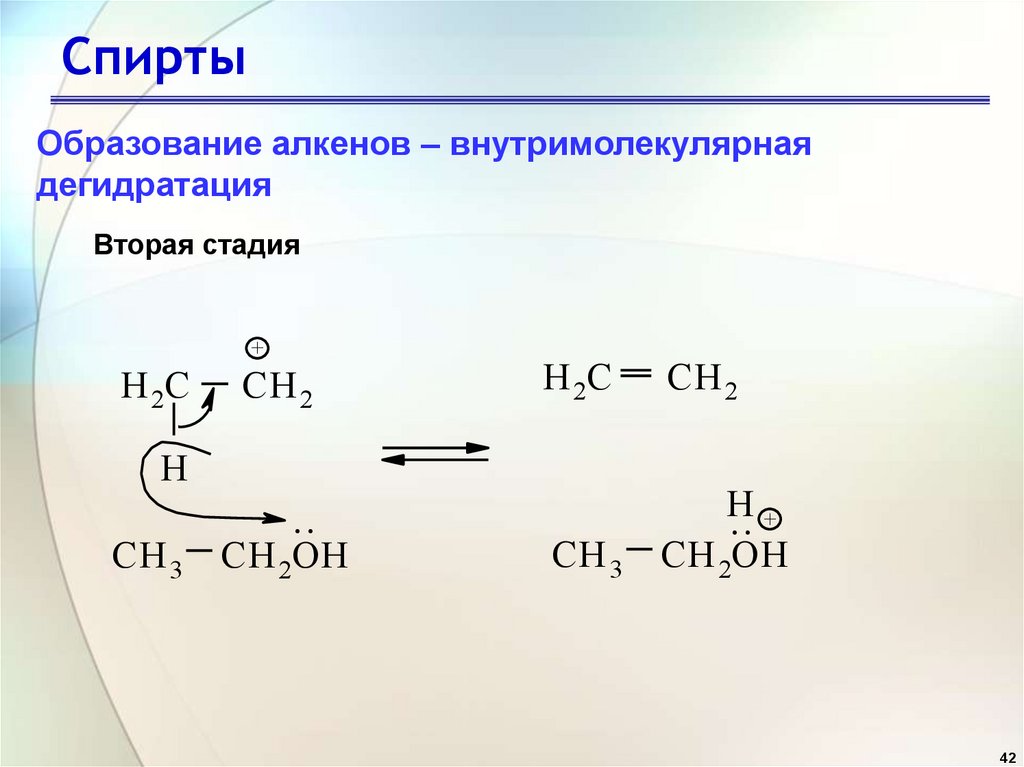
42. Спирты
Образование алкенов – внутримолекулярнаядегидратация
Вторая стадия
+
H 2C
CH 2
H 2C
CH 2
CH 3
H
.. +
CH 2OH
H
..
CH 3 CH 2OH
42
43. Спирты
Образование алкенов – внутримолекулярнаядегидратация
В отличие от галогеналканов, которые
подвергаются элиминированию в основном
по Е2-механизму, спирты реагируют только по
механизму Е1. Элиминирование Е2 требует
присутствия
сильного
основания
для
отщепления протона, но кислая среда,
необходимая для протонирования спирта, и
сильное основание не совместимы.
43
44. Спирты
Образование алкенов – внутримолекулярнаядегидратация
Ориентация. Элиминирование спиртов происходит с
образованием более устойчивого, т.е. более
алкилированного алкена (правило Зайцева).
CH 3
CH 2
CH
OH
CH 3
H 2SO 4, T
CH CH CH 3 + H 2O
2-Бутен
(основной продукт)
CH 3
44
45. Спирты
Образование алкенов – внутримолекулярнаядегидратация
Перегруппировка.
CH 3 CH 2 CH 2 CH 2 OH
+
H
+
CH 3 CH 2 CH 2 CH 2 OH 2
+
+
CH 3 CH 2 CH 2 CH 2 OH 2
+
CH 3 CH 2 CH 2 CH 2 +
Первичный карбокатион
H 2O
+
CH 3 CH
H
+
CH
CH 3
CH 3 CH
..
CH 3 CH 2 CH 2 CH 2 OH
Перегруп- CH 3 CH 2 CH CH 3
пировка Вторичный карбокатион
б. устойчив
CH CH 3
+
CH 3 CH 2 CH 2 CH 2 OH 2
45
46. Спирты
Реакции окисленияПервичные спирты можно окислить до альдегидов действием
К2Сr2О7, если одновременно с окислением вести отгонку легко
окисляющихся альдегидов, которые кипят при более низкой
температуре, чем исходные спирты
O
Отгонка [O]
CH 3
CH CH 2
CH 2
OH
CH 3
K2 Cr2 O7 , H2 SO4
K2 Cr2 O7 , H2 SO4
CH 3
CH CH 2
COO K
СH 3
Cоль растворима в воде
C
H
СH 3
Изовалериановый альдегид
Т к = 92,5 o C
СH 3
Изопентиловый спирт
Т к = 130,5 o C
[O]
CH CH 2
+
H
O
+
CH 3
CH CH 2
C
ОH
СH 3
Изовалериановая кислота
не растворима в воде
При нагревании первичных спиртов с водным
перманганата калия получают карбоновые кислоты.
раствором
46
47. Спирты
Реакции окисленияВторичные спирты окисляются до кетонов действием
перманганата калия или хромовой кислотой.
CH 3 CH
CH 3
OH
Изопропиловый
спирт
[O]
K 2Cr 2O 7, H 2SO 4
CH 3 C
CH 3
O
Ацетон
Дальнейшее окисление кетона возможно только в жестких
условиях, т.к. при этом происходит разрыв углерод-углеродной
связи.
47
48. Спирты
Реакции окисленияТретичные спирты в присутствии кислот превращаются в
алкены, которые далее легко окисляются. В щелочной и
нейтральной средах третичные спирты не окисляются.
48
49. Спирты
Реакции окисленияПревращение первичных спиртов в альдегиды, вторичных – в
кетоны можно осуществлять, нагревая пары спирта до
температуры 200-300 оС, над медным катализатором – реакция
дегидрирования.
H
CH 3
C
Н
O
Н
Сu, Т
СН 3
O
CH 3
C
+ Н 2,
Н
CH 3
C
H
O
Н
Сu, Т
CH 3
C
CH 3 + Н 2
O
49
50. Спирты
Замещение гидроксигруппы на водородСпирты устойчивы к действию химических восстановителей. Они
не восстанавливаются и водородом над катализаторами.
Поэтому они часто используются в качестве растворителей при
восстановлении. Методы непрямого восстановления спиртов
основаны на превращении спиртов в соединения других классов,
способных восстанавливаться до углеводородов
CH3CH2CH2OH
R-OH
HI
H2SO4, t
R-I
HI
CH3CH=CH2
H2 / Pt
CH3CH2CH3
R-H + I2
50
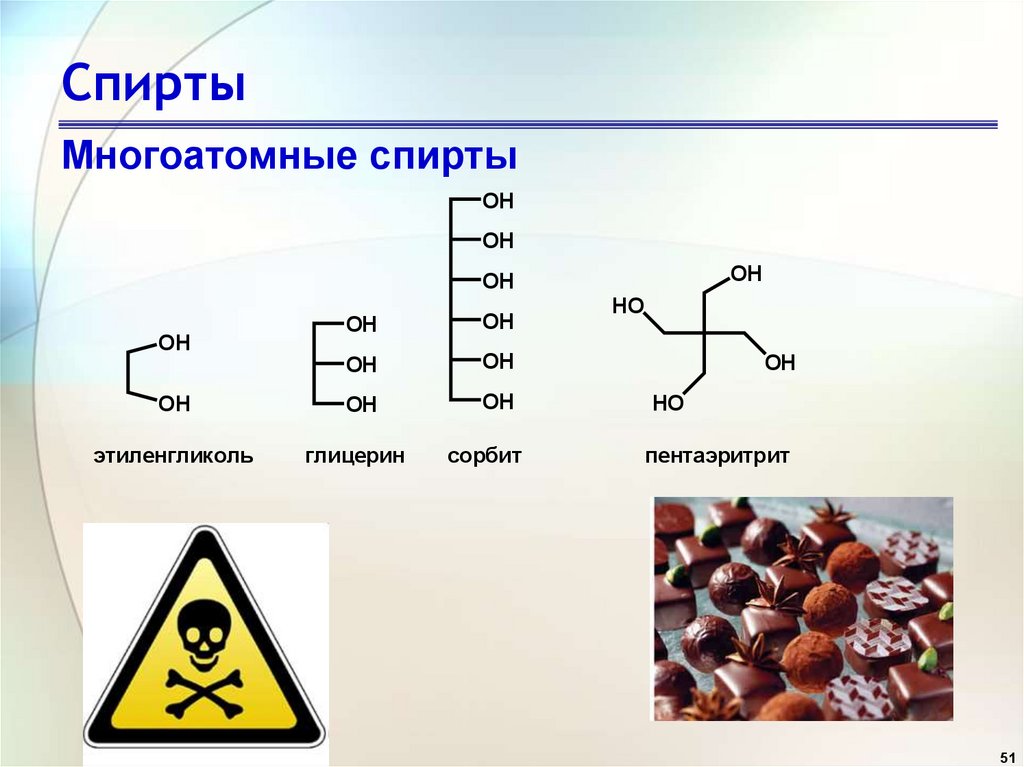
51. Спирты
Многоатомные спиртыOH
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
этиленгликоль
глицерин
сорбит
OH
HO
OH
HO
пентаэритрит
51
52. Спирты
Многоатомные спиртыПри гидроксилировании алкенов получают вицинальные
диолы. Простейший виц-диол – гликоль (этиленгликоль, 1,2этандиол). Получают в промышленности из этилена
CH2=CH2
Cl2 + H2O
CH2-CH2
Cl
Ca(OH)2
OH
CH2-CH2
O
H2O, H+
CH2-CH2
HO
OH
этиленхлоргидрин
H2 O, NaOH
Этиленгликоль применяю для получения простых эфиров,
диоксана (растворители) и в производстве полиэфиров.
52
53. Спирты
Многоатомные спиртыДругой важный многоатомный спирт (глицерин,
1,2,3-пропантриол) получаю в промышленности гидролизом
жиров или из пропилена
CH2=CH-CH3
Cl2, 400o
NaOH, H2O
CH2=CH-CH2 Cl
CH2=CH-CH2 OH
хл. аллил
аллиловый спирт
Cl2, H2 O
CH2 Cl-CH(OH)-CH2 Cl
H2 O2, H2 O
NaOH, H2O
HOCH2 -CH(OH)-CH2 OH
Глицерин используется в пищевой и парфюмерной
промышленности, для получения полимеров и др.
53
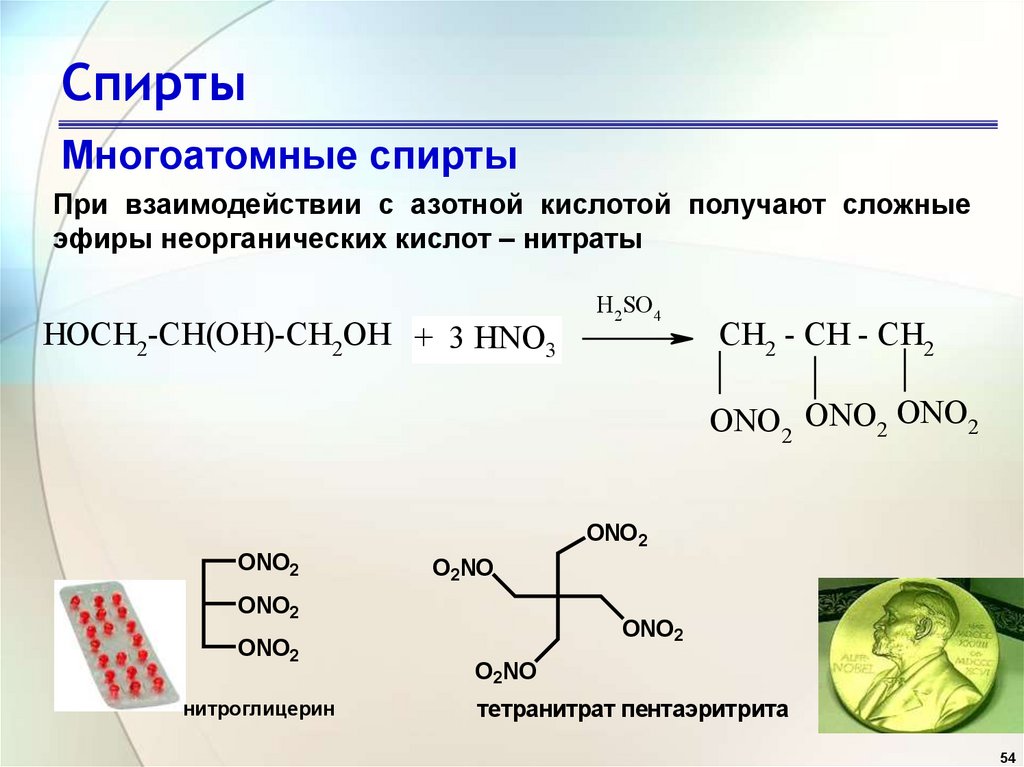
54. Спирты
Многоатомные спиртыПри взаимодействии с азотной кислотой получают сложные
эфиры неорганических кислот – нитраты
HOCH2-CH(OH)-CH2OH + 3 HNO3
H2 SO4
CH2 - CH - CH2
ONO2 ONO2 ONO2
ONO2
ONO2
O2NO
ONO2
ONO2
нитроглицерин
ONO2
O2NO
тетранитрат пентаэритрита
54
55. Спирты
Способы получения1. Гидратация алкенов (промышленный метод)
Присоединение воды к алкенам происходит в присутствии
кислых катализаторов (серная, фосфорная кислоты, оксид
алюминия или другой носитель, обработанный кислотами).
Реакция
идет
по
механизму
электрофильного
присоединения АЕ.
СН 2 = СН
СН 2 +
Н 2О
Н+
СН 3 СН
СН 3
ОН
Поскольку реакция электрофильного присоединения
протекает через стадию образования карбокатиона, возможна
перегруппировка с образованием наиболее устойчивого
карбокатиона
55
56. Спирты
Способы получения2. Брожение сахаров
Дрожжи сбраживают некоторые виды сахаров. Это сложный
каталитический многостадийный распад на спирт и диоксид
углерода
С 6Н 12О 6
2С 2Н 5ОН + 2СО 2
56
57. Спирты
Способы получения3. Гидролиз галогеналканов
Гидролиз галогеналканов проводят при нагревании с водным
раствором щелочей. Реакция протекает по механизму SN1 или
SN2 в зависимости от строения галогеналкана
ОН
Br
СН 3
СН
СН 3
NaOH, Т
СН 3 CH
CH 3
+ NaBr
Если реакция протекает по механизму SN1, возможна
перегруппировка с образованием наиболее устойчивого
карбокатиона
57
58. Спирты
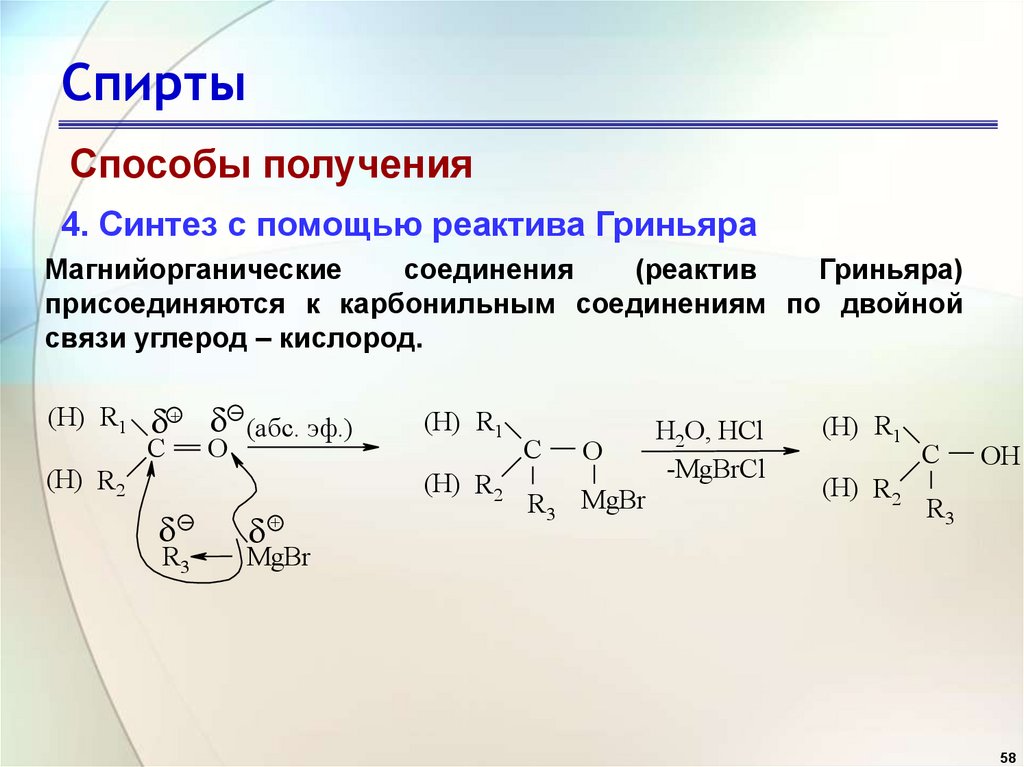
Способы получения4. Синтез с помощью реактива Гриньяра
Магнийорганические
соединения
(реактив
Гриньяра)
присоединяются к карбонильным соединениям по двойной
связи углерод – кислород.
(H) R1
+ (абс. эф.)
С
О
(H) R2
(H) R1
(H) R2
R3
+
С
О
R3 MgBr
H2O, HCl
-MgBrCl
(H) R1
(H) R2
С
ОH
R3
MgBr
58
59. Спирты
Способы получения4. Синтез с помощью реактива Гриньяра
Для синтеза первичных спиртов используют в качестве
карбонильного соединения муравьиный альдегид. Для
получения вторичных спиртов в качестве карбонильного
соединения используют соответствующий альдегид. В случае
синтеза третичных спиртов исходное карбонильное соединение
– кетон.
59
60. Спирты
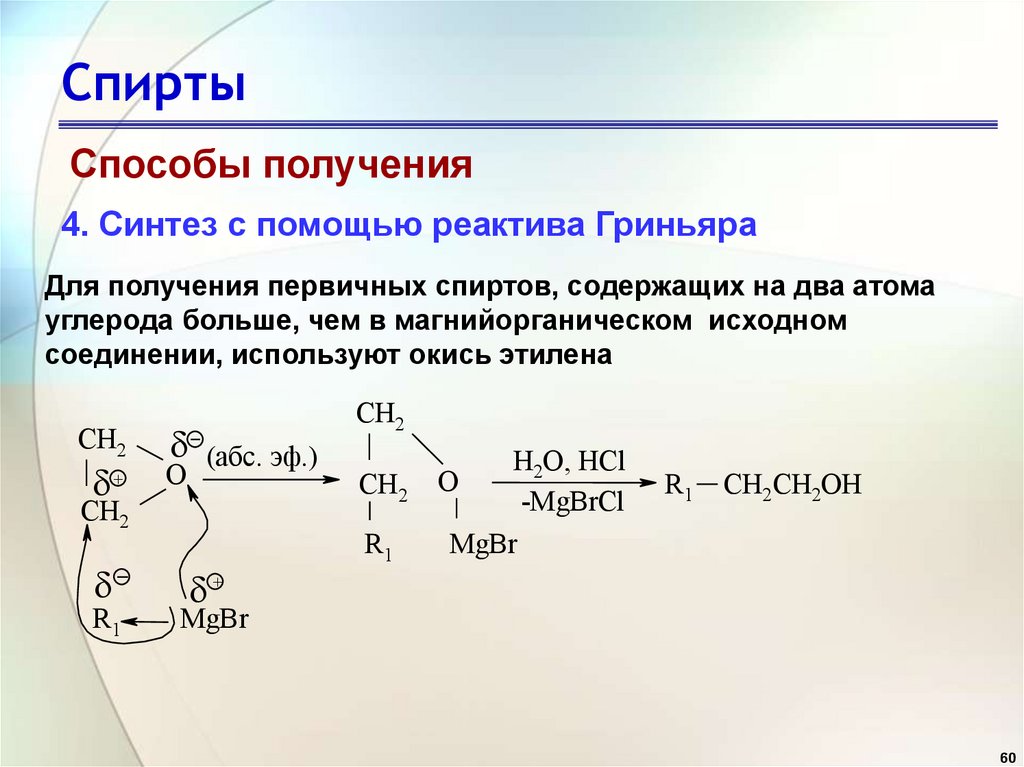
Способы получения4. Синтез с помощью реактива Гриньяра
Для получения первичных спиртов, содержащих на два атома
углерода больше, чем в магнийорганическом исходном
соединении, используют окись этилена
СН2
+
(абс. эф.)
О
СН2
R1
+
СН2
СН2
R1
H2O, HCl
О
-MgBrCl
MgBr
R1
CH2СН2OH
MgBr
60
61. Спирты
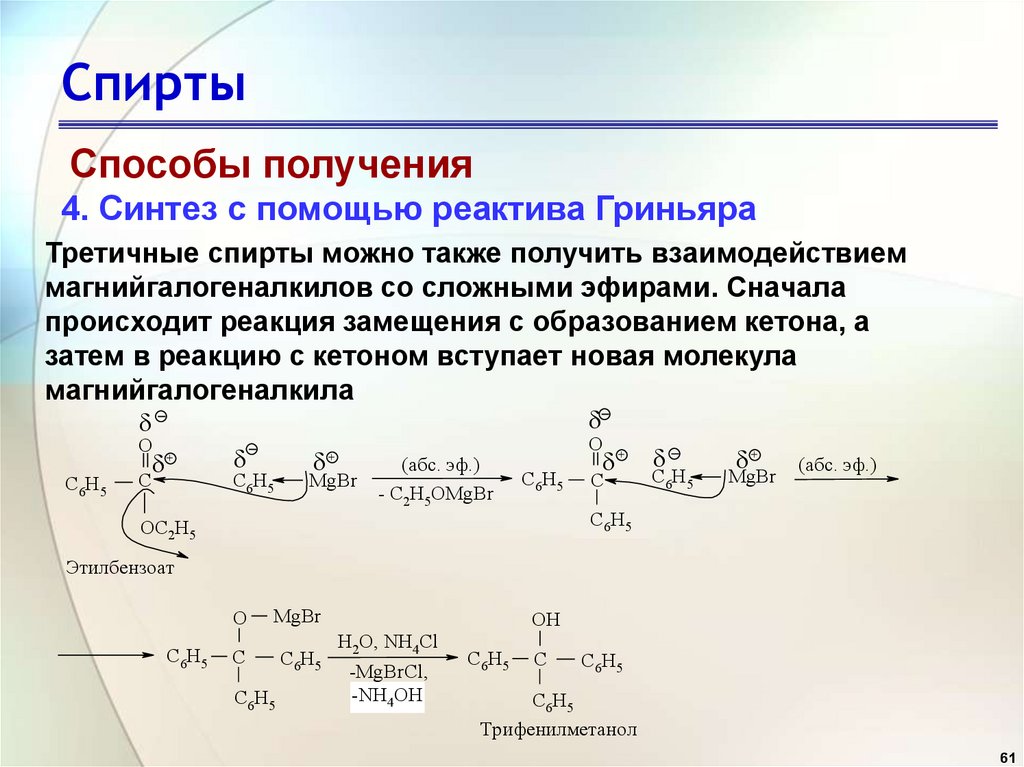
Способы получения4. Синтез с помощью реактива Гриньяра
Третичные спирты можно также получить взаимодействием
магнийгалогеналкилов со сложными эфирами. Сначала
происходит реакция замещения с образованием кетона, а
затем в реакцию с кетоном вступает новая молекула
магнийгалогеналкила
O
С6Н5
С
+
С6Н5
+
MgBr
(абс. эф.)
- С2Н5ОMgBr
O
С6Н5
+
С
С6Н5
+
MgBr
(абс. эф.)
С6Н5
ОС2Н5
Этилбензоат
С6Н5
О
MgBr
С
С6Н5
С6Н5
ОН
H2O, NH4Cl
-MgBrCl,
-NH4OH
С6Н5
С
С6Н5
С6Н5
Трифенилметанол
61
62. Спирты
Способы получения5. Гидроборирование-окисление алкенов
Алкены взаимодействуют с дибораном В2Н6 с образованием
алкилборана. Диборан - димер гипотетического борана ВН3 - в
рассматриваемой реакции действует как ВН3
CH 3 CH
CH 2
ВН 3
CH 3 CH
Н
CH 2
2CH 3 CH
ВН 2
CH 2
CH 3 CH 2 CH 2 В
CH 2 CH 2 CH 3
CH 2 CH 2 CH 3
Трипропилбор
Триалкилбораны затем окисляют гидропероксидом в присутствии
щелочи
(CH 3 CH 2 CH 2)3B
H 2O 2, OH
3CH 3 CH 2 CH 2OH
+
В(ОН)3
62
63. Спирты
Способы получения6. Восстановление карбонильных соединений
Альдегиды восстанавливаются в первичные спирты, кетоны –
во вторичные водородом (Ni) или с помощью алюмогидрида
лития LiAlH4, не затрагивая двойные углерод-углеродные связи.
O
CH 3 CH = CH
H 2, Ni
C
CH 3 CH 2 CH 2 CH 2OH
H
4 CH3
CH = CH
C
O
+ H
H
H
Al
+
H Li
H
OCH2
CH3
CH = CH
CH2O
Al
4 CH3
CH = CH
CH3
+
OCH2
OCH2
10 % H2SO4
CH = CH
CH = CH
CH = CH
CH2OH + Al+3
CH3
Li
CH3
+
Li+1
63
64. Спирты
Способы получения6. Восстановление карбонильных соединений
Литийалюминийгидрид LiAlН4 – удобный, но дорогой
восстанавливающий агент, используют для синтеза спиртов,
которые менее доступны, чем карбонильные соединения.
Эта реакция представляет собой нуклеофильное присоединение:
нуклеофилом
водород, переносимый вместе с парой
..является
электронов Н
от металла на карбонильный углерод
+
С=О
H
AlH3
AN
C
H
O
3 С=О
AlH3
+
Li
C
H
+
Al Li
O
4
+
Li
Образовавшийся таким образом комплексный алкоксид алюминия подвергается
гидролитическому расщеплению
64
65. Спирты
Способы получения6. Восстановление карбонильных соединений
Получение первичных спиртов восстановлением карбоновых
кислот предпочтительно в том случае, когда кислоты более
доступны, чем спирты.
O
CH3(CH2)14
C
LiAlH4
ОН
Пальмитиновая кислота
10 % H2SO4
CH3(CH2)14CH2OH
1-Гексадеканол
65
66. Спирты
Способы получения6. Восстановление карбонильных соединений
Первичные спирты также могут быть получены
восстановлением эфира, при этом оба фрагмента эфира
превращаются в спирты.
H2,Ni
O
CH3(CH2)14
C
Метилпальмитат
OCH3
LiAlH4
10 % H2SO4
CH3(CH2)14
CН2ОН + СН3ОН
66
67. Спирты
Способы получения7. Гидрированием окиси углерода в различных условиях можно
получить как чистый метиловый спирт, так и смесь его
первичных гомологов.
СО + 2Н 2
Н 3С
ОН
67












































 chemistry
chemistry








