Similar presentations:
Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений
1.
ОСОБЕННОСТИ СТРОЕНИЯ,РЕАКЦИОННОЙ СПОСОБНОСТИ
И МЕТОДЫ СИНТЕЗА
АЗОТСОДЕРЖАЩИХ СОЕДИНЕНИЙ
2.
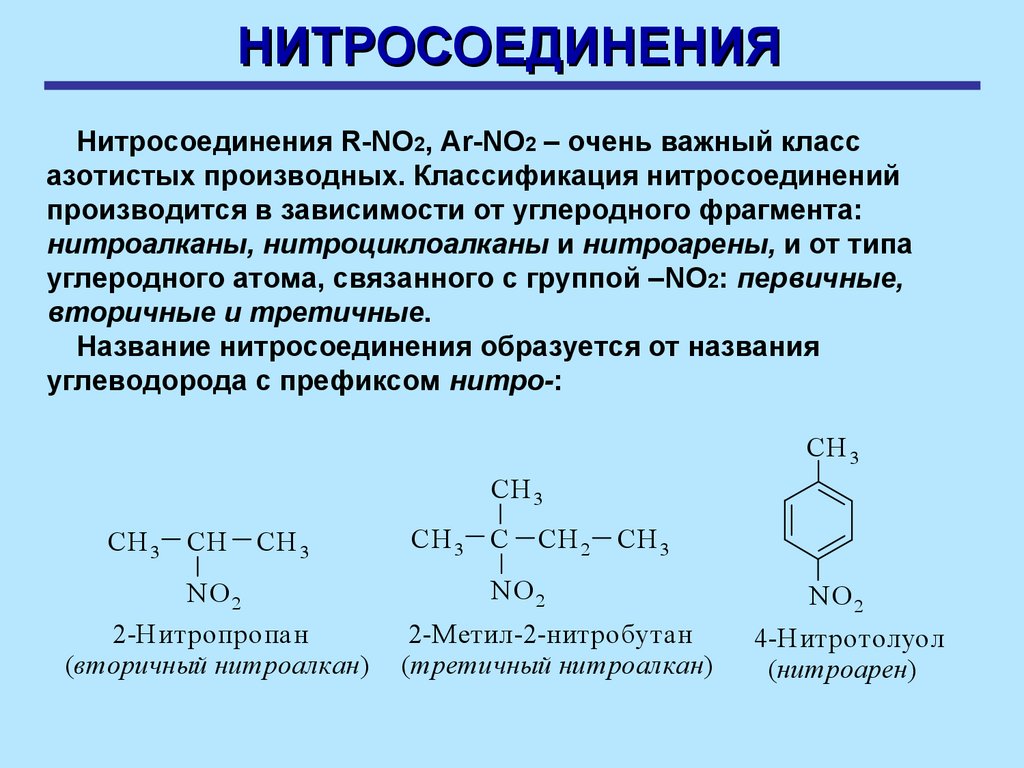
НИТРОСОЕДИНЕНИЯНитросоединения R-NO2, Ar-NO2 – очень важный класс
азотистых производных. Классификация нитросоединений
производится в зависимости от углеродного фрагмента:
нитроалканы, нитроциклоалканы и нитроарены, и от типа
углеродного атома, связанного с группой –NO2: первичные,
вторичные и третичные.
Название нитросоединения образуется от названия
углеводорода с префиксом нитро-:
СН 3
СН 3
CH 3
CH
CH 3
NO 2
2-Н итропропан
(вторичный нитроалкан)
CH 3
C
CH 2
СН 3
NO 2
2-Метил-2-нитробутан
(третичный нитроалкан)
NO 2
4-Нитротолуол
(нитроарен)
3.
НИТРОСОЕДИНЕНИЯСтроение и физические свойства
Нитрогруппа сильно полярна
+
R
N
O
O
R
+
N
O
O
+
R
N
O
1/2
O 1/2
В каждой из граничных структур показана семиполярная связь –
ковалентная донорно-акцепторная связь между азотом и
кислородом, образованная за счет пары электронов только одного
атома азота, вследствие чего оба атома получают заряды: атом
кислорода, акцептор пары электронов – отрицательный, атом азота,
донор пары электронов – положительный заряд
4.
НИТРОСОЕДИНЕНИЯСтроение и физические свойства
-NO2
электроноакцепторная группа
(-I, -M – эффекты)
O
N
+
..
..O
..
5.
НИТРОСОЕДИНЕНИЯСтроение и физические свойства
Нитроалканы представляют собой бесцветные жидкости с
высокими для их молекулярных масс температурами кипения.
Температура кипения нитрометана 101,2 оС; нитроэтана – 114 оС.
Они обладают приятным запахом, перегоняются без
разложения, мало растворимы в воде, ядовиты. Нитроалкены и
нитроарены – жидкие или твердые вещества желтого цвета. Они
тяжелее воды и не растворимы в ней. Эти нитросоединения
имеют острый запах и высокотоксичны, особенно нитробензол
6.
НИТРОСОЕДИНЕНИЯХимические свойства
Термодинамическая неустойчивость нитросоединений
Молярная теплота разложения нитрометана около 270 кДж/моль
СН3NO2→ 1/2 N2 + CO2 + 3/2 H2
Значительная энергия и большая скорость такого процесса
послужили основой для практического применения
нитросоединений в качестве взрывчатых веществ
7.
НИТРОСОЕДИНЕНИЯВосстановление нитросоединений до аминов
Восстановление нитросоединений до аминов – наиболее
важная реакция для синтеза азотсодержащих соединений.
Нитроалканы восстанавливают до алкиламинов оловом или
железом в кислой среде, водородом в условиях
гетерогенного катализа
СН 3NO 2
H 2, Ni
СН 3NH 2 + 2H 2O,
∆Н= -356 кДж/моль
8.
НИТРОСОЕДИНЕНИЯВосстановление нитросоединений до аминов
Реакция восстановления нитроаренов протекает гладко при
действии олова или железа в соляной кислоте, а также
водорода Н2 (Ni), гидросульфидов металлов, цинка в щелочной
среде
NO2
+
NaOH
NH3HSO4
Fe, H2SO4
NH2
+ NaCl + H2O
Гидросульфат
анилиния
NO 2 Sn, HCl
+
NH 3Cl
Хлорид анилиния
NaOH
NH 2 + NaCl + H 2O
9.
НИТРОСОЕДИНЕНИЯВосстановление нитросоединений до аминов
N O2
3H 2, Ni
25
o C,
N H 2 + 2H 2O
30 атм.
Реакция гидрирования очень экзотермична
NO 2
N O2
+
4
NO 2
м-Динитробензол
6N aH S
+ H 2O
4
+ 3Na 2S2O 3
NH 2
м-Нитроанилин
10.
НИТРОСОЕДИНЕНИЯЗИНИН
Николай Николаевич
(25.VIII.1812–18.II.1880)
академик, возглавлял кафедру
общей химии Медикохирургической академии в
Петербурге, организатор и
первый президент Русского
химического общества. Известен
своими работами в области
ароматических нитросоединений.
11.
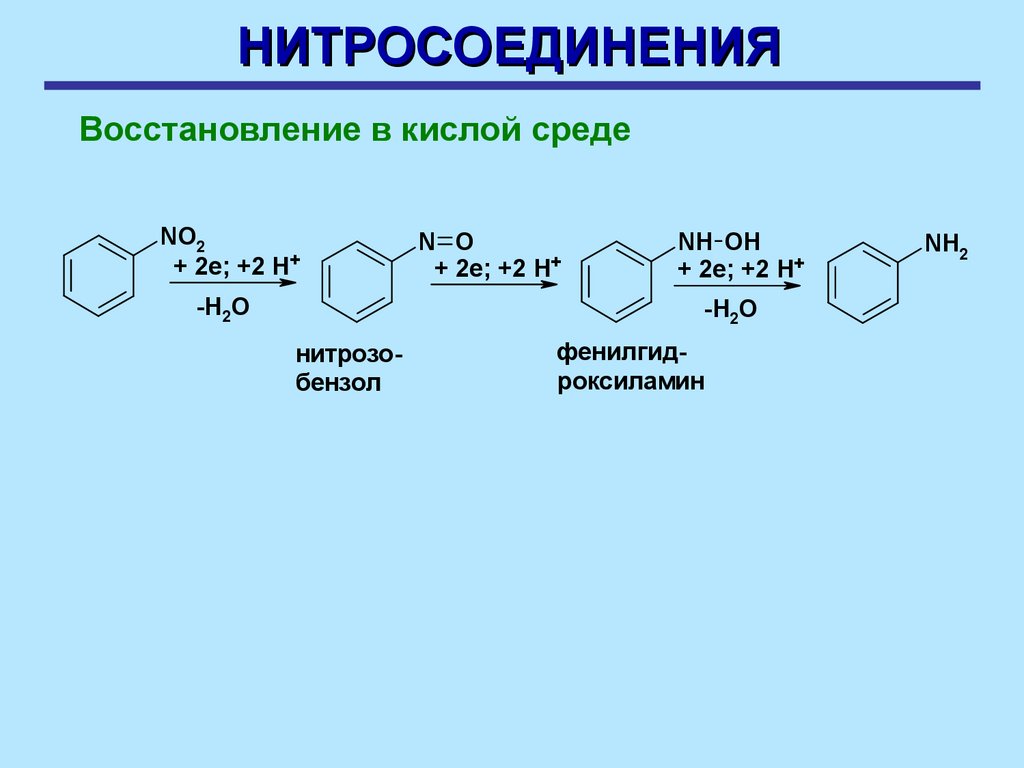
НИТРОСОЕДИНЕНИЯВосстановление в кислой среде
NO2
+ 2e; +2 H+
-H2O
N O
+ 2e; +2 H+
NH OH
+ 2e; +2 H+
-H2O
нитрозобензол
фенилгидроксиламин
NH2
12.
НИТРОСОЕДИНЕНИЯВ щелочной среде
NO2
Zn, NaOH
C2H5OH, 70
O
N N
+
азоксибензол
Zn, NaOH
C2H5OH, 70
NH OH
N O
OC
N N
OC
Zn, NaOH
C2H5OH, 70
азобензол
1) ZnCl2, HCl
2)NaOH
C6H5 NH2
OC
HN NH
гидразобензол
1) ZnCl2, HCl
2)NaOH
C6H5 NH2
В зависимости от условий восстановление можно остановить
на одной из стадий. Например, восстановление цинком в
водном растворе хлористого аммония дает
фенилгидроксиламин, а при действии цинка в водноспиртовом растворе анилин превращается в гидразобензол
13.
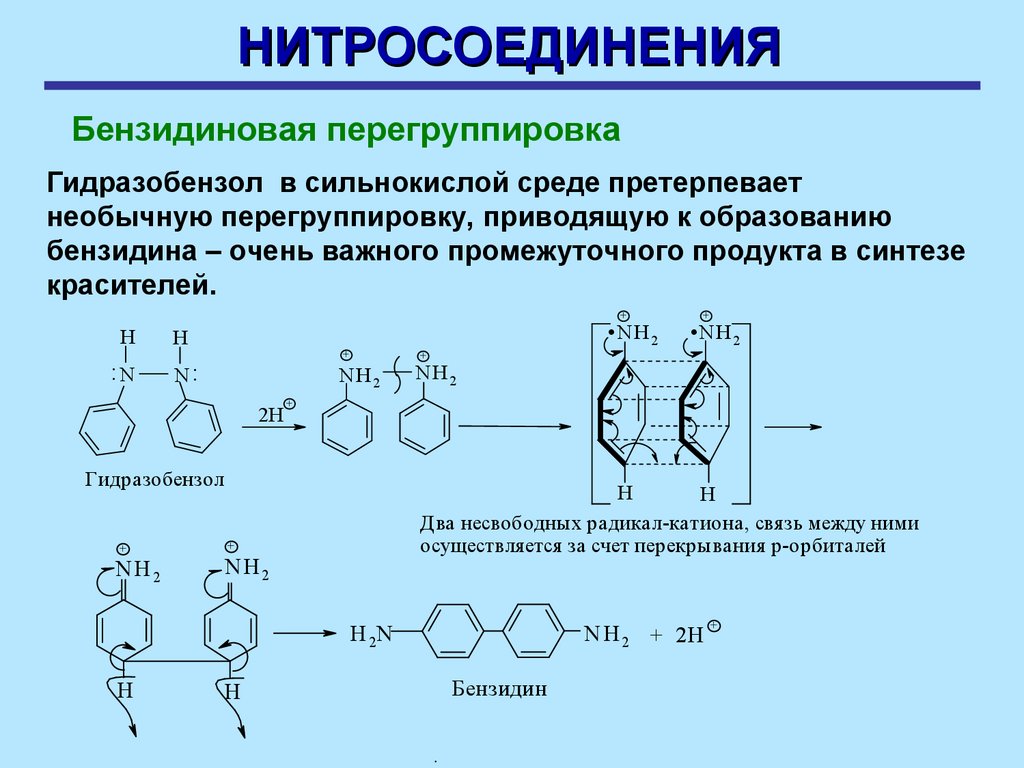
НИТРОСОЕДИНЕНИЯБензидиновая перегруппировка
Гидразобензол в сильнокислой среде претерпевает
необычную перегруппировку, приводящую к образованию
бензидина – очень важного промежуточного продукта в синтезе
красителей.
.N H .N H
+
H
:N
H
2
+
N:
NH2
+
Гидразобензол
NH2
H
H
Два несвободных радикал-катиона, свя зь между ними
осуществля ется за счет перекрывания р-орбиталей
+
NH2
N H 2 + 2H
H 2N
H
H
2
+
NH2
2H
+
+
Бензидин
+
14.
НИТРОСОЕДИНЕНИЯРеакции с участием -водородных атомов
Механизм
Стабилизация промежуточного продукта (II) осуществляется за счет
переноса протона от более слабого основания – гидроксид-иона к более
сильному
O
Н
C
-
CH 3
C
OH CH 3
N O 2 + HOH
Н CH 3
Более сильное основание
II
Н
C
Н
-
C NO 2 + OH
Более слабое
CH 3
основание
15.
НИТРОСОЕДИНЕНИЯСпособы получения
Нитрование алканов. Реакция Коновалова
Известно несколько способов нитрования алканов.
По жидкофазному способу алканы нитруют разбавленной азотной
кислотой, с массовой долей 40-50 %
CH 3CH 2CH 2CH 3
H NO 3, 120-125 o C, P
SR
CH 3CH CH 2CH 3
+
H 2O
NO 2
2-Н итробутан
(основной продукт)
По парофазному способу алканы нитруют в парах при температуре
350-500 оС
CH 3CH 2CH 3
HNO 3
Пропан
+
CH 3CHCH 3 +
CH 3CH 2CH 2NO 2 +
1-Нитропропан
Выход 25 %
NO 2
2-Нитропропан
Выход 40 %
CH 3CH 2NO 2
+
CH 3NO 2
Нитроэтан
Выход 10 %
Нитрометан
Выход 25 %
+
H 2O
16.
НИТРОСОЕДИНЕНИЯСпособы получения
Замещение галогена на нитрогруппу в галогеналканах
Удобным лабораторным методом получения первичных нитроалканов
является реакция нуклеофильного замещения галогена нитрит-ионом
R–X + NaNO2 → R–NO2 + NaX
CH 3CH 2CH 2Br
1-Бромпропан
ClCH 2COOH
Хлоруксусная
кислота
O 2N
+
NaOH
CH 2
NaNO 2
ДМФА
SN 2
ClCH 3COON a
COO H
CH 3CH 2CH 2NO 2 +
1-Нитропропан
N aN O 2
SN 2
O 2NCH 2COON a
100 o C
CH 3NO 2
- CO 2 Нитрометан
NaBr
H 3O
+
17.
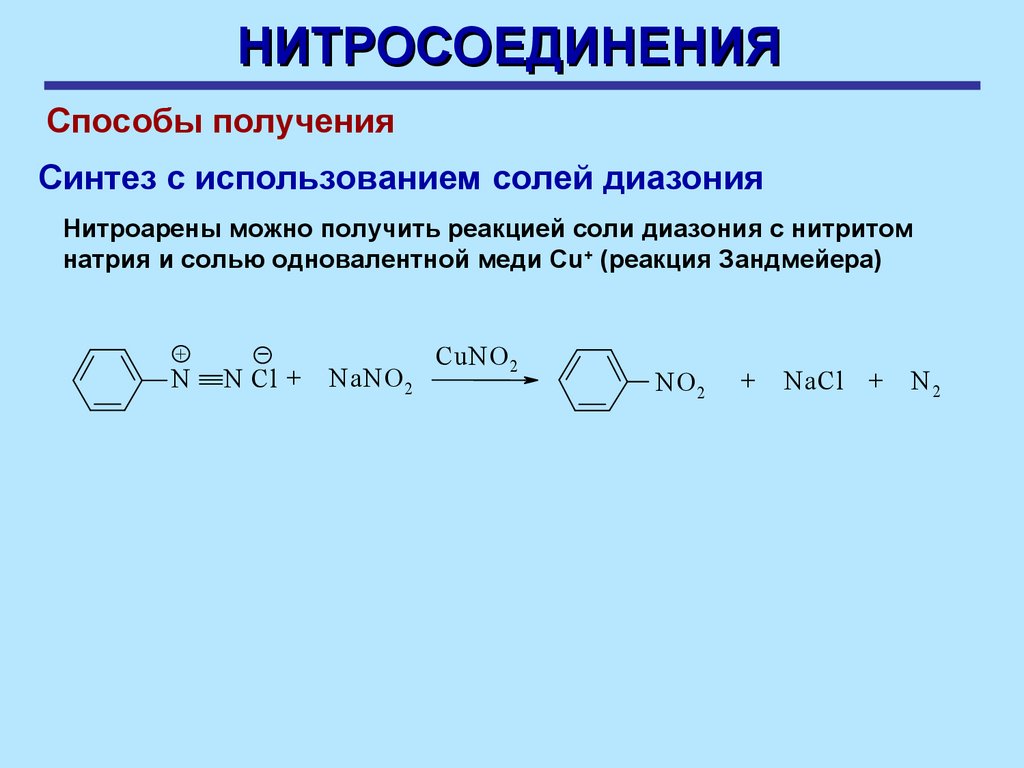
НИТРОСОЕДИНЕНИЯСпособы получения
Синтез с использованием солей диазония
Нитроарены можно получить реакцией соли диазония с нитритом
натрия и солью одновалентной меди Cu+ (реакция Зандмейера)
+
N
N Cl +
NaNO 2
CuNO 2
NO 2
+
NaCl +
N2
18.
АМИНЫАмины – производные аммиака NH3. В соответствии с
числом алкильных или арильных групп, связанных с
азотом, различают
первичные R–NH2, ArNH2;
вторичные R1–NH–R2, R–NH–Ar;
третичные амины
R1
N
R3
Ar , R 1
N
R3
R2
19.
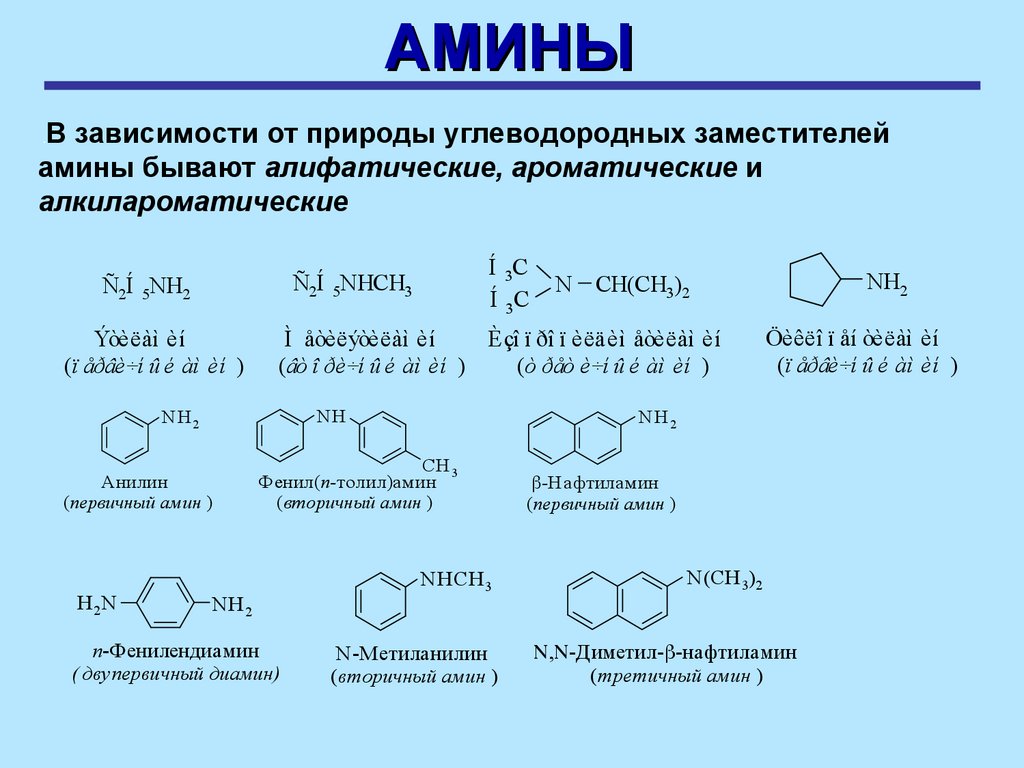
АМИНЫВ зависимости от природы углеводородных заместителей
амины бывают алифатические, ароматические и
алкилароматические
.
Ýòèëàì èí
(ï åðâè÷í û é àì èí )
NH
Анилин
(первичный амин )
N
п-Фенилендиамин
( двупервичный диамин)
Öèêëî ï åí òèëàì èí
(ï åðâè÷í û é àì èí )
NH 2
CH 3
Фенил(п-толил)амин
(вторичный амин )
NH 2
NH2
CH(CH3)2
Ì åòèëýòèëàì èí
Èçî ï ðî ï èëäèì åòèëàì èí
(âò î ðè÷í û é àì èí )
(ò ðåò è÷í û é àì èí )
NH 2
H 2N
Í 3C
Í 3C
Ñ2Í 5NHCH3
Ñ2Í 5NH2
NHСН 3
N -Метиланилин
(вторичный амин )
-Н афтиламин
(первичный амин )
N(СН 3)2
-Диметил- -нафтиламин
(третичный амин )
20.
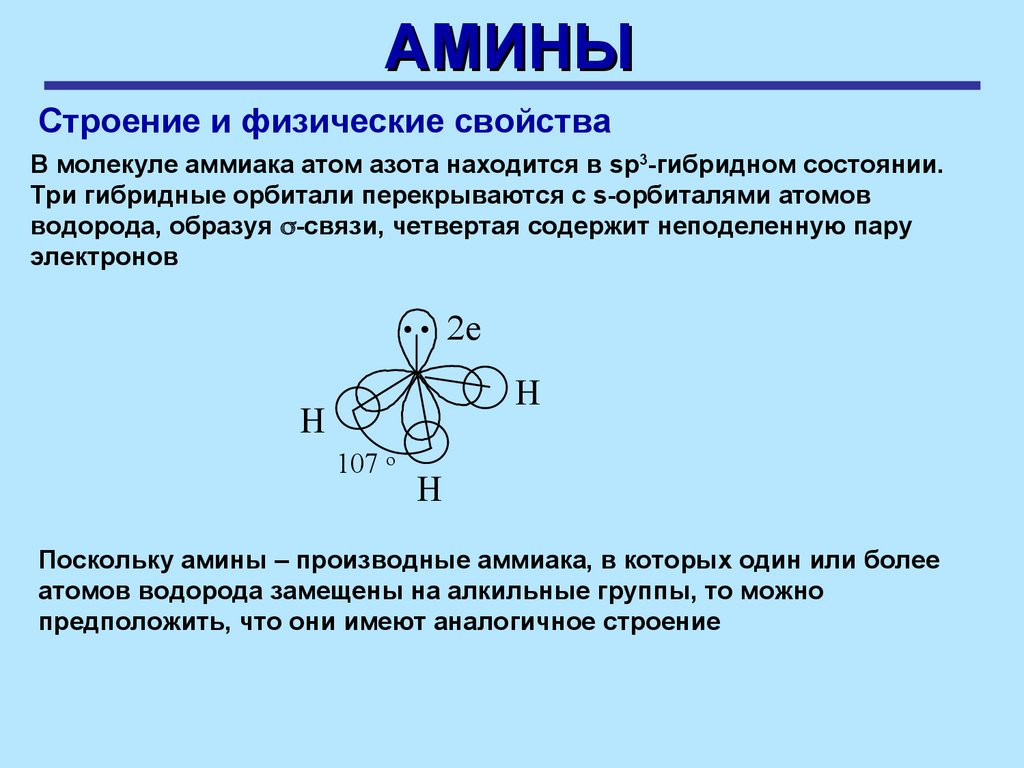
АМИНЫСтроение и физические свойства
В молекуле аммиака атом азота находится в sp3-гибридном состоянии.
Три гибридные орбитали перекрываются с s-орбиталями атомов
водорода, образуя -связи, четвертая содержит неподеленную пару
электронов
.. 2e
H
H
107 o
H
Поскольку амины – производные аммиака, в которых один или более
атомов водорода замещены на алкильные группы, то можно
предположить, что они имеют аналогичное строение
21.
АМИНЫСтроение и физические свойства
Простейшие алифатические амины – метиламин, диметиламин и
триметиламин – газы, хорошо растворимые в воде и обладающие
аммиачным запахом. Остальные низшие амины – жидкости с запахом
аммиака. Более сложные амины – жидкости с неприятным запахом
рыбы. Высшие амины – твердые, не растворимые в воде вещества,
лишенные запаха.
При равном числе атомов углерода наиболее высокая температура
кипения у первичных аминов, несколько ниже у вторичных и третичных.
Ароматические амины – жидкости или твердые тела с характерным
неприятным запахом, сильно токсичны. В воде растворяются мало,
накопление аминогрупп ведет к увеличению растворимости
22.
АМИНЫХимические свойства
Многие химические свойства аминов обусловлены
стремлением аминов обобществить неподеленную пару
электронов азота с протоном, благодаря чему они являются
основаниями, либо с электронодефицитным атомом другой
молекулы, что определяет их способность выступать в
качестве нуклеофильных реагентов
23.
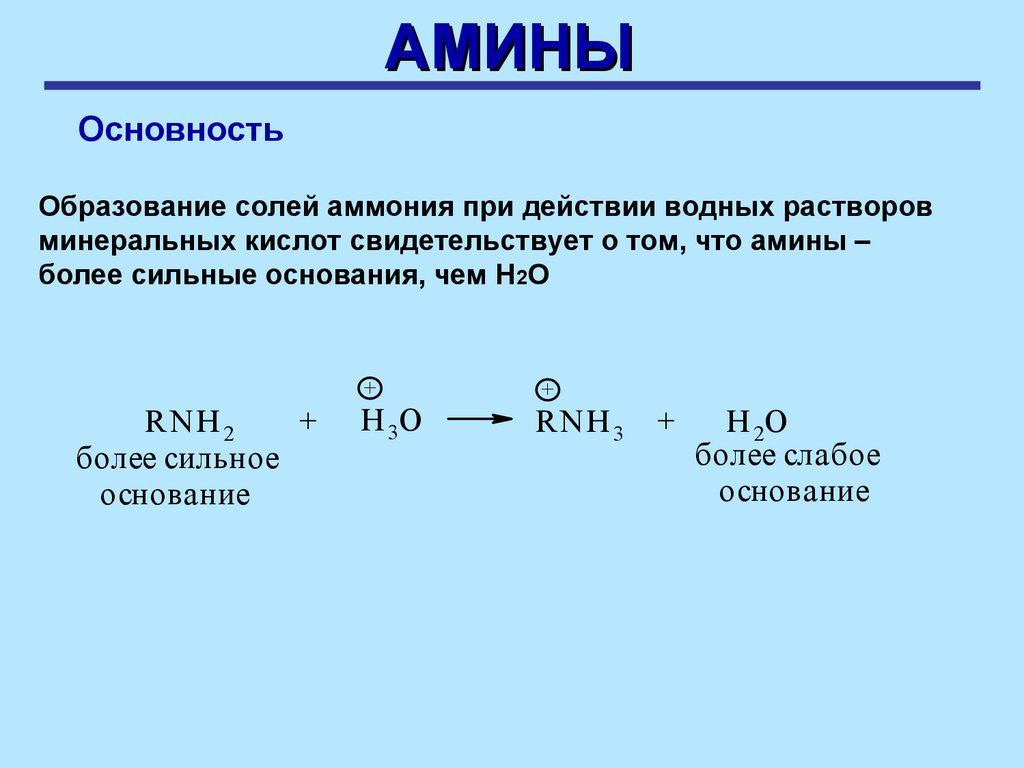
АМИНЫОсновность
Образование солей аммония при действии водных растворов
минеральных кислот свидетельствует о том, что амины –
более сильные основания, чем Н2О
R NH 2
+
более сильное
основание
+
+
H 3O
R NH 3 +
H 2O
более слабое
основание
24.
АМИНЫОсновность
Амины вытесняются из солей аммония при действии
гидроксид-иона, т.е. амины более слабые основания, чем
гидроксид-ион
+
R NH 3
+
OH
R NH 2 +
более сильное более слабое
основание
основание
H 2O
Основность убывает в ряду ОН > RNH2 > H2O
Чем больше константа основности Кb, тем сильнее основание.
Константа основности Kb для всех трех классов алифатических
аминов 10–3–10–4, т.е. алифатические амины более сильные
основания, чем аммиак Kb=1,8∙10-5. Для ароматических аминов
Kb<10–9
25.
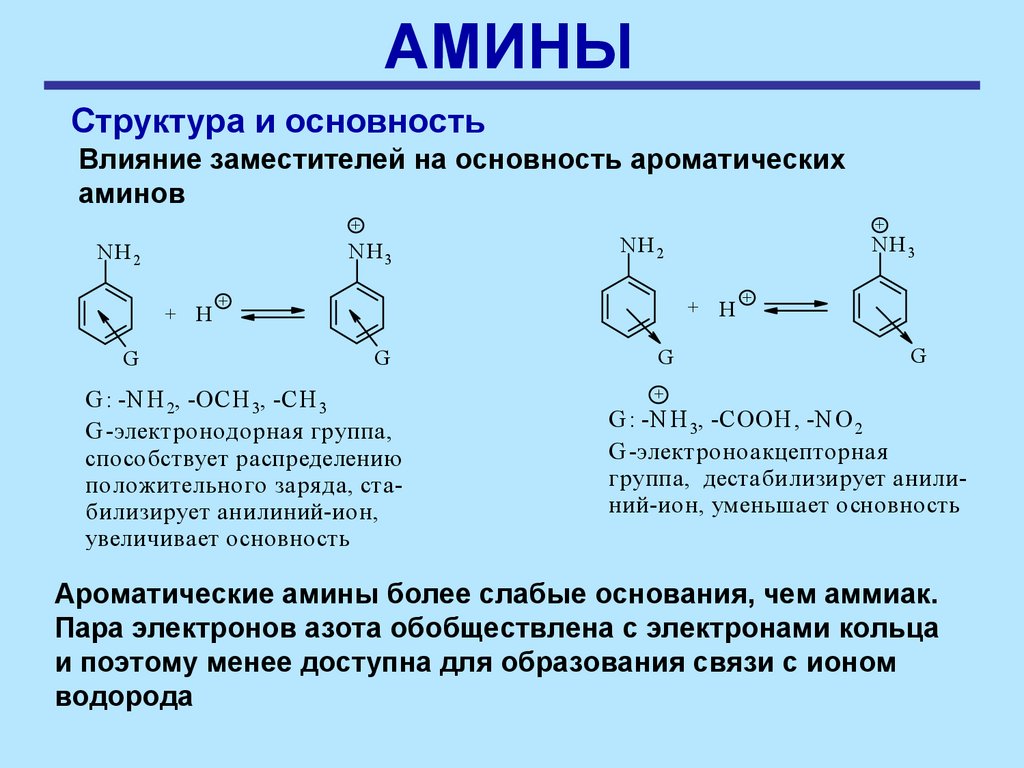
АМИНЫСтруктура и основность
Наличие заместителей оказывает сильное влияние на
основность. Алифатические амины – более сильные
основания, чем аммиак
H
H N: + H
H
+
H
+
H N H,
H
H
H
R
N: +
H
+
H
R ï î äàåò ýëåêòðî í û ,
äåëàåò 2å áî ëåå äî ñòóï í û ì è äëÿ àòàêè ï ðî òî í à
R
+
N H
H
R ï î äàåò ýëåêòðî í û ,
äåëàåò èî í àì ì î í èÿ
áî ëåå óñòî é÷èâû ì
óâåëè÷èâàåò
Основность алифатических аминов увеличивается в ряду
NH3 < R1NH2 < R1–NH–R2
26.
АМИНЫСтруктура и основность
Влияние заместителей на основность ароматических
аминов
+
NH 3
NH2
+
G
H
+
NH3
NH2
+
+
G
G : -N H 2, -OCH 3, -CH 3
G -электронодорная группа,
способствует распределению
положительного заря да, стабилизирует анилиний-ион,
увеличивает основность
G
H
+
G
+
G : -N H 3, -COOH , -N O 2
G -электроноакцепторная
группа, деcтабилизирует анилиний-ион, уменьшает основность
Ароматические амины более слабые основания, чем аммиак.
Пара электронов азота обобществлена с электронами кольца
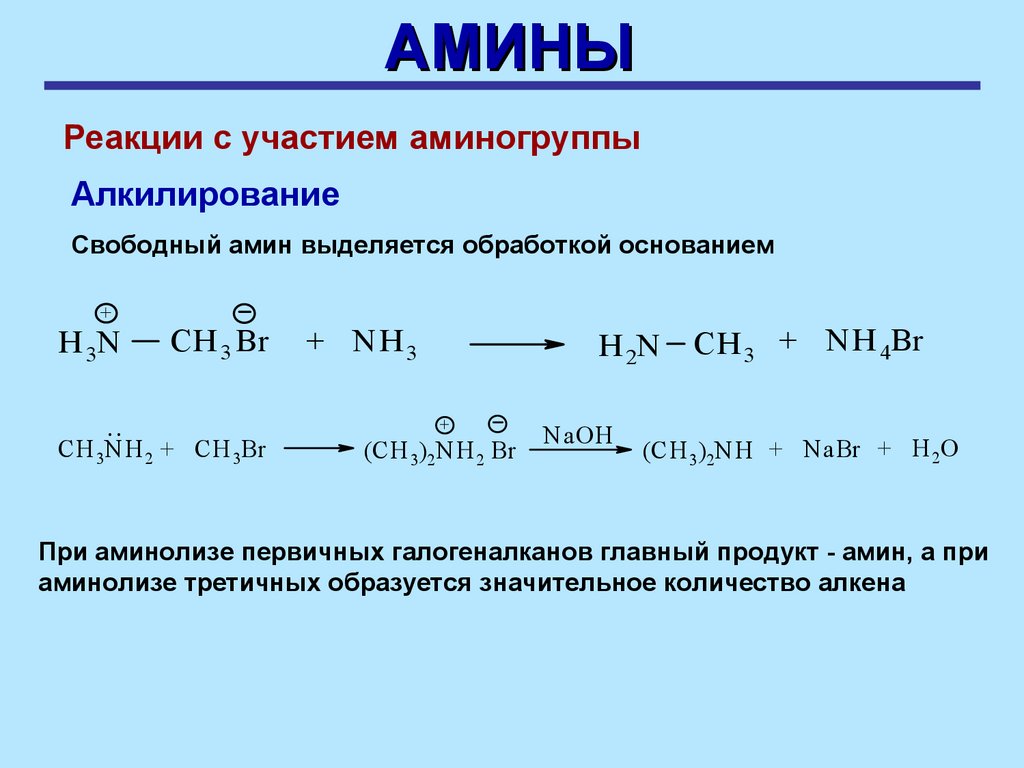
и поэтому менее доступна для образования связи с ионом
водорода
27.
АМИНЫРеакции с участием аминогруппы
Алкилирование
Амины могут реагировать с алкилгалогенидами, при этом образуется
более алкилированный амин
RX
RX
RX
RX
+
R4N X
Соль
четвертичного
аммония
Алкилирование аминов (аминолиз галогенпроизводных) – реакция
нуклеофильного замещения
NH3
RNH2
Перв.
амин
R2NH
Втор.
амин
R3N
Трет.
амин
28.
АМИНЫРеакции с участием аминогруппы
Алкилирование
Свободный амин выделяется обработкой основанием
+
H 3N
..
CH 3 Br
CH 3NH 2 + CH 3Br
+ NH3
H 2N
+
(CH 3)2NH 2 Br
NaOH
CH 3 + N Н 4Br
(CH 3)2NH + NaBr + H 2O
При аминолизе первичных галогеналканов главный продукт - амин, а при
аминолизе третичных образуется значительное количество алкена
29.
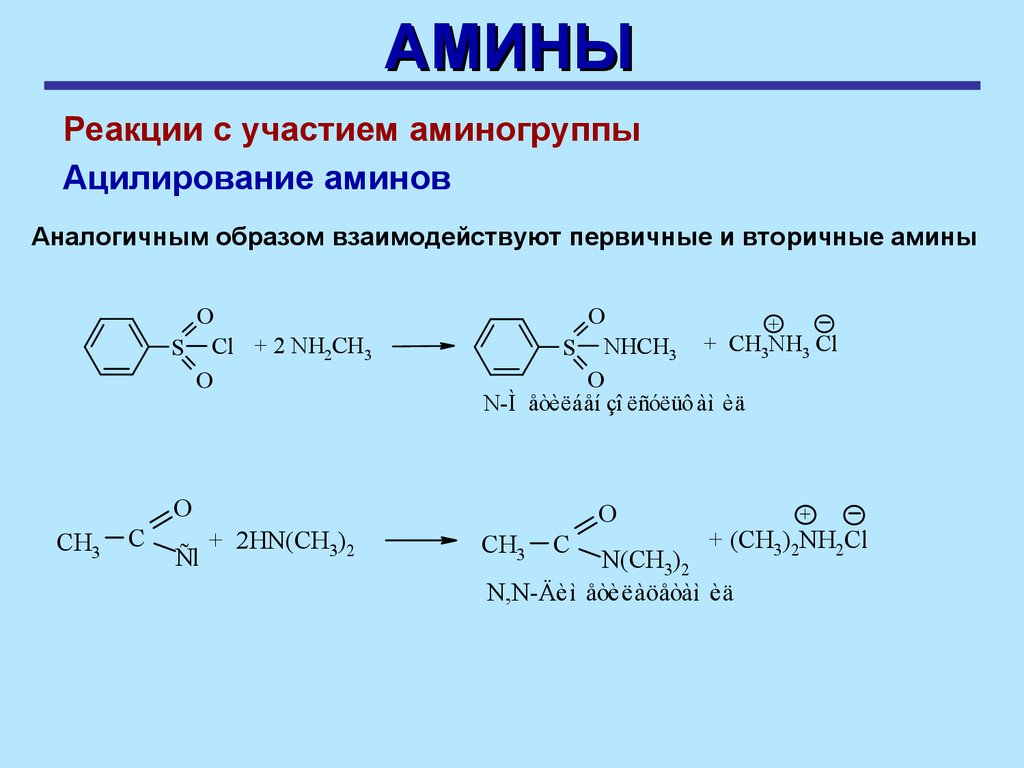
АМИНЫРеакции с участием аминогруппы
Ацилирование аминов
Аммиак реагирует с хлорангидридами карбоновых кислот и
сульфокислот с образованием амидов
O
2 NH3 + CH3C
Cl
O
SN(AN, E)
èëè (CH3CO)2O
2NH3 +
O
S Cl
O
CH3C
+ NH4Cl
NH2
Aöåòàì èä
O
S NH2 + NH4Cl
O
Áåí çî ëñóëüô àì èä
30.
АМИНЫРеакции с участием аминогруппы
Ацилирование аминов
Аналогичным образом взаимодействуют первичные и вторичные амины
O
S Cl + 2 NH2CH3
O
O
+
+
CH
S NHCH3
3NH3 Cl
O
N-Ì åòèëáåí çî ëñóëüô àì èä
O
CH3
C
Ñl
+ 2HN(CH3)2
O
+
+ (CH3)2NH2Cl
N(CH3)2
N,N-Äèì åòèëàöåòàì èä
CH3
C
31.
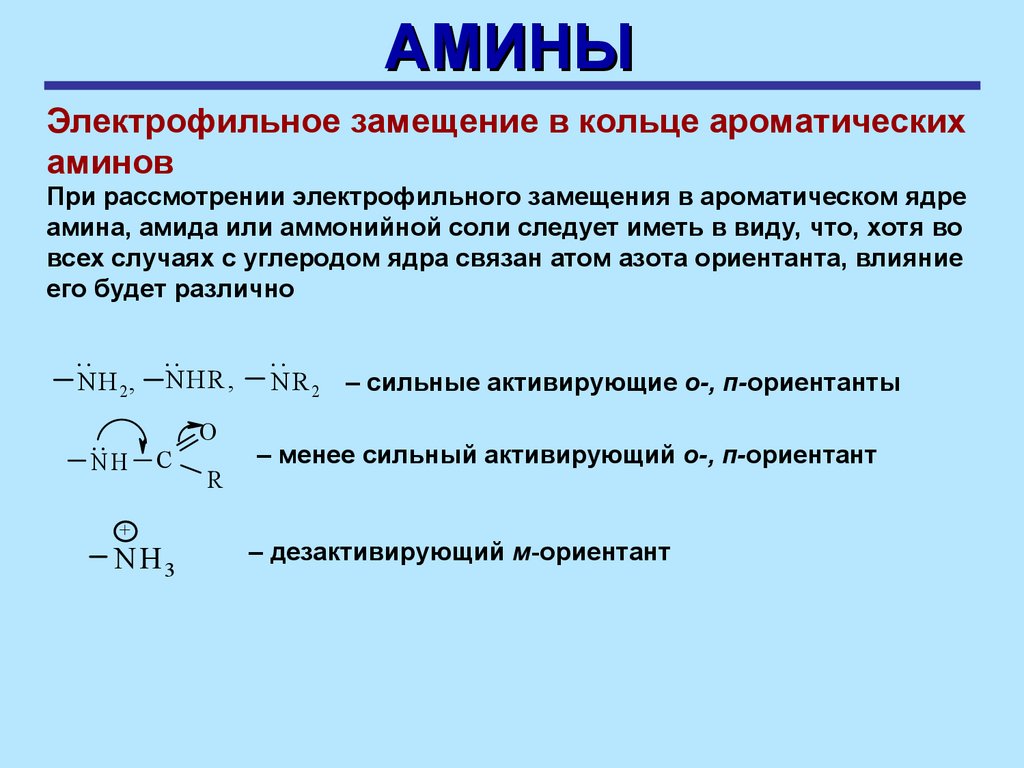
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
При рассмотрении электрофильного замещения в ароматическом ядре
амина, амида или аммонийной соли следует иметь в виду, что, хотя во
всех случаях с углеродом ядра связан атом азота ориентанта, влияние
его будет различно
..
NH 2,
..
NHR ,
O
..
NH
+
C
NH3
R
..
N R 2 – сильные активирующие о-, п-ориентанты
– менее сильный активирующий о-, п-ориентант
– дезактивирующий м-ориентант
32.
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
Галогенирование
Реакция бромирования анилина протекает очень быстро, все
свободные о-, п-атомы водорода замещаются галогеном
NH2
3Br2
Br
NH2
Br
+ 3НBr
Br
33.
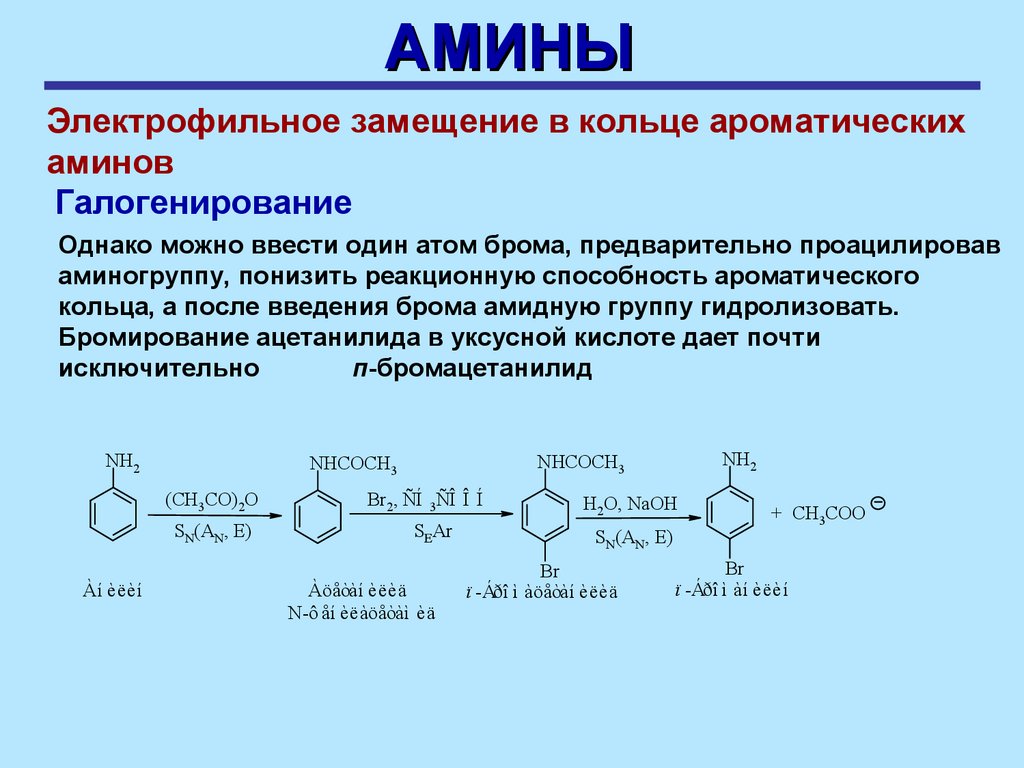
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
Галогенирование
Однако можно ввести один атом брома, предварительно проацилировав
аминогруппу, понизить реакционную способность ароматического
кольца, а после введения брома амидную группу гидролизовать.
Бромирование ацетанилида в уксусной кислоте дает почти
исключительно
п-бромацетанилид
NH2
(CH3CO)2O
SN(AN, E)
Àí èëèí
NH2
NHCOCH3
NHCOCH3
Br2, ÑÍ 3ÑÎ Î Í
SEAr
Àöåòàí èëèä
N-ô åí èëàöåòàì èä
H2O, NaOH
SN(AN, E)
Br
ï -Áðî ì àöåòàí èëèä
+ CH3COO
Br
ï -Áðî ì àí èëèí
34.
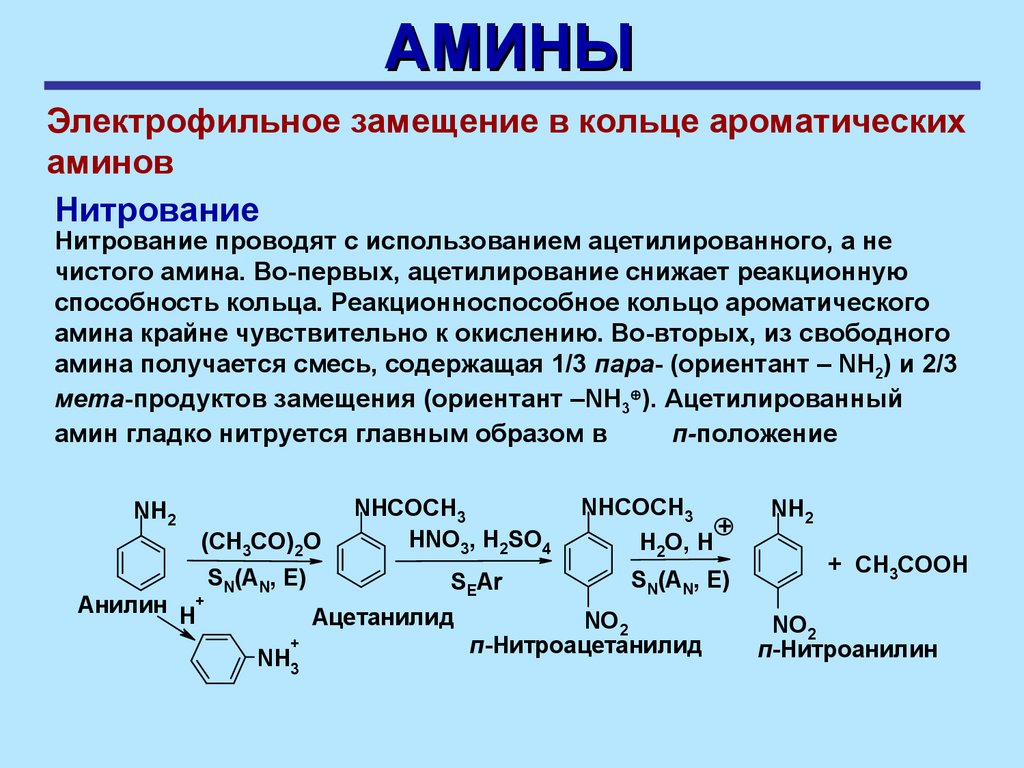
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
Нитрование
Нитрование проводят с использованием ацетилированного, а не
чистого амина. Во-первых, ацетилирование снижает реакционную
способность кольца. Реакционноспособное кольцо ароматического
амина крайне чувствительно к окислению. Во-вторых, из свободного
амина получается смесь, содержащая 1/3 пара- (ориентант – NH2) и 2/3
мета-продуктов замещения (ориентант –NH3 ). Ацетилированный
амин гладко нитруется главным образом в
п-положение
NH2
(CH3CO)2O
Анилин H+
SN(AN, E)
NHCOCH3
HNO3, H2SO4
SEAr
Ацетанилид
+
NH3
NHCOCH3
+
H2O, H
SN(AN, E)
NO2
п-Нитроацетанилид
NH2
+ CH3COOН
NO2
п-Нитроанилин
35.
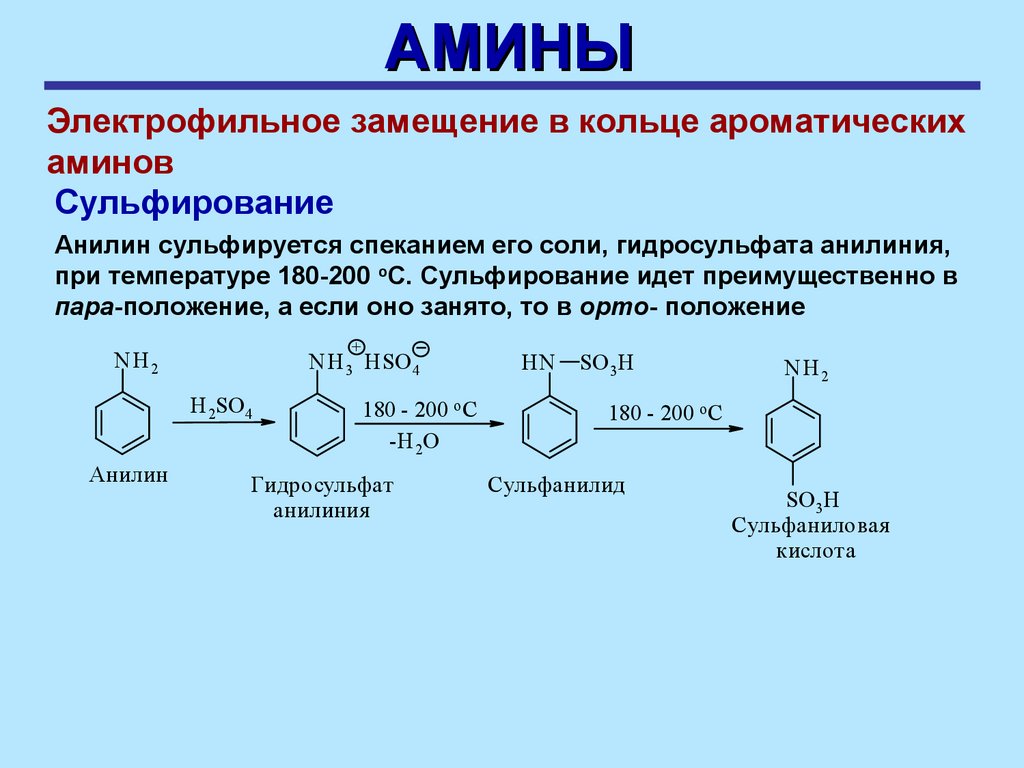
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
Сульфирование
Анилин сульфируется спеканием его соли, гидросульфата анилиния,
при температуре 180-200 оС. Сульфирование идет преимущественно в
пара-положение, a если оно занято, то в opтo- положение
+
NH 2
NH 3 HSO 4
H 2SO 4
Анилин
180 - 200 o C
-H 2O
Гидросульфат
анилиния
HN
SO 3H
NH 2
180 - 200 o C
Сульфанилид
SO 3H
Сульфаниловая
кислота
36.
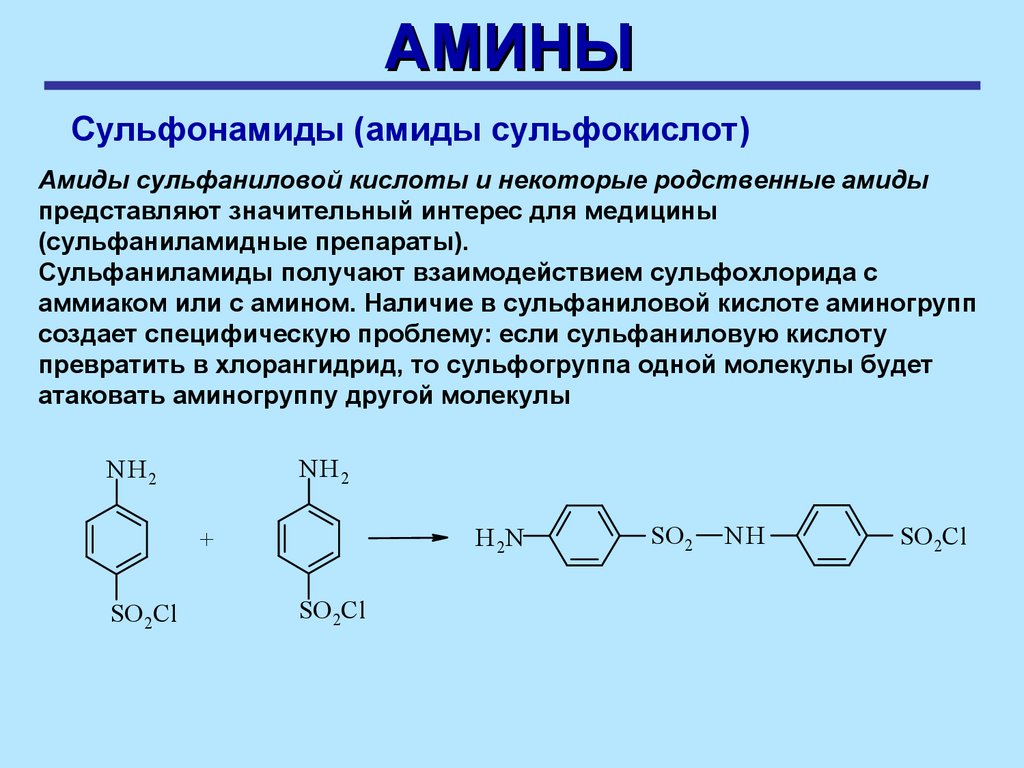
АМИНЫСульфонамиды (амиды сульфокислот)
Амиды сульфаниловой кислоты и некоторые родственные амиды
представляют значительный интерес для медицины
(сульфаниламидные препараты).
Сульфаниламиды получают взаимодействием сульфохлорида с
аммиаком или с амином. Наличие в сульфаниловой кислоте аминогрупп
создает специфическую проблему: если сульфаниловую кислоту
превратить в хлорангидрид, то сульфогруппа одной молекулы будет
атаковать аминогруппу другой молекулы
NH2
NH 2
H 2N
+
SO 2Cl
SO 2Cl
SO 2
NH
SO 2Cl
37.
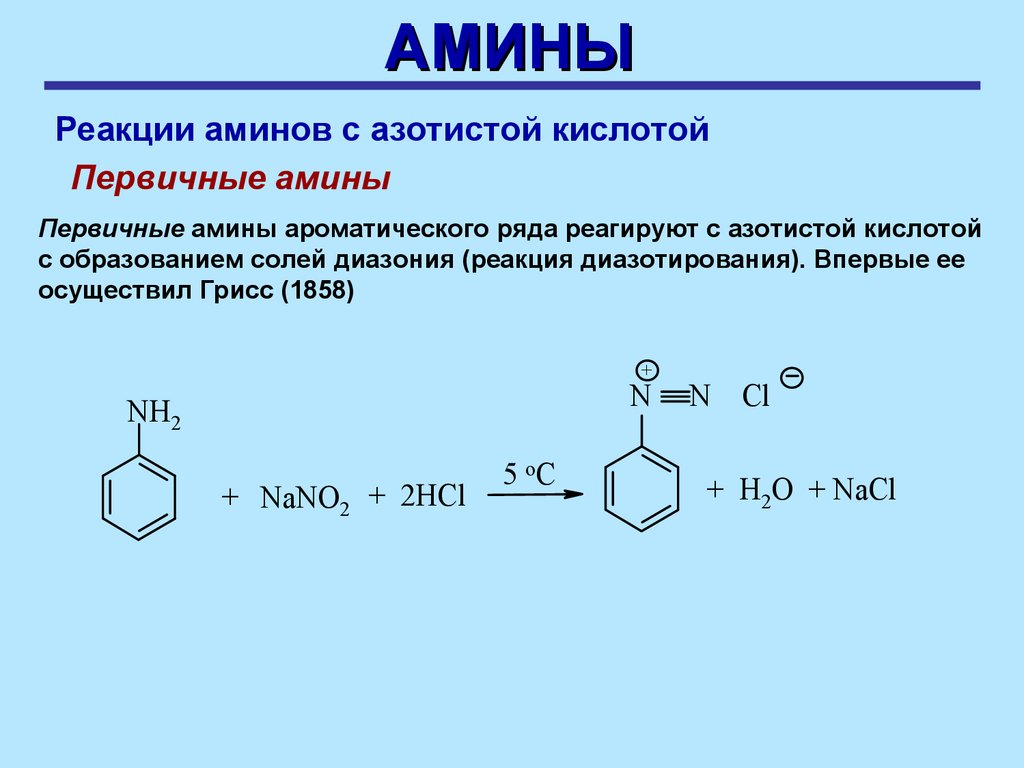
АМИНЫРеакции аминов с азотистой кислотой
Первичные амины
Первичные амины ароматического ряда реагируют с азотистой кислотой
с образованием солей диазония (реакция диазотирования). Впервые ее
осуществил Грисс (1858)
+
N
NH2
+ NaNO2 + 2HСl
5 оС
N Cl
+ H2O + NaCl
38.
АМИНЫРеакции аминов с азотистой кислотой
Первичные амины
На первой стадии при взаимодействии нитрита натрия с соляной
кислотой образуется азотистая кислота
NaNO2 + HCl
HNO2 + NaCl
Азотистая кислота является более слабой кислотой, чем азотная.
Поэтому в отсутствие сильных минеральных кислот электрофильная
реакционная способность азотистой кислоты невысока. Увеличить ее
можно, проводя реакции с аминами в присутствии сильных
минеральных
кислот
(чаще
для
этой
цели
используют
хлороводородную кислоту). При этом, по-видимому, происходят
протонированне атома кислорода гидроксильной группы, отщепление
воды и генерирование нитрозонийкатиона. В соляной кислоте
образуется нитрозилхлорид, который и является диазотирующим
агентом
39.
АМИНЫРеакции аминов с азотистой кислотой
Первичные амины
Первичные алифатические амины также дают соли диазония, но они
очень неустойчивы и легко разлагаются с образованием карбокатионов,
при этом выделяется азот. Карбокатион может реагировать с
нуклеофилом из среды (вода), претерпевать депротонирование в алкен
или в случае сложного карбокатиона подвергаться скелетным
перегруппировкам. Алкен также может взаимодействовать с HCl.
Образуется смесь спиртов, алкенов и галогеналканов
CH3CH2CH2NH2
CH3CH2CH2N
NaNO2, HCl
N Cl
H
CH3CH2CH2 - N - N =O Cl
+ H2O
CH3CH2CH2Cl + N2 + NaCl + H2O
H
CH3CH2CH2OH + CH3CH=CH2 +
40.
АМИНЫРеакции аминов с азотистой кислотой
Вторичные амины
Вторичные амины как ароматические, так и алифатические образуют
нитрозоамины (механизм реакции SE)
CH 3
CH 3
CH 3
NH + NaNO 2 + HCl
NH + NaNO 2 + HCl
CH 3
N
NO + NaCl + H 2O
CH 3
Диметилнитрозоамин
N
NO + NaCl + H 2O
CH 3
N-нитрозо-N-метиланилин
41.
АМИНЫРеакции аминов с азотистой кислотой
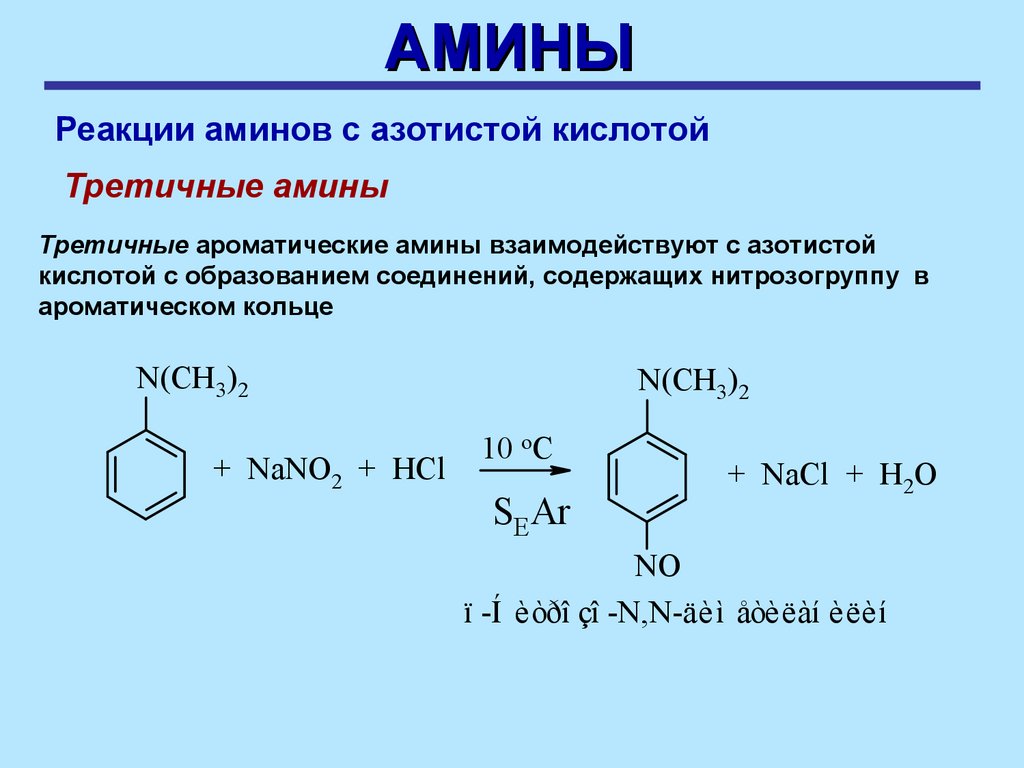
Третичные амины
Третичные ароматические амины взаимодействуют с азотистой
кислотой с образованием соединений, содержащих нитрозогруппу в
ароматическом кольце
N(CH3)2
+ NaNO2 + HCl
N(CH3)2
10 oC
SEAr
+ NaCl + H2O
NO
ï -Í èòðî çî -N,N-äèì åòèëàí èëèí
42.
АМИНЫРеакции аминов с азотистой кислотой
Третичные амины
Третичные алифатические амины в мягких условиях (разбавленные
растворы, комнатная температура) не реагируют с азотистой кислотой.
В жестких условиях происходит расщепление третичных аминов с
образованием N-нитрозопроизводных вторичных аминов,
отщепляющаяся от атома азота группа выделяется в виде альдегида
или кетона
(CH3CH2)3N
NaNO2, H
(CH3CH2)2 N =CHCH3
CH3CH2
CH3CH2
H2O
-H
N
CHCH3
H
N=O
-H2O, N2O (-HNO)
(CH3CH2)2N-CHCH3
OH
-CH3CHO
(CH3CH2)2NH
43.
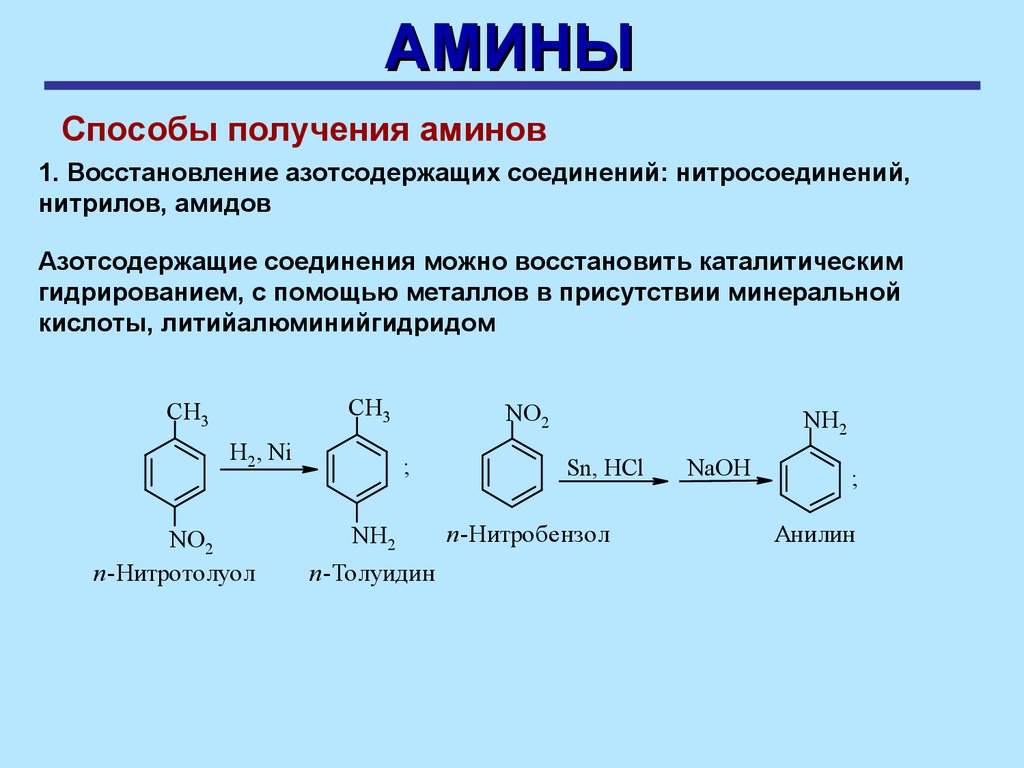
АМИНЫСпособы получения аминов
1. Восстановление азотсодержащих соединений: нитросоединений,
нитрилов, амидов
Азотсодержащие соединения можно восстановить каталитическим
гидрированием, с помощью металлов в присутствии минеральной
кислоты, литийалюминийгидридом
СН3
СН3
H2, Ni
NO2
п-Нитротолуол
NO2
;
NH2
п-Толуидин
NH2
Sn, HCl
п-Нитробензол
NaOH
;
Анилин
44.
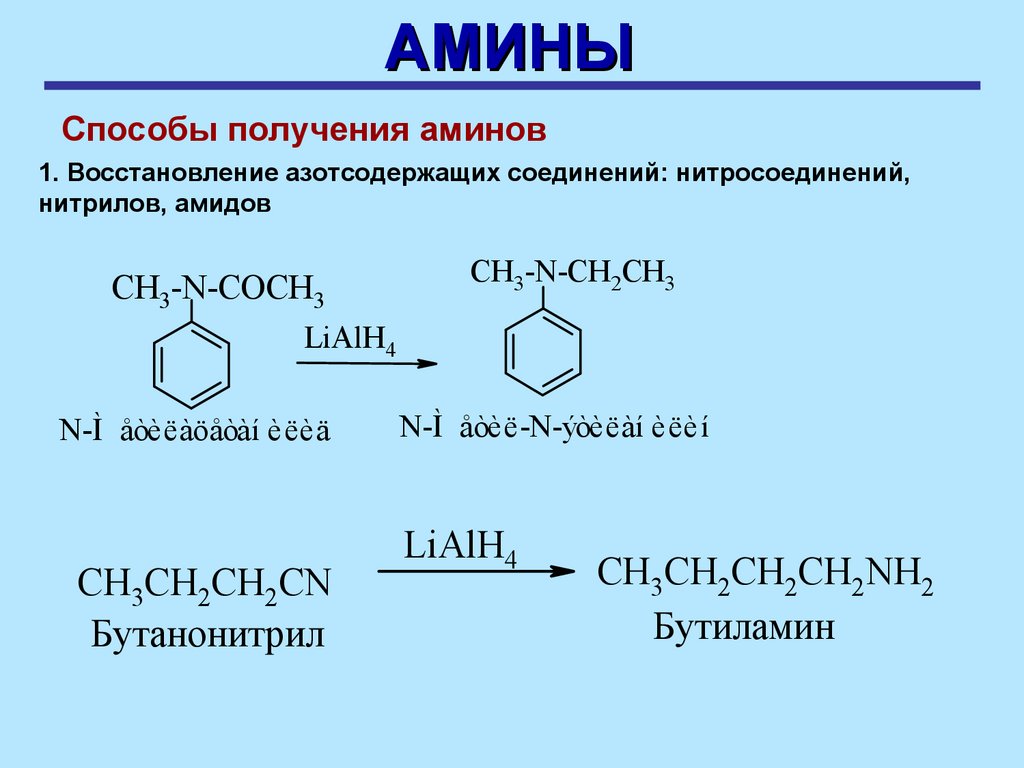
АМИНЫСпособы получения аминов
1. Восстановление азотсодержащих соединений: нитросоединений,
нитрилов, амидов
CH3-N-COCH3
CH3-N-CH2CH3
LiAlH4
N-Ì åòèëàöåòàí èëèä
СH3CH2CH2CN
Бутанонитрил
N-Ì åòèë-N-ýòèëàí èëèí
LiAlH4
СH3CH2CH2СН2NH2
Бутиламин
45.
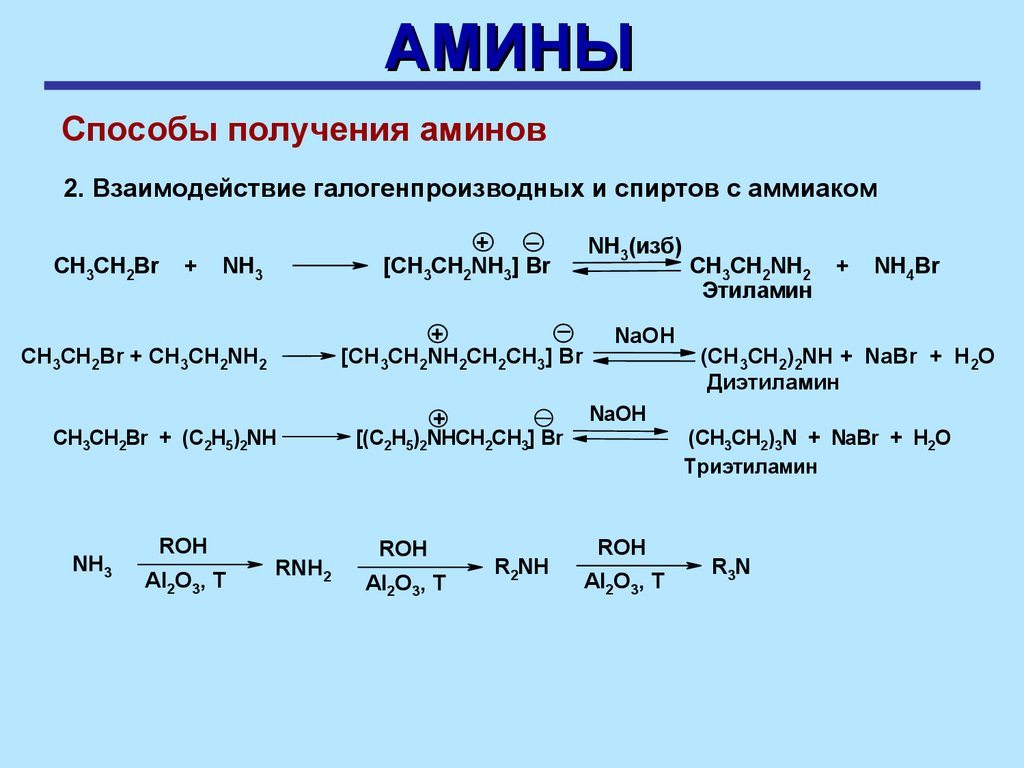
АМИНЫСпособы получения аминов
2. Взаимодействие галогенпроизводных и спиртов с аммиаком
СH3CH2Br
+
_
+
[CH3CH2NH3] Br
NH3
_
+
[CH3CH2NH2CH2CH3] Br
СH3CH2Br + CH3CH2NH2
СH3CH2Br + (C2H5)2NH
NH3
ROH
Al2O3, T
RNH2
+
[(C2H5)2NHCH2CH3] Br
ROH
Al2O3, T
R2NH
NH3(изб)
NaOH
CH3CH2NH2
Этиламин
+
NH4Br
(CH3CH2)2NH + NaBr + H2O
Диэтиламин
NaOH
(CH3CH2)3N + NaBr + H2O
Триэтиламин
ROH
Al2O3, T
R3N
46.
АМИНЫСпособы получения аминов
3. Восстановительное аминирование
Альдегиды и кетоны при обработке аммиаком или амином и водородом
в присутствии катализатора превращаются в амины. Вероятно, реакция
протекает через промежуточное образование иминов
O
Ñ
+ NH3
Ñ
Í
CH 2
H2 , Ni
Í
Áåí çàë üäåãè ä
СH 3
NH
Áåí çè ë àì è í
èì èí
C
CH 3 + NH 3 + H 2
Ni
СH 3
O
Бутанон
CH 2
Пропаналь
CH 2
CН
CH 3 + H 2O
NH 2
Втор-бутиламин
O
СH 3
CH2NH2
+ NH 2СН 3 + H 2
C
Н
Метиламин
Ni
СH 3
CH 2 CН 2 NH CH 3 + H 2O
Метилпропиламин
47.
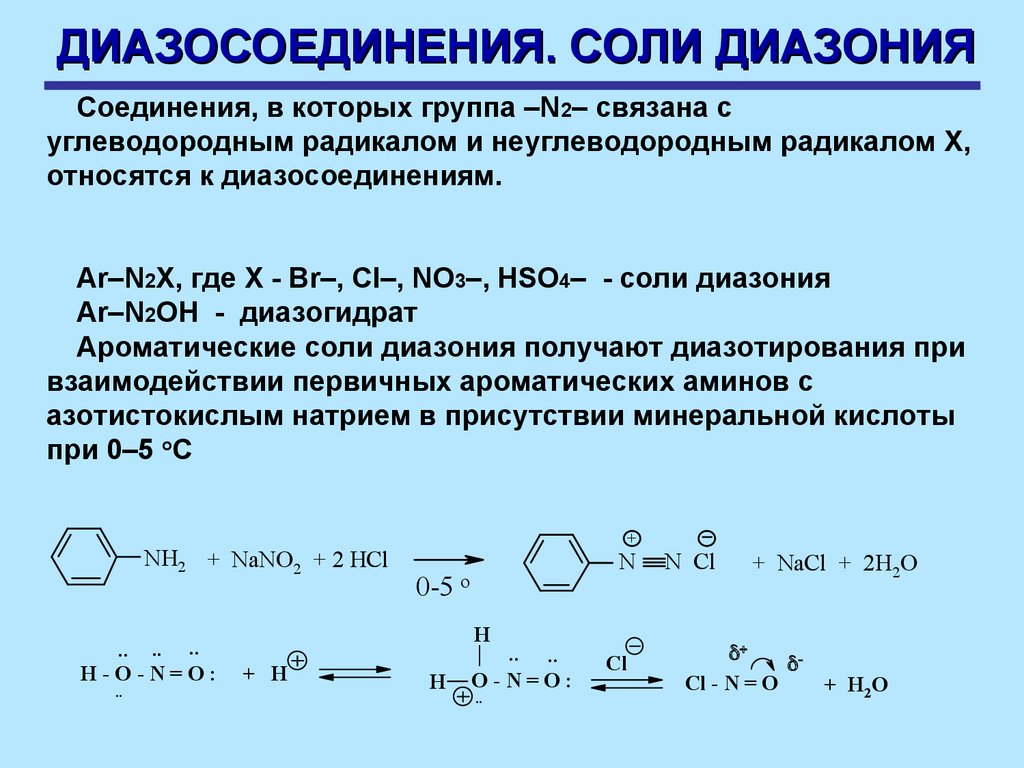
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯСоединения, в которых группа –N2– связана с
углеводородным радикалом и неуглеводородным радикалом Х,
относятся к диазосоединениям.
Ar–N2X, где X - Br–, Cl–, NO3–, HSO4– - cоли диазония
Ar–N2OH - диазогидрат
Ароматические соли диазония получают диазотирования при
взаимодействии первичных ароматических аминов с
азотистокислым натрием в присутствии минеральной кислоты
при 0–5 оС
NH2 + NaNO2 + 2 HCl
.. .. ..
H-O-N=O:
..
+
0-5
N
o
H
+ H
H
.. ..
O-N=O:
..
Cl
N Cl
+ NaCl + 2H2O
Cl - N = O
+ H 2O
48.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯАроматические соли диазония
+
N N: X
X- = Cl-, Br-, I-, HSO4-, BF4-, FeCl4ионные соединения
+ N2 HSO4
+ N2 Cl O2N
бензолдиазоний хлорид
п-нитробензолдиазоний гидросульфат
Ароматические диазопроизводные
.. ..
Ar N N X
ковалентные
соединения
.. ..
C6H5 N N C6H5
диазобензол
(дифенилдиазен)
X = различные группы
C6H5
.. ..
N N OH
бензолдиазогидрат
C6H5
.. ..
N N NH C6H5
1,3-дифенил1-триазен
49.
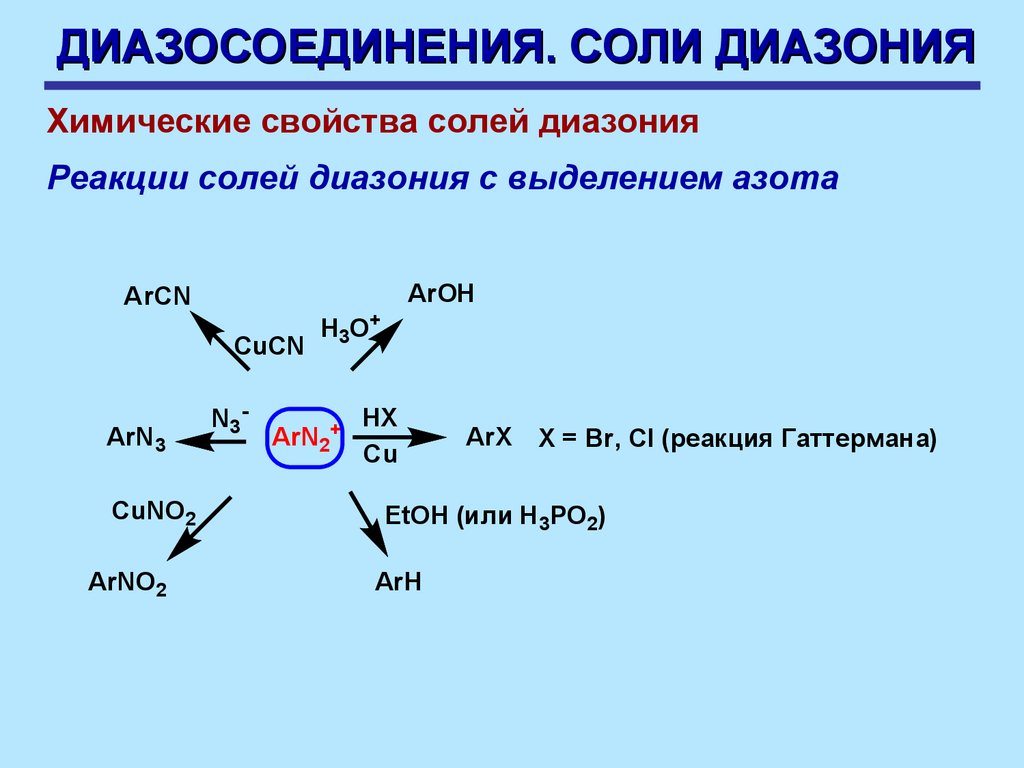
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯХимические свойства солей диазония
Реакции солей диазония с выделением азота
Ar H
Ar N O 2
Ar
NH 2
Ar N
+
N Cl
Ar Cl
Ar Br
Ar I
Ar
CN
Ar OH
Ar H
50.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯХимические свойства солей диазония
Реакции солей диазония с выделением азота
ArX
Х = Br, Cl (реакция Зандмейера)
HX CuX
ArNH2
NaNO2
+
o
H3O , 0
ArN2+
NaI
ArI
HBF4
ArN2+BF4-
t
ArF
реакция Больца-Шимана
51.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯХимические свойства солей диазония
Реакции солей диазония с выделением азота
ArOH
ArCN
CuCN
ArN3
CuNO2
ArNO2
N3 -
H3O+
ArN2+
HX
Cu
ArX Х = Br, Cl (реакция Гаттермана)
EtOH (или H3PO2)
ArH
52.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯРеакции замещения на галоген
Замещение диазогруппы на хлор и бром осуществляют,
смешивая свежеприготовленный раствор соли диазония с
хлоридом или бромидом одновалентной меди. Эти реакции с
использованием Сu называются реакциями Зандмейера
N
+
N Cl
CuCl2
Cl
+ N 2.
53.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯЗамещение на CN, синтез карбоновых кислот
CuCN
+
N
N Cl
C
N + N2
Áåí çî í èòðèë
C
N
H2O, H
+
+
COOH + NH4 .
Áåí çî éí àÿ êèñëî òà
Таким образом, нитросоединения можно превращать в
карбоновые кислоты
54.
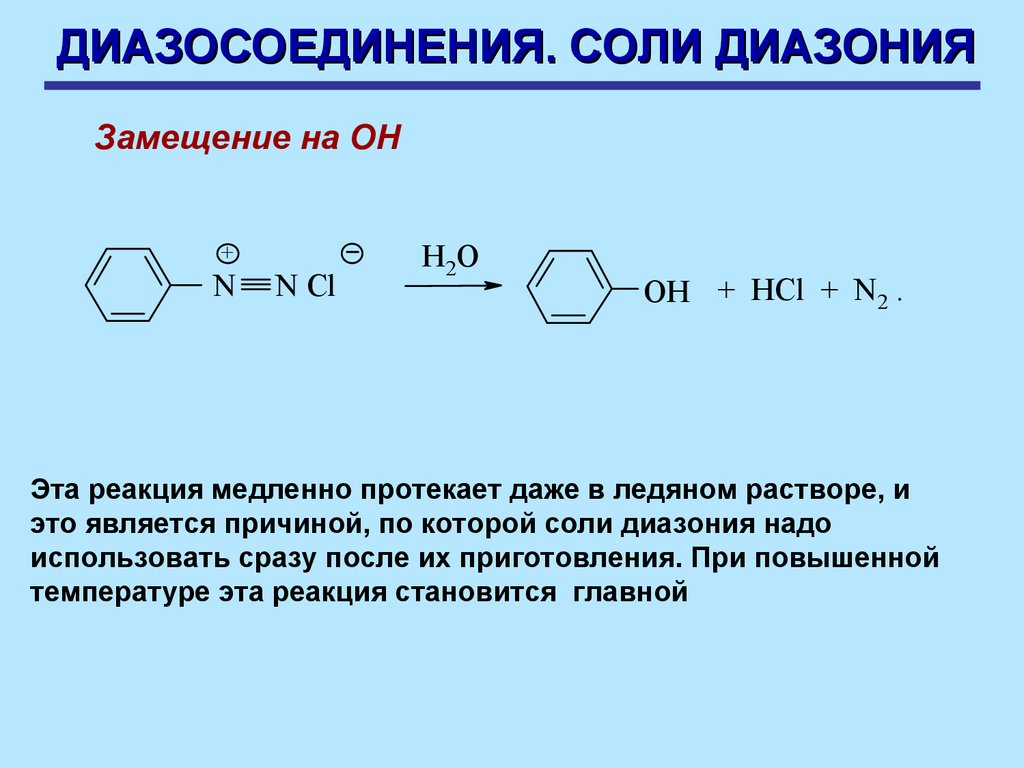
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯЗамещение на ОН
+
N
N Cl
H2 O
OH + HCl + N2 .
Эта реакция медленно протекает даже в ледяном растворе, и
это является причиной, по которой соли диазония надо
использовать сразу после их приготовления. При повышенной
температуре эта реакция становится главной
55.
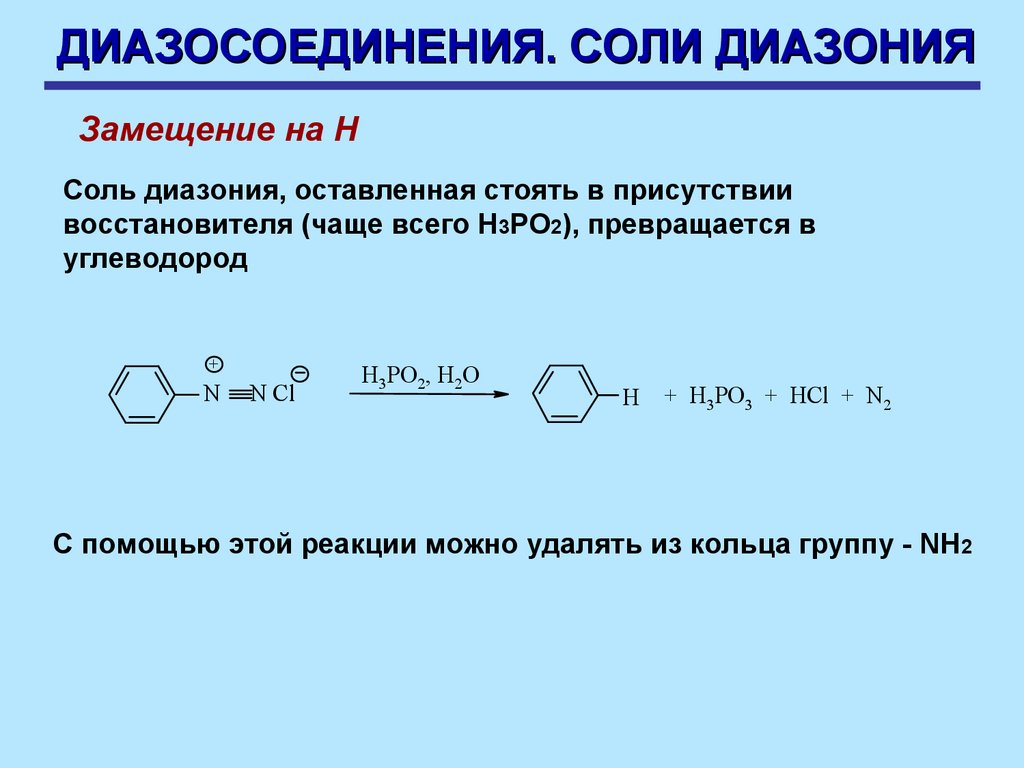
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯЗамещение на Н
Соль диазония, оставленная стоять в присутствии
восстановителя (чаще всего Н3РО2), превращается в
углеводород
+
N
N Cl
H3PO2, H2O
H
+ H3PO3 + HCl + N2
С помощью этой реакции можно удалять из кольца группу - NH2
56.
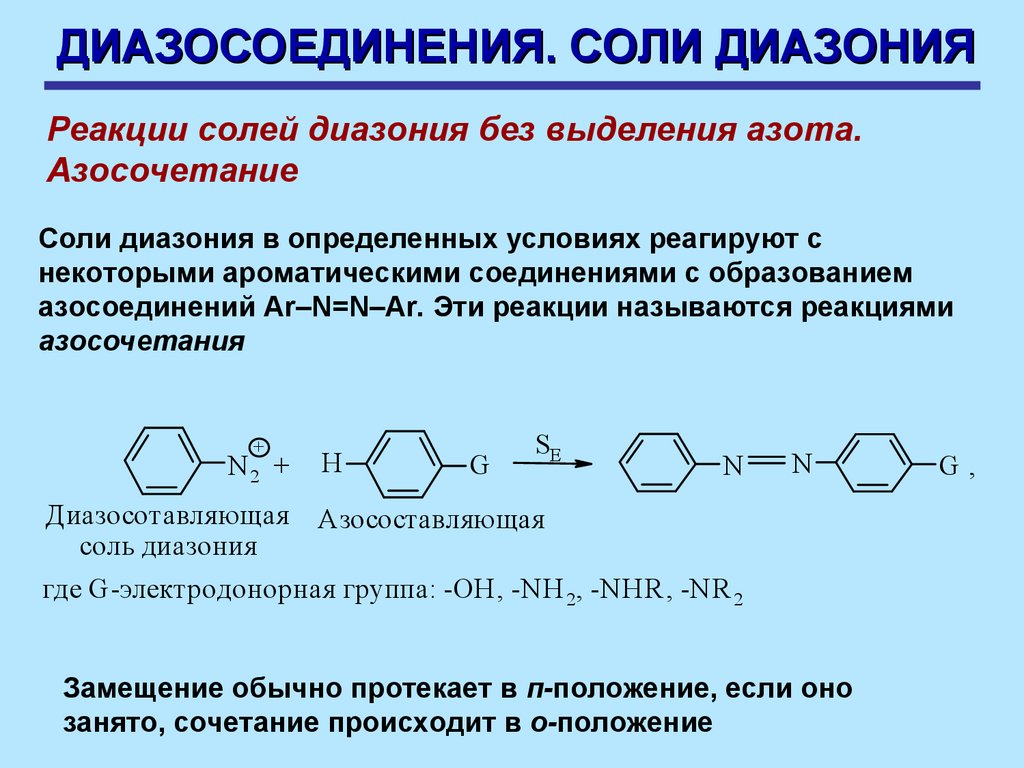
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯРеакции солей диазония без выделения азота.
Азосочетание
Соли диазония в определенных условиях реагируют с
некоторыми ароматическими соединениями с образованием
азосоединений Ar–N=N–Ar. Эти реакции называются реакциями
азосочетания
+
N2 +
Диазосотавля ющая
соль диазония
H
G
SE
N
N
Азосоставля ющая
где G-электродонорная группа: -OH, -N H 2, -NHR , -NR 2
Замещение обычно протекает в п-положение, если оно
занято, сочетание происходит в о-положение
G,
57.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯРеакции солей диазония без выделения азота.
Азосочетание
Механизм реакции – электрофильное замещение SEAr.
Электрофильным агентом является ион диазония, очень
слабый электрофил, поэтому он атакует только очень
реакционноспособные кольца
58.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯСочетание с аминами
Высокая кислотность среды способствует тому, что
диазосоединение полностью находится в виде диазокатиона,
который сочетается. Но чем выше кислотность, тем выше доля
амина в виде иона аммония, который не активен в реакциях
электрофильного присоединения. Поэтому среда должна быть
слабокислой, чтобы достаточное количество амина было в
свободном состоянии
+
NH 3
NH 2
H
Амин сочетается
+
Ион аммония
не сочетается
59.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯРеакции солей диазония без выделения азота.
Азосочетание
Во-вторых, если предположить, что азокомпонент образует связь с
четырехвалентным атомом азота, то при этом должна была бы
образоваться чрезвычайно невыгодная биполярная структура
N
X
N
Обычно диазоний катион атакует пара-, а не орто-положение
азокомпонента. Возможно это связано с тем, что в орто-положениях в
большей степени сказывается – I – эффект заместителей типа N(CH3)2 и
ОСН3, а также их экранирующее действие
60.
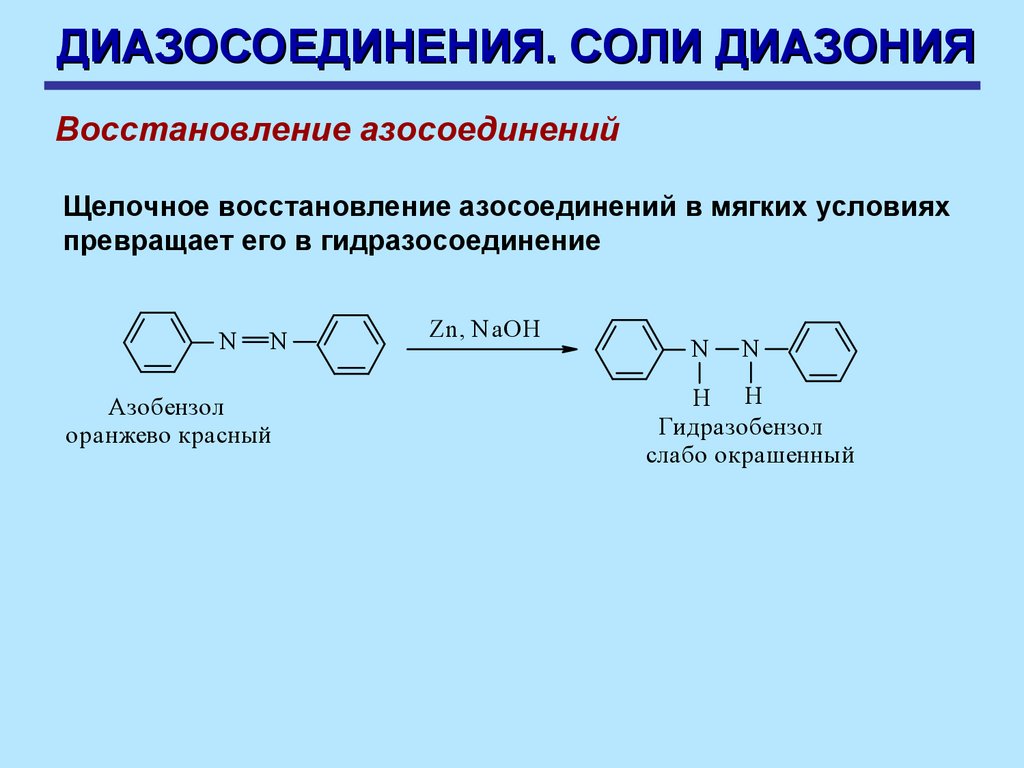
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯВосстановление азосоединений
Щелочное восстановление азосоединений в мягких условиях
превращает его в гидразосоединение
N
N
Азобензол
оранжево красный
Zn, NaOH
2H 2SO 4
N
N
H H
Гидразобензол
слабо окрашенный


































 chemistry
chemistry








