Similar presentations:
Азотсодержащие органические соединения. Строение и реакционная способность аминов, их основные и нуклеофильные свойства
1.
II КУРСМЕДИКО-БИОЛОГИЧЕСКОГО ФАКУЛЬТЕТА,
по направлению подготовки
МЕДИЦИНСКАЯ БИОХИМИЯ
Азотсодержащие органические соединения.
Строение и реакционная способность аминов, их
основные и нуклеофильные свойства.
2.
Амины• это производные аммиака (NH3), у которого один, два или три атома
водорода в молекуле замещены на углеводородные радикалы.
• по количеству радикалов, связанных с амино-группой
• по радикалу, связанному с амино-группой
3.
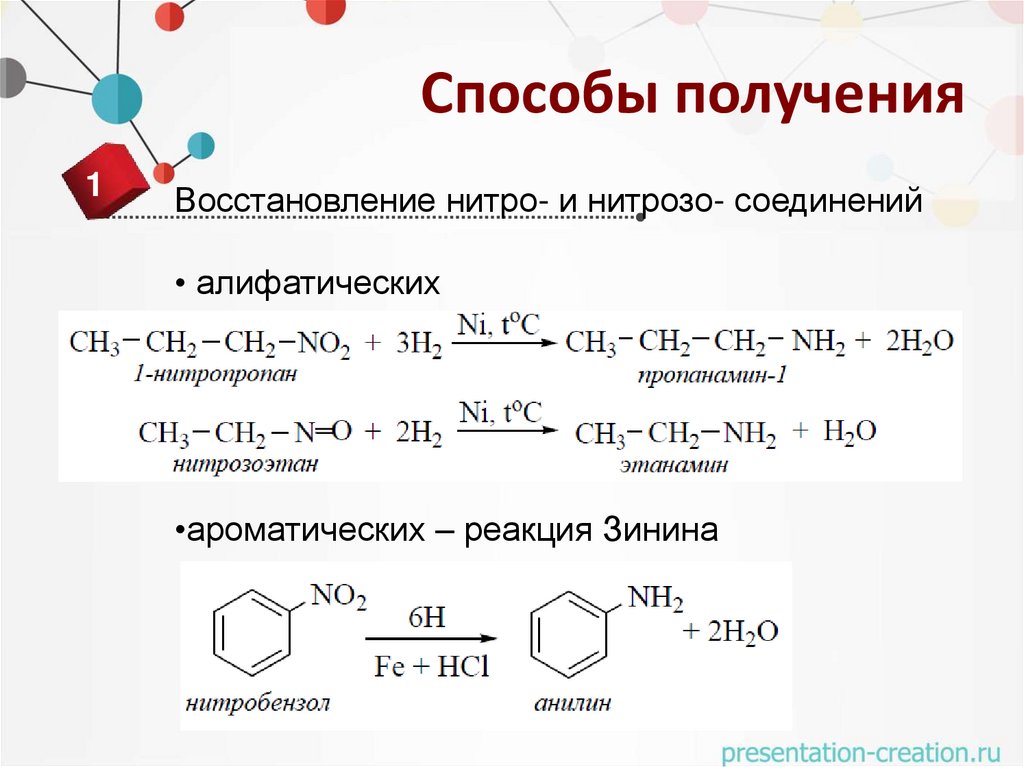
Способы получения1
Восстановление нитро- и нитрозо- соединений
• алифатических
•ароматических – реакция Зинина
4.
Способы получения2
Восстановление оксимов:
3
Восстановление нитрилов и изонитрилов:
5.
Способы получения4
Восстановление незамещённых и замещённых
амидов карбоновых кислот
6.
Способы получения5
Расщепление незамещённых амидов карбоновых
кислот по Гофману:
происходит укорачивание цепи на один атом углерода.
7.
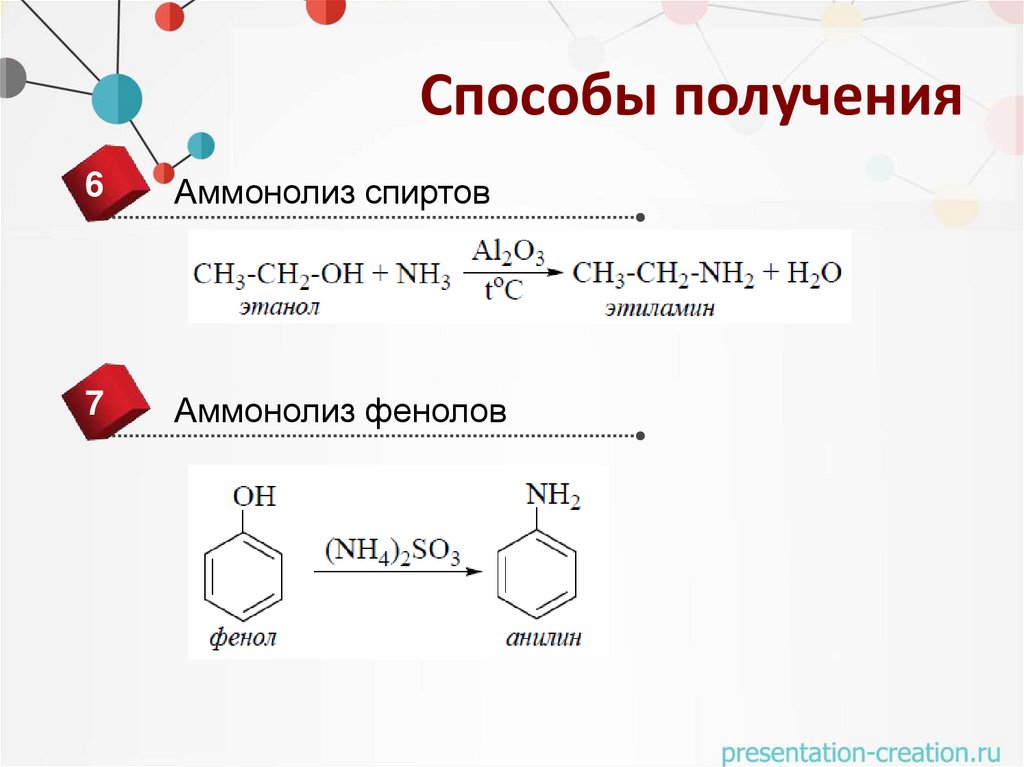
Способы получения6
Аммонолиз спиртов
7
Аммонолиз фенолов
8.
Способы получения8
Декарбоксилирование природных α –
аминокислот: получают биогенные амины
9.
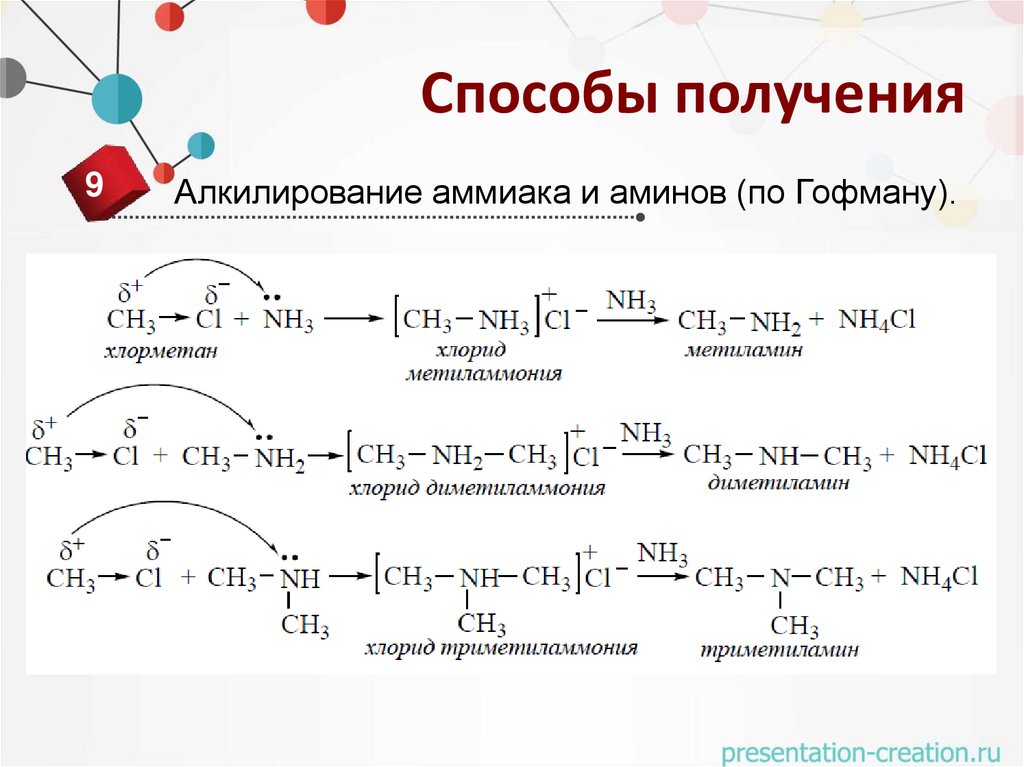
Способы получения9
Алкилирование аммиака и аминов (по Гофману).
10.
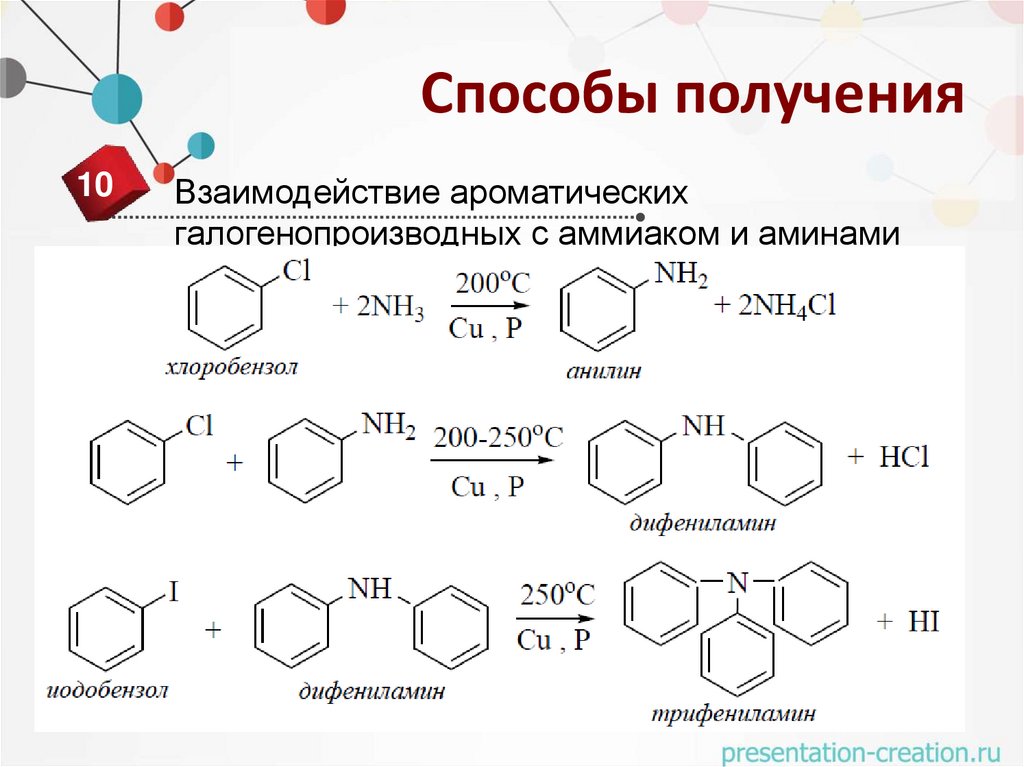
Способы получения10
Взаимодействие ароматических
галогенопроизводных с аммиаком и аминами
11.
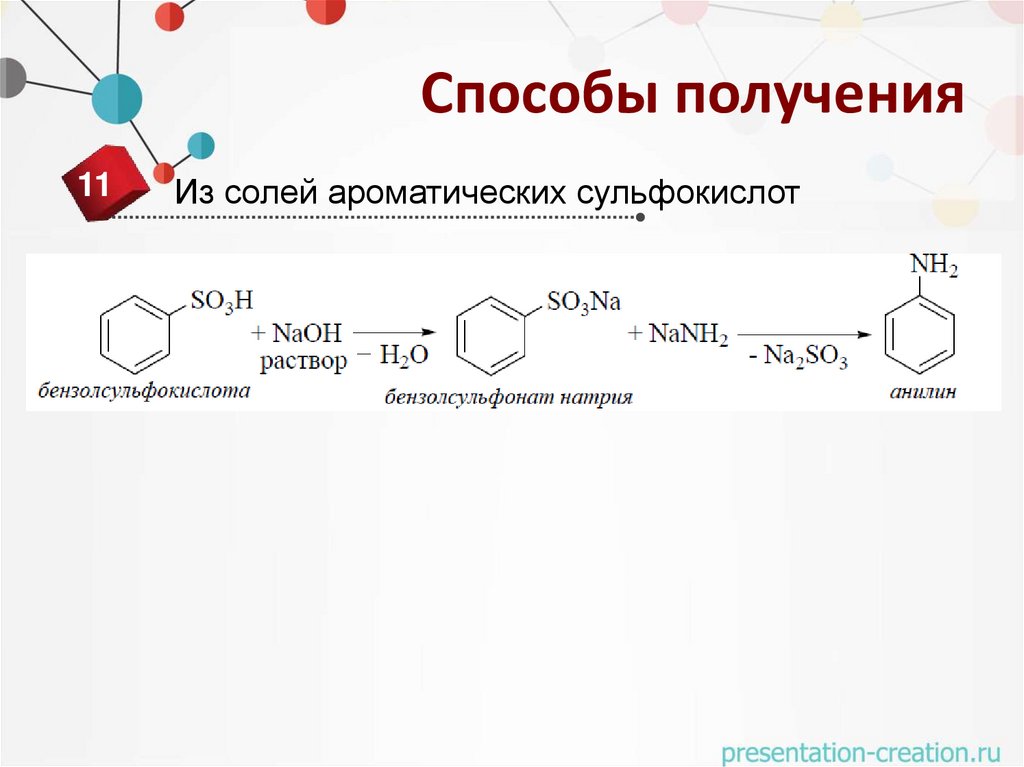
Способы получения11
Из солей ароматических сульфокислот
12.
Физические свойства• Метиламин, диметиламин, триметиламин –
бесцветные газы, легко растворяются в воде, имеют
запах селедочного рассола.
• Амины С6 – С15 – бесцветные жидкости с запахом
селедочного рассола.
• Амины С16 и > – бесцветные твердые вещества без
запаха.
• Ароматические амины – это бесцветные жидкости или
твердые кристаллические вещества. Легко окисляются
на воздухе, приобретая желтоватую окраску, плохо
растворимы в воде.
13.
Химические свойства14.
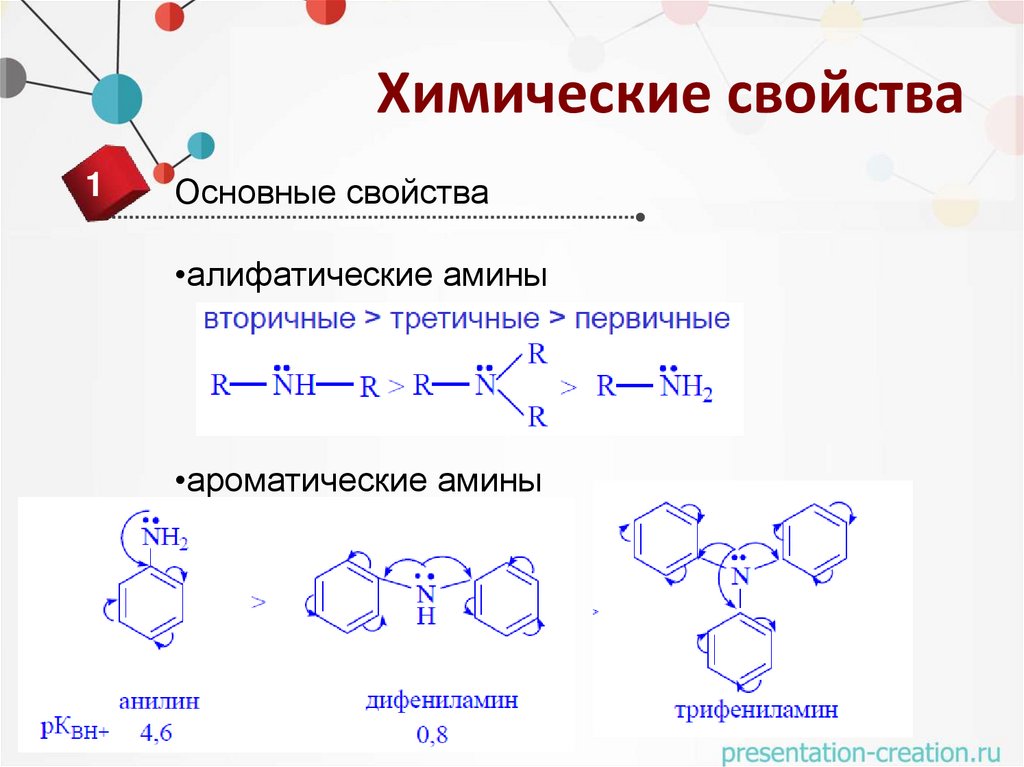
Химические свойства1
Основные свойства
•алифатические амины
•ароматические амины
15.
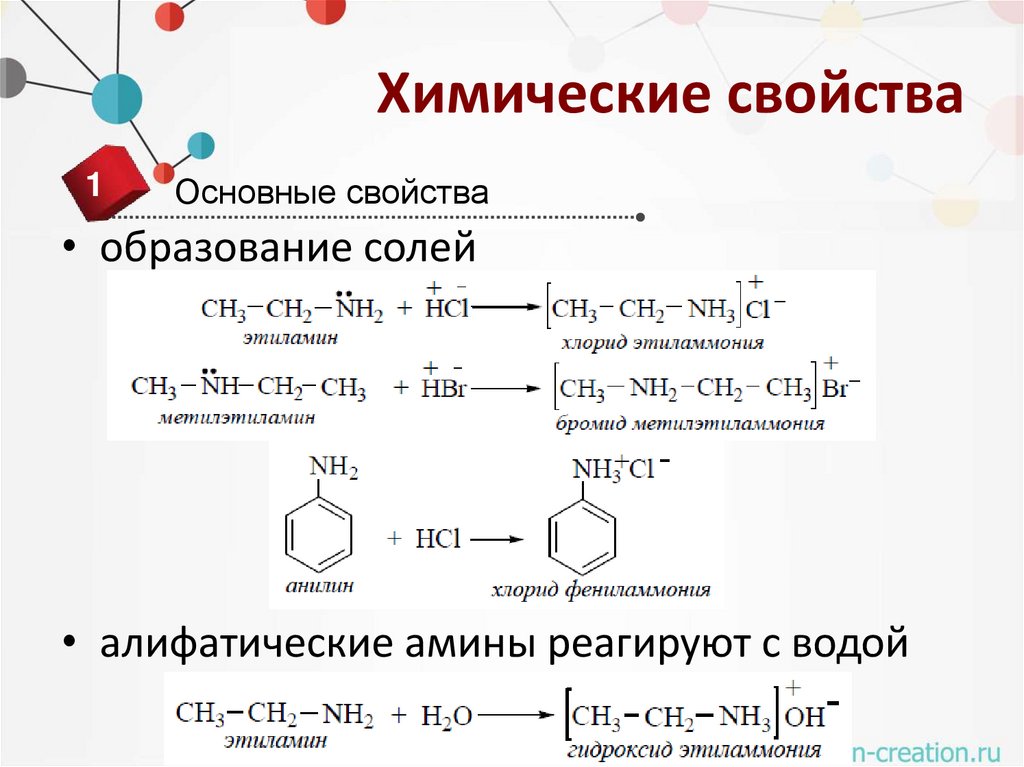
Химические свойства1
Основные свойства
• образование солей
• алифатические амины реагируют с водой
16.
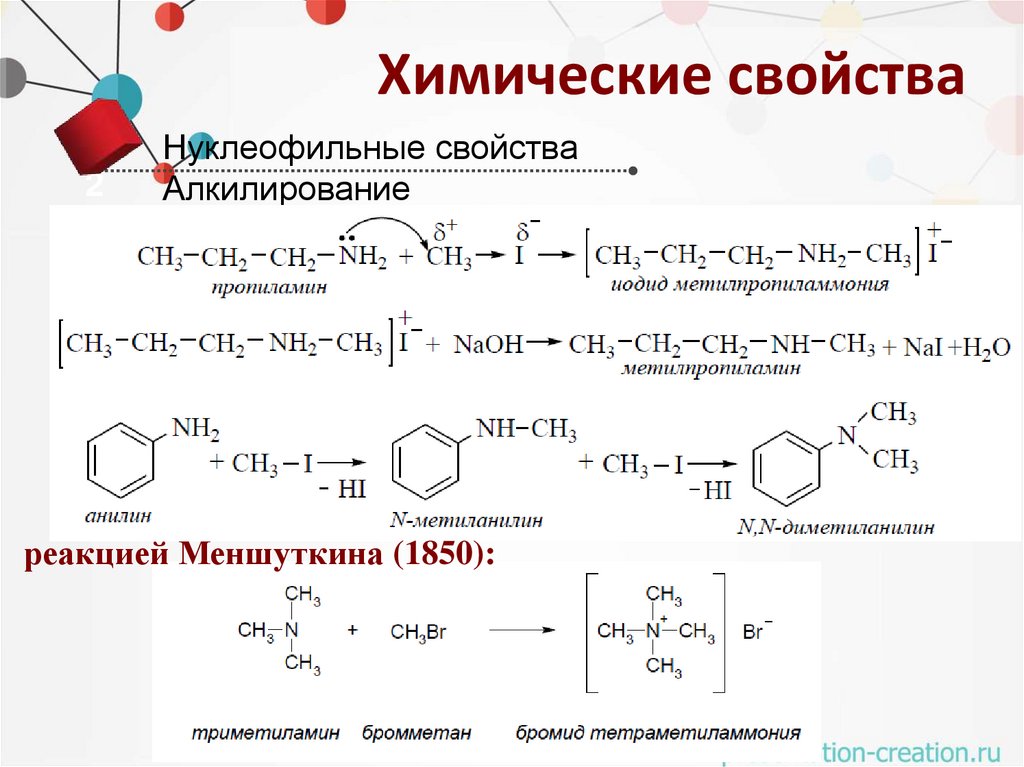
Химические свойства2
Нуклеофильные свойства
Алкилирование
реакцией Меншуткина (1850):
17.
Химические свойства2
Нуклеофильные свойства
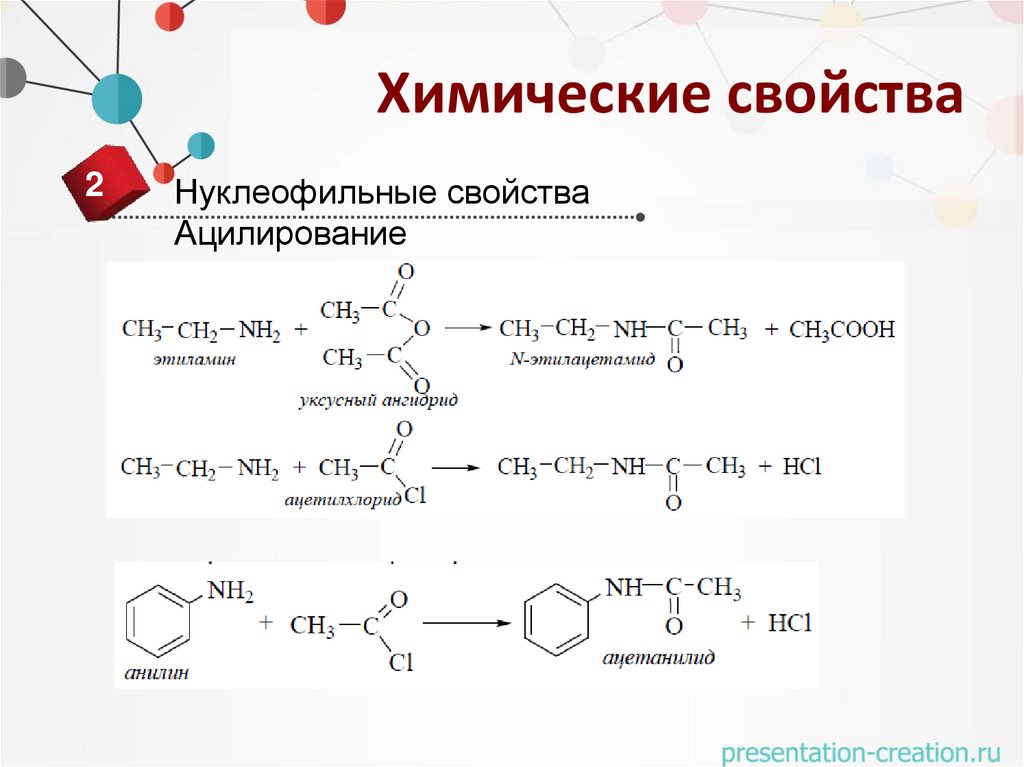
Ацилирование
18.
Химические свойства2
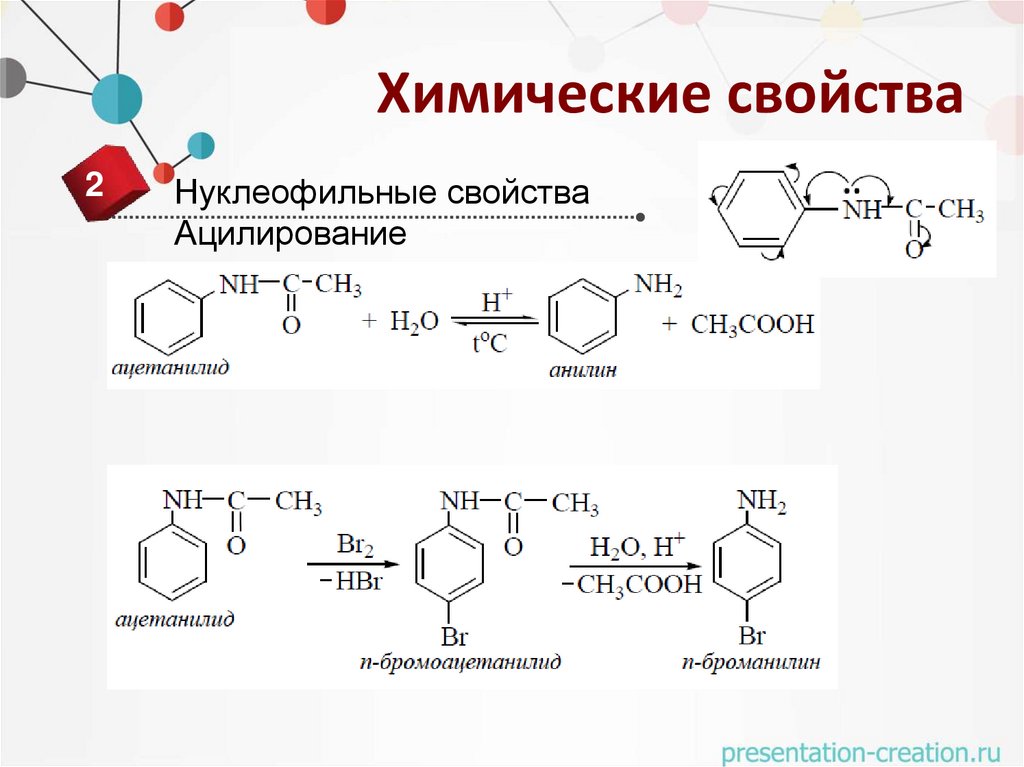
Нуклеофильные свойства
Ацилирование
19.
Химические свойства2
Нуклеофильные свойства
Взаимодействии с карбонильными
оснований Шиффа (Шифф, 1866):
соединениями
–AN,
обраоване
В организме происходит процесс превращения кетокислот в аминокислоты –
т.н. трансаминирование или переаминирование. Процесс катализируется
ферментами – трансаминазами, имеющими в качестве кофермента
пиридоксальфосфат – производное витамина B6:
Механизм этого процесса включает образование оснований Шиффа
20.
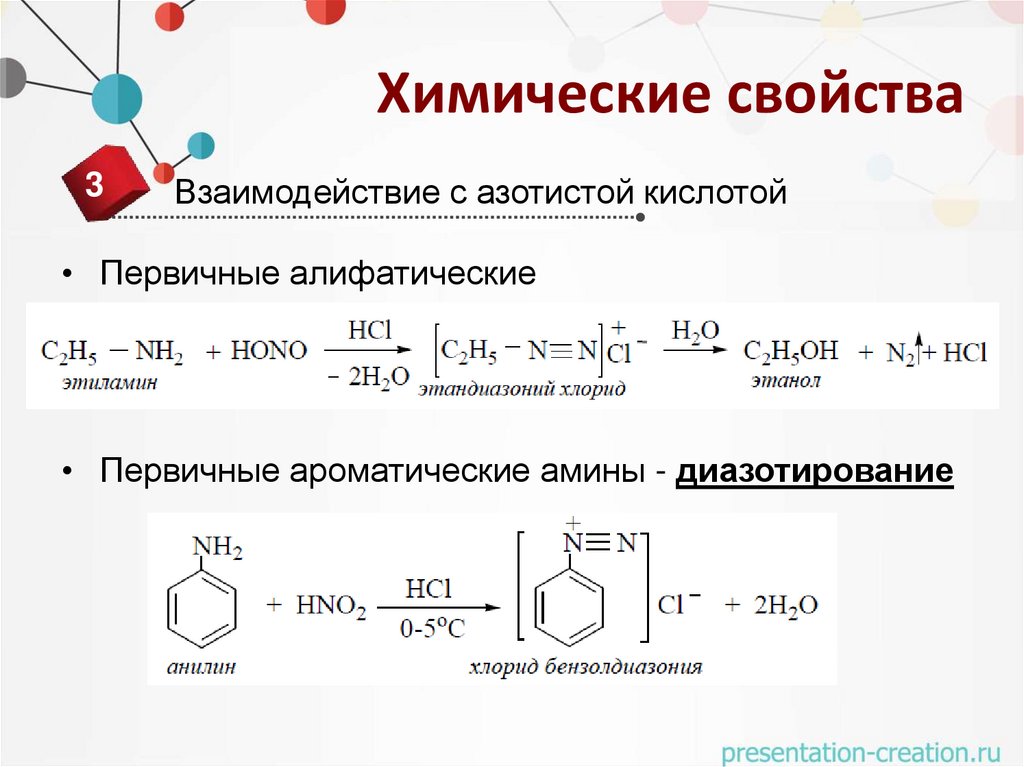
Химические свойства3
Взаимодействие с азотистой кислотой
• Первичные алифатические
• Первичные ароматические амины - диазотирование
21.
Химические свойства3
Взаимодействие с азотистой кислотой
• Вторичные алифатические, ароматические и
смешанные амины
22.
Химические свойства3
Взаимодействие с азотистой кислотой
• Третичные алифатические амины в обычных
условиях с азотистой кислотой не взаимодействуют.
• Третичные смешанные амины
23.
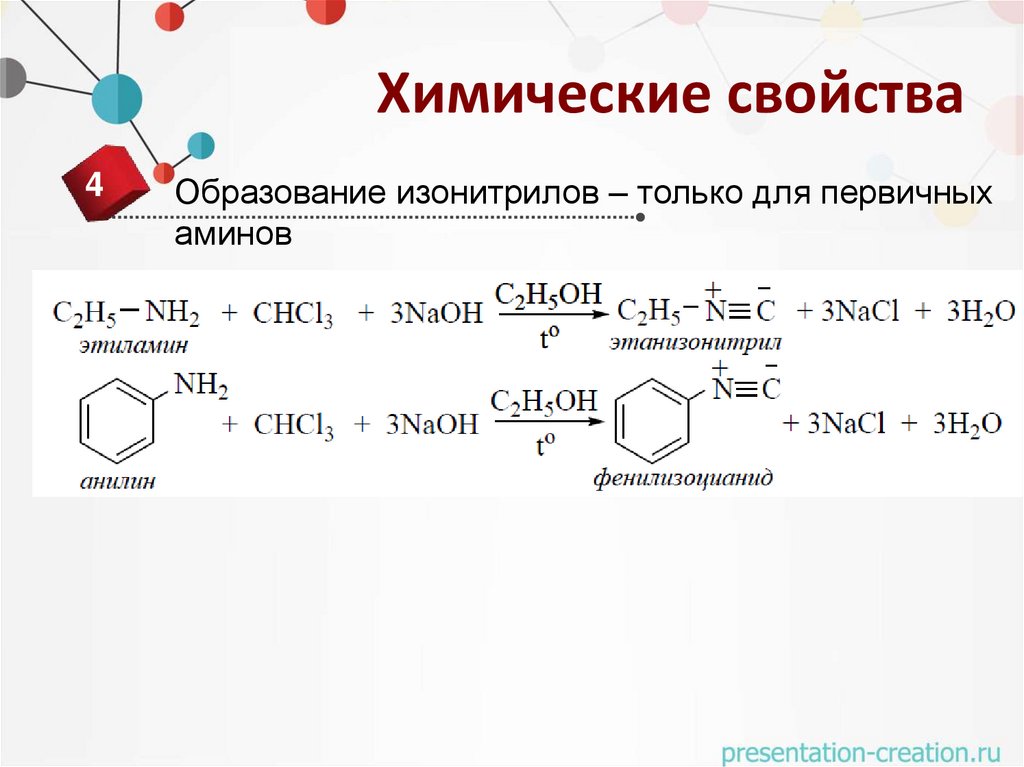
Химические свойства4
Образование изонитрилов – только для первичных
аминов
24.
Химические свойства5
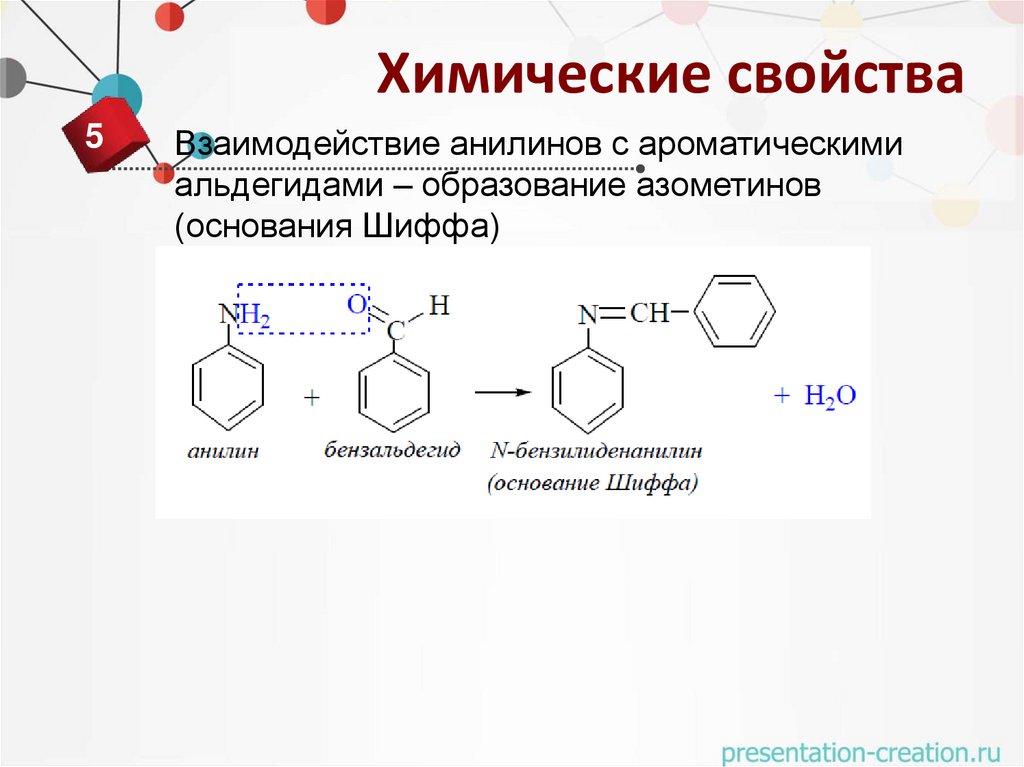
Взаимодействие анилинов с ароматическими
альдегидами – образование азометинов
(основания Шиффа)
25.
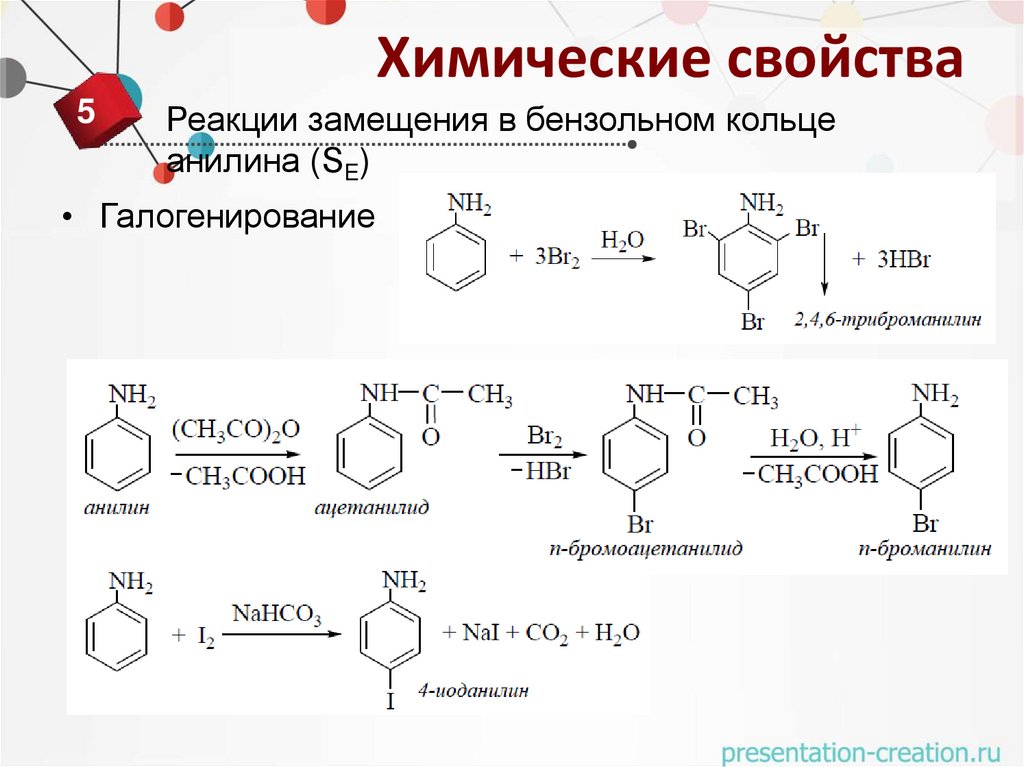
Химические свойства5
Реакции замещения в бензольном кольце
анилина (SE)
• Галогенирование
26.
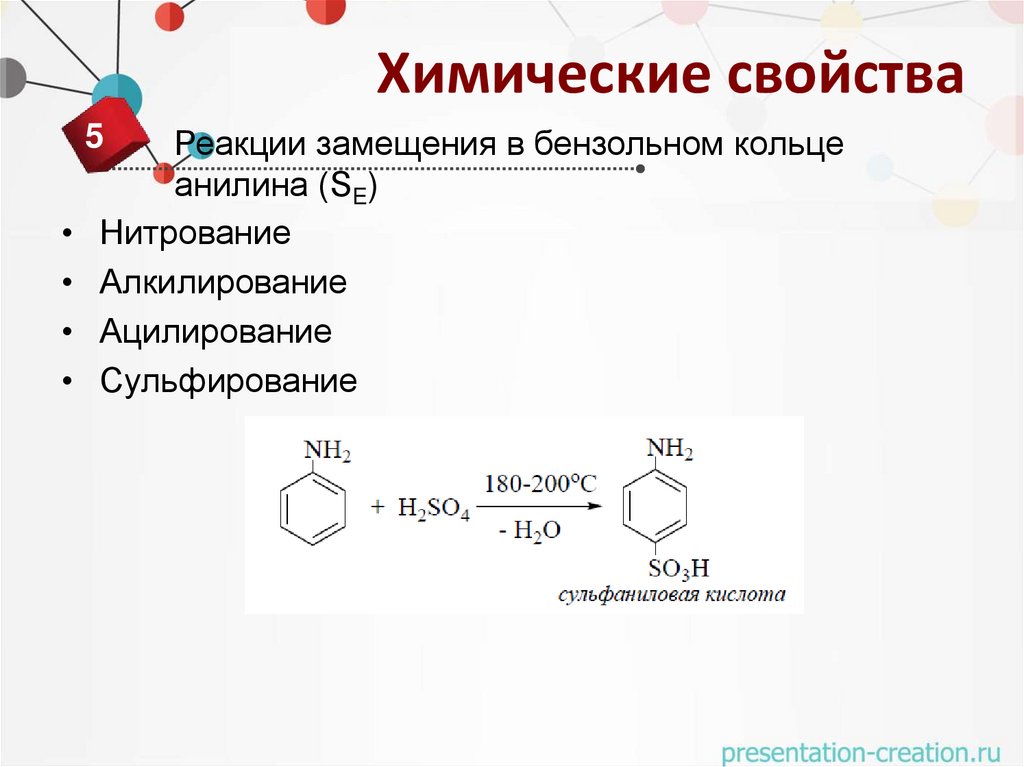
Химические свойства5
Реакции замещения в бензольном кольце
анилина (SE)
Нитрование
Алкилирование
Ацилирование
Сульфирование
27.
Азотсодержащие органические соединения.Строение и реакционная способность
диазосоединений
28.
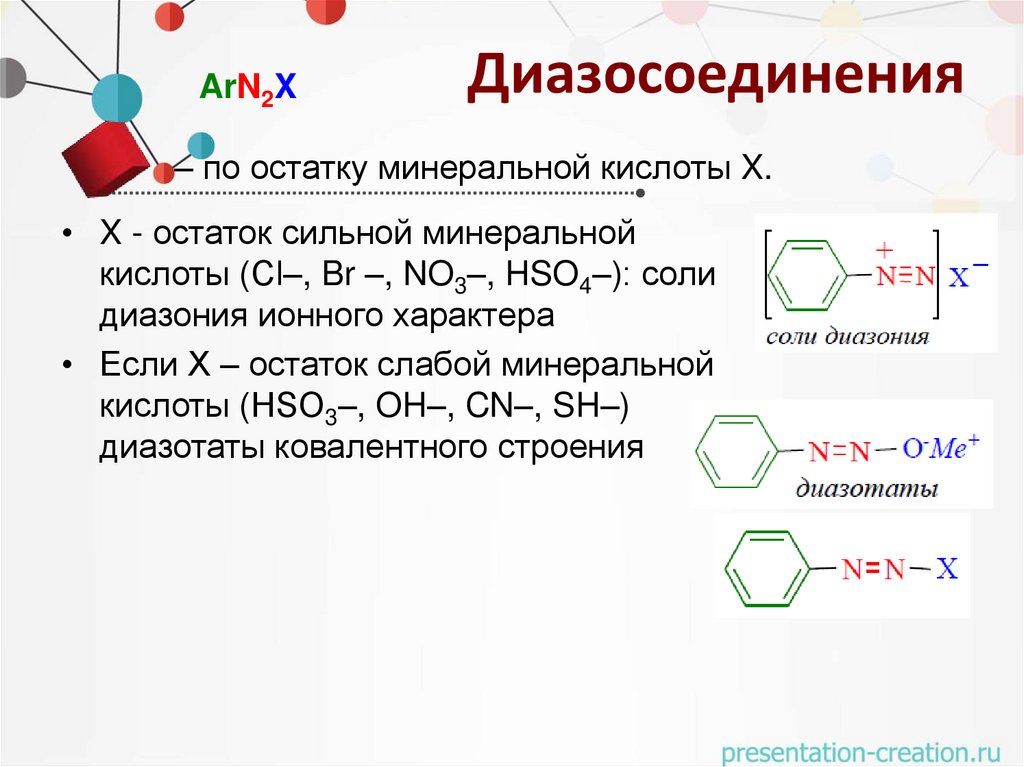
Диазосоединения– это класс органических соединений, которые содержат в молекуле группировку из двух атомов
азота, связанную с углеводородным радикалом и
остатком минеральной кислоты.
• По структуре радикала:
• Алифатические диазосоединения
неустойчивы и не имеют широкого
практического применения.
• Диазосоединения ароматического ряда – это
ароматические соединения, имеющие общую
формулу: ArN2X.
29.
ArN2XДиазосоединения
– по остатку минеральной кислоты X.
• X - остаток сильной минеральной
кислоты (Cl–, Br –, NO3–, HSO4–): соли
диазония ионного характера
• Если Х – остаток слабой минеральной
кислоты (HSO3–, OH–, CN–, SH–)
диазотаты ковалентного строения
30.
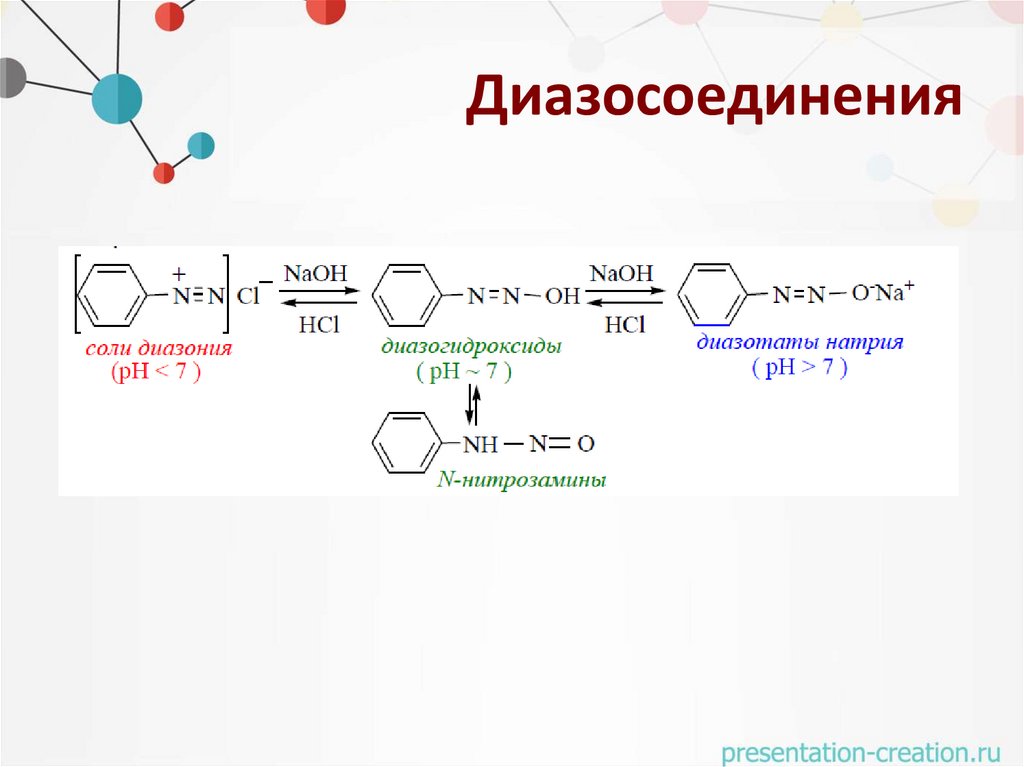
Диазосоединения31.
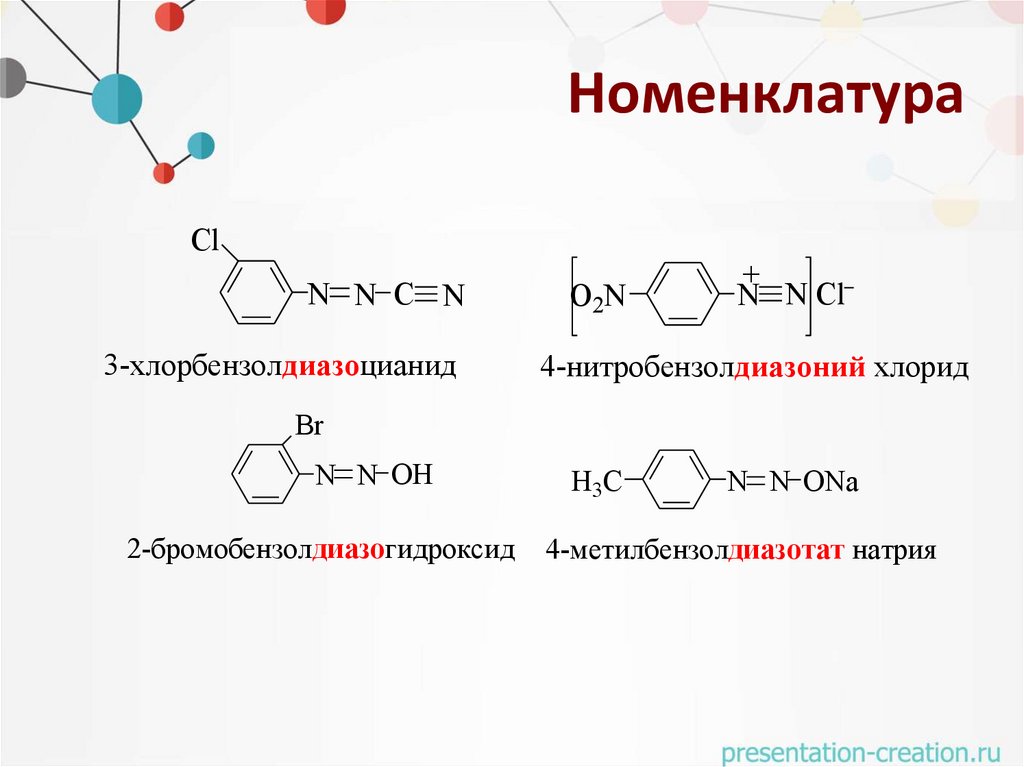
НоменклатураCl
N N C N
3-хлорбензолдиазоцианид
O2N
+
N N Cl
4-нитробензолдиазоний хлорид
Br
N N OH
2-бромобензолдиазогидроксид
H3С
N N ONa
4-метилбензолдиазотат натрия
32.
Получение1
Реакции диазотирования
• открыта в 1858 году немецким химиком П.
Гриссом
• бесцветные кристаллические вещества, легко
растворимые в воде
• неустойчивы, при нагревании и механических
воздействиях разлагаются со взрывом
Иоганн Петер Грисс
(1829 – 1888)
33.
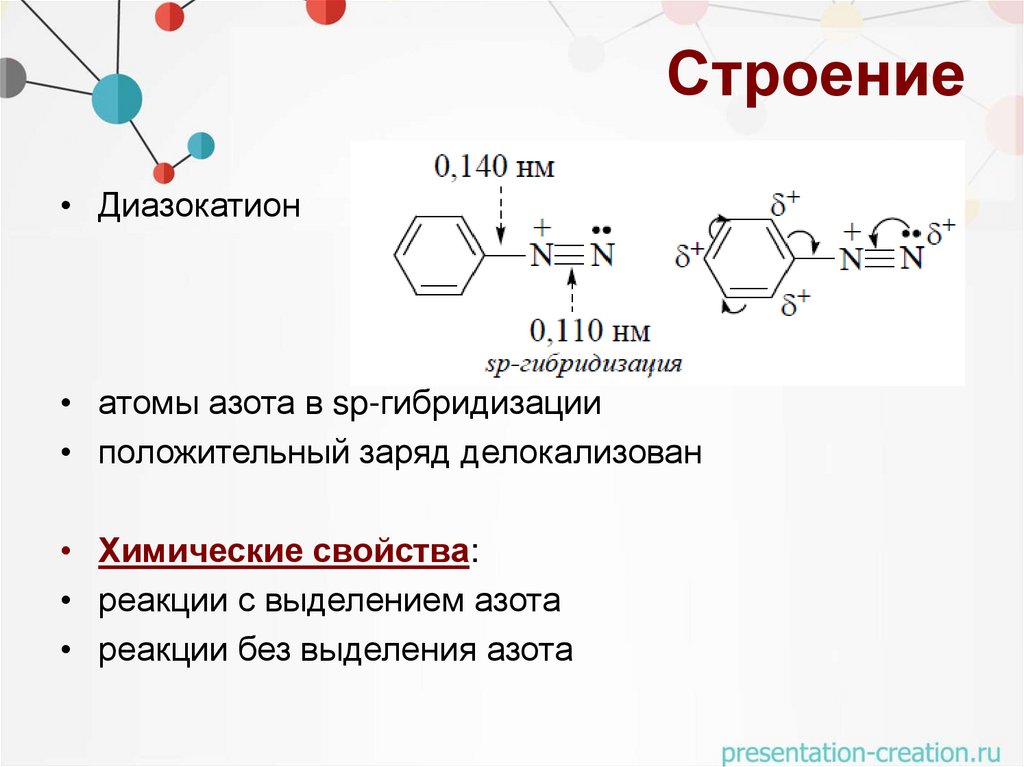
Строение• Диазокатион
• атомы азота в sp-гибридизации
• положительный заряд делокализован
• Химические свойства:
• реакции с выделением азота
• реакции без выделения азота
34.
Химические свойства:реакции с выделением азота
• позволяют ввести в ароматическое ядро
заместители, введение которые иными
способами невозможно
• два механизма SR или SN1
35.
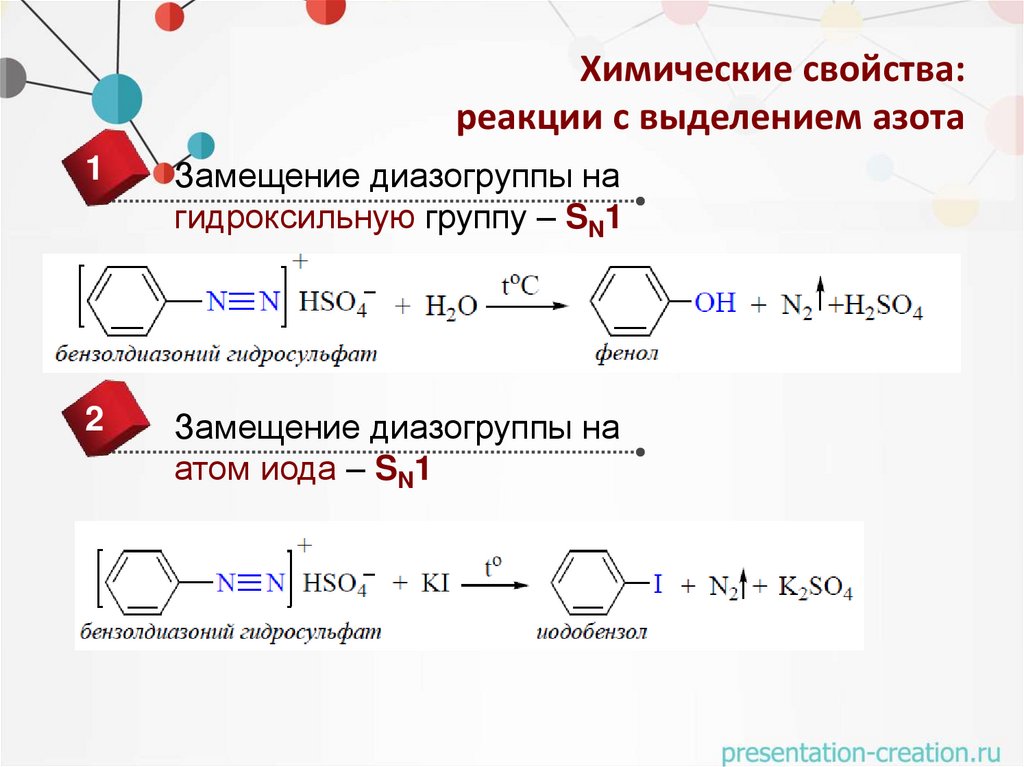
Химические свойства:реакции с выделением азота
1
Замещение диазогруппы на
гидроксильную группу – SN1
2
Замещение диазогруппы на
атом иода – SN1
36.
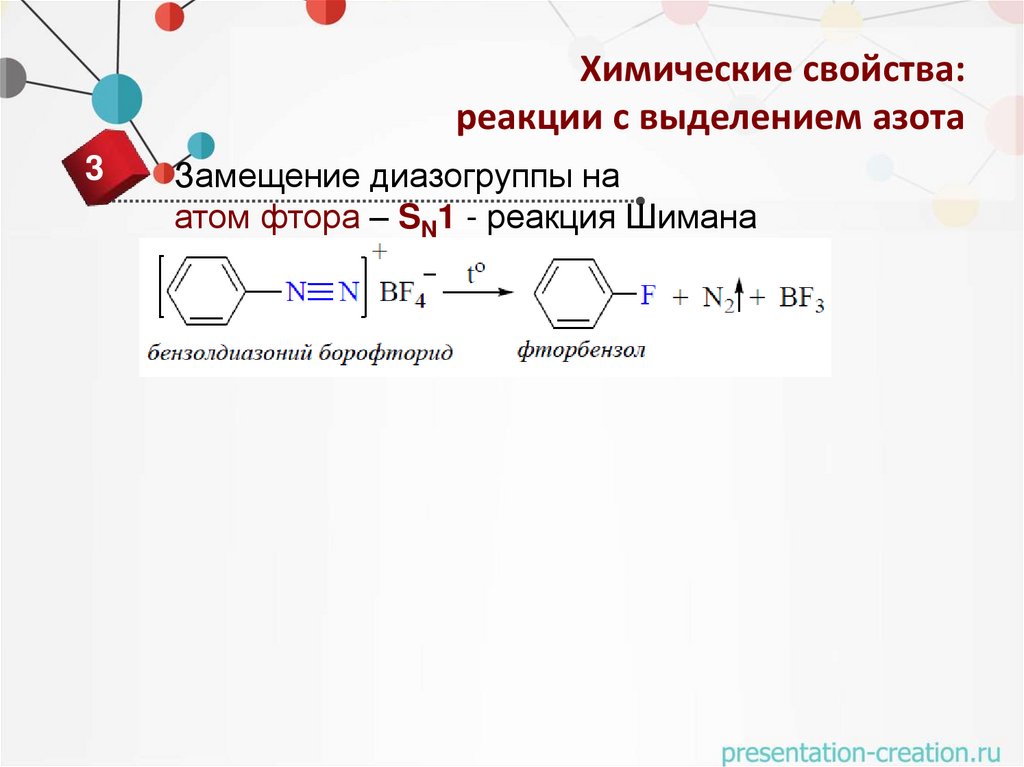
Химические свойства:реакции с выделением азота
3
Замещение диазогруппы на
атом фтора – SN1 - реакция Шимана
37.
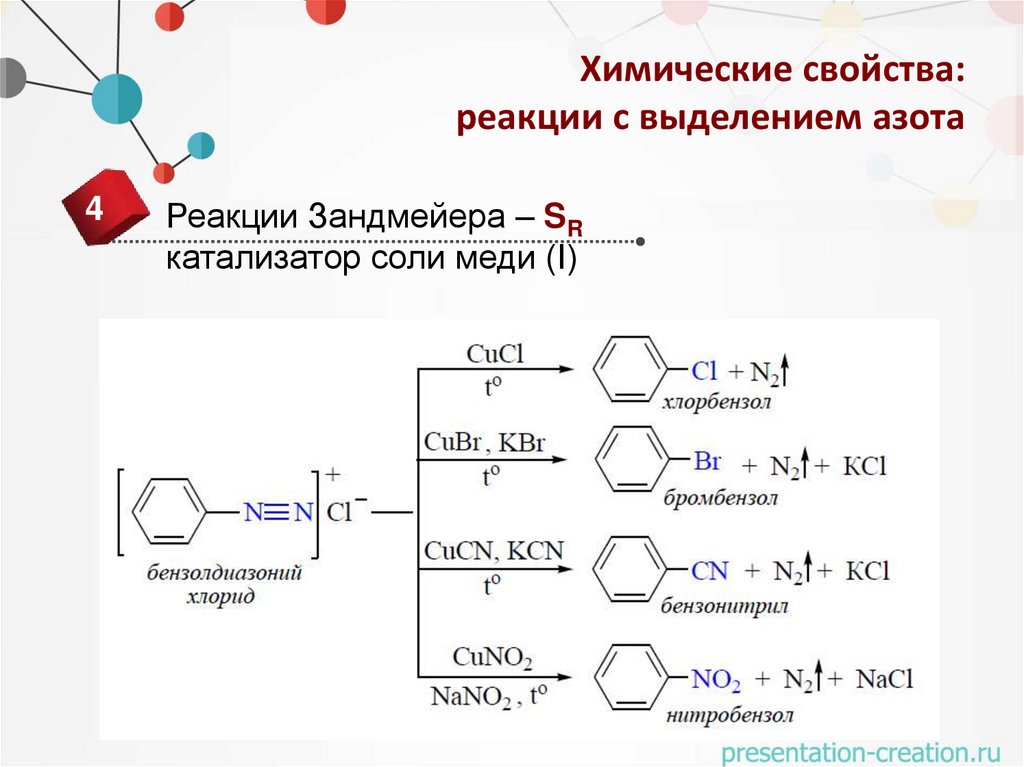
Химические свойства:реакции с выделением азота
4
Реакции Зандмейера – SR
катализатор соли меди (I)
38.
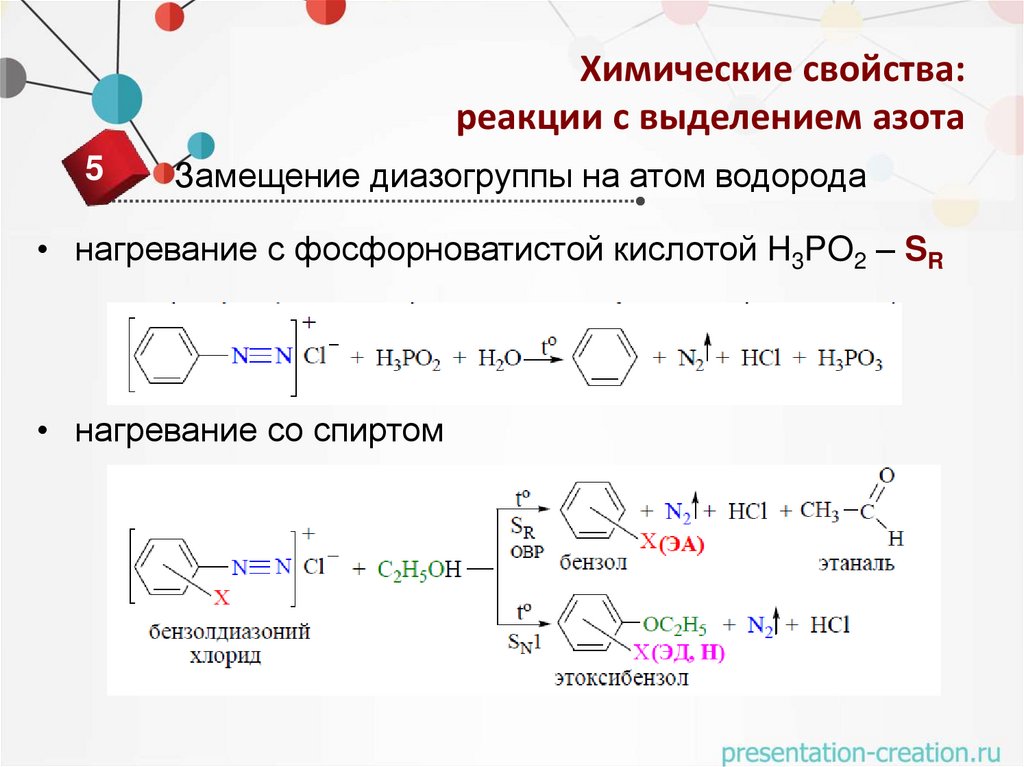
Химические свойства:реакции с выделением азота
5
Замещение диазогруппы на атом водорода
• нагревание с фосфорноватистой кислотой H3PO2 – SR
• нагревание со спиртом
39.
Химические свойства:реакции с выделением азота
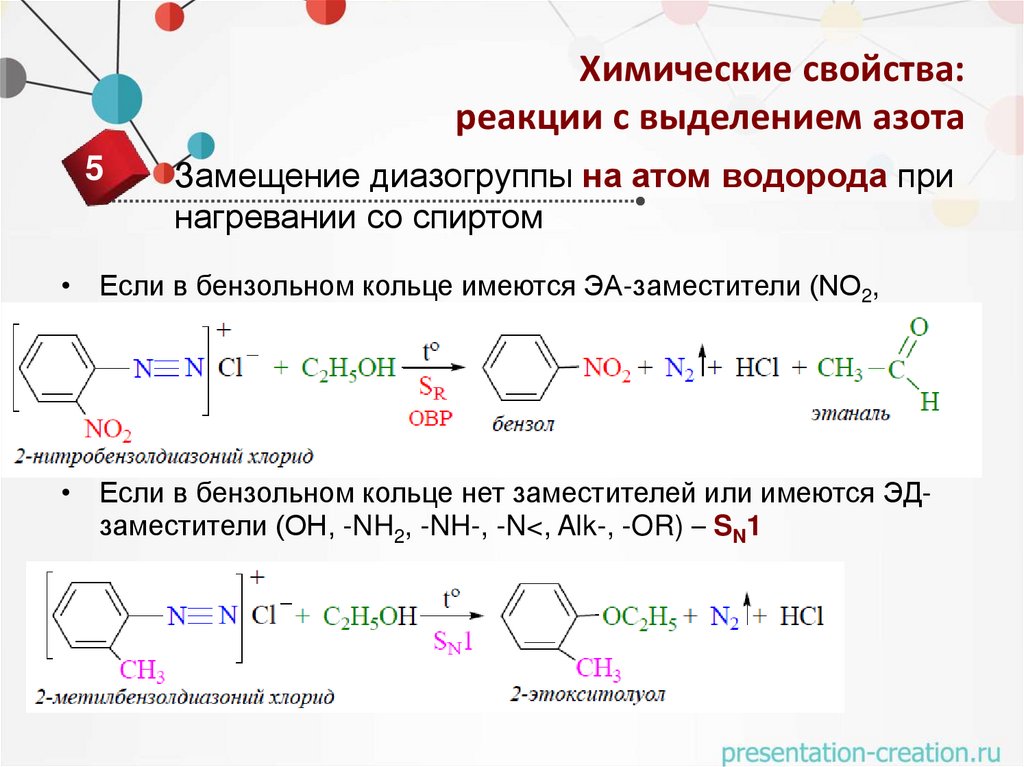
5
Замещение диазогруппы на атом водорода при
нагревании со спиртом
• Если в бензольном кольце имеются ЭА-заместители (NO2,
COOH, SO3H) – SR
• Если в бензольном кольце нет заместителей или имеются ЭДзаместители (OH, -NH2, -NH-, -N<, Alk-, -OR) – SN1
40.
Химические свойства:реакции с выделением азота
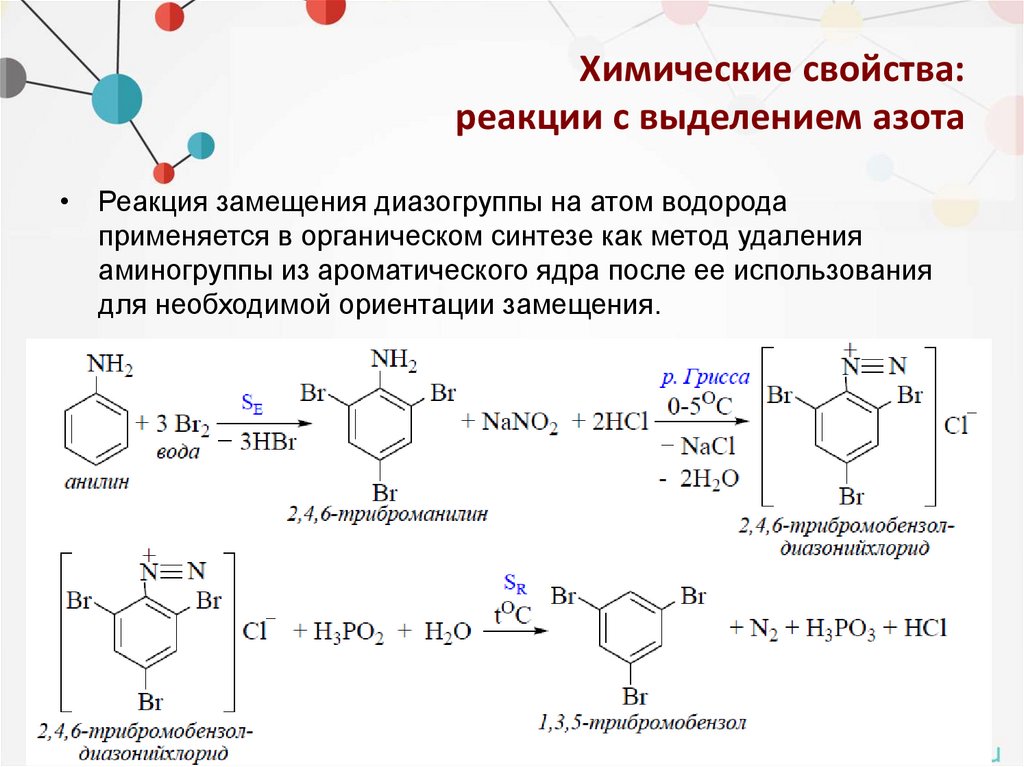
• Реакция замещения диазогруппы на атом водорода
применяется в органическом синтезе как метод удаления
аминогруппы из ароматического ядра после ее использования
для необходимой ориентации замещения.
41.
Химические свойства:реакции без выделения азота
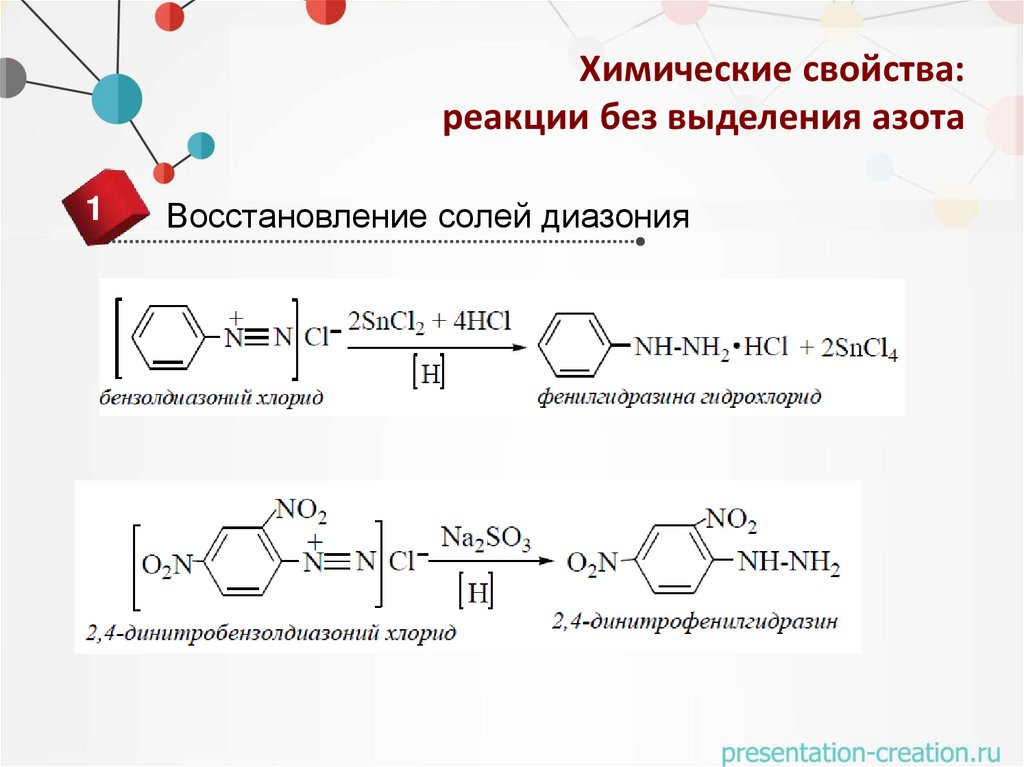
1
Восстановление солей диазония
42.
Химические свойства:реакции без выделения азота
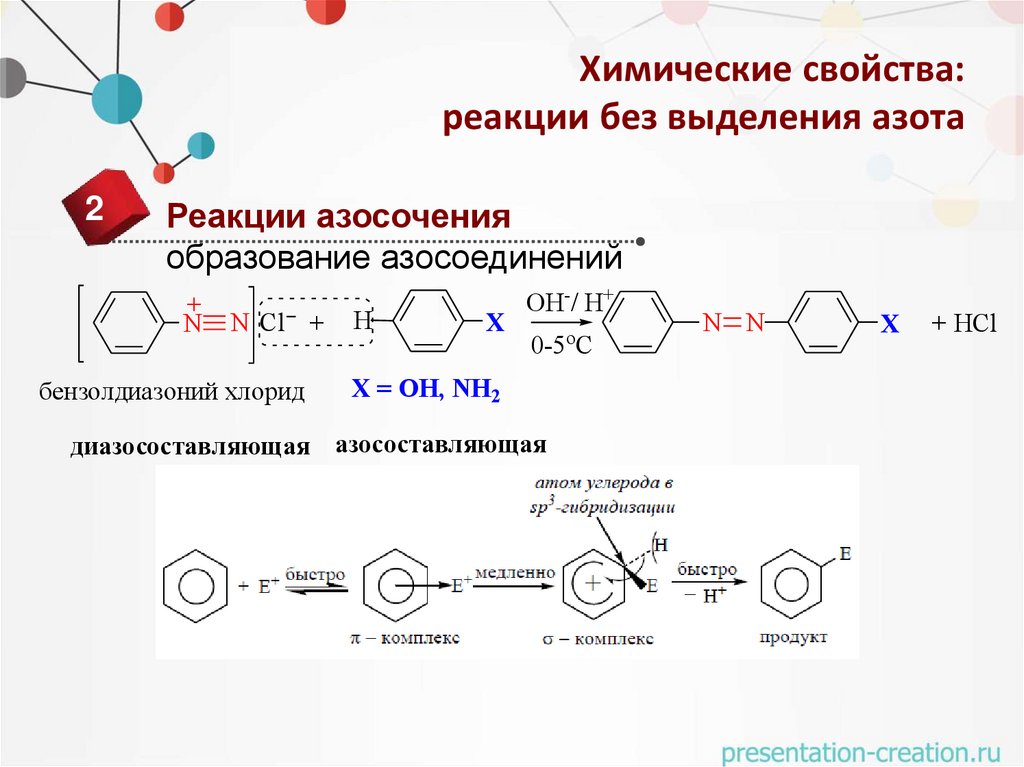
2
Реакции азосочения
образование азосоединений
+
N
N Cl +
бензолдиазоний хлорид
H
X
OH-/ H+
o
0-5 C
X = OH, NH2
диазосоставляющая азосоставляющая
N N
X
+ HCl
43.
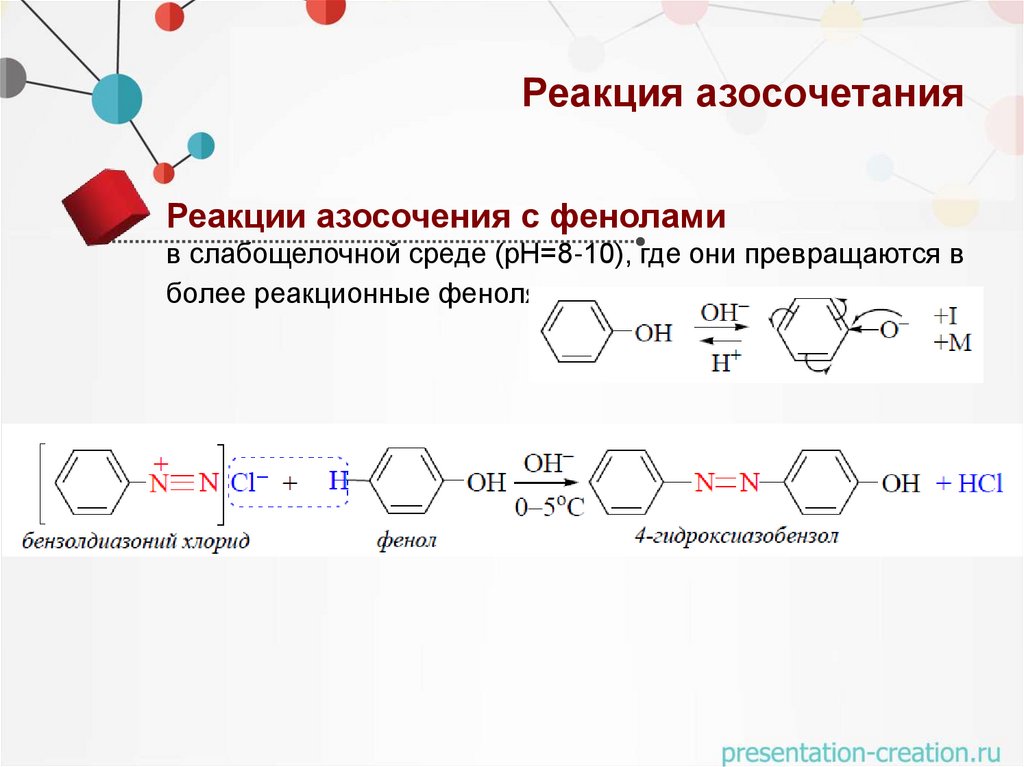
Реакция азосочетанияРеакции азосочения с фенолами
в слабощелочной среде (рН=8-10), где они превращаются в
более реакционные феноляты
44.
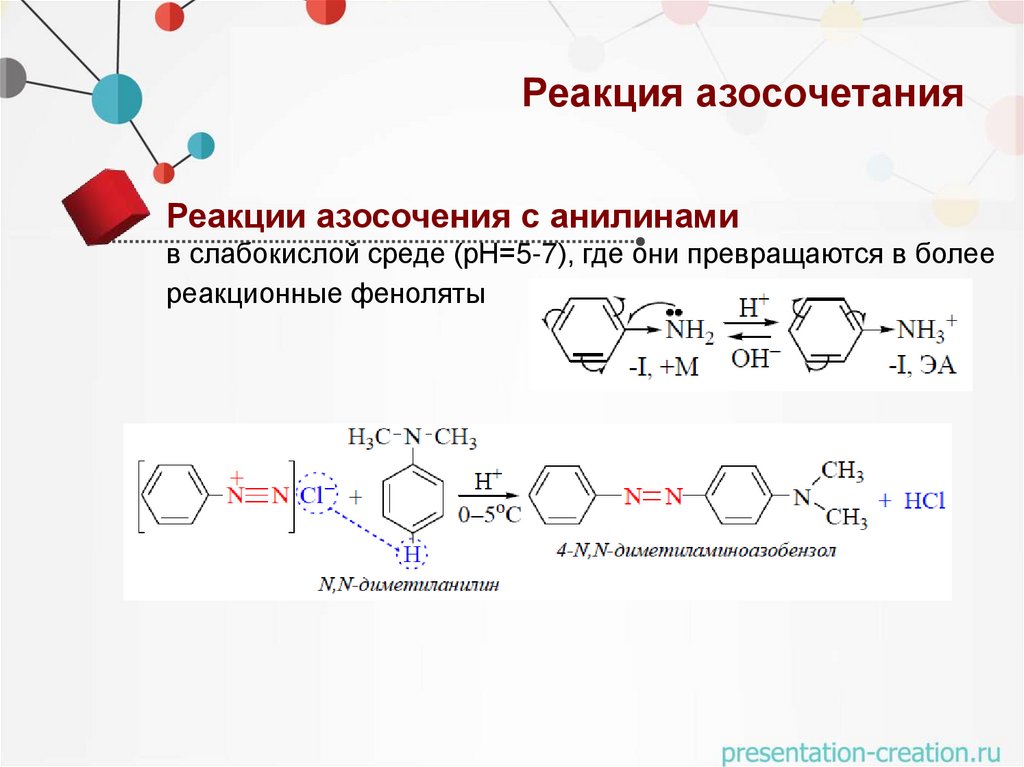
Реакция азосочетанияРеакции азосочения с анилинами
в слабокислой среде (рН=5-7), где они превращаются в более
реакционные феноляты
45.
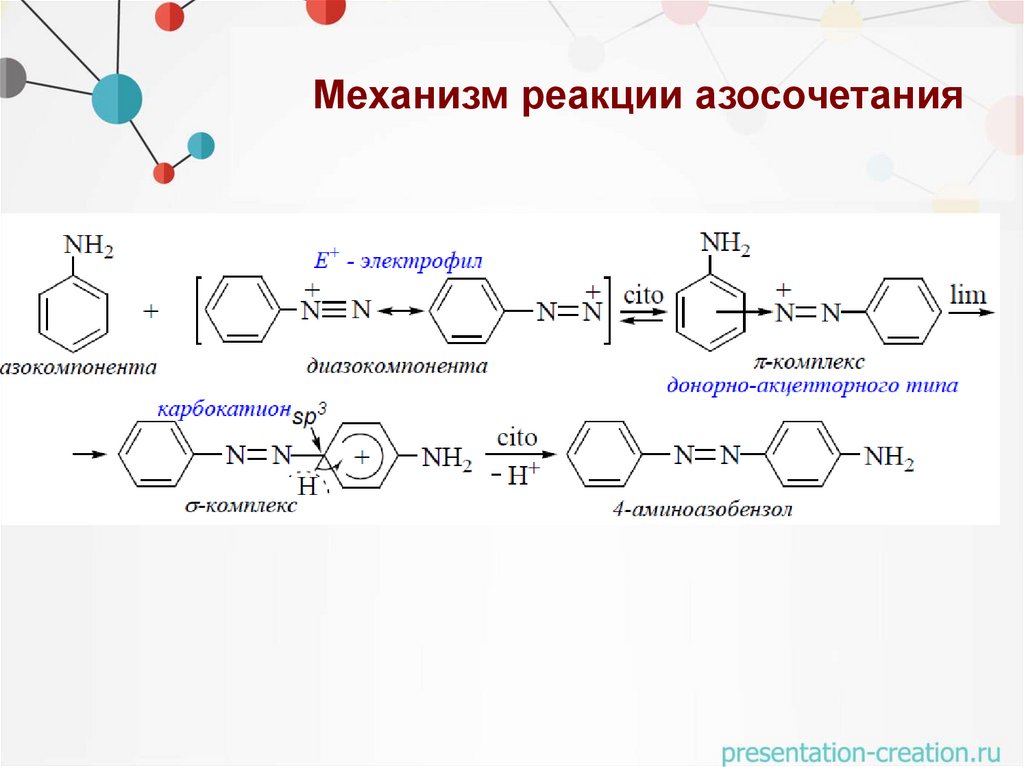
Механизм реакции азосочетания46.
Азотсодержащие органические соединения.Строение и реакционная способность
азосоединений.
47.
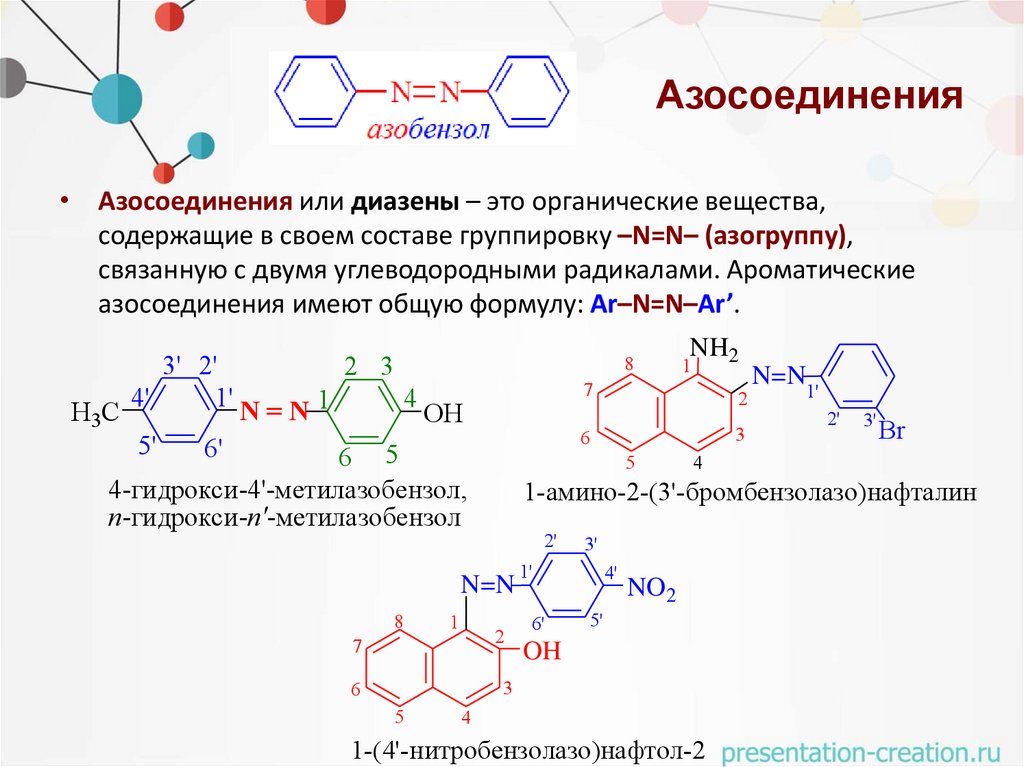
Азосоединения• Азосоединения или диазены – это органические вещества,
содержащие в своем составе группировку –N=N– (азогруппу),
связанную с двумя углеводородными радикалами. Ароматические
азосоединения имеют общую формулу: Ar–N=N–Ar’.
H3C
3' 2'
4'
1'
5'
2 3
8
4
N=N1
OH
6'
6 5
4-гидрокси-4'-метилазобензол,
п-гидрокси-п'-метилазобензол
1
2
6
3
N=N
1'
2'
3'
Br
4
1-аминo-2-(3'-бромбензолазо)нафталин
2'
7
2
6
3
5
7
5
N=N
8
NH2
1
3'
1'
6'
4'
NO2
5'
OH
4
1-(4'-нитробензолазо)нафтол-2
48.
Физические свойства азосоединений• Кристаллические вещества, окрашенные в
желтый, оранжевый, красный, синий и
другие цвета
• Часто применяются в качестве красителей и
индикаторов в аналитической химии
49.
Химические свойства азосоединений1
Основные свойства
1
Основные свойства
50.
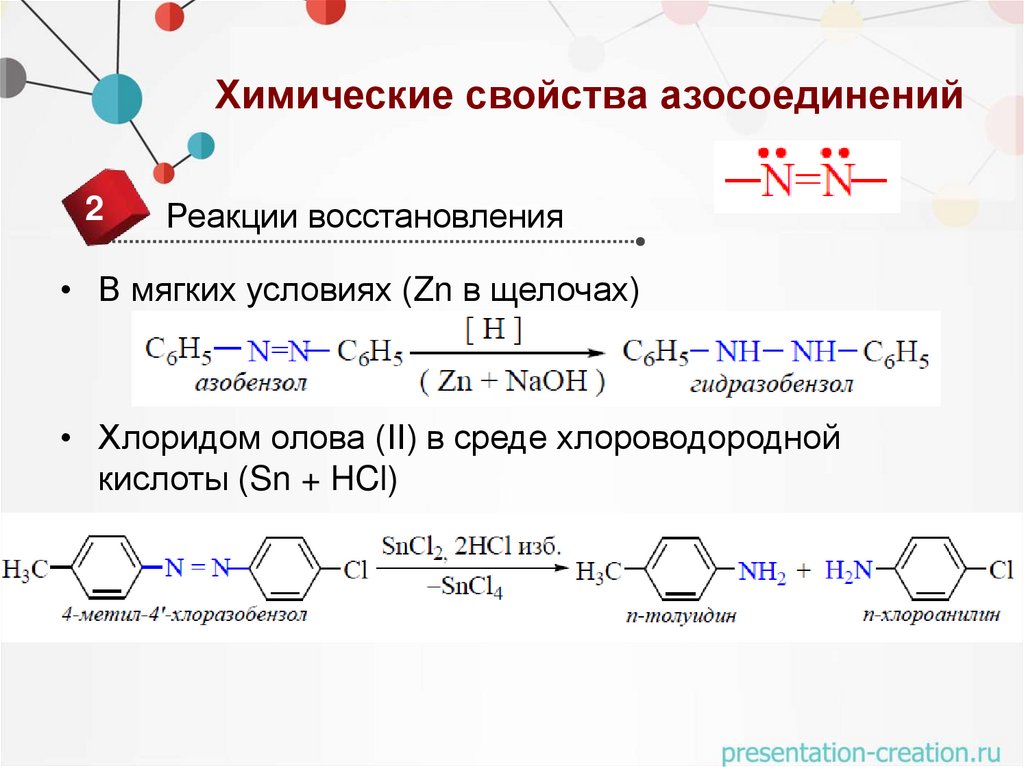
Химические свойства азосоединений2
Реакции восстановления
• В мягких условиях (Zn в щелочах)
• Хлоридом олова (II) в среде хлороводородной
кислоты (Sn + HCl)
51.
Теория цветности• До середины XIX века применяли красители
животного и растительного происхождения
• желтый – из коры граната, барбариса, шелухи
лука;
• красный – из корня марены;
• коричневый – из специальных сортов битума;
• зеленый – из сока растений и деревьев (бузина,
мерена, крапива);
• синий – индиго – получали из кустарника
индигофера красильная (семейство бобовые)
52.
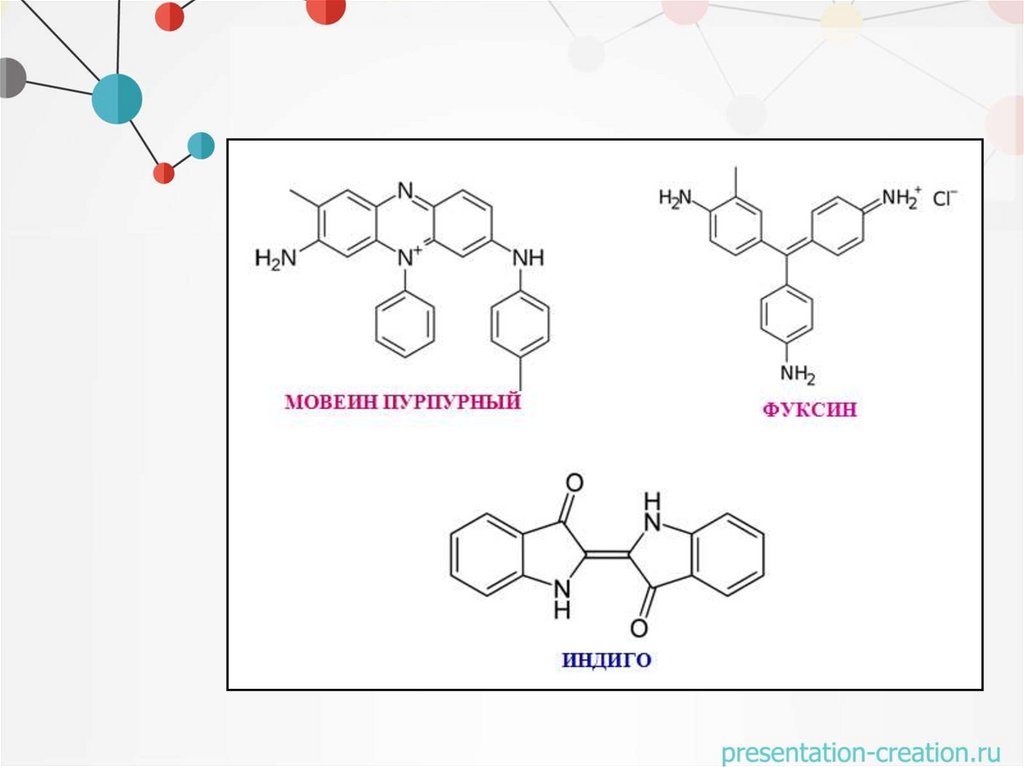
Синтетические красителиПервые синтетические красители на основе анилина
1856 г - мовеин пурпурный (английский химик Ульям Перкин)
1857 г – фуксин (польский химик Якуб Натансон)
1905 г – индиго (Иоганн Байер)
Ульям Перкин
1838 - 1907
Якуб Натансо́ н
(1832 – 1884)
Иоганн фон Ба́йер
(1935 - 1917)
Нобелевская премия 1905 года
53.
54.
Азокрасители• 1883 г – конго красный Полем Бёттигером
(Германия)
55.
Теория цветности• 1867 г хромофорно-ауксохромной теория
предложена немецким ученым О. Виттом.
• Причина окраски соединений – наличие протяженной
системы сопряжения; интенсивность цвета
обусловлена присутствием в молекуле определённых
групп атомов, называемых хромофорами и
ауксохромами
• Хромофоры (от греч. «хрома» - цвет и и «форос» носитель) – группы атомов, содержащие кратные
Отто Никалаус Витт
связи и обуславливающие окраску соединения
(1953 – 1915)
• Основные хромофоры: хиноидная группа, -N=O, -NO2,
-N=N-, -С=N-, -C=C-, -C=O
• Ауксохромны (от греческого «ауксео» - увеличиваю и
«хромос» - цвет) не являются окрашенными и не
вызывают появление окраски, но в присутствии
хромофора способствуют углублению окраски
• Ауксохромные группы: -OCH3, -NH2, -NR2, -SH, -OH, -Hal
(+М эффект)
56.
Теория цветности• 1915 г основы современной
электронной теории
цветности
Измаильский
Всеволод Александрович
(1885–1973)
57.
Теория цветности• Теория цветности возникла с развитием химии красителей
• Ощущение цвета возникает при воздействии на
зрительный нерв электромагнитных излучений с длиной
волны от 400 до 760 нм.
• При этом совместное действие электромагнитных
излучений во всём указанном интервале (называется
видимой частью спектра) вызывает ощущение белого
света
58.
Теория цветности• Для того, чтоб соединение было окрашено,
энергия возбуждения его молекулы (то есть
энергия перехода электронов между
уровнями) должна лежать в пределах
видимого спектра
• Е > 300 кДж/моль поглощение в УФ спектре
• Е < 158 кДж/моль поглощение в ИК спектре
59.
повышение цвета, гипсохромный сдвигуглубление цвета, батохромный сдвиг
Теория цветности
60.
61.
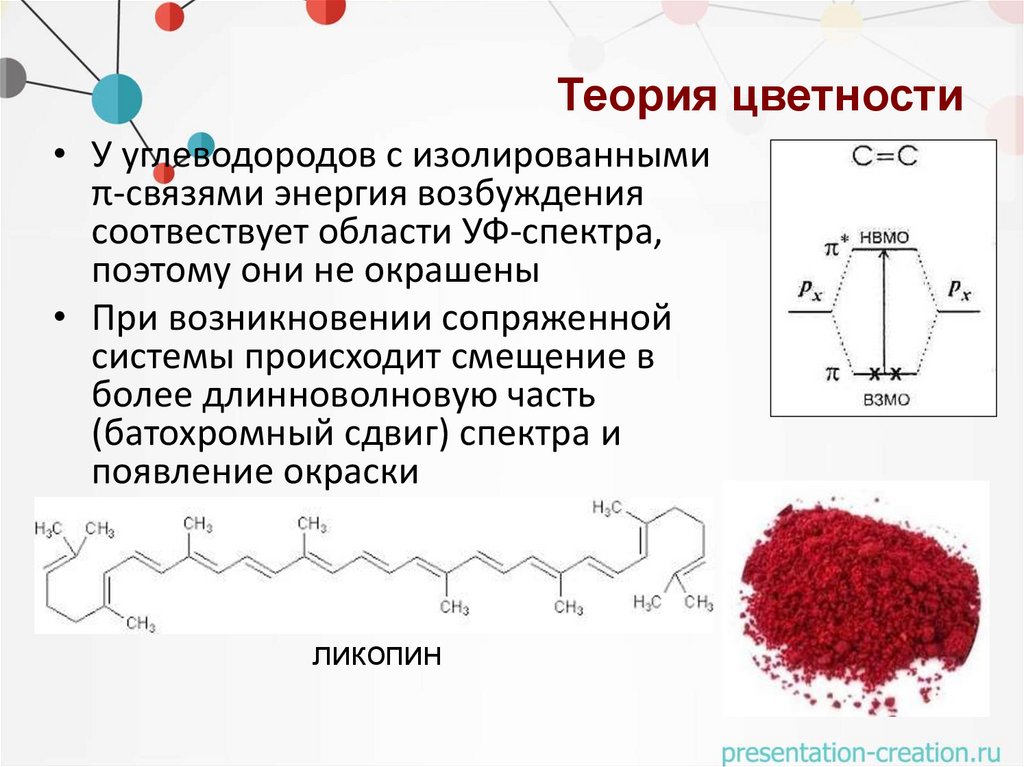
Теория цветности• У углеводородов с изолированными
π-связями энергия возбуждения
соотвествует области УФ-спектра,
поэтому они не окрашены
• При возникновении сопряженной
системы происходит смещение в
более длинноволновую часть
(батохромный сдвиг) спектра и
появление окраски
ликопин
62.
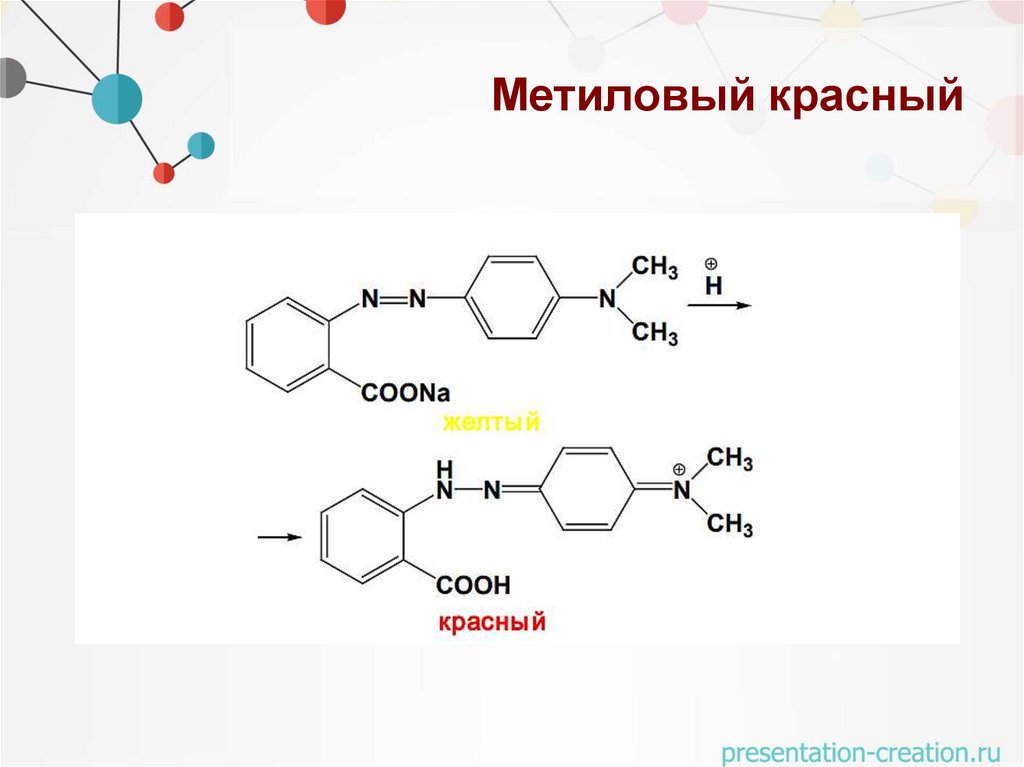
Метиловый красный• Синтетический анилиновый красител
• Интервал рН перехода 4,2 – 6,2
• красная → желтая
63.
Метиловый красный64.
Метиловый красный65.
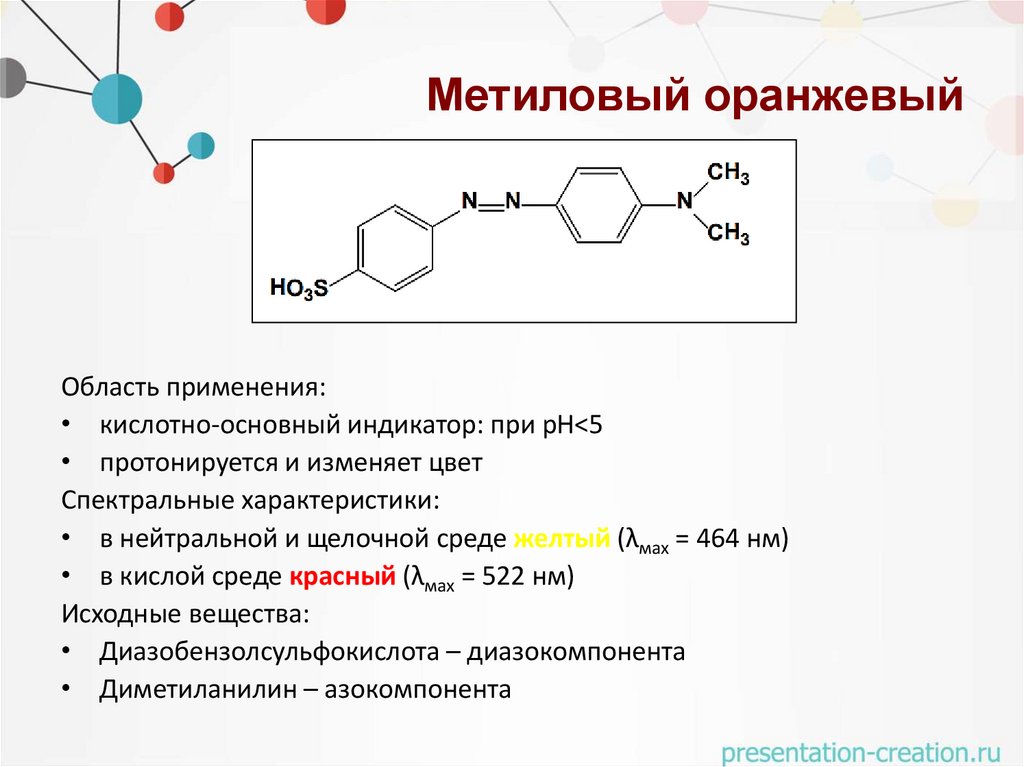
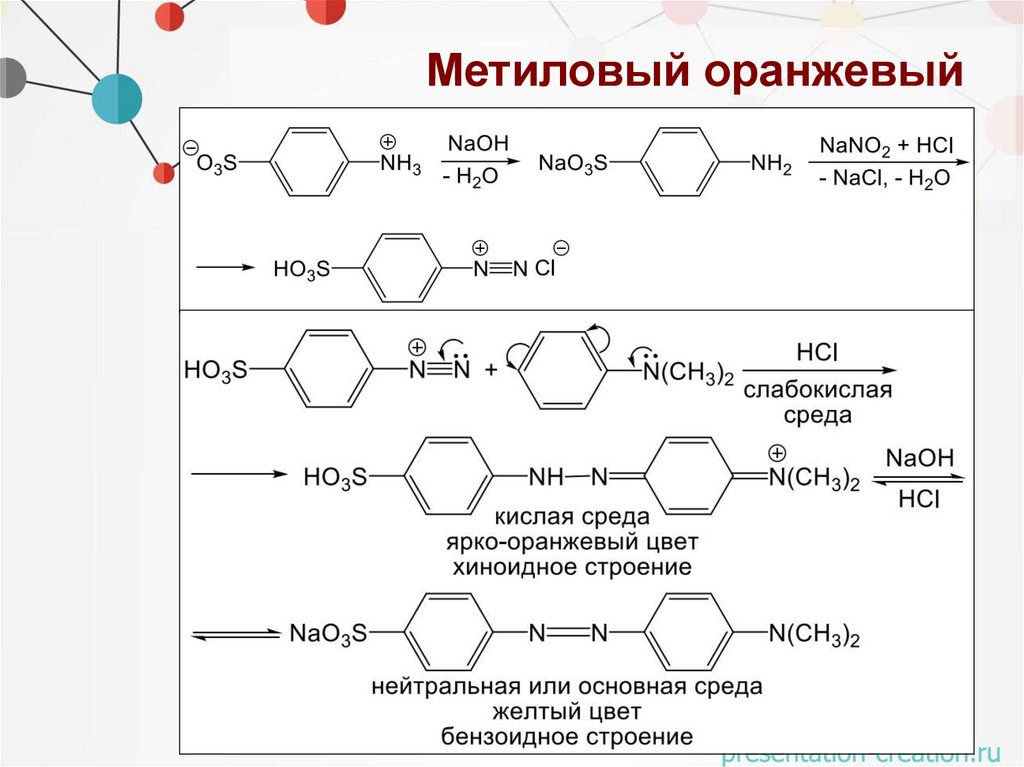
Метиловый оранжевыйОбласть применения:
• кислотно-основный индикатор: при рН<5
• протонируется и изменяет цвет
Спектральные характеристики:
• в нейтральной и щелочной среде желтый (λмах = 464 нм)
• в кислой среде красный (λмах = 522 нм)
Исходные вещества:
• Диазобензолсульфокислота – диазокомпонента
• Диметиланилин – азокомпонента
66.
Метиловый оранжевый67.
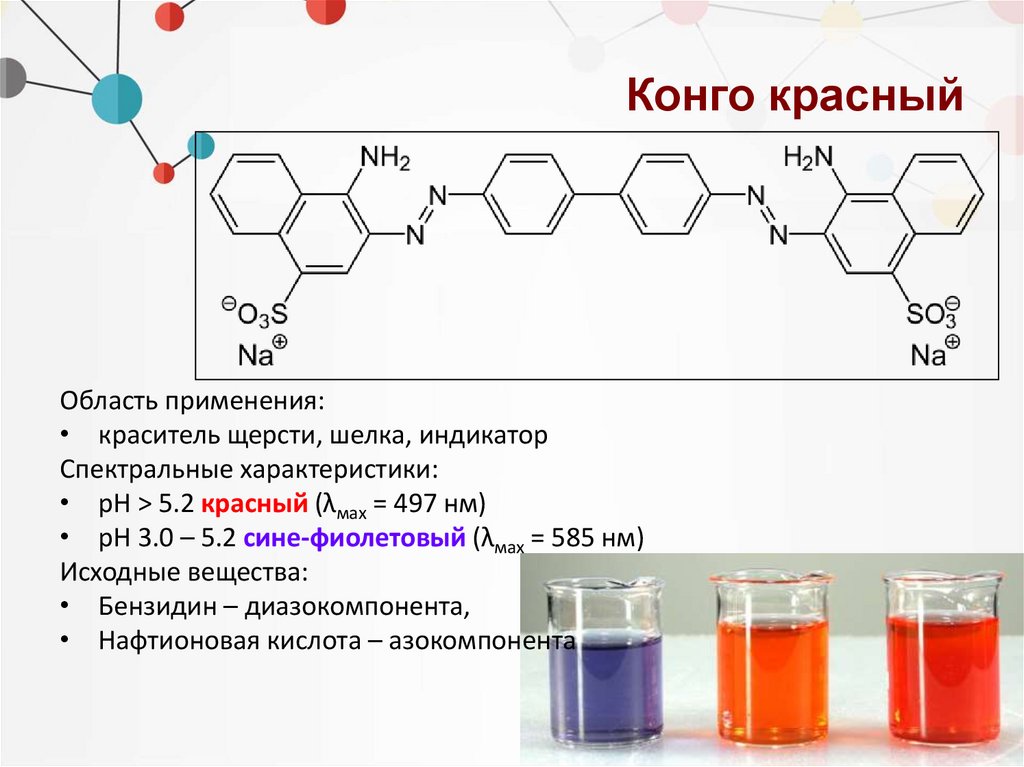
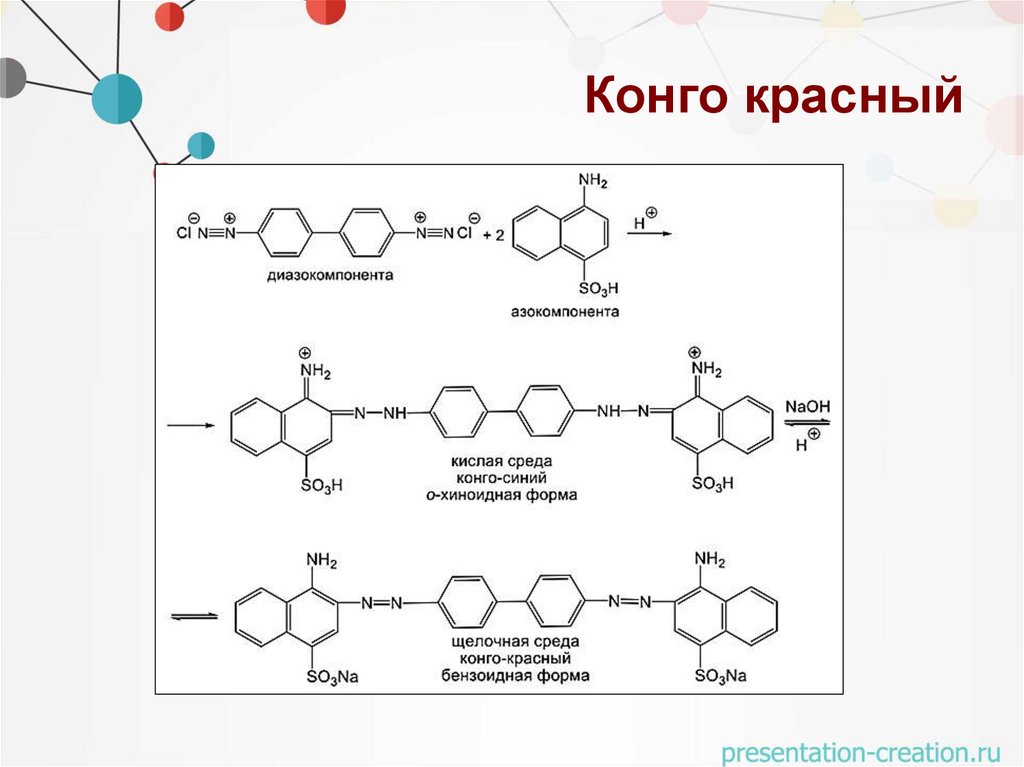
Конго красныйОбласть применения:
• краситель щерсти, шелка, индикатор
Спектральные характеристики:
• рН > 5.2 красный (λмах = 497 нм)
• рН 3.0 – 5.2 сине-фиолетовый (λмах = 585 нм)
Исходные вещества:
• Бензидин – диазокомпонента,
• Нафтионовая кислота – азокомпонента


























 chemistry
chemistry








