Similar presentations:
Азотсодержащие соединения: амины, диазо- и азосоединения. Аминокислоты, пептиды, белки
1.
Органическая химияАЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ: АМИНЫ,
ДИАЗО- И АЗОСОЕДИНЕНИЯ.
АМИНОКИСЛОТЫ, ПЕПТИДЫ, БЕЛКИ
М.В. Зыкова, зав. каф. химии, д-р фармацевт. наук
2.
Органическая химияАМИНЫ
М.В. Зыкова, зав. каф. химии, д-р фармацевт. наук
3.
АМИНЫ- это производные аммиака (NH3), в молекуле которого один, два
или три атома водорода (Н) замещены на углеводородные радикалы
(R).
Соответственно, по количеству R, связанных с аминогруппой,
различают:
Четвертичные
Третичные
Первичные Вторичные
аммониевые соли
амины
амины
амины
R4
R1 NH R2
R1 NH2
R1 N R2
+
R1 N R2 Cl
R3
R3
По строению R, связанного с аминогруппой, различают:
Алифатические
амины
H3C NH2
метиламин,
метанамин
Циклические
амины
NH2
Ароматические
амины
NH2
Смешанные амины
(жирноароматические)
NH-CH3
циклогексиламин,
циклогенсанамин
фениламин,
анилин
метилфениламин,
N-метиланилин
3
4.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОВВ молекулах аминов атом азота находится в низшей степени
окисления, поэтому многие способы получения аминов основаны на
процессах восстановлении азотсодержащих соединений других
классов.
1.
Восстановление нитро- и нитрозо- соединений:
а). Алифатических:
СH3 CH2 CH2 NO2 + 3H2
Ni, toC
СH3 CH2 CH2 NH2 + 2H2O
пропанамин-1
1-нитропропан
СH3 CH2 N O + 2H2
Ni, toC
СH3 CH2 NH2 + H 2O
нитрозоэтан
этанамин
б). Ароматических – реакция Зинина:
NO2
NH2
+ 2H2O
6H
Fe + HCl
нитробензол
анилин
4
5.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОВ2. Восстановление оксимов:
CH3-C=N-OH + 2 H2
CH3
Ni, toC
CH3-CH-NH2 + H2O
CH3
изопропиламин
оксим пропанона
3. Восстановление нитрилов и изонитрилов:
СH3 С
N + 2H 2
Ni,toC
этиламин
этанонитрил
СH3-CH 2
СH3 CH2
+
Ni,toC СH
N С + 2H 2
3 CH2
этанизонитрил
СH3
незамещенных
CH2
С
O LiAlH
пропанамид
CH3
С
LiAlH4
NH-CH3
N-метилэтанамид
NH-CH3
метилэтиламин
4. Восстановление
карбоновых кислот:
O
NH2
4
NH2
и
СH3 CH2 CH2
пропиламин
СH3 CH2 NH-CH3 + H2O ; CH3
метилэтиламин
замещённых
NH2 + H2O
O LiAlH
С
амидов
N-CH3
CH3
4
N,N-диметилэтанамид
СH3 CH2 N-CH3 + H2O
CH3
диметилэтиламин
5
6.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОВ5. Аммонолиз
Al2O3
СH3-СH2-NH2 + H2O
СH
-СH
-OH
+
NH
а) cпиртов:
3
2
3
toC
этанол
б) одноатомных фенолов:
этиламин
NH2
OH
(NH4)2SO3
анилин
фенол
в) многоатомных фенолов (реакция
Бухерера):
в
эту
реакцию
непосредственно фенол не вступает,
но вступают некоторые многоатомные
фенолы: резорцин и флороглюцин,
т.к.
мета-положение
облегчает
протекание реакции
в данную реакцию
также вступают
α- и β-нафтолы:
+ NH3
1600C
OH
OH
мета-аминофенол
NH2
резорцин
OH
+ 2 NH3
2000C
NH2
мета-фенилендиамин
OH
NaHSO3
+ NH3
0
нафтол
NH2
130-160 C
P=15 atm нафтиламин
NH2
+ H2O
6
7.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОВ6. Расщепление незамещенных амидов карбоновых кислот по
Гофману: происходит укорачивание углеродной цепи на один атом
O
СH3
CH2
С
пропанамид
+ KOBr
NH2
to
СH3 CH2
NH2 + CO2 + KBr
этиламин
7. Декарбоксилирование α-аминокислот: образуются биогенные
амины
O
CH2 CH С
+ Ba(OH)2
OH NH2 OH
серин
to
CH2 CH2 + BaCO3 + H2O
OH NH2
коламин
O
Ba(OH)2
CH2 CH2 CH2 CH2 + BaCO3 + H2O
CH2 CH2 CH2 CH С
o
t
OH
NH2
NH2 путресцин, NH2
NH2 орнитин
тетраметилендиамин,
бутандиамин-1,4
СH2 CH2 CH2 CH2
NH2
лизин
O Ba(OH)
2
CH С
CH2 CH2 CH2 CH2 CH2 + BaCO 3
o
t
OH
NH2 + H2O
кадаверин,
NH2
NH2
пентаметилендиамин,
пентандиамин-1,5
Коламин входит в состав фосфолипидов (кефалинов).
Путресцин и кадаверин – трупные яды (птомаины), образуются пр7и
гниении трупов.
8.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОВ8. Алкилирование аммиака и аминов по Гофману: получают смесь
первичных, вторичных и третичных аминов. В избытке аммиака будет
преобладать
первичный
амин,
если
взять
избыток
галогенопроизводного, то в смеси будут преобладать вторичные и
третичные амины
СH3
Сl + NH3
хлорметан
СH3
СH3
Сl + СH3 NH2
Сl + СH3 NH
CH3
СH3
+
NH3 Cl
NH3
хлорид
метиламмония
СH3 NH2
СH3 NH2 + NH4Cl
метиламин
+ NH3
СH3 NH СH3 + NH4Cl
СH3 Cl
диметиламин
хлорид диметиламмония
СH3
+
NH СH3 Cl
СH3
хлорид триметиламмония
NH3
СH3 N СH3 + NH4Cl
СH3
триметиламин
8
9.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОВ9. Взаимодействие ароматических галогенопроизводных с
аммиаком и аминами: при этом, если в орто- или пара- положение к
галогену в молекуле галогенопроизводного ввести электроноакцептор
(NO2, CN, COR), то реакция замещения галогена на аминогруппу
пойдет легче
Cl
NH2
200oC
+ 2NH4Cl
+ 2NH3
Сu , P
хлоробензол
Cl
+
анилин
NH2 200-250oC
NH
+ HCl
Сu , P
дифениламин
NH
I
+
иодобензол
дифениламин
250oC
Сu , P
N
+ HI
трифениламин
9
10.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОВ10. Из солей ароматических сульфокислот:
NH2
SO3H
+ NaOH
раствор
бензолсульфокислота
SO3Na
H2O
+ NaNH2
бензолсульфонат натрия
- Na2SO 3
анилин
10
11.
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОВМетиламин, диметиламин, триметиламин – бесцветные газы,
легко растворяются в воде, имеют запах селедочного рассола.
Амины состава С6–С15 – бесцветные жидкости с запахом
селедочного рассола.
Амины состава С16 и выше – бесцветные твердые вещества без
запаха.
Ароматические амины – это бесцветные жидкости или твердые
кристаллические вещества. Легко окисляются на воздухе, приобретая
желтоватую окраску, плохо растворимы в воде.
Растворимость аминов в воде уменьшается с увеличением длины
цепи.
Первичные и вторичные алифатические амины имеют более высокие
температуры кипения из–за образования ассоциатов (по сравнению с
третичными аминами, которые не образуют ассоциатов).
R
Ассоциаты образуются за счёт межмолекулярных
H
H
H
N
H
водородных связей: электроотрицательность атома
N
N
H
H
азота меньше чем атома кислорода, поэтому
R
R
первичные и вторичные амины образуют менее прочные ассоциаты,
чем спирты, следовательно, имеют более низкие температуры кипен11ия
и плавления.
12.
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОВцентр основности sp3 нуклеофильный центр
E+
H+
R
R N
R
o
108
В молекулах алифатических аминов атом азота находится в sp3гибридизации, углы связей С-N-C равны 108º. Химическое поведение
аминов обусловлено наличием на атоме азота неподеленной пары
электронов, за счёт которой возможно присоединение протона (Н+) от
кислоты. В этом случае амины проявляют основные свойства.
За счёт неподелённой пары электронов атома азота амины могут
взаимодействовать с электрофильными реагентами (Е+), имеющими
атом углерода с частичным или полным положительным зарядом. В
этом случае они проявляют нуклеофильные свойства.
Для ариламинов также еще характерны реакции электрофильного
замещения в бензольном кольце.
12
13.
I. ОСНОВНЫЕ СВОЙСТВА АМИНОВАлифатические амины гораздо более сильные основания, чем
ароматические, что объясняется p, -сопряжением NH2-группы с
кольцом, т.е. неподеленная пара электронов анилинов менее доступна
для присоединения протона.
Основность алифатических аминов уменьшается в ряду:
вторичные > третичные > первичные
R
R NH R > R N
> R NH2
R
А
основность
ароматических
аминов
уменьшается
в
противоположном направлении. Вследствие электроноакцепторных
свойств трёх бензольных колец, трифениламин практически не
обладает основными свойствами:
NH2
N
>
анилин
рКВН+ 4,6
N
H
дифениламин
0,8
>
трифениламин
13
14.
I. ОСНОВНЫЕ СВОЙСТВА АМИНОВОсновные свойства аминов можно доказать образованием солей с
+
+
кислотами:
СH3 CH2 NH2 + HCl
этиламин
СH3 NH CH2 СH3
СH3 CH2 NH3 Cl
хлорид этиламмония
+
+ HBr
метилэтиламин
СH3
+
NH2 CH2 СH3 Br
бромид метилэтиламмония
Если на соль амина подействовать сильным основанием, то амин можно
выделить в чистом виде. Эту реакцию используют для очистки аминов:
СH3 CH2
+
NH3 Cl
СH3 CH2 NH2 + NaCl + H2O
+ NaOH
этиламин
хлорид этиламмония
Водные растворы аминов имеют щелочную реакцию среды:
СH3 CH2 NH2 + H2O
этиламин
СH3 CH2
+
NH3 OH
гидроксид этиламмония
Анилин, как слабое основание, образует соли только с сильными кислотами:
NH2
NH3+Cl
+ HCl
анилин
хлорид фениламмония
14
15.
II. НУКЛЕОФИЛЬНЫЕ СВОЙСТВА АМИНОВ1.Алкилирование: вступают все амины (первичные, вторичные,
третичные). Алкилирование ароматических аминов протекает труднее,
чем алифатических:
СH3 CH2 CH2
пропиламин
СH3 CH2 CH2
I
СH3 CH2 CH2
+
NH2 СH3 I
иодид метилпропиламмония
+
NH2 СH3 I + NaOH
NH2
+ CH3 I
анилин
NH2 + СH3
СH3 CH2 CH2 NH СH3 + NaI +H2O
метилпропиламин
NH CH3
N
+ CH3 I
HI
N-метиланилин
CH3
СH3
HI
N,N-диметиланилин
15
16.
II. НУКЛЕОФИЛЬНЫЕ СВОЙСТВА АМИНОВ2. Ацилирование: вступают только первичные и вторичные амины:
O
СH3 CH2 NH2 +
этиламин
СH3 С
СH3
O
С
СH3 CH2 NH C
N-этилацетамид O
СH3 + CH3COOH
СH3 CH2 NH C
O
СH3 + HCl
O
уксусный ангидрид
O
СH3 CH2 NH2 + СH3 С
ацетилхлорид Сl
N-ацильные производные анилина и его гомологов называют
анилидами. Ацетанилид под названием антифебрин применялся в
медицине как жаропонижающее средство.
NH2
+ CH3
анилин
С
O
NH C CH3
+ HCl
O
Сl
ацетанилид
Амиды карбоновых кислот гидролизуются в кислой или щелочной
среде с образованием исходного амина и карбоновой кислоты или её
соли:
NH2
NH C CH3
+
O
ацетанилид
+ H2O
H
toC
+ CH3COOH
анилин
16
17.
II. НУКЛЕОФИЛЬНЫЕ СВОЙСТВА АМИНОВNH C CH3
+ H2O
O
ацетанилид
NH2
H+
toC
+ CH3COOH
анилин
На этом свойстве амидов основано применение реакции
ацилирования для временной защиты аминогруппы от окисления и
протекания по ней других реакций, если они нежелательны. Когда
защита аминогруппы не нужна, ее можно снять с помощью реакции
гидролиза в кислой или щелочной среде.
В N–ацильных производных ароматических
NH C CH3
аминов неподелённая пара электронов атома
O
азота находится в сопряжении не только
с π–электронной системой бензольного ядра, но и с π–электронами
двойной связи карбонильной группы >С=О, что приводит к
значительному снижению её электронодонорных свойств по
отношению к бензольному кольцу в сравнении с аминами.
Ацилированная аминогруппа – заместитель I рода, орто – и пара –
ориетант с гораздо менее сильным ориентирующим влиянием, чем у
аминогруппы. Больше пара- ориентант.
17
18.
III. РЕАКЦИИ С АЗОТИСТОЙ КИСЛОТОЙАмины разных типов с азотистой кислотой реагируют неодинаково.
По этой реакции можно различать первичные, вторичные и
третичные алифатические и ароматические амины.
1. Первичные алифатические амины: образуют спирты и
выделяется
молекула
азота.
Образующиеся
в
качестве
промежуточных продуктов соли алкилдиазония неустойчивы и
разлагаются водой с выделением азота и образованием спиртов.
C2H5
NH2 + HONO
этиламин
HCl
C2H5
N
+
N Сl
H 2O
C2H5OH + N2 + HCl
этанол
2H2O этандиазоний хлорид
2. Первичные ароматические амины с азотистой кислотой при
низкой температуре в присутствии сильной минеральной кислоты
образуются соли диазония. Эта реакция получила название реакции
диазотирования.
+
N
NH2
+ HNO2
анилин
HCl
0-5oC
N
Cl
хлорид бензолдиазония
+ 2H2O
18
19.
III. РЕАКЦИИ С АЗОТИСТОЙ КИСЛОТОЙ3.
Вторичные
алифатические,
ароматические
и
жирноароматические амины с азотистой кислотой образуют Nнитрозамины:
СH3 CH2
СH3 CH2
NH + HONO
СH3 CH2
СH3 CH2
диэтиламин
NH
N N O + H2O
N-нитрозодиэтиламин
+ HO
N
O
N
N
дифениламин
+ H 2O
O
N-нитрозодифениламин
NH CH3
+ HO
N
O
N CH3
N
+ H 2O
метилфениламин
O
N-метил-N-нитрозоанилин
Нитрозамины – желтые или оранжевые маслянистые жидкости,
19
обладающие канцерогенным действием.
20.
III. РЕАКЦИИ С АЗОТИСТОЙ КИСЛОТОЙ4.Третичные амины жирного ряда
азотистой кислотой не взаимодействуют.
в
обычных
условиях
с
5.Третичные жирно-ароматические амины под действием азотистой
кислоты вступают в реакцию нитрозирования в пара-положение
бензольного кольца, а если оно занято, то нитрозогруппа встает в
орто-положение:
CH3
CH3
N CH
3
N CH
3
+ HO
H
N,N-диметиланилин
N
+ H2O
O
N
O
4-нитрозо-N,N-диметиланилин
20
21.
IV. ОБРАЗОВАНИЕ ИЗОНИТРИЛОВЭто реакция характерна только для первичных аминов. При
нагревании первичных алкил- или ариламинов с хлороформом в
присутствии щелочей (NaOH, KOH) в спиртовой среде образуются
изонитрилы
(изоцианиды),
обладающие
очень
сильным
неприятным запахом. На этом свойстве основано использование
изонитрильной
реакции
для
качественного
обнаружения
первичных аминов:
C2H5OH C H +
2 5 N С + 3NaCl + 3H2O
o
t
этанизонитрил
этиламин
+
NH2
N С
C2H5OH
+ 3NaCl + 3H2O
+ СHCl3 + 3NaOH
o
t
C2H5 NH2 + СHCl3 + 3NaOH
анилин
фенилизоцианид
21
22.
V. ВЗАИМОДЕЙСТВИЕ АНИЛИНОВ САРОМАТИЧЕСКИМИ АЛЬДЕГИДАМИ:
ОБРАЗОВАНИЕ ОСНОВАНИЙ ШИФФА
В отличие от алкиламинов первичные ароматические амины
взаимодействуют при нагревании с ароматическими альдегидами,
образуя азометины:
O
NH2
C
H
N
CH
+ H2O
+
анилин
бензальдегид
N-бензилиденанилин
(основание Шиффа)
22
23.
VI. РЕАКЦИИ ЗАМЕЩЕНИЯ ВБЕНЗОЛЬНОМ КОЛЬЦЕ АНИЛИНА (SE)
Для ароматических аминов характерны реакции электрофильного
замещения (SE) по ароматическому кольцу. Аминогруппа является
сильным электронодонором и поэтому активизирует реакционную
способность бензольного кольца. Анилины вступают в реакции SE
значительно легче, чем бензол.
1. Реакции галогенирования. Анилин легко вступает в реакцию с
галогенами (Cl2, Br2) без катализатора с образованием 2,4,6–
тригалогенопроизводных. При взаимодействии анилина с бромной
водой практически с количественным выходом образуется осадок
белого цвета – 2,4,6 –трибромоанилин. Это качественная реакция
на ароматические свойства анилина:
NH2
NH2
+ 3Br2
H2O
Br
Br
+ 3HBr
Br
2,4,6-триброманилин
23
24.
VI. РЕАКЦИИ ЗАМЕЩЕНИЯ ВБЕНЗОЛЬНОМ КОЛЬЦЕ АНИЛИНА (SE)
Хлор в водных растворах окисляет анилин, поэтому хлорирование с
образованием 2,4,6–трихлороанилина осуществляют действием хлора
в неводных растворителях, например, в четырёххлористом
углероде.
Для того, чтобы получить моногалогенозамещенные анилины,
предварительно защищают аминогруппу реакцией ацилирования,
затем проводят реакцию галогенирования и снимают защиту.
Например:
NH C
NH2
(СН3СO)2O
O
CH3COOH
анилин
ацетанилид
CH3
Br2
HBr
NH C CH3
O
H2O, H+
NH2
CH3COOH
Br
п-бромоацетанилид
Br
п-броманилин
24
25.
VI. РЕАКЦИИ ЗАМЕЩЕНИЯ ВБЕНЗОЛЬНОМ КОЛЬЦЕ АНИЛИНА (SE)
Поскольку бензольное кольцо сильно активировано по отношению к
электрофильной атаке, то возможно его прямое иодирование.
Анилин иодируется в пара-положение, а выделяющийся иодоводород
связывается добавлением соды:
NH2
NH2
+ I2
NaHCO3
+ NaI + CO2 + H2O
I 4-иоданилин
2.Реакции нитрования. Прямое нитрование анилина азотной
кислотой (нитрующей смесью) сопровождается его окислением и не
применяется в синтезе нитросоединений. Поэтому, для получения
орто- и пара- производных нитрованию подвергают ацилированные
амины (реакция такая же как хлорирование).
3. Реакции алкилирования и ацилирования по Фриделю-Крафтсу
протекают аналогичным образом (реакция такая же как
25
хлорирование).
26.
VI. РЕАКЦИИ ЗАМЕЩЕНИЯ ВБЕНЗОЛЬНОМ КОЛЬЦЕ АНИЛИНА (SE)
4. Реакции сульфирования. Анилин при длительном нагревании
(180-200ºС) с серной кислотой превращается в сульфаниловую
кислоту:
NH2
NH2
+ H2SO4
180-200oC
- H 2O
SO3H
сульфаниловая кислота
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ АМИНОВ:
Метиламины, этиламины, тетраметилендиамин, пентаметилендиамин,
анилин, фенамин, орто-фенилендиамин
26
27.
Органическая химияДИАЗОСОЕДИНЕНИЯ
М.В. Зыкова, зав. каф. химии, д-р фармацевт. наук
28.
ДИАЗОСОЕДИНЕНИЯ– это органические вещества с общей формулой класса RN2X,
содержащие в молекуле группировку из двух атомов азота (–N 2 –),
связанную с углеводородным радикалом (R) и остатком минеральной
кислоты (X).
В зависимости от природы R различают алифатические и
ароматические диазосоединения:
Алифатические диазосоединения неустойчивы и не имеют
широкого практического применения.
Диазосоединения ароматического ряда – это ароматические
соединения, имеющие общую формулу: ArN2X.
Строение диазосоединений существенно зависит от природы
кислотного остатка - частицы Х (аниона Х).
Поэтому, связь между ArN2 и X может быть
+
Ионной, если Х – остаток сильной минеральной кислоты
либо
соли диазония
Ковалентной, если Х – остаток слабой минеральной
кислоты
либо
N N X
N N O-Me+
диазотаты
N N
X
28
29.
ДИАЗОСОЕДИНЕНИЯВ кислой среде (рН<7) диазосоединения существуют в форме
устойчивых солей диазония, в среде, близкой к нейтральной
(рН=7), диазосоединения имеют ковалентное строение амфотерных
диазогидроксидов (диазогидратов), а в щелочной среде (рН>7)
диазосоединения находятся в форме диазотатов.
Например:
+
N N Cl
соли диазония
(pH < 7 )
NaOH
N N
HCl
OH
диазогидроксиды
( pH ~ 7 )
NaOH
N N
HCl
O-Na+
диазотаты натрия
( pH > 7 )
NH N O
N-нитрозамины
Стр. 56
29
30.
СПОСОБЫ ПОЛУЧЕНИЯ СОЛЕЙ ДИАЗОНИЯРеакция диазотирования открыта в 1858г немецким химиком П.
Гриссом.
Реакция основана на взаимодействии первичных ароматических
аминов (анилинов) с азотистой кислотой в среде сильной
минеральной кислоты, чаще HCl или H2SO4.
Соли диазония при нагревании неустойчивы и легко разлагаются,
поэтому диазотирование проводят при низкой температуре (0–5ºС).
Анилин обрабатывают раствором соли азотистой кислоты (NaNO2,
KNO2), причем на 1 моль амина используют не менее 2,5 молей
минеральной кислоты. Один моль минеральной кислоты расходуется
на образование азотистой кислоты, один – на получение соли
диазония, а избыток кислоты необходим для создания кислой среды
(кислотный катализ).
+
o
NH2 + NaNO2 + 2HCl 0 5 C
анилин
N
N Cl + NaCl + 2H 2O
бензолдиазоний хлорид
30
31.
МЕХАНИЗМ РЕАКЦИИ ДИАЗОТИРОВАНИЯПри взаимодействии NaNO2 c минеральной кислотой получается
азотистая кислота, которая в кислой среде образует активный
диазотирующий агент – нитрозоний катион +N=O.
Затем, под действием
+N=O протекает реакция
диазотирования:
NaNO2 + HCl
HO-N=O + NaCl
+
+
H O N O
NO + H2O
катион нитрозония
H
1 мол-ла
H O N O + H+
kat (0,5)
протонированная азотистая кислота
+
NH2 + NO
H
+
N N
H
H
O
таутомерия
H+
возвр. kat
+
+ Cl
N N O-H
H
N N O
N-нитрозоанилин
+
N
N Cl
2 мол-ла
N N OH
H+Cl
- Cl
диазогидроксид
+ H2O
соль диазония
Сначала +N=O атакует атом азота анилина с образованием N–
нитрозоамина, который в кислой среде легко переходит в свою
таутомерную форму – диазогидроксид. Затем диазогидроксид в кислой
среде превращается в соль диазония.
В результате реакции получаются водные растворы солей диазония,
которые используют для дальнейших реакций.
Применение солей диазония в кристаллическом виде ограничено из3–1за
их взрывоопасности.
32.
ФИЗИЧЕСКИЕ СВОЙСТВА СОЛЕЙДИАЗОНИЯ
Соли
диазония
–
бесцветные
кристаллические
вещества,
легко
растворимые в воде, водные растворы
имеют нейтральную реакцию.
Соли диазония неустойчивы, при
нагревании
и
механических
воздействиях разлагаются со взрывом.
Поэтому реакции осуществляются при
охлаждении
и
используются
их
свежеполученные водные растворы.
32
33.
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙДИАЗОНИЯ
0,140 нм
Реакционная способность солей
диазония обусловлена наличием
в их структуре диазокатиона:
+
N
N
0,110 нм
+
N
N
sp-гибридизация
Атомы азота в диазокатионе расположены линейно в плоскости
бензольного кольца.
Связь между атомами азота по длине соответствует тройной связи
(0,110нм). Это свидетельствует о том, что оба атома азота
находятся в состоянии sp–гибридизации.
Один атом азота имеет положительный заряд, а второй –
неподеленную пару электронов. Положительный заряд катиона
делокализован, в основном, между атомами азота и лишь частично
за счет -электронной плотности бензольного кольца, поэтому они
более устойчивы, чем алифатические.
Реакции с участием солей диазония можно условно разделить на
две группы: с выделением азота и без выделения азота.
33
34.
I. РЕАКЦИИ СОЛЕЙ ДИАЗОНИЯ СВЫДЕЛЕНИЕМ АЗОТА
- это реакции замещения диазогруппы (– N2– ) на другие атомы и
группы.
Протекают по двум механизмам – SR или SN1.
Данные реакции имеют важное значение в органическом синтезе,
т.к. позволяют ввести в ароматическое ядро многие заместители,
введение которых иными способами невозможно.
Кроме того, можно получать ароматические соединения с таким
взаимным расположением функциональных групп, которого нельзя
достичь реакциями SЕ.
1. Замещение диазогруппы на гидроксильную группу. Образуются
фенолы. Для этого водные растворы диазосоединений нагревают.
Реакцию можно проводить с растворами любых солей, но лучше
использовать гидросульфаты (чтобы не было побочных продуктов).
Реакция SN1:
N
+
toC
N HSO4 + H2O
бензолдиазоний гидросульфат
OH + N2 +H2SO4
фенол
34
35.
I. РЕАКЦИИ СОЛЕЙ ДИАЗОНИЯ СВЫДЕЛЕНИЕМ АЗОТА
2. Замещение диазогруппы на атом иода. При добавлении к
растворам солей диазония иодида натрия или калия, диазогруппа
замещается на атом иода. Реакция SN1:
N
+
N HSO4 + KI
to
I + N2 + K2SO4
иодобензол
бензолдиазоний гидросульфат
3. Замещение диазогруппы на атом фтора. При нагревании сухих
борофторидов солей диазония образуются арилфториды – реакция
Шимана – это один из лучших способов введения фтора в
ароматическое кольцо. Реакция SN1:
N
+
N BF4
бензолдиазоний борофторид
to
F + N2 + BF3
фторбензол
35
36.
I. РЕАКЦИИ СОЛЕЙ ДИАЗОНИЯ СВЫДЕЛЕНИЕМ АЗОТА
4. Замещение диазогруппы, катализируемое солями меди (I) реакции Зандмейера. При каталитическом действии солями меди (I)
диазогруппу можно заместить на атомы хлора, брома, нитрогруппу,
цианогруппу. Реакция SR.
CuCl
to
N
+
N Cl
бензолдиазоний
хлорид
CuBr , KBr
to
CuCN, KCN
to
CuNO2
NaNO2 , to
Сl + N 2
хлорбензол
Br + N2 + КСl
бромбензол
CN + N 2 + КСl
бензонитрил
NO2 + N2 + NaСl
нитробензол
36
37.
I. РЕАКЦИИ СОЛЕЙ ДИАЗОНИЯ СВЫДЕЛЕНИЕМ АЗОТА
5. Замещение диазогруппы на атом водорода. При нагревании
солей диазония с восстанавливающими реагентами (H3PO2, СН3ОН,
С2Н5ОН), диазогруппа замещается на атом Н. В результате соль
диазония превращается в ароматический углеводород. Реакция SR.
N
+
N Cl
+ H3PO2 + H2O
to
+ N2 + HСl + H 3PO 3
При использовании в качестве восстановителя спиртов наряду с
восстановлением соли диазония параллельно по ионному
механизму протекает побочная реакция с образованием простых
алкилариловых эфиров. Количество побочных продуктов зависит от
строения исходной соли диазония:
+
N
N Cl
X
бензолдиазоний
хлорид
O
to
SR
+ C2H5OH
ОВР
to
SN1
+ N2 + HСl + CH3 C
бензол
X (ЭА)
этаналь
OC2H5 + N2 + HСl
X(ЭД, Н)
этоксибензол
H
37
38.
I. РЕАКЦИИ СОЛЕЙ ДИАЗОНИЯ СВЫДЕЛЕНИЕМ АЗОТА
а). Если в бензольном кольце имеются ЭА-заместители (NO2, COOH,
SO3H),
то
практически
полностью
преобладает
реакция
восстановления (без побочных продуктов), которая протекает по
радикальному механизму - SR.
б). Если в бензольном кольце нет заместителей или имеются ЭДзаместители (OH, -NH2, (-NH-, -N<, Alk-, -OR), то в значительной
степени происходит замещение диазогруппы по ионному механизму
на алкокси-группу – реакция SN1.
N
+
N Cl
O
+ C2H5OH
to
ОВР
NO2
NO2 + N2 + HСl + CH3
SR
C
этаналь
бензол
H
2-нитробензолдиазоний хлорид
N
CH3
+
N Cl + C2H5OH
2-метилбензолдиазоний хлорид
to
SN1
OC2H5 + N2 + HСl
CH3
2-этокситолуол
38
39.
I. РЕАКЦИИ СОЛЕЙ ДИАЗОНИЯ СВЫДЕЛЕНИЕМ АЗОТА
Реакция замещения диазогруппы на атом водорода применяется в
органическом синтезе как метод удаления аминогруппы из
ароматического ядра после ее использования для необходимой
ориентации замещения.
Например, такое соединение, как 1,3,5–трибромбензол, невозможно
получить прямым бромированием бензола.
NH2
NH2
+ 3 Br2
вода
Br
SE
Br
+ NaNO2 + 2HCl
3HBr
анилин
р. Грисса
Br
0-5OC
NaCl
- 2H2O
2,4,6-триброманилин
Br
+
N
N
Br
Br
2,4,6-трибромобензолдиазонийхлорид
+ H3PO2 + H2O
Br
N
Br
Cl
Br
2,4,6-трибромобензолдиазонийхлорид
SR
Cl
+
N
tO C
Br
Br
+ N2 + H3PO3 + HCl
Br
1,3,5-трибромобензол
39
40.
II. РЕАКЦИИ СОЛЕЙ ДИАЗОНИЯ БЕЗВЫДЕЛЕНИЕМ АЗОТА
1. Восстановление солей диазония. Проводят в мягких условиях при
действии на соли диазония цинковой пыли в уксусной кислоте или
хлорида олова (II) в хлороводородной кислоте, в результате
образуются арилгидразины:
+
N
N Cl
2SnCl2 + 4HCl
H
бензолдиазоний хлорид
NH-NH2 HCl + 2SnCl4
фенилгидразина гидрохлорид
При получении 2,4-динитрофенилгидразина используют в
качестве восстановителя сульфит натрия, который не затрагивает
нитрогруппы:
O2N
NO2
+
N
N Cl
Na2SO 3
2,4-динитробензолдиазоний хлорид
H
NO2
O2N
NH-NH2
2,4-динитрофенилгидразин
40
41.
II. РЕАКЦИИ СОЛЕЙ ДИАЗОНИЯ БЕЗВЫДЕЛЕНИЕМ АЗОТА
2. Реакция азосочетания – образования азосоединений Ar–N=N–Ar:
По механизму это реакция SE в ароматическом ряду.
атом углерода в
sp3-гибридизации
H
+ Е
+ быстро
Е
комплекс
+ медленно
+
E
комплекс
E
быстро
H+
Атакующий реагент
(Е+) - диазокатион
(катион
бензолдиазония).
продукт
Реакция азосочетания может протекать только между солью диазония и
ароматическим соединением с сильной ЭД-группой (ОН, NH2, NHR,
NR2), т.к. диазокатион – слабый электрофил.
ЭД заместители за счёт +М–эффекта увеличивают электронную
плотность в бензольном ядре и активируют его в реакциях SE.
Реакция азосочетания протекает в пара–положение к ЭД-группе, и только
если пара–положение занято, то в орто–положение.
Соль диазония в реакции азосочетания называют диазосоставляющей
(диазокомпонента), а фенол или анилин –
азосоставляющей
(азокомпонента).
Если в диазосоединении в орто– или пара– положении к диазогруппе
находится ЭА (NO2, SO3H, COOH), то реакционная способнос41ть
диазокатиона повышается.
42.
II. РЕАКЦИИ СОЛЕЙ ДИАЗОНИЯ БЕЗВЫДЕЛЕНИЕМ АЗОТА
Большое влияние на протекание реакции азосочетания оказывает рН
среды:
а). Реакцию с фенолами проводят в слабощелочной среде (рН=8-10),
OH
где они превращаются в более
реакционные феноляты,
H+
т.к. в феноксид-анионе группа –О– проявляет +I, +М, и следовательно,
является более сильным ЭД и активатором бензольного кольца,
чем группа –ОН.
Сильнощелочная среда недопустима, т.к. в этих условиях соль
диазония превращается в диазогидроксид, который не вступает в
реакцию азосочетания.
При более низких рН концентрация ионизированных молекул мала
и соответственно скорость реакции низкая.
OH
+
N
N Cl +
бензолдиазоний хлорид
O
+I
+M
OH
H
фенол
OH
0 5oC
OH + HCl
N N
4-гидроксиазобензол
42
43.
II. РЕАКЦИИ СОЛЕЙ ДИАЗОНИЯ БЕЗВЫДЕЛЕНИЕМ АЗОТА
В молекуле – β-нафтола (нафтола-2) реакция азосочетания пойдет в
α-положение
H
N=N
+
N
N Cl
OH
+
OH
OH0 5oC
нафтол-2
+ HCl
1-бензолазонафтол-2
б). Реакцию с ароматическими аминами - анилинами проводят в
слабокислой среде (рН 5–7).
В сильнокислой среде реакция не идет, т.к. аминогруппа
превращается в аммонийную, которая обладает только –I-эффектом,
является сильным ЭА и дезактивирует бензольное кольцо в
реакциях SE:
H+
NH3+
-I, ЭА
NH2
-I, +M OH
H3C N CH3
+
N
N Cl
H+
0 5oC
+
H
N,N-диметиланилин
N N
N
CH3
CH3
4-N,N-диметиламиноазобензол
+ HCl
43
44.
II. МЕХАНИЗМ РЕАКЦИИ АЗОСОЧЕТАНИЯКатион диазония является электрофильным реагентом, он атакует
атом углерода с наибольшей электронной плотностью в бензольном
кольце ароматического амина или фенола, образуя σ–комплекс,
который отщепляет протон и превращается в азосоединение:
NH2
NH2
E+ - электрофил
+
N
+
карбокатионsp3
N N
-комплекс
+
H
NH2
lim
-комплекс
донорно-акцепторного типа
диазокомпонента
азокомпонента
+
N N
+ cito
N N
N
cito
H+
N N
NH2
4-аминоазобензол
Все азосоединения являются окрашенными веществами, поэтому
реакция
азосочетания
широко
применяется
в
фармацевтическом
анализе
для
подтверждения
подлинности лекарственных препаратов, содержащих в своем
составе ароматическую аминогруппу или фенольный
44
гидроксил.
45.
Органическая химияАЗОСОЕДИНЕНИЯ
М.В. Зыкова, зав. каф. химии, д-р фармацевт. наук
46.
АЗОСОЕДИНЕНИЯ (ДИАЗЕНЫ)– это органические вещества, содержащие в своем составе
группировку –N=N– (азогруппу), связанную с двумя углеводородными
радикалами: R–N=N–R’
N N
азобензол
ПОЛУЧЕНИЕ АЗОСОЕДИНЕНИЙ –
РЕАКЦИЯ АЗОСОЧЕТАНИЯ
- наиболее важный промышленный способ получения азосоединений
Cl
+
N
SH
N Cl + H
о хлоробензолдиазоний хлорид
OH
OH
0 5oC
Cl
SH
N N
OH + HCl
4-гидрокси-3-меркапто-2'-хлороазобензол
46
47.
ФИЗИЧЕСКИЕ СВОЙСТВА АЗОСОЕДИНЕНИЙАзосоединения представляют собой кристаллические вещества,
окрашенные в желтый, оранжевый, красный, синий и другие цвета.
Многие из них применяются в качестве красителей и индикаторов в
аналитической химии.
47
48.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОСОЕДИНЕНИЙРеакционная способность обусловлена наличием в их молекуле
азогруппы: N=N
1. Основные свойства: за счёт неподелённых пар электронов на
атомах азота азогруппы, азосоединения проявляют слабые основные
свойства, и в присутствии минеральных кислот протонируются:
C6 H5
N=N C6 H5 + HCl
C6H5
+
N=N C6H 5 + Cl
H
2. Реакции восстановления:
а). В мягких условиях (действием цинка в присутствии щелочей)
образуются гидразосоединения:
C6H5
N=N C6H 5
азобензол
[H]
( Zn + NaOH )
C6H 5 NH NH C6H 5
гидразобензол
б). В жестких условиях (действием хлоридом олова (II) в среде
хлороводородной кислоты (Sn+HCl)) образуются ароматические амины.
Реакция используется для установления строения азокрасителей по
продуктам восстановления:
H3C
N=N
4-метил-4'-хлоразобензол
Cl
SnCl2, 2HCl изб.
SnCl4
NH2 + H2N
H3C
п-толуидин
Cl
п-хлороанилин 48
49.
ИНДИКАТОРНЫЕ СВОЙСТВАКрасители содержат атомные группы, называемые хромофорами,
и атомные группы, носящие название ауксохромов.
Хромофоры – это атомные группы, обусловливающие окраску
веществ (от греч. «хрома» - цвет и «форос» - носитель).
Основными хромофорами являются: достаточно длинная
сопряжённая система кратных связей (–С=С–), оксо-группа –С=О,
имино-группа –С=N–, азогруппа –N=N–, нитрогруппа –NO 2 , нитрозогруппа –N=O, хиноидная группа
Для появления окраски достаточно одного такого хромофора в
структуре молекулы.
Если молекула содержит несколько хромофоров, включённых в
единую
цепь
сопряжения,
интенсивность
окраски
увеличивается.
Но для того, чтобы вещество стало красителем, в его структуре
должны присутствовать группы, которые без хромофоров не
способны вызывать окраску, но, находясь с ними в единой цепи
сопряжения, усиливают окраску. Например, азобензол окрашен в
оранжевый цвет, но не является красителем. Такие группы
49
получили название ауксохромы.
50.
ИНДИКАТОРНЫЕ СВОЙСТВААуксохромы (от греческого «ауксео» - увеличиваю и «хромос» цвет). К ним относятся группы OH, NH2, NHR, NR2, OR, SH.
Ауксохромами обычно являются заместители, проявляющие +М–
эффект.
Ауксохромные группы не только усиливают окраску красителя, но и
обеспечивают его взаимодействие с окрашиваемым материалом,
что повышает устойчивость окраски к действию моющих средств.
Азокрасители применяют для окрашивания шерстяных и
искусственных тканей, кожи, бумаги.
Окраска некоторых азокрасителей изменяется в зависимости от рН
среды, что позволяет их использовать в качестве индикаторов.
Примером такого азокрасителя является метиловый оранжевый
(метилоранж, гелиантин):
NaO3S
N=N
N(CH3)2
метиловый оранжевый
Краситель может содержать в своём составе и кислотные группы –
карбоксильную и сульфо-, они придают красителю растворимость.
50
51.
ИНДИКАТОРНЫЕ СВОЙСТВАМетилоранж получают реакцией азосочетания диазотированной
сульфаниловой кислоты с N,N – диметиланилином:
+
NH3
+
N N
NH2
SO3
2NaCl; 2H2O
натриевая соль
сульфаниловой кислоты
O3 S
N
N
H
pH=3-4
SO3
SO3Na
сульфаниловая
кислота
N(CH3)2
NaNO2; 2HCl
+ NaOH
H2O
4-диазобензолсульфокислота
CH3COONa
+
N(CH3)2
CH3COOH
метиловый оранжевый (красная форма)
NaO3S
N=N
N(CH3)2
метиловый оранжевый (жёлтая форма)
51
52.
ИНДИКАТОРНЫЕ СВОЙСТВАВ нейтральной и щелочной средах метилоранж имеет жёлтое
окрашивание, в кислой среде окраска изменяется на красную
вследствие образования хиноидной структуры:
хиноидный фрагмент
NaO3S
N=N
желтая форма
N
CH3 2HCl
CH3 2NaOH
O3S
N
красная форма H
N
+ CH3
N
Cl
CH3
Желтая окраска метилоранжа в нейтральной и щелочной средах
обусловлена наличием в его структуре длинной сопряженной
системы, в состав которой входит хромофор – азогруппа –N=N–.
В кислой среде вследствие присоединения протона к одному из
атомов азота азогруппы происходит электронная перестройка
сопряженной системы, при которой азогруппа исчезает, но
появляется более сильная хромофорная группа – хиноидная. Это
приводит к углублению окраски.
Интервал перехода окраски от красной до желтой находится в
диапазоне рН среды от 3,1 до 4,4, поэтому метилоранж применяют в
качестве кислотно–основного индикатора.
52
53.
Органическая ХимияАМИНОКИСЛОТЫ
М.В. Зыкова, зав. каф. химии, д-р фармацевт. наук
54.
АМИНОКИСЛОТЫ (АК)- это производные карбоновых кислот, в углеводородном радикале (R)
которых один или несколько атомов H замещены на NH2-группу.
В зависимости от природы R, с которым связана COOH-группа, АК
подразделяют на:
алифатические (α, β, γ, δ, ε – аминокислоты и т.д.),
ароматические (орто-, мета- и пара- аминокислоты),
гетероциклические.
К аминокислотам также относятся аминосульфоновые кислоты.
CH3 CH COOH
NH2
аланин,
-аминопропионовая кислота,
2 -аминопропановая кислота
NH2
COOH
ПАБК,
п-аминобензойная
кислота,
4-аминобензойная кислота
CH3 CH СН2 COOH
NH2
аминомасляная кислота,
3-аминобутановая кислота
N
H
COOH
пролин (пирролидин-2
-карбоновая кислота)
CH2 СН2 СН2 COOH
NH2
ГАМК,
аминомасляная кислота,
4-аминобутановая кислота
NH2
SO3H
сульфаниловая кислота,
п-аминобензолсульфокислота,
4-минобензолсульфокислота
54
55.
ИЗОМЕРИЯобусловлена разной структурой R, с которым связана COOHгруппа, и разным положением NH2-группы в углеродной цепи
(структурная изомерия).
Например, для АК состава С4Н9NО2 характерны 5 структурных
изомеров 3 из которых будут существовать в виде энантиомеров:
CH3 CH2
*
СН COOH
NH2
аминомасляная кислота,
2-аминобутановая кислота
CH3
CH3 C*H СН2 COOH
NH2
CH2 СН2 СН2 COOH
NH2
3-аминобутановая кислота
4-аминобутановая кислота
аминомасляная кислота,
СН3
C COOH
NH2
CH2
NH2
аминомасляная кислота,
*
СН COOH
CH3
аминоизомасляная кислота,
аминоизомасляная кислота,
2-амино-2-метилпропановая кислота
3-амино-2-метилпропановая кислота
55
56.
ИЗОМЕРИЯВсе алифатические АК за исключением таурина, глицина и ω–АК
(буква ω обозначает положение заместителя на конце углеродной
цепи) содержат асимметрический атом углерода (С*) и поэтому могут
существовать в виде стереоизомеров (энантиомеров).
СН2-СН2 SO3H
NH2 таурин
CH2 (СН2)n COOH
NH2 АК
СН2 СООН
NH2 глицин
COOH
H
* NH2
CH2-CH3
D-2-аминобутановая кислота
COOH
NH2
* H
CH2-CH3
L-2-аминобутановая кислота
Большинство природных α–АК и все АК, входящие в состав белков
животного происхождения, относятся к L–стереохимическому ряду.
D–АК встречаются в составе белков микроорганизмов и некоторых
антибиотиков пептидной природы, например, грамицидина С.
56
57.
СПОСОБЫ ПОЛУЧЕНИЯ АК1. Получение α–АК:
а) Аммонолиз α–галогенокарбоновых кислот по методу Э.Фишера
(как наиболее доступных, лучше бром-производных):
SR
P красн
CH2 COOH + Br 2 o
tC
CH3
пропионовая кислота
CH3 CH COOH + 2NH 3
Br
бромпропионовая кислота
SN
CH3 CH COOH + HBr
Br
CH3 CH COOH + NH4Br
NH2
аминопропионовая кислота
б) Восстановительное аминирование оксокарбоновых кислот:
каталитическое гидрирование в присутствии аммиака:
H2, Pd
R-C-COOH + NH 3
H2O
O
-оксокислота
R-C-COOH
NH
-иминокислота
[H]
R CH COOH
NH2
-аминокислота
57
58.
СПОСОБЫ ПОЛУЧЕНИЯ АКв)
Синтез
Штреккера-Зелинского:
действие
аммиака
и
циановодородной кислоты на альдегиды. При взаимодействии
альдегидов с аммиаком вначале образуется альдимин, который в
в
α–
присутствии
циановодородной
кислоты
превращается
аминонитрил. Образующийся нитрил легко гидролизуется до кислоты:
O
CH3 С
уксусный
альдегид
AN-E
+ NH3
Н
NH
H2O
CH3 С
+ H-CN
альдимин
SN
CH3 CH C + 2 Н2О
NH2
2-аминопропанонитрил
Н
AN
НСl
CH3 CH C
NH2
2-аминопропанонитрил
CH3
CH COOH
NH2
+ NH4Cl
аминопропионовая кислота
58
59.
СПОСОБЫ ПОЛУЧЕНИЯ АК2. Получение β–АК:
а) Присоединение аммиака к α,β–ненасыщенным карбоновым
кислотам (присоединение аммиака протекает против правила
AE
Марковникова):
CH2 СН2 COOH
NH2
СН2=СН-СООН + NH2-H
аминопропионовая кислота
акриловая кислота
б) Способ Родионова (1926г, выход 30-70%): реакция альдегидов с
малоновой кислотой в присутствии аммиака. Промежуточный продукт алкилиденмалоновая кислота, к которой присоединяется аммиак. В
результате декарбоксилирования образуются β–аминокислоты:
СООН
СН2
СООН
малоновая
кислота
AN-E
O
СООН
СООН
AE
toC
+ CH3 С H O С=CH-CH3 + NH2-H
2
аммиак
СООН
Н
уксусный
альдегид
этилиденмалоновая
кислота
toC
CH3-CH CH2 -COOH
СH-CH-CH3
-CO2
NH2
NH2
аминомасляная кислота
СООН
59
60.
СПОСОБЫ ПОЛУЧЕНИЯ АК3. Получение γ, δ, ε–АК: общим способом получения АК с удаленной
аминогруппой (от С-4 до С-6) является гидролиз лактамов
(циклических
амидов).
Лактамы
образуются
в
результате
перегруппировки оксимов циклических кетонов (перегруппировка
Бекмана), которая сопровождается расширением цикла:
O
+ NH 2OH
циклогексанон
O
NOH
AN-E
перегруппировка
Бекмана
H2O
оксим циклогексанона
SN
NH + H-OH
H+
капролактам
O
CH2 СН2 СН2 СН2 СН2 C
OH
NH2 аминокапроновая кислота,
6 аминогексановая кислота
4. Получение ароматических
АК
–
восстановление
нитробензойных кислот (по
реакции Зинина):
СООН
СООН
6 [H ]
+ 2H2O
Fe+HCl
NO2
п-нитробензойная кислота
NH2
п-аминобензойная кислота
60
61.
ФИЗИЧЕСКИЕ СВОЙСТВА АК- это белые кристаллические вещества с высокими температурами
плавления, хорошо растворимые в воде.
Вследствие наличия в молекуле кислотного центра (группа –СООН)
и основного центра (группа –NH2) АК кристаллизуются из
нейтральных водных растворов в виде внутренних солей, которые
называют биполярными ионами, или цвиттер–ионами.
Так, в сильнокислой среде (рН=1–2) в АК полностью протонирована
аминогруппа и не диссоциирована карбоксильная группа.
А в сильнощелочной среде (рН>12), свободна аминогруппа и
полностью ионизирована карбоксильная группа:
Кислая среда
R CH COOH
+NH
3
катионная форма
pH=1-2
H+
OH
Нейтральная среда
R CH COO
NH+
3
OH
H+
Щелочная среда
R CH COO
NH2
цвиттер-ион
анионная форма
pH=7
pH=12-14
61
62.
ХИМИЧЕСКИЕ СВОЙСТВА АКПроявляют свойства первичных аминов и карбоновых кислот.
По СООН-группе они декарбоксилируются, образуют функциональные
производные карбоновых кислот (соли, сложные эфиры, амиды,
галогенангидриды).
С участием NH2-группы они образуют соли с минеральными кислотами,
вступают в реакции алкилирования, ацилирования, реагируют с
азотистой кислотой, а также дают другие реакции первичных аминов.
АК обладают амфотерными свойствами, так как образуют соли с
минеральными кислотами и основаниями.
I. Реакции солеобразования
реакции, доказывающие амфотерный характер аминокислот:
+ NaOH
СН3 CH COOН
NH2
аланин
H2O
+ HCl
СН3 CH COONa натриевая соль
аланина
NH2
СН3 CH COOН хлороводородная
соль аланина
+ NH Cl
3
62
63.
ХИМИЧЕСКИЕ СВОЙСТВА АКII. Реакции аминогруппы
1. Реакция Ван-Слайка, 1910г (взаимодействие с азотистой кислотой).
Реагируют АК, содержащие в молекуле первичную аминогруппу. По
объему выделившегося азота можно количественно определять АК:
СН3-CH-COOН + HNO2
NH2
СН3-CH-COOН + N2 + H2O
OH
молочная кислота
2. Реакция Сёренсена – формольное титрование (взаимодействие с
формальдегидом). При обработке АК избытком формалина получается
устойчивое N–гидроксиметильное производное, в котором
основные свойства аминогруппы понижены, поэтому полученный
продукт можно оттитровать щелочью, что применяется в
количественном анализе АК:
A N
СН3 CH COOН + СН2 = О
NH2
СН3 CH COOН
N-гидроксиметильное
NHСН2ОН производное аланина
63
64.
ХИМИЧЕСКИЕ СВОЙСТВА АКII. Реакции аминогруппы
3.
Реакция
Сёнгера,
1945г
(взаимодействие
с
2,4динитрофторбензолом). Пример нуклеофильного замещения в
бензольном ядре (SN) благодаря сильным ЭА-заместителям. Эту
реакцию используют для открытия концевых –АК в полипептидах и
белках на БХ и ТСХ в виде жёлтых пятен:
NO2
NO2
O2N
F + H2NCHCOOH
2,4-динитрофторбензол
NaOH
- HF
аланин CH3
O2N
NHCHCOOH
желтого цвета
CH3
2,4-динитрофенильное (ДНФ) производное аланина
4. N-ацилирование АК (способ защиты аминогруппы в синтезе
пептидов):
O
CH2 COOН + CH3 C
NH2
глицин
CH2 COOН + HCl
Сl
ацетилхлорид
NH C CH3
O N-ацетилглицин
64
65.
ХИМИЧЕСКИЕ СВОЙСТВА АКIII. Реакции карбоксильной группы
1. Реакция этерификации (способ защиты СООН-группы в синтезе
пептидов):
СН3 CH COOН + СН3-СН2-ОН
NH2
HCl
to C
СН3 CH COOC2H5 H2O
+ NH Cl
3
аланин
гидрохлорид этилового эфира
аланина
СН3 CH COOC2H5
+ NH Cl
3
NH3
СН3 CH COOC2H5 NH4Cl
NH2
этиловый эфир аланина
Сложные эфиры АК в отличие от самих АК не имеют биполярной
структуры и являются достаточно летучими соединениями, поэтому
используются в анализе смеси α–АК, образующихся при расщеплении
белков методом ГЖХ, масс–спектрометрии.
65
66.
ХИМИЧЕСКИЕ СВОЙСТВА АКIII. Реакции карбоксильной группы
2. Взаимодействие с хлоридом фосфора (V) (способ активации
СООН-группы в синтезе пептидов, т.к. галогенангидриды и ангидриды
обладают более высокой ацилирующей способностью, чем
карбоновые кислоты):
O
O
+ PCl5
СН3 СН С
ОН
NH2
аланин
СН3 СН С
+ NH Cl
Cl
+ POCl3
+ HCl
хлорангидрид гидрохлорида аланина
3
Обычно эту реакцию проводят после защиты аминогруппы:
CH2 COOН + PCl5
NH C CH3
O
N-ацетилглицин
O
CH2
C
+ POCl3 + HCl
Cl
NH C CH3 хлорангидрид
O
N-ацетилглицина
66
67.
ХИМИЧЕСКИЕ СВОЙСТВА АКIII. Реакции карбоксильной группы
3. Декарбоксилирование α-АК:
O
СН2 СН С
OH NH2 ОН
серин
Ba(OH)2, toC
СН2 СН2 + BaCO3
OH NH2
коламин
Ba(OH)2, toC
HOOC CH2 CH2 CH COOH
H2N CH2 CH2 CH2 COOH + BaCO3
CO
2
NH
глутаминовая кислота
2
аминомасляная кислота
В живых организмах декарбоксилирование протекает под действием
ферментов декарбоксилаз с образованием биогенных аминов.
67
68.
ХИМИЧЕСКИЕ СВОЙСТВА АКIV. Специфические свойства АК – отношение
к нагреванию
В этих реакциях одновременно принимают участие амино– и
карбоксильные группы.
При нагревании α-, β-, γ- и
δ–аминокислот образуются разные
продукты.
1. Нагревание α-АК - протекает реакция межмолекулярной
дегидратации с образованием циклических шестичленных диамидов –
дикетопиперазинов:
O
+ ОН
С
CH3 СН
O
NH2
+
H2N
аланин
СН CH3
+
C
O
HO
t oC
2
1
C
NH
3
CH CH3 + 2Н2О
CH3 HC
6
HN
C
4
5
O
3,6-диметил-2,5-дикетопиперазин
68
69.
ХИМИЧЕСКИЕ СВОЙСТВА АКIV. Специфические свойства АК – отношение
к нагреванию
2. Нагревание β-АК - отщепляют молекулу аммиака с образованием
α,β–ненасыщенных карбоновых кислот:
центр СН-кислотности
toC
СН3 СН = СН СООН + NH3
СН3 СН СН СООН
бутен-2-овая кислота
(кротоновая кислота)
NH2 H
аминомасляная кислота
3. Нагревание γ- и δ- АК – происходит внутримолекулярная
дегидратация с образованием циклических амидов - лактамов:
СН2
СН2
H2C
CH2
toC
С
СН2
NH H НО
O
4-аминобутановая кислота
H2C
C
N
+ Н 2О
O
H 4-бутанлактам,
бутиролактам
γ – и δ–лактамы являются
типичными
амидами
и
гидролизуются
до
соответствующих
АК
нагреванием с растворами
сильных
кислот
или
69
щелочей.
70.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ1. γ–Аминомасляная кислота (4–аминобутановая кислота, аминогам,
аминалон, гаммалон, ГАМК, GABA).
СН2 СН2 СН2 СООН
Белое кристаллическое вещество, хорошо
NH2 ГАМК, tплавл=202oC растворяется в воде.
ГАМК образуется в живых организмах при
глутаминовой
декарбоксилировании
кислоты.
Является
нейромедиатором,
принимающим участие в обменных процессах
головного мозга.
Применяется как ноотропное средство при
кровообращения,
нарушениях
мозгового
нервно-психических заболеваниях, старческом
слабоумии. Производными ГАМК являются
также некоторые ноотропные ЛП:
CH2 CH2
CH2
C O
N
СН2 C NH2
пирацетам O
(ноотропил)
C6H5-CH CH2
CH2
C O
CH2 СН СН2 COOH
NH2
фенибут
N
СН2 C NH2
фенотропил O
O
C NH CH
2
(4-фенилпирацетам)
N
СН2 СН2 COONa
пикамилон
70
71.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ2. ε – Аминокапроновая кислота (6–аминогексановая кислота).
СН 2 СН 2 СН 2 СН 2 СН 2 СООН Белое кристаллическое вещество, легко
растворяется в воде.
NH 2 t плавл = 372 o C
Применяется в медицине как ингибитор фибринолиза в качестве
кровоостанавливающего средства при хирургических вмешательствах
и различных патологических состояниях.
3. Антраниловая кислота (орто–аминобензойная кислота).
СООН
NH2
tплавл= 145oC
Белое кристаллическое вещество, практически не
растворяется
в
воде.
Применяется
в
производстве красителей и ЛП.
4. пара-Аминобензойная кислота (4–аминобензойная кислота, ПАБК).
Белое кристаллическое вещество, ростовый фактор
H2N
COOH
некоторых микроорганизмов, входит в состав
витамина Вс – фолиевой кислоты, играющей важную
роль в синтезе белков и нуклеиновых кислот.
71
В организме не синтезируется.
72.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИCOONa
NaOH
COOH - H2O
п - аминобензоат натрия
NH2
COOH
NH2
ПАБК обладает амфотерным
характером, поэтому может
давать соли с кислотами и
основаниями
HCl
п - карбоксибензоламмоний хлорид
+
NH3Cl
ПАБК является родоначальником местноанестезирующих ЛП:
O
H2N
COOC2H5
анестезин
H2N
C2H5
C OCH2CH2 N
новокаин
C2H5
Анестезин – этил-пара–аминобензоат, плохо растворим в воде, не
образует гидролитически устойчивых солей, не применяется в виде
инъекционных ЛП.
Новокаин
–
N,N-диэтиламиноэтил-пара–аминобензоат,
образует
гидролитически устойчивые соли, поэтому, может применяться в виде
7 2
инъекционных ЛП в форме водорастворимого новокаина гидрохлори д а.
73.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ5. Таурин (2–аминоэтан-1-сульфокислота).
СН2-СН2 SO3H Белое кристаллическое вещество, хорошо растворимо в воде,
плохо – в органических растворителях.
NH2
Образуется в организме из АК цистеина. Улучшает энергетические и обменные
процессы. У позвоночных животных и человека встречается в головном и
спинном мозге, переферических нервах, мышцах, печени, почках, крови,
молоке. Амиды, образованные таурином и желчными кислотами (н-р,
таурохолевая кислота), входят в состав желчи млекопитающих и обеспечивают
эмульгирование и всасывание жиров. Таурин выводится из организма с мочой в
свободном состоянии, а также в виде производных с гуанидином или
карбаминовой кислотой. При попадании в кишечник таурин под действием
микрофлоры распадается до неорганических сульфидов.
В виде глазных капель применяется при дистрофии или травме роговицы,
катаракте: капли Дибикор, Тауфон и др.
Применяется в качестве стимулирующего
средства в спортивном питании (тонизирующие,
энергетические напитки), в комплексном лечении
тиков, эпилептических припадков, стенокардии,
сердечной недостаточности, сахарного диабета,
отравлении сердечными гликозидами.
73
74.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ6. L-карнитин (левокарнитин, Витамин Вт, Витамин В11).
OH
фактор метаболических процессов для
поддержания активности кофермента А
CH2-CH-CH2-COO(КоА), присутствует в тканях поперечноCH3-N-CH3
полосатых мышц и печени.
CH3
Синтезируется в организме из ГАМК.
Транспортирует жиры в митохондрии клеток где они сгорают с
освобождением энергии. Снижая уровень жира, предупреждает
заболевания сердца и важен в качестве вспомогательного средства при
снижении веса.
Применяют
как
анаболическое,
антигипоксическое и антитиреоидное средство.
Используется в спортивном питании поскольку
также
обеспечивает
транспорт
ВСАА
аминокислот.
74
75.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ7. α-Аминомасляная кислота (2–аминобутановая кислота, бутирин,
этилглицин).
- промежуточный метаболит окислительного распада
треонина и метионина, но в состав белков не входит,
т.е. является непротеиногенной аминокислотой.
Входит в состав офтальмовой кислоты (трипептид), которая
содержится в хрусталике глаза, является аналогом глутатиона, где
остаток цистеина заменен на этилглицин. Повышает синтез белка, что
способствует его восполнению при интенсивных занятиях спортом.
Низкий уровень бутирина в организме свидетельствует о
недостаточном приеме треонина, метионина и витамин В6.
офтальмовая кислота
76.
Органическая Химияα-АМИНОКИСЛОТЫ
М.В. Зыкова, зав. каф. химии, д-р фармацевт. наук
77.
α-АМИНОКИСЛОТЫ (α-АК)- содержат NH2-группу и COOH-группу у одного и того же атома
углерода и отличаются строением радикала, связанного с α –
углеродным атомом
O
R CH C
OH
NH2
общийструктурный
фрагмент аминокислот
- В природе найдено около 150 α–АК
- В состав белков животного происхождения входит около 25 α–АК
- Примерно 20 α–АК присутствуют в каждой белковой молекуле
77
78.
Физические свойства α–АК- белые кристаллические вещества;
- ХР в воде, хуже - в органических растворителях;
- имеют высокие температуры плавления;
- большинство имеют сладкий вкус.
Классификация α–АК
I. Химическая природа радикала
1. Алифатические
2. Ароматические
3. Гетероциклические
O
R CH C
OH
NH
2
II. Кислотно–оснóвные свойства
III. Биологическое значение
78
79.
Классификация α–АКI. ХИМИЧЕСКАЯ ПРИРОДА РАДИКАЛА
1. Алифатические α-АК в зависимости от числа NH2 и СООН
групп подразделяют на:
- моноаминомонокарбоновые: глицин, аланин, валин, лейцин,
изолейцин
CH3 CH COOH
H 2N CH2 COOH
CH3 CH CH COOH
NH2
CH 3 CH CH2 CH COOH
CH 3
CH3 NH2
CH3 CH2 CH CH COOH
NH 2
CH3 NH2
- моноаминодикарбоновые: аспарагиновая и глутаминовая, а
также их амиды – аспарагин и глутамин
HOOC CH2 CH COOH
NH2
HOOC CH2 CH2 CH COOH
H2NOC CH2 CH COOH
NH2
NH2
H2NOC CH2 CH2 CH COOH
NH2
79
80.
Классификация α–АКI. ХИМИЧЕСКАЯ ПРИРОДА РАДИКАЛА
1. Алифатические α-АК в зависимости от числа NH2 и СООН
групп подразделяются на:
- диаминомонокарбоновые: орнитин, лизин, аргинин
CH 2 CH 2 CH2 CH COOH
CH2 CH2 CH2 CH 2 CH COOH
CH2 CH2 CH2 CH COOH
NH2
NH2
NH C NH2
NH2
NH2
NH2
NH
- гидроксиаминокислоты: серин, треонин
CH2 CH COOH
OH NH2
CH3 CH CH COOH
OH NH2
- серосодержащие: цистеин, цистин, метионин
CH2 CH COOH
SH
NH2
CH2 CH COOH
NH2
S
S
NH2
CH2 CH COOH
CH3 S CH2 CH2 CH COOH
NH2
80
81.
Классификация α–АКI. ХИМИЧЕСКАЯ ПРИРОДА РАДИКАЛА
2. Ароматические α-АК : фенилаланин и тирозин
CH2 CH COOH
CH2 CH COOH
HO
NH2
NH2
3. Гетероциклические α-АК :
- ароматические: гистидин, триптофан
N
CH2 CH COOH
CH2 CH COOH
NH2
NH2
N
H
N
H
- неароматические: пролин и оксипролин (гидроксипролин)
HO
COOH
N
H
COOH
N
H
81
82.
Классификация α–АКII. КИСЛОТНО-ОСНÓВНЫЕ СВОЙСТВА
1. Нейтральные: NH2- групп = СООН- групп
2. Кислые: NH2- групп < СООН- групп
3.Оснóвные: NH2- групп > СООН- групп
III. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
1. Заменимые α-АК – образуются в организме;
2.Незаменимые α-АК – не образуются в организме, поступают в
составе белков с пищей.
Восемь незаменимых α-АК : валин, лейцин, изолейцин, треонин,
лизин, метионин, фенилаланин, триптофан.
3. Частично/условно заменимые α-АК :
- не синтезируются в детском организме: аргинин и гистидин
- для синтеза необходимы незаменимые аминокислоты – это
тирозин (синтезируется при гидроксилировании фенилаланина) и
цистеин (синтезируется из серина, но при участии метионина)
82
83.
Получение α–АКОсновным источником α–АК для человека являются белки пищевых
продуктов:
-молочные продукты
-рыба
-мясо
-яйцо
-соя, горох, фасоль и т.д.
α–АК получают:
-синтетическим путём (органический синтез)
-выделяют из гидролизатов природных белков (рогов, копыт, волос,
перьев, чешуи, молока, крови).
α–АК содержатся во многих
лекарственных
растениях
(корневища
пиона
уклоняющегося,
рожки
спорынья и др.).
83
84.
Биосинтез α–АКосуществляется из α–кетонокислот – продуктов метаболизма углеводов
1. Восстановительное аминирование с участием кофермента НАДН:
HOOC-CH2-CH2 С COOH
O
-кетоглутаровая кислота
NH3
С COOH
NH
-иминоглутаровая кислота
HOOC-CH2-CH2
H2O
NH3
H2O
НАДН, Н+
НАД+
НАДН, Н+
НАД+
HOOC-CH2-CH2-CH-COOH
NH2
глутаминовая кислота (Глу)
84
85.
Биосинтез α–АК2. Трансаминирование (переаминирование) - когда источником NH2группы является другая α–АК. С помощью этой реакции устраняется
избыток α–АК в клетке и осуществляется связь между обменом белков
и обменом углеводов.
Реакция
протекает
при
участии
ферментов
аминотрансфераз
(трансаминаз), в активных центрах которых содержится коферментная
форма витамина В6 пиридоксальфосфат:
HOOC-CH2-CH2-CH-COOH + HOOC-CH2- С COOH
O
NH 2
глутаминоваякислота(Глу) щавелевоуксуснаякислота
трансаминаза+
пиридоксальфосфат
трансаминаза+
пиридоксальфосфат
HOOC-CH2-CH2 С COOH
O
NH 2
аспарагиноваякислота(Асп) кетоглутароваякислота
HOOC-CH2-CH-COOH
+
Участвуют практически все α–АК, кроме лизина, треонина и пролина
Наиболее активные α–АК: аланин, аспарагиновая и глутаминовая кислоты
Наиболее активные оксо-кислоты: пировиноградная, α–кетоглутаровая и
85
щавелевоуксусная кислоты
86.
Химические свойства α–АКявляются амфотерными соединениями,
существуют в виде внутренних солей:
R CH C
N H2
O
OH
R CH C
+ NH3
O
O
в
нейтральной
среде
биполярный ион
(внутрення соль)
1.
Гидроксилирование.
В
организме
осуществляется
гидроксилирование некоторых аминокислот, не имеющее аналогий в
химии in vitro, например, гидроксилирование фенилаланина в тирозин:
ферментфенилаланингидроксилаза
HO
CH 2 CH COOH
NH 2
фенилаланин (Фен)
CH 2 CH COOH
NH 2
тирозин(Тир)
Отсутствие в организме данного фермента приводит к тяжелому заболеванию –
фенилкетонурии
86
87.
Фенилкетонурия - повышение содержания в моче фенилаланина ипировиноградной кислоты, и как следствие расстройство функционирования
ЦНС и др. органов; развивается в первые дни жизни, уже к 6-7 мес
наблюдается умственная отсталость, олигофрения, дебилизм, имбицилия.
88.
Химические свойства α–АК2. Дезаминирование (удаление NH2– группы). Образуются αоксокислоты и α,β-ненасыщенные кислоты.
а). Окислительное дезаминирование (образуются α-оксокислоты и
аммиак). Протекает в две стадии: ферментативное окисление с
участием фермента НАД+ и гидролитическое расщепление
образовавшейся иминокислоты
НАД+
HOOC-CH2-CH2-CH-COOH
NH 2
НАДН, Н+
глутаминовая кислота
НАД+
НАДН, Н+
H2O
NH3
H2O
HOOC-CH2-CH2-C-COOH
NH 3
иминокислота NH
В обратном направлении при
участии кофермента НАДН
протекает
восстановительное
аминирование α-оксокислот
с образованием α-АК
HOOC-CH2-CH2С COOH
O
-кетоглутаровая кислота
88
89.
Химические свойства α–АКб).
Неокислительное
дезаминирование
ферментативное
внутримолекулярное дезаминирование, без участия О2 (образуются
α,β-ненасыщенные кислоты и аммиак)
HOOC-CH2-CH-COOH
NH2
аспарагиновая кислота
CH3 CH CH2 CH COOH
CH3
NH2
лейцин (Лей)
ферменты
- NH3
ферменты
NH3
HOOC-CH = CH-COOH
фумаровая кислота
(транс-изомер)
CH3 CH CH CH COOH
CH3
4 метилпентен 2 овая кислота
89
90.
Химические свойства α–АК3. Декарбоксилирование (выброс СО2):
HOOC CH2 CH2 CH COOH
NH2
глутаминовая кислота (Глу)
CO2
H2N CH2 CH2 CH2 COOH
аминомасляная кислота
Монокарбоновые α-АК образуют биогенные амины:
декарбоксилаза
HOCH 2 CH 2 NH 2
CH 2 CH COOH
- CO2
коламин
O H NH2 серин
декарбоксилаза
CH 2 CH 2
C H2 C H C O O H
N
- CO2
NH2
NH2
N
N
H
N
H
гистидин
N
H
гистамин
декарбоксилаза
CH2 CH COOH
- CO2
NH2
триптофан
C H 2 CH 2
N
H
NH2
триптамин
90
91.
Химические свойства α–АКПри декарбоксилировании фенилаланина – через ряд промежуточных
продуктов образуются: дофамин, норадреналин, адреналин
фенилаланингидроксилаза
CH 2 CH COOH
HO
фенилаланин NH 2
CH 2 CH COOH
HO
DOPAдекарбоксилаза
CO2
NH
2
HO
L-дигидроксифенилаланин
(L-ДОФА)
HO
HO
CH 2 CH COOH
NH 2
тирозин
CH2 CH NH2
HO
OH
норадреналин
дофамин- гидроксилаза
дофамин
HO
фенилаланин-N-метилтрансфераза
CH CH NH2
тирозингидроксилаза
HO
HO
CH CH NH CH3
OH
адреналин
91
92.
Химические свойства α–АК4. Реакции поликонденсации – образование пептидной связи:
- межмолекулярное взаимодействие
O
аминои
карбоксильных
группR CH C
остаток второй
различных
α–АК,
образуются NH2 NH R
аминокислоты
полиамиды ≡ пептиды
O
CH C N CH
R
H
R
Амидная связь –С(О)–NH– между двумя α– АК
фрагментами называется пептидной связью.
В проявлении биологических функций
пептидов и белков очень важно их
пространственное строение, которое в
значительной
степени
определяется
электронным
и
пространственным
строением пептидной группы, которое
обусловливает
жесткую
плоскостную
структуру пептидной группы
C
0,124 нм C
O
H
0,132 нм
N 0,147 нм
C
R
92
93.
Химические свойства α–АКВ результате вся полипептидная цепь выглядит следующим образом:
O
C
R1
N
C
H
O
H
O
N
C
R2
R3
N
C
H
O
H
O
N
C
R5
N
R4
H
В зависимости от числа α–АК остатков в цепи, пептиды делят на:
ди-, три-, тетра-пептиды и т.д.
Пептиды содержат от 50 до 100 остатков α–АК, белки – более 100.
93
94.
Химические свойства α–АКСинтез дипептида
# цистеилаланин ≡ цистеин-аланин ≡ Цис-Ала
I компонент-цистеин
II компонент-аланин
активация
CH3 CH COOH
CH2 CH COOH
SH
NH2
защита
NH2
защита
I стадия – защита аминогруппы в I компоненте (1 α-АК) - цистеине:
CH2 CH COOH +
CH 2 -O C Cl
SH
NH-H
цистеин
бензилхлорформиат
O
CH 2 CH COOH
HCl
SH NH-C-O-CH2-C6H5
O
94
95.
Химические свойства α–АКСинтез дипептида
II стадия – активация карбоксильной группы в I компоненте (1 α-АК) цистеине:
O O
+
CH 2 CH COOH
SH NH-C-O-CH2-C6H5
O
CH2-CH-C-O -C-OC2H5
Cl C OC2 H 5
- HCl S H NH-C-O-CH2-C6H5
O
этилхлорформиат
O
III стадия – защита карбоксильной группы во II компоненте (2 α-АК) аланине:
CH3 CH COOH + C2 H5 OH
этанол
NH2
аланин
H+
O
CH3 CH C
+ HOH
OC2H5
NH2
95
96.
Химические свойства α–АКСинтез дипептида
IV стадия – образование амидной (пептидной) связи:
пептиднаясвязь
O O
CH 3 O
O
O
CH2-CH-C-O-C-OC2H5 + C H 3 C H C
C H2 C H C NH C C
O C2 H5 C H OH
OC2H5
2 5
S H NH-C-O-CH2-C6H5
H-NH
S H N H - C -O - C2H -C
6 H
5
CO2
O
O
V стадия – снятие защиты:
O
CH 3 O
CH 3 O
O
+
H 2 /Pd
H /OH
C
H
C
H
NH
C
C C
+ HOH
C H2 C H C NH C C
2
OH - C6H CH
OC2H5
-C2H5OH
5 3
S H NH-C-O-CH2-C6H5
SH NH-C-O-CH2-C6H5
-CO2
O
O
пептидная связь
O
O
C H 2 C H C NH CH C
OH
CH
дипептид-цистеилаланин
3
SH NH
2
N концевая
аминокислота
С концевая
аминокислота
рН<7
96
97.
Названия пептидовстроят путем последовательного перечисления α-АК остатков,
начиная с N–концевой α-АК, причем названия α-АК , кроме последней,
получают суффикс «ил». Для последней С–концевой α-АК
сохраняется ее полное название.
В таком же порядке пишут и сокращенные названия.
Например, трипептид серилглутамилцистеин (Сер-Глу-Цис):
H2N CH CO NH CH CO NH CH COOH
CH2OH
(CH2)2 COOH CH2SH
серилглутамилцистеин
Сер Глу Цис
Допускается также писать названия через дефис, не изменяя при этом
окончания α-АК, например: серин-глутаминовая кислота-цистеин
98.
В природе встречается огромное многообразие пептидов и белков, ностроение их полипептидной (полиамидной) цепи одинаковое!
Она состоит из чередующихся пептидных (СОNH) и метиновых (>СН–
) групп.
На одном конце цепи находится аминокислота со свободной
аминогруппой (N–концевая аминокислота), а на другом – со
свободной карбоксильной группой (С–концевая аминокислота).
Пептидные и белковые цепи принято записывать так, чтобы N –
концевая аминокислота находилась слева, а С–концевая
аминокислота – справа.
H2N CH CO NH CH CO NH CH COOH
R
N концевая
аминокислота
R
пептидные
связи
трипептид
R
С концевая
аминокислота
Последовательность остатков аминокислот в пептидах и белках
характеризует их первичную структуру (наиболее прочная).
99.
Химические свойства пептидов ибелков
-обусловлены амидной природой - гидролиз в кислой и щелочной
среде
- в организме гидролиз осуществляется под действием ферментов –
протеиназ.
Гидролиз пептидов в кислой среде дает сведения об аминокислотах,
входящих в состав пептида.
Белок полностью гидролизуется до аминокислот в течение 24 часов
при кипячении с 0,1 М HCl.
Щелочной гидролиз обычно не проводят, т.к. в щелочной среде
аминокислоты не устойчивы.
99
100.
Качественные реакции на α-АК,пептиды и белки
универсальные
специфические
I. Универсальные: биуретовая и нингидриновая реакции
1. Биуретовая реакция – обнаружение пептидной связи. Белки и
пептиды, содержащие как минимум две(!) пептидные связи
образуют прочные хелатные комплексы с ионами тяжелых
металлов, например, с Cu(OH)2 образуется комплекс яркофиолетового
цвета.
Протекание
реакции
обусловлено
возможностью пептидной связи находиться в таутомерной
лактимной форме:
O
H 2 N C H C
R
OH
H
N
CHCOOH
R1
лактамнаяформа
H 2 N C H C
N
C H C O O
R
R1
лактимнаяформа
100
101.
Качественные реакции на α-АК,пептиды и белки
лактимная форма
R1
CH
C
NH2
N
R3
CH
H C
C
OH
R2
лактамная форма
трипептид
O
H2 N
O
C
NH
R3
R
N H C H COOH
C H
C
OH
Cu(OH)2
2 H2 O
:O
O
C
C H R1
N
Cu
R1
N
CH
C
HOOC C H
O
C
C H
R3
NH2
R
Биурет пептида – фиолетового цвета
Хелаты мало растворимы в воде и имеют интенсивную окраску,
поэтому их используют в аналитической практике для обнаружения αАК.
R
CH
Cu(OH)2
CH
C
2 H2O
C
2
O
R
NH2
OH
аминокислота
O
O
NH2
C
Cu
O
O
CH
H2N
медная соль
аминокислоты
(синего цвета)
R
101
102.
Качественные реакции на α-АК,пептиды и белки
2. Нингидриновая реакция – общая качественная реакция на
аминогруппу в α-АК, пептидах, белках (N-конец). При нагревании
аминокислот с избытком нингидрина, аминокислота дезаминируется,
декарбоксилируется и превращается в альдегид. Выделившийся
аммиак конденсируется с двумя молекулами нингидрина. В
результате получается продукт, окрашенный в сине-фиолетовый
цвет:
O
O
OH
2
OH
O
нингидрин
+ R CH COOH
NH2
аминокислота
O
toC
N
RCHO
3 H2O
CO2
OH
O
продукт сине-фиолетового цвета
Нингидриновый реактив применяется для проявления БХ и ТСХ
хроматограмм, а также для количественного определения α– АК
колориметрическим методом.
102
103.
Качественные реакции на α-АК,пептиды и белки
II. Специфические:
1. Ксантопротеиновая реакция - обнаружение
ароматических α–АК: фенилаланин, тирозин,
триптофан, гистидин. Реакция SE с образованием
нитропроизводного жёлто-оранжевого цвета:
NO2
CH2 CH COOH
+HNO3
+ NaOH
CH2 CH C O O H
CH2CHCOON
- H 2 O
NH2
NH2
оранжевогоцвета
же л то го ц в е т а
- H 2 O
NH2
H O
CH 2 CH COOH
NH2
тирозин
HNO3
NO2
H O
O2N
CH 2 CH COOH
NH2
желтаяокраска
NaOH
NaO
CH 2 CH COONa
NH2
O N O
оранжеваяокраска
103
104.
Качественные реакции на α-АК,пептиды и белки
2.
Реакция Фоля – цистеиновая реакция подтверждает присутствие серосодержащих α-АК
(цистеина, цистина, метионина), образуется
осадок черного цвета:
NaOH, toC
to C
Na2S + Pb(CH3COO)2
- 2 CH3COONa
CH2 CH CHOOH
- CH3 С COONa
SH NH2
O
цистеин
-NH3
PbS
сульфид свинца
черный осадок
3. Реакция Миллона – обнаружение
тирозина (на
фенольный гидроксил). Образуется осадок ртутной соли
тирозина пурпурно-красного цвета:
2 HO
CH2-CH-COOH
NH2
HgNO3, Hg(NO3)2
HNO3, HNO2
O
NO2
HOOC
CH H 2C
H2N
O
N
NH2
Hg
O
N O
O2N
пурпурно-красного цвета
CH2 CH
COOH
104
105.
Качественные реакции на α-АК,пептиды и белки
4. Реакция Паули – обнаружение гистидина (на имидазольное кольцо).
При взаимодействии со свежеприготовленным раствором 4диазобензолсульфокислоты образуется вишнёво-красная окраска.
Реакция используется в колориметрическом анализе:
N
2 O2S
N
NH +
H2 H
C C
HN
Na2CO3
COOH
-H2O,-CO2
NH2
O
H2
C
N
CH
COOH
NH2
O2S
ONa
N
N
N
N
H
N
SO2
ONa
105
106.
Качественные реакции на α-АК,пептиды и белки
5. Реакция Эрлиха – обнаружение триптофана (на индольное кольцо).
При
взаимодействии
с
раствором
4-(N,N-диметиламино)
бензальдегидом в кислой среде образуется красно-фиолетовая
окраска. Реакция используется в колориметрическом анализе:
CH2 CH COOH O
C
+
NH2
H
N
H
CH3
N
H+
CH3
NH2
CH2 -CH -COOH
CH
N
CH3
N
CH3
H
красно-фиолетового цвета
106
107.
Качественные реакции на α-АК,пептиды и белки
6. Реакция Вуазене – обнаружение триптофана (на индольное
кольцо). При взаимодействии с раствором формальдегида и нитритом
натрия в кислой среде образуется соль сине-фиолетового цвета.
H2N
2
COOH
CH
CH2
H2N
COOH
CH
CH2 CH COOH H H H+, NaNO2
CH2
+ C
NH2
-H2O
CH
N
N
O
H HO
H
сине-фиолетового цвета N
H
107
108.
Качественные реакции на α-АК,пептиды и белки
7. Реакция Адамкевича – обнаружение триптофана (на индольное
кольцо). При взаимодействии с глиоксиловой кислотой в кислой среде
образуется красно-фиолетовое окрашивание.
H2N
CH2 CH COOH H COOH H+, NaNO
2
C
+
NH2
-H2O
N
O
H
COOH
CH
CH2
N
H
H2N
COOH
CH
CH2
CH
HOOC
N
H
красно-фиолетового цвета
108
109.
Качественные реакции на α-АК,пептиды и белки
8. Реакция Сакагучи – обнаружение аргинина (на гуанидиновый
фрагмент). При взаимодействии нафтолом-1 в присутствии NaOBr
образуется красное окрашивание.
OH
CH2 CH2 CH2 CH COOH +
NH C NH2
NH2
NH
2 NaOBr
- 2 NaBr
- NH2OH
O
N C CH2-CH2- CH2-CH-COOH
O красного цвета NH2
109
110.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ α-АКФОРМУЛА, НАЗВАНИЕ
ЗНАЧЕНИЕ
АЛИФАТИЧЕСКИЕ
H2N CH2 COOH Является нейромедиаторной аминокислотой: связываясь с
рецепторами оказывает тормозящее действие на нейроны, а
ГЛИЦИН, Гли (Gly) также способствует передаче нервного импульса.
аминоэтановая кислота, Синтезируется в организме из глюкозы. Из глицина в
аминоуксусная кислота организме синтезируются другие аминокислоты, порфирины
(гемоглобин и цитохромы), пуриновые основания, коллаген. В
Заменимая
энергетическом плане является ключевым звеном в синтезе
*АУП – 3,5 г в сутки;
глюкагона – одного из основных факторов, влияющих на
**ВДУП – 5,6 г в сутки
использование запасов гликогена мышц и печени.
Способствует выведению токсичных веществ из организма.
Применяют в медицине в качестве ноотропного средства.
Оказывает
седативное,
противотревожное
и
антидепрессивное
действие,
улучшает
память
и
ассоциативные
процессы,
облегчает
засыпание
и
нормализует сон, используется в комплексной терапии
лечения алкогольной и опиатной абстиненции. Регулирует
обмен
веществ,
нормализует
процессы
защитного
торможения
ЦНС,
уменьшает
психоэмоциональное
напряжение.
Пищевая добавка Е640 (модификатор вкуса и аромата).
110
*АУП – адекватный уровень потребления;
**ВДУП – верхний допустимый уровень потребления
111.
Синтезируется в организме из глюкозы. Входит в составмногих белков, легко превращается в печени в глюкозу и
NH2
наоборот - процесс называется глюкозо-аланиновый
цикл и
является одним из основных путей
АЛАНИН, Ала (Ala)
глюконеогенеза в печени, т.е. играет главную роль в
2-аминопропановая кислота, цикле преобразования аминокислот в глюкозу. Является
α–аминопропионовая кислота важным источником энергии для мышечной ткани и
Заменимая
ЦНС,
укрепляет
иммунитет
(обладает
АУП – 6,6 г в сутки;
иммуномодулирующим действием).
ВДУП – 10, 6 г в сутки
Аланин
можно
эффективно
использовать
для
увеличения концентрации глюкозы в крови перед
стартом или после тренировки, когда это особенно
необходимо атлету.
Противоклимактерическое средство. Противодействует
резкому высвобождению гистамина, оказывает прямое
воздействие на расширение периферических кожных
сосудов, которое лежит в основе вегетативных реакций
при климаксе (приливы, ощущение тепла, жара,
головную
боль),
способствует
насыщению
БЕТА-АЛАНИН
3-аминопропановая кислота, периферических рецепторов нейротрансмиттеров.
β–аминопропионовая кислота При применении в спорте повышает выносливость при
физических нагрузках, превращается в мышечных
клетках в карнозин, который действует как буфер для
молочной кислоты, вырабатываемой
во время
физических
нагрузок,
и
помогает
отсрочить
111
наступление нервно-мышечной усталости.
CH3 CH COOH
112.
CH3 CH CH COOHCH3 NH2
ВАЛИН, Вал (Val)
2-амино-3-метилбутановая кислота,
α–аминоизовалериановая кислота
Незаменимая
АУП – 2,5 г в сутки; ВДУП – 3,9 г в сутки
CH3 CH CH2 CH COOH
CH3
NH2
ЛЕЙЦИН, Лей (Leu)
2-амино-4-метилпентановая кислота,
α–аминоизокапроновая кислота
Незаменимая
АУП – 4,6 г в сутки; ВДУП – 7,3 г в сутки
CH3 CH2 CH CH COOH
CH3 NH2
ИЗОЛЕЙЦИН, Иле (Ile)
2-амино-3-метилпентановая кислота, α–
амино–β–метил-валериановая кислота
Незаменимая
АУП – 2,0 г в сутки; ВДУП – 3,1 г в сутки
Аминокислоты
с
разветвлёнными
боковыми цепями - Branched-Chain
Amino Acids или BCAA (валин лейцин,
изолейцин).
BCAA-аминокислоты
–
основной материал для построения
мышц, принимают важное участие в
процессах анаболизма и восстановления
мышечной
ткани,
обладают
антикатаболическим
действием.
Являются прекурсорами для синтеза
других
аминокислот.
Стимулируют
выработку инсулина, сжигают жир за счёт
экспрессии лептина в адипоцитах.
Используются
в
спортивном
и
диетическом
питании.
В
большом
колличестве содержатся в семенах и
орехах.
Валин
также
является
исходным
веществом для синтеза пантотеновой
кислоты (Витамин В5) и пенициллина.
Лейцин
применяется
для
лечения
болезней печени, анемий.
112
113.
Синтезируется в организме из глюкозы.Участвует
в синтезе
протеолитических
ферментов и многих других аминокислот
(глицина, цистеина и др.), а также пуриновых
пиримидиновых
оснований,
2–амино–3–гидроксипропановая кислота, и
α–амино–β–гидроксипропионовая кислота сфинголипидов, коламина и др. важных
продуктов обмена веществ.
Заменимая
Участвует в производстве клеточной энергии,
АУП – 8,3 г в сутки;
в процессе распада превращается в
ВДУП – 13,3 г в сутки
пировиноградную
кислоту,
которая
включается в цикл Кребса. Стимулирует
иммунную систему.
CH2 CH COOH
OH NH2
СЕРИН, Сер (Ser)
CH3 CH CH COOH
OH NH2
ТРЕОНИН, Тре (Thr)
2–амино–3–гидроксибутановая кислота,
α–амино–β–гидроксимасляная кислота
Незаменимая
АУП – 2,4 г в сутки;
ВДУП – 3,7 г в сутки
Синтезируется бактериями и растениями из
аспарагиновой кислоты.
Улучшает состояние сердечно-сосудистой
системы, печени, ЦНС и иммунной системы.
Из треонина в организме синтезируются
глицин и серин. Уменьшает хрупкость костей
и повышает прочность зубной эмали,
является важным компонентом коллагена.
Участвует в обезвреживании токсинов.
Наряду с метионином улучшает липотропную
функцию печени (распад жиров и жирных
кислот), предотвращает накопление жира в
113
печени.
114.
В большом количестве содержится в казеине (основномCH3 S CH2 CH2 CH COOH белке молока), яйцах и мясе. Служит в организме
донором метильных групп в биосинтезе холина,
NH2
МЕТИОНИН, Мет (Met)
2–амино–4–метилтиобутановая
кислота, α–амино–γ–
метилтиомасляная кислота
Незаменимая
АУП – 1,8 г в сутки;
ВДУП – 2,8 г в сутки
адреналина, креатина, а также источником серы в
биосинтезе цистеина. Метионин как серосодержащий
хелатор обеспечивает усиленное выведение
из
организма токсинов, в т.ч. тяжелых металлов (Pb, Cd,
Hg), радиоактивных изотопов, участвует в жировом
обмене, снижая содержание холестерина. В результате,
у человека уменьшаются чувство усталости, проявления
депрессии, гиперактивности, нарушения концентрации
внимания и памяти, замедляется процесс старения,
улучшается
качество
кожи,
сон
и
функции
бронхолегочной системы, обладает положительным
влиянием при преждевременной эякуляции у мужчин.
Метионин способствует улучшению тонуса организма и
сопротивляемости, т.к. влияет на конечную стадию
синтеза адреналина.
Применяется в медицине для снижения содержания
холестерина, уменьшения жировых отложений в печени,
улучшения функции печени (препараты гептрал, гептор,
адеметионин), обладает антидепрессивным действием.
Применяется также в качестве радиофармпрепарата при
онкологических исследованиях головного мозга. В
форме метилсульфония хлорида применяется как
ранозаживляющее средство при язвенной б1о1л4езни
желудка и ДПК (Витамин U).
115.
CH2 CH COOHSH
NH2
ЦИСТЕИН, Цис (Cys)
2–амино–3–меркаптопропановая кислота,
α–амино–β–меркаптопропионовая кислота
Условно заменимая
(синтезируется при участии метионина)
АУП – 1,8 г в сутки;
ВДУП – 2,8 г в сутки
Играет
важную
роль
в
процессах
формирования тканей кожи. Входит в
состав
пищеварительных
ферментов,
влияет
на
выработку
адреналина,
обогащает организм серой. Синтезируется
в организме из серина при участии
метионина,
АТФ
и
витамина
В6.
Способствует пищеварению, участвует в
процессах
переаминирования
,
обезвреживает некоторые токсичные
вещества (алкоголь, ксенобиотики) и
защищает организм от повреждающего
действия
радиации,
предупреждает
поражение печени и головного мозга. Это
один из самых мощных антиоксидантов и
хелаторов.
Помогает устранять избыток меди в
организме,
влияющий
на
поведение
(агрессивность, возбудимость). Цистеин
также разрушает слизь в дыхательных
путях (препарат ацетилцистеин – АЦЦ –
муколитическое средство при бронхите и
муковисцидозе), предупреждает развитие
эмфиземы. В косметологии применяется
как средство для улучшения состояния
115
кожи, волос и ногтей.
116.
Являетсяпродуктом
окислительной
димеризации цистеина. Дисульфидные
цистиновые мостики (дисульфидная связь)
NH 2
S
играют важную роль в формировании и
S
поддержании третичной структуры белков и
NH 2
пептидов, их биологической активности
CH2 CH COOH
(гормоны инсулин, окситоцин, вазопрессин,
Обеспечивают
высокую
ЦИСТИН, Ц и с – S – – S – Цис (Cys)2 соматостатин).
жёсткость в кератине волос.
3,3–дитиобис–2–аминопропановая кислота,
Пищевая добавка Е921 (улучшитель муки и
β,β–дитиобис–α–аминопропионовая кислота
хлеба).
Заменимая
CH2 CH COOH
116
117.
CH2 CH2 CH2 CH COOHNH2
NH2
ОРНИТИН, Орн (Orn)
2,5–диаминопентановая кислота,
α,δ–диаминовалериановая кислота
Заменимая
CH2 CH2 CH2 CH2 CH COOH
NH2
NH2
ЛИЗИН, Лиз (Lys)
2,6–диаминогексановая кислота,
α,ε–диаминокапроновая кислота
Незаменимая
АУП – 4,1 г в сутки;
ВДУП – 6,4 г в сутки
Синтезируется в организме из аргинина.
Участвует в синтезе инсулина и гормона роста
соматотропина, улучшает белковый обмен.
Содержится в коже, связках, сухожилиях.
Способствует восстановлению поврежденных
тканей, клеток печени.
Проявляет
гепатопротекторные
свойства.
Участвует в выводе аммиака, уменьшает
уровень мочевины в крови и моче, способствует
поддержанию кислотно-основного равновесия в
организме.
Стимулирует иммунную систему.
Участвует в синтезе карнитина. Обеспечивает
должное
усвоение
кальция
(является
переносчиком кальция), участвует в синтезе
коллагена, ферментов, антител, гормонов.
вызывает
повышенную
Недостаток
утомляемость, иммунодефицитные состояния,
раздражительность, повреждение сосудов глаз,
потерю
волос,
анемию,
проблемы
в
репродуктивной сфере и опорно-двигательного
аппарата.
Оказывает противовирусное действие, особенно
в отношении вирусов герпеса и ОРВИ.
Источником лизина являются овощи, зл1а
ки,
17
орехи и семена.
118.
Синтезируется в организме из глюкозы.Стимулирует процессы высвобождения в
кровоток инсулина, глюкагона и гормона
роста, обладает выраженным анаболическим
NH
и жиросжигающим эффектом, помогает
залечивать раны и участвует в образовании
коллагена,
является
предшественником
АРГИНИН, Арг (Arg)
2–амино–5–гуанидилпентановая кислота α– креатина и орнитина.
амино–δ–гуанидилвалериановая кислота Аргинина много в соединительной ткани и
коже, семенной жидкости, при дефиците
Частично заменимая
возникает
атрофия
яичек,
снижением
(не синтезируется у младенцев и
иммунитета, сердечно-сосудистые патологии.
пожилых людей)
Один из ключевых метаболитов в процессах
АУП – 6,1 г в сутки;
азотистого обмена, является субстратом NOВДУП – 9,8 г в сутки
синтаз
в
синтезе
NO,
являющегося
локальным
тканевым
гормоном
с
множественными
эффектами
–
от
противовоспалительного
до
сосудистых
эффектов и стимуляции ангиогенеза.
Иммунореактивность организма повышает за
счет влияния на Т-лимфоциты иммунной
системы.
Входит в состав многих препаратов:
гепатопротекторов,
иммуномодуляторов,
противоожоговых,
кардиологических,
геронтологических и онкологических. 118
CH2 CH2 CH2 CH COOH
NH2
NH C NH2
119.
Синтезируется в организме из глюкозы.Играет важную роль в обмене азотистых
веществ и переаминировании, участвует в
АСПАРАГИНОВАЯ КИСЛОТА, образовании пуриновых и пиримидиновых
оснований, мочевины.
Асп (Asp)
Является предшественником в биосинтезе
2–аминобутандиовая кислота,
незаменимых аминокислот –
метионина,
α–аминоянтарная кислота
треонина
и
лизина
у
растений
и
Заменимая
микроорганизмов. При декарбоксилировании
АУП – 12,2 г в сутки;
образуются
альфаи
бета-аланины.
ВДУП – 19,5 г в сутки
Применяется в терапии сердечно-сосудистых,
эмоциональных и психических расстройств.
Препарат аспаркам (сумма аспартатов калия и
магния)
регулирует
метаболические
процессы,
способствует
восстановлению
электролитного
баланса,
оказывает
антиаритмическое действие.
Образуется из аспарагиновой кислоты в
H2NOC CH2 CH COOH
результате прямого аминирования.
NH2
Требуется
для
нормального
функционирования нервной системы, играет
АСПАРАГИН, Асн (Asn)
2–амино-3-карбомоилпропановая кислота, важную роль в метаболизме аммиака.
образования
аспарагина
из
α–амино-β-карбомоилпропионовая кислота Путём
аспарагиновой
кислоты
в
организме
Заменимая
связывается
токсический
для
нервной
системы аммиак. Богаты аспарагином 1б1е9лки
HOOC CH2 CH COOH
NH2
120.
HOOC CH2 CH2 CH COOHNH2
ГЛУТАМИНОВАЯ КИСЛОТА,
Глу (Glu)
2–аминопентандиовая кислота,
α–аминоглутаровая кислота
Заменимая
АУП – 13,6 г в сутки;
ВДУП – 21,8 г в сутки
Синтезируется в организме из глюкозы.
Играет важную роль в азотистом обмене.
Обеспечивает обменные процессы, участвует в
синтезе других аминокислот (глутамин, пролин,
аргинин),
глутатиона,
гамма-аминомасляной
кислоты
(ГАМК),
является
потенциальным
источником энергии в организме, способствует
концентрации внимания, применяется в лечении
депрессий.
Является нейромедиаторной аминокислотой, в
ЦНС находится около 106 глутаматергических
нейронов (содержатся в коре головного мозга,
обонятельной луковице, гиппокампе, чёрной
субстанции, мозжечке).
Повышенное содержание глутамата в синапсах
между нейронами может перевозбудить и даже
убить эти клетки, что приводит к таким
заболеваниям как амиотрофический склероз
(неизлечимое
заболевание
ЦНС,
сопровождающееся параличами и атрофией
мышц). Избыток глутаминовой кислоты у детей
вызывает синдром дефицита внимания и
гиперактиности (СДВГ).
Пищевая добавка – глутамат натрия (Е621)
используется как усилитель вкуса.
120
121.
H2NOC CH2 CH2 CH COOHNH2
ГЛУТАМИН, Глн (Gln)
2–амино-4-карбомоилбутановая кислота,
α–амино-γ-карбомоилмасляная кислота
Заменимая
Образуется из глутаминовой кислоты в
результате прямого аминирования.
Интегрирует азотистый обмен, участвует в
синтезе других аминокислот, а также
нуклеиновых кислот, углеводов, фолиевой
кислоты, пара-аминобензойной кислоты
(ПАБК), глутатиона, некоторых ферментов и
гормонов, обезвреживает аммиак, участвует в
нейромедиаторной функции и окислительных
процессах в клетках мозговой ткани с
выходом энергии, запасаемой в виде АТФ.
Превращается в γ-аминомасляную кислоту
(ГАМК).
Содержится в зерновых, особенно много его в
пшенице. Участвует в метаболизме жиров и
углеводов, повышает уровень сахара в крови
при гипогликемии, что снижает потребность в
сахаре и алкоголе.
Является «топливом для мозга», снижает
чувство тревоги, улучшает способность
мышления и настроение.
121
122.
АРОМАТИЧЕСКИЕХорошим источником данной аминокислоты
CH2 CH COOH
служат говядина, мясо птицы, рыба, соя, яйца,
творог и молоко.
NH2
Участвует в синтезе аминокислоты тирозина,
гормонов
адреналина,
норадреналина,
ФЕНИЛАЛАНИН, Фен (Phe)
2–амино–3–фенилпропановая кислота, инсулина и тироксина, а также нейромедиатора
α–амино–β–фенилпропионовая кислота дофамина, белков, ферментов.
Много содержится в коже и соединительной
Незаменимая
ткани, что отражает его влияние на обмен
АУП – 4,4 г в сутки;
коллагена, эластина и других белковых
ВДУП – 6,9 г в сутки
структур, важных для соединительной ткани.
Необходим для образования нейромедиаторов
(катехоламинов), осуществляющих передачу
импульсов от мозга к клеткам и от клетки к
клетке.
Уменьшает
проявление
депрессии,
предменструальные
и
менопаузные
болезненные
проявления у женщин, снижает чувство голода,
поддерживает состояние
бодрствования,
работает как антидепрессант, улучшает память
и способность к обучению.
122
123.
HOCH2 CH COOH
NH2
ТИРОЗИН, Тир (Tyr)
2–амино–3–пара-гидроксифенилпропановая кислота, α–амино–β–
пара-гидроксифенилпропионовая кислота
Условно заменимая
(синтезируется из фенилаланина)
АУП – 4,4 г в сутки;
ВДУП – 6,9 г в сутки
В организме синтезируется из фенилаланина.
С обменом тирозина связаны некоторые
наследственные
заболевания,
например,
фенилкетонурия –
когда фенилаланин не
превращается в тирозин, в результате чего
метаболиты фенилаланина накапливаются и
вызывают нарушения в развитии нервной
системы.
Из тирозина в организме синтезируются такие
вещества как ДОФА (предшественник дофамина,
адреналин,
норадреналина),
тиреоидные
гормоны (тироксин, трииодтиронин) и пигмент
меланин.
Тирозин помогает организму мобилизовать жир
из
депо,
ускорить
обмен
веществ,
простимулировать выработку в кишечнике
гормона холецистокинина, снижающего аппетит
и уменьшающего отложения жиров, способствует
выработке меланина и улучшает функции
надпочечников, щитовидной железы и гипофиза.
123
124.
ГЕТЕРОЦИКЛИЧЕСКИЕCH2 CH COOH
N
NH2
N
H
ГИСТИДИН, Гис (His)
2–амино–3–имидазолил-4пропановая кислота, α–
амино–β–(γ-имидазолил)пропионовая кислота
Частично заменимая
(не синтезируется у младенцев)
АУП – 2,1 г в сутки;
ВДУП – 3,4 г в сутки
Синтезируется в организме из АТФ и рибозы.
Участвует в производстве красных и белых
кровяных телец и применяется при анемии,
лечении
аутоиммунных
заболеваний
(аллергических
заболеваний,
ревматоидных
артритов), язв желудка и кишечника, тошноты и
изжоги.
Способствует росту и восстановлению тканей.
Входит в состав многих ферментов, является
предшественником гистамина нейротрансмиттера
и
биологически
активных
пептидов
мышц
(карнозина и анзерина).
Важной функцией гистидина является его
способность
строить
и
восстанавливать
миелиновые оболочки клеток, нарушение которых
приводит к тяжелым заболеваниям нервной
системы.
Недостаток может вызывать ослабление слуха,
психические
расстройства,
сексуальные
расстройства, нарушение альфа-ритмов в
головном мозге, раздражительность, напряжение,
страхи, повышенную чувствительности к стрессам.
Избыток
гистидина
вызывает
нарушение
менструального цикла, а также ассоциируется с
шизофренией.
124
125.
Синтезируется в природе микроорганизмами, растениями игрибами. В промышленности получают из антраниловой кислоты.
NH2
Активно взаимодействует в обмене с витаминами группы В:
N
H
участвует в синтезе витамина В3 (ниацина), необходим для
метаболизма витамина В6 (пиридоксина). Гиповитаминоз В3
сопряжен с недостатком триптофана. Дефицит триптофана
ТРИПТОФАН,
приводит также к потере организмом цинка, т.к. он необходим для
Три (Trp)
пиколиновой кислоты, усиливающей всасывание Zn в кишечнике.
2–амино–3–индолил-3Является метаболическим прекурсором (предшественником)
пропановая кислота, α–
«гормона удовольствия» серотонина, снижающего ощущения
амино–β–(β–индолил)страха и напряжения, мелатонина – основного гормона эпифиза,
пропионовая кислота
регулирующего циркадные ритмы всех живых организмов, а
Незаменимая
также биохимическим предшественником индольных алкалоидов.
АУП – 0,8 г в сутки;
Недостаток
в
пище
вызывает
заболевание
пеллагру.
ВДУП – 1,2 г в сутки
Применяется при расстройствах сна, в комплексной терапии
алкогольной
и
наркотической
зависимости,
лечении
маниакальной депрессии и депрессии, связанной с менопаузой.
Считает безопасной альтернативой антидепрессантам и
снотворным, помогает уменьшить или снять головные боли при
мигренях.
Избыток триптофана вызывает диффузный фасциит с
эозинофилией и нарушение когнитивных функций, т.н. синдром
эозинофильной миалгии (множественные системные поражения
легких, мышечной системы, суставов и фасций, симптомами
являются
кашель,
затрудненное
дыхание,
повышенная
утомляемость, боли в мышцах, неврологические наруше12н5ия и
воспаления суставов).
CH2 CH COOH
126.
Содержатся во всех белках всехорганизмов.
COOH
Наиболее
богат
пролином
и
N
гидроксипролином
основной
белок
H
соединительной ткани – коллаген.
Содержатся в желатине.
ПРОЛИН, Про (Pro)
В организме пролин синтезируется из
пирролидин–2–карбоновая кислота
глутаминовой кислоты, гидроксипролин –
Заменимая
из
пролина
в
результате
АУП – 4,5 г в сутки;
посттрансляционного гидроксилирования
ВДУП – 7,2 г в сутки
пептидной цепи.
В составе коллагена пролин окисляется в
гидрокиспролин
при
участии
аскорбиновой кислоты.
HO
Чередующиеся
остатки
пролина
и
оксипролина способствуют созданию
COOH
структуры
коллагена,
стабильной
N
придающей молекуле прочность.
H
Во
время
деградации
коллагена,
пролин
и
ГИДРОКСИПРОЛИН / ОКСИПРОЛИН, высвобождающиеся
гидроксипролин, не могут повторно
Про–ОН (Pro-OH)
4–гидроксипирролидин–2–карбоновая кислота, использоваться для синтеза этого белка.
4–гидроксипролин
Заменимая
126
127.
БЕЛКИСАМОСТОЯТЕЛЬНО - РЕФЕРАТ
План реферата:
1. Определение.
2. Общая формула.
3. Классификация белков.
4. Строение белков (первичная, вторичная,
третичная и четвертичная структуры).
5. Химические свойства белков.
6. Качественные реакции на белки.
7. Биологические функции белков.

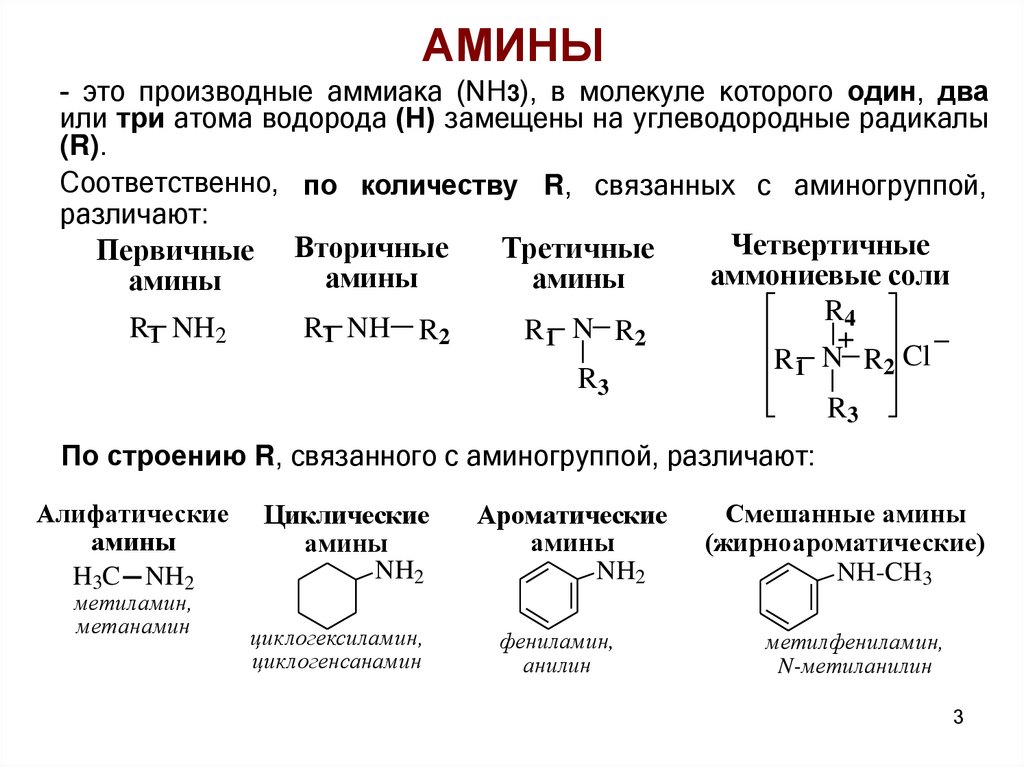
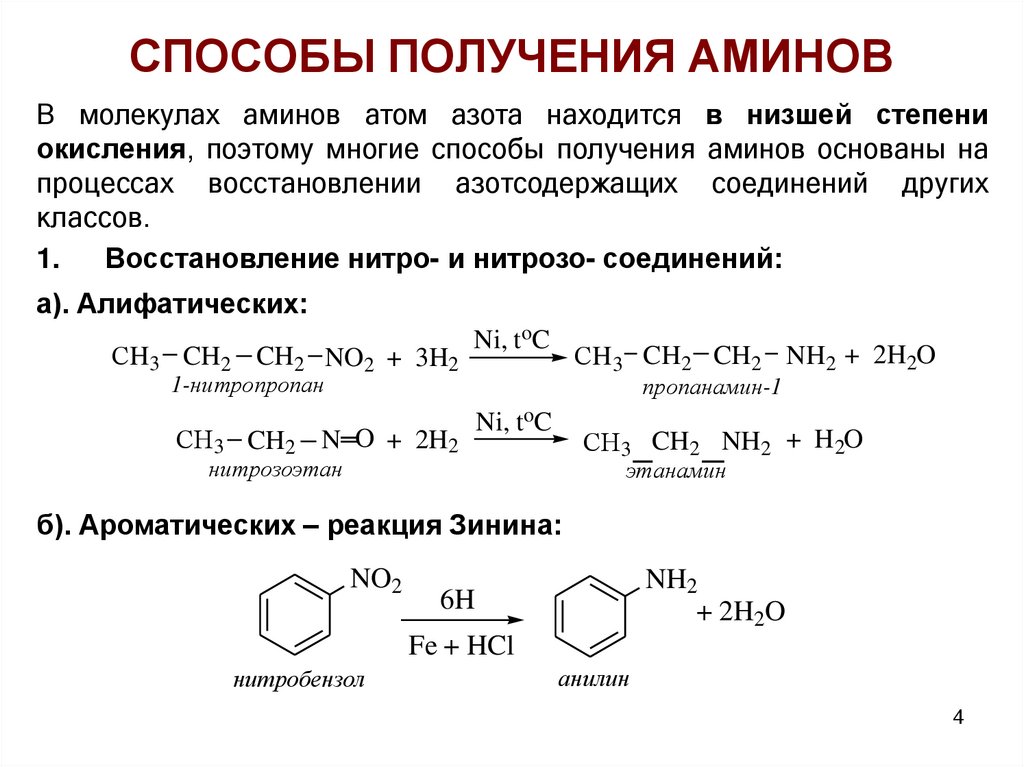
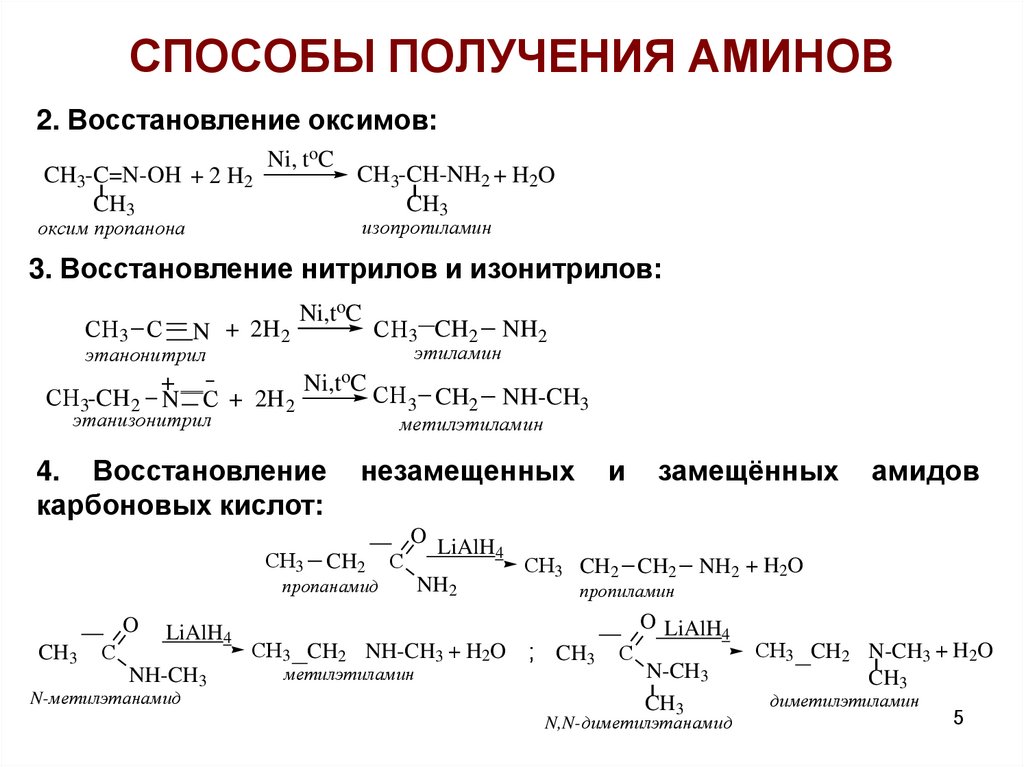


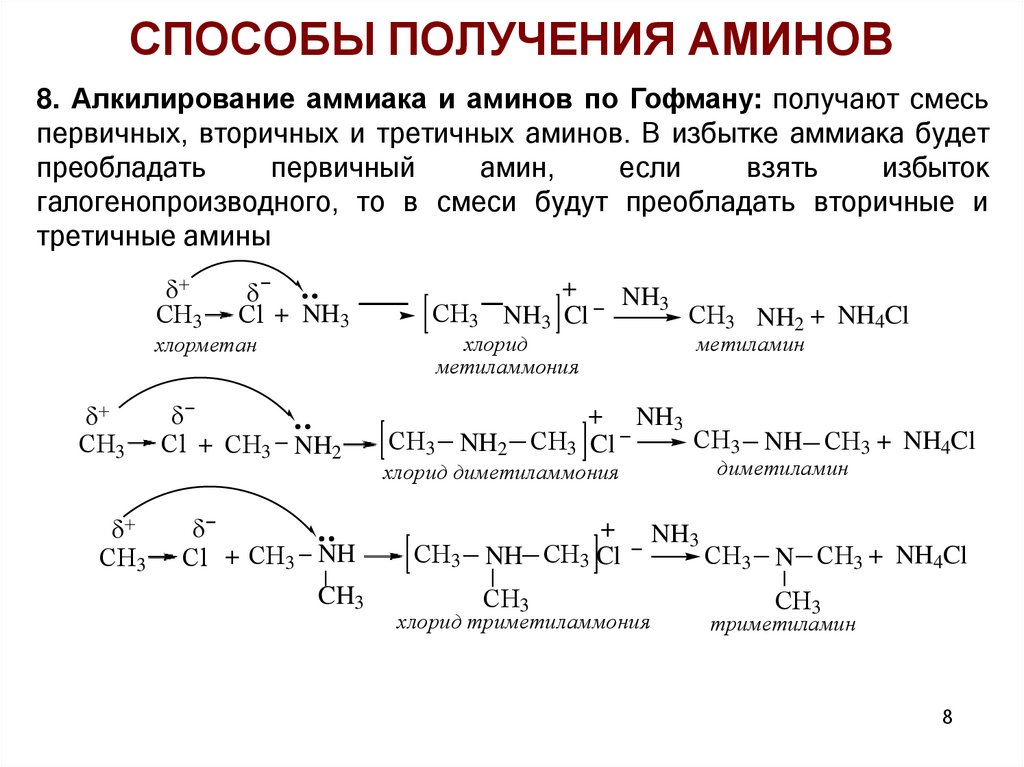
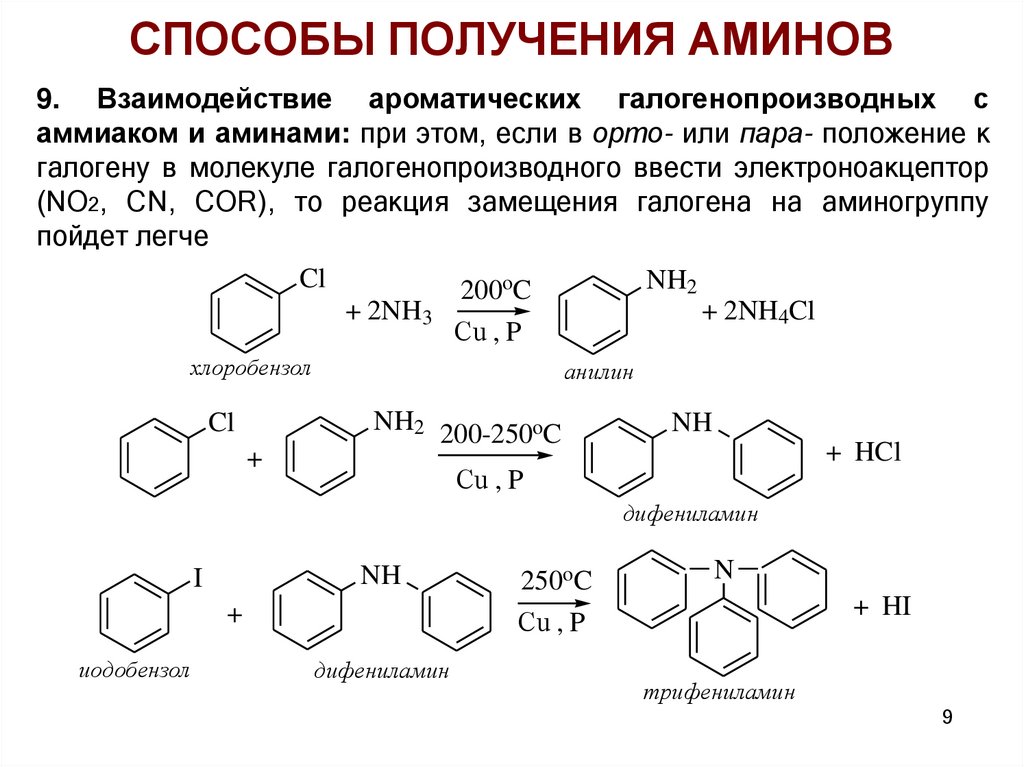



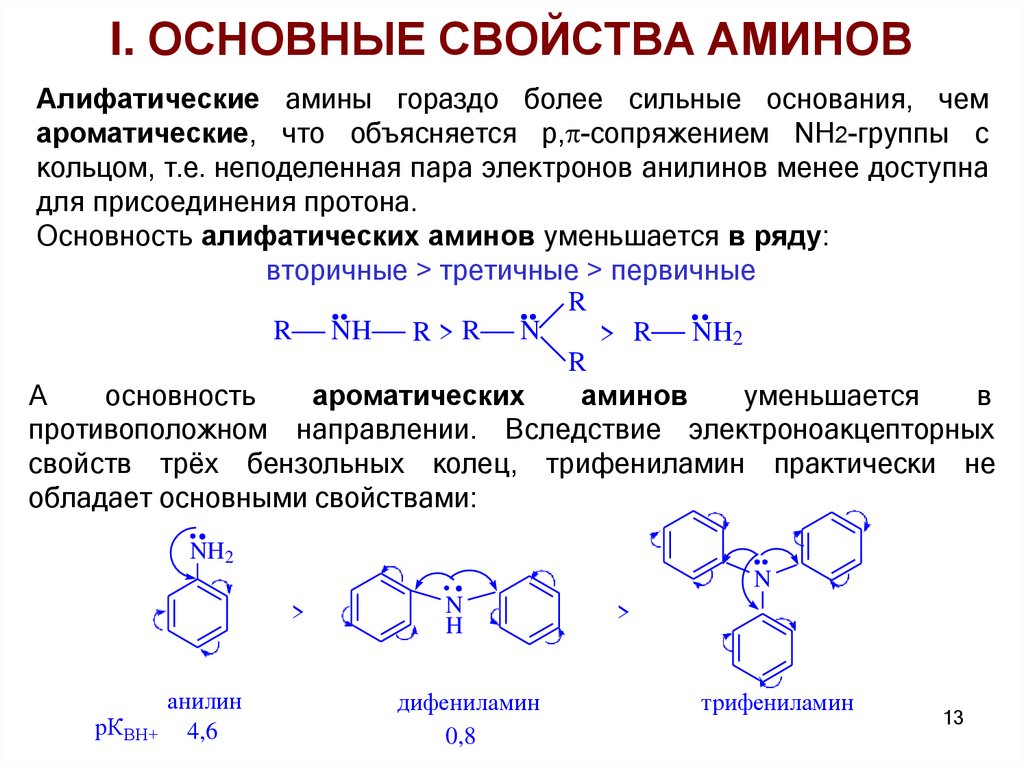
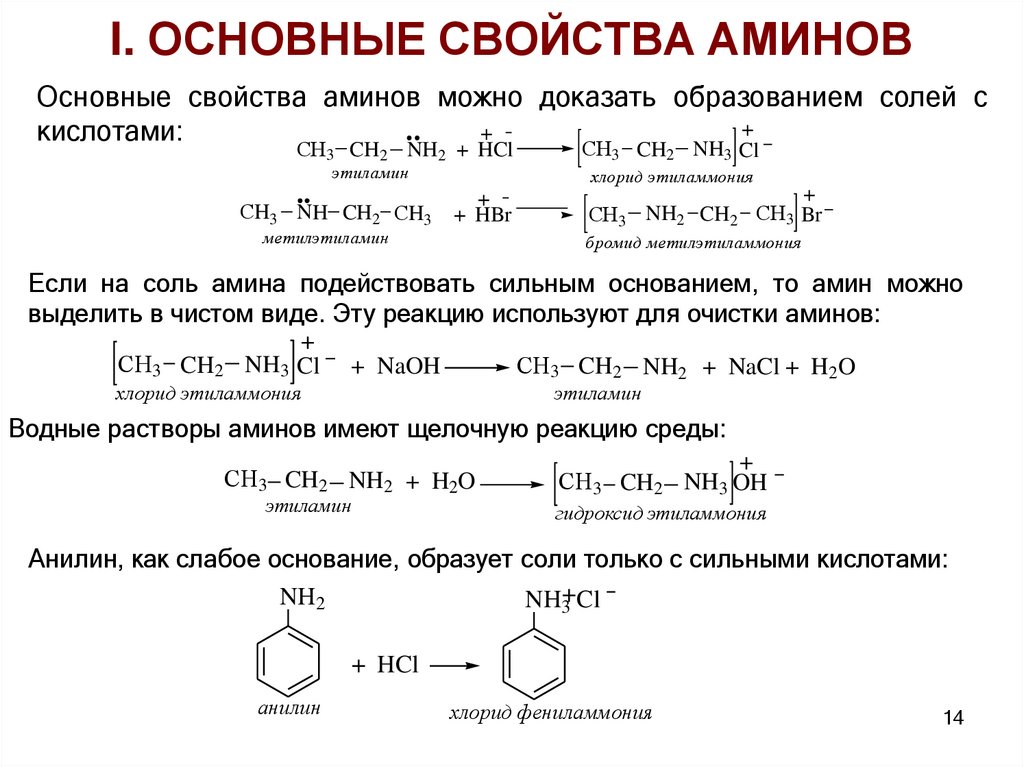
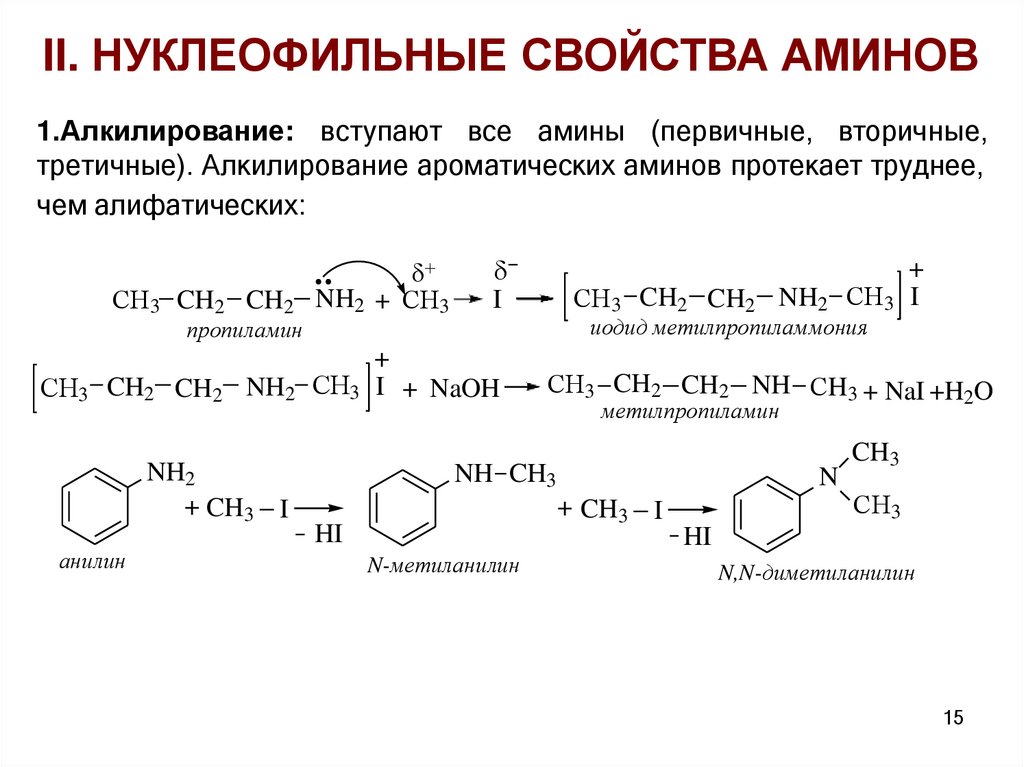
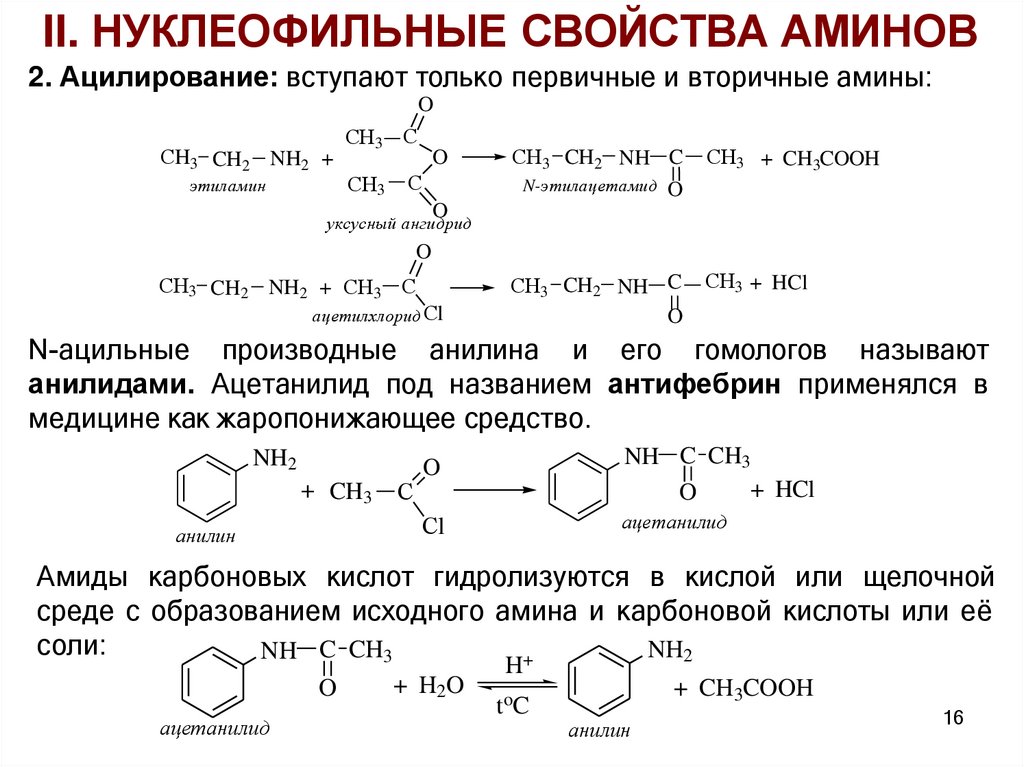
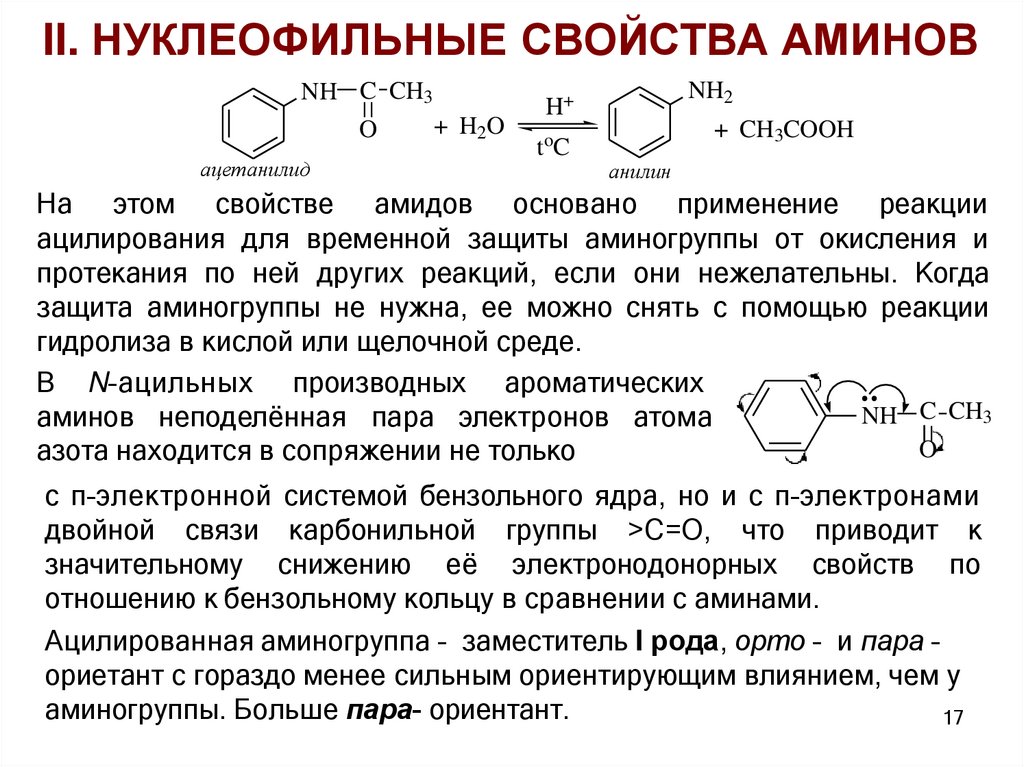
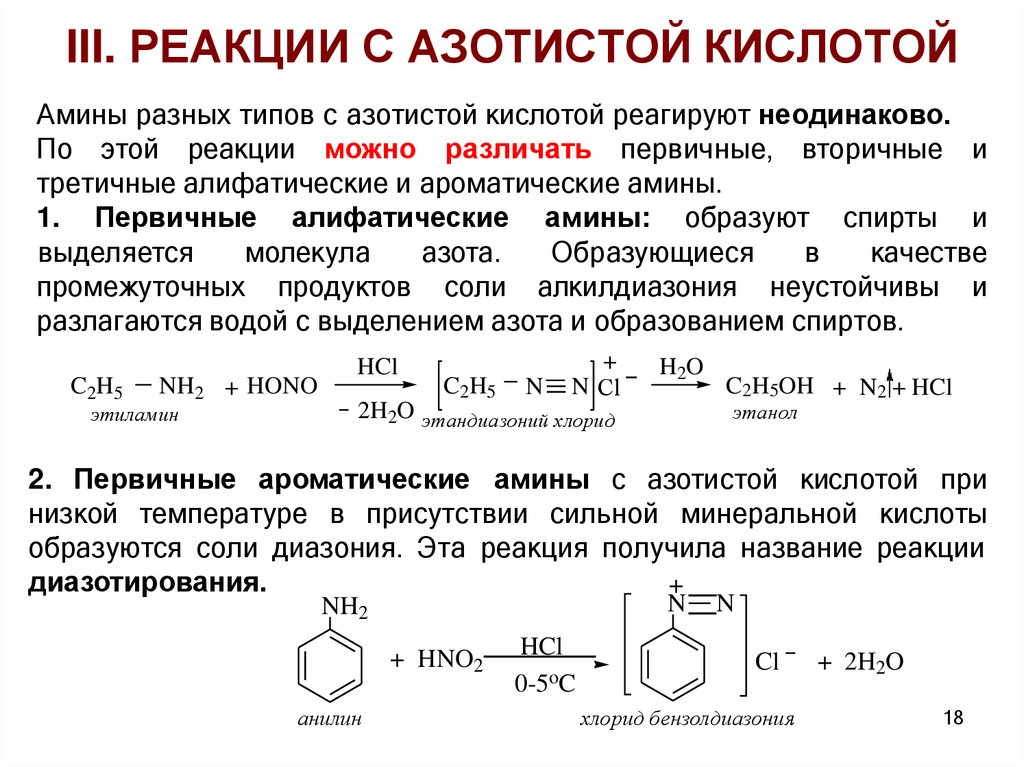
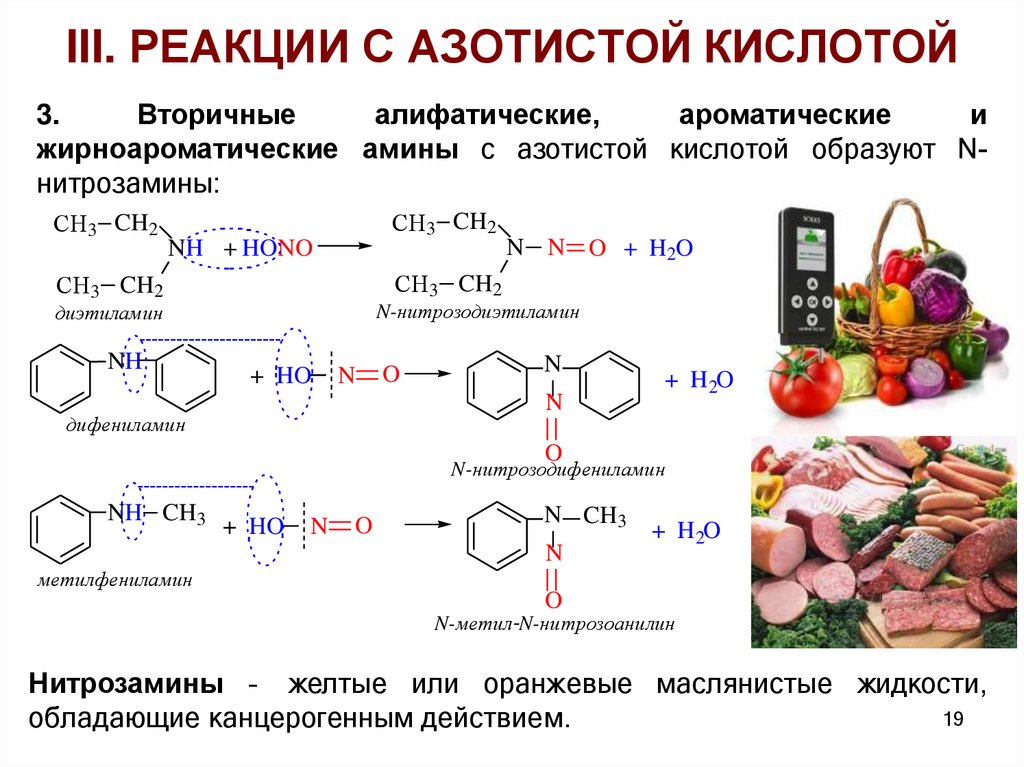
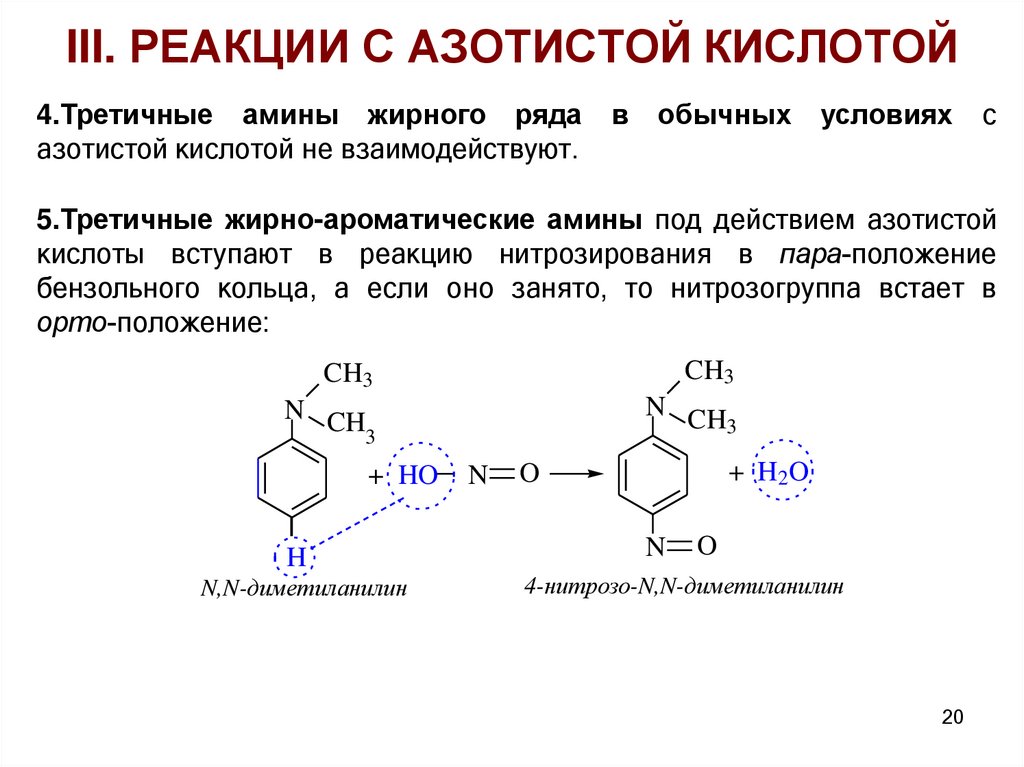
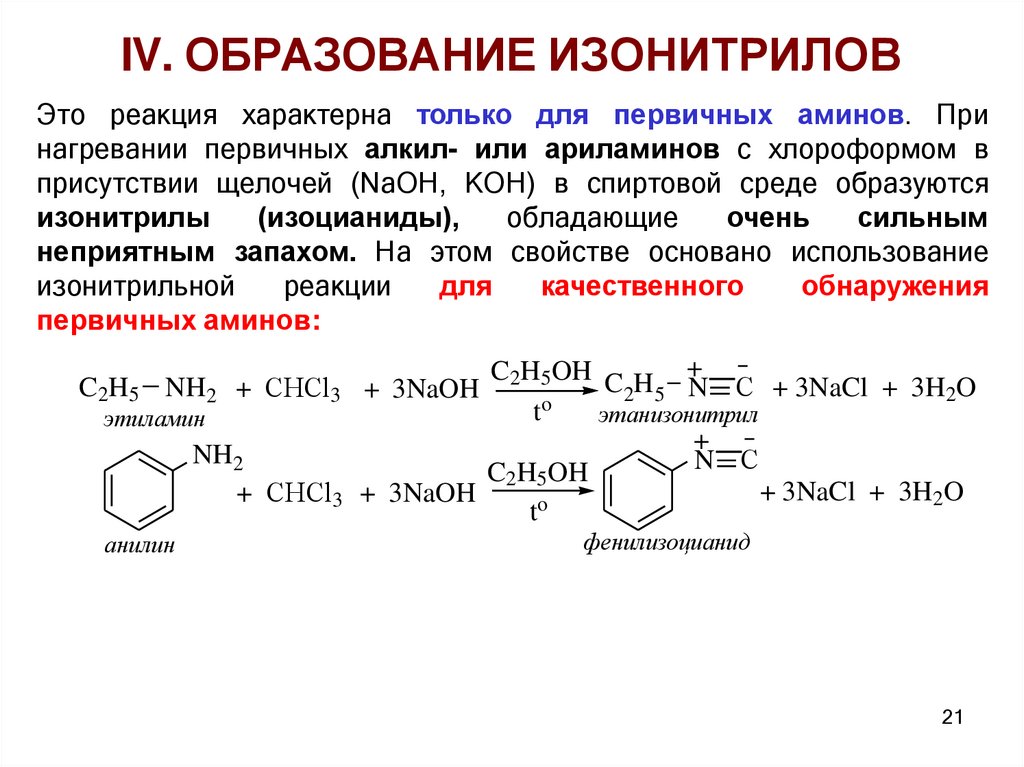
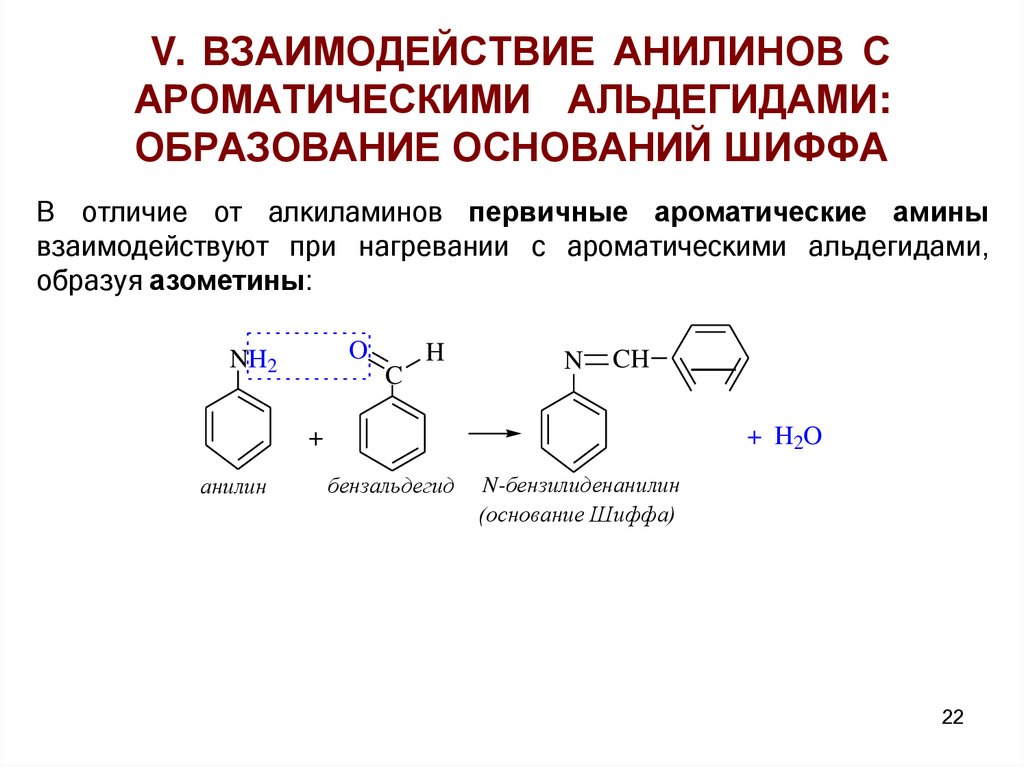

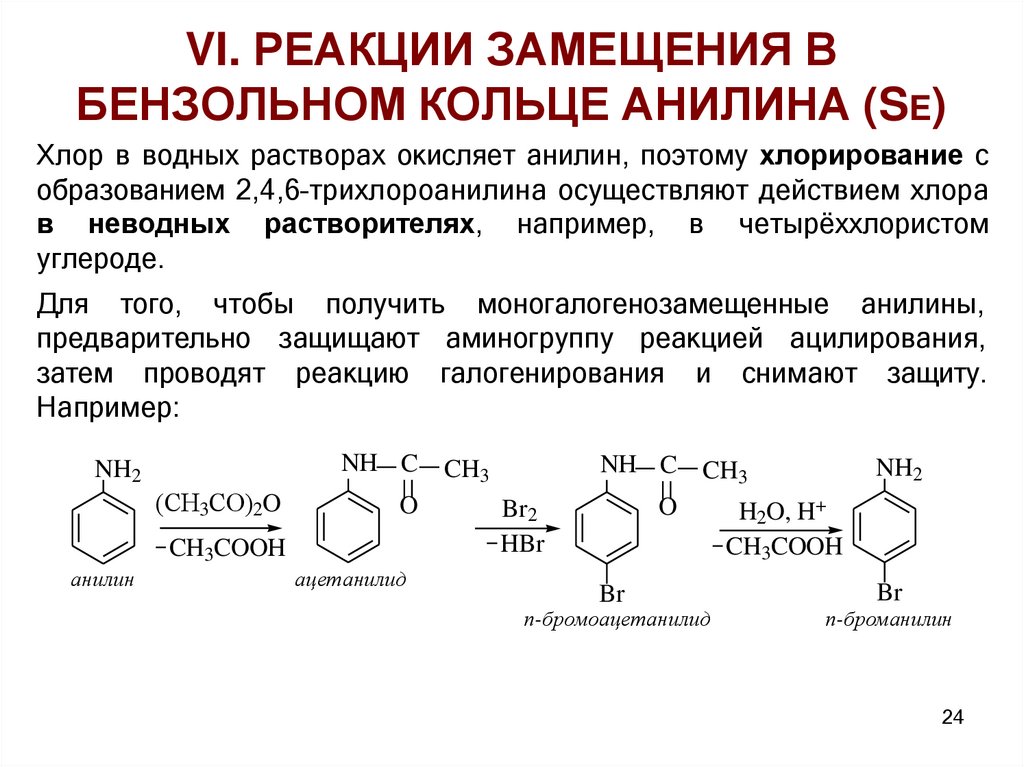

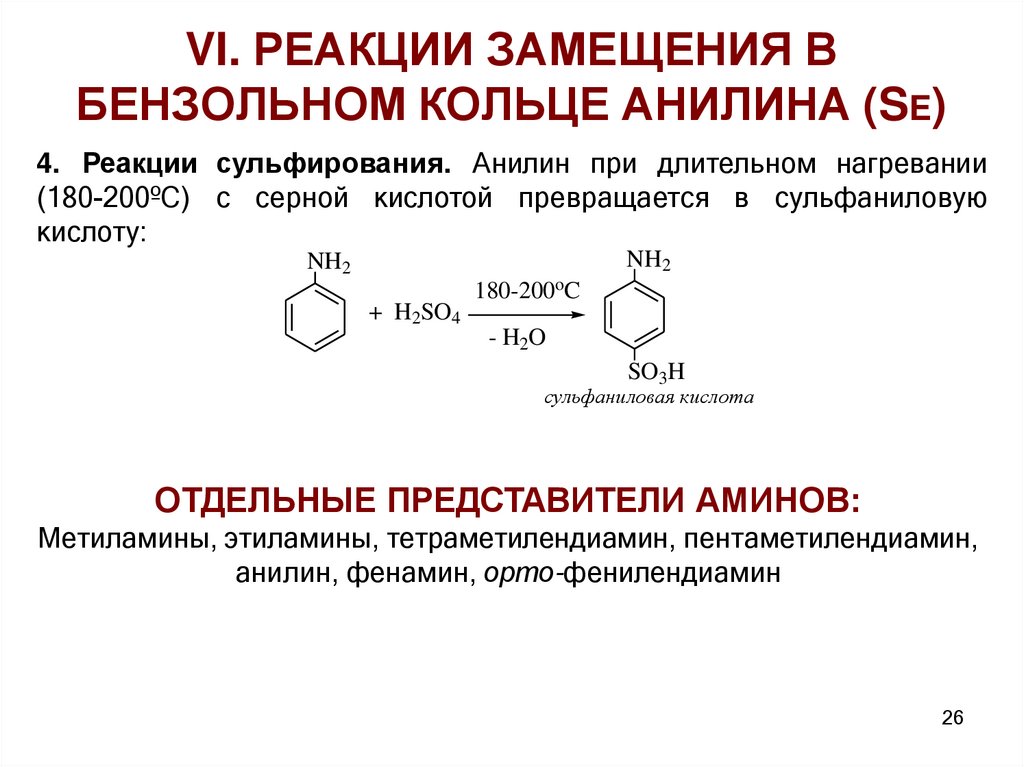

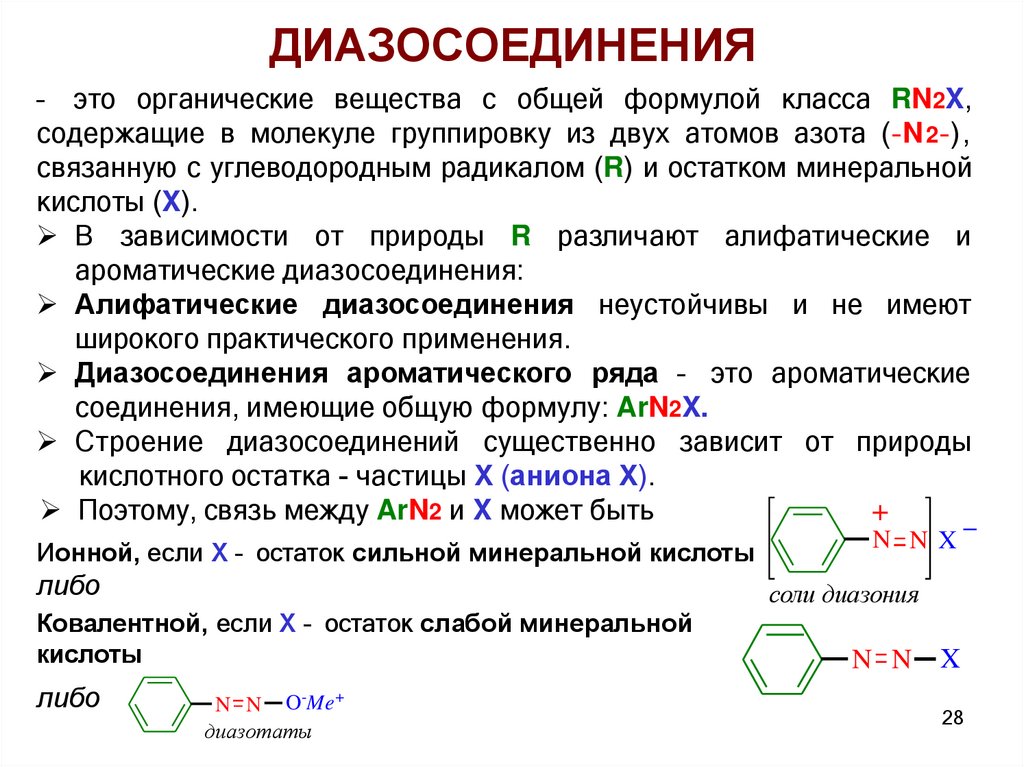
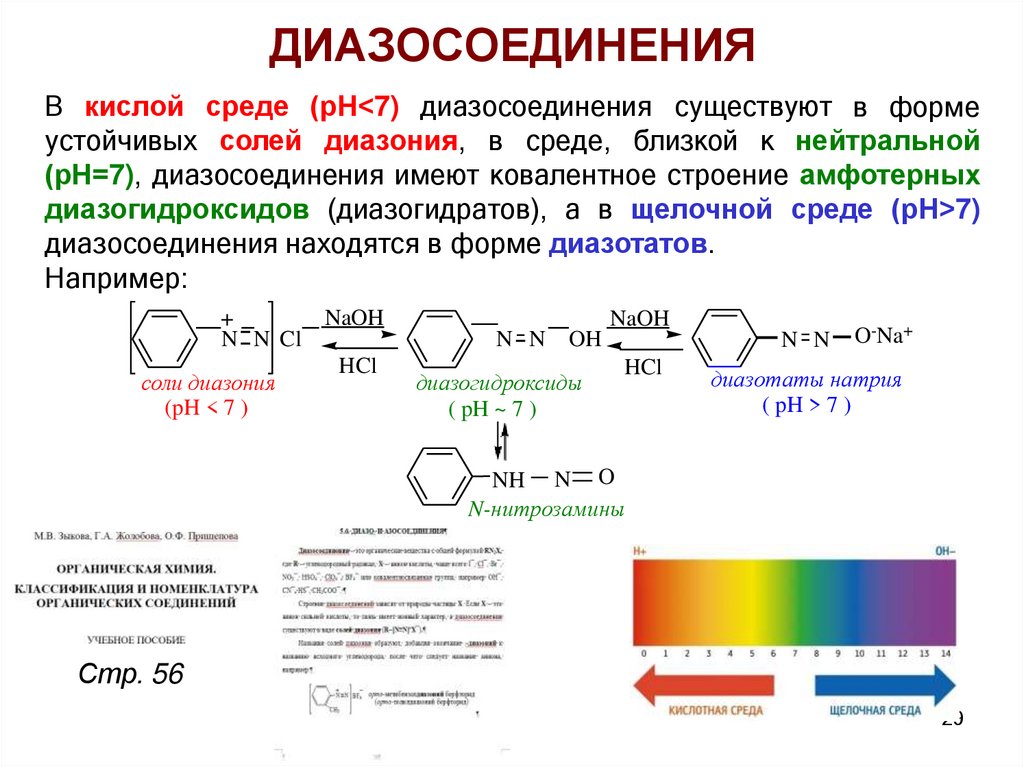

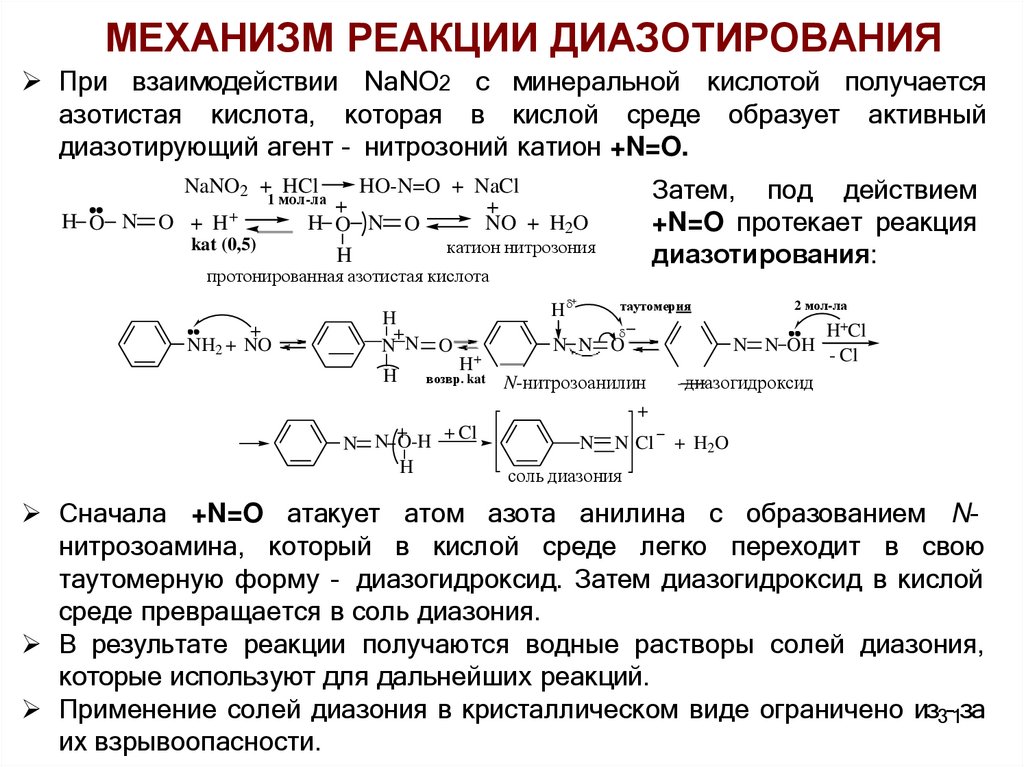



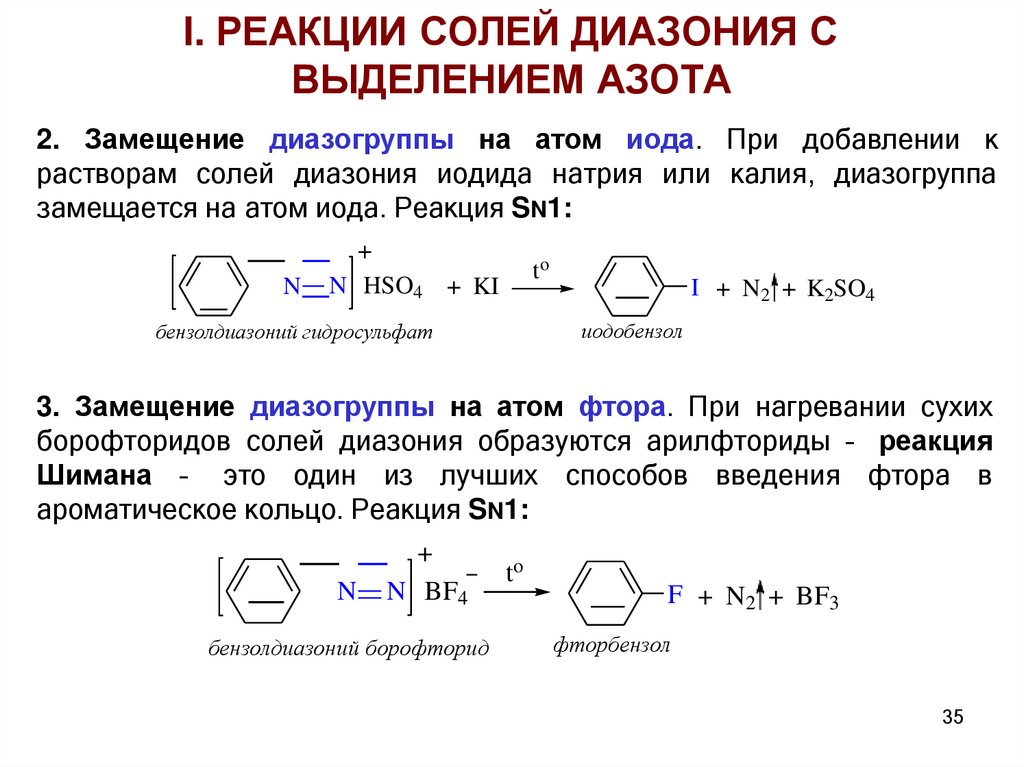
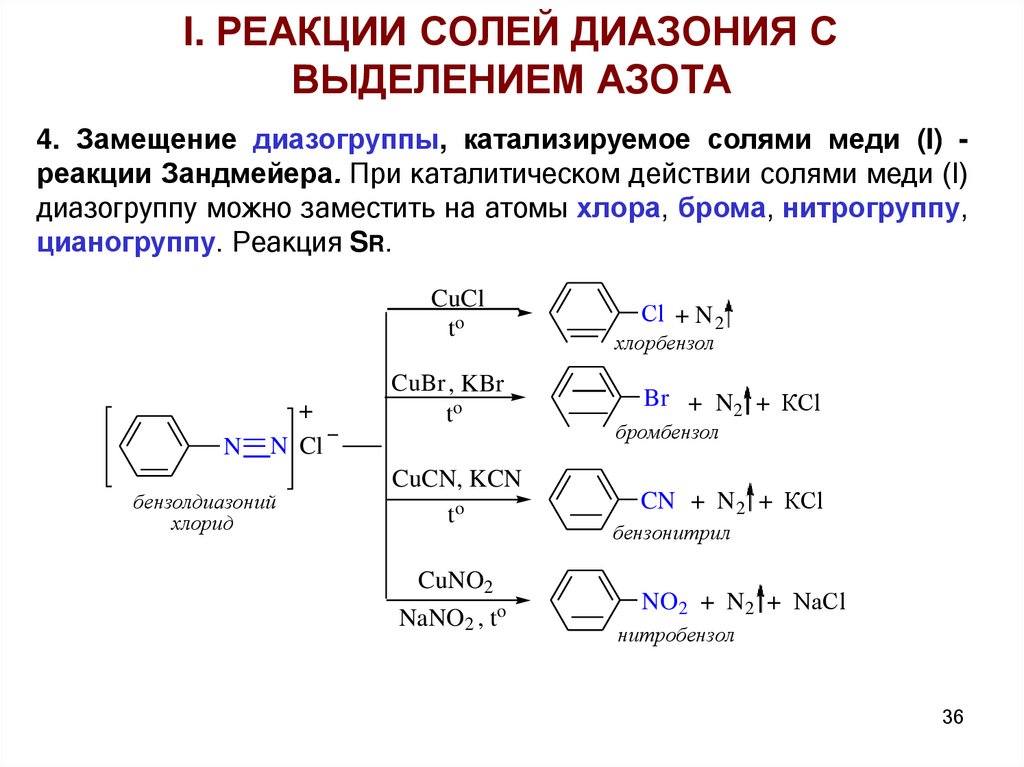

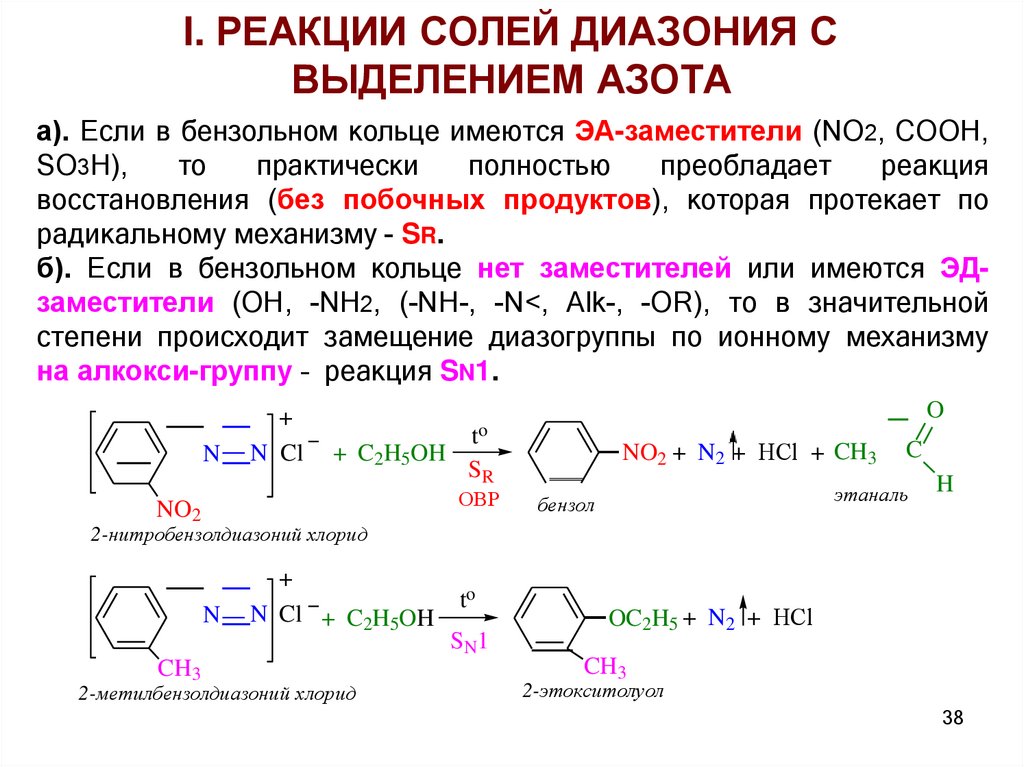
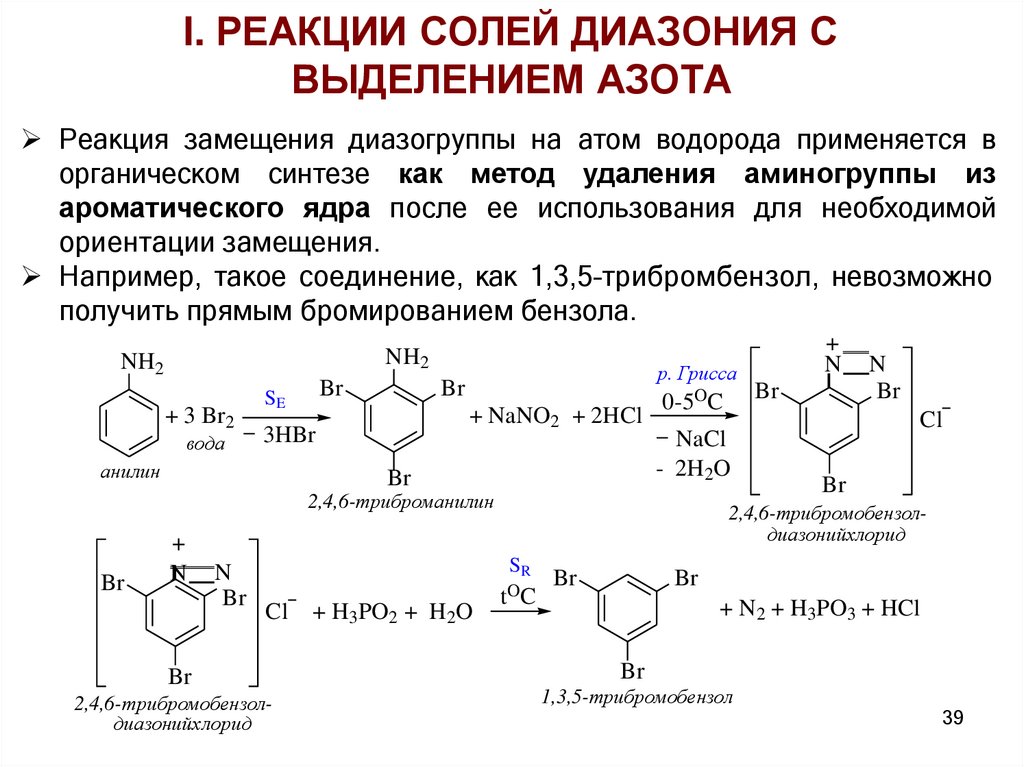
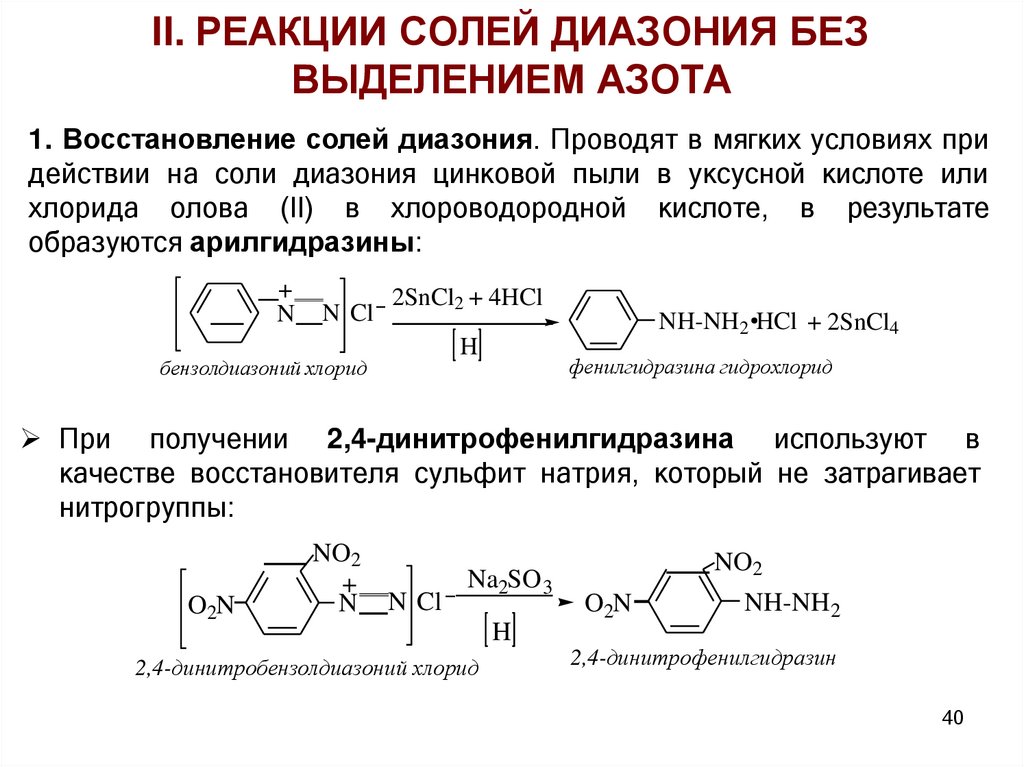
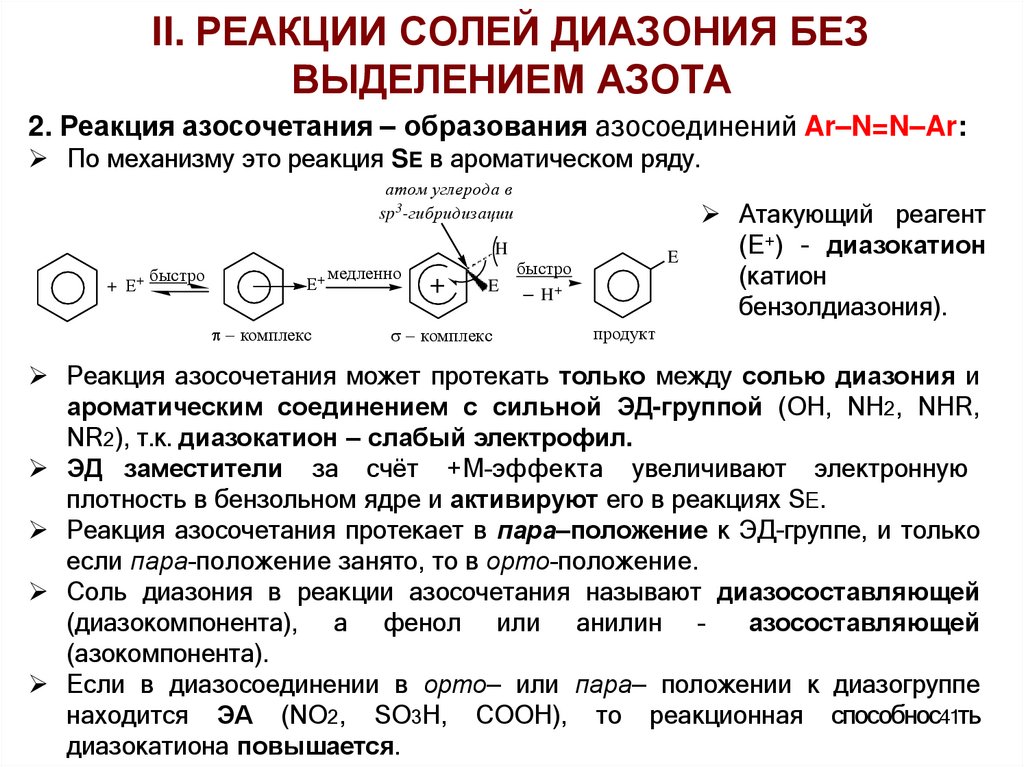
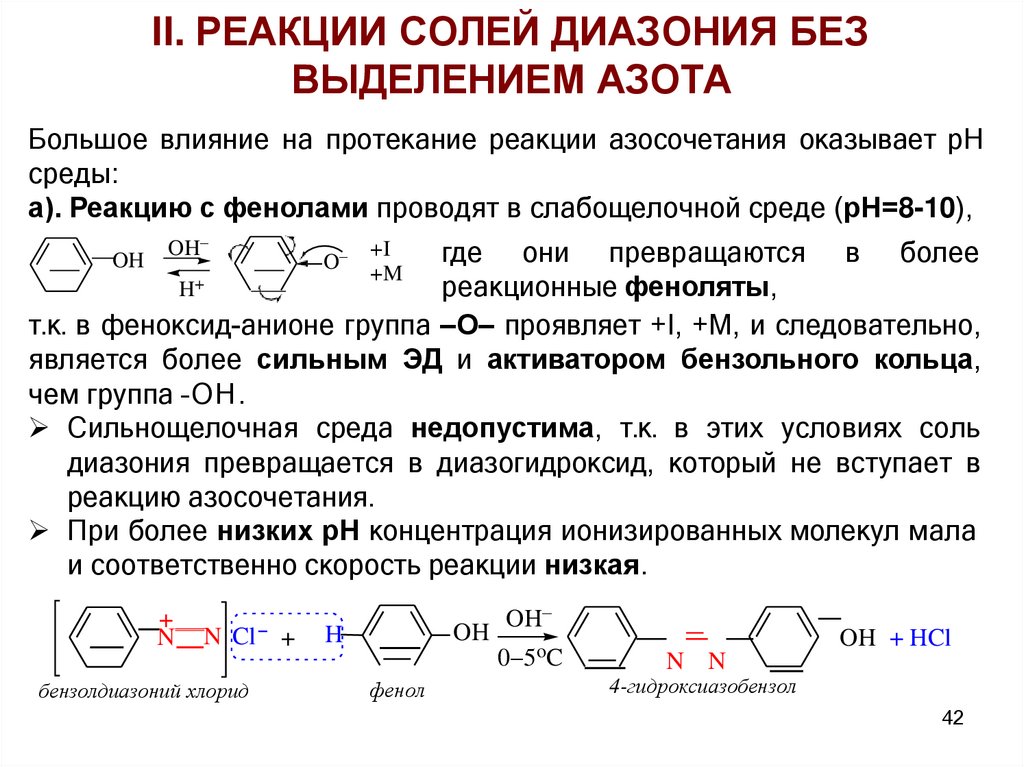

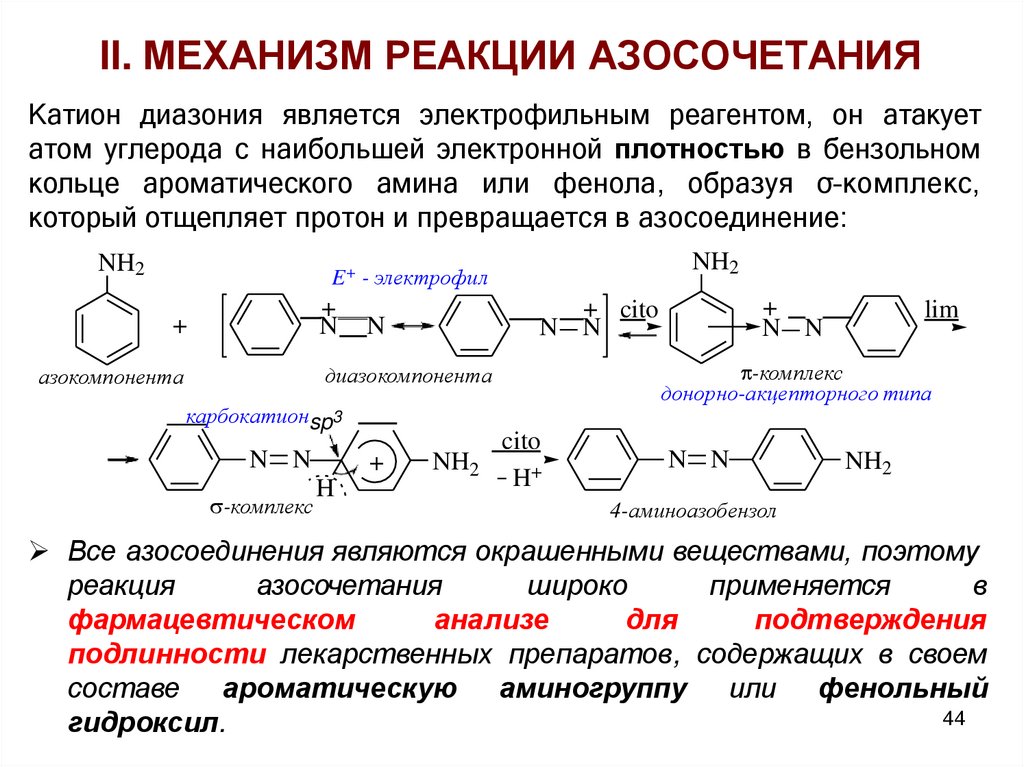

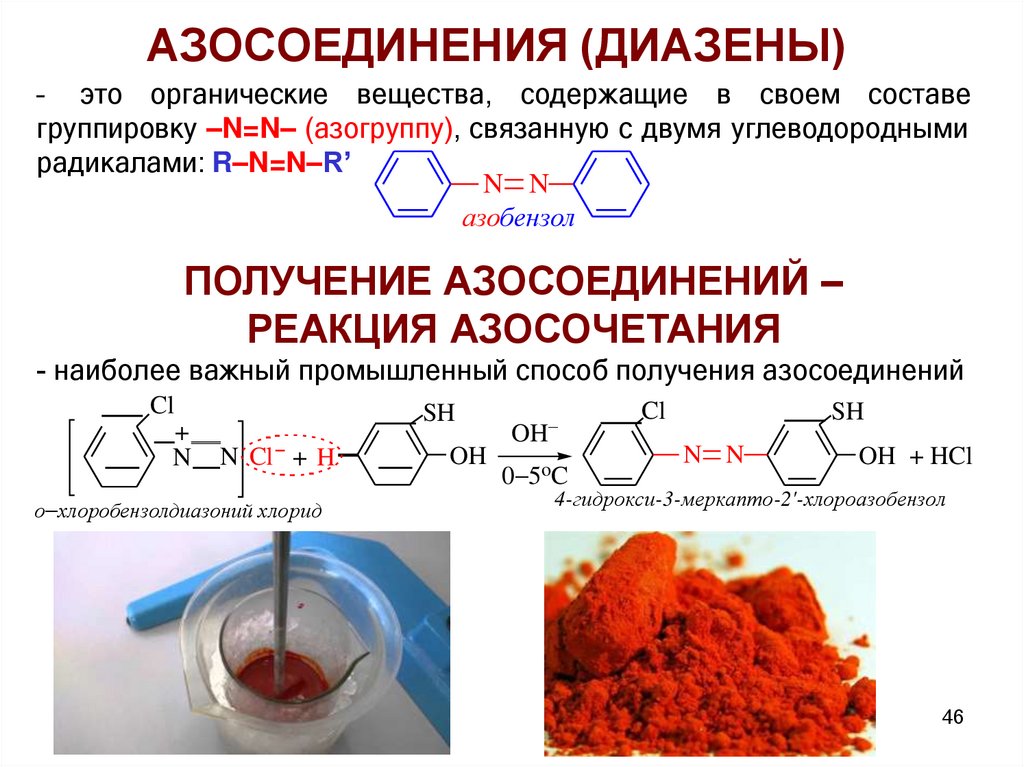




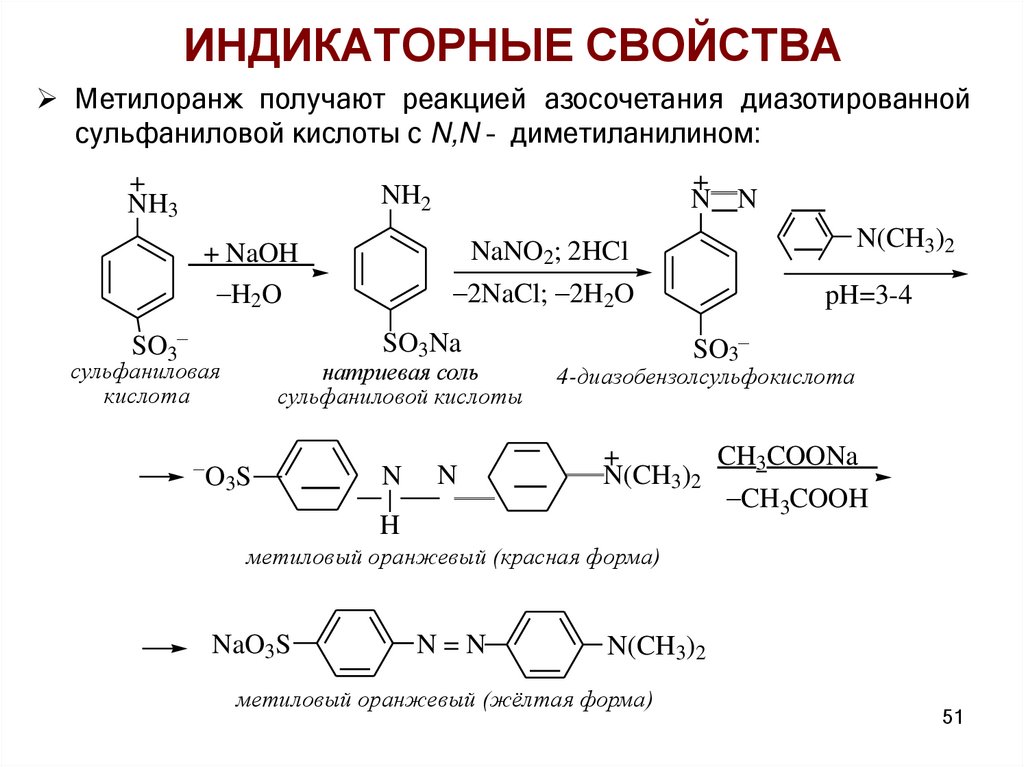
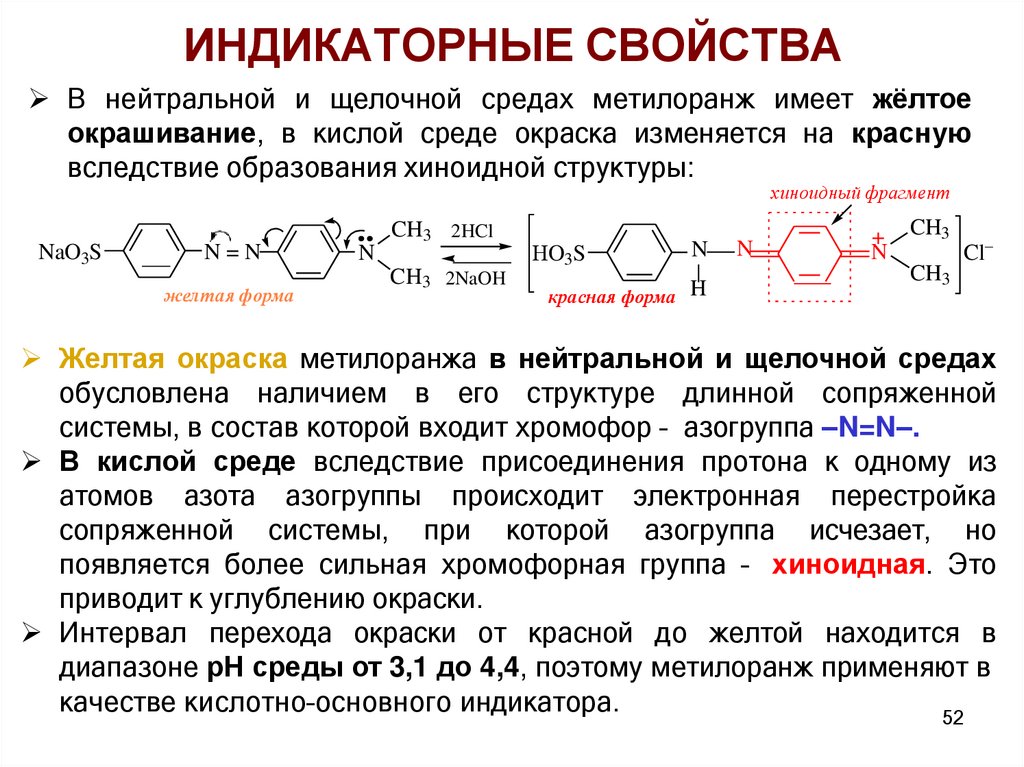

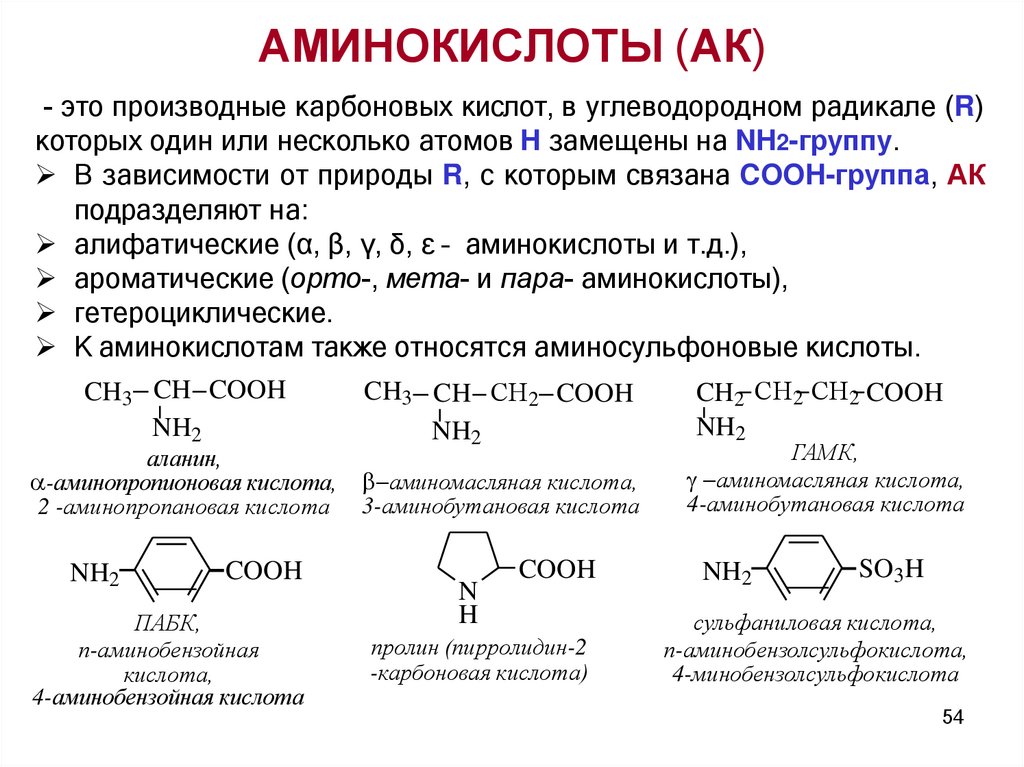


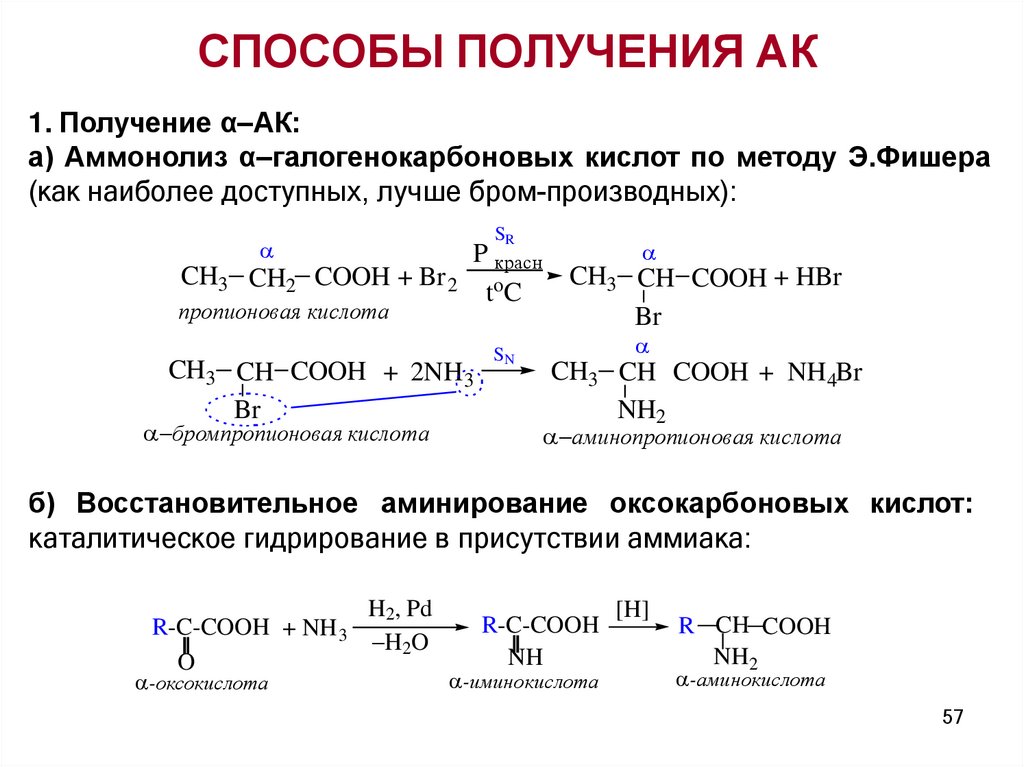


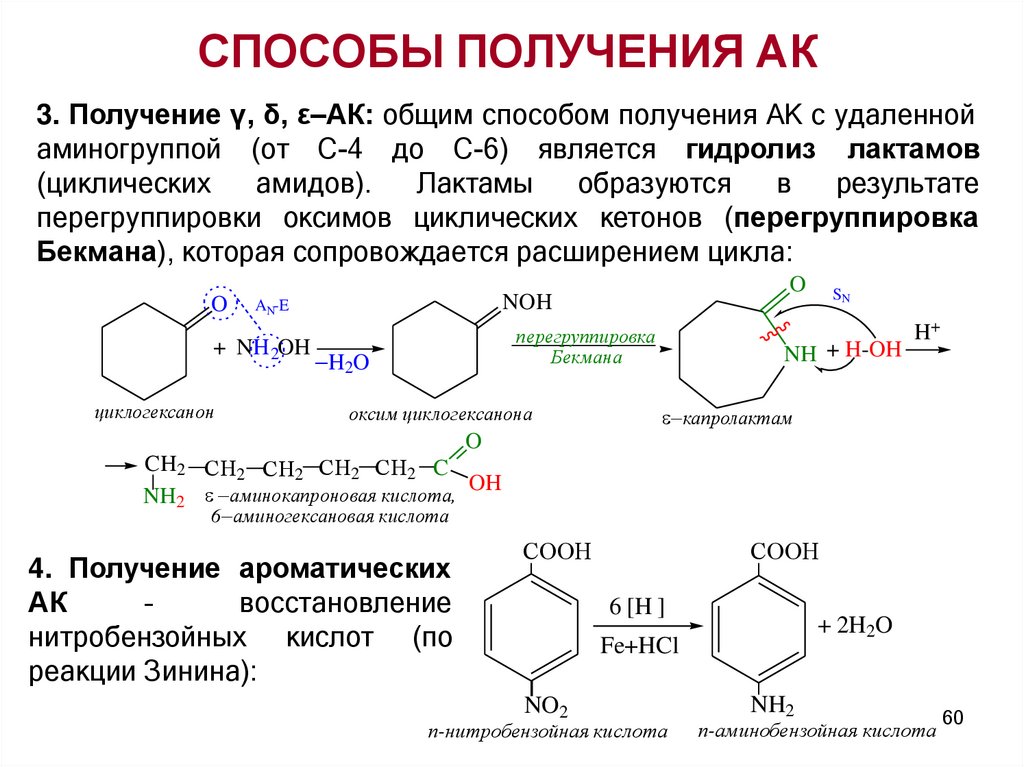



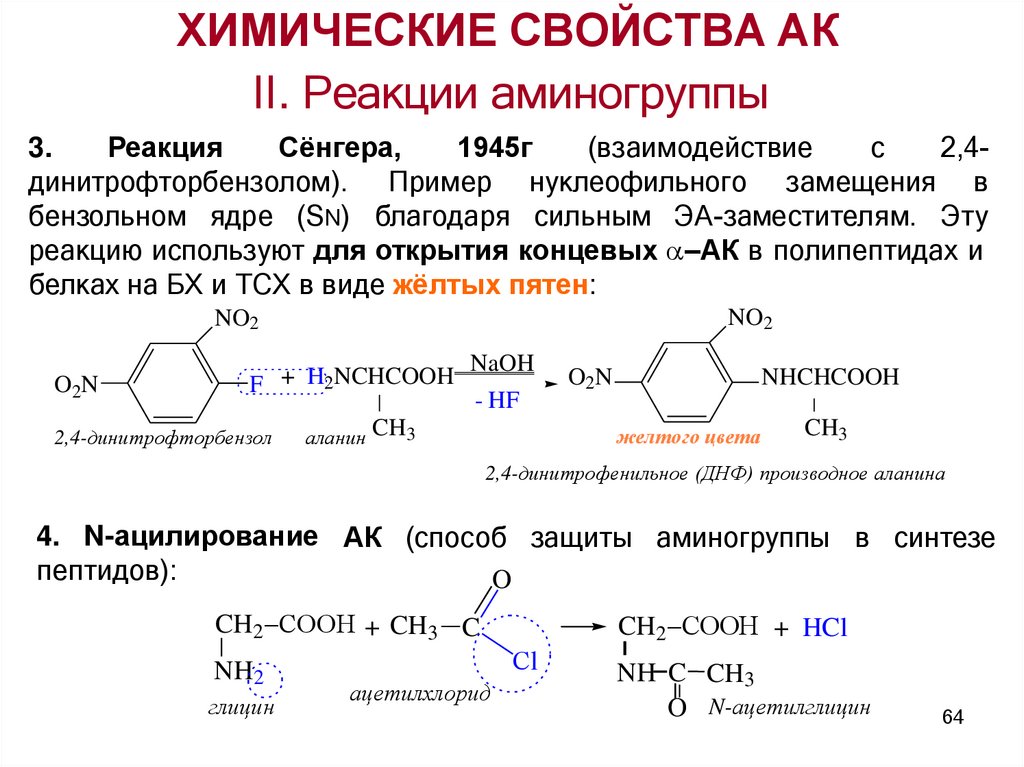



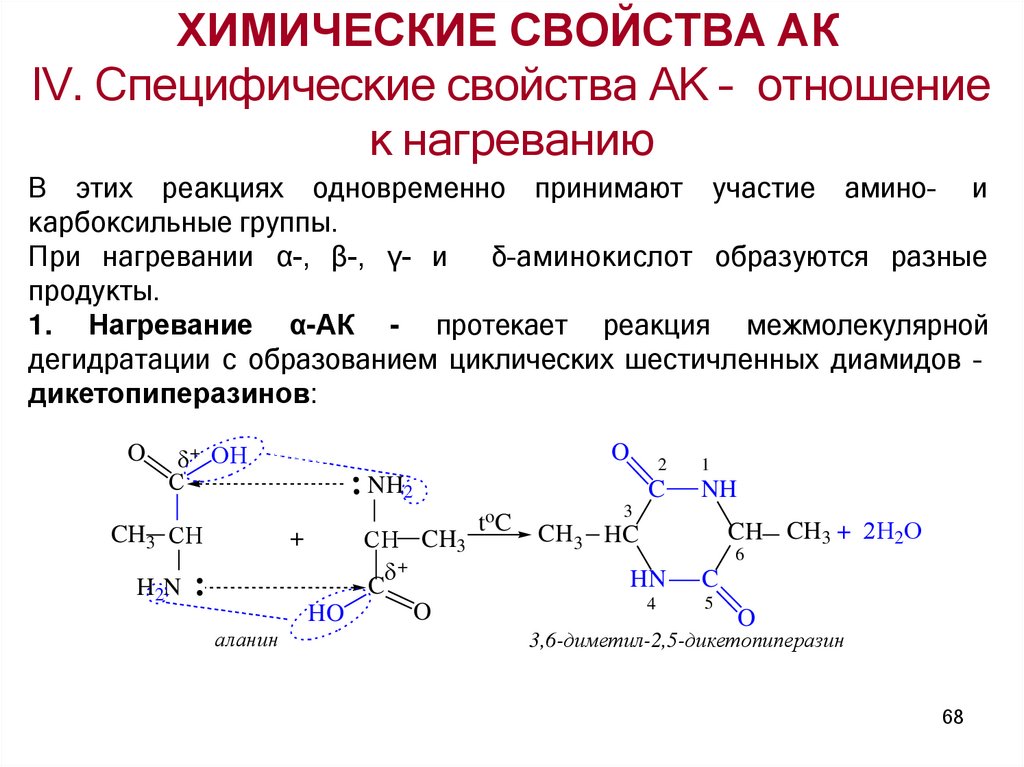
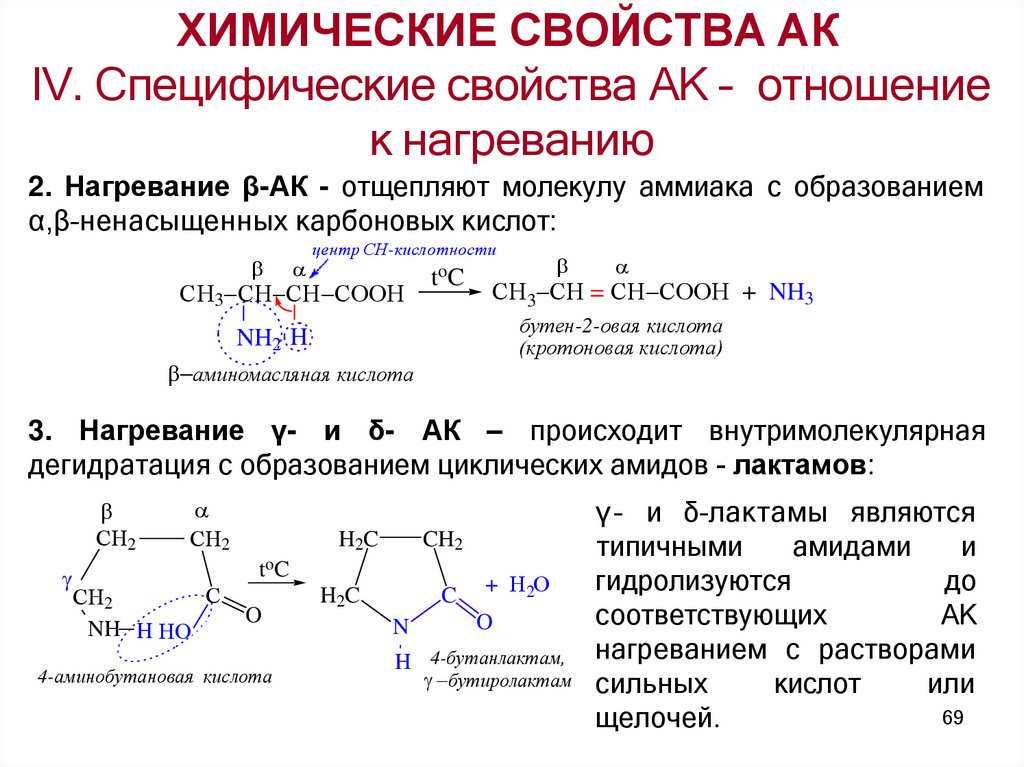
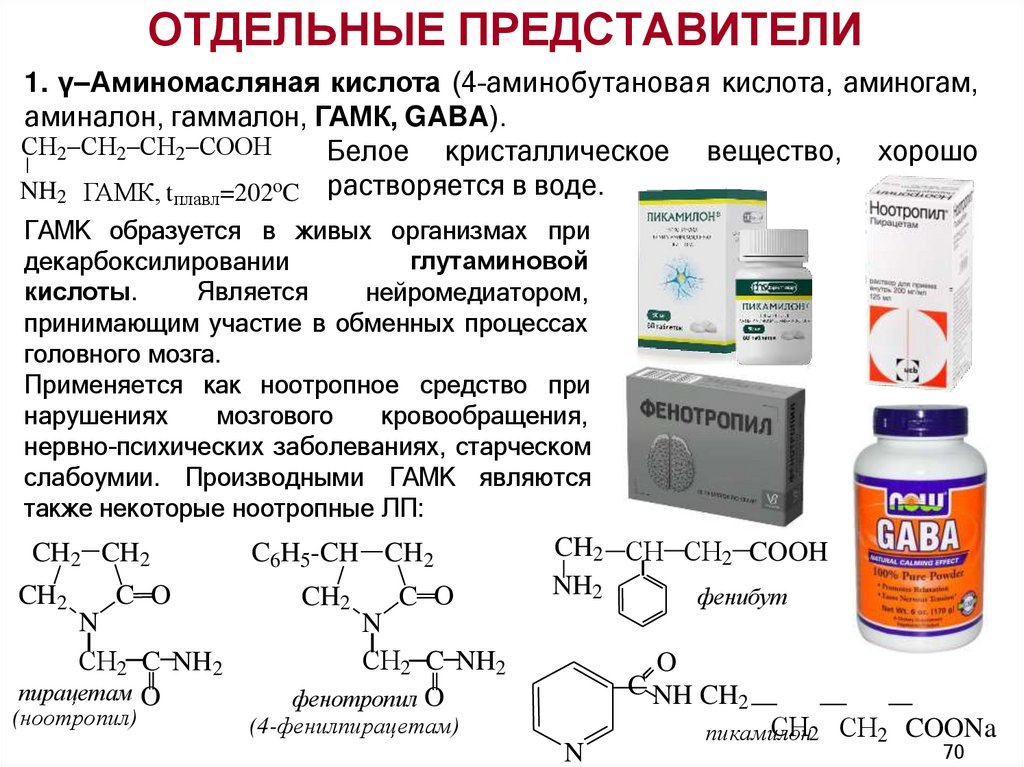

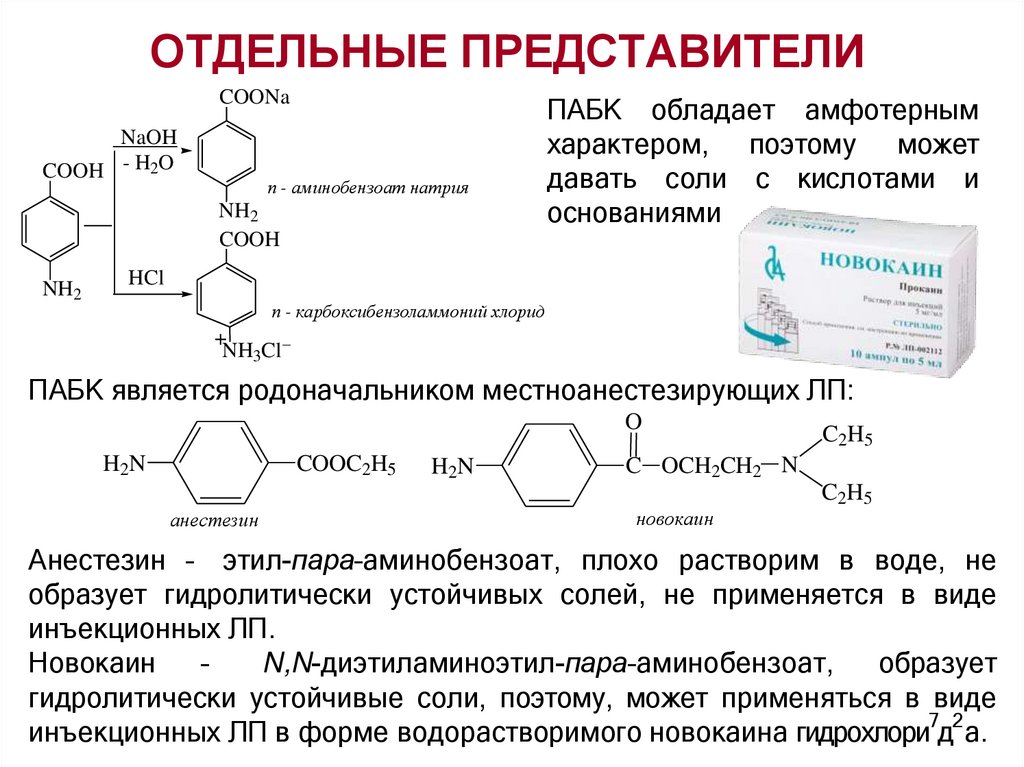



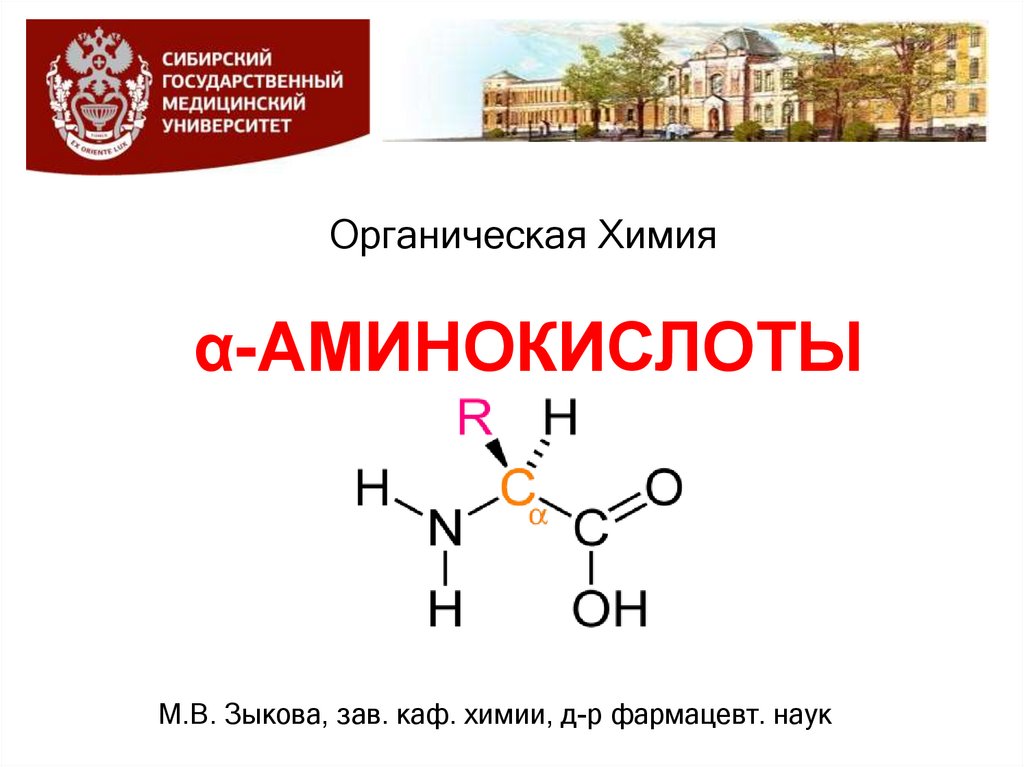




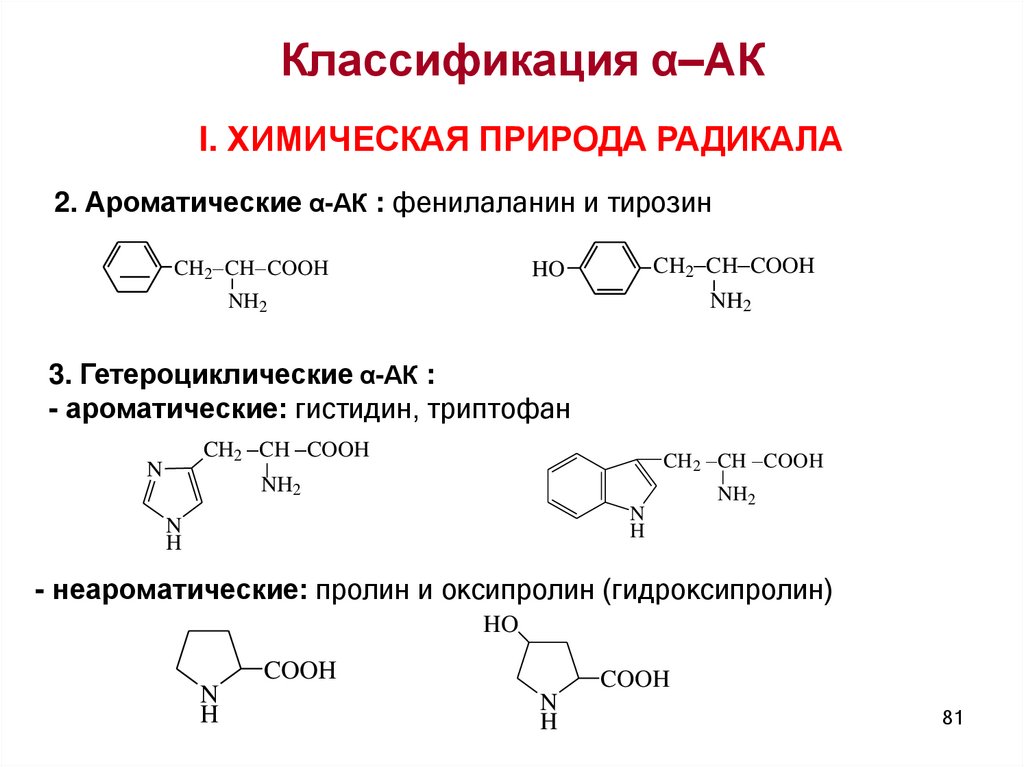

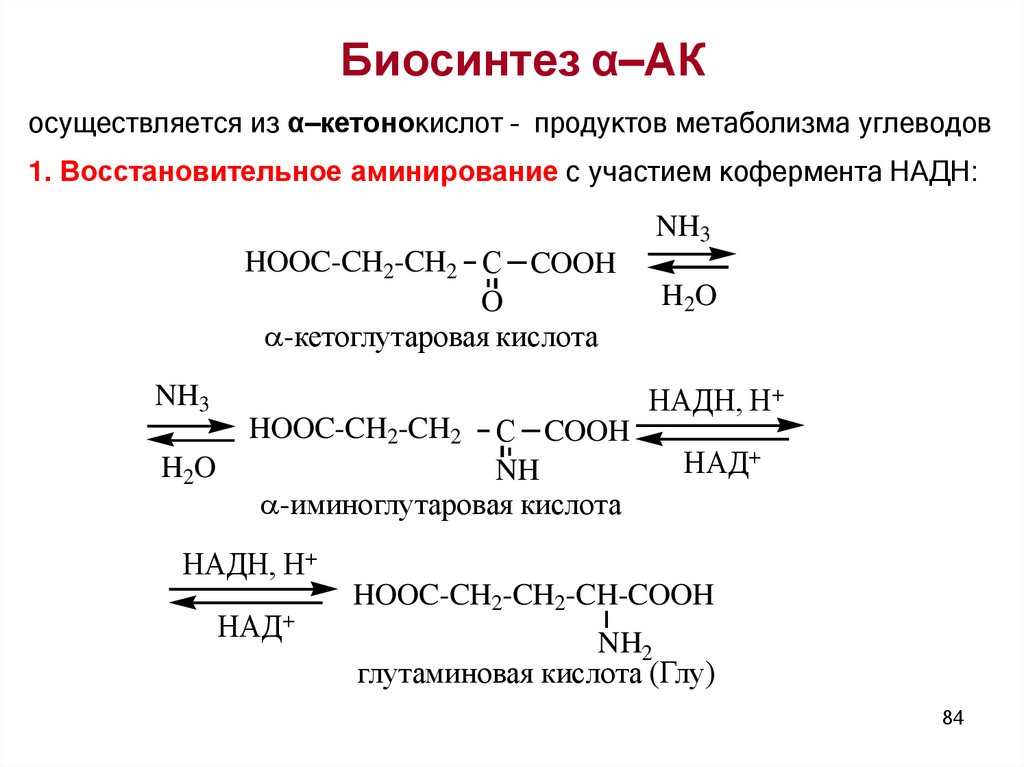

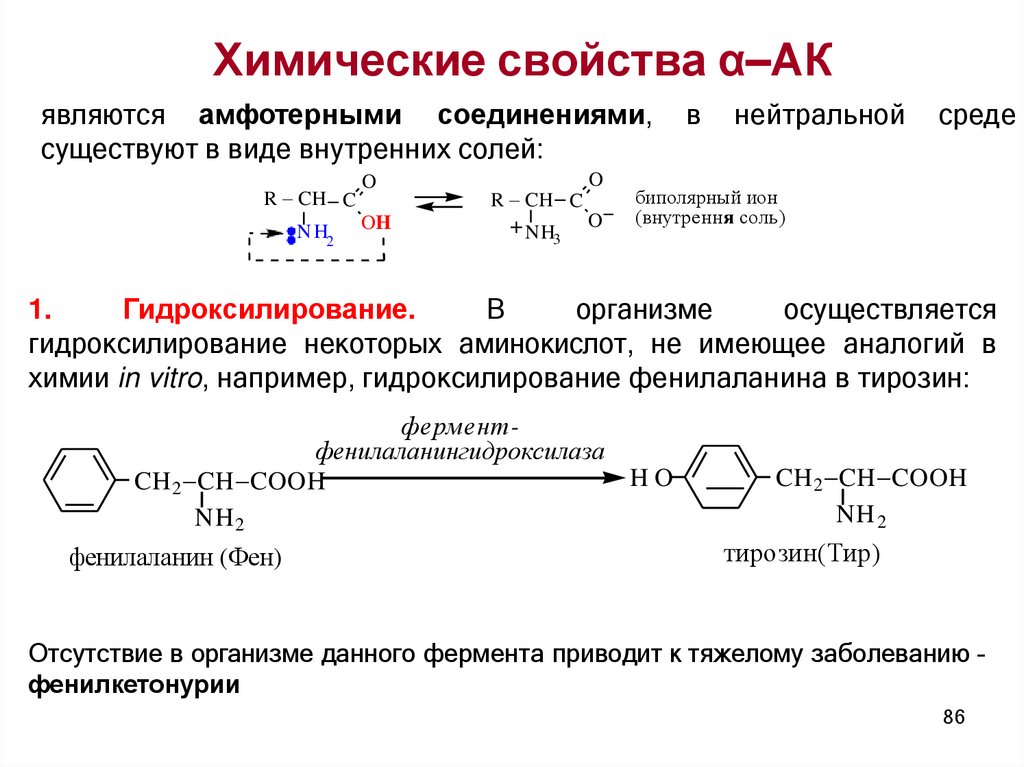



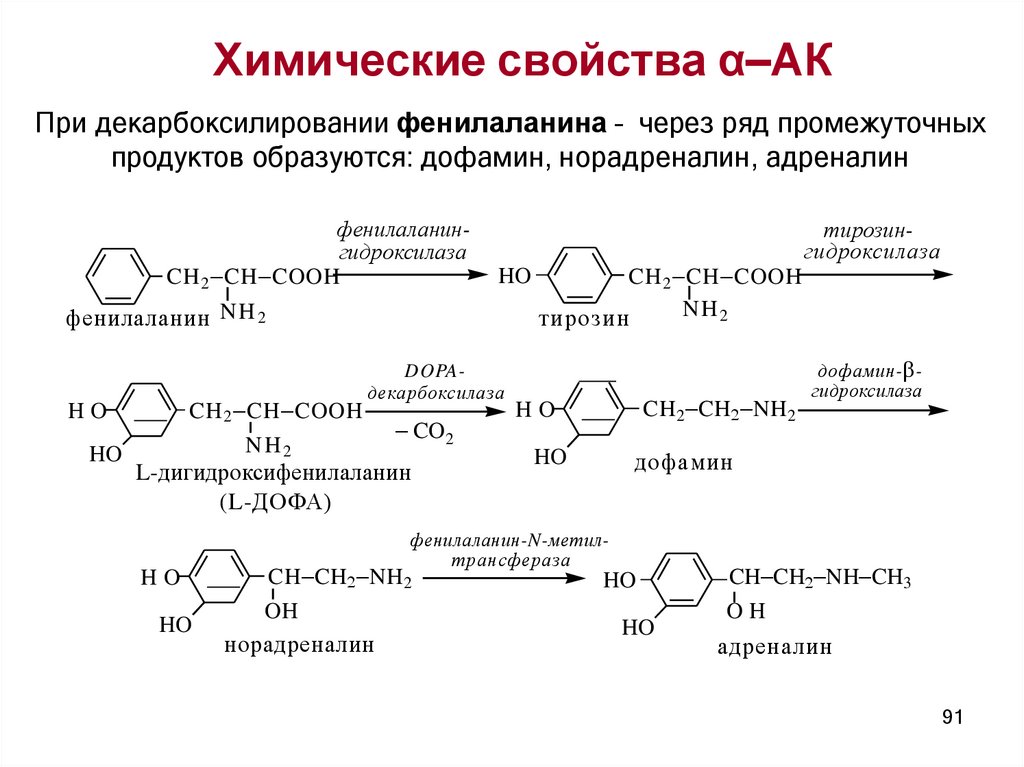

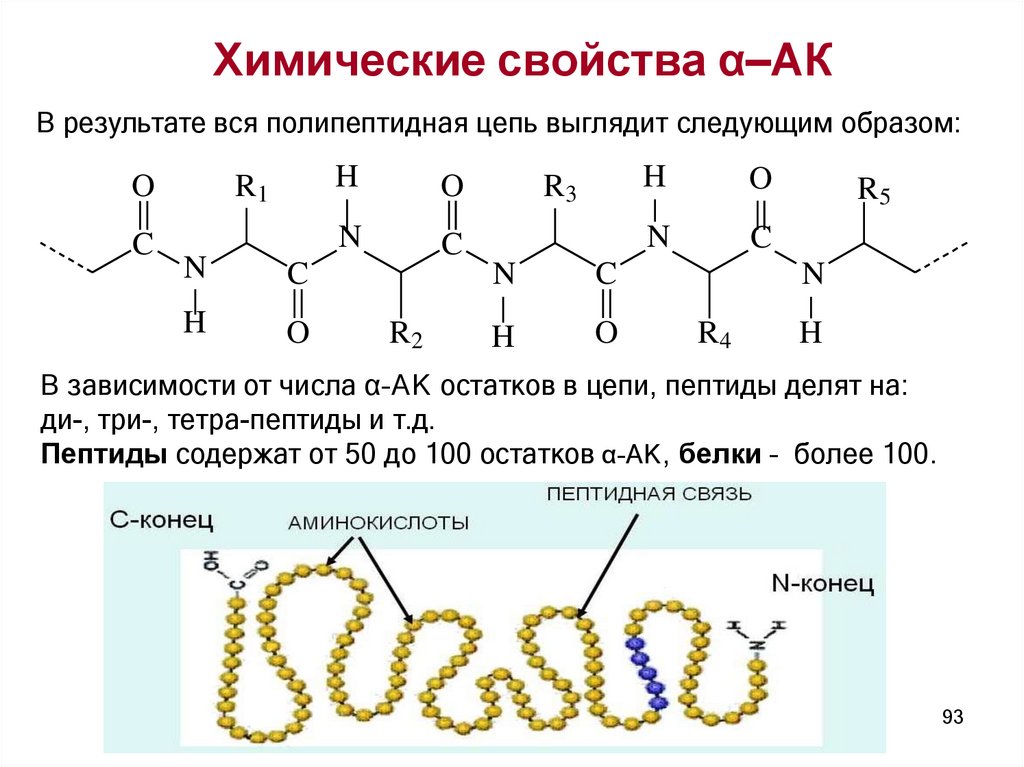
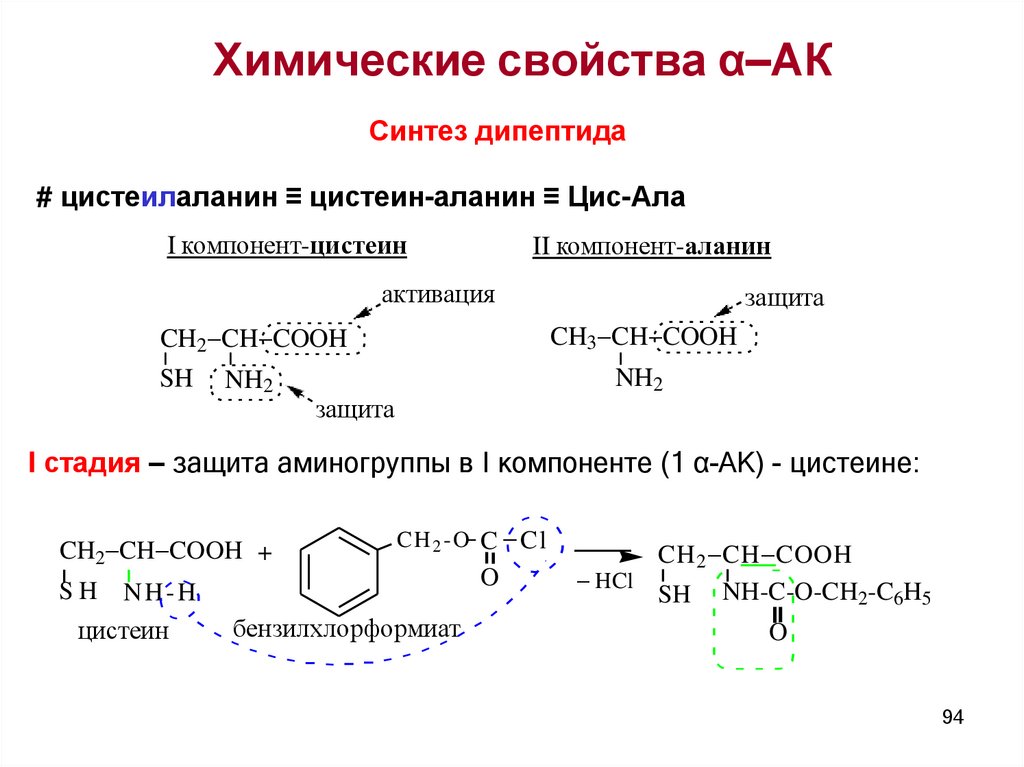
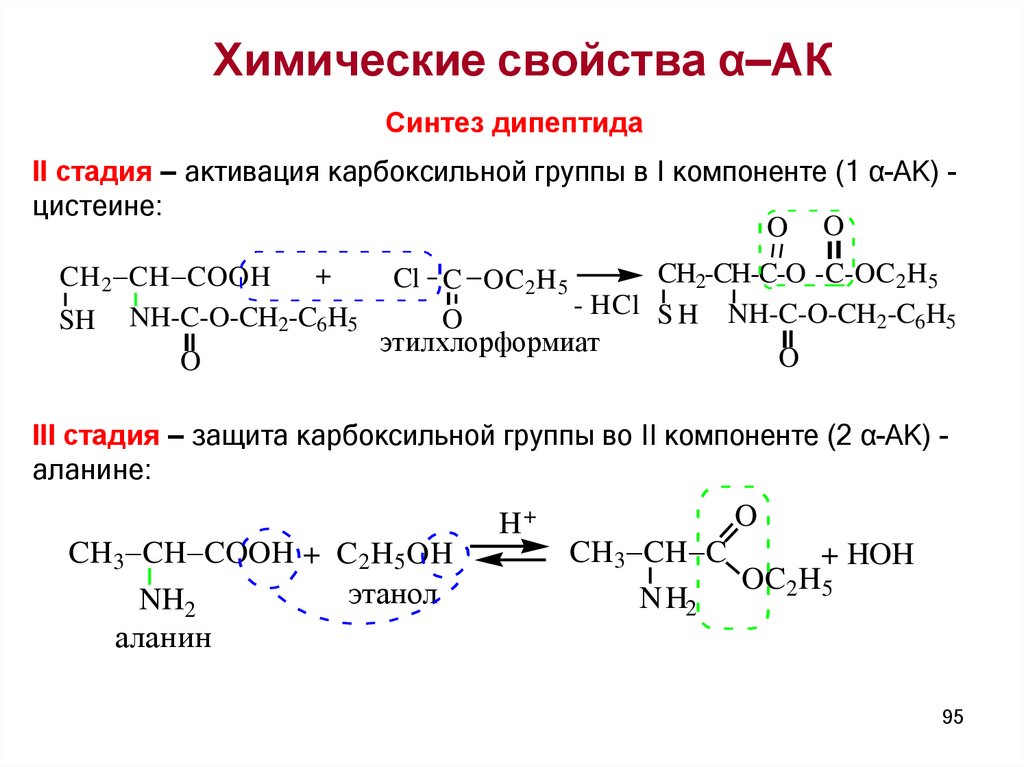
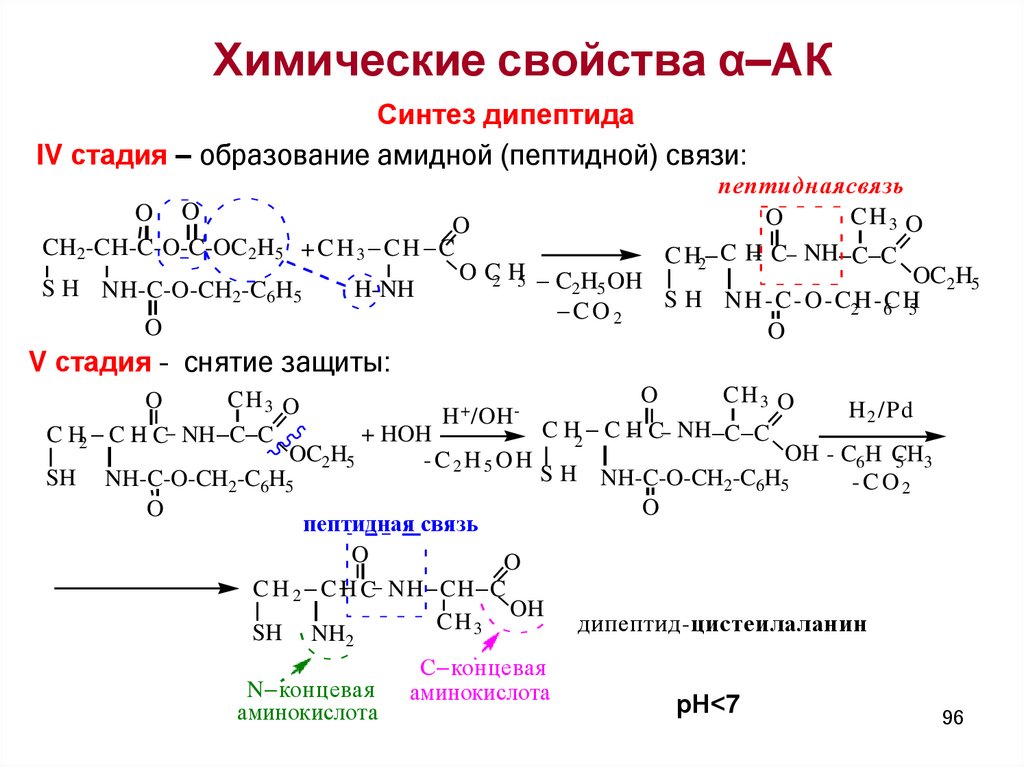

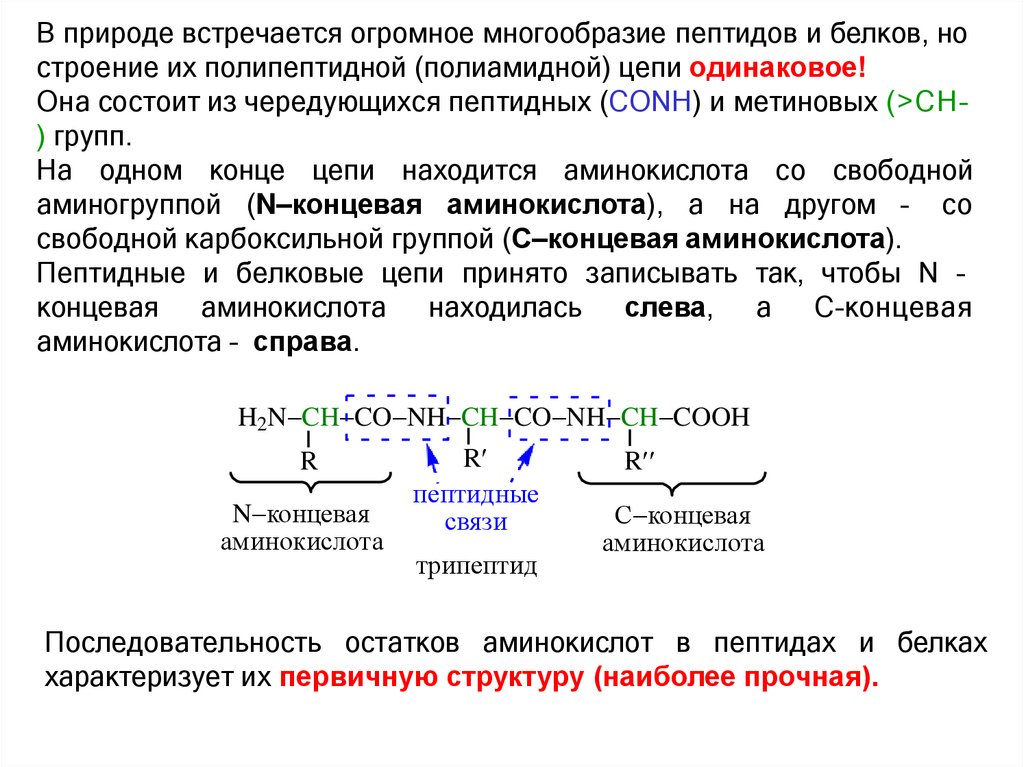

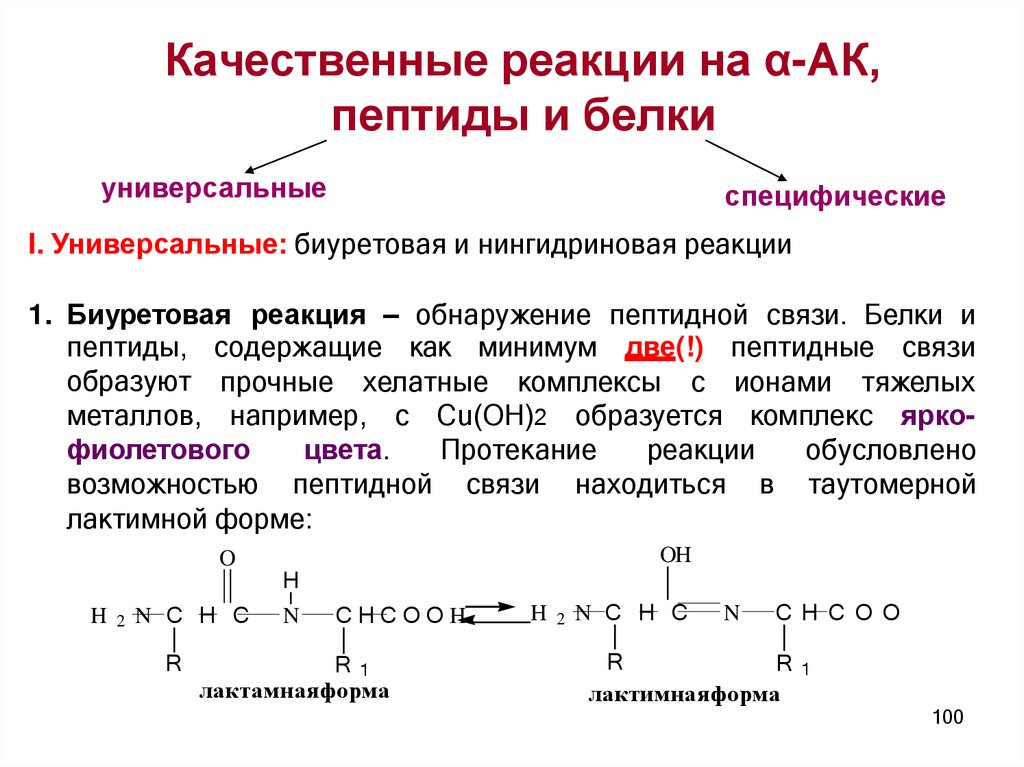
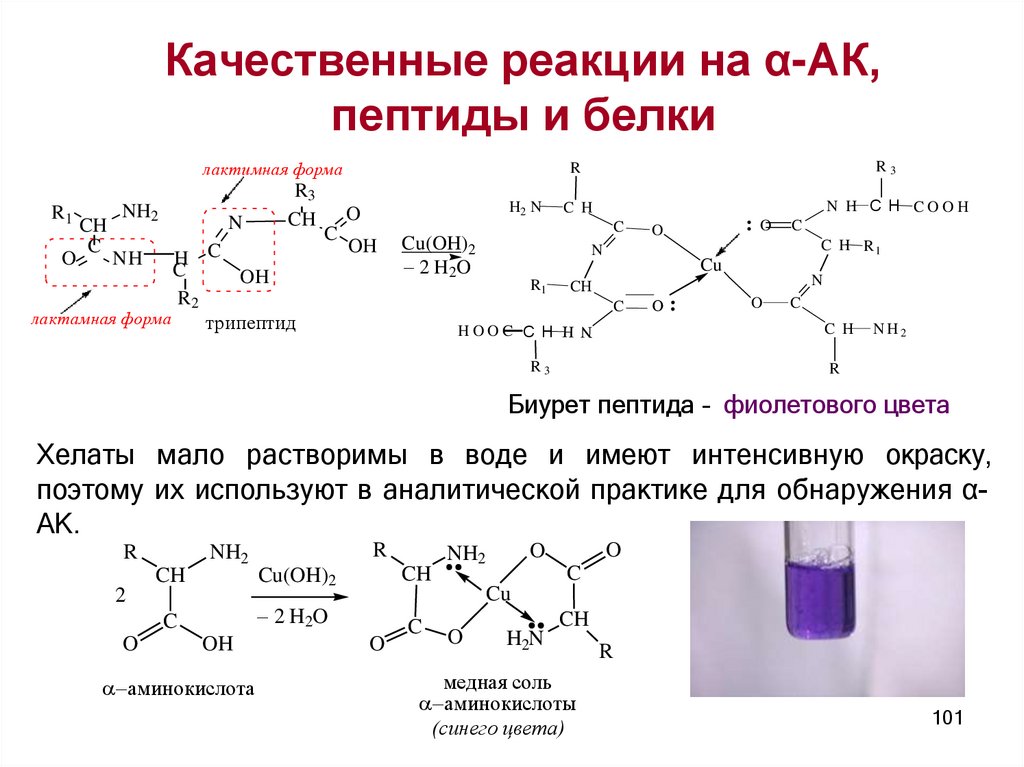
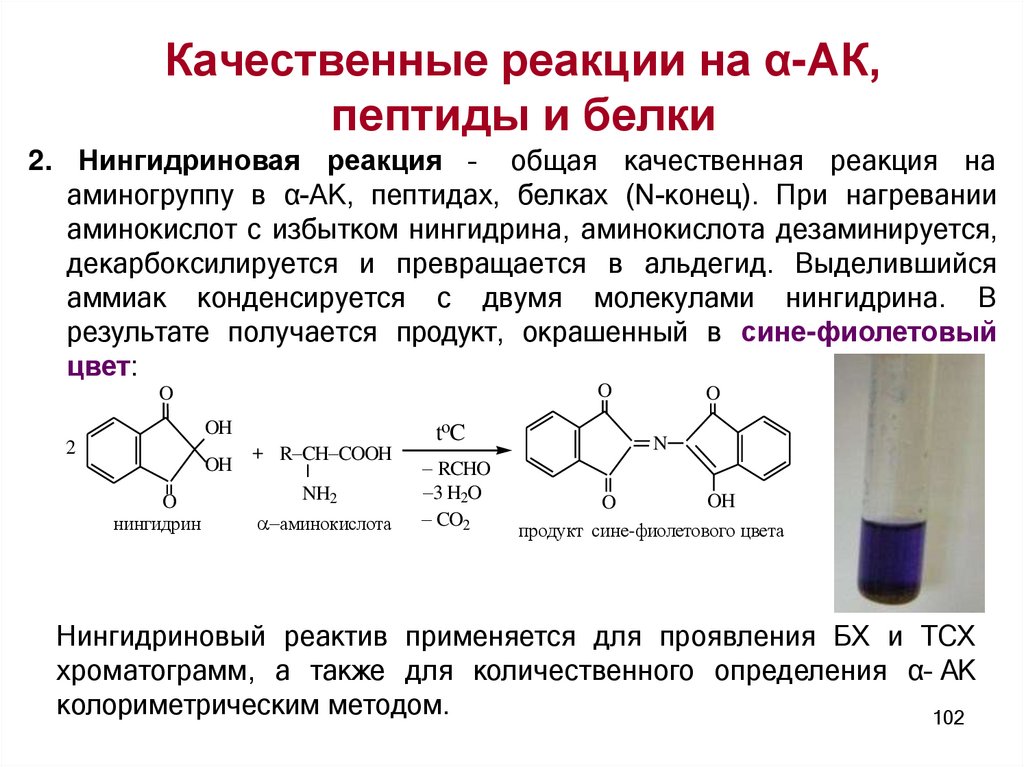
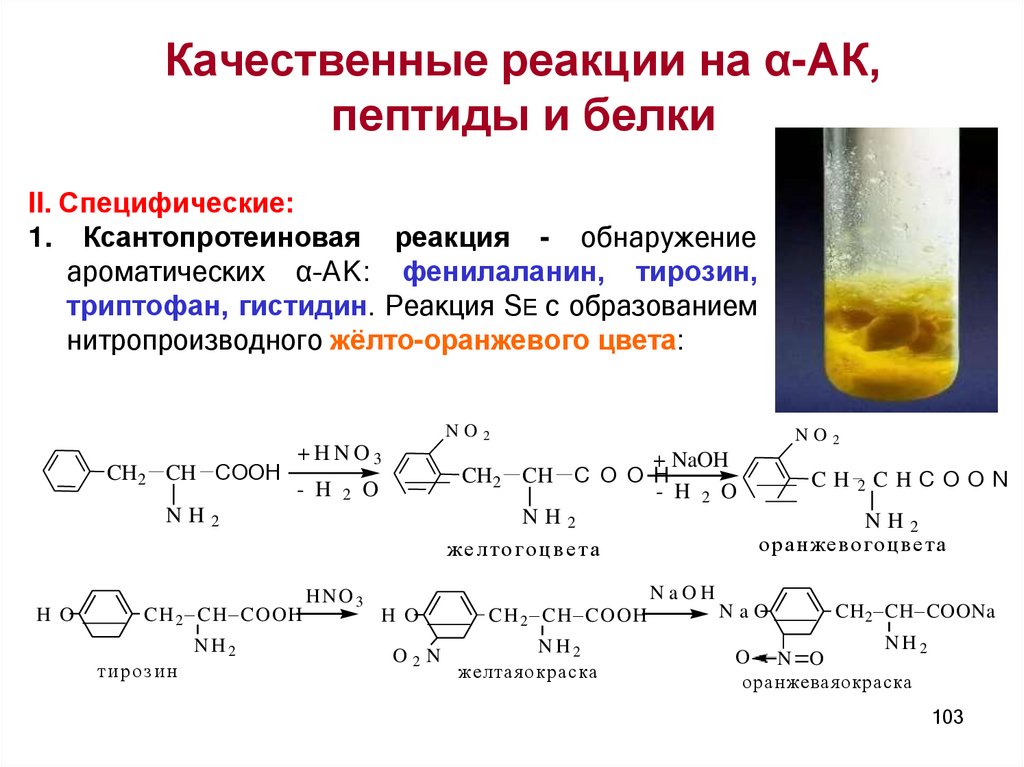
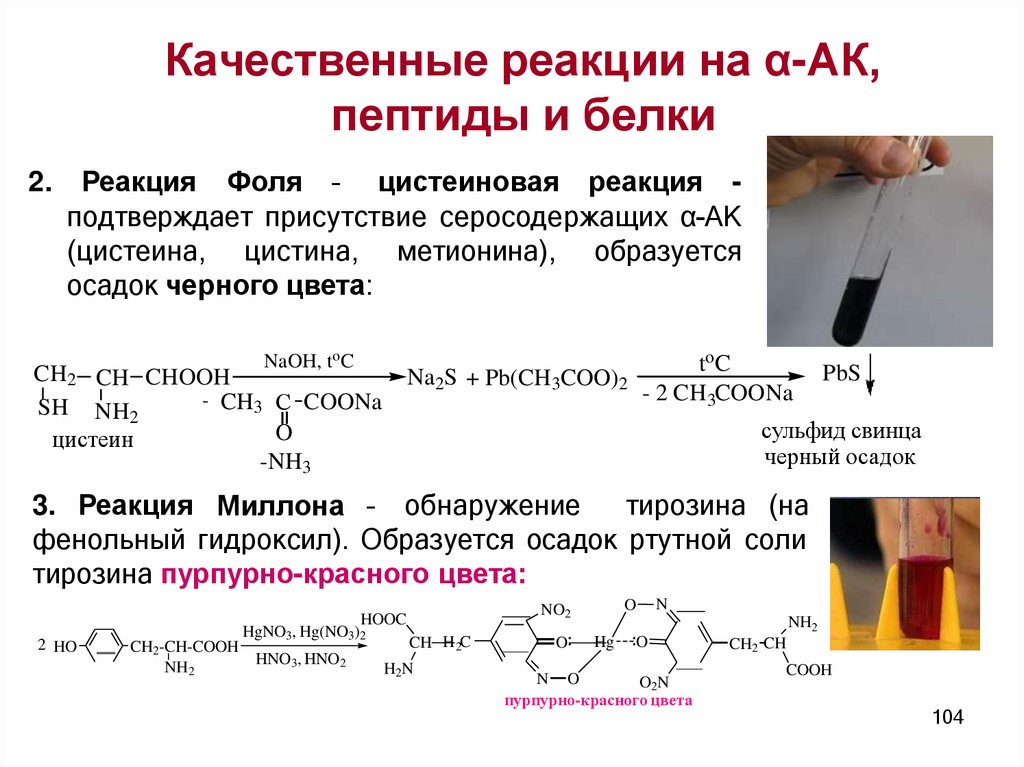
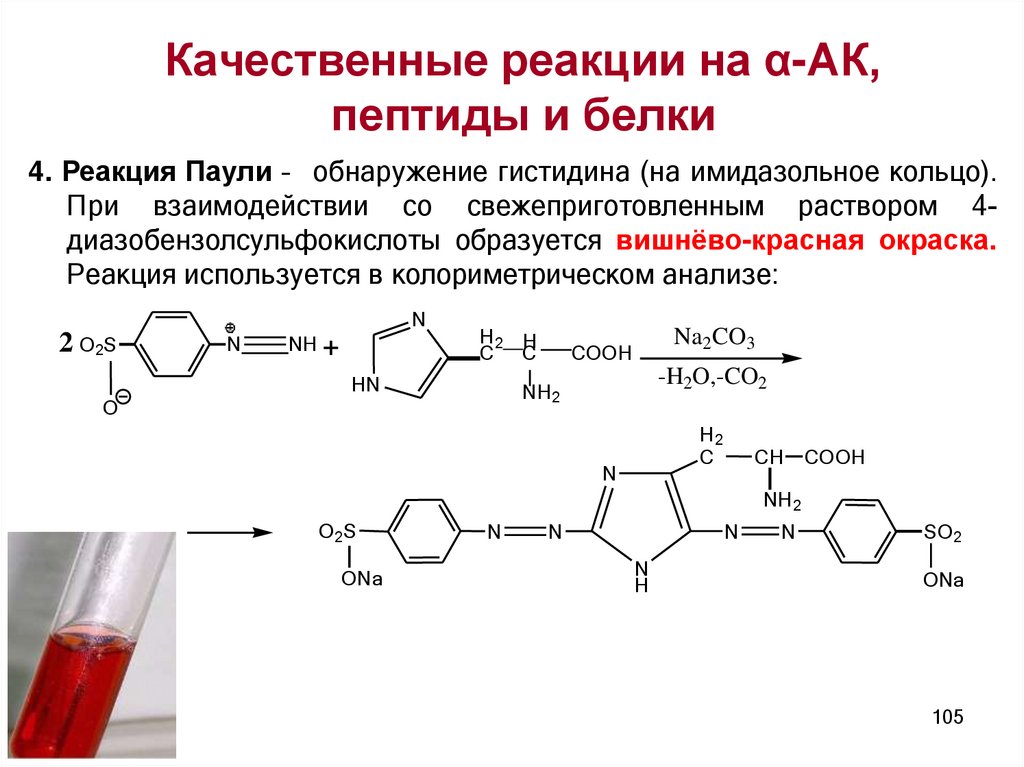
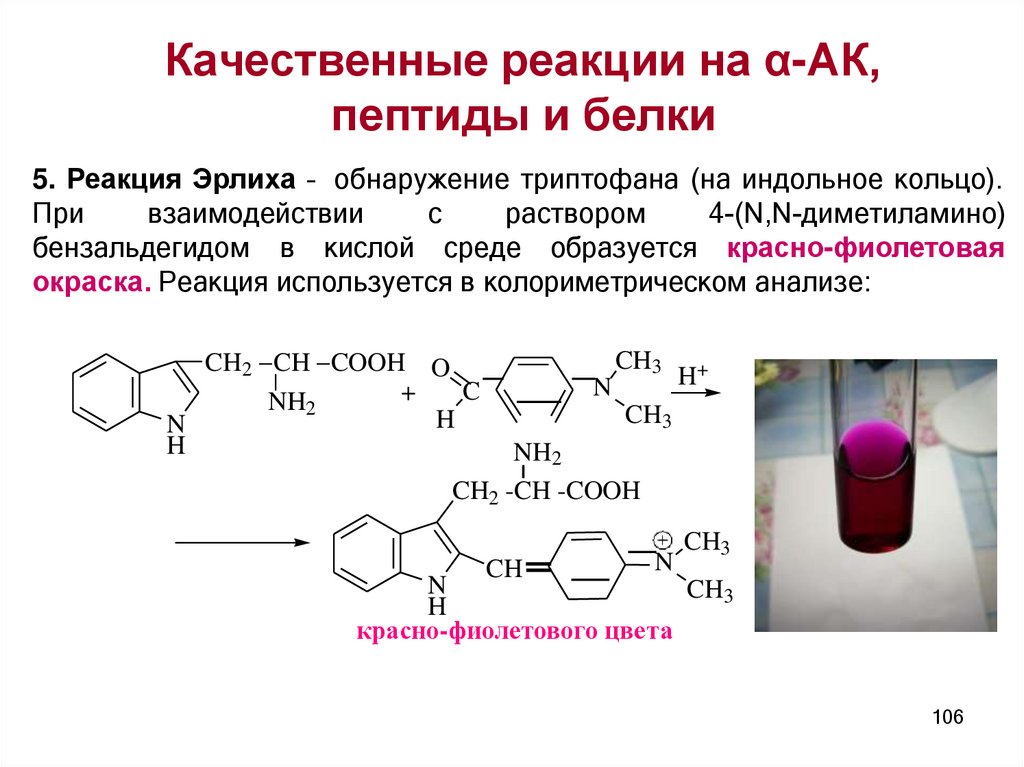
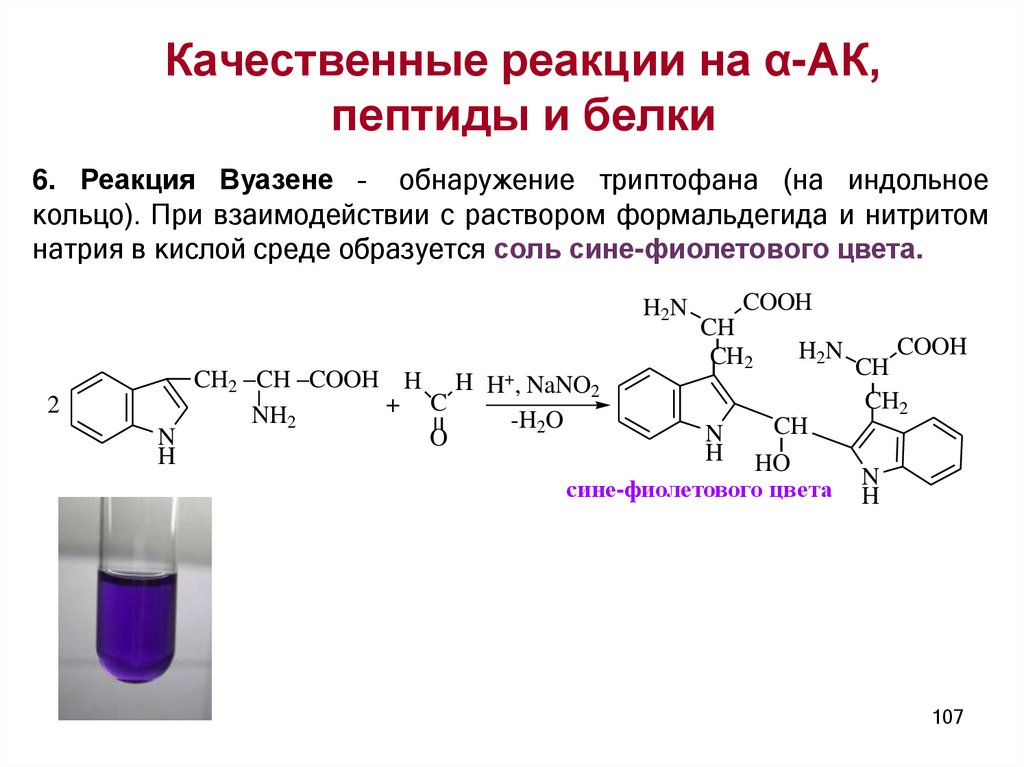
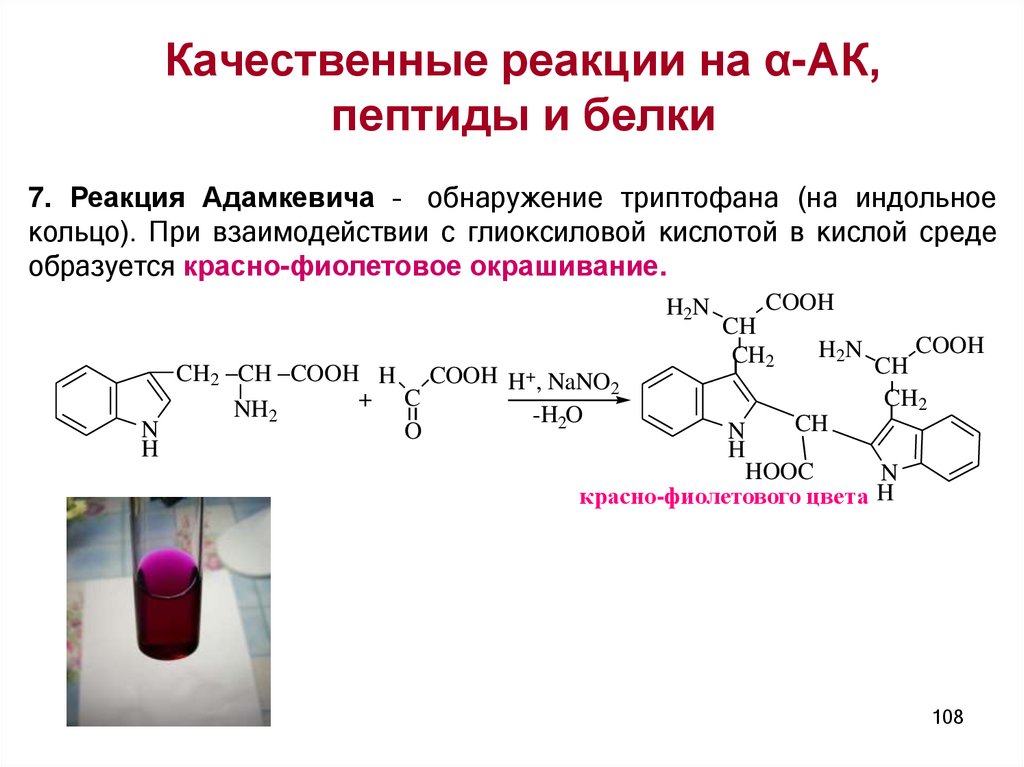
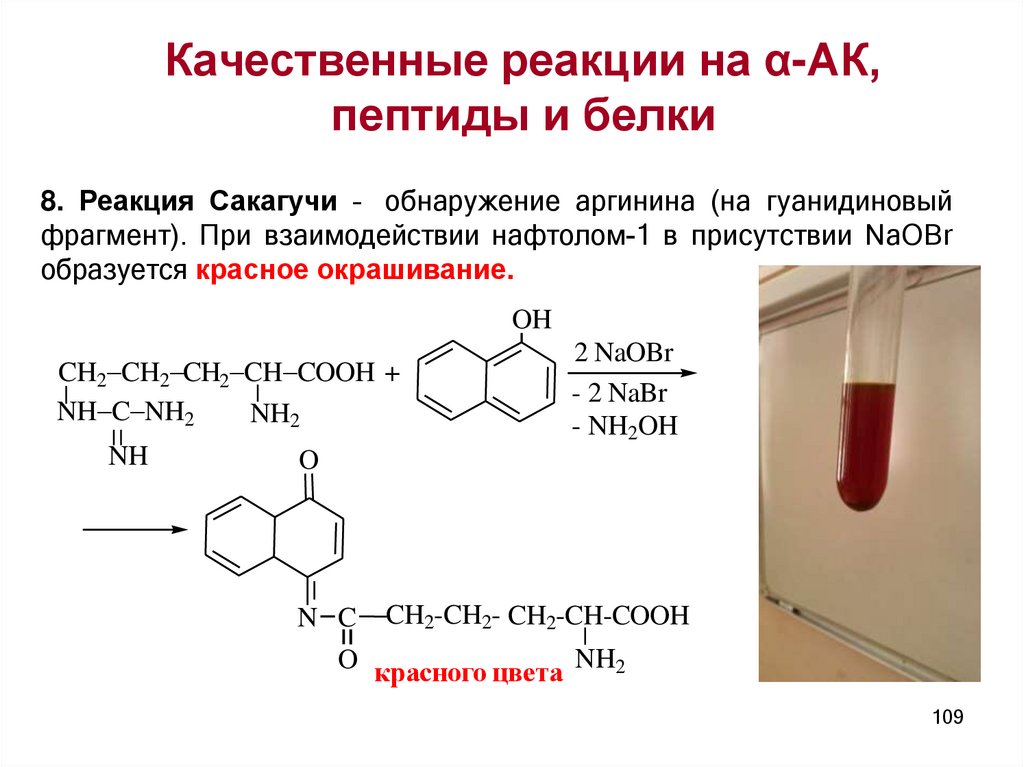



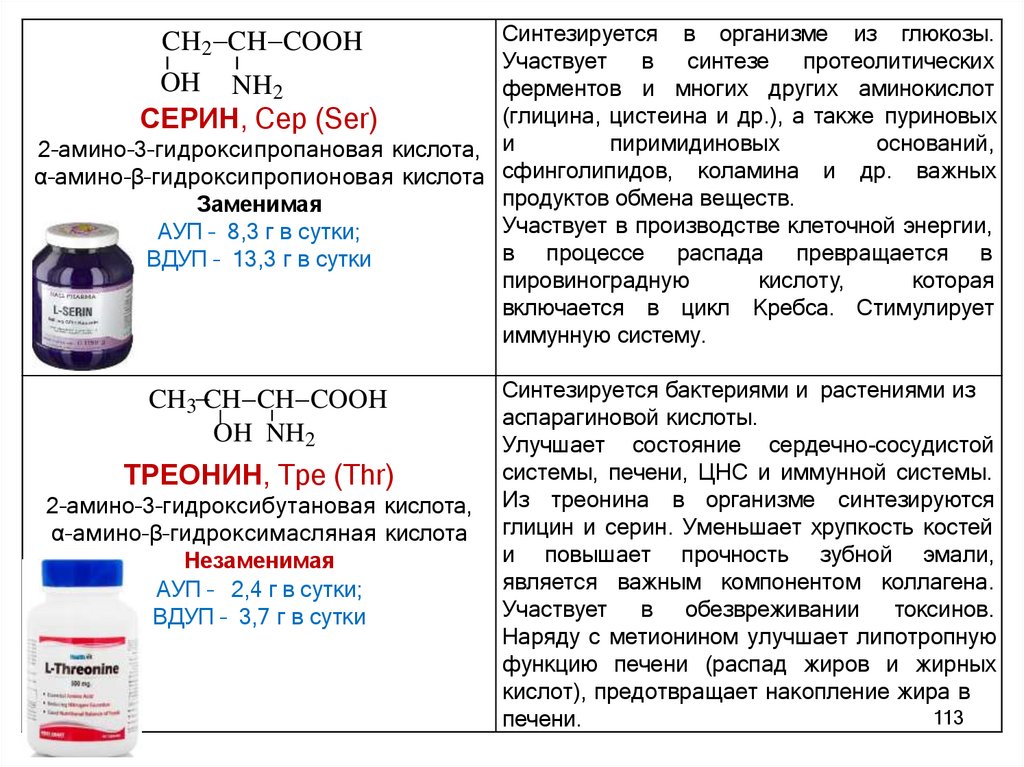

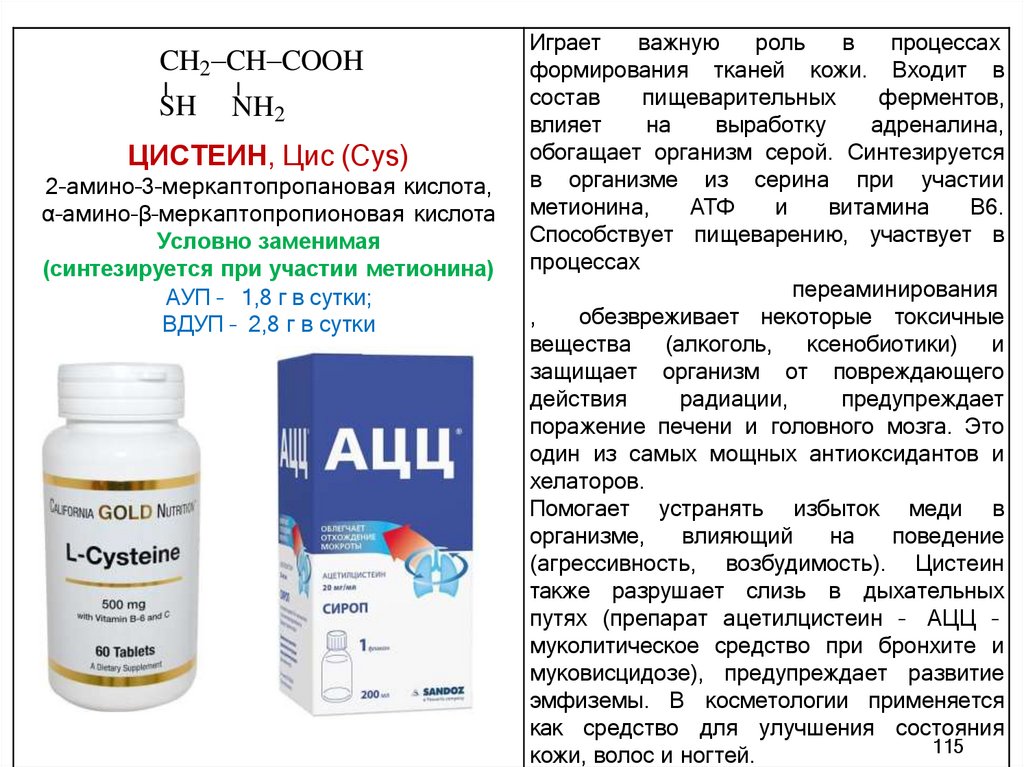








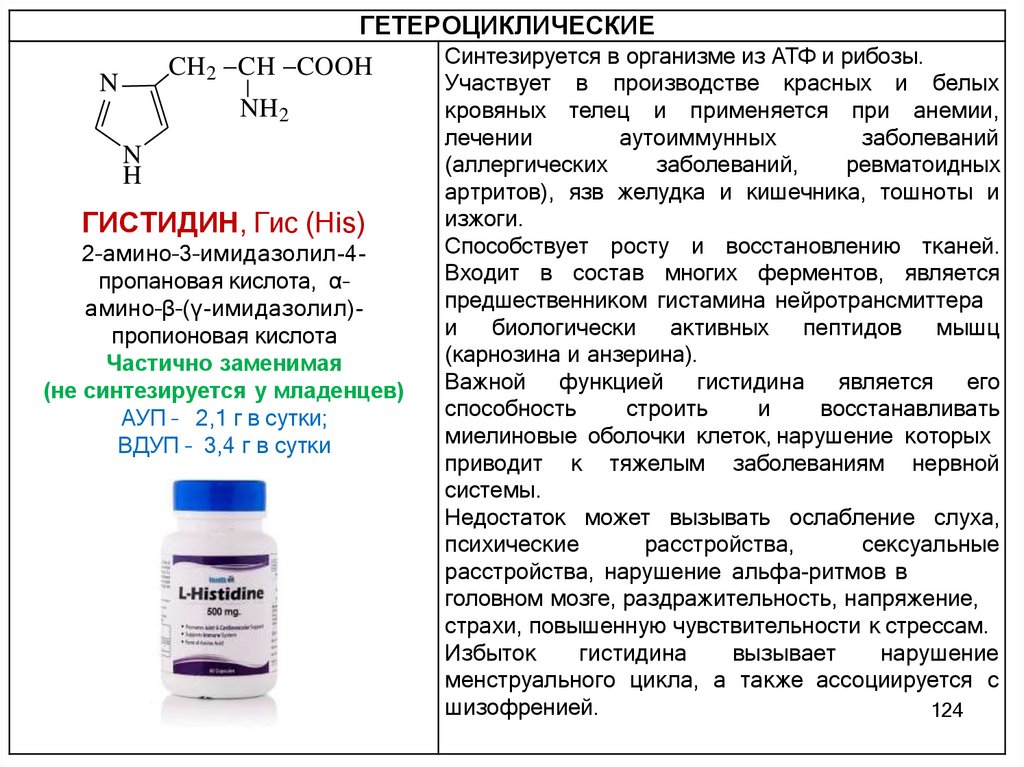

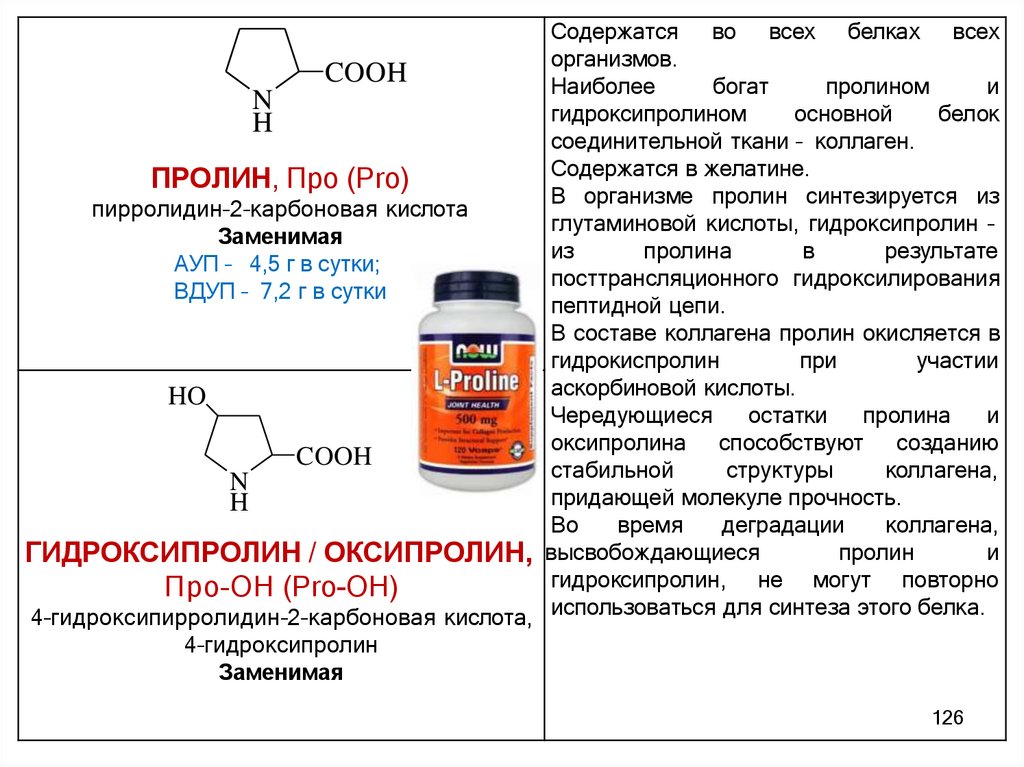

 chemistry
chemistry








