Similar presentations:
Амины. Аминокислоты
1.
2.
Амины – это производные аммиака, в молекуле которого один,два или три атома водорода замещены на углеводородный
радикал.
Наличие неподелённой пары электронов у атома азота объясняет общие
свойства аминов и аммиака
3.
Основные свойства:CH3-NH2 + HCl
(CH3-NH3)Cl
метиламин
хлорид метиламмония
CH3-NH2 + H2O
метиламин
(CH3-NH3)OH
гидроксид метиламмония
4.
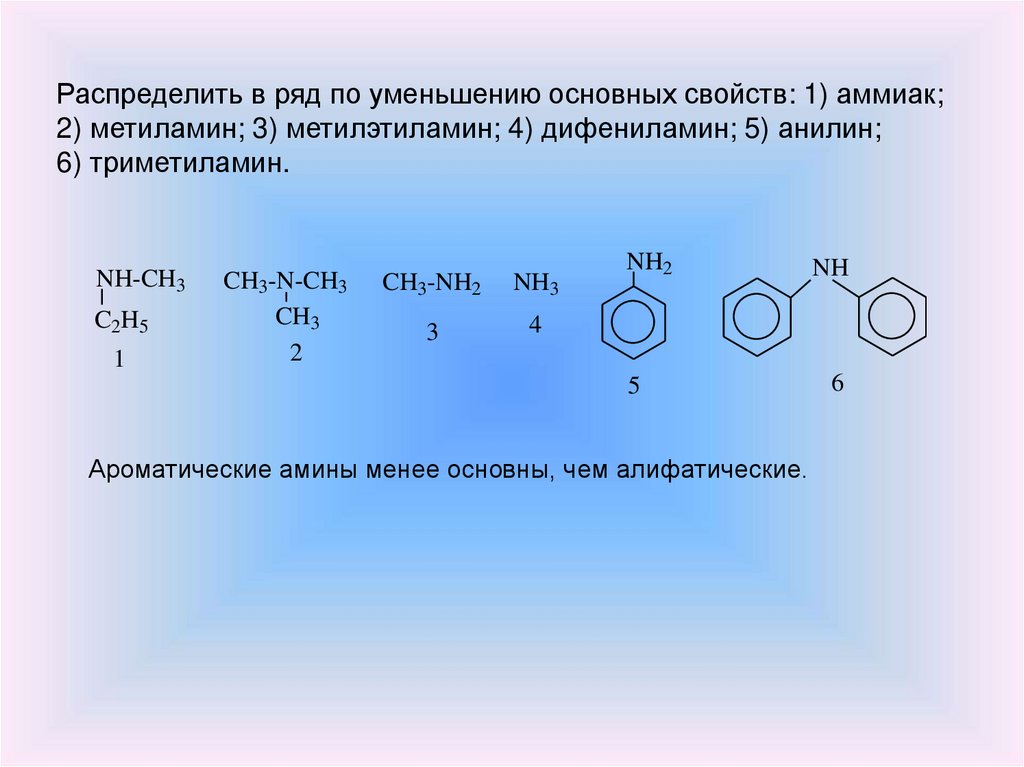
Распределить в ряд по уменьшению основных свойств: 1) аммиак;2) метиламин; 3) метилэтиламин; 4) дифениламин; 5) анилин;
6) триметиламин.
NH-CH3
C2H5
1
CH3-N-CH3
CH3
2
CH3-NH2
NH3
3
4
NH2
NH
5
6
Ароматические амины менее основны, чем алифатические.
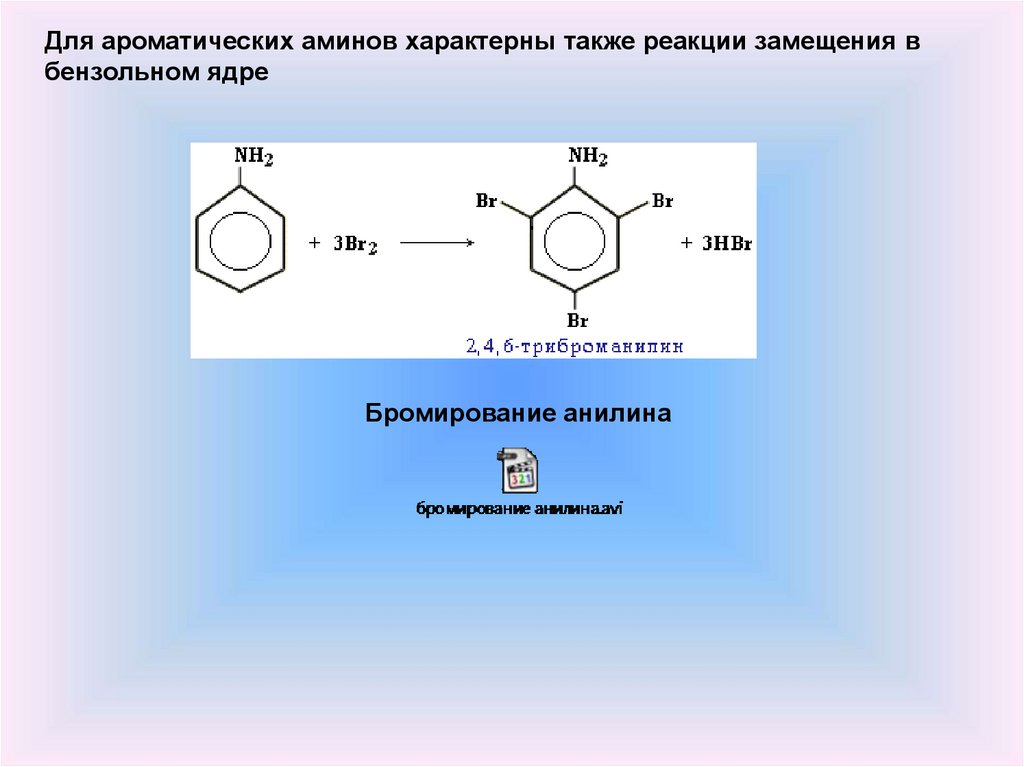
5.
Для ароматических аминов характерны также реакции замещения вбензольном ядре
Бромирование анилина
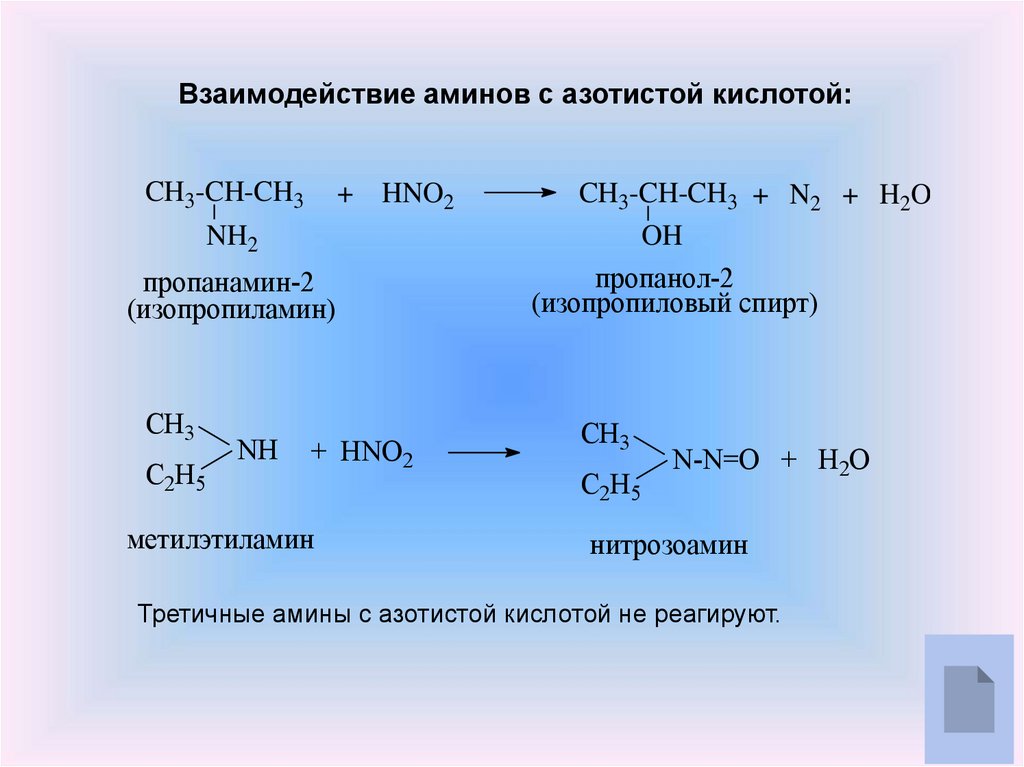
6.
Взаимодействие аминов с азотистой кислотой:CH3-CH-CH3
NH2
+ HNO2
пропанамин-2
(изопропиламин)
СН3
С2H5
NH
+ HNO2
метилэтиламин
CH3-CH-CH3 + N2 + H2O
OH
пропанол-2
(изопропиловый спирт)
СН3
С2H5
N-N=O + H2O
нитрозоамин
Третичные амины с азотистой кислотой не реагируют.
7.
Реакции алкилирования аминовЭтим способом получают из первичных аминов вторичные и
третичные, а из вторичных – третичные.
CH3NH2 + CH3Cl [(CH3)2NH2]+Cl–
метиламин
хлорид диметиламмония
NaOH
(CH3)2NH + NaCl
диметиламин
В избытке алкилгалогенида образуются третичные амины:
NaOH
CH3NH2 + 2C2H5Br
CH3N(C2H5)2 + 2NaBr
метиламин
метилдиэтиламин
8.
МОЧЕВИНАдиамид угольной кислоты
H 2N-C-NH2
O
Слабые основные свойства, реагирует с одним эквивалентом
кислоты:
+ -
H 2N-C-NH2 + HNO3
H 2N-C-NH3 NO3
O
O
Гидролиз мочевины:
H 2N-C-NH2 + H2O
O
H+
2NH3 + H2O + CO2
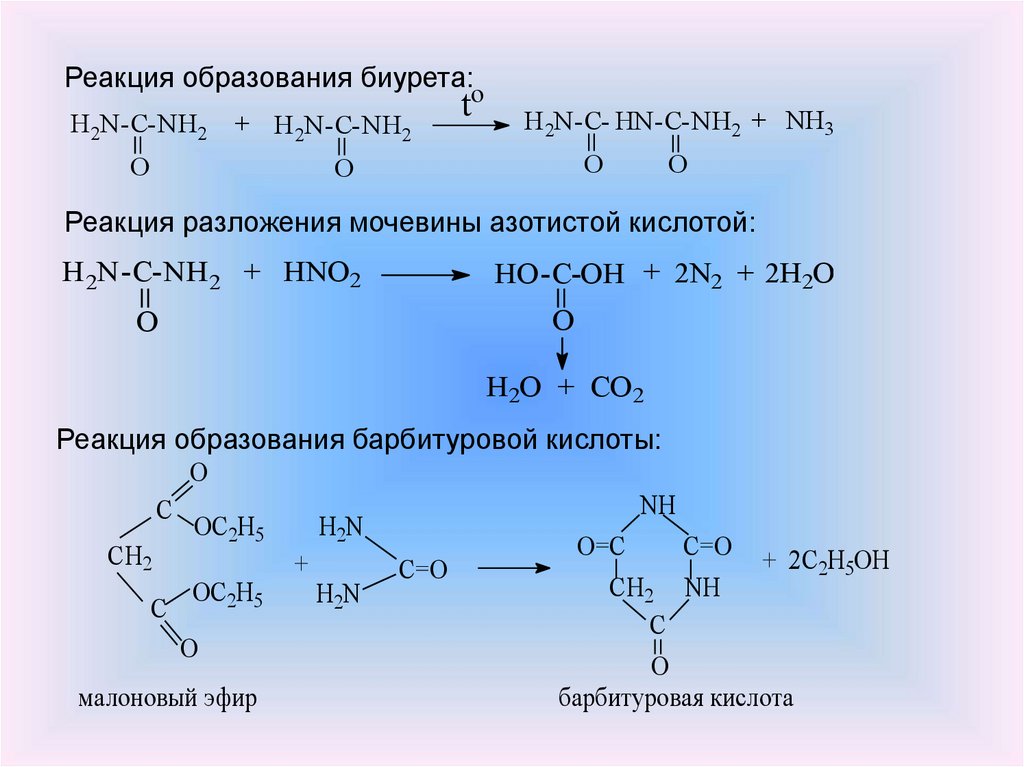
9.
Реакция образования биурета:H 2N-C-NH2
O
+ H 2N-C-NH2
to
H 2N-C- HN-C-NH2 + NH3
O
O
O
Реакция разложения мочевины азотистой кислотой:
H 2N-C-NH2 + HNO2
O
HO-C-OH + 2N2 + 2H2O
O
H2O + CO2
Реакция образования барбитуровой кислоты:
O
NH
C
OC2H5
H2N
O=C
C=O + 2C H OH
CH2
+
2 5
C=O
CH
NH
OC2H5
H2N
2
C
C
O
O
малоновый эфир
барбитуровая кислота
10.
Образование уреидокислот:СH3-C
O
+ Cl2
Pкр.
OH
O
CH2-C
+ HCl
OH
Cl
O
CH2-C
OH
Cl
+ H 2N- C-N H2
O
H 2N-C-NH-CH2-C
O
O
OH
+ HCl
уреидоуксусная кислота
Образование уреида кислоты:
СH3-C
O
OH
+ H 2N- C-N H2
O
СH3-C
O
HN- C-N H2
+ H2O
O
уреид уксусной кислоты
11.
12.
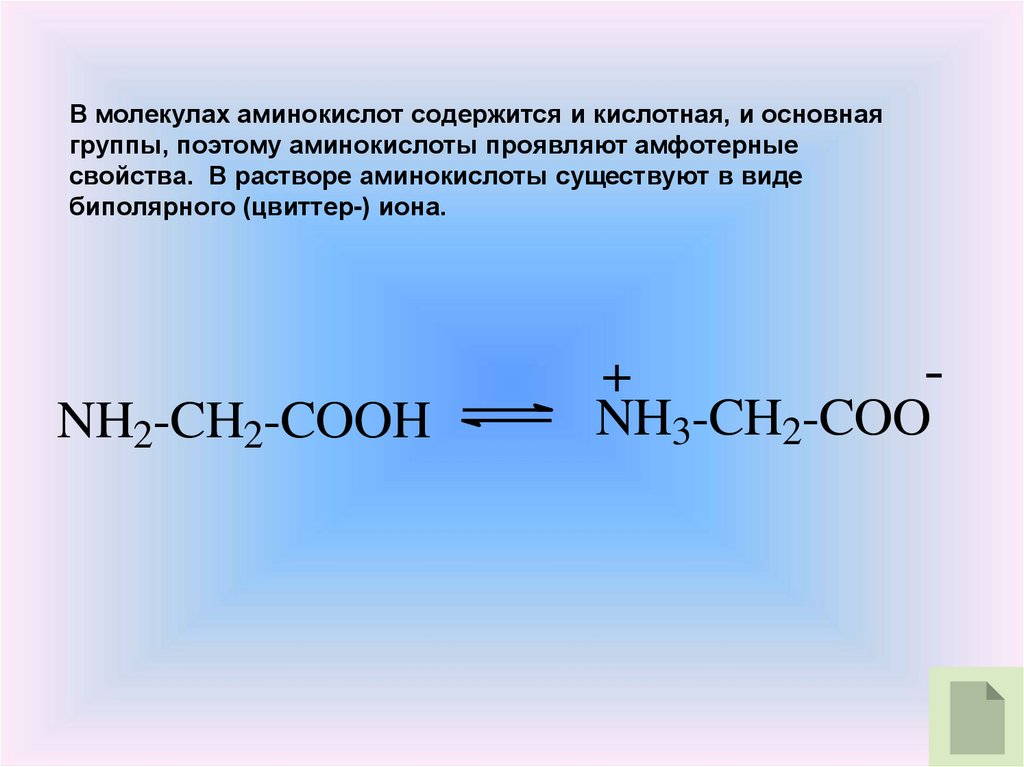
В молекулах аминокислот содержится и кислотная, и основнаягруппы, поэтому аминокислоты проявляют амфотерные
свойства. В растворе аминокислоты существуют в виде
биполярного (цвиттер-) иона.
NH2-CH2-COOH
+
NH3-CH2-COO
13.
Как карбоновые кислоты они образуют функциональныепроизводные:
а) соли
H2N–CH2–COOH + NaOH H2N–CH2–COO Na + H2O
б) сложные эфиры
H+
H2N–CH2–COOH + C2H5OH H2N–CH2–COOC2H5 + H2O
в) амиды
H2N–CH2COOH + NH3 H2N–CH2–CONH2 + H2O
14.
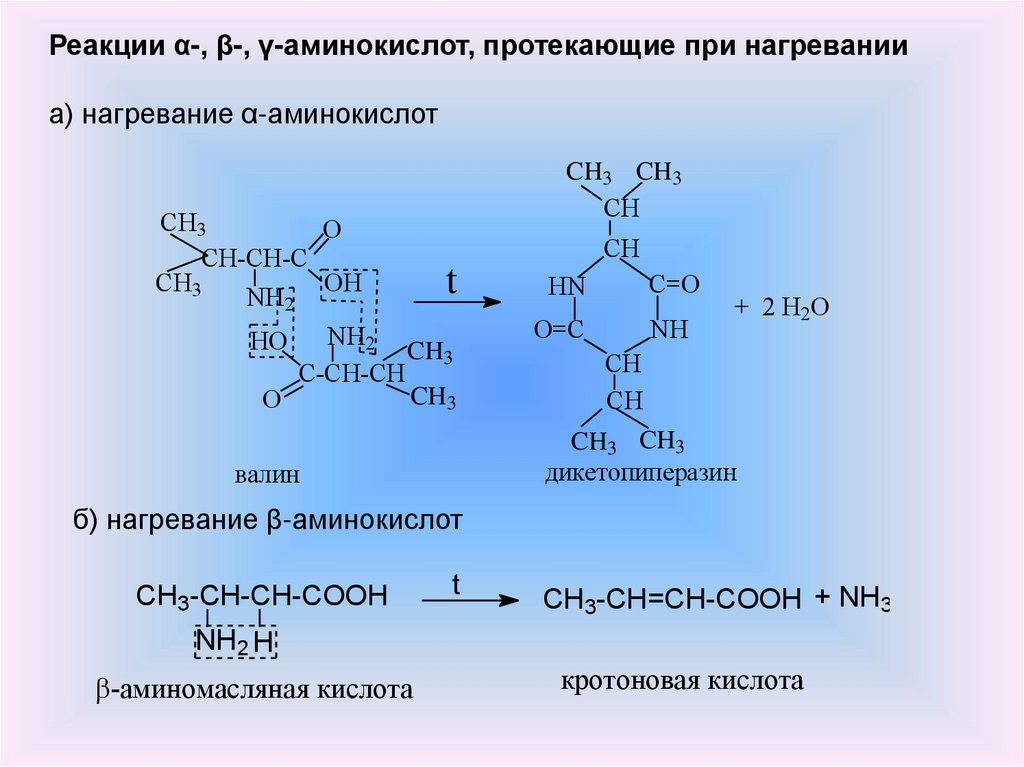
Реакции α-, β-, γ-аминокислот, протекающие при нагреванииа) нагревание α-аминокислот
CH3
O
CH-CH-C
CH3
OH
t
NH2
NH2
HO
CH3
C-CH-CH
CH3
O
валин
CH3 CH3
CH
CH
HN
C=O
O=C
NH
+ 2 H2O
CH
CH
CH3 CH3
дикетопиперазин
б) нагревание β-аминокислот
CH3-CH-CH-COOH
t
CH3-CH=CH-COOH + NH3
NH2 H
-аминомасляная кислота
кротоновая кислота
15.
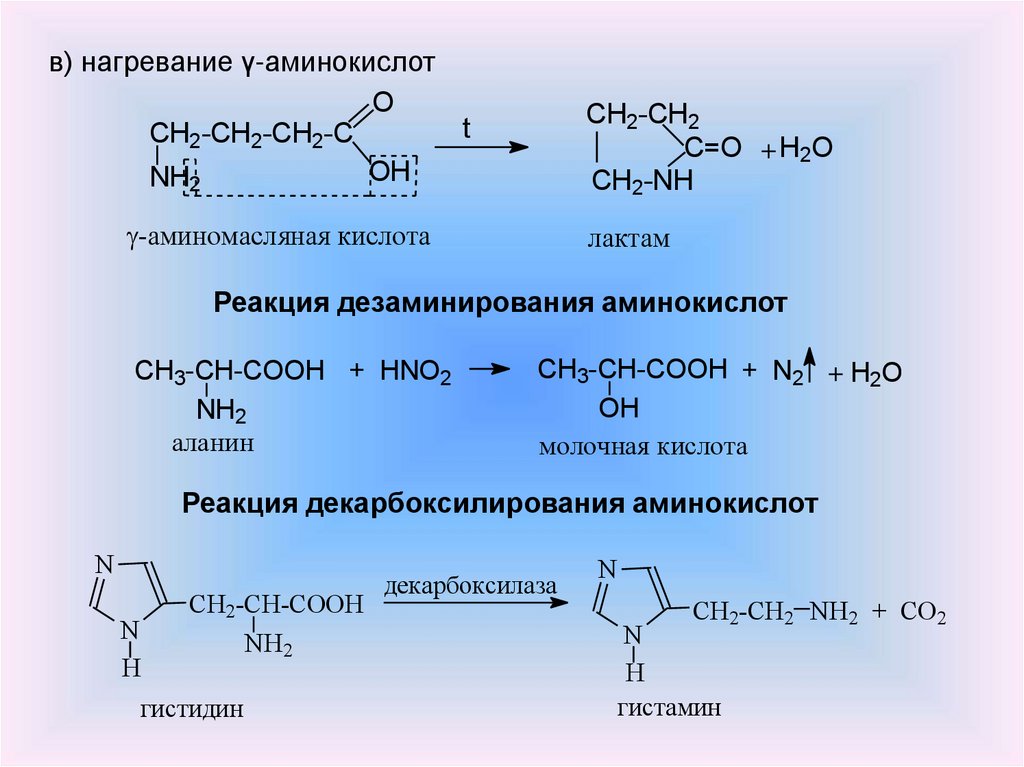
в) нагревание γ-аминокислотO
t
CH2-CH2-CH2-C
OH
NH2
CH2-CH2
C=O + H2O
CH2-NH
-аминомасляная кислота
лактам
Реакция дезаминирования аминокислот
CH3-CH-COOH + HNO2
NH2
аланин
CH3-CH-COOH + N2 + H2O
OH
молочная кислота
Реакция декарбоксилирования аминокислот
N
N
H
CH2-CH-COOH
NH2
гистидин
декарбоксилаза
N
CH2-CH2 NH2 + СO2
N
H
гистамин
16.
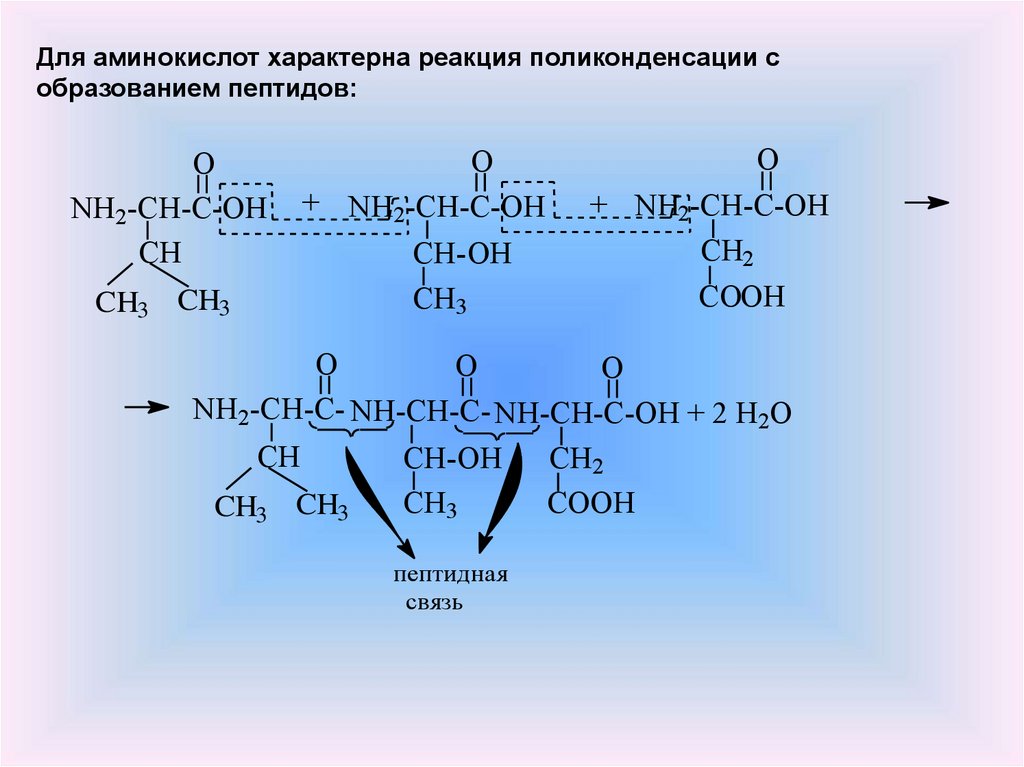
Для аминокислот характерна реакция поликонденсации собразованием пептидов:
O
NH2-CH-C-OH
CH
O
+ NH2-CH-C-OH
CH3 CH3
O
+ NH2-CH-C-OH
CH2
CH-OH
СH3
COOH
O
O
O
NH2-CH-C- NH-CH-C- NH-CH-C-OH + 2 H2O
CH
CH3 CH3
CH-OH
СH3
пептидная
связь
CH2
COOH








 chemistry
chemistry








