Similar presentations:
Амины и аминокислоты
1.
Тема: Амины и аминокислотыВопросы:
1. Строение, изомерия, номенклатура аминов.
2. Способы получения аминов.
3. Химические свойства аминов.
4. Аминокислоты, классификация.
5. Способы получения -аминокислот.
6. Химические свойства аминокислот.
7. Понятие о белках.
8. Реакции поликонденсации.
2.
Вопрос 1. Строение, изомерия, номенклатура аминовАмины можно рассматривать как производные аммиака, в котором 1 или несколько атомов водорода
замещены углеводородными радикалами. В зависимости от числа углеводородных радикалов, связанных с
атомами азота, различают амины первичные, вторичные и третичные амины.
первичные
вторичные
третичные
В зависимости от природы радикалов, входящих в состав аминов, их подразделяют на алифатические
(предельные и непредельные), алициклические, ароматические и гетероциклические. Вторичные и третичные
амины могут быть смешанными, например, алифатическо-ароматическими.
Названия первичных аминов производят от названий радикалов, связанных с атомом азота, с добавлением
слова «-амин» или «-диамин». Названия вторичных и третичных аминов образуют по правилам рациональной
номенклатуры, перечисляя имеющиеся в соединении радикалы. Например,
CH3–NH2 – метиламин; CH3–CH2–NH–CH2–CH3 –диэтиламин;
CH3–CH(CH3)–CH2–NH2 – 2-метилпропанамин;
NH2–CH2–CH2–NH2 – этилендиамин (1,2-этандиамин);
NH2–(CH2)6–NH2 – гексаметилендиамин (1,6-гександиамин);
CH2═CH–CH2–NH2 – аллиламин; CH2═CH–NH2 – виниламин;
C6H5–NH2 – ароматический амин с названием анилин.
3.
В зависимости от природы радикалов, входящих в состав аминов, их подразделяют наалифатические (предельные и непредельные), алициклические, ароматические и
гетероциклические. Вторичные и третичные амины могут быть смешанными, например,
алифатическо-ароматическими.
Названия первичных аминов производят от названий радикалов, связанных с атомом
азота, с добавлением слова «-амин» или «-диамин». Названия вторичных и третичных
аминов образуют по правилам рациональной номенклатуры, перечисляя имеющиеся в
соединении радикалы. Например,
CH3–NH2 – метиламин; CH3–CH2–NH–CH2–CH3 –диэтиламин;
CH3–CH(CH3)–CH2–NH2 – 2-метилпропанамин;
NH2–CH2–CH2–NH2 – этилендиамин (1,2-этандиамин);
NH2–(CH2)6–NH2 – гексаметилендиамин (1,6-гександиамин);
CH2═CH–CH2–NH2 – аллиламин; CH2═CH–NH2 – виниламин;
C6H5–NH2 – ароматический амин с названием анилин.
4.
Вопрос 2. Способы получения аминов1. Взаимодействия аммиака или аминов со спиртами при повышенной температуре в
присутствии катализаторов (Al2O3, ThO2). Получается смесь первичных, вторичных и
третичных аминов:
С2Н5ОН + NH3 →3000C, Al2O3 С2Н5NH2 + H2O
С2Н5NH2 + С2Н5ОН →3000C, Al2O3 (С2Н5)2NH + H2O
(С2Н5)2NH + С2Н5ОН →3000C, Al2O3 (С2Н5)3N + H2O.
2. Взаимодействие аммиака или аминов с галогенпроизводными углеводородов
(реакция Гофмана). Получают смесь аминов и соли аммония.
С2Н5I + 2NH3 С2Н5NH2 + NH4I;
2С2Н5I + 3NH3 С2Н5–NH–С2Н5+2NH4I;
3С2Н5I + 4NH3 С2Н5–N–С2Н5+3NH4I;
|
C2H5
С2Н5I + NH2 –CH3 С2Н5–NH –СН3+HI.
5.
3. Восстановительное аминирование альдегидов и кетонов:(температура, давление, Ni)
CH3–C(O)H + NH3 + H2 → C2H5–NH2 + H2O.
(температура, давление, Ni)
CH3–C(O)–CH3+CH3–NH2+Н2→CH3–CH(CH3)–NH–CH3+H2O
метилизопропиламин
4. Восстановление нитросоединений
катализаторов (Pt, Pd, Ni):
водородом
R–NO2 + 3H2 → Pt R–NH2 + 2H2O.
в
присутствии
6.
Вопрос 3. Химические свойства аминовАмины – органические основания; их водные растворы проводят электрический ток и окрашивают
лакмус в синий цвет.
1. Взаимодействие с водой:
CH3–NH2 + HOH [CH3–NH3]+OH–
гидроксид метиламмони.
2. Взаимодействие с кислотами, при этом образуются соли аминов, подобные по своему строению
солям аммония:
CH3–CH2–NH2 + HBr →[ CH3–CH2–NH3]+Br–
бромид этиламмония.
3. Взаимодействие с азотистой кислотой. Первичные амины разлагаются с образованием
соответствующего спирта и азота:
CH3–CH2–NH2 + O=N–OH → CH3–CH2–OH + N2 + H2O.
Вторичные амины образуют так называемые нитрозоамины:
CH3–NH–CH3 + O=N–OH → CH3–N(NO)–CH3 + Н2О.
диметилнитрозоамин
С третичными аминами азотистая кислота при комнатной температуре не реагирует. Следовательно, по
реакции с азотистой кислотой можно отличить друг от друга первичные, вторичные и третичные амины.
4. Алкилирование аминов. При взаимодействии первичных и вторичных аминов с
алкилгалогенидами происходит обмен подвижных атомов водорода, связанных с азотом, на
углеводородные радикалы:
C2H5NH2 + CH3Br → C2H5–NH–CH3 +HBr
C2H5–NH–CH3 + C2H5–Br → (C2H5)2–N–СН3+HBr.
Эта реакция используется для перевода первичных аминов во вторичные и третичные и служит для
получения аминов заданного строения.
7.
Вопрос 4. Аминокислоты, классификацияАминокислоты – это производные углеводородов, содержащие аминогруппы (–NH2) и карбоксильные
группы (–COOH).
Общая формула аминокислот (NH2)mR(COOH)n.
Классификация
по числу функциональных групп:
моноаминомонокарбоновые кислоты (m=1, n=1)
по положению аминогруппы:
-аминокислоты
диаминомонокарбоновые кислоты (m=2, n=1)
β-аминокислоты
моноаминодикарбоновые кислоты (m=1, n=2)
-аминокислоты
8.
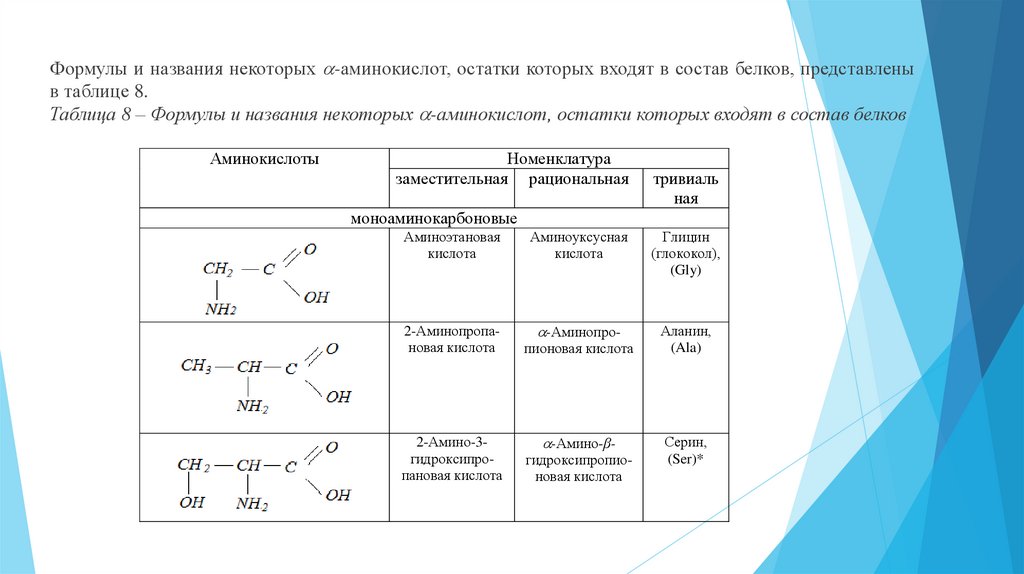
Формулы и названия некоторых -аминокислот, остатки которых входят в состав белков, представленыв таблице 8.
Таблица 8 – Формулы и названия некоторых -аминокислот, остатки которых входят в состав белков
Аминокислоты
Номенклатура
заместительная рациональная
тривиаль
ная
моноаминокарбоновые
Аминоэтановая
кислота
Аминоуксусная
кислота
Глицин
(глококол),
(Gly)
2-Аминопропановая кислота
-Аминопро-
Аланин,
(Ala)
2-Амино-3гидроксипропановая кислота
пионовая кислота
-Амино-βгидроксипропионовая кислота
Серин,
(Ser)*
9.
2-Амино-3меркаптопропановая кислота2-Амино-3метилбутановая
кислота
2-Амино-3фенилпропановая
кислота
2-Амино-3-(-nгидроксифенил)пропановая
кислота
-Амино-βмеркаптопропионовая кислота
-Аминоизовалериановая
кислота
-Амино-βфенилпропионова
я кислота
-Амино-β-(-nгидроксифенил)пропионовая
кислота
Цистеин,
(Cys)*
Валин,
(Val)*
Фенилалан
ин,
(Phe)*
Тирозин,
(Tyr)*
10.
Вопрос 5. Способы получения -аминокислот1) взаимодействие α–галогенкарбоновых кислот с избытком аммиака:
2) Гидролиз белков с образованием смеси аминокислот, из которой
специальными методами выделяют индивидуальные аминокислоты.
Вопрос 6. Химические свойства аминокислот
Аминокислоты обладают амфотерными свойствами за счет присутствия
аминогруппы и карбоксильной группы.
Основные свойства
(свойства аминов)
Кислотные свойства
(свойства карбоновых кислот)
Амфотерные свойства
11.
1.Взаимодействие с основаниями и с кислотами.
а) как кислота (участвует карбоксильная группа):
б) как основание (участвует аминогруппа):
2.
Взаимодействие кислот друг с другом – образование пептидов.
12.
Две аминокислоты образуют дипептид:Белки–это природные высокомолекулярные соединения (биополимеры),
структурную основу которых составляют полипептидные цепи, построенные
из остатков α-аминокислот.
Протеины
←
(простые белки)
Молекулы состоят
только из остатков
α-аминокислот
Белки
→
Протеиды
(сложные белки)
Молекулы содержат кроме
остатков α-аминокислот остатки полисахаридов,
ортофосфорной кислоты,
катионы металлов и т.д.
13.
Поликонденсацией называют реакцию образования полимеров(высокомолекулярных соединений), протекающую по механизму замещения,
которая сопровождается выделением низкомолекулярных соединений (H2O,
HCl, NH3, спирта и др.). В реакцию поликонденсации могут вступать
соединения (мономеры), содержащие функциональные группы –ОН, –СООН,
–NH2, галогены и др.
Пример:
1. nH–C═O + nC6H5 → {–C6H3–CH2–}n + nH2O
/
/
/
H
OH
OH
формальдегид
фенол
фенолформальдегидный полимер
2. nH2N–(CH2)6–NH2 + nClOC–(CH2)4–COCl →
гексаметилендиамин
хлорангидрид адипиновой кислоты
→ {–HN–(CH2)6––NH–CO–(CH2)4–CO–}n + 2nHCl.
капролактам












 chemistry
chemistry








