Similar presentations:
Амины
1.
АМИНЫАмины – производные аммиака NH3. В соответствии с
числом алкильных или арильных групп, связанных с
азотом, различают
первичные R–NH2, ArNH2;
вторичные R1–NH–R2, R–NH–Ar;
третичные амины
R1
N
R3
Ar , R 1
N
R3
R2
2.
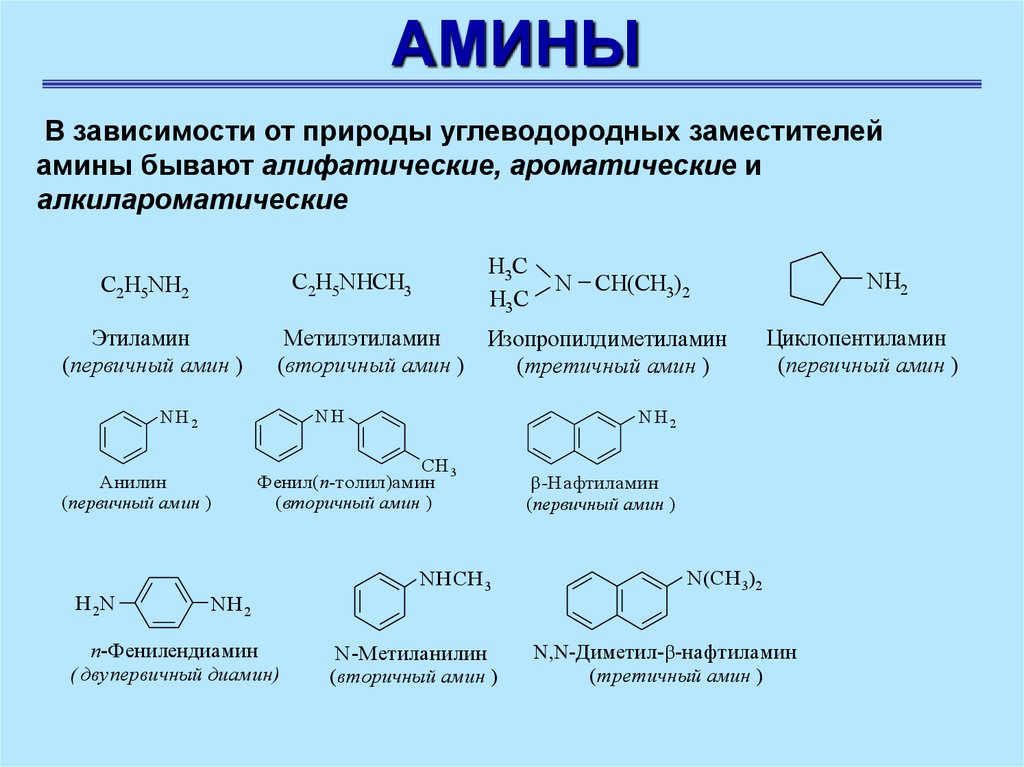
АМИНЫВ зависимости от природы углеводородных заместителей
амины бывают алифатические, ароматические и
алкилароматические
.
Этиламин
(первичный амин )
NH
Анилин
(первичный амин )
N
п-Фенилендиамин
( двупервичный диамин)
Циклопентиламин
(первичный амин )
NH 2
CH 3
Фенил(п-толил)амин
(вторичный амин )
NH 2
NH2
CH(CH3)2
Метилэтиламин
Изопропилдиметиламин
(вторичный амин )
(третичный амин )
NH 2
H 2N
Н3C
Н3C
С2Н5NHCH3
С2Н5NH2
NHСН 3
N-Метиланилин
(вторичный амин )
-Нафтиламин
(первичный амин )
N(СН 3)2
-Диметил- -нафтиламин
(третичный амин )
3.
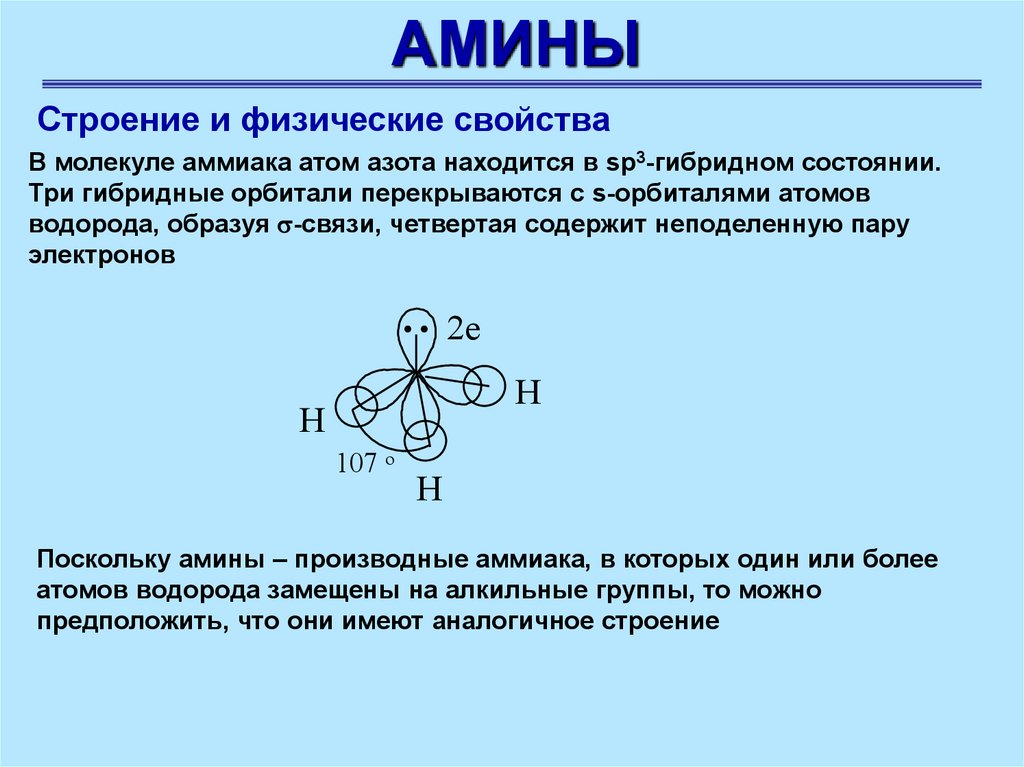
АМИНЫСтроение и физические свойства
В молекуле аммиака атом азота находится в sp3-гибридном состоянии.
Три гибридные орбитали перекрываются с s-орбиталями атомов
водорода, образуя -связи, четвертая содержит неподеленную пару
электронов
.. 2e
H
H
107 o
H
Поскольку амины – производные аммиака, в которых один или более
атомов водорода замещены на алкильные группы, то можно
предположить, что они имеют аналогичное строение
4.
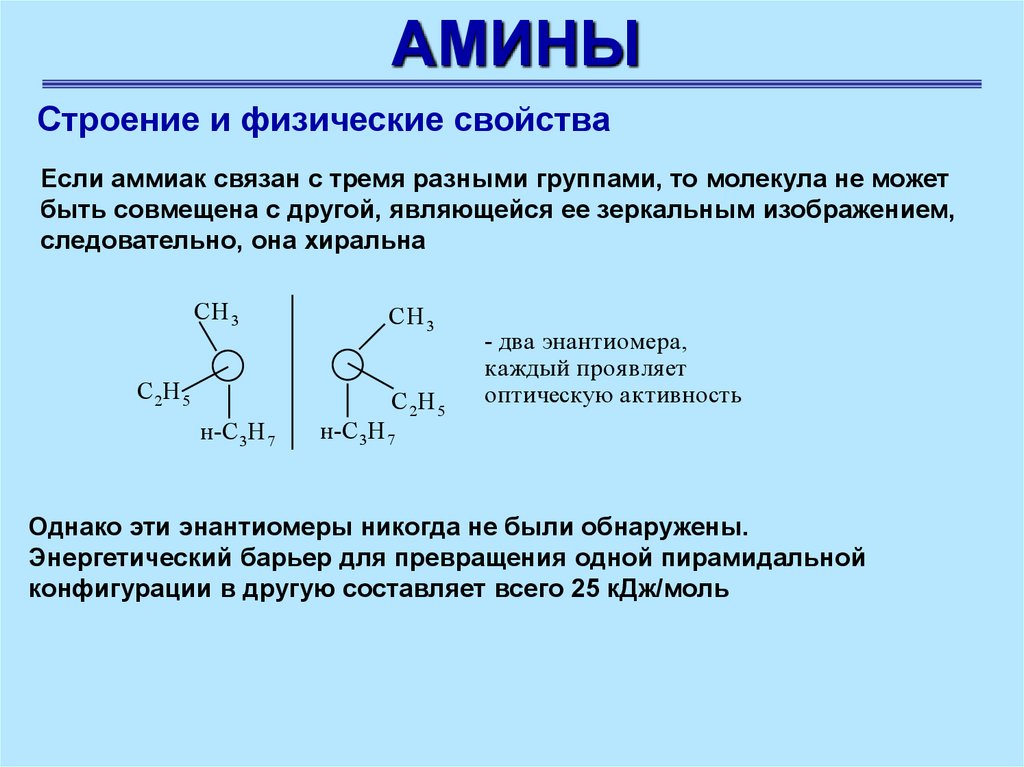
АМИНЫСтроение и физические свойства
Если аммиак связан с тремя разными группами, то молекула не может
быть совмещена с другой, являющейся ее зеркальным изображением,
следовательно, она хиральна
CH 3
С 2Н 5
н-C 3H 7
CH 3
С 2Н 5
- два энантиомера,
каждый проя вля ет
оптическую активность
н-C 3H 7
Однако эти энантиомеры никогда не были обнаружены.
Энергетический барьер для превращения одной пирамидальной
конфигурации в другую составляет всего 25 кДж/моль
5.
АМИНЫСтроение и физические свойства
Простейшие алифатические амины – метиламин, диметиламин и
триметиламин – газы, хорошо растворимые в воде и обладающие
аммиачным запахом. Остальные низшие амины – жидкости с запахом
аммиака. Более сложные амины – жидкости с неприятным запахом
рыбы. Высшие амины – твердые, не растворимые в воде вещества,
лишенные запаха.
При равном числе атомов углерода наиболее высокая температура
кипения у первичных аминов, несколько ниже у вторичных и третичных.
Ароматические амины – жидкости или твердые тела с характерным
неприятным запахом, сильно токсичны. В воде растворяются мало,
накопление аминогрупп ведет к увеличению растворимости
6.
АМИНЫХимические свойства
Многие химические свойства аминов обусловлены
стремлением аминов обобществить неподеленную пару
электронов азота с протоном, благодаря чему они являются
основаниями, либо с электронодефицитным атомом другой
молекулы, что определяет их способность выступать в
качестве нуклеофильных реагентов
7.
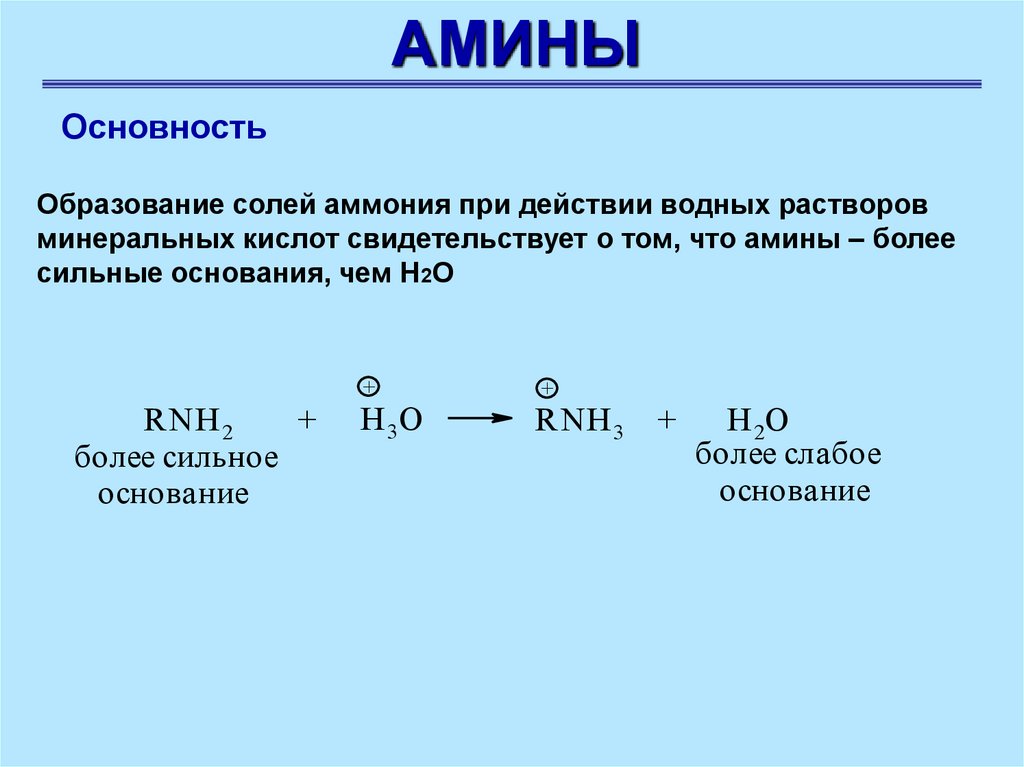
АМИНЫОсновность
Образование солей аммония при действии водных растворов
минеральных кислот свидетельствует о том, что амины – более
сильные основания, чем Н2О
RNH 2
+
более сильное
основание
+
+
H 3O
RNH 3 +
H 2O
более слабое
основание
8.
АМИНЫОсновность
Амины вытесняются из солей аммония при действии гидроксидиона, т.е. амины более слабые основания, чем гидроксид-ион
+
RNH 3
+
OH
RNH 2 +
более сильное более слабое
основание
основание
H 2O
Основность убывает в ряду ОН > RNH2 > H2O
9.
АМИНЫОсновность
По аналогии с кислотностью основность аминов удобно
сравнивать, определяя степень переноса протона с воды на
амин
RNH2 + H2O
более сильное
основание, чем
вода
+
RNH3 + OH
+
[RNH3][OH]
Kb=
[RNH2]
Чем больше константа основности Кb, тем сильнее основание.
Константа основности Kb для всех трех классов алифатических
аминов 10–3–10–4, т.е. алифатические амины более сильные
основания, чем аммиак Kb=1,8∙10-5. Для ароматических аминов
Kb<10–9
10.
АМИНЫСтруктура и основность
Наличие заместителей оказывает сильное влияние на
основность. Алифатические амины – более сильные основания,
чем аммиак
H
H N: + H
H
+
H
+
H N H,
H
H
H
R
N: + H
+
H
R подает электроны,
делает 2е более доступными для атаки протона
R
+
N H
H
R подает электроны,
делает ион аммония
более устойчивым
увеличивает
Основность алифатических аминов увеличивается в ряду
NH3 < R1NH2 < R1–NH–R2
11.
АМИНЫСтруктура и основность
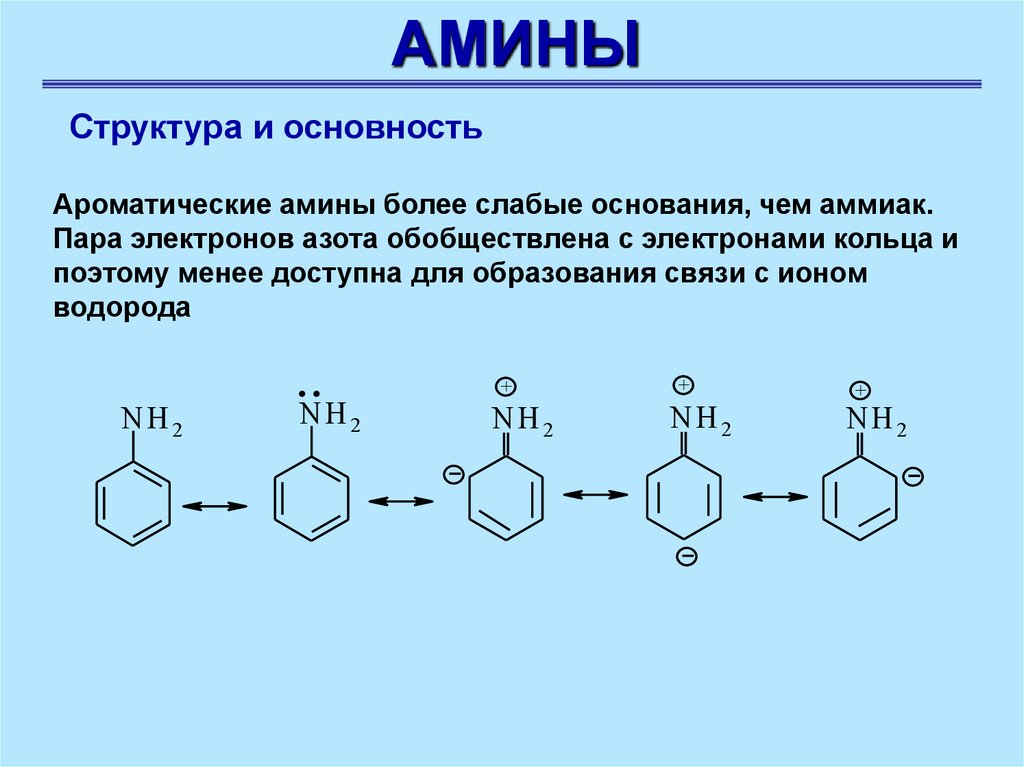
Ароматические амины более слабые основания, чем аммиак.
Пара электронов азота обобществлена с электронами кольца и
поэтому менее доступна для образования связи с ионом
водорода
NH 2
..
NH 2
+
+
NH 2
NH 2
+
NH 2
12.
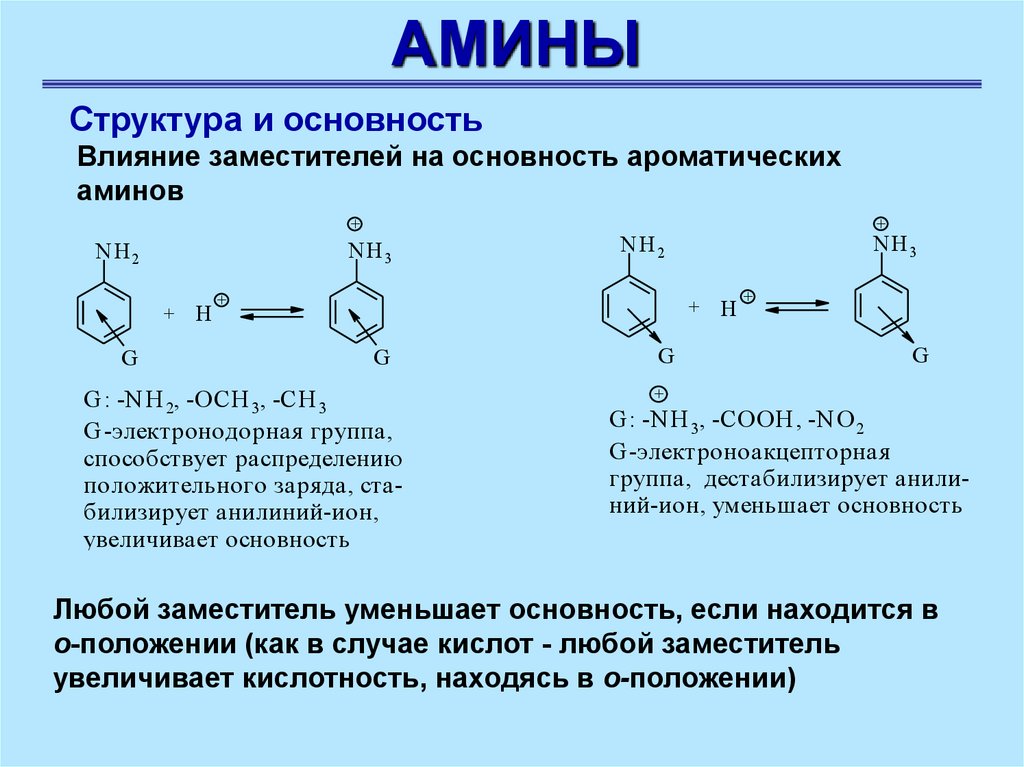
АМИНЫСтруктура и основность
Влияние заместителей на основность ароматических
аминов
+
NH 3
NH 2
+
G
H
+
NH 3
NH 2
+
+
G
G : -N H 2, -OCH 3, -CH 3
G -электронодорная группа,
способствует распределению
положительного заря да, стабилизирует анилиний-ион,
увеличивает основность
G
H
+
G
+
G : -N H 3, -COOH , -N O 2
G -электроноакцепторная
группа, деcтабилизирует анилиний-ион, уменьшает основность
Любой заместитель уменьшает основность, если находится в
о-положении (как в случае кислот - любой заместитель
увеличивает кислотность, находясь в о-положении)
13.
АМИНЫСтруктура и основность
Наиболее характерная реакция аминов - образование солей при
взаимодействии с кислотами
R NH 2
перв.
R 2NH
втор.
R 3N
трет.
+ H
+
X
+
R NH 3X
OH
+ H
+
X
+
R 2NH 2X
OH
+ H
Не растворимы
в воде
+
OH
+
X
R 3NHX
Соли - ионные соединения . Растворимы в воде, не растворимы
в неполя рных растворителя х
где X - Cl, NO 3, OSO 3H
Различие в растворимости аминов и их солей используют для
обнаружения и выделения аминов. Органическое соединение, не
растворимое в воде, но растворимое в холодной разбавленной
соляной кислоте, является основанием, почти наверняка - амином
14.
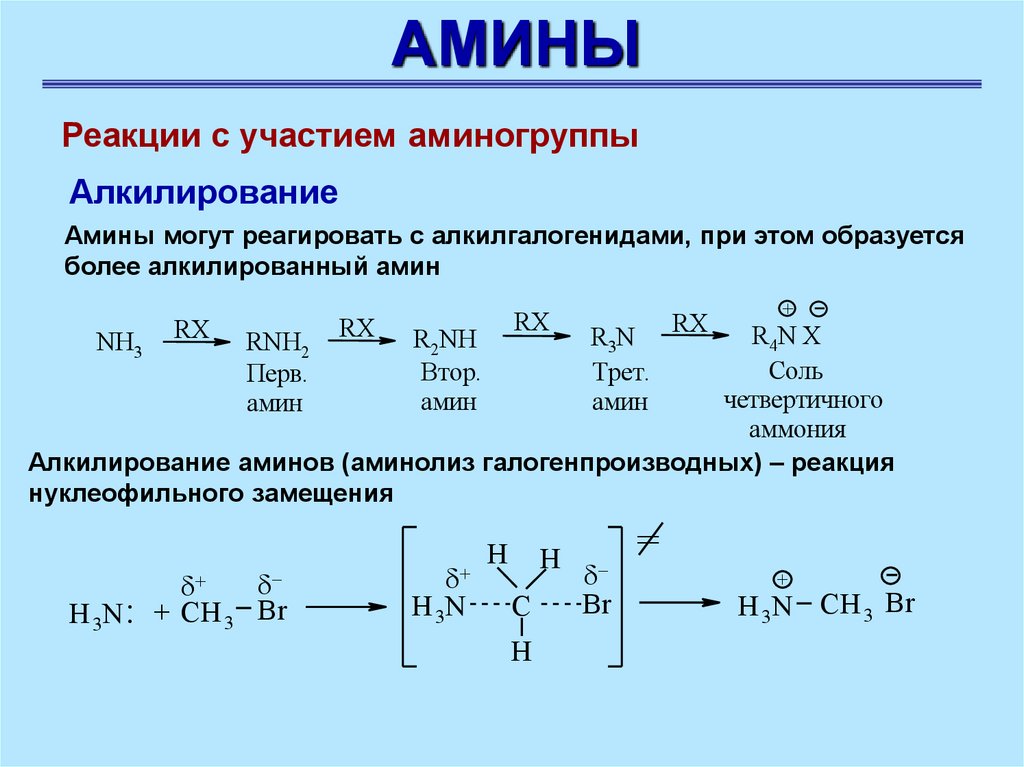
АМИНЫРеакции с участием аминогруппы
Алкилирование
Амины могут реагировать с алкилгалогенидами, при этом образуется
более алкилированный амин
RX
RX
RX
RX
+
R4N X
Соль
четвертичного
аммония
Алкилирование аминов (аминолиз галогенпроизводных) – реакция
нуклеофильного замещения
NH3
RNH2
Перв.
амин
H 3N : + CH 3 Br
R2NH
Втор.
амин
H 3N
H
H
C
H
R3N
Трет.
амин
Br
=
+
H 3N CH 3 Br
15.
АМИНЫРеакции с участием аминогруппы
Алкилирование
Свободный амин выделяется обработкой основанием
+
H 3N
..
CH 3 Br
CH 3NH 2 + CH 3Br
+ NH 3
H 2N
+
(CH 3)2NH 2 Br
NaOH
CH 3 + NН 4Br
(CH 3)2NH + NaBr + H 2O
При аминолизе первичных галогеналканов главный продукт - амин, а при
аминолизе третичных образуется значительное количество алкена
16.
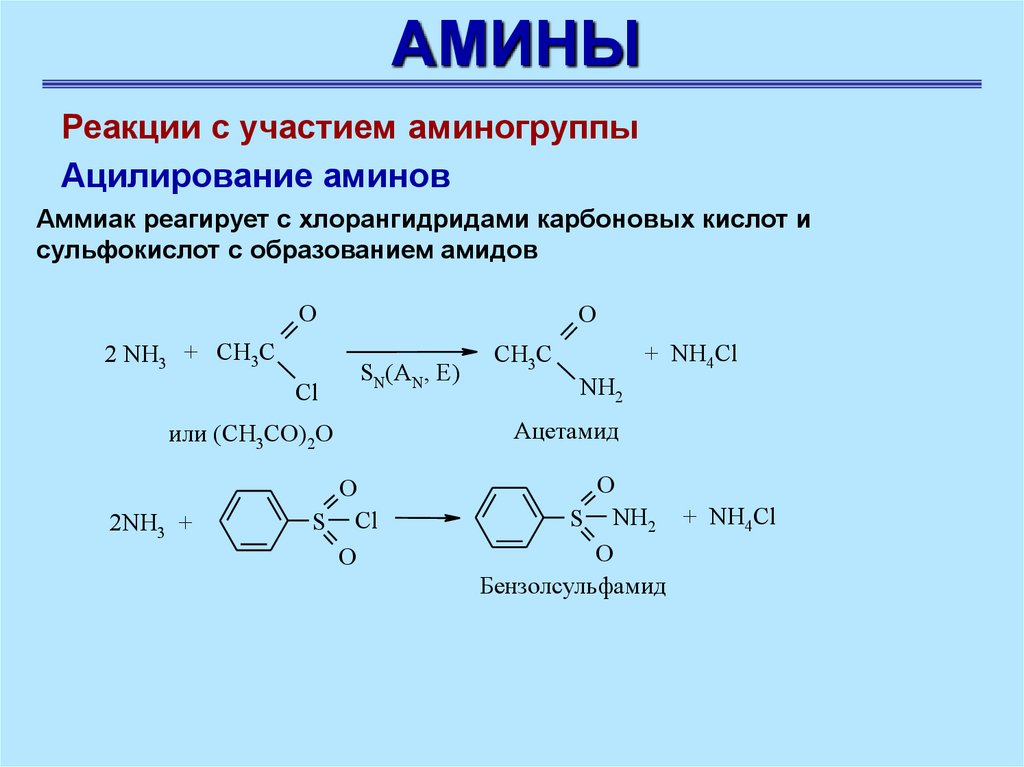
АМИНЫРеакции с участием аминогруппы
Ацилирование аминов
Аммиак реагирует с хлорангидридами карбоновых кислот и
сульфокислот с образованием амидов
O
2 NH3 + CH3C
Cl
O
SN(AN, E)
или (CH3CO)2O
2NH3 +
O
S Cl
O
CH3C
+ NH4Cl
NH2
Aцетамид
O
S NH2 + NH4Cl
O
Бензолсульфамид
17.
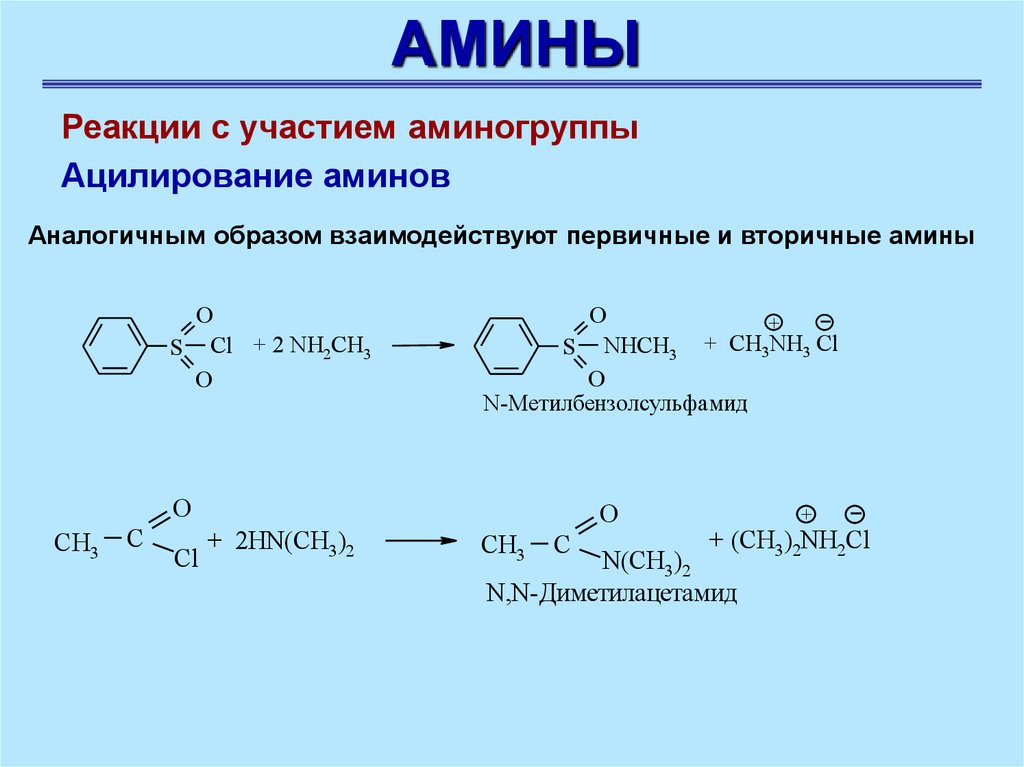
АМИНЫРеакции с участием аминогруппы
Ацилирование аминов
Аналогичным образом взаимодействуют первичные и вторичные амины
O
S Cl + 2 NH2CH3
O
O
+
+
CH
S NHCH3
3NH3 Cl
O
N-Метилбензолсульфамид
O
CH3
C
Сl
+ 2HN(CH3)2
O
+
+ (CH3)2NH2Cl
N(CH3)2
N,N-Диметилацетамид
CH3
C
18.
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
При рассмотрении электрофильного замещения в ароматическом ядре
амина, амида или аммонийной соли следует иметь в виду, что, хотя во
всех случаях с углеродом ядра связан атом азота ориентанта, влияние
его будет различно
..
NH 2,
..
NHR ,
O
..
NH
+
C
NH3
R
..
NR 2 – сильные активирующие о-, п-ориентанты
– менее сильный активирующий о-, п-ориентант
– дезактивирующий м-ориентант
19.
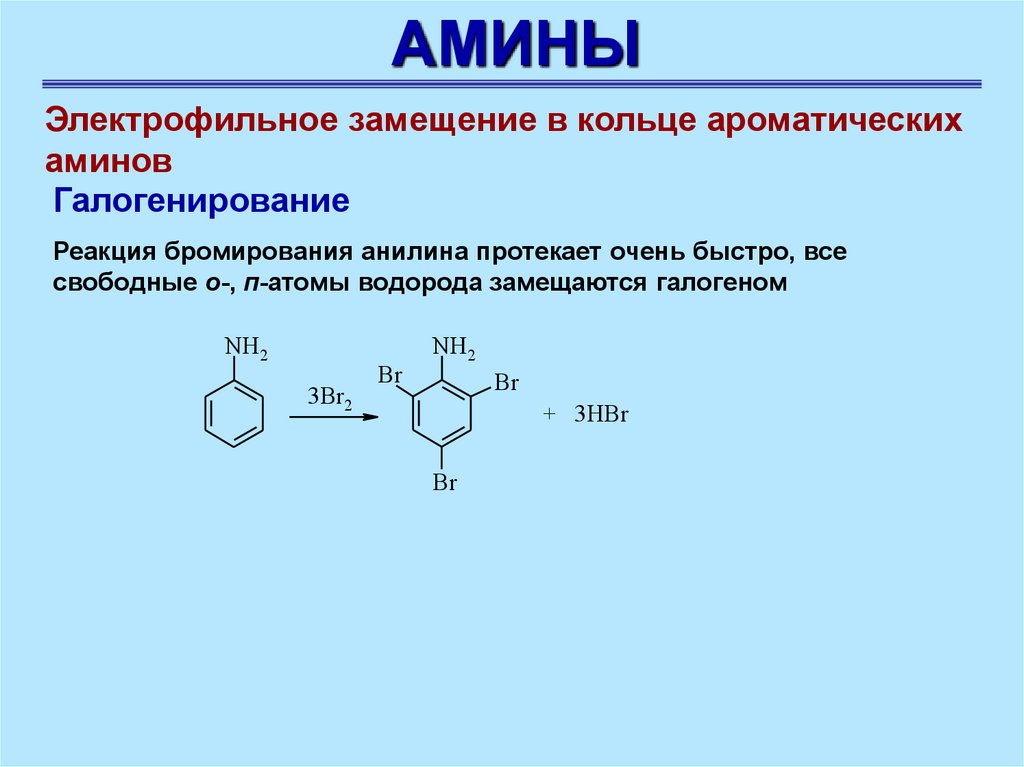
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
Галогенирование
Реакция бромирования анилина протекает очень быстро, все
свободные о-, п-атомы водорода замещаются галогеном
NH2
3Br2
Br
NH2
Br
+ 3НBr
Br
20.
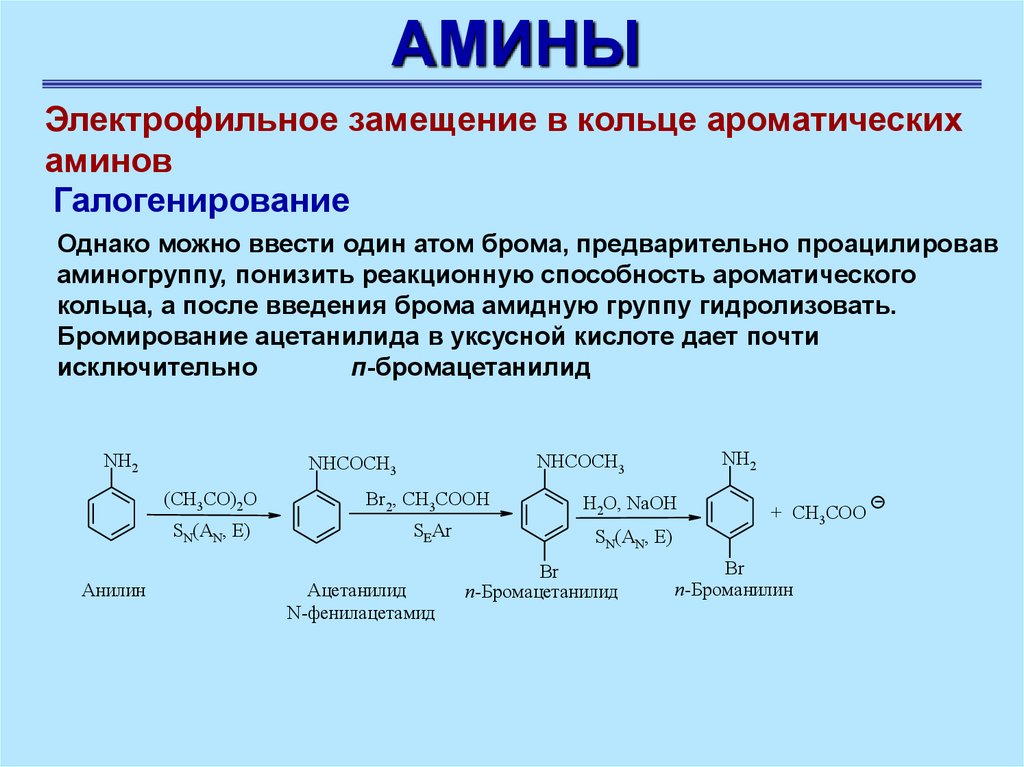
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
Галогенирование
Однако можно ввести один атом брома, предварительно проацилировав
аминогруппу, понизить реакционную способность ароматического
кольца, а после введения брома амидную группу гидролизовать.
Бромирование ацетанилида в уксусной кислоте дает почти
исключительно
п-бромацетанилид
NH2
Анилин
NH2
NHCOCH3
NHCOCH3
(CH3CO)2O
Br2, СН3СООН
H2O, NaOH
SN(AN, E)
SEAr
SN(AN, E)
Ацетанилид
N-фенилацетамид
Br
п-Бромацетанилид
+ CH3COO
Br
п-Броманилин
21.
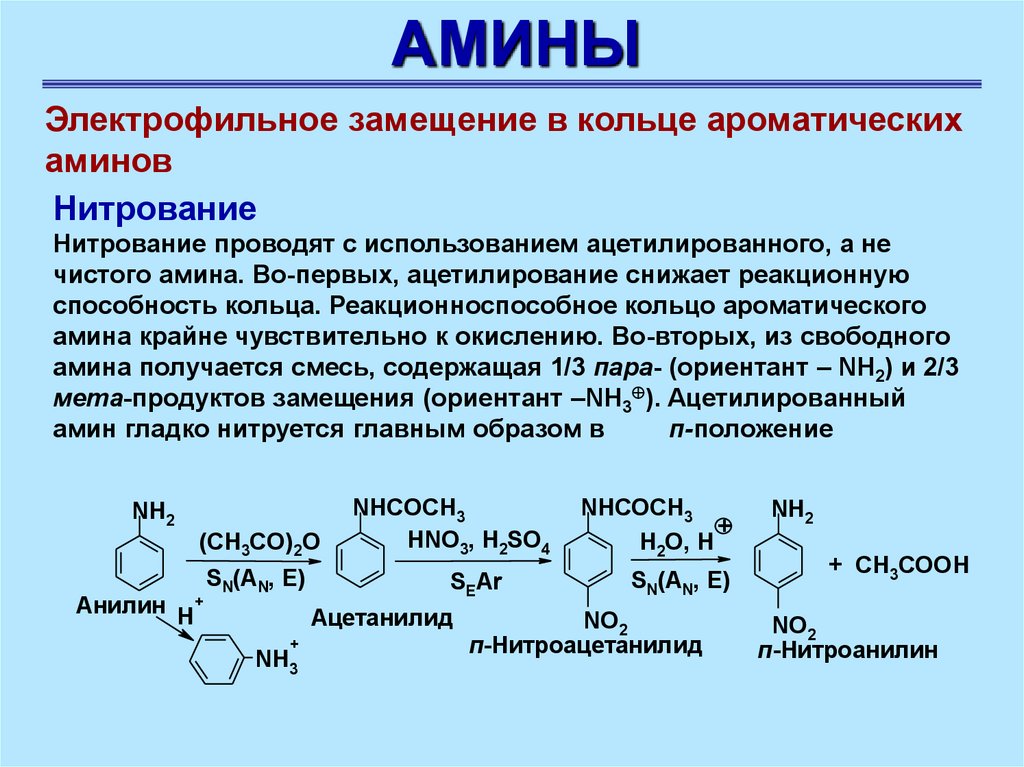
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
Нитрование
Нитрование проводят с использованием ацетилированного, а не
чистого амина. Во-первых, ацетилирование снижает реакционную
способность кольца. Реакционноспособное кольцо ароматического
амина крайне чувствительно к окислению. Во-вторых, из свободного
амина получается смесь, содержащая 1/3 пара- (ориентант – NH2) и 2/3
мета-продуктов замещения (ориентант –NH3 ). Ацетилированный
амин гладко нитруется главным образом в
п-положение
NH2
(CH3CO)2O
Анилин H+
SN(AN, E)
NHCOCH3
HNO3, H2SO4
SEAr
Ацетанилид
+
NH3
NHCOCH3
+
H2O, H
SN(AN, E)
NO2
п-Нитроацетанилид
NH2
+ CH3COOН
NO2
п-Нитроанилин
22.
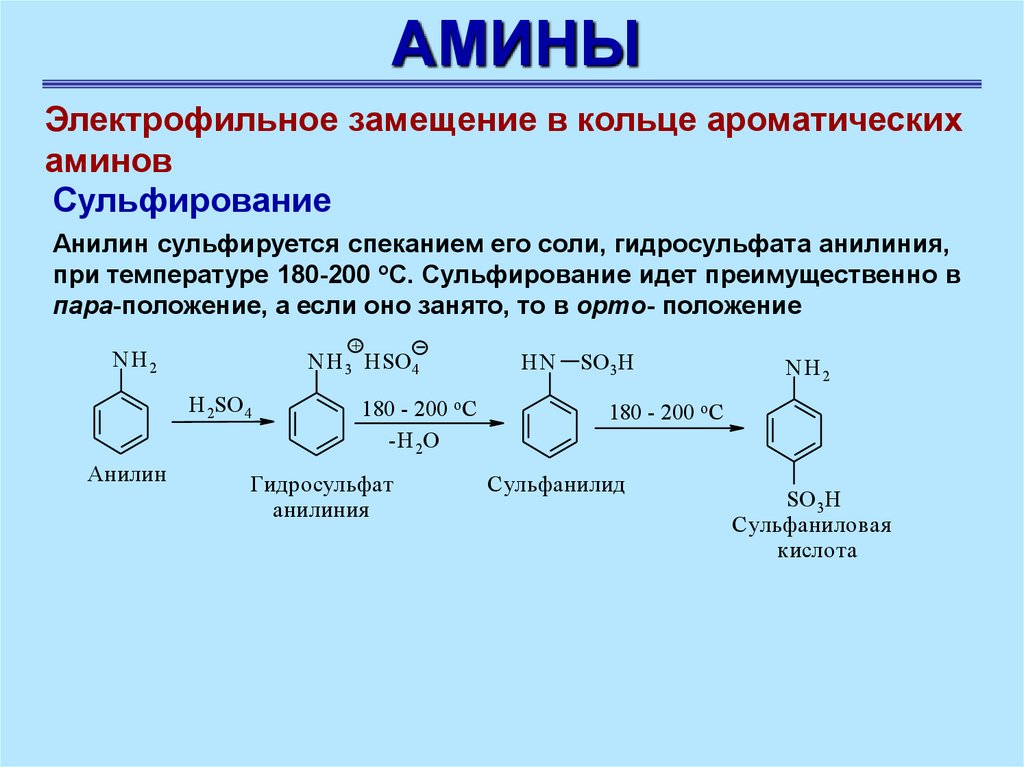
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
Сульфирование
Анилин сульфируется спеканием его соли, гидросульфата анилиния,
при температуре 180-200 оС. Сульфирование идет преимущественно в
пара-положение, a если оно занято, то в opтo- положение
+
NH 2
NH 3 HSO 4
H 2SO 4
Анилин
180 - 200 o C
-H 2O
Гидросульфат
анилиния
HN
SO 3H
NH 2
180 - 200 o C
Сульфанилид
SO 3H
Сульфаниловая
кислота
23.
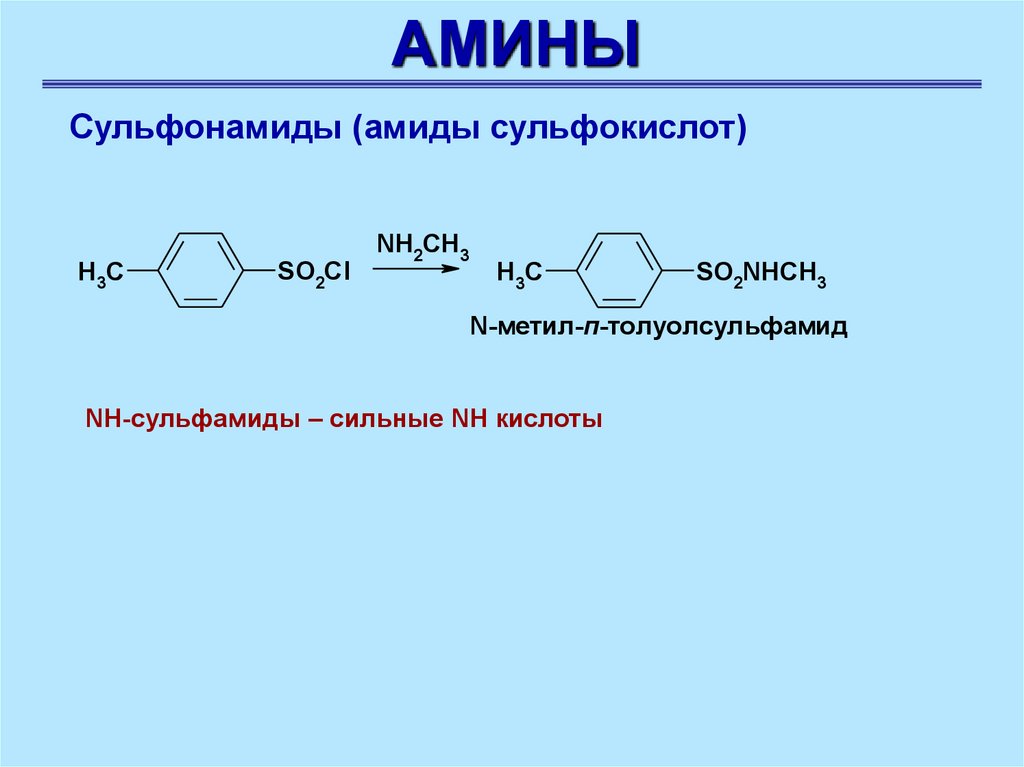
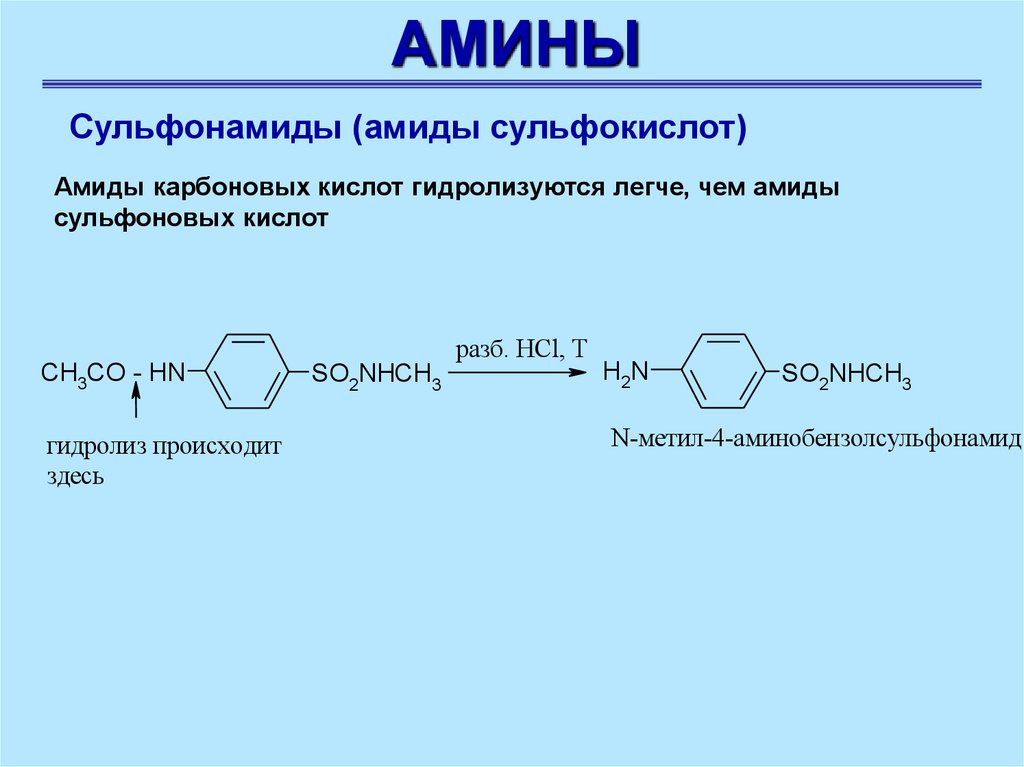
АМИНЫСульфонамиды (амиды сульфокислот)
H3C
SO2Cl
NH2CH3
H3C
SO2NHCH3
N-метил-п-толуолсульфамид
NH-сульфамиды – сильные NH кислоты
24.
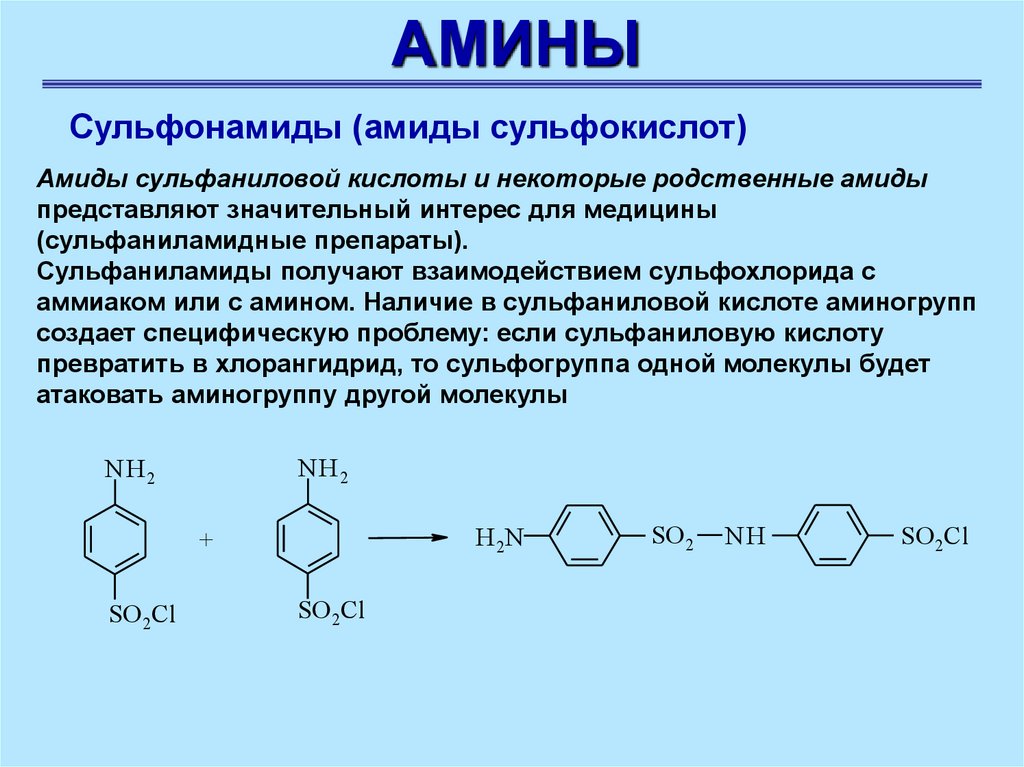
АМИНЫСульфонамиды (амиды сульфокислот)
Амиды сульфаниловой кислоты и некоторые родственные амиды
представляют значительный интерес для медицины
(сульфаниламидные препараты).
Сульфаниламиды получают взаимодействием сульфохлорида с
аммиаком или с амином. Наличие в сульфаниловой кислоте аминогрупп
создает специфическую проблему: если сульфаниловую кислоту
превратить в хлорангидрид, то сульфогруппа одной молекулы будет
атаковать аминогруппу другой молекулы
NH 2
NH 2
H 2N
+
SO 2Cl
SO 2Cl
SO 2
NH
SO 2Cl
25.
АМИНЫСульфонамиды (амиды сульфокислот)
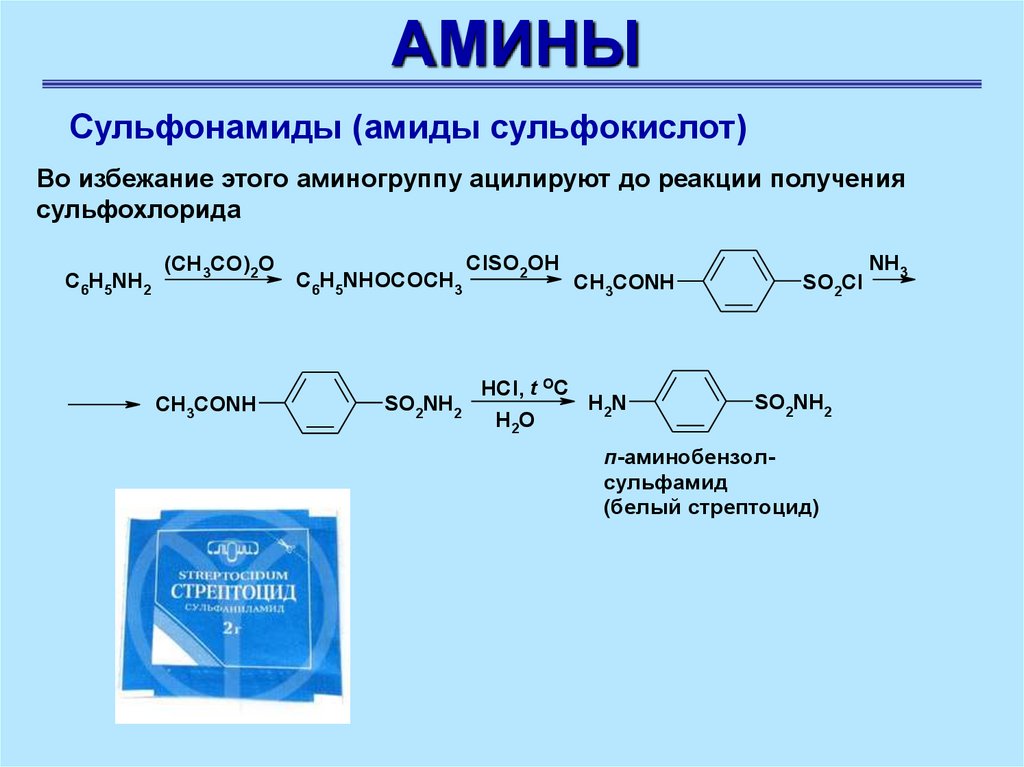
Во избежание этого аминогруппу ацилируют до реакции получения
сульфохлорида
C6H5NH2
(CH3CO)2O
CH3CONH
C6H5NHOCOCH3
SO2NH2
ClSO2OH
CH3CONH
HCl, t OC
H2N
H2O
SO2Cl
SO2NH2
п-аминобензолсульфамид
(белый стрептоцид)
NH3
26.
АМИНЫСульфонамиды (амиды сульфокислот)
Амиды карбоновых кислот гидролизуются легче, чем амиды
сульфоновых кислот
CH3CO - HN
гидролиз происходит
здесь
разб. HCl, T
SO2NHCH3
H2N
SO2NHCH3
N-метил-4-аминобензолсульфонамид
27.
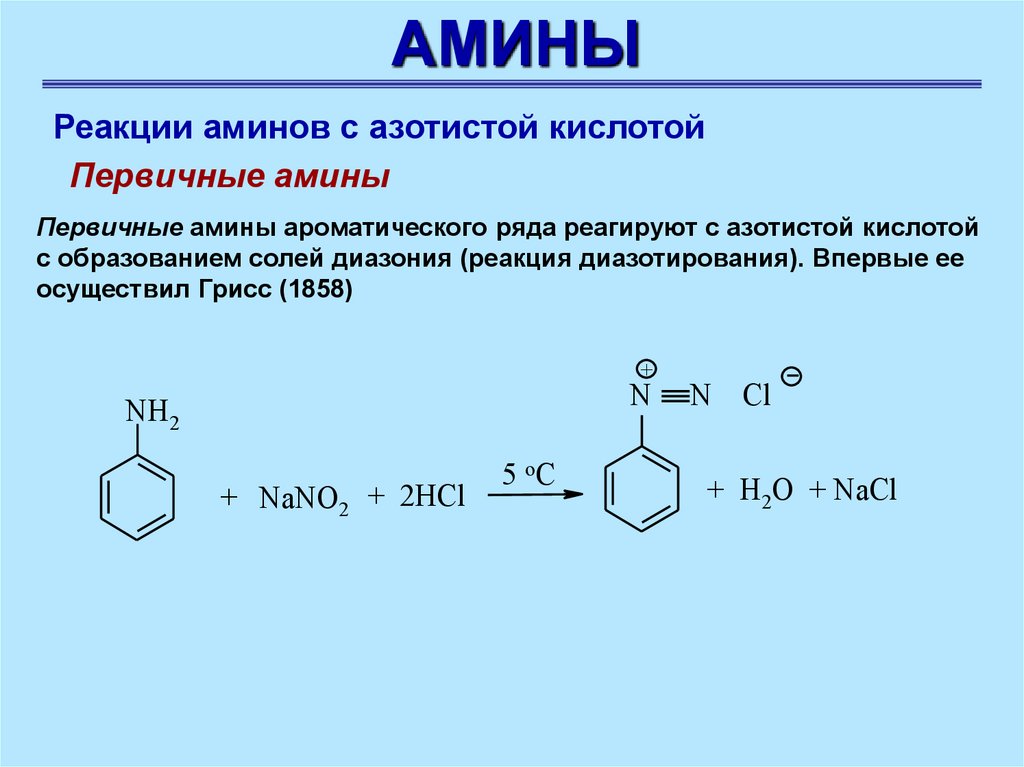
АМИНЫРеакции аминов с азотистой кислотой
Первичные амины
Первичные амины ароматического ряда реагируют с азотистой кислотой
с образованием солей диазония (реакция диазотирования). Впервые ее
осуществил Грисс (1858)
+
N
NH2
+ NaNO2 + 2HСl
5 оС
N Cl
+ H2O + NaCl
28.
АМИНЫРеакции аминов с азотистой кислотой
Первичные амины
На первой стадии при взаимодействии нитрита натрия с соляной
кислотой образуется азотистая кислота
NaNO2 + HCl
HNO2 + NaCl
Азотистая кислота является более слабой кислотой, чем азотная.
Поэтому в отсутствие сильных минеральных кислот электрофильная
реакционная способность азотистой кислоты невысока. Увеличить ее
можно, проводя реакции с аминами в присутствии сильных
минеральных кислот (чаще для этой цели используют хлороводородную
кислоту). При этом, по-видимому, происходят протонированне атома
кислорода гидроксильной группы, отщепление воды и генерирование
нитрозонийкатиона. В соляной кислоте образуется нитрозилхлорид,
который и является диазотирующим агентом
29.
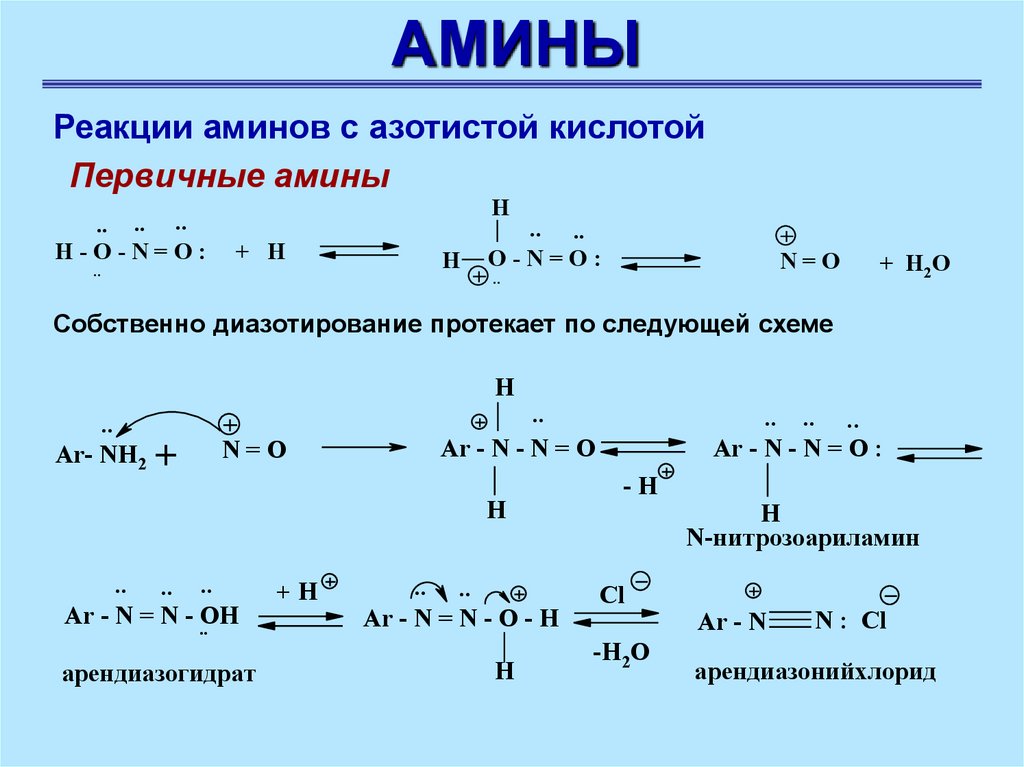
АМИНЫРеакции аминов с азотистой кислотой
Первичные амины
.. .. ..
H-O-N=O:
..
H
+ H
H
.. ..
O-N=O:
N=O
..
+ H2O
Собственно диазотирование протекает по следующей схеме
H
..
Ar- NH2 +
N=O
..
Ar - N - N = O
H
.. .. ..
Ar - N = N - ..OH
арендиазогидрат
+H
.. ..
Ar - N = N - O - H
H
.. .. ..
Ar - N - N = O :
-H
Cl
-H2O
H
N-нитрозоариламин
Ar - N
N : Cl
арендиазонийхлорид
30.
АМИНЫРеакции аминов с азотистой кислотой
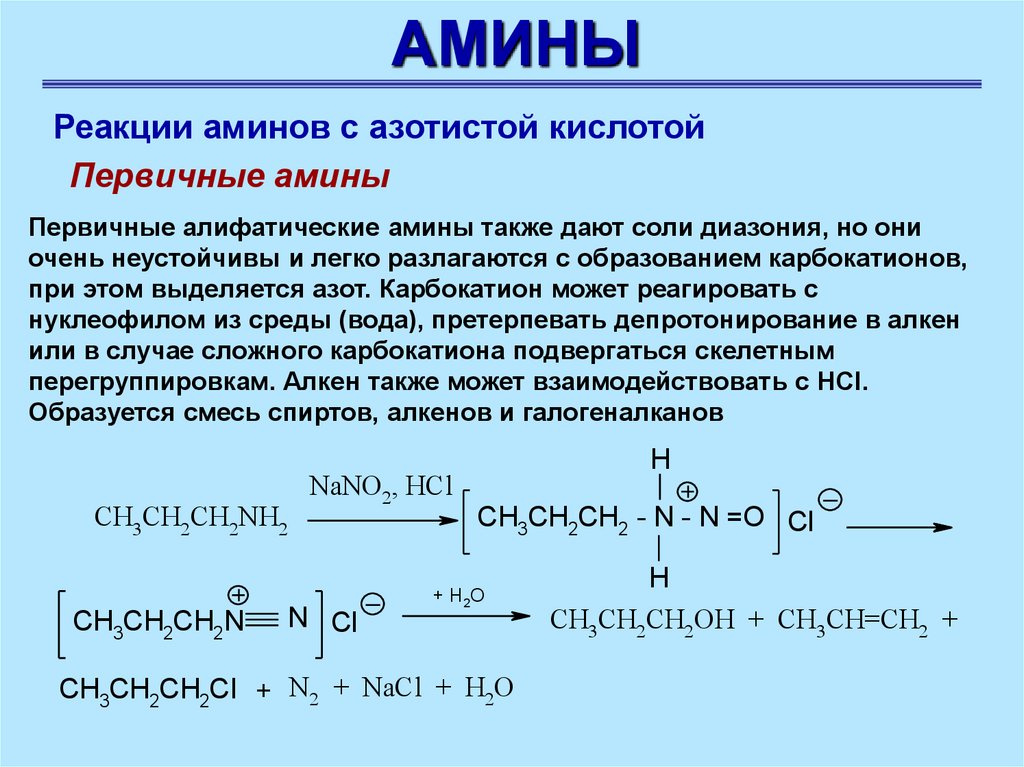
Первичные амины
Первичные алифатические амины также дают соли диазония, но они
очень неустойчивы и легко разлагаются с образованием карбокатионов,
при этом выделяется азот. Карбокатион может реагировать с
нуклеофилом из среды (вода), претерпевать депротонирование в алкен
или в случае сложного карбокатиона подвергаться скелетным
перегруппировкам. Алкен также может взаимодействовать с HCl.
Образуется смесь спиртов, алкенов и галогеналканов
CH3CH2CH2NH2
CH3CH2CH2N
NaNO2, HCl
N Cl
H
CH3CH2CH2 - N - N =O Cl
+ H2O
CH3CH2CH2Cl + N2 + NaCl + H2O
H
CH3CH2CH2OH + CH3CH=CH2 +
31.
АМИНЫРеакции аминов с азотистой кислотой
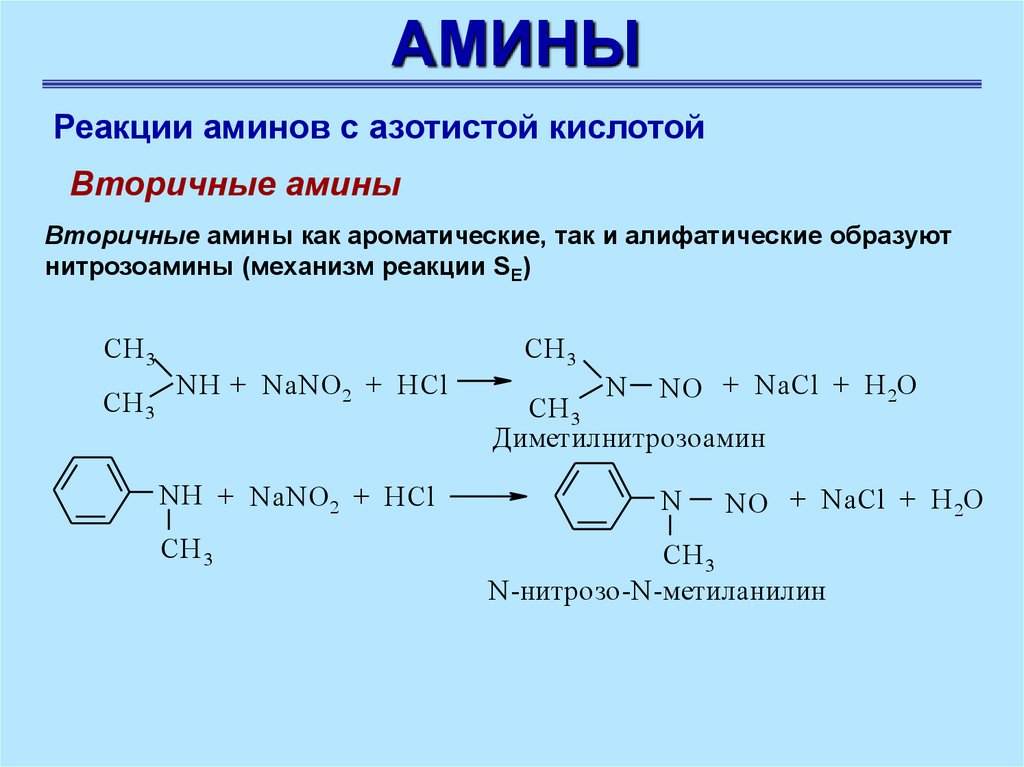
Вторичные амины
Вторичные амины как ароматические, так и алифатические образуют
нитрозоамины (механизм реакции SE)
CH 3
CH 3
CH 3
NH + NaNO 2 + HCl
NH + NaNO 2 + HCl
CH 3
N
NO + NaCl + H 2O
CH 3
Диметилнитрозоамин
N
NO + NaCl + H 2O
CH 3
N-нитрозо-N-метиланилин
32.
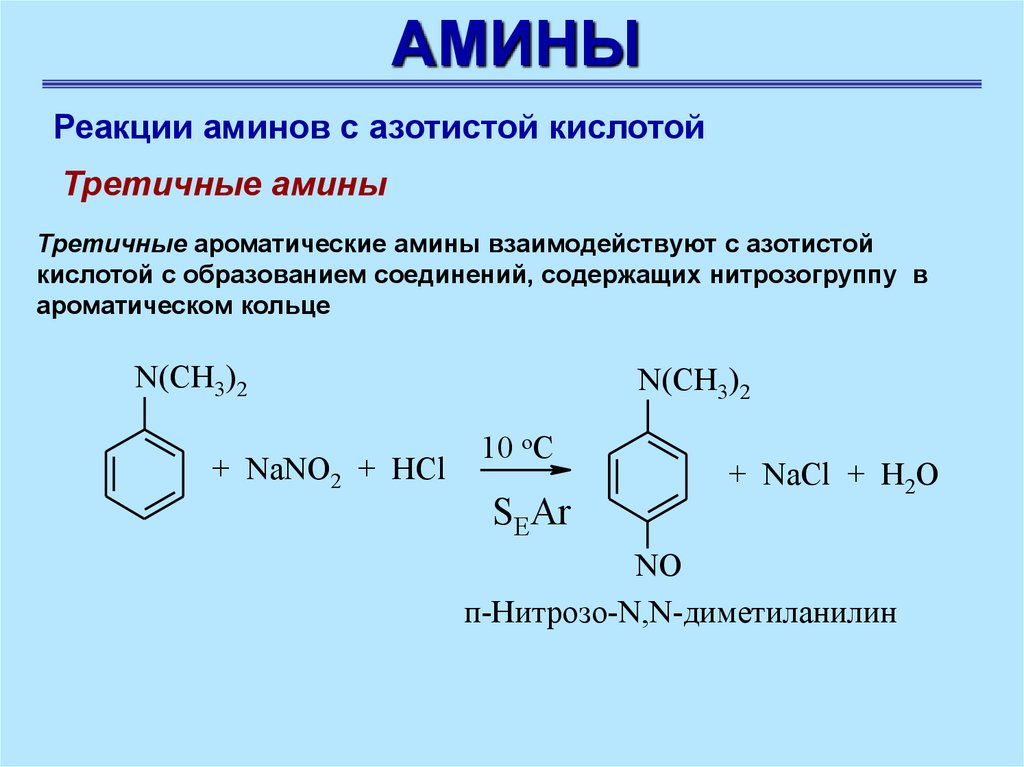
АМИНЫРеакции аминов с азотистой кислотой
Третичные амины
Третичные ароматические амины взаимодействуют с азотистой
кислотой с образованием соединений, содержащих нитрозогруппу в
ароматическом кольце
N(CH3)2
+ NaNO2 + HCl
N(CH3)2
10 oC
SEAr
+ NaCl + H2O
NO
п-Нитрозо-N,N-диметиланилин
33.
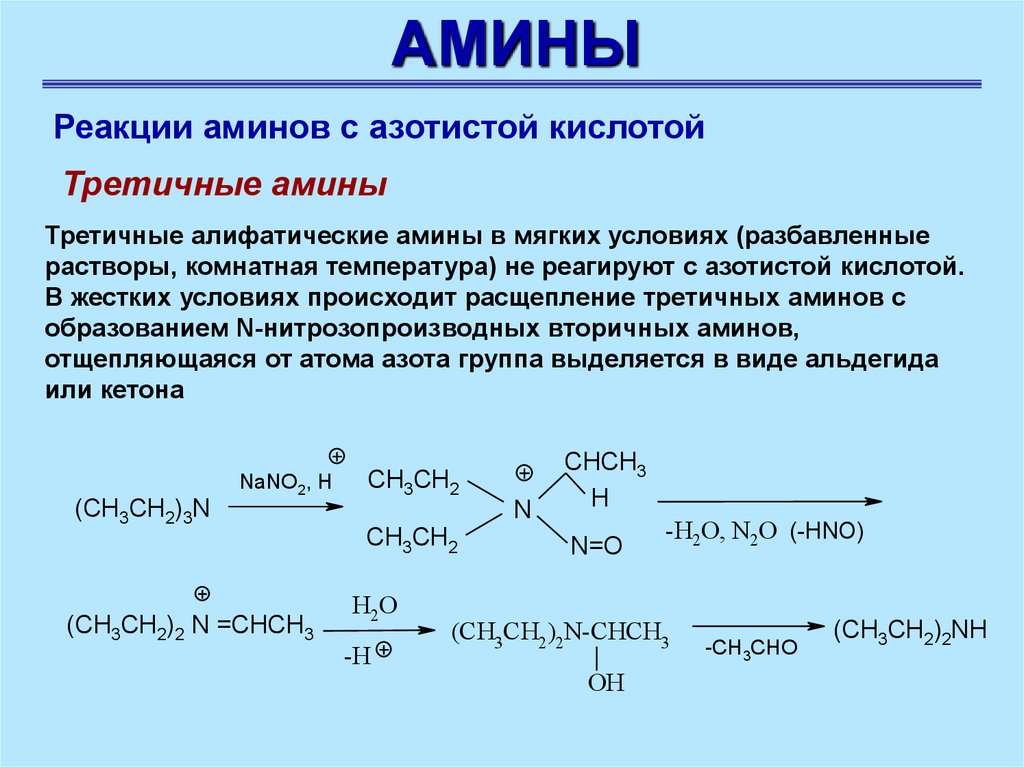
АМИНЫРеакции аминов с азотистой кислотой
Третичные амины
Третичные алифатические амины в мягких условиях (разбавленные
растворы, комнатная температура) не реагируют с азотистой кислотой.
В жестких условиях происходит расщепление третичных аминов с
образованием N-нитрозопроизводных вторичных аминов,
отщепляющаяся от атома азота группа выделяется в виде альдегида
или кетона
NaNO2, H
(CH3CH2)3N
CH3CH2
N
CH3CH2
(CH3CH2)2 N =CHCH3
H2O
-H
CHCH3
H
N=O
-H2O, N2O (-HNO)
(CH3CH2 )2N-CHCH3
OH
-CH3CHO
(CH3CH2)2NH
34.
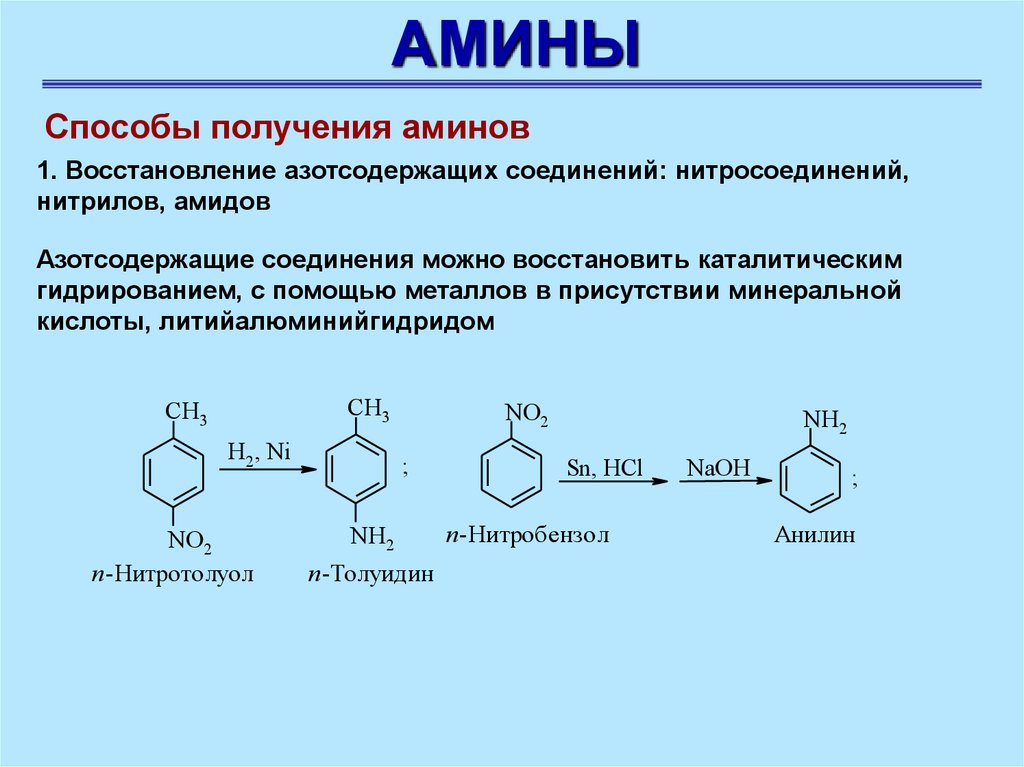
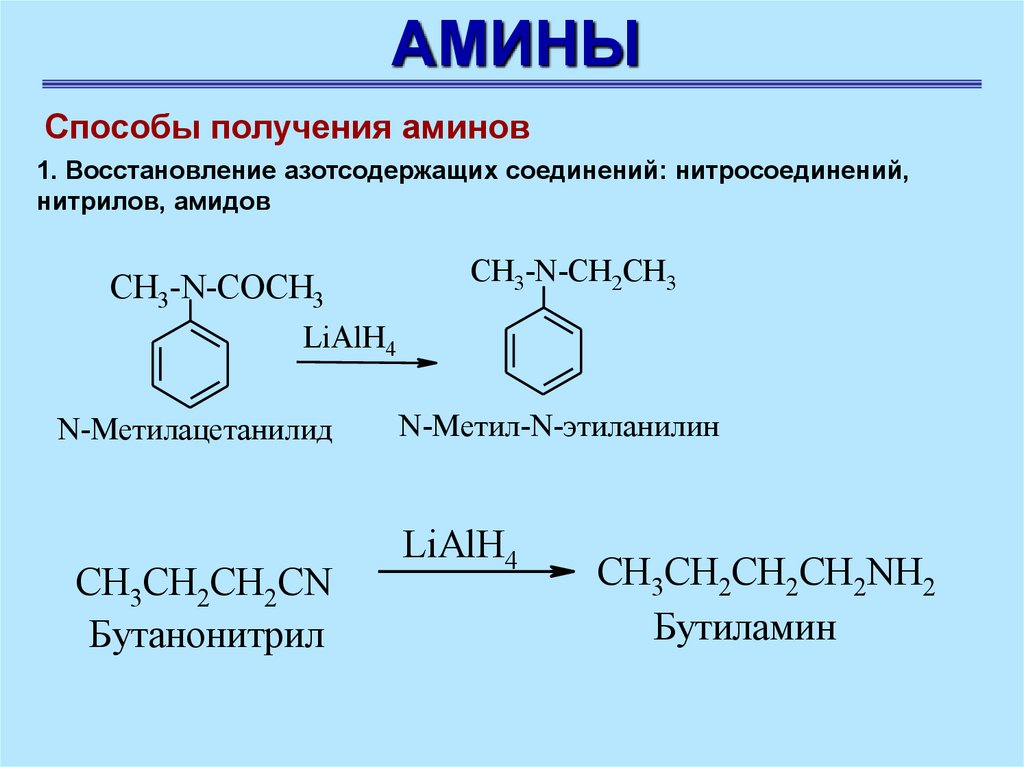
АМИНЫСпособы получения аминов
1. Восстановление азотсодержащих соединений: нитросоединений,
нитрилов, амидов
Азотсодержащие соединения можно восстановить каталитическим
гидрированием, с помощью металлов в присутствии минеральной
кислоты, литийалюминийгидридом
СН3
СН3
H2, Ni
NO2
п-Нитротолуол
NO2
;
NH2
п-Толуидин
NH2
Sn, HCl
п-Нитробензол
NaOH
;
Анилин
35.
АМИНЫСпособы получения аминов
1. Восстановление азотсодержащих соединений: нитросоединений,
нитрилов, амидов
CH3-N-COCH3
CH3-N-CH2CH3
LiAlH4
N-Метилацетанилид
СH3CH2CH2CN
Бутанонитрил
N-Метил-N-этиланилин
LiAlH4
СH3CH2CH2СН2NH2
Бутиламин
36.
АМИНЫСпособы получения аминов
2. Взаимодействие галогенпроизводных и спиртов с аммиаком
СH3CH2Br
+
NH3
СH3CH2Br + CH3CH2NH2
СH3CH2Br + (C2H5)2NH
NH3
ROH
Al2O3, T
RNH2
_
+
[CH3CH2NH3] Br
NH3(изб)
_
+
[CH3CH2NH2CH2CH3] Br
NaOH
+
[(C2H5)2NHCH2CH3] Br
ROH
Al2O3, T
R2NH
CH3CH2NH2
Этиламин
+
NH4Br
(CH3CH2)2NH + NaBr + H2O
Диэтиламин
NaOH
(CH 3CH2)3N + NaBr + H2O
Триэтиламин
ROH
Al2O3, T
R3N
37.
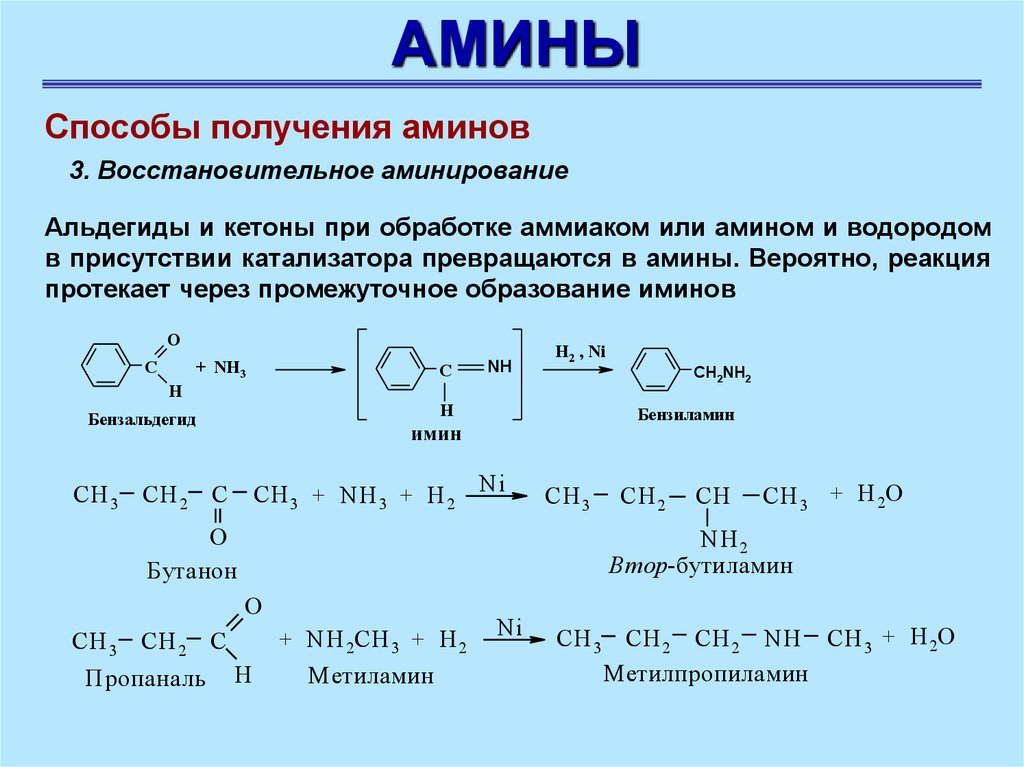
АМИНЫСпособы получения аминов
3. Восстановительное аминирование
Альдегиды и кетоны при обработке аммиаком или амином и водородом
в присутствии катализатора превращаются в амины. Вероятно, реакция
протекает через промежуточное образование иминов
O
С
+ NH3
С
Н
имин
CH 3 + NH 3 + H 2 Ni
CH 2 C
СH 3
CH 2
CН
CH 3 + H 2O
NH 2
Втор-бутиламин
O
+ NH 2СН 3 + H 2
CH 2 C
Пропаналь
CH2NH2
Бензиламин
O
Бутанон
СH 3
H2 , Ni
Н
Бензальдегид
СH 3
NH
Н
Метиламин
Ni
СH 3 CH 2 CН 2 NH CH 3 + H 2O
Метилпропиламин
38.
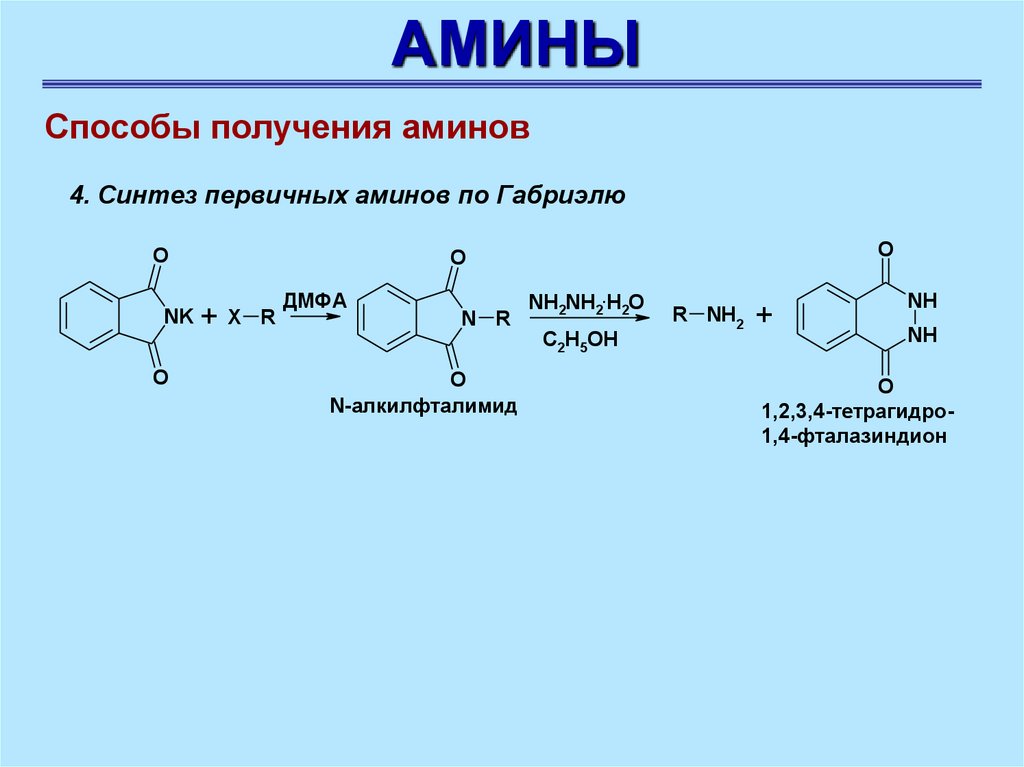
АМИНЫСпособы получения аминов
4. Синтез первичных аминов по Габриэлю
O
NK + X R
O
O
O
ДМФА
N R
O
N-алкилфталимид
NH2NH2.H2O
C2H5OH
R NH2 +
NH
NH
O
1,2,3,4-тетрагидро1,4-фталазиндион











 chemistry
chemistry








