Similar presentations:
Азотсодержащие органические соединения. Аминокислоты. Химические свойства, биологическая роль. Пептиды. Белки
1.
II КУРСМЕДИКО-БИОЛОГИЧЕСКОГО ФАКУЛЬТЕТА,
по направлению подготовки
МЕДИЦИНСКАЯ БИОХИМИЯ
Азотсодержащие органические соединения.
Аминокислоты. Химические свойства,
биологическая роль. Пептиды. Белки.
2.
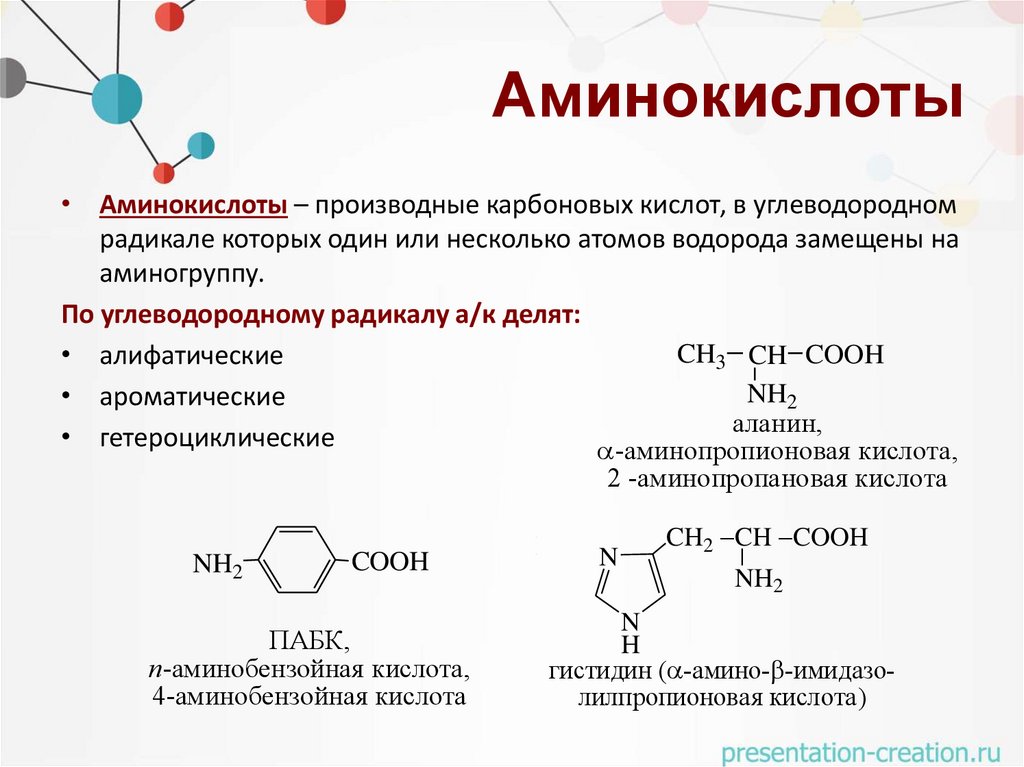
Аминокислоты• Аминокислоты – производные карбоновых кислот, в углеводородном
радикале которых один или несколько атомов водорода замещены на
аминогруппу.
По углеводородному радикалу а/к делят:
CH3 CH COOH
CH
• алифатические
NH2
• ароматические
аланин,
а
• гетероциклические
-аминопропионовая кислота, 3-ам
2 -аминопропановая кислота
COOH
NH2
CH2 CH COOH
COOH
NH2
NH2
N
CH2 CH COOH
SO3H
NH2
COOH
NH
N2
N
N
H
H
ПАБК,
сульфаниловая
кислота,
кислота,
H
ная(пирролидин-2
кислота, п-аминобензолсульфокислота,
кислота, п-аминобензойная
триптофан ( -амино- -индогистидин ( -амино- -имидазооновая
кислота)
4-аминобензойная
кислота
ая кислота
лилпропионовая
кислота)4-минобензолсульфокислота
лилпропионовая кислота)
3.
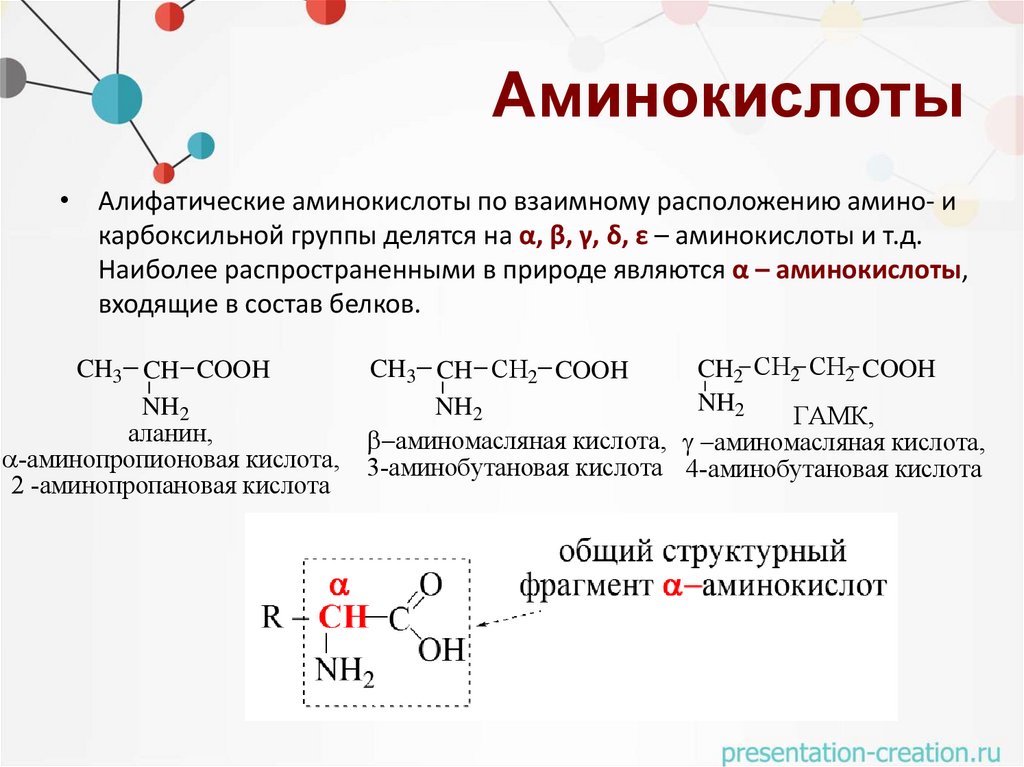
Аминокислоты• Алифатические аминокислоты по взаимному расположению амино- и
карбоксильной группы делятся на α, β, γ, δ, ε – аминокислоты и т.д.
Наиболее распространенными в природе являются α – аминокислоты,
входящие в состав белков.
CH3 CH COOH
NH2
аланин,
-аминопропионовая кислота,
2 -аминопропановая кислота
CH3 CH СН2 COOH
CH2 СН2 СН2 COOH
NH2
NH2
ГАМК,
аминомасляная кислота, аминомасляная кислота,
3-аминобутановая кислота 4-аминобутановая кислота
4.
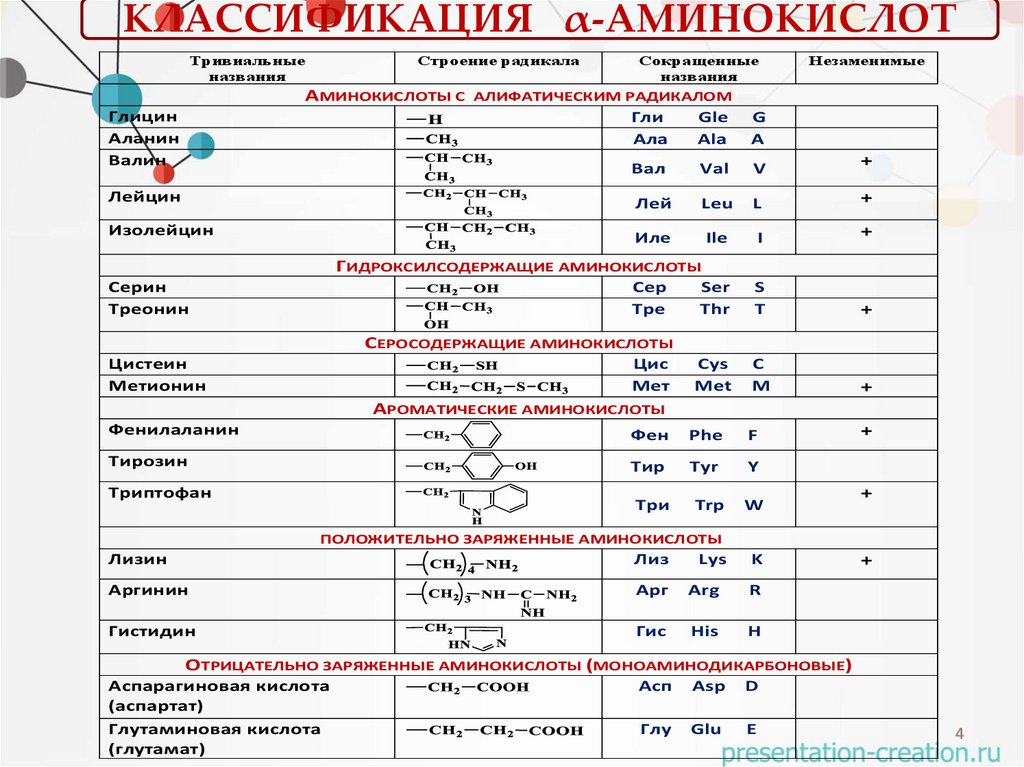
КЛАССИФИКАЦИЯ α-АМИНОКИСЛОТТривиальные
названия
Строение радикала
Сокращенные
названия
АМИНОКИСЛОТЫ С АЛИФАТИЧЕСКИМ РАДИКАЛОМ
Незаменимые
Глицин
Аланин
Валин
Гли
Ала
Gle
Ala
G
A
Вал
Val
V
+
Лейцин
Лей
Leu
L
+
Изолейцин
Иле
Ile
I
+
Ser
Thr
S
T
+
Cys
Met
C
M
+
+
ГИДРОКСИЛСОДЕРЖАЩИЕ АМИНОКИСЛОТЫ
Серин
Треонин
Сер
Тре
СЕРОСОДЕРЖАЩИЕ АМИНОКИСЛОТЫ
Цистеин
Метионин
Цис
Мет
АРОМАТИЧЕСКИЕ АМИНОКИСЛОТЫ
Фенилаланин
Фен
Phe
F
Тирозин
Тир
Tyr
Y
Три
Trp
W
Триптофан
+
ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННЫЕ АМИНОКИСЛОТЫ
Лизин
Лиз
Lys
K
Аргинин
Арг
Arg
R
Гистидин
Гис
His
H
+
ОТРИЦАТЕЛЬНО ЗАРЯЖЕННЫЕ АМИНОКИСЛОТЫ (МОНОАМИНОДИКАРБОНОВЫЕ)
Аспарагиновая кислота
(аспартат)
Глутаминовая кислота
(глутамат)
Асп
Asp
D
Глу
Glu
E
4
5.
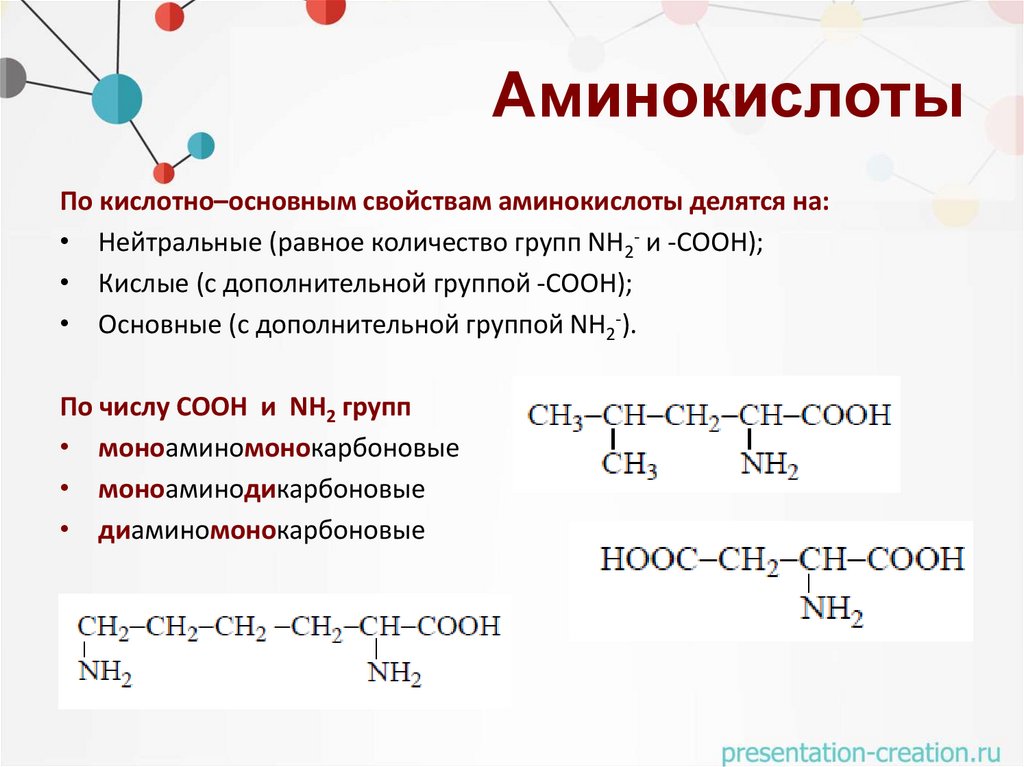
АминокислотыПо кислотно–основным свойствам аминокислоты делятся на:
• Нейтральные (равное количество групп NH2- и -СООН);
• Кислые (с дополнительной группой -СООН);
• Основные (с дополнительной группой NH2-).
По числу COOH и NH2 групп
• моноаминомонокарбоновые
• моноаминодикарбоновые
• диаминомонокарбоновые
6.
АминокислотыПо биологическому значению:
• Заменимые аминокислоты – образуются в организме;
• Незаменимые аминокислоты – те, которые организм не способен
синтезировать, они поступают в составе белков с пищей (валин,
лейцин, изолейцин, треонин, лизин, метионин, фенилаланин,
триптофан)
• Частично (условно) заменимые (аргинин и гистидин у детей, тирозин
- синтезируется из венилаланина, цистеин – синтезируется из серина
при участии метионина)
• Кетогенные – на синтез жиров: лейцин*, изолейцин, тирозин,
фенилаланин, триптофан.
• Глюкогенные – на синтез углеводов: глицин, аспарагиновая и
глутаминовые кислоты, аланин, серин, треонин, валин, аргинин,
гистидин, метионин.
7.
Изомерия аминокислот• Структурная
*
* СН COOH
CH2 СН2 СН2 COOH
CH3 CH2 СН
COOH
CH3 CH
2
NH2
NH2
NH2
аминомасляная кислота, аминомасляная кислота, аминомасляная кислота,
2-аминобутановая кислота 3-аминобутановая кислота 4-аминобутановая кислота
СН3
CH3 C COOH
NH2
аминоизомасляная кислота,
2-амино-2-метилпропановая кислота
* COOH
CH2 СН
NH2 CH3
аминоизомасляная кислота,
3-амино-2-метилпропановая кислота
8.
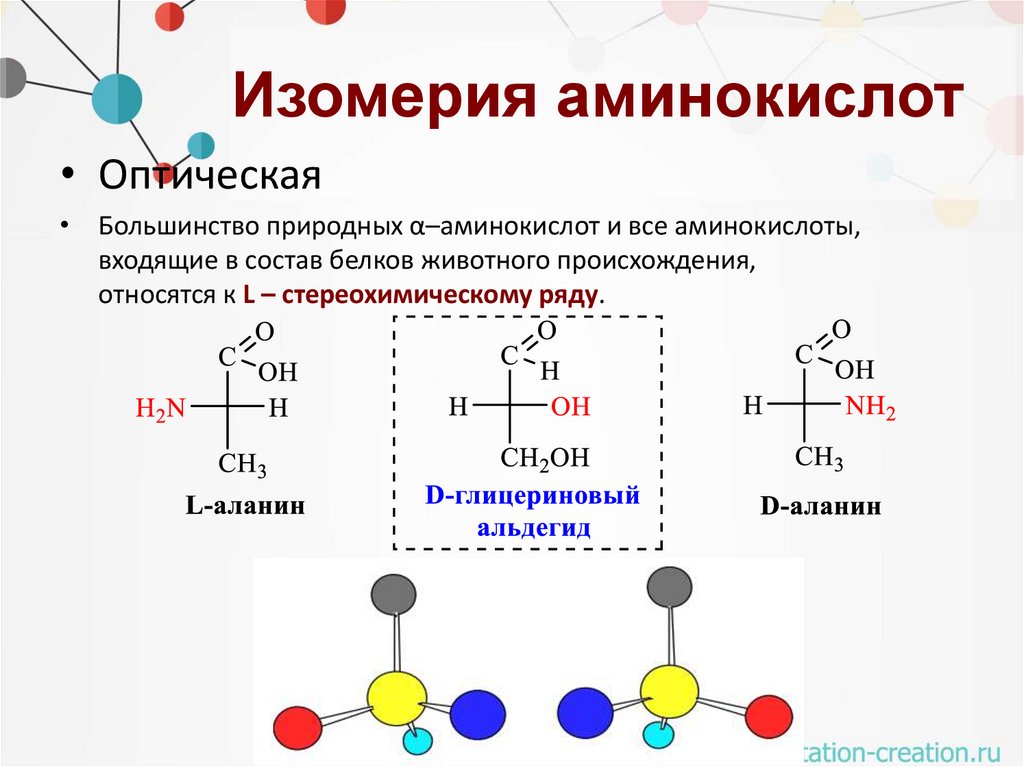
Изомерия аминокислот• Оптическая
• Большинство природных α–аминокислот и все аминокислоты,
входящие в состав белков животного происхождения,
относятся к L – стереохимическому ряду.
9.
Получение α–аминокислот1
Аммонолиз α–галогенокарбоновых кислот
(разработан Э. Фишером)
CH3 CH COOH + 2NH3
CH3 CH COOH + NH4Br
NH2
Br
бромпропионовая кислота аминопропионовая кислота
2
Синтез Штреккера-Зелинского
O
CH3 С
HCN
Н
уксусный
альдегид
NH3
CH C N
-H2O
NH2
OH
2-гидроксипропано2-аминопропанонитрил
нитрил
CH3-CH-C N
CH3
2Н2О, НСl
CH3
CH COOH + NH4Cl
NH2
a-аминопропионовая
кислота
10.
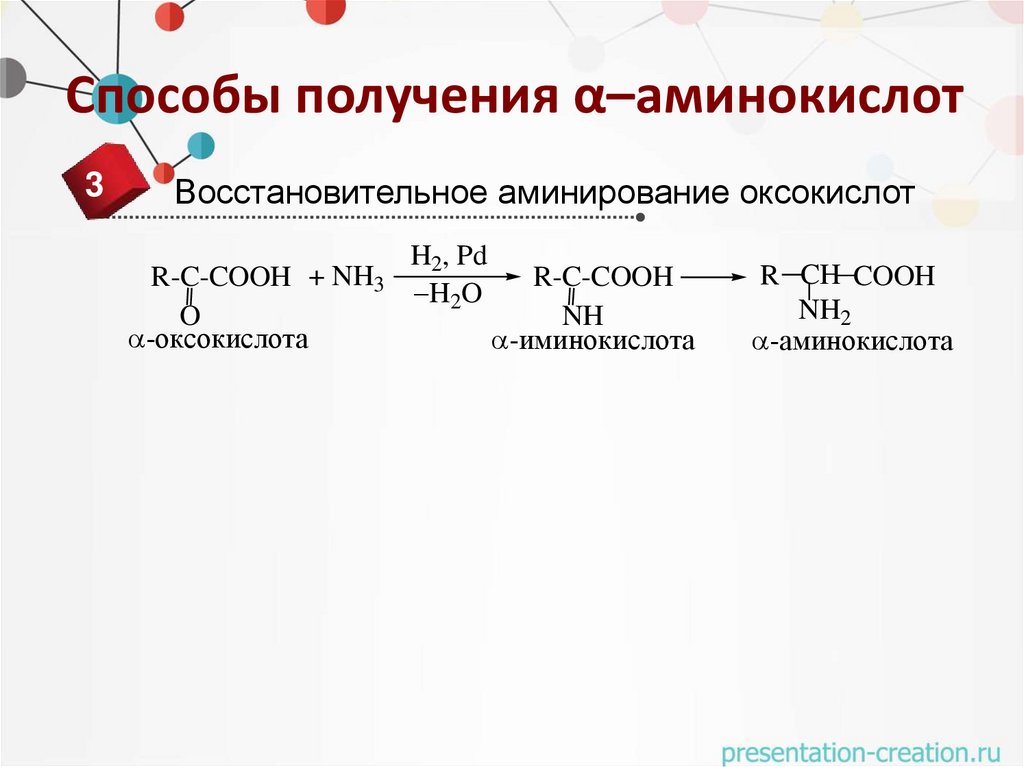
Способы получения α–аминокислот3
Восстановительное аминирование оксокислот
R-C-COOH + NH3
O
-оксокислота
H2, Pd
H2O
R-C-COOH
NH
-иминокислота
R CH COOH
NH2
-аминокислота
11.
Биосинтез α–аминокислот4
Восстановительное аминирование с участием
кофермента НАДН
• Щавелевоуксусная кислоты - > аспарагиновая кислота
• Пировиноградная кислота -> аланин
12.
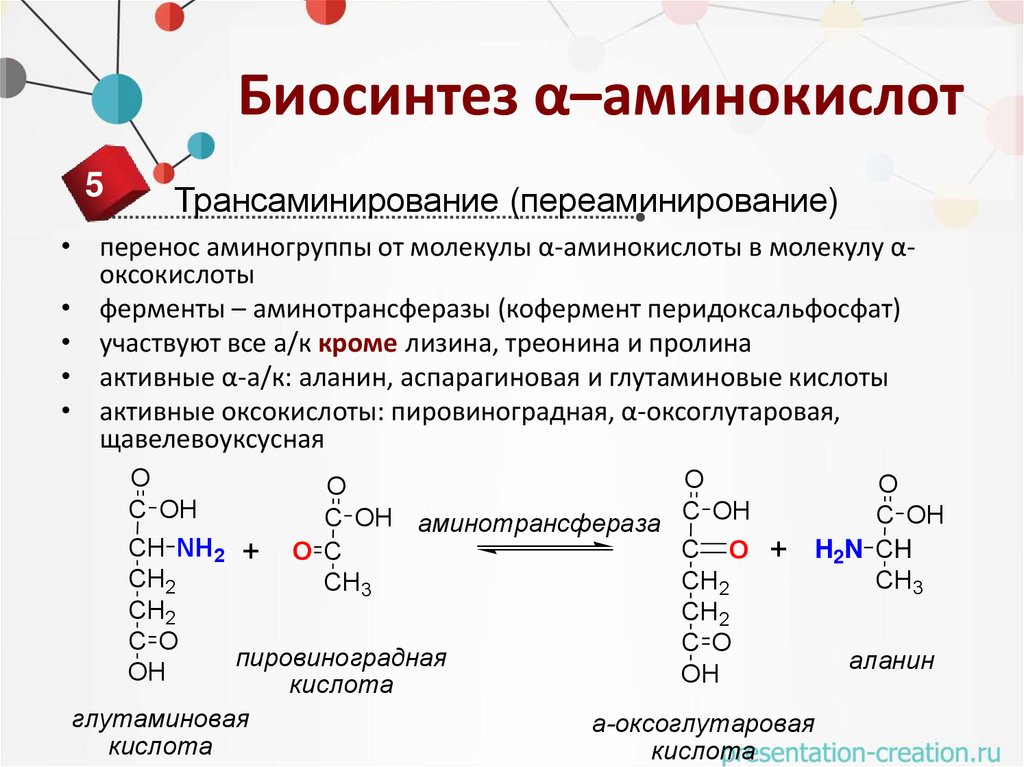
Биосинтез α–аминокислот5
Трансаминирование (переаминирование)
• перенос аминогруппы от молекулы α-аминокислоты в молекулу αоксокислоты
• ферменты – аминотрансферазы (кофермент перидоксальфосфат)
• участвуют все а/к кроме лизина, треонина и пролина
• активные α-а/к: аланин, аспарагиновая и глутаминовые кислоты
• активные оксокислоты: пировиноградная, α-оксоглутаровая,
щавелевоуксусная
O
O
C OH
C OH аминотрансфераза
CH NH2 + O C
CH2
CH3
CH2
C O
пировиноградная
OH
кислота
глутаминовая
кислота
O
C OH
C O +
CH2
CH2
C O
OH
O
C OH
H2N CH
CH3
a-оксоглутаровая
кислота
аланин
13.
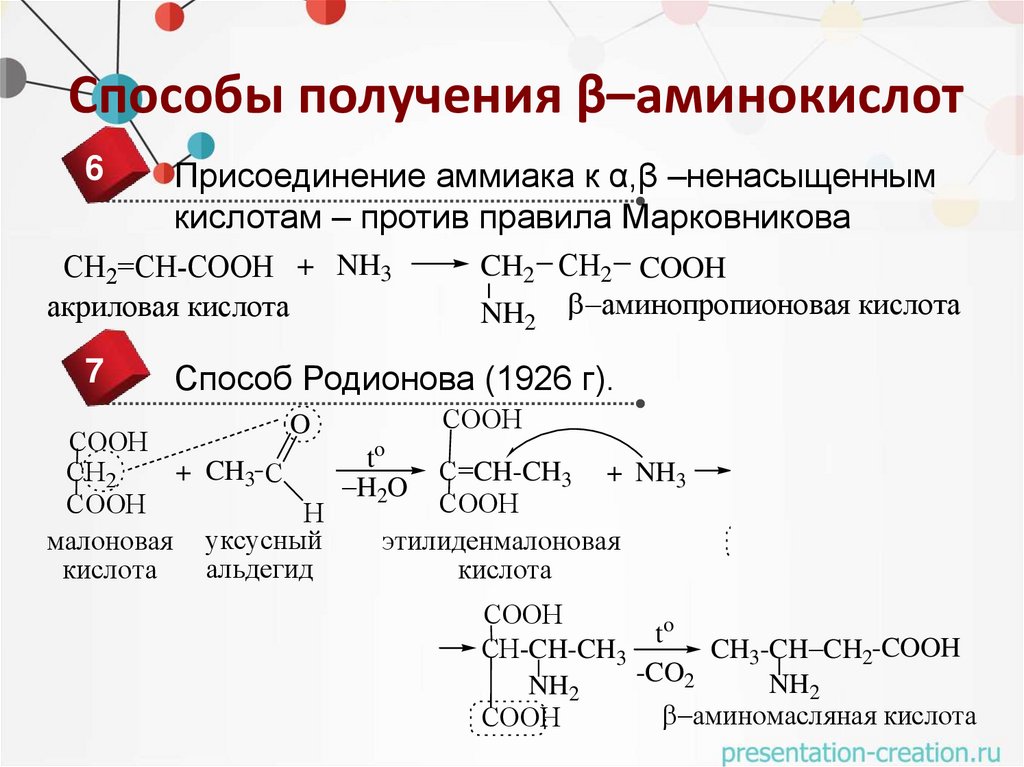
Способы получения β–аминокислот6
Присоединение аммиака к α,β –ненасыщенным
кислотам – против правила Марковникова
СН2=СН-СООН + NH3
акриловая кислота
7
CH2 СН2 COOH
NH аминопропионовая кислота
2
Способ Родионова (1926 г).
O
СООН
СООН
СООН
o
to
t
+ CH3 С
С=CH-CH3 + NH3
СН2
СH-CH-CH3
CH3 H2O
-CO2
СООН
СООН
NH2
Н
амином
СООН
малоновая уксусный
этилиденмалоновая
альдегид
кислота
кислота
СООН
O
СООН
o
to
t
С=CH-CH3 + NH3
СH-CH-CH3
CH3-CH CH2-COOH
3 С
H2O
-CO2
СООН
NH2
NH2
Н
аминомасляная кислота
усный
СООН
этилиденмалоновая
дегид
кислота
14.
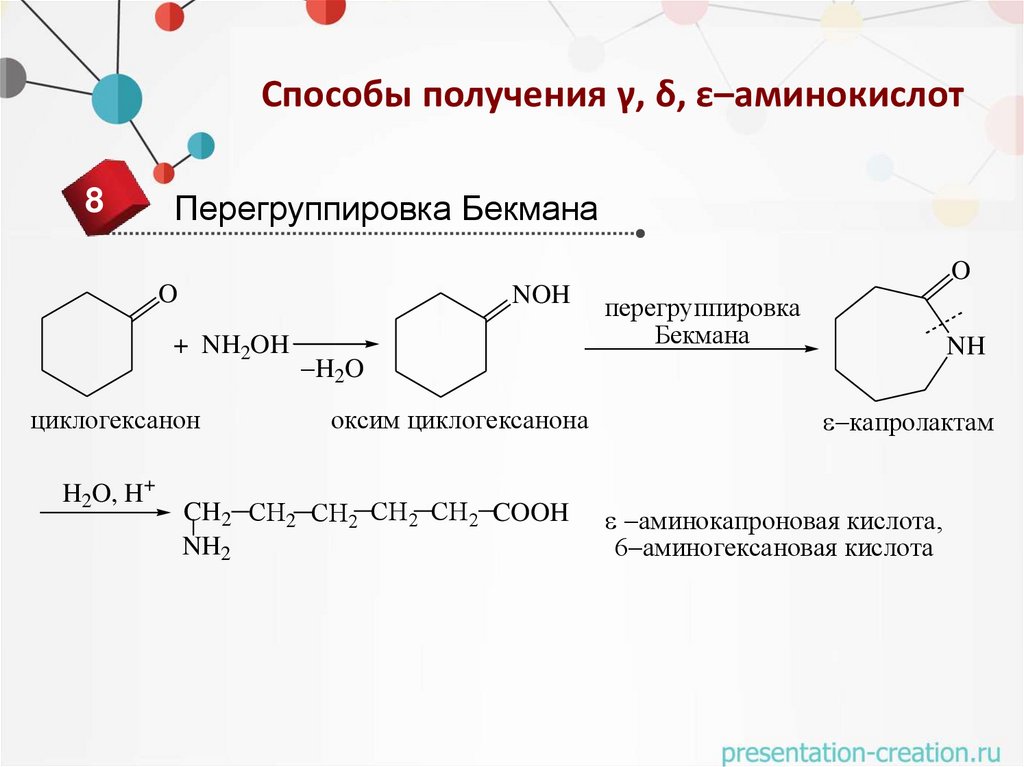
Способы получения γ, δ, ε–аминокислот8
Перегруппировка Бекмана
O
O
NOH
+ NH2OH
циклогексанон
H2O, H+
перегруппировка
Бекмана
NH
H2O
оксим циклогексанона
CH2 СН2 СН2 СН2 СН2 COOH
NH2
капролактам
аминокапроновая кислота,
6 аминогексановая кислота
15.
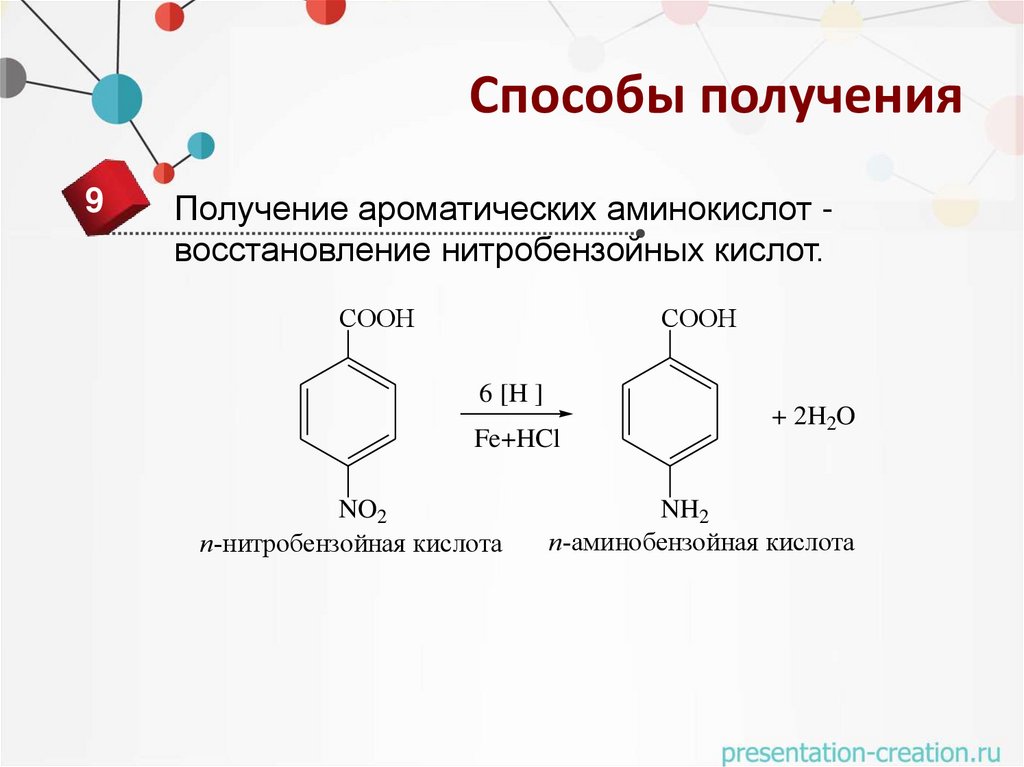
Способы получения9
Получение ароматических аминокислот восстановление нитробензойных кислот.
СООН
СООН
6 [H ]
Fe+HCl
NO2
п-нитробензойная кислота
+ 2H2O
NH2
п-аминобензойная кислота
16.
Физические свойства• белые кристаллические вещества
• хорошо растворимы в воде, хуже в органических
растворителях
• сладкие на вкус
• высокие температуры плавления
• кристаллизуются из нейтральных водных
растворов
17.
Изоэлектрическая точка• Изоэлектрическая точка - это значение рН-среды, при
котором заряд аминокислоты равен нулю, электрически
нейтрален (обозначается рI).
18.
Химические свойства19.
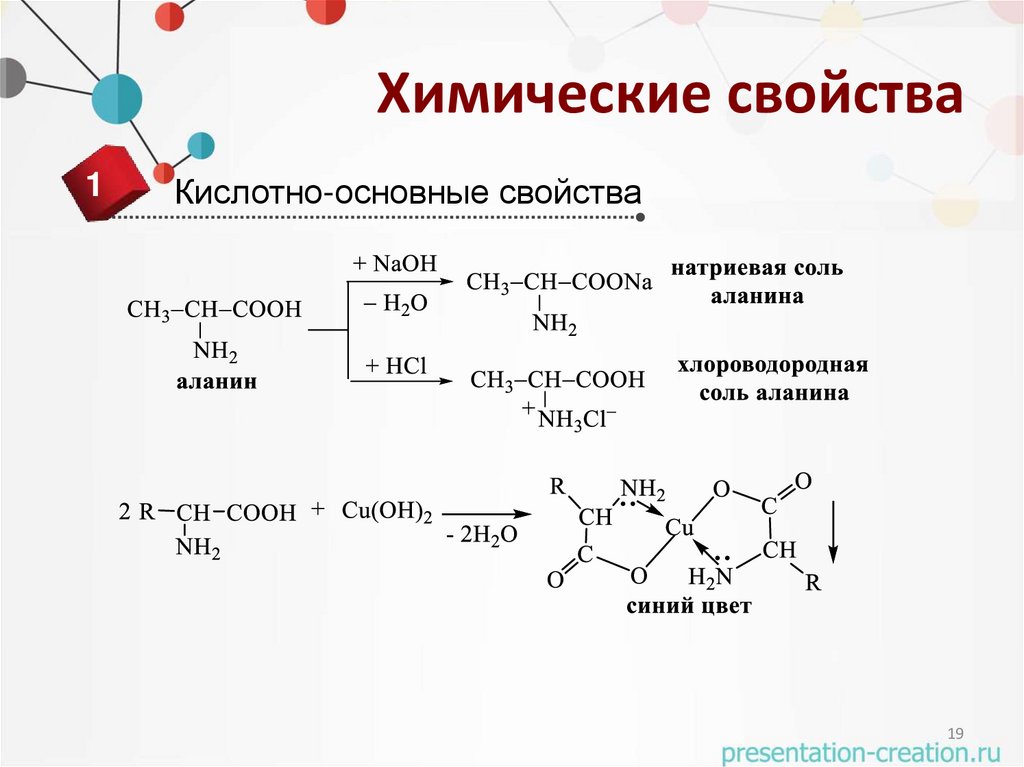
Химические свойства1
Кислотно-основные свойства
19
20.
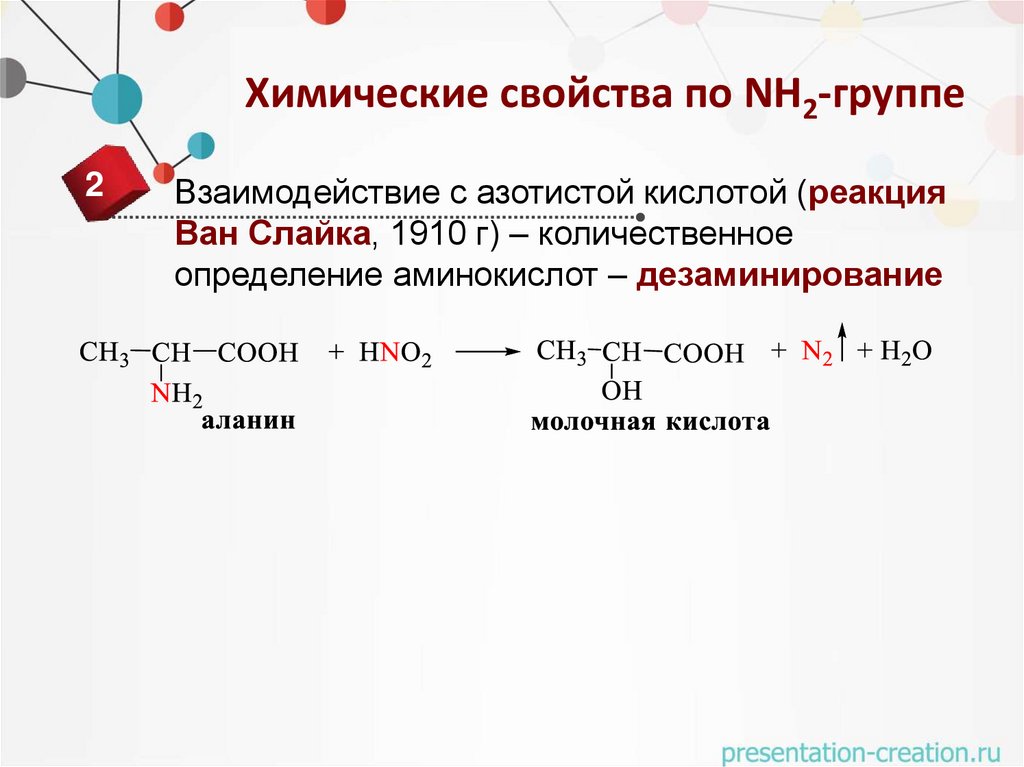
Химические свойства по NH2-группе2
Взаимодействие с азотистой кислотой (реакция
Ван Слайка, 1910 г) – количественное
определение аминокислот – дезаминирование
21.
Химические свойства по NH2-группе2
Неокислительное дезаминирование –
это ферментативное внутримолекулярное дезаминирование,
без участия кислорода (образуются α,β-ненасыщенные
кислоты).
21
22.
Химические свойства по NH2-группе2
Окислительное дезаминирование –
катализирует фермент дегидрогеназа, коферментом может
быть как НАД, так и НАДФ.
22
23.
Химические свойства по NH2-группе3
Взаимодействие с формальдегидом –
метод Сёренсена (формольное титрование)
24.
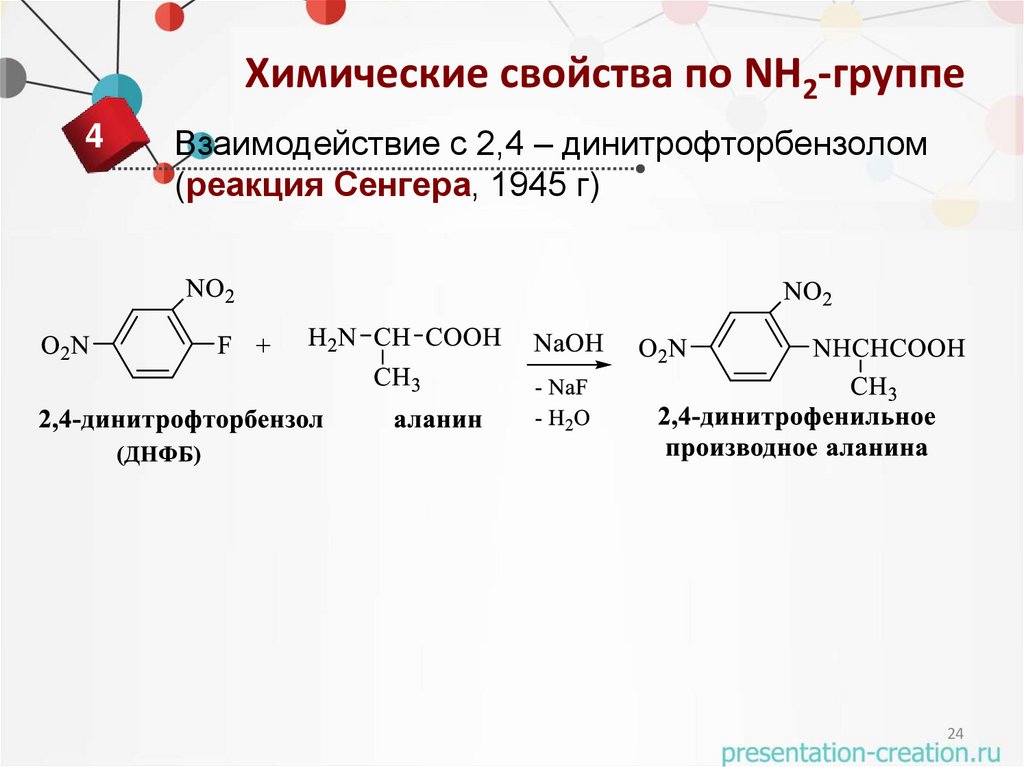
Химические свойства по NH2-группе4
Взаимодействие с 2,4 – динитрофторбензолом
(реакция Сенгера, 1945 г)
24
25.
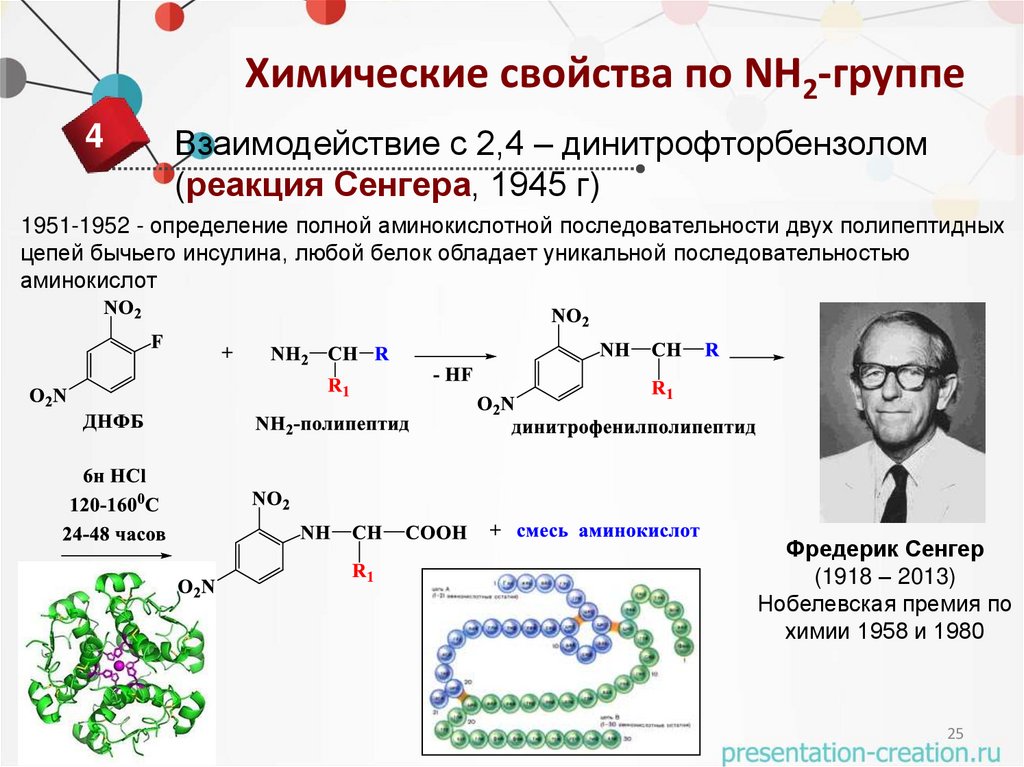
Химические свойства по NH2-группе4
Взаимодействие с 2,4 – динитрофторбензолом
(реакция Сенгера, 1945 г)
1951-1952 - определение полной аминокислотной последовательности двух полипептидных
цепей бычьего инсулина, любой белок обладает уникальной последовательностью
аминокислот
Фредерик Сенгер
(1918 – 2013)
Нобелевская премия по
химии 1958 и 1980
25
26.
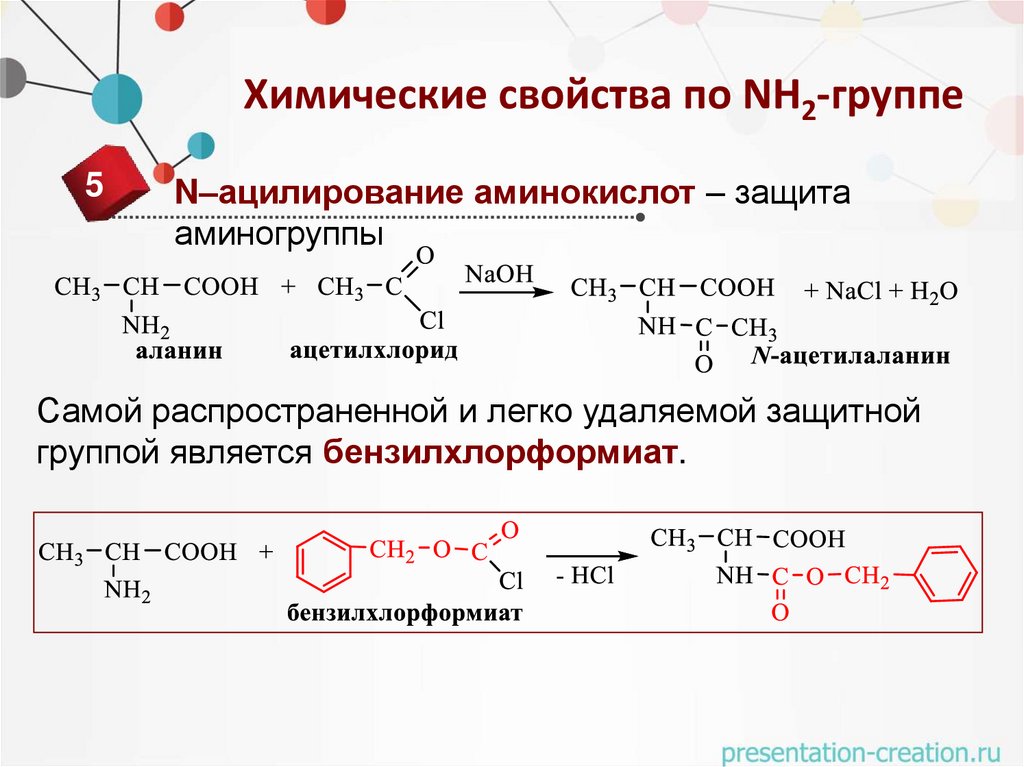
Химические свойства по NH2-группе5
N–ацилирование аминокислот – защита
аминогруппы
Самой распространенной и легко удаляемой защитной
группой является бензилхлорформиат.
27.
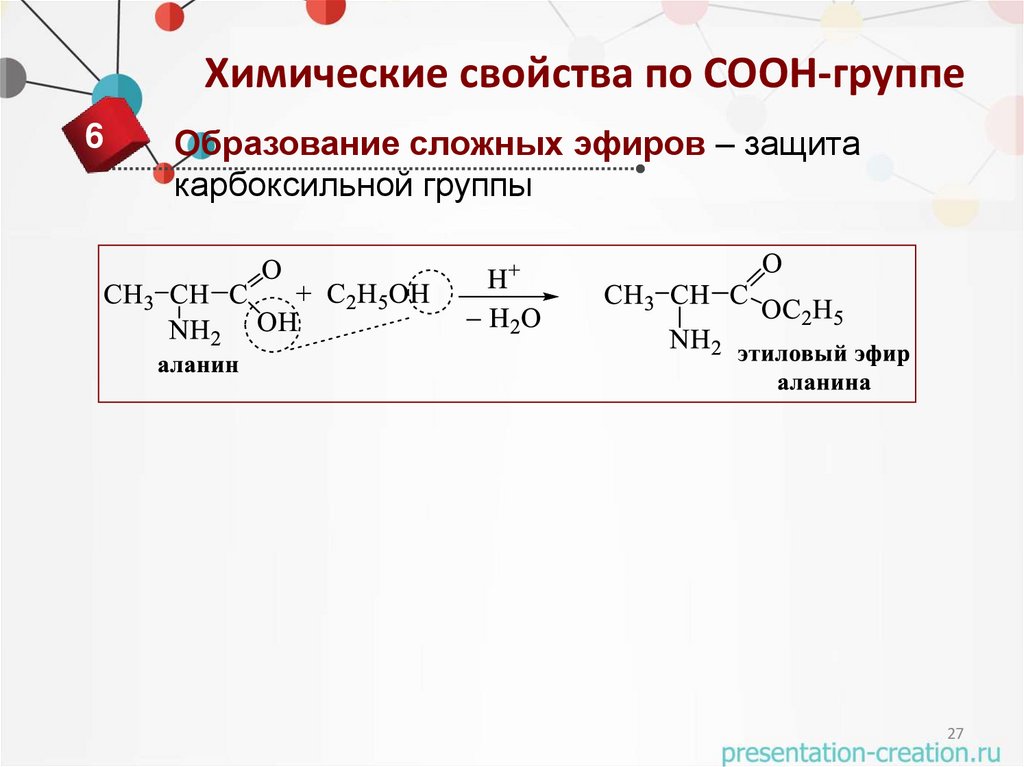
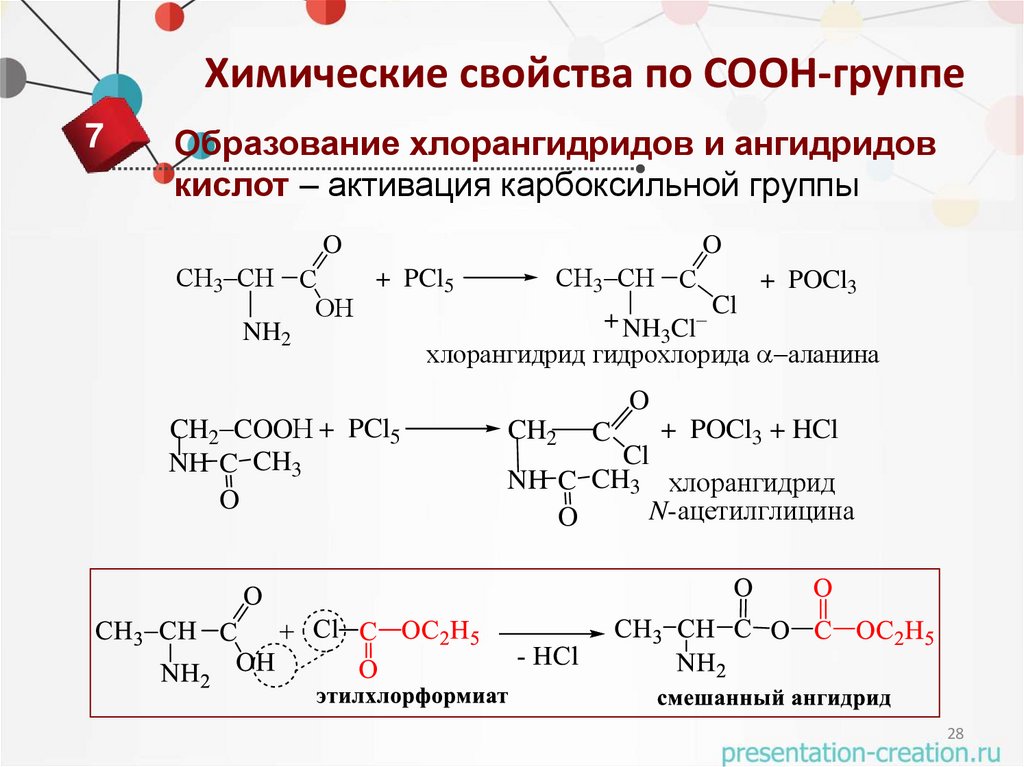
Химические свойства по COOH-группе6
Образование сложных эфиров – защита
карбоксильной группы
27
28.
Химические свойства по COOH-группе7
Образование хлорангидридов и ангидридов
кислот – активация карбоксильной группы
O
O
СН3 СН С
+ PCl5
СН3 СН С
+ POCl3
Cl
ОН
+
NH3Cl
NH2
хлорангидрид гидрохлорида аланина
CH2 COOН + PCl5
NH C CH3
O
O
CH2
C
+ POCl3 + HCl
Cl
NH C CH3 хлорангидрид
N-ацетилглицина
O
28
29.
Химические свойства по COOH-группе8
Декарбоксилирование α-аминокислот
Ba(OH)2, toC
HOOC CH2 CH2 CH COOH
H2N CH2 CH2 CH2 COOH + BaCO3
CO
2
NH2
аминомасляная кислота
глутаминовая кислота
29
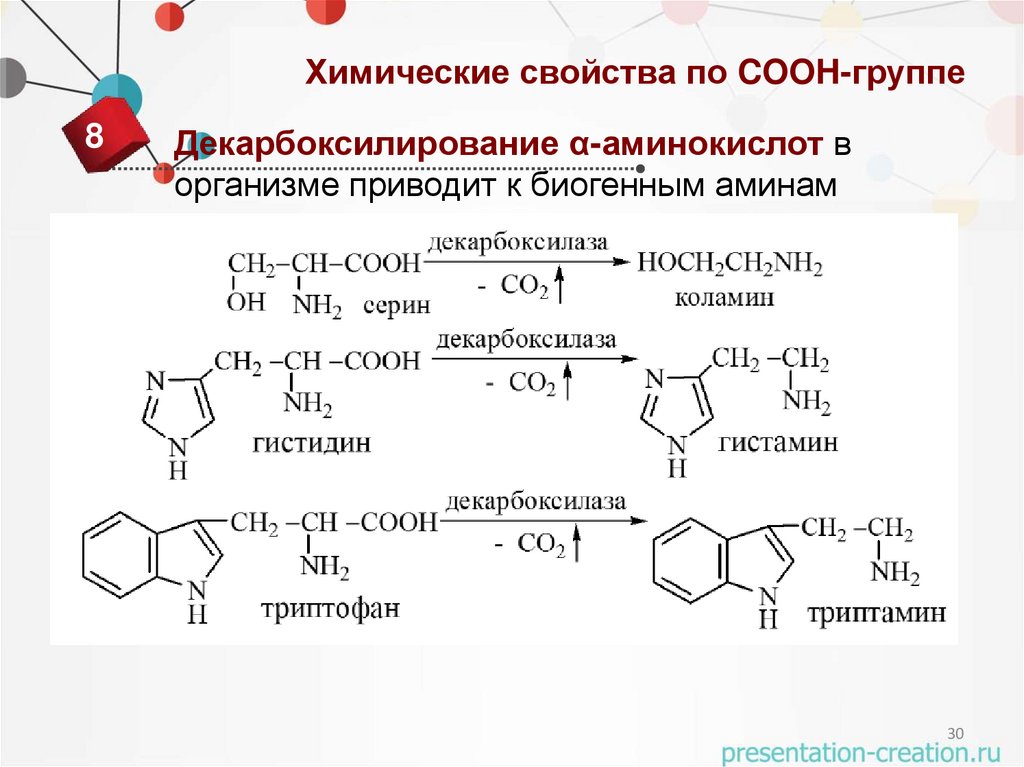
30.
Химические свойства по COOH-группе8
Декарбоксилирование α-аминокислот в
организме приводит к биогенным аминам
30
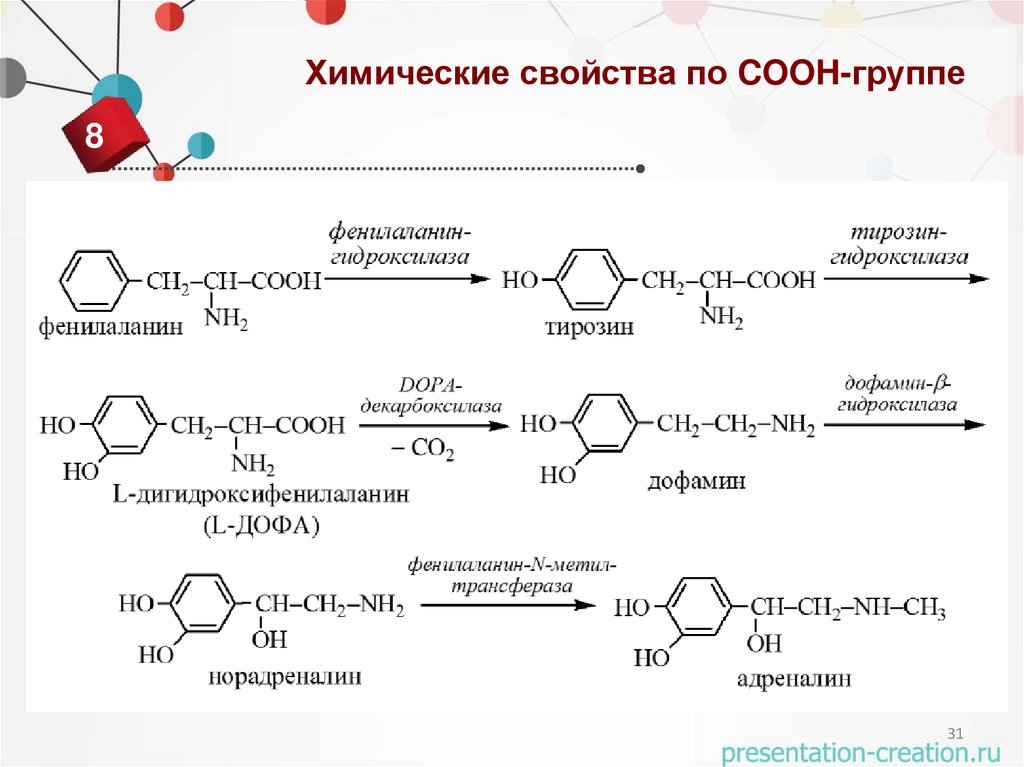
31.
Химические свойства по COOH-группе8
31
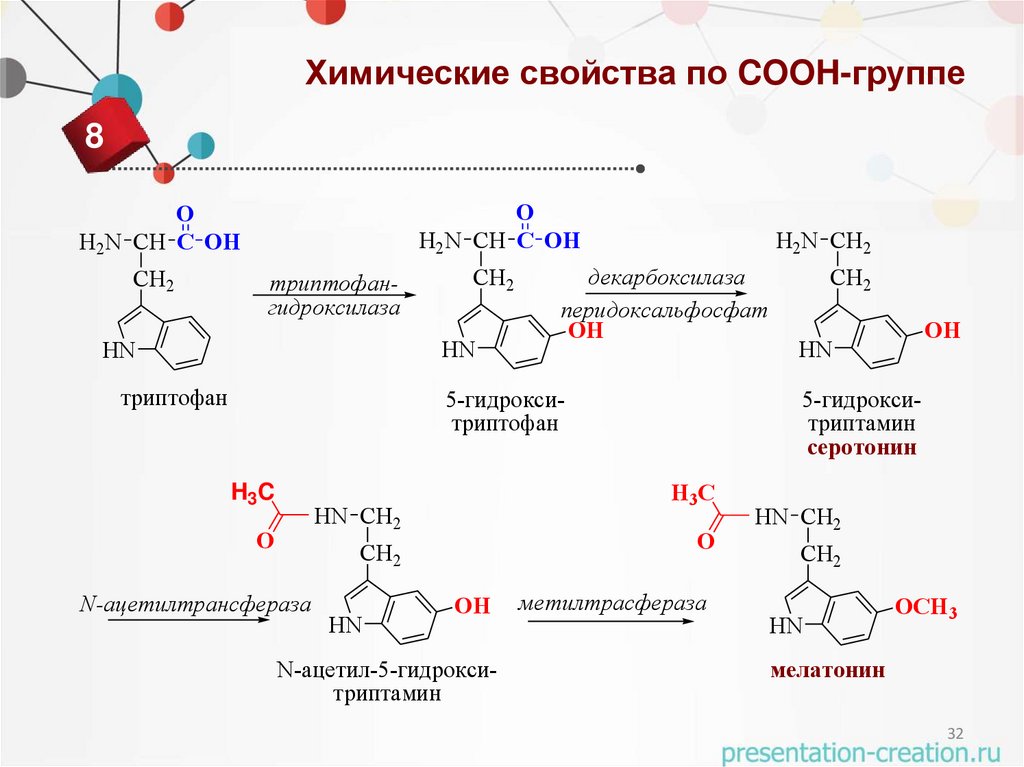
32.
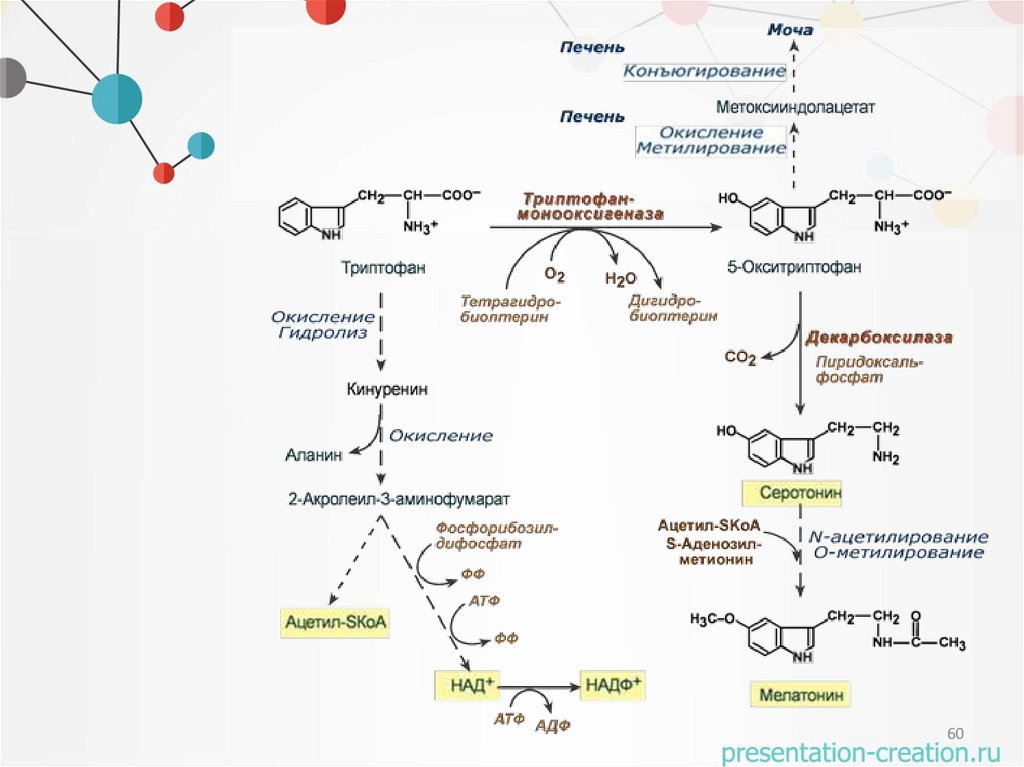
Химические свойства по COOH-группе8
O
H2N CH C OH
O
H2N CH C OH
CH2
триптофангидроксилаза
CH2
HN
HN
триптофан
H2N CH2
декарбоксилаза
перидоксальфосфат
OH
5-гидрокситриптофан
H3C
O
O
CH2
N-ацетилтрансфераза
HN
OH
N-ацетил-5-гидрокситриптамин
OH
HN
5-гидрокситриптамин
серотонин
H3 C
HN CH2
CH2
метилтрасфераза
HN CH2
CH2
HN
OCH3
мелатонин
32
33.
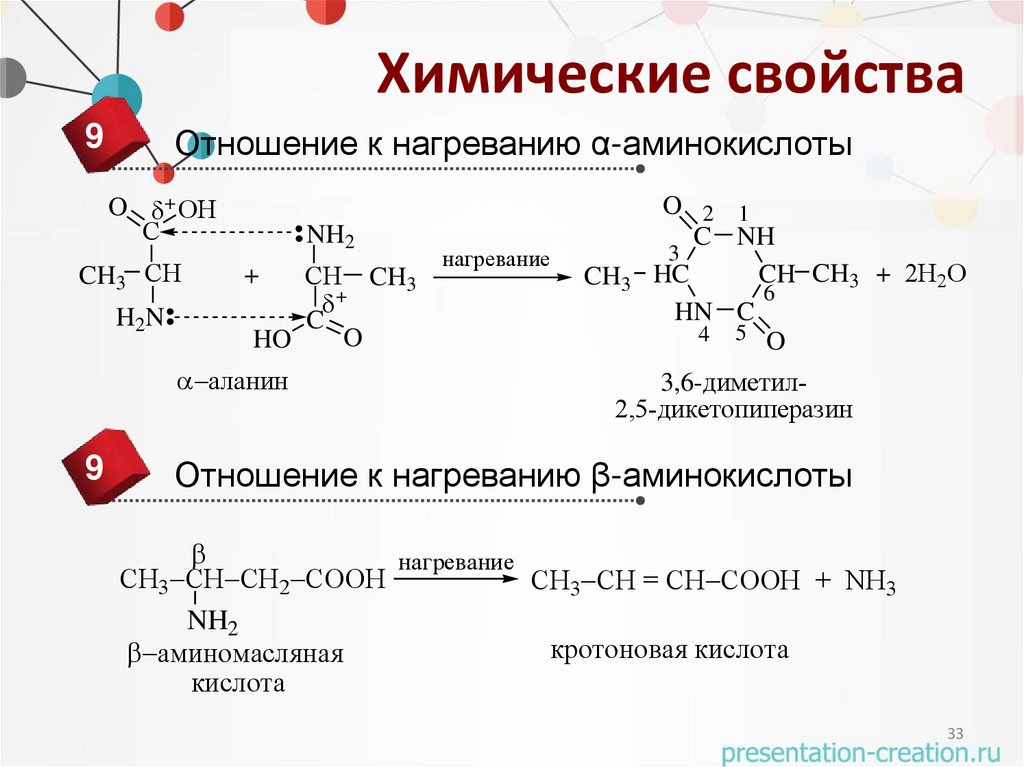
Химические свойства9
Отношение к нагреванию α-аминокислоты
O + ОН
С
CH3 СН
H2N
NH2
СН CH3
+
C
O
HO
+
аланин
9
нагревание
CH3
O 2 1
C NH
3
HC
CH CH3 + 2Н2О
6
HN C
4 5 O
3,6-диметил2,5-дикетопиперазин
Отношение к нагреванию β-аминокислоты
нагревание
СН3 СН СН2 СООН
СН3 СН = СН СООН + NH3
NH2
кротоновая кислота
аминомасляная
кислота
33
34.
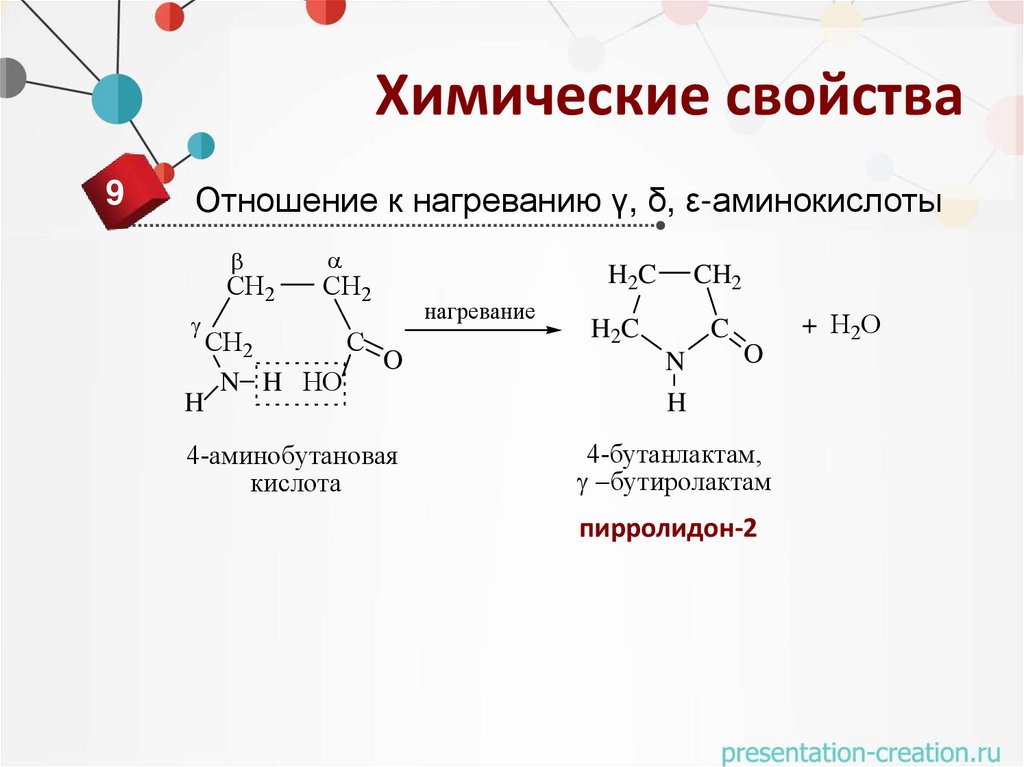
Химические свойства9
Отношение к нагреванию γ, δ, ε-аминокислоты
H2C
CH2
СН2
С
O
N H НО
H2C
C
4-аминобутановая
кислота
4-бутанлактам,
бутиролактам
СН2
H
СН2
нагревание
N
H
O
пирролидон-2
+ Н2О
35.
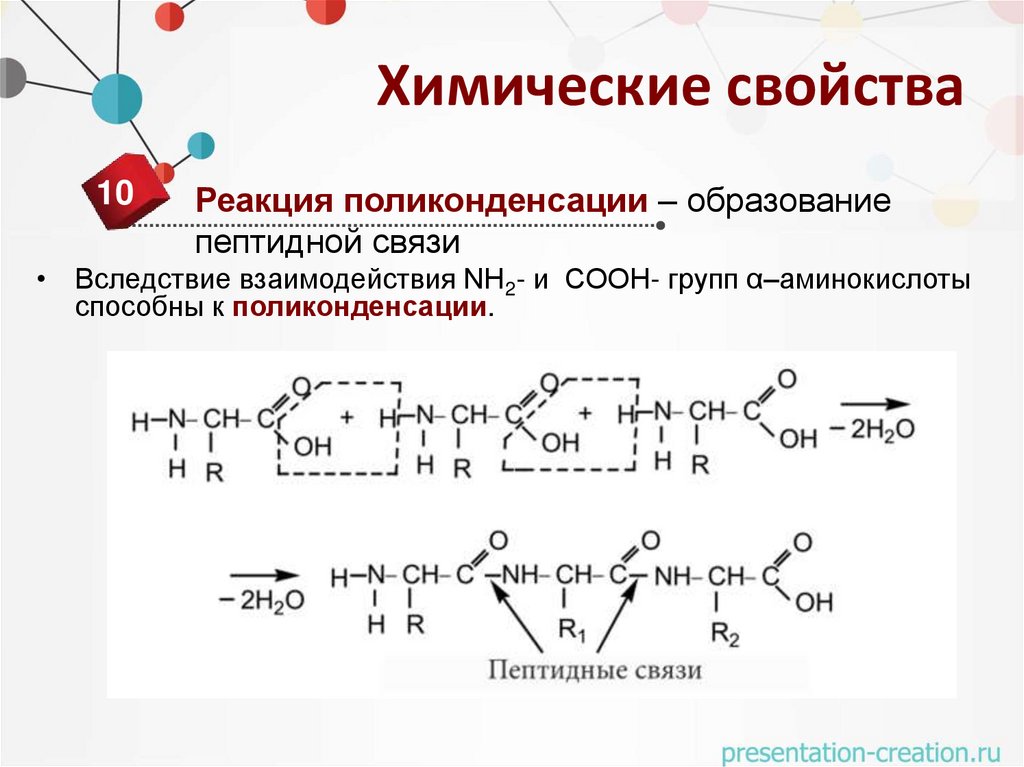
Химические свойства10
Реакция поликонденсации – образование
пептидной связи
• Вследствие взаимодействия NH2- и COOH- групп α–аминокислоты
способны к поликонденсации.
36.
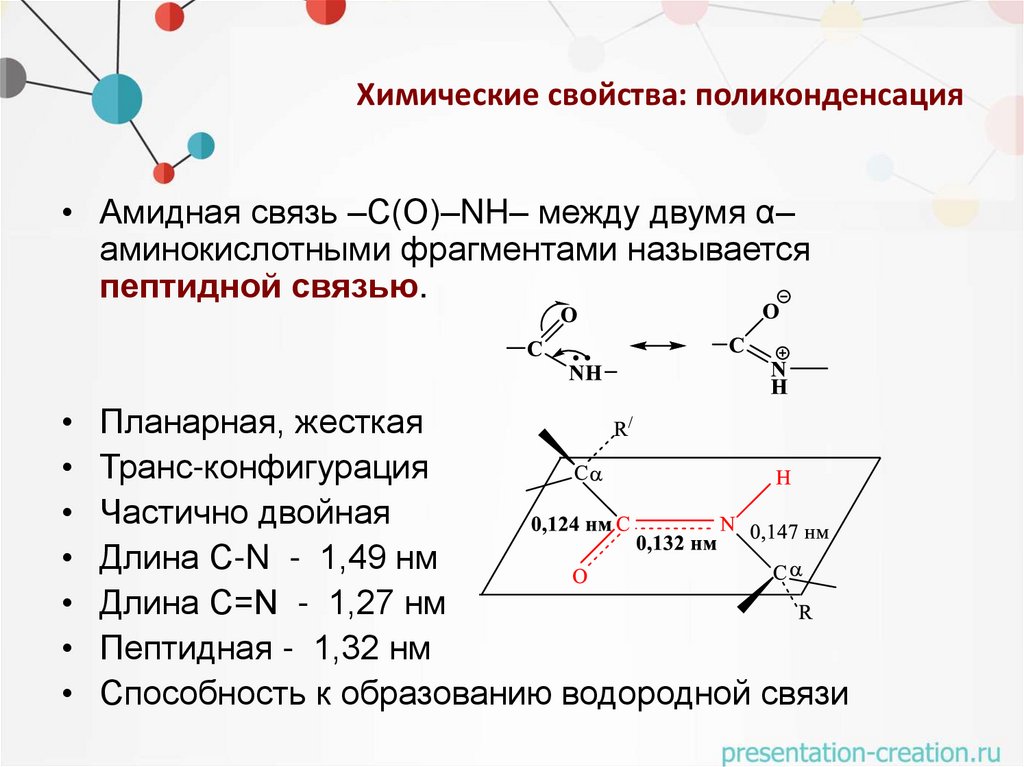
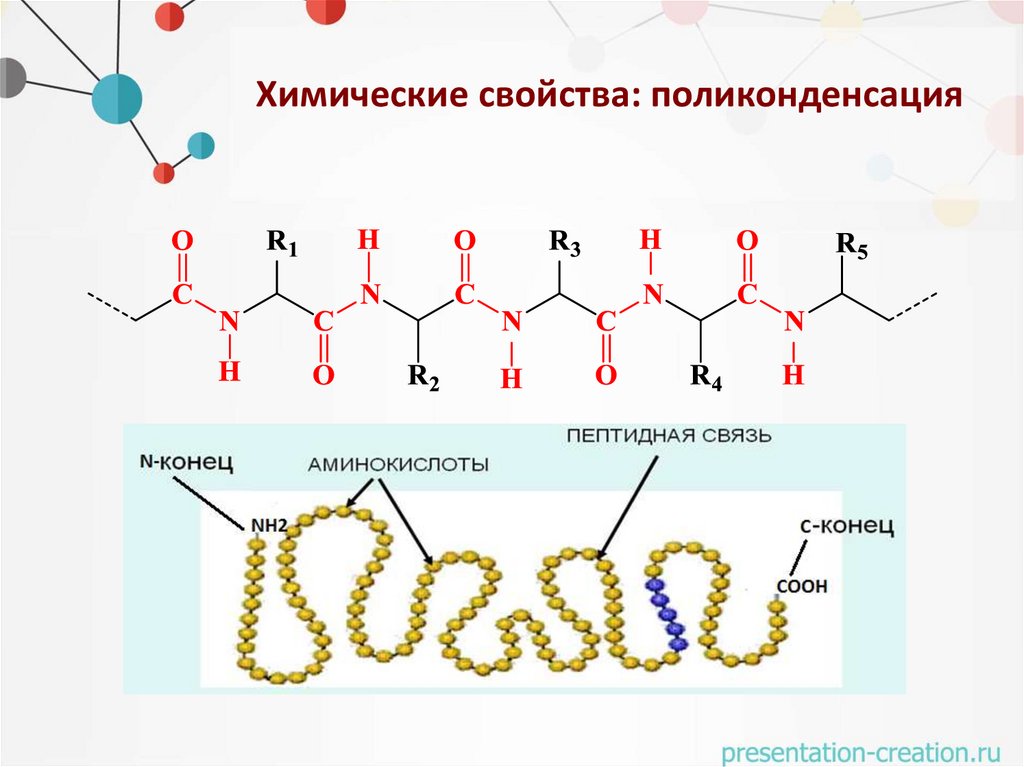
Химические свойства: поликонденсация• Амидная связь –С(О)–NH– между двумя α–
аминокислотными фрагментами называется
пептидной связью.
Планарная, жесткая
Транс-конфигурация
Частично двойная
Длина С-N - 1,49 нм
Длина С=N - 1,27 нм
Пептидная - 1,32 нм
Способность к образованию водородной связи
37.
Химические свойства: поликонденсация38.
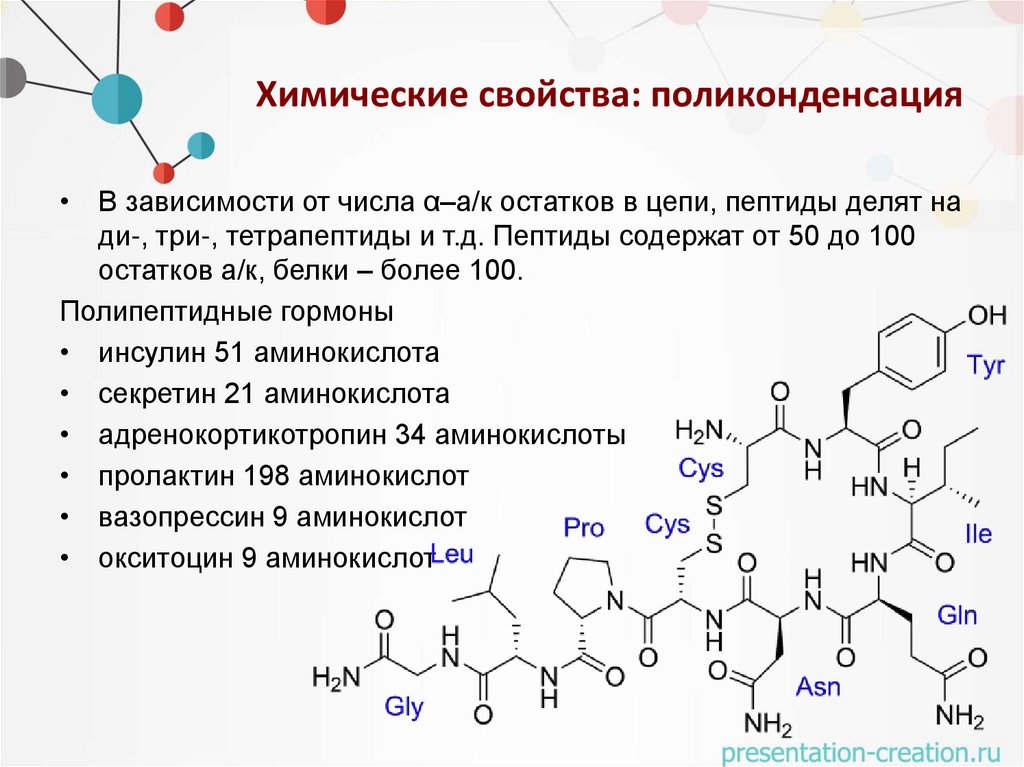
Химические свойства: поликонденсация• В зависимости от числа α–а/к остатков в цепи, пептиды делят на
ди-, три-, тетрапептиды и т.д. Пептиды содержат от 50 до 100
остатков а/к, белки – более 100.
Полипептидные гормоны
• инсулин 51 аминокислота
• секретин 21 аминокислота
• адренокортикотропин 34 аминокислоты
• пролактин 198 аминокислот
• вазопрессин 9 аминокислот
• окситоцин 9 аминокислот
39.
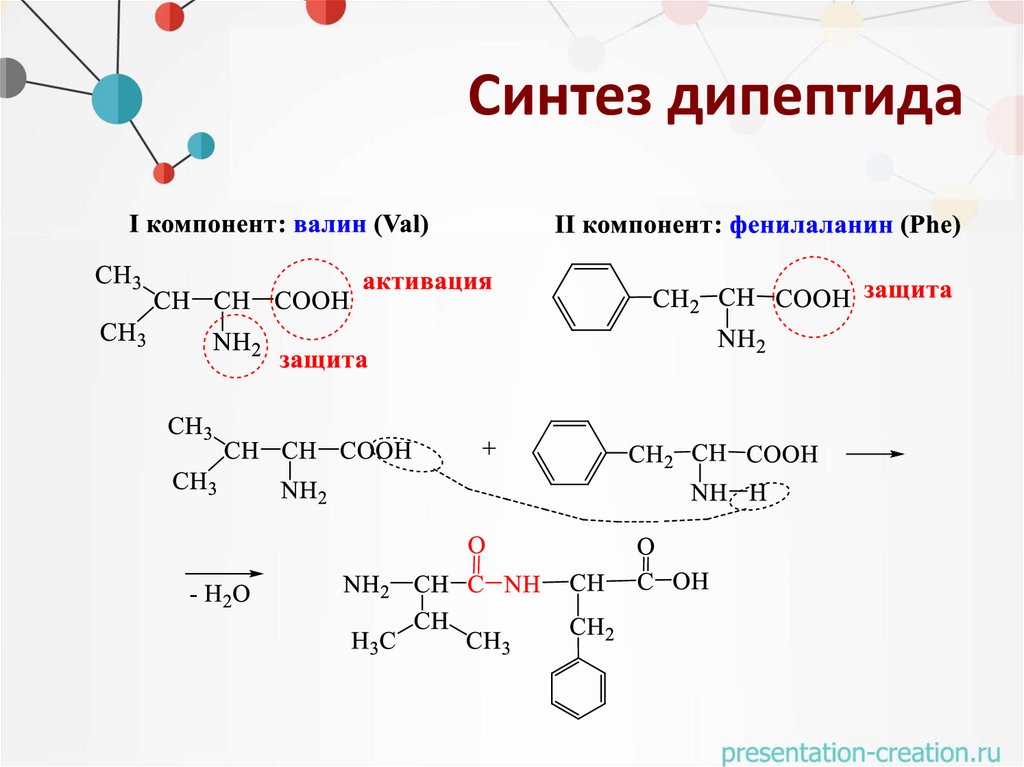
Синтез дипептида40.
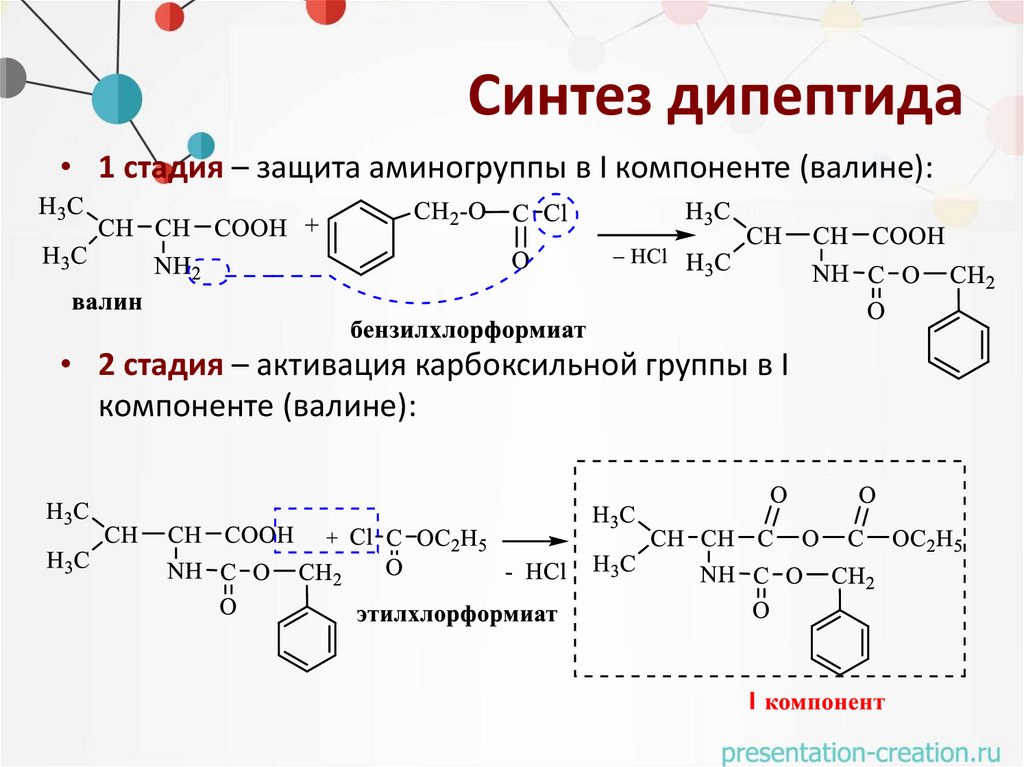
Синтез дипептида• 1 стадия – защита аминогруппы в I компоненте (валине):
• 2 стадия – активация карбоксильной группы в I
компоненте (валине):
41.
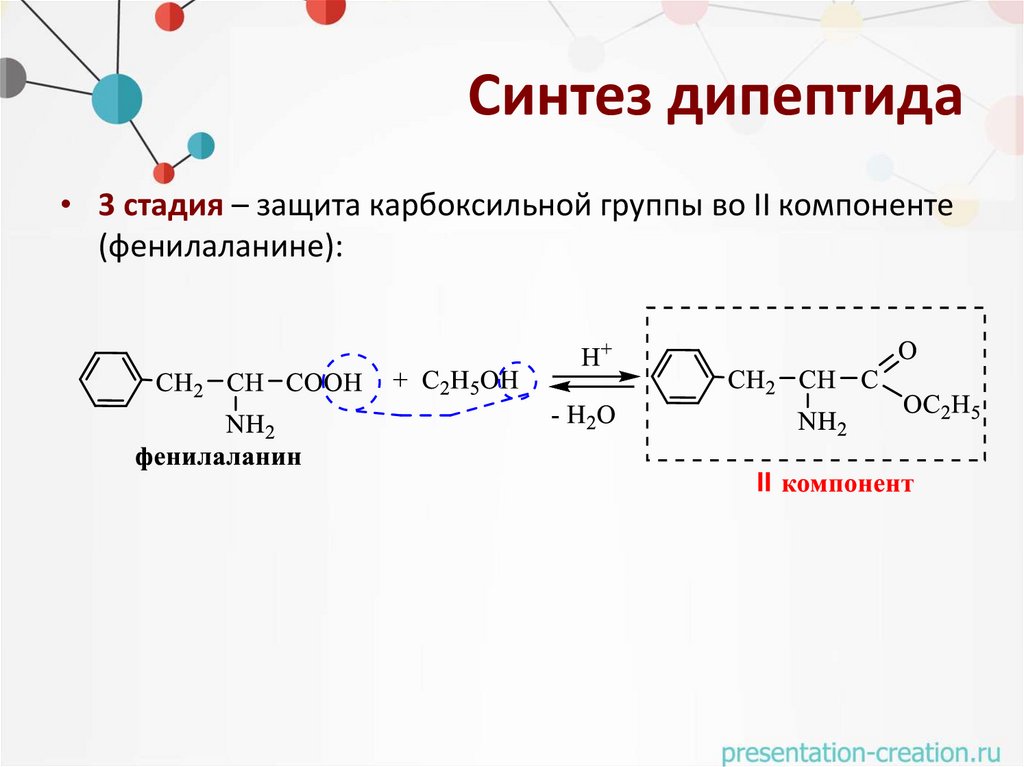
Синтез дипептида• 3 стадия – защита карбоксильной группы во II компоненте
(фенилаланине):
42.
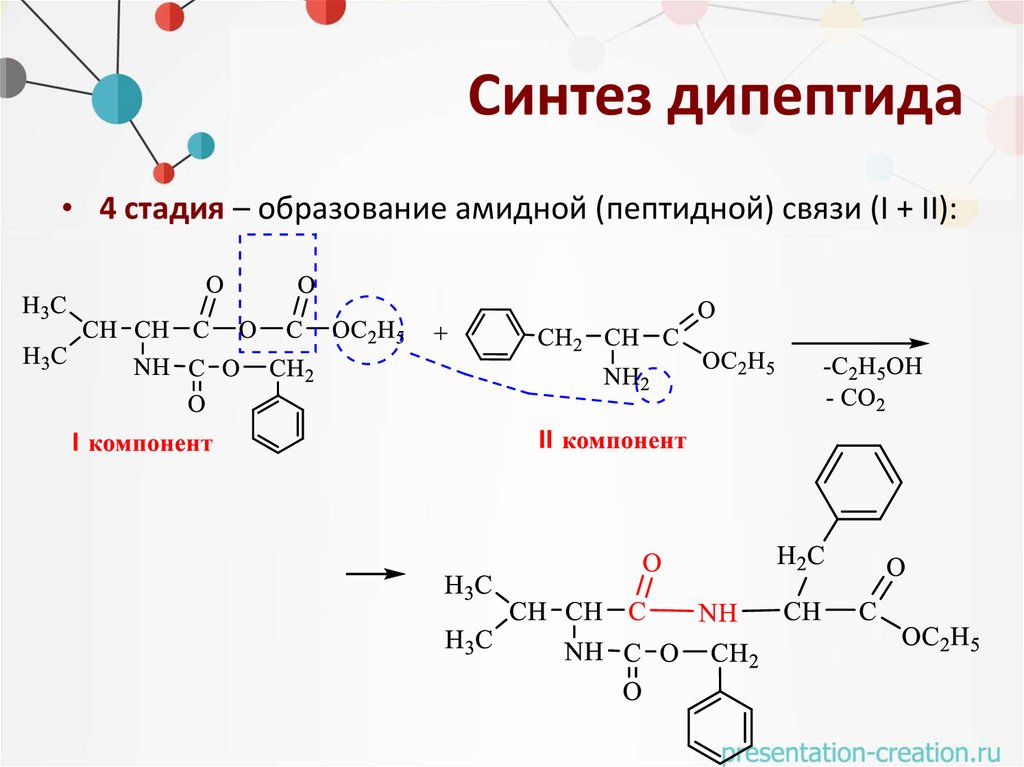
Синтез дипептида• 4 стадия – образование амидной (пептидной) связи (I + II):
43.
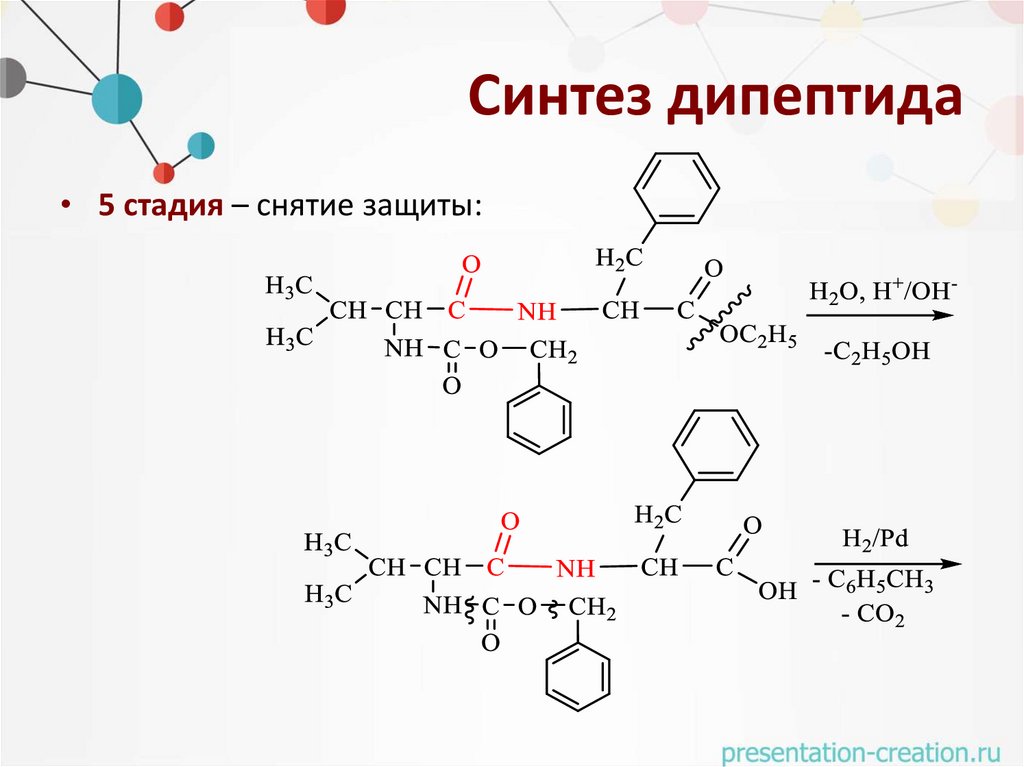
Синтез дипептида• 5 стадия – снятие защиты:
44.
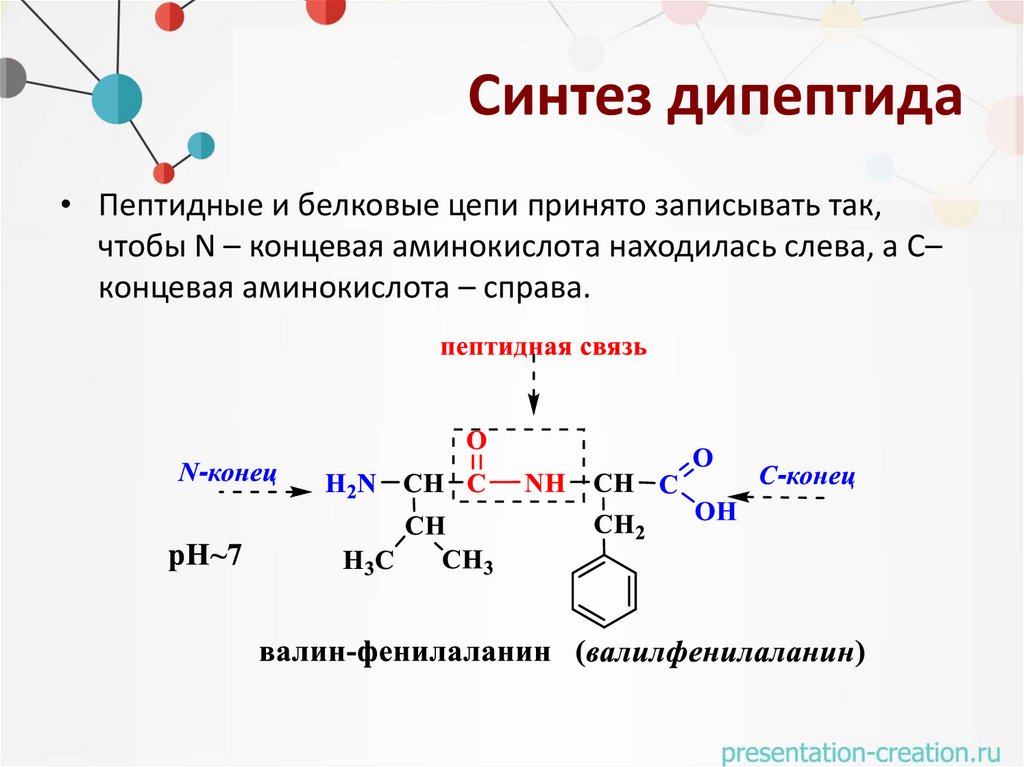
Синтез дипептида• Пептидные и белковые цепи принято записывать так,
чтобы N – концевая аминокислота находилась слева, а С–
концевая аминокислота – справа.
45.
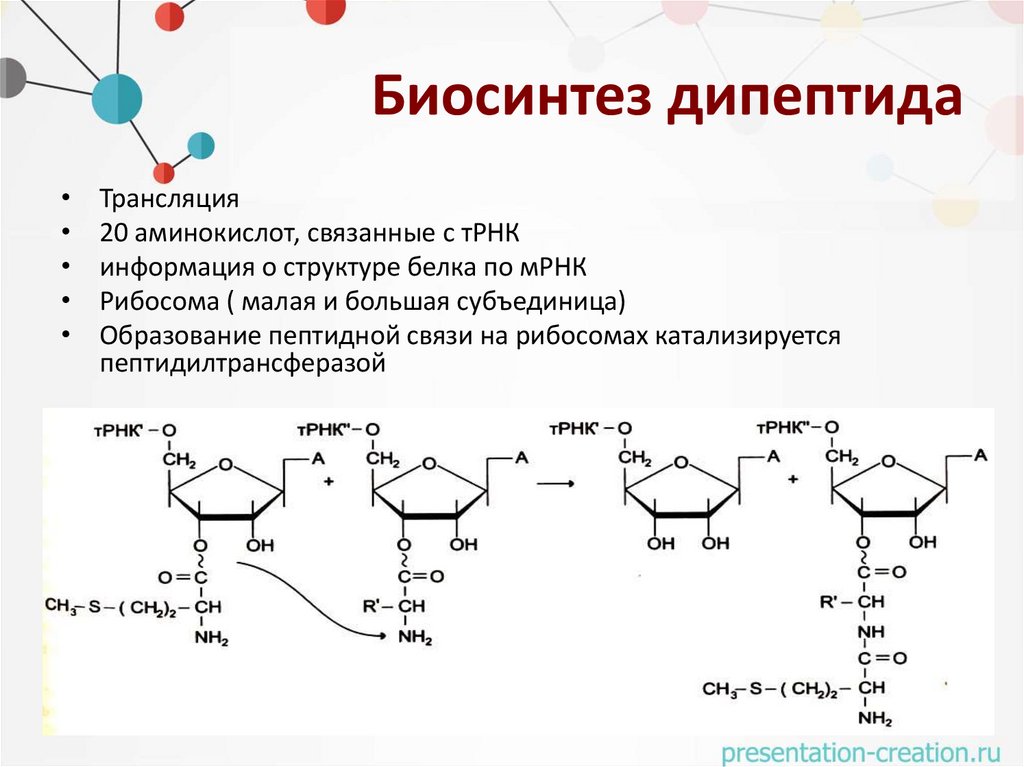
Биосинтез дипептидаТрансляция
20 аминокислот, связанные с тРНК
информация о структуре белка по мРНК
Рибосома ( малая и большая субъединица)
Образование пептидной связи на рибосомах катализируется
пептидилтрансферазой
46.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ• Высокая вязкость (золь-гель)
• Низкая способность к диффузии (диализ)
• Низкое осмотическое, высокое онкотическое давление (
белок в крови меньше 30* г/л – отеки, в норме
содержание белка в сыворотке крови составляет 65-85 г/л)
• Опалесценция (нефелометрия)
• Амфотерные свойства белков (электрофорез,
ионнообменная хроматография)
• Растворимость белков зависит от природы белка и состава
растворителя, рН среды (при 50% насыщении (NH4)2SO4
осаждаются глобулины, 100% - альбумины).
47.
Уровни организации белковой молекулы• Первичная структура - это определенный состав и
последовательность α-аминокислот в полипептидной цепи
48.
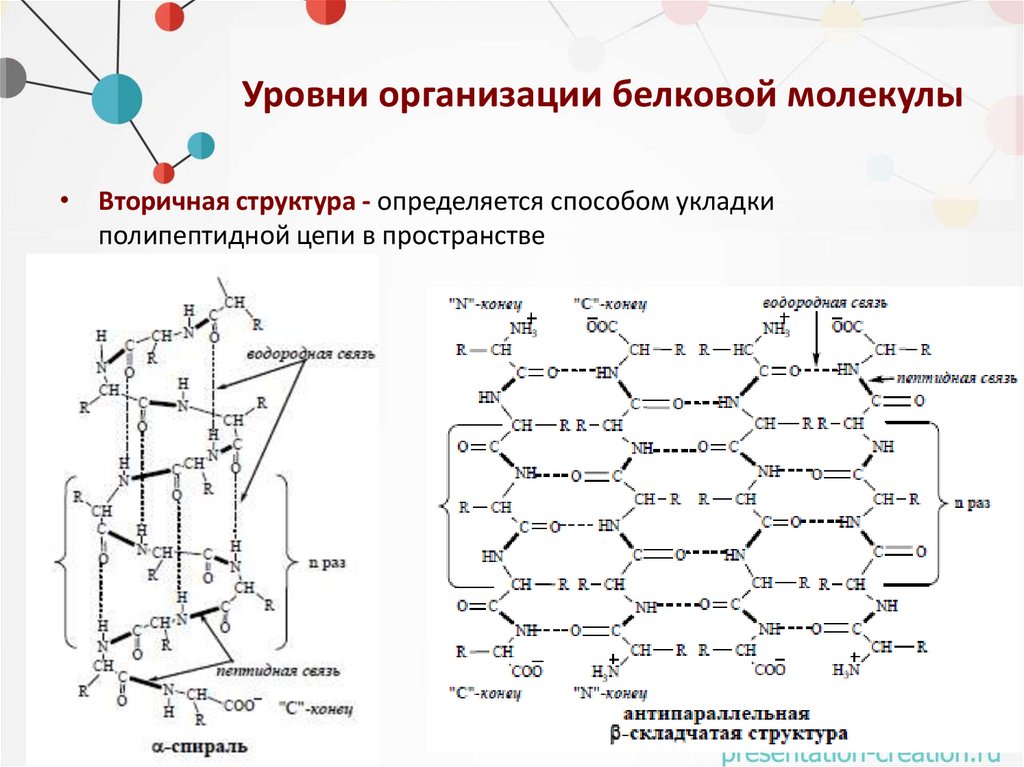
Уровни организации белковой молекулы• Вторичная структура - определяется способом укладки
полипептидной цепи в пространстве
49.
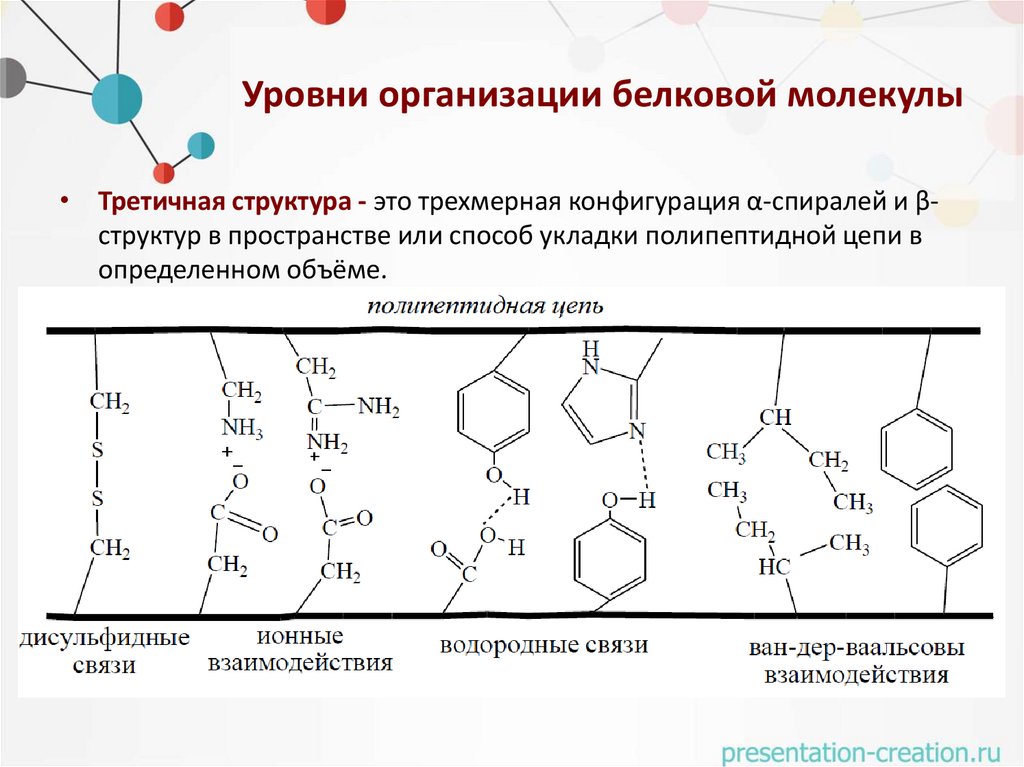
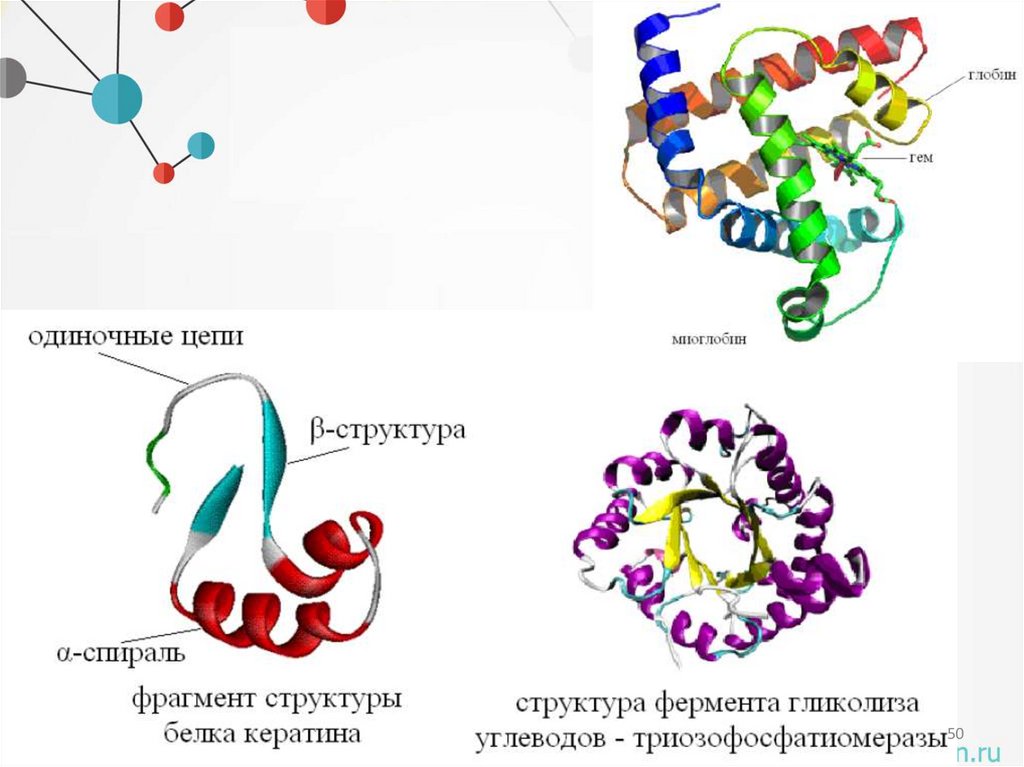
Уровни организации белковой молекулы• Третичная структура - это трехмерная конфигурация α-спиралей и βструктур в пространстве или способ укладки полипептидной цепи в
определенном объёме.
50.
5051.
Уровни организации белковой молекулы• Четвертичная структура представляет собой несколько от-дельных
полипептидных цепей (сохраняющих третичную структуру), способных соединяться нековалентными связями (ионные
взаимодействия, во-дородные связи, межмолекулярные ван-дерваальсовы взаимодействия и т.д.) и образовывать более сложные
макромолекулы.
52.
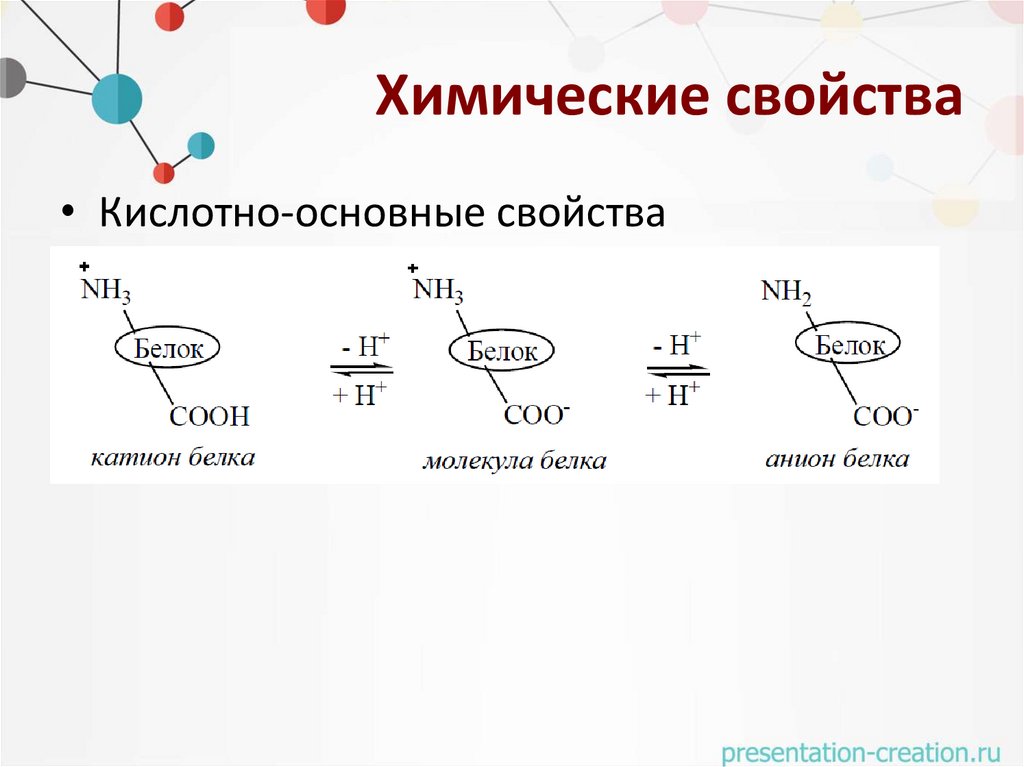
Химические свойства• Кислотно-основные свойства
53.
Химические свойства• Гидролиз
• Денатурация
54.
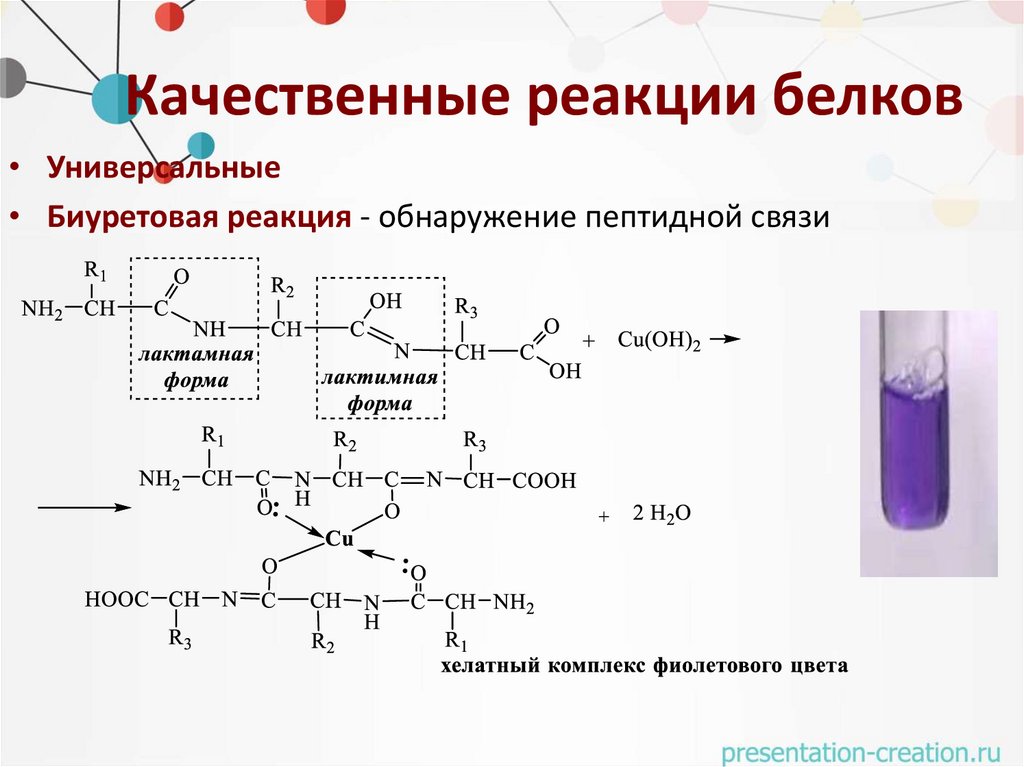
Качественные реакции белков• Универсальные
• Биуретовая реакция - обнаружение пептидной связи
55.
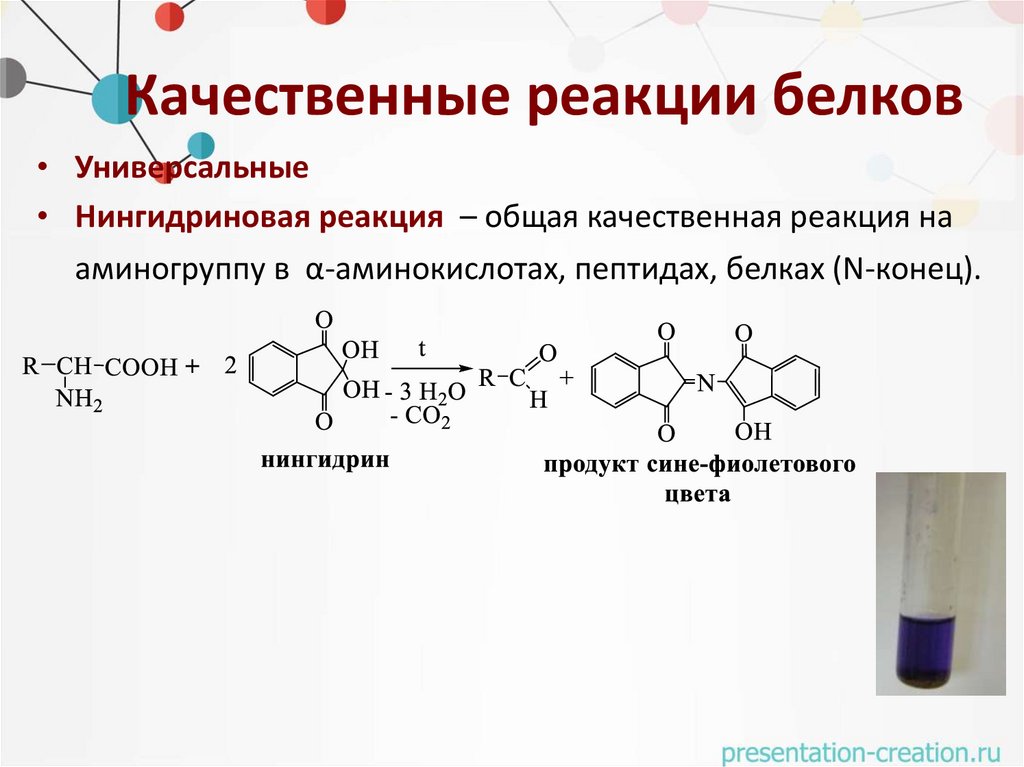
Качественные реакции белков• Универсальные
• Нингидриновая реакция – общая качественная реакция на
аминогруппу в α-аминокислотах, пептидах, белках (N-конец).
56.
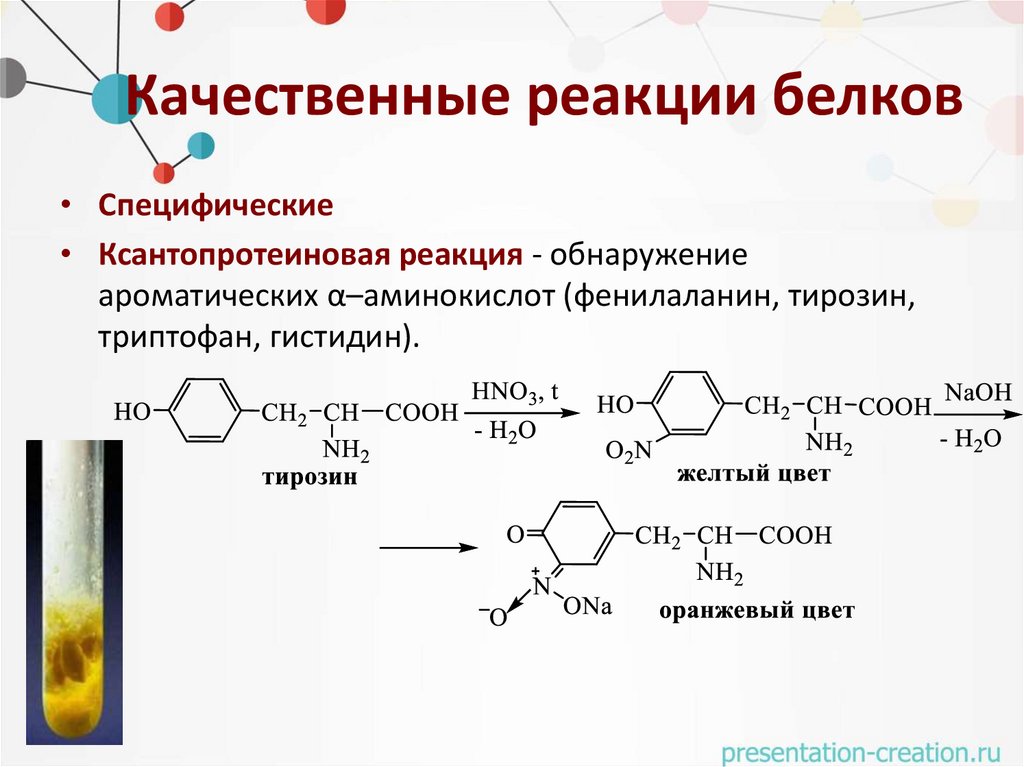
Качественные реакции белков• Специфические
• Ксантопротеиновая реакция - обнаружение
ароматических α–аминокислот (фенилаланин, тирозин,
триптофан, гистидин).
57.
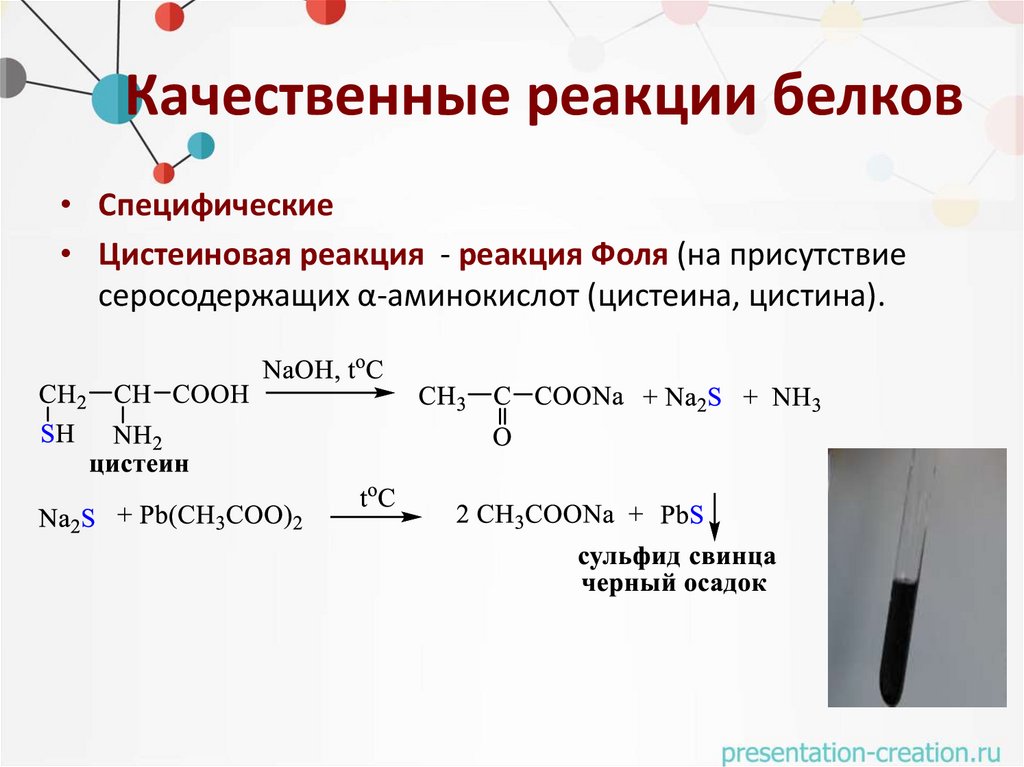
Качественные реакции белков• Специфические
• Цистеиновая реакция - реакция Фоля (на присутствие
серосодержащих α-аминокислот (цистеина, цистина).
58.
Качественные реакции белковСпецифические реакции – самостоятельно (конспект)
реакция Миллона
реакция Паули
реакция Эрлиха
реакция Вуазене
реакция Адамкевича
реакция Сакагучи
Конспект по классификации белков, уровням организации
и биологическим функциям
59.
Благодарю за внимание!59


















 chemistry
chemistry








